IDENTIFIKASI PENYEBAB BUSUK PANGKAL BATANG
JERUK (Citrus spp.) SERTA UJI ANTAGONISME in vitro
DENGAN Trichoderma harzianum DAN Gliocladium virens
EKA RETNOSARI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
EKA RETNOSARI. Identifikasi Penyebab Busuk Pangkal Batang pada Jeruk (Citrus spp.) serta Uji Antagonisme in vitro dengan Trichoderma harzianum dan Gliocladium virens. Dibimbing oleh MEITY SURADJI SINAGA.
Penyakit Busuk Pangkal Batang (BPB) yang disebabkan oleh organisme mirip cendawan (fungal like microorganisme) Phythopthora spp. menjadi kendala utama dan menjadi faktor pembatas produksi jeruk nasional. Penyebab BPB dapat disebabkan oleh P.palmivora, P.parasitica atau P.citrophthora. Laporan terakhir menyebutkan bahwa 85 % pertanaman jeruk terserang penyakit BPB yang disebabkan oleh Botryodiplodia theobromae atau Diplodia natalensis. Sampai saat ini belum ada laporan dan identifikasi yang tepat mengenai spesies penyebab BPB. Oleh karena itu, perlu dilakukan identifikasi yang akurat untuk mengetahui spesies patogen tanaman jeruk penyebab BPB sebagai dasar untuk menentukan strategi pengendalian yang efektif dan efisien. Penelitian bertujuan untuk mengidentifikasi spesies penyebab BPB pada tanaman jeruk dari 11 sentra produksi jeruk di Indonesia yaitu, Garut (Jawa Barat), Jember & Malang (Jawa Timur), Kintamani (Bali), Soe (NTT), Banjarmasin & Banjarbaru (Kalimantan Selatan), Berastagi (Sumatera Utara), Kampar (Riau), Jambi, dan Lampung serta mengevaluasi kemampuan in vitro Trichoderma harzianum dan Gliocladium virens dalam menekan pertumbuhan patogen penyebab BPB. Metode identifikasi patogen dilakukan melalui pengamatan secara makroskopis dan mikroskopis. Karakter morfologi Phytophthora meliputi bentuk dan ukuran sporangium, papilla, dan klamidospora; sedangkan untuk Botryodiplodia atau Diplodia yang diamati yaitu bentuk dan ukuran stroma, piknidia, konidiofor, klamidospora, dan konidia. Identifikasi Phytophthora menggunakan kunci identifikasi Erwin & Ribeiro (1996), sedangkan untuk Botryodiplodia atau Diplodia menggunakan kunci Barnett & Hunter (1998). Uji Postulat Koch dilakukan untuk meyakinkan penyebab penyakit. Uji antagonisme in vitro dilakukan dengan metode Dual Culture. Hasil identifikasi menurut kunci identifikasi Erwin & Ribeiro dan Barnett & Hunter diketahui 11 isolat yang diperoleh dari Garut (Jawa Barat), Jember & Malang (Jawa Timur), Kintamani (Bali), Soe (NTT), Banjarmasin & Banjarbaru (Kalimantan Selatan), Berastagi (Sumatera Utara), Kampar (Riau), Jambi, dan Lampung merupakan Botryodiplodia theobromae yang menyerang 11 sentra produksi jeruk di Indonesia. Sedangkan 1 isolat asal Desa Oehala, Kabupaten Timor Tengah Selatan (TTS) / Soe, propinsi Nusa Tenggara Timur (NTT) merupakan Phytophthora citrophthora. Uji postulat koch isolat dari 11 daerah yang dilakukan di rumah kasa maupun pada planlet menunjukkan hasil positif. Hasil uji antagonisme in vitro menunjukkan T. harzianum dan G. virens nyata menghambat pertumbuhan P. citrophthora dan B. theobromae. Pertumbuhan P. citrophthora lebih cepat dihambat oleh G. virens dibandingkan dengan T. harzianum. Sedangkan penggunaan T. harzianum maupun G. virens tidak berbeda nyata dalam menghambat B. theobromae.
IDENTIFIKASI PENYEBAB BUSUK PANGKAL BATANG
JERUK (Citrus spp.) SERTA UJI ANTAGONISME in vitro
DENGAN Trichoderma harzianum DAN Gliocladium virens
EKA RETNOSARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada Departemen Proteksi Tanaman
Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
dengan Trichoderma harzianum dan Gliocladium virens.
Nama Mahasiswa : Eka Retnosari NIM : A34060394
Disetujui, Pembimbing
Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc. NIP. 19501125197603 2 002
Diketahui,
Ketua Departemen Proteksi Tanaman
Dr. Ir. Dadang, M.Sc. NIP. 19640204199002 1 002
RIWAYAT HIDUP
Penulis dilahirkan di kota Bogor, Jawa Barat pada tanggal 29 Desember 1989 sebagai anak pertama dari tujuh bersaudara, dari pasangan Bapak Sahudi (Alm.) dan Ibu Suryati.
Penulis menyelesaikan pendidikan Sekolah Dasar di SD Negeri 02 Parung pada tahun 2000. Penulis melanjutkan studi ke SLTP Negeri 01 Parung Kabupaten Bogor dan lulus pada tahun 2003. Kemudian pada tahun 2006, penulis menyelesaikan pendidikan di SLTA Citra Bangsa. Semasa menjalani pendidikan di SLTP penulis aktif dalam kegiatan ekstrakurikuler, seperti pramuka, OSIS, dan Paskibra. Ketika di SLTA, penulis pernah menjabat sebagai sekretaris OSIS di SLTA Citra Bangsa, selain itu juga aktif di kegiatan ekstrakurikuler lain seperti Paskibra dan seni teater.
Puji dan syukur kami panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Identifikasi Penyebab Busuk Pangkal Batang pada Jeruk (Citrus spp.) serta Uji Antagonisme in vitro dengan Trichoderma harzianum dan Gliocladium virens”. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian Fakultas Pertanian Institut Pertanian Bogor. Penelitian dilakukan pada bulan Januari 2010 hingga Agustus 2010, bertempat di Laboratorium Mikologi Tumbuhan Departemen Proteksi Tanaman Institut Pertanian Bogor. Dana penelitian berasal dari proyek penelitian yang bekerjasama dengan Badan Penelitian dan Pengembangan Pertanian.
Terima kasih penulis ucapkan kepada Allah SWT yang telah memberikan rahmat dan hidayah-Nya; Ayahanda dan Ibunda yang telah memberikan semangat, cinta, do’a dan kasih sayangnya; Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc. selaku dosen pembimbing penelitian yang telah memberikan bimbingan, kritik, saran, dan masukan selama berlangsungnya penelitian hingga penyusunan skripsi ini; Dr. Ir. Yayi Munara Kusumah M.Si. selaku dosen pembimbing akademik; Dr. Ir. Dadan Hindayana, M.Sc selaku dosen penguji tamu; Seluruh staf pengajar di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut pertanian Bogor atas ilmu yang telah diberikan selama penulis menuntut ilmu di IPB; terimakasih kepada seluruh sahabat seperjuangan mahasiswa Proteksi Tanaman 43 khususnya kepada Windi Dhita, Haryanto, Algienka Defaosandi, Nuri Risa, Anief Nugroho, Vani Nur Oktaviany, Susi Sutardi dan Fitra Murgianto yang membantu memberikan dorongan semangat dan kebersamaannya. Terimakasih kepada anggota Laboratorium Mikologi Mbak Linda, Pak Tri, Mbak Nilda, Pak Fajar, Pak Jack, serta rekan-rekan yang namanya tidak dapat disebutkan satu persatu; Bapak Dadang, selaku laboran; Semua rekan di Proteksi Tanaman; serta semua pihak yang tidak dapat disebutkan satu persatu.
Semoga skripsi ini dapat memberikan manfaat serta informasi bagi semua pihak yang membutuhkannya.
Bogor, Januari 2011
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Tanaman Jeruk ... 4
Varietas Unggul Jeruk ... 4
Jeruk Japansche citroen (JC) ... 5
Penyakit Busuk Pangkal Batang ... 6
Gejala Penyakit ... 6
Penyebab penyakit ... 7
Daur Penyakit ... 7
Sifat Umum Phytophthora spp . ... 8
Morfologi Phytophthora spp ... 8
Siklus Hidup Patogen ... 10
Sifat Umum Botryodiplodia theobromae . ... 11
Morfologi B. theobromae ... 11
Siklus Hidup Patogen ... 11
Sifat Umum Trichoderma sp . . ... 11
Sifat Umum Gliocladium sp ….. ... 13
Pengendalian Penyakit BPB ... 14
BAHAN DAN METODE ... 16
Tempat dan Waktu Penelitian ... 16
Koleksi Sampel Tanaman Sakit ... 16
Isolasi Patogen dari Bahan Tanaman Sakit ... 16
Identifikasi Patogen Berdasarkan Karakter Morfologi ... 17
Uji Postulat Koch ... 17
Identifikasi Penyebab BPB berdasarkan karakter morfologi ... 19
Uji Postulat pada Bibit Japanesche Citroen (JC) ... 24
Persentase Penghambatan oleh Agens Antagonis ... 29
SIMPULAN DAN SARAN ... 30
DAFTAR PUSTAKA ... 31
DAFTAR LAMPIRAN
Halaman
permintaannya cukup besar dari tahun ke tahun dan paling menguntungkan untuk diusahakan. Data dinas pertanian Sumut menunjukkan luas panen tahun 2008 mencapai 13.090 hektar dan pada tahun 2009 menjadi 12.086 hektar. Sementara total produksinya sebesar 858.508 ton,dan menurun pada tahun 2009 yaitu sebesar 728.796 ton per hektar. Kondisi tersebut menunjukan terjadinya penurunan total produksi jeruk di Sumatera Utara sebagai salah satu daerah produksi jeruk terbesar di Indonesia. Sedangkan data produksi jeruk nasional berkisar 17 – 25 ton/hektar dari potensi 25-40 ton/hektar (Deptan 2009). Sebesar 3% dari total produksi jeruk nasional di Indonesia merupakan produk impor. Sehingga saat ini Indonesia termasuk negara pengimpor jeruk terbesar kedua di ASEAN setelah Malaysia, dengan volume impor sebesar 94.696 ton; sedangkan ekspornya hanya sebesar 1.261 ton dengan tujuan ke Malaysia, Brunei Darussalam, dan Timur Tengah. karena kemampuan ekspor Indonesia masih lemah dibandingkan dengan negara produsen jeruk lainnya (Zainurihanif 2010).
2 yang disertai terbentuknya (gumosis) sehingga menjadi busuk dan bau asam. Terdapat berbagai jenis Phytophthora yang menyerang jeruk yaitu P. nicotianae, P. citrophthora, atau P. Palmivora (Erwin & Ribeiro 1996). Pada salah satu daerah sentra budidaya jeruk keprok Soe, kabupaten Timur Tengah Selatan (TTS), diduga penyakit BPB disebabkan oleh Botryodiplodia spp. (Semangun 2000). Penyakit BPB menjadi sangat penting karena dapat mematikan tanaman mulai saat masih di pembibitan, maupun tanaman yang sudah berproduksi di lapangan. Selama ini penyebab BPB pada jeruk di Indonesia selalu diidentifikasi sebagai Phytophthora spp., ternyata, dilaporkan patogen cendawan lain yang juga dapat menimbulkan penyakit BPB, yaitu Botryodiplodia theobromae atau Diplodia natalensis.
Sampai saat ini belum ada laporan identifikasi yang tepat mengenai patogen utama BPB di sentra produksi jeruk di Indonesia. Oleh karena itu perlu dilakukan identifikasi yang akurat dari suatu penyebab penyakit sebagai dasar dalam menyusun strategi pengendalian penyakit yang efektif dan efisien (Ma & Themis 2007).
Tujuan Penelitian
Percobaan ini bertujuan untuk (i) mengidentifikasi spesies penyebab BPB jeruk dengan metode konvensional berdasarkan karakter morfologi cendawan patogen. (ii) mengevaluasi kemampuan antagonisme in vitro Trichoderma harzianum dan Gliocladium virens dalam menekan pertumbuhan penyebab BPB.
Manfaat Penelitian
TINJAUAN PUSTAKA
Tanaman Jeruk
Tanaman jeruk (Citrus spp.) merupakan tanaman hortikultura dataran tinggi tropis yang beriklim kering. Jeruk dikenal berasal dari Asia Tenggara, yaitu India, Cina Selatan, dan beberapa jenis dari Florida, Australia Utara, dan Kaledonia. Jeruk memiliki banyak spesies dari enam genus, yakni Citrus, Microcitrus, Fortunella, Poncirus, Cymedia, dan Eremocirus. Namun, yang memiliki nilai ekonomi tinggi hanyalah Citrus.
Tanaman jeruk dapat ditanam di dataran rendah hingga dataran tinggi pada suhu antara 20-30 0 C. Jeruk keprok baik ditanam di ketinggian antara 100-1.300 meter diatas permukaan laut (mdpl); jeruk manis antara 700-1.300 mdpl; dengan iklim kering dan berada di tempat tebuka. Jeruk besar antara 70-600 mdpl; dan jeruk nipis antara 200-600 mdpl. Di dataran tinggi, jeruk besar akan menghasilkan buah yang rasanya pahit / tidak segar. Pada umumnya tanaman menghendaki tanah yang subur, gembur, dan banyak mengandung bahan organik, berporositas tinggi dengan pH tanah 5-6. Curah hujan sekitar 1500-2000 mm per tahun.
Varietas Unggul Jeruk
dikarenakan biji jeruk Poncirus trifoliata dan kerabatnya sukar didapat karena bijinya masih diimpor. Bibit jeruk dapat ditanam pada umur 8-12 bulan yang tingginya antara 60-100 cm. Pupuk buatan berupa campuran Urea, TSP atau SP-36 dn KCl yang diberikan secara teratur setiap tiga bulan sekali (Sunarjono 2004).
Jeruk Japanshe Citroen (Citrus limonia Osbeck)
Jeruk Japanshe Citroen (Citrus limonia Osbeck) atau sering disebut JC merupakan varietas hibrida yang dihasilkan dari persilangan antara Citroes nobilis (keprok) X Citroes medica (lemon). JC bersifat tahan terhadap kekeringan, dapat merangsang pembentukan buah lebih awal dari biasanya dan menghasilkan produksi tinggi dengan kualitas yang baik. Jenis ini kurang toleran terhadap penyakit Busuk Pangkal Batang.
Menurut Masyarakat, jeruk JC mempunyai ciri-ciri sebagai berikut:
1. Pohon tegar dan produktif, ukuran sedang, cabang menyebar dan merunduk, duri kecil dan sedikit
2. Daun berwarna hijau gelap, aroma daun menyengat, pupus warna ungu 3. Bunga berukuran kecil hingga sedang, putik dan kelopak bunga berwarna
ungu tua
4. Buah kecil hingga sedang, warna kulit buah bila masak kekuningan sampai jingga kemerahan
5. Biji jumlahnya banyak, berukuran kecil dan warna keping biji hijau muda, setiap buah berisi 8-10 biji
6. Tanah kekeringan
7. Daya dukung terhadap batang atas baik dan cepat menghasilkan buah yang berkualitas sedang hingga baik
8. Peka terhadap Phytophthora, Exocortis,dan Xyloporosis 9. Tahan terhadap Psorosis dan agak tahan terhadap Tristeza.
6 Batang bawah JC memiliki kompatibilitas yang baik. Penggunaan batang bawah JC bersifat lebih mendorong pertumbuhan vegetatif batang atas dibandingkan dengan Rough Lemon.
Penyakit Busuk Pangkal Batang Gejala Busuk Pangkal Batang
Penyakit busuk pangkal batang atau disebut “blendok” atau “gumosis” tersebar luas dan terdapat di semua sentra budidaya jeruk di seluruh dunia. Penyakit ini memiliki bermacam-macam nama, antara lain foot root atau busuk kaki, brown root gummosis, Pythiacystis gummosis. Di Indonesia adanya penyakit ini telah dilaporkan dari Sumatera, Jawa, Kalimantan Timur, dan Sulawesi Selatan. Gejala ini dimulai dari kulit batang berwarna kebasah-basahan dan mengeluarkan blendok (gom) encer. Pada umumnya pembusukan mulai dari tempat menempelnya batang atas untuk tanaman asal biji (semai) pada aras permukaan tanah.
Penyakit BPB jeruk dapat disebabkan oleh Phytophthora spp., Diplodia atau Botryodiplodia spp. Menurut laporan Erwin & Ribeiro (1996), terdapat 11 spesies Phytophthora yang dapat diisolasi dari pohon jeruk sakit, yaitu P. boehmeriae, P. cactorum, P. cinnamoni, P. citricola, P. citrophthora, P.
drecshleri, P. hibernalis, P. megasperma, P. palmivora, P. parasitica
(P.nicotianae), dan P. shyringae. Namun di Indonesia dilaporkan terdapat tiga spesies Phytophthora yang penting yaitu P. parasitica Dast. ( P. nicotianae ), P palmivora, dan P. citrophthora.
membentuk bunga salah waktu yang diikuti pembentukan buah. Tetapi buah ini tidak dapat menjadi besar dan rasanya pun tidak enak. Inilah fase pembentukan bunga dan buah yang terakhir.
Sedangkan penyakit kulit Diplodia juga menyerang pertanaman jeruk yang gejalanya hampir sama dengan penyakit busuk pangkal batang. Di Indonesia, penyakit ini terdapat di Sumatera, Jawa, Bali, dan Sulawesi Selatan. Jeruk besar (Pamelo) merupakan jenis jeruk yang paling banyak diserang oleh penyakit ini. Pada jeruk dikenal dua macam serangan Diplodia, yaitu Diplodia basah dan Diplodia kering. Gejala pada Diplodia basah yaitu keluarnya blendok atau gom yang berwarna kuning dari batang atau cabang-cabang besar. Kemudian kulit yang sakit mengelupas dan menjadi sembuh.
Tetapi sering penyakit berkembang terus, sehingga pada kulit terjadi luka yang tidak teratur, yang luas tapi dangkal. Patogen berkembang di antara kulit dan kayu, merusak kambium sehingga cabang segera digelang dan mati. Pada persemaian sering terjadi infeksi pada tempelan-tempelan (okulasi) baru, patogen masuk melalui luka. Sedangkan Diplodia kering ini lebih berbahaya, karena gejalanya sulit diketahui. Kulit mengering dan jika dipotong kulit dan kayu di bawahnya berwarna hitam kehijauan. Kulit yang sakit membentuk celah-celah kecil, dari dalamnya keluar massa spora yang semula berwana putih tetapi akhirnya berwarna hitam. Bagian yang sakit meluas dengan sangat cepat. Biasanya infeksi baru diketahui jika daun-daun telah menguning, sehingga batang atau cabang yang sakit tidak dapat ditolong lagi.
Penyebab Busuk Pangkal Batang
8
theobromae (Pat.) Griff. Et Maubl., yang dulu dikenal dengan nama Diplodia natalensis P. Evans.
Daur Penyakit
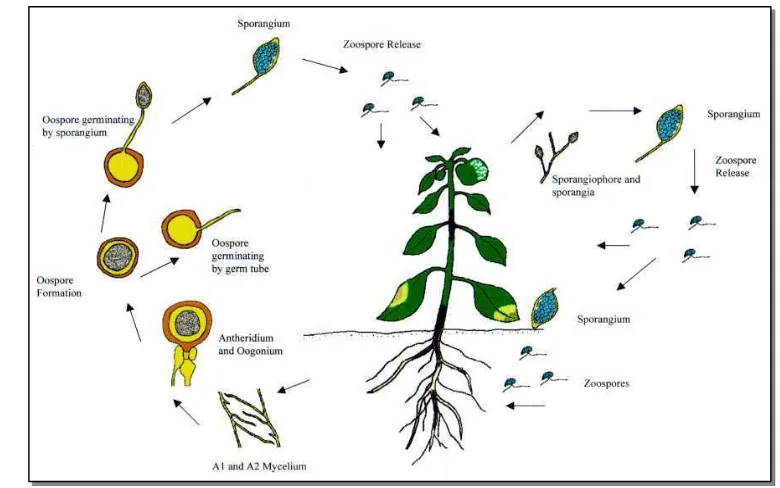
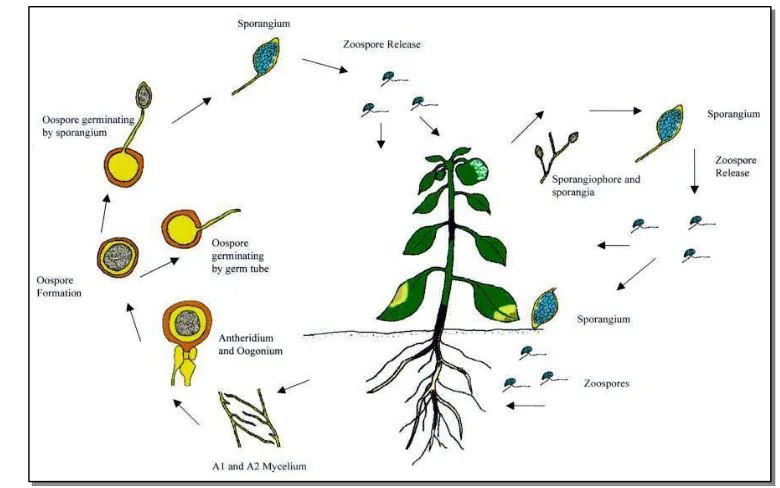
Dalam daur penyakit, Phytophthora dapat bertahan pada tanah dan membentuk sporangium dan spora kembara terutama dipencarkan oleh air hujan dan air yang mengalir dipermukaan tanah. Infeksi terjadi melalui luka alami maupun buatan karena alat-alat pertanian maupun hewan termasuk seranggga.
Sedangkan patogen penyebab penyakit kulit Diplodia sampai sekarang belum dikatahui daur penyakit dengan jelas karena Botryodiplodia merupakan cendawan yang polifag, menyerang bermacam-macam tumbuhan. Patogen ini termasuk parasit lemah yang mengadakan infeksi melalui luka-luka mekanis akibat pemangkasan. Konidium B. theobromae dapat dipencarkan oleh air dan serangga.
Sifat Umum Phytophthora spp. Morfologi Phytophthora spp.
Morfologi P. nicotianae var parasiticia sporangiumnya berbentuk jorong sampai agak bulat, berbentuk buah pir, 20-67 X 14-37 (42,5X 25,7) µm dengan sporangiofor lebih halus dari pada hifa yang lebarnya 9 µm. Spora mempunyai dua bulu cambuk (flagela) sehingga bisa bergerak dalam air, dan patogen dapat membentuk klamidospora bulat, berdinding agak tebal dengan garis tengah 20-60 µm. Sporangium dapat berkecambah secara tidak langsung dan mengeluarkan 18-24 spora kembara (zoospora) atau berkembang langsung dengan membentuk pembuluh kecambah. Klamidospora terbentuk pada interkalar atau terminal. Koloni pada PDA berbentuk arachnoid, tapi pada media V8 agar lebih halus atau seperti benang.
membentuk klamidospora. Pada media PDA, koloni petallate, sedangkan pada cornmeal agar, koloni stellate, lamose, indeterminate antara rosette dan lanose (Erwin & Ribeiro 1996). Sporangia P. citrophthora lebih panjang dibandingkan sporangia P. palmivora tetapi memiliki bentuk sporangia yang sangat bervariasi. P. citrophthora tidak menghasilkan oospora, temperatur optimum untuk pertumbuhan miselia yaitu 34-380C.
P. palmivora mempunyai sporangium jorong, dan dapat membentuk klamidospora. P. palmivora dapat bertahan dalam tanah dan membentuk spora kembara. Penyebaran terutama oleh hujan dan air pengairan yang mengalir di atas permukaan tanah. Penyakit busuk pangkal batang lebih banyak menyerang kebun dengan ketinggian lebih dari 400 mdpl, pada tanah - tanah yang basah, seperti tanah lempung berat yang dapat menahan air lebih lama.
Patogen masuk lewat luka pada pangkal batang (penyebaran oleh oospora melalui luka alamiah, luka karena alat pertanian, atau luka oleh serangga). Infeksi terjadi terutama pada musim hujan dan dibantu oleh pH tanah agak asam (6,0 - 6,5). Infeksi patogen juga dibantu oleh kabut dan fluktuasi suhu yang kecil yang akan memperlambat penguapan. Karakter koloni pada umumnya mempunyai pinggiran yang tidak rata dan berwarna putih, tipe rosaceous, stellate, cottony (Erwin & ribeiro 1996). Menghasilkan klamidospora yang berlimpah, Oospora berukuran 22-29 µm, dan temperatur optimum untuk pertumbuhan miselia yaitu 37-30 0 C.
10
didaerah tropis dan kadang-kadang subtropis dan bagian mediteranian selama musim panas dan lembab (Timmer et al 2000).
Siklus Hidup Patogen
Gambar 1 Siklus Hidup Phytophthora spp. (http://www.library.usu.ac.id)
Sifat Umum Botryodiplodia theobromae Morfologi Botryodiplodia theobromae
Botryosphaeriaceae merupakan kelompok cendawan yang memuat sejumlah spesies yang tersebar pada beberapa genus anamorp, diantaranya yang paling dikenal adalah Diplodia, Lasiodiplodia,Neofusicoccum, pseudofusicoccum,Dothiorella, dan Sphaeropsi. Anggota ini memiliki distribusi yang sangat luas. Kelompok cendawan dapat berperan sebagai saprofit, parasit, dan endofit (Begoude et al 2009).
Berdasarkan gejalanya, Diplodia dibedakan menjadi Diplodia basah dan Diplodia kering. Pada Diplodia basah B. theobromae membentuk piknidium yang tersebar, mula-mula tertutup, lalu pecah dan berwarna hitam, konidium jorong bersekat satu, berwarna gelap, rata-rata ukuran 24 x 15 µm. Kemungkinan Diplodia kering juga disebabkan oleh spesies patogen yang sama Diplodia natalensis P.Evans dianggap identik dengan D. zeae (Schw) Lev., dan keduanya identik dengan D. theobromae (Pat) Nowell (Wellman 1972) dan seterusnya dikatakan bahwa ketiganya adalah identik dengan Botryodiplodia theobromae pat. meskipun belum diketahui pada inang yang berbeda apakah antara Diplodia natalensis dengan Botryodiplodia theobromae memiliki patogenesitas yang sama. D. natalensis memiliki piknidium berwarna hitam dan letaknya tersebar, tidak memiliki stroma dibedakan dengan Botryodiplodia yang memiliki piknidium berkumpul dan berstroma.
Siklus Hidup Patogen
Spora (konidia) berkecambah membentuk miselium berkembang menjadi piknidia atau badan buah aseksual, dalam piknidia dihasilkan konidia, kumpulan dari piknidia ini disebut stroma.
Sifat Umum Trichoderma sp.
12
Trichoderma banyak ditemukan di tanah hutan maupun tanah pertanian atau pada substrat berkayu. Suhu optimum untuk tumbuhnya Trichoderma berbeda-beda setiap spesiesnya. Ada beberapa spesies yang dapat tumbuh pada temperatur rendah ada pula yang tumbuh pada temperatur cukup tinggi, kisarannya sekitar 7 °C – 41 °C. Trichoderma yang dikultur dapat tumbuh cepat pada suhu 25-30 °C, namun pada suhu 35 °C cendawan ini tidak dapat tumbuh. Perbedaan suhu mempengaruhi produksi beberapa enzim seperti karboksimetilselulase dan xilanase.
Pada Trichoderma yang dikultur, Morfologi koloninya bergantung pada media tempat bertumbuh. Pada media yang nutrisinya terbatas, koloni tampak transparan, sedangkan pada media yang nutrisinya lebih banyak, koloni dapat terlihat lebih putih. Konidia dapat terbentuk dalam satu minggu, warnanya dapat kuning, hijau atau putih. Pada beberapa spesies dapat diproduksi semacam bau seperti permen atau kacang. Reproduksi aseksual Trichoderma menggunakan konidia. Konidia terdapat pada struktur konidiofor. Konidiofor ini memiliki banyak cabang. Cabang utama akan membentuk cabang. Ada yang berpasangan ada yang tidak. Cabang tersebut kemudian akan bercabang lagi, pada ujung cabang terdapat fialid. Fialid dapat berbentuk silindris, lebarnya dapat sama dengan batang utama ataupun lebih kecil. Fialid dapat terletak pada ujung cabang konidiofor ataupun pada cabang utama. Konidia secara umum kering, namun pada beberapa spesies dapat berwujud cairan yang berwarna hijau bening atau kuning. Bentuknya secara umun adalah elips, jarang ditemukan bentuk globosa. Secara umum konidia bertekstur halus.
faktor ekologi yang membuat produksi bahan metabolit yang bervariasi pula. Trichoderma memproduksi metabolit yang bersifat volatil dan non volatil. Metabolit non volatil lebih efektif dibandingkan dengan yang volatil.Metabolit yang dihasilkan Trichoderma dapat berdifusi melalui membran dialisis yang kemudian dapat menghambat pertumbuhan beberapa patogen. Salah satu contoh metabolit tersebut adalah monooksigenase yang muncul saat adanya kontak antar jenis Trichoderma, dan semakin optimal pada pH 4. Ketiadaan metabolit ini tidak akan mengubah morfologi dari Trichoderma namun hanya akan menurunkan kemampuan penghambatan patogen.
Trichoderma harzianum merupakan salah satu contoh yang paling banyak dipelajari karena memiliki aktivitas antifungal yang tinggi. T. harzianum dapat memproduksi enzim litik dan antibiotik antifungal. Selain itu T. harzianum juga dapat berkompetisi dengan patogen dan dapat membantu pertumbuhan tanaman. T. harzianum memiliki kisaran penghambatan yang luas karena dapat menghambat berbagai jenis fungi. Trichoderma harzianum memproduksi metabolit seperti asam sitrat, etanol, dan berbagai enzim seperti urease, selulase, glukanase, dan kitinase. Hasil metabolit ini dipengaruhi kandungan nutrisi yang terdapat dalam media. T. harzianum dapat memproduksi beberapa pigmen yang bervariasi pada media tertentu seperti pigmen ungu yang dihasilkan pada media yang mengandung amonium oksalat, dan pigmen jingga yang dihasilkan pada media yang mengandung gelatin atau glukosa, serta pigmen merah pada medium cair yang mengandung glisin dan urea.
Saat berada pada kondisi yang kaya akan kitin, Trichoderma harzianum memproduksi protein kitinolitik dan enzim kitinase. Enzim ini berguna untuk meningkatkan efisiensi aktivitas biokontrol terhadap patogen yang mengandung kitin.
Sifat Umum Gliocladium sp.
14
bentuk peniculate dan kepalanya menghasilkan spora licin, sel spora genus fialid dan kadang-kadang berbentuk botol, konvek pada satu sisi fialosporanya berwarna kuning (Barnett and Hunter 1998). Gliocladium sp. memiliki konidiofor yang bersepta dan bercabang ke atas dengan struktur sikat yang penicilate. Masing-masing percabangan membentuk alur berputar yang memiliki 4-5 kelompok konidia. Konidia berbentuk lonjong sampai pipih dan hialin. Gliocladium mirip penicilium akan tetapi percabangan yang menyangga massa spora seolah-olah terikat atau konidia dalam satu kepala konidia (Barnett and Hunter, 1998). Cendawan Gliocladium sp. memarasit inangnya dengan cara menutupi atau membungkus patogen, memproduksi enzim-enzim dan menghancurkan dinding sel patogen hingga patogen mati. Gliocladium sp. dapat hidup baik sebagai saprofit maupun parasit pada cendawan lain, dapat berkompetisi akan makanan, dapat menghasilkan zat penghambat dan bersifat hiperparasit.
Mekanisme antagonistik dari Gliocladium sp. terhadap organisme lain adalah hiperparasitisme, antibiosis dan lisis atau kombinasi keduanya. Cendawan ini pertama kali dilaporkan memproduksi bahan anti cendawan (Anti Fungal) gliotoxin dan virin. Hubungan antagonisme antara agens antagonis dengan patogen dapat terjadi melalui beberapa hal yaitu parasitisme, antibiosis, kompetisi, predasi dan lisis. Gliocladium sp. dapat digunakan untuk mengendalikan penyakit tular tanah, termasuk penyakit damping off pada kacang buncis dan kubis, bercak daun pada tomat dan penyakit penyemaian pada tanaman kapas
Pengendalian Penyakit
Pengendalian kultur teknis, pengendalian penyakit yang dianjurkan adalah menanam jeruk diatas gundukan-gundukan setinggi 20-25 cm, tetapi tanaman tidak dibumbun agar batang atas tidak berhubungan dengan tanah. Selain itu menggunakan benih dengan mata tempel setingi 30-35 cm dari permukaan tanah, untuk mengurangi kemungkinan batang atas yang rentan terinfeksi cendawan tanah. Mengurangi kelembapan kebun dan mengatur drainase, jarak tanam, pemangkasan, dan sanitasi lingkungan atau kebun. Menghindari terjadinya pelukaan pada akar maupun pangkal batang pada waktu pemeliharaan atau penyiangan, pengamatan pangkal batang jeruk secara teliti dan teratur, terutama pada musim hujan, agar gejala penyakit dapat diketahui secara dini. pH tanah diusahakan agar lebih dari 6,5 dengan pemberian dolomit.
Secara mekanis, membongkar tanaman yang terserang berat, kemudian dibakar. Memotong atau membuang bagian tanaman sakit, termasuk 1-3 cm bagian kulit sekitarnya yang sehat, kemudian diolesi fungisidsa 6.2 % karbendazim ditambah dengan 73.8% mankozeb atau tembaga oksiklorida; menggunakan kaki ganda dengan teknik samping (aaneting) dengan batang bawah sehat.
Secara biologi, menggunakan agens antagonis cendawan Trichoderma sp. atau Gliocladium sp. yang dicampur dengan pupuk kandang atu kompos. Secara genetika, penggunaan varietas tahan terhadap phytophthora spp. Misalnya poncirus trifoliate dan Cleopatra mandarin; varietas tahan terhadap phytophthora dan salinitas, yaitu taiwanica dan citromello 4475.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian telah dilaksanakan dari bulan januari 2010 hingga Agustus 2010. Kegiatan isolasi, identifikasi cendawan penyebab BPB, dan uji antagonisme in vitro dilakukan di laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Institut Pertanian Bogor (IPB). Uji postulat pada bibit tanaman jeruk dilakukan di rumah kasa Departemen Proteksi Tanaman, IPB.
Metode Pelaksanaan Koleksi Sampel Tanaman Sakit
Penelitian ini merupakan gabungan penelitian yang melibatkan beberapa peneliti yang diketuai oleh Prof.Dr.Ir.Meity Suradji Sinaga, M.Sc. Koleksi atau pengumpulan bahan tanaman sakit dilakukan oleh tim peneliti dari 11 daerah sentra produksi jeruk yang ada di Indonesia yaitu Garut (Jawa Barat), Jember & Malang (Jawa Timur), Kintamani (Bali), Soe (NTT), Banjarmasin & Banjarbaru (Kalimantan Selatan), Berastagi (Sumatera Utara), Kampar (Riau), Jambi, dan Lampung. Bahan tanaman sakit berupa batang jeruk yang menunjukkan gejala serta tanah di sekitar pertanaman jeruk yang terserang cendawan BPB.
Isolasi Patogen dari Bahan Tanaman Sakit
Isolasi patogen dilakukan pada pangkal batang jeruk dan tanah. Isolasi batang sakit dilakukan dengan cara batang dicuci dengan air mengalir, kemudian didesinfeksi menggunakan kloroks 0,5 % selama satu menit, dibilas menggunakan air steril sebanyak tiga kali, selanjutnya batang ditanam pada media PDA. Koloni cendawan yang tumbuh dan menunjukkan ciri koloni dari Phytophthora spp. dibiakkan pada media V8 agar untuk merangsang sporulasinya .
pada buah, bagian yang bergejala tersebut diambil dan dikulturkan pada media PDA dan media selektif V8 agar untuk merangsang sporulasinya.
Identifikasi Patogen Berdasarkan Karakter Morfologi
Identifikasi patogen secara makroskopis dilakukan dengan visualisasi meliputi warna koloni, tipe koloni, serta lama pertumbuhan patogen pada media PDA dan V8 agar. Identifikasi secara mikroskopis dilakukan dengan menggunakan mikroskop binokuler, pengamatan meliputi bentuk dan ukuran sporangium, sporangiofor, papilla, ada tidaknya septa dan klamidospora untuk karakteristik morfologi Phytophthora spp.; sedangkan karakteristik morfologi Botryodiplodia sp. atau Diplodia sp. yaitu hifa, stroma, piknidia, konidiofor, klamidospora, bentuk dan ukuran konidium. Identifikasi spesies dari Phytophthora spp. menggunakan buku kunci identifikasi Erwin & Ribeiro (1996); Sedangkan untuk Botryodiplodia sp. atau Diplodia sp. Menggunakan sistem klasifikasi Saccardo menurut kunci identifikasi Barnett & Hunter (1998). Karakter morfologi sporangium Phytophthora sp. (rasio panjang/lebar) dan ukuran konidia Botryodiplodia sp.dan Diplodia sp. diukur dengan menggunakan mikrometer kemudian disajikan dalam bentuk tabel dan gambar.
Uji Postulat Koch
18
Uji Antagonisme Secara in vitro
Patogen yang telah dimurnikan, diuji dengan agens antagonis Trichoderma harzianum dan Gliocladium virens dengan metode biakan ganda (dual culture). Cendawan patogen dan Agens antagonis ditumbuhkan dalam satu cawan petri yang berisi media PDA dengan jarak 3 cm dari masing-masing tepi cawan yang berlawanan, diinkubasi pada suhu ruang. Pengamatan jari-jari koloni patogen yang menjauhi koloni isolat cendawan antagonis (R1), dan yang mendekati koloni
isolat cendawan antagonis (R2) diukur setiap hari sampai hari ke tujuh.
Persentase penghambatan dihitung dengan rumus : P = R1 – R2 X 100 %
R1
Selain persen penghambatan diamati mekanisme interaksinya yaitu, hiperparasitisme, lisis (zona degradasi), antibiosis, dan pertumbuhan di atas koloni patogen (over growth) oleh cendawan antagonis.
Rancangan Percobaan dan analisis data
Identifikasi Penyebab Berdasarkan Karakter Morfologi
Dalam pengembangan jeruk di lahan basah, penyakit Busuk Pangkal Batang yang disebabkan oleh organisme mirip cendawan (fungal like organisme) Phytophthora spp., patogen ini tersebar di seluruh dunia dan menyebabkan kehilangan hasil 10-30 % produksi jeruk (Timmer et al. 2000). Serangan lanjut penyakit tersebut menyebabkan mengering dan rontoknya daun, bunga, dan buah serta kematian semua stadia tanaman di pembibitan maupun di lapangan. Gejala spesifik dari BPB yaitu berupa busuk pada batang bawah atau di sekitar mahkota akar dekat dengan permukaan tanah. Busuk batang ditandai oleh jaringan batang dan kambium berwarna coklat-kekuningan. Di permukaan batang, infeksi sering nampak seperti terlokalisir atau sering kelihatan tidak meluas. Sebenarnya, infeksi mungkin meluas pada kambium yang menyebabkan jaringan batang retak, hancur dan mengeluarkan gumosis. Pada batang diatas permukaan tanah, gumosis dapat terjadi berlebihan, sedangkan dibawah permukaan tanah nampak pembentukan gumosis berkurang karena biasanya terabsorb oleh air tanah (Ditjen perlintan Hortikultura 2006; Graham and Timmer 2008).
Gum yang telah mengering diambil dari pembibitan maupun lapangan dan diisolasi dalam media PDA. Namun tidak ditemukan adanya patogen. Sehingga dalam kondisi seperti ini tanamn mengeluarkan gum sebagai reaksi tanaman atas serangan patogen, namun gum yang dikeluarkan tidak selalu mengandung patogen. Gum dihasilkan untuk melokalisir pathogen agar tidak berkembang lebih luas. Menurut Agrios (2005), gum yang dihasilkan dari permukaan kulit jaringan tanaman menunjukkan tingkat serangan yang sudah lanjut.
20
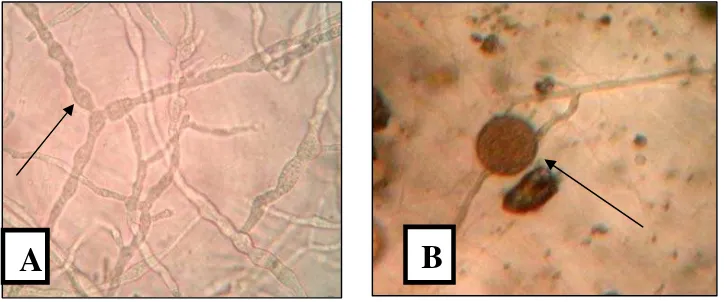
Pada identifikasi secara makroskopis, miselium yang diduga Botryodiplodia spp. awalnya berwarna putih dan pertumbuhannya aerial, namun setelah hari keempat miselium menjadi abu-abu sampai kehitaman. Setelah 7 atau 8 hari menjadi berwarna hitam. Secara umum pertumbuhan Botryodiplodia spp. sangat cepat, yaitu 3-7 Hsi pada media PDA. Sedangkan pada identifikasi secara mikroskopis, menunjukan hifa yang bersekat dan berwarna hialin kemudian menjadi coklat. Pembentukan klamidospora secara interkalar (Gambar 2b). Pertumbuhan piknidia pada media PDA sangat lambat yaitu ± 30 hari setelah isolasi. Sedangkan pada media water agar yang diberi potongan jerami padi yang telah disterilkan, piknidia lebih cepat terbentuk yaitu ± 14 hari setelah isolasi. Karena piknidia akan terbentuk jika kondisi lingkungan tidak menguntungkan. Oleh karena itu piknidia akan lebih cepat tumbuh jika isolat ditanam pada media yang miskin nutrisi.
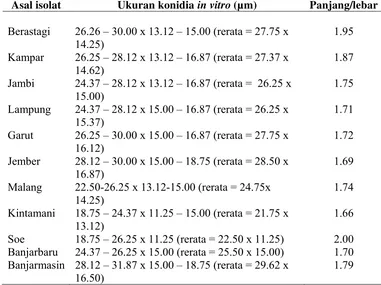
Konidia dihasilkan dalam piknidia. Piknidia terdiri dari konidia muda dan konidia matang, keduanya berbentuk ovoid dan ellipsoid. Konidia muda berwarna hialin, dindingnya terdiri dari dua lapisan, berbentuk granular dan tidak bersekat sedangkan konidia matangnya berwarna coklat, dinding selnya hanya satu lapisan dan memiliki satu sekat sehingga membentuk dua sel. Ukuran konidia bervariasi, yaitu panjangnya 18.75 – 31.87 µm dan lebarnya 11.25 – 18.75 µm, atau rerata panjang x lebarnya adalah 25.31 µm x 15.00 µm (Tabel 1). Sedangkan pembentukan piknidia secara berkelompok dalam stroma, memiliki konidiofor tunggal.
Gambar 2 Morfologi Botryodiplodia theobromae: Hifa yang bersekat (A), pembentukan klamidospora secara interkalar (B), konidia yang bersekat (C)
Tabel 1 Ukuran konidia Botryodiplodia theobromae
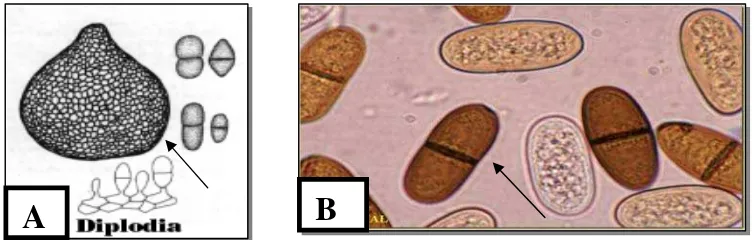
Menurut Phillips (2000), konidia Lasiodiplodia spp. awalnya hialin kemudian menjadi berwarna dan memiliki satu sekat. Melanin tersimpan dalam bentuk garis yang teratur dan tetap pada bagian sebelah dalam dinding konidia, sehingga kelihatan seperti garis yang membujur. Begitu juga menurut Sato et al (2008), konidia matang Lasiodiplodia spp. berwarna coklat tua, berdinding tebal, memiliki garis membujur disekelilingnya dan terdapat satu sekat melintang pada bagian tengah konidia. Menurut Barnett & Hunter (1998), morfologi Diplodia natalensis hampir sama dengan Botryodiplodia theobromae perbedaanya hanya pada bentuk konidia matang dan piknidia, yaitu pada D. natalensis konidia matang lebih lonjong dan piknidiumnya tidak berkelompok (Gambar 3). Diplodia natalensis memiliki piknidium berwarna hitam dan letaknya tersebar, tidak berstroma, dibedakan dengan B. theobromae yang memiliki piknidium berkumpul dan berstroma (Deptan, 2009).
Asal isolat Ukuran konidia in vitro (µm) Panjang/lebar
Berastagi 26.26 – 30.00 x 13.12 – 15.00 (rerata = 27.75 x 14.25)
1.95 Kampar 26.25 – 28.12 x 13.12 – 16.87 (rerata = 27.37 x
14.62)
1.87 Jambi 24.37 – 28.12 x 13.12 – 16.87 (rerata = 26.25 x
15.00)
1.75 Lampung 24.37 – 28.12 x 15.00 – 16.87 (rerata = 26.25 x
15.37)
1.71 Garut 26.25 – 30.00 x 15.00 – 16.87 (rerata = 27.75 x
16.12)
1.72 Jember 28.12 – 30.00 x 15.00 – 18.75 (rerata = 28.50 x
16.87)
1.69 Malang 22.50-26.25 x 13.12-15.00 (rerata = 24.75x
14.25)
1.74 Kintamani 18.75 – 24.37 x 11.25 – 15.00 (rerata = 21.75 x
13.12)
1.66 Soe 18.75 – 26.25 x 11.25 (rerata = 22.50 x 11.25) 2.00 Banjarbaru 24.37 – 26.25 x 15.00 (rerata = 25.50 x 15.00) 1.70 Banjarmasin 28.12 – 31.87 x 15.00 – 18.75 (rerata = 29.62 x
16.50)
22
Gambar 3 Morfologi Diplodia natalensis: Piknidium berwarna hitam dan tidak berkelompok (A), konidia berbentuk lonjong (B) (www.mycology.adelaide.edu.au)
Berdasarkan identifikasi morfologi terhadap 11 isolat dari lokasi yang berbeda ditemukan kesamaan karakter morfologi antara lain, konidia terbentuk didalam badan buah aseksual (piknidia); konidia berbentuk globose atau ellipsoid; konidia terdiri dari dua sel; konidia berpigmen gelap; dan piknidia terbentuk secara berkelompok didalam stroma. Dari beberapa karakter diatas, diketahui bahwa isolat-isolat tersebut merupakan Botryodiplodia theobromae Pat. sinonim dari Lasiodiplodia theobromae (Pat) Griffon dan Maubl. dan Diplodia natalensis Pole-Evans; teleomorph Botryosphaeria rhodina (Cooke) Arx).
Menurut kunci identifikasi Erwin & Ribeiro (1996) secara makroskopis, koloni isolat Phytophthora citrophthora berwarna putih, pada media PDA berbentuk rosaceous; pada V8 agar, biakan muda berbentuk stellate dan biakan tuanya berbentuk cottony. Secara mikroskopis, Nampak hifa tidak bersekat, bercabang, catenulate, corraloid, hialin, halus sampai kasar, membengkak, bulat sampai lonjong (ovoid) dan tidak beraturan. Klamidospora globose terbentuk secara interkalar (Gambar 4b). Terdapat beberapa bentuk sporangia, yaitu globose, ellipsoid,ovoid, limoniform, dan beberapa bentuk distorsi atau asimetris (Gambar 5), tetapi yang paling dominan muncul pada identifikasi adalah bentuk distorsi atau asimetris. Pada suhu kamar, Phytophthora spp. yang dibiakkan pada media PDA dapat tumbuh memenuhi cawan petri dengan diameter 9 cm pada 12 Hsi. Sedangkan media V8 agar pada 10 Hsi.
[image:32.612.136.509.339.461.2]
Gambar 4 Morfologi hifa dan klamidospora Phytophthora spp. : Hifa yang membengkak, bercabang dan tidak bersekat (A), klamidospora berbentuk globose (B)
Gambar 5 Bentuk spesifik sporangia Phytophthora citrophthora yang asimetris (A-C)
Tabel 2 Ukuran sporangia Phytophthoracitrophthora (panjang/lebar)
Bentuk sporangia Ukuran sporangia (µm) Panjang/lebar (µm)
A. distorsi (asimetris)
14.16 – 19.25 x 11.25 – 16.87
(rerata=18.75 x 15.00) 1.25
B. distorsi (asimetris)
11.25 – 16.87 x 9.12 – 14.24
(rerata=15.00 x 13.12) 1.14
C. distorsi (asimetris)
24.37 – 28.12 x 14.16 –
19.25(rerata=26.25 x 18.75) 1.40
A
B
[image:32.612.136.511.527.690.2]24
Secara mikroskopis cendawan patogen yang diduga Phytophthora citrophthora. memiliki hifa tidak bersekat, bercabang, catenulate, corraloid, hialin, halus sampai kasar, membengkak, bulat sampai lonjong (ovoid) dan tidak beraturan. Klamidospora globose terbentuk secara interkalar (Gambar 4b). Menurut kunci identifikasi Erwin & Ribeiro (1996), isolat Phytophthora spp. yang berasal dari Desa Oehala, Kabupaten Soe (NTT) adalah Phytophthora citrophthora (RE Smith & EH Smith) Leonian (1925).
Uji Postulat Koch
Uji postulat koch dilakukan pada bibit jeruk JC, karena pada awalnya JC dianggap tahan terhadap Phytophthora spp. dan memiliki sifat kompatibel yang tinggi terhadap batang atas. Tetapi dari waktu ke waktu, patogen terus mengalami evolusi dan memiliki kemampuan merubah genetik yang tinggi sehingga dapat membentuk strain baru yang lebih kuat serta memiliki patogenesitas yang tinggi. Uji postulat dilakukan dirumah kasa dengan pelukaan buatan (Gambar 6A) menunjukan gejala yang positif. Patogen ini dapat hidup sebagai endofit dalam organ tanaman, tanpa menghasilkan gejala dan tanda penyakit yang jelas. Penyakit hanya muncul apabila kondisi lingkungan tidak menguntungkan bagi tanaman. Sehingga tipe perkembangan gejala penyakit seperti ini disebut gejala laten, yaitu tipe perkembangan yang berbahaya dan menyulitkan dalam pengendalian. Pada tanaman kontrol tidak terlihat adanya gejala (Gambar 6B), sedangkan tanaman yang diinokulasi patogen pada permukaan batang gejala akan terlihat jelas jika pada titik inokulasi disayat, terdapat perbedaan yang jelas antara tanaman kontrol dan tanaman dengan perlakuan patogen.
yang lebih jelas permukaan batang disayat sampai ke kambium. Maryono (2010) melaporkan gejala penyakit BPB dengan inokulasi buatan isolat B. theobromae yang sama pada bibit JC menyebabkan gejala nekrosis pada kambium dan pembuluh, namun perkembangannya lambat (Gambar 6C). Menurut Umezurike (1979), nekrotik terjadi karena adanya aktivitas patogen yang menghasilkan enzim selulitik untuk mendegradasi selulosa dan hemiselulosa pada jaringan kayu bibit jeruk sehingga menjadi partikel-partikel yang lebih kecil dan dapat dimanfaatkan oleh patogen dan sebagai akibatnya jaringan tersebut mati.
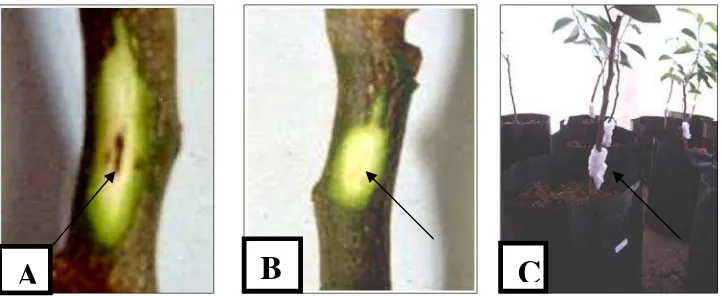
Gambar 6 Gejala nekrotik pada permukaan batang yang disayat (A), Tanpa gejala pada tanaman kontrol (B), Bibit JC yang diinokulasi patogen (C)
Perkembangan nekrosis menyebabkan daun menjadi berubah warna kemudian mati. Pada inokulasi P. citrophthora daun berubah warna menjadi coklat, sedangkan pada inokulasi B. theobromae daun menjadi berwarna hitam. Selanjutnya gejala berkembang menjadi gumosis. Gumosis adalah cairan yang dihasilkan oleh tumbuhan sebagai respon inang terhadap serangan patogen atau adanya benda asing yang ada dalam jaringan tanaman. Gumosis atau sering disebut blendok merupakan gejala khas pada BPB (Agrios 1996). Gejala Gumosis pada inokulasi oleh P. citrophthora dan B. theobromae terlihat berbeda berdasarkan warna dan kekentalannya (Gambar 7). Menurut Balitjestro (2006) permukaan batang atau kulit batang yang terserang Phytophthora spp.
26
[image:35.612.204.417.194.339.2]Permukaannya menjadi cekung, tidak merata dan mengeluarkan gumosis berwarna kuning yang encer dan mudah meluas (Gambar 7A). Sedangkan B. theobromae menghasilkan gumosis berwarna kuning kecoklatan dan lebih kental (Gambar 7B).
Gambar 7 Gejala Gumosis pada planlet JC yang diinokulasi P. citrophthora (A), diinokulasi B. theobromae (B) (Dhita 2010)
Pada uji planlet JC secara in vitro, secara berturut-turut menunjukan gejala klorosis, berkembang menjadi nekrotik, membentuk gumosis hingga menyebabkan kematian. Perkembangan pertumbuhan dan infeksi B. theobromae lebih cepat dibandingkan P. cithrophthora meskipun diawali klorosis pada waktu yang sama yaitu pada 3 Hsi. Perbedaan ini dipengaruhi oleh karakter masing-masing patogen. Menurut Sinaga (2000) P. citrophthora merupakan organisme hemibiotrop, dapat menyerang dan mendapatkan nutrisi dari jaringan hidup, tetapi masih mampu berkembang serta bersporulasi setelah jaringan inangnya mati. Meskipun perkembangan patogen ini lambat, namun pasti akan mematikan, begitupun B. theobromae memiliki siklus hidup yang cepat juga dapat mematikan inangnya. Sehingga teknik inokulasi secara in vitro lebih menguntungkan daripada teknik inokulasi langsung di lapang dilihat dari segi waktu yang dibutuhkan untuk mengetahui terjadinya proses infeksi yang ditunjukan oleh BPB (Dhita 2010).
Sedangkan gejala BPB pada pembibitan yaitu permukaan kulit batang yang terserang menjadi cekung dan mengeluarkan gumosis yang saat basah
terlihat bening, setelah mengering warnanya coklat keemasan. Bercak dapat meluas sampai mengelilingi batang. Akar terlihat membusuk sehingga bibit akan mengalami kematian (Gambar 8).
Gambar 8 Gejala gumosis di pembibitan (A), bercak yang meluas (B)
Uji Antagonisme Secara in vitro
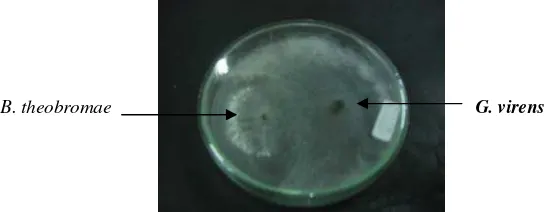
Pengujian dilakukan dengan metode Dual Culture secara in vitro dilaboratorium (Gambar 9). Isolat Gliocladium virens yang digunakan sebagai agens antagonis didapatkan dari eksplorasi bahan tanaman jeruk sakit yang berasal dari Banjarmasin. Sedangkan Trichoderma harzianum didapatkan dari koleksi Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, IPB. Media yang digunakan dalam percobaan yaitu media PDA dan V8 agar. Pertumbuhan Phytophthora spp. rendah pada media yang memiliki kandungan gula (maltosa dan glukosa) yang tinggi. Media V8 agar merupakan salah satu jenis media yang sangat disukai Phytophthora spp. karena memiliki kandungan kolesterol yang tinggi dan merangsang pembentukan oospora. Pada media PDA, terdapat asam laktat yang memiliki pH rendah sehingga menghambat pembentukan spora tetapi tidak menghambat perkembangan miseliumnya (Erwin & Ribeiro 1996). Sehingga media PDA dapat digunakan sebagai media untuk uji biakan ganda (dual culture) dimana pertumbuhan antara ke-2 koloni tersebut optimal, sehingga mengurangi kejadian penghambatan pertumbuhan Phytophthora spp. akibat media.
28
Pengujian dilakukan selama tujuh hari dengan mengukur jari-jari pertumbuhan kedua isolat yang ditanam, dimana R1 adalah jari-jari koloni isolat yang menjauhi agens antagonis; R2 adalah jari-jari koloni yang mendekati agens antagonis. Trichoderma sp. merupakan cendawan antagonis bagi patogen yang menginfeksi di perakaran dan batang tanaman. Cendawan ini menghasilkan enzim kitinase dan glukanase yang dikenal sebagai enzim yang terlibat dalam proses lisis dinding sel cendawan patogen selama proses antagonisme terjadi (Sulistyowati 2005). Menurut Sinaga 1986, Trichoderma sp. Merupakan cendawan yang tersebar luas di dunia dan terdapat hampir di berbagai jenis tanah dan habitat alam, terutama pada tanah yang mengandung bahan-bahan organik dan tanah yang diaplikasi kompos.
[image:37.612.172.449.346.452.2]B. theobromae B. theob G. virens
Gambar 9 Uji Antagonisme dengan metode dual culture
Selanjutnya interaksi yang terjadi adalah over growth, yaitu pertumbuhan koloni agens antagonis diatas koloni patogen. Mekanisme kompetisi juga terjadi dalam memperebutkan ruang dan nutrisi. Walaupun kompetisi tidak langsung melawan patogen, tetapi menghambat inokulum primer dari P. citrophthora untuk menginvasi lebih lanjut (Whipps & Lumsden 1996).
Berdasarkan pengamatan yang dilakukan selama 7 Hsi dengan mengukur jari-jari koloni patogen, nampak kemampuan antagonisme G. virens dan T. harzianum tidak berbeda nyata dan penghambatan patogen mencapai 100 % pada hari ketujuh. Peran Gliocladium maupun Trichoderma memberikan pengaruh yang nyata dengan mekanisme penghambatan yang sama yaitu hiperparasitisme, lisis dan toksisitas, serta kompetisi ruang dan hara (Tabel 3).
Tabel 3 Pengaruh Trichoderma harzianum dan Gliocladium virens terhadap persentase penghambatan Phytophthora citrophthora dan Botryodiplodia theobromae
a angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji selang berganda Duncan pada taraf nyata 5%.
Pemberian Trichoderma maupun Gliocladium dalam mengendalikan Botryodiplodia tidak memberikan pengaruh yang berbeda nyata karena keduanya memiliki mekanisme menghambat yang sama. Sedangkan pertumbuhan Phytophthora citrophthora lebih cepat dihambat oleh G. virens dibandingkan T. harzianum, dengan persen penghambatan masing-masing sebesar 100% dan 94.94% pada 7 Hsi.
No Perlakuan Persentase penghambatan pada hari ke-(%) a
1 2 3 4 5 6 7
1 A1B1 0.00h 0.00h 22.89g 50.16ef 68.90cd 84.46ab 94.94a
2 A1B2 0.00h 41.32f 62.44cde 86.17ab 92.02ab 97.67a 100a
3 A2B1 0.00h 0.00h 38.12f 56.89de 77.71bc 96.99a 100a
SIMPULAN DAN SARAN
Simpulan
Patogen yang ditemukan menyebabkan penyakit Gumosis pada 11 daerah sentra produksi jeruk di Indonesia yaitu Botryodiplodia theobromae Pat., sedangkan Phytophthora citrophthora hanya terdapat pada satu daerah produksi yaitu Desa Oehala, kabupaten Soe, Propinsi Nusa Tenggara Timur (NTT). Uji Postulat koch pada bibit jeruk JC dan planlet menunjukkan hasil yang positif. Agens antagonis Trichoderma harzianum maupun Gliocladium virens nyata dapat menekan pertumbuhan patogen dengan mekanisme hiperparasitisme, lisis dan toksisitas, serta persaingan ruang dan hara. Agens antagonis T. harzianum dan G. virens mampu menghambat kedua patogen dengan persentase 100 % pada hari ketujuh. Pertumbuhan P. citrophthora dapat lebih cepat ditekan dengan G. virens sedangkan penghambatan pertumbuhan B. theobromae oleh T. harzianum maupun G. virens tidak berbeda nyata.
Saran
Agrios G. 1996. Plant Pathology. Ed ke-3. New York:Academic Press.
Agrios GN. 2005. Plant Pathology. Ed ke-5. New York:Elsevier Academic Press. Anaf. 2009. Morfologi Gliocladium sp.http://anafzhu.blogspot.com [20 Januari
2011].
Balai Pengkajian Teknologi Pertanian Kalimantan Barat. 2009. Penyakit CVPD perlu ditangani dengan serius. http://kalbar.litbang.deptan.go.id [7 juli 2010].
Balitjestro. 2006. Penyediaan batang bawah dalam pengelolaan blok penangkar benih. http://www.citrusindo.org [25 Juni 2010].
Barnett HL, Hunter BB. 1998. Ilustrated Genera of Imperfect Fungi. Ed ke-4. Minnesota; Burgess Publishing Company.
[Deptan] Departemen Pertanian. 2009. Prospek dan arah pengembangan agribisnis jeruk tahun 2004. Dalam www. Deptan. go.id. [12 Juni 2010]
Dhita W. 2010. Pengembangan teknik uji ketahanan in vitro planlet mutan jeruk terhadap penyakit busuk pangkal batang jeruk [skripsi]. Bogor:IPB, Fakultas Pertanian.
Dinas Pertanian Sumatera Utara 2010. Lima komoditas hortikultura jadi primadona petani. http://www.medanbisnisdaily.com[15 Juli 2010]
Direktorat Jenderal Bina Produksi Hortikultura. 2003. Strategi pengembangan agribsinis jeruk di Indonesia. Lokakarya, kontes buah dan temu bisnis pamelo nasional, Batu-Jawa Timur, 13-14 Mei 2003. www.Deptan.go.id [26 Juni 2010].
Direktorat Perlindungan Tanaman Hortikultura. 2006. Peta penyebaran serangan OPT pada tanaman hortikultura. Hal 14
Erwin DC, Ribeiro OK. 1996. Phytophthora Diseases Worldwide. St Paul, Minnesota: APS Press.
Henuk JBD. 2010. Identifikasi dan uji patogenesitas penyebab busuk pangkal batang pada jeruk (Citrus spp) dari beberapa sentra produksi jeruk di Indonesia [Tesis]. Bogor:IPB, Fakultas Pertanian.
Maryono T. 2010. Peran FMA dan PGPR dalam menginduksi ketahanan tanaman jeruk terhadap penyakit busuk pangkal batang [Tesis]. Bogor:IPB, Fakultas Pertanian.
Mattjik AA, Sumertajaya IM. 2002. Perancangan percobaan dengan aplikasi SAS dan minitab. Bogor:Fakultas Matematika dan Ilmu Pengetahuan, IPB Press.
32
Mejia et al. 2000. Inoculation of beneficial endophyte fungi in to Theobroma cacao tissues. www.worldcocoafoundation.org [12 Juli 2010].
Phillips AJL. 2002. Anamorph genera associated with Botryosphaeria. Centro de Rescursos microbiologicos. Faculdade de ciencias e tecnologia. Universidade Nova de lisboa, 2829-516 Caparica, Portugal.
Sado F, Yumi I, Keisuke T, Satoshi T, Atsushio, Kazuko T. 2008. Black band of jews marrow caused by Lasiodiplodia theobromae. Journal of General Plant Pathology. 74:91-93.
Semangun H. 2000. Penyakit-penyakit Tanaman Hortikultura di Indonesia. Gadjah Mada University Press. Yogyakarta.
Sinaga MS. 1986. Biologycal control of some soil-borne fungal patogen of soybean (Glycine max (L) Merr.) with Gliocladium spp. [disertation]. Los Banos:University of the Philippines.
Sinaga MS. 2000. Dasar-dasar Penyakit Tumbuhan. Bogor: Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian IPB; Bogor.
Smith D, Onions AHS. 1994. The preservatons and maintanance of living Fungi. Oxon:Center for Agriculture and Bioscience International (CABI).
Sulistyowati et al. 2005. Isolation and sequencing of chitinase and glukanase of endophytic Trichoderma asperellum from Citrus Stem. The 1st International Conference of Crop Security;Malang, 20-22 September 2005. Malang:Crop Security for Food Safety and Human Health.hal 143. Sunarjono Hendro. 2004. Berkebun 21 jenis tanaman buah. Penebar Swadaya.
Bogor.
Timmer LW, SM Garnsey, J.H Graham. 2000. Compendium of Citrus Diseases 2nd id. The American Phytophatological society.92P.
Umezurike GM. 1979. The Cellulolytic Enzym of Botryodiplodia theobromae Pat.:Separation and characterization of cellulases and β -glucosidases.Biochem. 177:9-19.
Whipps JM, Lumsden RD. 1994. Biotechnology of fungi for improving plant growth. New York:Cambridge University Press.
34
Lampiran 1 Koloni isolat Botryodiplodia theobromae pada media PDA dari beberapa sentra produksi jeruk yaitu Kintamani (A), Kampar (B), Lampung (C), Berastagi (D), Jember (E), Garut (F), koloni isolat Phytophthora citrophthora pada media V8 agar berbentuk cottony (G), koloni isolat Phytophthora citrophthora pada media PDA berbentuk rosaceous (H)
A
B
C
D
E
F
P. citrophthora G. virens
B. theobromae
G. virens
B. theobromae
T. harzianum
Lampiran 2 Uji Antagonisme in vitro Gliocladium virens dengan Phytophthora citrophthora (A), Gliocladium virens dengan Botryodiplodia theobromae (B), dan Trichoderma harzianum dengan Botryodiplodia theobromae (6 Hsi)
A
B
36 A. Media Potato Dextrose Agar (PDA)
air destilata 1 liter
agar powder 15 gram
dekstrosa 20 gram
kentang 200 gram
Sebanyak 200 gram kentang yang telah dikupas dan dipotong-potong kemudian direbus dalam 1000 ml air steril dan dididihkan sampai empuk. Air hasil rebusan disaring dan ditambahkan air steril lagi hingga volumenya menjadi 1 liter. Lalu 20 gram dektrosa dan 15 gram agar dimasukan kedalamnya dan diautoklaf. Dektrosa dapat diganti dengan sukrosa untuk merangsang sporulasi berbagai jenis cendawan.
B. Media V-8 Juices Agar (Campbell soup) Air destilata 1 liter
Agar powder 20 gram
V-8 Juices Agar 200 ml
CaCo3 3 gram
Media ini merupakan media selektif yang digunakan untuk membantu pertumbuhan serta merangsang sporulasi cendawan. 200 ml sari V8 juice agar, 3 gram CaCo3, 20 gram agar dicampur dengan 800 ml air steril pH nya diatur antara 7-7,5 dengan pemberian CaCo3.
JERUK (Citrus spp.) SERTA UJI ANTAGONISME in vitro
DENGAN Trichoderma harzianum DAN Gliocladium virens
EKA RETNOSARI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
EKA RETNOSARI. Identifikasi Penyebab Busuk Pangkal Batang pada Jeruk (Citrus spp.) serta Uji Antagonisme in vitro dengan Trichoderma harzianum dan Gliocladium virens. Dibimbing oleh MEITY SURADJI SINAGA.
Penyakit Busuk Pangkal Batang (BPB) yang disebabkan oleh organisme mirip cendawan (fungal like microorganisme) Phythopthora spp. menjadi kendala utama dan menjadi faktor pembatas produksi jeruk nasional. Penyebab BPB dapat disebabkan oleh P.palmivora, P.parasitica atau P.citrophthora. Laporan terakhir menyebutkan bahwa 85 % pertanaman jeruk terserang penyakit BPB yang disebabkan oleh Botryodiplodia theobromae atau Diplodia natalensis. Sampai saat ini belum ada laporan dan identifikasi yang tepat mengenai spesies penyebab BPB. Oleh karena itu, perlu dilakukan identifikasi yang akurat untuk mengetahui spesies patogen tanaman jeruk penyebab BPB sebagai dasar untuk menentukan strategi pengendalian yang efektif dan efisien. Penelitian bertujuan untuk mengidentifikasi spesies penyebab BPB pada tanaman jeruk dari 11 sentra produksi jeruk di Indonesia yaitu, Garut (Jawa Barat), Jember & Malang (Jawa Timur), Kintamani (Bali), Soe (NTT), Banjarmasin & Banjarbaru (Kalimantan Selatan), Berastagi (Sumatera Utara), Kampar (Riau), Jambi, dan Lampung serta mengevaluasi kemampuan in vitro Trichoderma harzianum dan Gliocladium virens dalam menekan pertumbuhan patogen penyebab BPB. Metode identifikasi patogen dilakukan melalui pengamatan secara makroskopis dan mikroskopis. Karakter morfologi Phytophthora meliputi bentuk dan ukuran sporangium, papilla, dan klamidospora; sedangkan untuk Botryodiplodia atau Diplodia yang diamati yaitu bentuk dan ukuran stroma, piknidia, konidiofor, klamidospora, dan konidia. Identifikasi Phytophthora menggunakan kunci identifikasi Erwin & Ribeiro (1996), sedangkan untuk Botryodiplodia atau Diplodia menggunakan kunci Barnett & Hunter (1998). Uji Postulat Koch dilakukan untuk meyakinkan penyebab penyakit. Uji antagonisme in vitro dilakukan dengan metode Dual Culture. Hasil identifikasi menurut kunci identifikasi Erwin & Ribeiro dan Barnett & Hunter diketahui 11 isolat yang diperoleh dari Garut (Jawa Barat), Jember & Malang (Jawa Timur), Kintamani (Bali), Soe (NTT), Banjarmasin & Banjarbaru (Kalimantan Selatan), Berastagi (Sumatera Utara), Kampar (Riau), Jambi, dan Lampung merupakan Botryodiplodia theobromae yang menyerang 11 sentra produksi jeruk di Indonesia. Sedangkan 1 isolat asal Desa Oehala, Kabupaten Timor Tengah Selatan (TTS) / Soe, propinsi Nusa Tenggara Timur (NTT) merupakan Phytophthora citrophthora. Uji postulat koch isolat dari 11 daerah yang dilakukan di rumah kasa maupun pada planlet menunjukkan hasil positif. Hasil uji antagonisme in vitro menunjukkan T. harzianum dan G. virens nyata menghambat pertumbuhan P. citrophthora dan B. theobromae. Pertumbuhan P. citrophthora lebih cepat dihambat oleh G. virens dibandingkan dengan T. harzianum. Sedangkan penggunaan T. harzianum maupun G. virens tidak berbeda nyata dalam menghambat B. theobromae.
permintaannya cukup besar dari tahun ke tahun dan paling menguntungkan untuk diusahakan. Data dinas pertanian Sumut menunjukkan luas panen tahun 2008 mencapai 13.090 hektar dan pada tahun 2009 menjadi 12.086 hektar. Sementara total produksinya sebesar 858.508 ton,dan menurun pada tahun 2009 yaitu sebesar 728.796 ton per hektar. Kondisi tersebut menunjukan terjadinya penurunan total produksi jeruk di Sumatera Utara sebagai salah satu daerah produksi jeruk terbesar di Indonesia. Sedangkan data produksi jeruk nasional berkisar 17 – 25 ton/hektar dari potensi 25-40 ton/hektar (Deptan 2009). Sebesar 3% dari total produksi jeruk nasional di Indonesia merupakan produk impor. Sehingga saat ini Indonesia termasuk negara pengimpor jeruk terbesar kedua di ASEAN setelah Malaysia, dengan volume impor sebesar 94.696 ton; sedangkan ekspornya hanya sebesar 1.261 ton dengan tujuan ke Malaysia, Brunei Darussalam, dan Timur Tengah. karena kemampuan ekspor Indonesia masih lemah dibandingkan dengan negara produsen jeruk lainnya (Zainurihanif 2010).
2 yang disertai terbentuknya (gumosis) sehingga menjadi busuk dan bau asam. Terdapat berbagai jenis Phytophthora yang menyerang jeruk yaitu P. nicotianae, P. citrophthora, atau P. Palmivora (Erwin & Ribeiro 1996). Pada salah satu daerah sentra budidaya jeruk keprok Soe, kabupaten Timur Tengah Selatan (TTS), diduga penyakit BPB disebabkan oleh Botryodiplodia spp. (Semangun 2000). Penyakit BPB menjadi sangat penting karena dapat mematikan tanaman mulai saat masih di pembibitan, maupun tanaman yang sudah berproduksi di lapangan. Selama ini penyebab BPB pada jeruk di Indonesia selalu diidentifikasi sebagai Phytophthora spp., ternyata, dilaporkan patogen cendawan lain yang juga dapat menimbulkan penyakit BPB, yaitu Botryodiplodia theobromae atau Diplodia natalensis.
Sampai saat ini belum ada laporan identifikasi yang tepat mengenai patogen utama BPB di sentra produksi jeruk di Indonesia. Oleh karena itu perlu dilakukan identifikasi yang akurat dari suatu penyebab penyakit sebagai dasar dalam menyusun strategi pengendalian penyakit yang efektif dan efisien (Ma & Themis 2007).
Tujuan Penelitian
Percobaan ini bertujuan untuk (i) mengidentifikasi spesies penyebab BPB jeruk dengan metode konvensional berdasarkan karakter morfologi cendawan patogen. (ii) mengevaluasi kemampuan antagonisme in vitro Trichoderma harzianum dan Gliocladium virens dalam menekan pertumbuhan penyebab BPB.
Manfaat Penelitian
TINJAUAN PUSTAKA
Tanaman Jeruk
Tanaman jeruk (Citrus spp.) merupakan tanaman hortikultura dataran tinggi tropis yang beriklim kering. Jeruk dikenal berasal dari Asia Tenggara, yaitu India, Cina Selatan, dan beberapa jenis dari Florida, Australia Utara, dan Kaledonia. Jeruk memiliki banyak spesies dari enam genus, yakni Citrus, Microcitrus, Fortunella, Poncirus, Cymedia, dan Eremocirus. Namun, yang memiliki nilai ekonomi tinggi hanyalah Citrus.
Tanaman jeruk dapat ditanam di dataran rendah hingga dataran tinggi pada suhu antara 20-30 0 C. Jeruk keprok baik ditanam di ketinggian antara 100-1.300 meter diatas permukaan laut (mdpl); jeruk manis antara 700-1.300 mdpl; dengan iklim kering dan berada di tempat tebuka. Jeruk besar antara 70-600 mdpl; dan jeruk nipis antara 200-600 mdpl. Di dataran tinggi, jeruk besar akan menghasilkan buah yang rasanya pahit / tidak segar. Pada umumnya tanaman menghendaki tanah yang subur, gembur, dan banyak mengandung bahan organik, berporositas tinggi dengan pH tanah 5-6. Curah hujan sekitar 1500-2000 mm per tahun.
Varietas Unggul Jeruk
dikarenakan biji jeruk Poncirus trifoliata dan kerabatnya sukar didapat karena bijinya masih diimpor. Bibit jeruk dapat ditanam pada umur 8-12 bulan yang tingginya antara 60-100 cm. Pupuk buatan berupa campuran Urea, TSP atau SP-36 dn KCl yang diberikan secara teratur setiap tiga bulan sekali (Sunarjono 2004).
Jeruk Japanshe Citroen (Citrus limonia Osbeck)
Jeruk Japanshe Citroen (Citrus limonia Osbeck) atau sering disebut JC merupakan varietas hibrida yang dihasilkan dari persilangan antara Citroes nobilis (keprok) X Citroes medica (lemon). JC bersifat tahan terhadap kekeringan, dapat merangsang pembentukan buah lebih awal dari biasanya dan menghasilkan produksi tinggi dengan kualitas yang baik. Jenis ini kurang toleran terhadap penyakit Busuk Pangkal Batang.
Menurut Masyarakat, jeruk JC mempunyai ciri-ciri sebagai berikut:
1. Pohon tegar dan produktif, ukuran sedang, cabang menyebar dan merunduk, duri kecil dan sedikit
2. Daun berwarna hijau gelap, aroma daun menyengat, pupus warna ungu 3. Bunga berukuran kecil hingga sedang, putik dan kelopak bunga berwarna
ungu tua
4. Buah kecil hingga sedang, warna kulit buah bila masak kekuningan sampai jingga kemerahan
5. Biji jumlahnya banyak, berukuran kecil dan warna keping biji hijau muda, setiap buah berisi 8-10 biji
6. Tanah kekeringan
7. Daya dukung terhadap batang atas baik dan cepat menghasilkan buah yang berkualitas sedang hingga baik
8. Peka terhadap Phytophthora, Exocortis,dan Xyloporosis 9. Tahan terhadap Psorosis dan agak tahan terhadap Tristeza.
6 Batang bawah JC memiliki kompatibilitas yang baik. Penggunaan batang bawah JC bersifat lebih mendorong pertumbuhan vegetatif batang atas dibandingkan dengan Rough Lemon.
Penyakit Busuk Pangkal Batang Gejala Busuk Pangkal Batang
Penyakit busuk pangkal batang atau disebut “blendok” atau “gumosis” tersebar luas dan terdapat di semua sentra budidaya jeruk di seluruh dunia. Penyakit ini memiliki bermacam-macam nama, antara lain foot root atau busuk kaki, brown root gummosis, Pythiacystis gummosis. Di Indonesia adanya penyakit ini telah dilaporkan dari Sumatera, Jawa, Kalimantan Timur, dan Sulawesi Selatan. Gejala ini dimulai dari kulit batang berwarna kebasah-basahan dan mengeluarkan blendok (gom) encer. Pada umumnya pembusukan mulai dari tempat menempelnya batang atas untuk tanaman asal biji (semai) pada aras permukaan tanah.
Penyakit BPB jeruk dapat disebabkan oleh Phytophthora spp., Diplodia atau Botryodiplodia spp. Menurut laporan Erwin & Ribeiro (1996), terdapat 11 spesies Phytophthora yang dapat diisolasi dari pohon jeruk sakit, yaitu P. boehmeriae, P. cactorum, P. cinnamoni, P. citricola, P. citrophthora, P.
drecshleri, P. hibernalis, P. megasperma, P. palmivora, P. parasitica
(P.nicotianae), dan P. shyringae. Namun di Indonesia dilaporkan terdapat tiga spesies Phytophthora yang penting yaitu P. parasitica Dast. ( P. nicotianae ), P palmivora, dan P. citrophthora.
membentuk bunga salah waktu yang diikuti pembentukan buah. Tetapi buah ini tidak dapat menjadi besar dan rasanya pun tidak enak. Inilah fase pembentukan bunga dan buah yang terakhir.
Sedangkan penyakit kulit Diplodia juga menyerang pertanaman jeruk yang gejalanya hampir sama dengan penyakit busuk pangkal batang. Di Indonesia, penyakit ini terdapat di Sumatera, Jawa, Bali, dan Sulawesi Selatan. Jeruk besar (Pamelo) merupakan jenis jeruk yang paling banyak diserang oleh penyakit ini. Pada jeruk dikenal dua macam serangan Diplodia, yaitu Diplodia basah dan Diplodia kering. Gejala pada Diplodia basah yaitu keluarnya blendok atau gom yang berwarna kuning dari batang atau cabang-cabang besar. Kemudian kulit yang sakit mengelupas dan menjadi sembuh.
Tetapi sering penyakit berkembang terus, sehingga pada kulit terjadi luka yang tidak teratur, yang luas tapi dangkal. Patogen berkembang di antara kulit dan kayu, merusak kambium sehingga cabang segera digelang dan mati. Pada persemaian sering terjadi infeksi pada tempelan-tempelan (okulasi) baru, patogen masuk melalui luka. Sedangkan Diplodia kering ini lebih berbahaya, karena gejalanya sulit diketahui. Kulit mengering dan jika dipotong kulit dan kayu di bawahnya berwarna hitam kehijauan. Kulit yang sakit membentuk celah-celah kecil, dari dalamnya keluar massa spora yang semula berwana putih tetapi akhirnya berwarna hitam. Bagian yang sakit meluas dengan sangat cepat. Biasanya infeksi baru diketahui jika daun-daun telah menguning, sehingga batang atau cabang yang sakit tidak dapat ditolong lagi.
Penyebab Busuk Pangkal Batang
8
theobromae (Pat.) Griff. Et Maubl., yang dulu dikenal dengan nama Diplodia natalensis P. Evans.
Daur Penyakit
Dalam daur penyakit, Phytophthora dapat bertahan pada tanah dan membentuk sporangium dan spora kembara terutama dipencarkan oleh air hujan dan air yang mengalir dipermukaan tanah. Infeksi terjadi melalui luka alami maupun buatan karena alat-alat pertanian maupun hewan termasuk seranggga.
Sedangkan patogen penyebab penyakit kulit Diplodia sampai sekarang belum dikatahui daur penyakit dengan jelas karena Botryodiplodia merupakan cendawan yang polifag, menyerang bermacam-macam tumbuhan. Patogen ini termasuk parasit lemah yang mengadakan infeksi melalui luka-luka mekanis akibat pemangkasan. Konidium B. theobromae dapat dipencarkan oleh air dan serangga.
Sifat Umum Phytophthora spp. Morfologi Phytophthora spp.
Morfologi P. nicotianae var parasiticia sporangiumnya berbentuk jorong sampai agak bulat, berbentuk buah pir, 20-67 X 14-37 (42,5X 25,7) µm dengan sporangiofor lebih halus dari pada hifa yang lebarnya 9 µm. Spora mempunyai dua bulu cambuk (flagela) sehingga bisa bergerak dalam air, dan patogen dapat membentuk klamidospora bulat, berdinding agak tebal dengan garis tengah 20-60 µm. Sporangium dapat berkecambah secara tidak langsung dan mengeluarkan 18-24 spora kembara (zoospora) atau berkembang langsung dengan membentuk pembuluh kecambah. Klamidospora terbentuk pada interkalar atau terminal. Koloni pada PDA berbentuk arachnoid, tapi pada media V8 agar lebih halus atau seperti benang.
membentuk klamidospora. Pada media PDA, koloni petallate, sedangkan pada cornmeal agar, koloni stellate, lamose, indeterminate antara rosette dan lanose (Erwin & Ribeiro 1996). Sporangia P. citrophthora lebih panjang dibandingkan sporangia P. palmivora tetapi memiliki bentuk sporangia yang sangat bervariasi. P. citrophthora tidak menghasilkan oospora, tempera