KEMAMPUAN AKTINOMISET ENDOFIT SEBAGAI PENAMBAT NITROGEN DAN PERANNYA DALAM MENINGKATKAN
PERTUMBUHAN TANAMAN PADI
ANNISA PARAMITA PRATYASTO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Kemampuan Aktinomiset Endofit sebagai Penambat Nitrogen dan Perannya dalam Meningkatkan Pertumbuhan Tanaman Padi adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2012
ABSTRACT
ANNISA PARAMITA PRATYASTO. Capability of Endophytic Actinomycetes in Fixing Nitrogen and Their Role in Promoting Rice Seedlings Growth. Under direction of YULIN LESTARI and NISA RACHMANIA MUBARIK.
Nitrogen is the nutrient that most frequently limits on paddy productivity. Excessive chemical nitrogen fertilizer applied on conventional farming may have negative impact to the degradation of environment. An alternative solution for this problem is by using biological nitrogen fixation (BNF) to enhance crop growth which can be done by applying nitrogen fixing endophytic actinomycetes. The objective of this research was to obtain endophytic actinomycetes isolates which have the capability in fixing N2 based on vitro and planta assay. Based on in-vitro assay, SSW-02 was considered as the most promising N2 fixing bacteria based on its ability to reduce 2.1750 nmol acetylene/hour and produced ammonia 2.144 ppm for 15 days in free nitrogen medium. In-planta assessment was conducted in a greenhouse using IR-64 rice variety on sterile and non sterile soil with two-factors completely randomized factorial design. The factors were endophytic actinomycetes treatments which consisted of SSW-02, AB131-2, control and urea dosage which consisted of 0%, 50%, 100% dosage from 200 Kg/Ha. Each treatment had been done in three replications. Based on in-planta assay, SSW-02 application with 100% urea dosage increased total plant dry weight and leaf color. Although not significantly different, SSW-02 application with 50% urea dosage also had the highest number of tillering and ability to increase plant height and root length. Nitrogen content also increased by SSW-02 application with 100% urea dosage in sterile soil. Microscopic observation of SSW-02 and AB131-2 of rice treatment using reducing tetrazolium method showed that both of isolates were able to penetrate and colonize the root of rice, confirming them as endophytes. The results indicated that SSW-02 had promising role as a N2 fixing bacteria on rice plant.
RINGKASAN
ANNISA PARAMITA PRATYASTO. Kemampuan Aktinomiset Endofit sebagai Penambat Nitrogen dan Perannya dalam Meningkatkan Pertumbuhan Tanaman Padi . Dibimbing oleh YULIN LESTARI dan NISA RACHMANIA MUBARIK.
Pertambahan populasi penduduk di dunia berdampak langsung terhadap peningkatan kebutuhan akan produktivitas padi sebagai bahan pangan pokok di dunia, terutama di Indonesia. Produktivitas padi dibatasi salah satunya oleh kebutuhan akan nitrogen. Pengembangan keragaman pupuk yang responsif dan ditambah dengan kesadaran petani tentang pentingnya kebutuhan nitrogen, telah menyebabkan tingginya tingkat penggunaan pupuk nitrogen anorganik pada padi yang dapat membahayakan lingkungan. Salah satu solusi dari permasalahan di atas ialah memanfaatkan mikrob penambat N2 yaitu aktinomiset endofit yang dapat menjadi pelaku penambatan N2 di samping keistimewaannya dalam menghasilkan senyawa bioaktif dengan beragam fungsi seperti fitohormon, antimikrob dan enzim. Penelitian ini bertujuan untuk mengkaji kemampuan aktinomiset endofit terpilih dalam menambat N2 secara in-vitro dan in-planta serta mengetahui kemampuannya dalam meningkatkan pertumbuhan tanaman padi.
Mikrob yang digunakan dalam penelitian ialah 10 isolat aktinomiset endofit yang merupakan kelompok Streptomyces yaitu AB131-2, PS4-16, Impara 6A, AB131-1, AB131-3, A Fat, Membramo A, LSW-05, LBR-02, dan SSW-02 koleksi Laboratorium Mikrobiologi IPB. Peremajaan isolat aktinomiset endofit dilakukan dengan menggoreskan koloni isolat aktinomiset endofit pada media
Yeast Extract Starch Agar (YSA). Tahapan dalam penelitian ini dibagi menjadi dua tahapan yaitu uji kemampuan aktinomiset endofit dalam penambatan nitrogen secara in-vitro dan aktinomiset endofit terpilih diujikan secara in-planta. Secara
in-vitro, pada aktinomiset endofit dilakukan pengamatan kemampuan tumbuh pada media bebas nitrogen, uji penambatan nitrogen dengan metode reduksi asetilen dan uji produksi amonia dengan metode Nessler.
Aplikasi isolat aktinomiset endofit terpilih secara in-planta dilakukan pada padi varietas IR-64 di rumah kaca dengan kombinasi metode seed dressing dan
dipping dengan inokulan aktinomiset endofit terpilih. Desain penelitian dilakukan dengan Rancangan Acak Lengkap (RAL) faktorial dengan dua faktor yaitu faktor isolat aktinomiset endofit terpilih terdiri atas tiga taraf yaitu tanpa inokulasi (K), penambahan isolat aktinomiset endofit terpilih 1 (SSW-02) (S), dan penambahan isolat aktinomiset endofit terpilih 2 (AB131-2) (A); faktor dosis urea terdiri tiga taraf yaitu penggunaan dosis pupuk NPK sesuai standar (1) sebesar 200 Kg Urea/Ha: 100 Kg SP-36/Ha : 100 Kg KCl/Ha, setengah dosis standar pupuk Urea (0.5) dan tanpa pupuk Urea (0). Pengulangan dilakukan sebanyak tiga kali. Pengamatan mikrob endofit dalam jaringan akar padi dilakukan dengan pewarnaan tetrazolium dan pengamatan pertumbuhan vegetatif padi dilakukan setelah padi berumur 6 MST.
munculnya penataan rantai spora menunjukkan karakter Streptomyces spp. Penataan rantai spora pada aktinomiset endofit pun beragam seperti A Fat, LBR-02, PS4-16 dan LSW 05 memiliki tipe rantai spora Spirales, Impara 6 A dan AB131-3 memiliki tipe rantai spora Rectiflexibiles dan lainnya memiliki tipe rantai spora Retinaculiaperti.
Secara in-vitro, isolat aktinomiset endofit SSW-02 merupakan isolat terbaik yang mampu menambat nitrogen berdasarkan kemampuannya mereduksi asetilen sebesar 2.1750 nmol etilen/jam atau dengan reduksi asetilen spesifik sebesar 1.55 nmol etilen/jam per mg sel serta berdasarkan kemampuan produksi amonia yang dihasilkan sebesar 2.144 ppm dalam waktu optimum pertumbuhan 15 hari. Berdasarkan kemampuan reduksi asetilen dan produksi amonia, maka isolat aktinomiset endofit yang terpilih untuk diamati kemampuan penambatan N2 secara in-planta adalah isolat SSW-02 sebagai isolat dengan kemampuan penambatan N2 terbaik dan isolat AB131-2 sebagai isolat dengan kemampuan penambatan N2 rendah, namun memiliki kemampuan produksi IAA tertinggi.
Isolat SSW-02 dan AB131-2 juga mampu melakukan penetrasi di jaringan interseluler akar padi berdasarkan uji tetrazolium dengan akar padi setelah 6 minggu masa pertumbuhan vegetatif padi. Isolat SSW-02 memasuki bagian jaringan interselular akar, sedangkan, AB131-2 sebagian besar berada di daerah eksodermis dari arah irisan melintang akar. Kedua isolat juga berada di bagian pertengahan internal akar atau sekitar area korteks dan endodermis akar dari arah irisan membujur akar. Pada pengamatan hasil pertumbuhan vegetatif padi, aplikasi isolat SSW-02 mampu meningkatkan nilai warna hijau daun tertinggi sebesar 3.08 dan 3.00 pada tanah steril dan tidak steril juga peningkatan terhadap bobot kering total tanaman sebesar 17.44% dibandingkan kontrol pada tanah steril dengan penggunaan pupuk urea sebesar 100% (≈200 Kg Urea/Ha). Aplikasi SSW-02 dengan penggunaan pupuk urea 50% (≈100 Kg Urea/Ha) juga mampu menunjukkan peningkatan terhadap tinggi tanaman padi sebesar 4.05%, peningkatan panjang akar sebesar 10% dan peningkatan jumlah anakan sebesar 9% dibandingkan dengan kontrol di tanah steril. SSW-02 dengan dosis urea 100% juga menunjukkan peningkatan serapan nitrogen total tanaman padi tertinggi pada tanah steril sebesar 1.5005 g, namun di tanah tidak steril aplikasi AB131-2 memberikan hasil tertinggi sebesar 1.9426 g. Hal ini menunjukkan potensi aplikasi SSW-02 sebagai penambat N2 pada tanaman padi khususnya di tanah steril. Hal ini menunjukkan potensi aplikasi SSW-02 sebagai penambat N2 pada tanaman padi.
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
KEMAMPUAN AKTINOMISET ENDOFIT SEBAGAI PENAMBAT NITROGEN DAN PERANNYA DALAM MENINGKATKAN
PERTUMBUHAN TANAMAN PADI
ANNISA PARAMITA PRATYASTO
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Mikrobiologi
SEKOLAH PASCA SARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Kemampuan Aktinomiset Endofit sebagai Penambat Nitrogen dan Perannya dalam Meningkatkan Pertumbuhan Tanaman Padi
Nama Mahasiswa : Annisa Paramita Pratyasto
NRP : G351100161
Disetujui
Komisi Pembimbing
Dr. Ir. Yulin Lestari Dr. Nisa Rachmania Mubarik M.Si.
Ketua Anggota
Diketahui
Ketua Program Studi Mikrobiologi Dekan Sekolah Pascasarjana
Prof. Dr. Anja Meryandini, M.S. Dr. Ir. Dahrul Syah, M.Sc.Agr.
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Judul yang dipilih dalam penelitian ini yaitu Kemampuan Aktinomiset Endofit sebagai Penambat Nitrogen dan Perannya dalam Meningkatkan Pertumbuhan Tanaman Padi
Terima kasih penulis ucapkan kepada Dr. Ir. Yulin Lestari dan Dr. Nisa Rachmania Mubarik M.Si selaku pembimbing yang telah banyak memberikan arahan dan sarannya selama penulisan karya ilmiah ini. Terima kasih juga disampaikan kepada Dr. Ir. Sugiyanta M.Si.selaku penguji luar komisi dan Prof. Dr. Anja Meryandini, M.S. selaku Ketua Program Mayor Mikrobiologi IPB. Kepada I-MHERE B2c. IPB 2010/2012 terima kasih atas kepercayaannya untuk memberikan beasiswa kuliah selama menempuh pendidikan pascasarjana di IPB dan terimakasih atas hibah penelitian I-MHERE B2c. IPB a.n Dr. Ir. Yulin Lestari sehingga, penelitian yang saya lakukan dapat terlaksana dengan baik.
Penulis menyampaikan terima kasih kepada staf laboratorium Mikrobiologi, yaitu Mbak Heni dan Bapak Jaka, serta seluruh staf laboratorium Balai Penelitian Tanah, Litbang Pertanian Bogor khususnya Bapak Jatmo, Bu Ratih, dan Pak Yadi yang bersedia membantu penelitian saya. Ungkapan terima kasih juga penulis sampaikan kepada Gesti, Aya, Eka, Nia, Putri, Mbak Yessy, Mbak Diah, Sari, Pak Puji atas bantuan dan motivasinya selama penelitian. Ungkapan terima kasih disampaikan kepada ayah, ibu, Nadira Puspita Pratyasto, Citta Faradisa Pratyasto, serta Yudhi Hidayat atas doa, dukungan dan semangat yang diberikan. Kepada teman-teman Pascasarjana Mikrobiologi IPB 2010 terima kasih atas kebersamaan yang singkat dan sangat indah. Semoga penelitian ini dapat bermanfaat bagi kemajuan ilmu pengetahuan selanjutnya.
Bogor, Oktober 2012
RIWAYAT HIDUP
Penulis dilahirkan di Denpasar pada tanggal 2 Oktober 1987 dari ayah Ir. Lintjah Pratyasto dan ibu Ir. Ida Agustini Saidi, MP. Penulis merupakan putri pertama dari tiga bersaudara. Penulis lulus Sekolah Menengah Umum Negeri 16 Surabaya tahun 2005. Pada tahun yang sama penulis diterima masuk Universitas Gadjah Mada (UGM) sebagai mahasiswa Jurusan Teknologi Pangan dan Hasil Pertanian, Fakultas Teknologi Pertanian dan dinyatakan lulus S1 tahun 2009. Penulis sempat bekerja sebagai New Product Development Staff di PT. Synergy Beverage Indonesia pada periode Oktober 2010-Agustus 2011
Penulis melanjutkan pendidikan program Magister pada Sekolah Pascasarjana-Institut Pertanian Bogor (IPB) dengan memilih Program Mayor Mikrobiologi (MIK) dengan beasiswa program I-MHERE B2c. IPB pada tahun 2010. Saat menempuh pendidikan penulis pernah bekerja sebagai freelance reporter pada PT. Media Pangan Indonesia periode Juni 2011 hingga sekarang. Sebagai salah satu syarat untuk memperoleh gelar Magister Sains, penulis
DAFTAR ISI
Halaman
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xvii
DAFTAR LAMPIRAN ... xviii
PENDAHULUAN Latar Belakang ... 1
Perumusan Masalah ... 4
Hipotesis ... 4
Tujuan Penelitian ... 5
Manfaat Penelitian ... 5
Ruang Lingkup Penelitian ... 5
TINJAUAN PUSTAKA Aktinomiset Endofit ... 7
Penambatan Nitrogen ... 10
Padi ... 12
BAHAN DAN METODE Kerangka Penelitian ... 15
Rancangan Percobaan ... 16
Bahan ... 16
Peremajaan dan Pengamatan Mikroskopis Aktinomiset Endofit ... 18
Pengukuran Bobot Kering Sel Aktinomiset ... 18
Uji Kemampuan Aktinomiset Endofit dalam Penambatan N2 secara In-Vitro ... 18
Uji Kemampuan Aktinomiset Endofit dalam Penambatan N2 secara In-Planta ... 19
HASIL Pertumbuhan dan Morfologi Koloni Aktinomiset Endofit ... 23
Kemampuan Tumbuh Aktinomiset Endofit di Media Bebas Nitrogen ... 24
Aktivitas Penambatan Nitrogen Aktinomiset Endofit Berdasarkan Metode Reduksi Asetilen ... 25
Produksi Amonia oleh Aktinomiset Endofit ... 25
Kolonisasi Aktinomiset Endofit pada Jaringan Akar Padi ... 28
Kemampuan Aktinomiset Endofit Penambat Nitrogen dalam Peningkatan Pertumbuhan Vegetatif Tanaman Padi ... 29
Kemampuan Aktinomiset Endofit Penambat Nitrogen dalam Peningkatan Serapan Nitrogen Tanaman Padi ... 37
Kemampuan Aktinomiset Endofit dalam Penambatan N2 secara
In-Vitro ... 44
Kolonisasi Aktinomiset Endofit pada Jaringan Akar Padi ... 46
Kemampuan Aktinomiset Endofit Penambat Nitrogen dalam Peningkatan Pertumbuhan Vegetatif Tanaman Padi ... 47
Kemampuan Aktinomiset Endofit Penambat Nitrogen dalam Peningkatan Serapan Nitrogen Tanaman Padi ... 51
SIMPULAN DAN SARAN ... 55
Simpulan ... 55
Saran ... 55
DAFTAR PUSTAKA ... 57
DAFTAR TABEL
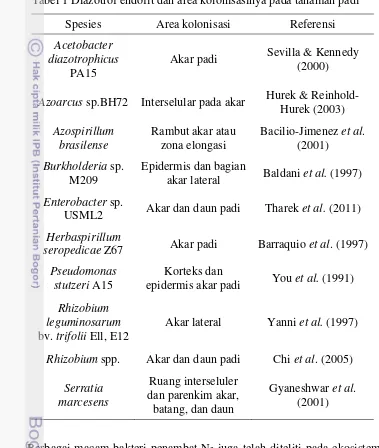
Halaman 1 Diazotrof endofit dan area kolonisasinya pada tanaman padi ... 2
2 Kemampuan aktinomiset endofit dalam mereduksi asetilen ... 25 3 Hasil uji kuantitatif produksi amonia aktinomiset endofit umur 15
hari ... 26 4 Pola produksi amonia pada isolat aktinomiset endofit terpilih ... 27 5 Pengaruh dosis urea dan aktinomiset terhadap tinggi tanaman padi
umur 6 MST pada tanah steril ... 30 6 Pengaruh dosis urea dan aktinomiset terhadap tinggi tanaman padi
umur 6 MST pada tanah tidak steril ... 30 7 Pengaruh dosis urea dan aktinomiset terhadap panjang akar
tanaman padi umur 6 MST pada tanah steril ... 31 8 Pengaruh dosis urea dan aktinomiset terhadap jumlah anakan
tanaman padi umur 6 MST pada tanah steril ... 32 9 Pengaruh dosis urea dan aktinomiset terhadap jumlah anakan
tanaman padi umur 6 MST pada tanah tidak steril ... 33 10 Pengaruh dosis urea dan aktinomiset terhadap nilai warna daun
tanaman padi umur 6 MST pada tanah steril ... 33 11 Pengaruh dosis urea dan aktinomiset terhadap nilai warna daun
tanaman padi umur 6 MST pada tanah tidak steril ... 34 12 Pengaruh dosis urea dan aktinomiset terhadap bobot kering akar
tanaman padi umur 6 MST pada tanah steril ... 34 13 Pengaruh dosis urea dan aktinomiset terhadap bobot kering akar
tanaman padi umur 6 MST pada tanah tidak steril ... 35 14 Pengaruh dosis urea dan aktinomiset terhadap bobot kering tajuk
tanaman padi umur 6 MST pada tanah tidak steril ... 36 15 Pengaruh dosis urea dan aktinomiset terhadap bobot kering total
tanaman padi umur 6 MST pada tanah steril ... 37 16 Pengaruh dosis urea dan aktinomiset terhadap serapan nitrogen
DAFTAR GAMBAR
Halaman
1 Proses penambatan N2 ... 10 2 Diagram alur penelitian ... 15 3 Pertumbuhan koloni isolat aktinomiset endofit di media YSA
umur 15 hari ... 23 4 Tipe penataan rantai spora aktinomiset ... 24 5 Pertumbuhan koloni isolat aktinomiset endofit di media bebas
nitrogen umur 15 hari ... 24 6 Hasil uji kualitatif produksi amonia dengan metode Nessler ... 26 7 Pola produksi amonia dengan metode Nessler ... 27 8 Kolonisasi aktinomiset endofit pada jaringan akar padi 6 MST ... 28 9 Pertumbuhan vegetatif tanaman padi pada tanah steril ... 29 10 Pertumbuhan vegetatif tanaman padi pada tanah tidak steril ... 29 11 Pengaruh dosis urea dan perlakuan aktinomiset terhadap panjang
akar tanaman padi umur 6 MST pada tanah tidak steril ... 31 12 Pengaruh dosis urea dan perlakuan aktinomiset terhadap bobot
kering tajuk tanaman padi umur 6 MST pada tanah tidak steril ... 35 13 Pengaruh dosis urea dan perlakuan aktinomiset terhadap bobot
kering total tanaman padi umur 6 MST pada tanah tidak steril ... 37 14 Pengaruh dosis urea dan perlakuan aktinomiset terhadap serapan
nitrogen akar tanaman padi umur 6 MST pada tanah tidak steril ... 38 15 Pengaruh dosis urea dan perlakuan aktinomiset terhadap serapan
nitrogen tajuk tanaman padi umur 6 MST pada tanah steril (a) dan tidak steril (b)... 39 16 Pengaruh dosis urea dan perlakuan aktinomiset terhadap serapan
DAFTAR LAMPIRAN
Halaman
1 Hasil analisis sidik ragam dan hasil uji lanjut Duncan nilai reduksi
asetilen dengan selang kepercayaan 95% ... 67 2 Hasil analisis sidik ragam dan hasil uji lanjut Duncan nilai produksi
amonia dengan selang kepercayaan 95% ... 68 3 Hasil produksi amonia oleh aktinomiset endofit pada hari ke-15 ... 69 4 Hasil produksi amonia isolat SSW-02 dan AB131-2 pada hari ke-5 ... 70 5 Hasil produksi amonia isolat SSW-02 dan AB131-2 pada hari ke-10 ... 70 6 Hasil produksi amonia isolat SSW-02 dan AB131-2 pada hari ke-15 ... 71 7 Perhitungan kebutuhan pupuk N, P, dan K dalam skala pot 5 Kg tanah ... 71 8 Data analisis sifat kimia tanah ultisol Cimanggu sebelum tanam ... 72 9 Kriteria penilaian sifat kimia tanah ... 72 10 Hasil analisis sidik ragam dan hasil uji lanjut Duncan tinggi padi pada
tanah steril dengan selang kepercayaan 95% ... 73 11 Hasil analisis sidik ragam dan hasil uji lanjut Duncan tinggi padi pada
tanah tidak steril dengan selang kepercayaan 95% ... 74 12 Hasil analisis sidik ragam dan hasil uji lanjut Duncan panjang akar pada
tanah steril dengan selang kepercayaan 95% ... 75 13 Hasil analisis sidik ragam dan hasil uji lanjut Duncan panjang akar pada
tanah tidak steril dengan selang kepercayaan 95% ... 76 14 Hasil analisis sidik ragam dan hasil uji lanjut Duncan jumlah anakan
pada tanah steril dengan selang kepercayaan 95% ... 77 15 Hasil analisis sidik ragam dan hasil uji lanjut Duncan jumlah anakan
pada tanah tidak steril dengan selang kepercayaan 95% ... 78 16 Hasil analisis sidik ragam dan hasil uji lanjut Duncan nilai warna daun
pada tanah steril dengan selang kepercayaan 95% ... 79 17 Hasil analisis sidik ragam dan hasil uji lanjut Duncan nilai warna daun
pada tanah tidak steril dengan selang kepercayaan 95% ... 80 18 Hasil analisis sidik ragam dan hasil uji lanjut Duncan bobot kering akar
pada tanah steril dengan selang kepercayaan 95% ... 81 19 Hasil analisis sidik ragam dan hasil uji lanjut Duncan bobot kering akar
20 Hasil analisis sidik ragam dan hasil uji lanjut Duncan bobot kering tajuk pada tanah steril dengan selang kepercayaan 95% ... 83 21 Hasil analisis sidik ragam dan hasil uji lanjut Duncan bobot kering
tajuk pada tanah tidak steril dengan selang kepercayaan 95% ... 84 22 Hasil analisis sidik ragam dan hasil uji lanjut Duncan bobot kering total
tanaman pada tanah steril dengan selang kepercayaan 95% ... 85 23 Hasil analisis sidik ragam dan hasil uji lanjut Duncan bobot kering total
tanaman pada tanah tidak steril dengan selang kepercayaan 95% ... 86 24 Hasil analisis sidik ragam dan hasil uji lanjut Duncan serapan nitrogen
akar pada tanah steril dengan selang kepercayaan 95% ... 87 25 Hasil analisis sidik ragam dan hasil uji lanjut Duncan serapan nitrogen
akar pada tanah tidak steril dengan selang kepercayaan 95% ... 88 26 Hasil analisis sidik ragam dan hasil uji lanjut Duncan serapan nitrogen
tajuk pada tanah steril dengan selang kepercayaan 95% ... 89 27 Hasil analisis sidik ragam dan hasil uji lanjut Duncan serapan nitrogen
tajuk pada tanah tidak steril dengan selang kepercayaan 95% ... 90 28 Hasil analisis sidik ragam dan hasil uji lanjut Duncan serapan nitrogen
total pada tanah steril dengan selang kepercayaan 95% ... 91 29 Hasil analisis sidik ragam dan hasil uji lanjut Duncan serapan nitrogen
PENDAHULUAN
Latar Belakang
Seiring dengan peningkatan penduduk di dunia, kebutuhan padi sebagai bahan baku utama produk pangan juga semakin meningkat. Produktivitas padi dibatasi salah satunya oleh kebutuhan akan nitrogen (Dawe 2000, Shenoy et al.
2001). Padi membutuhkan 1 Kg nitrogen untuk memproduksi 15-20 kg biji padi. Padi dataran rendah di tropik dapat menggunakan cukup N yang tersedia secara alami untuk memproduksi 2-3 Ton ha-1. Untuk hasil perolehan yang lebih tinggi, tambahan nitrogen harus diaplikasikan (Ladha & Reddy 2000). Pengembangan keragaman pupuk yang responsif dan ditambah dengan kesadaran petani tentang pentingnya kebutuhan nitrogen, telah menyebabkan tingginya tingkat penggunaan pupuk nitrogen anorganik pada padi. Penggunaan sejumlah besar pupuk anorganik dalam jangka waktu yang lama dapat menimbulkan pencemaran lingkungan, meningkatkan kebutuhan gas akan sumber daya alam yang tak dapat diperbarui, serta sisa produksi berupa gas CO2 dan NO2 yang berpotensi menimbulkan efek rumah kaca.
Salah satu solusi dari permasalahan di atas ialah memanfaatkan mikrob penambat N2 yang dapat mengurangi dampak lingkungan akibat penggunaan pupuk nitrogen sintetis. Jika sistem penambatan N2 secara biologis berbasis mikrob endofit dapat diterapkan pada tanaman padi, maka suplai nitrogen bagi tanaman akan meningkat sehingga pertumbuhan dan produktivitas padi juga meningkat. Jika sistem penambatan N2 secara biologi dapat dilakukan pada tanaman padi, maka hal ini dapat meningkatkan suplai nitrogen yang tersedia bagi tanaman hingga sebesar 50 Kg N/Ha lahan (Ladha & Reddy 2000, Cockrell 2004).
2
metabolit yang terdapat pada inang, proteksi terhadap kadar konsentrasi oksigen yang tinggi dan dapat mentransportasi nitrogen yang tertambat langsung kepada inang (Shenoy et al. 2001).
Tabel 1 Diazotrof endofit dan area kolonisasinya pada tanaman padi Spesies Area kolonisasi Referensi
Acetobacter diazotrophicus
PA15
Akar padi Sevilla & Kennedy (2000)
Azoarcus sp.BH72 Interselular pada akar Hurek & Reinhold-Hurek (2003)
Azospirillum brasilense
Rambut akar atau zona elongasi
Bacilio-Jimenez et al. (2001)
Burkholderia sp. M209
Epidermis dan bagian
akar lateral Baldani et al. (1997)
Enterobacter sp.
USML2 Akar dan daun padi Tharek et al. (2011)
Herbaspirillum
seropedicae Z67 Akar padi Barraquio et al. (1997)
Pseudomonas stutzeri A15
Korteks dan
epidermis akar padi You et al. (1991)
Rhizobium leguminosarum
bv. trifolii Ell, E12
Akar lateral Yanni et al. (1997)
Rhizobium spp. Akar dan daun padi Chi et al. (2005)
Serratia marcesens
Ruang interseluler dan parenkim akar,
batang, dan daun
Gyaneshwar et al. (2001)
3
meningkatkan tambatan nitrogen sebesar 11-19% total nitrogen, E. cloaceae pada padi varietas T65 berhasil meningkatkan 0-18% total nitrogen, dan Alcaligenes faecalis pada padi varietas Japonica dan Indica yang berhasil meningkatkan 20-30% total nitrogen (Shrestha & Maskey 2005). Bakteri endofit yang berperan pula sebagai diazotrof tersebut tersebar di berbagai area kolonisasi dari akar hingga duan padi (Tabel 1).
Aktinomiset endofit dapat menjadi pelaku penambat N2 di samping keistimewaannya dalam menghasilkan senyawa bioaktif dengan beragam fungsi seperti fitohormon, antimikrob, peningkat pertumbuhan tanaman dan produsen enzim yang sangat menguntungkan dalam bidang pertanian (Hasegawa et al. 2006, Mano & Morisaki 2008, Joseph et al. 2012). Hal ini dilaporkan Yuan dan Crawford (1995) yang telah meneliti beberapa spesies aktinomiset yang mampu menghasilkan zat pemacu pertumbuhan pada tanaman serta antibiotik selain sebagai penambat N2. Isolat aktinomiset endofit (Streptomyces sp.) yang diisolasi dari sweet pea juga telah diaplikasikan pada tanaman kedelai (Thapanapongworakul 2003, diacu dalam Soe et al. 2010). Isolat tersebut menunjukkan kemampuan anti cendawan patogen dan mampu meningkatkan pasokan nitrogen pada kedelai mencapai 83% serta kompatibel dengan penambahan Bradyrhizobium. Soe et al. (2010) juga menunjukkan kompatibilitas antara Streptomyces dengan Bradyrhizobium dan kemampuannya dalam peningkatan penambatan N2 pada tanaman kedelai. Mahendra dan Alvarez-Cohen (2005) juga telah berhasil meneliti Pseudonocardia dioxanivorans yang merupakan spesies aktinomiset baru dan memiliki kapabilitas penambatan N2.
4
padi khususnya IR-64 yang meningkat sesuai dengan periode pertumbuhan tanaman dan populasi tertinggi terjadi saat 4 minggu setelah tanam. Hal ini menunjukkan peran aktinomiset endofit pada tanaman padi khususnya saat masa vegetatif pertumbuhan padi.
Penelitian mengenai proses penambatan N2 secara biologi pada padi pada umumnya didominasi oleh bakteri diazotrof endofit non-aktinomiset, sedangkan aktinomiset endofit pada padi masih sangat jarang diteliti terutama pada kemampuannya dalam menambat N2 (Tian et al. 2004). Oleh sebab itu, penelitian terhadap aktinomiset endofit penambat N2 perlu dilakukan untuk melihat efektivitas aktinomiset dalam penambatan N2. Kajian kemampuan aktinomiset endofit dalam menambat N2 dapat dikaji baik secara in-vitro dengan metode reduksi asetilen, kemampuan tumbuh pada media bebas nitrogen, pengukuran produksi amonia, teknik 15N-isotop maupun secara in-planta dengan mengkombinasi inokulasi aktinomiset endofit dengan beberapa dosis pupuk anorganik. Dari hasil penelitian ini diharapkan mampu menjawab permasalahan terhadap kebutuhan nitrogen pada padi yang terbatas dan mampu meningkatkan pertumbuhan pada tanaman padi.
Perumusan Masalah
1. Nitrogen merupakan salah satu nutrisi pembatas pertumbuhan pada padi yang berkontribusi langsung terhadap produktivitas hasil panen.
2. Penggunaan pupuk nitrogen anorganik yang berlebihan dan terus-menerus mengakibatkan dampak negatif pada lingkungan.
3. Bakteri aktinomiset endofit dapat menjadi pelaku penambat N2 di samping keistimewaannya dalam menghasilkan senyawa bioaktif seperti fitohormon, antimikrob dan produsen enzim.
4. Penelitian tentang aktinomiset endofit pada padi masih jarang dilakukan dalam kapasitasnya sebagai penambat N2.
Hipotesis
5
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji kemampuan aktinomiset endofit terpilih dalam menambat N2 secara in-vitro dan in-planta serta mengetahui kemampuannya dalam meningkatkan pertumbuhan tanaman padi.
Manfaat Penelitian
Seleksi terhadap isolat aktinomiset endofit diharapkan mampu memilih satu isolat penambat nitrogen pada tanaman padi dengan kapasitas penambatan nitrogen paling optimal dan dapat meningkatkan pertumbuhan tanaman padi. Dari hasil yang telah diperoleh tersebut, diharapkan dapat dikembangkan produk hayati berbasis aktinomiset endofit yang mampu mensubstitusi kebutuhan nitrogen pada padi sekaligus meningkatkan pertumbuhannya serta merupakan alternatif yang tepat terhadap pemenuhan kebutuhan tanaman padi akan nitrogen yang ramah lingkungan.
Ruang Lingkup Penelitian
7
TINJAUAN PUSTAKA
Aktinomiset Endofit
Aktinomiset adalah kelompok bakteri Gram positif dengan kandungan GC yang tinggi (diatas 55 mol% G+C) (Otoguro et al. 2009, Sharma et al. 2012). Mayoritas aktinomiset biasanya dapat hidup baik dalam lingkungan netral hingga sedikit basa khususnya pada tanah, lingkungan rhizosfer dan mendegradasi bahan organik (Widyastuti & Ando 2009, Sharma et al. 2012). Aktinomiset juga menghasilkan struktur bertahan berupa spora yang dapat bertahan dalam kondisi tidak menguntungkan, seperti rendahnya kadar air dan suhu tinggi serta dapat bertahan dalam waktu yang lama. Tidak seperti bakteri penghasil spora lainnya, aktinomiset memproduksi spora sebagai cara utama bakteri ini dalam melakukan pemencaran atau dispersal (Schaad et al. 2000). Aktinomiset dikenal sebagai bakteri yang bersifat saprofit dan sangat umum dijumpai di rhizosfer hingga lapisan tanah dalam. Aktinomiset memiliki miselium aerial karena miselium dapat tumbuh pada lapisan udara. Ukuran miselium umumnya memiliki diameter 0,5-1,0 m, dengan panjang yang tidak tentu, dan tidak memiliki sekat pada fase vegetatif (Madigan & Martinko 2006).
Pada umumnya aktinomiset dibagi menjadi dua kelompok yaitu Streptomyces
dan non-Streptomyces atau rare actinomycetes. Genus Streptomyces dibentuk oleh Waksman & Henrici (1943) dan termasuk kelompok mikrob aerobik dengan kandungan G+C yang tinggi (69–78 mol%) dengan bentuk asal spora batang dari miselium substrat serta kelompok aktinomiset tersebut paling sering ditemukan di tanah dan mampu dikulturkan kembali (Otoguro et al. 2009, Widyastuti & Ando 2009). Streptomyces mempunyai filamen yang panjang dan bercabang serta membentuk rantai panjang spora udara yang disebut konidia. Pada media agar berwarna buram atau opak, tidak mengkilat, dan melekat kuat pada medianya.
Streptomyces spp. secara umum menyerupai kapang dengan ciri-ciri membentuk miselium aerial (Madigan & Martinko 2006). Struktur seluler kapang yang dimiliki
8
miselia aerial yang diikuti fragmentasi hifa yang membentuk cabang-cabang spora. Perbedaan dalam bentuk dan pembentukan filamen aerial serta munculnya struktur penataan spora dari beberapa spesies merupakan bagian utama yang digunakan untuk mengklasifikasi spesies Streptomyces. Konidia dan spora yang berpigmen memberikan peran dalam mengkarakterisasi koloni yang matang (Madigan & Martinko 2006). Menurut Miyadoh (1997), Streptomyces diklasifikasikan secara taksonomi sebagai berikut:
Dunia : Bacteria Divisi : Actinobacteria Kelas : Actinobacteria Ordo : Actinomycetales Famili : Streptomycetaceae Genus : Streptomyces
Schaad et al. (2000) melaporkan dari sekitar 400 spesies Streptomyces, sangat sedikit yang diketahui menjadi patogen pada tanaman. Isolasi aktinomiset dari jaringan tanaman dan lahan pertanian sering kali diperoleh aktinomiset yang bersifat saprofitik. Beberapa aktinomiset terbukti erat terkait dengan tumbuhan, yaitu pada penelitian Brunchorst yang berhasil mengisolasi genus Frankia dari nodul akar non legum pada tahun 1886 yang menunjukkan peran penambatan N2 dalam akar mirip dengan Rhizobium pada tanaman kacang-kacangan (Bandara et al.
2006).
9
Beberapa metabolit aktinomiset endofit langsung mempengaruhi fisiologi tanaman inang tetapi mikrob yang lain melakukannya secara tidak langsung dengan mempengaruhi populasi mikrob antibiosis atau melalui kompetisi. Aktinomiset pada tumbuhan inang dapat menghasilkan metabolit sebagai antibiotik, promoter pertumbuhan tanaman, inhibitor pertumbuhan tanaman, dan penghasil enzim. Oleh sebab itu, aktinomiset digunakan sebagai agen biokontrol, memproduksi jaringan tumbuhan yang memiliki ketahanan terhadap penyakit dan jaringan tumbuhan yang tahan terhadap kekeringan (Hasegawa et al. 2006).
Berdasarkan penelitian yang dilakukan oleh Tian et al. (2004), koloni
Streptomyces griseofuscus yang berhasil diisolasi mendominasi berkisar 36.1% - 69% pada padi dengan dua spesies berbeda di Guangdong, China. Selain itu, diketahui pula distribusi aktinomiset endofit pada tanaman padi kebanyakan berhasil diisolasi dari bagian akar daripada daun padi (Tian et al. 2004). Sardi et al.
(1992) juga berhasil mengisolasi aktinomiset endofit dari akar 28 spesies tanaman padi, dan didominasi oleh Streptomyces spp.. Aktinomiset endofit yang ditemukan tersebut memiliki kemampuan untuk memproduksi paling sedikit tiga jenis senyawa antagonistik di jaringan tanaman termasuk antibiotik, enzim, dan siderophores (Trejo-Estrada et al. 1998, Hasegawa et al. 2006).
Tian et al. (2004) dan Sardi et al. (1992) berhasil mengisolasi dan mengetahui dominansi Streptomyces spp. pada padi namun, penelitian mengenai aktinomiset endofit pada padi masih jarang dilakukan dengan kapasitasnya sebagai penambat N2. Penelitian aktinomiset endofit penambat N2 telah diaplikasikan pada kedelai oleh Soe et al. (2010), dengan inokulasi Streptomyces sp. disandingkan dengan
Bradyrhizobium. Dari hasil penelitian tersebut dinyatakan bahwa penggunaan
Streptomyces tidak menunjukkan hasil yang cukup signifikan namun lebih efektif ditambahkan pada inokulan dibandingkan penggunaan inokulasi Bradyrhizobium
10
pada padi yang ditujukan untuk kemampuan penambatan N2 masih belum banyak dilakukan penelitian lebih lanjut.
Penambatan Nitrogen
Penambatan N2 merupakan proses pengubahan N2 menjadi NH4+ yang berguna secara biologi. Penambatan N2 melibatkan penggunaan ATP dan proses reduksi ekuivalen berasal dari metabolisme primer. Semua reaksi yang terjadi dikatalisis oleh nitrogenase (White 2000).
Gambar 1 Proses penambatan N2 (Deacon 2012).
Mekanisme penambatan N2 menurut Sylvia et al. (1999), dimulai dengan dinitrogenase reduktase yang menerima elektron dari donor berupa ferredoksin tereduksi atau flavodoksin, dan berikatan dengan dua molekul MgATP. Elektron ditransfer menuju ke dinitrogenase. Dinitrogenase reduktase dan dinitrogenase membentuk kompleks, elektron ditransfer dan dua MgATP dihidrolisis menjadi dua molekul MgADP+Pi. Kompleks nitrogenase tersebut berdisosiasi dan dilakukan pengulangan proses. Ketika dinitrogenase telah mengumpulkan cukup elektron, senyawa tersebut mengikat molekul N2, mereduksinya dan dilanjutkan dengan pelepasan amonia. Dinitrogenase kemudian menerima tambahan elektron dari dinitrogenase reduktase untuk mengulangi proses tersebut. Reaksi penambatan N2 dapat dituliskan berdasarkan persamaan berikut:
N2 + 8H+ + 8e- + 16 ATP 2NH3 + H2 + 16ADP + 16 Pi Protein Fe tereduksi
Feredoksin teroksidasi Feredoksin tereduksi
Protein Fe teroksidasi
11
Serapan hidrogenase akan dikembalikan dalam bentuk H dalam sistem penambatan N2 (Gambar 1). Serapan hidrogenase yang dihasilkan dapat digunakan juga pada jalur konsumsi dioksigen untuk membantu menjaga kondisi lingkungan dalam keadaan anaerobik. Lingkungan anaerobik sangat penting bagi aktivitas nitrogenase diakibatkan karena kedua kompleks protein nitrogenase yang memiliki sensitivitas tinggi terhadap oksigen, sehingga kehadiran oksigen dapat menekan sistem serapan hidrogen dalam proses nitrogenase (Moat 2002).
Mikrob yang dapat melakukan penambatan N2 secara biologi disebut diazotrof dengan peranan utama dari enzim kompleks dinitrogenase. Diazotrof terdiri atas aerob (misal Azotobacter, Beijerinckia, Derxia), fakultatif anaerob (misal
Clostridium, Pseudomonas, Rhizobium), heterotrof (misal Klebsiella, Enterobacter) dan fototrof (misal Anabaena, Azospirillum, Nostoc). Berdasarkan hubungan fungsional dan spasial antar diazotrof dan inangnya, sistem diazotrof terdiri atas sistem diazotrof eksofit (bila diazotrof terdapat di luar tanaman inang) dan sistem diazotrof endofit (bila diazotrof terdapat di dalam tanaman inang). Sistem eksofit tersebut dapat merupakan free-living (bila diazotrof tidak kontak langsung dengan tanaman inang), asosiatif (bila diazotrof mendominasi permukaan luar, namun terkadang di dalam tanaman inang yaitu pada ruang interseluler) atau simbiotik (ketika diazotrof secara intraseluler berada pada tanaman inang) (Shenoy et al.
2001). Studi yang dilakukan telah menunjukkan bahwa nitrogen berasal dari udara dengan penambatan N2 yang berhasil ditambat oleh bakteri endofit berkisar 0-35% pada padi (Shrestha & Maskey 2005).
Metode reduksi asetilen merupakan salah satu cara untuk mengukur aktivitas nitrogenase dalam menambat N2. Nitrogenase mampu mereduksi N2 menjadi NH3, selain itu juga dapat mereduksi C2H2 menjadi C2H4, dengan kesetaraan reduksi C2H2 dan penambatan N2 sebesar 4:1 (Hardy 1973). Selain itu, pengukuran produksi amonia dengan nessler juga dapat dilakukan untuk mengukur output penambatan N2 yang dilakukan oleh mirob. Pengukuran produksi amonia tersebut didasarkan oleh prinsip pengikatan amonia (NH4) dengan Hg yang akan menimbulkan warna jingga pada sampel sesuai dengan reaksi berikut :
12
Kajian kemampuan aktinomiset endofit dalam menambat N2 dapat dikaji baik secara in-vitro seperti reduksi asetilen, kemampuan tumbuh pada media bebas nitrogen, pengukuran produksi amonia, teknik 15N-isotop maupun secara in-planta
dengan mengkombinasi inokulasi aktinomiset endofit dengan beberapa dosis pupuk anorganik.
Padi
Padi merupakan tanaman yang berumpun kuat dengan tinggi batang yang beragam (0,5-2 m). Helai daun berbentuk garis, kebanyakan bertepi kasar dan panjangnya 15-80 cm, serta memiliki malai dengan panjang 15-40 cm yang tumbuh ke atas dan ujungnya menggantung. Malai berupa bulir yang beraneka ragam, dengan ukuran 7-10 cm. Bulir yang masak akan menghasilkan buah yang kaya akan pati. Tanaman padi yang dapat tumbuh baik di daerah tropis ialah indica, sedangkan
japonica banyak diusahakan di daerah subtropis (Luh, 1991). Padi merupakan inang yang tepat bagi bakteri endofit yang dapat berdampak positif bagi pertumbuhan padi terutama pada akar, batang dan daunnya.
Menurut Cockrell (2004), padi memiliki nutrisi pembatas berupa nitrogen dan asosiasi dengan bakteri endofit penambat N2 dapat meningkatkan suplai nitrogen serta meningkatkan produktivitas pada tanaman padi. Padi membutuhkan 1 kg nitrogen untuk memproduksi 15-20 kg biji padi. Padi dataran rendah di daerah tropik dapat menggunakan cukup N yang tersedia alami untuk memproduksi 2-3 ton ha-1. Untuk hasil perolehan yang lebih tinggi, tambahan nitrogen harus diaplikasikan (Ladha & Reddy 2000). Berdasarkan Grist (1960), padi dapat diklasifikasikan secara taksonomi sebagai berikut:
Dunia : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Monocotyledoneae Ordo : Poales
Famili : Ginaceae Genus : Oryza
13
15
BAHAN DAN METODE
Kerangka Penelitian
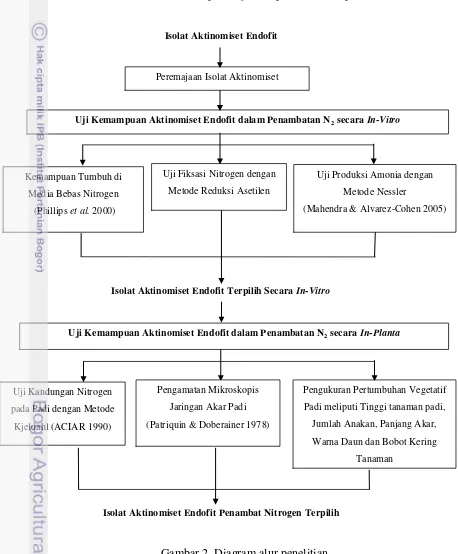
[image:41.595.78.536.181.735.2]Kerangka penelitian yang direncanakan (Gambar 2) meliputi peremajaan dan seleksi aktinomiset baik in-vitro maupun in-planta pada tanaman padi.
Gambar 2 Diagram alur penelitian.
Uji Fiksasi Nitrogen dengan
Metode Reduksi Asetilen
Uji Produksi Amonia dengan
Metode Nessler
(Mahendra & Alvarez-Cohen 2005) Peremajaan Isolat Aktinomiset
Uji Kemampuan Aktinomiset Endofit dalam Penambatan N2 secara In-Vitro
Kemampuan Tumbuh di
Media Bebas Nitrogen
(Phillips et al. 2000)
Uji Kemampuan Aktinomiset Endofit dalam Penambatan N2 secara In-Planta
Isolat Aktinomiset Endofit
Isolat Aktinomiset Endofit Terpilih Secara In-Vitro
Uji Kandungan Nitrogen
pada Padi dengan Metode
Kjeldahl (ACIAR 1990)
Pengukuran Pertumbuhan Vegetatif
Padi meliputi Tinggi tanaman padi,
Jumlah Anakan, Panjang Akar,
Warna Daun dan Bobot Kering
Tanaman
Isolat Aktinomiset Endofit Penambat Nitrogen Terpilih
Pengamatan Mikroskopis
Jaringan Akar Padi
16
Rancangan Percobaan
Penelitian dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL) faktorial dengan dua faktor yaitu perlakuan isolat aktinomiset endofit yang terpilih secara in-vitro dan dosis pupuk urea pada tanah steril dan tidak steril. Faktor perlakuan isolat aktinomiset endofit terpilih terdiri atas tiga taraf yaitu tanpa inokulasi (K), penambahan isolat aktinomiset endofit terpilih 1 (SSW-02) (S), dan penambahan isolat aktinomiset endofit terpilih 2 (AB131-2) (A). Faktor dosis pupuk urea terdiri tiga taraf yaitu penggunaan dosis pupuk NPK sesuai standar (1) sebesar 200 kg Urea/Ha: 100 kg SP-36/Ha: 100 kg KCl/Ha, setengah dosis standar pupuk Urea (0.5) dan tanpa pupuk Urea (0). Setiap perlakuan dilakukan pengulangan sebanyak tiga kali, sehingga jumlah plot percobaan dalam penelitian kali ini adalah 3 x 3 x 2 x 3 = 54 plot.
Berdasarkan rancangan acak lengkap faktorial yang telah disusun dengan tiga faktor perlakuan dapat diuraikan suatu model linear seperti di bawah ini:
Y ijkl= + αi + ßj + (αß)ij+ εijk i = 1,2,3 ; j = 1,2,3
Y ij = Nilai pengamatan pada satuan percobaan ke–l dengan kombinasi perlakuan ijk (taraf ke–i faktor perlakuan isolat aktinomiset endofit, taraf ke–j faktor dosis pupuk urea);
= Rataan umum;
αi = Pengaruh perlakuan isolat aktinomiset endofit taraf ke- i; ßj = Pengaruh dosis pupuk urea taraf ke-j;
(αß)ij = Pengaruh perlakuan isolat aktinomiset endofit taraf ke- i dan penambahan dosis urea taraf ke-j;
εij = Pengaruh galat dari satuan percobaan ke-k yang memperoleh kombinasi perlakuan ij.
Bahan
17
Laboratorium Mikrobiologi IPB. Enam isolat aktinomiset yaitu AB131-1, AB131-2, AB131-3, Impara 6A, A Fat, Membramo A merupakan aktinomiset endofit asal berbagai varietas tanaman padi yang ditanam di kebun percobaan Muara BB-Padi, Bogor, sedangkan empat lainnya PS4-16, LSW-05, LBR-02, dan SSW-02 merupakan isolat aktinomiset asal tanah hutan di Kalimantan (Yusepi 2011). Benih padi yang digunakan adalah benih padi varietas IR-64 yang diperoleh dari Balai Penelitian Tanah, Litbang Pertanian Bogor. Mikrob telah diuji berdasarkan kemampuan menghasilkan indol acetic acid (IAA), pelarutan fosfat, kitinase, HCN, dan anti mikrob (Yusepi 2011; Hastuti 2012).
Isolat aktinomiset yang diperoleh dari penelitian sebelumnya ditumbuhkan pada media peremajaan isolat sebagai kultur utama dan dilakukan penyiapan
working culture serta seed culture untuk peremajaan isolat kembali. Media peremajaan isolat aktinomiset yang digunakan yaitu media Yeast Extract Starch Agar (YSA) dengan komposisi media dalam 1 L terdiri atas 15 g pati terlarut, 4 g ekstrak khamir, 15 g bacto agar, 0.5 g K2HPO4 dan 0.5 g MgSO47 H2O dan
diinkubasi pada suhu ruang selama 14 hari.
Pada penelitian kali ini juga dibutuhkan media bebas nitrogen untuk pengujian penambatan nitrogen secara biologi dengan komposisi media dalam 1L terdiri atas komponen utama yaitu 1 g K2HPO4, 3 g KH2PO4, 0.065 g MgSO4, 0,01 g FeCl36H2O, 0.07 g CaCl22 H2O, 5 g dekstrosa dan komponen minor yaitu 240 g
Na2MoO42H2O, 3 g H3BO4, 1,83 g MnSO4H2O, 2λ0 g ZnSO47H2O, 130 g CuSO45H2O dan 120 g CoCl26H2O (Phillips et al. 2000).
Media bebas nitrogen tersebut dipergunakan untuk seleksi aktinomiset dan pengukuran penambatan N2 secara in-vitro, sedangkan untuk produksi isolat aktinomiset untuk pengujian in-planta digunakan media modified molasses-soy bean meal dalam 1 L terdiri atas 1 g molase, 2 g CaCo3, 1 g urea, 1 g SP-36, 1 g KCl, 1 g MgSO47H2O, 1 g NaCl, 0,001 g FeSO47H2O, 0,001 g MnCl27H2O, 0,001 g ZnSO47H2O, bubuk kedelai 0,5% (g/v) (Ulya 2009).
Benih padi yang digunakan dalam pengujian isolat aktinomiset endofit secara
18
penanaman padi berupa tanah ultisol Cimanggu, Bogor sebanyak 5 kg tanah per pot.
Peremajaan dan Pengamatan Mikroskopis Aktinomiset Endofit
Peremajaan isolat aktinomiset endofit dilakukan dengan menggoreskan koloni isolat aktinomiset endofit pada media Yeast Extract Starch Agar (YSA). Masa inkubasi isolat aktinomiset tersebut 14 hari pada suhu ruang. Media tersebut digunakan untuk mendukung pertumbuhan isolat aktinomiset secara optimal. Pengamatan morfologi mikroskopis aktinomiset endofit dilakukan menggunakan mikroskop cahaya dengan perbesaran 400 x.
Pengukuran Bobot Kering Sel Aktinomiset
Kultur aktinomiset yang telah ditumbuhkan pada media uji berupa media bebas nitrogen disentrifugasi dengan kecepatan 4000 x g (10000 rpm) pada suhu 4°C selama 30 menit. Kultur hasil sentifugasi disaring dengan menggunakan kertas saring hingga terpisah antara bagian pelet dan supernatan. Pelet dikeringkan di dalam oven selama 6 jam pada suhu 70°C, lalu ditimbang hingga konstan. Pengujian dilakukan sebanyak 3 kali ulangan.
Uji Kemampuan Aktinomiset Endofit dalam Penambatan N2 secara In-Vitro
Kemampuan Tumbuh di Media Bebas Nitrogen (Phillips et al. 2000).
Dalam seleksi isolat aktinomiset endofit yang berpotensi dapat melakukan penambatan N2 secara biologi dilakukan penginokulasian isolat aktinomiset pada media padat bebas nitrogen (Phillips et al. 2000).
Uji Penambatan Nitrogen dengan Metode Reduksi Asetilen. Kultur
aktinomiset endofit umur 5 hari sebanyak 2 cakram ( 5 mm) diinokulasikan pada media cair bebas nitrogen sebanyak 20 ml pada botol vial 50 ml selama 15 hari. Setelah masa inkubasi, botol vial ditutup dengan serum stopper dan 10% (3ml) dari
19
Uji Produksi Amonia dengan Metode Nessler (Mahendra & Alvarez-Cohen 2005). Kultur aktinomiset endofit umur 5 hari sebanyak 2 cakram ( 5 mm)
diinokulasikan pada 20 ml media cair bebas nitrogen pada botol bertutup dan diinkubasi pada inkubator bergoyang dengan kecepatan 125 rpm pada suhu ruang selama masa penambatan N2 15 hari pada suhu 30C. Penambahan 0.125 ml pereaksi Nessler (50 g KI, 22 g HgCl2, 500 ml larutan NaOH 5 M) dilakukan pada 5 ml kultur aktinomiset endofit. Pembentukan warna kuning hingga coklat menunjukkan reaksi positif terbentuknya ammonia dan kemudian dilakukan
pengukuran dengan spektrofotometer pada = 500 nm. Pengukuran amonia pada
media uji tanpa inokulasi digunakan sebagai kontrol, sedangkan 0-5 ppm NH3 digunakan dalam pembuatan kurva standar. Pola produksi amonia pada isolat aktinomiset endofit terpilih juga diamati tiap 5 hari hingga hari ke-15.
Uji Kemampuan Aktinomiset Endofit dalam Penambatan N2 secara In-Planta
Aplikasi Isolat Aktinomiset Endofit Terpilih secara In-Planta pada Tanaman Padi. Benih padi varietas IR-64 yang akan digunakan dalam pengujian ini, sebelum diberi perlakuan dan ditanam, terlebih dahulu harus dilakukan sterilisasi permukaan. Benih padi disterilisasi terlebih dahulu dengan alkohol 95% selama 20 detik kemudian dilakukan pembilasan tiga kali dengan air steril. Benih padi steril direndam pada 0.2% HgCl2 selama 8 menit, dilanjutkan pembilasan dan perendaman dalam air steril sebanyak enam kali dan dilanjutkan dengan perendaman dalam air steril selama 12 jam untuk merangsang perkecambahan.
Pembuatan inokulan dilakukan dengan menginokulasi sebanyak 5 cakram ( 5 mm) koloni aktinomiset endofit terpilih ke dalam 200 ml media modified molasses-soy bean meal (Ulya 2009) dan diinkubasi selama 15 hari. Kultur dipanen menggunakan sentrifugasi dengan kecepatan 1047 x g (10000 rpm) selama 15 menit pada suhu 4C untuk memisahkan supernatan dan pelet untuk pengukuran bobot basah aktinomiset.
20
per pot dengan sebelumnya diberi perlakuan tambahan yaitu perendaman akar padi hasil semai ke dalam inokulan aktinomiset endofit (dipping) masing-masing sebesar 2.5 gram selama 15 menit.
Media tumbuh yang digunakan adalah tanah ultisol, Cimanggu, Bogor sebesar 5 Kg/pot. Media tumbuh tanaman padi tersebut dianalisis sifat kimianya terlebih dahulu. Analisis sifat kimia tanah dilakukan di Laboratorium Kimia Tanah, Departemen Ilmu Tanah, Fakultas Pertanian IPB berupa pH, H2O, KCl, Bahan Organik %C (dengan metode Walkey & Black), %N (dengan metode Kjeldahl), P terlarut serta nilai tukar kation berupa Ca, Mg, K, Na, KTK, KB, Fe, Cu, Zn dan Mn. Media dimasukkan ke dalam pot berukuran 5 kg. Sebelum tanam, tanah digenangi sampai 5 cm dari permukaan tanah serta dilakukan pemupukan dasar sesuai dengan rancangan percobaan. Penelitian ini dilaksanakan selama pertumbuhan vegetatif padi yaitu sampai padi berumur 6 MST.
Selama masa pertumbuhan, padi diukur pertumbuhan dengan pengukuran ketinggian padi. Parameter yang diamati pada fase vegetatif akhir meliputi tinggi tanaman padi, jumlah anakan per rumpun, panjang akar, warna daun, bobot kering akar, bobot kering tajuk dan bobot kering total tanaman padi. Selain itu, juga dilakukan pengamatan mikroskopis jaringan akar tanaman padi (Patriquin & Doberainer 1978) dan pengukuran kandungan nitrogen padi dengan metode
Kjeldahl (ACIAR 1990). Dari hasil data pengukuran pertumbuhan padi dan pengukuran kapasitas penambatan N2 dan kandungan nitrogen pada jaringan tanaman dipilih satu isolat terbaik pada aktinomiset endofit penambat N2.
Pengamatan Mikroskopis Jaringan Akar Padi. Pengamatan dilakukan pada akar tanaman padi umur 6 MST dengan metode reducing tetrazolium
21
Uji Kandungan Nitrogen pada Padi dengan Metode Kjeldahl (ACIAR 1990). 0.25 g sampel tanaman dipindahkan ke tabung digesti beserta 1 g campuran
selen dan 2.5 ml H2SO4 p.a. Campuran diratakan dan diinkubasi dalam suhu ruang selama semalam untuk perarangan. Setelah inkubasi, tahapan dilanjutkan dengan pemanasan ke dalam blok digesti hingga suhu 350C. Akhir destruksi ditandai dengan adanya uap putih dan didapatkan ekstrak jernih (sekitar 4 jam). Tabung diangkat dan didinginkan, sehingga ekstrak dapat diencerkan dengan air destilata hingga tepat 50 ml dan dikocok sampai homogen. Selanjutnya campuran tersebut, dibiarkan semalam hingga partikel mengendap. Ekstrak jernih digunakan untuk pengukuran N dengan cara destilasi. Pipet 10 ml ekstrak contoh ke dalam labu didih. Sedikit serbuk batu didih dan aquades ditambahkan hingga setengah volume labu. Penampung NH3 yang dibebaskan yaitu Erlenmeyer yang berisi 10 ml asam borat 1% ditambahkan dua tetes indikator Conway (mengandung 0,100 g methyl red dan 0,15 g bromcresol green dengan 200 ml etanol 96%) dan dihubungkan dengan alat destilasi. NaOH 40% sebanyak 10 ml ditambahkan ke dalam labu didih yang berisi sampel dan secepatnya ditutup. Destilasi hingga volume penampung mencapai 50-75 ml (berwarna hijau). Destilat dititrasi dengan H2SO4 0,05 N hingga warna merah muda dan dilakukan pencatatan volume titar sampel (Vs) dan blanko (Vb).
Kadar N (%) = (Vs-Vb) x N x 28 x fk Keterangan:
Vs, Vb = ml titar sampel dan blanko N = Normalitas larutan baku H2SO4
fk = faktor koreksi kadar air = 100/(100-% kadar air)
23
HASIL
Pertumbuhan dan Morfologi Koloni Aktinomiset Endofit
[image:49.595.113.487.260.413.2]Sepuluh isolat aktinomiset endofit dapat tumbuh baik dengan morfologi koloni yang beragam pada media YSA. AB131-1, SSW-02, A Fat, Membramo A memiliki miselia berwarna coklat tua, AB131-2 dengan miselia berwarna hijau tua, Impara 6A memiliki miselia berwarna putih serta lainnya memiliki miselia coklat muda (Gambar 3).
Gambar 3 Pertumbuhan koloni isolat aktinomiset endofit di media YSA umur 15 hari: (a) Membramo A; (b) SSW-02; (c) AB131-2; (d) A-fat; (e) PS4-16; (f) LBR 02; (g) LSW 05; (h) Impara 6A; (i) AB131-1; (j) AB131-3.
Keseluruhan isolat aktinomiset endofit juga mampu membentuk penataan rantai spora yang beragam dan tersusun baik dengan bentuk keriting, kait, maupun spiral pada mikroskop dengan perbesaran 400X di media YSA (Gambar 4). Perbedaan dalam pembentukan miselia aerial serta munculnya penataan rantai spora menunjukkan karakter Streptomyces spp.
Dari hasil pengamatan terhadap rantai spora dari kesepuluh isolat aktinomiset (Gambar 4) maka diketahui bahwa A Fat, LBR-02, PS4-16 dan LSW 05 memiliki tipe rantai spora S, Impara 6 A dan AB131-3 memiliki tipe rantai spora RF dan AB131-1, AB131-2, Membramo A serta SSW-02 memiliki tipe rantai spora RA.
d
b c
a e
24
[image:50.595.37.488.39.843.2]
Gambar 4 Tipe penataan rantai spora aktinomiset. Pengamatan mikroskop dengan perbesaran 400x. Tipe Spirales (S): a) A Fat; b) LSW 05; c) PS4-16; d) LBR 02, Tipe Rectiflexibiles (RF): e) Impara 6 A; f) AB131-3 dan Tipe Retinaculiaperti (RA): g) AB131-1; h) AB131-2; i) Membramo A; j) SSW-02.
Kemampuan Tumbuh Aktinomiset Endofit di Media Bebas Nitrogen
Kesepuluh isolat aktinomiset endofit berhasil tumbuh di media bebas nitrogen (Gambar 5) dengan kecepatan pertumbuhan yang beragam, namun cenderung lebih lambat dibandingkan dengan pertumbuhan pada media yang mengandung nitrogen seperti medium YSA (Gambar 4).
Gambar 5 Pertumbuhan koloni isolat aktinomiset endofit di media bebas nitrogen umur 15 hari: (a) Membramo A; (b) SSW-02; (c) AB131-2; (d) A-fat; (e) PS4-16; (f) LBR 02; (g) LSW 05; (h) Impara 6A; (i) AB131-1; (j) AB131-3.
Miselium aktinomiset endofit terbentuk sempurna setelah dua minggu masa pertumbuhan di media bebas nitrogen, sedangkan pada medium dengan nitrogen
e d
c a
a c d e
g b
f h i j
h
f
i
g j
25
tercukupi seperti pada medium YSA miselium aktinomiset endofit dapat diamati setelah lima hari masa pertumbuhan.
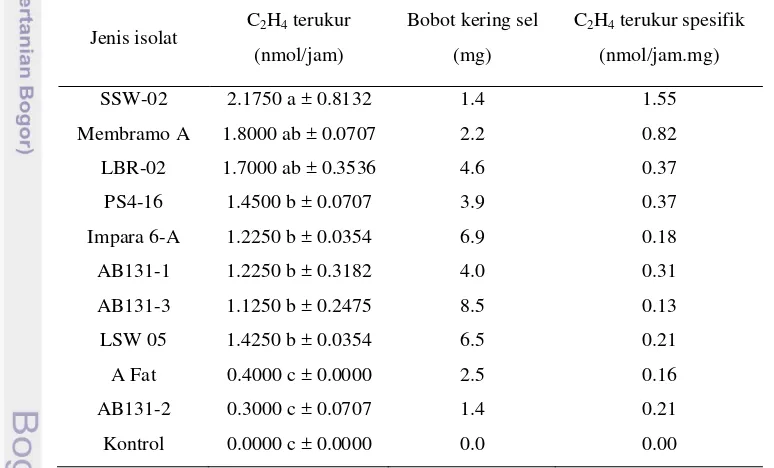
Aktivitas Penambatan Nitrogen Aktinomiset Endofit Berdasarkan Metode Reduksi Asetilen
[image:51.595.105.492.376.610.2]Aktivitas nitrogenase pada aktinomiset endofit diuji berdasarkan metode reduksi asetilen. Data hasil uji reduksi asetilen (Tabel 2) menunjukkan bahwa kesepuluh isolat aktinomiset endofit mampu mereduksi asetilen melalui aktivitas nitrogenase. Isolat SSW-02 paling berpengaruh terhadap kemampuan reduksi asetilen sebesar 2.1750 nmol etilen/jam dibandingkan isolat lainnya. SSW-02 memiliki aktivitas reduksi asetilen spesifik tertinggi sebesar 1.55 nmol etilen/jam per mg sel.
Tabel 2 Kemampuan aktinomiset endofit dalam mereduksi asetilen
Jenis isolat C2H4 terukur (nmol/jam)
Bobot kering sel
(mg)
C2H4 terukur spesifik
(nmol/jam.mg)
SSW-02 2.1750 a ± 0.8132 1.4 1.55
Membramo A 1.8000 ab ± 0.0707 2.2 0.82
LBR-02 1.7000 ab ± 0.3536 4.6 0.37
PS4-16 1.4500 b ± 0.0707 3.9 0.37
Impara 6-A 1.2250 b ± 0.0354 6.9 0.18
AB131-1 1.2250 b ± 0.3182 4.0 0.31
AB131-3 1.1250 b ± 0.2475 8.5 0.13
LSW 05 1.4250 b ± 0.0354 6.5 0.21
A Fat 0.4000 c ± 0.0000 2.5 0.16
AB131-2 0.3000 c ± 0.0707 1.4 0.21
Kontrol 0.0000 c ± 0.0000 0.0 0.00
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata menurut uji Duncan pada taraf 5%.
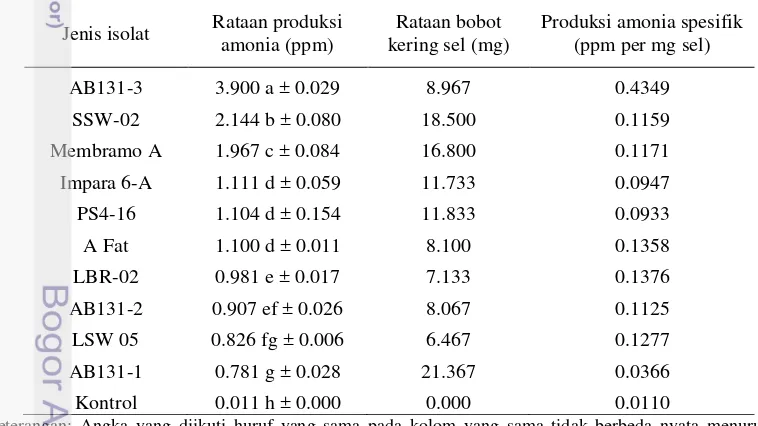
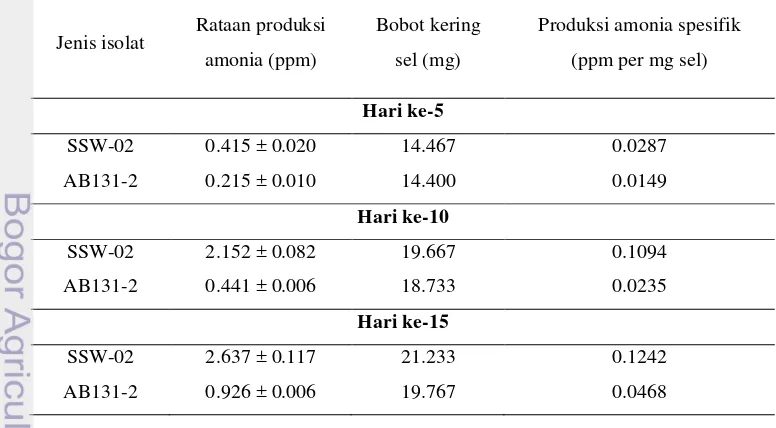
Produksi Amonia oleh Aktinomiset Endofit
26
dengan amonia. Tiap isolat aktinomiset endofit memproduksi amonia yang beragam. Isolat AB131-3, SSW-02 dan Membramo-A memiliki intensitas pembentukan warna jingga yang lebih tinggi dibandingkan isolat aktinomiset endofit lainnya.
Gambar 6 Hasil uji kualitatif produksi amonia dengan metode Nessler: a) AB131-3; b) SSW-02; c) Membramo-A; d) Impara 6-A; e) A Fat; f) PS4-16, g) LBR-02; h) AB131-2; i) AB131-1; j) LSW-05; k) kontrol.
[image:52.595.90.469.439.652.2]Hasil uji kuantitatif pengukuran konsentrasi amonia dengan metode Nessler (Tabel 3) menegaskan bahwa isolat AB131-3 dan SSW-02 memiliki kemampuan produksi amonia lebih tinggi dibandingkan isolat lainnya yaitu sebesar 3.900 ppm dan 2.144 ppm, dimana bobot kering AB131-3 8.967 mg dan SSW-02 18.500 mg. Hal ini sesuai dengan hasil pengukuran uji kualitatif Nessler (Gambar 6).
Tabel 3 Hasil uji kuantitatif produksi amonia aktinomiset endofit umur 15 hari
Jenis isolat Rataan produksi amonia (ppm)
Rataan bobot kering sel (mg)
Produksi amonia spesifik (ppm per mg sel)
AB131-3 3.900 a ± 0.029 8.967 0.4349
SSW-02 2.144 b ± 0.080 18.500 0.1159
Membramo A 1.967 c ± 0.084 16.800 0.1171
Impara 6-A 1.111 d ± 0.059 11.733 0.0947
PS4-16 1.104 d ± 0.154 11.833 0.0933
A Fat 1.100 d ± 0.011 8.100 0.1358
LBR-02 0.981 e ± 0.017 7.133 0.1376
AB131-2 0.907 ef ± 0.026 8.067 0.1125
LSW 05 0.826 fg ± 0.006 6.467 0.1277
AB131-1 0.781 g ± 0.028 21.367 0.0366
Kontrol 0.011 h ± 0.000 0.000 0.0110
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata menurut uji Duncan pada taraf 5%.
Berdasarkan kemampuan reduksi asetilen dan produksi amonia, maka isolat aktinomiset endofit yang terpilih untuk diamati kemampuan penambatan N2 secara
in-planta ialah isolat SSW-02 sebagai isolat dengan kemampuan penambatan N2 terbaik. Isolat AB131-2 juga dipilih sebagai isolat yang akan diuji secara in-planta
b d e f g h i j k
27
didasarkan atas kemampuan penambatan N2 yang rendah, namun memiliki kemampuan produksi asam indol asetat yang paling tinggi sebesar 99.23 ppm (lebih tinggi dibanding SSW-02 sebesar 10.81 ppm) dan kemampuan produksi senyawa anti patogen (Hastuti 2012; Yusepi 2011). Pemilihan kedua isolat terpilih tersebut dilakukan untuk mengevaluasi kapasitas bakteri penambat N2 SSW-02 dibandingkan dengan AB131-2 dalam peningkatan pertumbuhan tanaman padi.
[image:53.595.108.488.86.738.2]
Gambar 7 Pola produksi amonia dengan metode Nessler ( Keterangan: AB131-2, SSW-02).
Tabel 4 Pola produksi amonia pada isolat aktinomiset endofit terpilih
Jenis isolat Rataan produksi amonia (ppm)
Bobot kering
sel (mg)
Produksi amonia spesifik
(ppm per mg sel)
Hari ke-5
SSW-02 0.415 ± 0.020 14.467 0.0287
AB131-2 0.215 ± 0.010 14.400 0.0149
Hari ke-10
SSW-02 2.152 ± 0.082 19.667 0.1094
AB131-2 0.441 ± 0.006 18.733 0.0235
Hari ke-15
SSW-02 2.637 ± 0.117 21.233 0.1242
AB131-2 0.926 ± 0.006 19.767 0.0468
Pola produksi amonia dari kedua isolat aktinomiset endofit terpilih menunjukkan bahwa AB131-2 dan SSW-02 memiliki produksi amonia tertinggi
0.215
0.441 0.926
0.011 0.415 2.152 2.637 0 0.5 1 1.5 2 2.5 3
0 5 10 15 20
P
roduk
si amoni
a (
ppm)
[image:53.595.109.497.485.699.2]28
pada hari ke-15 dengan produksi amonia pada isolat SSW-02 sebesar 2.637 ppm dan produksi amonia pada isolat AB131-2 sebesar 0.926 ppm (Gambar 7). Hasil pengukuran bobot kering sel juga menunjukkan bobot kering sel tertinggi pada kedua isolat aktinomiset endofit tertinggi pada hari ke-15 (Tabel 4). Jika dihubungkan dengan kurva produksi amonia, maka produksi amonia dihasilkan paling tinggi setelah bobot kering sel yang dihasilkan pada kedua isolat aktinomiset endofit mencapai akhir optimum masa pertumbuhan. Hal ini menunjukkan bahwa bobot kering sel yang tinggi dari masing-masing isolat mempengaruhi produksi amonia oleh kedua isolat aktinomiset endofit tersebut.
Kolonisasi Aktinomiset Endofit pada Jaringan Akar Padi
Pengamatan mikroskopis akar padi yang diberi perlakuan tetrazolium baik pada SSW-02, AB131-2 dan kontrol menunjukkan pada tanaman padi dengan perlakuan isolat aktinomiset endofit terdapat koloni berwarna merah pada jaringan internal akar padi yang diduga merupakan aktinomiset endofit yang mengolonisasi bagian akar lateral padi (Gambar 8) dibandingkan dengan kontrol yang tidak terdapat koloni berwarna merah pada bagian internal akar.
Gambar 8 Kolonisasi aktinomiset endofit pada jaringan akar padi 6 MST. Pengamatan mikroskop dengan perbesaran 400x. irisan membujur: a) SSW-02, b) AB131-2, c) kontrol; irisan melintang: (d) SSW-02 (e) AB131-2; (f) kontrol.
Pada penampakan irisan melintang akar, isolat SSW-02 tampak memasuki bagian jaringan interselular akar, sedangkan isolat AB131-2 sebagian besar berada di daerah eksodermis dan pada kontrol tidak ditemukan koloni berwarna merah
a b
d e f
[image:54.595.77.487.134.816.2]29
pada bagian interselular akar. Pada penampakan irisan membujur akar, kedua isolat baik SSW-02 dan AB131-2 terletak beredar di bagian pertengahan internal akar atau sekitar area korteks dan endodermis akar, sedangkan kontrol tidak terdapat koloni merah pada bagian akar padi.
Kemampuan Aktinomiset Endofit Penambat Nitrogen dalam Peningkatan Pertumbuhan Vegetatif Tanaman Padi
Pada hasil uji in-planta umur 6 MST pada tanah steril (Gambar 9) terlihat bahwa pertumbuhan vegetatif padi memiliki pertumbuhan yang lebih tinggi dibandingkan pada tanah steril (Gambar 10).
Gambar 9 Pertumbuhan vegetatif tanaman padi pada tanah steril. Keterangan:
K1/S1/A1 = dengan pemupukan 100% (≈ 200 kg Urea/Ha),
K0.5/S0.5/A0.5 = dengan pemupukan 50% (≈ 100 kg Urea/Ha), K0/S0/A0 = dengan pemupukan 0% (≈ 0 kg Urea/Ha).
Gambar 10 Pertumbuhan vegetatif tanaman padi pada tanah tidak steril. Keterangan: K1/S1/A1 = dengan pemupukan 100% (≈ 200 kg Urea/Ha), K0.5/S0.5/A0.5 = dengan pemupukan 50% (≈ 100 kg Urea/Ha), K0/S0/A0 = dengan pemupukan 0% (≈ 0 kg Urea/Ha).
Tinggi Tanaman Padi. Data hasil uji in-planta menunjukkan bahwa tidak terjadi interaksi antara faktor dosis pupuk dan perlakuan aktinomiset endofit pada parameter tinggi tanaman padi baik di tanah steril maupun di tanah tidak steril.
K1 K0.5 K0
S1 S0.5 S0 A1 A0.5 A0
S0
NK0 S1 S0.5 A1 A0.5 A0
[image:55.595.101.510.98.809.2]30
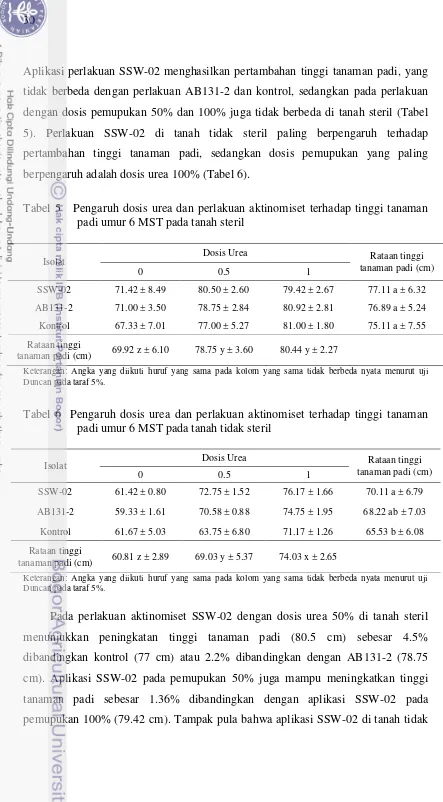
Aplikasi perlakuan SSW-02 menghasilkan pertambahan tinggi tanaman padi, yang tidak berbeda dengan perlakuan AB131-2 dan kontrol, sedangkan pada perlakuan dengan dosis pemupukan 50% dan 100% juga tidak berbeda di tanah steril (Tabel 5). Perlakuan SSW-02 di tanah tidak steril paling berpengaruh terhadap pertambahan tinggi tanaman padi, sedangkan dosis pemupukan yang paling berpengaruh adalah dosis urea 100% (Tabel 6).
Tabel 5 Pengaruh dosis urea dan perlakuan aktinomiset terhadap tinggi tanaman padi umur 6 MST pada tanah steril
Isolat Dosis Urea Rataan tinggi
tanaman padi (cm)
0 0.5 1
SSW-02 71.42 ± 8.49 80.50 ± 2.60 79.42 ± 2.67 77.11 a ± 6.32
AB131-2 71.00 ± 3.50 78.75 ± 2.84 80.92 ± 2.81 76.89 a ± 5.24
Kontrol 67.33 ± 7.01 77.00 ± 5.27 81.00 ± 1.80 75.11 a ± 7.55
Rataan tinggi
tanaman padi (cm) 69.92 z ± 6.10 78.75 y ± 3.60 80.44 y ± 2.27
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata menurut uji Duncan pada taraf 5%.
Tabel 6 Pengaruh dosis urea dan perlakuan aktinomiset terhadap tinggi tanaman padi umur 6 MST pada tanah tidak steril
Isolat Dosis Urea Rataan tinggi
tanaman padi (cm)
0 0.5 1
SSW-02 61.42 ± 0.80 72.75 ± 1.52 76.17 ± 1.66 70.11 a ± 6.79
AB131-2 59.33 ± 1.61 70.58 ± 0.88 74.75 ± 1.95 68.22 ab ± 7.03
Kontrol 61.67 ± 5.03 63.75 ± 6.80 71.17 ± 1.26 65.53 b ± 6.08
Rataan tinggi
tanaman padi (cm) 60.81 z ± 2.89 69.03 y ± 5.37 74.03 x ± 2.65
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata menurut uji Duncan pada taraf 5%.
[image:56.595.59.502.22.824.2]31
steril dengan dosis urea 100% (76.17 cm) mampu meningkatkan tinggi tanaman padi sebesar 7.02% dibandingkan kontrol (71.17 cm) dan 1.89% dibandingkan dengan AB131-2 (74.75 cm).
Panjang Akar. Hasil uji in-planta menunjukkan tidak terjadi interaksi antara faktor dosis pupuk dan perlakuan aktinomiset endofit pada parameter panjang akar pada tanah steril, namun terjadi interaksi di tanah tidak steril (Gambar 11).
Tabel 7 Pengaruh dosis urea dan perlakuan aktinomiset terhadap panjang akar tanaman padi umur 6 MST pada tanah steril
Isolat Dosis Urea Rataan panjang
akar (cm)
0 0.5 1
SSW-02 34.67 ± 2.89 37.67 ± 5.11 36.17 ± 2.02 36.17 a ± 3.36
AB131-2 33.50 ± 2.00 32.17 ± 3.69 33.83 ± 2.93 68.22 a ± 2.67
Kontrol 31.67 ± 4.54 35.50 ± 1.73 38.10 ± 2.65 65.53 a ± 3.94
Rataan panjang
akar (cm) 33.28 x ± 3.15 35.11 x ± 4.05 36.03 x ± 2.89
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata menurut uji Duncan pada taraf 5%.
Gambar 11 Pengaruh dosis urea dan perlakuan aktinomiset terhadap panjang akar tanaman padi umur 6 MST pada tanah tidak steril (Keterangan: AB131-2, SSW-02, kontrol. Diagram yang diikuti huruf yang sama tidak menunjukkan perbedaan nyata pada taraf 5% DMRT).
ab
a
ab ab
abc bc
c
ab ab
0 5 10 15 20 25 30 35 40 45
0 0.5 1
32
Perlakuan SSW-02 dengan dosis urea 50% di tanah tidak steril memberikan peningkatan panjang akar paling tinggi (38.5 cm) dengan peningkatan sebesar 24% dibandingkan dengan AB131-2 atau 10% dibandingkan dengan kontrol pada pemupukan 100%. Aplikasi SSW-02 dengan dosis urea 50% di tanah steril juga dapat meningkatkan panjang akar (37.7 cm) sebesar 9% dibandingkan dengan kontrol (35.5 cm) atau 1.4% dibandingkan dengan AB131-2 (32.17 cm) pada pemupukan yang sama, meskipun tidak signifikan (Tabel 7).
Jumlah Anakan. Data hasil uji in-planta menunjukkan bahwa tidak terjadi interaksi antara faktor dosis pupuk dan perlakuan aktinomiset endofit terhadap jumlah anakan di tanah steril dan tidak steril. Aplikasi perlakuan SSW-02 menghasilkan pertambahan jumlah anakan, yang tidak berbeda nyata dengan perlakuan AB131-2 dan kontrol, sedangkan dosis pemupukan 50% dan 100% menghasilk