SKRINING FITOKIMIA DAN UJI AKTIVITAS SERTA
KAPASITAS ANTIOKSIDAN TOTAL SARI BUAH
MARKISA UNGU (Passiflora edulis Sims) DAN SARI BUAH
MARKISA KONYAL (Passiflora ligularis Juss)
SKRIPSI
OLEH:
MAYA OCTAVIA
NIM 101501019
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
MARKISA UNGU (Passiflora edulis Sims) DAN SARI BUAH
MARKISA KONYAL (Passiflora ligularis Juss)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
MAYA OCTAVIA
NIM 101501019
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
2014
SKRINING FITOKIMIA DAN UJI AKTIVITAS SERTA
KAPASITAS ANTIOKSIDAN TOTAL SARI BUAH
MARKISA UNGU (Passiflora edulis Sims) DAN SARI BUAH
MARKISA KONYAL (Passiflora ligularis Juss)
OLEH:
MAYA OCTAVIA
NIM 101501019
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 06 Juni 2014
Pembimbing I, Panitia Penguji,
Prof. Dr. Rosidah, M.Si., Apt.
Prof. Dr. Urip Harahap, Apt. NIP 195103261978022001 NIP 195301011983031004
Pembimbing II, Prof. Dr. Rosidah, M.Si., Apt. NIP 195103261978022001
Dra. Suwarti Aris, M.Si., Apt. Dra. Herawaty Ginting, M.Si., Apt. NIP 195107231982032001 NIP 195112231980032002
Drs. Suryadi Achmad, M.Sc., Apt. NIP 195109081985031002
Medan, Juli 2014 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
Puji dan syukur kehadirat Tuhan Yang Maha Esa atas karunia yang berlimpah sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul Skrining Fitokimia dan Uji Aktivitas serta Kapasitas Antioksidan Total Sari Buah Markisa Ungu (Passiflora edulis Sims) dan Sari Buah Markisa Konyal (Passiflora ligularis Juss). Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Penulis juga mempersembahkan rasa terima kasih yang tak terhingga kepada keluarga tercinta, Papa Drs. Herijanto Osman dan Mama Gebiwati Tanudjaja, Kakak dan Abangku Yvonne Jolanda Osman, Dipl. Hos., Herbert, S.H., Rudy Wijaya, BSc., dan Roy Andrew Osman atas limpahan kasih sayang, doa, dan dukungan yang tak ternilai dengan apapun. Penulis juga ingin mengucapkan terima kasih kepada sahabat terdekat, Mita Joselin, Anddora Michi, Florencia, Novita Sari, Felicia Christine serta senior yang telah banyak membantu penulis selama masa perkuliahan dan memberikan masukan hingga selesainya skripsi ini, Leny, S.Farm, Helen Salviani, S.Farm, Vivian, S.Farm, Maggie, S.Farm dan kak Ajeng Pramita serta teman-teman mahasiswa/i Farmasi Stambuk 2010 yang selalu mendoakan dan memberi dukungan serta semangat yang tiada henti.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih belum sempurna, oleh karena itu penulis mengharapkan saran dan kritik yang membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Juli 2014 Penulis,
Skrining Fitokimia Dan Uji Aktivitas Serta Kapasitas Antioksidan Total Sari Buah Markisa Ungu (Passiflora edulis Sims) dan Sari Buah Markisa Konyal
(Passiflora ligularis Juss) Abstrak
Buah markisa ungu (Passiflora edulis Sims) dan buah markisa konyal (Passiflora ligularis Juss) merupakan buah tropis yang banyak tumbuh di Kabupaten Karo, Sumatera Utara. Markisa mengandung berbagai zat gizi seperti vitamin A, vitamin C, flavonoid dan karotenoid. Tujuan penelitian adalah untuk mengetahui skrining fitokimia, aktivitas dan kapasitas antioksidan total sari buah markisa ungu dan sari buah markisa konyal.
Skrining fitokimia meliputi uji alkaloid, glikosida, triterpenoid/steroid, flavonoid, tanin, saponin, dan glikosida antrakinon. Pengujian aktivitas antioksidan sari buah markisa ungu dan sari buah markisa konyal menggunakan metode pemerangkapan radikal bebas DPPH dengan vitamin C sebagai pembanding. Pengujian kapasitas antioksidan total sari buah markisa ungu dan sari buah markisa konyal dengan metode pembentukan kompleks fosfomolibdenum didasarkan pada reduksi Mo (VI) menjadi Mo (V) pada suasana asam dan terjadi perubahan warna menjadi warna hijau kebiruan, warna yang terbentuk diukur secara spektrofotometri sinar tampak pada panjang gelombang 715,5 nm.
Hasil skrining fitokimia diperoleh bahwa sari buah markisa ungu mengandung senyawa glikosida, flavonoid, saponin dan vitamin C, sedangkan sari buah markisa konyal mengandung senyawa glikosida, flavonoid dan vitamin C. Hasil pengujian aktivitas antioksidan dengan metode pemerangkapan radikal bebas DPPH menunjukkan bahwa sari buah markisa ungu memiliki nilai IC50
sebesar 3518,61 ppm, sari buah markisa konyal 6752,62 ppm serta vitamin C sebesar 4,16 ppm. Hasil pengujian kapasitas antioksidan total 1 g sari buah markisa ungu ekuivalen dengan kapasitas antioksidan vitamin C seberat (4,944 ± 0,27) mg dan kapasitas antioksidan total 1 g sari buah markisa konyal ekuivalen dengan kapasitas antioksidan vitamin C seberat (4,277 ± 0,18) mg.
Phytochemicals Screening and Antioxidant Activity and Total Antioxidant Capacity of Purple Granadilla Fruit Juice (Passiflora edulis Sims) and Sweet
Granadilla Fruit Juice (Passiflora ligularis Juss) Abstract
Purple granadilla fruit (Passiflora edulis Sims) and sweet granadilla fruit (Passiflora ligularis Juss) are tropical fruits which usually grow in Kabupaten Karo, North Sumatera. It contains vitamin A, vitamin C, flavonoid and carotenoid. The purpose of the research was to determine the phytochemicals screening, antioxidant activity and total antioxidant capacity of purple granadilla and sweet granadilla fruit juice.
Phytochemicals screening include alkaloid, glycoside, triterpene/steroid, flavonoid, tannin, saponin, and antraquinon glycoside tested. The antioxidant activity of purple granadilla and sweet granadilla fruit juice were tested by using DPPH free radical scavenging and the results were compared to vitamin C. The total antioxidant capacity of purple granadilla and sweet granadilla fruit juice were determined by using complex formation of phosphomolibdenum method based on the reduction of Mo (VI) to Mo (V) in acidic condition which lead to the colour changes to bluish green colour. The colour formed was measured by visible spectrophotometry at a wavelength of 715.5 nm.
The results of phytochemicals screening showed that purple granadilla fruit juice contained glycoside, flavonoid, saponin and vitamin C, while the sweet granadilla fruit juice contained glycoside, flavonoid and vitamin C. The results of antioxidant activity tested by using DPPH free radical scavenging method showed that purple granadilla fruit juice has got IC50 value 3518.61 ppm, sweet granadilla
fruit juice 6752.62 ppm and vitamin C 4.16 ppm. The results of the total antioxidant capacity of 1 g purple granadilla fruit juice is equivalent to antioxidant capacity of (4.944 ± 0,27) mg vitamin C and the total antioxidant capacity of 1 g sweet granadilla fruit juice is equivalent to antioxidant capacity of (4.277 ± 0,18) mg vitamin C.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis Penelitian ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 5
1.6 Kerangka Pikir Penelitian ... 6
BAB II TINJAUAN PUSTAKA ... 7
2.1 Uraian Tumbuhan ... 7
2.1.Habitat ... 7
2.1.2 Morfologi tumbuhan ... 7
2.1.4 Nama asing ... 9
2.1.5 Kandungan kimia ... 10
2.1.6 Kegunaan ... 10
2.2 Freeze Drying ... 11
2.3 Radikal Bebas ... 13
2.4 Antioksidan ... 15
2.4.1 Antioksidan enzimatis ... 16
2.4.2 Antioksidan non-enzimatis ... 17
2.4.2.1 Vitamin C (asam askorbat) ... 17
2.4.2.2 Flavonoid ... 19
2.4.2.3 Beta karoten ... 19
2.5 Metode Pemerangkapan Radikal Bebas DPPH (1,1 diphenyl 2-2 picrylhydrazil) ... 20
2.6 Metode Pembentukan Kompleks Fosfomolibdenum ... 22
2.7 Spektrofotometer UV-Vis ... 22
BAB III METODE PENELITIAN ... 24
3.1 Alat ... 24
3.2 Bahan ... 24
3.3 Penyiapan Bahan Tumbuhan ... 25
3.3.1 Pengumpulan bahan tumbuhan ... 25
3.3.2 Identifikasi tumbuhan ... 25
3.3.3 Pembuatan sari kental buah markisa ungu dan markisa konyal ... 25
3.4.2 Pereaksi Mayer ... 26
3.4.3 Pereaksi Dragendorff ... 26
3.4.4 Pereaksi Molish ... 26
3.4.5 Pereaksi asam klorida 2 N ... 27
3.4.6 Pereaksi asam sulfat 2 N ... 27
3.4.7 Pereaksi natrium hidroksida 2 N ... 27
3.4.8 Pereaksi timbal (II) asetat 0,4 M ... 27
3.4.9 Pereaksi besi (III) klorida 1% ... 27
3.4.10 Pereaksi Liebermann-Burchard ... 27
3.4.11 Pereaksi Ag ammoniakal ... 27
3.4.12 Pereaksi Fehling ... 28
3.4.13 Pereaksi fosfomolibdenum ... 28
3.4.14 Larutan DPPH 0,5 mM ... 28
3.5 Skrining Fitokimia ... 28
3.5.1 Pemeriksaan alkaloid ... 28
3.5.2 Pemeriksaan glikosida ... 29
3.5.3 Pemeriksaan triterpenoid/steroid ... 30
3.5.4 Pemeriksaan flavonoid ... 30
3.5.5 Pemeriksaan tanin ... 30
3.5.6 Pemeriksaan saponin ... 30
3.5.7 Pemeriksaan glikosida antrakinon ... 31
3.6 Identifikasi Vitamin C berdasarkan Daya Reduksi ... 31
3.6.1 Reaksi Ag ammoniakal ... 31
3.7 Pengujian Aktivitas Antioksidan Menggunakan Metode
Pemerangkapan Radikal Bebas DPPH ... 32
3.7.1 Prinsip metode pemerangkapan radikal bebas (DPPH) 32
3.7.2 Pembuatan larutan blanko ... 32
3.7.3 Pengukuran panjang gelombang serapan maksimum DPPH ... 32
3.7.4 Pembuatan larutan induk ... 32
3.7.4.1 Pembuatan larutan induk sampel uji ... 32
3.7.4.2 Pembuatan larutan induk vitamin C ... 33
3.7.5 Pembuatan larutan uji ... 33
3.7.5.1 Larutan uji sari kental buah markisa ungu ... 33
3.7.5.2 Larutan uji sari kental buah markisa konyal .... 33
3.7.5.3 Larutan uji vitamin C ... 34
3.7.6 Analisis persen pemerangkapan radikal bebas DPPH .. 34
3.7.7 Analisis nilai IC50 ... 34
3.8 Pengukuran Kapasitas Antioksidan Total dengan Metode Pembentukan Kompleks Fosfomolibdenum ... 35
3.8.1 Pembuatan larutan induk baku vitamin C ... 35
3.8.2 Pembuatan panjang gelombang maksimum ... 35
3.8.3 Penentuan waktu kerja (operating time) ... 35
3.8.4 Pengukuran kurva kalibrasi vitamin C ... 36
3.8.5 Uji kapasitas antioksidan total sampel uji ... 36
3.8.6 Validasi metode analisis ... 37
3.8.6.1 Penentuan batas deteksi (Limit of Detection) dan batas kuantitasi (Limit of Quantitation) ... 37
3.8.6.2 Akurasi atau kecermatan dengan persen perolehan kembali (% Recovery) ... 37
3.8.7 Analisis data secara statistik ... 39
BAB IV HASIL DAN PEMBAHASAN ... 40
4.1 Hasil Identifikasi Tumbuhan ... 40
4.2 Hasil Skrining Fitokimia ... 40
4.3 Hasil Identifikasi Vitamin C berdasarkan Daya Reduksi ... 41
4.4 Hasil Analisis Aktivitas Antioksidan Sampel Uji ... 41
4.4.1 Hasil pengukuran panjang gelombang serapan maksimum DPPH ... 41
4.4.2 Hasil analisis aktivitas antioksidan sampel uji ... 42
4.4.3 Hasil analisis peredaman radikal bebas DPPH oleh sampel uji ... 44
4.4.4 Analisis nilai IC50 (Inhibitory Concentration) sampel uji ... 46
4.5 Hasil Analisis Pengukuran Kapasitas Antioksidan Total ... 48
4.5.1 Hasil pengukuran panjang gelombang serapan maksimum ... 48
4.5.2 Hasil penentuan waktu kerja (operating time) ... 49
4.5.3 Hasil pengukuran kurva kalibrasi vitamin C ... 49
4.5.4 Hasil uji kapasitas antioksidan total sari kental buah markisa ungu ... 50
4.5.5 Hasil uji kapasitas antioksidan total sari kental buah markisa konyal ... 51
4.5.6 Validasi metode analisis ... 52
4.5.6.1 Hasil penentuan batas deteksi dan batas kuantitasi ... 52
4.5.6.2 Hasil uji persen perolehan kembali (% Recovery) ... 53
BAB V KESIMPULAN DAN SARAN ... 55
5.1 Kesimpulan ... 55
5.2 Saran ... 55
DAFTAR PUSTAKA ... 56
DAFTAR TABEL
Halaman Tabel 4.1 Hasil skrining fitokimia markisa ungu dan markisa konyal .... 40 Tabel 4.2 Penurunan absorbansi DPPH dengan penambahan sari kental
buah markisa ungu ... 43 Tabel 4.3 Penurunan absorbansi DPPH dengan penambahan sari kental
buah markisa konyal ... 43 Tabel 4.4 Penurunan absorbansi DPPH dengan penambahan vitamin C 43 Tabel 4.5 Aktivitas antioksidan (% peredaman) sari kental buah
markisa ungu ... 44 Tabel 4.6 Aktivitas antioksidan (% peredaman) sari kental buah
markisa konyal ... 44 Tabel 4.7 Aktivitas antioksidan (% peredaman) vitamin C ... 45 Tabel 4.8 Hasil persamaan regresi yang diperoleh dari sari kental buah
markisa ungu, markisa konyal dan vitamin C ... 47 Tabel 4.9 Nilai IC50 sari kental buah markisa ungu, markisa konyal dan
vitamin C ... 47 Tabel 4.10 Hasil uji kapasitas antioksidan total sari kental buah markisa
ungu ... 51 Tabel 4.11 Hasil uji kapasitas antioksidan total sari kental buah markisa
konyal ... 52 Tabel 4.12 Uji persen perolehan kembali (% recovery) antioksidan pada
DAFTAR GAMBAR
Halaman
Gambar 1.1 Skema kerangka pikir penelitian ... 6
Gambar 2.1 Reaksi enzimatis destruksi superoksida ... 16
Gambar 2.2 Reaksi peran protektif glutathione (GSH) ... 17
Gambar 2.3 Rumus bangun vitamin C ... 18
Gambar 2.4 Rumus bangun beta karoten ... 20
Gambar 2.5 Reaksi antara DPPH dengan atom H dari senyawa antioksidan ... 21
Gambar 4.1 Panjang gelombang maksimum DPPH dalam metanol ... 42
Gambar 4.2 Grafik hasil uji aktivitas antioksidan sari kental buah markisa ungu ... 45
Gambar 4.3 Grafik hasil uji aktivitas antioksidan sari kental buah markisa konyal ... 46
Gambar 4.4 Grafik hasil uji aktivitas antioksidan vitamin C ... 46
Gambar 4.5 Kurva panjang gelombang maksimum vitamin C ... 48
Gambar 4.6 Kurva waktu kerja (operating time) ... 49
DAFTAR LAMPIRAN
Halaman Lampiran 1 Hasil identifikasi buah markisa ungu dan buah markisa
konyal ... 59 Lampiran 2 Gambar buah markisa ungu dan buah markisa konyal ... 60 Lampiran 3 Bagan kerja penelitian ... 61 Lampiran 4 Gambar hasil identifikasi vitamin C berdasarkan daya
reduksi ... 62 Lampiran 5 Contoh perhitungan persen peredaman ... 63 Lampiran 6 Perhitungan nilai IC50 ... 64
Lampiran 7 Perhitungan bahan-bahan untuk pembuatan 100 ml larutan pereaksi fosfomolibdenum ... 65 Lampiran 8 Data penentuan waktu kerja (operating time) ... 67 Lampiran 9 Contoh perhitungan konsentrasi larutan vitamin C untuk
penentuan kurva kalibrasi ... 69 Lampiran 10 Kurva kalibrasi larutan vitamin C dengan berbagai
konsentrasi pada panjang gelombang 715,5 nm ... 70 Lampiran 11 Perhitungan persamaan garis regresi ... 71 Lampiran 12 Perhitungan persamaan korelasi ... 72 Lampiran 13 Contoh perhitungan kapasitas antioksidan total sari buah
markisa ungu ... 73 Lampiran 14 Contoh perhitungan kapasitas antioksidan total sari buah
markisa konyal ... 74 Lampiran 15 Perhitungan statistik ... 75 Lampiran 16 Perhitungan batas deteksi (LOD) dan batas kuantitasi
(LOQ) ... 78 Lampiran 17 Hasil uji perolehan kembali kapasitas antioksidan total
Lampiran 18 Contoh perhitungan persen perolehan kembali kapasitas antioksidan total dengan metode penambahan baku vitamin C (Standard Addition Method) ... 80 Lampiran 19 Perhitungan simpangan baku relatif (RSD) kapasitas
antioksidan total ... 81 Lampiran 20 Tabel distribusi t ... 83 Lampiran 21 Gambar alat spektrofotometer UV-Visible (Shimadzu
Skrining Fitokimia Dan Uji Aktivitas Serta Kapasitas Antioksidan Total Sari Buah Markisa Ungu (Passiflora edulis Sims) dan Sari Buah Markisa Konyal
(Passiflora ligularis Juss) Abstrak
Buah markisa ungu (Passiflora edulis Sims) dan buah markisa konyal (Passiflora ligularis Juss) merupakan buah tropis yang banyak tumbuh di Kabupaten Karo, Sumatera Utara. Markisa mengandung berbagai zat gizi seperti vitamin A, vitamin C, flavonoid dan karotenoid. Tujuan penelitian adalah untuk mengetahui skrining fitokimia, aktivitas dan kapasitas antioksidan total sari buah markisa ungu dan sari buah markisa konyal.
Skrining fitokimia meliputi uji alkaloid, glikosida, triterpenoid/steroid, flavonoid, tanin, saponin, dan glikosida antrakinon. Pengujian aktivitas antioksidan sari buah markisa ungu dan sari buah markisa konyal menggunakan metode pemerangkapan radikal bebas DPPH dengan vitamin C sebagai pembanding. Pengujian kapasitas antioksidan total sari buah markisa ungu dan sari buah markisa konyal dengan metode pembentukan kompleks fosfomolibdenum didasarkan pada reduksi Mo (VI) menjadi Mo (V) pada suasana asam dan terjadi perubahan warna menjadi warna hijau kebiruan, warna yang terbentuk diukur secara spektrofotometri sinar tampak pada panjang gelombang 715,5 nm.
Hasil skrining fitokimia diperoleh bahwa sari buah markisa ungu mengandung senyawa glikosida, flavonoid, saponin dan vitamin C, sedangkan sari buah markisa konyal mengandung senyawa glikosida, flavonoid dan vitamin C. Hasil pengujian aktivitas antioksidan dengan metode pemerangkapan radikal bebas DPPH menunjukkan bahwa sari buah markisa ungu memiliki nilai IC50
sebesar 3518,61 ppm, sari buah markisa konyal 6752,62 ppm serta vitamin C sebesar 4,16 ppm. Hasil pengujian kapasitas antioksidan total 1 g sari buah markisa ungu ekuivalen dengan kapasitas antioksidan vitamin C seberat (4,944 ± 0,27) mg dan kapasitas antioksidan total 1 g sari buah markisa konyal ekuivalen dengan kapasitas antioksidan vitamin C seberat (4,277 ± 0,18) mg.
Phytochemicals Screening and Antioxidant Activity and Total Antioxidant Capacity of Purple Granadilla Fruit Juice (Passiflora edulis Sims) and Sweet
Granadilla Fruit Juice (Passiflora ligularis Juss) Abstract
Purple granadilla fruit (Passiflora edulis Sims) and sweet granadilla fruit (Passiflora ligularis Juss) are tropical fruits which usually grow in Kabupaten Karo, North Sumatera. It contains vitamin A, vitamin C, flavonoid and carotenoid. The purpose of the research was to determine the phytochemicals screening, antioxidant activity and total antioxidant capacity of purple granadilla and sweet granadilla fruit juice.
Phytochemicals screening include alkaloid, glycoside, triterpene/steroid, flavonoid, tannin, saponin, and antraquinon glycoside tested. The antioxidant activity of purple granadilla and sweet granadilla fruit juice were tested by using DPPH free radical scavenging and the results were compared to vitamin C. The total antioxidant capacity of purple granadilla and sweet granadilla fruit juice were determined by using complex formation of phosphomolibdenum method based on the reduction of Mo (VI) to Mo (V) in acidic condition which lead to the colour changes to bluish green colour. The colour formed was measured by visible spectrophotometry at a wavelength of 715.5 nm.
The results of phytochemicals screening showed that purple granadilla fruit juice contained glycoside, flavonoid, saponin and vitamin C, while the sweet granadilla fruit juice contained glycoside, flavonoid and vitamin C. The results of antioxidant activity tested by using DPPH free radical scavenging method showed that purple granadilla fruit juice has got IC50 value 3518.61 ppm, sweet granadilla
fruit juice 6752.62 ppm and vitamin C 4.16 ppm. The results of the total antioxidant capacity of 1 g purple granadilla fruit juice is equivalent to antioxidant capacity of (4.944 ± 0,27) mg vitamin C and the total antioxidant capacity of 1 g sweet granadilla fruit juice is equivalent to antioxidant capacity of (4.277 ± 0,18) mg vitamin C.
BAB I PENDAHULUAN
1.1Latar Belakang
Radikal bebas merupakan atom atau molekul yang sifatnya sangat tidak stabil. Ketidakstabilan ini disebabkan karena atom tersebut memiliki satu atau lebih elektron yang tidak berpasangan. Atom tersebut berusaha untuk memiliki pasangan elektron sehingga sifatnya sangat reaktif dan cenderung mengambil partikel dari DNA, membran/selaput sel, membran lisosom (bagian sel yang mengandung enzim hidrolitik), mitokondria (tempat produksi energi sel), enzim-enzim, lemak, protein serta komponen jaringan lain yang menyebabkan terbentuknya senyawa baru yang tidak normal (Kosasih, dkk., 2004).
Pembentukan radikal bebas dapat terjadi di dalam tubuh secara normal oleh adanya proses oksidasi lipida, sedangkan pembentukan radikal bebas dari luar tubuh dapat disebabkan oleh faktor lingkungan yang kurang diperhatikan. Air yang banyak tercemar oleh logam berat, udara yang dipenuhi asap rokok, asap kendaraan bermotor, asap dari industri dan bahkan berbagai zat adiktif yang ditambahkan ke dalam makanan dapat menyebabkan terbentuknya radikal bebas yang berlebih (Kumalaningsih, 2006). Berbagai macam penyakit dapat terjadi karena tubuh terpapar oleh radikal bebas mulai dari radang sendi, asma, gangguan kardiovaskular, kanker, stroke dan kemunduran mental oleh karena serangan radikal bebas yang merusak sel tubuh (Lingga, 2012).
elektron dan menjadi tidak reaktif lagi (Kosasih, dkk., 2004). Berbagai studi yang dilakukan telah membuktikan bahwa mengkonsumsi sayur-sayuran dan buah-buahan dalam jumlah besar dapat menurunkan resiko penyakit degeneratif termasuk kanker hingga dua kali lebih besar dibandingkan dengan mereka yang kurang mengkonsumsi sayur-sayuran dan buah-buahan (Hanson, 2005).
Salah satu buah yang mudah diperoleh dan murah sehingga dapat dikonsumsi oleh semua kalangan adalah buah markisa. Kabupaten Karo, Sumatera Utara merupakan salah satu daerah yang menjadi sentra pertumbuhan markisa. Ada 2 jenis buah markisa yang banyak ditanam yakni buah markisa ungu (Passiflora edulis Sims) dan buah markisa konyal (Passiflora ligularis Juss) (Pertiwi, 2012).
Di Indonesia, buah markisa ungu dikonsumsi dalam bentuk segar berupa jus atau diolah menjadi sirup dan selai, sedangkan di luar negeri buah markisa ungu telah dikembangkan menjadi berbagai jenis makanan seperti es krim, permen, kue dan jelly. Warna jingga kekuningan yang cerah dan aroma khasnya diyakini banyak menarik produsen makanan untuk terus meningkatkan nilai jual buah ini (Hutabarat dan Manshur, 2010). Berbeda dengan sari buah markisa ungu, rasa sari buah markisa konyal yang manis dan tekstur daging buahnya yang lembut menjadikannya sebagai buah yang banyak digemari untuk dikonsumsi langsung.
Markisa memiliki kandungan vitamin C dan karotenoid yang saling mendukung dalam melindungi sel dari kerusakan. Mekanisme kerja vitamin C yakni memberikan perlindungan secara menyeluruh terhadap sitoplasma dan mitokondria dari serangan radikal bebas yang larut dalam air. Jika bergabung dengan vitamin E dan karotenoid, maka vitamin C juga dapat memberikan perlindungan terhadap radikal bebas yang larut dalam lemak (Lingga, 2012).
Berdasarkan uraian di atas, maka penulis meneliti buah markisa dengan melakukan uji aktivitas antioksidan dari sari buah markisa ungu (Passiflora edulis
Sims) dan sari buah markisa konyal (Passiflora ligularis Juss) dengan metode pemerangkapan radikal bebas DPPH dan uji kapasitas antioksidan total dengan metode pembentukan kompleks fosfomolibdenum.
1.2Perumusan Masalah
Berdasarkan uraian pada latar belakang tersebut, maka perumusan masalahnya adalah :
a. apakah berbeda golongan senyawa kimia yang terdapat pada sari buah markisa ungu dan sari buah markisa konyal?
b. apakah sari buah markisa ungu dan sari buah markisa konyal memiliki aktivitas antioksidan?
c. berapakah nilai IC50 sari buah markisa ungu dan sari buah markisa konyal
dalam memerangkap radikal bebas DPPH?
1.3Hipotesis Penelitian
Berdasarkan perumusan masalah tersebut, maka hipotesis pada penelitian ini adalah :
a. golongan senyawa kimia yang terdapat pada sari buah markisa ungu dan sari buah markisa konyal berbeda.
b. sari buah markisa ungu dan sari buah markisa konyal memiliki aktivitas antioksidan.
c. nilai IC50 sari buah markisa ungu dan sari buah markisa konyal dalam
memerangkap radikal bebas DPPH adalah < 50 ppm.
d. sari buah markisa ungu dan sari buah markisa konyal mengandung kapasitas antioksidan total dalam jumlah tertentu.
1.4Tujuan Penelitian
Tujuan dari penelitian ini adalah :
a. untuk mengetahui golongan senyawa kimia dari sari buah markisa ungu dan sari buah markisa konyal.
b. untuk mengetahui aktivitas antioksidan dari sari buah markisa ungu dan sari buah markisa konyal.
c. untuk mengetahui nilai IC50 sari buah markisa ungu dan sari buah markisa
konyal dalam memerangkap radikal bebas DPPH
1.5Manfaat Penelitian
1.6Kerangka Pikir Penelitian
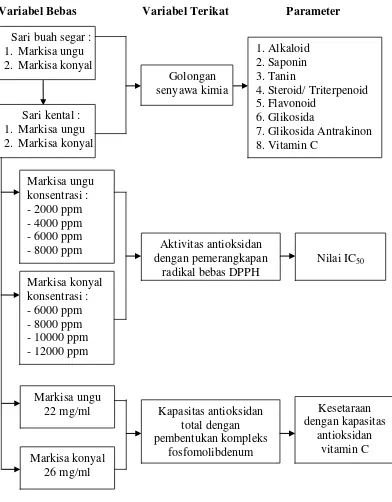
Penelitian ini dilakukan dengan kerangka pikir seperti yang ditunjukkan pada Gambar 1.1.
Variabel Bebas Variabel Terikat Parameter
Gambar 1.1 Skema kerangka pikir penelitian Sari buah segar :
1. Markisa ungu 2. Markisa konyal
Sari kental : 1. Markisa ungu 2. Markisa konyal
1. Alkaloid 2. Saponin 3. Tanin
4. Steroid/ Triterpenoid 5. Flavonoid
6. Glikosida
7. Glikosida Antrakinon 8. Vitamin C
Markisa ungu konsentrasi : -2000 ppm -4000 ppm -6000 ppm -8000 ppm Markisa konyal konsentrasi : -6000 ppm -8000 ppm -10000 ppm -12000 ppm
Aktivitas antioksidan dengan pemerangkapan
radikal bebas DPPH Golongan
senyawa kimia
Markisa ungu
22 mg/ml Kapasitas antioksidan total dengan pembentukan kompleks
fosfomolibdenum
Nilai IC50
BAB II
TINJAUAN PUSTAKA
2.1Uraian Tumbuhan
Uraian tumbuhan meliputi habitat, morfologi tumbuhan, sistematika tumbuhan, nama asing, kandungan kimia dan kegunaan dari tumbuhan.
2.1.1Habitat
Markisa ungu berasal dari Brazil bagian Selatan yaitu dari Paraguay hingga Argentina bagian Utara. Di Indonesia, markisa ungu ditanam di daerah dataran tinggi tropis dan di daerah subtropis pada ketinggian 700-2000 m di atas permukaan laut dengan suhu 18 - 25º C. Daerah penghasil markisa ungu masih terpusat di beberapa Kabupaten di Provinsi Sumatera Utara (Kabupaten Karo, Simalungun, Dairi, Tapanuli Utara) dan Provinsi Sulawesi Selatan (Kabupaten Gowa, Sinjai, Tator, Enrekang dan Polmas).
Markisa konyal berasal dari Pegunungan Andes diantara Bolivia dan Venezuela, tumbuh di daerah subtropis dengan ketinggian 900-2700 m di atas permukaan laut pada suhu 15 - 18º C. Di Indonesia, markisa konyal banyak ditanam di Provinsi Sumatera Utara (Kabupaten Karo dan Simalungun) dan Provinsi Jawa Barat (daerah Pelabuhan Ratu, Sukabumi, Bogor) (Hutabarat dan Manshur, 2010 ; Lim, 2012).
2.1.2 Morfologi tumbuhan
berwarna hijau dan setelah tua berubah menjadi hijau kecoklatan. Daun tanaman sangat rimbun tumbuh secara bergantian pada batang atau cabang. Bentuk daun menjari, bergerigi, berwarna hijau mengkilap dengan panjang tangkai 2-3 cm, panjang daun 9-12 cm dan lebar 7-9 cm (Rukmana, 2003).
Bunga markisa berbentuk mangkuk dengan dasar bunga yang meninggi untuk mendukung benang sari dan putik diatasnya (androginofor). Bunga berdiameter 5-7 cm, memiliki 5 daun kelopak yang berwarna putih kehijauan, 5 mahkota bunga berwarna putih yang di atasnya terdapat dua baris mahkota tambahan berbentuk benang-benang yang melingkar dengan panjang 2-3 cm berwarna putih dengan dasar ungu, juga memiliki 3 putik bercabang tiga dan 5 benang sari dengan kepala sari yang besar (Hermanto, 2013 ; Joy, 2010).
Buah markisa ungu berbentuk bulat atau bulat oval dengan panjang 4-6 cm. Kulit buah berwarna hijau muda dan berubah menjadi ungu gelap jika sudah matang. Kulit agak keras dan tebal serta memiliki lapisan (endocarp) berwarna putih di dalamnya. Biji berbentuk gepeng, berwarna hitam, dibungkus oleh selaput yang berisi sari buah berwarna kuning jingga yang memberikan rasa asam dengan aroma khas markisa yang kuat (Joy, 2010).
2.1.3Sistematika tumbuhan
Menurut Herbarium Medanesse (2013), sistematika tumbuhan buah markisa ungu dan buah markisa konyal adalah sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae Bangsa : Malpighiales Suku : Passifloraceae Marga : Passiflora
Jenis : Passiflora edulis Sims. Nama lokal : Markisa ungu
Sistematika tumbuhan buah markisa konyal adalah sebagai berikut : Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae Bangsa : Malpighiales Suku : Passifloraceae Marga : Passiflora
Jenis : Passiflora ligularis A.Juss Nama lokal : Markisa konyal
2.1.4Nama asing
Buah markisa konyal memiliki nama lain seperti sweet granadilla (Inggris), zoete markoesa (Belanda), buah selaseh (Malaysia), tumbo (Peru) (Duke, 2009). 2.1.5Kandungan kimia
Terdapat 3 komponen senyawa kimia utama yang terdapat di dalam buah markisa yaitu alkaloid, flavonoid, dan karotenoid. Alkaloid yang terdapat pada buah markisa adalah alkaloid harmala yang mengandung harman, harmin, harmlin, harmol, harmalol dalam jumlah yang kecil. Flavonoid yang terdapat dalam buah markisa mengandung homoorientin, isooerientin, orientin, isovitexin, vitexin, saponaretin, saponarin, dan kandungan karotenoid dalam buah markisa antara lain β-kriptoxanthin, α-karoten, β-karoten, dan likopen (Joy, 2010).
Komposisi dari buah markisa ungu antara lain air, protein, lemak, karbohidrat, berbagai mineral (kalsium, zat besi, magnesium, kalium, natrium), berbagai vitamin (tiamin, riboflavin, niasin, asam askorbat), dan asam organik seperti asam sitrat dan asam malat.
Komposisi dari buah markisa konyal antara lain air, protein, lemak, serat, polisakarida, berbagai mineral (kalsium, zat besi, fosfor), dan berbagai vitamin (riboflavin, niasin, asam askorbat) (Lim, 2012).
2.1.6Kegunaan
menstruasi. Jus buah markisa digunakan untuk mengobati infeksi saluran kemih di Peru dan digunakan sebagai stimulan pencernaan di pulau Madeira (Portugal).
Tidak hanya buah markisa yang digunakan untuk pengobatan, bunga dan daun markisa juga berkhasiat. Industri farmasi di Eropa mengambil senyawa passiflorin dari daun markisa yang telah dikeringkan dengan cara ekstraksi untuk dijadikan sebagai obat penenang, sedangkan bunga markisa telah digunakan untuk mengobati asma, kegelisahan, dan insomnia (Mbora, A., et al, 2008 ; Hutabarat dan Manshur, 2010).
2.2Freeze Drying
Freeze drying atau disebut juga lyophilization merupakan proses untuk menghilangkan air tanpa pemanasan berlebih. Umumnya digunakan untuk memenuhi kebutuhan farmasetik dalam meningkatkan stabilitas dan waktu simpan obat-obatan yang tidak stabil, digunakan industri makanan untuk memperpanjang waktu simpan dengan mencegah pertumbuhan mikroorganisme dan memperlambat oksidasi lipida (Nireesha et al, 2013).
Metode pengeringan freeze drying hanya sedikit mengubah warna, rasa, tekstur, nutrisi, penampilan, komponen kimia, dan aktivitas biologis dari sampel yang segar sehingga disebut sebagai metode pengeringan terbaik untuk makanan yang mengandung komponen sensitif panas dan komponen antioksidan seperti tokoferol, asam askorbat, karotenoid, dan fenolik (Dirim, 2012).
kondensor. Ruang pengering dihubungkan dengan sebuah katup ke ruang kondensor untuk mencapai temperatur -50 sampai -80ºC.
Tahapan yang terjadi pada saat freeze drying ada 3, yaitu : a. Freezing
Produk yang akan dikeringkan, dibekukan terlebih dahulu sehingga terbentuk massa yang solid.
b. Primary drying
Produk yang sudah beku dikondisikan dalam keadaan vakum dengan tekanan 10-4 sampai 10-5 atmosfer, sehingga pelarut dari produk menguap dari fase padat ke gas tanpa melewati fase cair atau disebut dengan sublimasi. Pada proses sublimasi perlu ditingkatkan temperatur sekitar -45º sampai -20º C untuk mempercepat penguapan. Peningkatan temperatur harus terus diperhatikan agar tetap di bawah critical process temperature (suhu dimana produk kembali mencair). Pada tahap ini, penguapan pelarut belum sempurna karena masih ada sisa-sisa embun hasil sublimasi yang masih tertinggal dalam produk.
c. Secondary drying
2.3Radikal Bebas
Radikal bebas (free radical) adalah suatu senyawa atau molekul yang mengandung satu atau lebih elektron tidak berpasangan pada orbital luarnya. Adanya elektron yang tidak berpasangan menyebabkan senyawa tersebut menjadi tidak stabil dan sangat reaktif mencari pasangan dengan cara menyerang dan mengikat elektron molekul yang berada di sekitarnya.
Secara umum sumber radikal bebas dapat dibedakan menjadi dua yaitu endogen dan eksogen. Radikal bebas endogen dihasilkan tubuh secara alami dari proses biokimia yang berlangsung di dalam sel (intraselular) dan di luar sel (ekstraselular), proses ini terjadi terus menerus selama kehidupan. Keberadaannya dalam jumlah normal berguna untuk melawan peradangan, membunuh kuman penyebab penyakit, detoksifikasi racun xenobiotik, polimerisasi dinding sel serta untuk mengendalikan tonus otot polos pada pembuluh darah dan organ-organ dalam tubuh (Lingga, 2012). Radikal bebas eksogen berasal dari luar sistem tubuh misalnya sinar UV dan lingkungan seperti radiasi, polusi, asap rokok, makanan, minuman, ozon, dan pestisida (Rohmatussolihat, 2009).
Radikal bebas dapat terbentuk dari oksigen dan nitrogen sebagai produk metabolisme sel normal, atau disebut dengan reactive oxygen species (ROS) dan
reactive nitrogen species (RNS). RNS dan ROS yang sangat reaktif terdiri atas kelompok radikal antara lain superoksida (O2•−), hidroksil (OH•), peroksil (RO2•),
hidroperoksil (HO2•), alkoksil (RO•), nitrit oksida (NO•), nitrogen dioksida
(NO2•), lipid peroksil (LOO•) dan kelompok non radikal yang kurang reaktif
namun masih tergolong radikal bebas seperti hidrogen peroksida (H2O2), asam
nitrit (HNO2), dinitrogen trioksida (N2O3) dan lipid peroksida (LOOH). Radikal
bebas yang berasal dari oksigen merupakan spesies radikal yang lebih banyak dihasilkan dalam sistem kehidupan (Sen et al, 2010).
Secara umum tahapan reaksi pembentukan radikal bebas adalah : a.Inisiasi
RH + initiator → R●
b.Propagasi
R● + O2 → ROO●
ROO● + RH → ROOH + R● c.Terminasi
R● + R●→ RR
ROO● + R●→ ROOR
Tahap inisiasi adalah tahap awal terbentuknya radikal bebas. Tahap propagasi adalah tahap perpanjangan radikal berantai, dimana terjadi reaksi antara suatu radikal dengan senyawa lain dan menghasilkan radikal baru. Tahap terminasi adalah tahap akhir, terjadinya pengikatan suatu radikal bebas dengan radikal bebas yang lain sehingga membentuk senyawa non-radikal yang biasanya kurang reaktif dari radikal induknya (Kumalaningsih, 2006).
kanker, aterosklerosis, penyakit jantung koroner dan diabetes mellitus (Rohmatussolihat, 2009).
2.4Antioksidan
Antioksidan merupakan senyawa pemberi elektron atau disebut reduktan. Senyawa ini mampu menginaktivasi berkembangnya reaksi oksidasi dengan mengikat radikal bebas sehingga kerusakan sel dapat dihambat. Konsumsi makanan yang mengandung antioksidan dapat meningkatkan status imunologis dan menghambat timbulnya penyakit degeneratif akibat penuaan (Winarsi, 2007).
Menurut Kumalaningsih (2006), berdasarkan fungsinya antioksidan dibedakan menjadi lima, yaitu :
a.Antioksidan primer
Antioksidan ini berfungsi untuk mencegah terbentuknya radikal bebas baru dengan mengurangi dampak negatif dari radikal bebas yang ada sebelum sempat bereaksi. Contoh antioksidan primer dalam tubuh adalah enzim superoksida dismutase (SOD). Enzim ini melindungi rusaknya sel-sel dalam tubuh akibat serangan radikal bebas.
b.Antioksidan sekunder
Antioksidan sekunder berfungsi memerangkap radikal bebas serta mencegah terjadinya reaksi berantai sehingga tidak terjadi kerusakan sel yang lebih parah. Contoh antioksidan sekunder adalah vitamin E, vitamin C dan betakaroten yang dapat diperoleh dari buah-buahan.
c.Antioksidan tersier
d.Oxygen scavenger
Antioksidan dalam kelompok ini berfungsi mengikat oksigen sehingga tidak mendukung reaksi oksidasi, misalnya vitamin C.
e.Chelators atau Sequesstrants
Antioksidan dalam kelompok ini berfungsi mengikat logam seperti besi dan tembaga yang mampu mengkatalis reaksi oksidasi lemak. Contohnya adalah asam sitrat dan asam amino.
2.4.1 Antioksidan enzimatis
Antioksidan enzimatis merupakan sistem pertahanan utama (primer) terhadap kondisi stres oksidatif. Enzim-enzim tersebut merupakan metaloenzim yang aktivitasnya sangat tergantung pada ion logam (Winarsi, 2007).
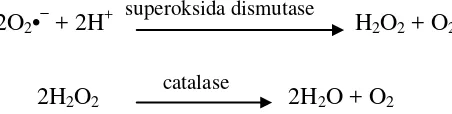
Antioksidan enzimatis yang dihasilkan tubuh antara lain SOD yang mengubah superokisda (O2•−) yang reaktif menjadi hidrogen peroksida (H2O2)
[image:35.595.188.414.526.583.2]yang masih merupakan ROS namun kurang reaktif, sehingga dengan adanya enzim katalase akan merusak H2O2. Reaksi yang terjadi dapat dilihat pada
Gambar 2.1.
2O2•− + 2H+
superoksida dismutase
H2O2 + O2
2H2O2
catalase
2H2O + O2
Gambar 2.1 Reaksi enzimatis destruksi superoksida
(GS-SG yang memiliki ikatan disulfida) oleh enzim glutathione reduktase dan tambahan NADPH akan membentuk GSH kembali. Reaksi pemecahan H2O2 oleh
GSH dapat dilihat pada Gambar 2.2. H2O2 + 2 GSH
Glutathione peroksidase
2H2O + GS-SG [image:36.595.187.450.166.237.2]
Glutathione reduktase
Gambar 2.2 Reaksi peran protektif glutathione (GSH) (Hanson, 2005) Antioksidan SOD bergantung pada logam Fe, Cu, Mn dan Zn. Beberapa makanan yang dapat meningkatkan produksi enzim ini adalah brokoli, kubis, kubis tunas, dedak beras atau biji serealia dan kecambah gandum. Enzim katalase bergantung pada logam Fe yang dapat diperoleh dari sayuran hijau, kacang-kacangan, hati, daging, telur, susu segar, tempe dan udang, sedangkan enzim glutathione peroksidase bergantung pada logam Se (Selenium) yang dapat diperoleh dari asparagus, alpukat, ikan laut, cabai, paprika, seledri dan kacang-kacangan (Lingga, 2012 ; Winarsi, 2007).
2.4.2 Antioksidan non-enzimatis
Selain antioksidan yang bersifat enzimatis, terdapat antioksidan non-enzimatis yang disebut juga antioksidan sekunder karena dapat diperoleh dari asupan bahan makanan seperti vitamin A, C, E, beta karoten dan flavonoid. Senyawa-senyawa ini berfungsi memerangkap senyawa oksidan serta mencegah terjadinya reaksi berantai (Winarsi, 2007).
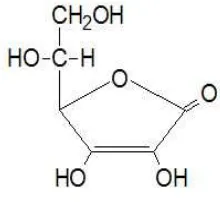
2.4.2.1 Vitamin C (asam askorbat)
Vitamin C atau asam askorbat mempunyai berat molekul 176,13 dengan rumus molekul C6H8O6. Pemerian vitamin C adalah hablur atau serbuk berwarna
putih atau agak kekuningan. Pengaruh cahaya lambat laun menyebabkan berwarna
gelap, dalam keadaan kering stabil di udara namun dalam larutan cepat teroksidasi. Vitamin C mudah larut dalam air, agak sukar larut dalam etanol, praktis tidak larut dalam kloroform, dalam eter dan dalam benzen (Ditjen POM, 1979).
Sesuai dengan sifatnya yang larut dalam air, vitamin C bekerja melindungi bagian tubuh dari radikal bebas yang larut dalam air dengan mendonorkan elektronnya ke dalam reaksi biokimia intraselluler dan ekstraselluler. Vitamin C mampu bereaksi dengan radikal bebas dan mengubahnya menjadi radikal askorbil yang kurang reaktif, kemudian membentuk asam monodehidroaskorbat dan atau asam dehidroaskorbat. Bentuk tereduksi ini dapat diubah kembali menjadi asam askorbat oleh enzim monodehidroaskorbat reduktase dan dehidroaskorbat reduktase (Packer, 2002).
[image:37.595.227.337.618.719.2]2.4.2.2 Flavonoid
Senyawa flavonoid merupakan salah satu senyawa polifenol terbesar yang mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi (C6 – C3 – C6), yaitu dua cincin aromatik yang dihubungkan oleh
satuan 3 karbon (Markham, 1988).
Flavonoid adalah antioksidan eksogen yang telah dibuktikan bermanfaat dalam mencegah kerusakan sel akibat stres oksidatif. Mekanisme kerja dari flavonoid sebagai antioksidan secara langsung adalah dengan mendonorkan ion hidrogen sehingga dapat menetralisir efek toksik dari radikal bebas dan mekanisme flavonoid sebagai antioksidan secara tidak langsung yaitu dengan meningkatkan ekspresi gen antioksidan endogen melalui aktivasi nuclear factor erythroid 2 related factor 2 (Nrf2) sehingga terjadi peningkatan gen yang berperan dalam sintesis enzim antioksidan endogen misalnya gen SOD (Sumardika dan I Made Jawi, 2012).
Hampir 80% dari total antioksidan dalam buah dan sayuran berasal dari flavonoid yang dapat berfungsi sebagai penangkap anion superoksida, lipid peroksida radikal, oksigen singlet, dan pengkelat logam (Kosasih, 2004).
2.4.2.3 Beta karoten
A merupakan bentuk yang siap diabsorpsi oleh tubuh. Kemampuan usus untuk menyerap beta karoten berkisar 9-22% bergantung sumber dan bentuk beta karoten yang akan diserap, ketersediaan lemak sebagai pelarutnya, dan kemampuan usus dari masing-masing individu.
Beta karoten bersifat larut dalam lemak sehingga melindungi sel dari kerusakan yang disebabkan oleh radikal bebas yang larut dalam lemak. Kemampuannya dalam menjaga integritas sel sangat baik sehingga dapat berperan sebagai antioksidan (Lingga, 2012). Rumus bangun betakaroten dapat dilihat pada Gambar 2.4.
Gambar 2.4 Rumus bangun betakaroten (Hanson, 2005).
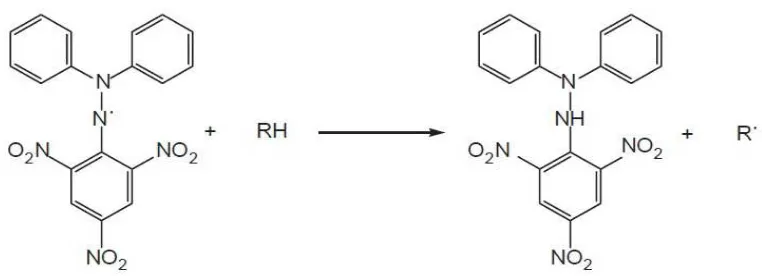
2.5Metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2- picrylhydrazil)
1,1-diphenyl-2-picrylhydrazil 1,1-diphenyl-2-picrylhydrazine
Gambar 2.5 Reaksi antara DPPH dengan atom H dari senyawa antioksidan (Widyastuti, 2010)
Metode DPPH merupakan metode yang cepat, sederhana, dan tidak mahal untuk mengukur kemampuan dari berbagai senyawa dalam memerangkap radikal bebas dan untuk mengevaluasi aktivitas antioksidan pada makanan dan minuman (Marinova, 2011).
Parameter yang dipakai untuk menunjukan aktivitas antioksidan adalah harga konsentrasi efisien atau Efficient Concentration (EC50) atau Inhibitory
Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat antioksidan yang memberikan persen penghambatan sebesar 50%. Zat yang mempunyai aktivitas antioksidan tinggi akan memiliki harga EC50 atau IC50 yang
2.6Metode pembentukan kompleks fosfomolibdenum
Metode ini diperkenalkan oleh Chipault et al. pada tahun 1955 untuk mengidentifikasi kapasitas antioksidan alami yang larut dalam air dan larut dalam lemak. Metode ini merupakan metode kuantitatif yang didasarkan pada reduksi Mo (VI) menjadi Mo (V) oleh sampel analit diikuti dengan pembentukan kompleks fosfat / Mo (V) berwarna hijau untuk mengidentifikasi adanya agen pereduksi. Konsentrasi diperoleh secara spektrofotometri dan hasil yang diperoleh
diekspresikan dalam bentuk ekuivalen terhadap asam askorbat atau α-tokoferol. Metode pembentukan kompleks fosfomolibdenum merupakan metode alternatif untuk evaluasi kapasitas antioksidan total lainnya karena metode ini sederhana dan pereaksinya murah (Prieto et al., 1999).
2.7 Spektrofotometer UV-Vis
Spektrofotometri adalah pengukuran absorbsi energi cahaya oleh suatu atom atau molekul pada panjang gelombang tertentu. Daerah spektrum ultraviolet biasanya dianggap berkisar dari 200 hingga 400 nm dan daerah sinar tampak dari 400 hingga 750 nm.
Ada beberapa hal yang harus diperhatikan dalam analisis dengan spektrofotometer ultraviolet dan sinar tampak yaitu:
a.Pembentukan molekul yang dapat menyerap sinar UV-Vis
Cara yang digunakan adalah dengan merubahnya menjadi senyawa lain atau direaksikan dengan pereaksi tertentu sehingga dapat menyerap sinar UV-Vis. b.Waktu kerja (operating time)
c.Pemilihan panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal.
d.Pembuatan kurva kalibrasi
Dilakukan dengan membuat seri larutan baku dalam berbagai konsentrasi kemudian absorbansi tiap konsentrasi diukur lalu dibuat kurva yang merupakan hubungan antara absorbansi dengan konsentrasi.
e.Pembacaan absorbansi sampel
BAB III
METODE PENELITIAN
Metode penelitian ini dilakukan secara eksperimental, meliputi identifikasi bahan tumbuhan, pengumpulan bahan tumbuhan, pembuatan sari buah markisa ungu dan sari buah markisa konyal segar, skrining fitokimia sari segar dan kental buah markisa ungu dan markisa konyal, identifikasi vitamin C sari kental buah markisa ungu dan markisa konyal. Pengujian aktivitas antioksidan sari buah markisa ungu dan sari buah markisa konyal dengan metode pemerangkapan radikal bebas 1,1-diphenyl-2-picrylhidrazyl (DPPH) serta pengukuran kapasitas antioksidan total dengan metode pembentukan kompleks fosfomolibdenum yang diukur dengan menggunakan spektrofotometer UV-Visible.
3.1 Alat
Alat-alat yang digunakan pada penelitian ini terdiri dari alat-alat gelas laboratorium, spektrofotometer UV-Visible (Shimadzu 1800), freeze dryer (Virtis Benchtop K), neraca analitis (Boeco Germany), penangas air (Stuart-SBS40), ultrasonikator (Bronson 1510), cawan porselin, desikator, saringan, spatula,
stopwatch.
3.2Bahan
bismuth (III) nitrat, besi (III) klorida, timbal (II) asetat, kalium iodida, iodium, α -naftol, asam asetat anhidrida, natrium hidroksida, amil alkohol, serbuk magnesium (Mg), perak (II) nitrat, kupri (II) sulfat, kalium natrium tartrat, larutan ammonia encer, ammonium molibdat, natrium fosfat dan air suling (teknis).
3.3Penyiapan Bahan Tumbuhan
Penyiapan bahan tumbuhan meliputi pengumpulan bahan tumbuhan, identifikasi tumbuhan, pembuatan sari buah markisa ungu dan sari buah markisa konyal segar, pengentalan sari buah markisa ungu dan sari buah markisa konyal segar dengan menggunakan freeze dryer.
3.3.1 Pengumpulan bahan tumbuhan
Metode pengumpulan bahan tumbuhan dilakukan secara purposif yaitu tanpa membandingkan dengan bahan tumbuhan yang sama dari daerah lain. Bahan tumbuhan yang digunakan adalah buah markisa ungu segar dan buah markisa konyal segar, diperoleh dari Pasar Tradisional Pringgan, Jalan Iskandar Muda, Medan Baru, Sumatera Utara.
3.3.2 Identifikasi tumbuhan
Identifikasi buah markisa ungu dan buah markisa konyal dilakukan di Herbarium Bogoriense, Bidang Botani, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor.
3.3.3 Pembuatan sari kental buah markisa ungu dan markisa konyal
sampai diperoleh sari buah yang kental. Selanjutnya digunakan sebagai sampel uji. Bagan pembuatan sampel uji dan bagan kerja penelitian dapat dilihat pada Lampiran 3, halaman 61.
3.4 Pembuatan Pereaksi 3.4.1 Pereaksi Bourchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.2 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml, pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10 ml air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.3 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang, dilarutkan dalam 20 ml asam nitrat pekat, pada wadah lain ditimbang sebanyak 27,2 g kalium iodida, dilarutkan dalam 50 ml air suling, kemudian kedua larutan dicampurkan dan didiamkan sampai memisah sempurna. Larutan yang jernih diambil dan diencerkan dengan air suling hingga volume larutan 100 ml (Ditjen POM, 1995).
3.4.4 Pereaksi Molish
3.4.5 Pereaksi asam klorida 2 N
Sebanyak 17 ml larutan asam klorida pekat ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.6 Pereaksi asam sulfat 2 N
Sebanyak 5,4 ml larutan asam sulfat pekat ditambahkan air suling sampai 100 ml (Ditjen POM, 1995).
3.4.7 Pereaksi natrium hidroksida 2 N
Sebanyak 8 g kristal natrium hidroksida dilarutkan dengan air suling sebanyak 100 ml (Ditjen POM, 1995).
3.4.8 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air suling bebas karbon dioksida sebanyak 100 ml (Ditjen POM, 1995).
3.4.9 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air secukupnya hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.10 Pereaksi Liebermann-Burchard
Sebanyak 5 bagian volume asam sulfat pekat dicampurkan dengan 50 bagian volume etanol 95%. Kemudian ditambahkan dengan hati-hati 5 bagian volume asam asetat anhidrida ke dalam campuran tersebut dan dinginkan (Ditjen POM, 1995).
3.4.11 Pereaksi Ag ammoniakal
Dilarutkan 3 g AgNO3 dengan 30 ml akuades (larutan A) dan 3 g NaOH
ditambahkan larutan ammonia yang telah diencerkan setetes demi setetes hingga perak oksida larut (Vogel, 1974).
3.4.12 Pereaksi Fehling
Larutan A. Larutkan 34,64 g kristal CuSO4 dengan akuades yang mengandung
beberapa tetes asam sulfat, dan encerkan larutan hingga 500 ml (Vogel, 1974). Larutan B. Larutkan 60 g NaOH murni dan 173 g garam Rochelle (kalium natrium tartrat) dengan akuades, jika perlu disaring, dan diencerkan hingga 500 ml (Vogel, 1974).
3.4.13 Pereaksi fosfomolibdenum
Sebanyak 494,3 mg ammonium molibdat dan 459,0 mg natrium fosfat dimasukkan ke dalam labu ukur 100 ml, dilarutkan dengan akuades, ditambahkan 3,26 ml asam sulfat pekat, dicukupkan dengan akuades hingga garis tanda (Prieto, et al., 1999).
3.4.14 Larutan DPPH 0,5 mM
Sebanyak 20 mg DPPH ditimbang kemudian dilarutkan dalam metanol hingga diperoleh volume larutan 100 ml (konsentrasi 200 µg/ml) (Marinova, 2011).
3.5Skrining Fitokimia
Skrining fitokimia meliputi pemeriksaan senyawa golongan alkaloida, glikosida, flavonoida, steroid/triterpenoid, saponin, tanin dan glikosida antrakinon.
3.5.1 Pemeriksaan alkaloid
dan disaring, filtrat dipakai untuk uji alkaloida. Diambil 3 tabung reaksi, lalu ke dalam masing-masing tabung reaksi dimasukkan 0,5 ml filtrat.
Pada tabung I : ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan menggumpal berwarna putih atau kuning.
Pada tabung II : ditambahkan 2 tetes pereaksi Dragendorff, akan terbentuk endapan berwarna coklat atau jingga kecoklatan.
Pada tabung III : ditambahkan 2 tetes pereaksi Bourchardat, akan terbentuk endapan berwarna coklat sampai kehitaman.
Alkaloid disebut positif jika terjadi endapan atau kekeruhan pada dua atau tiga dari percobaan di atas (Ditjen POM, 1995).
3.5.2 Pemeriksaan glikosida
Sebanyak 3 g sari buah kental ditimbang, disari dengan 30 ml campuran dari 7 bagian etanol 95% dengan 3 bagian air suling (7:3) dan 10 ml asam klorida 2N. Kemudian direfluks selama 10 menit, didinginkan, lalu disaring. Diambil 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3), perlakuan ini diulangi sebanyak 3 kali. Sari air dikumpulkan dan ditambahkan Na2SO4 anhidrat, disaring, kemudian diuapkan pada temperatur
batas kedua cairan, menunjukkan adanya ikatan gula (glikon) atau glikosida (Ditjen POM, 1995).
3.5.3 Pemeriksaan triterpenoid/steroid
Sebanyak 1 g sari buah kental ditimbang, dimaserasi dengan 20 ml n-heksan selama 2 jam, disaring, lalu filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 20 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat (pereaksi Liebermann-Burchard), timbulnya warna biru atau biru hijau menunjukkan adanya steroida, sedangkan warna merah, merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1987).
3.5.4 Pemeriksaan flavonoid
Sebanyak 1 g sari buah kental ditimbang, dilarutkan 10 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas. Ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966). 3.5.5 Pemeriksaan tanin
Sebanyak 0,5 g sari buah kental ditimbang, disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.5.6 Pemeriksaan saponin
selama 10 detik. Saponin positif jika terbentuk busa yang stabil tidak kurang dari 10 menit setinggi 1 sampai 10 cm dan dengan penambahan 1 tetes asam klorida 2N buih tidak hilang (Ditjen POM, 1995).
3.5.7 Pemeriksaan glikosida antrakinon
Sebanyak 0,2 g sari buah kental ditimbang, ditambahkan 5 ml asam sulfat 2 N, dipanaskan sebentar, setelah dingin ditambahkan 10 ml benzen, dikocok dan didiamkan. Lapisan benzen dipisahkan dan disaring. Di kocok lapisan benzen dengan 2 ml NaOH 2 N, didiamkan. Lapisan air berwarna merah dan lapisan benzen tidak berwarna menunjukkan adanya antrakinon (Ditjen POM, 1995).
3.6Identifikasi Vitamin C berdasarkan Daya Reduksi 3.6.1 Reaksi Ag ammoniakal
Ditambahkan beberapa tetes dari larutan sampel ke dalam 2-3 ml larutan Ag ammoniakal (yang mengandung ion [Ag(NH3)2]+ di dalam tabung reaksi yang
bersih. Hasil dinyatakan positif jika terbentuk cermin perak (Vogel, 1974). 3.6.2 Reaksi Fehling
Dimasukkan 4 ml larutan Fehling yang baru dibuat (dengan mencampurkan Fehling A (larutan CuSO4) dan larutan B (larutan alkalin tartrat) dalam jumlah
3.7 Pengujian Aktivitas Antioksidan Menggunakan Metode Pemerangkapan Radikal Bebas DPPH
3.7.1 Prinsip metode pemerangkapan radikal bebas (DPPH)
Kemampuan sampel uji dalam meredam proses oksidasi radikal bebas DPPH dalam larutan metanol (sehingga terjadi perubahan warna DPPH dari ungu menjadi kuning) dengan nilai IC50 (konsentrasi sampel uji yang mampu meredam
radikal bebas 50%) sebagai parameter menentukan aktivitas antioksidan sampel (Molyneux, 2004).
3.7.2 Pembuatan larutan blanko
Larutan DPPH 0,5 mM (konsentrasi 200 µg/ml) dipipet sebanyak 5 ml, kemudian dimasukkan ke dalam labu tentukur 25 ml, lalu dicukupkan dengan metanol sampai garis tanda (konsentrasi 40 µg/ml).
3.7.3 Pengukuran panjang gelombang serapan maksimum DPPH
Larutan DPPH konsentrasi 40 µg/ml dihomogenkan dan diukur serapannya pada panjang gelombang 400-750 nm yang merupakan panjang gelombang sinar tampak (Gandjar dan Rohman, 2007).
3.7.4 Pembuatan larutan induk
3.7.4.1 Pembuatan larutan induk sampel uji
3.7.4.2 Pembuatan larutan induk vitamin C
Sebanyak 25 mg serbuk vitamin C ditimbang, dimasukkan ke dalam labu tentukur 25 ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan metanol sampai garis tanda (konsentrasi 1000 µg/ml).
3.7.5 Pembuatan larutan uji
3.7.5.1 Larutan uji sari kental buah markisa ungu
Konsentrasi ditetapkan setelah dilakukan beberapa orientasi. Larutan induk dipipet sebanyak 2,5 ml ; 5 ml ; 7,5 ml ; 10 ml ke dalam labu ukur 25 ml untuk mendapatkan konsentrasi larutan uji 2000 µg/ml, 4000 µg/ml , 6000 µg/ml, 8000 µg/ml, ke dalam masing-masing labu ukur ditambahkan 5 ml larutan DPPH 0,5 mM (konsentrasi 200 µg/ml) lalu volumenya dicukupkan dengan metanol sampai garis tanda. Diamkan selama 60 menit, diukur serapannya menggunakan spektrofotometer UV-Visibel pada panjang gelombang serapan maksimum yang diperoleh.
3.7.5.2 Larutan uji sari kental buah markisa konyal
3.7.5.3 Larutan uji vitamin C
Larutan induk dipipet sebanyak 0,05 ml ; 0,1 ml ; 0,15 ml ; 0,2 ml ke dalam labu ukur 25 ml untuk mendapatkan konsentrasi larutan uji 2 µg/ml, 4 µg/ml, 6 µg/ml, 8 µg/ml, ke dalam masing-masing labu ukur ditambahkan 5 ml larutan DPPH 0,5 mM (konsentrasi 200 µg/ml) lalu volumenya dicukupkan dengan metanol sampai garis tanda. Diamkan selama 60 menit, diukur serapannya menggunakan spektrofotometer UV-Visibel pada panjang gelombang serapan maksimum yang diperoleh.
3.7.6 Analisis persen pemerangkapan radikal bebas DPPH
Menurut Molyneux (2004), penentuan persen pemerangkapan radikal bebas oleh sampel uji, sari buah markisa ungu dan markisa konyal dengan vitamin C sebagai pembanding, menggunakan metode pemerangkapan radikal bebas
1,1-diphenyl-2-picrylhydrazil (DPPH) dihitung dengan rumus sebagai berikut: Q =100 (A0-Ac) / A0
Keterangan: Q = Persen pemerangkapan radikal bebas DPPH A0 = Absorbansi tidak mengandung sampel
Ac = Absorbansi sampel
3.7.7 Analisis nilai IC50
Perhitungan yang digunakan dalam penentuan aktivitas pemerangkapan radikal bebas adalah nilai IC50 (Inhibitory Concentration), nilai tersebut
3.8 Pengukuran Kapasitas Antioksidan Total dengan Metode Pembentukan Kompleks Fosfomolibdenum
Metode pembentukan kompleks fosfomolibdenum merupakan metode yang digunakan untuk menentukan kapasitas antioksidan total yang dinyatakan sebagai jumlah yang setara asam askorbat berdasarkan daya reduksi Mo (VI) menjadi Mo (V) oleh sampel analit dan selanjutnya pembentukan kompleks yang berwarna hijau biru dari fosfat molibdenum yang mengandung antioksidan pada suasana asam (Prieto., et al, 1999).
3.8.1 Pembuatan larutan induk baku vitamin C
Ditimbang vitamin C sebanyak 100 mg kemudian dimasukkan ke dalam labu tentukur 100 ml, dan dilarutkan dengan akuades sampai garis tanda. Diperoleh konsentrasi vitamin C pada Larutan Induk Baku (LIB) I adalah 1000 µg/ml.
3.8.2 Penentuan panjang gelombang maksimum
Dipipet 7 ml dari LIB I, dimasukkan ke dalam labu tentukur 50 ml dan diencerkan dengan akuades sampai garis tanda (konsentrasi 140 µg/ml). Kemudian dipipet 0,5 ml, dimasukkan ke dalam tabung reaksi ditambahkan 5 ml larutan pereaksi fosfomolibdenum. Diperoleh konsentrasi vitamin C pada larutan ini adalah 12,727 µg/ml. Kemudian tabung ditutup, dipanaskan di penangas air selama 60 menit pada suhu 90ºC dan didinginkan pada suhu kamar. Kemudian diukur absorbansinya pada panjang gelombang 400-750 nm.
3.8.3 Penentuan waktu kerja (operating time)
ini adalah 12,727 µg/ml. Kemudian tabung ditutup, dipanaskan di penangas air selama 60 menit pada suhu 90ºC, didinginkan pada suhu kamar dan diukur absorbansinya pada panjang gelombang maksimum yang diperoleh diatas.
3.8.4 Pengukuran kurva kalibrasi vitamin C
Dipipet 4 ml, 5 ml, 6 ml, 7 ml, dan 8 ml dari LIB I, masing-masing dimasukkan ke dalam labu ukur 50 ml, diencerkan dengan akuades hingga garis tanda sehingga konsentrasi vitamin C yang diperoleh adalah 80 µg/ml, 100 µg/ml, 120 µg/ml, 140 µg/ml, 160 µg/ml. Kemudian dipipet masing-masing 0,5 ml dimasukkan ke dalam tabung reaksi dan ditambahkan 5 ml larutan pereaksi fosfomolibdenum. Diperoleh konsentrasi vitamin C pada larutan ini adalah 7,273 µg/ml, 9,091 µg/ml, 10,909 µg/ml, 12,727 µg/ml, 14,545 µg/ml. Kemudian tabung ditutup, dipanaskan di penangas air pada suhu 90ºC selama 60 menit, didinginkan pada suhu kamar dan diukur absorbansinya pada panjang gelombang maksimum dalam waktu kerja yang diperoleh.
3.8.5 Uji kapasitas antioksidan total sampel uji
gelombang maksimum dalam waktu kerja yang diperoleh. Perlakuan dilakukan sebanyak 6 kali pengulangan.
3.8.6 Validasi metode analisis
3.8.6.1 Penentuan batas deteksi (Limit of Detection) dan batas kuantitasi (Limit of Quantitation)
Batas deteksi atau Limit of Detection (LOD) merupakan jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan. Sedangkan batas kuantitasi atau Limit of Quantitation (LOQ) merupakan kuantitasi terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama.
Menurut Harmita (2004), batas deteksi dan batas kuantitasi dapat dihitung dengan rumus sebagai berikut :
Simpangan Baku =
(
)
2 2 − −
∑
n Yi YBatas Deteksi (LOD) =
slope X SY x
3
Batas Kuantitasi (LOQ) =
slope X SY x
10
3.8.6.2 Akurasi atau kecermatan dengan persen perolehan kembali (% Recovery)
Kecermatan atau akurasi adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Uji perolehan kembali atau
Persen perolehan kembali ditentukan dengan menentukan berapa persen analit yang ditambahkan tadi dapat ditemukan (Harmita, 2004). Masing-masing dilakukan sebanyak 6 kali pengulangan kemudian dianalisis dengan perlakuan yang sama seperti pada penetapan kapasitas sampel.
Menurut Harmita (2004), persen perolehan kembali (% recovery) dapat dihitung dengan rumus dibawah ini :
% recovery = 100%
A * C
C CF − A ×
Keterangan :
CF = Konsentrasi antioksidan dalam sampel setelah penambahan baku
CA = Konsentrasi antioksidan dalam sampel sebelum penambahan baku
C*A = Kapasitas antioksidan baku vitamin C yang ditambahkan
3.8.6.3 Simpangan baku relatif
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode yang dilakukan (Harmita, 2004).
Menurut Harmita (2004), rumus untuk menghitung simpangan baku relatif adalah sebagai berikut :
RSD = ×100%
X SD
Keterangan :
−
3.8.7 Analisis data secara statistik
Kapasitas antioksidan total yang diperoleh dari hasil pengukuran masing-masing 6 larutan sampel dianalisis untuk mengetahui data ditolak atau diterima dengan menggunakan uji distribusi t dengan rumus (Sudjana, 2005):
thitung =
n SD
X Xi
/ −
Data diterima jika nilai t hitung < t tabel. Tabel distribusi t dapat dilihat pada Lampiran 25, halaman 71.
Untuk mencari standar deviasi (SD) digunakan rumus (Sudjana, 2005) :
SD =
(
)
1 -nX -Xi 2
∑
Keterangan : Xi = Kadar sampel
X = Kadar rata-rata sampel
n = Jumlah pengulangan
Dan untuk menentukan kapasitas antioksidan total di dalam sampel dengan interval kepercayaan 99%, α = 1%, dk = n-1, dapat digunakan rumus (Sudjana, 2005):
µ = X ± ((tα/2, dk) x SD / √n ) Keterangan : µ = interval kepercayaan
X = kadar rata-rata sampel
t = harga t tabel sesuai dengan dk = n-1
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Herbarium Bogoriense, Bidang Botani, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor menunjukkan bahwa tumbuhan termasuk jenis Passiflora edulis Sims (markisa ungu) dan Passiflora ligularis Juss. (markisa konyal), suku Passifloraceae. Hasil identifikasi dapat dilihat pada Lampiran 1, halaman 59.
4.2 Hasil Skrining Fitokimia
[image:59.595.113.513.432.621.2]Hasil skrining fitokimia dari sari segar dan kental buah markisa ungu dan markisa konyal dapat dilihat pada Tabel 4.1.
Tabel 4.1 Hasil skrining fitokimia markisa ungu dan markisa konyal
No Pemeriksaan Sari buah markisa ungu Sari buah markisa konyal Segar Kental Segar Kental
1 Alkaloid - - - -
2 Glikosida + + + +
3 Triterpenoid/Steroid - - - -
4 Flavonoid + + + +
5 Tanin - - - -
6 Saponin + + - -
7 Glikosida antrakinon - - - - Keterangan : (+) : mengandung golongan senyawa
(-) : tidak mengandung golongan senyawa
Flavonoid mengandung cinicn aromatik yang terkonjugasi, umumnya terdapat dalam tumbuhan, terikat pada gula sebagai glikosida (Harborne, 1987). Flavonoid merupakan antioksidan yang dapat mengatasi berbagai macam radikal bebas dan memberikan perlindungan kepada sel secara menyeluruh, baik di luar (ekstraseluler) ataupun di dalam sel (intraseluler). Dalam buah markisa terdapat beberapa senyawa aktif yang mengakibatkan markisa dapat diperhitungkan sebagai antioksidan yakni kandungan vitamin C, polifenol, beta-karoten dan saponin (Lingga, 2012).
4.3 Hasil Identifikasi Vitamin C berdasarkan Daya Reduksi
Dari hasil pengamatan diperoleh bahwa sari buah markisa ungu dan sari buah markisa konyal memiliki vitamin C karena daya reduksinya terhadap pereaksi Ag ammoniakal dengan terbentuknya cermin perak dan pereaksi Fehling dengan terbentuknya endapan merah bata. Hasil pengamatan dapat dilihat pada Lampiran 4, Halaman 62.
4.4 Hasil Analisis Aktivitas Antioksidan Sampel Uji
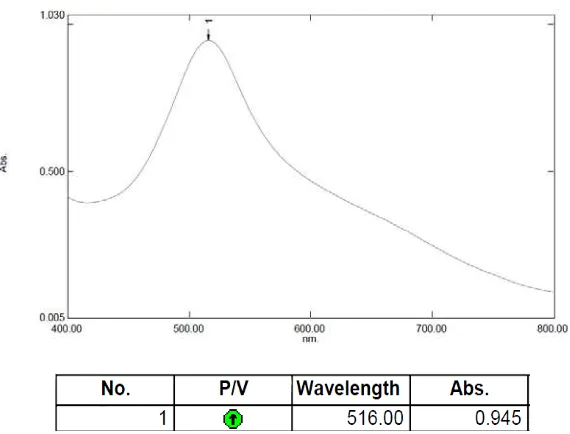
4.4.1 Hasil pengukuran panjang gelombang serapan maksimum DPPH
Kurva panjang gelombang maksimum larutan DPPH dalam metanol dapat dilihat pada Gambar 4.1.
Gambar 4.1 Panjang gelombang maksimum DPPH dalam metanol 4.4.2 Hasil analisis aktivitas antioksidan sampel uji
Tabel 4.2 Penurunan absorbansi DPPH dengan penambahan sari kental buah markisa ungu
Konsentrasi sampel
Absorbansi
I II III
[image:62.595.119.510.299.420.2]DPPH (0 ppm) 0,9683 0,9682 0,9675 2000 ppm 0,6322 0,6309 0,6305 4000 ppm 0,3028 0,3003 0,2978 6000 ppm 0,1852 0,1685 0,1591 8000 ppm 0,0840 0,0847 0,0857
Tabel 4.3 Penurunan absorbansi DPPH dengan penambahan sari kental buah markisa konyal
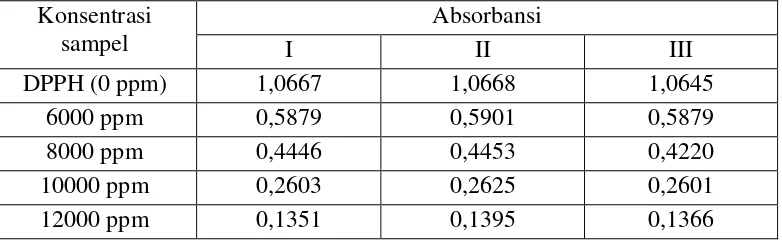
Konsentrasi sampel
Absorbansi
I II III
DPPH (0 ppm) 1,0667 1,0668 1,0645 6000 ppm 0,5879 0,5901 0,5879 8000 ppm 0,4446 0,4453 0,4220 10000 ppm 0,2603 0,2625 0,2601 12000 ppm 0,1351 0,1395 0,1366
Tabel 4.4 Penurunan absorbansi DPPH dengan penambahan vitamin C Konsentrasi
sampel
Absorbansi
I II III
DPPH (0 ppm) 0,9833 0,9881 0,9901 2 ppm 0,7581 0,7582 0,7584 4 ppm 0,5309 0,5305 0,5307 6 ppm 0,1894 0,1895 0,1897 8 ppm 0,0975 0,0971 0,0970
[image:62.595.112.514.465.588.2]Penurunan nilai absorbansi terjadi karena adanya transfer elektron atom hidrogen antioksidan kepada DPPH. Jika semua elektron pada DPPH menjadi berpasangan, maka warna larutan berubah dari ungu tua menjadi kuning terang (Molyneux, 2004).
4.4.3 Hasil analisis peredaman radikal bebas DPPH oleh sampel uji
[image:63.595.118.512.435.558.2]Kemampuan antioksidan diukur pada menit ke-60 sebagai penurunan serapan larutan DPPH (peredaman warna ungu DPPH) akibat adanya penambahan larutan uji. Nilai serapan larutan DPPH sebelum dan sesudah penambahan larutan uji tersebut dihitung sebagai persen peredaman. Aktivitas antioksidan (% peredaman) sari kental buah markisa ungu dapat dilihat pada Tabel 4.5, aktivitas antioksidan (% peredaman) sari kental buah markisa konyal dapat dilihat pada Tabel 4.6 dan aktivitas antioksidan (% peredaman) vitamin C dapat dilihat pada Tabel 4.7. Tabel 4.5 Aktivitas antioksidan (% peredaman) sari kental buah markisa ungu
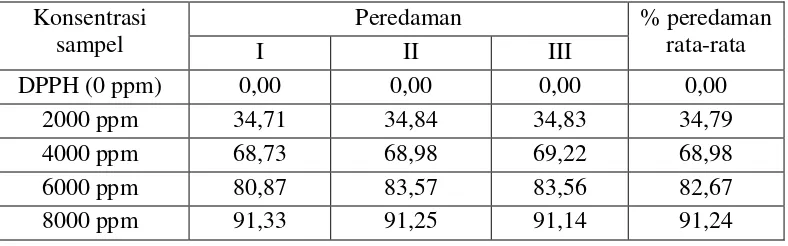
Konsentrasi sampel
Peredaman % peredaman rata-rata
I II III
DPPH (0 ppm) 0,00 0,00 0,00 0,00 2000 ppm 34,71 34,84 34,83 34,79 4000 ppm 68,73 68,98 69,22 68,98 6000 ppm 80,87 83,57 83,56 82,67 8000 ppm 91,33 91,25 91,14 91,24
Tabel 4.6 Aktivitas antioksidan (% peredaman) sari kental buah markisa konyal Konsentrasi
sampel
Peredaman % peredaman rata-rata