BAB II
TINJAUAN PUSTAKA
2.1Uraian Tumbuhan
Uraian tumbuhan meliputi habitat, morfologi tumbuhan, sistematika tumbuhan, nama asing, kandungan kimia dan kegunaan dari tumbuhan.
2.1.1Habitat
Markisa ungu berasal dari Brazil bagian Selatan yaitu dari Paraguay hingga
Argentina bagian Utara. Di Indonesia, markisa ungu ditanam di daerah dataran tinggi tropis dan di daerah subtropis pada ketinggian 700-2000 m di atas permukaan laut dengan suhu 18 - 25º C. Daerah penghasil markisa ungu masih
terpusat di beberapa Kabupaten di Provinsi Sumatera Utara (Kabupaten Karo, Simalungun, Dairi, Tapanuli Utara) dan Provinsi Sulawesi Selatan (Kabupaten
Gowa, Sinjai, Tator, Enrekang dan Polmas).
Markisa konyal berasal dari Pegunungan Andes diantara Bolivia dan Venezuela, tumbuh di daerah subtropis dengan ketinggian 900-2700 m di atas
permukaan laut pada suhu 15 - 18º C. Di Indonesia, markisa konyal banyak ditanam di Provinsi Sumatera Utara (Kabupaten Karo dan Simalungun) dan
Provinsi Jawa Barat (daerah Pelabuhan Ratu, Sukabumi, Bogor) (Hutabarat dan Manshur, 2010 ; Lim, 2012).
2.1.2 Morfologi tumbuhan
Tanaman markisa merupakan tumbuhan semak yang hidup menahun (perennial) dan bersifat merambat hingga sepanjang 20 m atau lebih. Batang
berwarna hijau dan setelah tua berubah menjadi hijau kecoklatan. Daun tanaman sangat rimbun tumbuh secara bergantian pada batang atau cabang. Bentuk daun
menjari, bergerigi, berwarna hijau mengkilap dengan panjang tangkai 2-3 cm, panjang daun 9-12 cm dan lebar 7-9 cm (Rukmana, 2003).
Bunga markisa berbentuk mangkuk dengan dasar bunga yang meninggi untuk
mendukung benang sari dan putik diatasnya (androginofor). Bunga berdiameter 5-7 cm, memiliki 5 daun kelopak yang berwarna putih kehijauan, 5 mahkota bunga
berwarna putih yang di atasnya terdapat dua baris mahkota tambahan berbentuk benang-benang yang melingkar dengan panjang 2-3 cm berwarna putih dengan dasar ungu, juga memiliki 3 putik bercabang tiga dan 5 benang sari dengan kepala
sari yang besar (Hermanto, 2013 ; Joy, 2010).
Buah markisa ungu berbentuk bulat atau bulat oval dengan panjang 4-6 cm.
Kulit buah berwarna hijau muda dan berubah menjadi ungu gelap jika sudah matang. Kulit agak keras dan tebal serta memiliki lapisan (endocarp) berwarna putih di dalamnya. Biji berbentuk gepeng, berwarna hitam, dibungkus oleh
selaput yang berisi sari buah berwarna kuning jingga yang memberikan rasa asam dengan aroma khas markisa yang kuat (Joy, 2010).
Buah markisa konyal berbentuk bulat telur dengan panjang 6-8 cm. Kulit buah berwarna hijau keunguan dengan bintik putih saat muda dan berwarna jingga kekuningan bila sudah matang. Kulit tipis dan rapuh pada bagian luar namun
berwarna putih dan lunak pada bagian dalam. Biji berbentuk gepeng dan berwarna hitam, dibungkus oleh selaput yang berisi sari buah berwarna putih keabuan dan
2.1.3Sistematika tumbuhan
Menurut Herbarium Medanesse (2013), sistematika tumbuhan buah markisa
ungu dan buah markisa konyal adalah sebagai berikut : Kingdom : Plantae
Divisi : Spermatophyta
Kelas : Dicotyledoneae Bangsa : Malpighiales
Suku : Passifloraceae Marga : Passiflora
Jenis : Passiflora edulis Sims.
Nama lokal : Markisa ungu
Sistematika tumbuhan buah markisa konyal adalah sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae
Bangsa : Malpighiales Suku : Passifloraceae
Marga : Passiflora
Jenis : Passiflora ligularis A.Juss Nama lokal : Markisa konyal
2.1.4Nama asing
Buah markisa ungu memiliki nama lain seperti purple granadilla (Inggris),
Buah markisa konyal memiliki nama lain seperti sweet granadilla (Inggris), zoete markoesa (Belanda), buah selaseh (Malaysia), tumbo (Peru) (Duke, 2009).
2.1.5Kandungan kimia
Terdapat 3 komponen senyawa kimia utama yang terdapat di dalam buah markisa yaitu alkaloid, flavonoid, dan karotenoid. Alkaloid yang terdapat pada
buah markisa adalah alkaloid harmala yang mengandung harman, harmin, harmlin, harmol, harmalol dalam jumlah yang kecil. Flavonoid yang terdapat
dalam buah markisa mengandung homoorientin, isooerientin, orientin, isovitexin, vitexin, saponaretin, saponarin, dan kandungan karotenoid dalam buah markisa antara lain β-kriptoxanthin, α-karoten, β-karoten, dan likopen (Joy, 2010).
Komposisi dari buah markisa ungu antara lain air, protein, lemak, karbohidrat, berbagai mineral (kalsium, zat besi, magnesium, kalium, natrium),
berbagai vitamin (tiamin, riboflavin, niasin, asam askorbat), dan asam organik seperti asam sitrat dan asam malat.
Komposisi dari buah markisa konyal antara lain air, protein, lemak, serat,
polisakarida, berbagai mineral (kalsium, zat besi, fosfor), dan berbagai vitamin (riboflavin, niasin, asam askorbat) (Lim, 2012).
2.1.6Kegunaan
Buah markisa telah dibuktikan secara ilmiah memiliki efek sedatif, menurunkan tekanan darah, menekan sistem saraf pusat, dan sebagai antiansietas.
Secara tradisional buah markisa juga dilaporkan memiliki efek sebagai antikonvulsan, disinfektan, antidepresan, kardiotonik (menstabilkan irama jantung
menstruasi. Jus buah markisa digunakan untuk mengobati infeksi saluran kemih di Peru dan digunakan sebagai stimulan pencernaan di pulau Madeira (Portugal).
Tidak hanya buah markisa yang digunakan untuk pengobatan, bunga dan daun markisa juga berkhasiat. Industri farmasi di Eropa mengambil senyawa passiflorin dari daun markisa yang telah dikeringkan dengan cara ekstraksi untuk
dijadikan sebagai obat penenang, sedangkan bunga markisa telah digunakan untuk mengobati asma, kegelisahan, dan insomnia (Mbora, A., et al, 2008 ; Hutabarat
dan Manshur, 2010).
2.2Freeze Drying
Freeze drying atau disebut juga lyophilization merupakan proses untuk
menghilangkan air tanpa pemanasan berlebih. Umumnya digunakan untuk memenuhi kebutuhan farmasetik dalam meningkatkan stabilitas dan waktu simpan
obat-obatan yang tidak stabil, digunakan industri makanan untuk memperpanjang waktu simpan dengan mencegah pertumbuhan mikroorganisme dan memperlambat oksidasi lipida (Nireesha et al, 2013).
Metode pengeringan freeze drying hanya sedikit mengubah warna, rasa, tekstur, nutrisi, penampilan, komponen kimia, dan aktivitas biologis dari sampel
yang segar sehingga disebut sebagai metode pengeringan terbaik untuk makanan yang mengandung komponen sensitif panas dan komponen antioksidan seperti tokoferol, asam askorbat, karotenoid, dan fenolik (Dirim, 2012).
Freeze drying adalah proses dimana air dihilangkan dari suatu produk dengan mengatur tekanan dan temperatur dalam keadaan vakum. Terdapat 2 komponen
kondensor. Ruang pengering dihubungkan dengan sebuah katup ke ruang kondensor untuk mencapai temperatur -50 sampai -80ºC.
Tahapan yang terjadi pada saat freeze drying ada 3, yaitu : a. Freezing
Produk yang akan dikeringkan, dibekukan terlebih dahulu sehingga terbentuk
massa yang solid. b. Primary drying
Produk yang sudah beku dikondisikan dalam keadaan vakum dengan tekanan 10-4 sampai 10-5 atmosfer, sehingga pelarut dari produk menguap dari fase padat ke gas tanpa melewati fase cair atau disebut dengan sublimasi. Pada
proses sublimasi perlu ditingkatkan temperatur sekitar -45º sampai -20º C untuk mempercepat penguapan. Peningkatan temperatur harus terus
diperhatikan agar tetap di bawah critical process temperature (suhu dimana produk kembali mencair). Pada tahap ini, penguapan pelarut belum sempurna karena masih ada sisa-sisa embun hasil sublimasi yang masih tertinggal dalam
produk.
c. Secondary drying
Ada sekitar 7-8% embun sisa primary drying yang harus dikeringkan pada temperatur yang lebih tinggi untuk mengurangi kandungan air dalam produk. Proses ini disebut dengan isothermal desorption. Pada tahap ini, temperatur
produk harus lebih tinggi dari temperatur lingkungannya dan tekanan diturunkan sampai minimum. Tahap ini memerlukan waktu 1/3 atau 1/2 kali
2.3Radikal Bebas
Radikal bebas (free radical) adalah suatu senyawa atau molekul yang
mengandung satu atau lebih elektron tidak berpasangan pada orbital luarnya. Adanya elektron yang tidak berpasangan menyebabkan senyawa tersebut menjadi tidak stabil dan sangat reaktif mencari pasangan dengan cara menyerang dan
mengikat elektron molekul yang berada di sekitarnya.
Secara umum sumber radikal bebas dapat dibedakan menjadi dua yaitu
endogen dan eksogen. Radikal bebas endogen dihasilkan tubuh secara alami dari proses biokimia yang berlangsung di dalam sel (intraselular) dan di luar sel (ekstraselular), proses ini terjadi terus menerus selama kehidupan. Keberadaannya
dalam jumlah normal berguna untuk melawan peradangan, membunuh kuman penyebab penyakit, detoksifikasi racun xenobiotik, polimerisasi dinding sel serta
untuk mengendalikan tonus otot polos pada pembuluh darah dan organ-organ dalam tubuh (Lingga, 2012). Radikal bebas eksogen berasal dari luar sistem tubuh misalnya sinar UV dan lingkungan seperti radiasi, polusi, asap rokok, makanan,
minuman, ozon, dan pestisida (Rohmatussolihat, 2009).
Radikal bebas dapat terbentuk dari oksigen dan nitrogen sebagai produk
metabolisme sel normal, atau disebut dengan reactive oxygen species (ROS) dan
reactive nitrogen species (RNS). RNS dan ROS yang sangat reaktif terdiri atas kelompok radikal antara lain superoksida (O2•−), hidroksil (OH•), peroksil (RO2•),
hidroperoksil (HO2•), alkoksil (RO•), nitrit oksida (NO•), nitrogen dioksida (NO2•), lipid peroksil (LOO•) dan kelompok non radikal yang kurang reaktif
nitrit (HNO2), dinitrogen trioksida (N2O3) dan lipid peroksida (LOOH). Radikal bebas yang berasal dari oksigen merupakan spesies radikal yang lebih banyak
dihasilkan dalam sistem kehidupan (Sen et al, 2010).
Secara umum tahapan reaksi pembentukan radikal bebas adalah : a.Inisiasi
RH + initiator → R●
b.Propagasi
R● + O2 → ROO●
ROO● + RH → ROOH + R● c.Terminasi
R● + R●→ RR
ROO● + R●→ ROOR
Tahap inisiasi adalah tahap awal terbentuknya radikal bebas. Tahap propagasi adalah tahap perpanjangan radikal berantai, dimana terjadi reaksi antara suatu
radikal dengan senyawa lain dan menghasilkan radikal baru. Tahap terminasi adalah tahap akhir, terjadinya pengikatan suatu radikal bebas dengan radikal bebas yang lain sehingga membentuk senyawa non-radikal yang biasanya kurang reaktif
dari radikal induknya (Kumalaningsih, 2006).
Keseimbangan antara kandungan antioksidan dan radikal bebas di dalam
tubuh merupakan salah satu faktor yang mempengaruhi kesehatan. Apabila jumlah radikal bebas terus bertambah sedangkan antioksidan endogen jumlahnya tetap, maka kelebihan radikal bebas tidak dapat dinetralkan. Akibatnya radikal
bebas akan bereaksi dengan komponen-komponen sel dan menimbulkan kerusakan sel. Dampak reaktifitas senyawa radikal bebas bermacam-macam mulai
kanker, aterosklerosis, penyakit jantung koroner dan diabetes mellitus (Rohmatussolihat, 2009).
2.4Antioksidan
Antioksidan merupakan senyawa pemberi elektron atau disebut reduktan. Senyawa ini mampu menginaktivasi berkembangnya reaksi oksidasi dengan
mengikat radikal bebas sehingga kerusakan sel dapat dihambat. Konsumsi makanan yang mengandung antioksidan dapat meningkatkan status imunologis
dan menghambat timbulnya penyakit degeneratif akibat penuaan (Winarsi, 2007). Menurut Kumalaningsih (2006), berdasarkan fungsinya antioksidan dibedakan menjadi lima, yaitu :
a.Antioksidan primer
Antioksidan ini berfungsi untuk mencegah terbentuknya radikal bebas baru
dengan mengurangi dampak negatif dari radikal bebas yang ada sebelum sempat bereaksi. Contoh antioksidan primer dalam tubuh adalah enzim superoksida dismutase (SOD). Enzim ini melindungi rusaknya sel-sel dalam
tubuh akibat serangan radikal bebas. b.Antioksidan sekunder
Antioksidan sekunder berfungsi memerangkap radikal bebas serta mencegah terjadinya reaksi berantai sehingga tidak terjadi kerusakan sel yang lebih parah. Contoh antioksidan sekunder adalah vitamin E, vitamin C dan betakaroten yang
dapat diperoleh dari buah-buahan. c.Antioksidan tersier
d.Oxygen scavenger
Antioksidan dalam kelompok ini berfungsi mengikat oksigen sehingga tidak
mendukung reaksi oksidasi, misalnya vitamin C. e.Chelators atau Sequesstrants
Antioksidan dalam kelompok ini berfungsi mengikat logam seperti besi dan
tembaga yang mampu mengkatalis reaksi oksidasi lemak. Contohnya adalah asam sitrat dan asam amino.
2.4.1 Antioksidan enzimatis
Antioksidan enzimatis merupakan sistem pertahanan utama (primer) terhadap kondisi stres oksidatif. Enzim-enzim tersebut merupakan metaloenzim yang
aktivitasnya sangat tergantung pada ion logam (Winarsi, 2007).
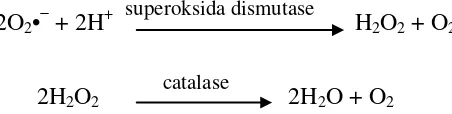
Antioksidan enzimatis yang dihasilkan tubuh antara lain SOD yang
mengubah superokisda (O2•−) yang reaktif menjadi hidrogen peroksida (H2O2) yang masih merupakan ROS namun kurang reaktif, sehingga dengan adanya enzim katalase akan merusak H2O2. Reaksi yang terjadi dapat dilihat pada
Gambar 2.1.
2O2•− + 2H+ superoksida dismutase
H2O2 + O2
2H2O2 catalase 2H2O + O2
Gambar 2.1 Reaksi enzimatis destruksi superoksida
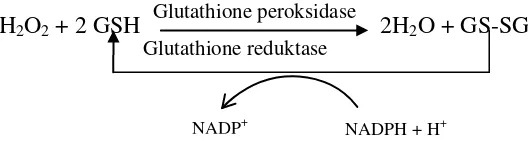
Antioksidan enzimatis lain dalam tubuh adalah molekul glutathione yang terdiri dari tiga buah asam amino yang bergabung membentuk tripeptida.
(GS-SG yang memiliki ikatan disulfida) oleh enzim glutathione reduktase dan tambahan NADPH akan membentuk GSH kembali. Reaksi pemecahan H2O2 oleh
GSH dapat dilihat pada Gambar 2.2.
H2O2 + 2 GSH Glutathione peroksidase
2H2O + GS-SG
Glutathione reduktase
Gambar 2.2 Reaksi peran protektif glutathione (GSH) (Hanson, 2005) Antioksidan SOD bergantung pada logam Fe, Cu, Mn dan Zn. Beberapa makanan yang dapat meningkatkan produksi enzim ini adalah brokoli, kubis, kubis tunas, dedak beras atau biji serealia dan kecambah gandum. Enzim katalase
bergantung pada logam Fe yang dapat diperoleh dari sayuran hijau, kacang-kacangan, hati, daging, telur, susu segar, tempe dan udang, sedangkan enzim
glutathione peroksidase bergantung pada logam Se (Selenium) yang dapat diperoleh dari asparagus, alpukat, ikan laut, cabai, paprika, seledri dan kacang-kacangan (Lingga, 2012 ; Winarsi, 2007).
2.4.2 Antioksidan non-enzimatis
Selain antioksidan yang bersifat enzimatis, terdapat antioksidan
non-enzimatis yang disebut juga antioksidan sekunder karena dapat diperoleh dari asupan bahan makanan seperti vitamin A, C, E, beta karoten dan flavonoid. Senyawa-senyawa ini berfungsi memerangkap senyawa oksidan serta mencegah
terjadinya reaksi berantai (Winarsi, 2007). 2.4.2.1 Vitamin C (asam askorbat)
Vitamin C atau asam askorbat mempunyai berat molekul 176,13 dengan rumus molekul C6H8O6. Pemerian vitamin C adalah hablur atau serbuk berwarna putih atau agak kekuningan. Pengaruh cahaya lambat laun menyebabkan berwarna
gelap, dalam keadaan kering stabil di udara namun dalam larutan cepat teroksidasi. Vitamin C mudah larut dalam air, agak sukar larut dalam etanol,
praktis tidak larut dalam kloroform, dalam eter dan dalam benzen (Ditjen POM, 1979).
Sesuai dengan sifatnya yang larut dalam air, vitamin C bekerja melindungi
bagian tubuh dari radikal bebas yang larut dalam air dengan mendonorkan elektronnya ke dalam reaksi biokimia intraselluler dan ekstraselluler. Vitamin C
mampu bereaksi dengan radikal bebas dan mengubahnya menjadi radikal askorbil yang kurang reaktif, kemudian membentuk asam monodehidroaskorbat dan atau asam dehidroaskorbat. Bentuk tereduksi ini dapat diubah kembali menjadi asam
askorbat oleh enzim monodehidroaskorbat reduktase dan dehidroaskorbat reduktase (Packer, 2002).
Asupan vitamin C sebaiknya 60-1000 mg per hari. Konsumsi terlalu banyak dikhawatirkan dapat mempengaruhi atau merusak nutrien lain di dalam tubuh. Peneliti lainnya menyarankan mengasup 500 mg vitamin C dua kali sehari untuk
mempertahankan tingkat optimal kebutuhan antioksidan. Vitamin C terdapat pada buah-buahan seperti jeruk, apel, sirsak, lemon, stroberi, melon serta sayuran
2.4.2.2 Flavonoid
Senyawa flavonoid merupakan salah satu senyawa polifenol terbesar yang
mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi (C6 – C3 – C6), yaitu dua cincin aromatik yang dihubungkan oleh satuan 3 karbon (Markham, 1988).
Flavonoid adalah antioksidan eksogen yang telah dibuktikan bermanfaat dalam mencegah kerusakan sel akibat stres oksidatif. Mekanisme kerja dari
flavonoid sebagai antioksidan secara langsung adalah dengan mendonorkan ion hidrogen sehingga dapat menetralisir efek toksik dari radikal bebas dan mekanisme flavonoid sebagai antioksidan secara tidak langsung yaitu dengan
meningkatkan ekspresi gen antioksidan endogen melalui aktivasi nuclear factor erythroid 2 related factor 2 (Nrf2) sehingga terjadi peningkatan gen yang
berperan dalam sintesis enzim antioksidan endogen misalnya gen SOD (Sumardika dan I Made Jawi, 2012).
Hampir 80% dari total antioksidan dalam buah dan sayuran berasal dari
flavonoid yang dapat berfungsi sebagai penangkap anion superoksida, lipid peroksida radikal, oksigen singlet, dan pengkelat logam (Kosasih, 2004).
2.4.2.3 Beta karoten
Beta karoten atau disebut provitamin A merupakan salah satu dari karoten yang paling banyak terdapat pada jaringan tanaman. Beta karoten yang masuk ke
dalam mukosa usus kecil akan dipecah oleh enzim beta karoten 15,15’-monooxygenase menjadi retinol (vitamin A). Satu molekul beta karoten akan
A merupakan bentuk yang siap diabsorpsi oleh tubuh. Kemampuan usus untuk menyerap beta karoten berkisar 9-22% bergantung sumber dan bentuk beta
karoten yang akan diserap, ketersediaan lemak sebagai pelarutnya, dan kemampuan usus dari masing-masing individu.
Beta karoten bersifat larut dalam lemak sehingga melindungi sel dari
kerusakan yang disebabkan oleh radikal bebas yang larut dalam lemak. Kemampuannya dalam menjaga integritas sel sangat baik sehingga dapat berperan
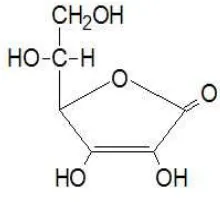
sebagai antioksidan (Lingga, 2012). Rumus bangun betakaroten dapat dilihat pada Gambar 2.4.
Gambar 2.4 Rumus bangun betakaroten (Hanson, 2005).
2.5Metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2- picrylhydrazil)
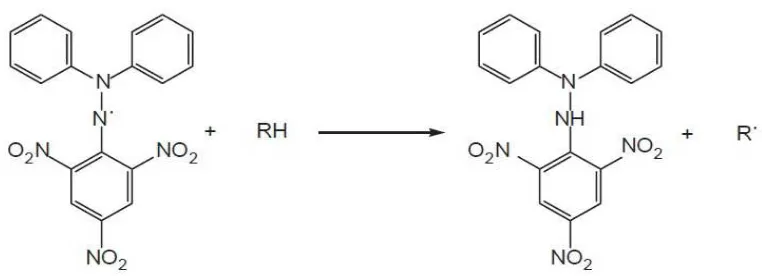
Metode pemerangkapan radikal bebas DPPH diperkenalkan 50 tahun yang lalu
oleh Marsden Blois. Sebagai sampel uji antioksidan, Blois menggunakan asam amino sistein yang mengandung gugus thiol. Ketika larutan DPPH dicampurkan
1,1-diphenyl-2-picrylhydrazil 1,1-diphenyl-2-picrylhydrazine
Gambar 2.5 Reaksi antara DPPH dengan atom H dari senyawa antioksidan (Widyastuti, 2010)
Metode DPPH merupakan metode yang cepat, sederhana, dan tidak mahal untuk mengukur kemampuan dari berbagai senyawa dalam memerangkap radikal
bebas dan untuk mengevaluasi aktivitas antioksidan pada makanan dan minuman (Marinova, 2011).
Parameter yang dipakai untuk menunjukan aktivitas antioksidan adalah harga konsentrasi efisien atau Efficient Concentration (EC50) atau Inhibitory
Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat antioksidan yang memberikan persen penghambatan sebesar 50%. Zat yang
mempunyai aktivitas antioksidan tinggi akan memiliki harga EC50 atau IC50 yang rendah. Metode ini akan memberikan hasil yang baik dengan menggunakan pelarut metanol atau etanol karena kedua pelarut ini tidak mempengaruhi dalam
2.6Metode pembentukan kompleks fosfomolibdenum
Metode ini diperkenalkan oleh Chipault et al. pada tahun 1955 untuk
mengidentifikasi kapasitas antioksidan alami yang larut dalam air dan larut dalam lemak. Metode ini merupakan metode kuantitatif yang didasarkan pada reduksi Mo (VI) menjadi Mo (V) oleh sampel analit diikuti dengan pembentukan
kompleks fosfat / Mo (V) berwarna hijau untuk mengidentifikasi adanya agen pereduksi. Konsentrasi diperoleh secara spektrofotometri dan hasil yang diperoleh
diekspresikan dalam bentuk ekuivalen terhadap asam askorbat atau α-tokoferol.
Metode pembentukan kompleks fosfomolibdenum merupakan metode alternatif untuk evaluasi kapasitas antioksidan total lainnya karena metode ini
sederhana dan pereaksinya murah (Prieto et al., 1999).
2.7 Spektrofotometer UV-Vis
Spektrofotometri adalah pengukuran absorbsi energi cahaya oleh suatu atom atau molekul pada panjang gelombang tertentu. Daerah spektrum ultraviolet biasanya dianggap berkisar dari 200 hingga 400 nm dan daerah sinar tampak dari
400 hingga 750 nm.
Ada beberapa hal yang harus diperhatikan dalam analisis dengan
spektrofotometer ultraviolet dan sinar tampak yaitu:
a.Pembentukan molekul yang dapat menyerap sinar UV-Vis
Cara yang digunakan adalah dengan merubahnya menjadi senyawa lain atau
direaksikan dengan pereaksi tertentu sehingga dapat menyerap sinar UV-Vis. b.Waktu kerja (operating time)
c.Pemilihan panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang
gelombang yang mempunyai absorbansi maksimal. d.Pembuatan kurva kalibrasi
Dilakukan dengan membuat seri larutan baku dalam berbagai konsentrasi
kemudian absorbansi tiap konsentrasi diukur lalu dibuat kurva yang merupakan hubungan antara absorbansi dengan konsentrasi.
e.Pembacaan absorbansi sampel