Lampiran 2. Gambar buah dan serbuk simplisia markisa ungu (Passiflora edulis
Sims)
Buah markisa ungu
Lampiran 2. (Lanjutan)
Lampiran 5. Gambar pengamatan gejala toksik
Uji Katalepsi Uji Panggung
Uji Urinasi Uji Defekasi
Lampiran 7. Hasil analisis statistik berat badan mencit pada minggu ke- 1 dan minggu ke-2
Descriptives
N Mean
Std.
Deviation Std. Error
Berat badan mencit minggu ke 1
Kontrol 5 25.4680 .78145 .34948
Dosis 500 mg/kg BB 5 26.7480 .57360 .25652
Dosis 1000 mg/kg BB 5 26.4580 1.29504 .57916
Dosis 2000 mg/kgBB 5 25.9580 .81729 .36551
Dosis 5000 mg/kg BB 5 26.3520 1.01300 .45303
Total 25 26.1968 .96102 .19220
Berat badan mencit minggu ke 2
Kontrol 5 28.0220 2.06445 .92325
Dosis 500 mg/kg BB 5 28.0940 2.79339 1.24924
Dosis 1000 mg/kg BB 5 28.6500 2.53499 1.13368
Dosis 2000 mg/kgBB 5 26.8120 1.86350 .83338
Dosis 5000 mg/kg BB 5 27.0300 3.60624 1.61276
Lampiran 7. (Lanjutan)
Multiple Comparisons
Tukey HSD
Dependent Variable
(I)
kelompok (J) kelompok
Mean Difference
(I-J) Std. Error Sig.
Berat badan mencit minggu ke-1
Kontrol Dosis 500 mg/kg BB -1.28000 .58726 .227
Dosis 1000 mg/kg BB -.99000 .58726 .464
Dosis 2000 mg/kgBB -.49000 .58726 .917
Dosis 5000 mg/kg BB -.88400 .58726 .571
Berat badan mencit minggu ke-2
Kontrol Dosis 500 mg/kg BB -.07200 1.67257 1.000
Dosis 1000 mg/kg BB -.62800 1.67257 .995
Dosis 2000 mg/kgBB 1.21000 1.67257 .949
Dosis 5000 mg/kg BB .99200 1.67257 .975
Lampiran 8. Hasil analisis statistik konsumsi minuman mencit pada minggu ke-1 dan minggu ke-2
Descriptives
N Mean
Std.
Deviation Std. Error
Jumlah konsumsi minuman minggu ke-1
Kontrol 7 30.1429 4.33699 1.63923
Dosis 500 mg/kg BB 7 30.5714 5.96817 2.25576
Dosis 1000 mg/kg BB 7 29.8571 7.08116 2.67643
Dosis 2000 mg/kg BB 7 30.5714 4.27618 1.61624
Dosis 5000 mg/kg BB 7 27.0000 5.06623 1.91485
Total 35 29.6286 5.29753 .89545
Jumlah konsumsi minuman minggu ke-2
Kontrol 7 30.2857 4.42396 1.67210
Dosis 500 mg/kg BB 7 29.5714 10.42205 3.93916
Dosis 1000 mg/kg BB 7 34.1429 2.34013 .88448
Dosis 2000 mg/kg BB 7 30.7143 5.49892 2.07840
Dosis 5000 mg/kg BB 7 28.2857 5.21901 1.97260
Lampiran 8. (Lanjutan)
Multiple Comparisons
Tukey HSD
Dependent Variable
(I)
kelompok (J) kelompok
Mean
Difference (I-J) Std. Error Sig.
Jumlah konsumsi minuman minggu ke-1
Kontrol Dosis 500 mg/kg BB -.42857 2.91326 1.000
Dosis 1000 mg/kg BB .28571 2.91326 1.000
Dosis 2000 mg/kg BB -.42857 2.91326 1.000
Dosis 5000 mg/kg BB 3.14286 2.91326 .816
Jumlah konsumsi minuman minggu ke-2
Kontrol Dosis 500 mg/kg BB .71429 3.30491 .999
Dosis 1000 mg/kg BB -3.85714 3.30491 .770
Dosis 2000 mg/kg BB -.42857 3.30491 1.000
Lampiran 9. Hasil statistik konsumsi makanan mencit pada minggu ke-1 dan minggu ke-2
Descriptives
N Mean Std. Deviation Std. Error
Jumlah konsumsi makanan pada minggu ke-1
Kontrol 7 20.3286 1.56882 .59296
Dosis 500 mg/ kg BB 7 19.2086 1.00917 .38143
Dosis 1000 mg/ kg BB 7 19.9343 3.44039 1.30035
Dosis 2000 mg/ kg BB 7 18.9343 1.85726 .70198
Dosis 5000 mg/ kg BB 7 19.7514 1.31668 .49766
Total 35 19.6314 1.96882 .33279
Jumlah konsumsi makanan pada minggu ke-2
Kontrol 7 19.1014 2.79902 1.05793
Dosis 500 mg/ kg BB 7 18.4000 2.55167 .96444
Dosis 1000 mg/ kg BB 7 22.3629 2.07931 .78590
Dosis 2000 mg/ kg BB 7 18.7286 1.80149 .68090
Dosis 5000 mg/ kg BB 7 19.4600 1.78484 .67461
Lampiran 9. ( Lanjutan )
Multiple Comparisons
Tukey HSD
Dependent Variable (I)
kelompok (J) kelompok
Mean
Difference (I-J) Std. Error Sig.
Jumlah konsumsi makanan pada minggu ke-1
Kontrol Dosis 500 mg/ kg BB 1.12000 1.08230 .837
Dosis 1000 mg/ kg BB .39429 1.08230 .996
Dosis 2000 mg/ kg BB 1.39429 1.08230 .700
Dosis 5000 mg/ kg BB .57714 1.08230 .983
Jumlah konsumsi makanan pada minggu ke-2
Kontrol Dosis 500 mg/ kg BB .70143 1.19762 .976
Dosis 1000 mg/ kg BB -3.26143 1.19762 .074
Dosis 2000 mg/ kg BB .37286 1.19762 .998
Dosis 5000 mg/ kg BB -.35857 1.19762 .998
Lampiran 10. (Lanjutan)
Tukey HSD
Dependent
Variable (I) kelompok (J) kelompok
Lampiran 11. Perhitungan volume pemberian EEKBMU dosis 500, 1000, 2000 dan 5000 mg/kg bb
- Dosis suspensi EEKBMU yang akan dibuat adalah 500 mg/kg bb, 1000 mg/kg bb, 2000 mg/kg bb dan 5000 mg/kg bb.
Artinya dosis 500 mg, 1000 mg, 2000 mg dan 5000 mg itu diberikan untuk
hewan dengan berat badan 1 Kg. Karena = x 1 kg = = x 1000 g =
10 ml. Maka tiap dosis dilarutkan dalam 10,0 ml suspensi Na-CMC
- CMC 0,5 % → 5 mg/ml
(Diberikan pada mencit adalah 0,2 ml, dasarnya adalah jumlah Ekstrak yang diberikan pada mencit).
CMC = , x 5 mg = 1 mg/mencit 20 g.
- Cara pembuatan suspensi ekstrak EEKBMU:
500 mg/kg bb = g
g x 500 mg = 10 mg/mencit 20 g
1000 mg/kg bb = g
g x 1000 mg = 20 mg/mencit 20 g
2000 mg/kg bb = g
g x 2000 mg = 40 mg/mencit 20 g
5000 mg/kg bb = g
- Volume suspensi EEKBMU yang diberikan pada mencit Berat mencit : 20 g.
Dosis 500 mg/kg bb = x 1 ml = 0,2 ml
Dosis 1000 mg/kg bb = x 1 ml = 0,2 ml
Dosis 2000 mg/kg bb = x 1 ml = 0,2 ml
DAFTAR PUSTAKA
Akanbi, B.O., Bodunrin, O.D., Olayanju, S.(2011). Phytochemical Screening and Antibacterial Activity Of Passiflora edulis.Hygeia Journal for drugs and medicines. 3(1):46-49.
BPOM RI. (2011). Pedoman Uji Toksisitas Nonklinik Secara In Vivo. Jakarta: Pusat Riset Obat dan Makanan BPOM RI. Halaman 25 – 29.
Delman, H.D dan Brown, E.M. (1992). Buku Teks Histologi veteriner II. Cetakan pertama Edisi ke-3. Jakarta: Penerbit Universitas Indonesia. Hal. 392 – 404.
Depkes RI. (1999). Inventaris Tumbuhan Obat Indonesia. Jilid V. Jakarta: Departemen Kesehatan Republik Indonesia . Halaman 141.
Gupta, D., dan Bhardwaj, S. (2012). Study of Acute, Subacute and Chronic Toxicity Test. International Journal of Advanced Research in Pharmaceutical and Bio Science (IJARPB). 1(2): 103 – 129.
Hermanto, C., Indriani, N.L., Hadiati, S. (2013). Keragaman dan Kekayaan Buah Tropika Nusantara. Jakarta: IAARD Press. Halaman 88-89.
Hodgson, E., dan Levi, P.E. (2004) A textbook of Modern Toxicology. New York: McGraw-Hill Companies Inc. Hal. 292, 298, 301.
Lu, F.C. (1994). Toksikologi Dasar: Asas, Organ Sasaran, dan Penilaian Resiko. Edisi II. Jakarta: UIP. Halaman 47 – 48, 74, 93 – 97, 206 – 211.
Lu, F.C. (1995). Toksikologi Dasar: Asas, Organ Sasaran, dan Penilaian Resiko. Edisi II. Jakarta: UIP. Halaman 46, 92, 206 – 220.
Manggung, R.E. (2008). Pengujian Toksisitas Akut Lethal Dose 50 (LD50) Ekstrak Etanol Belimbing wuluh (Avverhoa bilimbiL) Pada Mencit (Mus Musculus). Skripsi. Bogor : Fakultas Kedokteran Hewan Institut Pertanian.
Monalisa. (2015). Pemanfaatan Ekstrak Etanol Kulit Buah Markisa Ungu (Passiflora edulis Sims) Menjadi Pewarna Lipstik. Skripsi. Medan : Universitas Sumatera Utara.
Nugraha, S.E. (2015). Uji Aktivitas Antibakteri Ekstrak Etanol Dan Fraksi-Fraksi kulit Buah Markisa Ungu (Passiflora edulis Sims) Terhadap Bakteri
Staphylococcus aureus dan Escherychia coli. Skripsi. Medan : Universitas Sumatera Utara.
OECD. (2008). Organization for Economic Cooperation and Development Guidelines for The Testing of Chemicals TG 407. 132(1): 4 – 13.
Price, S.A., dan Wilson, L.M. (1997). Patofisiologi Konsep Klinis Proses-proses Penyakit. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 426 – 433. Priyanto. (2009). Toksikologi Mekanisme, Terapi Antidotum dan Penilaian
Resiko. Jakarta: Lembaga Studi dan Konsultasi Farmakologi Indonesia (LESKONFI). Halaman 1 – 28, 87 – 132.
Pudjiastuti., dan Yun, S. A. (2009). Uji Gelagat dan Uji Analgesik Ekstrak Etanol Daun Kembang Sungsang (Gloriosa superba L) Pada hewan Coba.
Puslitbag Biomedis dan Farmasi. I(02).
Retnomurti, H.R. (2008). Pengujian Toksisitas Akut Ekstrak Buah Merah
(Pandamous conoideum L) Secara In Vivo. Skripsi. Bogor : Fakultas Teknologi Pertanian Institut Pertanian Bogor. Hal. 30-31.
Rukmana, R.( 2003). Usaha Tani Markisa. Yogyakarta: Kanisius.
Santoso, H,B., dan Nurliani, A. (2006). Efek Doksisiklin Selama Masa Organogenesis pada Struktur Histologi Organ Hati dan Ginjal Feteus Mencit. Bioscience. 3(1): 15 – 27.
Syaifudin. (2006). Anatomi Fisiologi untuk Mahasiswa Keperawatan Edisi Ketiga. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 122.
Underwood, J.C.E., (1997). Patologi Umum dan Sistemik. Volume 2. Edisi 2. Jakarta: Kedokteran EGC.
Utomo, A.W. (2008). Uji Toksisitas Akut Ekstrak Alkohol Daun Jati Belanda (Guazuma ulmifolia Lamk) Pada Tikus Wistar. Skripsi. Semarang : Fakultas Kedokteran Universitas Diponegoro.
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode eksperimental dengan tahapan penelitian yaitu pengujian efek toksisitas akut secara oral terhadap mencit jantan, pengamatan gejala toksik, berat badan, berat organ relatif hati, jantung, ginjal kiri dan ginjal kanan, kematian mencit, pemeriksaan makropatologi organ hati dan histopatologi organ hati mencit. Data hasil penelitian dianalisis secara statistik dengan metode One Way Analisis of Variance ( ANOVA ) dilanjutkan dengan uji Post Hock Tuckey menggunakan SPSS ( Statistical Product and Service Solution ).
3.1. Alat dan Bahan
3.1.1 Alat–alat
Alat–alat yang digunakan pada penelitian ini adalah alat-alat gelas, neraca analitik, mortir dan stamfer, pipet tetes, oral sonde, seperangkat alat bedah, waterbath, neraca hewan, spuit 1 ml, kertas saring dan mikroskop cahaya. Alat untuk pembuatan preparat histopatologi adalah mikrotom, vakum, inkubator, cetakan, kaca objek dan kaca penutup.
3.1.2 Bahan-bahan
histopatologi adalah larutan hematoxylin, larutan eosin, etanol 70%, etanol 80%, etanol 96%, etanol absolut, xylol, paraffin cair, cairan perekat (DPX).
3.2 Hewan Penelitian
Hewan percobaan yang digunakan dalam penelitian ini adalah mencit (Mus Musculus) jantan yang sehat sebanyak 25 ekor dengan bobot 20 – 30 g. Mencit diaklimatisasi terlebih dahulu selama 7 – 14 hari. Hewan diletakkan di dalam kandang, diberi makan pelet ikan dan minum air suling.
3.3 Tahap Penelitian
3.3.1 Penyiapan ekstrak etanol kulit buah markisa ungu (EEKBMU)
Ekstrak etanol kulit buah markisa ungu (EEKBMU) diperoleh dari penelitian sebelumnya yang berjudul Uji Aktivitas Antibakteri Ekstrak Etanol dan Fraksi-Fraksi Kulit Buah Markisa Ungu (Passiflora edulis Sims) Terhadap Bakteri Staphylococcus aureus dan Escherychia coli (Nugraha, 2015).
3.3.2 Pembuatan suspensi Na-CMC 0,5 % b/v
Sebanyak 0,5 g Na-CMC dimasukkan kedalam lumpang yang telah berisi air panas sebanyak 1 ml, dibiarkan selama 15 menit sehingga mengembang, digerus hingga diperoleh massa yang transparan, lalu diencerkan dengan aquades, dimasukkan kedalam wadah, cukupkan dengan aquades hingga 100 ml.
3.3.3 Pembuatan suspensi ekstrak etanol kulit buah markisa ungu (EEKBMU)
kedalam lumpang dan ditambahkan suspensi Na-CMC 0,5 % b/v sedikit demi sedikit sambil digerus sampai homogen hingga 10 ml.
3.3.4 Penyiapan dan pengelompokan hewan uji
Hewan uji yang digunakan yaitu mencit (Mus Musculus) jantan yang sehat sebanyak 25 ekor dengan bobot 20 – 30 g. Mencit dibagi ke dalam 5 kelompok, tiap kelompok terdiri dari 5 ekor mencit. Kelompok 1 sebagai kontrol, kelompok 2 – 5 sebagai kelompok perlakuan. (perhitungan volume pemberian dapat dilihat pada lampiran 11, hal. 54).
Pembagian kelompok sebagai berikut :
Kelompok 1 (K) : Kontrol, diberi larutan suspensi Na-CMC 0,5% b/v
Kelompok 2 (P1) : Perlakuan, diberikan EEKBMU dengan dosis 500 mg/kg bb Kelompok 3 (P2) : Perlakuan, diberikan EEKBMU dengan dosis 1000 mg/kg bb Kelompok 4 (P3) : Perlakuan, diberikan EEKBMU dengan dosis 2000 mg/kg bb Kelompok 5 (P4) : Perlakuan, diberikan EEKBMU dengan dosis 5000 mg/kg bb
3.3.5 Pemberian sediaan uji dan pengamatan gejala toksik
dalam kelompok yang sama, dilanjutkan dengan kelompok yang lain. Mencit diamati dan ditentukan LD50nya untuk menentukan tingkat toksisitas dengan melihat jumlah mencit yang mati.
Adapun cara pengujian untuk mengamati efek gejala toksik, yaitu : a. Uji panggung
Mencit yang telah diberi EEKBMU diletakkan diatas meja alas bundar dengan diameter 30 – 40 cm dan tinggi 40 – 45 cm. Pada uji ini yang diamati adalah aktivitas mencit secara umum dan aktivitas motorik (BPOM RI, 2011). b. Uji katalepsi
Mencit yang telah diberi EEKBMU diletakkan diatas pensil yang digerakkan dari atas kebawah 2 – 3 cm diatas permukaan meja. Dicatat mudah tidaknya kaki depan mencit jatuh kembali keatas meja (BPOM RI, 2011).
c. Uji urinasi
Pengeluaran urin mencit yang telah diberi EEKBMU dibandingkan dengan kontrol, menggunakan kertas saring (BPOM RI, 2011).
d. Uji defekasi
Pengeluaran tinja mencit yang telah diberi EEKBMU dibandingkan dengan kontrol, menggunakan kertas saring (BPOM RI, 2011).
e. Uji salivasi
3.3.6 Pengamatan berat badan
Mencit ditimbang setiap hari selama 14 hari untuk melihat adanya pengaruh EEKBMU terhadap berat badan mencit. Perubahan berat badan mencit dianalisis seminggu sekali. Pada akhir penelitian, hewan yang masih bertahan hidup ditimbang dan kemudian dikorbankan secara dislokasi leher.
3.3.7 Pengamatan Konsumsi Makanan dan Minuman
Jumlah makanan mencit ditimbang setiap hari sebanyak 30 g, sisa makanan juga ditimbang untuk menghitung jumlah makanan yang dikonsumsi mencit setiap harinya. Jumlah minuman yang diberikan setiap hari diukur menggunakan gelas ukur sebanyak 100 ml, sisa minuman juga diukur untuk mengetahui jumlah minuman yang dikonsumsi mencit. Pengamatan dilakukan setiap hari secara berkala selama 14 hari.
3.3.8 Pengamatan kematian hewan
Mencit diamati kematiannya dari hari pertama sampai hari terakhir. Mencit yang mati setelah pemberian suspensi sediaan uji sesegera mungkin di bedah pada bagian perut secara melintang dan diambil organ hati, jantung dan ginjal. Hewan uji yang masih hidup sampai hari terakhir, dikorbankan secara fisik dengan dislokasi leher, selanjutnya dibedah, ditimbang dan diambil organnya.
3.3.9 Penimbangan organ hati, jantung, dan ginjal
3.3.10 Makropatologi organ hati
Organ hati diamati secara visual yaitu mengamati warna, bentuk permukaan dan konsistensi organ. Perubahan warna menjadi salah satu parameter terjadinya efek toksik yang bertujuan mendapatkan informasi mengenai toksisitas zat uji yang berkaitan dengan organ sasaran dan efek terhadap organ tersebut (Lu,1994). Warna merah kecoklatan dikarenakan adanya darah yang amat banyak (Junqueira dan Carneiro, 2003).
3.3.11 Histopatologi organ hati
Organ hati dicuci dengan natrium klorida, ditimbang dan dimasukkan ke dalam pot berisi formalin 10 %. Organ hati dikirim kebagian histopatologi kedokteran untuk pembuatan preparat histopatologinya ( pembuatan preparat histopatologi dilakukan di Laboratorium Patologi Anatomi Fakultas Kedokteran USU ). Dilakukan pengamatan dengan menggunakan mikroskop untuk melihat adanya perubahan atau kerusakan struktur histologi hati.
3.3.12 Analisis Data
Pengamatan berat badan, konsumsi makanan dan minuman, serta berat organ relatif dianalisis dengan menggunakan One way analysis of variance
BAB IV
HASIL DAN PEMBAHASAN
Pengujian efek toksik ekstrak etanol kulit buah markisa ungu (Passiflora edulis Sims), dilakukan terhadap mencit jantan. Pada penelitian ini, dosis ekstrak etanol kulit buah markisa ungu yang digunakan: 500, 1000, 2000 dan 5000 mg/kg bb. Pengamatan dilakukan selama 14 hari meliputi pengamatan gejala toksik, berat badan, konsumsi makanan dan minuman, kematian hewan, berat organ relatif, serta pemeriksaan makropatologi dan histopatologi organ hati mencit.
4.1 Hasil Pengamatan Gejala Toksik
Pengamatan terhadap pengujian efek toksik dilakukan pada setiap kelompok, efek toksik yang terjadi diamati dibandingkan dengan kontrol. Waktu pengamatan adalah 5 menit, 10 menit, 15 menit, 30 menit, 60 menit, 120 menit, 180 menit dan 240 menit. Total waktu pengamatan adalah 4 jam. Pengamatan efek toksik meliputi uji panggung, uji katalepsi, uji urinasi, uji defekasi dan uji salivasi. Hasil pengujian dapat dilihat pada Tabel 4.1 - Tabel 4.5.
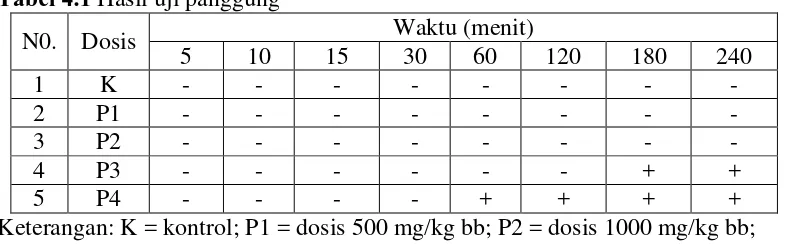
Tabel 4.1 Hasil uji panggung
N0. Dosis Waktu (menit)
5 10 15 30 60 120 180 240
1 K - - - -
2 P1 - - - -
3 P2 - - - -
4 P3 - - - + +
5 P4 - - - - + + + +
Berdasarkan Tabel 4.1 pada uji panggung menunjukkan bahwa mencit setelah pemberian EEKBMU masih dalam keadaan normal, tidak ditemukan gejala toksik pada kelompok kontrol, dosis 500 dan 1000 mg/kg bb, namun pada perlakuan dosis 2000 dan 5000 mg/kg bb ditemukan gejala toksik berupa penurunan aktivitas motorik mencit ditandai dengan abduksi, di mana kaki terbuka karena adanya depresi SSP, ataksia (sempoyongan) dan reaksi refleks yaitu ketidakmampuan mencit membalikkan dirinya apabila diletakkan dengan punggung yang terbalik (Pudjiastuti, 2009).
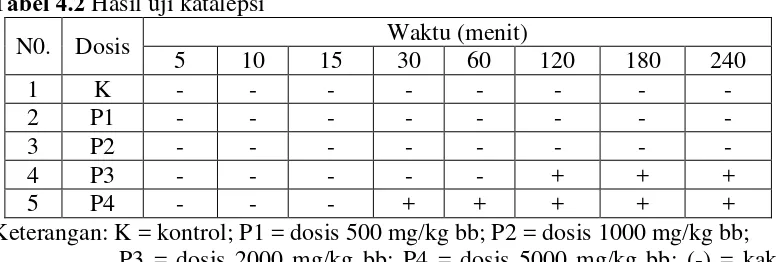
Tabel 4.2 Hasil uji katalepsi
N0. Dosis Waktu (menit) mencit tidak mudah mencapai permukaan meja
Tabel 4.3 Hasil uji urinasi pengeluaran urin; (+) = adanya pengeluaran urin
Berdasarkan Tabel 4.3 pada uji urinasi umumnya menunjukkan bahwa mencit setelah pemberian EEKBMU masih dalam keadaan normal pada kelompok kontrol dan dosis 500 mg/kg bb masih mengeluarkan urin sebagaimana mestinya, namun pada kelompok dosis 1000, 2000 dan 5000 mg/kg bb pengeluaran urin mencit sudah sangat berlebihan. Pengeluaran urin yang berlebihan menunjukkan adanya sifat muskarinik (Pudjiastuti, 2009).
Tabel 4.4 Hasil uji defekasi
N0. Dosis Waktu (menit)
Diare menunjukkan adanya tanda-tanda muskarinik dan merupakan salah satu gejala toksik (Pudjiastuti, 2009; dan Retnomurti, 2008)
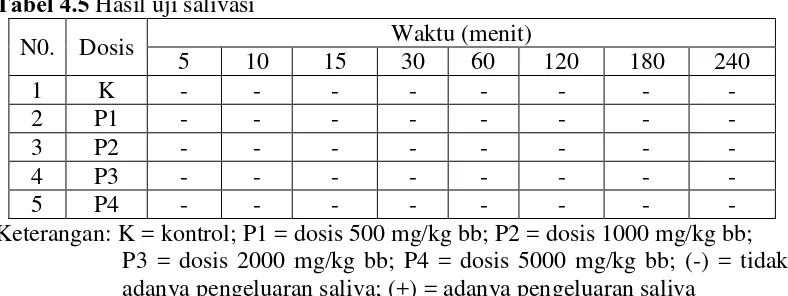
Tabel 4.5 Hasil uji salivasi
N0. Dosis Waktu (menit)
Keterangan: K = kontrol; P1 = dosis 500 mg/kg bb; P2 = dosis 1000 mg/kg bb; P3 = dosis 2000 mg/kg bb; P4 = dosis 5000 mg/kg bb; (-) = tidak adanya pengeluaran saliva; (+) = adanya pengeluaran saliva
Berdasarkan Tabel 4.5 pada uji salivasi yaitu tidak adanya pengeluaran saliva pada mencit pada semua kelompok, menunjukkan bahwa mencit masih dalam keadaan normal. Evaluasi toksisitas akut tidak hanya mengenai LD50 tetapi juga terhadap kelainan tingkah laku, stimulasi dan aktivitas motorik hewan uji untuk mendapatkan gambaran kematian (Retnomurti, 2008). Berdasarkan hasil pengamatan gejala toksik diatas terlihat bahwa mencit setelah pemberian EEKBMU menunjukkan adanya hubungan antara dosis dan efek toksik, semakin besar dosis yang diberikan maka semakin besar pula efek toksik yang timbul (Lu, 1995).
4.2 Hasil Pengamatan Berat Badan
2012). Hasil pengamatan berat badan dapat dilihat pada Tabel 4.6.
Tabel 4.6 Hasil rata-rata berat badan Minggu
Ke -
Rata-rata berat badan mencit (g) ± SD
K P1 P P2 p P3 P P4 P deviasi; p = angka kebermaknaan
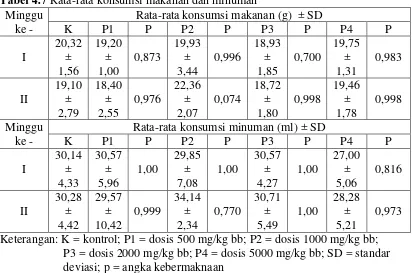
Tabel 4.7 Rata-rata konsumsi makanan dan minuman Minggu
ke -
Rata-rata konsumsi makanan (g) ± SD
K P1 P P2 P P3 P P4 P
Rata-rata konsumsi minuman (ml) ± SD
K P1 P P2 P P3 P P4 P deviasi; p = angka kebermaknaan
konsumsi makanan diukur secara berkala (Gupta et al., 2012)
4.3 Hasil pengamatan Kematian Hewan
Jumlah kematian hewan selama 14 hari dapat dilihat pada Tabel 4.8
Tabel 4.8 Hasil pengamatan kematian mencit
Kelompok Jumlah mencit Jumlah kematian
Kontrol 5 ekor 0
EEKBMU Dosis 500 mg/kg bb 5 ekor 0
EEKBMU Dosis 1000 mg/kg bb 5 ekor 0 EEKBMU Dosis 2000 mg/kg bb 5 ekor 0 EEKBMU Dosis 5000 mg/kg bb 5 ekor 0
Berdasarkan Tabel 4.8, setelah pemberian EEKBMU dosis tunggal diberikan secara oral sampai dengan dosis 5000 mg/kg bb, tidak ada satu pun mencit yang mati dari semua kelompok sehingga LD50 tidak dapat ditentukan. Nilai LD50 bukan suatu tetapan biologi mutlak, melainkan hanya merupakan salah satu petunjuk toksisitas akut. Bila toksisitasnya rendah, LD50 tidak perlu ditentukan secara tepat dan suatu angka perkiraan sudah dapat memberi manfaat (Retnomurti, 2008). Jika dosis maksimal tidak menimbulkan kematian hewan coba, maka LD50 dinyatakan LD50 “semu” yaitu dengan mengambil dosis maksimal, sehingga dalam penelitian ini diketahui LD50 sebagai LD50 semu, yaitu 5000 mg/kg bb (Jenova, 2009).
4.4 Hasil Berat Organ Relatif
Tabel 4.9 Hasil berat organ relatif
Organ Rata-rata berat organ relatif ± SD
K P1 P P2 P P3 P P4 P deviasi; p = angka kebermaknaan
Berdasarkan hasil berat organ relatif mencit pada Tabel 4.9 yang dianalisis secara statistik menunjukkan tidak ada perbedaan yang signifikan berat organ relatif hati, jantung dan ginjal mencit antara kelompok kontrol dan kelompok perlakuan setelah pemberian EEKBMU dengan tingkat signifikan p > 0,05. Dari hasil yang diperoleh dapat dikatakan bahwa pemberian EEKBMU dosis tunggal secara oral tidak berpengaruh terhadap perkembangan berat organ hati, jantung, ginjal kanan dan ginjal kiri mencit.
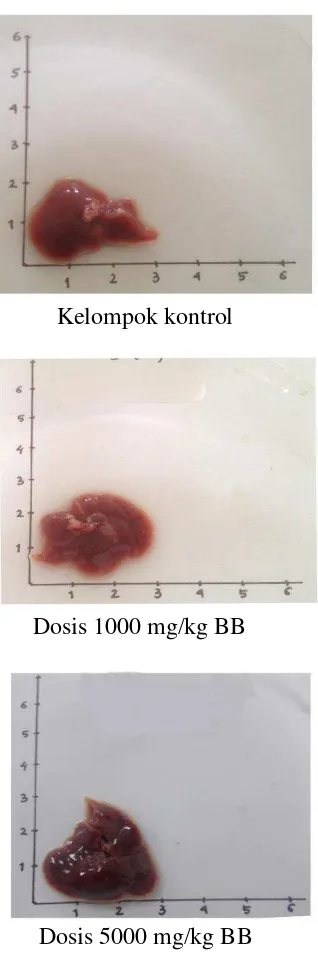
4.5 Hasil Pemeriksaan Makropatologi Organ
Pemeriksaan dilakukan dengan mengamati warna, bentuk permukaan dan konsistensi organ hati.
Kelompok kontrol Dosis 500 mg/kg BB
Dosis 1000 mg/kg BB Dosis 2000 mg/kg BB
Dosis 5000 mg/kg BB
Tabel 4.10 Hasil pemeriksaan makropatologi organ hati mencit
Kelompok Warna Permukaan Konsistensi
K Merah kecoklatan Licin Kenyal
P1 Merah Kecoklatan Licin Kenyal
P2 Merah kecoklatan Licin Kenyal
P3 Pucat Tidak Licin Tidak Kenyal
P4 Pucat Tidak Licin Tidak Kenyal
Keterangan: K = kontrol; P1 = dosis 500 mg/kg bb; P2 = dosis 1000 mg/kg bb; P3 = dosis 2000 mg/kg bb; P4 = dosis 5000 mg/kg bb
Berdasarkan Tabel 4.10 menunjukkan bahwa adanya perubahan warna organ hati pada kelompok dosis 2000 dan 5000 mg/kg bb. Hati terlibat dalam metabolisme makanan serta sebagian besar obat dan toksikan (Retnomurti, 2008). Zat makanan, obat-obatan serta toksisikan yang masuk melalui saluran pencernaan setelah diserap oleh epitel usus akan dibawa oleh vena vorta ke hati, oleh karena itu hati merupakan organ yang sangat potensial menderita keracunan lebih dahulu sebelum organ lain (Santoso, 2006). Perubahan warna menjadi salah satu parameter terjadinya efek toksik yang bertujuan mendapatkan informasi mengenai toksisitas zat uji yang berkaitan dengan organ sasaran dan efek terhadap organ tersebut (Lu,1994).
4.6 Hasil Pemeriksaan Histopatologi Organ Hati
Kontrol EEKBMU dosis 500 mg/ kg bb Keterangan: (1) = vena sentral, (2) = sinusoid, (3)= hepatosit
EEKBMU dosis 1000 mg/ kg bb EEKBMU dosis 2000 mg/ kg bb Keterangan: (1) = vena sentral, (2) = sel nekrosis (kariopiknosis)
Gambar 4.2 Hasil histopatologi hati mencit 1
2
3
1
EEKBMU dosis 5000 mg/ kg bb
Keterangan: (1) = vena sentral, (2) = sinusoid, (3) = sel nekrosis (kariopiknosis)
Gambar 4.2 Hasil histopatologi hati mencit (lanjutan)
Kerusakan hati dapat dilihat melalui pemeriksaan kadar enzim, makropatologi hati dan gambaran histopatologi sel hati. Pada Gambar 4.2, pengamatan histopatologi pada mencit kelompok kontrol yang diberi suspensi Na-CMC 0,5% dan EEKBMU dosis 500 mg/ kg bb tidak terdapat kerusakan pada organ yang dilihat dari vena sentral masih normal, hepatosit utuh, sinusoid tersusun secara radier kearah vena sentral. Pada dosis 1000 mg/kg bb (Gambar 4.2) terjadi kerusakan berupa sel nekrosis yang ditandai dengan inti sel mengecil dan berwarna kehitaman (kariopiknosis). Dosis 1000 mg/kg bb tidak toksik karena sinusoid masih tersusun secara radier ke vena sentral dan tidak mengalami kongesti, serta vena sentral masih dalam keadaan normal. Hal ini dapat dimaklumi karena uji toksisitas akut merupakan suatu pengujian untuk mendeteksi efek toksik yang muncul setelah pemberian sediaan uji yang diberikan secara oral dalam dosis tunggal, atau dosis berulang yang diberikan dalam waktu 24 jam (Badan POM RI, 2011).
1
2
Pada Gambar 4.2 dapat dilihat pada dosis 2000 mg/kg bb terjadi kerusakan pada hati ditandai dengan adanya nekrosis dan terjadinya kongesti pada vena sentral dan sinusoid tidak tersusun secara radier menuju vena sentral. Pada Gambar 4.2 dapat dilihat pada dosis 5000 mg/kg bb terjadi kongesti pada vena sentral dan sinusoid. Kerusakan pada hati ditandai dengan adanya nekrosis dan terjadinya kongesti pada sinusoid dan vena sentral, Kongesti pada vena sentral diakibatkan oleh lisisnya sel endotel sehingga lingkaran tidak utuh dan akhirnya lingkaran menjadi tidak jelas. Kerusakan pada vena sentral berkaitan dengan perannya pada sirkulasi, dimana vena sentralis menerima darah dari sinusoid-sinusoid yaitu 25% dialirkan dari arteri hepatika dan 75% dari vena porta yang mengalirkan darah dari saluran cerna hasil absorbsi usus. Vena sentral banyak menampung nutrient-nutrient dan zat-zat hasil metabolisme yang dapat bersifat toksik maupun nontoksik, banyaknya darah yang ditampung vena sentralis akan menyebabkan konsentrasi zat yang bersifat toksik jauh lebih besar sehingga hal inilah yang memperjelas kerusakan pada vena sentralis (Price, 1997; Underwood, 1997). Nekrosis merupakan kematian sel atau jaringan pada organisme hidup. Inti sel yang mati dapat dilihat lebih kecil dan lebih padat (kariopiknosis), Nekrosis merupakan suatu manifestasi toksik yang berbahaya tetapi tidak selalu kritis karena hati mempunyai kapasitas pertumbuhan kembali yang luar biasa (Lu, 1994).
hilang. Tetapi bila kerusakan itu terjadi berulang-ulang atau terus menerus pada organ ini, maka terbentuk banyak jaringan ikat bersama regenerasi sel hati (Junqueira dan Carneiro, 2003). Hati merupakan organ yang terlibat dalam metabolisme zat makanan dan sebagian besar obat dan toksikan. Zat makanan yang masuk melalui saluran cerna setelah diserap oleh epitel usus akan dibawa oleh vena porta ke hati. Oleh sebab itu, hati menjadi organ yang sangat potensial menderita keracunan lebih dahulu sebelum organ lain (Santoso, 2006).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian yang telah dilakukan, dapat disimpulkan pemberian ekstrak etanol kulit buah markisa ungu (Passiflora edulis Sims) kelompok kontrol, dosis 500 mg/kg bb, 1000 mg/kg bb tidak menunjukkan gejala toksik pada uji panggung, uji katalepsi, uji urinasi, uji defekasi dan uji salivasi, sedangkan pada dosis 2000 mg/kg bb dan 5000 mg/kg bb menunjukkan gejala toksik. Semua kelompok perlakuan tidak berpengaruh pada berat badan mencit, konsumsi makanan dan minuman, serta berat organ relatif. Hasil pemeriksaan histopatologi organ hati mencit menunjukkan bahwa pemberian ekstrak etanol kulit buah markisa ungu pada kelompok kontrol, dosis 500 mg/kg bb dan dosis 1000 mg/kg bb tidak menyebabkan ketoksikan, dosis 1000 mg/kg bb tidak toksik karena sinusoid masih tersusun secara radier ke vena sentral dan tidak mengalami kongesti,serta vena sentral masih dalam keadaan normal. Pada dosis 2000 mg/kg bb dan 5000 mg/kg bb dapat menyebabkan ketoksikan pada organ hati. Dosis maksimal tidak menimbulkan kematian hewan coba, maka LD50 dinyatakan LD50
“semu” yaitu dengan mengambil dosis maksimal, sehingga dalam penelitian ini
diketahui LD50 sebagai LD50 semu, yaitu 5000 mg/kg bb.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Nama Daerah
Tanaman markisa ungu di Indonesia memiliki berbagai macam nama daerah seperti buah monyet (Sunda), markisah (Melayu) dan buwah negri (Jawa) dan areuypasi (Jawa) (Depkes RI, 1999).
2.1.2 Nama Asing
Buah markisa ungu memiliki nama lain seperti purple granadilla (Inggris), marajuca doce (Brazil), ji dan guo (Cina), linmangkon (Thailand), paarse passievrucht (Belanda) dan buah susu (Malaysia).
2.1.3 Habitat
Markisa ungu adalah tanaman yang berasal dari Brazil bagian selatan yaitu dari Paraguay hingga Argentina bagian utara. Di Indonesia, markisa ungu di tanam didaerah dataran tinggi tropis dan didaerah subtropis pada ketinggian 700 sampai 2000 m di atas permukaan laut dengan suhu 18 sampai 25oC. Daerah penghasil markisa ungu masih terpusat di beberapa kabupaten di provinsi Sumatera Utara (Kabupaten Karo, Simalungun, Dairi, Tapanuli Utara) dan provinsi Sulawesi Selatan (Kabupaten Gowa, Sinjai, Tator, Enrekang Dan Polmas) (Karsinah, dkk., 2010).
2.1.4 Sistematika tumbuhan
Kindom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae Bangsa : Malpighiales Suku : Passifloraceae Marga : Passiflora
Jenis : Passiflora edulis Sims.
2.1.5 Morfologi tanaman
Tanaman markisa merupakan tumbuhan semak yang hidup menahun dan bersifat merambat hingga sepanjang 20 m atau lebih. Batang tanaman sedikit berkayu, bersulur dan memiliki bayak percabangan yang terkadang tumbuh tumpang tindih. Pada tanaman muda, cabang berwarna hijau dan setelah tua menjadi hijau kecoklatan. Daun tanaman sangat rimbun tumbuh secara bergantian pada batang atau cabang. Bentuk daun menjari, bergerigi, berwarna hijau, mengkilap dengan panjang tangkai 2 - 3 cm, panjang daun 9 - 12 cm dan lebar 7 - 9 cm (Rukmana, 2003).
buah tipis, liat dan tahan benturan pada saat pengangkutan. Bagian dalam buah diliputi oleh lapisan berwarna putih (endocarp) yang mengandung banyak petkin. Buah memiliki banyak biji berwarna hitam dan dibungkus oleh selaput berisi sari buah (juice) yang masam manis dan beraroma harum semerbak (Hermanto, dkk., 2013).
2.1.6 Kandungan kimia
Markisa ungu mengandung berbagai macam senyawa metabolit sekunder. Daun markisa ungu mengandung tanin, glikosida, flavonoid, saponin dan alkaloid. Batang tanaman markisa ungu mengandung glikosida, flavonoid, saponin dan alkaloid. Buah markisa ungu mengandung tanin, glikosida, flavonoid dan alkaloid (Akanbi, dkk., 2011).
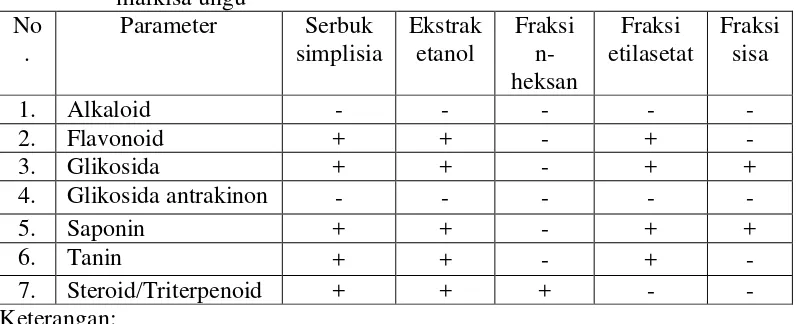
2.1.7 Hasil skrining fitokimia kulit buah markisa ungu
Hasil skrining fitokimia serbuk simplisia, ekstrak etanol, fraksi n-heksan fraksi etilasetat dan fraksi sisa kulit buah markisa ungu dapat dilihat pada Tabel 2.1 di bawah ini
Hasil skrining fitokimia kulit buah markisa ungu berupa serbuk simplisia dan ekstrak etanol menunjukkan hasil postitif pada senyawa yaitu flavonoid, glikosida, saponin, tanin dan triterpenoid. Fraksi n-heksan hanya menunjukkan hasil positif terhadap senyawa non polar yaitu triterpenoid. Pada fraksi etilasetat mengandung senyawa seperti flavonoid, glikosida, saponin dan tanin, sedangkan pada fraksi sisa tersisa senyawa glikosida dan saponin (Nugraha, 2015)
2.1.8 Manfaat markisa ungu
Markisa banyak mengandung vitamin B dan potassium. Markisa berkhasiat menyembuhkan gejala alergi kronis, memulihkan penyakit liver dan ginjal, meningkatkan kekebalan tubuh dan kekuatan antibodi dalam darah. Markisa juga mampu menyaring, memisahkan dan membuang racun dari dalam tubuh. Markisa juga dapat meningkatkan kesegaran kulit tubuh dan merangsang pertumbuhan sel muda pada kulit wajah. Markisa mengandung vitamin C dosis tinggi dan antioksidan (Hermanto, dkk., 2013).
2.2 Toksisitas
Obat sebelum dipasarkan atau digunakan harus menjalani serangkaian uji untuk memastikan efektivitas dan keamanannya (Priyanto, 2009). Umumnya uji toksisitas terdiri atas dua jenis, yaitu toksisitas umum (akut, subkronik dan kronik) dan toksisitas khusus (teratogenik, mutagenik dan karsinogenik) (Priyanto, 2009; Lu, 1994).
2.2.1Toksisitas umum
2.2.1.1Toksisitas akut
Uji toksisitas akut merupakan uji deteksi efek toksik yang muncul dalam waktu singkat setelah pemberian sediaan uji yang diberikan secara oral dalam dosis tunggal, atau dosis berulang yang diberikan dalam waktu 24 jam. Prinsip uji toksisitas akut oral yaitu sediaan uji dalam beberapa tingkat dosis yang diberikan pada beberapa kelompok hewan uji kemudian dilakukan pengamatan terhadap adanya efek toksik dan kematian sebagai parameter akhir (BPOM RI, 2011).
Tujuan toksisitas akut adalah untuk mendeteksi toksisitas dari suatu zat, untuk memperoleh informasi awal yang dapat digunakan untuk merancang uji toksisitas selanjutnya serta untuk menentukan LD50 (potensi ketoksikan) akut dari suatu senyawa (Priyanto, 2009; BPOM RI, 2011).
LD50 didefinisikan sebagai “ suatu dosis yang diberikan pada hewan uji diharapkan akan menyebabkan kematian pada 50% hewan percobaan ”. Pengujian
dari populasi di bawah kondisi yang ditentukan dari tes (Hudgson dan Levi, 2004). Nilai LD50 sangat berguna untuk hal-hal sebagai berikut:
a. Menentukan klasifikasi lazim zat kimia sesuai dengan toksisitas relatifnya, artinya penggolongan toksik suatu zat berdasarkan dosis yang menghasilkan LD50, dapat dilihat pada Tabel 2.2.
Tabel 2.2 Kategori penggolongan sediaan uji
Kategori LD50
Supertoksik 5 mg/kg atau kurang
Amat sangat toksik 5-50 mg/kg
Sangat toksik 50-500 mg/kg
Toksik sedang 0,5-5 g/kg
Toksik ringan 5-15 g/kg
Praktis tidak toksik >15 g/kg
supertoksik: (5 mg/kg bb atau kurang), contoh: Nikotin
amat sangat toksik : (5-50 mg/kg bb), contoh: timbal arsenat
sangat toksik : (50-500 mg/kg bb), contoh: hidrokinon
toksik sedang: (0.5-5 g/kg bb), contoh: isopropanol
toksik ringan : (5-15 g/kg bb), contoh: asam ascorbat
praktis tidak toksik : (>15 g/kg bb), contoh: propilen glikol
b. Evaluasi dampak keracunan yang tidak sengaja; perencanaan penelitian toksisitas subkronik dan kronik pada hewan, memberikan informasi tentang mekanisme toksisitas, pengaruh umur, seks, faktor lingkungan dan variasi respons antar spesies dan antar strain hewan, memberikan informasi tentang reaktivitas suatu populasi hewan (Lu, 1994).
2.2.1.2 Toksisitas subkronik
diberikan secara oral pada hewan uji, biasanya setiap hari atau lima hari dalam seminggu selama 28 hari (BPOM RI, 2011). Tujuan toksisitas subkronik oral adalah untuk memperoleh informasi adanya efek toksik zat yang tidak terdeteksi pada uji toksisitas akut, informasi kemungkinan adanya efek toksik setelah pemaparan sediaan uji secara berulang dalam jangka waktu tertentu (OECD, 2008) untuk memberikan informasi dosis yang tidak menimbulkan efek toksik dan mempelajari adanya efek reversibilitas zat tersebut (BPOM RI, 2011).
Prinsip uji toksisitas subkronik oral adalah sediaan uji dalam beberapa tingkat dosis diberikan setiap hari pada beberapa kelompok hewan uji dengan satu dosis per kelompok selama 28 atau 90 hari (OECD, 2008), bila diperlukan ditambahkan kelompok satelit untuk melihat adanya efek yang bersifat reversibel (BPOM RI, 2011). Studi subkronik dapat dilakukan pada tikus dan mencit dengan rute pemberian yang lazim yaitu oral. Sekurang-kurangnya digunakan tiga kelompok dosis yang berbeda, 1 kelompok kontrol dan 2 kelompok satelit (kelompok dosis tinggi dan kelompok kontrol). Dosis sediaan uji yang paling tinggi harus menimbulkan efek toksik tetapi tidak menimbulkan kematian atau gejala toksik yang berat, dosis menengah menimbulkan gejala toksik yang lebih ringan sedangkan dosis yang paling rendah tidak menimbulkan gejala toksik (BPOM RI, 2011).
konsumsi makanan yang nyata berkurang dapat menimbulkan efek yang mirip manifestasi toksik suatu zat (BPOM RI, 2011). Uji laboratorium klinik biasanya mencakup pemeriksaan hematologi, biokimia klinis dan histopatologi. Disamping itu, berat relatif organ harus diukur karena merupakan indikator yang
berguna bagi toksisitas (Lu, 1994).
2.2.1.3 Toksisitas kronik
Uji toksisitas kronis dilakukan dengan memberikan senyawa uji berulang-ulang selama masa hidup hewan uji atau sebagian besar masa hidupnya (Priyanto, 2009). Prinsip toksisitas kronik oral pada umumnya sama dengan uji toksisitas subkronik, hanya pada toksisitas kronik sediaan uji yang diberikan lebih lama yaitu tidak kurang dari 12 bulan (BPOM RI, 2011).
2.3.1Toksisitas khusus
2.3.1.1Uji teratogenik
Uji teratogenik merupakan suatu pengujian untuk memperoleh informasi adanya abnormalitas fetus yang terjadi karena pemberian suatu zat dalam masa perkembangan embrio (Priyanto, 2009). Prinsip pengujian ini senyawa uji dalam beberapa tingkat dosis diberikan kepada beberapa kelompok hewan hamil selama paling sedikit masa organogenesis dari kehamilan, satu dosis untuk satu kelompok. Sesaat sebelum waktu melahirkan, uterus diambil dan dilakukan evaluasi terhadap fetus (OECD, 2008).
2.3.1.2Uji mutagenik
mutagenik merupakan efek yang menyebabkan terjadinya perubahan pada sifat genetika sel tubuh makhluk hidup (Loomis, 1978).
2.3.1.3Uji karsinogenik
Uji karsinogenik merupakan uji yang dilakukan untuk memperoleh informasi mengenai efek korsinogenik suatu senyawa pada hewan percobaan (Lu, 1994) dan untuk mengetahui apakah zat jika dipakai dalam jangka panjang akan dapat menimbulkan kanker (Priyanto, 2009).
2.4Anatomi hati
Hati adalah organ terbesar di tubuh dengan berat 1,5 kg, organ ini terletak dalam rongga perut di bawah diafragma. Hati merupakan organ tempat pengolahan dan penyimpanan nutrient yang diserap dari usus halus untuk dipakai oleh bagian tubuh lainnya. Seluruh materi yang diserap melalui usus tiba di hati melalui vena porta. Pada bagian bawah permukaan hati terdapat pembuluh darah masuk (vena porta dan arteri hepatika), duktus hepatikus kiri dan kanan yang keluar dari organ ini di daerah yang disebut portal hepatis (Junqueira dan Carneiro, 2003). Hati terdiri dari dua lobus utama, yakni lobus kanan dan kiri yang masing-masing terdiri dari dua segmen. Lobus kanan dibagi menjadi segmen anterior dan posterior. Lobus kiri dibagi menjadi segmen medial dan lateral. Fungsi hati adalah sebagai berikut:
a. mengubah zat makanan yang diabsorpsi dan yang di simpan di suatu tempat dalam tubuh, dikeluarkan sesuai dengan pemakaiannya dalam jaringan.
c. menghasilkan enzim glikogenik glukosa menjadi glikogen.
d. sekresi empedu, garam empedu di buat di hati, dibentuk dalam system retikuloendotelium, dialirkan ke empedu.
e. pembentukan ureum, hati menerima asam amino diubah menjadi ureum dikeluarkan dari darah oleh ginjal dalam bentuk urin.
f. menyiapkan lemak untuk pemecahan terakhir asam karbonat dan air (Syaifuddin, 2006).
2.5 Gambaran histopatologi hati
Komponen struktur utama dari hati adalah sel hati atau hepatosit. Hepatosit tersusun berupa lempeng-lempeng yang saling berhubungan dan bercabang membentuk anyaman tiga dimensi (Junqueira dan Carneiro, 2003).
menerima darah dari sinusoid-sinusoid yaitu 25% dari arteri hepatika dan 75% dari vena porta (Underwood, 1997).
Sinusoid merupakan pembuluh darah kapiler yang mengisi lobulus, yang membawa darah dari arteri dan vena interlobularis masuk ke sinusoid dan menuju vena sentralis. Susunan percabangan ini menjamin hepatosit memiliki permukaan yang berhadapan dengan sinusoid yang hanya dibatasi oleh ruang perisinusoid
yaitu ruang sempit diantara sinusoid dan sel-sel hati. Ruang demikian tidak tampak dalam biopsy hati manusia atau hati hewan uji (Delman dan Brown, 1992; Junqueira dan Carneiro, 2003). Gambar skematis struktur hati dapat dilihat pada Gambar 2.1.
BAB I
PENDAHULUAN
1.1Latar Belakang
Masyarakat Indonesia sejak zaman dahulu telah mengenal, meramu dan menggunakan tanaman yang berkhasiat sebagai salah satu upaya dalam penanggulangan masalah kesehatan (Manggung, 2008). Penggunaan obat tradisional dalam upaya mempertahankan kesehatan masyarakat telah lama kita ketahui, bahkan sampai saat ini menurut perkiraan badan kesehatan dunia (WHO,
2013), 80% penduduk dunia masih tergantung kepada pengobatan tradisional. Menurut Undang-Undang No. 23 Tahun 1992, obat tradisional adalah bahan atau
ramuan bahan berupa bahan tumbuhan, bahan hewan, bahan mineral, sediaan sarian atau galenik, atau campuran dari bahan-bahan tersebut yang secara turun
temurun telah digunakan untuk pengobatan berdasarkan pengalaman ( Iwuanyanwu, et al., 2012).
Salah satu tumbuhan yang buahnya banyak dikonsumsi oleh masyarakat dan mempunyai banyak manfaat adalah buah markisa ungu. Markisa ungu yang memiliki nama latin Passiflora edulis Sims berasal dari suku passifloraceae, merupakan tumbuhan yang berasal dari Brazil bagian selatan yaitu Paraguai hingga Argentina bagian utara. Markisa ungu ditanam di daerah dataran tinggi tropis dan subtropis pada ketinggian 700 sampai 2000 m di atas permukaan laut
dengan suhu 18˚ sampai 25˚C. Daerah penghasil markisa ungu masih terpusat di
Tapanuli Utara) dan Sulawesi Selatan (Kabupaten Gowa, Sinjai, Tator, Enrekang dan Polmas) (Karsinah, dkk., 2010).
Menurut penelitian sebelumnya, kulit buah markisa ungu memiliki aktivitas antihipertensi dengan konsentrasi ekstrak 50 mg/kg bb dapat menurunkan tekanan darah sistolik sebanyak 12,3 mmHg (Sherma, et al., 2007). Kulit buah markisa ungu juga memiki aktivitas antibakteri terhadap bakteri
Staphylococcus aureus dan Escherichia coli (Nugraha, 2015) dan sebagai pewarna lipstik (Monalisa, 2015).
Berdasarkan penelitian sebelumnya diketahui bahwa kulit buah markisa ungu memiliki potensi sebagai obat. Penggunaan tumbuhan ini untuk pengobatan pada manusia harus melalui serangkaian uji, selain uji khasiat harus dilakukan uji toksisitas. Uji toksisitas dilakukan untuk mengetahui batas keamanan suatu senyawa digunakan sebagai obat.
Uji toksisitas merupakan suatu uji untuk mendeteksi efek toksik suatu zat pada sistem biologi dan data hubungan dosis-respon yang khas dari sediaan uji. Uji toksisitas akut merupakan uji deteksi efek toksik yang muncul dalam waktu singkat setelah pemberian sediaan uji yang diberikan secara oral dalam dosis tunggal, atau dosis berulang yang diberikan dalam waktu 24 jam (Badan POM RI, 2011). Uji toksisitas akut merupakan salah satu uji praklinik penting untuk menentukan efek toksik suatu senyawa yang akan terjadi pada waktu yang singkat setelah pemberiannya dalam takaran tertentu (Utomo, 2008).
makanan dan minuman, kematian hewan, berat organ relatif, serta pemeriksaan makropatologi dan histopatologi organ hati mencit.
1.2Perumusan Masalah
Berdasarkan uraian dalam latar belakang masalah di atas, dapat dirumuskan permasalahan penelitian ini yaitu apakah ekstrak etanol kulit buah markisa ungu berpotensi toksik terhadap mencit setelah pemberian dosis tunggal secara oral yang diamati selama 14 hari?
1.3Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis penelitian ini adalah ekstrak etanol kulit buah markisa ungu berpotensi toksik terhadap terhadap mencit setelah pemberian dosis tumggal secara oral yang diamati selama 14 hari.
1.4Tujuan Penelitian
Berdasarkan hipotesis di atas, tujuan penelitian ini adalah untuk mengetahui ekstrak etanol kulit buah markisa ungu berpotensi toksik terhadap mencit setelah pemberian dosis tunggal secara oral yang diamati selama 14 hari.
1.5Manfaat Penelitian
1.6Kerangka Pikir Penelitian
Variabel bebas Variabel terikat Parameter
2
Gambar 1.1 Kerangka pikir penelitian.
UJI TOKSISITAS AKUT EKSTRAK ETANOL KULIT BUAH MARKISA UNGU (Passiflora edulis Sims)
PADA MENCIT
ABSTRAK
Masyarakat Indonesia sejak zaman dahulu telah mengenal, meramu dan menggunakan tanaman yang berkhasiat sebagai salah satu upaya dalam penanggulangan masalah kesehatan. Salah satu tumbuhan yang buahnya banyak dikonsumsi oleh masyarakat dan mempunyai banyak manfaat adalah buah markisa ungu (Passiflora edulis Sims). Kulit buah markisa ungu memiliki aktivitas antihipertensi, antibakteri terhadap bakteri Staphylococcus aureus dan
Escherichia coli, sebagai pewarna lipstik. Tujuan dari penelitian ini adalah untuk mengetahui batas keamanannya untuk digunakan sebagai obat.
Penelitian ini menggunakan mencit jantan sebanyak 25 ekor yang dibagi menjadi 5 kelompok, yaitu kelompok kontrol yang diberi Na CMC 0,5%, kelompok uji diberi ekstrak etanol kulit buah markisa ungu dengan variasi dosis 500, 1000, 2000 dan 5000 mg/kg bb. Pada akhir pengujian dilakukan pengamatan gejala toksik, berat badan, konsumsi makanan dan minuman, kematian hewan, berat organ relatif, serta pemeriksaan makropatologi dan gambaran histopatologi hati mencit.
Berdasarkan penelitian yang telah dilakukan, dapat disimpulkan pemberian ekstrak etanol kulit buah markisa ungu (Passiflora edulis Sims) kelompok kontrol, dosis 500 mg/kg bb, 1000 mg/kg bb tidak menunjukkan gejala toksik pada uji panggung, uji katalepsi, uji urinasi, uji defekasi, dan uji salivasi, sedangkan pada dosis 2000 mg/kg bb dan 5000 mg/kg bb menunjukkan gejala toksik. Semua kelompok perlakuan tidak berpengaruh pada berat badan mencit, konsumsi makanan dan minuman, serta berat organ relatif. Hasil pemeriksaan histopatologi organ hati mencit menunjukkan bahwa pemberian ekstrak etanol kulit buah markisa ungu pada kelompok kontrol, dosis 500 mg/kg bb dan dosis 1000 mg/kg bb tidak menyebabkan ketoksikan, sedangkan pada dosis 2000 mg/kg bb dan 5000 mg/kg bb dapat menyebabkan ketoksikan pada organ hati. Dosis maksimal tidak menimbulkan kematian hewan coba, maka LD50 dinyatakan LD50
“semu” yaitu dengan mengambil dosis maksimal, sehingga dalam penelitian ini
diketahui LD50 sebagai LD50 semu, yaitu 5000 mg/kg bb.
ACUTE TOXICITY TEST OF ETHANOL EXTRACT PURPLE PASSION FRUIT PEEL ( Passiflora edulis Sims)ON MICE
ABSTRACT
Indonesian had known, gathered and used several plants as an effort in order to prevent health problems since a long ago. One of the plants is very famous in Indonesia which known have many benefits is purple passion fruit or markisa (Passiflora edulis Sims). Purple passion fruit peel has antihypertensive activity, an antibacterial against Staphylococcus aureus and Escherichia coli bacteria, an also as a color for lipstick. The objective of this study was to determine the safety limit to use it as a medicine.
This research used male mice, 25 animals were divided into 5 groups: control group who were given by CMC Sodium 0,5%, test group were given by ethanol extract of purple passion fruit peel with variety of doses 500, 1000, 2000 and 5000 mg / kg bw. Final tests had observed was toxic symptoms, weight, consumption of food and drink, animal lethal, relative organ weight, and examination picture of liver mice and macro pathology examination.
Based on the research that has been done, it can be concluded that ethanol extract of purple passion fruit peel (Passiflora edulis Sims) in control group, a histopathological examination of mice liver showed that the ethanol extract of purple passion fruit peel in the control group, a dose of 500 mg / kg bw and a dose of 1000 mg / kg bw did not caused a toxicity, while at a dose of 2000 mg / kg bw and 5000 mg / kg bw can caused a toxicity to the liver. The maximum dose does not caused the death of experimental animals, the LD50 stated LD50 "pseudo" is to take the maximum dose, so in this study had known LD50 as LD50 apparent, namely 5000 mg / kg bw.
UJI TOKSISITAS AKUT EKSTRAK ETANOL
KULIT BUAH MARKISA UNGU (Passiflora edulis Sims.)
PADA MENCIT
SKRIPSI
OLEH:
EDO KUSDA PRATAMA
NIM 131524058
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
UJI TOKSISITAS SUBKRONIK EKSTRAK ETANOL
KULIT BUAH MARKISA UNGU (Passoiflora edulis Sims.)
PADA MENCIT
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakuktas Farmasi
Universitas Sumatera Utara
OLEH:
EDO KUSDA PRATAMA
NIM 131524058
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
PENGESAHAN SKRIPSI
UJI TOKSISITAS AKUT EKSTRAK ETANOL KULIT BUAH
MARKISA UNGU (Passiflora edulis Sims.)
MENGGUNAKAN MENCIT
OLEH:
EDO KUSDA PRATAMA NIM 131524058
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 7 Maret 2016 Disetujui Oleh: Pembimbing I, Panitia Penguji,
Dra. Herawaty Ginting, M.Si,. Apt. Dr. Edy Suwarso, S.U., Apt. NIP 195112231980032002 NIP 195209271981031007
Dra. Herawaty ginting, M.Si., Apt. Pembimbing II, NIP 195112231980032002
Aminah Dalimunthe, S.Si., M.Si., Apt. Dra. Azizah Nasution, M.Sc., Ph.D., Apt. NIP 197806032005012004 NIP 195503121983032001
Marianne, S.Si., M.Si., Apt. NIP 198005202005012006
Medan, April 2016 Fakultas Farmasi
Universitas Sumatera Utara Pejabat Dekan,
KATA PENGANTAR
Bismillahirrahmaanirrahiim,
Puji syukur kepada Allah SWT atas segala limpahan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini, serta shalawat beriring salam untuk Rasulullah Muhammad SAW sebagai suri tauladan dalam kehidupan. Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera
Utara, dengan judul “Uji Toksisitas Akut Ekstrak Etanol Kulit Buah Markisa
Ungu (Passiflora edulis Sims.) Menggunakan Mencit”.
Ucapan terima kasih dan penghargaan yang tulus tiada terhingga kepada Ayahanda Kusdinata dan Ibunda Ida Royani, S.Pd. yang telah memberikan cinta dan kasih sayang yang tidak ternilai dengan apapun, pengorbanan baik materi maupun motivasi serta doa yang tulus yang tidak pernah berhenti. Adikku Dwi Kusda Nur Astry serta seluruh keluarga yang selalu mendoakan dan memberikan semangat.
Penulis juga tidak lupa mengucapkan terima kasih kepada teman-teman ekstensi farmasi angkatan 2013, dan sahabat-sahabatku yang telah memberikan bantuan dan semangat tak terhingga.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih jauh dari kesempurnaan, oleh karena itu dengan segala kerendahan hati, penulis menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya, penulis berharap semoga skripsi ini dapat memberi manfaat bagi kita semua.
Medan, April 2016 Penulis,
UJI TOKSISITAS AKUT EKSTRAK ETANOL KULIT BUAH MARKISA UNGU (Passiflora edulis Sims)
PADA MENCIT
ABSTRAK
Masyarakat Indonesia sejak zaman dahulu telah mengenal, meramu dan menggunakan tanaman yang berkhasiat sebagai salah satu upaya dalam penanggulangan masalah kesehatan. Salah satu tumbuhan yang buahnya banyak dikonsumsi oleh masyarakat dan mempunyai banyak manfaat adalah buah markisa ungu (Passiflora edulis Sims). Kulit buah markisa ungu memiliki aktivitas antihipertensi, antibakteri terhadap bakteri Staphylococcus aureus dan
Escherichia coli, sebagai pewarna lipstik. Tujuan dari penelitian ini adalah untuk mengetahui batas keamanannya untuk digunakan sebagai obat.
Penelitian ini menggunakan mencit jantan sebanyak 25 ekor yang dibagi menjadi 5 kelompok, yaitu kelompok kontrol yang diberi Na CMC 0,5%, kelompok uji diberi ekstrak etanol kulit buah markisa ungu dengan variasi dosis 500, 1000, 2000 dan 5000 mg/kg bb. Pada akhir pengujian dilakukan pengamatan gejala toksik, berat badan, konsumsi makanan dan minuman, kematian hewan, berat organ relatif, serta pemeriksaan makropatologi dan gambaran histopatologi hati mencit.
Berdasarkan penelitian yang telah dilakukan, dapat disimpulkan pemberian ekstrak etanol kulit buah markisa ungu (Passiflora edulis Sims) kelompok kontrol, dosis 500 mg/kg bb, 1000 mg/kg bb tidak menunjukkan gejala toksik pada uji panggung, uji katalepsi, uji urinasi, uji defekasi, dan uji salivasi, sedangkan pada dosis 2000 mg/kg bb dan 5000 mg/kg bb menunjukkan gejala toksik. Semua kelompok perlakuan tidak berpengaruh pada berat badan mencit, konsumsi makanan dan minuman, serta berat organ relatif. Hasil pemeriksaan histopatologi organ hati mencit menunjukkan bahwa pemberian ekstrak etanol kulit buah markisa ungu pada kelompok kontrol, dosis 500 mg/kg bb dan dosis 1000 mg/kg bb tidak menyebabkan ketoksikan, sedangkan pada dosis 2000 mg/kg bb dan 5000 mg/kg bb dapat menyebabkan ketoksikan pada organ hati. Dosis maksimal tidak menimbulkan kematian hewan coba, maka LD50 dinyatakan LD50
“semu” yaitu dengan mengambil dosis maksimal, sehingga dalam penelitian ini
diketahui LD50 sebagai LD50 semu, yaitu 5000 mg/kg bb.
ACUTE TOXICITY TEST OF ETHANOL EXTRACT PURPLE PASSION FRUIT PEEL ( Passiflora edulis Sims)ON MICE
ABSTRACT
Indonesian had known, gathered and used several plants as an effort in order to prevent health problems since a long ago. One of the plants is very famous in Indonesia which known have many benefits is purple passion fruit or markisa (Passiflora edulis Sims). Purple passion fruit peel has antihypertensive activity, an antibacterial against Staphylococcus aureus and Escherichia coli bacteria, an also as a color for lipstick. The objective of this study was to determine the safety limit to use it as a medicine.
This research used male mice, 25 animals were divided into 5 groups: control group who were given by CMC Sodium 0,5%, test group were given by ethanol extract of purple passion fruit peel with variety of doses 500, 1000, 2000 and 5000 mg / kg bw. Final tests had observed was toxic symptoms, weight, consumption of food and drink, animal lethal, relative organ weight, and examination picture of liver mice and macro pathology examination.
Based on the research that has been done, it can be concluded that ethanol extract of purple passion fruit peel (Passiflora edulis Sims) in control group, a histopathological examination of mice liver showed that the ethanol extract of purple passion fruit peel in the control group, a dose of 500 mg / kg bw and a dose of 1000 mg / kg bw did not caused a toxicity, while at a dose of 2000 mg / kg bw and 5000 mg / kg bw can caused a toxicity to the liver. The maximum dose does not caused the death of experimental animals, the LD50 stated LD50 "pseudo" is to take the maximum dose, so in this study had known LD50 as LD50 apparent, namely 5000 mg / kg bw.
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR ... iv
ABSTRAK ……… v
ABSTRACT ………. vi
DAFTAR ISI ... vii
DAFTAR GAMBAR ... x
DAFTAR TABEL ... xi
DAFTAR LAMPIRAN ... xii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 3
1.6 Kerangka Pikir Penelitian ………. 4
BAB II TINJAUAN PUSTAKA ……….. 5
2.1 Uraian Tumbuhan ... 5
2.1.1 Nama Daerah ... 5
2.1.2 Nama Asing ... 5
2.1.4 Sisitematika Tumbuhan ... 5
2.1.5 Morfologi Tanaman ... 6
2.1.6 Kandungan Kimia ... 7
2.1.7 Hasil Skrining Fitokimia Kulit Buah Markisa Ungu .. 7
2.1.8 Manfaat Markisa Ungu ... 8
2.2 Toksisitas ... 8
2.2.1 Toksisitas Umum ... 8
2.2.1.1 Toksisitas Akut ... 8
2.2.1.2 Toksisitas Subkronik ... 10
2.2.1.3 Toksisitas Kronik ... 12
2.3.1 Toksisitas Khusus ... 12
2.3.1.1 Uji Teratogenik ... 12
2.3.1.2 Uji Mutagenik ... 12
2.3.1.3 Uji Karsinogenik ... 13
2.4 Anatomi Hati ... 13
2.5 Gambaran Histopatologi Hati ... 14
BAB III METODE PENELITIAN ... 16
3.1 Alat dan Bahan ... 16
3.1.1 Alat-alat ... 16
3.1.2 Bahan-bahan ... 16
3.2 Hewan Penelitian ... 17
3.3 Tahap Penelitian ... 17
3.3.3 Pembuatan suspensi EEKBMU ... 17
3.3.4 Penyiapan dan pengelompokan hewan uji ... 18
3.3.5 Pemberian sediaan uji dan pengamatan gejala toksik .. 18
3.3.6 Pengamatan berat badan ... 19
3.3.7 Pengamatan konsumsi makanan dan minuman ... 20
3.3.8 Pengamatan kematian hewan ... 20
3.3.9 Penimbangan organ hati, jantung, dan ginjal ... 20
3.3.10 Makropatologi organ hati ... 20
3.3.11 Histopatologi organ hati ... 21
3.3.12 Analisis data ... 21
BAB IV HASIL DAN PEMBAHASAN ... 22
4.1 Hasil Pengamatan Gejala Toksik ... 22
4.2 Hasil Pengamatan Berat Badan ... 25
4.3 Hasil Pengamatan Kematian Hewan ... 27
4.4 Hasil Pengamatan Berat Organ Relatif ... 27
4.5 Hasil Pemeriksaan Makropatologi Organ ... 28
4.6 Hasil Pemeriksaan Histopatologi Organ Hati ... 30
BAB V KESIMPULAN DAN SARAN ... 35
5.1 Kesimpulan ... 35
5.2 Saran ... 35
DAFTAR PUSTAKA ... 36
DAFTAR GAMBAR
Gambar Halaman
1.1 Kerangka pikir penelitian ……… 4
2.1 Skematis struktur hati ………. 15
4.1 Gambar organ hati mencit ………... 29
DAFTAR TABEL
Tabel Halaman
2.1 Hasil skrining fitokimia kulit buah markisa ungu ……….. 7
2.2 Kategori penggolongan sediaan uji ……… 10
4.1 Hasil uji panggung ... 22
4.2 Hasil uji katalepsi ... 23
4.3 Hasil uji urinasi ... 24
4.4 Hasil uji defekasi ... 24
4.5 Hasil uji salivasi ... 25
4.6 Hasil rata-rata berat badan ... . 26
4.7 Hasil rata-rata konsumsi makanan dan minuman ... 26
4.8 Hasil pengamatan kematian mencit ... 27
4.9 Hasil berat organ relatif ... . 28
DAFTAR LAMPIRAN
Lampiran Halaman
1 Hasil identifikasi tanaman ... 39
2 Gambar buah dan serbuk simplisia markisa ungu (Passiflora edulis sims) ... 40
3 Gambar kandang mencit yang dilengkapi tempat makanan dan minuman ... 42
4 Gambar pembedahan mencit ... 43
5 Gambar pengamatan gejala toksik ... 44
6 Persetujuan etik penelitian ... 45
7 Hasil analisis statistik berat badan mencit minggu ke-1 dan minggu ke-2 ... . 46
8 Hasil analisis statistik konsumsi minuman mencit minggu ke-1 dan minggu ke-2 ... . 48
9 Hasil analisis statistik konsumsi makanan mencit minggu ke-1 dan minggu ke-2 ... . 50
10 Hasil analisis statistik berat relatif organ hati, ginjal, dan jantung mencit ... . 52