KARAKTERISASI DAN UJI AKTIVITAS ANTIOKSIDAN
MADU HUTAN LHOKNGA, MONTASIK DAN SARE
KABUPATEN ACEH BESAR SECARA
SPEKTROFOTOMETRI VISIBEL
SKRIPSI
OLEH: DIANA FEBRITA
NIM 081524042
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
KARAKTERISASI DAN UJI AKTIVITAS ANTIOKSIDAN
MADU HUTAN LHOKNGA, MONTASIK DAN SARE
KABUPATEN ACEH BESAR SECARA
SPEKTROFOTOMETRI VISIBEL
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: DIANA FEBRITA
NIM 081524042
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
LEMBAR PENGESAHAN
KARAKTERISASI DAN UJI AKTIVITAS ANTIOKSIDAN MADU HUTAN LHOKNGA, MONTASIK DAN SARE
KABUPATEN ACEH BESAR SECARA SPEKTROFOTOMETRI VISIBEL
OLEH: DIANA FEBRITA
NIM 081524042
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: Agustus 2011
Pembimbing I Panitia Penguji
Prof. Dr. Rosidah, M.Si., Apt. Prof. Dr. Urip Harahap, Apt. NIP 195103261978022001 NIP 195301011983031004
Pembimbing II, Prof. Dr. Rosidah, M.Si., Apt. NIP 195103261978022001
Dra. Herawaty Ginting, M.Si., Apt. Dr. Marline Nainggolan, M.Si., Apt. NIP 195112231980032002 NIP 195709091985112001
Dra. Suwarti Aris, M.Si., Apt. NIP 195107231982032001
Disahkan Oleh: Dekan
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT, karena limpahan rahmat dan
karuniaNya, sehingga penulis dapat menyelesaikan skripsi ini yang berjudul
”Karakterisasi Simplisia dan Uji Aktivitas Antioksidan Ekstrak n-Heksan, Etil
Asetat dan Etanol Daun Muda Dari Labu Siam (Sechium edule (Jacq.) Sw.)
Dengan Metode DPPH”.
Pada kesempatan ini penulis menyampaikan ucapan terimakasih dan
penghargaan yang tulus kepada Ayahanda dan Ibunda tercinta, Sudirman Nasir
dan Mulida Gustina atas doa dan pengorbanannya dengan tulus dan ikhlas, juga
kepada adik-adik tersayang yang selalu setia memberi doa, dorongan dan
semangat.
Penulis juga ingin menyampaikan rasa terimakasih yang sebesar-besarnya
kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas
Farmasi Universitas Sumatera Utara yang telah memberikan fasilitas
selama masa pendidikan.
2. Ibu Prof. Dr. Rosidah, M.Si., Apt., dan Dra. Herawaty Ginting, M.Si.,
Apt., selaku pembimbing yang telah memberikan waktu, bimbingan dan
nasehat selama penelitian dengan penuh kesabaran hingga selesainya
penyusunan skripsi ini.
3. Bapak Prof. Dr. Urip Harahap, Apt., Dr. Marline Nainggolan, M.Si., Apt.,
Dra. Suwarti Aris, M.Si., Apt., selaku dosen penguji yang telah
memberikan masukan dan saran selama penelitian hingga selesainya
4. Ibu Dra. Saodah, M.Sc, Apt., selaku dosen wali yang telah memberi
bimbingan dan dorongan kepada penulis selama perkuliahan.
5. Ibu dan Bapak Kepala Laboratorium Penelitian dan Laboratorium
Farmakognosi yang telah memberikan fasilitas, petunjuk dan membantu
selama penelitian.
6. Sahabat-sahabat terbaikku Rosdiana Lubis, Willy Delviana, Muzzammil di
Farmasi Klinis dan Komunitas 2007 terima kasih atas segala perhatian dan
kebersamaan selama ini.
Medan, Agustus 2011
Penulis,
KARAKTERISASI DAN UJI AKTIVITAS ANTIOKSIDAN MADU HUTAN LHOKNGA, MONTASIK DAN SARE
KABUPATEN ACEH BESAR SECARA SPEKTROFOTOMETRI VISIBEL
Abstrak
Madu merupakan cairan kental yang di kumpulkan dalam indung madu oleh lebah. Madu mengandung asam organik, enzim, asam fenolat, flavonoid, beta karoten, Vitamin A, vitamin C dan Vitamin E. Dalam madu terdapat banyak nutrisi yang berfungsi sebagai antioksidan dan semua senyawa tersebut bekerjasama dalam melindungi sel normal dan menetralisir radikal bebas. Telah dilakukan karakterisasi dan penentuan aktivitas antioksidan pada madu hutan Lhoknga, hutan Montasik dan hutan Sare. Aktivitas antioksidan ditentukan dengan peredaman 1,1-diphenyl-2-picrylhydrazyl (DPPH) secara spektrofotometri visible.
Karakterisasi madu dilakukan dengan pemeriksaan makroskopik, mikroskopik, penetapan kadar air, kadar abu total dan kadar abu yang tidak larut dalam asam. Madu di uji aktivitas antioksidannya sebagai penangkap radikal
1,1-diphenyl-2-picrylhydrazyl (DPPH) secara spektrofotometri visibel. Data diolah
menggunakan rumus persen inhibihi untuk mendapatkan aktivitas antioksidan.. Hasil pemeriksaan makroskopik dilakukan terhadap ketiga madu hutan Lhoknga, Montasik dan Sare merupakan cairan kental, berwarna coklat kemerahan, coklat kekuningan, coklat kekuningan tua, mempunyai bau dan rasa yang khas. Hasil mikroskopik madu menunjukkan adanya butir butir serbuk sari. Kadar air masing masing madu yang diperoleh 20,62%; 23,94%; 21,91%, kadar abu total 0,23%; 0,24%; 0,23% dan kadar abu yang tidak larut dalam asam 0,13%; 0,10%; 0,11%.
Hasil uji aktivitas antioksidan ketiga madu dengan konsentrasi masing-masing 3000 µg/ml, 4000 µg/ml, 5000 µg/ml diperoleh nilai aktivitas antioksidan madu hutan Lhoknga 73,34%; 73,89%; 79,66%; madu Montasik 63,36%; 68,88%; 74,18; madu Sare 65,58%; 67,17%; 75,06%. Sedangkan BHT sebagai pembanding dengan konsentrasi 20 µg/ml, 40 µg/ml, 60 µg/ml diperoleh nilai
aktivitas antioksidan 74,46%; 83,31%; 86,87%. BHT pada konsentrasi 20 µg/ml menunjukkan aktivitas antioksidan yang hampir sama dibandingkan dengan ketiga madu pada konsentrasi 5000 µg/ml. Peningkatan aktivitas antioksidan mempunyai arti bahwa telah terjadinya penangkapan radikal DPPH oleh madu.
CHARACTERIZATION AND ANTIOXIDANT ACTIVITY TEST OF HONEY FROM LHOKNGA, MONTASIK, AND SARE FOREST
IN ACEH BESAR REGENCY ACCORDING TO SPECTROPHOTOMETRY VISIBLE
Abstract
Honey is viscous liquid was collected in honey ovarian by bee. Honey contain of organic acid, enzyme, fenolic acid, flavonoid, beta caroten, Vitamin A, C and E. Honey contain many nutrision that use as antioxidant and all of that cooperate to save the normal cell from free radicals. It has been done characterization an antioxidant activity test of honey from Lhoknga, Montasik and Sare forest. Antioxidant activity determined by damping of
1.1-diphenyl-2-picrylhydrazyl (DPPH) according to spectrophotometry visible.
The characterization of honey by macroscopic examination, microscopic examination, determination of water content, total ash content and acid insoluble ash content. Honey was tested antioxidant activity assay as a catcher
1.1-diphenyl-2-picrylhydrazyl (DPPH) radicals. The data were analyzed using a percen of
inhibition equation to obtain antioxidant activity.
The macroscopic examination of Honey from Lhoknga, Montasik and Sare forest is viscous liquid, reddish brown, fawn, dark fawn, has a special smell and taste. The microscopic examination of honey showed that they had bee pollen. The results obtained characteristic of each honey are 20.62%; 23.94%; 21.91% water content, 0.23%; 0.24%; 0.23% total ash content, 0.13%; 0.10%; 0.11% acid insoluble ash content.
The result of antioxidant activity test all of three kind honey with each concentration 3000 µg/ml, 4000 µg/ml, 5000 µg/ml obtained the antioxidant activity of honey from Lhoknga 73.34%; 73.89%; 79.66%, honey from Montasik 63.36%; 68.88%; 74.18 and honey from Sare 65.58%; 67.17%; 75.06%. Whereas BHT as consideration with concentration 20 µg/ml, 40 µg/ml, 60 µg/ml obtained
the antioxidant activity 74.46%; 83.31%; 86.87%. BHT 20 µg/ml showed antioksidan activity as same as with three of honey with consentration 5000 µg/ml. Increase value of antioxidant activity showed that occurrence radical DPPH catching.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
ABSTRAK ... iii
ABSTRAC ... iv
DAFTAR ISI ... v
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
BAB I. PENDAHULUAN ... 1
1.1Latar Belakang ... 1
1.2Perumusan Masalah ... 3
1.3Hipotesis ... 3
1.4Tujuan Penelitian ... 4
1.5Manfaat Penelitian ... 4
1.6Kerangka Pikir Penelitian ... 4
BAB II. TINJAUAN PUSTAKA ... 5
2.1 Madu ... 5
2.1.1 Proses Terbentuknya Madu ... 5
2.1.2 Jenis Madu ... 6
2.1.3 Kualitas Madu ... 7
2.1.5 Manfaat Madu ... 9
2.2 Radikal Bebas ... 9
2.3 Antioksidan ... 10
2.3.1 Antioksidan Sintetik ... 11
2.3.2 Butylated Hydroxytoluen (BHT) ... 11
2.4 DPPH ... 12
2.4.1 Pelarut ... 13
2.4.2 Pengukuran Absorbansi-Panjang Gelombang... 13
2.4.3 Waktu Pengukuran ... 13
2.5 Spektrofotometri ... 14
BAB III.METODE PENELITIAN ... 15
3.1 Alat-alat ... 15
3.2 Bahan-bahan ... 15
3.3 Pengumpulan Sampel ... 15
3.4 Pembuatan Pereaksi ... 16
3.4.1 Pereaksi Molish ... 16
3.4.2 Pereaksi Benedict ... 16
3.4.3 Pereaksi Seliwanoff ... 16
3.4.4 Larutan DPPH 0,5 mM ... 16
3.5 Pemeriksaaan Karakteristik Sampel ... 16
3.5.1 Pemeriksaan Makroskopik ... 16
3.5.2 Pemeriksaan Mikroskopik ... 17
3.5.3 Penetapan Kadar Air ... 17
3.5.5 Penetapan Kadar Abu yang Tidak Larut dalam Asam ... 18
3.6 Skrining Madu ... 18
3.6.1 Pemeriksaan Flavonoid ... 18
3.6.2 Pemeriksaaan Sukrosa ... 18
3.6.3 Pemeriksaan Glukosa ... 19
3.6.7 Pemeriksaan Fruktosa ... 19
3.7 Pengujian Kemampuan Antioksidan Dengan Spektrofotometri Visibel ... 19
3.7.1 Prinsip Metode DPPH ... 19
3.7.2 Pengukuran Larutan DPPH ... 19
3.7.3 Pembuatan Larutan Induk ... 20
2.7.4 Pengukuran Aktivitas Antioksidan Sampel Uji... 20
2.7.5 Pengukuran Aktivitas Antioksidan BHT ... 20
2.7.6 Penentuan Persen Peredaman ... 20
BAB IV. HASIL DAN PEMBAHASAN ... 21
BAB V. KESIMPULAN DAN SARAN ... 26
5.1 Kesimpulan ... 26
5.2 Saran ... 26
DAFTAR PUSTAKA ... 27
DAFTAR TABEL
Tabel Halaman
2.1 Persyaratan Kualitas Madu ... 8
3.1 Hasil karakterisasi madu ... 22
3.2 Hasil skrining fitokimia madu ... 23
DAFTAR GAMBAR
Gambar Halaman
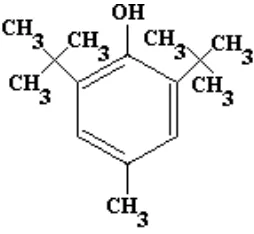
Gambar 2.3.2.1 Rumus Bangun BHT ... 11
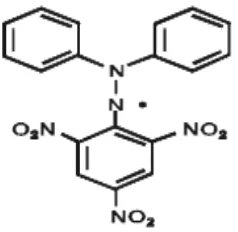
Gambar 2.4.1 Rumus Bangun DPPH ... 12
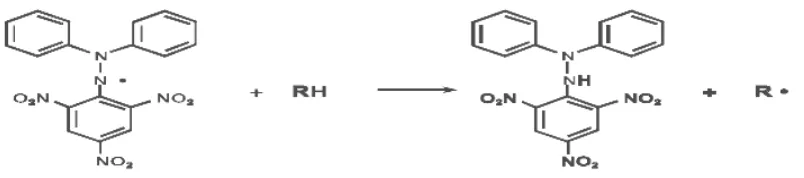
Gambar 2.4.2 Reaksi antara DPPH dengan atom H netral yang berasal dari antioksidan ... 13
Gambar 2.5.1 Konstruksi Dasar dar Spektrofotometri ... 14
DAFTAR LAMPIRAN
Lampiran Halaman
1. Bagan Kerja Penelitian ... 29
2. Gambar Daerah Pengambilan Madu ... 30
3. Gambar Makroskopik Madu ... 31
4. Gambar Mikroskopik Madu ... 32
5. Hasil Perhitungan Karakteristik Madu ... 33
6. Gambar Alat Spektrofotometri UV-Vis ... 38
7. Data absorbansi dan % inhibisi madu hutan Lhoknga, Montasik, Sare dan BHT ... 39
KARAKTERISASI DAN UJI AKTIVITAS ANTIOKSIDAN MADU HUTAN LHOKNGA, MONTASIK DAN SARE
KABUPATEN ACEH BESAR SECARA SPEKTROFOTOMETRI VISIBEL
Abstrak
Madu merupakan cairan kental yang di kumpulkan dalam indung madu oleh lebah. Madu mengandung asam organik, enzim, asam fenolat, flavonoid, beta karoten, Vitamin A, vitamin C dan Vitamin E. Dalam madu terdapat banyak nutrisi yang berfungsi sebagai antioksidan dan semua senyawa tersebut bekerjasama dalam melindungi sel normal dan menetralisir radikal bebas. Telah dilakukan karakterisasi dan penentuan aktivitas antioksidan pada madu hutan Lhoknga, hutan Montasik dan hutan Sare. Aktivitas antioksidan ditentukan dengan peredaman 1,1-diphenyl-2-picrylhydrazyl (DPPH) secara spektrofotometri visible.
Karakterisasi madu dilakukan dengan pemeriksaan makroskopik, mikroskopik, penetapan kadar air, kadar abu total dan kadar abu yang tidak larut dalam asam. Madu di uji aktivitas antioksidannya sebagai penangkap radikal
1,1-diphenyl-2-picrylhydrazyl (DPPH) secara spektrofotometri visibel. Data diolah
menggunakan rumus persen inhibihi untuk mendapatkan aktivitas antioksidan.. Hasil pemeriksaan makroskopik dilakukan terhadap ketiga madu hutan Lhoknga, Montasik dan Sare merupakan cairan kental, berwarna coklat kemerahan, coklat kekuningan, coklat kekuningan tua, mempunyai bau dan rasa yang khas. Hasil mikroskopik madu menunjukkan adanya butir butir serbuk sari. Kadar air masing masing madu yang diperoleh 20,62%; 23,94%; 21,91%, kadar abu total 0,23%; 0,24%; 0,23% dan kadar abu yang tidak larut dalam asam 0,13%; 0,10%; 0,11%.
Hasil uji aktivitas antioksidan ketiga madu dengan konsentrasi masing-masing 3000 µg/ml, 4000 µg/ml, 5000 µg/ml diperoleh nilai aktivitas antioksidan madu hutan Lhoknga 73,34%; 73,89%; 79,66%; madu Montasik 63,36%; 68,88%; 74,18; madu Sare 65,58%; 67,17%; 75,06%. Sedangkan BHT sebagai pembanding dengan konsentrasi 20 µg/ml, 40 µg/ml, 60 µg/ml diperoleh nilai
aktivitas antioksidan 74,46%; 83,31%; 86,87%. BHT pada konsentrasi 20 µg/ml menunjukkan aktivitas antioksidan yang hampir sama dibandingkan dengan ketiga madu pada konsentrasi 5000 µg/ml. Peningkatan aktivitas antioksidan mempunyai arti bahwa telah terjadinya penangkapan radikal DPPH oleh madu.
CHARACTERIZATION AND ANTIOXIDANT ACTIVITY TEST OF HONEY FROM LHOKNGA, MONTASIK, AND SARE FOREST
IN ACEH BESAR REGENCY ACCORDING TO SPECTROPHOTOMETRY VISIBLE
Abstract
Honey is viscous liquid was collected in honey ovarian by bee. Honey contain of organic acid, enzyme, fenolic acid, flavonoid, beta caroten, Vitamin A, C and E. Honey contain many nutrision that use as antioxidant and all of that cooperate to save the normal cell from free radicals. It has been done characterization an antioxidant activity test of honey from Lhoknga, Montasik and Sare forest. Antioxidant activity determined by damping of
1.1-diphenyl-2-picrylhydrazyl (DPPH) according to spectrophotometry visible.
The characterization of honey by macroscopic examination, microscopic examination, determination of water content, total ash content and acid insoluble ash content. Honey was tested antioxidant activity assay as a catcher
1.1-diphenyl-2-picrylhydrazyl (DPPH) radicals. The data were analyzed using a percen of
inhibition equation to obtain antioxidant activity.
The macroscopic examination of Honey from Lhoknga, Montasik and Sare forest is viscous liquid, reddish brown, fawn, dark fawn, has a special smell and taste. The microscopic examination of honey showed that they had bee pollen. The results obtained characteristic of each honey are 20.62%; 23.94%; 21.91% water content, 0.23%; 0.24%; 0.23% total ash content, 0.13%; 0.10%; 0.11% acid insoluble ash content.
The result of antioxidant activity test all of three kind honey with each concentration 3000 µg/ml, 4000 µg/ml, 5000 µg/ml obtained the antioxidant activity of honey from Lhoknga 73.34%; 73.89%; 79.66%, honey from Montasik 63.36%; 68.88%; 74.18 and honey from Sare 65.58%; 67.17%; 75.06%. Whereas BHT as consideration with concentration 20 µg/ml, 40 µg/ml, 60 µg/ml obtained
the antioxidant activity 74.46%; 83.31%; 86.87%. BHT 20 µg/ml showed antioksidan activity as same as with three of honey with consentration 5000 µg/ml. Increase value of antioxidant activity showed that occurrence radical DPPH catching.
BAB I PENDAHULUAN
1.1. Latar Belakang
Radikal bebas merupakan suatu molekul atau atom yang memiliki satu
atau lebih elektron yang tidak berpasangan. Adanya elektron yang tidak
berpasangan menyebabkan molekul tersebut menjadi sangat reaktif untuk mencari
pasangannya dengan menarik atau menyerang elektron dari senyawa lain sehingga
menyebabkan senyawa tersebut akan menjadi radikal juga (Kosasih, 2004).
Tubuh kita secara terus-menerus membentuk radikal bebas melalui
peristiwa metabolisme sel normal, peradangan, kekurangan gizi dan adanya
respons terhadap pengaruh dari luar tubuh seperti polusi lingkungan, sinar
ultraviolet dan asap rokok. Akibat yang ditimbulkan oleh lingkungan tercemar,
kesalahan pola makan dan gaya hidup, justru merangsang tumbuhnya radikal
bebas yang dapat merusak tubuh kita, proses penuaan berdasarkan timbulnya
kerusakan jaringan disebabkan oleh radikal bebas (Parwata, 2010).
Penelitian baru di bidang gizi pada tingkat sel membuktikan bahwa
antioksidan mampu melindungi jaringan tubuh dari efek negatif radikal bebas
(Bruce,2005). Senyawa antioksidan diantaranya adalah asam fenolat, flavonoid,
β-karoten, vitamin E, vitamin C dan asam organik. Zat-zat gizi mineral seperti
mangan, seng, tembaga dan selenium. Selain antioksidan alami terdapat
antioksidan sintetik antara lain Butylated Hydroxyanisole (BHA), Butylated
Hydroxytoluen (BHT), propil galat (Kumalaningsih, 2006). Selain dalam
Madu adalah makanan yang mengandung aneka zat gizi seperti
karbohidrat , protein, asam amino, vitamin, mineral, dekstrin, pigmen tumbuhan
dan komponen aromatik. Asam fenolat dalam madu memiliki daya aktif tinggi
serta dapat meningkatkan perlawanan tubuh terhadap tekanan oksidasi. Disamping
kandungan gulanya yang tinggi (fruktosa 41,0 %; glukosa 35 %; sukrosa 1,9 %)
madu juga mengandung komponen lain seperti tepung sari dan berbagai enzim
pencernaan serta mengandung berbagai vitamin seperti vitamin A, B1, B2, C, E,
mineral seperti kalsium, natrium, kalium, magnesium, besi, dan garam iodine.
Madu juga mengandung berbagai asam organik seperti asam malat, tartrat, sitrat,
laklat, dan oksalat. Karena itu madu sangat tinggi sekali khasiatnya (Anonim a,
2009).
Madu merupakan bahan konsumsi yang sangat baik untuk
mempertahankan kesehatan dan stamina jasmani (Anonim, 2010). Kandungan
nutrisi dalam madu yang berfungsi sebagai antioksidan adalah vitamin C, asam
organik, enzim, asam fenolat, flavonoid dan beta karoten yang bermanfaat sebagai
antioksidan tinggi serta Vitamin A, Vitamin E yang juga merupakan salah satu
vitamin antioksidan esensial yang utama (Parwata, 2010).
Berdasarkan hasil penelitian tentang aktivitas antioksidan yang telah
diteliti pada madu Randu dan madu Kelengkeng menunjukkan bahwa madu dari
jenis bunga yang berbeda memiliki aktivitas antioksidan yang berbeda (Parwata,
2010). Penelitian lain tentang aktivitas antioksidan telah dilakukan terhadap madu
floral Australia dari jenis bunga berbeda yang memiliki aktivitas antioksidan
Madu hutan merupakan salah satu jenis madu yang diperoleh lebah liar
yang hidup di hutan belantara yang menghisap bakal kuncup bunga bunga yang
bermekaran di alam hutan belantara, tidak ada rekayasa atau campur tangan
manusia (Anonim, 2010). Hutan Lhoknga, Montasik dan Sare merupakan hutan
penghasil madu di kabupaten Aceh Besar, yang telah di ketahui mempunyai
khasiat sangat baik bagi kesehatan.
Mengingat belum adanya publikasi yang menyebutkan tentang aktivitas
antioksidan madu hutan, terutama madu hutan Lhoknga, Montasik dan Sare maka
perlu dilakukan penelitian untuk mengetahui besarnya aktivitas antioksidan secara
spektrofotometri visible pada madu hutan Lhoknga, Montasik dan Sare yang
banyak digunakan oleh masyarakat dikabupaten Aceh Besar.
1.2`Perumusan Masalah
a. Apakah karakteristik madu hutan Lhoknga, montasik dan Sare sesuai
berdasarkan Standar Nasional Indonesia.
b. Seberapa besar aktivitas antioksidan madu hutan Lhoknga, Montasik dan
Sare dibandingkan dengan BHT.
1.3`Hipotesis
a. Karakteristik madu hutan Lhoknga, Montasik dan Sare dapat diperoleh
dengan menggunakan prosedur dari Standar Nasional Indonesia.
b. Aktivitas antioksidan madu hutan Lhoknga, Montasik dan Sare setara
dengan aktivitas antioksidan BHT.
1.4Tujuan Penelitian
a. Untuk mengetahui karakteristik madu hutan Lhoknga, Montasik dan Sare
Karakterisasi
Skrining
Uji Aktivitas Antioksidan
b. Untuk mengetahui besarnya aktivitas antioksidan madu hutan Lhoknga,
Montasik dan Sare dibandingkan dengan BHT.
1.5Manfaat Penelitian
Hasil penelitian ini dapat dimanfaatkan oleh masyarakat tentang aktivitas
antioksidan pada madu hutan Lhoknga, Montasik dan Sare yang berada di
Kabupaten Aceh Besar.
1.6Kerangka Pikir Penelitian
Variabel Bebas Variabel Terikat Parameter
Gambar. 1.1 Skema Kerangka Pikir Penelitian
Madu Lhoknga
larut dalam asam
- Fruktosa
- Glukosa
- Fruktosa
BAB II
TINJAUAN PUSTAKA
2.1 Madu
Madu adalah zat manis alami yang dihasilkan oleh lebah madu dari sari
bunga tanaman atau bagian lain dari tanaman. Madu merupakan produk yang
unik dari hewan, yang mengandung persentase karbohidrat yang tinggi, praktis
tidak ada protein maupun lemak. Nilai gizi dari madu sangat tergantung dari
kandungan gula-gula sederhana, fruktosa, glukosa dan sukrosa. Warnanya kuning
pucat sampai coklat kekuningan, rasa dan harumnya madu sangat dipengaruhi
oleh jenis nektar yang dikumpulkan dari bunga (SNI, 2004; Sarwono, 2001).
Madu adalah salah satu makanan penting untuk sumber nutrisi manusia
karena mengandung 82,3% karbohidrat yang jauh lebih tinggi dibandingkan
produk-produk ternak lainnya. Selain mengandung gula, madu juga mengandung
garam mineral, protein, dan vitamin (Sarwono, 2001; Sihombing, 1997).
Pengobatan dengan menggunakan madu telah dikenal orang Mesir kuno
sejak 2.600 SM. Bangsa Yunani, Romawi, dan China kuno sudah menggunakan
madu sebagai antiseptik dalam mengobati luka. Walaupun sejak abad ke-19
peranan madu sebagai pemanis telah tergeser oleh kehadiran gula yang terbuat
dari bit dan tebu, sampai sekarang madu masih dimanfaatkan dalam beberapa
produk pangan sebagai bahan tambahan (Sarwono, 2001).
2.1.1. Proses Terbentuknya Madu
Pada dasarnya, madu adalah zat manis alami yang dihasilkan lebah dengan
oleh kelenjar “necterifier” tanaman dalam bentuk larutan gula dengan konsentrasi
yang bervariasi. Sukrosa, fruktosa, dan glukosa adalah komponen utama nektar, di
samping zat-zat gula lainnya dalam konsentrasi yang lebih sedikit. Di samping itu,
terdapat juga zat lain dalam jumlah yang sedikit yaitu asam amino, resin, protein,
garam, dan mineral. Nektar dikumpulkan lebah pekerja dari bunga dengan cara
mengisapnya memakai mulut dan asaafagus, lalu masuk ke perut di dalam
abdomen. Sebagian air nektar diserap sel-sel dinding perut lebah dan dibuang ke
luar melalui pipa malfigi dan poros usus. Bersama air dibuang juga asam oksalat
dan turunannya, beberapa garam mineral, dan sebagian zat aromatik yang terdapat
di nektar. Zat aromatik yang tertinggal memberikan aroma khusus pada madu.
2.1.2. Jenis Madu
Madu digolongkan menurut jenis tanaman yang menjadi sumber
nektarnya. Jika madu dihasilkan oleh lebah yang mengambil makanannya dari
beragam sumber dan tidak ada tanaman yang dominan dinamakan madu
multiflora atau poliflora, contohnya, madu hutan, sedangkan madu yang berasal
dari salah satu tanaman dominan disebut dengan madu monoflora. Di beberapa
daerah juga terdapat madu biflora yang sumber nektar dominannya berasal dari
dua jenis pohon. Lebah memiliki kecenderungan hanya mengambil nektar dari
satu jenis tanaman tertentu. Lebah tersebut baru akan mengambil nektar dari
tanaman lain jika nektar dari tanaman tertentu tersebut tidak mencukupi.
Madu dapat dibedakan menjadi madu flora, madu ekstra flora,dan madu
embun (honey drew). Madu flora adalah madu yang bersumber dari nektar yang
terdapat dalam bunga. Madu ekstra flora dihasilkan dari sumber tanaman yang
dalam daun, cabang, atau batang pohon. Madu embun adalah madu yang dibuat
dari cairan yang dihasilkan oleh serangga yang terdapat di pohon-pohon.
(Sarwono, 2001).
2.1.3. Kualitas Madu
Kualitas madu merupakan pertimbangan yang sangat penting, karena itu
sangat perlu diperhatikan bahwa madu harus murni, bersih dari kotoran, misalnya
lalat, insek lain, dan bulu-bulu. Karena itu, adanya pengendalian mutu di
negara/daerah penghasil madu sangat penting khususnya untuk usaha
ekspor madu ke luar negeri. (Winarno, 1982).
Kualitas madu ditentukan oleh cara panen madu, warna madu, cita rasa
madu, jenis madu, komposisi madu, dan kadar air. Baik di alam maupun di
peternakan lebah, waktu pemanenan madu harus diperhatikan. Madu yang
dipanen harus memiliki kadar air di bawah 22%. Jika sel-sel dalam
sarang madu telah ditutupoleh lapisan lilin, madu tersebut telah memenuhi syarat
kadar air dan siap untuk dipanen” (Sarwono, 2001). Persyaratan kualitas madu
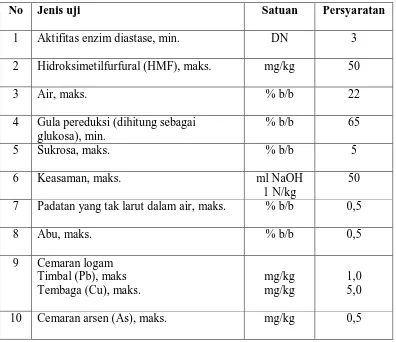
berdasarkan Standar Nasional Indonesia (SNI) dapat dilihat pada table 2.1
2.1.4 Kandungan Madu
Madu mengandung vitamin A, B1, B2, B3, B5, B6, C, D, E, K, β-karoten,
flavonoid dan asam fenolik. Didalam madu juga terdapat kandungan mineral dan
garam atau zat lain seperti zat besi, sulfur, magnesium, kalsium, kalium, khlor,
natrium, fosfor dan sodium serta enzim pencernaan. Rata-rata komposisi madu
adalah 23% air; 82,4% karbohidrat; 0,5% protein, asam amino, vitamin dan
mineral. Karbohidrat madu termasuk tipe sederhana yang terdiri dari fruktosa
Tabel 2.1. Persyaratan kualitas madu
No Jenis uji Satuan Persyaratan
1 Aktifitas enzim diastase, min. DN 3
2 Hidroksimetilfurfural (HMF), maks. mg/kg 50
3 Air, maks. % b/b 22
4 Gula pereduksi (dihitung sebagai glukosa), min. Timbal (Pb), maks Tembaga (Cu), maks.
mg/kg mg/kg
1,0 5,0
10 Cemaran arsen (As), maks. mg/kg 0,5
Disamping kandungan gulanya yang tinggi madu juga mengandung
komponen lain seperti butir-butir serbuk sari. Selain itu madu kaya akan
kandungan antioksidan. Kandungan nutrisi dalam madu yang berfungsi sebagai
antioksidan adalah vitamin C, asam organik, enzim, asam fenolik, flavonoid dan
beta karoten yang bermanfaat sebagai antioksidan tinggi (Anonim, 2010;
Gheldof,et al., 2002) serta Vitamin A, Vitamin E yang juga merupakan salah satu
vitamin antioksidan esensial yang utama (Anonim b, 2009). Dengan demikian
pada madu terdapat banyak nutrisi yang berfungsi sebagai antioksidan dan semua
senyawa tersebut bekerjasama dalam melindungi sel normal dan menetralisir
2.1.5 Manfaat Madu
Madu merupakan bahan konsumsi yang sangat baik untuk
mempertahankan kesehatan dan stamina jasmani. Mineralnya diperlukan tubuh
agar tetap segar, vitaminnya berperan dalam metabolisme protein dan mencegah
penyakit kulit seperti eksim dan herpes. Kandungan fruktosa madu berperan
dalam mempercepat proses oksidasi alkohol pada hati, sehingga dapat membantu
menanggulangi kerusakan hati pada peminum minuman beralkohol. Pada madu
juga terdapat banyak nutrisi yang berfungsi sebagai antioksidan (Anonim, 2010).
2.2 Radikal Bebas
Radikal bebas merupakan suatu molekul atau atom yang memiliki satu
atau lebih elektron yang tidak berpasangan. Adanya elektron yang tidak
berpasangan menyebabkan molekul tersebut menjadi sangat reaktif untuk mencari
pasangannya dengan menarik atau menyerang elekron dari senyawa lain sehingga
menyebabkan senyawa tersebut akan menjadi radikal juga. Reaksi oksidasi tidak
hanya berkaitan dengan kerusakan mutu produk pangan, namun reaksi oksidasi
yang terjadi pada berbagai organ dan cairan tubuh juga berkaitan dengan
munculnya penyakit degeneratif seperti katarak, kanker dan jantung. Target utama
radikal bebas didalam tubuh adalah protein, asam lemak tidak jenuh serta unsur
DNA. Berbagai kemungkinan dapat terjadi sebagai akibat kerja radikal bebas,
misalnya gangguan fungsi sel, kerusakan struktur sel dan molekul termodifikasi
yang tidak dapat dikenali oleh sistem imun. Semua gangguan tersebut dapat
memicu munculnya berbagai penyakit (Kosasih, 2004).
Radikal bebas yang sangat berbahaya dalam makhluk hidup antara lain adalah
peroksidal (RO-2), peroksinitrit (ONOO-), asam hipoklorit (HOCl), hidrogen
peroksida (H2O2) (Silalahi, 2006).
2.3 Antioksidan
Antioksidan merupakan senyawa pemberi elektron (elektron donor) atau
reduktan. Antioksidan mencegah terjadinya oksidasi atau menetralkan senyawa
yang telah teroksidasi dengan cara menyumbangkan hidrogen dan atau elektron
(Silalahi, 2006). Senyawa ini mampu menginaktivasi berkembangnya reaksi
oksidasi, dengan cara mencegah terbentuknya radikal atau dengan mengikat
radikal bebas dan molekul yang sangat reaktif. Antioksidan tubuh dikelompokkan
menjadi 3 yakni:
1. Antioksidan primer bekerja dengan cara mencegah terbentuknya radikal baru
sebelum radikal ini sempat bereaksi, misalnya enzim superoksida dismutase
yang berfungsi sebagai pelindung hancurnya sel-sel dalam tubuh karena radikal
bebas.
2. Antioksidan sekunder yang berfungsi menangkap senyawa serta mencegah
terjadinya reaksi berantai, misalnya vitamin E, vitamin C dan betakaroten yang
diperoleh dari buah-buahan dan sayur-sayuran.
3. Antioksidan tersier yang memperbaiki kerusakan sel-sel dan jaringan yang
disebabkan radikal bebas, misalnya enzim metionin sulfoksidan reduktase
untuk memperbaiki DNA pada inti sel (Kumalaningsih, 2006).
Antioksidan yang ada di alam dibagi atas tiga macam yaitu:
1. Antioksidan yang dibuat oleh tubuh kita sendiri berupa enzim pada tubuh
2. Antioksidan alami merupakan antioksidan yang dapat diperoleh dari tanaman
atau hewan berupa tokoferol, vitamin C, betakaroten, flavonoid dan senyawa
fenolik yang berfungsi menangkap radikal bebas serta mencegah terjadinya
reaksi berantai sehingga tidak terjadi kerusakan yang lebih besar.
3. Antioksidan sintetik, dibuat dari bahan-bahan kimia yang biasanya
ditambahkan ke dalam bahan pangan untuk mencegah terjadinya reaksi
autooksidasi. Senyawa antioksidan sintetik yang secara luas digunakan adalah
Butylated Hydroxyanisole (BHA), Butylated Hydroxytoluen (BHT), propil
galat (Kumalaningsih, 2006).
2.3.1 Antioksidan Sintetik
Antioksidan sintetik biasanya ditambahkan ke dalam bahan pangan yang
mengandung lemak untuk mencegah terjadinya reaksi autooksidasi. Banyaknya
dikembangkan senyawa antioksidan sintetik dikarenakan antioksidan alami seperti
vitamin E dan vitamin C sangat peka oleh berbagai proses pada pengolahan
senyawa lemak, seperti suhu yang tinggi pada penggorengan atau pemanggangan.
Senyawa antioksidan sintetik yang secara luas digunakan adalah Butylated
Hydroxyanisole (BHA), Butylated Hydroxytoluen (BHT), propil galat. (Branen,
et.al., 2002)
2.3.2 Butylated Hydroxytoluen (BHT)
Butylated Hydroxytoluen mempunyai berat molekul 220,35 dengan rumus
bangun C15H24O. Butylated Hydroxytoluen mengandung tidak kurang dari 99,0%
C15H24O. Pemerian: Hablur padat, putih, bau khas, lemah. Kelarutan: Tidak larut
dalam air dan propilen glikol, mudah larut dalam etanol, kloroform dan eter.
Penyimpanan dalam wadah tertutup baik (Ditjen POM, 1995).
2.4 DPPH
DPPH merupakan singkatan umum untuk senyawa kimia organik yaitu
1,1-diphenyl-2-picrylhydrazil. DPPH adalah bubuk kristal berwarna gelap
terdiri dari molekul radikal bebas yang stabil. DPPH mempunyai berat
molekul 394.32 dengan rumus bangun C18H12N5O6, larut dalam air. Penyimpanan
dalam wadah tertutup baik pada suhu -20°C (Molyneux, 2004).
Gambar 2.4.1 Rumus Bangun DPPH
DPPH dapat digunakan untuk menguji kemampuan antioksidan yang
terkandung dalam makanan. Prinsipnya dimana elektron ganjil pada molekul
DPPH memberikan serapan maksimum pada panjang gelombang 517 nm yang
berwarna ungu. Warna ini akan berubah dari ungu menjadi kuning lemah apabila
elektron ganjil tersebut berpasangan dengan atom hidrogen yang disumbangkan
senyawa antioksidan. Reaksi antara DPPH dengan atom H netral yang berasal dari
Gambar 2.4.2 Reaksi antara DPPH dengan atom H netral yang berasal dari
antioksidan
2.4.1 Pelarut
Metode ini akan bekerja dengan baik menggunakan pelarut metanol atau
etanol karena kedua pelarut ini tidak mempengaruhi dalam reaksi antara sampel
uji sebagai antioksidan dengan DPPH sebagai radikal bebas (Molyneux, 2004).
2.4.2 Pengukuran Absorbansi-Panjang Gelombang
Panjang gelombang maksimum (λmaks) yang digunakan dalam pengukuran
sampel uji sangat bervariasi. Menurut beberapa literatur panjang gelombang
maksimum untuk DPPH antara lain 515 nm, 516 nm, 517 nm, 518 nm, 519 nm,
520 nm. Bagaimanapun dalam praktiknya hasil pengukuran yang memberikan
peak maksimum itulah panjang gelombangnya yaitu sekitar panjang gelombang
yang disebutkan diatas (Molyneux, 2004).
2.4.3 Waktu Pengukuran
Lamanya pengukuran menurut beberapa literatur, yang direkomendasikan
adalah selama 30 menit, namun dalam beberapa penelitian khususnya belakangan
ini waktu pengukuran yaitu selama 60 menit. Waktu pengukuran digunakan
sebagai parameter untuk mengevaluasi aktivitas antioksidan sampel sebagai
rujukan untuk digunakan dalam penelitian-penelitian berikutnya (Molyneux,
2.5 Spektrofotometri
Spektrofotometri merupakan suatu metode pengukuran energi radiasi atau
intensitas sinar yang terserap oleh larutan. Spektrofotometri UV-Vis (Ultra
Violet-Visibel) adalah salah satu bentuk spektrofotometri absorbsi. Pada cara ini, cahaya
atau gelombang cahaya elektromagnetik (sinar UV-Vis) berinteraksi dengan zat
dan dilakukan pengukuran besarnya cahaya (gelombang elektromagnetik) yang
diabsorbsi (Benson, 1987).
Berdasarkan panjang gelombang spektrofotometer dibagi dua yaitu
spektrofotometer ultraviolet dengan panjang gelombang 200-400 nm,digunakan
untuk senyawa yang tidak berwarna dan spektrofotometri visibel (sinar tampak)
dengan panjang gelombang 400-800 nm, digunakan untuk senyawa yang
berwarna (Rohman, 2007).
Spektrofotometer pada dasarnya terdiri atas sumber cahaya,
monokromator, kuvet untuk zat yang diperiksa, detektor, penguat arus (amplifier)
dan alat ukur atau alat pencatat (recorder), seperti yang tertera pada gambar 2.6.1.
Gambar 2.5.1 Konstruksi dasar dari spektrofotometer
Keterangan : 1 = Sumber cahaya
2= Monokromator
3= Kuvet (tempat sampel)
4= Detektor
5= Amplifier
6 = Hasil
BAB III
METODE PENELITIAN
Jenis penelitian yang dilakukan adalah penelitian eksperimental. Metode
penelitian meliputi pengumpulan sampel, karakterisasi sampel, skrining dan
pengujian aktivitas antioksidan secara spektrofotometri visibel. Penelitian
dilakukan di Laboratorium Farmakognosi dan Laboratorium Penelitian Fakultas
Farmasi Universitas Sumatera Utara Medan.
3.1 Alat-alat
Alat-alat yang digunakan terdiri dari alat alat gelas, seperangkat alat
penetapan kadar air, kertas saring, aluminium foil, neraca kasar (Ohaus), neraca
analitis (Vibra), oven listrik (Stork), Spektrofotometer UV-Visibel (Shimadzu),
penangas air dan eksikator.
3.2 Bahan-bahan
Bahan yang digunakan dalam penelitian adalah madu dari hutan Lhoknga,
Montasik dan Sare. Bahan-bahan kimia adalah 1,1-diphenyl-2-picrylhydrazyl
(DPPH) (Sigma), Butylated Hydroxytoluen (BHT) (Sigma), metanol, serbuk Mg,
amil alkohol, α-naftol, asam nitrat pekat, natrium sitrat, natrium karbonat,
tembaga (II) sulfat, resrsinol, asam klorida pekat dan air suling.
3.3 Pengumpulan Sampel
Madu yang di gunakan diperoleh dari hutan Lhoknga, hutan Montasik dan
3.4 Pembuatan Pereaksi 3.4.1 Pereaksi Molish
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N hingga diperoleh
larutan 100 ml (Ditjen POM, 1995).
3.4.2 Pereaksi Benedict
Sebanyak 34,6 g natrium sitrat dan 20 g natrium karbonat dilarutkan dalam
180 ml air suling diaduk dan di saring, kemudian di tambahkan 3,46 g tembaga
(II) sulfat dalam 20 ml kemudian ditambahkan air suling sampai 200 ml (Ditjen
POM, 1995).
3.4.3 Pereaksi Benedict
Sebanyak 1 g resorsinol dilarutkan dalam asam klorida pekat, kemudian
dicukupkan volumenya sampai 100 ml (Ditjen POM, 1995).
3.4.4 Larutan DPPH 0,5 mM
Sebanyak 20 mg DPPH ditimbang kemudian dilarutkan dalam metanol
hingga volume 100 ml (Molyneux, 2004).
3.5 Pemeriksaan Karakteristik Sampel
Pemeriksaan karakteristik sampel meliputi pemeriksaan makroskopik,
mikroskopik, penetapan kadar air, penetapan kadar abu total dan penetapan kadar
abu yang tidak larut dalam asam.
3.5.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan terhadap madu meliputi pemeriksaan
3.5.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap madu untuk melihat butir
butir serbuk sari yaitu dengan cara meneteskan madu di atas objek glass lalu
ditutupi dengan kaca penutup kemudian diamati di bawah mikroskop.
3.5.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
Cara kerja:
1. Penjenuhan Toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu
alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2
jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume
air dalam tabung penerima dibaca skalanya.
2. Penetapan Kadar Air Sampel
Ke dalam labu yang berisi toluen jenuh diatas, dimasukkan 5 g madu yang
telah ditimbang seksama, labu dipanaskan hati-hati selama 15 menit. Setelah
toluen mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian
besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap
detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan
toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan
mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume
air dibaca. Selisih kedua volume air dibaca sesuai dengan kandungan air yang
terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (SNI, 2010)
3.5.4 Penetapan Kadar Abu Total
telah dipijar di dalam oven pada suhu 105ºC selama 30 menit dan ditara,
diratakan. Krus dipijarkan perlahan-lahan sampai arang habis, pemijaran
dilakukan pada suhu 500-600ºC sampai bobot tetap. Kemudian didinginkan dan
ditimbang. Kadar abu total dihitung dalam persen (SNI, 2010).
3.5.5 Penetapan Kadar Abu yang Tidak Larut dalam Asam
Abu yang diperoleh pada penetapan kadar abu total dididihkan dengan 25
ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring bebas abu, kemudian dicuci dengan
air panas. Residu dan kertas saring dikeringkan dalam oven pada suhu 105ºC
selama 30 menit lalu dipijar pada suhu 500-600ºC sampai bobot tetap, kemudian
didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung
dalam persen (SNI, 2010).
3.6 Skrining Madu
3.6.1 Pemeriksaan Flavonoid
Sebanyak 10 g madu ditambah 100 ml air panas, dididihkan selama 5
menit dan disaring dalam keadaan panas. Ke dalam 5 ml filtrat ditambahkan 0,1 g
serbuk Mg, 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan
memisah. Flavonoid positif jika pada lapisan amil alkohol terjadi warna merah
kekuningan atau jingga (Farnsworth, 1966).
3.6.2 Pemeriksaan Sukrosa
Sebanyak 5 ml madu di masukkan kedalam tabung reaksi, lalu
ditambahkan 2 tetes pereaksi Molish di campur rata, kemudian di tambahkan 3 ml
asam sulfat pekat secara perlahan lahan melalui dinding tabung, cincin ungu yang
3.6.3 Pemeriksaan Glukosa
Sebanyak 5 ml pereaksi benedict dimasukkan dalam tabung reaksi,
kemudian di tambahkan 8 tetes larutan madu di campur rata dan didihkan selama
5 menit, biarkan samapai dingin kemudian di amati perubahan warnanya, jika
terbentuk endapan merah bata menunjukkan reaksi postif (Gunawan, 2004).
3.6.4 Pemeriksaan Fruktosa
Masukkan 0,5 mL larutan madu ke dalam tabung reaksi, tambahkan 5 mL
pereaksi Seliwanoff, campur dan letakkan tabung di dalam penangas air mendidih
selama 60 detik, jika terbentuk warna merah menunjukkan reaksi positif
(Gunawan, 2004).
3.7 Pengujian Kemampuan Antioksidan Dengan Spektrofotometri Visibel 3.7.1 Prinsip Metode DPPH
Kemampuan sampel uji dalam meredam proses oksidasi DPPH
(1,1-diphenyl-2-picryl-hydrazil) sebagai radikal bebas dalam larutan metanol (sehingga
terjadi perubahan warna DPPH dari ungu menjadi kuning) dengan nilai IC50
(konsentrasi sampel uji yang mampu meredam radikal bebas 50%) digunakan
sebagai parameter untuk menentukan aktivitas antioksidan sampel uji.
3.7.2 Pengukuran Larutan DPPH
Timbang 20 mg DPPH kemudian dilarutkan dalam metanol hingga
volume 100 ml untuk mendapatkan Larutan DPPH 0,5 mM . Dipipet sebanyak 5
ml, kemudian dimasukkan ke dalam labu tentukur 25 ml, dicukupkan dengan
metanol sampai garis tanda. Pengukuran dilakukan setelah didiamkan selama 60
3.7.3 Pembuatan Larutan Induk
Sebanyak 500 mg sampel uji (madu) ditimbang, dimasukkan ke dalam
labu 50 ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan
metanol sampai garis tanda (konsentrasi 10.000 µg/ml).
3.7.4 Pengukuran Aktivitas Antioksidan Sampel Uji
Larutan induk dipipet sebanyak 7,5 ml dan 10 ml dan 12,5 ml ke dalam
labu tentukur 25 ml untuk mendapatkan konsentrasi larutan uji 3000 µg/ml, 4000
µg/ml dan 5000 µg /ml. Ke dalam masing-masing labu tentukur ditambahkan 5 ml
larutan DPPH 0,5 mM lalu volumenya dicukupkan dengan metanol sampai garis
tanda. Pengukuran dilakukan setelah didiamkan selama 60 menit pada panjang
gelombang 516 nm.
3.7.5 Pengukuran Aktivitas Antioksidan BHT
Sebanyak 25 mg BHT ditimbang, dimasukkan ke dalam labu tentukur 25
ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan metanol sampai
garis tanda. Dipipet sebanyak 0,5 ml; 1 ml; dan 1,5 ml ke dalam labu tentukur 25
ml untuk mendapatkan konsentrasi larutan uji 20 µg/ml, 40 µg/ml dan 60 µg/ml.
Ke dalam masing-masing labu tentukur ditambahkan 5 ml larutan DPPH 0,5 mM
lalu volumenya dicukupkan dengan metanol sampai garis tanda. Pengukuran
dilakukan setelah didiamkan selama 60 menit pada panjang gelombang 516 nm.
3.7.6 Penentuan Persen Peredaman
Penentuan aktivitas penangkap radikal bebas dari sampel uji menggunakan
metode DPPH. Pengukuran dilakukan setelah didiamkan selama 60 menit.
Nilai serapan larutan DPPH sebelum dan sesudah penambahan ekstrak tersebut
% inhibisi =
kontrol sampel kontrol
A
) A
(A −
X 100%
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
B A B IV
HASIL DAN PEMBAHASAN
4.1 Hasil Karakterisasi
Hasil pemeriksaan makroskopik dilakukan terhadap ketiga madu hutan
Lhoknga, Montasik dan Sare merupakan cairan kental, berwarna coklat
kemerahan, coklat kekuningan, coklat kekuningan tua, mempunyai bau dan rasa
yang khas. Hasil pemeriksaan mikroskopik dilakukan terhadap madu
menunjukkan adanya butir butir serbuk sari. Hasil penetapan kadar air, kadar abu
total dan kadar abu yang tidak larut dalam asam dapat dilihat pada table 4.1.
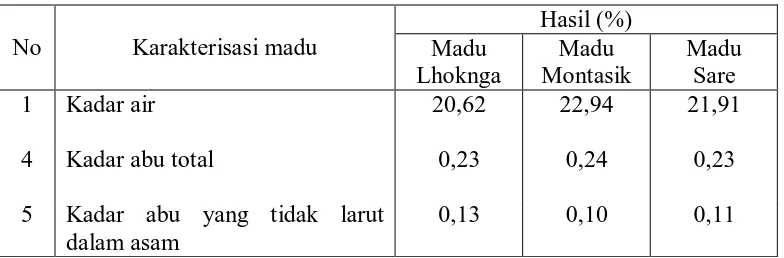
Tabel 4.1 Hasil karakterisasi madu
No Karakterisasi madu
Hasil (%) Madu
Lhoknga
Madu Montasik
Madu Sare
1 Kadar air 20,62 22,94 21,91
4 Kadar abu total 0,23 0,24 0,23
5 Kadar abu yang tidak larut dalam asam
0,13 0,10 0,11
Karakteristik madu telah terdapat dalam Standar Nasional Indonesia.
Persyaratan umum pada Standar Nasional Indonesia yaitu kadar air tidak lebih
dari 22% dan kadar abu tidak lebih dari 0,5%. Hasil penetapan kadar air dan kadar
abu memenuhi persyaratan pada Standar Nasional Indonesia. Kadar abu total
dilakukan untuk mengetahui jumlah senyawa anorganik pada madu, sedangkan
kadar abu yang tidak larut dalam asam dilakukan untuk mengetahui senyawa
4.2 Hasil Skrining
Hasil skrining terhadap madu diketahui bahwa madu mengandung
senyawa-senyawa seperti yang terlihat pada tabel berikut:
Tabel 3.2 Hasil skrining madu hutan Lhoknga, Montasik dan Sare
No Pemeriksaan Hasil
1 Flavonoid +
2 Fruktosa +
3 Glukosa +
4 Sukrosa +
Hasil skrining madu menunjukkan bahwa madu mengandung fruktosa,
glukosa dan sukrosa serta senyawa kimia golongan flavonoid. Selain flavonid
madu juga mengandung vitamin A, vitamin C, vitamin E asam organik, enzim,
asam fenolat, flavonoid dan beta karoten yang diketahui dapat bertindak sebagai
antioksidan yaitu sebagai penangkap radikal bebas karena gugus hidroksil yang
dikandungnya mendonorkan hidrogen kepada radikal bebas (Silalahi, 2006).
4.3 Hasil Pengukuran Aktivitas Antioksidan
Pemeriksaan aktivitas anti radikal bebas DPPH secara spektrofotometri
dilakukan dengan mereaksikan sampel dengan larutan pereaksi DPPH 0,5 mM.
Pengukuran aktivitas antioksidan madu dengan konsentrasi masing-masing 3000
µg/ml, 4000 µg/ml dan 5000 µg/ml yang dibandingkan dengan BHT konsentrasi
20 µg/ml sebagai kontrol larutan pereaksi DPPH 0,5 mM (tanpa penambahan
sampel). Hasil pengukuran aktivitas antioksidan madu hutan Lhoknga, hutan
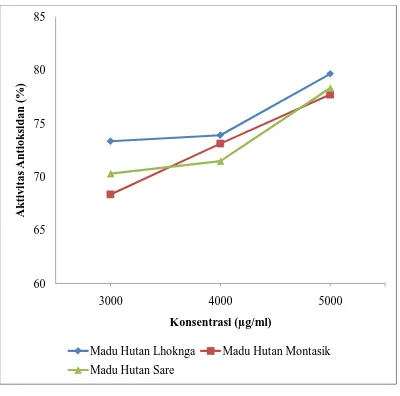
Tabel 4.3.1 Data aktivitas antioksidan madu hutan Lhoknga, Montasik dan Sare serta BHT
Larutan Uji
Aktivitas antioksidan (%) pada konsentrasi
3000 µg/ml 4000 µg/ml 5000 µg/ml
Madu hutan Lhoknga 73,34 73,89 79,66
Madu hutan Montasik 63,36 68,88 74,18
Madu hutan Sare 65,58 67,17 75,06
Pembanding 20 µg/ml 40 µg/ml 60 µg/ml
BHT 74,46 83,31 86,87
Data tersebut menunjukkan adanya peningkatan aktivitas antioksidan pada
ketiga madu dengan konsentrasi yang berbeda. BHT sebagai pembanding dengan
konsentrasi 20µg/ml menunjukkan aktivitas antioksidan yang hampir sama
dibandingkan dengan ketiga madu pada konsentrasi 5000 µg/ml.
Adanya perbedaan aktivitas antioksidan dari madu hutan Lhoknga,
Montasik dan Sare dapat disebabkan karena sumber nektar ketiga madu tersebut
berbeda sehingga komposisi senyawanya berbeda dan menghasilkan aktivitas
antioksidan yang berbeda pula. Pernyataan ini didukung oleh Parwata yang
menyatakan bahwa tiap jenis madu memang memiliki efek antioksidan yang
berbeda-beda dimana jumlah dan kandungan antioksidannya sangat tergantung
dari sumber nektarnya (Parwata, 2010). Hasil tersebut dapat dilihat pada gambar
Gambar 4.3.1 Grafik konsentrasi vs aktivitas antioksidan madu hutan Lhoknga,
Montasik dan Sare setelah didiamkan selama 60 menit
Gambar diatas menunjukkan adanya peningkatan aktivitas antioksidan
dari madu hutan Lhoknga, Montasik dan sare. Dimana aktivitas antioksidan
masing-masing madu pada konsentrasi 5000µg/ml lebih besar dibandingkan
dengan konsentrasi 4000µg/ml dan 3000µg/ml. Peningkatan aktivitas antioksidan
ini mempunyai arti bahwa telah terjadinya penangkapan radikal DPPH oleh madu.
Antioksidan pada madu bersumber dari vitamin A, vitamin C, vitamin E asam
organik, enzim, asam fenolat, flavonoid dan beta karoten yang terkandung di
dalam madu.
Madu Hutan Lhoknga Madu Hutan Montasik
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Hasil pemeriksaan makroskopik dilakukan terhadap ketiga madu hutan
Lhoknga, Montasik dan Sare merupakan cairan kental, berwarna coklat
kemerahan, coklat kekuningan, coklat kekuningan tua,, mempunyai bau
dan rasa yang khas. Hasil pemeriksaan mikroskopik menunjukkan adanya
butir butir serbuk sari. Kadar air, kadar abu total dan kadar abu yang tidak
larut dalam asam masing masing madu yang diperoleh memenuhi
persyaratan Standar Nasional Indonesia.
2. Hasil uji aktivitas antioksidan ketiga madu pada konsentrasi 5000 µg/ml
menunjukkan aktivitas antioksidan yang hampir sama dibandingkan BHT
pada konsentrasi20 µg/ml.
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk melakukan penelitian lebih
DAFTAR PUSTAKA
Anonim a. (2009). Madu Secara Umum. http//www.digilib.petra.ac.id/madu-chapter2. (Diakses 28 September 2010)
Anonim b. (2009). Khasiat Madu Bagi Kesehatan. http://www.voa-islam. com/health. (Diakses 22 Agustus 2010)
Anonim. (2010). Madu Makanan Yang Lengkap Menjadi Obat Untuk Berbagai
Jenis Penyakit
2010)
Badan Standarisasi Nasional Indonesia. (2010). Standar Nasional Indonesia Madu
01-3545-2004. Jakarta (Diakses 22 September 2010)
Benson, Harry. (1987). Principles of Chemical Instrumentation. W.B Saunders Company. West Washington. Pages 34
Bruce, R. (2005). Antioxidant In Australia Floral Honeys – Identification of Health-enhanching nutrient components. Journal of Aglicultural an
Food Chamistry
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Departemen Kesehatan RI. Jakarta. Halaman 1132-1140
Farnsworth, N.R. (1996). Biological and Phytochemical Screening of Plants,
Journal of Pharmaceutical Sciences. Volume 55. No.3. Reheis Chemical
Company. Chicago: Pages 263
Gheldof, N., Wang, XH., Engeseth, N.J. (2002). Identification and Quantification of Antioxidant of Honeys from Various Floral Source. Journal of
Aglicultural an Food Chamistry
Gunawan, D dan Mulyani, S. (2004). Ilmu Obat Alam. Jilid 1. Jakarta: Penebar Swadaya. Halaman 24-35
Harborne, J.B. (1987). Metode Fitokimia, Penuntun Cara Modern Menganalisa
Tumbuhan. Terjemahan K.Padmawinata. Edisi II. Bandung: ITB Press.
Halaman 76
Kosasih, E; Setiabudi, T. (2004). Peran Antioksidan pada Lanjut Usia. Jakarta: Pusat Pusat Kajian Nasional Masalah Lanjut Usia. Halaman 42-75
Kumalaningsih, S. (2006). Antioksidan Alami. Cetakan I. Surabaya: Trubus Agrisarana. Halaman 16-25
Molyneux, P. (2004). The use of the stable free radical diphenylpicrylhydrazyl
(DPPH) for estimating antioxidant activity. Songklanakarin J. Sci.
Parwata, A., Ratnayani, K., dan Listya, A. (2010). Aktivitas Antiradikal Bebas Serta Kadar Beta Karoten Pada Madu Randu (Ceiba Pentandra) Dan Madu Kelengkeng (Nephelium Longata L.). Jurnal Kimia FMIPA
Universitas Udayana
Rohman, A. (2007). Kimia Farmasi Analis. Yogyakarta: Pustaka Pelajar. Halaman 220-264
Sarwono, B. (2001). Lebah Madu. Jakarta: Agromedia Pustaka. Halaman 61-62, 68-69.
Sihombing, D. T. H. (1997). Lebah Madu. Yogyakarta: Gadjah Mada University Press. Halaman 28, 32, 93.
Silalahi, J. (2006). Makanan Fungsional. Yogyakarta: Penerbit Kanisius. Halaman 38-55
Sukrosa Fruktosa Madu
(Hutan Lhoknga, Montasik dan Sare)
Karakterisasi Skrining Uji Aktivitas
Antioksidan
Penetapan kadar air
Flavonoid
Penetapan kadar abu tidak larut dalam asam
Hasil
Penetapan kadar abu total Pemeriksaan makroskopik
Pemeriksaan mikroskopik
Glukosa
Lampiran 1. Gambar Bagan Kerja Penelitian
Lampiran 2. Gambar Daerah Pengambilan Madu
1 2 3
Keterangan :
1. Hutan Lhoknga
2. Hutan Montasik
Lampiran 4. Gambar Mikroskopik Madu
Serbuk sari dari masing masing madu
1. Madu Hutan Lhoknga
2. Madu Hutan Montasik
Lampiran 5. Hasil Perhitungan Karakteristik Madu
1. Perhitungan Kadar Air
% Kadar Air
1. Madu hutan Lhoknga
Berat Sampel : 5,013 g
2. Madu hutan Montasik
Lampiran 5. (lanjutan)
2. Perhitungan Kadar Sari yang Larut dalam Air
% Kadar Sari yang Larut dalam Air = x 100%
1. Madu hutan Lhoknga
Berat sampel = 5,013 g
2. Madu hutan Montasik
Lampiran 5. (lanjutan)
3. Perhitungan Kadar Sari yang Larut dalam Etanol
% Kadar Sari yang Larut dalam Etanol = x 100%
1. Madu hutan Lhoknga
Berat sampel = 5,013 g
2. Madu hutan Montasik
Lampiran 5. (lanjutan)
4. Perhitungan Kadar Abu Total
% Kadar Abu Total = x 100%
1. Madu hutan Lhoknga
Berat sampel = 2,0004 g
2. Madu hutan Montasik
Lampiran 5. (lanjutan)
5. Perhitungan Kadar Abu yang Tidak Larut dalam Asam
% Kadar Abu yang Tidak Larut dalam Asam = x 100%
1. Madu hutan Lhoknga
Berat sampel = 2,0004 g
2. Madu hutan Montasik
Lampiran 7. Data absorbansi dan % inhibisi madu hutan Lhoknga, Montasik,
Sare dan BHT setelah didiamkan selama 60 menit
1. Data absorbansi dan % inhibisi madu hutan Lhoknga
Konsentrasi Larutan Uji
Absorbansi Pengukuran ke-
Rata-rata
2. Data absorbansi dan % inhibisi madu hutan Montasik
Konsentrasi Larutan Uji
Absorbansi Pengukuran ke-
Rata-rata
3. Data absorbansi dan % inhibisi madu hutan Sare
Konsentrasi Larutan Uji
Absorbansi Pengukuran ke-
4. Data absorbansi dan % inhibisi BHT
Konsentrasi Larutan Uji
Absorbansi Pengukuran ke-
Rata-rata Absorbansi
Persen Inhibisi
(%)
1 2 3
DPPH 0,1 mM
BHT 20 µg/ml
1,110
0,292
1,113
0,284
1,113
0,275
1,112
0,284 74,46
BHT 40 µg/ml 0,193 0,190 0,174 0,186 83,31
Lampiran 8. Perhitungan % inhibisi madu hutan Lhoknga, Montasik, Sare dan
BHT setelah didiamkan selama 60 menit
1. Madu hutan Lhoknga
Konsentrasi 3000 µg/ml
% inhibisi = ( )x100%
Konsentrasi 4000 µg/ml
% inhibisi = ( )x100%
Konsentrasi 5000 µg/ml
% inhibisi = ( )x100%
2. Madu hutan Montasik
Konsentrasi 3000 µg/ml
Konsentrasi 4000 µg/ml
Konsentrasi 5000 µg/ml
% inhibisi = ( )x100%
Konsentrasi 3000 µg/ml
% inhibisi = ( )x100%
Konsentrasi 5000 µg/ml
4. BHT
Konsentrasi 20 µg/ml
% inhibisi = ( )x100%
Konsentrasi 40 µg/ml
% inhibisi = ( )x100%
Konsentrasi 60 µg/ml