Lampiran 3. Bagan proses pembuatan kapsul Penimbangan Pengeringan Avicel Pencampuran Karantina produk antara
Pengisian ke cangkang kapsul Kelembaban maks. 50%
Karantina produk ruahan Seleksi Pengemasan Karantina produk Gudang Obat Finished pack analysis IPC: - Pemerian - Ukuran
- Bobot 50 kapsul kosong
- Warna
- Bobot rata-rata 10 kapsul
- Waktu hancur IPC:
- Pemerian - LOD
IPC: - Pemerian
- Kadar zat berkhasiat - LOD
IPC: - Pemerian - Bobot rata-rata - Identifikasi - Waktu hancur - Disolusi
Lampiran 4. Proses pembuatan krim Penimbangan Pencampuran dengan vacuum homogenizer Peleburan bahan dasar krim/salep Pelarutan zat aktif, pengawetan
Pencampuran zat berkhasiat dengan mikser
Karantina produk antara
Pengisian ke tube
Karantina produk ruahan
IPC
- Pemerian - pH
- Stabilitas krim
Pengemasan IPC - Pemerian - Identifikasi - pH - Homogenitas - Stabilitas
- Kadar zat berkhasiat
IPC - Pemerian - Bobot rata-rata
- Simpangan baku relatif
Karantina produk IPC - Pemerian - Identifikasi - pH - Homogenitas - Bobot rata-rata
- Simpangan baku relatif - Kadar zat berkhasiat Gudang obat jadi
Lampiran 5. Bagan proses pembuatan tablet Penimbangan Granulasi Pengayakan Pengeringan dengan FBD Ruang Staging Lubrikasi/ Pencampuran akhir IPC: LOD
Karantina Produk Antara IPC:
• Pemerian • LOD • Kadar zat
berkhasiat
Karantina Produk Ruahan
Pengemasan Pencetakan IPC:
• Pemerian • Keseragaman
bobot
• Waktu hancur • Kekerasan • Friabilitas • Kadar zat
berkhasiat • Disolusi
IPC:
• Pemerian • Diameter • Keseragaman
bobot
• Waktu hancur • Kekerasan • Ketebalan • Friabilitas
Karantina Obat Jadi
Gudang Obat Jadi Finished Pack
DAFTAR PUSTAKA
Badan POM RI. (2012). Peraturan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia Nomor HK.03.1.33.12.12.8915 Tahun 2012 tentang Penerapan Pedoman Cara Pembuatan Obat yang Baik. Jakarta: Badan Pengawas Obat dan Makanan.
Badan POM RI.(2013). Petunjuk Operasional Penerapan Cara Pembuatan Obat Yang Baik.Jilid I. Jakarta: Badan Pengawas Obat dan Makanan.Hal.69-70,338,502-503,506.
Dirjen Binfar dan Alkes RI.(2011). Pedoman Pelayanan Perizinan Industri Farmasi. Jakarta: Direktorat Bina Produksi dan Distribusi Kefarmasian, Direktorat Jenderal Bina Kefarmasian dan Alat Kesehatan Kementerian Kesehatan RI. Hal. 4-5,8.
Kimia Farma. (2013). Operational Excellence: Laporan Tahunan 2014. Jakarta: PT. Kimia Farma Tbk. Hal. 7-8.
Kimia Farma.(2014).Visi dan Misi PT. Kimia Farma. Diakses 10 November 2015 http://www.kimia Farma.co.id/?page=general&id=0_2.
Kimia Farma.(2014).Sejarah Kimia Farma. Diakses 10 November 2015 http://www.Kimia Farma.co.id/?page=general&id=0_0_0.
Menkes RI. (1990). Surat Keputusan Menteri Kesehatan Nomor 245/Men.Kes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin Usaha Industri Farmasi. Jakarta: Departemen Kesehatan Republik Indonesia.
Menkes RI. (2010). Peraturan Menteri Kesehatan Republik Indonesia Nomor 1799/Menkes/Per/XII/2010 tentang Industri Farmasi. Jakarta: Departemen Kesehatan Republik Indonesia.
Presiden RI. (2009). Peraturan Pemerintah Republik Indonesia Nomor 51 tahun 2009 tentang Pekerjaan Kefarmasian. Jakarta: Presiden Republik Indonesia. Priyambodo, B. (2007). Manajemen Farmasi Industri. Yogyakarta: Global
BAB III
TINJAUAN PT. KIMIA FARMA (Persero) Tbk.
3.1 Tinjauan Umum PT. Kimia Farma (Persero) Tbk. 3.1.1 Sejarah Perusahaan
PT. Kimia Farma (Persero) Tbk. Plant Medan adalah unit produksi yang memproduksi obat-obatan. Distribusi obat-obatan PT. Kimia Farma (Persero) Tbk. Plant Medan dikelola oleh Unit Logistik Sentral yang ada di Jakarta. PT. Kimia Farma (Persero) Tbk. Plant Medan yang merupakan Badan Usaha Milik Negara (BUMN) dibentuk sebagai Perusahaan pada tanggal 16 Agustus 1971. Sejak berdiri hingga sekarang ini, PT.Kimia Farma (Persero) Tbk telah mengalami beberapa perubahan yaitu:
A. Periode I (1957-1959)
Periode ini adalah periode dimana pemerintah melaksanakan nasionalisasi perusahaan farmasi milik bangsa Belanda yang ada di Indonesia. Program nasionalisasi ini dikoordinasi oleh Badan Pengambil Alihan Perusahaan Farmasi (BAPPHAR). Adapun perusahaan farmasi milik Belanda tersebut yaitu: 1. NV. Rathkamp dan NV Bavosta di Jakarta.
2. NV. Bandoengsche Kinine Fabriek di Bandung. 3. NV. Ordeniming Iodium Watudakon di Mojokerto. 4. NV. Industri Tella di Surabaya.
5. CV. Apotek Malang di Malang.
B. Periode II (1960-1968)
Periode ini adalah periode pembentukan Perusahaan Negara Farmasi (PNF) dari perusahaan-perusahaan farmasi milik Belanda yang telah dinasionalisasikan sebelumnya. Pembentukan PNF ini berdasarkan PP Nomor 60/1961 dibawah koordinasi Badan Pimpinan Umum Farmasi Negara sebagai peleburan BAPPHAR yang bernaung dibawah Departemen Kesehatan.
Perusahaan-perusahaan yang didirikan adalah: 1. PNF. Radja Farma (ex. Rathkamp) di Jakarta. 2. PNF.Nurani Farma (ex. Van Gorkom) di Jakarta. 3. PNF. Nakula Farma (ex. Bavosta) di Jakarta. 4. PNF. Bhinneka Kina Farma di Bandung
5. PNF. Sari Husana (ex. Sari Delle) di Yogyakarta. 6. PNF. Kasa Husada (ex. Varbanstaffen) di Surabaya. 7. PNF. Biofarma (ex. Pasteur Institute) di Bandung. C. Periode III (1969-1970)
Untuk meningkatkan efisiensi setiap BUMN, dikeluarkan Instruksi Presiden Nomor 17/1967 sehingga Departemen Kesehatan melebur perusahaan-perusahaan milik negara tersebut ke dalam perusahaan-perusahaan Negara Farmasi dan Alat-alat Kesehatan Bhinneka Kimia Farma, PNF Kasa Husada di Surabaya diubah menjadi perusahaan umum dan perusahaan daerah, kemudian PNF Sari Husada di Yogyakarta berdiri sendiri sebagai anak perusahaan.
D. Periode IV (1971-2001)
Farmasi dan Alat-alat Kesehatan Bhinneka Kimia Farma setelah melalui proses audit dinyatakan lulus untuk menjadi Perseroan Terbatas (PT) yang selanjutnya disahkan pada tanggal 16 Agustus 1971 sebagai PT. Kimia Farma (Persero) dengan Akta Notaris dan diumumkan dalam lembaran berita negara.
E. Periode V (2001-sekarang)
Pada periode ini tepatnya tanggal 28 Juni 2001 PT. Kimia Farma (Persero) menjadi perusahaan terbuka (Tbk) dengan nama PT. Kimia Farma (Persero) Tbk. dimana untuk privatisasi tahap I saham yang lepas adalah sebanyak 9% dengan rincian 3% untuk program Kepemilikan Saham Karyawan dan Manajemen (KSKM) PT. Kimia Farma, dan sebanyak 6% untuk masyarakat umum.
Kimia Farma Tbk. adalah Badan Usaha Milik Negara (BUMN) yang dipimpin oleh Direktur Utama yang membawahi empat direktur, yaitu Direktur Umum dan Personalia, Direktur Pemasaran, Direktur Keuangan, dan Direktur Produksi. Pada tanggal 4 Januari 2003, PT. Kimia Farma Tbk. Melepas divisi Apotek dan PBF menjadi dua anak perusahaan, yaitu Apotek Kimia Farma menjadi PT. Kimia Farma Apotek dan PBF Kimia Farma menjadi PT.Kimia Farma Trading and Distribution (Kimia Farma, 2013).
3.1.2 Visi dan Misi Perusahaan A. Visi perusahaan
B. Misi perusahaan
Menghasilkan pertumbuhan nilai korporasi melalui usaha di bidang-bidang:
1. Industri kimia dan farmasi dengan basis penelitian dan pengembangan produk yang inovatif.
2. Perdagangan dan jaringan distribusi.
3. Pelayanan kesehatan yang berbasis jaringan retail farmasi dan jaringan pelayanan kesehatan lainnya.
4. Pengelolaan aset-aset yang dikaitkan dengan pengembangan usaha perusahaan.
3.1.3 Struktur Organisasi
PT. Kimia Farma dipimpin oleh seorang Direktur Utama sebagai pimpinan tertinggi yang bertugas memimpin seluruh direktorat yang bersifat operasional (produksi dan pemasaran) maupun yang bersifat penunjang (keuangan dan umum) dan bertanggung jawab kepada dewan komisaris. Direktur utama dibantu oleh 4 direksi yaitu:
1. Direktur Produksi dan Supply Chain
Meliputi: Plant Jakarta, Plant Bandung, Plant Watudakon Surabaya, Plant Medan, Plant Semarang, unit logistik sentral, riset pengembangan dan pengadaan.
2. Direktur Pengembangan Bisnis
3. Direktur Keuangan
Meliputi: keuangan corporate, akutansi corporate, anggaran dan investasi serta teknologi informasi.
4. Direktur Umum dan Human Capital
Meliputi: Sumber Daya Manusia, aset dan properti, pengadaan dan umum corporate.
3.1.4 Production Plant
A. Plant Jakarta, DKI Jakarta
Satu-satunya pabrik di Indonesia yang ditugaskan pemerintah untuk memproduksi obat golongan narkotika dan memproduksi ARV lini I & II. Memperoleh sertifikat Cara Pembuatan Obat yang Baik (CPOB), ISO-9001, dan mendapat rating “A” dari Badan POM. Mendapatkan Proper Biru dalam pengolahan limbah dari KLH dan penghargaan Gubernur DKI untuk Ketaatan & Kinerja Pengelolaan Lingkungan.
B. Plant Bandung, Jawa Barat
C. Plant Semarang, Jawa Tengah
Khusus memproduksi minyak jarak, minyak nabati, dan kosmetika (bedak).Telah menerapkan sistem manajemen mutu ISO-9001 dan mendapatkan sertifikat Cara Pembuatan Kosmetika yang Baik (CPKB).
D. Plant Watudakon, Jombang, Jawa Timur
Satu-satunya pabrik pengolah tambang iodium di Indonesia.Telah mendapatkan sertifikat CPOB serta ISO-9001 dan ISO 14001. Memproduksi bahan baku ferro sulfat sebagai bahan utama pembuatan tablet besi untuk obat penambah darah, serta kapsul lunak “yodiol”. Juga memproduksi obat dalam sediaan tablet, tablet salut, salep, sirup, dan cairan obat luar/dalam.
E. Plant Tanjung Morawa, Sumatera Utara
Memasok kebutuhan obat di wilayah Sumatera. Mendapatkan sertifikat Cara Pembuatan Obat yang Baik (CPOB) serta mendapat rating “A” untuk sertifikasi dari Badan POM. PT. Kimia Farma (Persero) Tbk Plant Medan telah mendapatkan sertifikat ISO 9001:2008 mengenai Sistem Manajemen Mutu untuk Pembuatan Produk Farmasi yang mulai berlaku sejak tanggal 7 Januari 2011 sampai 17 Januari 2017.
3.1.5 Produk-produk
Produk-produk yang dihasilkan perusahaan ini adalah: 1. Produk Ethical.
2. Produk Over The Counter (OTC). 3. Produk Generik Berlogo.
4. Produk lisensi dari beberapa perusahaan asing yaitu: Sankyo (Jepang), Heinrich (Jerman), dan Solvay Duphar (Belanda).
5. Produk kontrasepsi.
6. Produk-produk penugasan pemerintah (narkotika). 7. Produk Fitofarmaka.
3.2 Tinjauan Khusus PT. Kimia Farma (Persero) Tbk. Plant Medan 3.2.1 Personalia
Personalia pada PT. Kimia Farma (Persero) Tbk. Plant Medan per Januari 2014 berjumlah 56 orang yang berstatus pegawai tetap dan 33 orang pegawai tidak tetap. Susunan pegawai tetap menurut tingkat pendidikan yaitu apoteker 5 orang, sarjana (S1) 10 orang, sarjana muda (D3) 12 orang, SAA 3 orang, SMA 35 orang, SMP 7 orang dan SD 16 orang.
PT. Kimia Farma (Persero) Tbk. Plant Medan dipimpin oleh seorang Plant Manager yang membawahi:
• Bagian Perencanaan Produksi dan Pengendalian Inventori, terdiri dari:
- Supervisor Pengendalian Bahan dan Proses Produksi
Nissan • Bagian Produksi, yang terdiri dari :
- Supervisor Pengolahan Krim dan Pengemasan Krim
- Supervisor Pengemasan Sekunder
- Supervisor Pengolahan Tablet dan Kapsul • Bagian Pemastian Mutu, yang terdiri dari :
- Supervisor Sistem Mutu • Supervisor Pengawasan Mutu
• Supervisor Pembelian
• Supervisor Teknik dan Pemeliharaan
• Supervisor Umum dan Sumber Daya Manusia • Supervisor Akuntansi dan Keuangan
3.2.2 Letak dan Lokasi
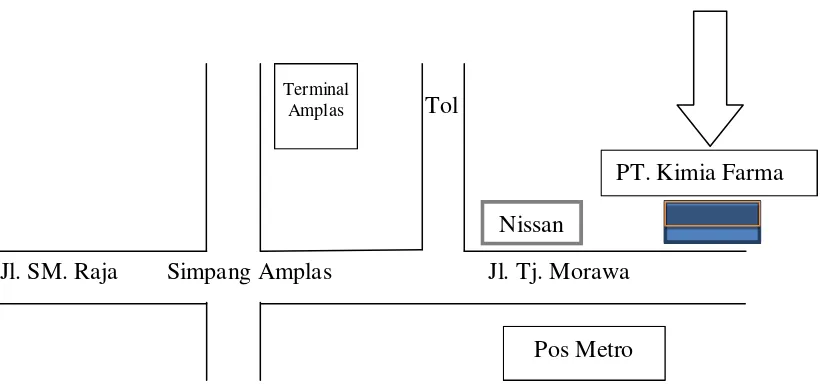
PT. Kimia Farma (Persero) Tbk. Plant Medan terletak di Jalan Raya Tanjung Morawa Km. 9 No. 59, Medan. Denah lokasi PT. Kimia Farma (Persero) Tbk. Plant Medan ditunjukkan pada Gambar 3 berikut ini.
Tol
Jl. SM. Raja Simpang Amplas Jl. Tj. Morawa
PT. Kimia Farma Terminal
Amplas
[image:14.595.118.530.515.711.2]3.2.3 Bangunan dan Fasilitas
PT. Kimia Farma (Persero) Tbk. Plant Medan terletak di Jalan Raya Tanjung Morawa Km. 9 No.59, Medan, dengan luas 19.000 m2
a. Ruang perkantoran
yang terdiri dari fasilitas:
b. Ruang laboratorium pengawasan mutu c. Ruang produksi
d. Ruang pengemasan
e. Ruang penyimpanan bahan baku f. Ruang penyimpanan bahan kemas g. Ruang penyimpanan etiket
h. Ruang penyimpanan obat jadi
i. Ruang penolakan bahan baku, bahan kemas dan obat jadi
j. Bangunan penunjang seperti tempat pencucian, dapur, klinik, mushola, bengkel dan tempat olahraga.
Ruang produksi PT. Kimia Farma (Persero) Tbk. Plant Medan telah dibuat sesuai dengan persyaratan CPOB dimana aliran proses dirancang mengalir sehingga menghindari kontaminasi selama proses produksi. Lantai, dinding dan langit-langit memiliki permukaaan licin dan tidak terdapat sambungan dilapisi dengan epoksi. Area produksi untuk masing–masing bentuk sediaan terletak secara terpisah.
loop system dan sistem udara tekan (air compressor) yang dilengkapi air dryer, oil and solid filter.
PT. Kimia Farma Plant (Persero) Tbk. Plant Medan juga memiliki gudang penyimpanan yang dilengkapi AC untuk menjaga suhu dan kelembaban ruangan. Ada pun ruangan di gudang penyimpanan antara lain:
1. Ruang karantina bahan baku. Ruang penimbangan Ruang sampling
2. Ruang bahan baku
Ruang bahan baku I Ruang bahan baku II
3. Ruang bahan kemas
Ruang bahan kemas I Ruang bahan kemas II
4. Ruang produk jadi
Ruang produk jadi I Ruang produk jadi II
5. Ruang reject
3.2.4 Perencanaan Produksi dan Pengendalian Inventory (PPPI) Tugas dan fungsi dari PPPI yaitu :
1. Merencanakan dan menghitung kebutuhan bahan produksi 2. Membuat rencana produksi
5. Melakukan stock opname setiap akhir triwulan
Dasar perencanaan adalah pesanan marketing kantor pusat di Jakarta per triwulan. PPPI menghitung kebutuhan bahan baku dan kemasan yang dibutuhkan dengan memperhatikan stok bahan yang ada persediaan gudang, stok produksi ruahan atau produk setengah jadi dan stok produk jadi sehingga diketahui bahan yang akan dipesan, selanjutnya PPPI mengeluarkan Surat Permintaan Pembelian Bahan (SPPB) ditujukan kepada supervisor pembelian.
Pembelian membuat pesanan ke pengadaan kantor pusat di Jakarta atau pengadaan langsung dari supplier di Medan. Bagian pembelian akan memilih pemasok yang paling murah tetapi memenuhi spesifikasi bahan yang diminta.
Barang pesanan yang datang diterima oleh bagian penyimpanan diarea penerimaan barang di sini dilakukan pemeriksaan kebersihan wadah barang, kecocokan nomor pesanan, jumlah, spesifikasi bahan yang diminta sesuai arsip pesanan. Bahan tersebut kemudian disimpan di area karantina dan diberi label status label kuning.
Selanjutnya petugas penyimpanan membuat surat permohonan periksa ke bagian pengawasan mutu untuk melakukan sampling dan pemeriksaan terhadap bahan tersebut. Bila barang tersebut memenuhi spesifikasi akan diberi label hijau disertai Hasil Pemeriksaan Laboratorium (HPL), jika tidak memenuhi spesifikasi diberi label merah dan HPL serta dikembalikan ke pihak pemasok.
Pengeluaran Bahan Baku (SPPBB) dan bahan pengemasan (SPPBK). SPK dibuat rangkap 4 dengan distribusi ke produksi, penyimpanan, laboratorium dan arsip.
Obat jadi yang selesai dikemas kemudian dikirim ke gudang penyimpanan obat jadi setelah finished pack analysis oleh petugas pemastian mutu. Obat jadi tersebut akan dikirimkan oleh PPPI ke Unit Logistik Sentral (ULS) Jakarta.
Tiap akhir bulan dilakukan penyesuaian stok bahan yang ada penyimpanan antara kartu stok dengan data komputer PPPI, sedangkan pada tiap akhir triwulan akan dilakukan stock opname.
3.2.5 Produksi
Produksi adalah semua kegiatan pembuatan mulai dari penerimaan bahan awal, pengolahan sampai menghasilkan obat jadi. Kegiatan produksi ini dilakukan di area tertutup dan tidak berhubungan langsung dengan bagian gudang ataupun perkantoran.
Tugas dari bagian produksi PT. Kimia Farma (Persero) Tbk. Plant Medan:
1. Melaksanakan pembuatan obat sesuai dengan surat perintah kerja (SPK) dari bagian PPPI, mulai dari permintaan bahan baku ke gudang, penimbangan, pengolahan, pengemasan, sampai pengiriman obat jadi ke gudang obat jadi sesuai dengan prosedur yang tertulis pada prosedur tetap (Protap).
2. Melaksanakan dokumentasi atas semua tindakan yang dilakukan selama proses pengolahan dan pengemasan dengan berpedoman pada Protap.
bersih, penutup kepala, mulut, dan mendesinfeksi tangan dengan desinfektan yang tersedia sebelum memakai sarung tangan. Juga dilakukan pemeriksaan oleh bagian pengawasa mutu meliputi kebersihan alat dan ruangan (line clearance) yaitu :
- Pemeriksaan kebersihan dan kesiapan alat/mesin • Label kalibrasi
• Label alat/mesin sudah dibersihkan
- Kebersihan dan kesiapan ruangan • Tidak ada produk sebelumnya
• Label ruangan sudah dibersihkan
- Kesesuaian dokumen
Hal-hal yang harus diperhatikan sebelum memulai kegiatan produksi:
1. Ruang produksi harus tetap terjaga kebersihan, di mana kegiatan pembersihan dilakukan tiap pagi sebelum dimulai kegitan produksi dan sore hari sesudah selesai kegitan produksi dan juga tidak ada sisa produk, label dari produk sebelumnya di ruang produksi.
2. Peralatan yang digunakan dipastikan selalu dalam keadaan bersih sebelum dan sesudah dilakukan kegiatan produksi.
3. Suhu dan kelembaban serta tekanan ruangan produksi telah sesuai dengan kualifikasi ruangan.
4. Ruangan produksi harus mendapat penerangan dan pertukaran udara yang cukup agar kegiatan produksi berjalan lancar.
6. Dokumen produksi (CPB) harus selalu mengikuti produk yang diolah.
Pengambilan bahan ke penyimpanan menggunakan CPB dan Surat perintah pengeluaran bahan baku dan bahan pengemas (SPPBB/SPPBK), petugas melakukan penimbangan dan menyerahan bahan sesuai dengan yang ditulis pada SPPBB/SPPBK tersebut.
Selama produksi berlangsung pelaksana produksi mencatat setiap tahapan produksi dalam Catatan Pengolahan Bets atau Catatan Pengemasan Bets serta setiap kendala yang ditemui selama produksi harus selalu dicatat yang bertujuan untuk dokumentasi produksi, sehingga bila terjadi kekeliruan ataupun kesalahan pada proses produksi, dapat segera diketahui pada proses mana kesalahan tersebut terjadi dan diambil tindakan untuk mengatasi permasalahan tersebut.
Laporan proses produksi membuat nama sediaan, nomor bets, besar bets, tahapan proses, operator, tanggal, jam, hasil, pengawasan yang berguna untuk mengetahui berapa lama waktu yang dibutuhkan untuk menghasilkan suatu bets sediaan. Laporan proses produksi ini diisi oleh petugas yang melakukan suatu tahapan proses produksi dan diketahui oleh supervisor produksi.
Area produksi PT. Kimia Farma (Persero) Tbk. Plant Medan terdiri dari: 1. Area Produksi Krim
Area ini telah memperoleh sertifikat CPOB. Area produksi ini terdiri dari beberapa ruangan dimana setiap ruangan diatur suhu, kelembaban dan tekanan udara dan pertukaran udara perjam sesuai dengan kualifikasi ruangan yang disyaratkan dalam CPOB dengan Air Handling System (AHS).
Adapun ruangan yang termasuk area produksi krim terdiri dari: a. Ruang penimbangan bahan.
Fungsi untuk menimbang bahan baku dan bahan tambahan sesuai dengan SPPB. Pada ruangan ini dilengkapi beberapa timbangan digital yang terkalibrasi, dilengkapi dust collector, Tekanan udara didesain negatif dari ruangan koridor. Ruang penimbangan ini dipakai untuk menimbang bahan sediaan krim, tablet dan kapsul.
b. Ruang penyimpanan bahan baku sisa penimbangan.
Bahan baku sisa penimbangan tidak dibolehkan dikembalikan ke ruang penyimpanan tapi harus ditempatkan dalam area penyimpanan khusus di area produksi. Tekanan udara ruang penyimpanan bahan baku sisa penimbangan didesain negatif dari ruangan koridor.
c. Ruang staging untuk bahan baku setelah penimbangan.
d. Ruang pencampuran krim.
Berfungsi untuk pembuatan massa krim, pada ruangan ini dilengakapi dengan mesin vacuum homogenizer kapasitas 120 kg, tangki double jacket kapasitas 100 liter dan oil tank kapasitas 40 kg, ruangan dilengkapi dust collector. Setiap tahapan dilakukan in process control meliput i pemeriksaan pemerian, pH, stabilitas, homogenitas dan pemeriksaan kadar zat berkhasiat massa krim. Tekanan udara ruang pencampuran krim didesain negatif dari ruangan koridor.
e. Ruang karantina produk antara.
Untuk penyimpanan sementara produk antara menunggu pemeriksaan mutu oleh pengawasan mutu. Tekanan udara ruang karantina produk antara negatif dibanding koridor
f. Ruang pengisian krim I.
Berfungsi untuk pengisian massa krim kedalam tube. Dilengkapi dengan mesin pengisian krim Elemech dengan kapasitas 3500 tube/jam dan timbangan digital untuk in process control. Tekanan udara ruang pengisian krim didesain positif dari ruangan koridor
g. Ruang pengisian krim II
dan simpangan baku relatif. Apabila memenuhi spesifikasi maka pengisian boleh dilanjutkan
h. Ruang karantina produk ruahan
Pada ruang ini disimpan produk ruahan untuk menunggu pemeriksaan laboratorium yang meliputi: pemerian, bobot rata-rata, simpangan baku relatif dan kadar zat berkhasiat. Produk ruahan yang telah selesai diperiksa oleh bagian pengemasan melalui pass box untuk dilakukan pengemasan sekunder.
2. Area Produksi Tablet
Area produksi ini telah memiliki sertifikat CPOB produksi tablet. Area produksi tablet terletak terpisah dari area produksi krim dan kapsul untuk menghindari terjadinya pencemaran silang. Pada area produksi tablet juga terdapat beberapa ruangan dimana setiap ruangan diatur suhu, kelembaban dan tekanan udara dan pertukaran udara perjam sesuai dengan kualifikasi ruangan yang disyaratkan dalam CPOB dengan Air Handling System (AHS). Adapun ruangan pada area produksi tablet terdiri dari :
a. Ruang granulasi
b. Ruang staging granul kering
Massa granul yang telah dikeringkan disimpan di ruang staging. Tekanan udara ruang staging granul kering didesain negatif dari ruangan koridor. c. Ruang pengayakan granul
Untuk mengubah granul kasar menjadi granul halus yang seragam sesuai spesifikasi produk. Massa granul yang telah dikeringkan dan telah memenuhi spesifikasi kemudian diayak dengan communiting fitz mill, ruangan dilengkapi dust collector. Tekanan udara ruang pengayakan granul didesain negatif dari ruangan koridor.
d. Ruang pencampuran akhir
Berfungsi untuk penambahan bahan pelicin, pengkilat dan bahan penghancur luar atau bahan perasa. Massa granul yang telah diayak dicampur dengan bahan pelicin, pengkilat dan bahan penghancur luar atau bahan perasa dimasukkan ke dalam alat V-mixer. Ruangan dilengkapi dust collector. Tekanan udara ruang pencampuran akhir didesain negatif dari ruangan koridor.
e. Ruang karantina produk antara tablet
Tempat penyimpanan sementara massa cetak (produk antara) menunggu pemeriksaan IPC meliputi: pemerian, LOD, kadar zat berkhasiat. Tekanan udara ruang karantina produk antara tablet didesain negatif dari ruangan koridor.
f. Ruang pencetakan tablet
inprocess control oleh operator. Ruangan dilengkapi dust collector, untuk menghisap debu selama pencetakan. Setiap 15 menit operator harus memeriksa keseragaman bobot. Pada awal pencetakan tablet bagian pengawasan melakukan pemeriksaan/pengujian terhadap hasil pencetakan yang meliputi: pemerian, keseragaman bobot, friabilitas, waktu hancur, dan kekerasan tablet. Apabila memenuhi spesifikasi maka pencetakan boleh dilanjutkan. Tekanan udara ruang cetak tablet didesain negatif dari ruangan koridor.
g. Ruang sortir tablet
Tablet yang dihasilkan disortir dari debu dan juga bentuk tablet yang tidak bagus/pecah. Ruangan dilengkapi dust collector. Tekanan udara ruang sortir tablet didesain negatif dari ruangan koridor.
h. Ruang karantina produk ruahan tablet
Tempat penyimpanan sementara produk ruahan menunggu pemeriksaan IPC meliputi: pemerian, keseragaman bobot, friabilitas, waktu hancur, kekerasan tablet, kadar zat aktif dan disolusi. Tekanan udara ruang karantina produk ruahan tablet didesain negatif dari ruangan koridor. i. Ruang penyetripan
j. Ruang counting
Tablet yang telah diluluskan oleh bagian pengawasan mutu dibawa keruang counting dan dikemas dalam kantok plastik. Ruang ini dilengkapi mesin counting. Ruangan dilengkapi dust collector. Setiap 15 menit operator memeriksa kebenaran hasil counting. Tekanan udara ruang counting didesain negatif dari ruangan koridor.
3. Area Produksi Kapsul
Area produksi ini telah memiliki sertifikat CPOB produksi kapsul. Sediaan kapsul yang produksi oleh PT. Kimia Farma (Persero) Tbk. Plant Medan adalah kloramfenikol kapsul. Seperti area produksi krim dan tablet, area produksi kapsul juga terletak terpisah untuk menghindari terjadinya mix up. Pada area produksi kapsul juga terdapat beberapa ruangan dimana setiap ruangan tersebut telah diatur suhu, kelembaban dan tekanan udara dan pertukaran udara perjam sesuai dengan kualifikasi ruangan yang disyaratkan dalam CPOB dengan Air Handling System (AHS).
Adapun ruangan pada unit kapsul terdiri dari : a. Ruang pengeringan
Berfungsi untuk pengeringan bahan pengisi, dilengkapi oven pengering, dust collector. Tekanan udara ruang pengeringan didesain negatif dari ruangan koridor.
b. Ruang pencampuran
negatif. Setelah homogen, massa dilakukan pemeriksaan oleh pengawasan mutu dan kemudian dipindahkan ruang karantina produk antara.
c. Ruang karantina produk antara kapsul
Untuk penempatan sementara produk antara menunggu pemeriksaan pengawasan mutu. Tekanan udara ruang karantina produk antara kapsul didesain negatif dari ruangan koridor.
d. Ruang pengisian kapsul
Berfungsi untuk pengisian massa kapsul kedalam cangkang kapsul. Diruang ini terdapat mesin filling kapsul dilengkapi dengan timbangan digital untuk in process control selama pengisian oleh operator. Juga dilengkapi dust collector. Setiap 15 menit dilakukan pemeriksaan keseragaman bobot oleh operator. Pada awal pengisian kapsul bagian pengawasan mutu melakukan pemeriksaan/pengujian terhadap hasil pengisian kapsul yang meliputi: pemerian, keseragaman bobot, dan waktu hancur. Apabila memenuhi spesifikasi maka pengisian kapsul boleh dilanjutkan. Tekanan udara ruang pengisian kapsul didesain negatif dari ruangan koridor.
e. Ruang seleksi kapsul
f. Ruang pengemasan primer
Kapsul yang telah diluluskan oleh bagian pemastian mutu disetrip atau dikemas dalam botol kemasan 100 di ruang pengemas primer.
4. Area Pengemasan Sekunder
Semua produk yang telah dikemas primer kemudian dikirim ke pengemasan sekunder melalui pass box yang menghubungkan antara jalur produksi dengan jalur pengemasan sekunder.
Sebelum memulai pengemasan, dilakukan pemeriksaan oleh bagian pengawasan mutu meliputi kebersihan jalur pengemasan atau line clearance yaitu :
- Pemeriksaan kesesuaian produk yang dikemas dengan kemasannya.
- Pemeriksaan kebenaran penulisan penomoran batch, tanggal kadaluarsa
- Pembersihan jalur pengemasan dari sisa bahan kemasan batch sebelumnya.
Setelah pengemasan, dilaksanakan pemeriksaan:
- Kesesuaian jumlah dalam kotaknya dengan cara ditimbang
- Kerapian pengemasan.
Selesai pengemasan petugas membuat permohonan pemeriksaan finished pack analysis kepada bagian pemastian mutu. Sediaan obat jadi yang telah dikemas dan diluluskan oleh bagian pemastian mutu selanjutnya dikirim ke gudang penyimpanan.
3.2.6 Pengawasan Selama Proses (In Process Control)
spesifikasi. Laboratorium pengujian IPC terletak di area produksi. Pengawasan ini dilakukan dengan cara mengambil contoh dan mengadakan pemeriksaan dan pengujian terhadap produk yang dihasilkan pada tahap-tahap tertentu dari proses pengolahan.
Pengawasan dalam proses pengolahan dilaksanakan oleh 2 pihak, yaitu:
1. Bagian produksi, yang menjamin bahwa mesin dan peralatan produksi serta proses yang digunakan akan menghasilkan produk yang memenuhi spesifikasi yang ditetapkan.
2. Bagian pengawasan mutu, yang meyakinkan bahwa produk yang dihasilkan pada tahap tertentu telah memenuhi spesifikasi yang ditetapkan sebelum dilanjutkan proses berikutnya. Bagian pengawasan mutu menentukan apakah tahap lanjutan dari proses pengolahan dapat dilaksanakan berdasarkan hasil pengujian yang dilakukan.
Pengawasan dalam proses pengolahan (IPC) oleh pengawasan mutu meliputi pengujian parameter kualitas antara lain:
1. Tablet:
- Massa tablet meliputi pemeriksaan pemerian, kadar air (LOD), kadar bahan aktif.
- Tablet meliputi pemeriksaan pemerian, kadar air, bobot rata-rata, bobot satuan, kekerasan, friabilitas, waktu hancur, kadar bahan aktif dan disolusi.
2. Kapsul:
- Kapsul meliputi pemeriksaan pemerian, bobot rata-rata, waktu hancur, kadar bahan aktif dan disolusi.
3. Krim:
- Basis krim meliputi pemeriksaan pemerian, pH, bobot rata-rata, stabilitas, dan homogenitas
- Massa krim meliputi pemeriksaan pemerian, pH, homogenitas, stabilitas dan kadar bahan aktif.
- Krim meliputi pemeriksaan pemeriaan, bobot rata-rata, simpangan baku relatif, pH, homogenitas, kadar zat berkhasial
3.2.7 Pengawasan Mutu
Tanggung jawab bagian pengawasan mutu antara lain:
1. Memeriksa bahan awal memenuhi spesifikasi yang ditetapkan untuk identitas, kekuatan, kemurnian, kualitas, dan keamanan.
2. Memeriksa setiap tahapan produksi obat telah dilaksanakan sesuai prosedur yang ditetapkan.
3. Memeriksa semua pengawasan selama proses dan pemeriksaan selama proses dan pemeriksaan laboratorium terhadap suatu bets obat telah dilaksanakan dan bets tersebut memilki spesifikasi yang ditetapkan sebelum didistribusi. 4. Memastikan suatu bets obat memenuhi persyaratan mutunya selama waktu
peredaran yang ditetapkan.
Sarana Pemeriksaan Laboratorium Plant Medan antara lain:
- HPLC 2 unit
- Spektrofotometer 1 unit
- Dissolution tester 2 unit
- Desintegration tester 1 unit
- Friabilation tester 1 unit.
- Moisture analyzer 2 unit
- Karl Fischer 1 unit
- Sieve analyze
- Melting Point
- Alat COD
- Alat BOD
- Coloni Counter
- Biologycal Sefty Cabbin
- Alat Laboratorium, dll
3.2.8 Pemeriksaan Mutu Bahan Baku dan Bahan Pengemas
Bahan baku dan bahan pengemas datang dari pemasok ke bagian gudang, kemudian petugas laboratorium melakukan sampling dan pemeriksaan terhadap: 1. Bahan baku dan bahan tambahan
a. Pemeriksaan organoleptis, meliputi bentuk, warna, bau dan rasa.
b. Pemeriksaan kimia, meliputi pemeriksaan kualitatif, kuantitatif dan pH. c. Pemeriksaan fisika, meliputi titik lebur, kelarutan dan berat jenis. 2. Bahan Pengemas
b. Pemeriksaan etiket, meliputi ukuran, kebenaran tulisan dan lambang, desain dan warna
3.2.9 Pemastian Mutu
Tanggung jawab bagian pemastian mutu antara lain:
1. Pengkajian semua dokumen yang digunakan dalam produksi pengemasan termasuk penyimpangan yang terjadi dalam produks i.
2. Memastikan pemeriksaan sudah dilakukan dengan metoda analisa yang benar dan telah tervalidasi.
3. Memastikan produksi sudah dilakukan dengan prosedur yang tervalidasi. 4. Memastikan obat yang diproduksi aman selama dalam masa edarnya.
5. Memastikan semua mesin, sarana penunjang beroperasi menghasil produk sesuai spesifikasi dan telah terkualifikasi.
Bagian pemastian mutu telah melaksanakan validasi proses dan validasi metoda analisa untuk semua produk, untuk alat ukur telah dikalibrasi sesuai jadwal dan mesin telah dikualifikasi. Dokumentasi produksi telah dilaksanakan sejak kedatangan bahan sampai produk jadi.
Sarana Penunjang Pemastian Mutu Plant Medan antara lain:
- Climatic chamber 2 unit
- Standar kalibrasi massa, termometer.
3.2.10 Pengolahan Limbah A.Pengolahan Limbah Cair
Gambar 4. Denah bak pengolahan limbah cair PT. Kimia Farma (Persero) Tbk. Plant Medan
Keterangan: A = Saluran masuk E = Bak Aerasi I B = Bak Penampungan F = Bak Aerasi II C = Mesin Pompa G = Bak Sedimentasi D = Bak Netralisasi H = Bak Biokontrol
Sumber limbah cair berasal dari air cucian di ruang produksi dan air cucian alat-alat di laboratorium.
Proses pengolahan limbah cair, yaitu:
1. Limbah cair yang dikeluarkan ditampung dalam bak penampungan (B) selanjutnya dipompakan dengan mesin pompa (C) ke bak netralisasi (D)
A B
D E
F G
2. Pada bak netralisasi (D) kalau perlu ditambahkan air kapur untuk menetralkan limbah cair yang dikeluarkan. Selanjutnya limbah cair yang telah netral dialirkan ke bak aerasi (E)
3. Pada bak aerasi I (E) dilakukan aerasi dengan menggunakan aerator yang bertujuan untuk menginjeksikan oksigen ke dalam bak tersebut supaya oksigen yang diinjeksikan tersebut dapat melakukan penguraian bahan-bahan organik yang terdapat dalam limbah cair tersebut .
4. Dari bak aerasi I (E) limbah akan mengalir ke bak aerasi II (F) secara over flow dan dilakukan proses yang sama dengan bak aerasi (E)
5. Dari bak aerasi (F) limbah mengalir ke bak sedimentasi (G), limbah cair diendapkan dan selanjutnya mengalir ke bak biokontrol (H).
6. Pada bak biokontrol, dilakukan pengujian terhadap hasil pengolahan limbah cair tersebut berupa nilai BOD (Biological Oxygen Demand) dan COD (Chemical Oxygen Demand) TSS, TDS, pH secara periodik.
7. Dari bak biokontrol limbah cair dibuang ke saluran pembuangan.
Selain pemeriksaan internal oleh perusahaan, limbah cair diperiksa tiap bulan oleh Balai Teknik Kesehatan Lingkungan dan Pengendalian Penyakit (BTKLPP) Kelas I Medan, dengan contoh uji air limbah penampungan awal dan air limbah bio control, dengan parameter pH, BOD, COD, dan TTS. Dimana hasil pengujian terlampir dalam Lampiran 6 dan 7, halaman 75 dan 76.
B. Pengolahan Limbah Padat
Sumber limbah padat berasal dari:
2. Debu yang berasal dari vacuum cleaner yang digunakan untuk membersihkan ruang produksi dan alat produksi.
3. Wadah, etiket yang rusak dari bagian pengemasan. Untuk tube sebelum dimusnahkan digunting terlebih dahulu.
4. Bahan-bahan yang tidak memenuhi spesifikasi ataupun yang telah rusak yang berasal dari bagian gudang.
Semua limbah padat tersebut dibakar oleh petugas dan sisa pembakaran tersebut dibuang ke tempat pembuangan akhir (TPA).
C. Pengolahan Limbah Suara
Pencemaran suara atau kebisingan dan/atau getaran adalah masuknya suara dan/atau getaran yang tidak diinginkan ke dalam lingkungan sehingga kualitas lingkungan menurun atau tidak sesuai dengan peruntukkannya. Limbah suara dan getaran dihasilkan antara lain oleh suara dan getaran dari mesin pabrik, genset.
Upaya pengelolaan lingkungan adalah dengan mengunakan pelindung telinga yaitu berupa ear plugs dan ear muffs.
D. Pengelolaan limbah udara
Pencemaran udara adalah masuknya gas dan senyawa asing ke dalam udara sehingga menyebabkan kualitas udara menurun atau membahayakan kehidupan makhluk hidup atau tidak sesuai lagi dengan peruntukkannya.
Limbah udara di industri farmasi dihasilkan antara lain oleh: 1. Debu selama proses produksi
1. Lemari asam dilengkapi dengan exhaust fan dan cerobong ± 6 meter dilengkapi dengan adsorben.
2. Debu disekitar mesin produksi dipasang penyedot debu dan dust colector unit, yang dilengkapi filter sebelum dibuang.
3. Asap dari genset dibuat cerobong asap ± 6 meter.
3.2.11 Administrasi dan Keuangan
Keuangan di PT. Kimia Farma (Persero) Tbk. dipusatkan ke kantor pusat yang ada di Jakarta. Oleh sebab itu, untuk membayar gaji karyawan ataupun pembayaran faktur masuk atas pembelian bahan-bahan baku harus dibuat surat permohonan uang ke Jakarta.
Setelah dilakukan pemesanan bahan baku oleh bagian pembelian ke pemasok, maka pemasok akan mengirimkan bahan baku tersebut disertai faktur masuk. Pembelian bahan baku tersebut dicatatkan kedalam buku pembelian. Pembayaran faktur tersebut ada 2 cara, yaitu:
1. Secara tunai, dibagi atas 2 macam yaitu:
a. Untuk pembelian dalam jumlah sedikit (<5 juta), pembayaran dilakukan dengan uang kas, dan dicatat ke dalam buku kas.
b. Untuk pembelian dalam jumlah banyak (>5 juta), pembayaran dilakukan dengan cek atau giro, dan dicatatkan ke dalam buku bank.
Pembayaran secara tunai juga berlaku untuk biaya pemeliharaan mesin. 2. Secara Kredit.
Produk jadi akan dikirimkan ke Unit Logistik Sentral di Jakarta dengan membuka faktur keluar (Nota Penyerahan Intern/NPI). PT. Kimia Farma (Persero) Tbk. Plant Medan tidak dapat melakukan penjualan ke pihak luar, tetapi diperbolehkan mengirimkan produk jadi tersebut ke PBF di Medan dan sekitarnya dengan faktur atas nama Unit Logistik Sentral Jakarta untuk menghemat biaya transportasi. Pembayaran atas penjualan (pelunasan faktur) diterima oleh kantor pusat Jakarta dan dicatatkan ke dalam buku penjualan.
Setiap pembelian dan penjualan barang akan dikenai pajak, begitu juga dengan industri farmasi. Setiap pembelian bahan-bahan baku dicatat dalam buku pembelian dikenai Pajak Pertambahan Nilai (PPN) yang tersebut PPN masukkan dalam dicatat dalam buku PPN masukan setiap penjualan obat jadi dicatat dalam buku penjualan dikenal PPN keluaran dan dicatat dalam buku PPN keluaran.
BAB IV PEMBAHASAN 4.1 Manajemen Mutu
PT. Kimia Farma telah menerapkan sistem manajemen mutu, tersedia kebijakan mutu, sasaran mutu sampai ke struktur paling bawah yang menjadi komitmen pegawai, pemasok dan distributor. Sasaran mutu disosialisasikan dan dituangkan dalam rencana mutu yang harus dipenuhi serta uraian pekerjaan yang jelas, dan dituangkan dalam prosedur sistem mutu, prosedur tetap dan formulir.
4.2 Aspek Personalia
PT. Kimia Farma (Persero) Tbk. Plant Medan memiliki personalia sebanyak 56 orang pegawai tetap dan 33 orang pegawai tidak tetap dengan berbagai tingkat pendidikan, keterampilan, dan kemampuan sesuai dengan bidang tugasnya masing-masing, semua dilatih pada bidang tugasnya masing masing dan latihan penyegaran serta on the job training ditempat kerja.
PT. Kimia Farma (Persero) Tbk. Plant Medan memiliki Apoteker penanggung jawab produksi, Apoteker penanggung jawab pengawasan mutu dan apoteker penanggung jawab pemastian mutu sesuai aturan CPOB.
4.3 Aspek Bangunan dan Peralatan
udara awal dan saringan udara akhir, sistem pengolahan air, konstruksi bangunan yang kokoh dan kedap air.
PT. Kimia Farma (Persero) Tbk. Plant Medan terletak dipinggir jalan Raya Tanjung Morawa Km. 9 No. 59, Medan. Di sekitar pabrik terdapat pabrik lainnya yang memungkinkan untuk terjadinya pencemaran, seperti pabrik pakan ternak, pabrik biskuit, dan pabrik karet. Untuk menghindari terjadinya pencemaran dari pabrik tersebut, maka PT. Kimia Farma (Persero) Tbk. Plant Medan telah dilengkapi dengan sistem tata udara (AHS) dengan menggunakan AC sentral yang dilengkapi saringan udara awal dan saringan udara akhir. Sistem ini terdapat di ruangan kelas E, dimana terdiri dari Pre-filter, Medium Filter dan HEPA Filter.
Pengolahan Air yang terdapat di PT. Kimia Farma (Persero) Tbk. Plant Medan dialirkan secara langsung ke ruangan-ruangan dengan menggunakan Looping System. Setiap jam dapat dihasilkan 100 liter air yang telah dimurnikan, dan telah dapat memenuhi kebutuhan produksi.
murni selanjutnya melewati filter 5µ, 1µ dan 0.2µ kemudian ditampung pada tabung penampungan akhir yang berkapasitas 500 liter.
Dari Aspek bangunan telah mempunyai konstruksi yang kuat, lantai, dinding dan plafond dilapisi epoksi sehingga tidak menyerap air. Tata udara telah dibangun baru dan telah dikualifikasi dan memenuhi persyaratan CPOB untuk ruangan kelas III atau kelas 100.000, seperti suhu, kelembaban, perbedaan tekanan ruang produksi dengan koridor dan pertukaran udara perjam serta pemeriksaan partikel dan mikroba telah sesuai dengan kualifikasi yang ditentukan CPOB serta dilengkapi dengan sarana Laboratorium mikrobiologi dengan kelas kebersihan kelas I.
Gudang terdiri dari gudang bahan baku, gudang bahan pengemas dan gudang obat jadi. Di gudang bahan baku terdapat penerimaan barang, ruangan karantina dan ruangan penyimpanan, juga sudah tersedia ruangan sampling, ruang barang reject (penolakan) untuk bahan baku, bahan kemasan dan obat jadi.
Penimbangan bahan dilakukan di ruang kelas III atau zona abu, dilengkapi dustcollector, Air Handling System, dan bahan yang ditimbang tidak menggunakan kemasan asli serta melewati ruang penyangga.
validasi, yang meliputi Validasi Proses (Proses Produksi dan Pengemasan), Validasi Metode Analisa dan hingga Validasi Pembersihan.
4.4 Sanitasi dan Higiene
Pembersihan peralatan dan ruangan produksi dilaksanakan sebelum dan sesudah proses produksi dilaksanakan sehingga pencemaran silang dapat dihindari. Pencemaran kimiawi dapat juga dihindarkan dengan cara menggunakan alat penghisap debu yang dilengkapi dengan saringan udara balik.
Semua karyawan diharuskan untuk melaksanakan higiene perorangan dan mengganti pakaiannya dengan pakaian kerja dan diwajibkan memakai pelindung diri, seperti tutup kepala, tutup mulut, sarung tangan dan sepatu kerja. Sebelum memasuki ruang produksi harus melewati ruang antara. Untuk karyawan yang bersentuhan langsung dengan bahan obat diharuskan menggunakan masker dan sarung tangan. Ketentuan ini juga berlaku untuk tamu yang berkunjung ke lingkungan proses produksi.
4.5 Aspek Produksi
PT. Kimia Farma (Persero) Tbk. Plant Medan memproduksi sediaan tablet, kapsul, salep dan krim dan dari hasil resertifikasi oleh BPOM telah mendapat sertifikat untuk produk tablet, kapsul dan krim.
- Produksi dilaksanakan oleh tenaga yang telah dilatih dan diberikan penyegaran CPOB secara rutin.
- Selama pengolahan dilakukan In Process Control (IPC) baik oleh operator produksi ataupun oleh petugas laboratorium.
- Produksi dilaksanakan dengan mesin produksi yang telah dikualifikasi.
- Semua kegiatan pembuatan obat mulai dari penimbangan, pengolahan, pengemasan, pengendalian dan evaluasi, diarsipkan pada dokumen produksi.
Obat yang telah selesai diproduksi dan dilakukan pengemasan primer dari Bagian Produksi dikirimkan melalui Kotak Hantar (Passing Box) ke Bagian Pengemasan Sekunder, untuk dikemas. Pada bagian Pengemasan Sekunder ini, kemasan karton ada yang masih dilakukan Pelabelan (Labelling) secara manual, dan ada yang telah diproses secara komputerisasi. Demikian pula untuk proses Pencetakan (Printing) terhadap Nomor Bets (Batch), Kode Produksi dan Tanggal Kadaluarsa ada yang masih dilakukan Pencetakan (Printing) secara manual, dan ada yang telah dicetak secara komputerisasi.
4.6 Aspek Pengawasan Mutu
4.7 Inspeksi Diri dan Audit Mutu
Pada PT. Kimia Farma (Persero) Tbk. Plant Medan terdapat program inspeksi diri dan audit mutu. Dimana program ini dilakukan 2 kali dalam setahun sesuai dengan kebijakan yang telah ditetapkan. Program ini dilakukan secara berkala guna untuk menilai kesesuaian segala aspek yang berkaitan dengan Cara Pembuatan Obat yang Baik (CPOB) dan juga untuk menjamin kualitas produk yang dihasilkan oleh PT. Kimia Farma (Persero) Tbk. Plant Medan.
4.8 Dokumentasi
Semua catatan diarsip dalam sistem dokumentasi dan harus disimpan sesuai waktu yang telah ditetapkan.Sistem dokumentasi Plant Medan terdiri dari:
- Kebijakan mutu
- Sasaran Mutu
- Prosedur sistem mutu
- Prosedur Tetap
- Formulir
4.9 Kualifikasi dan Validasi
4.10 Aspek Pengolahan Limbah
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
- Tugas dan fungsi apoteker di industri farmasi yakni di bagian produksi, bidang pemastian mutu, pengawasan mutu.
- PT. Kimia Farma (Persero) Tbk. Plant Medan telah menerapkan Cara Pembuatan Obat yang Baik (CPOB) dalam pelaksanaan kegiatan dan telah memiliki sertifikat CPOB untuk produk tablet, kapsul dan krim. Serta telah melaksanakan pengolahan limbah, Sistem Tata Udara dan Sistem Pengolahan Air telah sesuai CPOB.
5.1 Saran
- Dalam sistem pengolahan limbah padat, diharapkan menggunakan incenerator.
BAB II
TINJAUAN PUSTAKA
2.1Industri Farmasi
2.1.1Pengertian Industri Farmasi
Industri Farmasi menurut Peraturan Menteri Kesehatan RI Nomor 1799/Menkes/Per/XII/2010 adalah badan usaha yang memiliki izin dari menteri kesehatan untuk melakukan kegiatan pembuatan obat atau bahan obat. Industri Farmasi harus membuat obat sesuai aturan CPOB agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (registrasi) dan tidak menimbulkan risiko yang membahayakan konsumen, baik karena ketidakamanan, ketidakefektifan, maupun mutu obat yang substandar (Menkes RI, 2010).
2.1.2 Persyaratan Industri Farmasi
Proses pembuatan obat dan/atau bahan obat hanya dapat dilakukan oleh Industri Farmasi. Setiap pendirian Industri Farmasi wajib memperoleh Izin Industri Farmasi dari Direktur Jenderal. Direktur Jenderal yang dimaksud adalah Direktur Jenderal pada Kementerian Kesehatan yang bertugas dan bertanggung jawab dalam pembinaan kefarmasian dan alat kesehatan (Menkes RI, 2010).
Persyaratan untuk memperoleh Izin Industri Farmasi tercantum dalam Permenkes RI Nomor1799/Menkes/Per/XII/2010 adalah sebagai berikut :
1. Berbadan usaha berupa perseroan terbatas
4. Memiliki secara tetap paling sedikit 3 (tiga) orang Apoteker Warga Negara Indonesia masing-masing sebagai penanggung jawab pemastian mutu, produksi, dan pengawasan mutu
5. Komisaris dan direksi tidak pernah terlibat, baik langsung ataupun tidak langsung dalam pelanggaran peraturan perundang-undangan di bidang kefarmasian.
2.1.3 Izin Usaha Industri Farmasi
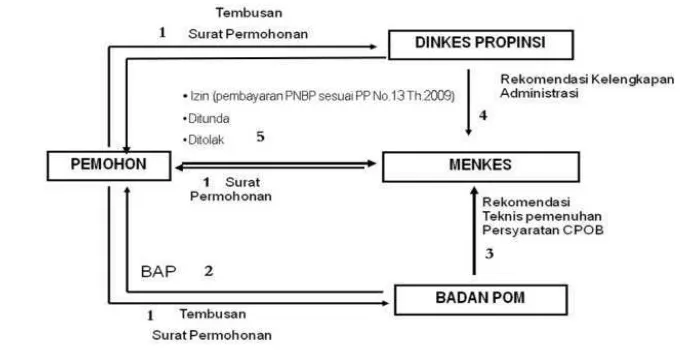
Tata cara pemberian persetujuan prinsip dan izin usaha industri farmasi dapat dilihat pada Gambar 1 dan Gambar 2.
Gambar 1. Tata cara pemberian persetujuan prinsip (Ditjen Binfar dan Alkes RI, 2011).
Gambar 2. Tata cara pemberian izin usaha industri farmasi (Ditjen Binfar dan Alkes RI, 2011).
2.1.4 Pembinaan dan Pengawasan Industri Farmasi
Pembinaan terhadap pengembangan Industri Farmasi dilakukan oleh Direktur Jenderal, sedangkan pengawasan dilakukan oleh Kepala Badan. Pelanggaran terhadap ketentuan dalam Permenkes RI Nomor 1799/Menkes/Per/XII/2010 dapat dikenakan sanksi administratif berupa:
[image:48.595.130.472.348.523.2]2. Larangan mengedarkan untuk sementara waktu dan/atau perintah untuk penarikan kembali obat atau bahan obat dari peredaran bagi obat atau bahan obat yang tidak memenuhi standar dan persyaratan keamanan, khasiat/kemanfaatan, atau mutu
3. Perintah pemusnahan obat atau bahan obat, jika terbukti tidak memenuhi persyaratan keamanan, khasiat/kemanfaatan, atau mutu
4. Penghentian sementara kegiatan 5. Pembekuan Izin Industri Farmasi 6. Pencabutan Izin Industri Farmasi
2.1.5 Pencabutan Izin Usaha Industri Farmasi a. Persetujuan Prinsip
Persetujuan prinsip batal apabila setelah jangka waktu 3 (tiga) tahun dan/atau setelah jangka waktu 1 (satu) tahun perpanjangan, pemohon belum menyelesaikan pembangunan fisik (Ditjen Binfar dan Alkes RI, 2011).
b. Izin Industri Farmasi
Izin produksi industri farmasi dapat dicabut apabila melanggar ketentuan peraturan perundangan yang berlaku (Ditjen Binfar dan Alkes RI, 2011).
2.2Cara Pembuatan Obat yang Baik (CPOB)
Berikut adalah aspek-aspek yang diatur dalam CPOB 2012: 2.2.1 Manajemen Mutu
Unsur dasar manajemen mutu adalah sistem mutu dan pemastian mutu. Sistem mutu mencakup struktur organisasi, prosedur, proses, dan sumber daya. Pemastian mutu/ Quality Assurance (QA) adalah totalitas semua pengaturan yang dibuat dengan tujuan untuk memastikan bahwa obat yang dihasilkan dengan mutu yang sesuai dengan tujuan pemakaiannya. Sedangkan pengawasan mutu/Quality Control (QC) adalah bagian dari CPOB yang berhubungan dengan pengambilan sampel, spesifikasi, pengujian serta organisasi, dokumentasi, prosedur pelulusan (Badan POM RI, 2012).
Konsep dasar Pemastian Mutu, Cara Pembuatan Obat yang Baik (CPOB), Pengawasan Mutu dan Manajemen Risiko Mutu adalah aspek manajemen mutu yang saling terkait (Badan POM RI, 2012).
Pemastian mutu mencakup Cara Pembuatan Obat yang Baik (CPOB) ditambah dengan faktor lain di luar pedoman ini seperti desain dan pengembangan produk. Sistem pemastian mutu yang benar dan tepat bagi industri farmasi hendaklah memastikan bahwa:
- Desain dan pengembangan obat dilakukan dengan memperhatikan persyaratan Cara Pembuatan Obat yang Baik (CPOB) dan semua langkah produksi dan pengawasan diuraikan secara jelas.
- Tanggung jawab manajerial diuraikan dengan jelas dalam uraian jabatan. - Pengaturan disiapkan untuk pembuatan pasokan dan penggunaan bahan awal
- Semua pengawasan terhadap produk antara dan pengawasan selama proses (In Process Control/IPC) lain memenuhi persyaratan yang ditetapkan.
- Pengkajian terhadap semua dokumen yang terkait dengan proses pengemasan dan pengujian Bets (Batch) dilakukan sebelum memberikan pengesahan pelulusan untuk distribusi. Penilaian hendaklah meliputi semua faktor yang relevan termasuk kondisi pembuatan, hasil dan Pengawasan Selama Proses (In Process Control/IPC), pengkajian dokumen produksi termasuk pengemasan, pengkajian penyimpangan dari prosedur yang telah ditetapkan, pemenuhan persyaratan dari spesifikasi produk jadi dan pemeriksaan produk dalam kemasan akhir.
- Obat tidak dijual atau dipasok sebelum Kepala Bagian Manajemen Mutu (pemastian mutu) menyatakan bahwa tiap bets (Batch) produksi dibuat dan dikendalikan sesuai dengan persyaratan yang tercantum dalam izin edar dan peraturan lain yang berkaitan dengan aspek produksi, pengawasan mutu dan pelulusan produk.
- Tersedia pengaturan yang memadai untuk memastikan bahwa sedapat mungkin produk disimpan, didistribusikan dan selanjutnya ditangani sedemikian rupa agar mutu tetap dijaga selama masa edar atau masa simpan obat.
- Tersedia prosedur inspeksi diri dan audit mutu yang secara berkala mengevaluasi efektivitas dan penerapan sistem pemastian mutu.
- Pemasok bahan awal dan bahan pengemas dievaluasi dan disetujui untuk memenuhi spesifikasi mutu yang telah ditentukan oleh perusahaan.
- Tersedia sistem persetujuan terhadap perubahan yang berdampak pada mutu produk.
- Prosedur pengolahan ulang dievaluasi dan disetujui.
- Evaluasi mutu produk berkala dilakukan untuk verifikasi konsistensi proses dan memastikan perbaikan proses yang berkesinambungan(Badan POM RI, 2012).
2.2.2 Personalia
Suatu industri farmasi bertanggung jawab menyediakan personil yang sehat, terkualifikasi dan dalam jumlah yang memadai agar proses produksi dapat berjalan dengan baik. Semua personil harus memahami prinsip CPOB agar produk yang dihasilkan bermutu (Badan POM RI, 2012).
Kesehatan personil hendaklah dilakukan pada saat perekrutan, sehingga dapat dipastikan bahwa semua calon karyawan (mulai dari petugas kebersihan, pemasangan dan perawatan peralatan, personil produksi dan pengawasan hingga personil tingkat manajerial) memiliki kesehatan fisik dan mental yang baik sehingga akan berdampak pada mutu produk yang dibuat. Disamping itu hendaklah dibuat dan dilaksanakan program pemeriksaan kesehatan berkala yang mencakup pemeriksaan jenis-jenis penyakit yang dapat berdampak pada mutu dan kemurnian produk akhir. Untuk masing-masing karyawan hendaklah ada catatan tentang kesehatan mental dan fisiknya.
supervisor yang melakukan evaluasi atau mengambil keputusan (Badan POM RI, 2012).
Berdasarkan Peraturan Pemerintah RI Nomor 51 tahun 2009, Industri Farmasi minimal harus memiliki 3 (tiga) orang Apoteker, yaitu sebagai penanggung jawab masing-masing pada bidang Pemastian Mutu, Produksi dan Pengawasan Mutu.
2.2.3 Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki desain, kontruksi, letak yang memadai dan kondisi yang sesuai serta perawatan yang dilakukan dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil terjadinya resiko kekeliruan, pencemaran silang dan kesalahan lain serta memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindari pencemaran silang, penumpukan debu atau kotoran dan dampak lain yang dapat menurunkan mutu obat.
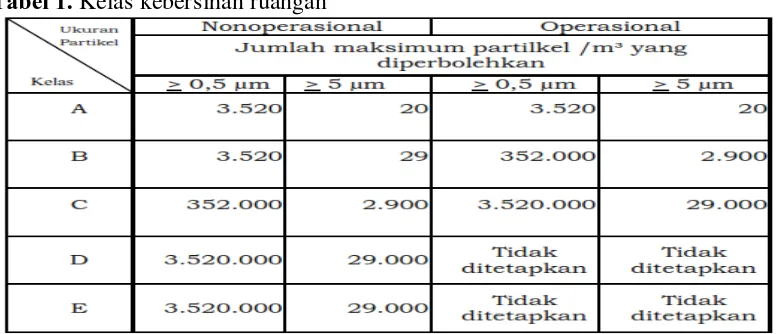
[image:53.595.118.507.588.755.2]Tingkat kebersihan ruang/area untuk pembuatan obat hendaklah diklasifikasikan sesuai dengan jumlah maksimum partikulat udara yang diperbolehkan untuk tiap kelas kebersihan sesuai Tabel 1.
Kelas A, B, C dan D adalah kelas kebersihan ruang untuk pembuatan produk steril. Kelas E adalah kelas kebersihan ruang untuk pembuatan produk nonsteril.
Ruangan produksi hendaklah dilengkapi dengan sistem ventilasi dengan pengontrol udara yang sesuai bagi produk dan aktifitas yang dilakukan, baik terhadap ruangan lain maupun terhadap udara luar (Badan POM RI, 2012).
Rancang bangunan hendaklah dibuat sehingga untuk kegiatan yang berhubungan langsung dengan daerah luar sarananya dikelompokkan. Kegiatan yang berhubungan langsung dengan daerah luar antara lain :
- Penerimaan bahan awal. - Keluar masuk karyawan. - Pemakaian seragam kerja. - Toilet, tempat cuci tangan.
- Penyerahan produk jadi untuk distribusi.
Rancangan diatas perlu ditekankan agar tidak berdampak negatif terhadap kegiatan produksi yang dilakukan di area dengan kelas kebersihan lebih tinggi (Badan POM RI, 2012).
Tata letak ruang hendaklah dikaji sejak tahap perencanaan kontruksi bangunan demi keefektifan semua kegiatan, kelancaran arus kerja, komunikasi, dan pengawasan serta untuk menghindari ketidakteraturan.
Tata letak ruang dalam area produksi yang harus dipenuhi antara lain sebagai berikut:
Udara yang dikeluarkan dari fasilitas itu dilewatkan atau melalui suatu sistem yang sesuai sebelum dilepaskan ke atmosfer.
- Luas area kerja produksi minimal 2 kali luas yang diperlukan untuk penempatan peralatan (termasuk wadah yang diperlukan untuk suatu kegiatan) ditambah luas area untuk keperluan pembersihan dan perawatan mesin oleh operator produksi atau teknisi.
- Permukaan lantai, dinding, langit-langit dan pintu hendaklah : • Kedap air.
• Tidak terdapat sambungan untuk mengurangi pelepasan atau pengumpulan
partikel.
• Mudah dibersihkan, serta tahan terhadap proses pembersihan, bahan
pembersih dan disinfektan yang digunakan berulangkali dengan memperhatikan faktor kepadatan, porositas, tekstur, dan sifat elektrostatis (Badan POM RI, 2013).
2.2.4 Peralatan
Rancangan bangunan dan kontruksi peralatan hendaklah memenuhi persyaratan sebagai berikut:
1. Permukaan peralatan yang bersentuhan dengan bahan baku, produk antara, produk jadi tidak boleh bereaksi, mengadisi atau mengasorbsi, yang dapat mengubah identitas, mutu atau kemurniannya di luar batas yang ditentukan. 2. Peralatan tidak boleh menimbulkan akibat yang merugikan terhadap produk 3. Bahan-bahan yang diperlukan untuk suatu tujuan khusus, seperti pelumas
atau pendingin tidak boleh bersentuhan langsung dengan bahan yang diolah 4. Peralatan hendaknya dapat dibersihkan dengan mudah, baik bagian dalam
maupun bagian luar
5. Peralatan yang digunakan untuk menimbang, mengukur, menguji, dan mencatat hendaklah diperiksa ketelitiannya secara teratur serta dikalibrasi menurut suatu program dan prosedur yang tepat
6. Peralatan hendaknya dirawat sesuai jadwal yang tepat
7. Alat-alat harus dikalibrasi dan divalidasi untuk menjamin kelancaran kerja 8. Daerah yang digunakan sebagai tempat penyimpanan bahan yang mudah
terbakar hendaklah dilengkapi dengan perlengkapan elektris yang kedap eksplosi serta dibumikan dengan sempurna (Badan POM RI, 2012).
2.2.5 Sanitasi dan Higiene
dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh serta terpadu (Badan POM RI, 2012).
Sanitasi dan higiene yang diatur dalam pedoman CPOB 2012 adalah terhadap personalia, bangunan, dan peralatan. Prosedur pembersihan, sanitasi dan higiene hendaklah divalidasi serta dievaluasi secara berkala untuk memastikan efektivitas prosedur dan selalu memenuhi persyaratan (Badan POM RI, 2012). 2.2.6 Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar (Badan POM RI, 2012).
Selain itu, produksi baiknya dilakukan dan diawasi oleh personil yang kompeten, mutu suatu obat tidak hanya ditentukan oleh hasil analisa terhadap produk akhir, melainkan juga oleh mutu yang dibangun selama tahapan proses produksi sejak pemilihan bahan awal, penimbangan, proses produksi, personalia, bangunan, peralatan, kebersihan dan higiene sampai dengan pengemasan. Prinsip utama produksi adalah:
a. Adanya keseragaman atau homogenitas dari bets ke bets.
b. Proses produksi dan pengemasan senantiasa menghasilkan produk yang seidentik mungkin (dalam batas syarat mutu) baik bagi bets yang sudah diproduksi maupun yang akan diproduksi.
Sedangkan hakikat produksi adalah:
b. Adanya prosedur baku (standar) untuk setiap langkah (tahapan) proses produksi dengan persyaratan yang harus diikuti dengan konsisten.
Hal-hal yang perlu diperhatikan dalam produksi antara lain: a. Pembelian Bahan Awal
Pembelian bahan awal hendaklah hanya dari pemasok yang telah disetujui dan memenuhi spesifikasi yang relevan. Semua penerimaan, pengeluaran dan jumlah bahan tersisa hendaklah dicatat. Catatan hendaklah berisi keterangan mengenai pasokan, nomor bets/lot, tanggal penerimaan, tanggal pelulusan, dan tanggal daluarsa.
b. Pencegahan Pencemaran Silang
Tiap tahap proses, produk dan bahan hendaklah dilindungi terhadap pencemaran mikroba dan pencemaran lain. Resiko pencemaran silang ini dapat timbul akibat tidak terkendalinya debu, uap, percikan atau organisme dari bahan atau produk yang sedang diproses, dari sisa yang tertinggal pada alat dan pakaian kerja operator. Tingkat resiko pencemaran ini tergantung dari jenis pencemaran dan produk yang tercemar.
Pencemaran silang hendaklah dihindari dengan tindakan teknis atau pengaturan yang tepat, antara lain:
- Produksi di dalam gedung yang terpisah (diperlukan untuk produk seperti penisilin, hormon, sitotoksik, dan produk biologi).
- Tersedia ruang penyangga udara dan penghisap udara.
- Melaksanakan prosedur pembersihan dan dekontaminasi yang terbukti efektif.
c. Penimbangan dan Penyerahan
Penimbangan dan penyerahan bahan awal, bahan pengemas, produk antara dan produk ruahan dianggap sebagai bagian dari siklus produksi dan memerlukan dokumentasi yang lengkap. Hanya bahan awal, bahan pengemas, produk antara dan produk ruahan yang telah diluluskan oleh pengawasan mutu dan masih belum daluarsa yang boleh diserahkan.
d. Pengembalian
Semua bahan awal dan bahan pengemas yang dikembalikan ke gudang penyimpanan hendaklah didokumentasikan dengan benar.
e. Pengolahan produk antara dan produk ruahan
Semua bahan yang dipakai di dalam pengolahan hendaklah diperiksa sebelum dipakai. Semua kegiatan pengolahan hendaklah dilaksanakan mengikuti prosedur yang tertulis. Tiap penyimpangan hendaklah dilaporkan. Semua produk antara dan ruahan diberi label.
f. Kegiatan Pengemasan
g. Pengawasan Selama Proses
Pengawasan selama proses hendaklah mencakup :
- Semua parameter produk, volume atau jumlah isi produk diperiksa pada saat awal dan selama proses pengolahan atau pengemasan.
- Kemasan akhir diperiksa selama proses pengemasan dengan selang waktu yang teratur untuk memastikan kesesuaiannya dengan spesifikasi dan memastikan semua komponen sesuai dengan yang ditetapkan dalam prosedur pengemasan induk.
h. Karantina Produk Jadi
Karantina produk jadi merupakan tahap akhir pengendalian sebelum penyerahan ke gudang dan siap untuk didistribusikan. Sebelum diluluskan untuk diserahkan ke gudang, pengawasan yang ketat hendaklah dilaksanakan untuk memastikan produk dan catatan pengolahan bets memenuhi spesifikasi yang ditentukan (Badan POM RI, 2012).
2.2.7 Pengawasan Mutu
Bagian Pengawasan Mutusecara keseluruhan mempunyai tanggung jawab, antara lain adalah:
- Membuat, memvalidasi dan menerapkan semua prosedur pengawasan mutu,
- Menyimpan sampel pembanding dari bahan dan produk,
- Memastikan pelabelan yang benar pada wadah bahan dan produk, - Memastikan pelaksanaan pemantauan stabilitas dari produk,
- Ikut serta pada investigasi dari keluhan yang terkait dengan mutu produk. Personil, bangunan dan fasilitas serta peralatan laboratorium hendaklah sesuai untuk jenis tugas yang ditentukan dan skala kegiatan pembuatan obat. Kegiatan bagian Pengawasan Mutu yang dipersyaratkan dalam CPOB adalah sebagai berikut:
a. Penanganan baku pembanding
b. Penyusunan spesifikasi dan prosedur pengujian c. Penanganan contoh pertinggal
d. Validasi
e. Pengawasan terhadap bahan awal, produk antara, produk ruahan, dan obat jadi meliputi spesifikasi, pengambilan contoh, pengujian untuk bahan-bahan tersebut, serta in process control
f. Pengujian ulang bahan yang diluluskan g. Pengujian stabilitas
Bagian Pengawasan Mutu memiliki wewenang khusus untuk memberikan keputusan akhir meluluskan atau menolak atas mutu bahan baku, produk obat ataupun hal lain yang mempengaruhi mutu obat.
Dokumentasi dan prosedur pelulusan yang diterapkan bagian Pengawasan Mutu hendaklah menjamin bahwa pengujian yang diperlukan telah dilakukan sebelum bahan digunakan dalam produksi dan produk disetujui sebelum didistribusikan (Badan POM RI, 2012).
2.2.8 Inspeksi Diri, Audit Mutu dan Audit & Persetujuan Pemasok
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB (Badan POM RI, 2012).
Aspek-aspek dalam inspeksi diri antara lain: - Personalia
- Bangunan termasuk fasilitas untuk personil - Perawatan bangunan dan peralatan
- Penyimpanan bahan awal, bahan pengemas dan obat jadi - Peralatan
- Pengolahan dan pengawasan selama proses - Pengawasan mutu
- Dokumentasi - Sanitasi dan higiene
- Pengawasan label
- Hasil inspeksi sebelumnya dan tindakan perbaikan
Inspeksi diri hendaklah dilakukan secara independent oleh personil perusahaan yang kompeten yaitu terkualifikasi dan mempunyai pengalaman yang memadai dalam melakukan inspeksi diri. Inspeksi diri dapat dilakukan oleh tiap bagian sesuai dengan kebutuhan pabrik namun inspeksi diri yang dilakukan secara menyeluruh hendaknya dilaksanakan minimal satu kali dalam setahun.
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen mutu dengan tujuan spesifik untuk meningkatkannya. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau suatu tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan. Audit mutu juga dapat diperluas terhadap pemasok dan penerima kontrak.
Hendaklah dibuat daftar pemasok yang disetujui untuk bahan awal dan bahan pengemas. Daftar pemasok hendaklah disiapkan dan ditinjau ulang. Hendaklah dilakukan evaluasi sebelum pemasok disetujui dan dimasukkan ke dalam daftar pemasok atau spesifikasi. Evaluasi hendaklah mempertimbangkan riwayat pemasok dan sifat bahan yang dipasok. Semua pemasok yang telah ditetapkan hendaklah dievaluasi secara teratur (Badan POM RI, 2012).
2.2.9 Penanganan Keluhan Terhadap Produk dan Penarikan Kembali Produk
bila perlu mencakup penarikan kembali produk yang diketahui atau diduga cacat dari peredaran secara cepat dan efektif (Badan POM RI, 2012).
Keluhan dapat ditangani dengan:
- Menunjuk personil yang bertanggung jawab untuk menangani keluhan dan memutuskan tindakan yang hendak dilakukan bersama staf yang memadai untuk membantunya.
- Tersedia prosedur tertulis yang merinci penyelidikan, evaluasi, tindak lanjut yang sesuai, termasuk pertimbangan untuk penarikan kembali produk, dalam menanggapi keluhan terhadap obat yang diduga cacat. - Memberikan perhatian khusus untuk menetapkan apakah keluhan
disebabkan oleh pemalsuan.
- Mencatat tiap keluhan yang menyangkut kerusakan produk yang mencakup rincian mengenai asal-usul keluhan dan diselidiki secara menyeluruh dan mendalam.
Pelaksanaan Penarikan Kembali Produk:
- Tindakan penarikan kembali produk hendaklah dilakukan segera setelah diketahui ada produk yang cacat mutu atau diterima laporan mengenai reaksi yang merugikan.
- Pemakaian produk yang berisiko tinggi terhadap kesehatan, hendaklah dihentikan dengan cara embargo yang dilanjutkan dengan penarikan kembali dengan segera.
- Pedoman dan prosedur penarikan kembali terhadap produk hendaklah dibuat untuk memungkinkan embargo dan penarikan kembali dapat dilakukan dengan cepat dan efektif dari seluruh mata rantai distribusi. Produk yang ditarik kembali diberi identifikasi dan disimpan terpisah di area yang aman sementara menunggu keputusan terhadap produk tersebut (Badan POM RI, 2012).
2.2.10 Dokumentasi
Dokumentasi pembuatan obat merupakan bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang sangat penting dari pemastian mutu. Sistem dokumentasi yang dirancang/digunakan hendaklah mengutamakan tujuannya, yaitu menentukan, memantau dan mencatat seluruh aspek produksi serta pengendalian dan pengawasan mutu. Dokumentasi sangat penting untuk memastikan bahwa tiap personil menerima uraian tugas secara jelas dan rinci sehingga memperkecil resiko terjadinya kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Dokumentasi meliputi:
- Spesifikasi
Spesifikasi menguraikan secara rinci persyaratan yang harus dipenuhi produk atau bahan yang digunakan atau diperoleh selama pembuatan. Dokumen ini merupakan dasar untuk mengevaluasi mutu. Spesifikasi meliputi spesifikasi bahan awal, spesifikasi bahan pengemas, spesifikasi produk antara dan produk ruahan, dan spesifikasi produk jadi.
- Dokumen Produksi
pengolahan, dan instruksi pengemasan) yang menyatakan seluruh bahan awal dan bahan pengemas yang digunakan serta menguraikan semua operasi pengolahan dan pengemasan.
- Prosedur
Prosedur berisi cara untuk melaksanakan operasi tertentu, misalnya pembersihan, berpakaian, pengendalian lingkungan, pengambilan sampel, pengujian dan pengoperasian peralatan.
- Laporan dan Catatan
Catatan menyajikan riwayat tiap bets produk, termasuk distribusi dan semua catatan yang berpengaruh pada mutu produk akhir (Badan POM RI, 2012). 2.2.11 Pembuatan dan Analisis berdasarkan Kontrak
Kontrak hendaklah dibuat antara pemberi kontrak dan penerima kontrak dengan menetapkan tanggung jawab masing-masing pihak yang berhubungan dengan produksi dan pengendalian mutu produk. Semua pengaturan pembuatan dan analisis harus sesuai dengan izin edar dan disetujui oleh kedua belah pihak. Pemberi kontrak hendaklah:
• Bertanggung jawab untuk menilai kompetensi penerima kontrak dalam
melaksanakan pekerjaan atau pengujian yang diperlukan.
• Menyediakan semua informasi yang diperlukan penerima kontrak untuk
melaksanakan pekerjaan kontrak secara benar sesuai izin edar dan persyaratan legal lain.
• Memastikan semua produk yang diproses dan bahan yang dikirimkan oleh
• Mempunyai gedung dan peralatan yang cukup, pengetahuan dan pengalaman,
dan personil yang kompeten
• Memastikan bahwa semua produk dan bahan yang diterima sesuai dengan
tujuan penggunaannya.
• Tidak mengalihkan pekerjaan atau pengujian kepada pihak ketiga tanpa
persetujuan pihak pemberi kontrak
• Membatasi diri dari segala aktifitas yang berpengaruh buruk pada mutu (Badan
POM RI, 2012).
2.2.12 Kualifikasi dan Validasi A. Kualifikasi
Validasi untuk mesin, peralatan produksi dan sarana penunjang disebut dengan kualifikasi. Jadi, kualifikasi adalah kegiatan pembuktian (dokumentasi) bahwa perlengkapan, fasilitas atau sistem yang digunakan dalam proses/sistem akan bekerja dengan kriteria yang diinginkan secara konsisten. Kualifikasi merupakan langkah awal (first step) dari keseluruhan pelaksanakan (Priyambodo, 2007).
Validasi atau kualifikasi mesin, peralatan produksi dan sarana penunjang terdiri dari 4 tingkatan, yaitu:
1. Kualifikasi Desain.
(termasuk bangunan untuk industri farmasi) tersebut dibeli atau dipasang atau dibangun.
2. Kualifikasi Instalasi.