LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI
di
PT. KIMIA FARMA (Persero) Tbk. PLANT MEDAN
DISUSUN OLEH :
MENTI NURHAIDA MANURUNG, S.Farm 083202049
PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
LEMBAR PENGESAHAN
LAPORAN PRAKTEK KERJA PROFESI DI PT. KIMIA FARMA (Persero) Tbk.
PLANT MEDAN
Laporan ini disusun untuk melengkapi salah satu syarat untuk memperoleh gelar
apoteker pada Fakultas Farmasi Universitas Sumatera Utara Medan.
Disusun Oleh :
MENTI NURHAIDA MANURUNG, S.Farm 083202049
PT. Kimia Farma (Persero) Tbk. Plant Medan Pembimbing
Asisten Manager Produksi Drs. Zulfadli., Apt
PT. Kimia Farma (Persero) Tbk. Plant Medan
Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Penulis memanjatkan syukur kepada Tuhan Yang Maha Esa atas segala
rahmat dan karuniaNya sehingga penulis dapat menyelesaikan Praktek Kerja
Profesi di PT.. Kimia Farma (Persero) Tbk. Plant Medan.
Praktek Kerja Profesi ini merupakan salah satu syarat yang diwajibkan
bagi mahasiswa tingkat apoteker di Fakultas Farmasi USU Medan dan tinjauan
langsung ke bagian Production Planning Inventor dan Control (PPIC), produksi,
gudang, pengawasan mutu, administrasi keuangan, dan personalia.
Pada kesempatan ini penulis menyampaikan penghargaan dan terima kasih
kepada:
1. Bapak Hendra Farma Johar, M.Si., Apt sebagai Plant Manager PT. Kimia
Farma (Persero) Tbk. Plant Medan, yang telah berkenan memberikan fasilitas
kepada kami untuk melaksanakan Praktek Kerja Profesi.
2. Bapak Drs. Zulfadli., Apt sebagai Asisten Manager Produksi PT. Kimia Farma
(Persero) Tbk. Plant Medan yang telah memberikan bimbingan dan
pengarahan kepada kami selama melaksakan Praktek Kerja Profesi.
3. Bapak Prof. Dr. Sumadio Hadisahputra, Apt. sebagai Dekan Fakultas Farmasi
USU Medan.
4. Bapak Drs. Wiryanto, M.S., Apt sebagai Koordinator Program Pendidikan
5. Seluruh staf dan karyawan PT. Kimia Farma (Persero) Tbk. Plant Medan atas
bantuan dan kerjasama yang diberikan selama Praktek Kerja Profesi di PT.
Kimia Farma (Persero) Tbk. Plant Medan.
Semoga Tuhan Yang Maha Esa membalas budi baik Bapak dan Ibu, dan
penulis berharap semoga tulisan ini dapat memberikan manfaat bagi
pengembangan ilmu farmasi.
Medan, Juni 2009
DAFTAR ISI
LEMBAR JUDUL... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR TABEL ... DAFTAR LAMPIRAN ... RINGKASAN ... BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan Praktek Kerja Profesi ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Sistem Manajemen Mutu ... 4
2.2 Personalia ... 5
2.3 Bangunan dan Fasilitas ... 6
2.4 Peralatan ... 8
2.5 Sanitasi dan Higiene ... 9
2.6 Produksi ... 10
2.7 Pengawasan Mutu ... 12
2.8 Inspeksi Diri dan Audit Mutu ... 13
2.9.1 Keluhan dan Laporan ... 13
2.9.2 Penarikan Kembali Obat Jadi ... 15
2.9.3 Obat Kembalian ... 15
2.10 Dokumentasi ... 16
BAB III TINJAUAN UMUM PT.KIMIA FARMA (Persero) Tbk ... 19
3.1 Tinjauan Umum PT. Kimia Farma (Persero) Tbk ... 19
3.1.1 Sejarah Perusahaan ... 19
3.1.2 Visi dan Misi Perusahaan ... 21
3.1.2.1 Visi Perusahaan ... 21
3.1.2.2 Misi Perusahaan ... 22
3.1.3 Struktur Organisasi ... 22
3.1.4 Produk-produk PT. Kimia Farma (Persero) Tbk ... 23
3.2 Tinjauan Umum PT. Kimia Farma (Persero) Tbk. Plant Medan ... 24
3.2.1 Personalia ... 24
3.2.2 Letak dan Lokasi Pabrik ... 24
3.2.3 PPPI ... 25
3.2.4 Produksi ... 27
3.2.5 Pengawasan Mutu ... 36
3.2.5.1 Pemeriksaan Mutu Bahan Baku dan Pengemas 37 3.2.5.2 Pengawasan Selama Proses (IPC) ... 37
3.2.5.3 Pengawasan dalam Proses Pengemasan ... 38
3.2.7 Pengolahan Limbah ... 40
3.2.7.1 Pengolahan Limbah Cair ... 40
3.2.7.2 Pengolahan Limbah Padat ... 42
3.2.8 Administrasi dan Keuangan ... 42
BAB IV PEMBAHASAN ... 43
4.1 Aspek Personalia ... 46
4.2 Aspek Bangunan ... 46
4.3 Aspek Produksi ... 48
4.4 Aspek Pengawasan Mutu ... 49
5.5 Aspek Pengolahan Limbah ... 49
BAB V KESIMPULAN DAN SARAN ... 51
5.1 Kesimpulan ... 51
5.2 Saran ... 51
DAFTAR PUSTAKA ... 52
DAFTAR TABEL
DAFTAR LAMPIRAN
RINGKASAN
Praktek Kerja Profesi di Industri Farmasi merupakan salah satu bagian dari
Praktek Kerja Profesi pada Program Pendidikan Profesi Apoteker Fakultas
Farmasi USU, yang bekerjasama dengan PT. Kimia Farma (Persero) Tbk. Plant
Medan yang berlokasi di Jalan Medan-Tanjung Morawa Km 9 sebagai salah satu
Industri Farmasi Indonesia.
Konstruksi bangunan PT. Kimia Farma (Persero) Tbk. Plant Medan telah
dibuat sesuai dengan persyaratan CPOB dimana dinding dan langit-langit
memiliki permukaan licin dan tidak terdapat sambungan. Lantai dan dinding di
dalam ruangan produksi dilapisi dengan epoksi, ruang produksi untuk
masing-masing bentuk sediaan terletak terpisah. Sistem pengaturan udara pada ruang
produksi menggunakan Air Handling System (AHS) dengan Air Conditioner (AC)
sentral.
PT. Kimia Farma (Persero) Tbk. Plant Medan memproduksi 3 jenis
sediaan yaitu tablet, kapsul, dan krim. Sebelum melakukan produksi dilakukan
pengujian pemastian mutu terhadap bahan awal, kemudian dilanjutkan pengujian
pemastian mutu dan produk ruahan dan obat jadi. Saat proses berlangsung
dilakukan In Proses Control (IPC) pada setiap tahapan proses produksi selesai,
dilakukan pengujian terhadap obat jadi. Setiap tahap mengikuti protap yang telah
BAB I PENDAHULUAN 1.1 Latar Belakang
Kesehatan merupakan salah satu indikator tingkat kesejahteraan manusia
sehingga senantiasa menjadi prioritas dalam pembangunan nasional suatu bangsa.
Salah satu komponen kesehatan yang sangat strategis adalah tersedianya obat
sebagai bagian dari pelayanan kesehatan kepada masyarakat. Tersedianya obat
dalam jumlah, jenis, dan kualitas yang memadai menjadi faktor penting dalam
pembangunan nasional khususnya di bidang kesehatan.
Industri farmasi sebagai industri penghasil obat, memiliki peran strategis
dalam usaha pelayanan kesehatan kepada masyarakat tersebut. Seiring dengan
meningkatnya pendidikan dan tingkat kesadaran masyarakat akan arti pentingnya
kesehatan, maka industri farmasi dituntut untuk dapat menyediakan obat dalam
jenis, jumlah, dan kualitas yang memadai.
Obat berfungsi untuk meningkatkan derajat kesejahteraan masyarakat
bahkan untuk menyelamatkan jiwa manusia harus dibuat dengan cara yang baik
agar dihasilkan produk yang bermutu tinggi. Industri farmasi, sebagai industri
penghasil obat, dituntut untuk dapat menghasilkan obat yang harus memenuhi
persyaratan khasiat (efficacy), keamanan (safety), dan mutu (quality) dalam dosis
yang digunakan untuk tujuan pengobatan. Karena menyangkut nyawa manusia
maka industri farmasi dan produk industri farmasi diatur secara ketat.
Peraturan-peraturan yang mengatur industri farmasi di Indonesia tertuang dalam Cara
Industri Kimia Farma merupakan salah satu realisasi untuk mencapai
kemandirian tersebut. Industri ini berfungsi memproduksi obat-obatan dengan
mutu, khasiat, serta keamanan yang terjamin untuk digunakan oleh masyarakat.
Kimia Farma berupaya menerapkan prinsip-prinsip Cara Pembuatan Obat yang
Baik(CPOB) dengan tujuan meningkatkan kualitas, keefektifan dan keamanan
obat yang diproduksi, meminimalkan terjadinya kesalahan dan menjamin agar
obat yang dihasilkan memenuhi persyaratan sesuai dengan tujuan penggunaan
sampai ditangan konsumen
Salah satu aspek CPOB adalah personalia yang memiliki pengetahuan dan
keterampilan yang cukup untuk melaksanakan tugas dan tanggung jawabnya di
industri farmasi. Apoteker sebagai personalia profesional harus memahami
aspek-aspek teknik dan non teknik penerapan CPOB disamping adanya pengetahuan dan
keterampilan baik yang berhubungan dengan kefarmasian ataupun kepemimpinan.
Kedudukan apoteker diatur oleh peraturan pemerintah yang dituangkan
dalam Pedoman Cara Pembuatan Obat yang Baik (CPOB), yaitu apoteker
berperan sebagai penanggung jawab produksi dan pengendali mutu. Untuk
menghasilkan sediaan obat jadi yang tetap memenuhi persyaratan yang telah
ditetapkan sesuai dengan tujuan penggunaanya, maka setiap industri farmasi wajib
menerapkan CPOB dalam seluruh aspek dan rangkaian kegiatan produksi
(Pedoman CPOB Badan POM, 2006).
Latar belakang tersebut diperlukan program pendidikan dan pelatihan yang
tepat bagi calon-calon farmasis atau apoteker baru. Praktek Kerja Profesi
sarana pelatihan bagi mahasiswa profesi apoteker sebelum menjalankan perannya
di bidang Industri Farmasi. Dengan adanya pelatihan diharapkan mahasiswa
peserta Praktek Kerja Profesi (PKP) mendapatkan pengalaman langsung dan dapat
mempelajari ilmu-ilmu yang diterapkan dalam industri farmasi, sehingga nantinya
dapat digunakan sebagai gambaran mengenai fungsi, peran dan tugas seorang
farmasis atau apoteker dalam lingkup industri farmasi, sehingga akan terwujud
seorang apoteker yang profesional.
1.2Tujuan Praktek Kerja Profesi
Praktek kerja profesi bertujuan untuk membekali calon apoteker dengan
wawasan, pengetahuan dan keterampilan mengenai seluruh aspek dalam industri
farmasi terutama yang berhubungan dengan bidang penelitian dan pengembangan,
pengawasan mutu dan bagian produksi sesuai dengan pedoman CPOB sehingga
dapat menghasilkan calon-calon Apoteker yang siap terjun ke dalam dunia kerja
BAB II
TINJAUAN PUSTAKA
Industri farmasi diwajibkan menerapkan Cara Pembuatan Obat yang Baik
(CPOB). Hal ini didasarkan oleh Keputusan Menteri Kesehatan RI.
No.43/MENKES/SK/II/1988 tentang CPOB dan Keputusan Direktur Jenderal
Pengawasan Obat dan Makanan DepKes RI. No.04510/A/SK/XII/1989 tentang
Petunjuk Operasional Penerapan CPOB.
Cara Pembuatan Obat yang Baik menyangkut seluruh aspek produksi dan
pengendalian mutu yang bertujuan untuk menjamin bahwa produk obat yang
dibuat senantiasa memenuhi persyaratan mutu yang telah ditentukan sesuai tujuan
penggunaannya.
Pengawasan menyeluruh pada pembuatan obat sangat penting untuk
menjamin bahwa konsumen menerima obat yang bermutu tinggi. Tidak cukup
bila obat jadi hanya sekedar lolos dari serangkaian pengujian, tetapi sangat
penting bahwa mutu obat harus dibentuk dalam produk obat tersebut. Semua obat
hendaknya dibuat dalam kondisi yang dikendalikan dan dipantau. CPOB meliputi
beberapa hal pokok yang menjadi perhatian utama antara lain:
2.1Sistem Manajemen Mutu
Cara Pembuatan Obat yang Baik (CPOB) menyangkut seluruh aspek
produksi dan pengendalian mutu, bertujuan agar obat yang dihasilkan sesuai
dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam
membahayakan penggunaannya karena tidak aman, mutu rendah, atau tidak
efektif.
Pengawasan mutu adalah bagian dari CPOB yang berhubungan dengan
pengambilan sample, spesifikasi dan pengujian, dokumentasi dan prosedur
pelulusan yang memastikan bahwa pengujian yang diperlukan dan relevan telah
dilakukan dan bahwa bahan yang belum diluluskan tidak digunakan serta produk
yang belum diluluskan tidak dijual atau dipasok sebelum mutunya dinilai dan
dinyatakan memenuhi syarat.
2.2Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan
sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Industri
farmasi bertanggung jawab menyediakan personil yang terkualifikasi dalam
jumlah yang memadai untuk melaksanakan semua tugas. Seluruh personil
hendaknya memahami prinsip CPOB dan memperoleh pelatihan awal dan
berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan
pekerjaan. Setiap karyawan juga harus memiliki kesehatan mental dan fisik yang
baik, sehingga mampu melaksanakan tugasnya secara profesional, memiliki sikap
dan kesadaran yang tinggi untuk mewujudkan CPOB.
Struktur organisasi perusahaan sebaiknya dibuat sedemikian rupa sehingga
bagian produksi dan pengawasan dipimpin oleh apoteker yang berlainan dan tidak
bertanggung jawab satu dengan lainnya. Masing-masing mempunyai wewenang
memiliki kepentingan lain diluar organisasi pabrik yang dapat menghambat atau
membatasi tanggung jawabnya.
Kepala bagian produksi maupun penanggung jawab mutu hendaklah
seorang apoteker yang terdaftar dan terkualifikasi, memperoleh pelatihan yang
sesuai, memiliki pengalaman praktis yang memadai di bidang pembuatan obat dan
keterampilan manajerial sehingga memungkinkan pelaksanaan tugasnya secara
profesional. Untuk menunjang dan membantu tugasnya dapat ditunjuk tenaga
yang terampil dalam jumlah yang sesuai untuk melaksanakan supervisi langsung
di bagian produksi dan pengawasan mutu. Selain itu tersedia juga tenaga yang
terlatih secara teknis dalam jumlah yang memadai untuk melaksanakan kegiatan
produksi dan pengawasan mutu sesuai dengan prosedur dan spesifikasi yang telah
ditentukan.
Seluruh karyawan yang terlibat langsung dalam kegiatan pembuatan obat
diberikan pelatihan oleh tenaga yang kompeten mengenai tugasnya sesuai dengan
CPOB. Latihan dilakukan secara berkesinambungan dengan frekuensi yang
memadai serta menurut program yang tertulis yang telah disetujui penanggung
jawab produksi dan penanggung jawab pengawasan mutu.
2.3 Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki desain,
konstruksi, dan letak yang memadai, serta disesuaikan kondisinya dan dirawat
dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan
desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadinya
pembersihan, sanitasi dan perawatan yang efektif untuk menghindari pencemaran
silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan
obat.
Hal-hal yang perlu dipertimbangkan dalam menentukan rancang bangun
dan penataan gedung adalah kesesuaian dengan kegiatan produksi, luasnya ruang
kerja, pencegahan terjadinya penggunaan kawasan produksi sebagai lalu lintas
umum bagi karyawan. Rancang bangun dan penataan gedung harus memenuhi
persyaratan:
1. Mencegah resiko tercampurnya obat atau komponen obat yang berbeda.
2. Kegiatan pengolahan bahan bagi produk bukan obat dipisahkan dari
ruang produksi obat.
3. Ruang terpisah untuk membersihkan alat yang dapat
dipindah-pindahkan dan ruang untuk menyimpan bahan pembersih.
4. Kamar ganti pakaian berhubungan langsung dengan daerah produksi
tetapi letaknya terpisah.
5. Toilet tidak terbuka langsung ke daerah produksi dan dilengkapi
dengan ventilasi yang baik.
Lokasi bangunan hendaklah sedemikian rupa sehingga dapat mencegah
pencemaran lingkungan di sekelilingnya seperti pencemaran udara, tanah dan air
maupun terhadap kegiatan di sekitarnya.
Permukaan bagian dalam ruangan seperti dinding, lantai dan langit-langit
sebaiknya licin, bebas keretakan dan sambungan terbuka serta mudah dibersihkan
permukaan rata dan memiliki permukaan yang mudah dicuci. Sudut-sudut antar
dinding, lantai dan langit-langit harus berbentuk lengkungan.
Saluran air limbah sebaiknya cukup besar dan mempunyai bak kontrol serta
ventilasi yang baik. Lubang pemasukan dan pengeluaran udara, pipa-pipa dan
saluran hendaknya dipasang sedemikian rupa sehingga dapat mencegah timbulnya
pencemaran terhadap produk.
Bangunan harus mendapatkan penerangan yang cukup dan mempunyai
ventilasi dengan fasilitas pengendali udara termasuk pengaturan suhu dan
kelembaban untuk kegiatan dalam bangunan. Disamping itu tersedianya tenaga
listrik yang memadai akan menjamin kelancaran fungsi peralatan produksi dan
laboratorium.
Pintu yang menghubungkan ruangan produksi dan lingkungan luar seperti
pintu bahaya kebakaran hendaklah selalu ditutup rapat untuk mencegah masuknya
cemaran. Seluruh bangunan termasuk daerah produksi, laboratorium, gedung dan
koridor serta daerah sekeliling gudang hendaknya dirawat agar senantiasa bersih
dan rapi. Daerah penyimpanan barang harus cukup luas, terang serta tertata rapi
untuk memungkinkan penyimpanan bahan produk dalam keadaan bersih dan
teratur.
2.4Peralatan
Peralatan yang digunakan dalam produksi obat sebaiknya memiliki
rancang bangun dan konstruksi yang tepat, ukuran yamg memadai serta
keseragamannya dari tiap batch serta memudahkan pembersihan dan
perawatannya.
Permukaan peralatan yang bersentuhan dengan bahan baku, produk antara,
produk ruahan atau obat jadi tidak boleh bereaksi yang dapat mengubah identitas
mutu dan kemurniannya dari batas yang telah ditetapkan. Peralatan tidak boleh
menimbulkan akibat yang merugikan terhadap produk dan sebaiknya dapat
dibersihkan dengan mudah, baik bagian dalam maupun bagian luar. Bahan yang
diperlukan untuk tujuan khusus misalnya pelumas tidak boleh bersentuhan
langsung dengan bahan yang diolah.
Setiap peralatan utama hendaknya diberi nomor pengenal yang jelas.
Selain itu juga diberi nomor pengenal untuk saluran air, uap, udara bertekanan
tinggi untuk membedakan satu dengan yang lainnya dan perlu diperhatikan
keamanannya baik terhadap pekerja maupun terhadap peralatan itu sendiri.
Peralatan hendaknya dirawat menurut jadwal yang tepat agar tetap
berfungsi baik dan dapat mencegah terjadinya pencemaran yang dapat mengubah
identitas, mutu atau kemurnian produk. Prosedur-prosedur tertulis untuk
perawatan peralatan hendaknya dibuat dan digunakan.
2.5 Sanitasi dan Higiene
Ruang lingkup sanitasi dan higiene meliputi personalia, bangunan,
peralatan dan perlengkapan, bahan produksi serta wadahnya dan setiap hal yang
dapat menjadi sumber pencemaran produk. Sumber pencemaran dapat dihilangkan
Semua karyawan yang berhubungan dengan pembuatan obat harus
memiliki kesehatan yang baik dan menggunakan pelindung badan dan penutup
rambut yang sesuai dengan tugas yang dilakukan, sehingga produk yang
dihasilkan dapat terhindar dari pencemaran oleh personal. Karena itu harus
dilakukan higiene perseorangan yang baik, khususnya pada saat penerimaan
karyawan baru.
Gedung yang digunakan untuk pembuatan obat harus dirancang dan
dibangun dengan tepat untuk memudahkan pelaksanaan sanitasi yang baik.
Disamping itu tersedia pula toilet dalam jumlah yang cukup dengan ventilasi yang
baik dan tempat cuci bagi karyawan yang letaknya mudah dicapai di daerah kerja,
serta fasilitas yang memadai untuk penyimpanan pakaian karyawan.
Prosedur sanitasi dan higiene harus selalu divalidasi dan dievaluasi secara
berkala untuk memastikan bahwa hasil penerapan prosedur yang bersangkutan
cukup efektif dan memenuhi persyaratan.
2.6 Produksi
Produksi harus dilaksanakan mengikuti prosedur yang telah ditetapkan
sehingga menjamin obat yang dihasilkan sesuai dengan spesifikasi yang telah
ditentukan.
Untuk bahan baku yang baru datang harus dikarantina sampai disetujui
dan diluluskan untuk digunakan oleh penanggung jawab pengawasan mutu.
Semua bahan awal yang tidak memenuhi persyaratan ditandai dengan jelas,
disimpan secara terpisah dan secepatnya dikembalikan ke supplier atau
merugikan kesehatan, mengurangi daya terapeutik atau mempengaruhi kualitas
suatu produk, tidak dapat diterima. Perhatian khusus harus diberikan pada
masalah pencemaran silang.
Suatu sistem yang menjabarkan cara penomoran batch dan lot secara rinci
diperlukan untuk memastikan bahwa produk dapat dikenali dari nomor lot atau
batch tertentu.
Setiap penimbangan atau pengukuran hendaknya dilakukan pembuktian
kebenaran, ketepatan identitas, dan jumlah bahan yang ditimbang dan diukur oleh
dua petugas secara terpisah. Bahan baku, produk antara, dan produk ruahan
hendaknya diperiksa ulang kebenarannya dan ditandatangani oleh supervisor
produksi sebelum diserahkan ke bagian produksi.
Penanganan bahan dan produk kering atau tablet menimbulkan masalah
pengendalian debu dan pencemaran silang, sehingga perlu dilengkapi dengan
pengendali debu yang efektif dan ditempatkan sedemikian rupa untuk
menghindari campur aduk antara produk. Tiap mesin hendaknya ditempatkan
dalam ruangan terpisah.
Terjadinya kesalahan dalam pengemasan dapat diperkecil dengan
pemakaian label gulungan, pemberian kode batch langsung pada jalur
pemasangan label, penggunaan alat pembacaan label, dan penghitung label
elektronik. Label dan barang cetak yang lain dirancang sedemikian rupa sehingga
memiliki tanda yang berbeda jelas terhadap produk yang berlainan. Disamping
pemeriksaan visual selama pengemasan berlangsung juga dilakukan pemeriksaan
bentuk dan warnanya sama atau hampir sama tidak boleh dikemas pada jalur yang
berdampingan, kecuali ada pemisah secara fisik. Pada setiap jalur pengemasan,
nama dan nomor batch produk yang sedang dikemas hendaknya dapat terlihat
jelas.
Produk antara atau produk ruahan dapat diolah ulang asalkan bahan
tersebut layak untuk diolah ulang dengan prosedur tertentu yang disahkan, serta
hasilnya masih memenuhi persyaratan spesifikasi yang ditentukan.
Produk antara, produk ruahan, dan obat jadi hendaknya dikarantina sambil
menunggu hasil pemeriksaan dan keputusan dari bagian pengawasan mutu.
2.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang penting dari CPOB agar tiap
obat yang dibuat memenuhi persyaratan mutu yang sesuai dengan tujuan
penggunaannya.
Pengawasan mutu meliputi semua fungsi analisa yang ada di laboratorium,
termasuk pengambilan contoh, pemeriksaan dan pengujian bahan awal, produk
antara, produk ruahan, dan produk jadi. Disamping itu juga dilakukan program uji
stabilitas, pemantauan lingkungan kerja, validasi, dokumentasi suatu batch,
program penyimpanan contoh dan penyusunan serta sertifikasi yang berlaku dari
tiap bahan dan produk termasuk metode pengujiannya.
Bagian pengawasan mutu hendaknya memberikan bantuan yang
diperlukan atau mengambil bagian dalam pelaksanaan validasi berkala oleh
bagian lain, khususnya bagian produksi untuk menjamin bahwa tiap produk yang
2.8 Inspeksi Diri dan audit mutu
Inspeksi diri bertujuan untuk melakukan penilaian apakah seluruh aspek
produksi dan pengendalian mutu selalu memenuhi CPOB. Program inspeksi diri
dirancang untuk mencari kelemahan dalam pelaksanaan CPOB dan untuk
menetapkan tindakan perbaikannya. Inspeksi diri harus dilakukan secara teratur
dan dibuat prosedur serta pencatatannya. Tindakan perbaikan yang disarankan
sebaiknya dilaksanakan. Untuk pelaksanaan inspeksi diri ditunjuk tim yang
mampu menilai secara objektif pelaksanaan CPOB.
Hal-hal yang diinspeksi meliputi karyawan, bangunan termasuk fasilitas
untuk karyawan, penyimpanan bahan awal dan obat jadi, peralatan, produksi,
pengawasan mutu, dokumentasi, serta pemeliharaan gedung dan peralatan.
Inspeksi diri dapat diakukan bagian demi bagian sesuai dengan kebutuhan
pabrik yang bersangkutan. Inspeksi diri yang menyeluruh dilakukan
sekurang-kurangnya sekali dalam setahun.
2.9 Penanganan Keluhan Terhadap Obat, Penarikan Kembali Obat dan Obat Kembalian
2.9.1. Keluhan dan Laporan
Keluhan dan laporan dapat menyangkut kualitas, efek samping yang
merugikan dan masalah medis lainnya. Keluhan dan laporan ditangani secara:
1. Hendaklah dibuat catatan tertulis mengenai semua keluhan dan laporan
yang diterima.
2. Keluhan dan laporan hendaklah ditangani oleh bagian yang bersangkutan
3. Terhadap tiap keluhan dan laporan dilakukan penelitian dan evaluasi
secara seksama, termasuk meninjau seluruh informasi yang masuk tentang
pemeriksaan atau pengujian terhadap contoh yang diterima. Bila perlu
dilakukan pemeriksaan terhadap contoh pertinggal batch yang
bersangkutan dan meneliti kembali semua data serta dokumentasi yang
berkaitan.
Tindak lanjut terhadap keluhan dan laporan:
1. Tindakan perbaikan yang diperlukan termasuk penarikan kembali batch
obat jadi atau seluruh obat jadi yang bersangkutan dan tindak lanjut
lainnya yang sesuai.
2. Hasil pelaksanaan penanganan keluhan dan laporan termasuk evaluasi
penelitian dan tindak lanjut yang diambil hendaklah dicatat dan dilaporkan
kepada bagian yang bersangkutan dan kepada pejabat pemerintah yang
berwenang.
2.9.2. Penarikan Kembali Obat Jadi
Penarikan kembali obat jadi dapat berupa penarikan kembali satu atau
beberapa batch atau seluruh obat jadi tertentu dari semua mata rantai distribusi.
Penarikan kembali dilakukan apabila ditemukan adanya produk yang tidak
memenuhi persyaratan kualitas atau atas dasar pertimbangan adanya efek samping
yang tidak diperhitungkan yang merugikan kesehatan.
Penarikan kembali dapat dilakukan atas prakarsa produsen sendiri atau
instruksi instansi pemerintah yang berwenang. Keputusan untuk melakukan
pabrik dan pimpinan perusahaan. Penarikan kembali obat jadi dapat pula sekaligus
merupakan penghentian pembuatan obat jadi yang bersangkutan.
Pelaksanaan penarikan kembali obat jadi:
1. Tindakan penarikan kembali dilakukan segera setelah diketahui adanya
obat jadi yang tidak memenuhi persyaratan atau mempunyai efek samping
yang tidak diperhitungkan sebelumnya dan membahayakan kesehatan.
2. Obat jadi yang mempunyai resiko besar terhadap kesehatan selain tindakan
penarikan hendaklah segera diambil tindakan khusus agar obat yang
bersangkutan dikenakan embargo untuk tidak digunakan. Dalam hal ini
penarikan dilakukan sampai ke tingkat konsumen.
Sistem dokumentasi pabrik dapat mendukung pelaksanaan penarikan
kembali dan embargo secara efektif, cepat, dan tuntas.
2.9.3. Obat Kembalian
Obat kembalian adalah obat jadi yang telah beredar dan kemudian
dikembalikan ke produsen karena adanya keluhan kadaluarsa, masalah keabsahan,
atau sebab lain mengenai kondisi obat, wadah, atau kemasan sehingga
menimbulkan keraguan akan keamanan, identitas, kualitas, dan kuantitas obat jadi
yang bersangkutan.
Pabrik hendaklah membuat prosedur untuk menahan, menyelidiki, dan
menganalisa obat yang dikembalikan, serta menetapkan apakah obat tersebut
dapat diproses kembali atau harus dimusnahkan. Terhadap obat kembalian
dilakukan evaluasi yang seksama untuk menentukan apakah obat jadi yang
Obat kembalian digolongkan sebagai berikut:
1. Obat kembalian yang masih memenuhi spesifikasi dan masih dapat
digunakan.
2. Obat kembalian yang masih dapat diolah ulang.
3. Obat kembalian yang tidak dapat diolah ulang.
Prosedur penanganan obat kembalian dibuat dengan memperhatikan
hal-hal berikut:
1. Jumlah dan identifikasi obat kembalian harus dicatat.
2. Obat kembalian yang diterima hendaklah dikarantina.
3. Terhadap obat kembalian dilakukan penelitian dan pemeriksaan oleh
bagian pengawasan mutu untuk menentukan tindak lanjut.
4. Keputusan untuk melakukan pengolahan obat kembalian hendaklah
dilakukan oleh pimpinan perusahaan atas dasar pertimbangan yang
seksama dan proses pengolahan harus diawasi secara ketat.
Obat kembalian tidak dapat diolah ulang harus dimusnahkan. Hendaklah
dibuat prosedur pemusnahan bahan atau produk yang ditolak yang mencakup
pencegahan pencemaran lingkungan dan mencegah kemungkinan jatuhnya obat
tersebut ke tangan orang yang tidak berwenang.
2.10 Dokumentasi
Dokumentasi pembuatan obat merupakan bagian dari sistem informasi
yang meliputi spesifikasi, prosedur, metode dan instruksi, catatan dan laporan,
serta jenis laporan lain yang ditentukan dalam perencanaan, pelaksanaan, dan
Dokumentasi sangat penting untuk memastikan bahwa setiap petugas
mendapat instruksi secara terinci dan jelas mengenai bidang tugas yang harus
dilaksanakannya, sehingga memperkecil resiko terjadinya kekeliruan yang
biasanya timbul karena hanya mengandalkan komunikasi lisan.
Sistem dokumentasi harus menggambarkan riwayat lengkap dari setiap
batch atau lot, sehingga memungkinkan penyelidikan atau penelusuran terhadap
batch atau lot bersangkutan. Sistem dokumentasi digunakan pula dalam
BAB III TINJAUAN UMUM
PT. KIMIA FARMA (Persero) Tbk
3.1 Tinjauan Umum PT. Kimia Farma (Persero) Tbk 3.1.1 Sejarah Perusahaan
PT. Kimia Farma (Persero) Tbk sebagai Badan Usaha Milik Negara
(BUMN) dibentuk sebagai Perusahaan Perseroan pada tanggal 16 Agustus 1971.
Sejak berdirinya hingga sekarang ini PT. Kimia Farma (Persero) Tbk telah
mengalami beberapa perubahan, yaitu:
Periode I (1957-1959)
Periode ini adalah periode dimana pemerintah melaksanakan nasionalisasi
perusahaan farmasi milik bangsa Belanda yang ada di Indonesia. Program
nasionalisasi ini dikoordinasi oleh Badan Pengambil alihan Perusahaan Farmasi
(BAPPHAR). Adapun perusahaan farmasi milik Belanda tersebut yaitu:
1. NV. Rathkamp dan NV Bavosta di Jakarta
2. NV. Bandoengsche Kinine Fabriek di Bandung
3. NV. Ordeneming Iodium Watudakon di Mojokerto
4. NV. Industri Tella di Surabaya
5. CV. Apotek Malang di Malang
Periode II (1960-1968)
Periode ini adalah periode pembentukan Perusahaan Negara Farmasi
(PNF) dari perusahaan-perusahaan farmasi milik Belanda yang telah
dinasionalisasikan sebelumnya. Pembentukan PNF ini berdasarkan
PP.No.60/1961 di bawah koordinasi Badan Pimpinan Umum Farmasi Negara
sebagai peleburan BAPPHAR yang bernaung di bawah Departemen Kesehatan.
Perusahaan-perusahaan yang didirikan adalah:
1. PNF. Radja farma (ex. Rathkamp) di Jakarta
2. PNF. Nurani Farma (ex. Van Gorkom) di Jakarta
3. PNF. Nakula Farma (ex. Bavosta) di Jakarta
4. PNF. Bhineka Kina Farma di Bandung
5. PNF. Sari Husada (ex. Sari Delle) di Yogyakarta
6. PNF. Kasa Husada (ex. Varbanstaffen) di Surabaya
7. PNF. Biofarma (ex. Pasteur Institute) di Bandung
Periode III (1969-1970)
Untuk meningkatkan efisiensi setiap BUMN, dikeluarkan Instruksi Presiden
No. 17/1967 sehingga Departemen Kesehatan melebur perusahaan-perusahaan
milik negara tersebut ke dalam perusahaan Negara Farmasi dan Alat-alat
Kesehatan Bhinneka Kimia Farma dan PNF Kasa Husada di Surabaya dirubah
menjadi Perusahaan Umum dan Perusahaan Daerah, kemudian PN Sari Husada di
Periode IV (1971-2001)
Periode IV dimulai tahun 1971 ditandai dengan dikeluarkannya PP No.116
tahun 1971 yang berlaku sejak tanggal 19 Maret 1971. Perusahaan Negara
Farmasi dan Alat-Alat Kesehatan Bhinneka Kimia Farma setelah melalui proses
audit dinyatakan lulus untuk menjadi Perseroan Terbatas (PT) yang selanjutnya
disahkan pada tanggal 16 Agustus 1971 sebagai PT. Kimia Farma (Persero)
dengan Akta Notaris dan diumumkan dalam berita Negara.
Periode V (2001-Sekarang)
Pada periode ini tepatnya tanggal 28 Juni 2001 PT. Kimia Farma (Persero)
menjadi Perusahaan Terbuka (Tbk) dengan nama PT. Kimia Farma (Persero) Tbk
dimana untuk privatisasi tahap I saham yang lepas adalah sebanyak 9% dengan
rincian 3% untuk program Kepemilikan Saham Karyawan dan Manajemen
(KSKM) PT. Kimia Farma, dan sebanyak 6% untuk masyarakat umum.
Pada tanggal 4 Januari 2003 PT. Kimia Farma membentuk 2 anak
perusahaan yaitu:
1. PT. Kimia Farma Health & Care
2. PT. Kimia Farma Trading & Distribution
Sedangkan pabrik sebagai Holding Company
3.1.2 Visi dan Misi Perusahaan 3.1.2.1Visi Perusahaan
Visi perusahaan berupa komitmen pada peningkatan kualitas kehidupan,
3.1.2.2 Misi Perusahaan
PT. Kimia Farma (Persero) Tbk mempunyai misi:
1. Mengembangkan industri kimia dan farmasi dengan melakukan
penelitian dan pengembangan produk yang inovatif.
2. Mengembangkan bisnis pelayanan kesehatan terpadu (health care
provider) yang berbasis jaringan distribusi dan jaringan apotek.
6. Meningkatkan kualitas Sumber Daya Manusia dan mengembangkan
sistem informasi perusahaan.
3.1.3 Struktur Organisasi
Pimpinan tertinggi PT. Kimia Farma (Persero) Tbk adalah seorang
direktur utama yang bertugas memimpin seluruh direktorat yang bersifat
operasional (Produksi dan pemasaran) maupun yang bersifat penunjang
(Keuangan dan umum) dan bertanggung jawab kepada Dewan Komisaris.
Direktur Utama dibantu oleh empat direksi yaitu:
1. Direktur Pemasaran
Meliputi : Branded Ethical, lisensi, Pasar Institusi, Produk Alkes dan
Support Pemasaran.
2. Direktur Produksi
Meliputi : Plant Jakarta, Plant Bandung, Plant Watudakon Surabaya,
Plant Medan, Plant Semarang, Unit Logistik Sentral, Riset Pengembangan
3. Direktur Umum/Personalia
Meliputi : Sumber Daya Manusia, Aset dan Properti, Pengadaan dan umum
Corporate.
4. Direktur Keuangan.
Meliputi : Keuangan Corporate, Akutansi Corporate, Anggaran dan Investasi
serta Teknologi Informasi.
Bidang Usaha
Bidang usaha PT. Kimia Farma (Persero) Tbk dibagi atas :
1. Bidang Produksi
2. Bidang Pelayaran (PT. Health & care)
3. Bidang Distribusi (PT. Trading & Distribution)
4. Klinik Kesehatan dan Optik
3.1.4 Produk – Produk PT. Kimia Farma (Persero) Tbk
Produk – produk yang dihasilkan perusahaan ini adalah:
1. Produk ethical
2. Produk “ Over The Counter “ (OTC)
3. Produk Generik berlogo
4. Produk lisensi dari beberapa perusahaan asing yaitu : Sankyo (Jepang),
Heinrich (Jerman), Solvay Duphar (Belanda).
5. Produk bahan baku
6. Produk kontrasepsi
7. Produk – produk penugasan pemerintah (narkotika)
3.2 Tinjauan Khusus PT. Kimia Farma (Persero) Tbk. Plant Medan 3.2.1 Personalia
Personalia pada PT. Kimia Farma (Persero) Tbk. Plant Medan berjumlah
75 orang yang berstatus pegawai tetap yang terdiri dari 10 orang sebagai pejabat
dan 65 orang sebagai pelaksana.
PT Kimia Farma (Persero) Tbk, Plant Medan dipimpin oleh seorang Plant
Manager yang membawahi:
1. Bagian Perencanaan Produksi dan Pengendalian Inventori
2. Bagian Produksi yang terdiri dari :
a Supervisor Produksi
b Supervisor Pengemasan
3. Bagian Pengolahan Mutu
4. Supervisor Penyimpanan
5. Supervisor Tekhnik dan Pemeliharaan
6. Supervisor Umum dan Personalia
7. Supervisor Akuntansi
8. Supervisor Keuangan
3.2.2 Letak dan Lokasi Bangunan Pabrik
PT. Kimia Farma (Persero) Tbk. Plant Medan terletak di Jalan Tanjung
Morawa km 9 dengan luas 20.269 m2 yang terdiri dari :
a. Ruang perkantoran
b. Ruang laboratorium pengawasan mutu
d. Ruang produksi krim/salep
e. Ruang penimbangan sentral
f. Gudang bahan baku
g. Gudang bahan kemas
h. Gudang etiket
i. Gudang obat jadi
j. Ruang sampling
k. Bangunan penunjang seperti tempat pencucian, dapur, mushola, dan tempat
olahraga.
Konstruksi bangunan PT. Kimia Farma (Persero) Tbk. Plant Medan telah
dibuat sesuai dengan persyaratan CPOB dimana dinding dan langit-langit
memiliki permukaaan licin dan tidak terdapat sambungan. Lantai dan dinding di
dalam ruangan produksi dilapisi dengan epoksi, ruang produksi untuk
masing-masing bentuk sediaan terletak terpisah. Sistem pengaturan udara pada ruang
produksi menggunakan Air Handling System (AHS) dengan Air Conditioner (AC)
sentral.
3.2.3 PPPI (Perencanaan Produksi dan pengembangan dan Pengendalian Inventori)
Tugas dan fungsi dari PPPI yaitu :
1. Merencanakan kebutuhan bahan produksi
2. Mengontrol jalannya pembuatan obat
3. Merencanakan pengiriman obat jadi
Dasar perencanaan adalah pemesanan pemasaran yang berasal dari
direktorat pemasaran di Jakarta per triwulan. Dari jumlah pesanan tersebut
dikonversikan per batch karena tiap produk memiliki ukuran batch yang berbeda.
Untuk pemesanan bahan, PPPI memperhatikan stok bahan baku yang ada
di gudang, stok produksi ruahan atau setengah jadi dari stok produk jadi di
gudang, sehingga dapat diketahui beberapa bahan yang akan dipesan.
Setelah semua jumlah bahan yang diperlukan untuk produksi dihitung,
maka PPPI mengeluarkan Surat Permintaan Pembelian Bahan (SPPB) ditujukan
kepada bagian pembelian. Pembelian ada 2 cara yaitu secara terpusat di Jakarta
dan secara lokal di Medan. Bagian pembelian ini akan memilih pemasok yang
paling murah tetapi memenuhi spesifikasi bahan yang diminta, kemudian bagian
pembelian menerbitkan surat pemesanan (Purchase Order/PO) dan ditandatangani
pimpinan. Dibuat tembusan satu lembar arsip pesanan ke bagian gudang agar
disiapkan tempatnya.
Bahan pesanan yang datang diterima oleh bagian gudang dimana bagian
gudang akan memeriksa kecocokan nomor pesanan, jumlah, spesifikasi bahan
yang diminta pada arsip pesanan dengan bahan yang akan diantarkan. Bahan
tersebut akan dikarantina dan diberi label kuning sementara bagian gudang
membuat surat permohonan periksa ke bagian pengawasan mutu untuk melakukan
sampling dan pemeriksaan terhadap bahan tersebut. Bila bahan memenuhi syarat
akan diberi label hijau disertai Hasil Pemeriksaan Laboratorium (HPL), jika tidak
memenuhi syarat yang akan diberi label merah dan HPL serta dikembalikan ke
Setelah semua bahan yang dipesan lengkap, maka PPPI membuat Surat
perintah Kerja (SPK) ke bagian produksi yang ditandatangani pimpinan. Pada
SPK tersebut ditulis No. SPK, nama sediaan, No Batch, dan kapan obat tersebut
diharapkan siap diproduksi. SPK dari PPPI yang dikirim ke bagian produksi
dilampiri catatan pengolahan batch, catatan pengemasan batch, Surat Perintah
Pengeluaran Bahan Baku (SPPBB) dan bahan pengemasan (SPPBK). SPK dibuat
rangkap 4 dengan distribusi ke produksi, gudang, laboratorium dan arsip.
Obat jadi yang telah siap diproduksi dan dikemas kemudian dikirim ke
gudang penyimpanan obat jadi. Setalah dilakukan finished pack analysis oleh
petugas pengawasan mutu. Obat jadi tersebut akan dikirimkan oleh PPPI ke Unit
Logistik Sentral (ULS) Jakarta, maka PPPI membuat surat ke bagian gudang
untuk menyiapkan obat jadi tersebut untuk dikirimkan ke Jakarta.
Tiap akhir bulan stok bahan yang ada di gudang disesuaikan dengan kartu
stok dan data di komputer yang ada pada PPPI, sedangkan pada tiap akhir
triwulan akan dilakukan stock opname. Pada bahan yang telah di stock opname
akan diberi label stock opname yang dituliskan tanggal dilakukan stock opname,
nama bahan dan jumlahnya.
3.2.4 Produksi
Produksi adalah semua kegiatan pembuatan mulai dari peneriman bahan
awal, pengolahan sampai dengan menghasilkan obat jadi. Kegiatan produksi ini
dilakukan di area tertutup dan tidak berhubungan langsung dengan bagian gudang
Tugas dari bagian produksi PT. Kimia Farma (Persero) Tbk. Plant Medan:
1. Melaksanakan pembuatan obat sesuai dengan surat perintah kerja (SPK) dari
bagian PPPI, mulai dari permintaan bahan baku ke gudang, penimbangan,
pengolahan, pengemasan, sampai pengiriman obat jadi ke gudang obat jadi
sesuai dengan prosedur tertulis yang telah ditetapkan (protap).
2. Melaksanakan dokumentasi atas semua tindakan yang dilakukan selama
proses pengolahan dan pengemasan dengan berpedoman pada protap.
Sebelum dimulainya kegiatan produksi, petugas yang terlibat dalam
kegiatan produksi ataupun yang memasuki area produksi harus memakai pakaian
bersih, penutup kepala, mulut, dan mendeinfeksi tangan dengan desinfektan yang
tersedia sebelum memakai sarung tangan.
Hal – hal yang harus diperhatikan sebelum memulai kegiatan produksi :
1. Ruang produksi harus tetap terjaga kebersihan, dimana kegiatan pembersihan
dilakukan tiap pagi sebelum dimulai kegiatan produksi dan sore hari sesudah
selesai kegiatan produksi.
2. Temperatur dan kelembaban tiap ruangan produksi diatur sedemikian rupa
menggunakan Air Handling Unit (AHU) menggunakan AC sentral.
3. Peralatan yang digunakan harus dipastikan selalu dalam keadaan bersih
sebelum dan sesudah dilakukan kegiatan produksi.
4. Ruangan produksi harus mendapat penerangan dan pertukaran udara yang
Produksi dilaksanakan setelah adanya SPK dari bagian PPPI ke bagian
produksi, dan dilakukan produksi sesuai dengan protap yang telah ditetapkan serta
mendokumentasi setiap tindakan yang dilakukan selama produksi.
Jalur Produksi
Setelah adanya perintah produksi dari PPPI, bagian produksi untuk
meminta bahan baku ke bagian gudang dengan surat perintah pengeluaran bahan
baku dan bahan pengemas, petugas gudang melakukan penimbangan atau
penyerahan bahan sesuai dengan yang ditulis pada SPPBB/SPPBK tersebut.
Selama produksi berlangsung, dibuat laporan proses produksi berlangsung, dibuat
laporan proses produksi mulai dari penimbangan bahan sampai pengemasan yang
bertujuan untuk dokumentasi. Sehingga bila terjadi kekeliruan ataupun kesalahan
pada proses produksi, dapat segera diketahui pada proses mana kesalahan tersebut
terjadi dan diambil tindakan untuk mengatasi permasalahan tersebut.
Laporan proses produksi membuat nama sediaan, No batch, besar batch,
tahapan proses, operator, tanggal, jam, hasil, pengawasan yang berguna untuk
mengetahui berapa lama waktu yang dibutuhkan untuk menghasilkan suatu batch
sediaan. Laporan proses produksi ini diisi oleh petugas yang melakukan suatu
tahapan proses produksi dan diketahui oleh supervisor produksi.
Selama proses produksi berlangsung dilakukan pengawasan dalam proses
(In Process Control / IPC). IPC yang dilakukan ada 2 macam, yaitu:
1. Yang dilakukan oleh pihak produksi, yaitu setiap 15 menit sekali dilakukan
2. Yang dilaksanakan oleh pihak pengawasan mutu, antara lain: uji kekerasan,
waktu hancur, disolusi, friabilitas, keseragam bobot dan kadar zat berkhasiat.
Obat yang telah selesai diproduksi akan dilakukan pengemasan primer di
bagian produksi yang selanjutnya diserahkan ke bagian pengemasan melalui pass
box untuk dilakukan pengemasan sekunder sampai dihasilkan obat jadi. Obat jadi
yang telah selesai dikemas, ditimbang bobotnya dan dicatat selanjutnya dibuat
permohonan periksa ke bagian pengawasan mutu untuk dilakukan finished pack
analysis. Obat jadi yang lulus pemeriksaan selanjutnya diserahkan ke gudang
penyimpanan obat jadi.
Bagian produksi pada PT. Kimia Farma (Persero) Tbk. Plant Medan
terdiri dari:
1. Jalur Produksi Krim
Jalur penyimpanan krim terpisah dari jalur produksi yang lain dimana pada
jalur produksi ini terdiri dari beberapa ruangan dimana setiap ruangan tersebut
telah diatur suhu, kelembaban dan tekanan dengan AHU. Adapun ruangan
pada jalur produksi krim terdiri dari:
a. Ruang penimbangan
Pada ruangan ini dilengkapi dengan beberapa alat timbangan digital,
lemari asam, dust collector, Air Handling System (AHS). Bahan-bahan
yang telah ditimbang akan ditempatkan pada staging area untuk kemudian
diambil oleh petugas produksi lain untuk dilakukan proses produksi
selanjutnya. Ruang penimbangan ini dipakai untuk menimbang bahan
b. Ruang pencampuran
Pada ruangan ini dilengkapi dengan alat double jacket tank untuk
memanaskan air, ultraturrax untuk mencampur bahan aktif dengan
bahan dasar krim, mixer untuk pengadukan sehingga diperoleh produk
ruahan. Alat-alat tersebut dibersihkan setiap pagi hari sebelum digunakan
dan sore hari sesudah selesai digunakan. Bila tidak ada kegiatan produksi
maka pembersihan dilakukan seminggu sekali. Selama proses produksi
dilakukan IPC oleh bagian pengawasan mutu.
c. Ruang pengisian
Ruang untuk melakukan pengisian sediaan krim ada 3 yaitu:
i. Ruang Pengisian I
Dilengkapi dengan mesin pengisian krim Elemech dengan kapasitas 2400
tube/jam dan neraca analitik.
ii. Ruang pengisian II
Dilengkapi dengan mesin pengisi bahan Pharmech dengan kapasitas
900-2000 tube/jam dan neraca digital.
Sebelum pengisian krim, tube kosong yang telah dibersihkan di bagian
pengemasan dimasukkan ke pass box, dibawa oleh petugas produksi ke
ruang pengisian dan disusun ke mesin pengisian yang telah dimasukkan
massa krim kemudian dilakukan pengisian. Setiap 15 menit dilakukan
pemeriksaan bobot oleh operator dan pada awal dan akhir pengisian
d. Ruang karantina
Pada ruang ini disimpan produk ruahan untuk menunggu pemeriksaan
laboratorium. Produk ruahan yang telah selesai diperiksa oleh bagian
pengemasan melalui pass box untuk dilakukan pengemasan sekunder.
Bagan proses pembuatan krim/salep dapat dilihat pada Lampiran 2.
2. Jalur Produksi tablet
Jalur produksi tablet terletak terpisah dari jalur produksi krim untuk
menghindari terjadinya pencemaran silang. Pada unit tablet juga terdapat beberapa
ruangan dimana setiap ruangan tersebut telah diatur suhu, kelembaban dan
tekanan dengan AHS, juga dilengkapi dengan dust collector sentral. Adapun
ruangan pada jalur produksi tablet terdiri dari :
a. Ruang pencampuran
Semua bahan tambahan dan bahan aktif dimasukkan ke dalam super mixer
dan dicampur hingga homogen, pengecualian untuk bahan pelicin dan bahan
penghancur luar. Massa di atas digranulasi dengan menggunakan alat rotary
wet granulator sehingga didapat granul basah. Untuk selanjutnya granul
basah tersebut dipindah ke ruang pengeringan.
b. Ruang pengeringan
Granul basah yang dihasilkan dikeringkan di dalam oven dengan suhu
50-60oC selama 10 jam-12 jam (tergantung pada bahan yang akan dikeringkan).
Kapasitas oven tersebut 450 kg/hari. Setelah kering dilakukan pemeriksaan
laboratorium dan selanjutnya dipindahkan ke ruangan granulasi untuk
c. Ruang granulasi
Massa granul yang telah dikeringkan di granulasi dengan alat communiting
fitz mill, kemudian dipindahkan ke ruang pencampuran akhir.
d. Ruang pencampuran akhir
Massa yang telah digranulasi dimasukkan ke dalam alat V-mixer dan
ditambahkan dengan bahan pelicin dan bahan penghancur luar, hasil yang
diperoleh kemudian dilakukan pemeriksaan IPC. Massa yang telah memenuhi
syarat dipindahkan ke ruang pencetakan.
e. Ruang pencetakan
Ruang untuk pencetakan ada 5, masing-masing ruangan terdapat 1 alat cetak
dan juga terdapat dust collector, neraca analitis, dan AHU. Pencetakan
dilakukan misalnya dengan menggunakan mesin cetak tablet merek Cadmach
(Cu) dengan kecepatan mesin 50 ribu tablet/jam. Setiap 15 menit operator
harus memeriksa keseragaman bobot. Bagian pengawasan mutu di dalam
ruangan produksi melakukan pemeriksaan/pengujian terhadap produk ruahan
yang meliputi : pemerian, friabilitas, waktu hancur, kekerasan tablet, disolusi
dan keseragaman bobot.
f. Ruang sortir
Tablet yang dihasilkan disortir oleh petugas dari debu dan juga bentuk tablet
yang tidak bagus /pecah kemudian dipindahkan ke ruangan pengemasan.
g. Ruang pengemasan
Tablet yang telah diluluskan oleh bagian pengawasan mutu dibawa ke ruang
1000 tablet dengan menggunakan mesin penghitung dan silica gel. Setelah
selesai dilakukan pengemasan primer dipindahkan ke ruangan melalui pass
box untuk dilakukan pengemasan sekunder.
Bagan proses pembuatan tablet dapat dilihat pada Lampiran 3.
3. Jalur Produksi Kapsul
Sediaan kapsul yang produksi oleh PT. Kimia Farma (Persero) Tbk. Plant
Medan adalah kloramfenikol kapsul. Seperti jalur produksi krim dan tablet, jalur
produksi kapsul juga terletak terpisah untuk menghindari terjadinya mix up. Pada
jalur produksi kapsul juga terdapat beberapa ruangan dimana setiap ruangan
tersebut telah diatur suhu, kelembaban dan tekanan, juga dilengkapi dust collector
sentral. Adapun ruangan pada unit kapsul terdiri dari :
a. Ruang pengeringan
Bahan yang akan dipakai untuk pembuatan kapsul ditimbang di ruang
penimbangan sesuai dengan SPK. Untuk bahan pengisi (Avicel) dikeringkan
terlebih dahulu di dalam oven selama ± 12 jam pada suhu 85oC. Setelah itu
semua bahan dipindahkan ke ruang pencampuran.
b. Ruang pencampuran
Pada ruang ini dilakukan pencampuran bahan aktif, bahan pengisi dan bahan
tambahan lainnya dengan menggunakan alat V-mixer selama ±15 menit.
Setelah homogen, massa dilakukan pemeriksaan oleh bagian pengawasan
c. Ruang pengisian kapsul
Massa yang telah homogen dimasukkan ke mesin pengisi kapsul (Kwang
Dah). Pada awal dan akhir pengisian dilakukan pengisian laboratorium dan
setiap 15 menit dilakukan pemeriksaan keseragaman bobot oleh operator.
Setelah itu dipindahkan ke ruang seleksi kapsul.
d. Ruang seleksi kapsul
Kapsul yang telah selesai diisi disortir dan dibersihkan dari debu-debu yang
melekat pada kapsul. Setelah itu dilakukan pemeriksaan oleh bagian
pengawasan mutu dan dipindahkan ke ruang pengemasan .
e. Ruang pengemasan primer
Kapsul yang telah diluluskan oleh bagian pengawasan mutu dibawa ke ruang
pengemasan primer dan dikemas dalam kantong plastik. Tiap kantong berisi
1000 kapsul dengan menggunakan mesin penghitung dan silica gel. Setelah
selesai dilakukan pengemasan melalui pass box untuk dilakukan pengemasan
sekunder.
Bagan proses pembuatan kapsul dapat dilihat pada Lampiran 4.
4. Jalur pengemasan
Semua sediaan dilakukan pengemasan primer (krim, tablet, kapsul) di
zona abu, kemudian dimasukkan ke bagian pengemasan sekunder melalui pass
box yang menghubungkan antara jalur produksi dengan jalur pengemasan.
Sebelum dilaksanakan pengemasan sekunder dilaksanakan pemeriksaan kesiapan
kemasan dan etiket batch sebelumnya. Pada bagian pengemasan terdapat 3 jalur
pengemasan.
Sebelum memulai pengemasan, dilakukan pemeriksaan kesesuaian produk
yang dikemas dengan kemasannya yang meliputi etiket, penomoran batch, tanggal
kadaluarsa. Setelah pengemasan, dilaksanakan pemeriksaan kesesuaian jumlah
dalam kotaknya, ditimbang kemudian dikarantina. Sediaan obat jadi yang telah
dikemas dan diluluskan oleh bagian pengawasan mutu selanjutnya dikirim ke
gudang penyimpanan.
3.2.5. Pengawasan Mutu
Pengawasan mutu adalah semua pengawasan yang dilakukan selama
pembuatan dan dirancang untuk menjamin agar produk obat yang dihasilkan
senantiasa memenuhi spesifikasi, identifikasi, kekuatan, kemurnian dan
karakteristik lain yang telah ditetapkan. Pengawasan mutu merupakan bagian
yang paling penting dari Cara Pembuatan Obat Yang Baik (CPOB) agar tiap obat
yang dibuat memenuhi persyaratan mutu yang sesuai dengan tujuan
penggunaannya.
Tanggung jawab bagian pengawasan Mutu:
1. Memastikan bahan awal memenuhi spesifikasi yang ditetapkan untuk
identitas, kekuatan, kemurnian, kualitas, dan keamanan.
2. Memastikan tahapan produksi obat telah dilaksanakan sesuai prosedur
yang ditetapkan dan telah divalidasi.
3. Memastikan semua pengawasan selama proses dan pemeriksaan selama
dilaksanakan dan batch tersebut memiliki spesifikasi yang ditetapkan
sebelum didistribusi.
4. Memastikan suatu batch obat memenuhi persyaratan mutunya selama
waktu peredaran yang ditetapkan.
Setiap bahan baku yang dikarantina dilakukan pengujian oleh bagian
pengawasan mutu yang mencakup: spesifikasi identitas, kualitas,
kekuatan/potensio dan persyaratan lain yang ditentukan.
3.2.5.1 Pemeriksaan Mutu Bahan Baku dan Bahan Pengemas
Bahan baku dan bahan pemgemas datang dari pemasok ke bagian gudang,
kemudian petugas laboratorium melakukan sampling dan pemeriksaan terhadap :
1. Bahan baku dan bahan tambahan
a. Pemeriksaan organoleptis, meliputi bentuk, warna, bau dan rasa.
b. Pemeriksaan kimia, meliputi pemeriksaan kualitatif, kuantitatif dan pH.
c. Pemeriksaan fisika, meliputi titik lebur, kelarutan dan berat jenis.
2. Bahan Pengemas
a. Pemeriksaan kemasan, meliputi ukuran dan kebocoran wadah.
b. Pemeriksaan etiket, meliputi ukuran, kebenaran tulisan dan lambang, desain
dan warna.
3.2.5.2 Pengawasan Selama Proses (In Process Control/IPC)
Tujuan dilakukan pengawasan selama berlangsungnya proses pengolahan
yaitu untuk mencegah diproduksinya obat yang tidak memenuhi spesifikasi.
Laboratorium pengujian IPC terletak di area produksi. Pengawasan ini dilakukan
terhadap produk yang dihasilkan pada tahap-tahap tertentu dari proses
pengolahan.
Pengawasan dalam proses pengolahan dilaksanakan oleh 2 pihak, yaitu :
1. Bagian produksi, yang menjamin bahwa mesin dan peralatan produksi
serta proses yang digunakan akan menghasilkan produk yang memenuhi
spesifikasi yang ditetapkan.
2. Bagian pengawasan mutu, yang meyakinkan bahwa produk yang
dihasilkan pada tahap tertentu telah memenuhi spesifikasi yang ditetapkan
sebelum dilanjutkan proses berikutnya. Bagian pengawasan mutu
menentukan apakah tahap lanjutan dari proses pengolahan dapat
dilaksanakan berdasarkan hasil pengujian yang dilakukan.
Pengawasan dalam proses pengolahan (IPC) hendaklah meliputi pengujian
parameter kualitas antara lain :
1. Tablet : pemerian, kadar air, bobot rata-rata, bobot satuan, kadar bahan
aktif, kekerasan, friabilitas, waktu hancur dan disolusi.
2. Kapsul : pemerian, bobot rata-rata, bobot satuan, kadar bahan aktif, waktu
hancur dan disolusi.
3. Krim dan salep : pemerian, pH (kecuali salep), bobot rata-rata,
homogenitas dan kadar bahan aktif.
3.2.5.3 Pengawasan dalam Proses Pengemasan
Pengawasan dalam proses pengemasan hendaklah meliputi pemeriksaan
parameter kualitas, antara lain :
b. Jumlah satuan produk dalam kemasan.
c. Kebenaran dan kebersihan bahan pengemas yang dipakai.
d. Kerapian pengemasan, penulisan nomor batch, tanggal kadaluarsa.
e. Kebocoran produk yang dikemas dalam strip.
3.2.6 Gudang
Gudang masih berada di area produksi tetapi tidak berhubungan langsung
dengan bagian produksi. Di gudang terbagi atas beberapa ruangan dimana ruangan
tersebut saling berhubungan dan dilengkapi AC untuk menjaga suhu dan
kelembapan ruangan. Adapun ruangan di gudang antara lain :
a. Ruang karantina bahan obat
b. Ruang penyimpanan bahan pembantu yang telah diluluskan bagian
pengawasan mutu.
c. Ruang penyimpanan bahan baku yang telah diluluskan oleh bagian
pengawasan mutu.
d. Ruang penyimpanan kapsul kosong.
e. Ruang penyimpanan obat jadi.
f. Ruang penyimpanan bahan pengemas dan etiket.
Bahan pesanan yang masuk dari pemasok ke bagian gudang akan diperiksa
kesesuaian nomor pesanan, jenis, jumlah bahan sesuai dengan surat pesanan oleh
petugas gudang dan dikarantina terlebih dahulu dan diberi label kuning, kemudian
bagian gudang membuat surat permohonan periksa ke bagian pengawasan mutu
untuk melakukan pemeriksaan terhadap bahan tersebut. Bila bahan memenuhi
tidak memenuhi syarat akan diberi label merah dan HPL serta dikembalikan ke
pihak pemasok ataupun dimusnahkan. Bahan baku yang telah diluluskan oleh
bagian pengawasan mutu akan disimpan di ruang penyimpanan bahan baku dan
dicatat ke dalam kartu stok, begitu juga dengan bahan pembantu.
Bahan-bahan tersebut akan dikeluarkan bagian gudang ke bagian produksi
untuk ditimbang setelah adanya surat perintah pengeluaran bahan baku dan bahan
pengemas dari PPPI. Tiap bahan yang dikeluarkan akan dicatat ke kartu stok oleh
petugas gudang. Setelah obat jadi selesai diproduksi dan dikemas, bagian gudang
akan menyimpan obat jadi tersebut dalam bentuk obat jadi di ruang penyimpanan
obat jadi dan akan mengeluarkannya untuk dikirim setelah adanya instruksi dari
PPPI.
Bahan-bahan yang ada di gudang akan dilakukan pemeriksaan ulang
sesuai dengan jenis bahan dan telah dicantumkan dalam HPL.
3.2.7 Pengolahan Limbah
3.2.7.1 Pengolahan Limbah Cair
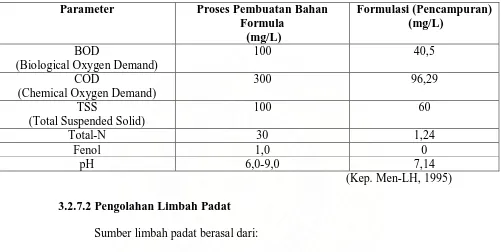
Gambar 1. Denah Bak Pengolahan Limbah Cair PT. Kimia Farma (Persero) Tbk.
Plant Medan
A B
C D
E F
Keterangan: A = Saluran masuk D = Bak Aerasi
B = Bak Penampungan E = Bak Aerasi
= Aerator F = Bak Sedimentasi
C = Bak Netralisasi G = Bak Biokontrol
Sumber limbah cair berasal dari air cucian di ruang produksi dan air
cucian alat-alat di laboratorium.
Proses pengolahan limbah cair, yaitu:
1. Limbah cair yang dikeluarkan ditampung dalam bak penampungan
selanjutnya dipompakan dengan mesin pompa ke bak netralisasi.
2. Pada bak netralisasi kalau diperlukan maka dilakukan penambahan air
kapur untuk menetralkan limbah cair yang dikeluarkan. Selanjutnya
limbah cair yang telah netral dialirkan ke bak aerasi (D)
3. Pada bak aerasi (D) dilakukan aerasi dengan menggunakan aerator yang
bertujuan untuk menginjeksikan udara ke dalam bak tersebut supaya
bakteri aerob yang terdapat dalam bak tersebut dapat melakukan
penguraian bahan-bahan organik yang terdapat dalam limbah cair tersebut.
Selanjutnya juga dialirkan ke bak aerasi (E) dengan mendapatkan
perlakuan yang sama. Lalu dialirkan ke bak sedimentasi.
4. Pada bak sedimentasi, limbah cair tersebut didiamkan/diendapkan dan
selanjutnya dialirkan ke bak biokontrol.
5. Pada bak biokontrol, dilakukan pengujian terhadap hasil pengolahan
limbah cair tersebut berupa nilai BOD (Biological Oxygen Demand) dan
dan COD maka limbah cair yang telah diolah tersebut dapat dibuang ke
lingkungan. Air buangan (limbah) digunakan menyiram tanaman di
lingkungan pabrik.
Tabel 1. Hasil Analisis Limbah Cair oleh PT. Sucofindo 25 April 2009
(Kep. Men-LH, 1995)
3.2.7.2 Pengolahan Limbah Padat
Sumber limbah padat berasal dari:
1. Debu yang ada pada dust collector di ruang produksi.
2. Debu yang berasal dari vacum cleaner yang digunakan untuk
membersihkan ruang produksi, alat produksi.
3. Wadah, etiket yang rusak dari bagian pengemasan. Untuk tube sebelum
dimusnahkan digunting terlebih dahulu.
4. Bahan-bahan yang tidak memenuhi spesifikasi ataupun yang telah rusak
yang berasal dari bagian gudang.
Semua limbah padat tersebut dibakar oleh petugas dan sisa pembakaran
tersebut dibuang ke tempat pembuangan akhir.
Parameter Proses Pembuatan Bahan
3.2.8 Administrasi dan Keuangan
Keuangan di PT. Kimia Farma (Persero) Tbk. Plant Medan dipusatkan ke
kantor pusat yang ada di Jakarta. Oleh sebab itu, untuk membayar gaji karyawan
ataupun pembayaran faktur masuk atas pembelian bahan-bahan baku, bahan
kemasan, biaya umum dan biaya pemeliharaan harus dibuat surat permintaan
droping uang ke kantor pusat di Jakarta.
Setelah dilakukan pemesanan bahan baku oleh bagian pembelian ke
pemasok, maka pemasok akan mengirimkan bahan baku tersebut disertai faktur
masuk. Pembelian bahan baku tersebut dicatatkan ke dalam buku pembelian.
Pembayaran faktur tersebut ada 2 cara, yaitu:
1. Secara tunai, dibagi atas 2 macam yaitu:
a. Untuk pembelian dalam jumlah sedikit (<5 juta), pembayaran dilakukan
dengan uang kas, dan dicatatkan ke dalam buku kas (dokumen 1).
b. Untuk pembelian dalam jumlah banyak (>5 juta), pembayaran dilakukan
dengan cek atau giro, dan dicatatkan ke dalam buku bank.
Pembayaran secara tunai ini juga berlaku untuk biaya pemeliharaan mesin.
2. Secara kredit
Tenggang waktu pembayaran yang diberikan untuk pembelian secara
kredit bervariasi tergantung pada pemasok, akan tetapi berkisar 2 minggu sampai
1 bulan.
Produk jadi akan dikirimkan ke Unit Logistik Sentral di Jakarta dengan
membuka faktur keluar (Nota Penyerahan Intern/NPI). PT. Kimia Farma (Persero)
diperbolehkan mengirimkan produk jadi tersebut ke PBF di Medan dan sekitarnya
dengan faktur atas nama Unit Logistik Sentral Jakarta untuk menghemat biaya
transportasi. Pembayaran atas penjualan (pelunasan faktur) diterima oleh kantor
pusat di Jakarta dan dicatatkan ke dalam buku penjualan.
Setiap pembelian dan penjualan barang akan dikenai pajak, begitu juga
dengan industri farmasi. Setiap pembelian bahan-bahan baku dicatat dalam buku
pembelian dikenai Pajak Pertambahan Nilai (PPN) yang disebut PPN masukan
dan dicatat dalam buku PPN masukan dan setiap penjualan obat jadi dicatat dalam
buku penjualan dikenai PPN keluaran dan dicatat dalam buku PPN keluaran.
Untuk PT. Kimia Farma (Persero) Tbk. Plant Medan tidak berhak mengeluarkan
PPN keluaran karena masih satu NPWP (Nomor Pokok Wajib Pajak) dengan yang
ada di Jakarta.
Apabila PPN masukan lebih besar dari PPN keluaran, maka harus
dilakukan restitusi (permintaan kembali atas kelebihan pembayaran pajak).
Apabila PPN keluaran lebih besar dari PPN masukan, maka kekurangan
pembayaran harus dibayar ke kantor pajak. Untuk PT. Kimia Farma (Persero)
BAB IV PEMBAHASAN
4.1 Aspek Personalia
PT. Kimia Farma (Persero) Tbk. Plant Medan memiliki personalia
sebanyak 75 orang dengan berbagai tingkat pendidikan, keterampilan, dan
kemampuan sesuai dengan bidang tugasnya masing-masing.
PT. Kimia Farma (Persero) Tbk. Plant Medan terdiri dari 3 bagian yaitu
produksi, pengawasan mutu dan PPPI. Setiap bagian dikepalai oleh seseorang
asisten manager. Tugas dari kepala bagian pengawasan mutu dan PPPI ditangani
oleh manager dan dibantu oleh supervisor.
4.2 Aspek Bangunan
Menurut CPOB, dalam pemilihan lokasi bangunan hendaklah dipilih
lokasi dimana tidak ada pencemaran. Apabila lingkungan pabrik tidak dapat
dihindarkan dari pencemaran, maka hendaklah dilakukan tindakan pencegahan,
antara lain dengan cara melengkapi sistem ventilasi dengan saringan udara awal
dan saringan udara akhir, konstruksi bangunan yang kokoh dan kedap air. PT.
Kimia Farma (Persero) Tbk. Plant Medan telah dilengkapi dengan sistem tata
udara dengan menggunakan AC sentral yang dilengkapi dengan saringan udara
awal dan saringan udara akhir sehingga dapat mencegah pencemaran dari udara
sekitarnya. Rancang bangun, ukuran dan penataan ruangan serta konstruksi
bangunan dibuat sedemikian rupa sehingga memudahkan pelaksanaan produksi,
Permukaan bagian dalam ruang proses produksi (dinding, lantai dan
langit-langit) licin, bebas dari retakan dan sambungan serta mudah dibersihkan.
Permukaan bagian dalam ruang proses produksi PT. Kimia Farma (Persero) Tbk.
Plant Medan sudah dilapisi dengan epoksi. Setiap tahapan proses produksi,
dilakukan di ruangan yang terpisah untuk menghindari tercampurnya obat dan
bahan, terlewatnya satu langkah produksi serta terjadinya pencemaran silang.
Selain itu, rancang bangun juga dibuat sedemikian rupa sehingga arus lalu lintas
barang yang masuk memiliki jalur yang terpisah dengan jalur lalu lintas
karyawan. Hal ini sudah sesuai dengan persyaratan yang tercantum dalam CPOB.
Peralatan yang bersentuhan langsung dengan bahan baku, produk antara
atau produk ruahan adalah bahan yang inert. Perawatan tiap peralatan
dilaksanakan sesuai dengan petunjuk yang terdapat di catatan pedoman
operasional pembersihan peralatan yang terdapat di ruangan tempat peralatan.
Pembersihan peralatan dan ruangan produksi dilaksanakan sebelum dan sesudah
proses produksi dilaksanakan sehingga pencemaran silang dapat dihindari.
Pencemaran kimiawi dapat juga dihindarkan dengan cara menggunakan alat
penghisap debu yang dilengkapi dengan saringan udara balik. Hal ini sudah
dilaksanakan PT. Kimia Farma (Persero) Tbk. Plant Medan sesuai dengan yang
tercantum dalam CPOB.
Gudang terdiri dari gudang bahan baku, gudang bahan pengemas dan
gudang obat jadi. Hal ini dilakukan untuk menghindari terjadinya kontaminasi
silang. Di gudang bahan baku terdapat pembagian ruangan yaitu ruangan
kondisinya merupakan zona abu, dilengkapi dust collector, lemari asam, AHU,
dan bahan yang ditimbang tidak menggunakan kemasan asli serta melewati ruang
penyangga.
4.3 Aspek Produksi
PT. Kimia Farma (Persero) Tbk. Plant Medan memproduksi sediaan
tablet, kapsul, salep dan krim. Produksi obat dilaksanakan sesuai dengan prosedur
tetap agar selalu diperoleh obat jadi yang memenuhi spesifikasi yang ditentukan.
Prosedur tetap pembuatan obat yang diikuti sudah mengacu pada CPOB. Kegiatan
penimbangan, pengolahan, pengemasan, pengendalian dan evaluasi,
didokumentasikan dalam dokumen produksi.
Pelaksanaan sanitasi dan higiene di lingkungan produksi sudah
dilaksanakan. PT. Kimia Farma (Persero) Tbk. Plant Medan memiliki area
abu-abu dan hitam yang mana area abu-abu-abu-abu untuk produksi dan pengemasan primer,
sedangkan area hitam untuk pengemasan sekunder. Semua karyawan diharuskan
untuk melaksanakan higiene perorangan dan mengganti pakaiannya dengan
pakaian kerja dan disediakan pelindung diri, seperti tutup kepala, tutup mulut,
sarung tangan dan sepatu kerja. Sebelum memasuki ruang produksi harus
melewati ruang antara. Untuk karyawan yang bersentuhan langsung dengan bahan
obat diharuskan menggunakan masker dan sarung tangan. Ketentuan ini juga
berlaku untuk tamu yang berkunjung ke lingkungan proses produksi. Setelah obat
selesai diproduksi dan dikemas (primer) maka selanjutnya obat akan diteruskan ke