ISOLASI NANOKRISTAL SELULOSA DARI TONGKOL JAGUNG
(Zea Mays L) DENGAN METODE HIDROLISA MENGGUNAKAN
PELARUT DIMETIL ASETAMIDA/LITIUM KLORIDA
(DMAc/LiCl)
SKRIPSI
KASRAWATI
090802010
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
2014
ISOLASI NANOKRISTAL SELULOSA DARI TONGKOL JAGUNG
(Zea Mays L) DENGAN METODE HIDROLISA MENGGUNAKAN
PELARUT DIMETIL ASETAMIDA/LITIUM KLORIDA (DMAc/LiCl)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
KASRAWATI 090802010
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2014
PERSETUJUAN
Judul : Isolasi Nanokristal Selulosa Dari Tongkol Jagug (Zea mays L) Dengan Metode hidrolisa Menggunakan Pelarut Dimetil Asetamida/Litium Klorida (DMAc/LiCl)
Kategori : Skripsi
Nama : Kasrawati
Nomor Induk Mahasiswa : 090802010
Program Studi : Sarjana (S-1) Kimia
Departemen : Kimia
Fakultas : Matematika Dan Ilmu PengetahuanAlam Universitas Sumatera Utara
Disetujui di
Medan, Maret 2014
Komisi Pembimbing:
Pembimbing 2 Pembimbing 1
Saharman Gea, Ph.D Dr. Marpongahtun M.Sc
NIP. 196811101999031001 NIP.196111151988032002
Diketahui/Disetujui oleh :
Departemen Kimia FMIPA USU Ketua,
Dr. Rumondang Bulan, MS. NIP. 195408301985032001
PERNYATAAN
ISOLASI NANOKRISTAL SELULOSA DARI TONGKOL JAGUNG
(Zea Mays L) DENGAN METODE HIDROLISA MENGGUNAKAN PELARUT
DIMETIL ASETAMIDA/LITIUM KLORIDA (DMAc/LiCl)
SKRIPSI
Saya mengakui skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing – masing disebutkan sumbernya.
Medan, Maret 2014
KASRAWATI 090802010
PENGHARGAAN
Bismillahirrahmanirrahim
Syukur Alhamdulillah, segala puji penulis ucapkan kehadirat Allah SWT yang telah melimpahkan rahmat dan karunia – Nya sehingga skripsi ini dapat diselesaikan. Shalawat beriring salam kepada baginda Rasulullah Muhammad SAW sebagai tauladan seluruh umat. Dalam hal ini penulis ucapkan terimakasih dan penghargaan kepada :
Kedua orang tua, ayahanda Abubakar dan ibunda Nazariati yang dengan doa dan kerja kerasnya telah ikhlas membesarkan, membiayai, dan mendidik penulis agar dapat menjadi manusia yang berguna bagi bangsa dan agama serta bermanfaat bagi orang lain. Bang Yusri, kakak Tuty Suwandari, adik Fitri Zahra yang selalu memberikan semangat dan bantuan moril sehingga penulis dapat menyelesaikan skripsi ini. Untuk Cek Samsul Bahri, tante Desi aryani, cek Muslim dan Nabila Dara Anggraini.
Ibu Dr. Marpongahtun, M. Sc, sebagai dosen pembimbing I dan Bapak Saharman Gea, Ph.D sebagai dosen pembimbing II yang telah banyak memberikan pengarahan dan bimbingan hingga selesainya skripsi ini. Ibu Dr. Rumondang Bulan Nasution, M. S, dan Bapak Drs. Albert Pasaribu, M. Sc selaku Ketua Departemen dan Sekretaris Departemen Kimia FMIPA USU. Ibu Dra. Saur Lumban Raja, M. Si selaku penasehat akademik dan seluruh staf dosen pengajar jurusan kimia FMIPA USU Medan.
Sahabat-sahabat terbaikku Indah, Asmi, Rina, kak Emi, dan Nur jannah yang selalu memberikan semangat dan doanya. Untuk Echa, Supran, Saipul, Ilman, irwanto, Icha dan Dwi Serta teman-teman seperjuangan Stambuk 2009 yang namanya tidak bisa disebut satu persatu, untuk adik-adik 2010-2012 dan untuk kak ayu. Terkhusus untuk bang Miswar yang selalu setia memberikan semangat serta mendoakan penulis sehingga dapat menyelesaikan skripsi ini.
Akhirnya penulis menyadari bahwa skripsi ini masih jauh dari sempurna, oleh karena itu diharapkan kritik dan saran yang membangun demi kesempurnaan skripsi ini. Semoga skripsi ini bermanfaat bagi kita semua.
Penulis
ISOLASI NANOKRISTAL SELULOSA DARI TONGKOL JAGUNG
(Zea May L) DENGAN METODE HIDROLISA MENGGUNAKAN PELARUT
DIMETIL ASETAMIDA/LITIUM KLORIDA (DMAc/LiCl)
ABSTRAK
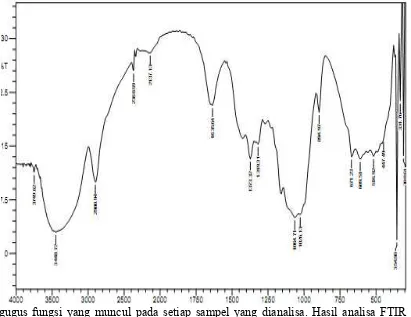
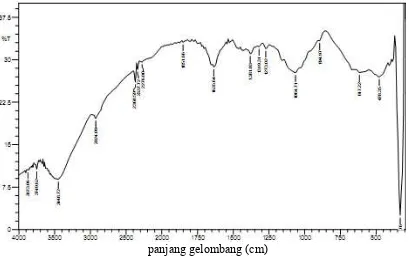
Telah dilakukan penelitian mengenai isolasi nanokristal selulosa dari tongkol jagung (Zea Mays L) dengan metode hidrolisa menggunakan pelarut dimetil asetamida/litium klorida (DMAc/LiCl). Tongkol jagung didelignifikasi dengan HNO3 3,5% dan NaNO2, kemudian diendapkan dengan NaOH 17,5% serta proses pemutihan dengan H2O2 10%. Nanokristal selulosa diperoleh melalui metode hidrolisis menggunakan pelarut dimetil acetamida/litium klodida (DMAc/LiCl). Hasil analisa morfologi dengan menggunakan transmission electron microscopy (TEM) menunjukkan bahwa nanokristal selulosa yang diperoleh memiliki diameter sebesar 60,71 nm. Hasil analisa degradasi termal dengan menggunakan Thermogravimetry Analysis (TGA) menunjukkan bahwa α -selulosa mulai terdekomposisi pada suhu 341oC dan nanokristal selulosa mulai terdekomposisi pada suhu 160oC. Nanokristal selulosa memperlihatkan massa residu yang jauh lebih besar daripada α-selulosa, yaitu masing-masing sebesar 33,47% dan 2,416% pada suhu 1000oC. Analisa spektrum FTIR menunjukkan adanya serapan gugus C-O-C pada bilangan gelombang 1064 cm-1 yang mengidentifikasi adanya ikatan glikosida pada α-selulosa dan nanokristal selulosa. Pada puncak 3448 cm-1 menunjukkan adanya gugus O-H dan puncak 2900-2924 cm-1 adanya gugus C-H.
ISOLATION OF CELLULOSE NANOCRYSTAL FROM CORNCORB
(Zea Mays L) BY HYDROLYZED METHOD USING SOLVENT DIMETHYL
ACETAMIDE / LITHIUM CHLORIDE (DMAc / LiCl)
ABSTRACT
Isolation of cellulose nanocrystal from corncorb (Zea Mays, L) by hydrolyzed method using solvent dimethyl acetamide/lithium chloride (DMAc/LiCl) have been done. Corncorb was delignificated with 3.5% nitric acid and sodium nitrite, then the residue was treated with 17.5% sodium hydroxide, and bleached with 10% hydrogen peroxide. Cellulose nanocrystal was done by hydrolysis method using solvent dimethyl acetamide / lithium klodida (DMAc/LiCl). From the image of transmission electron microscopy (TEM) analysis shows that the average diameter of cellulose nanocrystal is 60,71 nm. Thermogravimetry Analysis (TGA) curve show that α-cellulose occurs decompose at around 341oC, while cellulose nanocrystal occurs decompose at 160oC. the amount of char residue at 1000oC in cellulose nanocrystal was remarkably higher compare to α-cellulose is 33,47% and 2,416% respectively. FTIR spectra show C-O-C stretch of α-cellulose and cellulose nanocrystal at 1064 cm-1 which indicate that there are glycoside bonding in the compound structure. The peak 3448 cm-1 representative of the O-H group and peak near 2900-2924 cm-1 representatif of the C-H groups.
3.3.1.1 Pembuatan Larutan HNO3 3,5% 28 Thermogravimetry Analysis (TGA) 31
3.3.7 Analisa gugus fungsi dengan FTIR 31
3.4 Bagan penelitian 32
3.4.1 Preparasi Serbuk Tongkol Jagung 32
3.4.2 Ekstraksi -Selulosa dari Tongkol Jagung 33
3.4.3 Isolasi nanokristal selulosa dari α-selulosa 34 3.4.4 Karakterisasi Nanokristal Selulosa 35 BAB 4 HASIL DAN PEMBAHASAN 4.1 Hasil penelitian 36
4.2.4 Analisa Degradasi Termal dengan menggunakan TGA 41
DAFTAR TABEL
Nomor Judul Halaman
Tabel
2.1 Komposisi kimia jagung 9
2.2 Karakteristik dan komposisi tongkol jagung 10 4.1 Bilangan gelombang FTIR α-selulosa 44
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
2.1 Struktur kimia selulosa 12
2.2 Proses dialisis dengan menggunakan membran dialisis 20
4.1 Alfa selulosa yang diisolasi dari tongkol jagung 36
4.2 Nanokristal selulosa 37
4.3 Analisa Morfologi Nanokristal selulosa dengan TEM 40
4.4 Kurva TGA α-Selulosa dan Nanokristal selulosa 42
4.5 Spektrum FTIR α-Selulosa 43
4.6 Spektrum FTIR Nanokristal Selulosa 44
DAFTAR SINGKATAN
DMAc = Dimetil acetamida
DP = Derajat polimerisasi
FTIR = Fourier Transform infrared
LiCl = Litium klorida
NMMO = N-metilmorfolin-N-oksida
MCC = Microcrystalline cellulose
TEM = Transmisi electron microscopy
TGA = Thermogravimetry analysis
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lampiran
1 FTIR standar untuk α-selulosa 50
2 Serbuk tongkol jagung yang telah dihaluskan 50
3 Proses delignifikasi tongkol jagung 51
4 Proses penyaringan pulp 51
5 Penambahan NaOH 17,5% 52
6 Proses pemutihan 52
7 Proses dialisis selama 8 hari 53
8 Proses penguapan aquadest 53
9 Kurva TGA α-Selulosa dari tongkol jagung 54
10 Kurva TGA Nanokristal Selulosa 54
11 Hasil analisa FTIR α-selulosa tongkol jagung 55
12 Hasil analisa FTIR nanokristal selulosa tongkol jagung 56
ISOLASI NANOKRISTAL SELULOSA DARI TONGKOL JAGUNG
(Zea May L) DENGAN METODE HIDROLISA MENGGUNAKAN PELARUT
DIMETIL ASETAMIDA/LITIUM KLORIDA (DMAc/LiCl)
ABSTRAK
Telah dilakukan penelitian mengenai isolasi nanokristal selulosa dari tongkol jagung (Zea Mays L) dengan metode hidrolisa menggunakan pelarut dimetil asetamida/litium klorida (DMAc/LiCl). Tongkol jagung didelignifikasi dengan HNO3 3,5% dan NaNO2, kemudian diendapkan dengan NaOH 17,5% serta proses pemutihan dengan H2O2 10%. Nanokristal selulosa diperoleh melalui metode hidrolisis menggunakan pelarut dimetil acetamida/litium klodida (DMAc/LiCl). Hasil analisa morfologi dengan menggunakan transmission electron microscopy (TEM) menunjukkan bahwa nanokristal selulosa yang diperoleh memiliki diameter sebesar 60,71 nm. Hasil analisa degradasi termal dengan menggunakan Thermogravimetry Analysis (TGA) menunjukkan bahwa α -selulosa mulai terdekomposisi pada suhu 341oC dan nanokristal selulosa mulai terdekomposisi pada suhu 160oC. Nanokristal selulosa memperlihatkan massa residu yang jauh lebih besar daripada α-selulosa, yaitu masing-masing sebesar 33,47% dan 2,416% pada suhu 1000oC. Analisa spektrum FTIR menunjukkan adanya serapan gugus C-O-C pada bilangan gelombang 1064 cm-1 yang mengidentifikasi adanya ikatan glikosida pada α-selulosa dan nanokristal selulosa. Pada puncak 3448 cm-1 menunjukkan adanya gugus O-H dan puncak 2900-2924 cm-1 adanya gugus C-H.
ISOLATION OF CELLULOSE NANOCRYSTAL FROM CORNCORB
(Zea Mays L) BY HYDROLYZED METHOD USING SOLVENT DIMETHYL
ACETAMIDE / LITHIUM CHLORIDE (DMAc / LiCl)
ABSTRACT
Isolation of cellulose nanocrystal from corncorb (Zea Mays, L) by hydrolyzed method using solvent dimethyl acetamide/lithium chloride (DMAc/LiCl) have been done. Corncorb was delignificated with 3.5% nitric acid and sodium nitrite, then the residue was treated with 17.5% sodium hydroxide, and bleached with 10% hydrogen peroxide. Cellulose nanocrystal was done by hydrolysis method using solvent dimethyl acetamide / lithium klodida (DMAc/LiCl). From the image of transmission electron microscopy (TEM) analysis shows that the average diameter of cellulose nanocrystal is 60,71 nm. Thermogravimetry Analysis (TGA) curve show that α-cellulose occurs decompose at around 341oC, while cellulose nanocrystal occurs decompose at 160oC. the amount of char residue at 1000oC in cellulose nanocrystal was remarkably higher compare to α-cellulose is 33,47% and 2,416% respectively. FTIR spectra show C-O-C stretch of α-cellulose and cellulose nanocrystal at 1064 cm-1 which indicate that there are glycoside bonding in the compound structure. The peak 3448 cm-1 representative of the O-H group and peak near 2900-2924 cm-1 representatif of the C-H groups.
BAB 1
PENDAHULUAN
1.1.Latar Belakang
Jagung (Zea mays L) merupakan salah satu tanaman pangan dunia yang terpenting,
selain gandum dan padi. Sebagai sumber karbohidrat utama di Amerika Tengah dan
Selatan, jagung juga merupakan alternatif sumber pangan di Amerika Serikat.
Penduduk di beberapa daerah di Indonesia seperti Madura dan Nusa Tenggara juga
menggunakan jagung sebagai pangan pokok. Kebutuhan jagung di Indonesia saat ini
cukup besar, yaitu lebih dari 10 juta ton pipilan kering per tahun. Adapun konsumsi
jagung terbesar adalah sector pangan dan industri ternak (Budiman, 2002).
Produksi jagung Sumatera Utara (Sumut) pada tahun 2010 berdasarkan angka
tetap (Atap) III mencapai 1.337.718 ton, sementara produksi jagung di tahun 2011
sebesar 1.240.529 ton. Pada tahun 2012, Dinas Pertanian Sumut menyatakan produksi
jagung Sumut sebesar 1.500.552 ton dan 2013 sebesar 1.773.625 ton. Jumlah limbah
tersebut dapat dikatakan sangat banyak dan akan menjadi sangat potensial jika
dapat dimanfaatkan secara tepat.
Budiman (2002) menyatakan tongkol jagung adalah tempat tersusunnya bunga
betina, yang tumbuh diantara batang dan pelepah daun dimana merupakan tempat
penyimpanan makanan dan mengandung sekitar 40-41% selulosa. Komposisi kimia
dalam tongkol jagung membuat tongkol jagung dapat digunakan sebagai sumber
energi dan sumber karbon bagi pertumbuhan mikroorganisme.
Limbah pada dasarnya adalah suatu bahan yang tidak dipergunakan kembali
dari hasil aktivitas manusia maupun proses-proses alam. Jenis limbah yang belum
banyak dimamfaatkan adalah limbah pertanian. Limbah tongkol jagung biasanya hanya
digunakan sebagai tambahan bahan makanan ternak dan sebagai pengganti kayu bakar
Meskipun selulosa tidak dapat digunakan sebagai bahan makanan oleh
tubuh, namun selulosa yang terdapat sebagai serat-serat tumbuhan, sayuran atau
buah-buahan, berguna untuk memperlancar pencernaan makanan. Adanya
serat-serat dalam saluran pencernaan, gerak peristaltik ditingkatkan dan dengan
demikian memperlancar proses pencernaan dan dapat mencegah konstipasi. Tentu
saja jumlah serat yang terdapat dalam bahan makanan tidak boleh terlalu banyak
(Poedjiadi, 2006)
Selulosa hampir tidak pernah ditemui dalam keadaan murni di alam melainkan
selalu berikatan dengan lignin dan hemiselulosa. Serat selulosa alami terdapat di dalam
dinding sel tanaman dan material vegetatif lainnya. Selulosa tidak dapat diperoleh
dalam keadaan murni, namun hanya dapat diperoleh sebagai hasil yang kurang murni
yang biasanya disebut α-selulosa yang digunakan sebagai bahan pembuatan kertas
(Soeprijanto, 2008).
Nanokristal selulosa adalah suatu material yang dapat diperbarui dalam banyak
aplikasi berbeda, seperti dalam bidang kimia, makanan, farmasi, dan lain-lain. Suspensi
nanokristal selulosa dapat dibentuk menjadi suatu fase kristalin liquid. Proses isolasi
nanokristal selulosa memiliki banyak peninjauan, seperti dimensi skala nanometer,
tinggi kekuatan spesifik dan modulus, dan tinggi daerah permukaan (Habibi, 2010).
Nanokristal juga bisa dikatakan sebagai material berukuran nanometer dengan dimensi
tidak lebih dari seratus nanometer dan berbentuk kristalin. Pada umumnya, material
dengan dimensi kurang dari satu mikrometer atau seribu nanometer biasa disebut
partikel nanometer. Namun jika material tersebut menunjukkan sifat kristalinitas, maka
bisa disebut dengan nanokristal yang bisa dimamfaatkan dalam persiapan perangkat
biomedis, implan, dan tekstil karena sifatnya yang tidak beracun (Benavides, 2011).
Nanokristal selulosa yang berasal dari hidrolisis dengan menggunakan pelarut
DMAc/LiCl menghasilkan selulosa yang memiliki morfologi yang berbeda tergantung
pada kondisi hidrolisis, yang mempunyai diameter dalam kisaran 10-20 nm dan
panjang dari beberapa ratus nanometer kristalin. Hidrolisis ini adalah salah satu proses
yang digunakan untuk produk nanokristalin selulosa, yang merupakan bangunan kecil
blok yang dilepaskan dari serat selulosa yang murni. Selulosa murni terdiri dari daerah
dengan daerah kristalin, sehingga serat selulosa ketika menjadi sasaran dari pelarut
DMAc/LiCl, daerah amorf putus melepaskan daerah kristal (Peng, 2011).
Beberapa penelitian telah dilakukan yaitu Aulia (2012) telah meneliti tentang
nanokristal selulosa yang diisolasi dari Tandan Kosong Kelapa Sawit (TKKS) yang
dihidrolisis dengan menggunakan asam sulfat. Harahap (2012) telah meneliti tentang
selulosa asetat yang dibuat dari α-selulosa yang diisolasi dari Tandan Kosong Kelapa
Sawit (TKKS). α-selulosa yang diperoleh dari Tandan Kosong Kelapa Sawit diubah
menjadi selulosa asetat dengan penambahan asam asetat glasial. Habibah (2012) telah
meneliti tentang berat molekul dan derajat polimerisasi α-selulosa yang berasal dari
alang-alang (Imperatacylindrica) dengan metode viskositas. Viskositas α-selulosa yang
diperoleh diukur dengan menggunakan viscometer Ostwald dan pengukuran berat
molekul serta derajat polimerisasi dilakukan berdasarkan persamaan
Mark-Kuhn-Houwink.
Proses hidrolisis nanokristal selulosa dapat dilakukan dengan dua cara yaitu
hidrolisis dengan menggunakan asam sulfat dan hidrolisis dengan menggunakan pelarut
organik DMAc/LiCl. Silverio (2012) telah melakukan penelitian dengan menghidrolisis α-selulosa yang diperoleh dari tongkol jagung dengan menggunakan asam sulfat 9,17 M dengan variasi waktu hidrolisis 30, 60 dan 90 menit. Berdasarkan uraian diatas
penulis tertarik untuk melakukan penelitian dengan menghidrolisis α-selulosa yang
diperoleh dari tongkol jagung dengan menggunakan media pelarut organik
DMAc/LiCl.
1.2 PerumusanMasalah
Pada penelitian ini yang menjadi masalah adalah:
1. Apakah α-selulosa dapat diisolasi dari tongkol jagung.
3. Bagaimana karakterisasi nanokristal selulosa dari tongkol jagung, meliputi sifat
morfologi dengan menggunakan Transmisi Electron Microscopy (TEM),
analisis termal dengan menggunakan Thermogravimetry analysis (TGA) dan
analisa gugus fungsi dengan menggunakan fourier transform infrared (FTIR).
1.3Pembatasan Masalah
Penelitian ini mengambil batasan-batasan sebagai berikut:
1. Tongkol Jagung yang digunakan berasal dari limbah pemipilan biji jagung yang
didapat dari pabrik jagung Sepakat kelompok tani dusun 3 desa Bekulap,
kecamatan Selesai kabupaten Langkat.
2. Isolasi nanokristal selulosa dari α-Selulosa dilakukan melalui hidrolisis dengan
menggunakan pelarut DMAc/LiCl
3. Karakterisasi nanokristal selulosa yang diperoleh menggunakan Transmisi
Electron Microscopy (TEM), Thermogravimetry analysis (TGA) dan Fourier
Transform Infrared (FTIR).
1.4Tujuan Penelitian
Penelitian ini bertujuan:
1. Untuk mengetahui bagaimana cara memperoleh nanokristal selulosa dari α
-selulosa tongkol jagung.
2. Untuk mengetahui bagaimana hasil nanokristal yang diperoleh
3. Untuk mengetahui bagaimana hasil karakterisasi nanokristal selulosa dari
tongkol jagung.
1.5Manfaat Penelitian
Penelitian ini diharapkan dapat bermanfaat sebagai berikut:
1. Pemamfaatan tongkol jagung sebagai bahan baku pembuatan nanokristal
selulosa diharapkan mampu memberikan nilai tambah secara ekonomi pada
2. Memberikan informasi tentang cara memproduksi nanokristal selulosa dari α
-Selulosa yang diperoleh dari tongkol jagung dengan cara hidrolisis
menggunakan media pelarut organik DMAc/LiCl.
3. Sebagai bahan literatur di perpustakaan USU serta menjadi bahan penelitian
selanjutnya.
1.6Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Ilmu Dasar FMIPA USU Medan,
Laboratorium Kimia Fisika FMIPA USU Medan, uji FTIR di laboratorium organik
FMIPA UGM Yogyakarta, uji TEM di Laboratorium TEM FMIPA UGM Yogyakarta
dan Uji TGA di Laboratorium Terpadu FMIPA USU Medan.
1.7Metodologi Penelitian
Penelitian ini berupa eksperimen laboratorium. Ada beberapa tahapan penelitian
yaitu:
1. Tahap pertama adalah penyiapan Tongkol Jagung yang kemudian diisolasi
untuk mendapatkan α-Selulosa
2. Tahap kedua adalah isolasi nanokristal selulosa melalui hidrolisis dengan
menggunakan DMAc/LiCl dan dengan menggunakan sentrifugasi untuk
menghilangkan pelarut organik, sehingga diperoleh bentuk kristalnya
3. Tahap ketiga adalah karakterisasi nanokristal selulosa dengan menggunakan
Transmisi Electron Microscopy (TEM), dan Thermogravimetry analysis (TGA).
Variabel yang digunakan adalah :
a. Variabel tetap
Suhu (oC)
b. Variabel terikat
Ukuran partikel
Stabilitas termal
Spektrum inframerah
BAB 2
TINJAUAN PUSTAKA
2.1. Jagung
2.1.1 Taksonomi Jagung
Jagung (Zea mays L) berasal dari Amerika Tengah atau Meksiko bagian Selatan.
Budidaya jagung telah dilakukan di daerah ini 10.000 tahun yang lalu, lalu teknologi ini
dibawa ke Amerika Selatan sekitar 7000 tahun yang lalu. Jagung hasil budidaya
merupakan keturunan langsung dari teosinte (zea mays ssp. Parviglumis). Bentuk liar
tanaman jagung disebut pod maize dan telah tumbuh 4500 tahun yang lalu di
pegunungan Andes, Amerika Selatan. Literatur lain menyebutkan bahwa jagung
tumbuh subur di kawasan Meksiko, kemudian menyebar ke Amerika Tengah dan
Amerika Selatan (Rukmana, 1997).
Dalam sistematika (taksonomi) tumbuhan, kedudukan tanaman jagung
diklasifikasikan sebagai berikut:
Kingdom : Plantae
Divisio : Spermatophyta
Subdivisio : Angiospermae
Kelas : Monocotyledonae Ordo
: Poales Famili
: Poaceae (Graminae) Genus
: Zea
Spesies : Zea mays L.
Di indonesia jagung merupakan makanan pokok kedua setelah pati. Ada
beberapa daerah di indonesia yang mengkonsumsi jagung antara lain Madura,
Tanaman jagung termasuk jenis tanaman pangan yang diketahui banyak
mengandung serat kasar. Serat kasar tersebut terdiri atas lignin, hemiselulosa, selulosa
dan lignoselulosa. Masing-masing senyawa tersebut merupakan senyawa potensial
yang dapat dikonversikan untuk menjadi senyawa lain secara biologik (Soeprijanto,
2008).
2.1.2 Komposisi Tongkol Jagung
Jagung juga merupakan sumber thiamin (vitamin B1) yang sangat penting bagi
kesehatan sel otak dan fungsi kognitif sebab thiamin dibutuhkan untuk membentuk
acetylcholine yang berfungsi untuk memaksimalkan komunikasi antar sel untuk
mencegah terjadinya pikun atau penyakit alzheimer. Biji jagung terdiri atas empat
bagian utama yaitu kulit luar (5%), lembaga (12%), endosperma (82%), dan tudung biji
(1%). Tongkol jagung kaya akan pentosa yang dipakai sebagai bahan baku pembuatan
furfural (Budiman, 2002). Tongkol jagung merupakan bagian terbesardari limbah
jagung. Dari berat jagung bertongkol, diperkirakan 40-50% adalah tongkol jagung,
yang besarnya dipengaruhi oleh varietas jagungnya (Richana, 2007).
Menurut Richana (2007) tongkol jagung merupakan bahan berlignoselulosa
(kadar serat 38,99%) yang mengandung xilan tertinggi (12,4%) dibanding limbah
pertanian lain. Xilan adalah hemiselulosa yang merupakan polimer dari pentosa atau
xilosa dengan ikatan ß-1,4 yang jumlah monomernya berkisar 150-200 unit.
Hemiselulosa sendiri merupakan polimer dari monomer gula (gula-gula anhidro) yang
dapat dikelompokkan menurut penyusunnya yaitu heksosa (glukosa, manosa dan
galaktosa), pentosa (xilosa, arabinopiranosa, arabinofuranosa), asam heksuronat
(glukoronat, metilglukoronat dan galakturonat) dan deoksi heksosa (rhamnosa dan
fruktosa). Rantai utama hemiselulosa hanya terdiri atas satu macam monomer saja
(homopolimer), misalnya xilan, atau terdiri dua atau lebih monomer (heteropolimer),
misalnya glukomanan.
Pada umumnya limbah tidak mempunyai nilai ekonomi, atau mempunyai nilai
ekonomi yang rendah. Rendahnya nilai ekonomi limbah karena sifatnya yang dapat
Memanfaatkan limbah adalah salah satu alternatif untuk menaikkan nilai ekonomi
limbah. Limbah pertanian yang dapat dimanfaatkan diantaranya adalah tongkol jagung,
yang selama ini hanya dijadikan pakan ternak atau hasil industri minyak jagung.
Sebenarnya tongkol jagung dapat diolah kembali menjadi produk yang memiliki nilai
ekonomi yang tinggi (Soeprijanto, 2008).
Tongkol jagung muda dan biji jagung merupakan sumber karbohidrat
potensial untuk dijadikan bahan pangan, sayuran , dan bahan baku berbagai industri
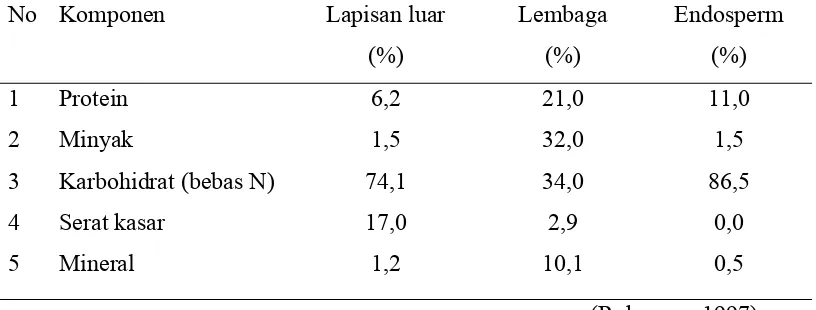
makanan. Kandungan kimia jagung dapat dilihat pada tabel 2.1 terdiri atas air 13,5%,
protein 10,0%, lemak 4,0%, karbohidrat 61,0%, gula 1,4%, pentosan 6,0%, serat
kasar 2,3%, abu 1,45, dan zat-zat lain 0,4% (Rukmana, 1997).
Tabel 2.1. Komposisi kimia jagung (% bobot kering)
No Komponen Lapisan luar
Karbohidrat (bebas N)
Serat kasar
Limbah pertanian (seperti tongkol jagung), mengandung selulosa (40-60%),
hemiselulosa (20-30%) dan lignin (15-30%). Komposisi kimia tersebut membuat
tongkol jagung dapat digunakan sebagai sumber energi, bahan pakan ternak dan
sebagai sumber karbon bagi pertumbuhan mikroorganisme. Tongkol jagung juga
dapat dipakai sebagai bahan dasar pembuatan xylitol (Shofianto, 2008). Komposisi
tongkol jagung dapat dilihat pada Tabel 2.2.
Tabel 2.2. Komposisi tongkol jagung
kandungan (%)
Air 9
Hemiselulosa 26
Xilan 18
Lignin 6
(Shofianto, 2008)
Pemanfaatan tongkol jagung masih sangat terbatas. Kebanyakan limbah tongkol
jagung hanya digunakan untuk bahan tambahan makanan ternak, atau hanya
digunakan sebagai pengganti kayu bakar. Melihat komposisi selulosa dan hemiselulosa
yang cukup besar seperti yang tertera pada tabel 2.2, maka tongkol jagung sangat
potensial untuk dimanfaatkan menjadi bentuk biopolimer. Selulosa merupakan sumber
karbon yang dapat digunakan mikroorganisme sebagai substrat dalam proses
fermentasi. Struktur berkristal dan adanya lignin dan hemiselulosa merupakan
hambatan utama dalam menghidrolisis selulosa. Pada hidrolisis yang sempurna akan
dihasilkan glukosa, sedangkan hidrolisis parsial akan dihasilkan disakarida sellobiosa
(Soeprijanto, 2008).
2.2 Selulosa
2.2.1 Pengertian Selulosa
Selulosa adalah polisakarida yang terbentuk dari sisa β-D(+)-glukosa yang bergabung
dalam rantai linear dengan ikatan β-1-4 diantara satuan glukosanya. Selulosa
merupakan senyawa polimer yang berlimpah di alam dan merupakan senyawa organik
yang paling umum (Deman, 1997).
Selulosa berfungsi sebagai bahan struktur dalam jaringan tumbuhan dalam
bentuk campuran polimer homolog dan biasanya disertai polisakarida lain seperti lignin
dalam jumlah yang beragam. Lignin dapat dihilangkan dengan cara delignifikasi. Ada
beberapa faktor yang mempengaruhi delignifikasi yaitu:
Bahan-bahan yang dapat digunakan dalam proses delignifikasi yaitu asam
phosfat, asam klorida (HCl), asam sulfat, dan yang basa seperti NaOH, natrium sulfit
dan natrium sulfat.
b. Waktu delignifikasi
Pada proses delignifikasi waktu berpengaruh pada hasil delignifikasi, biasanya
digunakan waktu 1-3 jam.
c. Temperatur delignifikasi
Temperatur operasi mempengaruhi kualitas dari produk delignifikasi yang
dihasilkan (Widodo, 2012).
Campuran senyawa lain yang terdapat bersamaan dengan selulosa yaitu
hemiselulosa. Hemiselulosa adalah polisakarida kompleks nonselulosa dan nonpati
yang terdapat dalam banyak jaringan tumbuhan. Hemiselulosa mengacu kepada
polisakarida nonpati yang tidak larut dalam air, pentosa mengacu kepada polisakarida
nonpati yang larut dalam air. Hemiselulosa tidak berperan dalam biosintesis selulosa
tetapi dibuat tersendiri dalam tumbuhan sebagai komponen struktur dinding sel.
Hemiselulosa dikelompokkan berdasarkan kandungan gulanya (Deman, 1997).
Molekul selulosa memanjang dan kaku, meskipun dalam larutan. Gugus
hidroksil yang menonjol dari rantai dapat membentuk ikatan hidrogen dengan mudah,
mengakibatkan kekristalan dalam batas tertentu (Deman, 1997).
Ketika meneliti struktur selulosa, sebagai contoh lain dari polisakarida di mana
monomer glukosa diatur dengan cara yang sesuai dengan fungsinya (Solomon, 1987).
Struktur elulosa merupakan polimer dari D-glukosa di mana masing-masing unit
dihubungkan oleh β -glukosida obligasi dari karbon anomerik unit ke hidroksi 1-4 dari
unit berikutnya. Selulosa dapat dihidrolisis oleh asam klorida 30% untuk memberikan
Gambar 2.1 Struktur kimia selulosa (Streitweiser, 1986).
Diketahui bahwa selulosa murni, ketika mengalami hidrolisis, dapat
dengan mudah terurai menjadi "mikrokristal selulosa "dengan hampir tidak ada
penurunan berat. Turunan selulosa dapat dibuat dengan proses eterifikasi, esterifikasi,
ikat silang, atau reaksi grafting-kopolimerisasi.untuk memodifikasi struktur selulosa,
ikatan hidrogen harus dihancurkan dengan cara pembengkakan atau pemutusan (Yu,
2009). Selulosa yang diperbaharui digunakan sebagai serat (rayon sutera nabati buatan)
dan sebuah film (kertas kaca), turunan selulosa secara kimia seperti ester organik dan
asetat adalah yang paling penting dan merupakan polimer bagian kecil dengan struktur
yang hampir sama dengan selulosa (Billmayer, 1984).
2.2.2 Sumber Selulosa
Jaringan berserat dalam dinding sel mengandung polisakarida selulosa. Polisakarida ini
adalah polimer alam yang paling banyak terdapat dan paling banyak tersebar di alam.
Jutaan ton selulosa digunakan setiap tahun untuk membuat perabot kayu, tekstil, dan
kertas. Sumber utama selulosa adalah kayu, umumnya kayu mengandung sekitar 50%
selulosa, tanaman mengandung 33% dan kapas mengandung 90% selulosa (Cowd,
1991).
Selulosa menjadi konstituen utama dari berbagai serat alam yang terjadi sebagai
rambut-rambut biji yang mengelilingi biji-bijian dari beberapa jenis tumbuhan
(misalnya kapas), sebagai kulit bagian dalam kayu yang berserat (serta batang) dan
sebagai konstituen-konstituen berserat dari beberapa tangkai daun (serat-serat daun).
Jumlah selulosa dalam serat bervariasi menurut sumbernya dan biasanya berkaitan
mineral. Derajat polimerisasi dari selulosa kapas berkisar 15.000 dibandingkan dengan
sekitar 10.000 untuk selulosa kayu. Pemisahan selulosa kayu dari lignin menyebabkan
penurunan DP ke sekitar 2600 (Steven, 2001).
Adapun sumber selulosa yaitu:
1. Kayu
2. Bukan kayu
a. Serat buah/biji (seed fibers) : kapas, kapuk
b. Serat kulit (bast fibers) : rami, kenaf, rosela dll
c. Serat daun (leaf fibers) : Nenas, pisang dll
d. Residu pertanian (agriculture Residues) :bagas, jerami, merang, tandan kosong
sawit, tongkol jagung
e. Bambu
f. Non vegetable : bacterial cellulose (BC) sebagai bahan akustik, kertas khusus.
Pemisahan selulosa dari kayu melibatkan pembuburan kayu dengan larutan
belerang dioksida dan hidrogen sulfit dalam air pada proses sulfit atau larutan natrium
hidroksida dan natrium sulfida dalam air pada proses sulfat (Proses kraf). Pada proses
ini lignin dilarutkan sehingga diperoleh selulosa (Cowd, 1991).
2.2.3 Jenis-Jenis Selulosa
Jenis selulosa yang dapat digunakan sebagai bahan baku pembuatan pulp dan kertas
adalah yang sifat fisik maupun kimianya seseragam mungkin serta dapat secara kontinu
tersedia dalam jumlah yang banyak. Jumlah selulosa limbah tongkol jagung sangat
banyak sehingga bisa digunakan sebagai sumber selulosa untuk bahan baku pembuatan
pulp dan kertas (Sutiya, 2012).
Selulosa sangat stabil dalam berbagai pelarut dan hanya dapat dihancurkan
dengan adanya asam kuat atau sistem pelarut dengan ikatan hidrogen yang kuat,
biasanya basa-amina. Selulosa membentuk mikrofibril melalui ikatan inter dan
intramolekuler sehingga memberikan struktur yang dapat dipecah. Mikrofibril selulosa
Berdasarkan Derajat Polimerisasi (DP) dan kelarutan dalam senyawa natrium
hidroksida (NaOH) 17,5%, selulosa dapat dibedakan menjadi tiga jenis :
1. Selulosa alfa : selulosa berantai panjang, tidak larut dalam larutan NaOH 17,5%
atau larutan basa kuat dengan DP (Derajat Polimerisasi) 600 – 1500 sebagai
penentu tingkat kemurnian selulosa.
2. Selulosa beta : selulosa berantai pendek, larut dalam larutan NaOH 17,5% atau basa
kuat dengan DP (Derajat Polimerisasi) 15 – 90 dan juga dapat mengendap bila di
netralkan.
3. Selulosa gamma : sama seperti selulosa beta, tetapi Derajat Polimerisasinya kurang
dari 15 (Widodo, 2012).
Selulosa alfa merupakan kualitas selulosa yang paling tinggi (murni). Selulosa
alfa digunakan sebagai penentu tingkat kemurnian selulosa (Sugiyama, 1991). Selulosa
mempunyai daerah kristal dan daerah amorf, daerah kekristalan lebih rapat daripada
daerah nonkristal. Daerah nonkristal merupakan penyusun kecil yang disebut sebagai
daerah amorf yang tidak menyerap air dengan bagus (Gardner, 2008).
2.2.4 Sifat Kimia Selulosa
Selulosa mengembang (swelling) dalam air dan teristimewa dalam basa pekat. Polimer
yang mengembang dalam basa, dikenal sebagai selulosa alkali atau selulosa soda
dipakai untuk mempreparasikan selulosa regenerasi. Proses mereaksikan kapas dengan
basa air, dan kemudian menghilangkan basa tersebut dikenal sebagai merserasi. Kapas
yang termerserasi memiliki tingkat kekilauan yang lebih tinggi daripada kapas alam
yang kurang rapat, dan tingkat kekristalannya agak sedikit rendah.
Meskipun jumlah gugus hidroksil pada selulosa besar, selulosa tidak larut dalam
air dan sebagian besar pelarut lainnya yang umum, meskipun akan larut ke beberapa
campuran pelarut. Larutan dari logam-logam kompleks seperti tembaga (II)-amonia
adalah LiCl-dimetilasetamida, dimetil sulfoksida-paraformaldehida, amin oksida dan
asam fosfat (Steven, 2001).
Sifat – sifat selulosa dengan pereaksi kimia :
1. Selulosa dengan asam encer tidak dapat terhidrolisis
2. Selulosa dengan asam konsentrasi yang tinggi dapat terhidolisis menjadi selubiosa
dan D-glukosa
3. Dengan asam sulfat dapat menghidrolisis selulosa, digunakan untuk pembuatan
kertas. Selulosa direaksikan dengan aluminium sulfat yang dapat bereaksi dengan
sejumlah kecil pulp kertas untuk menghasilkan aluminium karboksilat yang
membantu mengentalkan serat pulp menjadi permukaan kertas yang keras (Cowd,
1991).
Turunan selulosa yang merupakan selulosa komersil seperti selulosa asetat, berperan
dalam film fotografi, bahan perekat, dan serat sintetik. Selulosa asetat mempunyai sifat
– sifat yaitu: tidak satbil, mudah terbakar bila bereaksi dengan oksigen film selulosa
asetat menjadi rusak dan tidak dapat digunakan lagi serta melepaskan asam asetat.
Untuk mengukur massa molekul selulosa sangat sulit karena:
a. Tidak banyak pelarut untuk selulosa
b. Selulosa sangat cenderung terombak selama proses
c. Cukup rumit menggunakan selulosa dari sumber yang berbeda.
Cara yang seringkali dipilih ialah menitratkan selulosa dengan cara tak merusak
massa molekul awal bagi selulosa sebelum dinitratkan (Steven, 2000).
Ditinjau dari strukturnya dapat saja diharapkan selulosa mempunyai kelarutan
yang besar dalam air, karena banyaknya kandungan gugus hidroksil yang dapat
membentuk ikatan hidrogen dengan air (antaraksi yang tinggi antara pelarut-pelarut).
Akan tetapi kenyataannya tidak demikian, selulosa bukan hanya tak larut dalam air dan
juga dalam pelarut lain seperti pelarut-pelarut organik. Penyebabnya adalah kekuatan
rantai dan tingginya gaya antar-rantai tersebut akibat ikatan hidrogen antar gugus
kekristalan yang tinggi dari serat selulosa. Selulosa juga larut dalam larutan tembaga
(II) hidroksida bromida (Cowd, 1991).
2.3 Nanokristal Selulosa
Definisi umum dari nanopartikel adalah partikel padat dengan ukuran sekitar 10–100
nm. Metode preparasi sangat mempengaruhi pembentukan nanopartikel, baik itu dalam
bentuk nanosphere, atau nanokapsul. Nanopartikel memiliki sifat yang baik karena
faktor peningkatan luas permukaan dan efek kuantum yang dapat meningkatkan
reaktivitas, kekuatan, dan sifat listrik. Parameter utama dari nanopartikel adalah
bentuknya, ukuran dan marfologi struktur dari substansi (Liufu, 2004).
Nanokristal selulosa adalah nanopartikel kristalin terbuat dari selulosa biasanya
mempunyai lebar 2-6 nm dan panjang ratusan nanometer. Nanokristal selulosa dapat
diproduksi dengan menghidrolisis bagian yang amorf dari daerah selulosa dan
meninggalkan kristal yang berbentuk utuh. Asam kuat seperti asam sulfat, asam nitrat
dan asam klorida telah digunakan untuk selektif menghidrolisis bentuk yang amorf dari
selulosa. Kondisi yang optimal adalah metode hidrolisis dengan menggunakan asam
sulfat untuk mempersiapkan individual kristalit (Rong, 2011).
Metode-metode hidrolisis yang dapat digunakan untuk menghidrolisis selulosa
menjadi nanokristal ada 5 yaitu:
a. Sistem pelarut LiCl/DMAc
Sekitar tahun 1980 ditemukan bahwa N-dimetil-acetamida (DMAc) yang
mengandung lithium klorida (8-9%) dapat melarutkan selulosa. Sistem ini
menunjukkan potensi yang besar untuk selulosa dalam sintesis organik serta untuk
tujuan analitik karena pelarut tidak berwarna dan pembubaran berhasil tanpa atau
setidaknya degradasi diabaikan bahkan dalam kasus berat molekul yang tinggi
polisakarida seperti bahan katun atau selulosa bakteri. Kandungan selulosa dalam
pembubaran selama 6 jam pada suhu 100oC. Selulosa yang mempunyai berat molekul
tinggi dapat larut dengan waktu isolusi yang dapat dipersingkat jika suhu awal proses
pembubaran adalah 150oC dan sistem didinginkan perlahan-lahan.
Klorida-selulosa menyumbang sekitar 80% terhadap dipole-dipole interaksi antara
DMAc dan selulosa, sedangkan Li spesifik (DMAc) n-selulosa interaksi kontribusi
sekitar 10%.
b. Sistem pelarut NMMO
Proses ini didasarkan pada penggunaan pelarut N-metil morfolina-N-oksida
(NMMO) monohidrat, dimana 100oC pelarut NMMO dalam kombinasi dengan air
dapat melarutkan selulosa biasanya sebagai monohidrat (sekitar 13% air) di sekitar
100oC tanpa aktivasi sebelumnya atau derivatisasi. NMMO/H2O/DETA telah terbukti
menjadi pelarut termodinamika baik untuk selulosa dan cocok untuk sampel berbagai
asal-usul. Suatu larutan 32,6% berat NMMO, 10,0% berat H2O, dan 57,4% DETA
dapat melarutkan selulosa pada suhu kamar, dan suhu sedikit lebih tinggi (40oC) pada
proses awal pelarutan hanya memerlukan waktu yang pendek untuk isolasi.
c. Sistem pelarut berbasis logam pengkompleks
Sejumlah logam pengkompleks dapat digunakan untuk melarutkan selulosa. Pelarut
yang paling terkenal pada kelompok ini adalah kupri hidroksida dalam amonia berair,
yang sering disebut cuoxam. Selulosa dapat dilarutkan ke tingkat molekuler dalam
cuoxam dan paling efektif mengikat koordinatif dari kompleks logam ke gugus
hidroksil terdeprotonasi di posisi C2 dan C3 dari AGU dalam rantai. Namun, cuoxam
memiliki beberapa kelemahan, yang terdiri dari rantai selulosa yang mudah
terdegradasi, warna biru tua, dan kekuatan pelarutan terbatas yaitu terbatas pada derajat
polimerisasi DP 5000.
d. Sistem pelarut ionik cair
Sistem ini dapat digunakan sebagai pelarut untuk selulosa non derivat (bukan
turunan). Pelarut ini menggabungkan anion, yang akseptor ikatan hidrogen kuat adalah
yang paling efektif, terutama bila dikombinasikan dengan pemanasan microwave,
e. Sistem pelarut NaOH/Urea berair
Untuk menghidrolisis selulosa dapat dicapai dengan cepat (sekitar 5 menit) pada
suhu kamar (di bawah 20oC), dan larutan yang dihasilkan tidak berwarna dan
transparan. Namun, selulosa dengan berat molekul yang relatif tinggi tidak dapat larut
dalam pelarut tanpa pendinginan ke -12oC atau tanpa penambahan urea (Yu, 2009).
2.4Ultrasonifikasi
Spektrum suara (sonic) yang memiliki frekuensi sangat tinggi disebut ultrasonik.
Rentang frekuensi ultrasonik yaitu 20 kHz–10 MHz. Ultrasonik dibagi menjadi tiga
golongan utama: frekuensi rendah (20–100 kHz), frekuensi menengah (100 kHz–1
MHz), dan frekuensi tinggi (1–10 MHz). Ultrasonik dengan frekuensi 20 kHz – 1 MHz
banyak digunakan dalam bidang kimia yang biasa disebut dengan sonokimia
(Sonochemistry). Frekuensi ultrasonik diatas 1 MHz banyak digunakan dalam bidang
kedokteran seperti pencitraan, analisis aliran darah, kedokteran gigi, sedot lemak, ablasi
tumor, dan penghancuran batu ginjal (Ensminger, 2009).
Menurut Kuldiloke (2002), salah satu manfaat metode ekstraksi ultrasonik
adalah untuk mempercepat proses ekstraksi. Hal ini dibuktikan dengan penelitian
Cameron (2006) tentang ekstraksi pati jagung yang menyebutkan rendemen pati jagung
yang didapat dari proses ultrasonik selama 2 menit adalah sekitar 55,2-67,8 % hampir
sama dengan rendemen yang didapat dari pemanasan dengan air selama 1 jam yaitu
53,4%. Dengan penggunaan ultrasonik proses ektraksi senyawa organik pada tanaman
dan biji-bijian dengan menggunakan pelarut organik dapat berlangsung lebih cepat.
Dinding sel dari bahan dipecah dengan getaran ultrasonik sehingga kandungan yang
ada di dalamnya dapat keluar dengan mudah (Mason,1990).
Cara kerja metode ultrasonik dalam mengekstraksi adalah sebagai berikut:
gelombang ultrasonik terbentuk dari pembangkitan ultrason secara lokal dari kavitasi
mikro pada sekeliling bahan yang akan diekstraksi sehingga terjadi pemanasan pada
bahan tersebut, sehingga melepaskan senyawa ekstrak. Terdapat efek ganda yang
selama 17 jam dengan satu set zat terlarut dengan berat molekul yang diketahui.
Dikatakan bahwa berat molekul zat terlarut setidaknya 90% tertahan selama tes dan zat
terlarut yang keluar kurang dari 10%.
Untuk mengaktifkan membran dialsis dilakukan dengan cara yaitu, membran
dialisis yang telah dipotong dimasukkan ke dalam suatu wadah yang telah diisi dengan
aquabidest lalu dipanaskan pada suhu 40oC selama 30 menit. Membran yang telah
diaktifkan bisa langsung digunakan untuk proses dialisis.
Larutan yang mengandung beberapa jenis molekul, biasanya glukosa dan pati,
ditempatkan ke dalam kantong dialisis semipermeabel, seperti membran selulosa
dengan pori-pori, dan ditutup dengan simpul. Kantong dialisis disegel ditempatkan
dalam wadah larutan atau aquadest. Molekul cukup kecil untuk melewati membran (air,
garam, monosakarida, dan molekul kecil lainnya) cenderung bergerak ke dalam atau
keluar dari kantong dialisis ke arah konsentrasi yang rendah, sehingga terjadilah difusi.
Molekul yang lebih besar (seperti protein, atau polisakarida) yang memiliki dimensi
jauh lebih besar daripada diameter pori dipertahankan dalam kantong dialisis (Mahlicli,
2007).
2.6Transmisi Electron Microscopy (TEM)
Mikroskop adalah alat yang memungkinkan perbesaran obyek untuk mengamati
rincian dari obyek tersebut. Perkembangannya mulai dari mikroskop optik yang
menggunakan satu seri lensa gelas untuk membelokkan gelombang cahaya tampak
agar menghasilkan citra yang diperbesar, mikroskop petrografik, mikroskop
medan-gelap, mikroskop rasa, mikroskop ultraviolet, mikroskop medan dekat dan
mikroskop elektron yang menggunakan berkas elektron untuk mengiluminasi obyek
elektron memiliki panjang gelombang yang jauh lebih kecil daripada panjang
gelombang cahaya, jadi mikroskop elektron dapat melihat struktur yang lebih kecil
(Ardisamita, 2000).
Difraksi elektron biasanya diselesaikan dengan memakai mikroskop elektron
Sampel-sampel polimer harus sangat tipis dalam beberapa ratus satuan amstrong.
Sebagaimana dengan difraksi sinar-x, informasi yang dikumpulkan oleh difraksi
elektron mesti mempergunakan morfologi dimensi kristal, derajat kekristalan, dan
lain-lain. Keuntungan utama dari difraksi elektron adalah bahwa (1) pengukuran difraksi
dan transmisi sekaligus menjadi mungkin dalam satu sampel, (2) syarat-syarat ukuran
sampel sangat kecil, dan (3) intensitas difraksi dan jumlah refleksi jauh lebih tinggi.
Kekurangannya adalah bahwa elektron-elektron bisa menimbulkan reaksi-reaksi radikal
bebas (misalnya, pengguntingan rantai, ikat silang) dalam sampel tersebut.
Ketika mikroskop elektron dioperasikan dalam mikroskop elektron transmisi,
merupakan hal yang memungkinkan untuk memecahkan sifat-sifat morfologis seperti
kristal-kristal tunggal polimer dengan resolusi dalam daerah 2 sampai 5 amstrong pada
pembesaran 200.000 sampai 500.000. pencitraan yang bagus dengan menggunakan
TEM bergantung pada kontras sampel relatif terhadap latar (Steven, 2001).
Ketika elektron ditransmisikan pada spesimen tipis tanpa adanya interaksi
dalam spesimen, maka berkas elektron ini dikatakan mengalami transmisi. Transmisi
elektron berbanding terbalik dengan ketebalan specimen. Bidang spesimen yang lebih
tebal akan mengalami transmisi elektron lebih sedikit sehingga akan terlihat lebih
gelap, sebaliknya daerah tipis akan mengalami lebih banyak transmisi elektron,
sehingga akan terlihat lebih terang (Voutou, 2008).
Menurut Ardisasmita (2000), berkas elektron dipancarkan langsung melalui
obyek yang akan diperbesar, sebagian diserap dan sebagian lainnya dilewatkan.
Obyek tersebut harus dipotong sangat tipis agar dapat dilihat dengan TEM yaitu
tebalnya harus lebih kecil dari beberapa ribu angstrom. Biasanya pelat fotografi
atau layar flouresensi ditempatkan di belakang cuplikan untuk menangkap citra dan
perbesaran yang dihasilkan bisa mencapai satu juta kali.
Mikrograf elektron transmisi dari serat selulosa yang diambil dengan CM
Philips 30 mikroskop elektron transmisi dengan tegangan 75 kV percepatan. Nanofibril
diendapkan dari dispersi encer berair padaukuran mikro ditutupi dengan film tipis
karbon (~ 200 nm). Serat yang disimpan paling sering diwarnai dengan larutan uranil
2.7 Analisis Termogravimetri (TGA).
Metode thermal adalah sebuah bagian dari teknik dimana sifat fisik dan kimia dari zat
atau produk reaksi tersebut diukur sebagai fungsi temperatur, zat/substansi sebagai
objek yang dikontrol temperaturnya. Aplikasinya untuk quality kontrol, penelitian
produk industri seperti polimer, farmasi, tanah, mineral, dan logam. Teknik-teknik yang
dicakup dalam metode analisis termal adalah analisis termogravimetri
(thermogravimetry analysis = TGA) yang didasari pada perubahan berat akibat
pemanasan. TGA merupakan teknik mengukur perubahan berat suatu sistem bila
temperaturnya berubah dengan laju tertentu.
Teknik analisis termogravimetri dapat dilakukan baik secara dinamik maupun
secara statik. Pada termogravimetri dinamik, sampel dinaikkan temperaturnya secara
linear terhadap waktu. Pada cara statik atau termogravimetri isotermal, sampel
dipelihara temperaturnya pada suatu periode waktu tertentu, selama waktu tersebut
setiap perubahan berat dicatat. Pada rangkaian peralatannya diperlukan paling tidak tiga
komponen utama yaitu timbangan berpresisis tinggi, tungku dan perekam. Kenaikan
temperatur dalam tungku haruslah berfungsi linear terhadap waktu dan mampu
digunakan baik dalam lingkungan inert, oksidasi maupun reduks. Perubahan temperatur
dan berat direkam secara kontinyu sedemikian rupa sehingga tidak ada satu termogram
yang terlewati (Khopkar, 1990).
TGA dipakai terutama untuk menetapkan stabilitas panas polimer-polimer.
Metode TGA yang paling banyak dipakai didasarkan pada pengukuran berat yang
kontinyu terhadap suatu neraca sensitif (disebut neraca panas) ketika suhu sampel di
naikkan dalam udara atau dalam suatu atmosfer yang inert. TGA ini dinyatakan sebagai
nonisotermal. Data dicatat sebagai termogram berat versus temperatur. Hilangnya berat
bisa timbul dari evaporasi lembab yang tersisa atau pelarut, tetapi pada suhu-suhu yang
lebih tinggi terjadi dari terurainya polimer. Selain memberikan imformasi mengenai
stabilitas panas, TGA bisa dipakai untuk mengkarakterisasi polimer melalui hilangnya
suatu entitas yang diketahui, seperti HCl dari poli (vinil klorida). TGA juga
lainnya. Penelitian-penelitian stabilitas panas adalah merupakan aplikasi dari TGA
(Steven, 2001).
Termogravimetri analisis dilakukan dengan menggunakan sebuah Mettler
Toledo Model TGA/SDTA851e termogravimetri analyzer untuk mencegah terjadinya
penambangan stabilitas termal. Untuk analisis, sampel dipanaskan dari kamar suhu 600
o
C dalam atmosfir nitrogen pada 10o C min-1 (Sheltami, 2012). Metode analisis termal
ini diantaranya berguna untuk mengetahui formula materi hasil dekomposisi termal. Ia
berguna juga untuk mengetahui range temperatur. Ini dapat dilakukan laju pemanasan
dan mencatat perubahan beratnya. Data termogravimetri dapat dimamfaatkan untuk
mengevaluasi parameter kinetik (Khopkar, 1990).
2.7Fourier Transform Infrared (FTIR)
Fourier transform infrared (FTIR) adalah teknik yang digunakan untuk
mendapatkan spektrum inframerah penyerapan, emisi, fotokonduktivitas atau hamburan
Raman dari padat, cair atau gas. Spektrometer FTIR secara bersamaan mengumpulkan
data spektral dalam berbagai spektrum yang luas. Ini mendapat keuntungan yang
signifikan atas spektrometer dispersif yang mengukur intensitas sedikit rentang panjang
gelombang pada suatu waktu.
Hasil spektrum memperlihatkan absorbsi dan transmisi molecular, membentuk
sidik jari molekul sampel. Seperti halnya sidik jari, tidak ada dua struktur molekul
berbeda yang memiliki spektrum inframerah yang sama (Lawson, 2001). Hampir
semua molekul menyerap sinar inframerah, dan masing-masing molekul hanya
menyerap sinar inframerah padafrekuensi tertentu. Hal ini menunjukkan karakteristik
khas untuk setiap molekul. Masing-masing jenis molekul hanya menyerap pada
frekuensi tertentu dan akan terbentuk pola spektrum absorpsi yang khas atau sidik jari
pada spectrum inframerah.
Shimadzu telah merilis berbagai sistem FTIR membuat resolusi tinggi dan
sensitivitas tinggi dan berbagai instrumen terkait, seperti unit mikroskop inframerah,
aplikasi pengukuran non-destruktif, seperti untuk memenuhi syarat. Teknik
spektroskopi IR banyak digunakan dalam tahap karakterisasi selulosa karena metode
ini relatif mudah dan dapat memberikan informasi awal tentang komposisi kimia,
konformasi molekular serta pola ikatan hidrogen (Silverio, 2012).
Spektroskopi FTIR didasarkan pada prinsip bahwa hamper semua molekul
mengabsorpsi sinar inframerah. Hanya monoatomik dan molekul diatomik homopolar
yang tidak mengabsorpsi sinar inframerah. Pancaran inframerah yang kerapatannya
kurang dari 100 cm-1 diserap oleh sebuah molekul organik dan diubah menjadi energi
putaran molekul. Spectrum rotasi molekul terdiri dari garis-garis yang tersendiri.
Atom molekul bergerak dengan berbagai cara tetapi selalu pada tingkat energy
tertentu. Energy getaran rentang untuk molekul organik harus sesuai dngan radiasi
inframerah dengan bilangan gelombang 1200-4000 cm-1. Terdapat dua macam getaran
molekul, yaitu getaran ulur dan getaran tekuk. Identifikasi pita absorpsi khas yang
disebabkan oleh berbagai gugus fungsi merupakan dasar penafsiran spectrum
inframerah. Ikatan O-H dari golongan karboksil diabsorpsi pada daerah 2500 sampai
3300 cm-1 dan ikatan C=O ditunjukkan diantara 1710 sampai 1750 cm-1. Hanya getaran
yang menghasilkan perubahan momen dwi kutub secara berirama yang teramati di
dalam inframerah (Rong, 2011).
BAB 3
METODE PENELITIAN
3.1Alat Penelitian
Alat-alat yang digunakan pada penelitian ini adalah:
Nama Alat Merek
alat-alat Gelas Pyrex
Neraca Analitis OHaus
Termometer Fisher
Hot Plate Cimarec
Statif dan klem -
Oven Carbolite
Indikator Universal Merck
Sentrifugator Himachi
Seperangkat alat TGA shimadzu
Seperangkat alat TEM JEOL
3.2Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah:
Bahan Merek
Tongkol Jagung -
Aquadest -
Asam nitrat (HNO3) 65% merck
Natrium nitrit (NaNO2) merck
Natrium hidroksida (NaOH) merck
Natrium sulfit (NaSO3) merck
Natrium hipoklorit (NaOCl) 12% merck
Hidrogen peroksida (H2O2) 30% merck
Dimetil acetamida (DMAc) 99% merck
Litium klorida (LiCl) merck
3.3 Prosedur Kerja
3.3.1 Pembuatan Reagen
3.3.1.1 Pembuatan Larutan HNO3 3,5%
Disediakan HNO3 65% sebanyak 53,8 ml, dimasukkan kedalam labu takar 1000 ml,
diencerkan dengan aquadest sampai garis tanda, dihomogenkan.
3.3.1.2 Pembuatan Larutan NaOH 2%
Ditimbang 20 gram NaOH, dimasukkan kedalam labu takar 1000 ml. Diencerkan
dengan aquadest sampai garis tanda dan dihomogenkan.
3.3.1.3 Pembuatan Larutan NaSO3 2%
Ditimbang 20 gram NaSO3, dimasukkan kedalam labu takar 1000 ml. Diencerkan
dengan aquadest sampai garis tanda dan dihomogenkan.
3.3.1.4 Pembuatan Larutan NaOCl 1,75%
Disediakan NaOCl 12% sebanyak 73 ml, dimasukkan kedalam labu takar 500 ml,
diencerkan dengan aquadest sampai garis tanda dan dihomogenkan.
3.3.1.5 Pembuatan Larutan NaOH 17,5%
Ditimbang 87,5 gram NaOH dimasukkan ke dalam labu takar 500 ml, diencerkan
3.3.1.6 Pembuatan Larutan H2O2 10%
Disediakan H2O2 30% sebanyak 167 ml, dimasukkan kedalam labu takar 500 ml,
diencerkan dengan aquadest sampai garis tanda dan dihomogenkan.
3.3.2 Preparasi Serbuk Tongkol Jagung
Tongkol Jagung dipotong kecil-kecil. Selanjutnya dikeringkan sampai benar-benar
kering. Kemudian dihaluskan dengan menggunakan blender sampai berbentuk serbuk.
3.3.3 Isolasi α-Selulosa dari Tongkol Jagung
Serbuk Tongkol Jagung sebanyak 75 g dimasukkan ke dalam beaker glass, kemudian
ditambahkan 1 L campuran HNO3 3,5% dan 10 mg NaNO2 dipanaskan di atas hot plate
pada suhu 90oC selama 2 jam. Setelah itu disaring dan ampas dicuci hingga filtrat
netral. Selanjutnya di digesti dengan 750 ml larutan yang mengandung NaOH 2% dan
Na2SO3 2% pada suhu 50oC selama 1 jam lalu disaring dan ampas dicuci sampai netral.
Selanjutnya dilakukan pemutihan dengan 250 ml larutan NaOCl 1,75% pada
temperatur mendidih selama 0,5 jam. Ampas tersebut disaring dan dicuci sampai pH
filtrat netral. Setelah itu dilakukan pemurnian Alfa selulosa dari sampel dengan 500 ml
larutan NaOH 17,5 % pada suhu 80oC selama 0,5 jam lalu disaring, dicuci hingga filtrat
netral. Dilanjutkan pemutihan dengan H2O2 10% pada suhu 60oC selama 15 menit.
Dicuci dan disaring selulosa yang terbentuk hingga netral. Dilakukan pengeringan
dengan oven selama 3 jam pada suhu 60oC dan disimpan dalam desikator
(Ohwoavworhua, 2005).
α-Selulosa sebanyak 2 gram dilarutkan dalam 50 ml DMAc, lalu dipanaskan di dalam bath oil pada suhu 50-60oC. Dipisahkan campuran DMAc dan α-selulosa. Ditambahkan
4 gram LiCl yang telah di vakum selama 1 jam pada suhu 80oC ke dalam larutan
DMAc tersebut secara perlahan-lahan sambil dipanaskan pada suhu 60oC. Setelah itu
ditambahkan α-selulosa yang telah diaktifkan ke dalam campuran DMAc dan LiCl.
Lalu distirer sambil dipanaskan pada suhu 60oC selama 45 menit. Kemudian
didinginkan dan ditambahkan dengan 25 ml aquabidest, lalu dibiarkan selama satu
malam hingga terbentuk suspensi. Suspensi yang terbentuk disentrifugasi dengan
kecepatan 10000 rpm selama 20 menit lalu diultrasinifikasi selama 10 menit, setelah itu
dimasukkan ke dalam membran dialisis yang telah direndam dalam 100 ml aquabidest
pada suhu 40oC, didiamkan selama 8 hari sambil distirer. Kemudian aquabidest
diuapkan pada suhu 70oC untuk mendapatkan nanokristal selulosa.
3.3.5 Uji Morfologi menggunakan TEM
Analisa morfologi nanokristal selulosa dilakukan dengan menggunakan alat TEM
JEOL JEM 1400 dengan tegangan sebesar 120 kV. Pertama-tama nanokristal selulosa
ditetesi dengan cairan ammonium molibdat 2%, kemudian cairan yang terbentuk di
perangkap dalam resin. Selanjutnya dilakukan pemotongan dengan menggunakan
microgrid untuk memperoleh nanokristal tunggal (single nanocrystal). Nanokristal
tunggal yang terbentuk dimasukkan ke dalam kisi karbon untuk dilakukan pengujian
TEM. Dari analisa permukaan menggunakan TEM dapat dihitung ukuran nanokristal
selulosa menggunakan persamaan (1) (Chang, 2010).
=
………. (1)
3.3.6 Uji degradasi termal menggunakan TGA
TGA menggunakan instrumen shimadzu TA 50 yang didialisis gas nitrogen.
600oC dengan laju pemanasan 10oC/menit. Analisis dilakukan dengan menaikkan suhu
sampel secara bertahap dan menentukan perubahan berat terhadap temperatur. Suhu
dalam metode pengujian mencapai 650oC atau lebih. Perubahan berat akibat proses
pemanasan dapat ditentukan langsung dari termogram yang terhasil. Setelah data
diperoleh, dapat ditentukan puncak dekomposisinya.
3.3.7 Analisa Gugus Fungsi dengan FTIR
Analisa gugus fungsi dilakukan dengan menggunakan alat shimadzu
IRPrestige-21. Sampel di preparasi dalam bentuk bubur (mull). Bubur diperiksa dalam
sebuah film tipis yang diletakkan diantara lempengan-lempengan garam yang datar.
Pengujian dilakukan dengan menjepit film hasil campuran pada tempat sampel.
Kemudian film diletakkan pada alat ke arah sinar infrared. Hasilnya akan ditampilkan
3.4 Bagan Penelitian
3.4.1 Preparasi Serbuk Tongkol Jagung
Dipotong hingga kecil-kecil
Direndam dengan air bersih
Dikeringkan
Dihaluskan dengan menggunakan blender hingga berbentuk serbuk
Diayak dengan ayakan 80 mesh Tongkol Jagung
3.4.2. Ekstraksi -Selulosa dari Tongkol Jagung
Dimasukkan ke dalam beaker glass
Ditambahkan 1 L campuran HNO3 3,5% dan 10 mg NaNO2
Dipanaskan diatas hotplate pada suhu 90oC selama 2 jam
Disaring dan ampas dicuci hingga filtrat netral
Didigesti dengan 750 mL larutan yang mengandung 75 g serbuk tongkol jagung
Filtrat - Selulosabasah
3.4.3 Isolasi nanokristal selulosa dari α-selulosa
ditambahkan 50 mL DMAc
dipanaskan didalam bath oil pada suhu 50- 60oC selama 30 menit
dipisahkan campuran DMAc dan α-selulosa
ditambahkan 4 g LiCl yang telah divakum selama 1 jam pada suhu 80oC kedalam larutan DMAc secara perlahan-lahan sambil dipanaskan pada suhu 60oC
ditambahkan α-selulosa yang telah diaktifkan ke dalam campuran DMAc dan LiCl
distirer sambil dipanaskan pada suhu 60oC selama 45 menit
didinginkan
ditambahkan 25 mL aquabidest
dibiarkan selama 1 malam
dipisahkan suspense yang terbentuk
dimasukkan ke dalam kuvet
disentrifugasi dengan kecepatan 10000 rpm selama 20 menit hingga pH netral
diultrasonifikasi selama 10 menit
dimasukkan ke dalam membran dialisis yang telah direndam dalam 100 ml aquabidest pada suhu 40oC
distrirer selama 4-8 hari
diuapkan aqubidest pada suhu 70° C 2 gram α-selulosa
Suspensi Larutan
3.4.4 Karakterisasi Nanokristal Selulosa
Dikarakterisasi
Nanokristal selulosa
Analisa Degradasi Termal
(TGA)
Analisa Gugus Fungsi
(FTIR) Analisa Marfologi
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Isolasi α-selulosa dari tongkol jagung
Berdasarkan serangkaian proses delignifikasi, pulping atau pembuburan, dan proses
pemutihan maka didapatkan α-selulosa yang berwarna putih. Pada proses isolasi α
-selulosa digunakan 75 gram serbuk tongkol jagung, dan menghasilkan α-selulosa murni
sebanyak 19,30 gram. Alfa selulosa yang dihasilkan dari penelitian ini dapat dilihat
pada Gambar 4.1.
Gambar 4.1 Alfa selulosa yang diisolasi dari tongkol jagung
Alfa selulosa yang diperoleh dihidrolisis dengan menggunakan pelarut dimetil
acetamida/litium klorida (DMAc/LiCl) untuk menghasilkan nanokristal selulosa yang
berbentuk kristal jarum dan berwarna bening seperti ditunjukkan pada gambar 4.2. Dari
2 gram α-selulosa yang digunakan diperoleh nanokristal selulosa sebanyak 0,20 gram,
hal ini menunjukkan hanya sekitar 10% dari massa awal α-selulosa yang membentuk
nanokristal.
Gambar 4.2 Nanokristal selulosa
4.2 Pembahasan
4.2.1. Proses isolasi α-selulosa dari tongkol jagung
Sebelum proses isolasi, tongkol jagung terlebih dahulu dicuci dengan air bersih,
kemudian dikeringkan di bawah sinar matahari hingga bebas air. Setelah itu dipotong
kecil-kecil kemudian dihaluskan dengan blender hingga halus untuk mempermudah
proses delignifikasi selulosa. Ada beberapa tahapan dalam isolasi α-selulosa yaitu
delignifikasi dengan menggunakan campuran HNO3 3,5% dan NaNO2 kemudian
zatnya, meninggalkan sisa padat dan berserat yang dinamakan selulosa. Proses yang
kedua yaitu pulping atau pembuburan ditambahkan campuran NaOH 2% dan Na2SO3
2% dengan perbandingan 2:1. Warna dari hasil delignifikasi ini adalah putih
kekuningan sampai putih kecoklatan kemudian disaring dan dicuci hingga netral. Untuk
menghilangkan warna coklat dari selulosa maka dilakukan pemutihan dengan NaOCl
1,75%. Ion hipoklorit merupakan oksidan kuat yang mampu memecah ikatan eter
dalam struktur lignin, akibatnya derajat putih pulp naik secara cepat. Agar α-selulosa
yang dihasilkan benar-benar murni, maka dilakukan penambahan dengan NaOH 17,5%
untuk menghilangkan β-selulosa, dimana β-selulosa akan larut dalam NaOH 17,5%
kemudian disaring dan dinetralkan. Hasil dari penambahan ini pulp kembali menjadi
kuning kecoklatan. Untuk menghilangkan warna coklat dari α-selulosa maka dilakukan
pemutihan dengan menggunakan H2O2 10%. α-selulosa yang dihasilkan dari proses ini
memiliki bentuk berupa pulp yang berwarna putih yang kemudian dikeringkan di dalam
oven pada suhu 60oC selama 4 jam.
Nanokristal selulosa yang diperoleh dari isolasi α-selulosa berupa kristal jarum
yang berwarna bening. Pembuatan nanokristal selulosa terdiri atas beberapa tahapan,
yaitu hidrolisis dengan menggunakan pelarut dimetil asetamida (DMAc/LiCl) tujuan
dari proses ini adalah untuk memecah daerah amorf dari selulosa, sehingga daerah
kristalin yang diperoleh. Kemudian proses sentrifugasi untuk menghilangkan pelarut
organik, serta ultrasonifikasi.
Sentrifugasi dalam proses ini diperlukan agar nanokristal yang dihasilkan menjadi
netral setelah dihidrolisis dengan pelarut dimetil asetamida/litium klorida. Proses
penetralan menggunakan aquabidest agar dihasilkan nanokristal yang lebih murni
dengan terbentuknya suspensi, suspensi adalah suatu campuran fluida yang
mengandung partikel padat atau dengan kata lain campuran heterogen dari zat cair dan
zat padat yang dilarutkan dalam zat cair tersebut, partikel padat dalam sistem suspensi
umumnya lebih besar dari 1 mikrometer sehingga cukup besar untuk memugkinkan
terjadinya sedimentasi. Reaksi hidrolisis alfa selulosa : (Spange, 1998).
Dimana R= C4H9NO
X= Cl
Tahap selanjutnya adalah proses dialisis dengan menggunakan membran dialisis,
disertai dengan perendaman dengan aquabidest dan distirer agar nanokristal labih cepat
keluar dari membran. Proses ini dilakukan selama 8 hari, setelah itu dilakukan
penguapan agar diperoleh nanokristal.
morfologi dengan menggunakan TEM
Analisa Transmisi electron microscopy (TEM) adalah alat yang digunakan untuk
melihat ukuran terkecil dari suatu obyek, mikroskop elektron dapat melihat struktur
yang lebih kecil dimana diperoleh ukuran kuantitatif partikel, distribusi ukuran, dan
marfologi dari sampel yang digunakan. Karakterisasi ini dilakukan dengan cara sampel
disinari dengan electron yang menggunakan berkas elektron untuk mengiluminasi
obyek Elektron memiliki panjang gelombang yang jauh lebih kecil daripada
panjang gelombang cahaya.
Dengan menggunakan TEM dapat dilihat hasil dari analisa marfologi
nanokristal selulosa yang ditunjukkan pada Gambar 4.3. Dari gambar tersebut ukuran
nanokristal selulosa dapat dihitung dengan menggunakan persamaan (1).
=
jadi ukuran nanokristal yang diperoleh adalah:
,
2x = (200 nm) x (0,6071)
= ,4
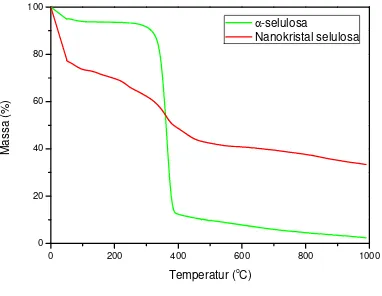
perubahan massa dapat dibagi menjadi 3 daerah, yaitu daerah pertama penurunan massa
awal terjadi pada suhu 160oC. Daerah kedua terjadi pada suhu 310oC, dan daerah ketiga
yaitu pada suhu 404oC dan % residu nanokristal selulosa yaitu sebesar 33,47%.
0 200 400 600 800 1000
0 20 40 60 80 100
Ma
ss
a
(%)
Temperatur (oC)
-selulosa
Nanokristal selulosa
Gambar 4.4 Kurva TGA α-selulosa dan Nanokristal selulosa
Thermogravimetri menggunakan atmosfer nitrogen untuk mencegah terjadinya
degradasi dini. % residu dari nanokristal selulosa adalah 33,47%. Hal ini menunjukkan
bahwa nanokristal selulosa tidak dapat melebur secara permanen. Ukuran partikel serta
banyaknya rantai tunggal yang terdapat pada nanokristal menyebabkan senyawa ini
terdekomposisi pada suhu yang rendah dan menyebabkan jumlah residu meningkat.