i
STRUKTUR GENETIK MANGGIS (Garcinia mangostana L.)
BERBASIS MARKA MORFOLOGI DAN MOLEKULER
ELLINA MANSYAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
i
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan disertasi “Struktur Genetik Manggis
(Garcinia mangostana L.) Berbasis Marka Morfologi dan Molekuler” adalah
karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan telah dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini
Bogor, Februari 2012
iii
ABSTRACT
ELLINA MANSYAH. Genetic Structure of Mangosteen (Garcinia mangostana L.). Based on Morphology and Molecular Markers. Under direction of SOBIR, ROEDHY POERWANTO and EDI SANTOSA.
Knowledge of genetic variability is important for mangosteen breeding to increase fruit quality. The objectives of this study were: 1) to reveal genetic variation of mangosteen individuals from Sumatra region based on morphology and molecular markers, 2). to study the relationships between morphology and genetic of mangosteen, 3). to access genetic structure of mangosteen populations. Eleven random ISSR primers were chosen to differenciate 22 mangosteen accessions from Sumatera regions. Combination of fruit morphology and DNA analysis using 8 RAPD and 5 ISSR primers were used to study relationships between morphology and molecular. The total of 106 samples from four
mangosteen populations were analyzed on the study population genetic structure.
Morphological and molecular data were analyzed by using NTSYS 2.1 program, and population genetic structure by program GenAlex 6.2. The results showed that mangosteen has wide diversity of morphology and narrow molecular diversity with similarity coefficient 0.08 to 1.0 and 0.83 to 0.99 respectively. It is mean that the morphological characters strongly influenced by environmental factors. There is a close correlation between the grouping based on morphological and molecular (.r = 0.95). Genetic analysis based on morphology at individual and population level separate the accessions into two groups: 1). The group with elliptical stigma lobe, small and thin petals, and number of fruit segments 5 to 11, and 2). groups of accessions with round stigma lobe, thick and large petals and the number of fruit segments 4-8. Molecular-based analysis at the individual level divides accession into two groups while at the population level into three groups. These results suggest that population-based analysis by using molecular markers showed more accurate results. Study population genetic structure separating mangosteen individuals into three groups: (A), Tembilahan (B), and mixed groups Tembilahan, Purwakarta Kerinci and Bulukumba, (C) that are grouped based on geography. In addition, the study population structure able to detect difference genetic groups within one population. AMOVA describe that genetic differences within populations equal to among populations, i.e., 50%. Although genetic variation within and among mangosteen population is nil, sufficient DNA polymorphism is found among some accessions to allow differentiation. Population genetic parameters show that the highest genetic variation present at Purwakarta population (Na = 1320, Ne = 1322, I = 0276, and PPL 62%), and the lowest at Kerinci population (Na = 1.00, Ne = 1171, I = 0154, and PPL=30%). Relationships between populations suggests that pair of population Tembilahan and Bulukumba have the greatest genetic differences (PhiPT = 0.491, the furthest genetic distance (D = 0169) and the lowest genetic identity (Nei I =. 0849). In contrast, pair of Kerinci and Bulukumba populations show the smallest genetic difference ( PhiPT = 0.320), the closest genetic distance (D = 0079) and the highest genetic identity (0924). Each of Tembilahan and Purwakarta population divides into two distinct genetic groups where both regions have local specific clones.
v
RINGKASAN
ELLINA MANSYAH. Struktur Genetik Manggis (Garcinia mangostana L.) Berbasis Marka Morfologi dan Molekuler. Dibimbing oleh SOBIR, ROEDHY POERWANTO dan EDI SANTOSA.
Pengetahuan tentang variabilitas genetik manggis penting untuk program pemuliaan dan sebagai dasar bagi perbaikan tanaman serta peningkatan daya saing. Manggis dikenal sebagai tanaman buah tropika yang mempunyai mekasisme reproduksi secara apomiksis dengan variasi genetik yang sempit. Penelitian tentang variasi genetik pada manggis sudah cukup banyak dilakukan namun belum terverifikasi dengan baik. Informasi tentang struktur genetik serta hubungan antara keragaman morfologi dan genetik belum tersedia. Untuk itu perlu dilakukan serangkaian kegiatan penelitian yang bertujuan untuk: 1). Mempelajari variasi genetik manggis pada tingkat individu berdasarkan karakter morfologi dan molekuler, 2). Mempelajari hubungan antara variasi morfologi dan genetik, dan 3). Mengungkap struktur genetik empat populasi manggis Indonesia
berbasis marka molekuler.
Kombinasi antara pendekatan morfologi dengan teknik analisis DNA memegang peranan penting dalam studi keragaman dan identifikasi varietas manggis. Pendekatan ini dapat meningkatkan akurasi dan mempersingkat waktu penelitian. Sebelas marka Inter-simple sequence repeat (ISSR) digunakan untuk mengetahui variasi genetik 22 individu manggis dari berbagai wilayah Sumatera. Hubungan antara karakter morfologi dan molekuler dipelajari menggunakan 33 aksesi manggis yang berasal dari Leuwiliang (Bogor-Jawa Barat), Kiara Pedes (Purwakarta-Jawa Barat), dan Pulau Palas (Tembilahan-Riau). Pengamatan morfologi difokuskan pada 10 karakter buah, dan analisis molekuler dilakukan dengan menggunakan 8 primer RAPD dan 5 primer ISSR. Struktur genetik populasi dipelajari dengan menggunakan 106 sampel tanaman manggis dari empat populasi manggis di Indonesia yaitu Purwakarta (Jawa Barat), Kerinci (Jambi),
Tembilahan (Riau) dan Bulukumba (Sulawesi Selatan). Data morfologi dianalisis
dengan metode Kruskal Wallis. Pengelompokan berdasarkan morfologi, molekuler dan gabungan morfologi dan mplekuler dianalisis dengan program NTSYSpc 2.1. Struktur genetik populasi dianalisis menggunakan program GenAlex 6.2.
vi
Analisis berbasis molekuler pada tingkat individu membagi aksesi menjadi dua kelompok sedangkan pada tingkat populasi menjadi tiga kelompok. Hasil ini menunjukkan bahwa analisis berbasis populasi dengan penggunaan marka molekuler menunjukkan hasil yang lebih akurat. Primer yang dapat digunakan untuk membedakan aksesi manggis antara lain adalah OPH-13, OPH-18, P3, PKBT-3, PKBT-7, dan PKBT-10, sedangkan marka morfologinya adalah ukuran dan tebal kelopak, bentuk cupat, jumlah segmen buah.
Analisis keragaman genetik 106 individu manggis menggunakan 8 primer RAPD dan 5 primer ISSR menghasilkan 132 pita DNA yang terdiri dari 95 (72.2%) pita polimorfik dan 37 (28.8%) pita monomorfik. Parameter genetik populasi menunjukkan bahwa
variasi genetik tertinggi terdapat pada populasi Purwakarta (Na=1.440, Ne=1.315,
I=0.293, dan PPL 62%), diikuti oleh Bulukumba (Na=1.160, Ne=1.214, I=0.201,
dan PPL 46%), Tembilahan (Na=1.140, Ne=1.218, I=0.20, dan PPL 40%) dan yang terendah populasi Kerinci (Na=1.00, Ne=1.171, I=0.154, dan PPL=30%.
Studi struktur genetik populasi manggis memisahkan individu manggis tersebut menjadi tiga kelompok yaitu Purwakarta (A), Tembilahan (B), dan kelompok campuran Tembilahan, Purwakarta Kerinci dan Bulukumba (C) yang berkelompok berdasarkan geografi. Selain itu studi struktur populasi mampu mendeteksi kelompok genetik berbeda dalam satu populasi yang sama . AMOVA menunjukkan bahwa secara umum perbedaan genetik antar populasi sama dengan perbedaan genetik dalam populasi yaitu masing-masing sebesar 50%. Komposisi genotipe antar populasi menunjukkan pengelompokan berdasarkan lokasi. Artinya tidak ada genotipe klonal dari satu populasi dijumpai pada lokasi lainnya sehingga setiap individu tanaman tersebut merupakan genotipe lokal.
Semua parameter genetik populasi (jumlah alel, Shannon Information index, dan jumlah lokus polimorfik) menunjukkan bahwa populasi Purwakarta mempunyai perbedaan genetik tertinggi dan yang terendah pada populasi Kerinci. Polymorfisme DNA yang dijumpai pada sejumlah individu dalam populasi mampu memberikan perbedaan antar pasangan populasi. Nilai PhiPT antara
pasangan populasi menunjukkan perbedaan genetik yang nyata satu sama lain
pada taraf 1%. Hubungan antar populasi menunjukkan bahwa pasangan populasi
Tembilahan dan Bulukumba mempunyai perbedaan genetik terbesar
(PhiPT=0,491, jarak genetik terjauh (D=0.169) dan identitas genetik terendah (Nei I=. 0.849). Sebaliknya pasangan populasi Kerinci dan Bulukumba menunjukkan perbedaan genetik terkecil (PhiPT=0.320), jarak genetik terdekat (D=0.079) dan
identitas genetik tertinggi (0.924). Populasi Purwakarta dan Tembilahan
masing-masing terbagi menjadi dua kelompok genetik berbeda yang menunjukkan kedua daerah tersebut memiliki klon lokal yang berpotensi untuk dikembangkan lebih lanjut. Pembentukan populasi manggis diawali dari Tembilahan, kemudian menyebar ke Purwakarta, Kerinci dan Bulukumba.
vii
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan
karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu
masalah
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya
ix
STRUKTUR GENETIK MANGGIS (Garcinia mangostana L.)
BERBASIS MARKA MORFOLOGI DAN MOLEKULER
ELLINA MANSYAH
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Agronomi dan Hortikultura Mayor Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
x
Penguji Pada Ujian Tertutup : 1. Prof. Dr. Ir Bambang S. Purwoko M.Sc Departemen Agronomi dan Hortikultura Fakultas Pertanian, Institut Pertanian Bogor
2. Dr. Ir. Hajrial Aswidinnoor. M.Sc. Departemen Agronomi dan Hortikultura Fakultas Pertanian, Institut Pertanian Bogor
Penguji pada Ujian Terbuka : 1. Dr. Ir. Memen Surahman M.Sc. Agr Departemen Agronomi dan Hortikultura Fakultas Pertanian, Institut Pertanian Bogor
2. Dr. Ir. Yusdar Hilman M.S
Kepala Pusat Penelitian dan Pengembangan Hortikultura.
xi
Judul Disertasi : Struktur Genetik Manggis (Garcinia mangostana L.) Berbasis Marka Morfologi dan Molekuler
Nama : Ellina Mansyah
NRP : A263070061
Disetujui
Komisi Pembimbing
Dr. Ir. Sobir, MSi Ketua
Prof. Dr. Ir. H. Roedhy Poerwanto, M.Sc Dr. Edi Santosa, SP, MSi Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Pemuliaan dan Bioteknologi Tanaman
Dr. Ir. Trikoesoemaningtyas, M.Sc. Dr. Ir. Dahrul Syah, M.Sc.Agr
xiii
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah swt atas segala rahmat dan karunia Nya sehingga disertasi ini berhasil diselesaikan. Aspek yang dipilih dalam penelitian ini berkaitan dengan komoditas manggis dengan judul “Struktur Genetik Manggis (Garcinia mangostana L.) Berbasis Marka Morfologi dan Molekuler”.
Penulis mengucapkan terimakasih kepada Dr. Ir. Sobir, M.Si, Prof. Dr. Ir. Roedhy Poerwanto, M.Sc., dan Dr. Edi Santosa, SP. M.Si selaku komisi pembimbing yang telah memberikan masukan, arahan, bimbingan dan motivasi sejak penulis mengikuti pendidikan, penyusunan proposal, pelaksanaan penelitian hingga tersusunnya disertasi ini. Terimakasih juga disampaikan kepada Prof. Dr. Ir. Bambang S. Purwoko, M.Sc. dan Dr. Ir. Hajrial Aswidinnoor, M.Sc. sebagai penguji luar komisi pembimbing pada ujian tertutup, serta Dr. Ir. Memen Surahman, M.Sc. Agr dan Dr. Ir. Yusdar Hilman, MS sebagai penguji pada ujian terbuka atas koreksi, saran, dan masukan dalam perbaikan disertasi ini.
Terimakasih kepada Kepala Badan Litbang Pertanian atas beasiswa program S3 pada Institut Pertanian Bogor dan dana penelitian KKP3T tahun 2008 sampai 2010. Penghargaan dan terimakasih tak lupa disampaikan kepada Kepala Balai Penelitian Tanaman Buah Tropika, Kepala Balai Besar Penelitian dan Pengembangan Sumberdaya Genetik Pertanian atas dukungan fasilitas penelitian. Terimakasih juga penulis sampaikan kepada Kepala Pusat Kajian Buah Tropika (PKBT-.IPB) beserta staf atas izin penggunaan sarana penelitian dan kerjasama yang baik dalam pelaksanaan penelitian ini.
Penelitian ini terlaksana atas bantuan berbagai pihak. Pada kesempatan ini penulis juga mengucapkan terimakasih kepada Ir. Susmala, PPL Kabupaten Kerinci, Bapak Ir. M. Kamrah dari Dinas Pertanian Kabupaten Bantaeng Sulawesi Selatan, dan Dr. Ir. M. Arif Nasution atas bantuanya dalam pelaksanaan penelitian di lapangan. Rasa terimakasih juga disampaikan kepada Ir Giwan (Tembilahan), Bapak Nanang (Leuwiliang), dan Bapak Nandang (Purwakarta) yang telah mengizinkan penggunaan kebun manggis beliau untuk keperluan penelitian ini. Terimakasih juga penulis sampaikan kepada Sulassih SP MSi, Dr. Ir. Tri Joko Santoso, Ir. Atmitri Sisharmini, MSi, Pipiet, dan Ir. Dwi Wahyuni atas bantuannya dalam pelaksanaan penelitian di laboratorium. Rasa terimakasih juga penulis sampaikan kepada teman teman seperjuangan pada Mayor Pemuliaan dan Bioteknologi dan Agronomi dan Hortikultura angkatan 2007 untuk persahabatan dan kebersamaan selama masa studi. Kepada Ibunda Aisyah, kakak dan adik adikku semua terimakasih atas doa, bantuan dan pengorbanan yang telah diberikan selama ini. .Kepada suami tercinta Ir. Irwan Muas, MP, dan anak anaku Miko N. Hidayat, Rhiza W. Nurazman, dan M. Fikri Triwansyah, terimakasih atas segala pengorbanan, pengertian dan kesabarannya selama ini.
Semoga disertasi ini dapat bermanfaat untuk kemajuan ilmu pengetahuan khususnya dalam pengembangan komoditas manggis.
xv
RIWAYAT HIDUP
Penulis dilahirkan di Padang pada tanggal 23 April 1963 sebagai anak kedua dari Bapak Lukman (Alm) dan Ibu Aisyah. Pada tahun 1987 penulis menyelesaikan pendidikan S1 pada Fakultas Pertanian Universitas Andalas di Padang dan bekerja sebagai staf peneliti pada Balai Penelitian Tanaman Buah Tropika Badan Litbang Pertanian sejak tahun 1991. Tahun 1999 penulis memperoleh kesempatan mengikuti pendidikan S2 pada Program Studi Pemuliaan Tanaman, Fakultas Pertanian Universitas Padjadjaran, Bandung. Selanjutnya pada tahun 2007 penulis diberi kesempatan untuk melanjutkan studi ke jenjang S3 pada Mayor Pemuliaan dan Bioteknologi Tanaman, Departemen Agronomi dan Hortikultura, Institut Pertanian Bogor dengan dana beasiswa dari Badan Litbang Pertanian. Pada tahun 1993 penulis menikah dengan Ir. Irwan Muas MP dan dikaruniai tiga orang putra, Miko N. Hidayat, Rhiza W. Nurazman, dan M. Fikri Triwansyah.
xvii
DAFTAR ISI
Halaman
DAFTAR TABEL... xix
DAFTAR GAMBAR... xxi
DAFTAR LAMPIRAN... xxiii
PENDAHULUAN 1 Latar Belakang... 1
Tujuan Penelitian... 4
Bagan alir penelitian... 4
TINJAUAN PUSTAKA Klasifikasi, Botani, Daerah Asal dan Penyebaran Manggis... 5
Metode Reproduksi Manggis ... 7
Apomiksis dan Poliploidi... 11
Variasi Pada Tanaman Apomiksis ... 14
Analisis Morfologi dan Molekuler ... 15
KERAGAMAN GENETIK INDIVIDU MANGGIS (Garcinia mangostana L.) DARI BERBAGAI WILAYAH SUMATERA BERDASARKAN MARKA ISSR Abstrak... 19
Abstract... 21
Pendahuluan ... 23
Bahan dan Metode... 24
Hasil dan Pembahasan... 28
Kesimpulan 34 Daftar Pustaka... 34
STUDI KERAGAMAN MANGGIS BERBASIS MARKA MORFOLOGI DAN MOLEKULER Abstrak... 37
Abstract... 39
Pendahuluan... 41
Bahan dan Metode... 42
Hasil dan Pembahasan... 50
Kesimpulan 68 Daftar Pustaka... 69
STRUKTUR GENETIK POPULASI MANGGIS (Garcinia mangostana L.) INDONESIA Abstrak... 71
xviii
Pendahuluan ... 75
Bahan dan Metode... 77
Hasil dan Pembahasan... 83
Kesimpulan 98 Daftar Pustaka... 99
PEMBAHASAN UMUM ... 103
KESIMPULAN DAN SARAN... 109
DAFTAR PUSTAKA ... 111
LAMPIRAN ... 123
xix
DAFTAR TABEL
Halaman
1 Aksesi manggis yang digunakan untuk analisis ISSR... 25
2 Primer yang digunakan dalam penelitian... 27
3 Produk amplifikasi sebelas primer ISSR pada 23 aksesi manggis...
29
4 Kondisi lingkungan tempat pengambilan sampel ... 42
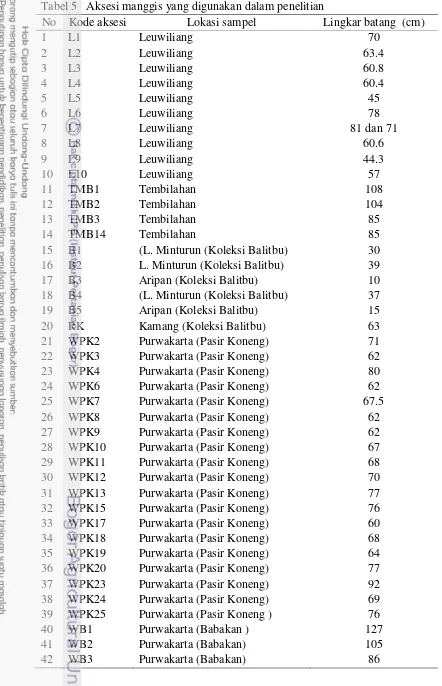
5 Aksesi manggis yang digunakan dalam penelitian ... 43
6 Primer yang dgunakan dalam penelitian... 46
7 Keragaman 10 karakter buah 42 aksesi manggis berdasarkan uji Kruskal Wallis...
59
8 Aksesi manggis yang digunakan untuk analisis struktur genetik populasi...
80
9 Karakteristik umum lokasi pengambilan sampel manggis ... 82
10 Produk amplifikasi dari 8 primer RAPD dan 5 primer ISSR pada 106 aksesi manggis...
85
11 Hasil pengamatan parameter genetik populasiG.mangostana menggunakan program GenAlex 6.2 ...
90
12 Hasil analisis varians molekuler (AMOVA) populasi manggis...
91
13 Pasangan nilai PhiPT dan uji statistik antar populasi G.
mangostana...
92
14 Pasangan jarak genetik Nei (D) dan identitas genetik (Nei I) pada 4 populasi manggis ...
xxi
DAFTAR GAMBAR
Halaman
1 Bagan alir penelitian... 4
2 Mekanisme berbagai tipe apomiksis... .
10
3 Bagian dari analisis PCR aksesi manggis menggunakan tiga primer ISSR...
29
4 Pola pita ISSR 23 aksesi manggis dengan primer PKBT-2, PKBT-3, PKBT-4, PKBT-7, PKBT-12 dan ISSRED-14...
30
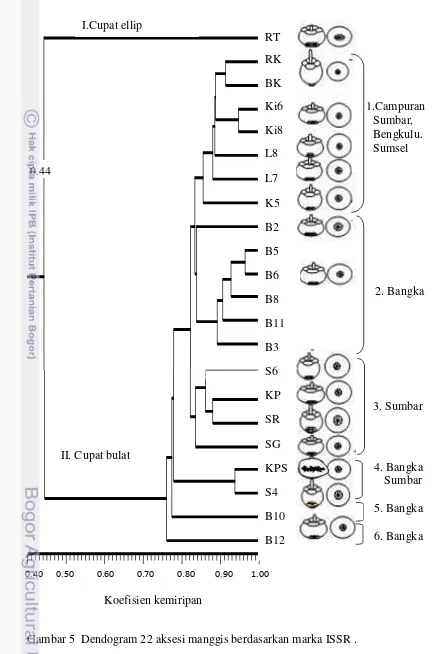
5 Dendogram 22 aksesi manggis berdasarkan marka ISSR ...
32
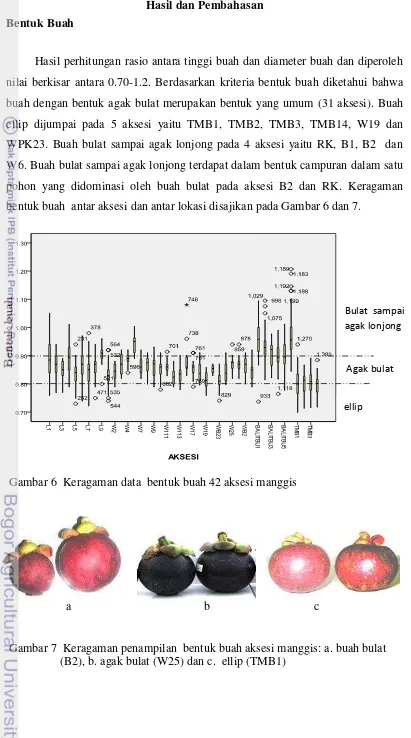
6 Keragaman data bentuk buah 42 aksesi manggis... 50
7 Keragaman penampilan bentuk buah aksesi manggis... 50
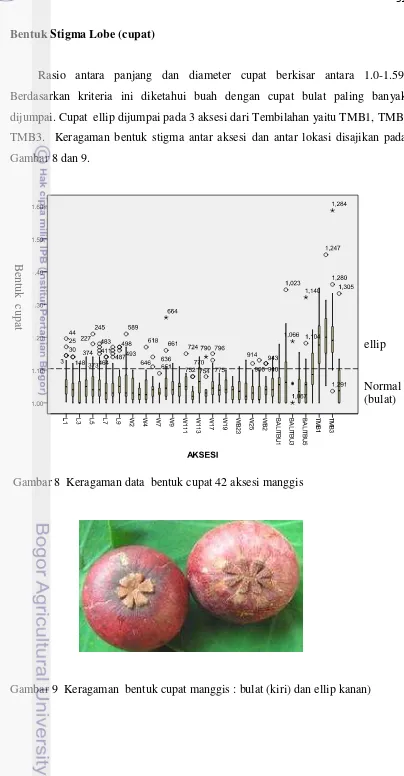
8 Keragaman data bentuk cupat 42 aksesi manggis... 51
9 Keragaman bentuk cupat manggis ... 51
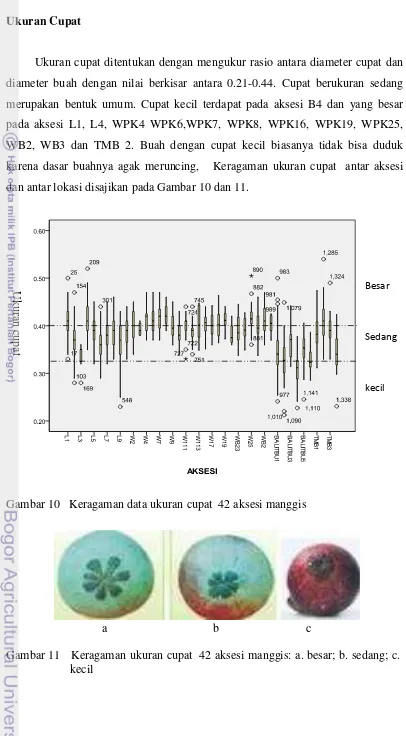
10 Keragaman data ukuran cupat 42 aksesi manggis... 52
11 Keragaman ukuran cupat 42 aksesi manggis... 52
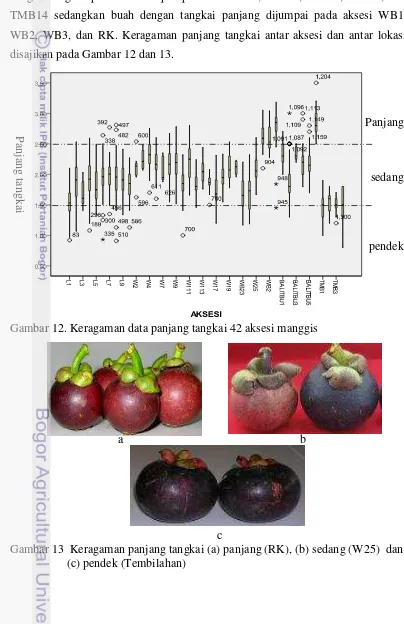
12 Keragaman data panjang tangkai 42 aksesi manggis... 53
13 Keragaman panjang tangkai... 53
14 Keragaman data diameter tangkai buah manggis ... 54
15 Keragaman data jumlah segmen buah 42 aksesi manggis... 55
16 Keragaman segmen buah 42 aksesi manggis... 55
17 Keragaman data tebal kulit buah... 56
18 Keragaman tebal kulit buah... 56
19 Keragaman ukuran kelopak buah antar aksesi dan antar lokasi...
57
20 Keragaman ukuran dan tebal kelopak buah manggis... 57
21 Dendogram 42 aksesi manggis berdasarkan 10 karakter morfologi...
xxii
22 Dendogram 33 aksesi manggis berdasarkan 8 primer RAPD dan 5 primer ISSR...
63
23 Dendogram 33 aksesi manggis berdasarkan gabungan data morfologi dan molekuler ...
65
24 Lokasi pengambilan sampel populasi manggis... 80
25 Dendrogram 106 aksesi manggis berdasarkan 5 primer RAPD and 11 primer ISSR ...
87
26 Pohon filogenetik populasi manggis Indonesia berdasarkan 8
primer RAPD dan 5 primer ISSR...
93
27 27 Kladogram populasi manggis yang dikonstruksi dari 8 primer RAPD dan 5 primer ISSR…...
xxiii
DAFTAR LAMPIRAN
Halaman
1 Output Hasil analisis MxComp data morfologi 33 aksesi manggis...
125
2 Output Hasil analisis MxComp data molekuler 33 aksesi manggis ...
126
3 Output Hasil analisis MxComp data gabungan morfologi dan molekuler 33 aksesi manggis ...
127
4 Fragmen DNA yang paling berperan dalam pengelompokan 33 aksesi manggis ...
128
5 da Hasil analisis PCR manggis populasi Jambi dengan primer PKBT2, OPH13, dan P3...
129
6 Bagian dari analisis molekuler manggis populasi Tembilahan dengan primer OPH12, OPH13, OPH18, P1, dan PKBT3...
130
7 Bagian dari hasil analisis PCR manggis populasi Purwakarta dengan primer OPH13, P1, P5, OPH12, OPH18 dan PKBT2...
131
8 Bagian dari profil pita DNA populasi Bulukumba dengan primer OPH13,PKBT3, OPHPKBT2, P5 dan OPH12...
132
9 Output hasil analisis MxComp data 132 pita DNA 106 aksesi...
PENDAHULUAN
Latar Belakang
Manggis merupakan tanaman buah penting karena perannya yang sangat besar dalam ekspor buah segar, industri makanan, untuk kesehatan, dan kosmetik (ICUC 2007). Sebagai komoditas ekspor manggis Indonesia telah dipasarkan ke 40 negara diantaranya ke Taiwan, Hongkong, Malaysia, Singapura, Republik Rakyat Cina, Saudi Arabia, Uni Emirat Arab, Belanda, dan Jerman (Sabar 2005). Dalam industri makanan buah manggis dapat diolah menjadi berbagai produk diantaranya sari buah, jelly, sirup, dan buah kalengan. Kulit buah manggis diketahui mengandung xanthone yang bermanfaat dalam menunjang keseimbangan mikrobiologi, sistim kekebalan tubuh, dan menunjang kesehatan mental (ICUC 2003). Kulit buah manggis juga mengandung pektin, tanin, dan resin yang telah diuji berguna sebagai obat disentri, diare kronis, cystitis, infeksi kulit, dan dapat diekstrak sebagai bahan penyamak dan pewarna (Hume 1947; Yaacob & Tindall 1995).
Indonesia merupakan salah satu negara penghasil manggis utama dunia bersama dengan Thailand, Malaysia, dan Philippina. Indonesia memiliki luas panen 9352 ha (BPS 2009), hampir sama dengan Thailand yaitu 11000 ha (data tahun 2000), dan lebih tinggi daripada Malaysia seluas 7632 ha (data tahun1998) dan Philipina 1354 ha (data tahun 2000) (Osman & Milan 2006). Selama 10 tahun terakhir volume dan nilai ekspor manggis merupakan yang tertinggi dibandingkan buah-buahan lainnya. Pada tahun 2008 total produksi manggis nasional mencapai 78647 ton dengan volume ekspor sebesar 9466 ton dan nilai ekspor sebesar 5833000 USD (BPS 2009). Berdasarkan data tersebut diketahui bahwa dari total produksi manggis Indonesia sebagian kecil (sekitar 12%) yang mencapai pasar ekspor.
permintaan akan buah manggis dan membuka peluang pasar yang lebih besar baik untuk tujuan ekspor maupun kebutuhan dalam negeri. Untuk keperluan tersebut perlu dilakukan berbagai upaya perbaikan daya saing buah manggis serta mengembangkan berbagai produk olahannya. Kriteria standar manggis mutu ekspor antara lain adalah warna kulit buah seragam dengan kelopak masih hijau dan segar, tidak rusak, bersih, bebas dari hama penyakit, serta tidak terdapat getah kuning pada kulit dan daging buah. Standar Nasional Indonesia mendiskripsikan mutu manggis segar antara lain warna kulit hijau kemerahan sampai dengan merah muda mengkilat dan dibagi menjadi 3 kelas berdasarkan diameter buah yaitu Super (> 65 mm), Mutu I (55 – 65 mm) dan Mutu II (<55 mm)( Direktorat Tanaman Buah 2002).
Manggis dikenal sebagai tanaman yang mempunyai mekanisme reproduksi secara apomiksis (Horn 1940; Cox 1976; Verheij 1991) dan termasuk kelompok apomiksis obligat (Richards 1990b). Organisme apomiktik telah lama dinyatakan tanpa variasi genetik. Namun beberapa puluh tahun terakhir terdapat bukti bahwa kebanyakan tanaman apomiktik secara genetik polimorfik (Asker & Jerling 1992). Misalnya keturunan yang bervariasi pada apomik obligat telah dilaporkan pada Taraxacum (Hughes & Richards 1985; Ford & Richards 1985). Sekali terbentuk polimorfisme genetik variasi tersebut akan tetap ada pada keturunan apomiksis (Schneller 1998).
Adanya variasi genetik pada manggis telah dilaporkan oleh Mansyah et al. (2003b) berdasarkan perbedaan pola pita DNA pada 23 aksesi dari Pulau Jawa dan Sumatera Barat melalui teknik RAPD, serta antara tetua dan turunan (Mansyah et al. 2004 dan 2008; Sinaga et al. 2008). Selain itu Ramage et al. (2004) melaporkan adanya sembilan genotipe berbeda diantara 37 aksesi G.
mangostana. Disamping keragaman molekuler tanaman manggis juga
Pengetahuan tentang keragaman genetik penting untuk program pemuliaan tanaman dan merupakan dasar dalam menentukan langkah perbaikan kualitas, kuantitas dan daya saing manggis. Informasi tentang keragaman morfologi dan molekuler diperlukan untuk identifikasi dan seleksi sumberdaya genetik manggis sebagai materi dasar perbaikan tanaman. Sejauh ini studi keragaman genetik pada manggis masih terbatas pada pembuktian ada atau tidaknya variasi genetik. Sebagian besar diantaranya masih berbasis individu tanaman dari lokasi yang berjauhan. Hubungan antara keragaman morfologi dan molekuler belum diketahui, serta informasi tentang struktur genetik populasinya belum tersedia. Untuk menyediakan informasi tersebut perlu dilakukan serangkaian penelitian yang terdiri dari studi variasi genetik berbasis individu, hubungan antara karakter morfologi dan genetik, serta struktur genetik populasi yang merupakan dasar studi adaptasi dan spesiasi. Studi genetik berbasis individu diperlukan untuk mengetahui apakah variasi genetik pada tingkat individu untuk tanaman apomiktik dapat mewakili variasi pada skala yang lebih luas pada tingkat populasi atau pada tingkat spesies.
Besarnya diversitas genotipik pada populasi tanaman apomiktik belum banyak dijelaskan. Kebanyakan informasi tentang struktur genetik populasi tersedia pada tanaman seksual. Studi struktur genetik populasi dapat memberikan informasi tentang lokasi geografi yang menunjukkan perbedaan genetik. Dari sini dapat ditentukan populasi berbeda di dalam spesies, kuantifikasi besarnya variasi diantara populasi dan hubungan kekerabatannya, serta dapat mengetahui stabilitas struktur populasi terhadap perbedaan lokasi (Ellstrand & Roose 1987).
Studi genetik populasi melalui persilangan sulit untuk dilakukan pada manggis karena merupakan tanaman berumur panjang dan bersifat apomiksis. Pola keragaman genetik dan pewarisan sifat pada makhluk hidup semacam ini dapat dianalisis menggunakan data pengamatan langsung pada populasi yang ada dengan bantuan marka molekuler. Penggunaan marka molekuler mempunyai beberapa keuntungan, diantaranya tidak dipengaruhi oleh lingkungan serta memberikan informasi langsung dari genom individu (Levebre et al. 2001).
wilayah di Sumatera, hubungan antara marka morfologi dan molekuler, serta struktur genetik populasi manggis Indonesia. Informasi yang diperoleh dari kegiatan ini dapat dimanfaatkan sebagai acuan dalam analisis genetik pada tanaman apomiksis, menunjang peningkatan daya saing manggis Indonesia, serta sebagai acuan dalam pengelolaan dan pemanfaatan plasma nutfah manggis. Bagan alir penelitian tersebut disajikan pada Gambar 1.
Tujuan Penelitian:
1 Memperoleh informasi tentang variasi genetik manggis dari berbagai wilayah di Sumatera dan pola pengelompokan aksesi manggis berdasarkan individu.
2 Memperoleh informasi tentang hubungan antara variasi morfologi dan molekuler pada manggis.
3 Memperoleh informasi tentang struktur genetik empat populasi manggis Indonesia berbasis marka molekuler.
Gambar 1. Bagan alir penelitian.
3.STRUKTUR GENETIK
POPULASI BERBASIS
MARKA MOLEKULER
INFORMASI TENTANG STRUKTUR GENETIK MANGGIS MENUNJANG PENINGKATAN DAYA SAING MANGGIS INDONESIA
STRUKTUR GENETIK MANGGIS INDONESIA BERBASIS MARKA MORFOLOGI DAN MOLEKULER
2.KERAGAMAN BERBASIS MARKA
MORFOLOGI DAN MOLEKULER
KERAGAMAN MANGGIS
SUMATERA
KERAGAMAN BERBASIS
INDIVIDU
HUBUNGAN MARKA
MORF0LOGI DAN
MOLEKULER
MARKA UNTUK
IDENTIFIKASI DAN STUDI POPULASI
STRUKTUR GENETIK
DALAM POPULASI
STRUKTUR GENETIK
ANTAR POPULASI
I. KERAGAMAN
TINJAUAN PUSTAKA
Klasifikasi, Botani, Daerah Asal dan Penyebaran Manggis
Dalam sistematika tumbuhan tanaman manggis diklasifikasikan kedalam Domain: Eukaryota, Kingdom: Plantae, Subkingdom: Viridaeplantae, Phylum:
Tracheophyta, Subphylum: Euphyllophytina, Kelas: Magnoliopsida, Subkelas:
Dilleniidae, Superordo: Theanae Ordo: Hypericales, Famili: Clusiaceae,
Subfamili: Clusioideae, Tribe: Garcinieae, Genus: Garcinia, Spesies: Garcinia
mangostana L. (ZippcodeZoo.com 2009). Genus Garcinia memiliki sekitar 800
species (Osman & Milan 2006). Data Herbarium Bogoriense mencatat terdapat 100 jenis Garcinia di Indonesia (Sari 1996). Whitmore (1973) mencatat lebih kurang terdapat 39 spesies Garcinia dan diantaranya hanya beberapa yang diketahui dan digunakan untuk keperluan medis di Thailand, diantaranya G. atroviridis Griff, G. speciosa Wall., G. cowa Roxb. dan G. dulcis
Manggis berasal dari Indonesia dan kawasan Asia Tenggara (Almeyda & Martin 1976), India Timur, dan Asia Tenggara (Campbell 1966), dan Peninsular Malaysia (Verheij 1991; ICUC 2003). Morton (1987) menyatakan bahwa manggis dipercaya berasal dari Kepulauan Sunda dan Maluku walaupun terdapat bukti yang menyatakan berasal dari Semenanjung Malaya (Verheij 1991). Sebagian besar produksi komersial manggis berada di Indonesia, Papua New Guinea, Philippina, Malaysia, Thailand, Burma (Myanmar), Vietnam, dan Cambodia. Sejak dua abad yang lalu, tanaman ini telah menyebar sampai ke Madagaskar, Sri Lanka, India, Honduras, Brazil, dan Australia. Saat ini, manggis dapat dijumpai di pekarangan dan kebun pada beberapa negara dengan iklim hangat dan bebas salju (ICUC 2003). Di Australia sekitar 50 hektar manggis telah ditanam di Queensland Utara (Downtown & Chacko 1998).
bebas salju di Honduras, Madagaskar dan Australia Utara. Di India manggis ditanam pada daerah dataran tinggi (Osman & Milan 2006).
Manggis tumbuh subur pada daerah dengan temperatur antara 25-35°C dan RH diatas 80%. Daerah dengan suhu 20-25°C juga cukup sesuai untuk budidaya manggis. Naungan sangat penting selama 2-4 tahun pertama baik dipembibitan maupun selama awal penanaman di lapang. Tanah terbaik untuk budidaya manggis adalah porous, dalam, lembab dengan irigasi yang baik, sedikit masam, dan kaya bahan organik (Campbell 1967; Almeyda & Martin 1978). Curah hujan diatas 1270 mm/tahun sangat baik untuk pertumbuhan tanaman (Yaacob & Tindall 1995).
Di Indonesia manggis tumbuh dalam kawasan geografi yang luas meliputi hampir semua kepulauan. Tanaman ini dapat tumbuh sampai mendekati ketinggian 1.000 meter dari permukaan laut dengan lingkungan tumbuh yang bervariasi mulai dari lahan kering sampai lahan rawa pasang surut (Mansyah et al. 2005). Daerah dengan luas panen tertinggi adalah Jawa Barat (1.471 ha), disusul oleh Sumatera Barat (1.420 ha), Jawa Timur (752 ha), Bengkulu (728 ha), Banten (706 ha), Sumatera Utara (669 ha), Riau (512 ha), Sulawesi Selatan (449 ha) serta daerah lainnya dengan luas panen yang lebih kecil (BPS 2009).
Manggis mempunyai nilai gizi yang cukup baik. Dalam 100 g daging buah terkandung 79.2 g air, 0.5 g protein, 19.8 g karbohidrat, 0.63 g asam sitrat, 0.3 g serat, 11.0 mg kalsium, 17.0 mg fosfor, 0.9 mg zat besi, 14.0 IU vitamin A, 0.09 mg vitamin B (thiamin), 0.06 mg vitamin B2, 0.1 mg vitamin B5, dan 66 mg vitamin C (Ming 1990 dalam Yaacob & Tindall 1995).
Pohon manggis terlihat selalu hijau dengan kanopi berbentuk piramid dengan tinggi antara 8-10 meter. Daunnya berhadapan, tebal dan bergetah. Buah berbentuk bulat dengan diameter 3.5-7 cm berat 75-150 g, kulit buah tebal (6-8 mm), berwarna hijau pucat ketika masih muda dan merah keunguan ketika matang penuh. Didalam buah terdapat 4-8 segmen buah berwarna putih. Buah bisa tidak berbiji atau 1-5 biji perbuah dan dapat mennghasilkan lebih dari satu tanaman per biji (poliembrioni) (ICUC 2003).
stadia awal pembentukan bunga maupun setelah bunga membuka. Pengamatan benang sari secara mikroskopik telah dilakukan oleh Lim (1984) yang melaporkan bahwa anthesis terjadi antara pukul 4 sampai 6 pagi dan setelah 24 jam petal terlepas dan sepal tetap ada sampai buah matang. Pada anther muda, sel induk tepung sari terbentuk dengan baik. Setelah terjadi pembelahan meiosis juga terjadi proses degenerasi inti dan sitoplasma yang menyebabkan sebagian besar di antaranya berdegenerasi. Pada berbagai fase meiosis terjadi proses degenerasi hingga hanya sedikit terbentuk tetrad dan sel tunggal normal yang akhirnya mati. Yaacob & Tindall (1995) melaporkan bahwa manggis mempunyai bunga dengan serbuk sari yang steril.
Manggis termasuk jenis buah yang lambat perkembangannya di antara buah-buahan tropika lainnya, sehingga ketersediaannya di pasaran untuk konsumen di luar Asia Tenggara sangat terbatas. Hal ini disebabkan oleh beberapa masalah, antara lain pertumbuhan bibit yang sangat lambat, masa juvenil yang panjang, sedikitnya ketersediaan materi tanaman, serta membutuhkan tenaga kerja intensif dalam pemanenan (Chong 1992).
Metode Reproduksi Manggis
Tanaman manggis mempunyai mekanisme reproduksi secara apomiksis (Wester 1926; Horn 1940; Cox 1976; Verheij 1991). Beberapa penulis juga menyebutkan sebagai partenokarpi (Corner 1952; Whitmore 1972). Richards (1990a) menyatakan bahwa sebagian besar genus Garcinia adalah agamospermy fakultatif. Tanaman jantan dijumpai pada semua spesies kecuali G. schortechinii King dan G. mangostana. Manggis merupakan agamospermy obligat dengan reproduksi melalui sel adventif dari jaringan ovular. Reproduksi aseksual yang demikoan mengakibatkan keseragaman buah manggis di manapun ditanam dan kelihatannya hanya satu varietas (Horn 1940).
pada ovul tanaman berbunga. Pada apomiksis, sel dengan jumlah kromosom unreduksi yang berasal dari sel somatik atau sel germinal dalam ovul berkembang menjadi embrio tanpa penggabungan inti telur dan sperma (Ramulu et al. 1995). Beberapa penulis menyebutkan sebagai agamospermy (‘seeds without sex’) (Rhichards 1990a; Ramachandran & Raghavan 1992).
Apomixis merupakan kejadian yang umum pada tanaman. Sekitar 60% tanaman mengalami mekanisme ini namun sering diabaikan oleh ahli teori reproduktif (Rhichards 2003). Kejadian apomiksis merupakan proses pembentukan populasi yang seragam secara genetik dan merupakan pola unik dari spesiasi tanaman. Lebih kurang 400 taksa dari 35 famili tanaman berbunga tercatat sebagai apomiktik. Sebagian besar diantaranya adalah spesies pohon pohonan tropika seperti jeruk, mangga, dan rumputan tropik seperti Brachiaria
dan Paspalum (Carman 2001).
Apomiksis telah diduga terjadi pada manggis sejak lama dan diyakini sebagai apomiksis obligat karena hanya dijumpai sebagai tanaman betina dan dapat menghasilkan biji fertil (Richards 1997). Dengan demikian, semua pohon manggis secara praktis termasuk varietas klonal karena karakter apomiktiknya. Beberapa peneliti lain memperkuat bahwa mekanisme reproduksi apomiksis pada manggis termasuk ke dalam embryony adventitious (Lim 1984; Richards 1990b; Asker & Jerling 1992). Spesies dengan embyony adventitious biasanya mempunyai meiosis yang teratur. Hal ini berdasarkan fakta bahwa sebagian besar di antaranya merupakan pseudogamous dan membutuhkan serbuk sari fungsional untuk fertilisasi dan pembentukan biji. Pada beberapa spesies mempunyai pembentukan endosperm secara autonomous seperti pada Alchornea ilicifolia dan
Euphorbia dulcis, di mana serbuk sari tidak berfungsi dan meiosis jantan
terganggu (Asker & Jerling 1992).
Apomiksis merupakan proses yang secara random distimulasi oleh lingkungan dan faktor nutrisi. Analisis keturunan pada persilangan antara apomiksis dengan bentuk seksual menunjukkan bahwa kemampuan untuk reproduksi apomiksis ditentukan secara genetik. Sebagai contoh perkembangan embrio nuselar pada jeruk dikontrol oleh lokus dominan tunggal (Parlevliet & Cameron, 1959 dalam Koltunow 1993).
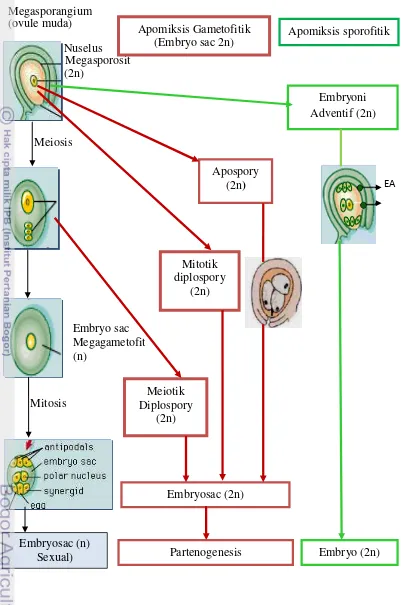
Apomiksis dikendalikan oleh sedikit gen tetapi pengaruhnya sangat besar yaitu memerintahkan sel nuselar somatik untuk membentuk kantong embrio (embryo sac) tanpa meiosis, menjadi embrio dan endosperm tanpa fertilisasi. Perbedaan penting apomiksis dari reproduksi seksual adalah bahwa embrio apomiktik berasal semata-mata dari sel jaringan ovul maternal tanpa fusi gamet jantan dan betina. Biji fertil yang dihasilkan dari reproduksi apomiktik apabila tidak mengalami mutasi mengandung embrio yang mempunyai konstitusi genetik yang sama dengan tetua betina. Pada reproduksi seksual gen apomiksis tidak ada atau tidak berekspresi (Koltunow 1993). Perbedaan mekanisme apomiksis dan seksual pada angiosperm dijelaskan melalui Gambar 2.
Gambar 2 membedakan mekanisme reproduksi apomiksis atas diplospory,
apospory, dan adventitious embriony. Diplospory adalah pembentukan kantong
Megasporangium (ovule muda)
Nuselus Megasporosit
(2n)
Mitosis
Embryo sac Megagametofit (n)
[image:35.595.111.513.97.702.2]
EA
Gambar 2 Mekanisme berbagai tipe apomiksis (Dimodifikasi dari Carneiro et al. 2006, Koltunow dan Grossniklaus 2003) . EA =Embrio Adventif. Meiosis
Apospory (2n)
Mitotik diplospory
(2n)
Embryosac (2n) Meiotik
Diplospory (2n)
Embryoni Adventif (2n)
Embryo (2n) Apomiksis Gametofitik
(Embryo sac 2n)
Apomiksis sporofitik
Embryosac (n)
Apomiksis juga termasuk pembentukan embrio dari sel telur yang tidak dibuahi (haploid partenogenesis), atau sel lain dari gametofit (haploid apogamy), tetapi sebagai hasil sporofit haploid biasanya steril dan proses tersebut tidak dapat berulang dari satu generasi ke generasi berikutnya yang disebut sebagai non-recurrent apomixis. Pada recurrent apomixis inti kantong embrio biasanya diploid. Dapat juga dihasilkan diploid partenogenesis (dari ovum diploid) atau diploid apogamy (dari beberapa sel diploid gametofit) (Wardlaw 1955).
Gametofitik apomiksis dan embryo adventif terjadi baik pada spesies herbaceous dan spesies tanaman berkayu. Penelitian secara embriologi masih sedikit diantaranya telah dilakukan oleh Lim (1984) pada G, mangostana dan Ha et al. (1988) pada G. malaccensis, G. forbesii King dan G. Scortechinii King. Pada Malus apomiksis dilaporkan merupakan karakter dominan (Sax 1959, dalam Asker & Jerling 1992).
Perbedaan antara apomiksis fakultatif dan obligat penting untuk pemuliaan. Apomiksis fakultatif (sebagian) adalah bentuk apomiksis dimana beberapa kejadian seksual juga dijumpai. Misalnya pada spesies jeruk, proses seksual dan apomiktik terjadi secara bersamaan dalam ovul yang sama (Koltunow 1993). Apomiksis fakultatif yang mempunyai tendensi seksualitas rendah termasuk apomiksis obligat (den Nijs & van Dijk 1993). Sebagian besar apomik adalah fakultatif dan hanya sedikit yang 100% obligat. Tingkat reproduksi seksual sering masih ada, sehingga terjadi beberapa penyimpangan (Asker & Jerling 1992).
Apomiksis dan Poliploidi
Asker & Jerling (1992) menyatakan bahwa asosiasi antara apomiksis, poliploid dan poliembrioni dijumpai pada beberapa spesies. Apomiksis umumnya adalah poliploid, dan teraploid merupakan tingkat yang umum dan sangat sedikit yang diploid secara alami. Manggis adalah tanaman poliploid dengan jumlah kromosom 2n = 96 (Tixier 1955). Rhichards (1990c) menyatakan bahwa morfologi manggis adalah intermediet antara dua kerabat dekatnya yaitu G.
agamospermy fakultatif. Studi sitologi menunjukkan bahwa manggis mungkin merupakan derivat allotetraploid dari ke dua spesies tersebut dengan. G. hombroniana sebagai tetua betina dan G.malaccensis sebagai tetua jantan.
Mackanzie (2005) menyatakan bahwa allotetraploid dapat terjadi melalui beberapa cara yaitu ‘one-step’ dan ‘two-step’ pathways. One-step pathway adalah pembentukan dari penggabungan dua gamet unreduksi spesies berbeda,
dan two-step pathways melalui jembatan triploid atau dari penggandaan
kromosom somatik secara spontan dari diploid interspesifik yang steril. Secara alami allopoliploidi lebih umum dari pada autopoliploidi. Kebanyakan poliploidi merupakan produk kejadian tunggal dan spesies tetuanya mempunyai variasi genetik. Spesies poliploid terjadi dari hibridisasi secara terpisah pada lokasi berbeda sehingga membentuk serangkaian populasi yang berbeda secara genetik.
Gene flow kemudian mungkin terjadi antara populasi poliploidi berbeda dan
menghasilkan variabilitas genetik yang dapat meningkat melalui penyusunan kromosom kembali. Terdapat bukti bahwa allopoliploid mengalami perubahan genomik yang ekstensif setelah pembentukannya (Soltis & Soltis 1999).
Percobaan pada allopoliploid Brassica menunjukkan bahwa perkembangan diversitas genetik dan fenotipik terjadi setelah beberapa generasi (Song et al. 1995). Selanjutnya spesiasi hibrid poliploid menghasilkan bentuk dinamis yang berevolusi (Mackanzie 2005). Poliploidi penting tidak hanya untuk spesiasi tanaman, tetapi dapat memperkaya pemahaman tentang proses evolusi. Beberapa observasi menunjukkan bukti sitogenetik bahwa poliploidi terjadi secara berulang pada skala waktu evolusi dan tersebar luas pada angiospermae serta kelompok tanaman lain. Bukti tambahan tentang frekuensi terjadinya spesiasi polyploid berasal dari studi distribusi jumlah kromosom (Otto & Whitton 2000). Hasil penelitian menunjukkan bahwa kebanyakan spesies poliploid muncul secara berulang, berlawananan dengan prinsip bahwa spesies secara biologi mempunyai keunikan monophyletic origin (Soltis & Soltis 1999).
Studi molekuler pada tetraploid Tragopogon miscellus dan Tragopogon
mirus, menunjukkan bahwa penyebaran setiap spesies terjadi tidak melalui single
origin tetapi melalui pengulangan. Kedua spesies mungkin terbentuk melalui
20 dan 12 kali berturut-turut dalam 70 tahun. Spesies polyploid Draba dan
Saxifraga juga merupakan multiple origin dari diploid progenitornya (Brochmann
et al. 1998, dalam Mackanzie 2005). Hasil penelitian ini menunjukkan bahwa genom poliploidi tidak statis karena merupakan gabungan dari dua genom berbeda pada inti dan mungkin disertai dengan reorganisasi (Wendel 2000; Liu & Wendel 2002).
Poliploidi berasosiasi dengan tingginya tingkat variasi epigenetik, yang mempunyai efek pada fenotip dan berpotensi untuk seleksi. Contoh penting epigenetik adalah variasi waktu berbunga pada allopoliploid sintetik Brassica (Schranz & Osborn 2000, diacu dalam Wendel 2000). Satu dari beberapa kemungkinan akibat duplikasi genom setelah pembentukan poliploid adalah gene
silencing. Proses ini terjadi pada permulaan pembentukan poliploidi dan
meningkat sejalan waktu (Wendel 2000).
Penggabungan genom pada alloppoliploid juga berpotensi untuk menyebarkan transposable element antara dua genom. Transposable elements terdapat dimana mana pada pada genom tanaman (Bennetzen 2000), yang berkontribusi pada evolusi genom, diversitas genetik dan ekspresi gen. Sebagian besar transposable element tidak aktif pada kondisi normal tetapi aktif pada kondisi stress (Wessler 1996, dalam Mackanzie 2005). Mekanisme terjadinya perubahan meliputi transposisi, translokasi, amplifikasi, dan delesi. Variasi yang dihasilkan oleh aktifitas tranposable element kelihatannya tidak stabil. Stress lingkungan eksternal dapat menginduksi mekanisme perubahan genomik secara cepat. Jika perubahan terjadi dalam meristem dan ditransmisikan ke gamet, variasi genomik dapat terjadi dalam satu generasi dan dapat diwariskan kepada generasi berikut (Walbot & Cullis 1985).
Pengaruh penyisipan elemen tergantung pada lokasinya. Penyisipan pada
non coding region seperti intron dari gen dapat menghalangi ekspresi gen normal,
tetapi pengeluaran elemen dapat menyembunyikan fungsi gen normal. Penyisipan pada coding region dapat menyebabkan frameshift mutation.Tranposable element tidak hanya menciptakan dan memulai mutasi, tetapi merupakan fokus dalam melanjutkan instabilitas (Walbot & Cullis 1985).
Variasi Pada Tanaman Apomiksis
Keturunan bervariasi pada apomik obligat telah dilaporkan pada Taraxacum. Studi menggunakan isozim esterase pada lima agamospesies Taraxacum menunjukkan rata-rata variasi genetik sebesar 19%. Hal ini membuktikan bahwa variasi yang muncul melalui apomik terjadi pada kecepatan yang lebih besar dari pada mutasi. Variasi juga dijumpai pada dua dari tiga famili keturunan dengan rata-rata 22%. Genus Taraxacum meliputi 200 spesies dan 90% diantaranya adalah poliploid dan mengalami reproduksi secara aseksual melalui agamospermy obligat. Empat dari sepuluh agamospesies tersebut telah diidentifikasi tidak mempunyai serbuk sari (Hughes & Richards 1985; Ford & Richards 1985).
Diketahui bahwa genom tanaman berulangkali mengalami tantangan keberadaan dan integritas genetiknya dalam waktu yang panjang. Ketersediaan mekanisme genetik yang memungkinkan genom untuk membentuk variasi genetik baru yang lebih adaptif terhadap lingkungan atau perubahan iklim di mana ia berada akan dapat mengurangi bahaya kepunahan (Kindiger & Dewald 1996). Variasi somaklonal dapat terjadi sebagai hasil dari mutasi point, autosegregasi,
‘’somatic crossing over’’, amplifikasi atau kehilangan material DNA, penyusunan kromosom kembali, dan aktivitas perubahan gen oleh transposable element. Kasus sederhana dari autosegregasi adalah ketika sel saudara yang satu menerima terlalu banyak kromosom dan yang lain terlalu sedikit dalam pembelahan sel induk kantong embrio (Walbot & Cullis 1985).
Variasi genetik pada manggis ditunjukkan oleh perbedaan pola pita DNA melalui teknik RAPD pada 23 aksesi yang berasal dari Pulau Jawa dan Sumatera Barat. (Mansyah et al. 2003), antara tetua dan turunan (Mansyah et al. 2004, Mansyah et al. 2008; Sinaga et al. 2008). Ramage et al. (2004) juga melaporkan adanya diversitas genetik pada G. mangostana. Diantara 37 aksesi G. mangostana diidentifikasi sembilan genotipe berbeda yang terdiri dari tiga kluster berbeda.
di Kepulauan Sulu dengan kulit buah yang tebal dan daging buah lebih masam. Cox (1976) merangkum beberapa laporan dan menyatakan bahwa manggis di Jawa mempunyai rasa superior dengan ukuran yang lebih besar daripada manggis di Filipina. Di Nicaragua terdapat tanaman dengan daun yang besar dengan ukuran buah yang bervariasi dan daun kecil dengan buah yang kecil.
Selanjutnya pengamatan pada individu manggis Sumatera Barat (Mansyah
et al. 1992) menunjukkan variasi bentuk kanopi, ukuran daun, bobot buah,
diameter buah, tebal kulit buah, dan jumlah buah per kluster. Melalui pengamatan yang intensif data keragaman morfologi ini terus berkembang sehingga dijumpai variasi morfologi yang lebih spesifik. Karakter morfologi tersebut diantaranya bentuk buah (ellip, agak bulat, bulat dan agak lonjong). Selain itu dijumpai perbedaan dalam bentuk cupat (bulat dan ellip), ukuran cupat (besar, sedang dan kecil), dan jumlah segmen buah (Mansyah et al. 2005). Sobir dan Poerwanto (2007) melaporkan adanya variasi warna sepal pada manggis Wanayasa Jawa Barat.
Analisis Morfologi dan Molekuler
Marka morfologi berdasarkan kepada pengamatan secara langsung karakter fenotipik tanaman. Marka ini telah banyak digunakan sebagai dasar studi genetik dan metode praktis untuk pemuliaan tanaman (Tanksley et al. 1983). Marka morfologi mudah untuk diamati, tetapi sangat dipengaruhi oleh lingkungan. Jumlahnya sangat terbatas dan beberapa diantaranya muncul diakhir pertumbuhan misalnya warna bunga. Hal ini membuat marka morfologi tidak memungkinkan untuk penilaian secara cepat. Selain itu suatu marka morfologi dapat mempengaruhi marka morfologi lain atau sifat yang menjadi target dalam program pemuliaan karena adanya pengaruh aksi gen pleiotropik (Poehlman & Sleper 1995).
estimasi kecepatan outcrossing (Williams et al. 1990; Powell et al. 1996). Marka molekuler merupakan alat tambahan untuk deskripsi varietas, dan marka DNA mempunyai keuntungan karena tidak dipengaruhi oleh lingkungan serta memberikan informasi langsung dari genom setiap individu (Lefebvre et al. 2001). Castillo et al. (1994) menyatakan bahwa PCR sangat potensial untuk marka genetik tanaman yang berumur panjang.
Berbagai teknik analisis molekuler dapat digunakan seperti RAPD (Random
Amplified Polymorphysm DNA), AFLP (Amplified Fragment Length
Polymorphysm), RFLP (Restriction Fragment Length Polymorphysm), SSR
(Simple Sequence Repeat) dan ISSR (Inter Simple Sequence Repeat) yang
memiliki kelebihan dan kekurangan masing-masing. Metode-metode tersebut
mendeteksi polimorfisme melalui variasi urutan DNA dalam genom (Powell et al 1996).
Teknik RAPD mempunyai beberapa keuntungan dibandingkan metode lain, di antaranya membutuhkan DNA yang lebih sedikit (10–25 ng), tidak membutuhkan informasi urutan primer, tidak bersifat radioaktif, serta pelaksanaanya relatif lebih mudah (Gupta et al. 1996; Powell et al. 1996). Walaupun demikian teknik RAPD juga mempunyai beberapa keterbatasan, antara lain tidak dapat membedakan individu homozigot dan heterozigot karena bersifat sebagai penanda dominan (Williams et al. 1990). Perubahan kecil dalam kondisi reaksi dengan nyata dapat merubah jumlah dan intensitas produk amplifikasi sehingga keterulangan sulit untuk dipertahankan. Dilaporkan juga kesulitan untuk memperoleh pita yang identik dari set primer dan material yang sama antar laboratorium yang berbeda. Tipe thermocycler yang digunakan kelihatanya merupakan kunci penentu reprodusibilitas pola pita (Hallden et al 1996).
Timur dan genus Passiflora, pemisahan kelompok terjadi masing-masing pada pada koefisien kemiripan 0.30 – 0.98 dan 0.64 –0.91.
Penggunaan analisis RAPD untuk studi variabilitas pada tanaman apomiksis telah dilakukan pada ubi kayu. Hasil penelitian tersebut menyimpulkan bahwa tanaman tersebut adalah apomiksis fakultatif dan terjadi pada frekuensi rendah (Nassar et al. 1998). Selain itu juga telah digunakan pada studi apomiktik
Hypericum perforatum dan memungkinkan untuk identifikasi perbedaan
individual (Pilepic et al. 2008). Marka ISSR sangat baik untuk membedakan antar
individu berkerabat dekat dan dapat diaplikasikan untuk studi variasi didalam
populasi (Gonzales et al. 2005). Penggunaan ISSR pada studi populasi
Monimopetalum chinense menunjukkan bahwa 110 pita ISSR berbeda dihasilkan
KERAGAMAN GENETIK INDIVIDU MANGGIS (Garcinia
mangostana L.) DARI BERBAGAI WILAYAH SUMATERA
BERDASARKAN MARKA ISSR
Abstrak
Marka Inter-simple sequence repeat (ISSR) digunakan untuk mengetahui variasi genetik berbasis individu pada manggis. Tujuan penelitian ini adalah untuk mempelajari variasi genetik individu manggis dari berbagai wilayah di Sumatera berdasarkan karakter marka ISSR. Sebanyak dua puluh dua aksesi Garcinia
mangostana yang dikumpulkan dari berbagai wilayah di Sumatera dianalisis
menggunakan 11 primer ISSR. Analisis menghasilkan 72 pita DNA yang terdiri dari 42 (58%) pita polimorfik dan 30 (42%) monomorfik. Tujuh dari sembilan primer yang polimorfik menghasilkan pola pita DNA yang unik untuk aksesi dari Tembilahan (Propinsi Riau). Pada tingkat kemiripan 0.44 terdapat dua kelompok aksesi yaitu: satu aksesi dari Tembilahan dengan karakter morfologi utama bentuk buah ellip, cupat ellip, kelopak buah tipis dan jumlah segmen buah 5 sampai 11, dan 21 aksesi lainnya dengan bentuk buah bulat, agak lonjong, ellip, bentuk cupat bulat dan segmen buah 4 sampai 8. Primer ISSR PKBT-2, PKBT-3, PKBT-7, PKBT-10, dan PKBT-11 merupakan yang terbaik untuk digunakan pada tahap selanjutnya. Hasil penelitian ini menambah bukti tentang adanya keragaman genetik pada manggis.
GENETIC VARIABILITY OF MANGOSTEEN (Garcinia
mangostana L.) GROWN IN DIFFERENT SUMATRA REGION
BASED ON ISSR MARKER
Abstract
Inter-simple sequence repeat (ISSR) markers were used to examine the level of genetic diversity of twenty two Garcinia mangostana accessions collected from Sumatra region. The objective of this study was to explain genetic variation of mangosteen individu from Sumatra region. Eleven random ISSR primers were chosen to differenciate the investigated accessions. The primers generated 72 bands of which 42 (58%) were polymorphic and 30 bands (42%) monomorphic. From the 11 primers tested, two primers were monomorphic. Seven of the nine polymorphic primers produced fingerprint profiles unique to the accession from Tembilahan (Riau Province). Cluster analysis divided the accessions into two major groups with genetic similarity coefficient ranging from 0.44 - 0.96. The first group contained only one accession from Tembilahan with elliptical stigma lobe, thin petals and 5 to 11 fruit segments. The second group consist of 21 other accessions with round stigma lobe, round, ovoid, and elliptical fruit, thick petals and 4 to 8 fruit segments, which could be divided clearly into six sub-clusters. The result shows that mangosteen accessions with different genetic background exist in this region. This confirms to the general opinion that mangosteen is not uniform in genetic. PKBT-2, PKBT-3, PKBT-7, PKBT-10, and PKBT-11 are the best primers for further use.
Keywords : genetic variability, Inter-simple sequence repeat, mangosteen, Sumatra.
Pendahuluan
Indonesia termasuk daerah asal tanaman manggis dengan daerah distribusi yang luas. Wilayah Sumatera merupakan daerah penghasil manggis yang potensial dan perlu digali potensi keragaman genetiknya. Daerah manggis potensial di Sumatera diantaranya adalah Sumatera Barat, Riau, Sumatera Selatan, Bangka Belitung dan Bengkulu. Data produksi dan luas panen manggis tahun 2008 menunjukkan bahwa Sumatera Barat mempunyai luas panen sekitar 1420 ha dengan produksi 13932 ton, Riau 512 ha dan 2666 ton, Sumatera Selatan 249 ha dan 777 ton, Bangka Belitung 243 ha dan 2637 ton, dan Bengkulu 238 ha dan 4636 ton (BPS 2009).
Penelitian tentang keragaman genetik pada manggis di Indonesia telah cukup banyak dilakukan diantaranya antar aksesi di Pulau Jawa (Mansyah et al. 2003b), dan antar individu manggis Tasikmalaya (Sinaga et al. 2007b). Ramage et al. (2004) melaporkan sembilan genotipe berbeda pada pada 37 aksesi G. mangostana yang berasal dari Bogor, Jawa, Madura, Malaysia, Singapura, dan Thailand yang dapat dipisahkan kedalam tiga kelompok genetik berbeda. Hasil penelitian ini menyimpulkan bahwa secara individu tanaman manggis menunjukkan variasi secara genetik.
Pada penelitian ini dianalisis keragaman genetik manggis berbasis individu dengan studi kasus menggunakan sampel dari berbagai wilayah Sumatera. Berbagai marka molekuler dapat digunakan sebagai alat bantu analisis genetik tanaman diantaranya RAPD (Random Amplified Polymorphysm DNA), AFLP
(Amplified Fragment Lenght Polymorphysm), RFLP (Restriction Fragment
Length Polymorphysm), SSR (Simple Sequence Repeat) dan ISSR (Inter-simple
Sequence Repeat). Masing-masing teknik tersebut memiliki kelebihan dan
kekurangan masing-masing. ISSR merupakan semiarbitrary marker yang komplemen dengan microsatelit, memberikan analisa yang cepat, murah, tidak membutuhkan informasi sekuen, multilokus, tingkat polimorfisme tinggi, dan menghasilkan marka dominan (Zietkiewicz et al. 1994; Mishra et al. 2003).
SSR. Teknik ISSR sangat bermanfaat untuk mengetahui instabilitas genetik pada stadia dini kultur in vitro, evaluasi diversitas genetik, identifikasi kultivar dan monitoring variasi somaklonal (Racoczy-Trojanowska and Bolibok 2004). ISSR lebih informatif daripada RAPD pada gandum, tanaman buah (strawberi dan apel) dan Pisum sativum (Korbin et al. 2002; Rakoczy-Trojanowska et al. 2004). Marka ini cukup reprodusibel dan telah digunakan untuk karakterisasi secara cepat pada banyak kultivar seperti poplar (Gao et al. 2006), kacang kacangan (Gonzales et al. 2005), cycad (Xiao et al. 2005), studi kekerabatan antara kerabat jahe (Wahyuni et al. 2004), dan isolat Fusarium culmorum (Mishra et al. 2003).
Tujuan penelitian ini adalah : (1) untuk mempelajari variasi genetik manggis dari berbagai wilayah di Sumatera, (2) mengetahui variasi genetik manggis berbasis individu, dan (3) untuk seleksi primer ISSR yang terbaik bagi penelitian selanjutnya.
Bahan dan Metode
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Balai Penelitian Tanaman Buah Tropika dan Pusat Kajian Buah-buahan Tropika mulai bulan Januari 2008 sampai Desember 2008.
Bahan dan Alat
Metode Penelitian
Ekstraksi, Purifikasi dan Penentuan Kuantitas DNA
Ekstraksi DNA dilakukan berdasarkan metode Doyle & Doyle (1987).
buffer ekstraksi (10% CTAB; 0.5 M EDTA (pH 8.0); 1 M Tris-HCl (pH 8.0), 5 M
[image:50.595.77.483.276.785.2]NaCl; 1% -mercaptoethanol) dan kemudian divorteks agar homogen. Campuran selanjutnya diinkubasi di dalam waterbath pada suhu 65oC selama 1 jam. Sekitar 0.15 mg daun digerus pada mortar yang diberi pasir kuarsa dan 0.6-0,8 ml
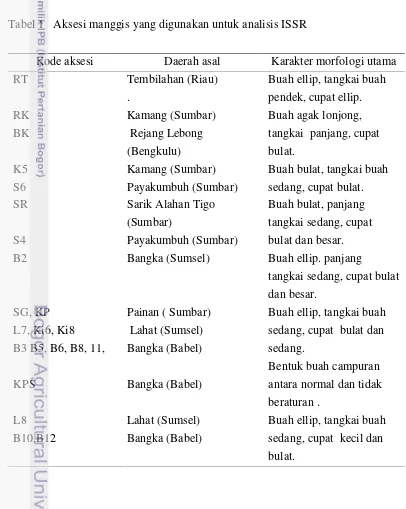
Tabel 1 Aksesi manggis yang digunakan untuk analisis ISSR
Kode aksesi Daerah asal Karakter morfologi utama
RT Tembilahan (Riau)
.
Buah ellip, tangkai buah pendek, cupat ellip. RK
BK
Kamang (Sumbar) Rejang Lebong (Bengkulu)
Buah agak lonjong, tangkai panjang, cupat bulat.
K5 S6
Kamang (Sumbar) Payakumbuh (Sumbar)
Buah bulat, tangkai buah sedang, cupat bulat. SR
S4
Sarik Alahan Tigo (Sumbar)
Payakumbuh (Sumbar)
Buah bulat, panjang tangkai sedang, cupat bulat dan besar.
B2 Bangka (Sumsel) Buah ellip. panjang
tangkai sedang, cupat bulat dan besar.
SG, KP L7, Ki6, Ki8
B3 B5, B6, B8, 11,
KPS
Painan ( Sumbar) Lahat (Sumsel) Bangka (Babel)
Bangka (Babel)
Buah ellip, tangkai buah sedang, cupat bulat dan sedang.
Bentuk buah campuran antara normal dan tidak beraturan .
L8 B10,B12
Lahat (Sumsel) Bangka (Babel)
Pemurnian DNA dilakukan dengan penambahan 0.6-0.7 ml buffer purifikasi/ CIA (Chloroform : Isoamil Alcohol = 24:1 v/v), dan pemisahan fraksi di dalam campuran dilakukan dengan sentrifugasi 11.000 rpm selama 10 menit. Setelah itu fase cair (supernatan) yang diperoleh dipindahkan ke tabung mikro steril ukuran 1000 l yang baru. Tahapan ini dapat diulang 2 – 3 kali tergantung kualitas DNA
yang dihasilkan. Selanjutnya ditambah dengan 500-600 l 2-propanol dingin, diinkubasi pada freezer selama 1 malam. Fase cair dibuang dan fase padat/pelet dikering anginkan maksimal 1 malam. Selanjutnya pelet dilarutkan dalam 50 - 100 l TE (1 M Tris-HCl pH 8.0; 0.5 M EDTA pH 8.0; dan Aquades).
Pengujian kuantitas dan kualitas DNA dilakukan dengan menggunakan metode elektroforesis. Sebanyak 5 l DNA hasil ekstraksi ditambah dengan 1 l loading dye dimasukkan pada sumur gel. Perkiraan kuantitas DNA ditentukan dengan membandingkan ketebalan pita DNA dengan lambda DNA pada gel agarose 1,2% yang dielektroforesis selama 45 menit pada tegangan 50 volt. Hasil elektroforesis diwarnai dengan ethidium bromida 1% dan dibilas aquades, selanjutnya pita DNA hasil elektroforesis dilihat dan divisualisasi melalui UV transiluminator dan dipotret dengan kamera digital. DNA yang diperoleh siap digunakan untuk reaksi PCR dengan diencerkan terlebih dahulu sampai konsentrasi 20 ng.
Ampilifikasi DNA
DNA diamplifikasi menggunakan 11 primer ISSR yang diperoleh dari laboratorium PKBT-IPB (Tabel 2). Amplifikasi dilakukan menggunakan Biorad
diwarnai dengan ethidium bromide 1% dan di visualiasikan menggunakan UV transiluminator dan kamera digital.
Tabel 2 Primer ISSR yang digunakan dalam penelitian
Primer* Sekuen (5’…….3’) Suhu annealing (oC)
PKBT-2 (AC)8TT 51
PKBT-3 (AG)8T 51
PKBT-4 (AG)8AA 51
PKBT-5 (AG)8TA 51
PKBT-7 (GA)9-A 51
PKBT-8 (GA)9-C 54
PKBT-9 (GA)9-T 53
PKBT-10 (GT)9-A 54
PKBT-11 (GT)9-C 54
PKBT-12 (GT)9-T 54
ISSRED -14 (GACA)4 53
*Catatan: Primer merupakan koleksi PKBT-IPB
Analisis Data
Produk amplifikasi primer ISSR adalah berupa pola pita DNA dengan ukuran tertentu. Ukuran potongan DNA genom ditentukan dengan membandingkannya dengan berat molekul standar 1 kb DNA ladder. Perbedaan antar individu ditunjukkan oleh jumlah pita dan jarak migrasinya. Penilaian
(scoring) dilakukan terhadap pita-pita yang jelas dan tajam secara konsisten. Jika
ada pita diberi skor 1 (ada) dan tidak ada diberi skor 0. Data skoring dianalisis dengan NTSYSpc 2.1 menggunakan metode UPGMA (Unweight Pair-Group Methode Arithmetic) dan fungsi Similarity Qualitatif (SIMQUAL) (Rohlf 2000). Matrik kesamaan genotipik dihitung berdasarkan koefisien Dice dengan rumus :
S = 2nab / na + nb
Keterangan : S = Koefisien kemiripan,
a dan b = dua individu yang dibandingkan
nab = jumlah pita DNA yang sama posisinya baik pada individu a maupun b
Hasil dan Pembahasan
Polimorfisme Marka ISSR
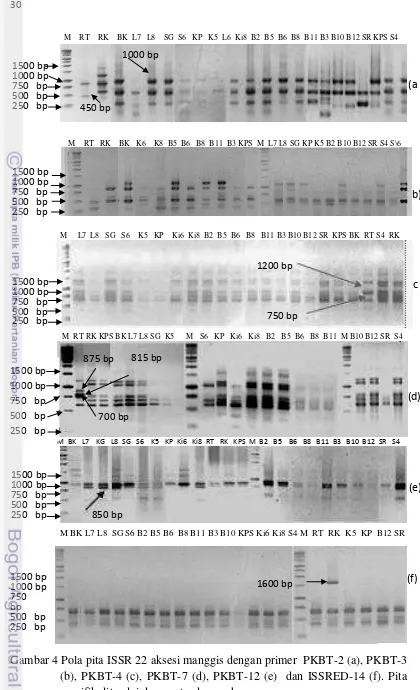
Amplifikasi 22 aksesi manggis dengan 11 primer ISSR menghasilkan 72
pita DNA yang terdiri dari 42 (52%) pita polimorfik dan 30 (42%) monomorfik
dengan ukuran 250 - 2200 bp (Tabel 3, Gambar 3 dan 4). Jumlah pita maksimum
diperoleh pada primer PKB-T11 (11 pita) dan minimum pada PKBT-12 (2 pita).
Dua dari 11 primer tersebut adalah monomorfik (PKBT-5 dan PKBT-9). Primer
PKBT-2, PKBT-3, PKBT-7, PKBT-10, dan PKBT-11 menunjukkan tingkat
polimorfisme yang tinggi dan produk amplifikasi yang tajam sehingga dapat
dipilih untuk digunakan pada tahapan selanjutnya.
Tujuh dari sembilan primer polimorfik menunjukkan pola pita yang unik
pada aksesi RT yang tumbuh di daerah rawa pasang surut Tembilahan (Propinsi
Riau). Keunikan pola pita DNA ditunjukan oleh kehilangan dan tambahan pita
DNA tertentu. Terdapat tambahan beberapa pita spesifik pada aksesi RT yaitu
primer PKBT-7 ( 875, 815 dan 700 bp) (Gambar 4d), dan 450 bp pada primer
PKBT-2 (Gambar 4a). Selain itu aksesi RT juga merupakan satu satunya aksesi
yang menunjukkan kehilangan dua pita PKBT-4 (1200 dan 750 bp) (Gambar 4c).
Dalam hubungannya dengan aksesi lain RT menunjukkan kehilangan 2 pita
PKBT-10 875 bp dan 600 bp (Gambar 3b), dan satu pita PKBT-11 1400 bp
(Gambar 3c) bersama sama dengan aksesi Ki6.
Aksesi lain juga menunjukkan pola pita spesifik untuk primer tertentu.
Sebagai contoh aksesi S6 kehilangan satu pita PKBT-7 1200 bp (Gambar 4d).
Aksesi BK, KP, B10 dan SR kehilangan pita PKBT-12 800 bp (Gambar 4e). KG,
L7, dan B12 kehilangan 1250 bp, sedangkan B3, B10 dan SR kehilangan 600 bp
untuk primer PKBT-2 (Gambar 4a). Variasi yang cukup besar ditunjukkan oleh
primer PKBT-3 yang menghasilkan lima pita polimorfik (Gambar 4b). Pita
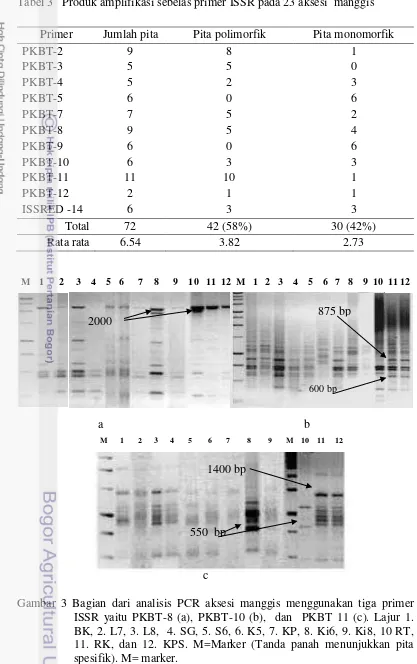
Tabel 3 Produk amplifikasi sebelas primer ISSR pada 23 aksesi manggis
Primer Jumlah pita Pita polimorfik Pita monomorfik
PKBT-2 9 8 1
PKBT-3 5 5 0
PKBT-4 5 2 3
PKBT-5 6 0 6
PKBT-7 7 5 2
PKBT-8 9 5 4
PKBT-9 6 0 6
PKBT-10 6 3 3
PKBT-11 11 10 1
PKBT-12 2 1 1
ISSRED -14 6 3 3
Total 72 42 (58%) 30 (42%)
Rata rata 6.54 3.82 2.73
a b
c
Gambar 3 Bagian dari analisis PCR aksesi manggis menggunakan tiga primer ISSR yaitu PKBT-8 (a), PKBT-10 (b), dan PKBT 11 (c). Lajur 1. BK, 2. L7, 3. L8, 4. SG, 5. S6, 6. K5, 7. KP, 8. Ki6, 9. Ki8, 10 RT, 11. RK, dan 12. KPS. M=Marker (Tanda panah menunjukkan pita spesifik). M= marker.
M 1 2 3 4 5 6 7 8 9 10 11 12 M 1 2 3 4 5 6 7 8 9 10 11 12
M 1 2 3 4 5 6 7 8 9 M 10 11 12 2000
600 bp
875 bp
1400 bp
[image:54.595.68.485.90.754.2](e) (d) (f) (c (a (b) 1500 bp 1000 bp 750 bp 500 bp 250 bp
M RT RK BK L7 L8 SG S6 KP K5 L6 Ki8 B2 B5 B6 B8 B11 B3 B10 B12 SR KPS S4
M RT RK BK K6 K8 B5 B6 B8 B11 B3 KPS M L7 L8 SG KP K5 B2 B10 B12 SR S4 S\6
M L7 L8 SG S6 K5 KP Ki6 Ki8 B2 B5 B6 B8 B11 B3 B10 B12 SR KPS BK RT S4 RK
M RT RK KPS BK L7 L8 SG K5 M S6 KP Ki6 Ki8 B2 B5 B6 B8 B11 M B10 B12 SR S4
M BK L7 KG L8 SG S6 K5 KP Ki6 Ki8 RT RK KPS M B2 B5 B6 B8 B11 B3 B10 B12 SR S4
[image:55.595.103.523.52.742.2]
M BK L7 L8 SG S6 B2 B5 B6 B8 B11 B3 B10 KPS Ki6 Ki8 S4 M RT RK K5 KP B12 SR
Gambar 4 Pola pita ISSR 22 aksesi manggis dengan primer PKBT-2 (a), PKBT-3 (b), PKBT-4 (c), PKBT-7 (d), PKBT-12 (e) dan ISSRED-14 (f). Pita spesifik ditandai dengan tanda panah.
1500 bp 1000 bp 750 bp 500 bp 250 bp
1500 bp 1000 bp 750 bp 500 bp 250 bp
450 bp
1500 bp 1000 bp 750 bp 500 bp 250 bp
1500 bp 1000 bp 750 bp 500 bp 250 bp
1200 bp
750 bp
875 bp 815 bp
Hubungan Kekerabatan Antar Aksesi
Koefisien kemiripan genetik 22 aksesi manggis berdasarkan marka ISSR adalah 0.44-0.96 (Gambar 5). Analisis kluster memisahkan aksesi menjadi dua kelompok utama. Kelompok pertama terdiri dari satu kultivar RT dari Tembilahan (Riau) dengan ciri khas cupat berbentuk ellip dengan kemiripan genetik dengan aksesi lain sebesar 44%. Kelompok kedua terdiri dari 21 aksesi dengan ciri khas cupat berbentuk bulat dan kemiripan genetik 0.71-0.96. Kelompok ini terbagi menjadi 5 sub kluster yaitu (1) dua aksesi dengan bentuk buah agak lonjong (ovoid) dan cupat kecil (BK dan RK) dengan koefisien kemiripan 0.