AKTIVITAS ANTIMIKROBA EKSTRAK KULIT BUAH
MANGGIS (Garcinia mangostana) TERHADAP BAKTERI
Aeromonas hydrophila, Edwardsiella tarda DAN JAMUR
Saprolegnia sp.
SKRIPSI
MADIAH HANDAYANI
100302085
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
LEMBAR PENGESAHAN
Judul Penelitian : Aktivitas Antimikroba Ekstrak Kulit Buah Manggis (Garcinia mangostana) Terhadap Bakteri Aeromonas hydrophila, Streptococcus agalactiae dan Jamur Saprolegnia sp.
Nama : Madiah Handayani
NIM : 100302085
Program Studi : Manajemen Sumberdaya Perairan
Disetujui Oleh Komisi Pembimbing
Prof. Dr. Dwi Suryanto, M.Sc Ir. Tajuddin Siregar, M.MA
Ketua Anggota
Mengetahui,
Dr. Ir. Yunasfi, M.Si
ABSTRAK
MADIAH HANDAYANI. Aktivitas Antimikroba Ekstrak Kulit Buah Manggis (Garcinia mangostana) Terhadap Bakteri Aeromonas hydrophila, Edwardsiella tarda dan Jamur Saprolegnia sp. Dibimbing oleh DWI SURYANTO dan TAJUDDIN SIREGAR.
Penelitian ini bertujuan untuk mengetahui potensi antimikroba dari ekstrak kulit buah manggis (Garcinia mangostana) terhadap bakteri Aeromonas hydrophila, Edwardsiella tarda dan Jamur Saprolegnia sp., serta megetahui toksisitasnya terhadap Artemia salina Leach. Kulit buah manggis diekstrak dengan pelarut yang berbeda yaitu metanol, etil asetat dan n-heksana. Pengujian aktivitas antimikroba dilakukan dengan metode difusi cakram, untuk mengetahui senyawa yang terkandung di dalam ekstrak dilakukan uji fitokimia. Untuk mengetahui tingkat toksisitas ekstrak menggunakan metode Brine Shrimp Lethality Test. Analisis senyawa kimia menunjukkan dalam ekstrak kulit buah manggis mengandung fenolik, terpen/steroid dan alkaloid. Ekstrak kulit buah manggis dapat menghambat pertumbuhan bakteri Aeromonas hydrophila,
Edwardsiella tarda dan jamur Saprolegnia sp. dengan besar zona hambat yang berbeda. Zona hambat pertumbuhan mikroba terbesar terdapat pada bakteri E. tarda
sebesar 12 mm. Ekstrak yang memiliki aktivitas antimikroba optimal dihasilkan dengan menggunakan pelarut etil asetat. Ekstrak kulit buah manggis memiliki toksisitas dengan nilai LC50<1000 μg/ml.
ABSTRACT
MADIAH HANDAYANI. Antimicrobial Activity of Extract Mangosteen Rind (Garcinia mangostana) on Aeromonas hydrophila, Edwardsiella tarda Bacteria and Saprolegnia sp. Fungi. Under academic supervision of DWI SURYANTO and TAJUDDIN SIREGAR.
This reseach head to determine antimicrobial potential of stem bark extract mangosteen rind (Garcinia mangostana) again bacterial of Aeromonas hydrophila, Edwardsiella tarda and fungus Saprolegnia sp. and determine the level of toxicity bacterial against Artemia Salina Leach. The mangosteen rind was extracted with several solvent, such as methanol, etil asetat and n-hexsana. Testing of antimicrobial activity carried out by disc diffusion method, to determine the compounds contained in the extract phytochemical test. To determine the level of toxicity of the extract using the Brine Shrimp Lethality Test. The chemical compound analysis showed that extract of lotus seed contains fenolik, terpen/steroid dan alkaloid. The extracts inhibitated the growth of Aeromonas hydrophila, Streptococcus agalactiae bacteria and Saprolegnia sp. fungi to some extent. Largest microbial growth inhibition zone of bacteria present in E. tarda by 12 mm.The optimal antimicrobial activity was obtained from etil asetat. The extract showed cytotoxic activity with LC50<1000 μg/ml.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT karena atas rahmat,
hidayah, serta karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang
berjudul “Aktivitas Antimikroba Ekstrak Kulit Buah Manggis (Garcinia mangostana) Terhadap Bakteri Aeromonas hydrophila, Edwardsiella tarda dan Jamur Saprolegnia sp.”
Pada kesempatan ini penulis mengucapkan terima kasih kepada kedua
orang tua dan keluarga yang selalu memberi motivasi dan dukungan sehingga
penulis dapat menyelesaikan usulan penelitian ini. Ucapan terima kasih juga
penulis sampaikan kepada Bapak Prof. Dr. Dwi Suryanto, M.Sc selaku Ketua
Komisi Pembimbing dan kepada Bapak Ir. Tajuddin Siregar, M.MA selaku
anggota Komisi Pembimbing serta dosen-dosen Program Studi Manajemen
Sumberdaya Perairan yang telah banyak memberikan arahan dan masukan dalam
penyelesaian usulan penelitian ini.
Demi kesempurnaan usulan penelitian ini penulis mengharapkan kritik dan
saran yang sangat membangun untuk penyempurnaan usulan penelitian ini,
sehingga penelitian dapat berjalan dengan baik.
Medan, Mei 2014
DAFTAR ISI
Pengujian Ekstrak Kulit Buah Manggis Terhadap Bakteri dan Jamur ... 24
Pengamatan Zona Hambat Pertumbuhan Bakteri dan Jamur ... 25
Uji Toksisitas Kulit Buah Manggis ... 26
HASIL DAN PEMBAHASAN
Hasil
Uji Fitokimia Kulit Buah Manggis (Garcinia mangostana) ... 28 Ekstraksi Kulit Buah Manggis (Garcinia mangostana) ... 28 Uji Toksisitas Kulit Buah Manggis (Garcinia mangostana) ... 29 Uji Aktivitas Antimikroba Kulit Buah Manggis
(Garcinia mangostana) ... 29 Pembahasan
Uji Fitokimia Kulit Buah Manggis (Garcinia mangostana) ... 31 Ekstraksi Kulit Buah Manggis (Garcinia mangostana) ... 32 Uji Toksisitas Kulit Buah Manggis (Garcinia mangostana) ... 33 Uji Aktivitas Antimikroba Kulit Buah Manggis
(Garcinia mangostana) ... 35
KESIMPULAN DAN SARAN
Kesimpulan ... 40 Saran ... 40
DAFTAR GAMBAR
No. Teks Halaman
1. Kerangka Pemikiran Penelitian ... 5
2. Manggis (Garcinia mangostana)... 7
3. Aeromonas hydrophila ... 9
4. Edwardsiella tarda ... 11
5. Saprolegnia sp ... 12
6. Perhitungan Zona Hambat Bakteri ... 25
DAFTAR TABEL
No. Teks Halaman
1. Hasil Uji Fitokimia Kulit Buah Manggis (Garcinia mangostana) .... 28
2. Hasil Ekstraksi Kulit Buah Manggis (Garcinia mangostana)... 28
3. Hasil Uji Toksisitas Kulit Buah Manggis (Garcinia Mangostana) ... 29
DAFTAR LAMPIRAN
No. Teks Halaman
1. Persiapan Media Bakteri dan Jamur ... 46
2. Sterilisasi Alat dan Bahan... 47
3. Pembuatan Larutan Baku McFarland ... 47
4. Proses Pembuatan Ekstrak Kulit Buah Manggis ... 48
5. Proses Pengujian Toksisitas A. salina ... 49
6. Pembuatan Konsentrasi Larutan Uji ... 50
7. Analisis Kriteria Bakteri Aeromonas hydrophila ... 51
8. Analisis Kriteria Bakteri Edwardsiella tarda ... 52
9. Analisis Kriteria Jamur Saprolegnia sp ... 53
10. Proses Pengujian Antimikroba ... 54
11. Hasil Skrining Fitokimia Kulit Buah Manggis ... 55
12. Hasil Pengujian Antimikroba ... 56
13. Data Awal Kematian A. salina Pada Berbagai Konsentrasi ... 57
14. Contoh Perhitungan Penentuan LC50 ... 58
15. Data Awal Zona Hambat Ekstrak Kulit Buah Manggis ... 63
ABSTRAK
MADIAH HANDAYANI. Aktivitas Antimikroba Ekstrak Kulit Buah Manggis (Garcinia mangostana) Terhadap Bakteri Aeromonas hydrophila, Edwardsiella tarda dan Jamur Saprolegnia sp. Dibimbing oleh DWI SURYANTO dan TAJUDDIN SIREGAR.
Penelitian ini bertujuan untuk mengetahui potensi antimikroba dari ekstrak kulit buah manggis (Garcinia mangostana) terhadap bakteri Aeromonas hydrophila, Edwardsiella tarda dan Jamur Saprolegnia sp., serta megetahui toksisitasnya terhadap Artemia salina Leach. Kulit buah manggis diekstrak dengan pelarut yang berbeda yaitu metanol, etil asetat dan n-heksana. Pengujian aktivitas antimikroba dilakukan dengan metode difusi cakram, untuk mengetahui senyawa yang terkandung di dalam ekstrak dilakukan uji fitokimia. Untuk mengetahui tingkat toksisitas ekstrak menggunakan metode Brine Shrimp Lethality Test. Analisis senyawa kimia menunjukkan dalam ekstrak kulit buah manggis mengandung fenolik, terpen/steroid dan alkaloid. Ekstrak kulit buah manggis dapat menghambat pertumbuhan bakteri Aeromonas hydrophila,
Edwardsiella tarda dan jamur Saprolegnia sp. dengan besar zona hambat yang berbeda. Zona hambat pertumbuhan mikroba terbesar terdapat pada bakteri E. tarda
sebesar 12 mm. Ekstrak yang memiliki aktivitas antimikroba optimal dihasilkan dengan menggunakan pelarut etil asetat. Ekstrak kulit buah manggis memiliki toksisitas dengan nilai LC50<1000 μg/ml.
ABSTRACT
MADIAH HANDAYANI. Antimicrobial Activity of Extract Mangosteen Rind (Garcinia mangostana) on Aeromonas hydrophila, Edwardsiella tarda Bacteria and Saprolegnia sp. Fungi. Under academic supervision of DWI SURYANTO and TAJUDDIN SIREGAR.
This reseach head to determine antimicrobial potential of stem bark extract mangosteen rind (Garcinia mangostana) again bacterial of Aeromonas hydrophila, Edwardsiella tarda and fungus Saprolegnia sp. and determine the level of toxicity bacterial against Artemia Salina Leach. The mangosteen rind was extracted with several solvent, such as methanol, etil asetat and n-hexsana. Testing of antimicrobial activity carried out by disc diffusion method, to determine the compounds contained in the extract phytochemical test. To determine the level of toxicity of the extract using the Brine Shrimp Lethality Test. The chemical compound analysis showed that extract of lotus seed contains fenolik, terpen/steroid dan alkaloid. The extracts inhibitated the growth of Aeromonas hydrophila, Streptococcus agalactiae bacteria and Saprolegnia sp. fungi to some extent. Largest microbial growth inhibition zone of bacteria present in E. tarda by 12 mm.The optimal antimicrobial activity was obtained from etil asetat. The extract showed cytotoxic activity with LC50<1000 μg/ml.
PENDAHULUAN
Latar Belakang
Melihat besarnya potensi pengembangan perikanan budidaya serta
didukung peluang pasar internasional yang baik maka perikanan budidaya di
Indonesia merupakan salah satu komponen yang penting di sektor perikanan. Hal
ini berkaitan dengan perannya dalam menunjang persediaan pangan nasional,
penciptaan pendapatan dan lapangan kerja serta mendatangkan penerimaan negara
dari ekspor. Perikanan budidaya juga berperan dalam mengurangi beban sumber
daya laut. Di samping itu perikanan budidaya dianggap sebagai sektor penting
untuk mendukung perkembangan ekonomi pedesaan (Grandiosa, 2010).
Keberadaan penyakit di dalam lingkungan perairan merupakan salah satu
kendala di dalam pengembangan subsektor budidaya perikanan. Penyakit tersebut
terdiri atas penyakit infeksi atau menular (infectious disease) yang disebabkan
oleh organisme patogen infektif dan penyakit non infeksi (non infectious disease)
yang disebabkan oleh faktor fisika dan kimia lingkungan, pakan dan metabolisme,
stress sebagai bagian reaksi psikologis ikan. Serangan penyakit infeksi maupun
non infeksi menyebabkan produktivitas budidaya terganggu dan bahkan dapat
menyebabkan kegagalan serta kerugian bagi para pembudidaya (Kurniawan,
2012).
Disamping bakteri beberapa jamur dapat menimbulkan penyakit infeksi
pada ikan budidaya, baik ikan air tawar maupun ikan laut atau payau, ikan
konsumsi ataupun ikan hias. Salah satunya adalah jamur Saprolegnia sp., ikan
tumbuh pada kulit, sirip, insang mata dan telur ikan. Serangan jamur ini
menyebabkan kematian pada ikan yang dapat merugikan (Widya, 2013).
Manusia memegang peranan penting dalam upaya mencegah terjadinya
serangan penyakit pada ikan budidaya, baik di kolam, keramba, tambak, maupun
di wadah budidaya lainnya, yaitu dengan cara memelihara keserasian interaksi
antara tiga komponen di atas. Ini berarti, kerugian yang diderita karena serangan
penyakit sebenarnya dapat dihindari apabila petani mempunyai pengetahuan yang
memadai mengenai cara menjaga keserasian antara ketiga komponen penyebab
penyakit ikan. Di samping itu, ketelitian dan kecermatan petani juga sangat
menentukan keberhasilan dalam pencegahan serangan penyakit ikan tersebut
(Kordi, 2004).
Penggunaan bahan alami untuk mengobati maupun mencegah penyakit
pada ikan, termasuk parasit perlu dikembangkan seiring dengan semakin
berkurang dan dilarangnya penggunaan bahan kimia. Efek samping yang
dihasilkan oleh bahan alami dapat dikatakan tidak signifikan terhadap kerusakan
lingkungan, resistensi bibit penyakit, residu yang tidak terakumulasi di dalam
jaringan atau organ, dan aman baik komoditas budidaya maupun konsumen.
Indonesia memiliki banyak sekali tanaman herbal yang dapat dijadikan obat bagi
penanggulangan penyakit dalam bidang budidaya perikanan. Banyak jenis
tanaman yang mengandung senyawa yang bersifat antimikroba, baik bakterisidal,
bakteristatik, fungisidal, dan sebagainya. Berbagai penelitian telah membuktikan
bahwa fitofarmaka efektif mengatasi penyakit ikan dan memiliki beberapa
keuntungan, seperti dapat menjadi bahan alami pengganti antibiotik untuk
menyebabkan residu pada ikan dan manusia, mudah diperoleh dan tersedia cukup
banyak, harganya ekonomis dan cukup murah (Kurniawan, 2012).
Manggis (Garcinia mangostana) merupakan salah satu buah tropika
unggulan nasional Indonesia dan menjadi primadona penghasil devisa negara.
Kulit buah manggis (KBM) merupakan bagian terbesar dari buah manggis yang
dikategorikan sebagai limbah. Beberapa penelitian menunjukkan bahwa KBM
memiliki sifat fungsional bagi kesehatan karena mengandung berbagai senyawa
antioksidan, seperti senyawa fenolik atau polifenol termasuk didalamnya xanthone
dan epikatekin, disamping senyawa antosianin dan tanin. Senyawa xanthone
memiliki sifat antioksidan, antidiabetic, antikanker, anti-imflammatory,
hepatoprotective, immuno-modulation, dan antibakteria, mampu menekan
pembentukkan senyawa karsinogen pada kolon, antifungal, serta antiplasmodial
(Widayanti, dkk., 2009).
Pemanfaatan ekstrak kulit buah manggis untuk pengendalian penyakit
pada ikan belum pernah dilakukan, maka dari itu perlu dilakukan penelitian
pengaruh ekstrak kulit buah manggis (Garcinia mangostana) dalam menghambat
pertumbuhan bakteri Aeromonas hydrophila, Edwardsiella tarda dan jamur
Saprolegnia sp. yang merupakan penyebab penyakit pada ikan.
Perumusan Masalah
1. Apakah kandungan senyawa kimia yang terdapat dalam kulit buah manggis?
2. Apakah ekstrak kulit buah manggis dapat menghambat pertumbuhan bakteri
dan jamur patogen pada ikan?
Tujuan Penelitian
1. Mengidentifikasi senyawa kimia yang terkandung dalam ekstrak kulit buah
manggis.
2. Mengetahui daya antimikroba ekstrak kulit buah manggis terhadap bakteri uji
Aeromonas hydrophila, Edwardsiella tarda dan jamur Saprolegnia sp. secara
in vitro.
3.
Mengetahui daya toksisitas ekstrak kulit buah manggis terhadap Artemia salinaLeach dengan metode uji Brine Shrimp Lethality Test.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi tentang alternatif
penggunaan bahan antimikroba yang lebih ekonomis dan aman untuk
mengendalikan penyakit ikan yang disebabkan oleh Aeromonas hydrophila,
Edwardsiella tarda dan jamur Saprolegnia sp. serta untuk meningkatkan produksi
budidaya perikanan di Indonesia.
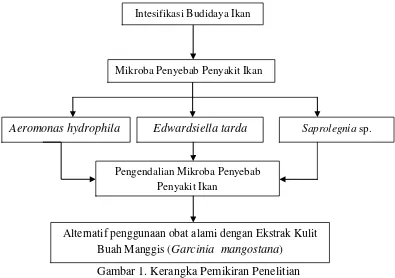
Kerangka Pemikiran Penelitian
Masalah utama yang banyak dihadapi oleh para pembudidaya adalah
penyakit yang menyerang ikan. Pengendalian mikroba penyakit pada ikan
seringkali menggunakan bahan kimia yang efek penggunaannya dapat
menimbulkan resistensi dan pencemaran lingkungan karena bahan kimia yang
digunakan sudah jelas tidak ramah lingkungan. Oleh sebab itu pengendalian
mikroba penyakit pada ikan menggunakan alternatif penggunaan bahan alami
alami yang dapat dijadikan obat alami yaitu Ekstrak Kulit Buah Manggis
(Garcinia mangostana). Adapun kerangka pemikiran penelitian dapat dilihat
pada Gambar 1.
Gambar 1. Kerangka Pemikiran Penelitian
Hipotesis Penelitian
1. Kulit buah manggis mengandung senyawa kimia terpenoid, steroid, saponin,
alkaloid, senyawa golongan fenolik (tanin dan flavonoid).
2. Ekstrak kulit buah manggis dapat menghambat bakteri Aeromonas hydrophila,
Edwardsiella tarda dan jamur Saprolegnia sp. karena mengandung senyawa
antimikroba.
3. Ekstrak kulit buah manggis menunjukkan toksisitas yang rendah.
Intesifikasi Budidaya Ikan
Mikroba Penyebab Penyakit Ikan
Edwardsiella tarda Aeromonas hydrophila
Saprolegnia sp.
Pengendalian Mikroba Penyebab Penyakit Ikan
TINJAUAN PUSTAKA
Manggis (Garcinia mangostana)
Manggis dalam bahasa Inggris dikenal dengan nama mangosteen dan
memiliki nama latin Garcinia mangostana Linn. Manggis termasuk tanaman dari
kelas Dicotyledonae, keluarga Guttiferae dan genus Garcinia. Nama latin
Garcinia mangostana adalah nama yang diberikan oleh Laurent Garcin seorang
penjelajah hutan berkebangsaan Prancis pada abad keenam belas (Hasanah, 2012).
Manggis merupakan tanaman tahunan dari hutan tropis teduh di kawasan
Asia Tenggara, seperti Malaysia dan Indonesia. Tanaman itu menyebar ke
Amerika Tengah dan daerah tropis lainnya, seperti Srilanka, Malagasi, Karibia,
Hawai, Brazil, Honduras, Panama dan Australia Utara. Manggis dijuluki sebagai
Queen of Fruits. Sebutan ini konon berkaitan dengan kesukaaan ratu (queen)
Kerajaan Inggris terhadap buah manggis (Paramawati, 2010).
Secara morfologi, manggis (Gambar 2) merupakan tanaman berkayu yang
keras dan baru mulai berbuah setelah tanaman ini berusia 8-10 tahun. Umurnya
relatif panjang karena bisa mencapai 150 tahun. Karena sifat kayunya yang keras,
di beberapa daerah di Indonesia, khususnya sentra manggis yang tumbuh liar,
pohon manggis banyak ditebang dan kayunya digunakan untuk bahan bangunan
karena memang sangat kuat (Hasanah, 2012).
Pohon manggis akan tumbuh dengan baik jika hidup di dataran rendah
hingga ketinggian kurang dari 1.000 m dpl. Adapun ketinggian yang paling cocok
untuk bertanam manggis adalah 500-600 m dpl dengan curah hujan tahunan
musim akan sangat berpengaruh pada kualitas buah manggis. Jika pohon
kekeringan akibat musim kemarau panjang, buah manggis yang dihasilkan
berukuran kecil dan mengandung getah kuning sehingga menjadikan buah
manggisnya tidak layak ekspor. Ciri buah manggis yang sudah masak adalah kulit
buahnya berwarna ungu kemerahan, bentuknya bulat agak pipih, tangkainya sudah
lunak dan diameter buahnya sekitar 4-7 cm. Tingkat kematangan buah sangat
berpengaruh terhadap mutu dan daya simpan buah. Semakin matang semakin
singkat daya simpannya (Hasanah, 2012). Adapun sistematika dan klasifikasinya
adalah sebagai berikut:
Kingdom : Plantae
Divisi : Magnoliophyta
Kelas : Magnoliopsida
Ordo : Malpighiales
Famili : Clusiaceae
Genus : Garcinia
Spesies : Garcinia mangostana
Bakteri Aeromonas hydrophila
Bakteri adalah organisme satu sel yang mempunyai daerah penyebaran
relatif luas, sehingga hampir dapat dijumpai di mana saja. Bakteri mempunyai
ukuran relatif lebih besar daripada virus, yaitu antara 0.3-0.5 mikron. Fungsi
utama bakteri di lingkungannya adalah mengerjakan berbagai fungsi dalam proses
fermentasi dan industri lainnya. Bakteri patogen dapat ditumbuhkan dalam media
buatan seperti agar darah atau trypticase soy di mana koloninya dapat dilihat
dengan mata telanjang. Bakteri ada yang bergerak dan sebagian lagi tidak
bergerak (Afrianto dan Liviawaty, 1992).
Aeromonas adalah bakteri yang motil dengan panjang 1-4 µm. Morfologi
koloninya sama dengan batang enterik gram negatif, dan mereka menghasilkan
hemolisis yang berzona besar pada agar darah. Spesies Aeromonas yang
dikulturkan dari spesimen tinja tumbuh dengan mudah pada media yang berbeda
yang biasa digunakan untuk kultur batang enterik gram negatif dan mirip bakteri
enterik. Spesies Aeromonas berbeda dari batang enterik gram negatif dilihat dari
adanya reaksi oksidase positifnya pada pertumbuhan yang didapat dari cawan agar
darah (Jawetz dkk., 2001).
Bakteri Aeromonas umumnya hidup di air tawar, terutama yang
mengandung bahan organik tinggi. Ciri utama bakteri Aeromonas adalah
bentuknya seperti batang, ukurannya 1–4,4 x 0,4–1μm, bersifat gram negatif,
fakultatif anaerob (dapat hidup dengan atau tanpa oksigen), tidak berspora,
bersifat motil (bergerak aktif) karena mempunyai satu flagel (Monotrichous
flagella) yang keluar dari salah satu kutubnya, senang hidup di lingkungan
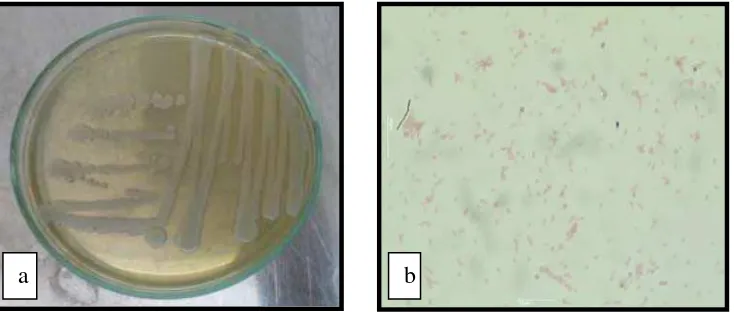
Bakteri A. hydrophila (Gambar 3) dimasukkan ke dalam kelompok bakteri
gram negatif dengan ciri-ciri berbentuk batang, motil, terdapat di perairan tawar,
opurtunis pada ikan yang mengalami stress atau pada pemeliharaan padat tebar
tinggi. Bakteri ini dapat menyerang semua jenis ikan air tawar dan bersifat laten.
Penyakit ini dikenal dengan nama motile aeromonas septicemia (MAS) atau
disebut juga hemorrhage septicemia. Serangan bakteri ini baru terlihat apabila
pertahanan tubuh ikan menurun dengan menunjukkan gejala klinis seperti adanya
hemorrhage pada kulit, insang, rongga mulut, borok pada kulit hingga jaringan
otot, exopthalmia, ascites, pembengkakan limpa dan ginjal, dropsy, serta necrosis
pada limpa, hati, ginjal, dan jantung (Kurniawan, 2012).
Gambar 3. Aeromonas hydrophila (a) Makroskopis (b) Mikroskopis
Aeromonas hydrophila dapat ditemukan dalam makanan dan lingkungan
perairan di seluruh dunia. Bakteri ini adalah anggota dari famili Aeromonadaceae
yang dikenal sebagai patogen pada hewan. Bakteri ini dapat menyebabkan infeksi
usus manusia dan beberapa penyakit yang berakibat fatal. Karena sering
ditemukan di lingkungan perairan A. hydrophila dapat menyebabkan penyakit
serius pada ikan (Belal dkk., 2009).
Ikan yang terserang bakteri A. hidrophyla menujukkan perubahan warna
tubuh menjadi gelap, berenang tidak beraturan, mata ikan rusak, sisik seperti akan
lepas, sirip rusak, insang berwarna pucat, ikan berenang ke permukaan seperti
kekurangan oksigen, insang rusak sehingga sulit bernapas, kulit ikan menjadi
kasat dan timbul pendarahan dengan luka-luka borok, perut menjadi besar (dropsi)
dan apabila dibedah akan terlihat pendarahan pada hati, ginjal dan limpa (Widya,
2013).
Bakteri Edwardsiella tarda
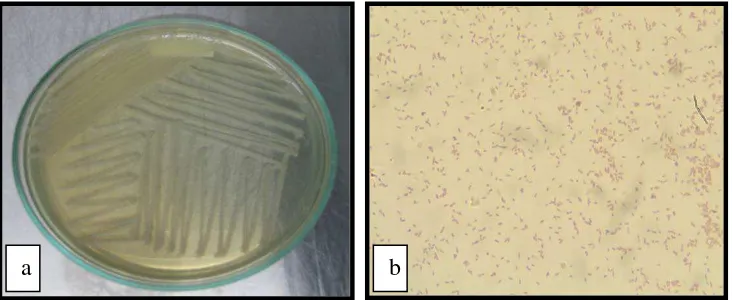
E. tarda merupakan bakteri Gram-negatif yang berbentuk batang bengkok,
dengan ukuran 1 x 2-3 μm, bersifat gram negatif bergerak dengan bantuan
flagella, tidakmembentuk spora atau kapsul dan bersifat fakultatif anaerob.
Bakteri ini dapatdijumpai di lingkungan air tawar dan air laut, dengan suhu
optimal bagi pertumbuhannya sekitar 35oC, sedangkan pada suhu di bawah 10oC
atau di atas 45oC tidak dapat tumbuh (Park dkk, 2012).
E. tarda merupakan bakteri penyebab penyakit edwardsiellosis. Bakteri ini
menyerang spesies-spesies ikan di daerah tropis dan bisa menjadi patogen
oportunistik pada manusia, menyebabkan meningitis dan diare (Wyatt dkk, 1979).
Penularannya secara horizontal yaitu kontak antara inang satu dengan inang
Gambar 4. Edwardsiella tarda (a) Makroskopis (b) Mikroskopis
Nadirah (2012) menjelaskan ikan yang terjangkit edwardsiellosis akan
memperlihatkan gejala sebagai berikut:
1. Terjadi luka pada kulit yang kemudian akan meluas ke bagian daging, sehingga
dengan segera akan mengakibatkan perdarahan. Luka semacam ini sering
dijumpai pada hati ikan.
2. Jika tidak segera diobati, luka-luka ini akan berkembang menjadi bisul dan
mengeluarkan nanah (abses).
3. Pada jaringan daging, hati dan ginjal sering terjadi nekrosa.
Jamur Saprolegnia sp.
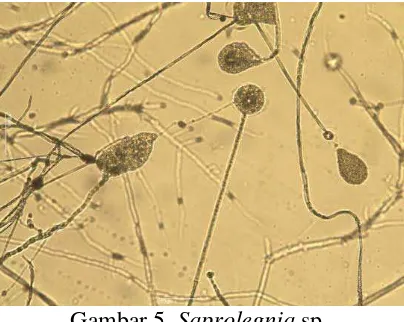
Saprolegnia sp. adalah jenis jamur yang hidup di perairan tawar. Jamur ini
memperbanyak keturunannya dengan cara seksual (dengan alat kelamin) dan
dengan cara aseksual (tanpa alat kelamin). Memperbanyak keturunan secara
aseksual dilakukan dengan spora yang mempunyai dua buah rambut getar
(biflagellata) (Kordi, 2004).
Jamur Saprolegnia sp. (Gambar 5) dapat menyerang sebagian besar ikan
air tawar, tetapi umumnya menyerang ikan mas, gurame, tawes, gabus dan lele.
Selain itu, organisme ini juga sering menyerang telur ikan. Jamur ini umumnya
menyebabkan terjadinya infeksi sekunder sebab ia senang menyerang tubuh ikan
yang mengalami luka-luka oleh aktivitas antibakteri atau parasit lain. Selain
adanya luka, intensitas serangan Saprolegnia sp. akan meningkat apabila
temperatur turun dan ikan mengalami stres (Afrianto dan Liviawaty, 1992).
Gambar 5. Saprolegnia sp.
Saprolegnia sp. menyebabkan penyakit saprolegniasis pada ikan air tawar
seperti ikan mas, tawes, gabus, gurami dan nila. Ikan yang terserang
saprolegniasis biasanya diawali serangan dari bakteri dan parasit serta
penanganan yang tidak baik setelah terserang bakteri tersebut. Jamur ini biasanya
menyerang ikan dan telur ikan. Pada ikan dewasa biasanya yang diserang bagian
kulit yang telah terluka. Sedangkan telur ikan yang terserang akan terlihat seperti
dilapisi kapur (Widya, 2013).
Ikan dan telur ikan yang terserang jamur ini dapat diketahui dengan
mudah, sebab terlihat bagian organ ikan (biasanya bagian luar) atau telur yang
terserang, ditumbuhi oleh sekumpulan miselium jamur yang menyerupai
gumpalan benang-benang halus (hypa) yang tampak seperti kapas. Kumpulan
Diameter hypa kira-kira 20μm. Di dalam kantong sporangianya dijumpai ribuan
zoospora yang mempunyai rambut getar (flagella) (Kordi, 2004).
Ekstraksi
Extractio berasal dari perkataan “extrahere”, “to draw out”, menarik sari
yaitu suatu cara untuk menarik satu atau lebih zat dari bahan asal. Umumnya zat
berkhasiat tersebut dapat ditarik, namun khasiatnya tidak berubah. Dalam
kefarmasian, istilah ini terutama hanya dipergunakan untuk penarikan zat-zat dari
bahan asal dengan mempergunakan cairan penarik atau pelarut (Syamsuni, 2006).
Ekstraksi merupakan suatu metode untuk memisahkan senyawa penting
dari bahan tertentu agar senyawa tersebut dapat lebih baik dalam pemanfaatannya.
Ekstraksi yang sering digunakan adalah dengan menggunakan pelarut karna lebih
ekonomis walaupun membutuhkan waktu yang lama (Widya, 2013).
Umumnya ekstraksi dikerjakan untuk simplisia yang mengandung zat-zat
yang berkhasiat atau zat-zat lain untuk keperluan tertentu. Simplisia
(hewan/tumbuhan) mengandung bermacam-macam zat atau senyawa tunggal;
sebagian mengandung khasiat pengobatan, misalnya bermacam-macam alkaloid,
glukosida, damar, oleoresin, minyak atsiri, lemak dan sebagainya (Syamsuni,
2006).
Tujuan utama ekstraksi ialah mendapatkan atau memisahkan sebanyak
mungkin zat-zat yang memiliki khasiat pengobatan (concentrata) dari zat-zat yang
tidak berfaedah, agar lebih mudah dipergunakan (kemudahan diabsorpsi, rasa,
pemakaian dan lain-lain) dan disimpan dibandingkan simplisia asal, dan tujuan
Ekstraksi adalah metode pemisahan suatu komponen solute (cair) dari
campurannya menggunakan sejumlah massa solven sebagai tenaga pemisah.
Proses ekstraksi terdiri dari tiga langkah besar, yaitu proses pencampuran, proses
pembentukan fasa setimbang, dan proses pemisahan fasa setimbang. Solven
merupakan faktor terpenting dalam proses ekstraksi, sehingga pemilihan solven
merupakan faktor penting. Solven ini harus saling melarutkan terhadap salah satu
komponen murninya, sehingga diperoleh dua fasa rafinat. Proses ekstraksi dapat
berjalan dengan baik bila pelarut ideal harus memenuhi syarat-syarat yaitu
selektivitasnya tinggi, memiliki perbedaan titik didih dengan solute cukup besar,
bersifat inert, perbedaan density cukup besar, tidak beracun, tidak bereaksi secara
kimia dengan solute maupun diluen, viskositasnya kecil, tidak bersifat korosif,
tidak mudah terbakar, murah dan mudah didapat. Beberapa faktor yang
berpengaruh dalam proses ekstraksi adalah temperatur, waktu kontak,
perbandingan solute, faktor ukuran partikel, pengadukan dan waktu dekantasi
(Yasita dan Intan, 2010).
Antimikroba
Antibakteri adalah antimikroba yang dapat menghambat pertumbuhan
bakteri. Pengertian antimikroba secara umum adalah zat yang dapat menghambat
pertumbuhan mikroba dan digunakan untuk kepentingan pengobatan infeksi pada
manusia dan hewan (Gan, dkk., 1980).
Berdasarkan kemampuan mempengaruhi banyaknya jenis mikroba,
dikenal antimikroba berspektrum sempit dan berspektrum luas. Antimikroba yang
berspektrum luas mempengaruhi bakteri gram positif dan gram negatif serta
beberapa jenis mikroba lainnya (Dzen, dkk., 2003).
Antimikroba yang sangat toksik yang membahayakan inangnya bukan
merupakan antibiotik yang baik dan dianggap beracun. Antimikroba yang baik
adalah antimikroba yang mampu menyembuhkan penyakit tanpa menimbulkan
efek samping terhadap inangnya dan juga harus memiliki sifat toksisitas selektif
yang tinggi (Widya, 2013).
Senyawa antimikroba yang berasal dari tanaman, sebagian besar diketahui
merupakan metabolit sekunder tanaman, terutama golongan fenolik dan terpenoid
dalam minyak atsiri. Beberapa senyawa yang bersifat antimikroba alami berasal
dari tanaman diantaranya adalah fitoleksin, asam organik, minyak esensial (atsiri),
fenolik dan beberapa kelompok pigmen tanaman atau senyawa sejenis
(Mawaddah, 2008).
Sejumlah agen antimikroba bekerja dengan merusak DNA. Aktivitas
antimikroba diukur in vitro untuk menentukan (1) potensi agen antimikrobia
dalam larutan (2) konsentrasinya dalam cairan tubuh atau jaringan dan (3)
kepekaan mikroorganisme penyebab terhadap obat yang diketahui (Jawetz, dkk.,
2001).
Antimikrobia yang ideal menunjukkan toksisitas selektif. Hal ini secara
tidak langsung menjelaskan bahwa obat berbahaya bagi parasit dan tidak
membahayakan inang. Seringkali toksisitas selektif lebih bersifat relatif dan tidak
mutlak; hal ini menyatakan bahwa konsentrasi obat-obatan yang toleran terhadap
Senyawa Fitokimia
Steroid adalah senyawa antiinflamasi kuat yang digunakan sejak kurang
lebih tahun lima puluhan. Secara alamiah bahan ini merupakan hormon endogen
yang dihasilkan oleh korteks adrenal (Ardhie, 2004). Beberapa senyawa steroid
mempunyai aktivitas seperti sterol (α-sipanasterol) sebagai anti inflamasi,
glikosida jantung sebagai racun, berbagai hormon, vitamin dan lain-lain. Secara
biosintesis pembentukan steroid berasal dari kondensasi isopentenil pirofosfat
dengan isomernya, dimetil alil pirofosfat. Kondesasi ini berlangsung sampai
terbentuknya skualena dan melalui proses sikliasi dan modifikasi akan terbentuk
steroid (Saleh, 2009). Steroid pada tumbuhan dibentuk oleh senyawa sterol dan
banyak terdapat dalam jaringan tumbuhan sehingga sering dikenal dengan
fitosterol. Senyawa steroid dapat menghambat pertumbuhan bakteri gram positif
(Ayuningtyas, 2008).
Senyawa flavonoida adalah suatu kelompok senyawa fenol yang terbesar
yang ditemukan dialam. Senyawa-senyawa ini merupakan zat warna merah, ungu
dan biru dan sebagai zat warna kuning yang ditemukan dalam tumbuh-tumbuhan.
Flavonoida mempunyai kerangka dasar karbon yang terdiri dari 15 atom karbon,
dimana dua cincin benzen (C6) terikat pada suatu rantaipropana (C3) sehingga
membentuk suatu susunan C6- C3- C6 (Lenny, 2006). Makanan yang kaya
flavonoid dianggap penting untuk mengobati penyakit-penyakit seperti kanker dan
penyakit jantung (yang dapat memburuk akibat oksidasi lipoprotein densitas
rendah) (Heinrich, dkk., 2010).
Alkaloid adalah suatu golongan senyawa organik yang terbanyak
tumbuh-tumbuhan dan tersebar luas dalam berbagai jenis tumbuh-tumbuhan. Hampir semua
alkaloida yang ditemukan dialam mempunyai keaktifan biologis tertentu, ada
yang sangat beracun tetapi ada pula yang sangat berguna dalam pengobatan.
Misalnya kuinin, morfin dan stiknin adalah alkaloida yang terkenal dan
mempunyai efek sifiologis dan psikologis. Alkaloida dapat ditemukan dalam
berbagai bagian tumbuhan seperti biji, daun, ranting dan kulit batang. Alkaloida
umumnya ditemukan dalam kadar yang kecil dan harus dipisahkan dari campuran
senyawa yang rumit yang berasal dari jaringan tumbuhan (Lenny, 2006).
Saponin adalah senyawa penurun tegangan permukaan yang kuat yang
menimbulkan busa bila dikocok dalam air. Sifat saponin menyerupai sabun
(bahasa latin sapo berarti sabun) Saponin bekerja sebagai antimikroba dengan
mengganggu stabilitas membran sel bakteri sehingga menyebabkan sel bakteri
lisis (Ardananurdin, dkk., 2004). Saponin adalah glikosida, yaitu metabolit
sekunder yang banyak terdapat di alam, terdiri dari gugus gula yang berikatan
dengan aglikon atau sapogenin. Senyawa ini bersifat racun bagi binatang berdarah
dingin. Oleh karena itu dapat digunakan untuk pembasmi hama tertentu
(Prihatman, 2001).
Tanin secara umum didefinisikan sebagai senyawa polifenol yang
memiliki berat molekul cukup tinggi (lebih dari 1000) dan dapat membentuk
kompleks dengan protein. Kandungan tanin terkondensasi berpengaruh terhadap
aktivitas antioksidan karena tanin merupakan salah satu antioksidan alami dalam
tumbuhan (Malangngi, 2012). Tanin adalah senyawa organik yang sangat
kompleks dan banyak terdapat pada bermacam-macam tumbuhan. Tanin
dipisahkan sehingga sukar mengkristal, tanin dapat diidentifikasikan dengan
kormatografi, senyawa fenol dari tanin mempunyai aksi adstrigensia, antiseptik
dan pemberian warna (Fachry, dkk., 2012).
Fenol terdiri dari rantai dasar benzene aromatik dengan satu atau lebih
kelompok hidroksil. Tingkat toksisitas fenol beragam tergantung dari jumlah atom
atau molekul yang melekat pada rantai benzene-nya. Untuk fenol terklorinasi,
semakin banyak atom klorin yang diikat rantai benzena maka semakin toksik
rantai tersebut. Klorofenol lebih bersifat toksik pada biota air, seperti akumulasi
dan lebih persisten dibanding dengan fenol sederhana. Fenol sederhana seperti
phenol, cresol dan xylenol mudah larut dalam air dan lebih mudah didegradasi
(Dewilda, dkk., 2012). Aktivitas antimikroba senyawa fenolik adalah dengan
merusak lipid pada membran plasma mikroorganisme, sehingga menyebabkan isi
sel keluar. Dinding sel Mycobacterium penyebab tuberculosis dan lepra kaya
dengan lipid sehingga Mycobacterium sangat peka terhadap senyawa fenolik
(Pratiwi, 2008).
Uji Brine Shrimp Lethality Test
Brine Shrimp Lethality Test (BSLT) merupakan salah satu metode untuk
menguji bahan-bahan yang bersifat toksik. Uji toksisitas dengan metode BSLT ini
merupakan uji toksisitas akut dimana efek toksik dari suatu senyawa ditentukan
dalam waktu singkat, yaitu rentang waktu selama 24 jam setelah pemberian dosis
uji. Suatu ekstrak dikatakan toksik berdasarkan metode BSLT jika harga LC50 <
1000 μg/ ml. BSLT digunakan untuk pengujian sitotoksik sederhana pada dosis
senyawa aktif terhadap udang, akan tetapi prosedur yang sederhana, biaya yang
rendah dan korelasinya terhadap pengujian sitotoksitas dan pengujian antitumor
membuat pengujian ini sebagai uji pendahuluan yang sesuai dan dapat dilakukan
secara rutin di laboratorium dengan fasilitas sederhana (Aras, 2013).
Uji bioaktivitas menggunakan larva udang A. salina dikenal dengan istilah
Brine Shrimp Lethality Test (BSLT). BSLT adalah suatu metode penelusuran
untuk menentukan toksisitas ekstrak ataupun senyawa terhadap larva udang dari
A. salina (Darmawan, 2011). Larva udang tersebut sangat peka terhadap apapun
yang berada di lingkungannya dan berkembang dengan sangat cepat menyerupai
pertumbuhan sel kanker. Keadaan membran kulitnya yang sangat tipis
memungkinkan terjadinya difusi zat dari lingkungan yang mempengaruhi
metabolisme dalam tubuhnya. Oleh karena itu, penambahan zat ekstraktif yang
diduga mengandung senyawa bioaktif yang juga berpotensi sebagai senyawa obat
diharapkan mampu mengganggu metabolisme dan menyebabkan kematian larva
udang (Meilani, 2006).
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Mei-Desember 2014. Pembuatan
ekstrak dan pengujian fitokimia kulit buah manggis di Laboratorium Kimia Bahan
Alam, Fakultas Matematika dan Ilmu Pengetahuan Alam. Pengujian aktivitas
antimikroba di Stasiun Karantina Ikan Pengendalian Mutu dan Keamanan Hasil
Perikanan Kelas I Medan II. Pengujian Brine Shrimp Lethality Test dilakukan di
Unit Pelayanan Teknis (UPT) Budidaya Ikan, Dinas Perikanan dan Kelautan Kota
Medan.
Alat dan Bahan
Adapun alat-alat yang digunakan dalam penelitian ini antara lain adalah
Mikroskop, mortar, ayakan mesh 32, labu Erlenmeyer, spatula, blender, pipet
tetes, rak tabung, objek glass, cover glass, tabung reaksi, timbangan digital,
corong, rotary evaporator, gelas ukur, timbangan analitik, botol vial, cawan petri,
oven, hot plate, magnetic stirrer, autoclave, Laminar air flow, jarum ose, bunsen,
inkubator, beaker glass, pinset, jangka sorong, sarung tangan, masker, kamera
digital, alat tulis, corong pemisah, water bath dan kertas saring.
Adapun bahan-bahan yang digunakan dalam penelitian ini antara lain
adalah kulit buah manggis (Garcinia mangostana), isolat murni bakteri
Aeromonas hydrophila diperoleh dari Balai Karantina Ikan Pengendalian Mutu
dan Keamanan Hasil Perikanan Kelas I Medan I, Edwardsiella tarda diperoleh
Kelas I Medan II dan jamur Saprolegnia sp. diperoleh dari Balai Karantina Ikan
Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Medan II, Thin Layer
Cromatography (TLC), air, garam non-yodium, pelarut n-Heksana, Etil asetat,
Metanol, Dimethyl sulfoxide (DMSO), asam asetat anhidrat, H2SO4 pekat, HCl 2
N, Pb asetat, kloroform isopropanol, FeCl3 1%, metanol, NaOH 10%, petroleum
bensin, pereaksi Dragendrof, pereaksi Bouchardat, pereaksi Mayer, pereaksi
Wagner, Trypticase soy agar (TSA), Potato Dextrose Agar (PDA),\ akuades,
alkohol 70%, NaCl 0,9% , kertas cakram, kloramfenikol, nistatin, kapas, kertas
label, aluminium foil. Alat dan bahan yang digunakan terlebih dahulu dilakukan
sterilisasi, tahapan sterilisasi dapat dilihat pada Lampiran 2.
Prosedur Penelitian
Pembuatan Ekstrak Kulit Buah Manggis
Beberapa kulit buah manggis yang diperoleh dari daerah sekitar kota
Medan. Buah yang sudah tua memiliki karakteristik warna kulit ungu kehitaman
kemudian dikupas dan dipisahkan kulit dengan buahnya. Kulit buah manggis
dipotong dengan cara manual yaitu dengan menggunakan pisau dan dirajang
hingga membentuk ukuran yang lebih kecil. Kuilt dikeringkan pada suhu ruangan
tanpa terkena sinar matahari langsung selama ± 1 minggu. Kulit yang kering akan
berwana kehitaman dan mengeras. Kulit yang sudah kering dihaluskan dengan
menggunakan blender sehingga menjadi serbuk (simplisia). Selanjutnya simplisia
ditimbang sebanyak 300 gram dan dimasukkan ke dalam labu erlenmeyer yang
kamar dan tidak boleh terkena sinar matahari selama ± 24 jam dan dilakukan
pengadukan sesekali.
Setelah ± 24 jam, sampel disaring dengan menggunakan kertas saring
sehingga diperoleh filtrat dan ampas, kemudian filtrat dievaporasi dengan rotary
evaporator untuk memisahkan pelarut dengan ekstrak kulit buah manggis. Ekstrak
dimasukkan kedalam botol vial dan dilakukan pemekatan ekstrak dengan
penangas air (water bath) sampai seluruh pelarutnya habis menguap dan diperoleh
ekstrak pekat. Lakukan perlakuan yang sama pada larutan etil asetat dan metanol
secara berturut-turut dengan menggunakan pengenceran tunggal.
Uji Fitokimia
Uji fitokimia kulit buah manggis merupakan uji yang dilakukan untuk
mengetahui senyawa-senyawa kimia yang terdapat di dalam kulit buah manggis.
Tahapan pengujian ini dilakukan berdasarkan metode Harborne (1998).
a. Uji Alkaloid
Ekstrak sampel diambil 4 ml dimasukkan masing-masing 1 ml kedalam 4
tabung reaksi. Tabung pertama ditambah 2 tetes pereaksi Bouchardat, apabila
terbentuk endapan berwarna cokelat sampai hitam maka sample positif alkaloid.
Tabung kedua ditambah 2 tetes pereaksi Dragendroff, apabila terbentuk endapan
berwarna merah/jingga maka sampel positif alkaloid. Tabung ketiga ditambah 2
tetes pereaksi Mayer, apabila terbentuk endapan berwarna putih/kuning maka
sampel positif alkaloid. Tabung keempat ditambah 2 tetes pereaksi Wagner,
b. Uji Senyawa Golongan Fenolik/Flavonoid/Tanin
Ekstrak sampel diambil 1 ml dimasukkan kedalam tabung reaksi kemudian ditambah FeCl3 1% apabila terjadi perubahan warna menjadi hitam maka positif mengandung fenolik.
d. Uji Saponin
Ekstrak sampel sebanyak 2 ml ditambahkan akuades kemudian dikocok
selama 1 menit. Apabila menimbulkan busa ditambahkan HCl 1 N, apabila busa
stabil selama 10 menit dengan ketinggian 1-3 cm, maka ekstrak positif
mengandung saponin.
e. Uji Terpenoid dan Steroid
Ekstrak sampel diambil 2 ml dimasukkan kedalam tabung reaksi kemudian
ditambah dengan 2 tetes pereaksi Lieberman-Bouchard apabila terbentuk warna
biru/hijau positif terpen/steroid.
Pengujian dengan CeSO4 dilakukan dengan metode Thin Layer
Chromatography (TLC) dengan cara ekstrak sampel diteteskan ke plat TLC
kemudian disemprot dengan pereaksi CeSO4 dan dipanaskan diatas hot plate.
Perubahan warna yang terjadi di plat diamati dan dibandingkan dengan standar
tripenoid dan β-sitosterol yang terbentuk.
Persiapan Bakteri dan Jamur
Pembuatan media tumbuh bakteri dan jamur dapat dilihat pada Lampiran
1. Bakteri Aeromonas hydropila dan Edwardsiella tarda diinokulasi ke media
TSA sedangkan jamur Saprolegnia sp. diinokulasikan ke media PDA. Inokulum
Aeromonas hydropila, Edwardsiella tarda dan 7 hari untuk jamur Saprolegnia sp.
Stok kultur bakteri yang ada diambil biakannya dengan jarum ose steril dan
suspensikan ke dalam tabung yang berisi 3 ml larutan NaCl fisiologis 0,9%.
Kemudian dihomogenkan dengan vortex hingga diperoleh kekeruhan suspensi
sebanding dengan kekeruhan larutan Mc Farland sama dengan 0,5 x 108 CFU/ml.
Pembuatan larutan Mc Farland dapat dilihat pada Lampiran 3. Jamur dipotong 0,5
x 0,5 cm dengan menggunakan pisau steril kemudian diletakkan ke media PDA
baru.
Pembuatan Konsentrasi Larutan Uji
Konsentrasi yang akan digunakan yaitu 0% (Kontrol negatif); 20%; 40%;
60% dan 80% (b/v). Larutan dibuat dengan cara menimbang ekstrak kulit buah
manggis sebanyak 0,8 g yang dilarutkan dengan DMSO sebanyak 1 ml. Larutan
dengan konsentrasi 60%, 40% dan 20% dibuat dengan cara pengenceran dari
konsentrasi 80% dengan DMSO 0,5 ml. Untuk kontrol positif digunakan
kloramfenikol 30µg/ml untuk bakteri dan disk nistatin 100µg/ml untuk jamur dan
kontrol negatif digunakan DMSO.
Pengujian Ekstrak Kulit Buah Manggis Terhadap Bakteri dan Jamur
Pengujian ekstrak kulit buah manggis dilakukan dengan metode difusi disk
menggunakan kertas cakram berdiamter 6 mm. Cakram dimasukkan ke dalam
botol vial yang telah berisi larutan ekstrak dengan konsentrasi 20%; 40%; 60%
Sebanyak 10 ml TSA dan PDA masing-masing dituangkan ke dalam
cawan petri steril dan dibiarkan memadat. Pada suspensi bakteri dicelupkan lidi
kapas steril dan diusapkan perlahan-lahan pada permukaan media secara merata
dan ditunggu hingga mengering pada suhu kamar. Cakram yang telah ditetesi
ekstrak dengan konsentrasi berbeda dan antibiotik diletakkan secara teratur pada
permukaan media uji dengan menggunakan pinset steril.
Pada media tumbuh jamur yang berumur 2 hari diletakkan cakram yang
telah ditetesi ekstrak dengan konsentrasi berbeda dan antibiotik secara teratur
dengan menggunakan pinset steril dan diinkubasi selama 7 hari.
Pengamatan Zona Hambat Pertumbuhan Bakteri dan Jamur
Pengamatan untuk bakteri dilakukan setelah masa inkubasi yaitu dengan
melihat adanya zona hambatan (daerah bening) di sekitar cakram. Diameter zona
hambat diukur dengan jangka sorong. Diameter zona hambat diukur dengan
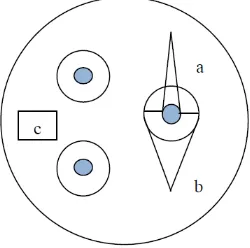
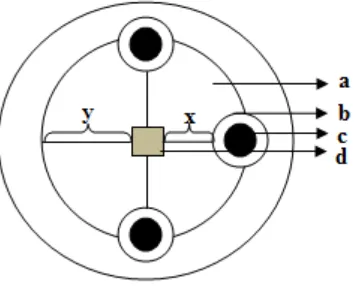
mengurangkan diameter zona hambat dengan diameter kertas cakram (Gambar 6).
Pengamatan untuk jamur ditentukan dengan cara mengukur jari-jari
pertumbuhan hifa normal dikurang dengan jari-jari pertumbuhan hifa yang
terhambat oleh ekstrak (Gambar 7).
Gambar 7. Perhitungan Zona Hambat Jamur; a: Pertumbuhan koloni jamur, b: Zona hambat ekstrak kulit buah manggis terhadap koloni jamur, c: Blank disk yang berisi ekstrak, d: Letak koloni jamur yang ditanam, x: Koloni jamur yang pertumbuhannya terhambat, y: Koloni jamur yang pertumbuhannya normal, y-x : Jari-jari zona hambat
Uji Toksisitas Kulit Buah Manggis
Pengujian toksisitas kulit buah manggis ini dilakukan dengan
menggunakan metode Brine Shrimp Lethality Test (BSLT). Kista A. salina
ditetaskan dalam bejana yang sudah berisi air dengan salinitas 83 ppt dan
dilengkapi dengan alat aerasi. Selanjutnya dibiarkan selama 48 jam hingga kista
menetas dan tumbuh dewasa (naupli).
Larutan induk ekstrak kulit buah manggis untuk setiap uji dibuat dengan
melarutkan 20 mg dalam 2 ml pelarut DMSO. Larutan uji 1000 ppm dibuat
dengan memipet larutan induk sebanyak 500 μl, sedangkan larutan uji 100 ppm
dengan memipet 50 μl dan 10 ppm dibuat 5 μl dari larutan induk. Masing-masing
larutan uji dimasukkan ke dalam vial dan ditambahkan air dengan salinitas 83 ppt
ekor larva udang A. salina dimasukkan ke dalam vial. Masing-masing konsentrasi
dibuat ulang sebanyak 5 kali (5 vial) dan 1 vial untuk kontrol. Kematian A. salina
diamati setelah 24 jam.
Analisis Data
Pengujian Fitokimia
Pengujian ini dilakukan untuk mengetahui senyawa-senyawa kimia yang
terdapat di dalam kulit buah manggis. Pengamatan dilakukan langsung setelah
pemberian bahan-bahan sesuai dengan senyawa fitokimia yang akan diuji.
Pengujian Daya Antimikroba
Perlakuan yang diberikan yaitu ekstrak kulit buah manggis yang berbeda
yaitu perlakuan P0 0% (DMSO), P1 20%, P2 40%, P3 60%, P4 80% dan P5
antibiotik untuk uji antimikroba. Perlakuan dilakukan sebanyak 5 kali ulangan
untuk setiap konsentrasi.
Pengujian Brine Shrimp
Perlakuan yang diberikan yaitu P0 0% (kontrol), P1 10 ppm, P2 100 ppm
dan P3 1000 ppm. Perlakuan dilakukan sebanyak 5 kali ulangan untuk setiap
konsentrasi. Pengamatan A. salina dilakukan setelah 24 jam. Analisis data
menggunakan analisis probit untuk menentukan LC50. Perhitungan LC50
dilakukan dengan menggunakana persamaan regresi linier yaitu y = a + bx yang
didapat dari grafik hubungan antara log konsentrasi dengan mortalitas probit
HASIL DAN PEMBAHASAN
Hasil
Uji Fitokimia Kulit Buah Manggis (Garcinia mangostana)
Dari hasil pengujian fitokimia ekstrak kulit buah manggis dengan
menggunakan pelarut metanol, etil asetat dan n-heksana memperlihatkan bahwa
secara keseluruhan ekstrak kulit buah manggis mengandung senyawa metabolit
sekunder seperti terpen/steroid, alkaloid dan fenolik (tanin dan flavonoid). Hasil
pengujian fitokimia kulit buah manggis dengan masing-masing pelarut dapat
dilihat pada Tabel 1.
Tabel 1. Hasil uji fitokimia kulit buah manggis (Garciniamanggostana)
Golongan
Terpen/ Steroid Lieberman-Bouchard Cerium sulfat (CeSO4)/TLC
+
Ekstraksi Kulit Buah Manggis (Garcinia mangostana)
Ekstraksi kulit buah manggis dilakukan dengan menggunakan pelarut
metanol, etil asetat dan n-heksana dengan metode maserasi/perendaman simplisia
kulit buah manggis. Hasil ekstraksi kulit buah manggis dapat dilihat pada Tabel 2.
Tabel 2. Hasil ekstraksi kulit buah manggis (Garciniamangostana)
Hasil Pelarut
Metanol Etil asetat n-Heksana Warna Merah kehitaman Merah kecoklatan Kuning
Uji Toksisitas Kulit Buah Manggis (Garcinia mangostana)
Dari hasil pengujian ekstrak kulit buah manggis terhadap Artemia salina
memperlihatkan tingginya jumlah kematian pada kisaran LC50 antara
100-1000ppm. Hasil uji toksisitas berdasarkan konsentrasi ekstrak kulit buah manggis
dengan masing-masing pelarut dapat dilihat pada Tabel 3.
Tabel 3. Hasil uji toksisitas kulit buah manggis (Garciniamangostana) dengan metode Brine Shrimp Lethality Test (BSLT)
Pelarut Konsentrasi (ppm)
Uji Aktivitas Antimikroba Kulit Buah Manggis (Garcinia mangostana)
Pengujian aktivitas antimikroba dilakukan dengan metode difusi cakram
dengan menggunakan blanc disc ukuran 6 mm. Ekstrak kulit buah manggis
menunjukkan adanya zona hambat pada ketiga mikroba uji. Aktivitas antimikroba
dapat terlihat dengan mengamati zona bening yang terbentuk disekitar cakram dan
menghambat pertumbuhan bakteri dan jamur. Zona hambat bakteri A. hydrophila
dan E. tarda dapat dilihat setelah masa inkubasi selama 24 jam. Zona hambat
jamur Saprolegnia sp. dapat dilihat setelah 3 hari sampai hifa normal tumbuh
menutupi cawan petri. Hasil pengujian aktivitas antimikroba dapat dilihat pada
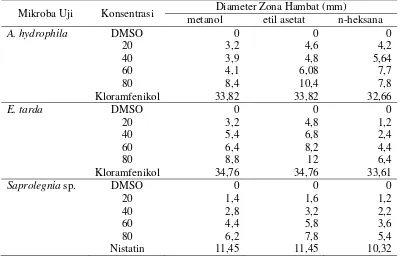
Tabel 4. Hasil pengamatan antimikroba dengan metode difusi
Mikroba Uji Konsentrasi Diameter Zona Hambat (mm)
metanol etil asetat n-heksana
A. hydrophila DMSO 20
Hasil pengujian ekstrak kulit buah manggis terhadap pertumbuhan bakteri
A. hydrophila, E. tarda dan jamur Saprolegnia sp. menunjukkan adanya zona
hambat pada ekstrak kulit buah manggis dengan pelarut metanol, etil asetat dan
n-heksana. Besarnya zona hambat yang dihasilkan oleh ekstrak terlihat dengan
terhambatnya pertumbuhan bakteri dan jamur disekitar cakram (Lampiran 12).
Pembahasan
Uji Fitokimia Kulit Buah Manggis (Garcinia mangostana)
Uji fitokimia dilakukan untuk mengetahui adanya senyawa alkaloid
(pereaksi Bouchardat, Dragendroff, Mayer, dan Wagner), fenolik/flavonoid/tanin
(FeCl3), terpen/steroid (CeSO4/+Lieberman Bouchard) dan saponin (Aqua) pada
ekstrak kulit buah manggis (Garcinia mangostana).
Uji fitokimia terhadap senyawa terpen/steroid dengan menggunakan
pereaksi CeSO4/+Lieberman Bouchard menunjukkan hasil yang positif terhadap
ketiga ekstrak tersebut. Hal ini ditandai dengan perubahan warna larutan menjadi
hijau kebiruan yang menunjukkan adanya senyawa terpen/steroid. Senyawa
terpen/steroid selanjutnya diuji dengan menggunakan metode Thin Layer
Cromatography (TLC) ditambah pereaksi CeSO4 1%. Hasil positif terdapat pada
ketiga ekstrak yang ditandai dengan perubahan warna ekstrak yang menyerupai
warna standar β-sitosterol dan triterpenoida.
Uji fitokimia terhadap senyawa alkaloid dengan menggunakan pereaksi
Dragendroff menunjukkan hasil yang positif terhadap ekstrak metanol dan etil
asetat. Hal ini ditandai dengan perubahan warna larutan menjadi merah pada
pereaksi Dragendroff.
Uji fitokimia terhadap senyawa fenolik/flavonoid/tanin dengan
menggunakan pereaksi FeCl3 menunjukkan hasil yang positif terhadap ekstrak
metanol dan etil asetat. Hal ini ditandai dengan perubahan warna larutan menjadi
hitam. Perubahan warna dari uji fitokimia dapat dilihat pada Lampiran 11.
Asifa (2014) menyebutkan bahwa ekstrak n-heksana kulit buah manggis
kulit buah manggis mengandung senyawa saponin, triterpenoid, tanin dan
polifenol, flavonoid serta alkaloid yang dikemukakan oleh Windarini dkk (2013).
Putri dkk (2013) menyatakan bahwa etil asetat merupakan pelarut yang dapat
digunakan untuk ekstraksi kulit buah manggis karena dapat menarik senyawa
golongan alkaloid, flavonoid, saponin, tannin, polifenol dan triterpenoid.
Ekstraksi Kulit Buah Manggis (Garcinia mangostana)
Hasil ekstraksi kulit buah manggis dengan menggunakan pelarut metanol
diperoleh ekstrak pekat sebanyak 16,54 gram dengan warna merah kehitaman,
pelarut etil asetat menghasilkan ekstrak pekat sebanyak 7,4 gram dengan warna
merah kecoklatan sedangkan pelarut n-heksana menghasilkan ekstrak pekat
sebanyak 3,51 gram dengan warna kuning. Menurut Achmadi (1992) ekstraksi
adalah peristiwa pemindahan zat terlarut (solute) antara dua pelarut yang tidak
saling bercampur dengan tujuan untuk memperoleh ekstrak murni.
Proses ekstraksi dengan pelarut yang berbeda sifat kepolarannya dilakukan
dengan tujuan untuk mengetahui sifat senyawa antimikroba yang terdapat dalam
kulit buah manggis. Hal ini dilakukan karena setiap pelarut dengan sifat
kepolarannya masing-masing akan melarutkan komponen-komponen yang
berbeda termasuk komponen yang aktif sebagai antimikroba. Hasil penelitian
menunjukkan bahwa ekstrak pekat kulit buah manggis yang dihasilkan paling
banyak terekstrak pada pelarut metanol yang bersifat polar. Ketaren (1986)
menyatakan bahwa jenis dan mutu pelarut yang digunakan menentukan
yang diinginkannya, mempunyai titik didih yang rendah, murah, tidak toksik dan
mudah terbakar.
Uji Toksisitas Kulit Buah Manggis (Garcinia mangostana)
Uji toksisitas dengan metode Brine Shrimp Letahlity Test (BSLT)
merupakan suatu uji yang digunakan untuk mengetahui senyawa aktif yang
terkandung dalam ekstrak. Tanaman. Suatu ekstrak dianggap toksik apabila
memiliki nilai LC50<1000 ppm sedangkan untuk senyawa murni dikatakan toksik
apabila LC50<200 ppm (Meyer dkk., 1982).
Uji toksisitas terhadap Artemia salina dengan ekstrak metanol dilakukan
dengan 5 kali pengulangan pada masing-masing konsentrasi 10, 100, 1000 ppm.
Pada konsentrasi 10, 100, 1000 ppm jumlah kematian berturut-turut mencapai 10,
20 dan 29 ekor dengan total populasi 50 ekor setiap konsentrasi. Hasil analisa
persen kematian yang dikonversikan ke nilai probit dan menghitung persamaan
regresi linier untuk mendapatkan nilai LC50, didapatkan nilai LC50 terhadap
ekstrak metanol sebesar 372,524 ppm maka hasil uji BSLT ekstrak metanol kulit
buah manggis (Garcinia mangostana) dikategorikan toksik terhadap A. salina.
Data hasil perhitungan nilai LC50 dapat dilihat pada Lampiran 14.
Tingkat kematian dapat ditemukan secara langsung melalui perbandingan
konsentrasi yang berkisar dari konsentrasi terendah hingga konsentrasi tertinggi.
Dengan kata lain, kematian Artemia disebabkan oleh peningkatan konsentrasi
dalam sampel (Apurba, 2013).
Hasil uji toksisitas ekstrak etil asetat pada konsentrai 10, 100, 1000 ppm
konsentrasi. Nilai LC50 yang didapat yaitu sebesar 431,811 ppm yang
dikategorikan toksik sedangkan nilai LC50 ekstrak n-heksana diperoleh sebesar
114,384 ppm. Nilai LC50 ekstrak etil asetat kulit buah manggis tidak berbeda jauh
dengan penelitian Fatimawati dkk (2013) ekstrak kulit buah manggis yakni 418
ppm. Nilai LC50 ekstrak n-heksana paling toksik dibandingkan dengan ekstrak
metanol dan etil asetat. Widya (2013) menyatakan bahwa ekstrak yang dihasilkan
dengan pelarut n-heksana mengandung senyawa non polar yang memiliki ukuran
kecil sehingga mudah untuk masuk ke dalam membran sel melalui proses difusi
yang menyebabkan sel lebih cepat mengalami kerusakan atau mati. Meilani
(2006) menambahkan bahwa keadaan membran kulitnya yang sangat tipis
memungkinkan terjadinya difusi zat dari lingkungan yang mempengaruhi
metabolisme dalam tubuhnya.
n-Heksana merupakan pelarut yang bersifat paling tidak polar sehinggga
ekstrak yang dihasilkan pun bersifat non polar. Komponen yang umumnya larut
dalam n-heksana adalah lilin, lemak, dan komponen terpenoid (Nuraini, 2007).
Komponen yang terkandung dalam n-heksana inilah yang menyebabkan persen
kematian Artemia salina lebih besar dibandingkan etil asetat dan metanol.
Uji toksisitas dengan metode BSLT ini juga menggunakan 2 jenis kontrol
yaitu dengan menggunakan kontrol air laut dan kontrol DMSO yang merupakan
pelarut yang digunakan untuk melarutkan bahan ekstrak metanol, etil asetat dan
n-heksana yang digunakan pada penelitian ini. Nilai persen mortalitas yang cukup
rendah pada kontrol air laut dan kontrol DMSO menunjukkan bahwa air laut dan
DMSO yang digunakan pada penelitian ini bukan merupakan penyebab kematian
Uji Aktivitas Antimikroba Kulit Buah Manggis (Garcinia mangostana)
Uji aktivitas antimikroba dalam menghambat pertumbuhan bakteri dan
jamur uji ditunjukkkan oleh ukuran areal bening yang membentuk lingkaran
disekitar kertas cakram sehingga dapat dihitung diameter penghambatannya.
Terbentuknya areal bening disebabkan karena adanya bahan antimikroba pada
ekstrak kulit buah manggis sehingga pertumbuhan bakteri dan jamur terhambat.
Hasil uji aktivitas antimikroba terhadap bakteri A. hydophila, E. tarda dan
jamur Saprolegnia sp. menunjukkan hasil bahwa kontrol negatif yang berupa
DMSO tidak membentuk zona benting ataupun zoba hambat disekitar cakram
pada ketiga mikroba tersebut. Hal ini menunjukkan bahwa DMSO yang
digunakan sebagai pelarut pembuatan variasi konsentrasi tidak memiliki aktivitas
antimikroba sehingga aktivitas antimikroba hanya berasal dari larutan uji bukan
pelarut yang digunakan. Widowati dan Harfia (2009) menyatakan bahwa DMSO
merupakan pelarut yang dapat digunakan untuk melarutkan sebagian ekstrak yang
tidak dapat larut dalam air dan pada konsentrasi dibawah 3% DMSO tidak toksik
kepada sel.
Pengujian aktivitas antibakteri digunakan klromfenikol sebagai kontrol
positif dimana hasil pengujian menunjukkan adanya aktivitas antibakteri dengan
terbentuknya zona bening disekitar cakram yaitu sebesar 33,82 mm untuk A.
hydophila dan sebesar 34,76 mm untuk E. tarda. Siswandono dan Soekardjo
(1995) menyatakan bahwa kloramfenikol digunakan sebagai antibiotik bersfifat
bakteriostatik dan mempunyai spektrum luas. Telaah lain menyebutkan bahwa
kloramfenikol memberikan efek dengan cara bereaksi pada sub unit 50S ribosom
membentuk ikatan peptida antara asam amino terakhir yang sedang berkembang.
Sebagai akibatnya, sintesis protein bakteri akan terhenti seketika (Pratiwi, 2008).
Pengujian aktivitas antijamur digunakan nistatin sebagai kontrol positif
dimana hasil pengujian menunjukkan adanya zona hambat disekitar cakram yaitu
sebesar 11,45 mm untuk Saprolegnia sp. Pelczar dan Chan (2005) menyatakan
bahwa cara kerja nistatin adalah merusak sel-sel khamir, juga sel cendawan lain
dengan cara bergabung dengan sterol yang terdapat dalam membran sel. Hal ini
mengakibatkan kacaunya organisasi di dalam struktur molekuler membran, diikuti
dengan gangguan pada fungsinya.
Pengujian aktivitas ekstrak metanol menunjukkan bahwa hambatan
pertumbuhan terbesar terdapat pada bakteri E. tarda yaitu sebesar 8,8 mm pada
konsentrasi 80%, kemudian bakteri A. hydrophila sebesar 8,4 mm pada
konsentrasi 80% dan jamur Saprolegnia sp. sebesar 6,2 mm pada konsentrasi
80%. Adanya aktivitas antimikroba tersebut kemungkinan disebabkan karena
kerja dari senyawa-senyawa metabolit sekunder yang terkandung dalam kulit buah
manggis (Garcinia mangostana) seperti fenolik/flavonoid/tanin, terpen/steroid
dan alkaloid. Perbedaan luas hambatan disebabkan oleh bahan penyusun dinding
atau membran sel dari setiap mikroba uji yang berbeda.
Menurut Pratiwi (2008) Golongan fenol diketahui memiliki aktivitas
antimikroba yang bersifat bakterisidial namum tidak bersifat sporisidial dengan
mendenaturasi protein dan merusak membran sel bakteri serta aktif pada pH asam.
Golongan ini juga merusak lipid pada membran plasma mikroorganisme sehingga
menyebabkan isi sel keluar. Mekanisme antimikroba senyawa fenolik adalah
adalah mengganggu transport aktif dan kekuatan proton (Davidson dan Branen,
1993).
Pengujian aktivitas ekstrak etil asetat menunjukkan bahwa hambatan
pertumbuhan terbesar terdapat pada bakteri E. tarda yaitu sebesar 12 mm pada
konsentrasi 80%, kemudian bakteri A. hydrophila sebesar 10,4 mm pada
konsentrasi 80% dan jamur Saprolegnia sp. sebesar 7,8 mm pada konsentrasi
80%.
Menurut Naufalin (2005) alkaloid dan glikosida merupakan senyawa yang
sudah diketahui memiliki aktivitas antimikroba. Sinergisme dari senyawa
fitokimia dalam ekstrak etil asetat diduga lebih mudah berdifusi dan mampu
menghambat pertumbuhan bakteri karena memiliki polaritas yang optimum.
Harborne (1998) menyatakan bahwa ketersediaan alkaloid dapat mengganggu
terbentuknya komponen penyusun peptidoglikan pada sel bakteri sehingga dapat
mengakibatkan sel bakteri menjadi lisis.
Pengujian aktivitas ekstrak n-heksana menunjukkan bahwa hambatan
pertumbuhan terbesar terdapat pada bakteri A. hydrophila yaitu sebesar 7,8 mm
pada konsentrasi 80%, kemudian bakteri E. tarda sebesar 6,4 mm pada
konsentrasi 80% dan jamur Saprolegnia sp. sebesar 5,4 mm pada konsentrasi
80%.
Fessenden dan Fessenden (1997) menyatakan bahwa steroid merupakan
senyawa yang paling penting diantara senyawa yang aktif dari segi biologi.
Banyak steroid dengan gugus karbonil dan hidroksil pada karbon 11 mempunyai
obat dan zat antibakterial adalah β-sitosterol yang diisolasi dari tanaman Trema
orientalis yang dapat menghambat pertumbuhan bakteri Gram negatif.
Dari hasil uji aktivitas antimikroba diperoleh data diameter zona hambat
ketiga ekstrak kulit buah manggis yang menunjukkan bahwa ekstrak etil asetat
mempunyai daya antimikroba yang kuat, ekstrak metanol dan n-heksana
mempunyai daya antimikroba yang sedang tetapi ekstrak n-heksana juga
mempunyai daya antimikroba yang cenderung lemah. Hasil uji antibakteri A.
hydrophila dapat dilihat pada Gambar 8, E. tarda dapat dilihat pada Gambar 9 dan
Saprolegnia sp. dapat dilihat pada Gambar 10. Davis dan Stout (1971)
menyatakan bahwa daerah hambatan sebesar 20 mm atau lebih berarti sangat kuat,
daerah hambatan 10-20 mm kuat, daerah hambatan 5-10 mm sedang dan kurang
dari 5 mm lemah.
Berdasarkan hasil pengamatan ekstrak n-heksana menghasilkan zona
hambat yang paling kecil dalam penelitian ini dibandingkan dengan zona hambat
yang dihasilkan ekstrak metanol dan ekstrak etil asetat kulit buah manggis.
Ketidakefektifan ekstrak n-heksana dalam menghambat pertumbuhan bakteri uji
diduga berkaitan dengan sifat n-heksana yang sangat tidak polar sehingga hanya
sedikit komponen zat aktif yang larut di dalamnya. Menurut Naufalin (2005)
ekstrak heksana mengandung minyak atsiri yang bersifat antimikroba, namun
kontak antara senyawa antimikroba dan minyak atsiri dengan sel bakteri terhalang
oleh adanya minyak dan lemak dalam ekstrak heksana. Minyak dan lemak lainnya
mengganggu proses difusi dan melindungi bakteri dari senyawa antibakteri.
Berdasarkan hasil pengamatan ekstrak etil asetat menghasilkan zona
yang dihasilkan ekstrak metanol dan ekstrak n-heksana kulit buah manggis.
Menurut Kanazawa dkk (1995) suatu senyawa yang mempunyai polaritas
optimum akan mempunyai aktivitas antimikroba maksimum, karena untuk
interaksi suatu senyawa antibakteri dengan bakteri diperlukan keseimbangan
hidrofilik-lipofilik. Adawiyah (1998) menyatakan bahwa etil asetat merupakan
pelarut yang bersifat semi polar. Sifat etil asetat yang semi polar menyebabkan
ekstrak etil asetat akan memiliki dua sifat kelarutan yaitu hidrofilik dan lipofilik.
Berdasarkan hasil pengamatan ekstrak metanol menunjukkan terbentuknya
zona hambat meskipun diameter penghambatannya tidak sebesar ekstrak etil
asetat. Metanol merupakan pelarut yang bersifat polar. Davidson dan Naidu
(2000) menyatakan bahwa komponen yang banyak terdapat pada
tumbuh-tumbuhan dan bersifat polar antara lain senyawa dari golongan fenolik.
Mekanisme komponen antibakteri fenolik umumnya akan berinteraksi dengan
protein yang ada pada dinding sel atau sitoplasma melalui ikatan hidrogen dan
interaksi hidrofobik. Mekanisme lain kemungkinan adalah dengan mengganggu
aktivitas enzim dalam sel.
KESIMPULAN DAN SARAN
Kesimpulan
1. Hasil uji fitokimia ekstrak kulit buah manggis (Garcinia mangostana) dengan
pelarut metanol, etil asetan dan n-heksana mengandung senyawa
fenolik/flavonoid/tanin, terpen/steroid dan alkaloid.
2. Ekstrak kulit buah manggis mampu menghambat pertumbuhan bakteri A.
hydrophila, E.tarda dan jamur Saprolegnia sp. dan ekstrak kulit buah manggis
dengan pelarut etil asetat merupakan pelarut yang paling efektif.
3. Ekstrak kulit buah manggis bersifat toksik terhadap A. salina L dengan LC50
114,384 ppm pada ekstrak n-heksana, 372,524 pada ekstrak metanol dan
431,811 ppm pada ekstrak n-heksana.
Saran
Sebaiknya dilakukan pengujian lebih lanjut secara In vivo terhadap ekstrak
etil asetat kulit buah manggis (Garcinia mangostana) karena merupakan ekstrak
yang paling aktif dalam menghambat bakteri A. hydrophila, E. tarda dan jamur
Saprolegnia sp. dengan langsung menguji terhadap ikan yang terserang bakteri
dan jamur agar dapat lebih mengetahui ekstrak kulit buah manggis dapat dijadikan