Lampiran 1. Proses Pembuatan Ekstrak Daun Sambiloto
Gambar 1. a) Daun sambiloto yang telah kering, b) Simplisia daun sambiloto yang telah di belender, c) Perendaman simplisia selama 48 jam, d) Penyaringan setelah maserasi dan e) Pemekatan ekstrak dengan water bath.
a
b
c
d
Lampiran 2. Data Awal Zona Hambat Ekstrak Daun Sambiloto a. Aeromonas hydrophila
Pelarut
Konsentrasi
Ulangan
∑ Rata-rata (mm) U1 U2 U3
Metanol
DMSO 0 0 0
10 6,15 6,21 6,12 18,48 6,16
30 7,10 7,05 7,15 21,3 7,10
40 7,45 7,20 7,18 21,81 7,27
60 7,51 7,33 7,25 22,08 7,36
Chloroamphenicol 31,06 31,06 31,06
Etil asetat
DMSO 0 0 0
10 9,06 9,15 9,12 27,33 9,11
30 10,12 9,20 9,15 28,47 9,49 40 10,21 10,15 9,25 29,61 9,87 60 11,06 11,15 10,15 32,34 10,78
Chloroamphenicol 31,06 31,06 31,06
n-heksana
DMSO 0 0 0
10 6,06 7,05 6,25 19,35 6,45
30 6,25 7,15 8,05 21,45 7,15
40 7,15 7,40 8,15 22,68 7,56
60 8,06 8,40 8,35 24,81 8,27
Chloroamphenicol 31,06 31,06 31,06
b. Edwardsiella tarda
Pelarut Konsentrasi
Ulangan
∑ Rata-rata (mm) U1 U2 U3
Metanol
DMSO 0 0 0
10 8,15 8,05 8,05 24,24 8,08
30 8,35 8,25 8,20 24,78 8,26
40 8,40 8,27 8,25 24,90 8,30
60 8,55 8,35 8,40 25,29 8,43
Chloramphenicol 25,15 25,15 25,15
Etil asetat
DMSO 0 0 0
10 6,05 6,15 6,10 18,30 6,10
30 6,10 6,05 7,10 19,23 6,41
40 8,10 7,10 7,25 22,44 7,48
60 8,25 11,10 9,15 28,50 9,50
Chloramphenicol 25,15 25,15 25,15
n-heksana
DMSO 0 0 0
10 7,15 7,10 8,05 22,29 7,43
30 8,05 7,25 8,20 23,49 7,83
40 8,15 9,10 8,35 25,59 8,53
60 8,55 9,35 8,55 26,43 8,81
c. Saprolegnia sp.
Pelarut Konsentrasi
Ulangan
∑ Rata-rata (mm) U1 U2 U3
Metanol
DMSO 0 0 0
10 0 0 0 0 0
30 0 0 0 0 0
40 0 0 0 0 0
60 0 0 0 0 0
Nistatin 9,95 9,95 9,95
Etil asetat
DMSO 0 0 0
10 0 0 0 0 0
30 0 0 0 0 0
40 0 0 0 0 0
60 0 0 0 0 0
Nistatin 9,95 9,95 9,95
n-heksana
DMSO 0 0 0
10 0 0 0 0 0
30 0 0 0 0 0
40 0 0 0 0 0
60 0 0 0 0 0
Lampiran 3. Alat Dan Bahan Yang Digunakan
a
b
c
dLampiran 3. Lanjutan
Gambar 2. a) Bunsen, b) Larutan DMSO, c) Water bath, d) H2SO4 dan BaCl2, e) Hot plate, f) Spray, g) Timbangan, h) Pipet mikro, i) Inkubator, j) Kertas saring, k) Laminar air flow, l) Reagen Vp A, Vp B, Reagen MR dan Reagen Indol.
g h
i j
Lampiran 4. Analisis Bakteri Edwardsiella tarda
Gambar 3. Analisis Bakteri Edwardsiella tarda, a) MR positif dan VP negatif, b) Positif Citrat dan c) O/F positif Fermentatif
a b
Lampiran 5. Analisis Bakteri Aeromonas hydrophilla
Gambar 4. Analisis Bakteri Aeromonas hydrophilla, a) Positif Manitol dan Sorbitol, b) O/F positif Oksidatif dan Fermentatif dan c) Negatif Citrat
a b
Lampiran 6.Pengujian Antimikroba
Pengujian Antibakteri Terhadap Bakteri Aeromonas hydrophilla Terhadap Pelarut a) Etil asetat, b) n-Heksana dan c) Metanol Heksana (Kontrol positif
Kloroamfenikol dan kontrol negatif DMSO)
a b
c
Lampiran 6. Lanjutan
Pengujian Antibakteri Terhadap Bakteri Edwardsiella tarda Terhadap Pelarut a) Metanol, b) Etil asetat dan c) n-Heksana (Kontrol positif
Kloroamfenikol dan kontrol negatif DMSO)
Pengujian Antijamur Terhadap Jamur Saprolegnia sp. Terhadap Pelarut a) Metanol, b) n-Heksana dan c) Etil asetat (Kontrol positif Nistatin dan
kontrol negatif DMSO) c
n-heksana
a b
Lampiran 7. Data Awal Kematian A. salina Pada Berbagai Konsentrasi Perlakuan Ulangan
U1 U2 U3 Rata-rata
Kontrol Air Laut 1 0 0 0,33
Kontrol DMSO 1 1 2 1,33
Metanol
10 ppm 2 3 3 2,66
100 ppm 5 7 4 5,33
1000 ppm 8 9 9 8,66
Etil Asetat
10 ppm 2 3 3 2,33
100 ppm 4 4 5 4,33
1000 ppm 7 9 8 8
n-Heksana
10 ppm 3 2 2 2,33
100 ppm 4 6 6 5,33
Lmpiran 8. Contoh Perhitungan Penentuan LC50 a. Ekstrak Daun Sambiloto dengan Pelarut Metanol
Pelarut Konsentrasi (ppm)
Total Populasi
Jumlah Kematian
Persen Mortalitas
Log Konsentrasi
Probit LC (ppm)
50
Metanol
10 30 8 26 1 4,36
64.5
100 30 16 53 2 5,08
1000 30 27 86 3 6,08
Pada ekstrak dengan konsentrasi 100 ppm. Persen mortalitas =
=
=
53%Kurva hubungan log konsentrasi dengan nilai probit ekstrak Metanol
Dari grafik hubungan antara log konsentrasi (sumbu x) dengan nilai probit (sumbu y) didapatkan persamaan y = 0,86x + 3,4433 dan R2 = 0,9871. Penentuan LC50 (Konsentrasi yang dapat menyebabkan kematian sebesar 50%), maka nilai probit dengan y = 5 dan x = log konsentrasi adalah sebagai berikut :
X 100%
Lampiran 8. Lanjutan y = 0,86x + 3,4533 5 = 0,86x + 3,4533 x = (5 - 3,4533) / 0,86 x = 1,798488
maka LC50 LC
adalah anti log dari nilai x anti log 1,798488 50
b. Ekstrak Daun Sambiloto dengan Pelarut Etil Asetat = 64.5 ppm.
Pelarut Konsentrasi (ppm) Total Populasi Jumlah Kematian Persen Mortalitas Log Konsentrasi
Probit LC (ppm)
50 Etil
Asetat
10 30 8 26 1 4,36
100
100 30 13 43 2 4,80
1000 30 24 80 3 5,84
Pada ekstrak dengan konsentrasi 100 ppm. Persen mortalitas =
=
=
43%Kurva hubungan log konsentrasi dengan nilai probit ekstrak Etil Asetat X 100%
Lampiran 8. Lanjutan
Dari grafik hubungan antara log konsentrasi (sumbu x) dengan nilai probit (sumbu y) didapatkan persamaan y = 0,74x + 3,52 dan R2 = 0,9481. Penentuan LC50
y = 0,74x + 3,52
(Konsentrasi yang dapat menyebabkan kematian sebesar 50%), maka nilai probit dengan y = 5 dan x = log konsentrasi adalah sebagai berikut :
5 = 0,74x + 3,52 x = (5 – 3,52) / 0,74 x = 2
maka LC50 LC
adalah anti log dari nilai x anti log 2 50
c. Ekstrak Daun Sambiloto dengan Pelarut n-Heksana = 100 ppm.
Pelarut Konsentrasi (ppm) Total Populasi Jumlah Kematian Persen Mortalitas Log Konsentrasi
Probit LC (ppm)
50
n-heksana
10 30 7 23 1 4,26
118,6
100 30 16 53 2 5,08
1000 30 21 70 3 5,52
Pada ekstrak dengan konsentrasi 100 ppm. Persen mortalitas =
=
=
53%X 100%
Kurva hubungan log konsentrasi dengan nilai probit ekstrak n-heksana
Dari grafik hubungan antara log konsentrasi (sumbu x) dengan nilai probit (sumbu y) didapatkan persamaan y = 0,63x + 3,6933 dan R2 = 0,9706. Penentuan LC50
y = 0,63x + 3,6933
(Konsentrasi yang dapat menyebabkan kematian sebesar 50%), maka nilai probit dengan y = 5 dan x = log konsentrasi adalah sebagai berikut :
5 = 0,63x + 3,6933 x = (5 – 3,6933) / 0,63 x = 2,0741269
maka LC50 LC
Lampiran 9. Hasil Uji Antijamur Saprolegnia sp.
Hasil pengujian antijamur Saprolegnia sp. terhadap a) ekstrak methanol, b) ekstrak etil asetat dan c) ekstrak n-Heksana
a
b
Lampiran 10. Hasil pengujian antibakteri
Hasil pengujian antibakteri a) Aeromonas hydrophila (kiri), Edwardsiella tarda (kanan) dan b) kontrol positif Chloramphenicol (Kiri) dan kontrol
negatif DMSO (Kanan)
a
Lampiran 11. Uji BSLT Menggunakan Artemia salina
Pengujian BSLT Artemia salina a) Kista A. salina (kiri), Wadah penetasan (kanan), b) Pengukuran air 5 ml (kiri), Pemasukan A. salina (kanan) dan
c) Setelah pengamatan selama 24 jam
a
b
Lampiran 12. Tabel Probit Menurut Vilchez dkk (2001)
Persentase Probit
0 1 2 3 4 5 6 7 8 9
0 - 2,67 2,95 3,12 3,25 3,36 3,45 3,52 3,59 3,66 10 3,72 3,77 3,82 3,87 3,92 3,96 4,01 4,05 4,08 4,12 20 4,16 4,19 4,23 4,26 4,29 4,33 4,36 4,39 4,44 4,45 30 4,48 4,50 4,53 4,56 4,59 4,61 4,64 4,67 4,69 4,72 40 4,75 4,77 4,80 4,82 4,85 4,87 4,90 4,92 4,95 4,97 50 5,00 5,03 5,05 5,08 5,10 5,13 5,15 5,18 5,20 5,23 60 5,25 5,28 5,31 5,33 5,36 5,39 5,41 5,44 5,47 5,50 70 5,52 5,55 5,58 5,61 5,64 5,67 5,71 5,74 5,77 5,81 80 5,84 5,88 5,92 5,95 5,99 6,04 6,08 6,13 6,18 6,23 90 6,28 6,34 6,41 6,48 6,55 6,64 6,75 6,88 7,05 7,33 99 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
DAFTAR PUSTAKA
Achmadi, S. 1992. Kimia Kayu. Institut Pertanian Bogor, Bogor.
Andrews J. M. 2008. BSAC Standardized Disc Susceptibility Testing Method (version 7). Journal of Antimicrobial Chemotherapy. 62: 256 – 278. Andriyanto S, Hririah, Y. Yulianti, S.H.I. Purnomo, S.T Astuti, Nurlaila, T.
Samudro dan B.P. Priosoeryanto. 2009. Deteksi Edwarsiella tarda Secara Imunohistokimia Pada Ikan Patin (Pangasius pangasius). Majalah Ilmu Kehewanan Indonesia. 1(1) : 1-6.
Asniatih., M. Idris dan K. Sabilu. 2013. Studi Histopatologi Pada Ikan Lele Dumbo (Clarias gariepinus) yang Terinfeksi Bakteri Aeromonas hydrophila. Jurnal Mina Laut Indonesia.3(12) : 13-21.
Assidqi A., W. Tjahjaningsih dan S. Sigit. 2012. Potensi Ekstrak Daun Patikan Kebo (Euphorbia Hirta) Sebagai Antibakteri Terhadap Aeromonas hydrophila Secara In Vitro. Journal of Marine and Coastal Science. 1(2) :113 – 124.
Cahyadi, R. 2009. Uji Toksisitas Akut Ekstrak Etanol Buah Pare (Momordica charantia L) Terhadap larva Artemia salina Leach Dengan Metode Brine Shrimp Lethality Test (BST). Laporan Akhir Penelitian Karya Tulis Ilmiah. Fakultas Kedokteran. Universitas Dipenogoro. Semarang.
Edeoga, H.O, D.E. Okwu, B.O. Mbaebie. 2005. Phytochemical Constituents of Some Nigerian Medicinal Plants. African Journal of Biotechnology. 4 (7) : 685- 688.
Fatimah S., B dan M. Handarto. 2008. Pengaruh Komposisi Media Tanam Terhadap Pertumbuhan dan Hasil Tanaman Sambiloto (Andrographis paniculata). Jurnal EMBRYO. 5(2) : 34-37.
Fessenden R.J dan J.S. Fessenden. 1997. Kimia Organik. Penerbit Airlangga, Jakarta.
Harborne, J. B. 1987. Metode Fitokimia. Penuntun Cara Modern Menganalisis Tumbuhan. Terjemahan K. Padmawinata & I. Soediro, Penerbit ITB, Bandung.
(Oreochromis niloticus) di Loa Kulu Kutai Kartanegara Kalimantan Timur. Jurnal Kedokteran Hewan. 8(2) : 86-92.
Haryani A., R. Grandiosa, I. D. Buwono dan A. Santika. 2012. Uji Efektivitas Daun Pepaya (Carica papaya) Untuk Pengobatan Infeksi Bakteri Aeromonas hydrophila Pada Ikan Mas Koki (Carassius auratus). Jurnal Perikanan dan Kelautan. 3(3) : 213-220.
Ketaren, S. 1986. Pengantar Teknologi Minyak dan Lemak Pangan. UI Press, Jakarta.
Kordi, G. H. 2004. Penanggulangan Hama dan Penyakit Ikan. Rineka Cipta, Jakarta.
Krisnata, B.A., Y. Rizka dan D. Mulawarmanti. 2014. Daya Hambat Ekstrak Daun Mangrove (Avicennia marina) Terhadap Pertumbuhan Bakteri Mixed periodontopatogen. Jurnal Kedokteran Gigi. 8(1) : 22-25.
Lingga M.N., I. Rustikawati dan I.D. Buwono. 2012. Efektivitas Ekstrak Bunga Kecombrang (Nicolaia speciosa Horan) Untuk Pencegahan Serangan Saprolegnia sp. Pada Lele Sangkuriang. Jurnal Perikanan dan Kelautan. Fakultas Perikanan dan Ilmu Kelautan Unpad. 3(4) : 75 – 80.
Lukistyowati I. 2012. Studi Efektifitas Sambiloto (Andrographis paniculata) Untuk Mencegah Penyakit Edwardsiellosis Pada Ikan Patin (Pangasius hypopthalmus). Jurnal Berkala Perikanan Terubuk. 40(2) : 56-74.
Meilani, S. W. 2006. Uji Bioaktivitas Zat Ekstraktif Kayu Suren (Toona sureni Merr) dan Ki Bonteng (Platea latifolia BL.) Menggunakan Brine Shrimp Lethality Test (BSLT). Departemen Hasil Hutan, Fakultas Kehutanan. Institut Pertanian Bogor, Bogor.
Meyer, B.N., N.R. Ferrigni., J.E. Putman., L.B. Jacobsen., D.E. Nichols dan J.L. McLauglin. 1982. Brine Shrimp : A convenient general bioassay for active plant constituents. Planta Med. 45 : 34 – 35.
Narwiyani S. 2010. Lethal Concentration 50% (LC-50) Empat Isolat Edwardsiella tarda pada Ikan Air Tawar di Indonesia. Jurnal Sain. Balai Besar Karantina Ikan, Hasanuddin, Makassar. 28(2) : 35-37.
Nuraini A.D. 2007. Ekstraksi Komponen Antibakteri dan Antioksidan dari Biji Teratai (Nymphaea pubescens L). [Skripsi]. Departemen Ilmu dan Teknologi Pangan. Institut Pertanian Bogor, Bogor.
Pujiasmanto B., J. Moenandir, Syamsulbahri, Kuswanto. 2007. Kajian Agroekologi dan Morfologi Sambiloto (Andrographis paniculata) pada Berbagai Habitat. Jurnal Biodiversitas. 8(4) : 326-329.
Pratiwi S.T. 2008. Mikrobiologi Farmasi. Penerbit Erlangga. Jakarta.
Purba S.P., S.H. Bhuyan., F. Khatun., M.S. Liza., M. Matin dan Md. F. Hossain. 2013. Assessment of Cytotoxic Activity of Two Medicinal Plants Using Brine Shrimp (Artemia salina) as an Experimental Tool. International Journal of Pharmaceutical Sciences and Research. 4(3) : 1125 – 1130. Purwanto, N., E. Rismawati dan E.R. Sadiyah. 2015. Uji Sitotoksik Ekstrak Biji
Salak ( Salacca Zalacca (Gaert) Voss) dengan Menggunakan Metode Brine Shrimp Lethality Test (BSLT). Prosiding Penelitian Spesia Unisba. ISSN 2460-6472.
Ratnawati A., U. Purwaningsih dan Kurniasih. 2013. Histopatologis Dugaan Edwardsiella tarda sebagai Penyebab Kematian Ikan Maskoki (Crassius auratus): Postulat Koch. Jurnal Sain Veteriner. Balai Penelitian dan Pengembangan Budidaya Air Tawar, Bogor. 31(1) : 25-29.
Royani, J.I., D. Hardianto dan S. Wahyuni. 2014. Analisa Kandungan Andrographolide Pada Tanaman Sambiloto (Andrographis Paniculata) Dari 12 Lokasi Di Pulau Jawa. Jurnal Bioteknologi dan Biosains Indonesia. 1(1). ISSN 2442-2606.
Sawitti M.Y., H. Mahatmi dan I. N. K. Besung. 2013. Daya Hambat Perasan Daun Sambiloto Terhadap Pertumbuhan Bakteri Escherichia coli. Jurnal Medicus Veterinus. 2(2) : 142-150.
Siswandono dan B. Soekardjo. 1995. Kimia Medisial. Penerbit Airlangga University Press, Surabaya.
Suryanto D., N. Irawati dan E. Munir. 2011. Isolation and Characterization of Chitinolytic Bacteria and Their Potential to Inhibit Plant Pathogenic Fungi. Microbiology Indonesia. 5(3): 144 – 148.
Wahjuningrum D., M.N. Ikhsan., Sukenda dan Y. Evan. 2014. Penggunaan Ekstrak Kunyit Sebagai Pengendali Infeksi Bakteri Edwardsiella tarda Pada Ikan Lele. Jurnal Akuakultur Indonesia. 13(1) : 1 – 10.
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian telah dilaksanakan dari bulan Agustus – Oktober 2015. Ekstraksi dan uji fitokimia daun sambiloto dan uji aktivitas antibakteri di Balai Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Medan II. Uji Brine Shrimp Lethality Test (BSLT) di Unit Pelayanan Teknis Daerah (UPTD) Balai Benih Ikan (BBI), Kecamatan Medan Tuntungan, kota Medan.
Alat dan Bahan Penelitian
Alat yang digunakan dalam penelitian ini adalah pisau, timbangan analitik, stoples kaca, gelas ukur, corong, blender, labu Erlenmeyer, vortex, aluminium foil, rotary evaporator, spatula, cawan petri, karet gelang, pipet tetes, tabung reaksi, rak tabung reaksi, hot plate, ayakan, Beaker glass, cotton bud, Autoclave, laminar air flow, refrigerator/lemari es, sprayer, api bunsen, jarum ose, pinset,
magnetic stirrer, tisu, kapas, kertas cakram, mikropipet, jangka sorong, inkubator,
waterbath (penangas air), botol vial sebagai wadah Artemia salina dalam uji
BSLT, kamera digital dan alat tulis yang dapat dilihat pada Lampiran 3.
sulfoxide (DMSO), Potato Dextrose Agar (PDA), Tryptic Soy Agar (TSA), kloramfenikol, nistatin, larutan Mc. Farland 0.5, larutan NaCl 0,9 %.
Prosedur Penelitian
a. Ekstraksi Daun Sambiloto
Daun Sambiloto yang sudah dikumpulkan terlebih dahulu ditimbang beratnya. Pada penelitian ini digunakan daun sambiloto yang utuh dengan berat 3,5 Kg. Daun sambiloto yang diambil mulai dari pucuk hingga 2 helai di bawah pucuk daun sambiloto. Daun sambiloto yang sudah dikumpulkan terlebih dahulu dicuci sampai bersih. Daun sambiloto dipotong kecil-kecil kira-kira lebarnya 1 cm dan diiris setipis mungkin, hal ini dimaksudkan untuk mempercepat proses pengeringan daun sambiloto. Proses pengolahan bahan alamiah yang dipergunakan sebagai obat dengan melalui cara pengeringan disebut simplisia.
Daun sambiloto yang sudah terpotong-potong kemudian dikeringkan dengan cara diangin-anginkan. Proses selanjutnya menghaluskan daun sambiloto yang telah kering dengan menggunakan blender dan diperoeh serbuk halus seberat 1,2 Kg yang dapat dilihat pada Lampiran 1.
b. Pembuatan Pelarut Ekstrak daun Sambiloto
air (water bath) agar seluruh pelarutnya habis menguap. Ekstrak tersebut kemudian disimpan di dalam beaker glass yang ditutup dengan alumunium foil.
Uji Fitokimia
Analisis fitokimia dilakukan berdasarkan Harborne (1987) :
a. Identifikasi alkaloid
Sampel dicampur dengan 5 ml kloroform dan 5 ml amoniak kemudian dipanaskan, dikocok dan disaring. Ditambahkan 5 tetes asam sulfat 2 N pada masing-masing filtrat, kemudian kocok dan didiamkan. Bagian atas dari masingmasing filtrat diambil dan diuji dengan pereaksi Meyer, Wagner, dan Dragendorf. Terbentuknya endapan jingga, cokelat, dan putih menunjukkan adanya alkaloid.
a. Identifikasi Flavonoid
Sampel dicampur dengan 5 ml etanol, dikocok, dipanaskan, dan dikocok lagi kemudian disaring. Kemudian ditambahkan Mg 0,2 g dan 3 tetes HCl pada masingmasing filtrat. Terbentuknya warna merah pada lapisan etanol menunjukkan adanya flavonoid.
b. Identifikasi Saponin
c. Identifikasi Steroid
Sampel diekstrak dengan etanol dan ditambah 2 ml asam sulfat pekat dan 2 ml asam asetat anhidrat. Perubahan warna dari ungu ke biru atau hijau menunjukkan adanya steroid..
d. Identifikasi Triterpenoid
Sampel dicampur dengan 2 ml kloroform dan 3 ml asam sulfat pekat. Terbentuknya warna merah kecoklatan pada antar permukaan menunjukkan adanya triterpenoid.
e. Identifikasi Tanin
Sampel didihkan dengan 20 ml air lalu disaring. Setelah itu ditambahkan beberapa tetes feriklorida 1% dan terbentuknya warna coklat kehijauan atau biru kehitaman menunjukkan adanya tanin.
Uji Aktivitas Antibakteri dan Antifungi
Bakteri A. hydropila dan E. tarda diremajakan masing-masing dengan cara menggoreskan jarum ose yang mengandung bakteri A. hydropila pada 1 cawan petri yang berisi media TSA dan E. tarda pada petri yang lainnya secara aseptis. Setelah itu dinkubasi selama 24 – 48 jam pada suhu 37oC. Untuk peremajaan jamur Saprolegnia sp. dilakukan dengan mengambil potongan kecil miselium menggunakan blade dan menanamnya secara aseptis pada media PDA. Setelah itu diinkubasi pada suhu 27o
Bakteri yang telah diremajakan diambil biakannya menggunakan jarum ose dan disuspensikan ke dalam tabung reaksi berisi 3 ml larutan NaCl 0,9%. Suspensi yang terbentuk disetarakan dengan larutan baku Mc. Farland 0.5 yang
ekuivalen dengan suspensi sel bakteri dengan konsentrasi 1,5 × 108
Konsentrasi larutan uji yang digunakan adalah 10%, 30%, 40% dan 60 (b/v). Konsentrasi 60% dibuat dengan cara menimbang ekstrak daun Sambiloto sebanyak 0,6 g yang dilarutkan dengan 1 ml DMSO. Larutan dengan konsentrasi 10% dan 30%, 40% dibuat dengan cara pengenceran dari konsentrasi 60% menggunakan 0,5 ml DMSO. Kontrol negatif digunakan DMSO dan kontrol
positif digunakan kloramfenikol (30 μg/ml) untuk bakteri dan nistatin (100 μg/ml)
untuk jamur.
cfu/ml (Andrews, 2008).
Pengujian antibakteri dilakukan dengan metode disc diffusion (tes Kirby-Bauer). Cutton bud steril dimasukkan ke dalam tabung reaksi yang berisi suspensi bakteri kemudian dioleskan pada media TSA. Setelah olesan bakteri mengering, kertas cakram (diameter 6 mm) yang telah direndam ekstrak selama 1 jam pada berbagai konsentrasi ditiriskan dan diletakkan di atas media yang berisi olesan bakteri dengan sedikit ditekan agar cakram menempel pada permukaan media (Gambar 2). Selanjutnya diinkubasi pada suhu 37o
Uji terhadap Saprolegnia sp. dilakukan dengan cara mengambil potongan kecil miselium dengan bentuk kubus dan menanamkannya di media PDA dengan posisi di tengah. Kertas cakram yang telah berisi ekstrak dengan berbagai konsentrasi diletakkan di sekitar potongan jamur tersebut dengan jarak yang sama (Gambar 3). Setelah itu diinkubasi pada suhu 27
C selama 24 – 48 jam.
o
Pengukuran Zona Hambat
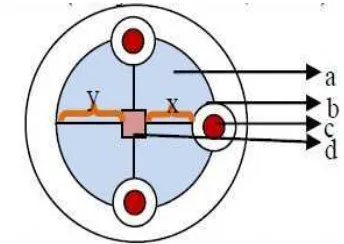
Menurut Pratiwi (2008), aktivitas antibakteri di nyatakan positif apabila terbentuk zona hambat berupa zona bening di sekeliling kertas cakram. Diameter zona hambat dideskripsikan dengan Gambar 2 di bawah ini:
Gambar 2. Perhitungan diameter zona hambat antibakteri.; a = Diameter kertas cakram (6 mm) b = Diameter zona hambat yang terbentuk (mm) c = Daerah yang ditumbuhi bakteri (Pratiwi, 2008).
Aktivitas antifungi ditentukan dengan rumus uji antagonis yaitu dengan mengukur jari-jari pertumbuhan hifa normal di kurang dengan jari-jari pertumbuhan hifa yang terhambat oleh ekstrak (Suryanto dkk., 2011).
Uji Toksisitas Ekstrak dengan Metode Brine Shrimp Lethality Test (BSLT) Kista Artemia salina ditetaskan di dalam bejana yang sudah diisi 3 liter air laut buatan bersalinitas 35 ppt. Bejana dilengkapi dengan alat aerasi dan kista dibiarkan menetas pada suhu 25o
Pada setiap konsentrasi uji ditambahkan air laut ± 2 ml kemudian masukkan 10 ekor A. salina ke dalam setiap vial dan cukupkan volumenya sampai 5 ml dengan air laut. Masing-masing konsentrasi uji dibuat 3 ulangan termasuk kontrol positif (DMSO) dan kontrol negatif (air laut). Setelah 24 jam dilakukan pengamatan terhadap kematian A. salina.
C, setelah 48 jam hewan uji siap untuk digunakan. Larutan induk dibuat dengan melarutkan 20 mg sampel dalam 2 ml DMSO. Larutan uji 1000 ppm dibuat dengan memipet larutan induk sebanyak 500
μl, sedangkan larutan uji 100 ppm dan 10 ppm dibuat dengan memipet 50 μl dan 5
μl dari larutan induk.
Analisis Data
HASIL DAN PEMBAHASAN
Hasil
Uji Fitokimia Ekstrak Daun Sambiloto
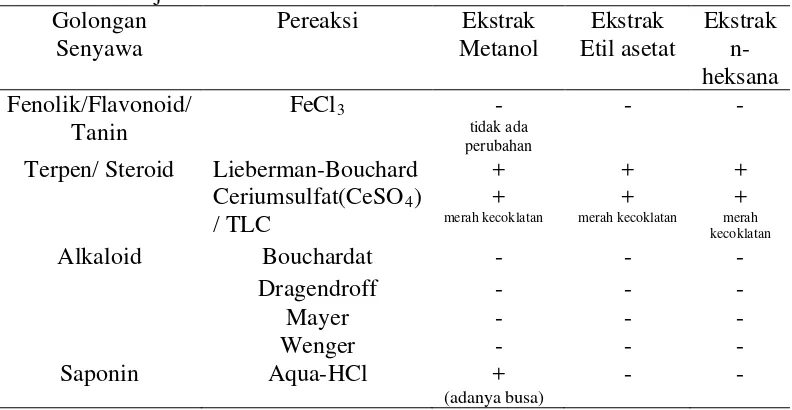
Dari hasil pengujian fitokimia ekstrak daun sambiloto dengan menggunakan pelarut metanol, etil asetat dan n-heksana memperlihatkan bahwa hanya sebagian dari ekstrak daun sambiloto mengandung senyawa metabolit sekunder seperti terpen/steroid dan saponin. Hasil pengujian fitokimia ekstrak daun sambiloto dengan masing-masing pelarut dapat dilihat pada Tabel 1.
Tabel 1. Hasil Uji Fitokimia Ekstrak Daun Sambiloto Golongan
Senyawa
Pereaksi Ekstrak Metanol Ekstrak Etil asetat Ekstrak n-heksana Fenolik/Flavonoid/ Tanin
FeCl3 -
tidak ada perubahan
- -
Terpen/ Steroid Lieberman-Bouchard Ceriumsulfat(CeSO4 / TLC ) + + merah kecoklatan + + merah kecoklatan + + merah kecoklatan
Alkaloid Bouchardat - - -
Dragendroff - - -
Mayer - - -
Wenger - - -
Saponin Aqua-HCl +
(adanya busa)
- -
Uji Biokimia Bakteri Edwardsiella tarda dan Aeromonas hydrophila
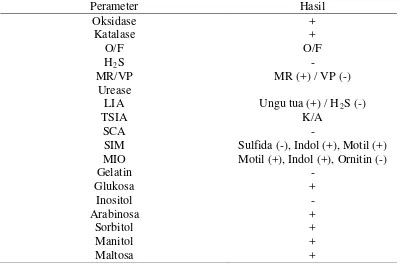
Berdasarkan pada uji biokima yang telah dilakukan dengan menggunakan beberapa parameter, diketahui bahwa bakteri yang diidentifikasi adalah bakteri Edwardsiella tarda dan Aeromonas hydrophia. Hasil uji biokimia bakteri E. tarda
Tabel 3. Hasil uji biokimia bakteri Edwardsiella tarda
Parameter Hasil
Oksidase -
Katalase +
O/F F
H2S +
MR/VP MR (+) / VP (-)
Urease -
LIA -
TSIA H2
SCA
S, Gas, K/A +
SIM S (+) I (+) M (+)
MIO Motil (+) Indol (+) Ornitin (+)
Gelatin -
Glukosa -
Inositol -
Arabinosa +
Sorbitol +
Manitol +
Maltosa +
Keterangan :
O/F : Oksidasi/Fermentasi SCA : Simons Citrate Agar TSIA : Triple Sugar Iron Agar LIA : Lysin Iron Agar SIM : Sulfida Indol Motility
MIO : Motilitas Indol Ornitin
Tabel 4. Hasil uji biokimia bakteri Aeromonas hydrophila
Perameter Hasil
Oksidase +
Katalase +
O/F O/F
H2S -
MR/VP MR (+) / VP (-)
Urease
LIA Ungu tua (+) / H2
TSIA
S (-) K/A
SCA -
SIM Sulfida (-), Indol (+), Motil (+) MIO Motil (+), Indol (+), Ornitin (-)
Gelatin -
Glukosa +
Inositol -
Arabinosa +
Sorbitol +
Manitol +
[image:30.595.113.513.460.724.2]Pengamatan Slide Culture Jamur Saprolegnia sp.
Berdasarkan pengamatan slide culture yang telah dilakukan dengan menggunakan media PDA dan jamur yang telah diremajakan, diketahui bahwa jamur yang diidentifikasi adalah jamur Saprolegnia sp. (Kordi, 2004). Hasil dari pengamatan slide culture jamur Saprolegnia sp. dapat dilihat pada Gambar 4 di bawah.
[image:31.595.120.510.251.408.2]
(a) (b)
Gambar 5. Hasil pengamatan slide culture jamur Saprolegnia sp. a) pertumbuhan jamur yang berumur 3 hari dan b) pertumbuhan jamur yang berumur 6 hari ditandai dengan membentuknya sporangium.
Uji Aktivitas Antimikroba Daun Sambiloto
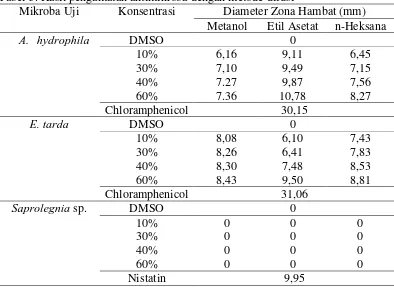
Tabel 5. Hasil pengamatan antimikroba dengan metode difusi
Mikroba Uji Konsentrasi Diameter Zona Hambat (mm) Metanol Etil Asetat n-Heksana
A. hydrophila DMSO 0
10% 6,16 9,11 6,45
30% 7,10 9,49 7,15
40% 7.27 9,87 7,56
60% 7.36 10,78 8,27
Chloramphenicol 30,15
E. tarda DMSO 0
10% 8,08 6,10 7,43
30% 8,26 6,41 7,83
40% 8,30 7,48 8,53
60% 8,43 9,50 8,81
Chloramphenicol 31,06
Saprolegnia sp. DMSO 0
10% 0 0 0
30% 0 0 0
40% 0 0 0
60% 0 0 0
Nistatin 9,95
Uji Toksisitas Daun Sambiloto
Dari hasil pengujian ekstrak daun sambiloto terhadap A. salina memperlihatkan tingginya jumlah kematian pada kisaran LC50
Tabel 6. Hasil uji toksisitas ekstrak daun sambiloto dengan metode Brine Shrimp Lethality (BSLT)
antara 100 – 1000 ppm. Hasil uji toksisitas berdasarkan konsentrasi ekstrak daun sambiloto dengan masing-masing pelarut dapat dilihat pada Tabel 6.
Pelarut Konsentrasi (ppm) Total Populasi (ekor) Jumlah Kematian (ekor) LC (ppm) 50 Metanol
10 30 8
64,5
100 30 16
1000 30 26
Etil asetat
10 30 8
100
100 30 13
1000 30 24
n-heksana
10 30 7
118,6
100 30 16
[image:32.595.116.511.571.738.2]Pembahasan
Ekstraksi Daun Sambiloto
Ekstraksi daun sambiloto dilakukan dengan menggunakan tiga pelarut, yaitu metanol, etil asetat dan n-heksana (Lampiran 1). Hasil ekstraksi daun sambiloto dengan menggunakan pelarut metanol diperoleh pekat sebanyak 20 gram dengan warna hijau tua, pelarut etil asetat menghasilkan ekstrak pekat sebanyak 20 gram dengan warna hitam dan pelarut n-heksana menghasilkan ekstrak pekat sebanyak 10 gram dengan warna hijau kecokelatan. Achmadi (1992) ekstraksi adalah peristiwa pemindahan zat terlarut (solute) antara dua pelarut yang tidak saling bercampur dengan tujuan untuk memperoleh ekstrak yang murni.
Untuk mengetahui senyawa fitokimia yang terkandung dalam daun sambiloto ini dilakukan dengan menggunakan tiga pelarut yang sifat kepolarannya berbeda. Hal tersebut dilakukan karena setiap pelarut dengan sifat kepolarannya masing-masing akan melarutkan atau menarik komponen-komponen yang berbeda termasuk komponen aktif yang berfungsi sebagai antimikroba maupun antifungi. Dari penelitian yang telah dilakukan didapatkan hasil ekstraksi yang paling banyak dihasilkan oleh pelarut metanol yang bersifat polar dan etil asetat yang bersifat semi polar. Kataren (1986) meyatakan jenis dan mutu pelarut yang digunakan menentukan keberhasilan proses ekstraksi.
Uji Fitokimia Daun Sambiloto
ditambahkan dengan pereaksi CeSO4
Uji fitokimia terhadap senyawa saponin dengan menggunakan pereaksi Aqua/HCl menunjukkan terbentuknya busa pada permukaan pelarut metanol sebanyak 5 ml yang kemudian di aduk di dalam tabung reaksi. Hal ini menunjukkan bahwa ekstrak daun sambiloto mengandung saponin.
1%. Hasil positif terdapat pada ketiga ekstrak yang ditandai dengan perubahan ekstrak menjadi merah menyerupai warna standar β-sitosterol dan triterpenoida.
Krisnata dkk (2014) mengatakan Flavonoid merupakan senyawa polar yang umumnya mudah larut dalam pelarut polar seperti etanol, methanol, butanol dan aseton. Flavonoid merupakan golongan terbesar dari senyawa fenol, senyawa fenol mempunyai sifat efektif menghambat pertumbuhan virus, bakteri dan jamur. Mekanisme kerja flavonoid dalam menghambat pertumbuhan bakteri adalah flavonoid menyebabkan terjadinya kerusakan permeabilitas dinding sel bakteri dan flavonoid mampu menghambat motilitas bakteri.
Terpenoid mempunyai manfaat penting sebagai obat tradisional, antibakteri, dan gangguan kesehatan. Senyawa terpenoid dapat menghambat pertumbuhan dengan mengganggu proses terbentuknya membran dan atau dinding sel, membran atau dinding sel tidak terbentuk atau terbentuk tidak sempurna. Karena mekanisme itulah terpenoid lebih bersifat bakteriostatik.
Saponin merupakan glukosida yang larut dalam air dan etanol, tetapi tidak larut dalam eter. Saponin bekerja sebagai antibakteri dengan mengganggu stabilitas membran sel bakteri sehingga menyebabkan sel bakterilisis, jadi mekanisme kerja saponin termasuk dalam kelompok antibakteri yang mengganggu permeabilitas membran sel bakteri, yang mengakibatkan kerusakan membran sel dan menyebabkan keluarnya berbagai komponen penting dalam sel bakteri yaitu protein, asam nukleat dan nukleotida.
Uji Biokimia Bakteri Edwardsiella tarda dan Aeromonas hydrophila
Uji biokimia merupakan cara atau perlakuan yang dilakukan untuk mengidentifikasi dan mendeterminasi suatu biakan murni bakteri hasil isolasi melalui sifat-sifat fisiologinya. Uji biokimia yang dilakukan menggunakan dua isolasi bakteri, yaitu bakteri Edwardsiella tarda dan Aeromonas hydrophila.
Uji biokimia pada bakteri A. hydrophila (Lampiran 4) dengan menggunakan delapan belas parameter menunjukkan perubahan pada parameter MIO, SIM, Oksidase, Katalase, LIA, MR dan Gula-gula (Glukosa, Arabinosa, Sorbitol, Manitol dan Maltosa). Hasil ini juga sesuai dengan Tantu dkk (2013) dalam penelitiannya menggunakan bakteri A. hydrophila pada ikan nila yang dibudidayakan di Keramba Jaring Apung (KJA).
Tujuan dari dilakukannya uji motilitas adalah untuk mengetahui gerak dari bakteri yang diuji dengan menggunakan media MIO dan SIM. Pada media SIM selain untuk melihat motilitas bisa juga untuk test indol dan pembentukan H2
Uji MR digunakan untuk mengetahui adanya fermentasi asam campuran (metilen glikon). Adanya perubahan warna media menjadi merah setelah ditambahkan methyl red 1% menunjukkan bahwa bakteri menghasilkan asam campuran (metilen glikon) dari proses fermentasi glukosa yang terkandung dalam media MR. Uji VP digunakan untuk mengetahui pembentukan asetil metil karbinol (asetoin) dari hasil fermentasi glukosa.
S. Adanya penyebaran yang berwarna putih seperti akar di sekitar inokulasi, menunjukan adanya pergerakan dari bakteri yang diinokulasikan, yang berarti bahwa bakteri ini memiliki flagel.
berwarna kuning (bersifat asam) dan lereng (slant) berwarna merah (bersifat basa) Al/Ac atau K/A, memfermentasi semua karbohidrat bila pada dasar (butt) media berwarna kuning (bersifat asam) dan lereng (slant) berwarna kuning (bersifat asam) Ac/Ac atau A/A dan tidak memfermentasi semua karbohidrat bila pada dasar (butt) media berwarna merah (bersifat basa) dan lereng (slant) berwarna merah (bersifat basa) Al/Al atau K/K.
Uji gula-gula digunakan untuk mengetahui apakah bakteri memfermentasi masing-masing gula di atas membentuk asam. Tidak terjadi perubahan warna media dari merah menjadi kuning, artinya bakteri tidak memfermentasi gula dan terjadi perubahan warna media dari merah menjadi kuning, artinya kuman memfermentasi gula.
Pengamatan Slide Culture Jamur Saprolegnia sp.
Slide Culture (kultur slide) merupakan teknik yang sangat penting dalam
identifikasi fungi. Slide culture adalah teknik menumbuhkan fungi pada slide dengan perlakuan tertentu. Perlakuan yang di maksud di antaranya adalah fungi ditumbuhkan pada sepotong agar dan diletakkan di atas kaca benda. Tujuan slide culture adalah melihat morfologi mikroskopis fungi, yang terdiri dari bentuk hifa,
sporangium.
sebelumnya. Sporangium yang telah tumbuh ini bentuknya cenderung lonjong yang terdapat pada ujung-ujung hifa (Gambar 4). Sporangium inilah yang kemudian pecah dan menghasilkan spora-spora yang baru yang kemudian tumbuh menyebar memenuhi media PDA pada cawan petri Sehingga setelah dilakukan pengecekan barulah diketahui bahwa jamur yang telah diremajakan adalah jamur Saprolegnia sp.
Uji Aktifitas Antimikroba Daun Sambiloto
Uji aktifitas antimikroba dalam menghambat pertumbuhan bakteri dan jamur ditunjukkan oleh ukuran areal bening yang membentuk lingkaran disekitar kertas cakram yang kemudian dapat dihitung diameter penghambatnya. Terbentuknya area bening disebabkan karena adanya senyawa antimikroba pada ekstrak daun sambiloto sehingga pertumbuhan bakteri dan jamur terhambat.
Hasil uji aktivitas antimikroba terhadap bakteri A. hydrophila, E. tarda dan jamur Saprolegnia sp. menunjukkan bahwa pada kontrol negatif menggunakan DMSO tidak membentuk zona bening atau zona hambat di sekitar kertas cakram pada ketiga mikroba tersebut. Hal ini menunjukkan bahwa palarut DMSO tidak memiliki aktivitas antimikroba.
Pengujian aktivitas antibakteri menggunakan kloramfenikol sebagai kontrol positif dimana hasil pengujiannya menunjukkan adanya zona hambat yaitu sebesar 30,15 mm untuk bakteri A. hydrophila dan sebesar 31,06 mm untuk bakteri E.
tarda (Lampiran 10). Siswandono dan Soekardjo (1995) menyatakan bahwa
50S yang merupakan langkah penting dalam pembentukan ikatan peptida. Kloramfenikol efektif terhadap bakteri aerob gram positif dan beberapa bakteri aerob gram negatif.
Pengujian aktivitas antijamur menggunakan nistatin sebagai kontrol positif dimana hasil pengujian menunjukkan adanya zona hambat pada sekitar cakram yaitu sebesar 9,95 mm untuk jamur Saprolegnia sp. Pelczar dan Chan (2005) menyatakan bahwa cara kerja nistatin adalah merusak sel-sel khamir, juga sel cendawan lain dengan cara bergabung dengan sterol yang terdapat dalam membran sel. Hal ini mengakibatkan kacaunya organisasi di dalam struktur molekuler membran, diikuti dengan gangguan pada fungsinya.
Pengujian aktivitas ekstrak metanol menunjukkan bahwa hambatan pertumbuhan terbesar terdapat pada bakteri E. tarda yaitu sebesar 8,43 mm pada konsentrasi 60%, kemudian bakteri A. hydrophila sebesar 7,36 mm, sedangkan untuk jamur Saprolegnia sp. tidak terjadi hambatan pada semua konsentrasi yang diberikan dalam seluruh ekstrak daun sambiloto (Lampiran 9). Adanya aktivitas antimikroba tersebut kemungkinan disebabkan karena adanya kerja dari senyawa-senyawa metabolit sekunder yang terkandung di dalam daun sambiloto. Lukistyowati (2012) menyatakan zona hambat yang dihasilkan dari larutan sambiloto diduga karena kandungan senyawa utama andrographolide yang berperan sebagai antibiotik dan antibakteri. Perbedaan luas hambatan disebabkan oleh bahan penyusun dinding atau membran sel dari setiap mikroba uji yang berbeda.
E. tarda sebesar 9,50 mm pada konsentrasi 60%, sedangkan pengujian aktivitas
ekstrak n-heksana menunjukkan hambatan pertumbuhan terbesar terjadi pada bakteri E. tarda yaitu sebesar 8,81 mm dan bakteri A. hydrophila yaitu sebesar 8,27 mm pada konsentrasi 60%. Jika dibandingkan dengan zona hambat yang dihasilkan oleh chloramphenicol sebagai kontrol positif, ekstrak metanol, etil asetat dan n-heksana menghasilkan zona hambat yang lebih kecil. Meskipun zona hambat yang dihasilkan lebih kecil dari kontrol positif, hasil penelitian ini menunjukkan daun sambiloto dapat menghambat pertumbuhan bakteri A. hydrophila dan E. tarda. Sawitti dkk (2013) menyatakan kecilnya zona hambat
yang terbentuk dapat dipengaruhi pula oleh mutu ekstrak daun. Mutu ekstrak dipengaruhi oleh dua faktor utama yaitu faktor biologi dan faktor kimia.
Pengujian antimikroba yang dilakukan terhadap jamur Saprolegnia sp. tidak mengalami penghambatan sama sekali pada seluruh ekstrak daun sambiloto. Hal ini di duga karena ekstrak daun sambiloto ini hanya mengandung senyawa metabolit sekunder terpen/steroid untuk seluruh pelarut dan saponin untuk pelarut methanol yang berfungsi hanya sebagai antibakteri.
Uji Toksisitas Ekstrak Daun Sambiloto
Uji toksisitas dengan metode BSLT merupakan suatu uji yang digunakan untuk mengetahui senyawa aktif yang terkandung di dalam ekstrak suatu tanaman. Suatu ekstrak dianggap toksik apabila memiliki nilai LC50<1000 ppm, sedangkan untuk senyawa murni dikatakan toksik jika LC50
Uji toksisitas terhadap Artemia salina dengan ekstrak metanol dilakukan dengan tiga kali ulangan pada masing-masing konsentrasi 10, 100, 1000 ppm. Pada konsentrasi 10, 100, 1000 ppm jumlah kematian berturut-turut mencapai 8, 16 dan 26 ekor dengan total populasi 30 ekor pada setiap konsentrasi. Kematian larva udang ini diduga karena pemberian ekstrak daun sambiloto yang mengandung senyawa metabolit sekunder dan lemahnya daya tahan tubuh larva tersebut. Meilani (2006) menyatakan larva udang sangat peka terhadap apapun yang berada di lingkungannya dan berkembang dengan sangat cepat menyerupai pertumbuhan sel kanker. Keadaan membran kulitnya yang sangat tipis memungkinkan terjadinya difusi zat dari lingkungan yang mempengaruhi metabolisme di dalam tubuhnya. Oleh karena itu, penambahan zat ekstraktif yang diduga mengandung senyawa bioaktif dan berpotensi sebagai senyawa obat diharapkan mampu mengganggu metabolisme dan menyebabkan kematian larva udang. Hasil analisis persen kematian yang dikonversikan ke nilai probit dan menghitung persamaan regresi linier untuk mendapatkan nilai LC
< 200 ppm (Meyer dkk., 1982).
Uji toksisitas terhadap A. salina dengan ekstrak etil asetat dilakukan dengan tiga kali ulangan pada masing-masing konsentrasi 10, 100, 1000 ppm. Pada konsentrasi 10, 100, 1000 ppm jumlah kematian berturut-turut mencapai 8, 13 dan 24 ekor dengan total populasi 30 ekor pada setiap konsentrasi. Hasil analisis persen kematian yang dikonversikan ke nilai probit dan menghitung persamaan regresi linier untuk mendapatkan nilai LC50, didapatkan nilai LC50 pada ekstrak etil asetat sebesar 100 ppm. Sehingga uji BSLT ekstrak etil asetat dikatagorikan toksik terhadap A. salina begitu juga dengan hasil uji BSLT n-heksana yang didapatkan nilai LC50
Purba dkk (2013) mengatakan tingkat kematian dapat ditentukan secara langsung melalui perbandingan konsentrasi yang berkisar dari konsentrasi terendah hingga konsentrasi tertinggi. Dengan kata lain, kematian A. salina disebabkan oleh peningkatan konsentrasi dalam sampel.
nya sebesar 118,6 ppm. Data hasil perhitungan dapat dilihat pada Lampiran 8.
Kematian A. salina dalam botol vial karena pemberian konsentrasi yang semakin tinggi mengalami gerakan yang tidak teratur. Artemia salina dalam botol vial ini tetap aktif bergerak, akan tetapi gerakannya berputar-putar, sedangkan A. salina yang berada dalam botol vial sebagai kontrol tidak memberikan kematian
sama sekali dalam waktu 24 jam pengamatan. Hal ini membuktikan kematian A. salina disebabkan oleh sifat toksik dari ketiga ekstrak daun sambiloto. Harborne
(1994), menyebutkan semakin tinggi konsentrasi ekstrak maka sifat toksiknya akan semakin tinggi.
tinggi pada ekstrak n-heksana dan paling kecil pada ekstrak metanol. Perbedaan tingkat toksisitas tersebut disebabkan oleh senyawa metabolit sekunder yang terkandung di dalam ekstrak tersebut. Cahyadi (2009) menjelaskan bahwa cara kerja senyawa-senyawa tersebut dengan bertindak sebagai stomach poisoning atau racun perut. Oleh sebab itu jika senyawa tersebut masuk ke dalam tubuh larva, alat pencernaannya akan terganggu.
KESIMPULAN DAN SARAN
Kesimpulan
1. Ekstrak daun sambiloto (Andrographis paniculata) mampu menghambat pertumbuhan bakteri A. hydrophila dan E. tarda. namun tidak menghambat pertumbuhan jamur Saprolegnia sp.
2. Hasil uji fitokima menunjukkan bahwa ekstrak daun sambiloto (Andrographis paniculata) dengan pelarut metanol, etil asetat dan n-heksana mengandung
senyawa terpen/steroid pada seluruh ekstrak dan saponin pada ekstrak metanol. 3. Ekstrak daun sambiloto (Andrographis paniculata) bersifat toksik pada A.
salina dengan LC50 64,5 ppm untuk ekstrak metanol, 100 ppm untuk ekstrak etil asetat, dan 118,6 ppm untuk ekstrak n-heksana.
Saran
TINJAUAN PUSTAKA
Andrographolide Pada Daun Sambiloto
Pada tanaman sambiloto kandungan andrographolide terakumulasi paling tinggi pada bagian daun (2,39%) sedangkan paling rendah ditemukan di biji. Andrographolide mudah larut dalam metanol, etanol, piridin, asam asetat dan
aseton, dan sulit larut dalam eter dan air. Titik leleh dari senyawa andrographolide adalah 228o-230o
Ekstrak Daun Sambiloto Terhadap Beberapa Bakteri
C dan panjang gelombang (λ) maksimal adalah 223 nm. Selain faktor tempat pertumbuhan dan genetik aksesi sambiloto, kadar andrographolide juga dipengaruhi oleh waktu pengambilan sampel. Sambiloto
yang diambil dari tempat yang sama tetapi sampling dilakukan pada waktu yang berbeda ternyata berbeda intensitas absorpsi puncaknya ketika dilakukan analisa kadar andrographolide (Royani dkk., 2014).
Zona hambat yang dihasilkan dari larutan sambiloto diduga karena kandungan senyawa utama andrographolide yang berperan sebagai antibiotik dan antibakteri (Lukistyowati, 2012).
Kecilnya zona hambat yang terbentuk dapat dipengaruhi pula oleh mutu ekstrak daun. Mutu ekstrak dipengaruhi oleh dua faktor utama yaitu faktor biologi dan faktor kimia. Faktor biologi meliputi spesies tanaman, lokasi tanaman asal, waktu pemanenan, penyimpanan bahan baku, umur serta bagian tanaman yang digunakan. Lokasi tanaman dipengaruhi oleh lingkungan seperti tanah, atmosfir, cuaca, temperatur, cahaya, air, senyawa organik dan anorganik. Waktu panen juga mempengaruhi kandungan zat aktif daun sambiloto, dimana kandungan zat aktif tersebut mencapai jumlah optimal pada saat tanaman akan berbunga (Sawitti dkk., 2013).
Bakteri Aeromonas hydrophila dan Penyakit Motile Aeromonas Septicemia
Aeromonas hydrophila merupakan bakteri heterotrofik uniseluller,
tergolong protista prokariot yang dicirikan dengan tidak adanya membran yang memisahkan inti dengan sitoplasma. Bakteri ini biasanya berukuran 0,7-1,8 x
1,0-1,5 μm dan bergerak menggunakan sebuah polar flagel. A. hydrophila bersifat
tersebut. Disamping itu, bakteri Aeromonas hydrophila mampu tumbuh pada kisaran pH 4,7 - 11 (Haryani dkk., 2012).
Ikan lele dumbo memiliki pertumbuhan yang cepat namun sangat rentan terhadap penyakit khususnya serangan bakteri. Salah satu bakteri yang menyerang ikan lele dumbo yaitu A. hydrophila yang biasa dikenal dengan penyakit Motile
Aeromonas Septicemia (MAS) atau penyakit bercak merah. A. hydrophila
merupakan mikroorganisme akuatik yang berada di perairan laut maupun perairan tawar, dalam kondisi stres bakteri tersebut menjadi patogen dan bersifat patogen oportunistik pada penyakit Hemoragi septicemia (penyakit bercak merah) pada ikan (Asniatih dkk., 2013).
Pengendalian penyakit MAS pada ikan sering diatasi dengan penggunaan obat-obatan dan antibiotik, namun hasilnya kurang memuaskan. Penyakit ini dapat menimbulkan kematian pada ikan budidaya yang dapat merugikan para petani ikan Penggunaan obat-obatan yang secara terus menerus menyebabkan timbulnya bakteri patogen yang resisten, penimbunan residu oba-tobatan di dalam tubuh ikan maupun pencemaran lingkungan yang akhirnya mempengaruhi organisme yang berguna (Assidqi dkk., 2012).
Bakteri A. hydrophila merupakan bakteri septisemia sehingga penyebaran bakteri di dalam tubuh inang terjadi sangat cepat. Ikan lele yang diinjeksi dengan
A. hydrophila kepadatan 106 cfu/ml mengalami peradangan dan kematian
Bakteri Edwarsiella tarda Dan Penyakit Edwardsiellosis
Edwardsiella tarda adalah penyebab penyakit Edwardsiellosis /
Emphisemathous Putrevactive disease of Catfish (EPDC) atau Edwardsiella
Septicaemia (ES). Penyakit Edwardsiellosis dikenal sebagai penyakit utama pada
budidaya catfish di Amerika. E. tarda tidak memproduksi endotoksin seperti umumnya bakteri gram negatif lainnya, tetapi menghasilkan 2 eksotoksin yang dapat menyebabkan lesi. E. tarda dapat diidentifikasi melalui gejala klinis, isolasi dan identifikasi secara morfologi dan moleloler DNA. Edwardsiellosis dapat ditularkan secara horizontal antara ikan sakit dan ikan sehat. E. tarda dapat bertahan di dalam air dan lumpur sehingga air dan lumpur yang sudah bebas dari ikan yang sakit pun dapat menjadi karier dan menyebabkan timbulnya kembali penyakit (Narwiyani, 2010).
Edwardsiella tarda sebagian besar ditemukan pada kehidupan air tawar dan
laut termasuk pada kura-kura, ikan, anjing laut, ular dan kadal serta menyebabkan penyakit pada catfish, penguin dan belut. Ikan yang terserang tidak menunjukkan gejala klinik yang tersifat, hanya anoreksia yang bersifat umum. Gejala lain yaitu pendarahan pada kulit, kehilangan warna tubuh dan terjadi luka yang merata pada seluruh permukaan tubuh. Sekurang-kurangnya 250 kasus penyakit yang disebabkan oleh E. tarda telah dilaporkan menimbulkan gastroenteritis, septicemia dan infeksi pada jaringan lunak (Ratnawati dkk., 2013).
dan terlihat bentuk cembung yang menyebar ke seluruh tubuh. Warna tubuh hilang, dan luka-luka merata di seluruh tubuh. Jika luka digores akan tercium bau busuk (H2
Jamur Saprolegnia sp.
S) (Andriyanto dkk., 2009).
Dalam budidaya ikan, ketersediaan benih ikan secara kontinyu dalam kuantitas cukup dan mempunyai kualitas yang baik merupakan syarat mutlak untuk meningkatkan produksi. Salah satu permasalahan yang sering dihadapi dalam pembenihan secara intensif adalah serangan penyakit yang disebabkan oleh jamur dari Saprolegnia sp. yang dapat menurunkan derajat penetasan telur. Saat proses inkubasi sering ditemukan telur ikan yang mati akibat serangan jamur. Beberapa bahan kimia yang umum digunakan sebagai anti jamur antara lain adalah methylene blue dan gentian violet. Selain itu, NaCl juga diketahui efektif dalam mengobati serangan jamur Saprolegnia sp. Namun, penggunaan anti jamur berbahan kimia dalam jangka waktu yang panjang dan secara terus-menerus sebaiknya dihindarkan karena dapat menimbulkan efek yang berbahaya bagi organisme yang menggunakannya. Salah satu alternatif yang dianjurkan adalah pencegahan dan pengobatan infeksi Saprolegnia sp. dengan menggunakan senyawa fitokimia dari tumbuhan herbal (Lingga dkk., 2012).
Brine Shrimp Lethality Test (BSLT)
BSLT merupakan salah satu metode yang banyak digunakan untuk pencarian senyawa antikanker baru yang berasal dari tanaman. Brine Shrimp Lethality Test merupakan salah satu metode skrining untuk menentukan toksisitas
yang diberikan. Selain itu metode BSLT ini memiliki keuntungan saat waktu pelaksanaan yang cepat, biaya selektif yang murah, praktis, tidak memerlukan teknik yang aseptis, sempel yang relatif sedikit, dan hasil ujinya berkorelasi baik dengan beberapa metode uji sitotoksik. Pengujian ini merupakan tahap awal untuk mengetahui apakah senyawa tersebut berpotensi atau tidak sebagai antikanker yang selanjutnya dapat dilakukan uji sitotoksik menggunakan biakan sel kanker (Purwanto dkk., 2015).
Artemia salina yang digunakan pada pengujian toksisitas ialah Artemia
salina yang berada pada tahap nauplii atau tahap larva. Hal ini dikarenakan
Artemia salina pada tahap nauplii sangat mirip dengan sel manusia. Korelasi
PENDAHULUAN
Latar Belakang
Sambiloto merupakan tumbuhan liar yang memiliki banyak khasiat yaitu dapat mengobati berbagai macam penyakit. Karena merupakan jenis tumbuhan liar, sambiloto dapat di temukan di tempat-tempat seperti kebun, tepi sungai, tanah kosong yang lembab atau pekarangan. Manfaat daun sambiloto banyak digunakan untuk berbagai pengobatan tradisional. Sambiloto sudah dikenal luas di kalangan masyarakat pengguna tanaman obat, pembuatan jamu dan pengobatan tradisional (Fatimah dan Budi, 2008).
Sambiloto (Andrographis paniculata) ialah tumbuhan semusim yang termasuk dalam suku Acanthaceae. Sambiloto ialah herba tegak, yang tumbuh secara alami di daerah dataran rendah hingga ketinggian ± 1600 dpl. Habitat sambiloto ialah di tempat terbuka seperti ladang, pinggir jalan, tebing, saluran atau sungai, semak belukar, di bawah tegakan pohon jati atau bambu. Masyarakat memanfaatkan bagian tajuk (daun dan batang) tumbuhan sambiloto sebagai bahan obat tradisional untuk obat penguat, demam, disentri, kolera, diabetes dan sakit paru-paru. Tumbuhan sambiloto dipanen dari habitat aslinya oleh masyarakat untuk sumber bahan obat tradisional (Pujiasmanto dkk., 2007).
mengandung saponin, alkaloid dan tanin. Kandungan kimia lain yang terdapat pada daun adalah lactone, paniculin, dan kalmegin. Secara farmakologi disebutkan daun sambiloto mempunyai sifat sebagai analgesik, antiinflamasi, antibakteri, antimalaria, antiviral, imunostimulator, hepatoprotektif, kardiovaskular, dan antikanker (Sawitti dkk., 2013).
Rumusan Masalah
Berdasarkan pada latar belakang diatas, perumusan masalah yang dapat diambil adalah :
1. Bagaimana pengaruh ekstrak daun sambiloto (Andrographis paniculata) dalam mengendalikan pertumbuhan bakteri Aeromonas hydrophila, Edwardsiella tarda dan jamur Saprolegnia sp. ?
2. Apakah daun Sambiloto mengandung senyawa alkaloid, tanin, terpen/steroid, dan saponin melalui uji fitokimia ?
3. Apakah ekstrak etil asetat, ekstrak metanol dan ekstrak n-heksana dari daun Sambiloto bersifat toksik terhadap Artemia salina ?
Kerangka Pemikiran
patogen pada ikan budidaya, seperti bakteri dan jamur. Bakteri patogen yang menjadi masalah utama dalam kegiatan budidaya adalah jenis bakteri Aeromonas hydrophila dan Edwardsiella tarda. Sedangkan jamur yang bersifat patogen yang
kerap mengganggu kegiatan budidaya adalah jamur Saprolegnia sp.
[image:53.595.117.507.419.709.2]Pengendalian mikroba-mikroba yang bersifat patogen tersebut kebanyakan masih menggunakan bahan antiseptik kimia yang bila penggunaannya dilakukan secara terus menerus dapat berdampak buruk bagi lingkungan budidaya dan organism yang dibudidayakan tersebut. Untuk itulah penelitian tentang ekstrak daun sambiloto dilakukan apakah daun sambiloto ini mempunyai sifat antibaktri atau tidak. Bila daun sambiloto ini bersifat antibakterial, maka dapat di jadikan obat alami dalam mengendalikan serangan mikroba-mikroba yang bersifat patogen tersebut.
Gambar 1. Kerangka Pemikiran Penelitian Kegiatan Budidaya Ikan
Kualitas Air Buruk
Mikroba Patogen Pada Ikan Budidaya
Edwardsiella tarda
Aeromonas hydrophila Saprolegnia sp.
Pengendalian Mikroba Penyebab Penyakit Ikan
Tujuan Penelitian
Adapun tujuan dari dilaksanakannya penelitian ini adalah :
1. Untuk mengetahui daya hambat ekstrak daun sambiloto terhadap pertumbuhan bakteri A. hydrophila, E. tarda dan jamur Saprolegnia sp.
2. Mengetahui apakah kandungan fitokima dari daun sambiloto melalui uji fitokimia.
3. Mengetahui toksisitas dari ekstrak daun sambiloto terhadap A. salina.
Manfaat Penelitian
ABSTRAK
LIHARDO SINAGA. Ekstrak Daun Sambiloto (Andrographis Paniculata) Dalam Mengendalikan Pertumbuhan Bakteri Aeromonas hydrophila, Edwarsiella tarda
Dan Jamur Saprolegnia sp. Secara In Vitro. Dibimbing oleh DWI SURYANTO
dan INDRA LESMANA.
Penelitian ini bertujuan untuk mengetahui potensi antimikroba dari ekstrak daun sambiloto (Andrographis Paniculata) terhadap bakteri Aeromonas hydrophila, Edwardsiella tarda dan jamur Saprolegnia sp. serta mengetahui toksisitasnya terhadap Artemia salina. Daun sambiloto diekstrak dengan pelarut ang berbeda yaitu metanol, etil asetat dan n-heksana. Pengujian aktivitas antimikroba dilakukan dengan metode difusi cakram, untuk mengetahui senyawa yang terkandung di dalam ekstrak dilakukan uji fitokimia. Untuk mengetahui tingkat toksisitas ekstrak menggunakan metode Brine Shrimp Lethality Test (BSLT). Analisis senyawa kimia menunjukkan dalam ekstrak daun sambiloto mengandung Terpenoid/Steroid dan Saponin. Ekstrak daun sambiloto dapat menghambat pertumbuhan bakteri Aeromonas hydrophila, Edwardsiella tarda, tetapi tidak dapat menghambat pertumbuhan jamur Saprolegnia sp. dengan zona hambat yang berbeda. Ekstrak yang paling optimal dalam menghambat bakteri Aeromonas hydrophila dan Edwardsiella tarda adalah ekstrak etil asetat dengan rata-rata zona hambat 9,11 – 10,78 mm pada bakteri Aeromonas hydrophila dan 6,10 – 9,50 pada bakteri Edwardsiella tarda . Zona hambat pertumbuhan terbesar terdapat pada bakteri A. hydrophila yaitu sebesar 10,78 mm. Ekstrak n-heksana memiliki nilai LC50 tertinggi yaitu 118,6 ppm yang tergolong toksik pada Artemia salina. Ekstrak daun sambiloto memiliki toksisitas dengan nilai LC50< 1000 µg/ml.
ABSTRACT
LIHARDO SINAGA. Antimicrobial Activity of Extract of Sambiloto’s Leaf (Andrographis paniculata) to Aeromonas hydrophila, Edwardsiella tarda and Saprolegnia sp. Under academic supervision of DWI SURYANTO and INDRA LESMANA.
This study was aimed to know antimicrobial potential of extract of sambiloto’s Leaf (Andrographis paniculata) against bacteria Aeromonas hydrophila, Edwardsiella tarda and Saprolegnia sp. and to know the extract toxicity to brine shrimp (Artemia salina). Sambiloto’s leaf was extracted using methanol, ethyl acetate and n-Hexane. Antimicrobial activity test was done using diffusion discs method to know the compunds contained in the extract phytochemical test was conducted. The chemical compound test showed that extract of sambiloto’s leaf contained terpenoid/steroid and saponin. The extracts inhibit the growth of Aeromonas hydrophila and Edwardsiella tarda but can not inhibited the growth of Saprolegnia sp. The most optimal extract in inhibiting the bacteria Aeromonas hydrophila and Edwardsiella tarda is extract of ethyl acetate with the average zone of inhibition 9.11 - 10.78 mm in bacteria Aeromonas hydrophila and 6.10 - 9.50 mm in bacteria Edwardsiella tarda. Extract n-hexane has the highest value of LC50 118.6 ppm as classified toxic to Artemia salina. Extracts showed cytotoxic activity with LC50<1000 µg/ml.
EKSTRAK DAUN SAMBILOTO (
Andrographis paniculata
)
DALAM MENGENDALIKAN PERTUMBUHAN BAKTERI
Aeromonas hydrophila, Edwarsiella tarda
dan Jamur
Saprolegnia
sp. SECARA
IN VITRO
LIHARDO SINAGA 110302063
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
EKSTRAK DAUN SAMBILOTO (
Andrographis paniculata
)
DALAM MENGENDALIKAN PERTUMBUHAN BAKTERI
Aeromonas hydrophila, Edwarsiella tarda
dan Jamur
Saprolegnia
sp. SECARA
IN VITRO
SKRIPSI
LIHARDO SINAGA 110302063
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
EKSTRAK DAUN SAMBILOTO (
Andrographis paniculata
)
DALAM MENGENDALIKAN PERTUMBUHAN BAKTERI
Aeromonas hydrophila, Edwarsiella tarda
dan Jamur
Saprolegnia
sp. SECARA
IN VITRO
SKRIPSI
LIHARDO SINAGA 110302063
Skripsi Sebagai Salah Satu Diantara Beberapa Syarat Untuk Dapat Memperoleh Gelar Sarjana Di Program Studi Manajemen Sumberdaya Perairan, Fakultas
Pertanian Universitas Sumatera Utara, Medan
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
LEMBAR PENGESAHAN
Judul Penelitian : Ekstrak Daun Sambiloto (Andrographis paniculata) Dalam Mengendalikan Pertumbuhan Bakteri Aeromonas hydrophila, Edwarsiella tarda dan Jamur Saprolegnia sp. Secara In Vitro
Nama : Lihardo Sinaga
NIM : 110302063
Program Studi : Manajemen Sumberdaya Perairan
Disetujui Oleh, Komisi Pembimbing
Prof. Dr. Dwi Suryanto, M.Sc Indra Lesmana, S.Pi, M.Si Ketua Anggota
Mengetahui
Dr. Ir. Yunasfi, M.Si
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Saya yang bertanda tangan dibawah ini : Nama : Lihardo Sinaga
NIM : 110302063
Menyatakan bahwa skripsi saya yang berjudul “Ekstrak Daun Sambiloto (Andrographis paniculata) Dalam Mengendalikan Pertumbuhan Bakteri Aeromonas hydrophila, Edwarsiella tarda dan Jamur Saprolegnia sp. Secara In Vitro” adalah benar hasil karya saya sendiri dan belum dijadikan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan di dalam teks dan dicantumkan dalam bagian akhir skripsi ini.
Medan, Januari 2016
LEMBAR PENGESAHAN
Judul Penelitian : Ekstrak Daun Sambiloto (Andrographis paniculata) Dalam Mengendalikan Pertumbuhan Bakteri Aeromonas hydrophila, Edwarsiella tarda dan Jamur Saprolegnia sp. Secara In Vitro
Nama : Lihardo Sinaga
NIM : 110302063
Program Studi : Manajemen Sumberdaya Perairan
Disetujui Oleh, Komisi Pembimbing
Prof. Dr. Dwi Suryanto, M.Sc Indra Lesmana, S.Pi, M.Si Ketua Anggota
Mengetahui
Dr. Ir. Yunasfi, M.Si
ABSTRAK
LIHARDO SINAGA. Ekstrak Daun Sambiloto (Andrographis Paniculata) Dalam Mengendalikan Pertumbuhan Bakteri Aeromonas hydrophila, Edwarsiella tarda
Dan Jamur Saprolegnia sp. Secara In Vitro. Dibimbing oleh DWI SURYANTO
dan INDRA LESMANA.
Penelitian ini bertujuan untuk mengetahui potensi antimikroba dari ekstrak daun sambiloto (Andrographis Paniculata) terhadap bakteri Aeromonas hydrophila, Edwardsiella tarda dan jamur Saprolegnia sp. serta mengetahui toksisitasnya terhadap Artemia salina. Daun sambiloto diekstrak dengan pelarut ang berbeda yaitu metanol, etil asetat dan n-heksana. Pengujian aktivitas antimikroba dilakukan dengan metode difusi cakram, untuk mengetahui senyawa yang terkandung di dalam ekstrak dilakukan uji fitokimia. Untuk mengetahui tingkat toksisitas ekstrak menggunakan metode Brine Shrimp Lethality Test (BSLT). Analisis senyawa kimia menunjukkan dalam ekstrak daun sambiloto mengandung Terpenoid/Steroid dan Saponin. Ekstrak daun sambiloto dapat menghambat pertumbuhan bakteri Aeromonas hydrophila, Edwardsiella tarda, tetapi tidak dapat menghambat pertumbuhan jamur Saprolegnia sp. dengan zona hambat yang berbeda. Ekstrak yang paling optimal dalam menghambat bakteri Aeromonas hydrophila dan Edwardsiella tarda adalah ekstrak etil asetat dengan rata-rata zona hambat 9,11 – 10,78 mm pada bakteri Aeromonas hydrophila dan 6,10 – 9,50 pada bakteri Edwardsiella tarda . Zona hambat pertumbuhan terbesar terdapat pada bakteri A. hydrophila yaitu sebesar 10,78 mm. Ekstrak n-heksana memiliki nilai LC50 tertinggi yaitu 118,6 ppm yang tergolong toksik pada Artemia salina. Ekstrak daun sambiloto memiliki toksisitas dengan nilai LC50< 1000 µg/ml.
ABSTRACT
LIHARDO SINAGA. Antimicrobial Activity of Extract of Sambiloto’s Leaf (Andrographis paniculata) to Aeromonas hydrophila, Edwardsiella tarda and Saprolegnia sp. Under academic supervision of DWI SURYANTO and INDRA LESMANA.
This study was aimed to know antimicrobial potential of extract of sambiloto’s Leaf (Andrographis paniculata) against bacteria Aeromonas hydrophila, Edwardsiella tarda and Saprolegnia sp. and to know the extract toxicity to brine shrimp (Artemia salina). Sambiloto’s leaf was extracted using methanol, ethyl acetate and n-Hexane. Antimicrobial activity test was done using diffusion discs method to know the compunds contained in the extract phytochemical test was conducted. The chemical compound test showed that extract of sambiloto’s leaf contained terpenoid/steroid and saponin. The extracts inhibit the growth of Aeromonas hydrophila and Edwardsiella tarda but can not inhibited the growth of Saprolegnia sp. The most optimal extract in inhibiting the bacteria Aeromonas hydrophila and Edwardsiella tarda is extract of ethyl acetate with the average zone of inhibition 9.11 - 10.78 mm in bacteria Aeromonas hydrophila and 6.10 - 9.50 mm in bacteria Edwardsiella tarda. Extract n-hexane has the highest value of LC50 118.6 ppm as classified toxic to Artemia salina. Extracts showed cytotoxic activity with LC50<1000 µg/ml.
RIWAYAT HIDUP
Penulis dilahirkan di Dolok Merangir, Kabupaten Simalungun pada tanggal 15 April 1992. Anak ke tiga dari empat bersaudara dari pasangan Bapak Alden Anwar Sinaga dan Ibu Derpina br. Sipayung.
Pendidikan formal pertama diawali di SD 0952194 Pondok Pasir, Dolok Ilir, Kabupaten Simalungun pada tahun 1998-2004. Bersamaan dengan berakhirnya pendidikan dasar, penulis melanjutkan pendidikan di SLTP Negeri 1 Dolok Batu Nanggar Kabupaten Simalungun dan lulus pada tahun 2007. Pada tahun yang sama penulis melanjut ke SMA Negeri 1 Dolok Batu Nanggar Kabupaten Simalungun dan menyelesaikan pendidikannya pada tahun 2010. Pada tahun 2011 penulis melanjutkan pendidikan S1 di Program Studi Manajemen Sumberdaya Perairan Fakultas Pertanian Univesitas Sumatera Utara melalui jalur Ujian Masuk Bersama (UMB).
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa, atas berkat dan kasih karunia-Nya, penulis dapat menyelesaikan usulan penelitian yang berjudul “Ekstrak Daun Sambiloto (Andrographis Paniculata) Dalam Mengendalikan Pertumbuhan Bakteri Aeromonas hydrophila, Edwarsiella
tarda Dan Jamur Saprolegnia sp. Secara In Vitro”. Proposal ini sebagai usulan
tugas akhir serta sebagai syarat untuk menyelesaikan studi di Program Studi Manajemen Sumberdaya Perairan, Fakultas Pertanian, Universitas Sumatera Utara.
Pada kesempatan ini penulis mengucapkan terimakasih yang sebesar-besarnya kepada :
1. Ayahanda Alden Anwar Sinaga dan Ibunda Derpina br. Sipayung yang menjadi alasan untuk menggapai cita-cita. Terimakasih untuk doa, dukungan dan motivasi yang tiada henti kepada penulis.
2. Bapak Prof. Dr. Dwi Suryanto, M.Sc selaku ketua komisi pembimbing dan Bapak Indra Lesmana S.Pi, M.Si selaku anggota komisi pembimbing yang telah bersedia untuk memberikan saran serta meluangkan waktu untuk memberikan bimbingan dalam penyusunan skripsi ini.
3. Bapak Dr. Ir. Yunasfi, M.Si selaku ketua Program Studi Manajemen Sumberdaya Perairan.
4. Seluruh dosen Manajemen Sumberdaya Perairan USU yang telah memberikan banyak ilmu kepada penulis serta pegawai administrasi MSP USU kak Nur Asiah, A.Md.
Nababan, Ainul Mardiah yang telah memberikan motivasi dan mengingatkan penulis untuk segera menyelesaikan skripsi ini.
6. Ibu Ied Perinduri, S.Si selaku pembimbing penelitian si SKIPM Kelas 1 Medan 2 Belawan yang telah membantu dalam menyelesaikan penelitian. Terimakasih kepada Bapak Ir. Felix Lumban Tobing, S.Pi, M.P selaku kepala SKIPM kelas 1 Medan 2, Bapak Sondang Sitorus, S.Si selaku kasubsi tata pelayanan SKIPM Kelas 1 Medan 2, Ibu Cut Rina Meutia selaku, SH selaku kepala urusan tata usaha SKIPM Kelas 1 Medan 2, Bapak Dicky Agung Setiyawan, S.St.Pi selaku kepala laboratorium SKIPM Kelas 1 Medan 2 yang telah memberikan dukungan baik materi maupun bantuan kepada penulis selama terlaksananya kegiatan penelitian.
7. Bapak Gatot Pahlawan, S.Pi selaku kepala UPTD budidaya Dinas Pertanian dan Kelautan Kota Medan beserta staf dan pegawai yang telah memberikan kesempatan kepada penulis untuk melakukan penelitian di instansi tersebut. 8. Bapak Dr. Lamek Marpaung, M.Phil, Ph.D selaku kepala laboratorium kimia
dan bahan alam Fakultas MIPA USU yang telah memberikan kesempatan kepada penulis untuk melakukan penelitian di laboratorium tersebut.
Penulis berharap semoga skripsi ini dapat memberikan manfaat sebagai informasi dan perkembangan ilmu pengetahuan, khususnya dibidang mikrobiologi akuatik dan hama penyakit ikan.
DAFTAR ISI
Halaman
ABSTRAK i
ABSTRACT ii
RIWAYAT HIDUP iii
KATA PENGANTAR iv
DAFTAR ISI vi
DAFTAR GAMBAR viii
DAFTAR TABEL viiii
DAFTAR LAMPIRAN ix
PENDAHULUAN Latar Belakang 1
Rumusan Masalah 2
Kerangka Pemikiran 2
Tujuan Penelitian 4
Manfaat Penelitian 4
TINJAUAN PUSTAKA Andrographolide Pada Daun Sambiloto 5
Ekstrak Daun Sambiloto Terhadap Beberapa Bakteri 5
Bakteri Aeromonas hydrophila dan Penyakit Motile Aeromonas Septicemia 7
Bakteri Edwarsiella tarda Dan Penyakit Edwardsiellosis 9
Jamur Saprolegnia sp 10
METODE PENELITIAN Waktu dan Tempat Penelitian 11
Alat dan Bahan Penelitian 11
Prosedur Penelitian 11
a. Ekstraksi Daun Sambiloto 11
b. Pembuatan Pelarut Ekstrak Daun Sambiloto 12
Uji Fitokimia 13
a. Alkaloid 13
b. Flavanoid 13
c. Saponin 14
d. Steroid 14
e. Triterpenoid 14
f. Tanin 14
Uji Aktivitas Antibakteri dan Antifungi 14
Pengukuran Zona Hambat 16
Uji Toksisitas Ekstrak dengan Metode Brine Shrimp Lethality Test 17
Analisis Data 17
HASIL DAN PEMBAHASAN 18
Hasil Uji Fitokimia Ekstrak Daun Sambiloto 18
Uji Biokimia Bakteri Aeromonas hydrophila dan Edwardsiella tarda 19
Uji Aktivitas Antimikroba Daun Sambiloto 20
Uji Toksisitas Daun Sambiloto 21
Pembahasan Ekstraksi Daun Sambiloto 22
Aeromonas hydrophila 23 Uji Aktifitas Antimikroba Daun Sambiloto 25 Uji Toksisitas Ekstrak Daun Sambiloto 27
DAFTAR GAMBAR
No. Teks Halaman
1. Kerangka Pemikiran 3
2. Perhitungan diameter zona hambat antibakteri 16
3. Perhitungan zona hambat jamur Saprolegnia sp. 17
DAFTAR TABEL
No. Teks Halaman
1. Hasil Uji Fitokimia Ekstrak Daun Sambiloto 18
2. Hasil ekstraksi daun sambiloto 19
3. Hasil uji biokimia bakteri Edwardsiella tarda 19
4. Hasil uji biokimia bakteri Aeromonas hydrophila 20
5. Hasil pengamatan antimikroba dengan metode difusi 21
DAFTAR LAMPIRAN
No. Teks Halaman
1. Proses Pembuatan Ekstrak Daun Sambiloto ... 34
2. Data Awal Zona Hambat Ekstrak Daun Sambiloto ... 35
3. Alat dan Bahan Yang Digunakan ... 37
4. Analisis Bakteri Edwardsiella tarda ... 39
5. Analisis Aeromonas hydrophilla ... 40
6. Pengujian Antimikroba ... 41
7. Data Aw