UJI DAYA HAMBAT EKSTRAK KULIT BATANG Rhizophora
mucronata TERHADAP PERTUMBUHAN BAKTERI
Aeromonas hydrophila, Streptococcus agalactiae
DAN JAMUR Saprolegnia sp. SECARA IN VITRO
DEDI PRADANA
090302007PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
UJI DAYA HAMBAT EKSTRAK KULIT BATANG Rhizophora
mucronata TERHADAP PERTUMBUHAN BAKTERI
Aeromonas hydrophila, Streptococcus agalactiae
DAN JAMUR Saprolegnia sp. SECARA IN VITRO
SKRIPSI
OLEH :
DEDI PRADANA
090302007Skripsi sebagai satu diantara beberapa syarat untuk memperoleh gelar Sarjana Perikanan di Program Studi Manajemen Sumberdaya Perairan, Fakultas Pertanian,
Universitas Sumatera Utara
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
UJI DAYA HAMBAT EKSTRAK KULIT BATANG Rhizophora
mucronata TERHADAP PERTUMBUHAN BAKTERI
Aeromonas hydrophila, Streptococcus agalactiae
DAN JAMUR Saprolegnia sp. SECARA IN VITRO
SKRIPSI
DEDI PRADANA
090302007Skripsi sebagai satu diantara beberapa syarat untuk memperoleh gelar Sarjana Perikanan di Program Studi Manajemen Sumberdaya Perairan, Fakultas Pertanian,
Universitas Sumatera Utara
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
LEMBAR PENGESAHAN
Judul Skripsi : Uji Daya Hambat Ekstrak Kulit Batang Rhizophora mucronata Terhadap Pertumbuhan Bakteri Aeromonas
hydrophila, Streptococcus agalactiae dan Jamur Saprolegnia sp. Secara In Vitro.
Nama Mahasiswa : Dedi Pradana
NIM : 090302007
Program Studi : Manajemen Sumberdaya Perairan
Disetujui Oleh
Komisi Pembimbing
Prof. Dr. Dwi Suryanto, M. Sc Dr. Ir. Yunasfi, M. Si
Ketua Anggota
Mengetahui
Dr. Ir. Yunasfi, M. Si
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Yang bertanda tangan dibawah ini:
Nama : Dedi Pradana
NIM : 090302007
Menyatakan bahwa skripsi yang berjudul “Uji Daya Hambat Ekstrak Kulit Batang
Rhizophora mucronata Terhadap Pertumbuhan Bakteri Aeromonas hydrophila,
Streptococcus agalactiae dan Jamur Saprolegnia sp. Secara In Vitro.” benar
merupakan hasil karya sendiri dan belum diajukan dalam bentuk apapun kepada
perguruan tinggi manapun. Semua sumber dan data informasi yang berasal atau
dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain
telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di akhir
skripsi ini.
Medan, Januari 2014
ABSTRAK
DEDI PRADANA. Uji Daya Hambat Ekstrak Kulit Batang Rhizophora mucronata terhadap Pertumbuhan Bakteri Aeromonas hydrophila, Streptococcus agalactiae dan Jamur Saprolegnia sp. secara In Vitro. Dibimbing oleh DWI SURYANTO dan YUNASFI.
Penelitian ini bertujuan untuk mengetahui potensi antimikroba dari ekstrak kulit batang Rhizophora mucronata terhadap bakteri patogen Aeromonas hydrophila, Streptococcus agalactiae dan jamur Saprolegnia sp., serta mengetahui toksisitasnya terhadap Artemia salina Leach. Ekstraksi dilakukan dengan cara maserasi tunggal menggunakan pelarut metanol, pelarut etil asetat, dan pelarut n-heksana. Uji fitokimia dilakukan terhadap semua ekstrak. Uji toksisitas dilakukan dengan metode Brine Shrimpe Lethality Test. Uji aktivitas antimikroba dilakukan dengan metode difusi agar. Hasil uji fitokimia serbuk simplisia kulit batang Rhizophora mucronata menunjukkan adanya senyawa golongan alkaloid, tanin, steroid/terpenoid, dan saponin. Ketiga ektrak kulit batang Rhizophora mucronata aktif terhadap A. salina. Hasil pengujian menunjukkan bahwa ekstrak etil asetat merupakan ekstrak yang paling toksik. Aktivitas antimikroba ditandai dengan terbentuknya zona bening di sekitar cakram. Hasil uji menunjukkan bahwa ekstrak etil asetat kulit batang R. mucronata merupakan antimikroba berspektrum luas karena mampu menghambat pertumbuhan semua mikroba uji.
ABSTRACT
DEDI PRADANA. Inhibition Test of Rhizophora mucronata Bark Extract against Aeromonas hydrophila Bacteria Growth, Streptococcus agalactiae, and fungus Saprolegnia sp. this research was suvervised by DWI SURYANTO and YUNASFI.
This reseach head to determine antimicrobial potential of stem bark extract Rhizophora mucronata again bacterial pathogens of Aeromonas hydrophila, Streptococcus agalactiae and fungus Saprolegnia sp. and determine the level of toxicity against Artemia Salina Leach. Extraction was done by a single maceration using methanol solvent, ethyl acetate solvent and n-hexane solvent. Phytochemical test conducted on all extracts. Toxicity test was conducted using Brine Shrimp Lethality Test. Antimicrobial activity test was done by the agar diffusion method. The result of simplicia bark powder Rhizophora mucronata test showed compound of class alkaloid, tannin, steroid/terpenoid and saponin. The result of this research showed the extact of that three bark of Rhizophora mucronata active against A. salina. The result showed that ethyl acetate extract was the most toxic ectract. The antimicrobial activity is characterized by the formation of clear zone around the disc. The test result showed ethyl acetate extract of R. mucronata stem bark was broad-spectrum antimicrobial because it was able to inhibit the growth of all the experimental microbes.
RIWAYAT HIDUP
Penulis dilahirkan di Kabupaten Simalungun,
Provinsi Sumatera Utara pada tanggal 4 September 1990
sebagai anak kedua dari empat bersaudara pasangan
Sugito dan Mesia. Penulis memulai jenjang pendidikan
formal di SDN 095215 Dolok Mainu, Kabupaten
Simalungun sampai tahun 2003. Penulis kemudian
melanjutkan pendidikan di SMP Neg. 1 Dolok Batu
Nanggar, Kabupaten Simalungun (tahun 2003 – 2006). Tahun 2009 penulis
menyelesaikan pendidikan menengah atas di SMA Neg. 1 Dolok Batu Nanggar,
Kabupaten Simalungun. Pada tahun yang sama penulis diterima sebagai
mahasiswa di Universitas Sumatera Utara melalui jalur ujian tertulis Seleksi
Penerimaan Mahasiswa Baru Program Studi Manajemen Sumberdaya Perairan.
Selama masa perkuliahan penulis aktif sebagai anggota Ikatan Mahasiswa
Manajemen Sumberdaya Perairan (IMMASPERA). Penulis juga aktif sebagai
asisten praktikum mata kuliah Fisiologi Hewan Air, Biologi Perairan dan
Dinamika Populasi Ikan. Penulis melakukan Praktik Kerja Lapangan (PKL) di
Pelabuhan Perikanan Samudera Belawan pada tanggal 4 Februari 2013 sampai
KATA PENGANTAR
Puji syukur penulis ucapkan kehadirat Allah SWT karena atas rahmat,
hidayah, serta karunia-Nya penulis dapat menyelesaikan penelitian dan
penyusunan skripsi yang berjudul, ”Uji Daya Hambat Ekstrak Kulit Batang
Rhizophora mucronata terhadap Pertumbuhan Bakteri Aeromonas hydrophila,
Streptococcus agalactiae dan Jamur Saprolegnia sp. Secara In Vitro”.
Pada kesempatan ini penulis mengucapkan terima kasih kepada ayahanda
Sugito dan Ibunda Mesia serta abang Aris Sadeli, adik Trianita, adik Bastian dan
semua saudara atas segala doa, kasih sayang dan dukungan baik moril maupun
materil sehingga penulis tetap semangat dan termotivasi dalam melaksanakan
penelitian hingga penyelesaian skripsi ini. Terimakasih juga penulis ucapkan
kepada Bapak Prof. Dr. Dwi Suryanto, M. Sc selaku ketua komisi pembimbing
dan Bapak Dr. Ir. Yunasfi, M.Si selaku anggota komisi pembimbing yang telah
banyak memberikan bimbingan dan arahan dengan penuh kesabaran selama
penelitian dan penulisan skripsi ini, kepada seluruh rekan-rekan mahasiswa
angkatan 2009, staf pengajar dan pegawai di Program Studi Manajemen
Sumberdaya Perairan Fakultas Pertanian Universitas Sumatera Utara. Tak lupa
pula ucapan terimakasih kepada seluruh staf pegawai di Balai Karantina Ikan
Belawan Kelas I Medan II, staf pegawai di Stasiun Pusat Informasi dan
Pengembangan Ikan Hias, UPTD Budidaya pada Dinas Pertanian dan Kelautan
Kota Medan dan seluruh pihak yang telah membantu dalam penyelesaian skripsi
Penulis berharap semoga skripsi ini dapat bermanfaat dalam
pengembangan dan pengetahuan khususnya untuk diri penulis, pembaca dan
Program Studi Manajemen Sumber Daya Perairan.
Medan, Januari 2014
DAFTAR ISI
Deskripsi Tumbuhan Rhizophora mucronata ... 6Senyawa Fitokomia ... 7
Persiapan dan Ekstraksi Kulit Batang R. mucronata ... 20
Uji Fitokimia ... 21
Uji Aktifitas Antibakteri ... 23
Uji Toksisitas ... 28
HASIL DAN PEMBAHASAN Hasil
Uji fitokimia ... 30
Ekstraksi ... 31
Uji toksisitas artemia ... 32
Uji aktifitas antimikroba ... 32
Pembahasan Uji fitokimia ... 36
Ekstraksi ... 39
Uji toksisitas ... 41
Uji Aktivitas Antimikroba ... 46
KESIMPULAN DAN SARAN Kesimpulan ... 57
Saran ... 57
DAFTAR TABEL
No. Teks Halaman
1. Klasifikasi respon hambatan pertumbuhan mikroba ... 17
2. Hasil identifikasi kandungan fitokimia pada ekstrak kulit batang
tumbuhan Rhizophora mucronata ... 30
3. Hasil ekstraksi kulit batang tumbuhan Rhizophora mucronata. ... 31
4. Data hasil uji BSLT ekstrak etil asetat, ekstrak metanol dan ekstrak
n-heksana dari kulit batang Rhizophora mucronata ... 32
5. Rata-rata diameter zona hambat ekstrak kulit batang R. mucronata
terhadap bakteri A. Hydrophila dan bakteri S. agalactiae ... 33
6. Rata-rata jari-jari zona hambat ekstrak kulit batang R. mucronata
DAFTAR GAMBAR
No. Teks Halaman
1. Kerangka Pemikiran Penelitian ... 4
2. Kulit Batang, Akar, Bunga, Buah dan Daun R. mucronata ... 7
3. Aeromonas hydrophila dan Hasil pewarnaan Gram. ... 14
4. Streptococcus agalactiaedanHasil pewarnaan Gram ... 15
5. Pertumbuhan Saprolegnia sp.pada media PDA, dan Saprolegnia sp. pada hasil pengamatan mikroskopis. ... 16
6. Perhitungan Diameter Zona Hambat antibakteri ... 27
7. Perhitungan jari-jari zona hambat jamur Saprolegnia sp. ... 27
8. Hasil uji fitokimia ... 31
9. Hasil pengujian antibakteri terhadap bakteri A. hydrophila... 33
10. Hasil pengujian antibakteri terhadap bakteri S. agalactiae ... 34
DAFTAR LAMPIRAN
No. Teks Halaman
1. Proses Ekstraksi ... 65
2. Proses Pengujian Tosisitas ... 66
3. Proses Pengujian Antimikroba ... 68
4. Analisis Kriteria Bakteri Aeromonas hydrophila ... 69
5. Analisis Kriteria Bakteri Streptococcus agalctiae ... 70
6. Analisis Kriteria Bakteri Saprolegnia sp. ... 71
7. Data Awal Zona Hambat Ekstrak Kulit Batang Rhizophora mucrona ta terhadap Bakteri Aeromonas hydrophila, Streptococcus agalactiae dan Jamur Saprolegnia sp.. ... 72
8. Tabel Probit ... 74
9. Data awal kematian Artemia salina pada berbagai konsentrasi uji ... 75
10. Perhitungan LC50 dengan pelarut etil asetat ... 76
ABSTRAK
DEDI PRADANA. Uji Daya Hambat Ekstrak Kulit Batang Rhizophora mucronata terhadap Pertumbuhan Bakteri Aeromonas hydrophila, Streptococcus agalactiae dan Jamur Saprolegnia sp. secara In Vitro. Dibimbing oleh DWI SURYANTO dan YUNASFI.
Penelitian ini bertujuan untuk mengetahui potensi antimikroba dari ekstrak kulit batang Rhizophora mucronata terhadap bakteri patogen Aeromonas hydrophila, Streptococcus agalactiae dan jamur Saprolegnia sp., serta mengetahui toksisitasnya terhadap Artemia salina Leach. Ekstraksi dilakukan dengan cara maserasi tunggal menggunakan pelarut metanol, pelarut etil asetat, dan pelarut n-heksana. Uji fitokimia dilakukan terhadap semua ekstrak. Uji toksisitas dilakukan dengan metode Brine Shrimpe Lethality Test. Uji aktivitas antimikroba dilakukan dengan metode difusi agar. Hasil uji fitokimia serbuk simplisia kulit batang Rhizophora mucronata menunjukkan adanya senyawa golongan alkaloid, tanin, steroid/terpenoid, dan saponin. Ketiga ektrak kulit batang Rhizophora mucronata aktif terhadap A. salina. Hasil pengujian menunjukkan bahwa ekstrak etil asetat merupakan ekstrak yang paling toksik. Aktivitas antimikroba ditandai dengan terbentuknya zona bening di sekitar cakram. Hasil uji menunjukkan bahwa ekstrak etil asetat kulit batang R. mucronata merupakan antimikroba berspektrum luas karena mampu menghambat pertumbuhan semua mikroba uji.
ABSTRACT
DEDI PRADANA. Inhibition Test of Rhizophora mucronata Bark Extract against Aeromonas hydrophila Bacteria Growth, Streptococcus agalactiae, and fungus Saprolegnia sp. this research was suvervised by DWI SURYANTO and YUNASFI.
This reseach head to determine antimicrobial potential of stem bark extract Rhizophora mucronata again bacterial pathogens of Aeromonas hydrophila, Streptococcus agalactiae and fungus Saprolegnia sp. and determine the level of toxicity against Artemia Salina Leach. Extraction was done by a single maceration using methanol solvent, ethyl acetate solvent and n-hexane solvent. Phytochemical test conducted on all extracts. Toxicity test was conducted using Brine Shrimp Lethality Test. Antimicrobial activity test was done by the agar diffusion method. The result of simplicia bark powder Rhizophora mucronata test showed compound of class alkaloid, tannin, steroid/terpenoid and saponin. The result of this research showed the extact of that three bark of Rhizophora mucronata active against A. salina. The result showed that ethyl acetate extract was the most toxic ectract. The antimicrobial activity is characterized by the formation of clear zone around the disc. The test result showed ethyl acetate extract of R. mucronata stem bark was broad-spectrum antimicrobial because it was able to inhibit the growth of all the experimental microbes.
PENDAHULUAN
Latar Belakang
Indikator keberhasilan dalam usaha budidaya ikan adalah kondisi
kesehatan ikan. Oleh karena itu masalah penyakit merupakan masalah yang sangat
penting untuk ditangani secara serius. Penyakit pada ikan budidaya diantaranya
terdiri atas penyakit bakterial dan mikotik. Contoh penyakit bakterial yaitu
penyakit Motil Aeromonas Septicemia (MAS) atau penyakit bercak merah yang
disebabkan bakteri Aeromonas hydrophila sebagai bakteri patogen gram negatif
dan penyakit Streptococcosis yang disebabkan oleh Streptococus agalactiae
sebagai bakteri patogen gram positif, sedangkan penyakit mikotik salah satunya
disebabkan oleh Saprolegnia sp. yang menyebabkan penyakit saprolegniasis pada
ikan budidaya (Kordi, 2004). Jika penyakit tersebut tidak segera diatasi dapat
membuat ikan budidaya menjadi cacat bahkan mengalami kematian yang akhirnya
dapat menyebabkan harga jualnya turun sehingga dapat mengurangi keuntungan
usaha.
Penanggulangan penyakit dapat dilakukan dengan cara pencegahan dan
pengobatan. Pencegahan penyakit pada ikan biasanya dilakukan dengan cara
menciptakan lingkungan steril dan pemberian pakan yang bernilai gizi baik.
Pengobatan yang dilakukan pada saat ikan terserang, biasanya diberikan bahan
kimia atau sejenisnya. Akan tetapi penggunaan bahan kimia mempunyai dampak
lingkungan yang kurang baik karena bisa mencemari lingkungan (Wiyanto, 2010).
Penggunaan bahan kimia seperti antibiotik juga sering menimbulkan
konsumen. Untuk menghindari hal tersebut, salah satu alternatif yang dapat
dilakukan adalah penggunaan anti bakterial lain yang bersifat alami dan efektif
untuk membunuh dan menghambat pertumbuhan bakteri atau fungi, ramah
lingkungan dan mudah terurai di perairan. Pemanfaatan bahan-bahan dari alam,
yang salah satunya diketahui mengandung senyawa antibakterial adalah tumbuhan
mangrove (Maryani dkk., 2002).
Tumbuh-tumbuhan di ekosistem mangrove dimanfaatkan oleh penduduk
pesisir dan pulau-pulau sebagai bahan obat sejak lama baik kulit, buah maupun
daunnya. Ekstrak dan bahan mentah dari berbagai tumbuhan mangrove selain
digunakan dalam keperluan pengobatan juga digunakan sebagai bahan tradisional
insektisida dan pestisida. Tumbuhan mangrove mengandung senyawa seperti
alkaloid, flavonoid, fenol, terpenoid, steroid dan saponin. Golongan senyawa ini
merupakan bahan yang dapat digunakan untuk racun ikan, antimikrobial, anti
kanker dan anti leukimia (Kordi, 2012). Hasil penelitian yang dilakukan oleh
Ningsih dkk. (2006) menyimpulkan bahwa ekstrak kasar metanol kulit batang
Rhizophora mucronata mengandung senyawa golongan alkaloid yang terdeteksi
dengan pereaksi Dragendrof. Ekstrak kasar metanol kulit batang ini diperkirakan
mengandung golongan senyawa tertentu yang dapat menghambat pertumbuhan
bakteri Escherichia coli.
Penelitian terhadap tumbuhan mangrove famili Rhizophoraceae, di
antaranya pada spesies R. mucronata belum banyak dilaporkan, terutama kajian
senyawa kimia kulit batangnya yang berpotensi sebagai antibakterial pada
penyakit ikan. Berdasarkan uraian di atas maka penelitian ini dilakukan untuk
pertumbuhan bakteri A. hydrophila, S. agalactiae dan jamur Saprolegnia sp. yang
merupakan penyebab penyakit bakterial dan mikotik pada ikan.
Perumusan Masalah
1. Senyawa kimia apa yang terkandung dalam ekstrak kulit batang R. mucronata?
2. Apakah ekstrak kulit batang R. mucronata dapat menghambat pertumbuhan
bakteri dan jamur patogen pada ikan?
3. Apakah ekstrakkulit batang R. mucronata toksik terhadap Artemia salina
Leach?
Kerangka Pemikiran
A. hydrophila, S. agalactiae dan jamur Saprolegnia sp. merupakan
penyebab penyakit bakterial dan mikotik pada ikan budidaya yang dapat membuat
ikan menjadi cacat bahkan mengalami kematian sehingga dapat mengurangi
keuntungan usaha. Penanggulangan agen penyebab penyakit pada ikan ini dapat
dilakukan dengan dua cara yaitu pencegahan dan pengobatan. Pencegahan
dilakukan apabila ikan belum terserang penyakit yaitu dengan cara menciptakan
lingkungan steril dan pemberian pakan yang bernilai gizi baik. Sedangkan
pengobatan dilakukan apabila ikan telah mengalami serangan oleh
mikroorganisme patogen tersebut.
Pengobatan pada ikan umumnya dilakukan dengan pemberian antibiotik
yang memiliki dampak resistensi terhadap bakteri dan jamur patogen penyebab
penyakit pada ikan, pencemaran terhadap lingkungan perairan bahkan residu pada
ikan yang dapat membahayakan konsumen. Sebagai alternatifnya dilakukan
pengobatan alami dengan terapi herbal yang salah satunya adalah dengan ekstrak
dapat memberikan informasi tentang senyawa metabolit sekunder yang berpotensi
sebagai antibakteri serta toksisitas ekstrak kulit batang R. mucronata ini melalui
Brine Shrimp Letality Test. Berdasarkan permasalahan di atas kerangka pemikiran
penelitian ini dapat dilihat pada Gambar 1
Gambar 1. Kerangka pemikiran penelitian
Tujuan Penelitian
1. Mengidentifikasi senyawa kimia yang terkandung dalam ekstrak kulit batang
R. mucronata.
2. Mengetahui daya antibakteri ekstrak kulit batang R. mucronata terhadap
bakteri uji Aeromonas hydrophila, Streptococcusagalactiae dan jamur
Saprolegnia sp. secara in vitro.
Bakteri dan Jamur Penyebab Penyakit Pada Ikan
Aeromonas hydrophila Streptococus
agalactiae
Saprolegnia sp.
Pengendalian Bakteri dan Jamur Penyebab Penyakit
Antibiotik/Bahan ekstrak kulit batang R. mucronata
Uji fitokimia Untuk Senyawa kimia yang terkandung dalam
3. Mengetahui daya toksisitas ekstrak kulit batang R. mucronata dengan metode
uji Brine Shrimp (A. salina Leach).
Manfaat
1. Sebagai bahan masukan bagi pembudidaya ikan tentang penggunaan ekstrak
kulit batang R. mucronata dalam mengendalikan penyakit bakterial dan
mikotik khususnya yang disebabkan oleh A. hydrophila, S. agalactiae dan
jamur Saprolegnia sp.
2. Sebagai bahan pertimbangan bagi pengambil keputusan dalam menerapkan
kebijakan yang berkaitan dengan penggunaan obat-obatan kimia yang resisten
dan mencemari lingkungan dalam kegiatan produksi perikanan budidaya.
Hipotesis Penelitian
1. Ekstrak kulit batang R. mucronata mengandung senyawa kimia terpenoid,
steroid, saponin, alkaloid, senyawa golongan fenolik (tanin dan flavanoid).
2. Ekstrak kulit batang R. mucronatadapat menghambat pertumbuhan bakteri A.
hydropila, S. agalactiae dan jamur Saprolegnia sp.karena mengandung
senyawa antibakteri.
3. Ekstrak kulit batang R. mucronata menunjukkan toksisitas yang rendah
TINJAUAN PUSTAKA
Deskripsi Tumbuhan Rhizophora mucronata
Bakau Rhizophora mucronata atau dikenal dengan nama bakau hitam
ialah nama sekelompok tumbuhan di hutan mangrove dari genus Rhizophora dan
famili Rhizophoraceae. Berdasarkan identifikasi Kusmana dkk. (2003) di Teluk
Bintuni, Irian jaya, R. mucronata mampu tumbuh hingga mencapai diameter 35
cm dengan tinggi 30 m. Batang berdiri tegak, tidak berlekuk, tidak berpilin, dan
tidak berbenjol. Kulit luar berwarna abu-abu terang, retak-retak membentuk
persegi empat dengan tepi terangkat, bersisik, dan mengelupas. Jenis ini
mempunyai daun tunggal dengan susunan opposite (daun berpasangan pada
ketinggian yang sama pada masing masing sisi ranting). Bentuk daun elliptical
membesar dengan ukuran panjang 16 – 22 cm, lebar 8 – 11 cm. Septa ujung daun
acute (runcing) dan pangkal daun cuneate (meruncing). Ujung daun memiliki
mucro (jarum). Permukaan atas daun bewarna hijau, sedang permukaan bawah
hijau kekuningan dan berbintik-bintik hitam. Bunga tersusun menggarpu dengan 2
– 3 bunga. Calyx bewarna krem sampai kuning dan petal bewarna krem sampai
putih. R. mucronata umumnya tumbuh di pinggiran sungai yang digenangi air
pasang agak besar.
Buah R. mucronata berdiameter 2 – 2,3 cm dengan panjang panjang 50 –
70 cm, berwarna hijau sampai dengan hijau kekuningan. Kotiledon kuning saat
masak dengan permukaan berkutil, hipokotil menempel di bawah kotiledon,
Sistem perakaran berupa akar tunjang (Setyawan dkk., 2002). Secara visual,
(a) (b) (c)
Gambar 2. (a) Akar R. mucronata, (b) Kulit batang R. mucronata, (c) Bunga dan daun R. mucronata.
R. mucronata banyak dimanfaatkan dalam bidang kesehatan karena
memiliki khasiat untuk menyembuhkan beberapa penyakit seperti beri-beri,
haematoma, hepatitis dan borok (Kordi, 2012). Selain itu, Harwoko dan Utami
(2010) telah menunjukkan dalam penelitiannya bahwa Fraksi n-heksana:
kloroform dari ekstrak metanol kulit batang R. mucronata memiliki aktivitas
sitotoksik pada sel kanker myeloma dengan nilai IC50
Senyawa Fitokimia
sebesar 15 μg/mL serta
kandungan kimia dalam fraksi tersebut adalah senyawa flavonoid dan terpenoid.
Diastuti dan Suwandri (2009) menyatakan bahwa ekstrak metanol kulit batang R.
mucronata juga mengandung senyawa terpenoid. Ningsih dkk. (2006) juga
melaporkan bahwa senyawa golongan alkaloid terkandung di dalam ekstrak kasar
metanol kulit batang R. mucronata.
Senyawa fitokimia merupakan zat atau senyawa kimia metabolit sekunder
dari tiap tanaman (Sirait, 2007). Uji fitokimia dilakukan untuk mengetahui secara
kualitatif adanya golongan senyawa aktif dalam tumbuhan yang diharapkan dapat
bahwa senyawa metabolit sekunder merupakan senyawa kimia yang umumnya
mempunyai kemampuan bioaktifitas dan berfungsi sebagai pelindung tumbuhan
tersebut dari gangguan hama penyakit untuk tumbuhan itu sendiri atau
lingkungannya. Senyawa-senyawa kimia yang merupakan hasil metabolisme
sekunder pada tumbuhan sangat beragam dan dapat diklasifikasikan dalam
beberapa golongan senyawa bahan alam yaitu saponin, steroid, triterpenoid,
alkaloid, fenolik (tanin dan flavanoid).
Saponin adalah glikosida triterpenoid dan sterol. Saponin berasal dari
bahasa latin “sapo” yang berarti sabun, diberi nama demikian karena sifatnya
yang menyerupai sabun. Saponin adalah senyawa aktif permukaan yang kuat yang
menimbulkan busa jika dikocok dalam air dan pada konsentrasi yang rendah
sering menyebabkan hemolisis sel darah merah. Dalam larutan yang sangat encer
saponin sangat beracun untuk ikan, dan tumbuhan yang mengandung saponin
telah digunakan sebagai racun ikan selama beratus-ratus tahun. Beberapa saponin
juga bekerja sebagai antimikroba (Robinson, 1995). Senyawa saponin dapat
bersifat antibakteri dengan merusak membran sel. Rusaknya membran
menyebabkan substansi penting keluar sel dan juga dapat mencegah masuknya
bahan-bahan penting ke dalam sel. Jika fungsi membran sel dirusak maka akan
mengakibatkan kematian sel (Monalisa dkk., 2011). Oesman dkk. (2010)
menyatakan bahwa saponin adalah senyawa polar yang keberadaanya dalam
tumbuhan dapat diekstraksi dengan pelarut semi polar dan polar.
Steroid adalah senyawa organik lemak sterol tidak terhidrolisis yang dapat
dihasilkan dari reaksi penurunan dari terpena atau skualena. Steroid merupakan
inggris: saturated tetracyclic hydrocarbon: 1,2 –
cyclopentano-perhydro-phenanthrene) dengan 17 atom karbon dan 4 cincin (Dwilistiani, 2013). Monalisa
dkk. (2011) menyatakan dalam penelitiannya bahwa senyawa steroid yang
terkandung dalam ekstrak daun tapak liman merupakan senyawa antibakteri
terhadap Staphylococcus aureus dan Salmonella typhi dengan konsentrasi ekstrak
daun tapak liman 20%. Mekanisme kerja antibakteri senyawa steroid yaitu dengan
cara merusak membran sel bakteri.
Triterpenoid adalah senyawa dengan kerangka karbon yang disusun dari 6
unit isoprene dan dibuat secara biosintesis dari skualen, suatu C30
Flavanoid adalah senyawa yang terdiri atas C
hidrokarbon
alisiklik. Senyawa tersebut mempunyai struktur siklik yang relatif kompleks,
kebanyakan merupakan suatu alkohol, aldehid atau asam karboksilat. Senyawa
tersebut tidak berwarna, kristalin, sering mempunyai titik lebur tinggi, Triterpen
dapat ditemukan pada resin, kulit kayu, dan dalam lateks (Sirait, 2007). Menurut
Heinrich dkk. (2009), triterpen juga merupakan komponen resin dan eksudat resin
dari tanaman yang diproduksi jika pohon menjadi rusak sebagai perlindungan
fisik terhadap serangan fungi dan bakteri. Selain itu, banyak komponen terpenoid
resin ini memiliki aktivitas antimikroba yang tinggi, baik membunuh mikroba
yang berpotensi menyerang maupun memperlambat pertumbuhannya hingga
pohon dapat memperbaiki kerusakannya.
6 – C3 – C6. Flavanoid
umumnya terdapat pada tumbuhan sebagai glikosida. Flavanoid terdapat pada
seluruh bagian tanaman, termasuk pada buah, tepung sari, dan akar. Kegunaan
flavanoid untuk tumbuhan diantaranya adalah untuk menarik serangga, yang
membantu penyebaran biji (Sirait, 2007). Monalisa dkk. (2011) juga menyatakan
bahwa Senyawa flavonoid dapat menggumpalkan protein, senyawa flavonoid juga
bersifat lipofilik, sehingga dapat merusak lapisan lipid pada membran sel bakteri.
Fenolik merupakan senyawa yang mengandung fenol (senyawa turunan
fenol) yang secara kimiawi telah diubah untuk mengurangi kemampuannya dalam
mengiritasi kulit dan meningkatkan aktivitas antibakterinya. Aktivitas antimikroba
senyawa fenolik adalah dengan merusak lipid pada membran plasma
mikroorganisme sehingga menyebabkan isi sel keluar (Pratiwi, 2008). Kemudian
Septiadi dkk. (2013) menyatakan dalam penelitiannya bahwa senyawa fenolik
bersifat fungistatik yang dapat mendenaturasi protein dinding jamur Candida
albicans yang menyebabkan kerapuhan pada dinding sel tersebut sehingga mudah
ditembus zat aktif lainnya yang bersifat fungistatik. Jika protein yang
terdenaturasi adalah protein enzim maka enzim tidak dapat bekerja yang
menyebabkan metabolisme dan proses penyerapan nutrisi terganggu.
Tanin ditandai oleh sifatnya yang dapat menciutkan dan mengendapkan
protein dari larutan dengan membentuk senyawa yang tidak larut (Sirait, 2007).
Kadar tanin yang tinggi mungkin mempunyai arti pertahanan bagi tumbuhan,
membantu mengusir hewan pemangsa tumbuhan. Beberapa tanin terbukti
mempunyai aktivitas antioksidan, menghambat pertumbuhan tumor dan
menghambat enzim seperti enzim reverse transkriptase dan DNA topoisomerase.
Tanin juga dapat meracuni hati (Robinson, 1995). Tanin tersebar luas dalam
tumbuhan berpembuluh, dalam angiospermae terdapat khusus dalam jaringan
kayu. Dalam industri, tanin adalah senyawa yang berasal dari tumbuhan, yang
kemampuannya menyambung silang protein. Di dalam tumbuhan, letak tanin
terpisah dari protein dan enzim sitoplasma, tetapi bila jaringan rusak, misalnya
bila hewan memakannya, maka reaksi penyamakan dapat terjadi. Reaksi ini
menyebabkan protein lebih sukar dicapai oleh cairan pecernaan hewan. Sebagian
besar tumbuhan yang banyak bertanin dihindari oleh hewan pemakan tumbuhan
karena rasanya yang sepat (Rustaman dkk., 2006). Secara garis besar tanin terbagi
menjadi dua golongan: tanin dapat terhidrolisis, yang terbentuk dari esterifikasi
gula (misalnya glukosa) dengan asam fenolat sederhana yang merupakan tanin
turunan sikimat (misalnya asam galat), dan tanin tidak terhidrolisis yang kadang
disebut tanin terkondensasi, yang berasal dari reaksi polimerasi (kondensasi) antar
flavanoid (Heinrich dkk., 2009).
Alkaloid adalah senyawa kimia tanaman hasil metabolisme sekunder, yang
terbentuk berdasarkan prinsip pembentukan campuran. Alkaloid dapat ditemukan
pada daun, kuncup muda, akar, pada getah yang diproduksi di tabung-tabung
getah dalam epidermis dan sel-sel yang langsung di bawah epidermis seperti pada
korteks. Oleh sebab itu, untuk simplisia-simplisia alkaloid digunakan akar, daun,
buah, biji dan kulit (Sirait, 2007). Rustaman dkk. (2006) menyatakan bahwa
alkaloid merupakan senyawa organik siklik yang mengadung nitrogen dengan
bilangan oksidasi negatif, yang penyebarannya terbatas pada makhluk hidup.
Alkaloid juga merupakan golongan zat metabolit sekunder yang terbesar, yang
pada saat ini telah diketahui sekitar 5500 buah. Alkaloid pada umumnya
mempunyai keaktifan fisiologi yang menonjol, sehingga oleh manusia alkaloid
Ekstraksi
Ekstraksi terhadap bahan tanaman bertujuan untuk memisahkan senyawa
bioaktif tanaman (biasanya dari senyawa tunggal atau kelompok senyawa).
Sebelum dilakukan proses ekstraksi sampel dikecilkan ukurannya untuk
memudahkan kontak dengan pelarut sehingga diharapkan semakin banyak
senyawa bioaktif yang dapat terekstrak (Sari, 2008).
Ekstrak adalah sediaan kering, kental atau cair dibuat dengan penyari
simplisia menurut cara yang cocok, di luar pengaruh cahaya matahari langsung.
Ekstrak kering harus mudah digerus menjadi serbuk (BPOM RI, 2010). Ekstraksi
terdiri atas tahap penghancuran sampel, maserasi, penyaringan dan evaporasi.
Penghancuran bertujuan untuk memperkecil ukuran partikel sehingga
meningkatkan kontak antara bahan dengan pelarutnya. Maserasi adalah proses
perendaman sampel dalam pelarut dengan waktu tertentu sehingga senyawa dalam
sampel larut dalam pelarut tersebut dan umumnya proses maserasi dibantu dengan
pengadukan. Pengadukan dimaksudkan untuk mencapai waktu ekstraksi yang
lebih singkat. Teknik ekstraksi didasarkan pada kenyataan bahwa jika suatu zat
dapat larut dalam dua fase yang tercampur, maka zat itu dapat dialihkan dari satu
fase ke-fase lainnya dengan mengocoknya bersama-sama. Beberapa pertimbangan
dalam memilih pelarut yaitu:
1) Pelarut polar akan melarutkan senyawa polar dan pelarut non-polar akan
melarutkan senyawa non-polar,
2) Pelarut organik cenderung melarutkan senyawa organik,
3) Air cenderung melarutkan senyawa anorganik dan garam dari asam maupun
4) Asam-asam organik yang larut dalam pelarut organik dapat diekstraksi ke
dalam air dengan menggunakan basa (NaOH, Na2CO3 dan NaHCO3
Penyaringan bertujuan memisahkan sampel dengan senyawa bioaktif yang larut
dalam pelarutnya. Evaporasi dilakukan untuk menguapkan pelarut sehingga
ekstrak dapat terpisah dengan pelarutnya dan dilakukan pada suhu 30 – 40 ).
o
Bakteri Aeromonas hydrophila
C
untuk mengurangi kerusakan senyawa aktif pada suhu tinggi (Sari, 2008).
Bakteri Aeromonas hydrophila termasuk dalam famili Pseudomonadaceae
yang bersifat patogen dan dapat menyebabkan penyakit bercak merah atau
septicemia haemorrhagica pada ikan. Bakteri Aeromonas umumnya hidup di air
tawar yang mengandung bahan organik tinggi. Ciri utama bakteri Aeromonas
adalah bentuknya seperti batang, ukurannya 1 – 4 x 0,4 – 1 mikron, bersifat gram
negatif, fakultatif aerobik (dapat hidup dengan atau tanpa oksigen), tidak
berspora, bersifat motil (bergerak aktif) karena mempunyai satu flagel
(monotrichous flagella) yang keluar dari salah satu kutubnya, senang hidup di
lingkungan bersuhu 15 – 30 0C dan pH antara 5,5 – 9. Beberapa hewan akuatik
yang telah diserang oleh bakteri A. hydrophila menunjukkan gejala-gejala infeksi
yang sama, yaitu: warna tubuh ikan menjadi gelap, kemampuan berenang
menurun, mata ikan rusak dan agak menonjol, sisik terkuak, seluruh siripnya
rusak, insang berwarna merah keputihan, ikan terlihat megap-megap di
permukaan air, insangnya rusak sehingga sulit bernapas, kulit ikan menjadi kasat
dan timbul pendarahan selanjutnya diikuti dengan luka borok, perut kembung
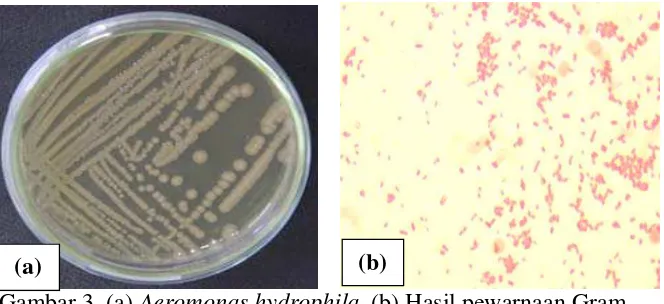
serta limpa (Kordi, 2004). Pertumbuhan A. hydrophila pada media TSA dan hasil
pewarnaan gramnya dapat dilihat pada Gambar 3.
Gambar 3. (a) Aeromonas hydrophila (b) Hasil pewarnaan Gram.
Yuhana dkk. (2008) mengemukakan bahwa ikan yang terserang bakteri ini
akan mengalami pendarahan pada bagian tubuh terutama di bagian dada, perut,
dan pangkal sirip. Penyebaran penyakit ini terjadi secara horizontal, yaitu melalui
air yang telah terkontaminasi bakteri A. hydrophila atau dari ikan yang sakit.
Apabila sudah terdapat gejala klinis yang parah, maka ikan harus segera
dimusnahkan karena sifat penyakitnya yang mudah menular.
Bakteri Streptococcusagalactiae
Menurut Kordi (2004), bakteri Streptococcus agalactiae merupakan
bakteri gram positif yang dapat menyebabkan penyakit pendarahan pada mata
(streptococcis). Menurut Hardi dkk. (2011), bakteri Streptococcus agalactiae
termasuk gram positif, memiliki dua tipe hemolitik yaitu β-hemolitik dan
non-hemolitik. Kemampuan menghidrolisis gula kedua tipe bakteri bervariatif, bakteri
tipe β-hemolitik memiliki kamampuan menghidrolisis gula lebih banyak termasuk
arabinose, sorbitol, lactose, trehalose dibandingkan dengan tipe non-hemolitik.
Bakteri S. agalactiae dapat menyebabkan sakit pada ikan yang dapat dilihat secara
makroskopis maupun mikroskopis. Perubahan pada mata (mata mengkerut, pupil
mata mengecil, mata seperti berkabut (opacity), purulens hingga sebelah mata
dapat hilang). Pembengkakan mata atau eksoptalmia yang disertai dengan
pendarahan juga dapat ditemui pada mata ikan yang terinfeksi S. agalactiae.
perubahan warna yang menghitam, ulcer, abses pada perut dan perubahan pola
renang (whirling dan gasping) dapat menjadi indikasi adanya infeksi. Koloni
bakteri Streptococcus agalactiae pada perbenihan agar darah berbentuk bulat,
berwarna transparan dengan permukaan cembung, pada pewarnaan gram bakteri
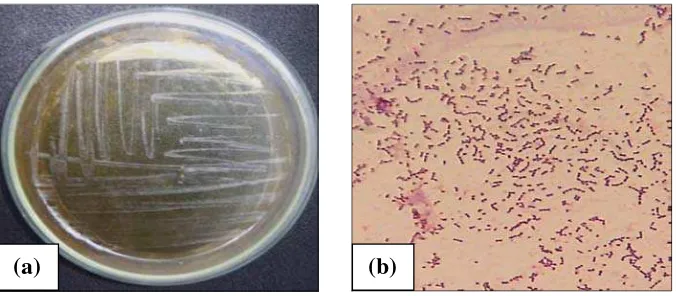
ini bersifat gram positif dan berbentuk bulat (Poeloengan, 2009). Pertumbuhan S.
agalactiae pada media BHIA dan hasil pewarnaan gramnya dapat dilihat pada
Gambar 4.
Gambar 4. (a) Streptococcus agalactiae, (b) Hasil pewarnaan Gram.
Jamur Saprolegnia sp.
Saprolegnia sp. adalah jenis jamur yang terdapat di seluruh dunia dan
hidup di perairan tawar. Jamur Saprolegnia sp. dapat menyerang sebagian besar
ikan air tawar tetapi umumnya ikan mas, tawes, gabus, gurami, nila dan lele dan
menyebabkan penyakit Saprolegniasis (Kordi, 2004).
Saprolegnia sp. memiliki hifa berdiameter 25 – 29 μm. Sporangiumnya
berbentuk memanjang dan menggembung yang merupakan diferensiasi dari hifa
vegetatif. Spora berkembang memadati sporangium dan bergerak dari arah hifa
menuju sporangium dengan ukuran spora 3 – 5 μm (Suhendi, 2009). Berikut
adalah pertumbuhan Saprolegnia sp. pada media PDA dan bentuk hifa hasil
pengamatan mikroskopis yang dapat dilihat pada Gambar 5.
Gambar 5. (a) Pertumbuhan Saprolegnia sp. pada media PDA, (b) Saprolegnia sp. pada hasil pengamatan mikroskopis.
Ikan dan telur ikan yang terserang jamur ini dapat diketahui dengan
mudah, sebab terlihat bagian organ ikan (biasanya bagian luar) atau telur yang
terserang ditumbuhi oleh sekumpulan mycelium jamur yang menyerupai
gumpalan benang-benang halus (hype) yang tampak seperti kapas sehingga
disebut white cottony growth. Kumpulan benang ini biasanya terlihat di bagian
kepala, tutup insang atau di sekitar sirip. Pada ikan dewasa biasanya diserang pada
bagian kulit yang telah terluka, sedangkan telur ikan yang terserang akan terlihat
seperti dilapisi kapur (Kordi, 2004).
Antimikroba
Menurut Pelczar and Chan (1988), Antimikroba merupakan bahan atau
senyawa yang mengganggu pertumbuhan dan metabolisme mikroba. Dalam
penggunaan umum, istilah ini menyatakan penghambatan pertumbuhan dan bila
dimaksudkan untuk kelompok-kelompok organisme yang khusus, maka seringkali
digunakan istilah-istilah seperti antibakterial dan antifungal. Berdasarkan sifatnya
maka bahan antimikrobial dapat bersifat bakterisida (suatu bahan yang dapat
mematikan bentuk-bentuk vegetatif bakteri) dan bakteriostatis (suatu bahan yang
dapat menghambat pertumbuhan bakteri).
Mekanisme penghambatan mikroba oleh senyawa antimikroba sebagai
berikut: (1) merusak dinding sel sehingga mengakibatkan lisis atau menghambat
proses pembentukan dinding sel pada sel yang sedang tumbuh; (2) mengubah
permeabilitas membran sitoplasma yang menyebabkan kebocoran nutrien dari
dalam sel; (3) mendenaturasi protein sel; (4) merusak sistem metabolisme di
dalam sel dengan cara menghambat kerja enzim intraseluler (Poeloengan dkk.,
2006). Menurut Sufriadi (2006), ada beberapa faktor yang mempengaruhi
efektivitas dari suatu antimikroba yaitu konsentrasi, suhu, waktu, sifat fisik, dan
kimia subtrat (pH, kadar air, jenis, dan jumlah zat terlarut). Adanya aktivitas
antimikroba dapat dilihat dari terbentuknya zona bening disekitar kertas cakram.
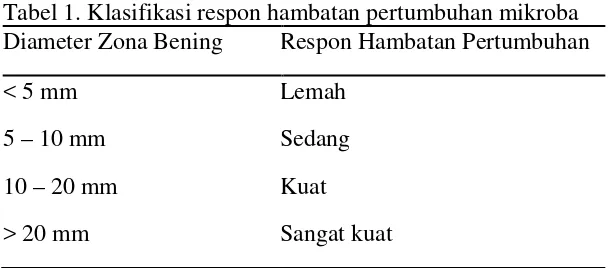
Klasifikasi respon hambatan pertumbuhan mikroba terhadap suatu senyawa
antimikroba dapat dilihat pada Tabel 1.
Tabel 1. Klasifikasi respon hambatan pertumbuhan mikroba Diameter Zona Bening Respon Hambatan Pertumbuhan
< 5 mm Lemah
5 – 10 mm Sedang
10 – 20 mm Kuat
> 20 mm Sangat kuat
Sumber: Suryawiria (1978) diacu oleh Indriani (2007).
Uji Brine Shimp Lethality Test
Brine Shrimp Lethality Test (BSLT) merupakan salah satu metode skrining
2011). Pengujian terhadap kadar toksisitas ekstrak tanaman dilakukan dengan
mengamati tingkat kematian (mortalitas) yang ditimbulkan oleh ekstrak terhadap
larva udang jenis Artemia salina Leach setelah dilakukan pengujian selama 24
jam (Hayati dan Nur, 2010). Larva udang tersebut sangat peka terhadap apapun
yang berada di lingkungannya dan berkembang dengan sangat cepat menyerupai
pertumbuhan sel kanker. Keadaan membran kulitnya yang sangat tipis
memungkinkan terjadinya difusi zat dari lingkungan yang mempengaruhi
metabolisme dalam tubuhnya. Oleh karena itu, penambahan zat ekstraktif yang
diduga mengandung senyawa bioaktif yang juga berpotensi sebagai senyawa obat
diharapkan mampu mengganggu metabolisme dan menyebabkan kematian larva
udang (Meilani, 2006).
Brine Shrimp Lethality Test (BSLT) dipilih karena sering digunakan untuk
praskrining terhadap senyawa aktif yang terkandung dalam ekstrak tumbuhan
karena sederhana, cepat, murah, mudah, dapat dipercaya dan hasilnya
representatif. Hasil uji bersifat toksik/aktif terhadap A. salina Leach bila ekstrak
tumbuhan tersebut memiliki nilai LC50 < 1000 µg/mL (Meyer dkk., 1982).
METODE PENELITIAN
Waktu dan Tempat
Penelitian dilaksanakan dari bulan September – Nopember 2013.
Pembuatan ekstrak dan pengujian fitokimia kulit batang R. mucronata di
Laboratorium Kimia Bahan Alam, Fakultas Matematika dan Ilmu Pengetahuan
Alam, Universitas Sumatera Utara. Pengujian efektivitas antibakteri di Stasiun
Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Medan
II. Pengujian Brine Shrimp dilakukan di Unit Pelayanan Teknis (UPT) Budidaya
Ikan, Dinas Perikanan dan Kelautan Kota Medan.
Alat dan Bahan
Alat yang dibutuhkan dalam penelitian ini adalah pisau, timbangan
analitik, stoples kaca, gelas ukur, corong, blender, erlenmeyer, vortex, aluminium
foil, rotary evaporator, spatula, cawan petri, karet gelang, pipet tetes, tabung
reaksi, rak tabung reaksi, hot plate, ayakan, beaker glass, cotton bud, autoclave,
laminar air flow, refrigerator/lemari es, sprayer, api bunsen, jarum ose, pinset,
magnetic stirrer, tisu, kapas, kertas cakram, mikropipet, jangka sorong, inkubator,
waterbath (penangas air), botol vial, plat TLC, kamera digital dan alat tulis.
Adapun bahan yang digunakan adalah pelarut n-heksana (non polar), etil
asetat (semi polar), metanol (polar), kulit batang R. mucronata, akuades steril,
alkohol 70%, spiritus, biakan A. hydrophila diperoleh dari Balai Karantina Ikan
Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Medan II, S.
agalactiae diperoleh dari Balai Penelitian dan Pengembangan Budidaya Air
Mikrobiologi, Fakultas MIPA Universitas Sumatera Utara, kista Artemia salina,
besi (III) klorida (FeCl3) 1%, cerium sulfat (CeSO4
Persiapan dan Ekstraksi Kulit Batang R. mucronata
) 1%, pereaksi dragendorf,
pereaksi bouchardat, pereaksi mayer, pereaksi wagner, standar triterpenoid dan
ß-sitosterol, HCl 2 N, air laut, Dimethyl sulfoxide (DMSO), Potato Dextrose Agar
(PDA), Tryptic Soy Agar (TSA), kloramfenikol, nistatin, larutan Mc. Farland 0.5,
larutan NaCl 0,9 %.
Kulit batang tumbuhan R. mucronata dikumpulkan sebanyak 9 kg dalam
berat basah dari kawasan hutan mangrove desa Denai Kuala, Kec. Pantai Labu,
Kab. Deli Serdang. Kulit batang R. mucronata dicuci dengan air mengalir dan
dipotong kecil-kecil kemudian dikeringkan selama 7 hari dengan cara
diangin-anginkan untuk mengurangi penguapan yang mengikutkan senyawa yang
terkandung di dalamnya. Proses pengeringan ini bertujuan menurunkan kadar air
sehingga tidak mudah ditumbuhi kapang dan bakteri serta menghilangkan
aktivitas enzim yang dapat menguraikan lebih lanjut kandungan zat aktif yang
terdapat di kulit batang tumbuhan tersebut (Gunawan dan Sri, 2004). Kulit batang
yang sudah kering selanjutnya dipotong menjadi potongan yang lebih kecil agar
mudah dihaluskan dengan blender hingga berbentuk serbuk. Serbuk selanjutnya
diayak menggunakan ayakan hingga diperoleh serbuk yang halus dan seragam.
Serbuk hasil ayakan sebanyak 1,47 kg kemudian disimpan ke dalam stoples kaca
karena tidak langsung digunakan untuk proses selanjutnya (Lampiran 1).
Langkah selanjutnya adalah ekstraksi bahan aktif. Ekstraksi merupakan
suatu proses penarikan komponen atau zat aktif menggunakan pelarut tertentu
dilakukan dengan metode maserasi yaitu proses pengambilan senyawa zat aktif
yang dilakukan dengan cara merendam serbuk dalam pelarut yang sesuai dengan
kepolarannya. Dalam penelitian ini digunakan tiga pelarut dengan kepolaran
berbeda yaitu n-heksana (non polar), etil asetat (semi polar) dan metanol (polar).
Serbuk sampel masing-masing sebanyak 300 g direndam dengan 1 liter pelarut
etil asetat dan 1 liter pelarut metanol dan sebanyak 870 g direndam dengan 1,5
liter n-heksana di dalam erlenmeyer. Erlenmeyer yang berisi rendaman tersebut
kemudian ditutup dengan alumunium foil selama 24 jam sambil sesekali diaduk
untuk mempercepat kontak antara sampel dengan pelarut. Setelah itu sampel
disaring dengan kapas sehingga diperoleh filtrat dan ampas. Filtrat yang diperoleh
kemudian pelarutnya dievaporasi menggunakan rotary evaporator sehingga
diperoleh ekstrak kental dari kulit batang R. mucronata. Ekstrak kental yang
diperoleh tersebut dipekatkan dengan penangas air (water bath) agar seluruh
pelarutnya habis menguap dan diperoleh ekstrak pekat/kering. Ekstrak tersebut
kemudian disimpan di dalam botol vial tertutup (Lampiran 1).
Uji Fitokimia
Analisis fitokimia merupakan uji kualitatif untuk mengetahui keberadaan
golongan senyawa-senyawa aktif yang terkandung dalam ekstrak kulit batang R.
mucronata. Analisis fitokimia dilakukan berdasarkan metode Depkes (2009) yang
diacu oleh Tirtana dkk. (2013). Identifikasi kandungan kimia dalam ekstrak kulit
batang R. mucronata dilakukan terhadap senyawa-senyawa:
a. Saponin
Larutan ekstrak sebanyak 2 ml ditambahkan akuades, kemudian dikocok
stabil dan tidak kurang dari 10 menit. Pada penambahan 1 tetes HCl 2 N, busa
tidak hilang.
b. Steroid/ triterpenoid
Sebanyak 2 ml larutan ekstrak dimasukkan ke dalam tabung reaksi
kemudian ditambah dengan pereaksi Lieberman-Burchard. Senyawa steroid
menimbulkan warna hijau dan triterpenoid menimbulkan warna ungu.
Untuk pengujian menggunakan CeSO4 1% dilakukan dengan metode Thin Layer Chromatography (TLC). Plat TLC diberi tanda sesuai dengan nama pelarut
yang digunakan dalam ekstraksi. Plat TLC kemudian dibagi menjadi 3 bagian
untuk diteteskan ekstrak sampel, standar triterpenoida dan β-sitosterol.
Selanjutnya tetesan ekstrak tersebut disemprot dengan penampak noda atau
pereaksi CeSO4
c. Senyawa golongan fenolik (tanin dan flavanoid)
1% dan plat TLC dipanaskan di atas hot plate. Selanjutnya
diamati perubahan warna yang terjadi dan bandingkan dengan standar
triterpenoida dan β-sitosterol.
Larutan ekstrak sebanyak 2 ml dimasukkan ke dalam tabung reaksi dan
ditambahkan 2 tetes pereaksi besi (III) klorida 1%. Tanin akan menghasilkan
warna biru atau hitam kehijauan. Untuk senyawa flavonoid maka sampel dengan
pelarut etil asetat sebanyak 2 ml dimasukkan ke dalam tabung reaksi dan di
tambahkan 2 tetes pereaksi FeCl3 1%. Larutan positif mengandung flavonoid
d. Alkaloid
Larutan ekstrak sebanyak 2 ml dimasukkan ke dalam tabung reaksi dan
diperiksa adanya senyawa alkaloid dengan pereaksi Dragendorff, Bouchardat,
Mayer dan pereaksi Wagner sebagai berikut:
1. Larutan ekstrak ditambah 2 tetes pereaksi Dragendorf. Larutan positif
mengandung alkaloid jika terbentuk endapan berwarna merah jingga atau
cokelat muda sampai kuning/oranye.
2. Larutan ekstrak ditambah 2 tetes pereaksi Bouchardat. Larutan positif
mengandung alkaloid jika terbentuk endapan berwarna cokelat sampai hitam.
3. Larutan ekstrak ditambah 2 tetes pereaksi Mayer. Larutan positif mengandung
alkaloid jika terbentuk endapan berwarna putih/kuning.
4. Larutan ekstrak ditambah 2 tetes pereaksi Wagner. Larutan positif mengandung
alkaloid jika terbentuk endapan berwarna cokelat.
Uji Aktifitas Antibakteri
Prosedur pengujian aktivitas antibakteri, meliputi :
Pembuatan media pertumbuhan
Media pertumbuhan untuk bakteri A. hydrophila dan S. agalactiae dibuat
dengan menggunakan bubuk TSA sebanyak 24 gram yang dilarutkan dengan 600
ml akuades di dalam Erlenmeyer ukuan 1 liter. Batang magnetic stirrer
dimasukkan ke dalam larutan media agar media teraduk sempurna saat pemanasan
di atas hot plate. Erlenmeyer kemudian ditutup rapat dengan kapas yang
dibungkus alumunium foil. Setelah media mendidih dan berubah menjadi bening,
media dibagi ke dalam 2 erlenmeyer yang berukuran 500 ml dan ditutup rapat
TSA disterilkan di dalam autoklaf selama 15 – 20 menit pada suhu 1210
Untuk pertumbuhan jamur Saprolegnia sp. media yang digunakan adalah
bubuk PDA sebanyak 11,7 gram yang dilarutkan dalam 300 ml akuades. Untuk
proses pembuatannya sama dengan pembuatan media TSA di atas.
C dan
tekanan 1 atm. Setelah media disterilkan, media selanjutnya didiamkan sebentar di
dalam laminar air flow sampai hangat-hangat kuku untuk kemudian dituang
kedalam 30 cawan petri steril. Proses penuangan ini dilakukan di dalam laminar
air flow dan dekat dengan api Bunsen untuk menjaga kesterilan media. Media
TSA kemudian dibiarkan memadat selama 24 jam. Media yang tidak
terkontaminasi selanjutnya dibungkus dengan kertas steril dan disimpan di dalam
lemari pendingin untuk digunakan dalam proses selanjutnya.
Sterilisasi alat dan bahan
Cawan petri, tabung reaksi, cotton bud, kertas cakram, termasuk seluruh
alat dan bahan kecuali ekstrak kulit batang R. mucronata yang akan digunakan
disterilisasi di dalam autoklaf selama 20 menit dengan mengatur tekanan sebesar
15 dyne/ cm3 (1 atm) dan suhu sebesar 1210
Peremajaan bakteri dan jamur
C setelah sebelumnya dicuci bersih,
dikeringkan dan dibungkus dengan kertas (Kusuma, 2012).
Bakteri A. hydropila dan S. agalactiae diremajakan masing-masing pada
media TSA dengan cara menggoreskan jarum ose yang mengandung bakteri A.
hydropila pada 1 cawan petri yang berisi media TSA dan S. agalactiae pada petri
yang lainnya. Penggoresan dilakukan secara aseptis yaitu membakar jarum ose
dengan api Bunsen sampai berpijar sebelum dan sesudah penggoresan, selalu
mengatur jarak jarum ose yang mengandung bakteri dengan api Bunsen agar
bakteri yang akan diremajakan tidak mati. Setelah itu media yang berisi bakteri
tersebut dinkubasi selama 24 – 48 jam pada suhu 370
Untuk peremajaan jamur Saprolegnia sp. dilakukan dengan mengambil
sebagian dari koloni dengan blade dan menanamnya secara aseptis pada media
PDA. Setelah itu diinkubasi pada suhu 27
C.
0
Pembuatan suspensi bakteri dan konsentrasi uji
C sampai hifa tumbuh penuh pada
media tersebut.
Setelah bakteri tumbuh saat peremajaan, bakteri siap untuk dilakukan uji
antibakteri. Tahap pertama yang dilakukan adalah pembuatan suspensi bakteri
dengan cara mengambil biakan menggunakan sengkelit (ose) `dan disuspensikan
dengan cara dimasukan ke dalam tabung berisi 3 ml larutan NaCl 0,9%. Suspensi
yang terbentuk disetarakan dengan larutan baku Mc. Farland 0.5 yang ekuivalen
dengan suspensi sel bakteri dengan konsentrasi 1,5 × 108
Pada penelitian ini konsentrasi larutan uji yang digunakan adalah 20%,
40% dan 60% (b/v). Istilah persen larutan diartikan untuk menunjukkan
pengertian gram dari zat terlarut per 100 ml larutan (Waluyo, 2010). Larutan
dibuat dengan cara menimbang ekstrak kulit batang R. mucronata sebanyak 0,6 g
yang dilarutkan dengan DMSO sebanyak 1 ml. Larutan dengan konsentrasi 40%
dan 20% dibuat dengan cara pengenceran dari konsentrasi 60% dengan DMSO
0,5 ml (lampiran 11). Untuk kontrol negatif digunakan DMSO dan kontrol positif
digunakan kloramfenikol (30 µg/ml) untuk bakteri dan nistatin (100 µg/ml) untuk
jamur.
cfu/ml. (Andrews,
Pengujian daya antibakteri
Pengujian antibakteri dilakukan dengan metode disc diffusion (tes Kirby &
Bauer). Prinsipnya adalah pirinngan yang berisi agen antimikroba diletakkan pada
media agar yang telah ditanami mikroorganisme yang akan berdifusi pada media
agar tersebut. Area jernih mengindikasikan adanya hambatan pertumbuhan
mikroorganisme oleh agen antimikroba pada permukaan media agar (Pratiwi,
2008).
Pada penelitian ini pengujian antibakteri menggunakan blank disc (kertas
cakram kosong) berdiameter 6 mm. Cutton buds steril dimasukkan ke dalam
tabung reaksi yang berisi suspensi bakteri dan diguncang sedikit agar bakteri
teraduk rata kemudian Cutton buds yang mengandung bakteri dioleskan pada
media TSA. Setelah olesan bakteri mengering, kertas cakram yang telah direndam
selama 1 jam pada berbagai konsentrasi ditiriskan dan diletakkan di atas media
yang berisi olesan bakteri dengan sedikit ditekan agar cakram menempel pada
permukaan media. Semuan pengerjaan dilakukan dengan aseptis. Selanjutnya
diinkubasi pada suhu 370
Uji terhadap Saprolegnia sp. dilakukan dengan cara mengambil potongan
kecil miselium dengan bentuk kubus dan menanamkannya di media PDA dengan
posisi di tengah. Kertas cakram kosong yang telah berisi ekstrak dengan berbagai
konsentrasi diletakkan di sekitar potongan jamur tersebut dengan jarak yang sama.
Setelah itu diinkubasi pada suhu 27
C selama 24 jam di inkubator.
0
Penentuan zona hambatan
C selama 3 hari.
Aktivitas antibakteri dinyatakan positif apabila terbentuk zona hambat
negatif apabila tidak terbentuk zona bening. Diameter zona hambat dihitung
dengan rumus sebagai berikut:
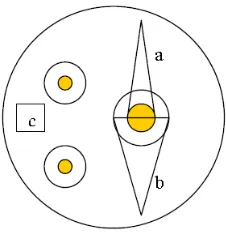
Gambar 6. Perhitungan diameter zona hambat antibakteri
Keterangan:
a = Diameter kertas cakram (mm)
b = Diameter zona hambat yang terbentuk (mm)
c = Daerah yang ditumbuhi bakteri
b + a = Diameter Zona hambat
Untuk aktifitas antifungi ditentukan dengan cara mengukur jari-jari
pertumbuhan hifa normal dikurang dengan jari-jari pertumbuhan hifa yang
terhambat oleh ekstrak.
Gambar 7. Perhitungan jari-jari zona hambat jamur Saprolegnia sp.
Keterangan:
a = Pertumbuhan koloni jamur
b = Zona hambat ekstrak R. mucronata terhadap koloni jamur
b c a
d
c = Blank disc yang telah berisi ekstrak
d = Letak koloni jamur yang ditanam
x = Koloni jamur yang terhambat pertumbuhannya
y = Koloni jamur yang pertumbuhannya normal
y – x = Jari-jari zona hambat
Uji Toksisitas
Uji Toksisitas ini dilakukan dengan metode Brine Shrimp Lethality test
(BST) (Kelana, 2007). Kista Arthemia salina Leach ditetaskan di dalam bejana
yang sudah diisi 3 liter air laut buatan bersalinitas 35 ppt. Bejana kemudian
dilengkapi dengan alat aerasi dan kista dibiarkan menetas pada suhu 250
Larutan induk setiap uji dibuat dengan melarutkan 20 mg sampel dalam 2
ml DMSO. Larutan uji 1000 ppm dibuat dengan memipet larutan induk sebanyak
500 μl, sedangkan larutan uji 100 ppm dan 10 ppm dibuat dengan memipet 50 μl
dan 5 μl dari larutan induk. Masing-masing konsentrasi dibuat 3 ulangan, 3 vial
untuk kontrol positif (DMSO) dan 3 vial untuk kontrol negatif (air laut). Pada
setiap konsentrasi ditambahkan air laut kurang lebih 2 ml kemudian masukkan 10
ekor anak udang ke dalam setiap vial dan cukupkan volumenya sampai 5 ml
dengan air laut. Setelah 24 jam dilakukan pengamatan terhadap kematian A.
salina.
C, setelah
48 jam hewan uji siap untuk digunakan.
Analisis Data
Pada pengujian aktivitas antibakteri data hasil pengukuran zona bening
dirata-ratakan dan dianalisis dengan metode deskipstif dalam bentuk tabel dan
konsentrasi uji terhadap toksisitas A. salina dapat dihitung dengan analisis probit
untuk menetukan LC50. Perhitungan LC50 dilakukan dengan persamaan regresi
linear y = a + bx yang didapatkan dari grafik hubungan antar log konsentrasi
HASIL DAN PEMBAHASAN
Hasil
Uji fitokimia
Dari hasil uji fitokimia pada masing-masing pelarut diketahui bahwa
secara keseluruhan ekstrak kulit batang Rhizophora mucronata mengandung
senyawa metabolit sekunder seperti senyawa fenolik (tanin), steroid/ terpen,
alkaloid dan saponin. Senyawa-senyawa tersebut akan terlarut pada pelarut yang
mempunyai tingkat kepolaran yang sama dengan senyawa tersebut seperti yang
terlihat pada Tabel 2 dan Gambar 8 berikut ini.
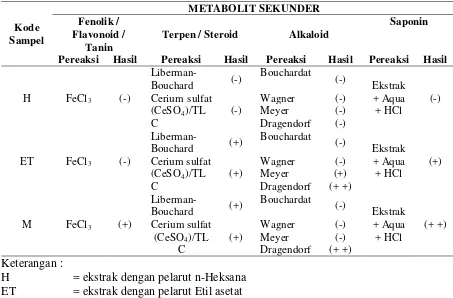
Tabel 2. Hasil identifikasi kandungan fitokimia pada ekstrak kulit batang tumbuhan Rhizophora mucronata
Keterangan :
H = ekstrak dengan pelarut n-Heksana ET = ekstrak dengan pelarut Etil asetat M = ekstrak dengan pelarut Metanol (+ +) = Kuat
Terpen / Steroid Alkaloid
Saponin
Pereaksi Hasil Pereaksi Hasil Pereaksi Hasil Pereaksi Hasil
(a) (b) (c) (d)
(e) (f) (g)
Gambar 8. Hasil uji fitokimia; (a) ekstrak metanol positif saponin (b) ekstrak metanol positif tanin (c) ekstrak metanol positif alkaloid dengan pereaksi Dragendorf (d) ekstrak etil asetat positif alkaloid dengan pereaksi Dragendorf dan (e) dengan pereaksi Meyer (f) ekstrak etil asetat positif saponin (g) ekstrak metanol dan etil asetat positif steroid/terpen pada uji TLC.
Ekstraksi
Ekstraksi dilakukan dengan metode maserasi/perendaman serbuk kulit
batang tumbuhan Rhizophora mucronata menggunakan pelarut n-heksana, etil
asetat dan metanol. Hasil ekstraksi kulit batang tumbuhan Rhizophora mucronata
tersaji dalam Tabel 3 di bawah ini.
Tabel 3. Hasil ekstraksi kulit batang tumbuhan Rhizophora mucronata.
No. Hasil Metanol Etil asetat n-Heksana
1. Berat sampel (gram) 300 300 870
2. Berat ekstrak (gram) 5,0505 1,2183 0,87
3. Bentuk Pasta Pasta kering Pasta agak cair
4. Warna Merah
kehitaman
Cokelat kemerahan
Uji toksisitas artemia
Toksisitas ekstrak kulit batang R. mucronata dapat diketahui dengan
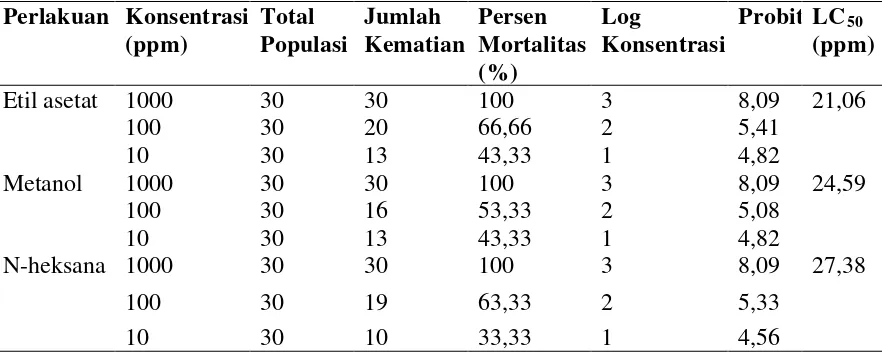
melakukan metode Brine Shrimp Lethality Test (BSLT). Data hasil uji BSLT
ekstrak etil asetat, ekstrak metanol dan ekstrak n-heksana dari kulit batang R.
mucronata disajikan pada Tabel 4 berikut ini.
Tabel 4. Data hasil uji BSLT ekstrak etil asetat, ekstrak metanol dan ekstrak n-heksana dari kulit batang Rhizophora mucronata
Perlakuan Konsentrasi
Pengujian aktivitas antibakteri dilakukan dengan metode difusi cakram
yang menggunakan blank disc ukuran 6 mm. Aktivitas antibakteri dapat terlihat
dengan mengamati zona bening yang terbentuk disekitar cakram dan menghambat
pertumbuhan bakteri setelah masa inkubasi selama 24 jam. Besarnya daya
antibakteri dapat diketahui dengan mengukur zona bening yang terbentuk dan
mengurangkannya dengan diameter blank disc. Zona bening dan Rata-rata
diameter zona hambat ekstrak kulit batang R. mucronata terhadap pertumbuhan
bakteri A. hydrophila dan bakteri S. agalactiae disajikan pada Tabel 5, Gambar 9
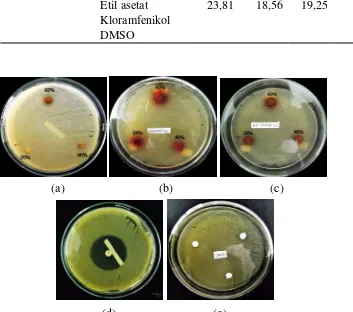
Tabel 5. Rata-rata diameter zona hambat ekstrak kulit batang R. mucronata terhadap bakteri A. hydrophila dan bakteri S. agalactiae
Bakteri Ekstrak dengan pelarut
Rata-rata diameter zona hambat (mm) 60% 40% 20% Kontrol
A. hydrophila Metanol 0 0 0
N-heksana 10,91 7,36 0
Etil asetat 10,58 7,65 7,21
Kloramfenikol 34,88
DMSO 0
S. agalactiae Metanol 15,5 14,2 14,45
N-heksana 0 0 0
Etil asetat 23,81 18,56 19,25
Kloramfenikol 43,4
DMSO 0
(a) (b) (c)
(d) (e)
(a) (b) (c)
(d) (e)
Gambar 10. Hasil pengujian antibakteri terhadap bakteri S. agalactiae; (a) ekstrak dengan pelarut n-heksana (b) ekstrak dengan pelarut metanol (c) ekstrak dengan pelarut etil asetat (d) kontrol positif/kloramfenikol (e) kontrol negatif (DMSO)
Sementara itu hasil pengujian ekstrak kulit batang R. mucronata terhadap
pertumbuhan jamur Saprolegnia sp. menunjukkan bahwa ekstrak tersebut mampu
menghambat pertumbuhan hifa dari jamur tersebut. Besarnya daya hambat
ekstrak kulit batang R. mucronata terhadap pertumbuhan jamur Saprolegnia sp.
dapat diketahui dengan menghitung jari-jari pertumbuhan normal hifa jamur yang
dikurangi dengan jari-jari pertumbuhan hifa jamur yang terhambat oleh ekstrak
kulit batang R. mucronata. Pengamatan terhadap pertumbuhan jamur
Saprolegnia sp. dilakukan selama 3 hari sampai hifa normal tumbuh menutupi
cawan petri. Rata-rata jari-jari zona hambat ekstrak kulit batang R. mucronata
terhadap jamur Saprolegnia sp. dapat dilihat pada Tabel 6 dan Gambar 11 di
Tabel 6. Rata-rata jari-jari zona hambat ekstrak kulit batang R. mucronata terhadap jamur Saprolegnia sp.
Hari ke Konsentrasi Zona hambat (mm) ekstrak R. mucronata dengan berbagai pelarut
Metanol N-heksana Etil asetat Nistatin DMSO
1 60% 4,4 1 4
2 0
40% 3,4 0 3,7
20% 3,4 0 3
Kontrol
2 60% 21 2,6 21,7
2 0
40% 20,6 2,6 20
20% 19,6 1,3 19,4
Kontrol
3 60% 19 0 30,7
0 0
40% 8,7 0 29,4
20% 4,4 0 20
Kontrol
(a) (b) (c)
(d) (e)
Pembahasan Uji fitokimia
Uji fitokimia merupakan salah satu cara untuk mengetahui kandungan
metabolit sekunder pada suatu ekstrak tanaman atau merupakan uji pendahuluan
untuk mengetahui keberadaan senyawa kimia spesifik seperti senyawa alkaloid,
fenolik (tanin dan flavonoid), terpen/steroid, dan saponin. Golongan senyawa
dalam ekstrak dapat ditentukan dengan mengamati perubahan warna dan
terbentuknya endapan setelah ditambahkan pereaksi yang spesifik untuk setiap uji
kualitatif. Pemilihan pelarut dalam proses ekstraksi harus memperhatikan sifat
kandungan kimia bahan yang akan diekstrak. Dengan mengetahui sifat metabolit
yang akan diekstrak dapat dipilih pelarut yang sesuai berdasarkan kepolaran
zatnya (Sari, 2008). Dalam penelitian ini digunakan pelarut dengan tingkat
kepolaran yang berbeda yaitu pelarut metanol (polar), etil asetat (semi polar) dan
n-heksana (nonpolar).
Dari hasil uji fitokimia (Tabel 2) diketahui bahwa senyawa alkaloid,
terpen/steroid dan saponin terkandung di dalam ekstrak metanol dan etil asetat
kulit batang R. mucronata. Sedangkan untuk senyawa golongan fenolik hanya
terdapat pada ekstrak metanol. Flavonoid dan tanin merupakan bagian dari
senyawa fenolik. Tertariknya senyawa golongan fenolik karena pelarut metanol
merupakan pelarut yang bersifat universal yang dapat menarik sebagian besar
senyawa kimia dalam tanaman. Hal ini disebabkan karena metanol memiliki
gugus polar (-OH) dan gugus nonpolar (-CH3) sehingga dapat menarik
analit-analit yang bersifat polar dan nonpolar (Astarina dkk., 2013). Diduga senyawa
pengujian dengan FeCl3 1% ekstrak metanol menunjukkan reaksi positif dengan
berubahnya warna ekstrak menjadi hitam kehijauan. Marlinda dkk. (2012)
menyatakan dalam penelitiannya bahwa ekstrak etanol biji buah alpukat (Persea
americana Mill.) positif mengandung tanin yang ditandai dengan perubahan
warna ekstrak menjadi hitam kehijauan setelah penambahan 2 – 3 tetes larutan
FeCl3 1% . Pada penambahan larutan FeCl3
Menurut Lisdawati dkk. (2006), senyawa-senyawa yang larut dalam
pelarut semi polar diantaranya adalah senyawa alkaloid, senyawa flavanoid,
senyawa kumarin dan golongan asam lemak. Untuk melihat ada tidaknya senyawa
flavanoid yang terkandung dalam ekstrak kulit batang R. mucronata maka
dilakukan pengujian terhadap ekstrak etil asetat dengan pereaksi FeCl
1% diperkirakan larutan ini bereaksi
dengan salah satu gugus hidroksil yang ada pada senyawa tanin.
3 1%.
Reaksi dengan besi (III) klorida (FeCl3) telah digunakan secara luas untuk
mengidentifikasi senyawa fenol, tetapi tidak dapat dipakai untuk membedakan
macam-macam golongan (Robinson, 1995). Penambahan pereaksi FeCl3
Senyawa alkaloid yang terkandung di dalam ekstrak metanol ditandai
dengan adanya reaksi positif pada pereaksi Dragendorff yang menimbulkan
endapan seperti pada Gambar 8 (c). Sedangkan pada pereaksi Bouchardat,
Wagner dan pereaksi Mayer diperoleh hasil negatif (tidak terjadi perubahan warna
dan endapan). Untuk ekstrak dengan pelarut etil asetat senyawa alkaloid ditandai
dengan adanya perubahan warna dan endapan pada pereaksi Mayer (Gambar 8 1%
dalam ekstrak etil asetat kulit batang R. mucronata tidak merubah warna ekstrak
menjadi biru atau hitam kehijauan, hal ini mengindikasikan bahwa senyawa
(e)) dan pereaksi Dragendorff (Gambar 8 (d)). Hasil ini sesuai dengan penelitian
yang dilakukan Ningsih dkk. (2006) yang melaporkan bahwa fraksinasi ekstrak
kasar metanol kulit batang R. mucronata dihasilkan fraksi-fraksi yang
mengandung senyawa golongan alkaloid.
Hasil positif alkaloid pada uji Dragendorff ditandai dengan terbentuknya
endapan coklat muda sampai kuning. Endapan tersebut adalah kalium-alkaloid
yang terjadi akibat atom nitrogen yang mempunyai pasangan elektron bebas pada
alkaloid membentuk ikatan kovalen koordinat dengan ion logam K+ dari kalium tetraiodobismutat membentuk kompleks kalium-alkaloid yang mengendap.
Sedangkan hasil positif alkaloid pada uji Mayer ditandai dengan terbentuknya
endapan putih. Diperkirakan endapan tersebut adalah kompleks kalium-alkaloid.
Pada uji alkaloid dengan pereaksi Mayer, diperkirakan nitrogen pada alkaloid
akan bereaksi dengan ion logam K+
Uji senyawa saponin diperoleh hasil positif pada ekstrak metanol dan etil
asetat yang ditandai dengan adanya buih stabil setinggi 1 – 10 cm selama 10 menit
dan buih tidak hilang dengan penambahan 1 tetes HCl 2 N seperti Gambar 8 (a)
untuk ekstrak metanol dan Gambar 8 (f) untuk ekstrak etil asetat. Saponin adalah
senyawa polar yang keberadaanya dalam tumbuhan dapat diekstraksi dengan
pelarut semi polar dan polar (Oesman dkk., 2010).
dari kalium tetraiodomerkurat(II) membentuk
kompleks kalium-alkaloid yang mengendap (Marliana dkk., 2005).
Senyawa terpen/steroid positif terkandung di dalam ekstrak metanol dan
etil asetat yang ditandai dengan perubahan warna hijau untuk steroid dan warna
ungu untuk triterpenoid dengan pereaksi Lieberman-Bouchard. Senyawa