PENAPISAN AWAL KOMPONEN BIOAKTIF
DARI KERANG DARAH (
Anadara granosa
)
SEBAGAI SENYAWA ANTIBAKTERI
Oleh:
Ika Pranata Wahyu Daluningrum C34104010
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
LEMBAR PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi Penapisan Awal Komponen Bioaktif dari Kerang Darah (Anadara granosa) sebagai Senyawa Antibakteri adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2009
Ika Pranata W.D.
RINGKASAN
IKA PRANATA WAHYU DALUNINGRUM. C34104010. Penapisan Awal Komponen Bioaktif dari Kerang Darah (Anadara granosa) sebagai Senyawa Antibakteri. Dibawah bimbingan: ELLA SALAMAH dan KOMARIAH TAMPUBOLON.
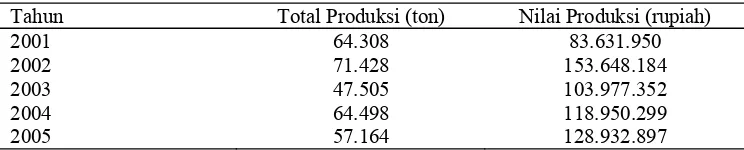
Produksi kerang darah Indonesia tahun 2003 sebesar 47.505 ton dan tahun 2004 mencapai 64.498 ton. Masyarakat pesisir Malaysia dan Thailand telah memanfaatkan kerang darah sebagai obat tradisional untuk mengatasi penyakit kolera, hepatitis A dan disenteri. Pemanfaatan kerang darah sebagai obat tradisional menunjukkan adanya dugaan kerang darah memiliki komponen aktif.
Tujuan penelitian ini adalah mengekstrak komponen aktif pada kerang darah dengan tiga jenis pelarut yaitu heksana, etil asetat dan metanol, menguji ekstrak sebagai senyawa antibakteri, mengamati zona hambat yang dihasilkan pada penyimpanan suhu 10oC dan 30oC selama tujuh hari serta analisis fitokimia terhadap ekstrak yang menunjukkan aktivitas antibakteri paling baik.
Penelitian ini terdiri dari beberapa tahap, yaitu analisis proksimat kerang darah, ekstraksi senyawa aktif dari kerang darah, uji aktivitas antibakteri dari ekstrak yang dihasilkan terhadap bakteri E. coli dan S. aureus dengan konsentrasi ekstrak 2%, 3,5%, 5% dan 6,5% serta analisis fitokimia terhadap ekstrak yang memiliki aktivitas antibakteri paling baik.
Penelitian ini menunjukkan hasil analisis proksimat kerang darah mempunyai kadar air 81,82%, kadar abu 2%, kadar protein 11,84%, kadar lemak 0,6% dan kadar karbohidrat 3,75%. Ekstrak kerang darah dengan pelarut heksana adalah 3,00±1,40 mg, dengan pelarut etil asetat adalah 107,50±3,50 mg dan dengan pelarut metanol adalah 995,50±0,70 mg. Hasil uji aktivitas antibakteri ekstrak kerang darah dengan pelarut etil asetat mampu menghasilkan zona hambat pada S. aureus untuk konsentrasi 2%, 3,5%, 5% dan 6,5% masing-masing 3 mm, 4 mm, 6 mm dan 7 mm, serta menghambat E. coli dengan zona hambat masing-masing konsentrasi 1 mm, 2 mm, 3 mm dan 4 mm. Ekstrak kerang darah dengan pelarut metanol tidak menunjukkan penghambatan pada konsentrasi 2% dan 3,5%, tetapi pada konsentrasi 5% dan 6,5% menghasilkan zona hambat sebesar 0,5 mm dan 1 mm pada E. coli dan S. aureus. Kemampuan penghambatan ekstrak kerang darah dari pelarut etil asetat yang lebih baik daripada pelarut metanol berarti senyawa antibakteri yang terdapat pada kerang darah bersifat semi polar karena larut dalam pelarut etil asetat.
PENAPISAN AWAL KOMPONEN BIOAKTIF
DARI KERANG DARAH (
Anadara granosa
)
SEBAGAI SENYAWA ANTIBAKTERI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh:
Ika Pranata Wahyu Daluningrum C34104010
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : PENAPISAN AWAL KOMPONEN BIOAKTIF DARI KERANG DARAH (Anadara granosa) SEBAGAI SENYAWA ANTIBAKTERI
Nama : Ika Pranata Wahyu Daluningrum NRP : C34104010
Menyetujui,
Pembimbing I
Dra. Ella Salamah, M.Si NIP. 131 788 597
Pembimbing II
Ir. Komariah Tampubolon, MS NIP. 130 355 555
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP. 131 578 799
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segenap limpahan karunia dan hidayah-Nya. Shalawat serta salam semoga tetap tercurah kepada Rasulullah SAW.
Penyusunan skripsi yang berjudul “Penapisan Awal Komponen Bioaktif dari Kerang Darah (Anadara granosa) sebagai Senyawa Antibakteri” merupakan salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada seluruh pihak yang telah membantu baik moral maupun material dalam penyelesaian skripsi ini, diantaranya kepada:
1. Ibu Dra. Ella Salamah, MSi dan Ibu Ir. Komariah Tampubolon, MS selaku komisi pembimbing atas segala saran, kritik, arahan dan motivasi. 2. Ibu Dr. Ir. Sri Purwaningsih, MS dan Ibu Ir. Iriani Setyaningsih, MS
selaku dosen penguji atas segala saran dan arahan.
3. Ibu Ir. Winarti Zahiruddin, MS selaku pembimbing akademik atas segala bimbingan dan motivasi yang telah diberikan.
4. Seluruh staf dan dosen pengajar Departemen Teknologi Hasil Perairan atas segala arahan dan bimbingan.
5. Bu Ema, Mbak Ica, Mas Zacky dan Mas Ipul atas bantuan dan bimbingannya selama ini.
6. Kedua orang tua, Bapak Soekadi dan Ibu Sri Nastiti atas segala cinta, kasih sayang, pengorbanan, doa dan jerih payah yang tidak terbalas. 7. Adikku, Dhimas Harianto, atas segala cinta, doa dan perhatiannya.
Kesempurnaan skripsi ini tidak terlepas dari segala kritik dan saran yang membangun dari semua pihak. Akhir kata, semoga skripsi ini dapat bermanfaat bagi pihak-pihak yang membutuhkannya.
Bogor, Januari 2009
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada pihak-pihak yang telah membantu baik moral maupun material dalam penyelesaian skripsi ini, diantaranya kepada:
1. Pak Man, Bulek Lolo, Umar, Ibrahim, Ismail, Ahmad, Atika, Afifah, Aqrom, Aiman dan Sarah di Kalimalang atas cinta, kasih sayang dan perhatiannya.
2. Mas Andik dan istri di Sukabumi atas perhatiannya. 3. Mas Nur dan Mbak Aulia di Jakarta atas kasih sayangnya.
4. Oom Wiwid, Mbak Yuni dan Kiki atas kasih sayang dan perhatiannya. 5. Rekan-rekan THP angkatan 39, 40, 41, 42 dan 43 atas kerjasama dan
persahabatan yang indah.
6. Kerabat-kerabat Blitarian_Soekarnoensis di Kawah Kelud, Bek La, Ali, Farikha, Bek Fah, Mas Alfa, Mas Aris, Mas Tyo, Dedi, Fa’i, To’o, Iin, Nelly, Mbak Niken, Dody, Dicky, Jo, Azzam, Sapek, Dan, Ulie, Tyas dan Ikka atas kasih sayang, nasehat dan dukungannya.
7. Eka, Nia, Dilla dan Sereli atas kasih sayang, perhatian serta persahabatan yang indah dan tak terlupakan .
8. Andi Patria atas kasih sayang, semangat dan kenangan yang telah terukir. 9. Saukya Singgih atas perhatian, cinta dan kasih sayang yang diberikan. 10.Anang, An’im, Windhyka, Nuzul, Laler, Alim, Nicolas, Sait, Glory,
Estrid, Amel, Yudha dan lain-lain yang tidak dapat disebutkan satu per satu, terima kasih atas persahabatan yang sangat indah selama ini.
RIWAYAT HIDUP
Penulis dilahirkan di Blitar, Jawa Timur pada tanggal 29 April 1986 dari ayah Soekadi dan ibu Sri Nastiti. Penulis merupakan putri pertama dari dua bersaudara. Tahun 2004 penulis menyelesaikan pendidikan di Sekolah Menegah Atas Negeri I Srengat, Jawa Timur dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) dengan memilih Program Studi Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis aktif dalam organisasi FORCES (Forum For Scientific Students) tahun 2004/2005 dan Badan Eksekutif Mahasiswa divisi Kewirausahaan tahun 2005/2006. Penulis juga menjadi asisten mata kuliah Penanganan Hasil Perairan tahun ajaran 2006/2007, mata kuliah Transportasi Biota Perairan tahun ajaran 2007/2008, mata kuliah Diversifikasi Produk Hasil Perairan tahun ajaran 2007/2008, mata kuliah Hasil Samping Perairan tahun ajaran 2007/2008 dan mata kuliah Biotoksikologi Hasil Perairan tahun ajaran 2008/2009. Pada tahun 2008 penulis menjuarai Kompetisi Pemikiran Kritis Mahasiswa (KPKM) tingkat nasional bidang perekomomian sebagai juara II, dengan judul karya tulis Tantangan dalam Meningkatkan Standar Kualitas Udang Ekspor Indonesia melalui Traceability System.
DAFTAR ISI
3.3.3 Uji aktivitas antibakteri dari ekstrak kasar kerang darah (Anadara granosa) (Noer & Nurhayati 2006) ... 20
4.3.1 Uji pendahuluan aktivitas antibakteri ... 32
4.3.2 Uji aktivitas antibakteri dengan berbagai konsentrasi ... 33
4.3.3 Pengamatan zona hambat pada penyimpanan suhu 10oC dan 30oC ... 37
5. KESIMPULAN DAN SARAN ... 50
5.1 Kesimpulan ... 50
5.2 Saran ... 50
DAFTAR PUSTAKA ... 51
PENAPISAN AWAL KOMPONEN BIOAKTIF
DARI KERANG DARAH (
Anadara granosa
)
SEBAGAI SENYAWA ANTIBAKTERI
Oleh:
Ika Pranata Wahyu Daluningrum C34104010
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
LEMBAR PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi Penapisan Awal Komponen Bioaktif dari Kerang Darah (Anadara granosa) sebagai Senyawa Antibakteri adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2009
Ika Pranata W.D.
RINGKASAN
IKA PRANATA WAHYU DALUNINGRUM. C34104010. Penapisan Awal Komponen Bioaktif dari Kerang Darah (Anadara granosa) sebagai Senyawa Antibakteri. Dibawah bimbingan: ELLA SALAMAH dan KOMARIAH TAMPUBOLON.
Produksi kerang darah Indonesia tahun 2003 sebesar 47.505 ton dan tahun 2004 mencapai 64.498 ton. Masyarakat pesisir Malaysia dan Thailand telah memanfaatkan kerang darah sebagai obat tradisional untuk mengatasi penyakit kolera, hepatitis A dan disenteri. Pemanfaatan kerang darah sebagai obat tradisional menunjukkan adanya dugaan kerang darah memiliki komponen aktif.
Tujuan penelitian ini adalah mengekstrak komponen aktif pada kerang darah dengan tiga jenis pelarut yaitu heksana, etil asetat dan metanol, menguji ekstrak sebagai senyawa antibakteri, mengamati zona hambat yang dihasilkan pada penyimpanan suhu 10oC dan 30oC selama tujuh hari serta analisis fitokimia terhadap ekstrak yang menunjukkan aktivitas antibakteri paling baik.
Penelitian ini terdiri dari beberapa tahap, yaitu analisis proksimat kerang darah, ekstraksi senyawa aktif dari kerang darah, uji aktivitas antibakteri dari ekstrak yang dihasilkan terhadap bakteri E. coli dan S. aureus dengan konsentrasi ekstrak 2%, 3,5%, 5% dan 6,5% serta analisis fitokimia terhadap ekstrak yang memiliki aktivitas antibakteri paling baik.
Penelitian ini menunjukkan hasil analisis proksimat kerang darah mempunyai kadar air 81,82%, kadar abu 2%, kadar protein 11,84%, kadar lemak 0,6% dan kadar karbohidrat 3,75%. Ekstrak kerang darah dengan pelarut heksana adalah 3,00±1,40 mg, dengan pelarut etil asetat adalah 107,50±3,50 mg dan dengan pelarut metanol adalah 995,50±0,70 mg. Hasil uji aktivitas antibakteri ekstrak kerang darah dengan pelarut etil asetat mampu menghasilkan zona hambat pada S. aureus untuk konsentrasi 2%, 3,5%, 5% dan 6,5% masing-masing 3 mm, 4 mm, 6 mm dan 7 mm, serta menghambat E. coli dengan zona hambat masing-masing konsentrasi 1 mm, 2 mm, 3 mm dan 4 mm. Ekstrak kerang darah dengan pelarut metanol tidak menunjukkan penghambatan pada konsentrasi 2% dan 3,5%, tetapi pada konsentrasi 5% dan 6,5% menghasilkan zona hambat sebesar 0,5 mm dan 1 mm pada E. coli dan S. aureus. Kemampuan penghambatan ekstrak kerang darah dari pelarut etil asetat yang lebih baik daripada pelarut metanol berarti senyawa antibakteri yang terdapat pada kerang darah bersifat semi polar karena larut dalam pelarut etil asetat.
PENAPISAN AWAL KOMPONEN BIOAKTIF
DARI KERANG DARAH (
Anadara granosa
)
SEBAGAI SENYAWA ANTIBAKTERI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh:
Ika Pranata Wahyu Daluningrum C34104010
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : PENAPISAN AWAL KOMPONEN BIOAKTIF DARI KERANG DARAH (Anadara granosa) SEBAGAI SENYAWA ANTIBAKTERI
Nama : Ika Pranata Wahyu Daluningrum NRP : C34104010
Menyetujui,
Pembimbing I
Dra. Ella Salamah, M.Si NIP. 131 788 597
Pembimbing II
Ir. Komariah Tampubolon, MS NIP. 130 355 555
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP. 131 578 799
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segenap limpahan karunia dan hidayah-Nya. Shalawat serta salam semoga tetap tercurah kepada Rasulullah SAW.
Penyusunan skripsi yang berjudul “Penapisan Awal Komponen Bioaktif dari Kerang Darah (Anadara granosa) sebagai Senyawa Antibakteri” merupakan salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada seluruh pihak yang telah membantu baik moral maupun material dalam penyelesaian skripsi ini, diantaranya kepada:
1. Ibu Dra. Ella Salamah, MSi dan Ibu Ir. Komariah Tampubolon, MS selaku komisi pembimbing atas segala saran, kritik, arahan dan motivasi. 2. Ibu Dr. Ir. Sri Purwaningsih, MS dan Ibu Ir. Iriani Setyaningsih, MS
selaku dosen penguji atas segala saran dan arahan.
3. Ibu Ir. Winarti Zahiruddin, MS selaku pembimbing akademik atas segala bimbingan dan motivasi yang telah diberikan.
4. Seluruh staf dan dosen pengajar Departemen Teknologi Hasil Perairan atas segala arahan dan bimbingan.
5. Bu Ema, Mbak Ica, Mas Zacky dan Mas Ipul atas bantuan dan bimbingannya selama ini.
6. Kedua orang tua, Bapak Soekadi dan Ibu Sri Nastiti atas segala cinta, kasih sayang, pengorbanan, doa dan jerih payah yang tidak terbalas. 7. Adikku, Dhimas Harianto, atas segala cinta, doa dan perhatiannya.
Kesempurnaan skripsi ini tidak terlepas dari segala kritik dan saran yang membangun dari semua pihak. Akhir kata, semoga skripsi ini dapat bermanfaat bagi pihak-pihak yang membutuhkannya.
Bogor, Januari 2009
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada pihak-pihak yang telah membantu baik moral maupun material dalam penyelesaian skripsi ini, diantaranya kepada:
1. Pak Man, Bulek Lolo, Umar, Ibrahim, Ismail, Ahmad, Atika, Afifah, Aqrom, Aiman dan Sarah di Kalimalang atas cinta, kasih sayang dan perhatiannya.
2. Mas Andik dan istri di Sukabumi atas perhatiannya. 3. Mas Nur dan Mbak Aulia di Jakarta atas kasih sayangnya.
4. Oom Wiwid, Mbak Yuni dan Kiki atas kasih sayang dan perhatiannya. 5. Rekan-rekan THP angkatan 39, 40, 41, 42 dan 43 atas kerjasama dan
persahabatan yang indah.
6. Kerabat-kerabat Blitarian_Soekarnoensis di Kawah Kelud, Bek La, Ali, Farikha, Bek Fah, Mas Alfa, Mas Aris, Mas Tyo, Dedi, Fa’i, To’o, Iin, Nelly, Mbak Niken, Dody, Dicky, Jo, Azzam, Sapek, Dan, Ulie, Tyas dan Ikka atas kasih sayang, nasehat dan dukungannya.
7. Eka, Nia, Dilla dan Sereli atas kasih sayang, perhatian serta persahabatan yang indah dan tak terlupakan .
8. Andi Patria atas kasih sayang, semangat dan kenangan yang telah terukir. 9. Saukya Singgih atas perhatian, cinta dan kasih sayang yang diberikan. 10.Anang, An’im, Windhyka, Nuzul, Laler, Alim, Nicolas, Sait, Glory,
Estrid, Amel, Yudha dan lain-lain yang tidak dapat disebutkan satu per satu, terima kasih atas persahabatan yang sangat indah selama ini.
RIWAYAT HIDUP
Penulis dilahirkan di Blitar, Jawa Timur pada tanggal 29 April 1986 dari ayah Soekadi dan ibu Sri Nastiti. Penulis merupakan putri pertama dari dua bersaudara. Tahun 2004 penulis menyelesaikan pendidikan di Sekolah Menegah Atas Negeri I Srengat, Jawa Timur dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) dengan memilih Program Studi Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis aktif dalam organisasi FORCES (Forum For Scientific Students) tahun 2004/2005 dan Badan Eksekutif Mahasiswa divisi Kewirausahaan tahun 2005/2006. Penulis juga menjadi asisten mata kuliah Penanganan Hasil Perairan tahun ajaran 2006/2007, mata kuliah Transportasi Biota Perairan tahun ajaran 2007/2008, mata kuliah Diversifikasi Produk Hasil Perairan tahun ajaran 2007/2008, mata kuliah Hasil Samping Perairan tahun ajaran 2007/2008 dan mata kuliah Biotoksikologi Hasil Perairan tahun ajaran 2008/2009. Pada tahun 2008 penulis menjuarai Kompetisi Pemikiran Kritis Mahasiswa (KPKM) tingkat nasional bidang perekomomian sebagai juara II, dengan judul karya tulis Tantangan dalam Meningkatkan Standar Kualitas Udang Ekspor Indonesia melalui Traceability System.
DAFTAR ISI
3.3.3 Uji aktivitas antibakteri dari ekstrak kasar kerang darah (Anadara granosa) (Noer & Nurhayati 2006) ... 20
4.3.1 Uji pendahuluan aktivitas antibakteri ... 32
4.3.2 Uji aktivitas antibakteri dengan berbagai konsentrasi ... 33
4.3.3 Pengamatan zona hambat pada penyimpanan suhu 10oC dan 30oC ... 37
5. KESIMPULAN DAN SARAN ... 50
5.1 Kesimpulan ... 50
5.2 Saran ... 50
DAFTAR PUSTAKA ... 51
DAFTAR TABEL
Halaman
1 Produksi kerang darah tahun 2001-2005 ... 4
2 Kandungan gizi kerang per 100 gram bahan ... 4
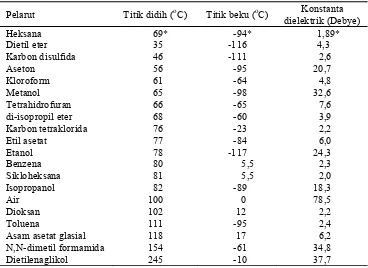
3 Sifat fisik dari beberapa pelarut ... 7
4 Data proksimat kerang darah (A. granosa) ... 27
5 Kadar proksimat kerang ... 27
6 Berat ekstrak kasar kerang darah (A. granosa) ... 29
7 Aktivitas antibakteri ekstrak kerang darah pada konsentrasi 2% ... 32
8 Aktivitas antibakteri ekstrak kerang darah pada berbagai konsentrasi ... 34
9 Pengamatan zona hambat ekstrak kerang darah dengan pelarut etil asetat pada penyimpanan suhu 10oC ... 38
10 Pengamatan zona hambat kloramfenikol pada penyimpanan suhu 10oC ... 41
11 Pengamatan zona hambat ekstrak kerang darah dengan pelarut etil asetat pada penyimpanan suhu 30oC ... 43
12 Pengamatan zona hambat kloramfenikol pada penyimpanan suhu 30oC ... 45
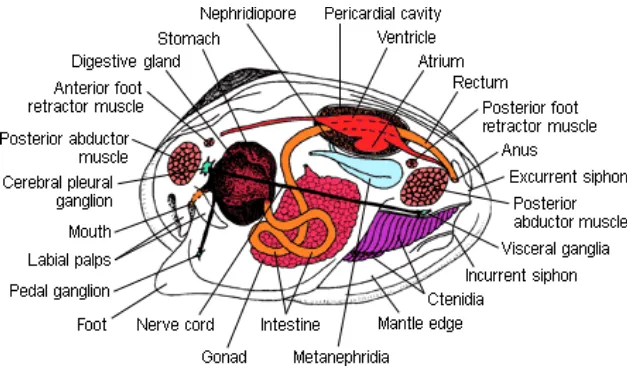
DAFTAR GAMBAR
Halaman 1 Anatomi kerang ... 3 2 Rumus umum heksana ... 8 3 Sintesis etil asetat ... 9 4 Reaksi pembentukan metanol ... 10 5 Bakteri Escherichia coli ... 11 6 Bakteri Staphylococcus aureus ... 12 7 Tahapan uji aktivitas antibakteri (Noer dan Nurhayati 2006) ... 13 8 Struktur kloramfenikol ... 14 9 Tahapan proses ekstraksi (Darusman et al. 1994) ... 21 10 Tahapan uji pendahuluan aktivitas antibakteri ( modifikasi
Noer & Nurhayati 2006) ... 24 11 Tahapan uji aktivitas antibakteri pada berbagai konsentrasi ekstrak
DAFTAR LAMPIRAN
Halaman 1 Perhitungan rendemen daging kerang darah (A. granosa) ... 56 2 Kerang darah (A. granosa) yang digunakan untuk penelitian... 56 3 Ekstraksi kerang darah (A. granosa) ... 57 4 Perhitungan rendemen ekstrak kerang darah (A. granosa) ... 58 5 Uji pendahuluan aktivitas antibakteri pada bakteri E. coli ... 59 6 Uji pendahuluan aktivitas antibakteri pada bakteri S. aureus ... 60 7 Contoh perhitungan konsentrasi ekstrak ... 60 8 Uji aktivitas antibakteri ekstrak etil asetat dan metanol kerang darah pada bakteri E. coli ... 61 9 Uji aktivitas antibakteri ekstrak etil asetat dan metanol kerang darah pada bakteri S. aureus ... .62 10 Uji aktivitas antibakteri kontrol (kloramfenikol) pada bakteri E. coli ... 63 11 Uji aktivitas antibakteri kontrol (kloramfenikol) pada bakteri S. aureus ... 64 12 Pengamatan zona hambat suhu 10oC hari-1 ... 65 13 Pengamatan zona hambat suhu 10oC hari-2 ... 66 14 Pengamatan zona hambat suhu 10oC hari-3 ... 67 15 Pengamatan zona hambat suhu 10oC hari-4 ... 68 16 Pengamatan zona hambat suhu 10oC hari-5 ... 69 17 Pengamatan zona hambat suhu 10oC hari-6 ... 70 18 Pengamatan zona hambat suhu 10oC hari-7 ... 71 19 Pengamatan zona hambat suhu 30oC hari-1 ... 72 20 Pengamatan zona hambat suhu 30oC hari-2 ... 73 21 Pengamatan zona hambat suhu 30oC hari-3 ... 74 22 Pengamatan zona hambat suhu 30oC hari-4 ... 75 23 Pengamatan zona hambat suhu 30oC hari-5 ... 76 24 Pengamatan zona hambat suhu 30oC hari-6 ... 77 25 Pengamatan zona hambat suhu 30oC hari-7 ... 78
1. PENDAHULUAN
1.1. Latar Belakang
Wilayah nusantara sebagian besar merupakan perairan yang terdiri atas perairan tawar dan perairan laut dengan kandungan kekayaan alam yang berupa sumber bahan pangan dan non pangan. Perairan Indonesia kaya akan moluska, salah satunya adalah kerang darah (Anadara granosa), yang merupakan hasil laut dengan nilai ekonomis penting dan menjadi salah satu sumber bahan pangan. Produksi kerang darah Indonesia tahun 2003 adalah 47.505 ton dan meningkat pada tahun 2004 menjadi 64.498 ton (DKP 2006).
Bivalvia (kerang) merupakan salah satu kelas dari tujuh kelas pada filum Moluska. Di daerah tropis terdapat bermacam-macam Bivalvia seperti tiram, remis dan kerang, terutama di daerah pantai yang berhutan bakau. Ciri utama dari kelas ini adalah tubuhnya yang tertutup oleh dua cangkang dengan satu atau dua pasang otot adduktor. Berbentuk pipih ke arah lateral dan bagian kepala mengalami reduksi.
Kerang darah banyak ditemukan di sepanjang pantai di daerah tropis dengan substrat lumpur halus atau kadang-kadang pasir berlumpur dan dilindungi atau berasosiasi dengan pohon-pohon bakau. Pathansali (1966) diacu dalam Erianto (2005) menyebutkan bahwa habitat ideal untuk kerang darah adalah lumpur halus berukuran kurang dari 0,124 mm, terlindung dari ombak dan dengan salinitas antara 18-30‰.
Ninda (2008) dalam artikelnya menyatakan bahwa kerang mampu membantu melawan bakteri dan beberapa jenis penyakit. Tan dan Ng (2008) juga menyebutkan bahwa beberapa daerah berpantai di Malaysia dan Thailand telah membudidayakan kerang darah, namun belum terlalu populer. Pada daerah tersebut, kerang darah telah dimanfaatkan sebagai obat tradisional untuk penyakit kolera, hepatitis A dan disenteri. Pemanfaatan kerang darah sebagai obat tradisional tersebut memberikan dugaan bahwa kerang darah memiliki suatu senyawa aktif yang bersifat antibakteri. Senyawa antibakteri adalah senyawa biologis atau kimia yang dapat membunuh atau menghambat pertumbuhan dan aktivitas bakteri (Irianto 2006). Senyawa-senyawa aktif dari kerang darah yang diperoleh dari hasil penelitian ini diharapkan dapat dimanfaatkan dalam bidang farmasi, pangan, industri, dan lain-lain
1.2. Tujuan
Tujuan utama penelitian ini adalah untuk membuktikan adanya senyawa antibakteri pada kerang darah (Anadara granosa) melalui metode ekstraksi bertingkat, sedangkan tujuan khusus yang ingin dicapai antara lain:
1) Mengekstrak komponen aktif dari kerang darah (Anadara granosa) melalui metode ekstraksi bertingkat dengan pelarut non polar, semi polar dan polar. 2) Menguji aktivitas ekstrak yang dihasilkan sebagai senyawa antibakteri pada
bakteri Staphylococcus aureus dan Escherichia coli.
3) Mengamati zona hambat ekstrak yang memiliki aktivitas terbaik pada penyimpanan suhu 10oC dan 30oC.
2. TINJAUAN PUSTAKA
2.1. Kerang Darah (Anadara granosa)
Broom (1985) dalam Erianto (2005) menyusun sistematika kerang darah (Anadara granosa)sebagai berikut:
filum : Mollusca kelas : Bivalvia famili : Arcidae sub famili : Anadarinae genus : Anadara
spesies : Anadara granosa
Kelas Pelecypoda dicirikan oleh bentuk kakinya seperti kampak. Storer dan Usinger (1957) diacu dalam Mubarak (1987) menjelaskan bahwa ciri lain dari kerang darah adalah mempunyai cangkang terdiri dari dua keping yang biasanya simetris (oleh karena itu disebut juga kelas Bivalvia) dengan hinge dan ligamen pada bagian dorsal serta memiliki satu atau dua pasang otot adduktor.
Broom (1985); Pathansali (1966) diacu dalam Erianto (2005) menjelaskan bahwa kerang darah hidup di daerah pasang surut, umumnya ditemukan pada lahan pantai yang berada di antara daerah rataan pasang dan rataan surut berlumpur lunak berbatasan dengan hutan bakau dengan habitat ideal berupa substrat lumpur halus berukuran kurang dari 0,124 mm sebanyak 90% pada hamparan pasang (tidal flat) yang terlindung dari ombak, di luar muara sungai dengan salinitas 18-30‰.
Kerang darah termasuk sebagai salah satu komoditas perikanan yang produktivitasnya cukup baik. Tabel 1 menunjukkan total produksi dan nilai produksi kerang darah pada tahun 2001-2005.
Tabel 1 Produksi kerang darah tahun 2001-2005
Tahun Total Produksi (ton) Nilai Produksi (rupiah) 2001
Kandungan gizi kerang darah yang cukup baik menyebabkan kerang darah banyak dibudidayakan sebagai alternatif sumber protein. Kadar lemak kerang darah yang cukup rendah apabila dibandingkan dengan lemak pada produk perikanan lainnya, seperti ikan bandeng sebesar 4,8 g/100 g (Poedjiadi 1994), menjadi salah satu alasan kerang darah digemari masyarakat untuk dikonsumsi. Kandungan gizi yang terdapat pada kerang dapat dilihat pada Tabel 2.
Tabel 2 Kandungan gizi kerang per 100 gram bahan
2.2. Senyawa Bioaktif
Senyawa bioaktif merupakan suatu senyawa aktif yang termasuk metabolit sekunder. Metabolit sekunder merupakan suatu komponen hasil metabolisme yang unik dan terbatas, yang terkadang hanya dijumpai pada kelompok tertentu, biasanya tidak dibutuhkan oleh sel (organisme) untuk hidup, tetapi berperan dalam interaksi sel (organisme) dengan lingkungan, menjamin ketahanan hidup organisme tersebut pada ekosistem hidupnya(Verpoorte dan Alfermann 2000).
Alkaloid merupakan golongan terbesar dari senyawa metabolit sekunder pada tumbuhan dan hingga saat ini sebanyak 5500 jenis alkaloid telah diketahui. Pada umumnya alkaloid merupakan senyawa yang bersifat basa yang mengandung satu atau lebih atom nitrogen sebagai bagian dari sistem siklik. Alkaloid seringkali bersifat racun bagi manusia, tetapi beberapa alkaloid memiliki aktivitas farmakologis dan digunakan secara luas dalam bidang kesehatan (Harborne 1987). Senyawa ini pada tumbuhan berfungsi untuk melindungi diri dari prodator karena bersifat racun pada satwa misalnya serangga, sebagai zat perangsang dan pengatur tumbuh dan membantu aktivitas metabolisme dan reproduksi tumbuhan (Verpoorte dan Alfermann 2000).
jantung adalah racun, tetapi terdapat juga yang berkhasiat farmakologi, terutama terhadap jantung, seperti tercermin pada namanya (Harborne 1987).
Flavonoid merupakan senyawa yang larut dalam air dan dapat diekstrak dengan etanol 70% dan tetap ada dalam lapisan air setelah ekstrak ini dikocok dengan eter. Flavonoid umumnya terdapat dalam tumbuhan. Flavonoid yang banyak terdapat di alam adalah jenis flavon dan flavonol, sedangkan isoflavon dan biflavonol hanya terdapat pada beberapa suku tumbuhan saja (Harborne 1987).
Sabir (2005) dalam penelitiannya menjelaskan bahwa senyawa flavonoid memiliki kemampuan menghambat pertumbuhan bakteri dengan beberapa mekanisme yang berbeda, antara lain flavonoid menyebabkan terjadinya kerusakan permeabilitas dinding bakteri, mikrosom dan lisosom sebagai hasil interaksi antara flavonoid dengan DNA bakteri (Bryan 1982; Wilson dan Gisvold 1982 diacu dalam Sabir 2005), sementara Mirzoeva et al. (1997) diacu dalam Sabir (2005) dalam penelitiannya berpendapat bahwa flavonoid mampu melepaskan energi transduksi terhadap membran sitoplasma bakteri, selain itu juga menghambat motilitas bakteri. Mekanisme yang berbeda dikemukakan oleh Di Carlo et al. (1999) dan Estrela et al. (1995) diacu dalam Sabir (2005) yang menyatakan bahwa gugus hidroksil yang terdapat pada struktur senyawa flavonoid menyebabkan perubahan komponen organik dan transpor nutrisi yang akhirnya akan mengakibatkan timbulnya efek toksik terhadap bakteri.
2.3. Ekstraksi
Departemen Kesehatan (2000) diacu dalam Adolf (2006) menjelaskan ekstraksi adalah peristiwa penarikan komponen yang diinginkan dari suatu bahan dengan cara pemisahan satu atau lebih komponen dari sumbernya. Struktur kimia yang berbeda-beda akan mempengaruhi kelarutan dan stabilitas senyawa-senyawa tersebut terhadap pemanasan, udara, cahaya, logam berat dan derajat keasaman., dengan diketahuinya senyawa aktif yang terkandung dalam bahan akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat.
dengan pelarut pada waktu tertentu, kemudian diikuti dengan melakukan pemisahan dari bahan yang telah diekstrak (Houghton & Raman 1998).
Pemilihan pelarut organik yang akan digunakan dalam ekstraksi komponen aktif merupakan faktor penting dan menentukan untuk mencapai tujuan dan sasaran ekstraksi komponen. Tabel 3 menunjukkan sifat fisik beberapa jenis pelarut organik yang dapat digunakan untuk ekstraksi. Semakin tinggi nilai konstanta dielektrik, titik didih dan kelarutan dalam air, maka pelarut akan makin polar (Sudarmadji et al. 2007).
Tabel 3 Sifat fisik dari beberapa pelarut
Pelarut Titik didih (oC) Titik beku (oC) Konstanta
Sumber: Nur dan Adijuwana (1989) *Sudarmadji et al. (2007)
dengan pelarut polar, sehingga akan diperoleh ekstrak kasar (crude extract) yang berturut-turut senyawa nonpolar, semi polar dan polar.
Heksana memiliki konstanta dielektrik sebesar 1,89 Db, indeks polaritas 0, titik didih 69oC dan titik beku -94oC (Sudarmadji et al. 2007). Nilai konstanta dielektrik pelarut heksana merupakan konstanta paling rendah apabila dibandingkan dengan konstanta dielektrik pelarut yang lain, sehingga pelarut heksana termasuk dalam pelarut non polar. Isomer heksana sangat tidak reaktif dan sering digunakan sebagai pelarut organik yang inert.
Heksana merupakan salah satu jenis dari senyawa hidrokarbon, yaitu persenyawaan organik yang hanya mengandung aton karbon dan hidrogen. Heksana termasuk dalam hidrokarbon jenuh, artinya hidrokarbon dengan karbon-karbon yang mempunyai satu ikatan. Senyawa dengan rantai lurus mempunyai gaya tarik menarik antar molekul lebih besar daripada rantai cabang, sehingga akan lebih sukar bereaksi dengan molekul lain. Sebagai contoh, heksana merupakan pelarut non polar, molekul heksana tidak tertarik oleh molekul air, sehingga heksana tidak larut dalam air. Heksana memiliki berat jenis yang lebih rendah (0,66 g/ml) daripada air (1,0 g/ml), sehingga akan terapung dalam air. Api yang disebabkan oleh minyak atau lemak tidak dapat dimatikan oleh air karena minyak atau lemaknya akan mengapung di atas air. Air justru akan menyebarkan apinya (Fessenden dan Fessenden 1997). Rumus umum dari heksana ditunjukkan pada Gambar 2.
CH3 CH2 CH2 CH2 CH2 CH3 Gambar 2 Rumus umum heksana. Sumber: Fessenden dan Fessenden (1997)
Etil asetat merupakan pelarut polar menengah (semi polar) yang volatil, tidak beracun dan tidak higroskopis. Etil asetat dapat melarutkan air hingga 3% dan larut dalam air hingga kelarutan 8% pada suhu kamar. Kelarutannya akan meningkat pada suhu yang lebih tinggi. Tetapi senyawa ini tidak stabil dalam air yang mengandung asam atau basa. Etil asetat adalah senyawa organik yang merupakan ester dari etanol dan asam asetat. Senyawa ini berwujud cairan tidak berwarna, memiliki aroma yang khas dan sering disingkat dengan EtOAc, dimana Et mewakili gugus etil dan OAc mewakiliki asetat. Etil asetat diproduksi dalam skala besar dan digunakan sebagai pelarut (Fessenden dan Fessenden 1997). Sintesis etil asetat ditunjukkan pada Gambar 3.
CH3CH2OH + CH3COOH → CH3COOCH2CH3 + H2O Gambar 3 Sintesis etil asetat.
Sumber: Fessenden dan Fessenden (1997)
Etil asetat merupakan pelarut semi polar yang mampu mengekstrak fenol, terpenoid, alkaloid, aglikon dan aglisida dari suatu bahan (Harborne 1987). Pambayun et al. (2007) menggunakan etil asetat sebagai salah satu pelarut dalam mengekstraksi gambir untuk mengetahui sifat antibakteri. Hasil dari penelitian tersebut menunjukkan bahwa ekstrak gambir dengan pelarut etil asetat memiliki aktivitas antibakteri paling baik apabila dibandingkan dengan ekstrak kloroform dan etanol karena ekstrak etil asetat diduga mengandung senyawa fenol yang paling tinggi, dimana senyawa fenol merupakan komponen terpenting terkait dengan sifat antibakteri.
pernafasan, maka metanol akan menimbulkan kebutaan. Terdapat laporan yang menjelaskan bahwa terjadi kematian yang disebabkan mimum metanol kurang dari 30 ml (Fessenden dan Fessenden 1997).
CO + 2H2
Gambar 4 Reaksi pembentukan metanol. Sumber: Fessenden dan Fessenden (1997)
Metanol juga dikenal sebagai alkohol kayu atau spiritus dan merupakan bentuk alkohol paling sederhana. Metanol digunakan sebagai bahan pendingin anti beku karena titik bekunya yang rendah yaitu -98oC, pelarut, bahan bakar dan sebagai bahan aditif pada industri etanol. Salah satu kelemahan metanol sebagai bahan bakar adalah sifat korosi terhadap beberapa logam, termasuk aluminium. Penggunaan metanol terbanyak saat ini adalah sebagai bahan pembuat bahan kimia lainnya. Sekitar 40% metanol diubah menjadi formaldehid yang kemudian diaplikasikan dalam berbagai macam produk seperti plastik, kayu lapis, cat, peledak dan tekstil (Fessenden dan Fessenden 1997). Yuharmen et al. (2002) menggunakan metanol sebagai pelarut dalam uji antimikroba dari lengkuas. Dari penelitian tersebut diperoleh informasi bahwa ekstrak metanol mengandung flavonoid, fenol dan terpenoid.
2.4. Bakteri
Bakteri adalah sel prokariotik yang khas, uniseluler dan rata-rata berukuran lebar 0,5-1,0 μm serta panjang hingga 10 μm. Bakteri memiliki peranan yang cukup penting dalam memelihara lingkungan, yaitu menghancurkan bahan-bahan yang tertumpuk di daratan maupun di perairan. Akan tetapi beberapa bakteri juga mampu menimbulkan efek negatif, seperti menyebabkan penyakit pada manusia, hewan dan tumbuhan (Irianto 2006).
2.4.1. Escherichia coli
batang tunggal dan berpasangan dengan ukuran 1,1-1,5 μm x 2,0-6,0 μm, diameter koloni 2-3 μm, memiliki kapsul dan mikrokapsul. E. coli tumbuh pada temperatur 15-45oC dengan suhu optimum 37oC (Fardiaz 1992).
E. coli merupakan penghuni normal saluran pencernaan (coliform fecal) manusia dan hewan, maka digunakan secara luas sebagai bioindikator pencemaran lingkungan. Bakteri ini juga mengakibatkan banyak infeksi pada saluran pencernaan makanan (enterik) manusia dan hewan (Pelczar dan Chan 1986).
Gambar 5 Bakteri Escherichia coli. Sumber: Wikipedia (2008b)
Bahan makanan yang sering terkontaminasi oleh E. coli antara lain daging ayam, daging sapi, daging babi, ikan dan makanan hasil laut lainnya, telur dan produk olahannya, sayuran, buah-buahan, sari buah serta minuman seperti susu (Fardiaz 1992). E. coli merupakan penyebab utama meningitis pada bayi yang baru lahir dan juga penyebab infeksi tractus urinarius pada manusia yang dirawat di rumah sakit (nosocomial infection) (Greeenwood et al. 1995).
2.4.2. Staphylococcus aureus
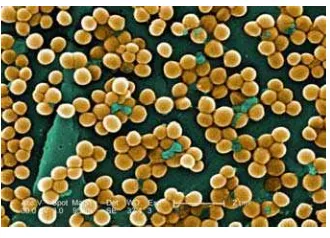
Gambar 6 Bakteri Staphylococcus aureus. Sumber: Dyer (2008)
S. aureus dapat dijumpai pada kulit, selaput lendir, bisul-bisul dan luka-luka. Bakteri ini sering ditemukan pada produk pangan dengan bahaya sedang dan penyebarannya terbatas. Ciri-ciri khusus S. aureus penyebab adalah memproduksi enterotoksin yang stabil terhadap pemanasan hingga 100oC selama beberapa menit, memproduksi toksin epidermolitik yang menyebabkan kulit melepuh dan menghasilkan Toxic Shock Syndrome Toxin (TSST 1) yang menyebabkan kerusakan pada jaringan (Greenwood et al. 1995).
S. aureus menghasilkan koagulase, dijumpai pada selaput hidung, kulit, kantung rambut, dapat menyebabkan keracunan makanan serta komplikasi pada influenza. Keracunan makanan yang umum terjadi karena termakannya toksin yang dihasilkan oleh galur-galur toksigenik S. aureus yang tumbuh pada makanan tercemar. Jumlah enterotoksin yang termakan menentukan waktu timbulnya gejala serta parah tidaknya infeksi tersebut. Pada umumnya gejala-gejala mual, pusing, muntah dan diare muncul 2-6 jam setelah mengkonsumsi makanan tercemar tersebut (Greenwood et al. 1995).
2.5. Uji Aktivitas Antibakteri
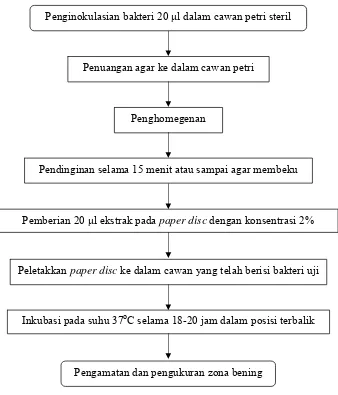
Zat-zat yang digunakan sebagai antibakteri harus mempunyai beberapa kriteria ideal, antara lain ekonomis, efektif, stabil, tidak bersifat racun bagi manusia atau hewan lain, tidak bergabung dengan komponen organik lain, memiliki aktivitas pada suhu kamar atau suhu tubuh, tidak menimbulkan karat atau warna dan tidak mempengaruhi bau (Irianto 2006). Salah satu metode uji aktivitas antibakteri yang banyak digunakan adalah metode uji aktivitas antibakteri Noer dan Nurhayati (2006) yang disajikan pada Gambar 7.
Gambar 7 Tahapan uji aktivitas antibakteri (Noer dan Nurhayati 2006).
Kerusakan bakteri merupakan hasil interaksi antibakteri dengan bagian tertentu pada sel bakteri. Interaksi antibakteri tersebut dapat menyebabkan sejumlah perubahan pada sel bakteri yang berakhir pada kematian sel bakteri.
Penuangan agar ke dalam cawan petri
Penghomegenan
Pendinginan selama 15 menit atau sampai agar membeku
Pemberian 20 μl ekstrak pada paper disc dengan konsentrasi 2%
Peletakkan paper disc ke dalam cawan yang telah berisi bakteri uji
Inkubasi pada suhu 37oC selama 18-20 jam dalam posisi terbalik Penginokulasian bakteri 20 μl dalam cawan petri steril
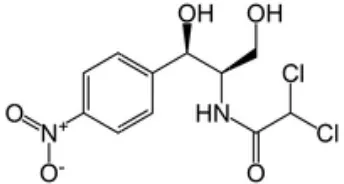
sintesa protein yang sangat diperlukan dalam perbanyakan dan pembelahan sel bakteri. Kloramfenikol merupakan antibiotik yang paling stabil. Zat ini juga cepat dan hampir sempurna diabsorpsi oleh saluran pencernaan (Fardiaz 1992).
3. METODOLOGI
3.1. Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan April hingga bulan November 2008 di Laboratorium Karakteristik Bahan Baku, Laboratourium Mikrobiologi Hasil Perairan, Laboratorium Biokimia Hasil Perairan, Program Studi Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, Pusat Antar Universitas Pangan dan Gizi serta Pusat Studi Biofarmaka, Institut Pertanian Bogor.
3.2. Alat dan Bahan
Alat-alat yang digunakan pada persiapan sampel antara lain pisau, talenan, timbangan digital dan kertas label. Alat-alat untuk ekstraksi sampel antara lain timbangan digital, gelas ukur, labu erlenmeyer, sudip kaca, kertas label, corong kaca, nyilon mesh, pipet tetes, kertas saring whatman, aluminium foil dan kapas steril. Alat-alat untuk evaporasi ekstrak antara lain vacuum rotary evaporator dan botol steril. Alat-alat untuk uji aktivitas antibakteri antara lain tabung reaksi, rak tabung reaksi, pipet tetes, pipet mikro, bulp, autoklaf, jarum ose, bunsen, inkubator, vorteks, cawan petri, paper disc dan plastik wrapping.
Bahan yang digunakan sebagai sampel adalah kerang darah (A. granosa) yang diambil dari pasar ikan Muara Angke, Jakarta Utara. Bahan untuk ekstraksi adalah pelarut teknis (heksana, etil asetat dan metanol). Bahan untuk uji aktivitas antibakteri adalah kloramfenikol sebagai antibakteri standar, NB (Nutrient Broth), TSA (Trypticase Soy Agar), media MHA (Mueller Hinton Agar), bakteri uji (Escherichia coli dan Staphylococcus aureus), akuades, korek api, spiritus dan alkohol 70%. Sedangkan bahan untuk analisis fitokimia antara lain H2SO4 2N, pereaksi Dragendorff, pereaksi Meyer, pereaksi Wagner, kloroform, H2SO4 pekat, anhidrida asetat, serbuk magnesium dan amil alkohol.
3.3. Metode Kerja
Analisis proksimat kerang darah meliputi uji kadar air, kadar abu, kadar lemak, kadar protein dan kadar karbohidrat. Ekstraksi senyawa bioaktif dari kerang darah dilakukan secara bertingkat dengan tiga pelarut yang berbeda tingkat kepolarannya, yaitu heksana (non polar), etil asetat (semi polar) dan metanol (polar). Ekstrak yang telah diperoleh kemudian diuji aktivitasnya sebagai senyawa antibakteri terhadap bakteri E. coli dan S. aureus. Ekstrak dengan kemampuan penghambatan paling baik kemudian diamati zona hambatnya selama tujuh hari pada suhu 10oC dan 30oC dan dianalisis fitokimia untuk mengetahui komponen-komponen yang terdapat dalam ekstrak.
3.3.1. Analisis proksimat
a. Analisis kadar air (AOAC 1995)
Cawan kosong yang digunakan dikeringkan dalam oven selama 15 menit atau sampai diperoleh berat tetap, kemudian didinginkan dalam desikator selama 30 menit dan ditimbang. Sampel kira-kira sebanyak 5 gram ditimbang dan diletakkan dalam cawan kemudian dipanaskan dalam oven selama 24 jam pada suhu 105oC. Cawan kemudian didinginkan dalam desikator kemudian ditimbang kembali. Persentase kadar air dapat dihitung dengan rumus sebagai berikut:
b. Analisis kadar abu (AOAC 1995)
desikator dan ditimbang. Rumus perhitungan kadar abu adalah sebagai
c. Analisis kadar protein (AOAC 1995)
Sampel ditimbang sebanyak 1-2 gram lalu dimasukkan ke dalam labu kjeldahl. Setelah itu ditambahkan 10 ml H2SO4 dan pelet kjeldahl kemudian sampel didihkan dalam ruang asam sampai larutan berwarna hijau kebiruan jernih. Larutan jernih ini lalu dipindahkan ke dalam labu ukur 100 ml. Labu kjeldahl dibilas dengan aquades (1-2 ml) kemudian air bilasan dimasukkan ke dalam labu ukur, selanjutnya diencerkan dengan aquades hingga 100 ml.
Sampel yang telah diencerkan dengan aquades dipipet sebanyak 10 ml dan dimasukkan dalam alat destilasi, kemudian ditambahkan sedikit demi sedikit NaOH 40% sebanyak 10 ml. Ujung tabung kondensor alat destilasi harus terendam dalam erlenmeyer yang berisi larutan asam borat (H3BO3) 4%. Dilakukan pemanasan alat destilasi hingga larutan asam borat yang semula berwarna merah muda menjadi berwarna hijau kebiruan. Selang kondensor kemudian dibilas dengan sejumlah aquades untuk menghindari kemungkinan adanya nitrogen yang menempel pada selang. Setelah itu erlenmeyer yang telah menangkap nitrogen dari sampel dititrasi dengan HCl 0,1 N hingga terjadi perubahan warna menjadi merah muda. Titrasi juga dilakukan terhadap larutan blanko.
d. Analisis kadar lemak (AOAC 1995)
kondensor diletakkan di bagian atas dan labu lemak diletakkan di bagian bawah. Pelarut heksana dimasukkan ke dalam labu lemak secukupnya. Selanjutnya dilakukan refluks selama minimal 5 jam sampai pelarut yang turun kembali ke dalam labu lemak berwarna jernih.
Pelarut yang ada dalam labu lemak didestilasi, dan pelarut ditampung kembali. Labu lemak yang berisi lemak hasil ekstraksi kemudian dipanaskan di dalam oven pada suhu 105oC hingga mencapai berat tetap dan setelah itu didinginkan dalam desikator. Selanjutnya labu beserta lemak didalamnya ditimbang dan berat lemak dapat diketahui.
%
e. Perhitungan kadar karbohidrat (AOAC 1995)
Perhitungan kadar karbohidrat dilakukan secara by different, yaitu dengan menggunakan rumus:
3.3.2. Ekstraksi senyawa bioaktif (Darusman et al. 1994)
Sampel dimaserasi dengan heksana selama 24 jam pada suhu ruang. Setelah 24 jam, sampel disaring menggunakan nyilon mesh sebagai saringan kasar, selanjutnya penyaringan dengan corong kaca dan kertas saring whatman
untuk memisahkan filtrat dengan ampas I. Ampas I kemudian dimaserasi dengan pelarut etil asetat selama 24 jam, disaring sehingga diperoleh filtrat etil asetat dan ampas II. Ampas II selanjutnya dimaserasi dengan pelarut metanol selama 24 jam, disaring sehingga diperoleh filtrat metanol dan residu III.
Filtrat heksana, filtrat etil asetat dan filtrat metanol yang diperoleh selanjutnya dievaporasi dengan menggunakan vacuum rotary evaporator pada suhu 40oC, sehingga diperoleh ekstrak kasar dari pelarut heksana, etil asetat dan metanol. Ekstrak yang diperoleh dimasukkan dalam botol steril untuk mencegah kontaminasi kemudian disimpan dalam freezer. Tahapan proses ekstraksi dapat dilihat pada Gambar 9.
3.3.3. Uji aktivitas antibakteri dari ekstrak kasar kerang darah (Anadara granosa) (Noer dan Nurhayati 2006)
Uji aktivitas antibakteri dilakukan terhadap ekstrak kerang darah (A. granosa). Uji ini meliputi persiapan media padat TSA, persiapann media cair
NB, persiapan suspensi bakteri, persiapan media padat MHA, prosedur uji pendahuluan aktivitas antibakteri, prosedur uji aktivitas antibakteri dengan berbagai konsentrasi dan pengukuran zona hambat. Bakteri uji yang digunakan adalah E. coli dan S. aureus. Pengujian aktivitas antibakteri dilakukan dengan metode difusi agar menggunakan paper disc.
a) Persiapan media padat TSA
Gambar 9 Tahapan proses ekstraksi (Darusman et al. 1994). Keterangan: Produk
Proses
Pemisahan daging dari cangkang
Penimbangan Pencacahan Pencucian
Maserasi dengan heksana (24 jam)
Penyaringan
Evaporasi
Evaporasi
Penyaringan
Evaporasi Maserasi dengan etil asetat (24 jam)
Maserasi dengan metanol (24 jam) Kerang darah (Anadara granosa)
Ekstrak kasar heksana
Ekstrak kasar etil asetat
Ekstrak kasarmetanol
Residu III Ampas II
Ampas I
Penyaringan Filtrat heksana
Filtrat etil asetat
b) Persiapan media cair NB
Media NB (Nutrient Broth) dibuat dari 2,6 gram media NB bubuk yang dilarutkan dalam aquades hingga volume 200 ml, selanjutnya dipanaskan sambil diaduk hingga mendidih. NB dipipet sebanyak 9 ml kedalam tabung reaksi dan masing-masing tabung ditutup menggunakan kapas dan alumunium foil. Sebelum digunakan, media disterilisasi dengan autoklaf pada suhu 121oC selama 15 menit. Setelah itu media didinginkan di tempat yang steril pada suhu ruang.
c) Persiapan suspensi bakteri
Sebanyak 1 ose bakteri uji digoreskan pada media TSA dengan pola zig zag secara aseptik, selanjutnya diinkubasi pada suhu 37oC selama 18-24 jam. Setelah itu 1-2 ose bakteri uji dari media TSA dimasukkan ke dalam media NB yang telah dingin secara aseptik. Selanjutnya diinkubasi pada suhu 37oC selama 18-24 jam.
d) Persiapan media padat MHA
Media padat yang digunakan untuk pengujian aktivitas antibakteri adalah media Mueller Hinton Agar (MHA). MHA dibuat dengan melarutkan 7,6 gram media MHA bubuk dalam aquades hingga volume 200 ml, kemudian dipanaskan sambil diaduk hingga mendidih. Larutan dipipet 15 ml, kemudian dimasukkan ke dalam tabung reaksi dan masing-masing tabung ditutup dengan kapas dan alumunium foil. Sebelum digunakan, media disterilisasi dengan autoklaf pada suhu 121oC selama 15 menit. Media didinginkan pada suhu ruang sampai agar membeku. Setelah membeku, media disimpan dalam refrigerator.
Media agar tersebut didiamkan pada suhu ruang selama 15 menit atau sampai agar membeku.
Ekstrak kerang darah yang digunakan dalam uji aktivitas antibakteri adalah ekstrak kerang darah dengan pelarut etil asetat dan ekstrak kerang darah dengan pelarut metanol karena ekstrak kerang darah dengan pelarut heksana yang diperoleh sangat sedikit. Dalam uji aktivitas antibakteri, setiap
paper disc diberi ekstrak sebanyak 20 μl dengan konsentrasi 2% (20 mg ekstrak yang dilarutkan dalam 1 ml metanol). Konsentrasi kloramfenikol yang digunakan sebagai antibakteri kontrol juga sama dengan konsentrasi ekstrak yang digunakan, yaitu 2%. Setelah seluruh pelarut ekstrak pada paper disc
menguap, masing-masing paper disc diletakkan dalam cawan petri yang telah berisi agar dan bakteri, kemudian cawan petri dilapisi dengan plastik wrapping
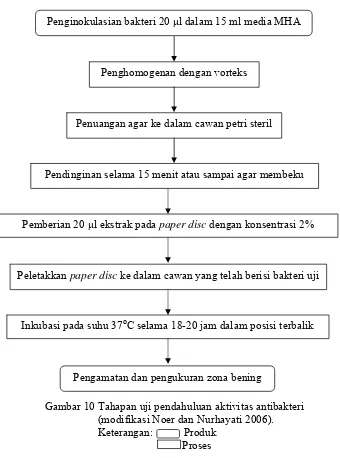
untuk menghindari kontaminasi dan disimpan dalam inkubator dengan posisi terbalik pada suhu 37oC selama 18-20 jam. Aktivitas antibakteri dapat dilihat dengan mengamati zona hambat yang terbentuk disekitar paper disc. Diagram alir uji pendahuluan aktivitas antibakteri dapat dilihat pada Gambar 10.
f) Prosedur uji aktivitas antibakteri pada berbagai konsentrasi ekstrak (modifikasi Darusman et al. 1994)
Media MHA sebanyak 15 ml dalam keadaan cair ditambahkan dengan 20 μl bakteri uji yang telah diukur OD-nya (Optical Density) antara 0,6-0,8 (Lalitha 2004) pada panjang gelombang 600 nm, masing-masing 0,797 (E. coli) dan 0,750 (S. aureus), kemudian divorteks agar homogen dan segera dituangkan ke dalam cawan petri steril dan digoyangkan membentuk angka delapan agar menyebar secara merata. Media tersebut didiamkan pada suhu ruang selama beberapa saat agar membeku.
dalam cawan petri berisi MHA dan bakteri yang telah membeku, kemudian cawan petri dilapisi dengan plastik wrapping untuk mencegah kontaminasi dan selanjutnya diinkubasi dengan posisi terbalik selama 18-20 jam pada suhu 37oC. Diagram alir uji aktivitas antibakteri pada berbagai konsentrasi ekstrak dapat dilihat pada Gambar 11. Setelah diinkubasi selama 18-20 jam, selanjutnya dilakukan pengamatan zona bening selama tujuh hari pada ekstrak dengan kemampuan penghambatan paling baik dengan penyimpanan pada suhu 10oC dan pada suhu 30oC untuk mengetahui kemampuan ekstrak dalam menghambat pertumbuhan bakteri (modifikasi Darusman et al. 1994).
Gambar 10 Tahapan uji pendahuluan aktivitas antibakteri (modifikasi Noer dan Nurhayati 2006). Keterangan: Produk
Proses
Penghomogenan dengan vorteks
Penuangan agar ke dalam cawan petri steril
Pendinginan selama 15 menit atau sampai agar membeku
Pemberian 20 μl ekstrak pada paper disc dengan konsentrasi 2%
Peletakkan paper disc ke dalam cawan yang telah berisi bakteri uji
Inkubasi pada suhu 37oC selama 18-20 jam dalam posisi terbalik Penginokulasian bakteri 20 μl dalam 15 ml media MHA
g) Pengukuran zona hambat
Aktivitas antibakteri dinyatakan positif apabila terbentuk zona hambat berupa zona bening disekeliling paper disc dan aktivitas antibakteri dinyatakan negatif apabila tidak terbentuk zona bening. Diameter zona hambat dihitung dengan rumus sebagai berikut:
B -A hambat
Zona =
Keterangan :
A = Diameter zona hambat yang terbentuk (mm)
B = Diameter kertas cakram (mm)
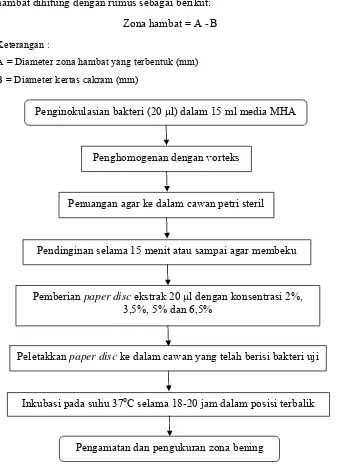
Gambar 11 Tahapan uji aktivitas antibakteri pada berbagai konsentrasi ekstrak (modifikasi Darusman et al. 1994).
Keterangan: Produk Proses
Penghomogenan dengan vorteks
Penuangan agar ke dalam cawan petri steril
Pendinginan selama 15 menit atau sampai agar membeku
Pemberian paper disc ekstrak 20 μl dengan konsentrasi 2%, 3,5%, 5% dan 6,5%
Peletakkan paper disc ke dalam cawan yang telah berisi bakteri uji
Inkubasi pada suhu 37oC selama 18-20 jam dalam posisi terbalik Penginokulasian bakteri (20 μl) dalam 15 ml media MHA
3.3.4. Analisis fitokimia
Identifikasi komponen aktif yang berperan sebagai antibakteri dalam kerang darah (A. granosa) dilakukan terhadap senyawa alkaloid, flavonoid dan steroid (Darusman et al. 1994) dengan metode sebagai berikut (Harborne 1987): a) Alkaloid (Harborne 1987)
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2N kemudian diuji dengan tiga pereaksi Alkaloid, yaitu pereaksi Dragendorff, Meyer dan Wagner. Hasil uji dinyatakan positif bila pereaksi Meyer terbentuk endapan putih kekuningan, endapan cokelat dengan pereaksi Wagner dan endapan merah sampai jingga dengan pereaksi Dragendorff.
b) Steroid (Harborne 1987)
Sejumlah sampel dilarutkan dalam 2 ml kloroform dalam tabung reaksi yang kering. Ke dalamnya ditambahkan 10 tetes anhidrida asetat dan 3 tetes H2SO4 pekat. Terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau menunjukkan reaksi positif.
c) Flavonoid (Harborne 1987)
4. HASIL DAN PEMBAHASAN
4.1. Analisis Proksimat
Kerang darah yang digunakan dalam penelitian ini merupakan kerang darah yang diambil dari pasar ikan Muara Angke, Jakarta Utara pada bulan September 2008. Analisis proksimat yang dilakukan pada kerang darah meliputi uji kadar air, kadar abu, kadar protein, kadar lemak dan kadar karbohidrat. Data analisis proksimat kerang darah ditunjukkan pada Tabel 4.
Tabel 4 Data proksimat kerang darah Tabel 5 Kadar proksimat kerang
Kerang darah contoh memiliki rendemen sebesar 17,17%. Nilai rendemen diperoleh melalui perbandingan berat daging kerang darah setelah dipreparasi dengan berat kerang darah sebelum dipreparasi dan dinyatakan dalam persen. Berat kerang darah contoh sebelum dipreparasi adalah 6 kg dan berat daging kerang darah contoh setelah dipreparasi adalah 1,03 kg. Perhitungan rendemen daging kerang darah dapat dilihat pada Lampiran 1.
Berdasarkan Tabel 4 dan Tabel 5, diketahui bahwa kadar air kerang darah contoh adalah 81,82%, nilai tersebut lebih rendah apabila dibandingkan dengan kadar air kerang secara umum menurut Poedjiadi (1994) yaitu sebesar 85%. Analisis kadar abu kerang darah contoh menunjukkan hasil sebesar 2% dimana nilai tersebut lebih rendah apabila dibandingkan dengan kadar abu kerang secara umum menurut Poedjiadi (1994) yaitu sebesar 2,3%.
sebesar 0,60%. Kadar karbohidrat kerang darah contoh sebesar 3,75%. Nilai tersebut telah sesuai dengan kadar kerang secara umum menurut Poedjiadi (1994) yang menyebutkan bahwa kadar karbohidrat kerang adalah 3,6%.
Perbedaan kadar proksimat kerang darah contoh dengan kerang pada umumnya diduga karena terjadinya perbedaan waktu dan lokasi pengambilan contoh. Dugaan tersebut diperkuat oleh pernyataan Trilaksani dan Nurjanah (2004) diacu dalam Erianto (2005) yang menjelaskan bahwa perbedaan komposisi kimia kerang darah terjadi karena adanya perbedaan waktu dan lokasi pengambilan contoh. Komposisi kimia kerang sangat bervariasi, tergantung pada spesies, jenis kelamin, umur, musim dan habitat.
4.2. Ekstraksi Komponen Bioaktif
Tahap ekstraksi merupakan tahap awal ekstraksi senyawa bioaktif dari kerang darah. Metode ekstraksi yang digunakan pada penelitian ini adalah metode ekstraksi bertingkat menurut Darusman et al. (1994). Pelarut yang digunakan dalam ekstaksi ini berturut-turut adalah heksana (non polar), etil asetat (semi polar) dan metanol (polar). Kesempurnaan esktraksi bertingkat tergantung pada jenis ekstraksi yang dilakukan, terutama apabila ekstraksi dilakukan secara berulang dengan jumlah pelarut sedikit demi sedikit. Ekstraksi dengan pelarut heksana dilakukan pada awal proses dengan tujuan memisahkan lipid dari bahan sehingga tidak menghalangi keluarnya senyawa bioaktif pada ekstraksi dengan pelarut-pelarut berikutnya. Proses ekstraksi selanjutnya digunakan pelarut etil asetat untuk mengekstrak senyawa semi polar dan terakhir pelarut metanol untuk mengekstrak senyawa polar.
Proses maserasi dilakukan selama 24 jam dengan cara merendam sampel dalam pelarut dengan perbandingan 1:2. Pengadukan dilakukan sebanyak beberapa kali untuk meningkatkan tumbukan antara partikel bahan yang diekstraksi dengan pelarut sehingga komponen bioaktif yang keluar dari jaringan dan larut dalam pelarut juga semakin meningkat.
penguap putar yang hampa (rotary vacuum evaporator) pada suhu tidak terlalu tinggi (30-40oC) untuk mencegah terjadi kerusakan pada komponen aktif.
Ekstraksi kerang darah dengan tiga jenis pelarut menghasilkan ekstrak dari pelarut heksana, ekstrak dari pelarut etil asetat dan ekstrak dari pelarut metanol dengan berat masing-masing ekstrak ditunjukkan pada Tabel 6. Ekstrak yang diperoleh dari ekstraksi kerang darah merupakan ekstrak kasar karena belum mengalami pemurnian. Pemurnian ekstrak kasar dapat dilakukan dengan fraksinasi untuk memisahkan golongan utama kandungan yang satu dari golongan utama yang lainnya(Harborne 1987).
Tabel 6 Berat ekstrak kasar kerang darah (A. granosa) Jenis pelarut Berat ekstrak (mg) Heksana
terpenoid, alkaloid, aglikon dan aglisida (Harborne 1987). Ekstrak yang dihasilkan dari ekstraksi dengan pelarut heksana memiliki nilai yang rendah dikarenakan heksana merupakan pelarut non polar yang biasa digunakan untuk memisahkan lipid dari bahan.
Gambar 12 Ekstrak kerang darah.
Keterangan: A = Ekstrak kerang darah dengan pelarut heksana B = Ekstrak kerang darah dengan pelarut etil asetat C = Ekstrak kerang darah dengan pelarut metanol
Jumlah ekstrak kerang darah yang diperoleh dari hasil penelitian ini sangat sedikit, karena daging kerang yang diekstrak dicacah secara kasar, diduga dengan pencacahan lebih halus akan menghasilkan ekstrak yang lebih banyak karena partikel pelarut akan lebih banyak yang bertumbukan dengan partikel bahan. Waktu ekstraksi juga diduga berpengaruh terhadap jumlah ekstrak kerang darah yang dihasilkan. Pada penelitian ini ekstraksi kerang darah dilakukan selama 24 jam, apabila waktu ekstraksi ditambah, diduga jumlah senyawa aktif yang terekstrak juga akan meningkat. Perbandingan pelarut dengan bahan pada penelitian ini adalah 1:2, apabila jumlah pelarut ditambah, diduga juga akan meningkatkan jumlah ekstrak. Dugaan tersebut diperkuat oleh pustaka yang menyatakan bahwa hasil ekstraksi yang diperoleh tergantung pada beberapa faktor, yaitu kondisi alamiah senyawa, metode ekstraksi yang digunakan, ukuran
B
partikel sampel, kondisi ekstraksi, lama ekstraksi dan perbandingan jumlah pelarut dengan jumlah sampel (Houghton & Raman 1998).
Bobot ekstrak dengan pelarut heksana, ekstrak dengan pelarut etil asetat dan ekstrak dengan pelarut metanol kerang darah yang dihasilkan dapat digunakan untuk mengetahui nilai rendemen ekstrak. Rendemen merupakan perbandingan antara bobot ekstrak yang dihasilkan dengan bobot awal dan dinyatakan dalam persen. Rendemen ekstrak kerang darah mengalami peningkatan seiring dengan peningkatan kepolaran pelarut yang digunakan (Gambar 13).
Gambar 13 Rendemen ekstrak kerang darah dengan tiga jenis pelarut. Gambar 13 menunjukkan bahwa rendemen terbesar ekstrak kerang darah adalah ekstrak dengan pelarut metanol, yaitu sebesar 0,4978% dan ekstrak terkecil adalah ekstrak dengan pelarut heksana sebesar 0,0015%, sedangkan ekstrak dengan pelarut etil asetat yang dihasilkan sebesar 0,0538%. Rendemen ekstrak dengan pelarut metanol dan pelarut etil asetat pada kerang darah yang cukup besar menunjukkan bahwa komponen organik pada kerang darah diduga bersifat polar polar dan semi polar karena dapat larut pada pelarut metanol dan etil asetat.
4.3. Uji Aktivitas Antibakteri
4.3.1. Uji pendahuluan aktivitas antibakteri
Ekstrak kerang darah yang telah diperoleh dari proses ekstraksi selanjutnya diuji aktivitasnya sebagai senyawa antibakteri terhadap dua jenis bakteri patogen yang mewakili bakteri gram positif dan bakteri gram negatif, yaitu
S. aureus (OD = 0,723) dan E. coli (OD = 0,788). Lalitha (2004) menjelaskan bahwa interval OD (Optical Density) bakteri yang digunakan pada uji antibakteri adalah 0,6-0,8. Davis dan Strout (1971) dalam penelitiannya menjelaskan bahwa antibiotik dengan diameter zona hambat 20 mm atau lebih berarti sangat kuat, diameter zona hambat 10-20 mm berarti kuat, diameter zona hambat 5-10 mm berarti sedang dan diameter zona hambat 5 mm atau kurang berarti lemah. Hasil pengujian aktivitas antibakteri ekstrak kerang darah dengan konsentrasi ekstrak 2% disajikan pada Tabel 7.
Tabel 7 Aktivitas antibakteri ekstrak kerang darah pada konsentrasi 2%
Jenis bakteri
Diameter zona hambat (mm) Ekstrak kerang
Berdasarkan Tabel 7 dapat diketahui bahwa ekstrak kerang darah dengan pelarut etil asetat memiliki daya hambat sedang dalam menghambat pertumbuhan bakteri E. coli dengan diameter zona hambat sebesar 6 mm dan bakteri S. aureus
ekstraksi senyawa antibakteri dari produk gambir (Pambayun et al. 2007). Aktivitas antimikroba in vitro dipengaruhi beberapa hal, seperti pH lingkungan, komponen-komponen media, stabilitas obat, takaran inokulum, lama inkubasi serta aktivitas metabolisme mikroorganisme (Irianto 2006). Uji aktivitas antibakteri tidak dilakukan pada ekstrak kerang darah dengan pelarut heksana karena rendemen ekstrak yang sedikit.
Hasil positif uji antibakteri oleh ekstrak kerang darah dengan pelarut etil asetat dan hasil negatif uji antibakteri oleh ekstrak kerang darah dengan pelarut metanol pada konsentrasi 2% menunjukkan dugaan bahwa komponen aktif pada kerang darah yang berpotensi sebagai senyawa antibakteri bersifat semi polar karena terlarut pada pelarut etil asetat yang bersifat semi polar. Dugaan ini didukung oleh pustaka yang menyatakan bahwa senyawa polar lebih mudah larut dalam pelarut polar, senyawa semi polar mudah larut pada pelarut semi polar dan senyawa non polar lebih larut dalam pelarut non polar (Sudarmadji et al. 2007).
Kloramfenikol sebagai antibakteri kontrol mampu menghasilkan zona hambat dengan diameter sebesar 23 mm pada E. coli dan 28 mm pada S. aureus
pada konsentrasi kloramfenikol sebesar 2%. Berdasarkan diameter zona hambat yang dihasilkan, kloramfenikol termasuk antibakteri dengan kemampuan penghambatan kuat. Hasil tersebut didukung oleh penjelasan pada penelitian Davis dan Strout (1971) yang menyatakan bahwa antibiotik dengan diameter zona hambat 10-20 mm termasuk antibiotik kuat.
Zona hambat yang dihasilkan kloramfenikol jauh lebih besar apabila dibandingkan dengan zona hambat yang dihasilkan ekstrak kerang darah dengan pelarut etil asetat dan ekstrak kerang darah dengan pelarut metanol. Hal tersebut dikarenakan kloramfenikol merupakan antibiotik yang memiliki spektrum luas dalam menghambat pertumbuhan bakteri baik gram positif maupun gram negatif (Pelczar dan Chan 1988).
4.3.2. Uji aktivitas antibakteri dengan berbagai konsentrasi
digunakan adalah 2%, 3,5%, 5% dan 6,5% (modifikasi Darusman et al. 1994) dengan ukuran masing-masing diameter zona hambat yang dihasilkan tertera pada Tabel 8.
Uji aktivitas antibakteri dengan berbagai konsentrasi ekstrak dilakukan untuk mengetahui konsentrasi minimum dari tiap ekstrak yang dapat menghambat aktivitas pertumbuhan bakteri uji. Uji aktivitas dilakukan pada 15 ml media MHA menggunakan paper disk yang telah ditetesi 20 μl ekstrak dengan konsentrasi masing-masing adalah 2%, 3,5%, 5% dan 6,5% terhadap dua bakteri uji, yaitu
Staphylococcus aureus dan Escherichia coli. Contoh perhitungan konsentrasi ekstrak per paper disk dapat dilihat pada Lampiran 6.
Tabel 8 Aktivitas antibakteri ekstrak kerang darah pada berbagai konsentrasi Konsentrasi ekstrak
kerang darah dengan pelarut etil asetat (%)
Zona hambat (mm)
lemah dalam menghambat pertumbuhan S. aureus pada konsentrasi 2% dan 3,5% dengan diameter zona hambat masing-masing 3 mm dan 4 mm tetapi memiliki aktivitas sedang pada konsentrasi 5% dan 6,5% dengan diameter zona hambat masing-masing 6 mm dan 7 mm. Hasil pengukuran diameter zona hambat tersebut menunjukkan bahwa ekstrak kerang darah dengan pelarut etil asetat dengan konsentrasi 6,5% pada bakteri E. coli memiliki kekuatan sama dengan ekstrak kerang darah dengan pelarut etil asetat 3,5% dalam menghambat aktivitas pertumbuhan bakteri S. aureus yaitu dengan diameter zona hambat sebesar 4 mm. Ekstrak kerang darah dengan pelarut etil asetat dengan konsentrasi 5% dalam menghambat pertumbuhan bakteri E. coli memiliki diameter zona hambat yang sama dengan ekstrak kerang darah dengan pelarut etil asetat 2% dalam menghambat bakteri S. aureus yaitu sebesar 3 mm.
Ekstrak kerang darah dengan pelarut metanol tidak menunjukkan aktivitas penghambatan pada pertumbuhan bakteri E. coli dan S. aureus pada konsentrasi 2% dan 3,5%, tetapi menunjukkan aktivitas lemah pada konsentrasi 5% dan 6,5% dengan diameter zona hambat masing-masing 0,5 mm dan 1 mm. Hal tersebut diduga karena komponen aktif yang berpotensi sebagai antibakteri yang terlarut dalam ekstrak kerang darah dengan pelarut metanol lebih rendah apabila dibandingkan dengan komponen antibakteri yang terlarut pada etil asetat sehingga kemampuan penghambatan ekstrak kerang darah dengan pelarut metanol lebih rendah.
Diameter zona hambat yang dihasilkan ekstrak kerang darah dengan pelarut etil asetat dan ekstrak kerang darah dengan pelarut metanol pada bakteri
E. coli selalu lebih kecil apabila dibandingkan dengan diameter zona hambat bakteri S. aureus. Kondisi tersebut diduga karena E. coli lebih tahan terhadap senyawa antibakteri apabila dibandingkan dengan S. aureus. Dugaan tersebut didukung oleh pernyataan yang menyebutkan bahwa bakteri gram positif lebih sensitif terhadap penambahan desinfektan daripada bakteri gram negatif (Greenwood et al. 1995). Alakomi et al. (2000) diacu dalam Adolf (2006) juga menjelaskan bahwa S. aureus merupakan bakteri gram positif yang memiliki 40 lapisan peptidoglikan dan merupakan 50% dari bahan dinding sel. Bakteri E. coli
merupakan 5-10% dari bahan dinding sel tetapi bakteri gram negatif memiliki lapisan tambahan pada dinding sel yang disebut membran luar terdiri dari lapisan lipopolisakarida yang berfungsi sebagai penghalang masuknya senyawa-senyawa yang tidak diperlukan sel, sehingga bakteri gram negatif lebih resisten terhadap adanya senyawa asing, seperti senyawa antibakteri, karena terlebih dulu ditahan oleh membran luar yang berupa lipopolisakarida.
Daya hambat yang dihasilkan ekstrak kerang darah dengan pelarut etil asetat lebih besar daripada daya hambat yang dihasilkan oleh ekstrak kerang darah dengan pelarut metanol dikarenakan etil asetat merupakan pelarut semi polar yang mampu mengekstrak senyawa fenol, terpenoid dan alkaloid sedangkan pelarut metanol mampu mengekstrak alkaloid kuartener dan komponen fenolik lainnya (Harborne 1987). Darusman et al. (1994) menjelaskan bahwa beberapa komponen yang berpotensi sebagai senyawa antibakteri antara lain senyawa alkaloid, terpenoid dan flavonoid.
Zona hambat yang dihasilkan oleh kloramfenikol, baik bakteri E. coli
maupun S. aureus, jauh lebih besar apabila dibandingkan dengan zona hambat yang dihasilkan oleh ekstrak kerang darah dengan pelarut metanol dan ekstrak kerang darah dengan pelarut etil asetat. Hal ini dikarenakan kloramfenikol mampu menghambat pertumbuhan bakteri dalam spektrum yang luas dalam konsentrasi rendah. Aktivitas antibakteri kloramfenikol tidak bisa dibandingkan dengan aktivitas antibakteri ekstrak kerang darah dengan pelarut etil asetat maupun ekstrak kerang darah dengan pelarut metanol dari segi diameter zona hambat yang dihasilkan, tetapi apabila dilihat dari segi keamanan maka ekstrak kerang darah dengan pelarut etil asetat dan ekstrak kerang darah dengan pelarut metanol akan memiliki keunggulan karena sumber bahan bakunya yang berasal dari alam, sedangkan kloramfenikol merupakan senyawa antimikroba sintesis yang berbahaya bagi kesehatan. Darmowandowo dan Kaspan (2009) menyatakan bahwa akumulasi kloramfenikol yang berlebihan dalam tubuh akan menyebabkan gangguan kesehatan seperti gangguan pada sumsum tulang belakang, leukimia dan gray baby syndrome.
pendahuluan aktivitas antibakteri berbeda dengan diameter zona hambat ekstrak kerang darah dengan pelarut etil asetat dan ekstrak kerang darah dengan pelarut metanol pada uji aktivitas antibakteri dengan berbagai konsentrasi ekstrak, hal ini diduga karena terjadi perbedaan waktu pengambilan sampel kerang darah. Kerang darah yang digunakan pada uji pendahuluan aktivitas antibakteri diambil dari pasar ikan Muara Angke, Jakarta Utara pada bulan September 2008 sedangkan kerang darah yang digunakan pada uji aktivitas antibakteri pada berbagai konsentrasi ekstrak diambil dari pasar ikan Muara Angke, Jakarta Utara pada bulan November 2008. Perbedaan waktu pengambilan sampel tersebut diduga berkaitan dengan perbedaan musim, karena perbedaan musim menyebabkan terjadinya perubahan metabolisme pada tubuh organisme akibat perubahan kondisi lingkungan, sehingga menyebabkan komponen aktif yang terdapat dalam tubuh juga mengalami perubahan. Dugaan tersebut didukung oleh Hans (2004) yang menyebutkan bahwa senyawa bioaktif hasil ekstraksi dari organisme yang hidup pada lingkungan dengan tingkat gangguan rendah berbeda dengan senyawa bioaktif yang dihasilkan oleh organisme yang hidup pada lingkungan dengan tingkat gangguan tinggi. Hal ini dikarenakan organisme yang hidup di lingkungan dengan tingkat gangguan rendah menggunakan energinya untuk pertumbuhan dan reproduksi, sehingga produksi metabolit sekunder yang dihasilkan lebih rendah. Organisme yang hidup pada lingkungan dengan tingkat gangguan tinggi menggunakan energinya untuk pertumbuhan, reproduksi dan memproduksi metabolit sekunder sebagai fasilitas untuk pertahanan diri, sehingga ketika dilakukan ekstraksi maka senyawa bioaktif yang dihasilkan dari organisme yang hidup di daerah dengan gangguan tinggi akan lebih besar daripada organisme yang hidup di daerah dengan gangguan lingkungan yang lebih rendah.