1
UIN SYARIF HIDYATULLAH JAKARTA
UJI AKTIVITAS ANTIBAKTERI EKSTRAK DAN
FRAKSI DAUN SINTOK (
Cinnamomum sintoc
Blume.)
TERHADAP
Staphylococcus aureus
DAN
Pseudomonas
aeruginosa
SERTA ANALISA KOMPONEN SENYAWA
FRAKSI AKTIF DENGAN KROMATOGRAFI GAS -
SPEKTROMETRI MASSA
SKRIPSI
ZAKIYA KAMILA MUHAMAD
1110102000012
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ii
UIN SYARIF HIDYATULLAH JAKARTA
UJI AKTIVITAS ANTIBAKTERI EKSTRAK DAN
FRAKSI DAUN SINTOK (
Cinnamomum sintoc
Blume.)
TERHADAP
Staphylococcus aureus
DAN
Pseudomonas
aeruginosa
SERTA ANALISA KOMPONEN SENYAWA
FRAKSI AKTIF DENGAN KROMATOGRAFI GAS -
SPEKTROMETRI MASSA
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi
ZAKIYA KAMILA MUHAMAD
1110102000012
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
iii
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah hasil karya sendiri,
dan semua sumber yang dikutip maupun dirujuk
telah saya nyatakan dengan benar.
Nama : Zakiya Kamila Muhamad
NIM : 1110102000012
Tanda Tangan :
iv
HALAMAN PERSETUJUAN PEMBIMBING
Nama : Zakiya Kamila Muhamad
NIM : 1110102000012
Program Studi : Farmasi
Judul : Uji Aktivitas Antibakteri Ekstrak dan Fraksi Daun Sintok (Cinnamomum sintoc. Blume) terhadap Staphylococcus aureus
dan Pseudomonas aeruginosa serta Analisa Komponen Senyawa Fraksi Aktif dengan Kromatografi Gas – Spektrometri Massa.
Menyetujui, Pembimbing I
Prof. Dr. Atiek Soemiati, Apt. M.S
Pembimbing II
Arief Heru Prianto, M.Si NIP: 197805032003121002
Mengetahui,
Ketua Program Studi Farmasi FKIK UIN Syarif Hidayatullah Jakarta
v
HALAMAN PENGESAHAN SKRIPSI
Skripsi ini diajukan oleh :
Nama : Zakiya Kamila Muhamad
NIM : 1110102000012
Program Studi : Farmasi
Judul : Uji Aktivitas Antibakteri Ekstrak dan Fraksi Daun Sintok (Cinnamomum sintoc. Blume) terhadap Staphylococcus aureus
dan Pseudomonas aeruginosa serta Analisa Komponen Senyawa Fraksi Aktif dengan Kromatografi Gas – Spektrometri Massa.
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
DEWAN PENGUJI
Pembimbing 1 : Prof. Dr. Atiek Soemiati, Apt. M.S ( ) Pembimbing 2 : Arief Heru Prianto, M.Si ( ) Penguji 1 : Drs. Umar Mansur, Msc., Apt. ( ) Penguji 2 : Puteri Amelia M.Farm., Apt. ( )
Ditetapkan di : Jakarta
vi ABSTRAK
Nama : Zakiya Kamila Muhamad Jurusan : Farmasi
Judul : Uji Aktivitas Antibakteri Ekstrak dan Fraksi Daun Sintok (Cinnamomum sintoc. Blume) terhadap Staphylococcus aureus
dan Pseudomonas aeruginosa serta Analisa Komponen Senyawa Fraksi Aktif dengan Kromatografi Gas – Spektrometri Massa.
Cinnamomum sintoc Blume. merupakan salah satu tanaman yang terdapat di hutan tropis Indonesia yang secara empiris digunakan untuk pengobatan luka dan diare (Soh wuu - kuang, 2011). Penelitian ini bertujuan mengetahui aktivitas antibakteri ekstrak n– heksana, etil asetat, metanol daun Cinnamomum sintoc dan fraksi dari ekstrak yang mempunyai aktivitas antibakteri tertinggi. Ekstrak n –
heksana, etil asetat dan metanol diperoleh dengan metode maserasi bertingkat, ketiga ekstrak tersebut diuji dengan metode difusi cakram untuk mengetahui aktivitas antibakterinya. Dari ketiga ekstrak tersebut, ekstrak etil asetat memiliki aktivitas antibakteri tertinggi dengan rata – rata diameter zona hambat 10,85 mm terhadap bakteri Staphylococcus aureus ATCC 25923 dan 11,625 mm terhadap bakteri Pseudomonas aeruginosa ATCC 27853. Ekstrak etil asetat kemudian difraksinasi menggunakan kromatografi kolom dan didapatkan 10 fraksi. Kesepuluh fraksi tersebut diuji dengan metode bioautografi untuk mengetahui aktivitas antibakterinya. Fraksi 1 mempunyai aktivitas antibakteri tertinggi terhadap bakteri Pseudomonas aeruginosa ATCC 27853, tetapi tidak mempunyai aktivitas antibakteri terhadap Staphylococcus aureus ATCC 2592. Fraksi 8 mempunyai aktivitas antibakteri tertinggi terhadap bakteri Staphylococcus aureus ATCC 2592, tetapi tidak mempunyai aktivitas antibakteri terhadap Pseudomonas aeruginosa ATCC 27853. Hasil pengujian mikrodilusi menunjukkan nilai KHM fraksi 1 yaitu 12,5 mg/ml terhadap bakteri Pseudomonas aeruginosa ATCC 27853. Hasil Kromatografi Gas – Spektrometri Massa dari fraksi 1 diperoleh 21 senyawa yang merupakan golongan sesquiterpen (47,42%), fenol (5,88%), aldehid alifatik (21,8%), ester (1,32%), asam lemak (2,65%), sesquiterpen alkohol (1,4%), keton alifatik (2,64%), hidrokarbon alifatik (4,94%), dan alkohol (11,94%). Senyawa yang memiliki kelimpahan terbesar yaitu δ – Cadinene (14,34%) dan
Myristaldehyde (13,03%).
vii ABSTRACT
Name : Zakiya Kamila Muhamad Program Study : Pharmacy
Title : Antibacterial Activity of Leaf Extracts and Fractions of Sintok (Cinnamomum sintoc. Blume) against Staphylococcus aureus
and Pseudomonas aeruginosa, and Gas Chromatography – Mass Spectrometry Analysis of Chemical Constituent of Active Fraction.
Cinnamomum sintoc is one of the plants which are founded in the tropical forest of Indonesia, which empirically is used for the medicinal treatment of wounds and diarrhea. This study aims to determine the antibacterial activity of extracts n - hexane, ethyl acetate, methanol of leaf Cinnamomum sintoc and fractions of the extract which has the highest antibacterial activity. Extract n - hexane, ethyl acetate and methanol are obtained with multistage maceration method, those extracts are tested by disc diffusion method to determine its antibacterial activities. From those, ethyl acetate extract has the highest antibacterial activity with average diameter of inhibiton zone is 10,85mm to Staphylococcus aureus
ATCC 25923 and 11,625 mm to Pseudomonas aeruginosa ATCC 27853, then ethyl acetate extract is fractionated by using column chromatography and produced 10 fractions. Each fraction is tested by biaoutographic method to determine its antibacterial activities. Fraction 1 has the highest antibacterial activity to Pseudomonas aeruginosa ATCC 27853, but does not have antibacterial activity to Staphylococcus aureus ATCC 25923. Fraction 8 has the highest antibacterial activity to Staphylococcus aureus ATCC 25923, but does not have antibacterial activity to Pseudomonas aeruginosa ATCC 27853. Microdilution test results show MIC values of fraction 1 is 12.5 mg / ml to Pseudomonas aeruginosa ATCC 27853. Gas Chromatography result - Mass Spectrometry of fraction 1 is obtained with 21 compounds which are a class of sesquiterpenes (47,42%), phenol (5,88%), aliphatic aldehydes (21,8%), esters (1,32%), fatty acid (2,65%), sesquiterpen alcohol (1,4%), aliphatic ketones (2,64%), aliphatic hydrocarbons (4,94%), alcohols (11,94%). Compounds that have the greatest abundance are δ - Cadinene (14.34%) and Myristaldehyde (13.03%).
viii
KATA PENGANTAR
Alhamdulillahirabbil’alamin atas segala nikmat iman, Islam, kesempatan, serta kekuatan yang telah diberikan Allah Subhanahuwata’ala sehingga Penulis dapat menyelesaikan penelitian dan penulisan skripsi ini. Shalawat serta salam untuk tuntunan dan suri tauladan Rasulullah Shallallahu‘alaihiwasallam beserta keluarga dan sahabat beliau yang senantiasa menjunjung tinggi nilai-nilai Islam yang sampai saat ini dapat dinikmati oleh seluruh manusia di dunia.
Skripsi ini dibuat sebagai salah satu syarat untuk mendapat gelar sarjana farmasi dari Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah. Judul skripsi ini adalah “Uji Aktivitas Antibakteri Ekstrak dan Fraksi Daun Sintok (Cinnamomum sintoc
Blume.) terhadap Staphylococcus aureus dan Pseudomonas aeruginosa serta Analisa Komponen Senyawa Fraksi Aktif dengan Kromatografi Gas – Spektrometri Massa”.
Penulis menyadari bahwa keberhasilan penelitian dan penulisan skripsi ini tidak lepas dari bantuan dan bimbingan dari banyak pihak. Oleh karena itu, pada kesempatan kali ini penulis mengucapkan terima kasih kepada:
1. Prof. Dr. Atiek Soemiati, Apt. MS. selaku pembimbing pertama dan bapak A. Heru Prianto, Msi selaku pembimbing kedua yang senantiasa dengan sabar tulus dan ikhlas memberikan arahan, bimbingan, dorongan, semangat, saran dan solusi selama penelitian dan penulisan skripsi.
2. Prof. Dr. (hc) dr. M.K. Tadjudin, Sp. And. selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Drs. Umar Mansur, M.Sc., Apt selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
4. Prof (Ris) Dr. Sulaeman Yusuf, M. Agr selaku kepala Puslit Biomaterial LIPI.
ix
Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
6. Para laboran Farmasi UIN, Ka Liken, Ka Rahmadi, Ka Eris, Mba Rani, Ka Lisna dan Ka Tiwi yang telah banyak membantu selama praktikum maupun penelitian.
7. Pak Dedi, Pak Rivo, Bu Denny, Ka Awie, dan seluruh staf Puslit Biomaterial LIPI Cibinong yang telah banyak memberi bimbingan dan membantu selama penelitian.
8. Pusat Konservasi Tumbuhan – Kebun Raya Bogor, LIPI yang telah membantu perihal bahan baku penelitian yaitu tanaman Cinnamomum sintoc Blume.
9. Mama yang selalu memberikan kasih sayang, semangat dan doa yang tiada henti serta dukungan baik moral maupun materil dan almarhum papa yang telah mendidik dan memberi nasehat semasa beliau ada. Kasih sayang yang kalian berikan sungguh tak ternilai.
10.Om dan tante, serta adik – adikku tersayang, Zaid Hafiz M yang selalu mendukung dan memberikan bantuan setiap kali dibutuhkan, Zaim Kamil M yang selalu menghibur dan memberikan keceriaan dikala penat.
11.Teman – teman seperjuangan dalam penelitian ini yaitu Kurnia Anisah dan Annisa Alfira yang senantiasa dengan sabar menemani, mendukung dan membantu disaat sedang dibutuhkan.
12.Teman – teman “ngocol” tersayang Amel, Vicka, Afifah, Dita, Ipho, Dias, Diah dan khususnya Desi Syifa yang telah memberikan kesempatan kepada saya untuk melakukan penelitian di Puslit Biomaterial, terima kasih karena kalian selalu mengerti, membantu, mendukung dan berbagi cerita disaat senang maupun sedih, semoga
ukhuwah kita akan selalu terjaga sampai kapanpun.
13.Teman – teman “Andalusia” Farmasi 2010 yang solid dan selalu membantu satu sama lain.
x
Penulis menyadari bahwa skripsi ini masih banyak keterbatasan dan kekurangan. Oleh Karena itu, dengan segala kerendahan hati, penulis sangat mengharapkan kritik dan saran yang membangun demi kesempurnaan skripsi ini. Penulis berharap semoga skripsi ini dapat bermanfaat dan member sumbangan pengetahuan khususnya di Program Studi Farmasi Fakultas Kedokteran dan Ilmu kesehatan, Universtas Islam Negeri Syarif Hidayatullah Jakarta dan pembaca pada umumnya.
Jakarta, 1 September 2014
xi
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIK
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, Saya yang bertanda tangan di bawah ini :
Nama : Zakiya Kamila Muhamad NIM : 1110102000012
Program studi : Farmasi
Fakultas : Fakultas Kedokteran dan Ilmu Kesehatan (FKIK) Jenis Karya : Skripsi
Demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya dengan judul :
UJI AKTIVITAS ANTIBAKTERI EKSTRAK DAN FRAKSI DAUN SINTOK (Cinnamomum sintoc. Blume) TERHADAP Staphylococcus aureus
DAN Pseudomonas aeruginosa SERTA ANALISA KOMPONEN SENYAWA FRAKSI AKTIF DENGAN KROMATOGRAFI GAS – SPEKTROMETRI
MASSA
untuk dapat diakses melalui Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta. Dengan demikian persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Jakarta
Pada Tanggal : 10 September 2014 Yang menyatakan,
xii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI……… xi
DAFTAR ISI……… xii BAB II TINJAUAN PUSTAKA……… 5
2.1 Tanaman Kayu Sintok………... 5
2.2 Metode Ekstraksi………... 7
2.3 Metode Pengujian Antibakteri………... 2.4 Tinjauan Tentang Bakteri……….. 10 13 2.5 Tinjauan Tentang Antibakteri……… 19
2.6 Macam – Macam Medium………. 22
2.7 Kromatografi……….………. 23
BAB III METODOLOGI PENELITIAN ……… 27
3.1 Waktu dan Tempat Penelitian ………... 27
3.3.6 Skrining Fitokimia Ekstrak yang Memiliki Aktivitas
xiii
3.3.7 Penetapan Kadar Air Ekstrak yang Memiliki Aktivitas Antibakteri Tertinggi……….. 3.3.8 Kromatografi Lapis Tipis (KLT)……… 3.3.9 Fraksinasi Ekstrak Etil Asetat Menggunakan Kromatografi
Kolom……….
3.3.10 Uji Aktivitas Antibakteri Fraksi dari Ekstrak yang Memiliki Aktivitas Antibakteri Tertinggi dengan Metode Bioautografi 3.3.11 Penentuan Nilai Konsentrasi Hambat Minimum (KHM) Fraksi yang Mempunyai Aktivitas Antibakteri Tertinggi…. 3.3.12 Analisa Komponen Senyawa Fraksi yang Mempunyai
Aktivitas Antibakteri Tertinggi dengan Kromatografi Gas –
Spektrometri Massa………
4.2 Kadar Air Simplisia Daun Cinnamomum sintoc………..
4.3 Pembuatan Ekstrak………..
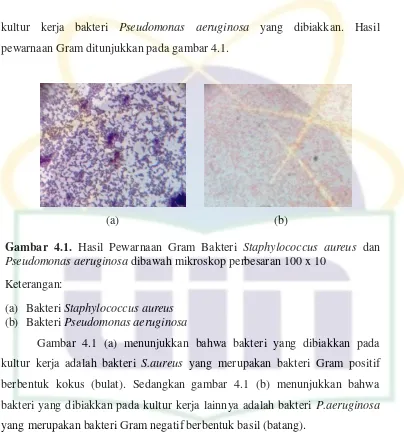
4.4 Pewarnaan Gram………..
4.5 Pengujian Aktivitas Antibakteri Ekstrak n – heksana, Etil Asetat dan Metanol Daun Cinnamomum sintoc Dengan Metode Difusi Cakram (Disc Diffusion)………...
4.6 Kadar Air Ekstrak Etil Asetat daun Cinnamomum sintoc………
4.7 Uji Fitokimia Ekstrak Etil Asetat………. 4.8 Fraksinasi Ekstrak Etil Asetat Menggunakan Kromatografi
Kolom………...
4.9 Uji Aktivitas Antibakteri Fraksi Dengan Metode Bioautografi... 4.10 Penentuan Nilai Konsentrasi Hambat Minimum (KHM) Fraksi 1 dari Ekstrak Etil Asetat………. 4.11 Analisa Komponen Senyawa pada Fraksi 1 dari Ekstrak Etil
Asetat dengan Kromatografi Gas –Spektrometri Massa………. 39
BAB V KESIMPULAN DAN SARAN……… 57
5.1Kesimpulan……….
5.2Saran………...
57 58
xiv
DAFTAR GAMBAR
Halaman
Gambar 2.1 Pohon Cinnamomum sintoc………. 6 Gambar 2.2 Daun dan batang Cinnamomum sintoc………... 6 Gambar 2.3 Rumus bangun tetrasiklin……… 21 Gambar 4.1 Hasil pewarnaan Gram bakteri Staphylococcus aureus dan
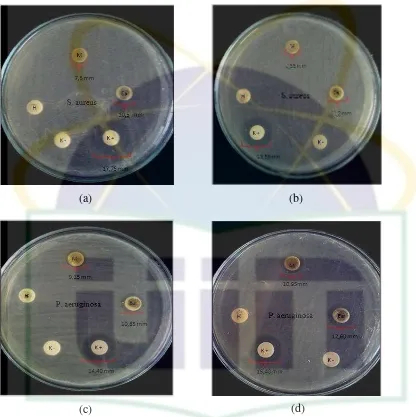
Pseudomonas aeruginosa dibawah mikroskop perbesaran 100 x 10………... 41 Gambar 4.2 Hasil uji aktivitas antibakteri ekstrak metanol, etil asetat, n–
heksana daun C. sintoc konsentrasi 50 mg/ml terhadap bakteri Staphylococcus aureus ATCC 25923 dan
Pseudomonas aeruginosa ATCC 27853……….. 43 Gambar 4.3 Hasil uji aktivitas antibakteri fraksi dari ekstrak etil setat
dan tetrasiklin dengan metode bioautografi terhadap bakteri
Staphylococcus aureus ATCC 25923 dan Pseudomonas aeruginosa ATCC 27853………... 49 Gambar 4.4 Hasil uji bioautografi fraksi 8 terhadap S. aureus dan fraksi 1
xv
DAFTAR TABEL
Halaman Tabel 2.1 Perbedaan ciri –ciri bakteri Gram positif dan Gram negatif……... 15 Tabel 4.1 Hasil rendemen ekstrak n– heksana, etil asetat dan metanol…... 40 Tabel 4.2 Rata – rata diameter zona hambat ekstrak n– heksana, etil asetat
dan metanol daun C. sintoc konsentrasi 50 mg/ml terhadap bakteri Staphylococcus aureus dan Pseudomonas
aeruginosa……… 42
Tabel 4.3 Hasil uji fitokimia ekstrak etil asetat………... 46 Tabel 4.4 Bobot masing –masing fraksi………... 47 Tabel 4.5 Hasil uji aktivitas antibakteri fraksi dari ekstrak etil asetat dengan
metode bioautografi terhadap bakteri Staphylococcus aureus
ATCC 25923 dan Pseudomonas aeruginosa ATCC
27853………...…………... 48
Tabel 4.6 Data hasil uji KHM fraksi 1 dari ekstrak etil asetat terhadap
bakteri Pseudomonas aeruginosa.………... 52 Tabel 4.7 Hasil analisis senyawa pada fraksi 1 dari ekstrak etil asetat
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil determinasi tanaman Cinnamomum sintocBlume……… 64
Lampiran 2. Alur penelitian……… 65
Lampiran 3. Bagan kerja ekstraksi simplisia daun Cinnamomum sintoc….. 66
Lampiran 4. Penghitungan rendemen ekstrak………. 67
Lampiran 5. Profil KLT ekstrak aktif antibakteri (ekstrak metanol dan ekstrak etil Asetat)……… 68
Lampiran 6. Penghitungan kadar air simplisia dan ekstrak etil asetat……… 69
Lampiran 7. Skema pembuatan suspensi bakteri uji………... 70
Lampiran 8. Bagan kerja uji aktivitas antibakteri ekstrak n – heksana, etil asetat dan metanol dengan metode disc diffusion……….. 71
Lampiran 9. Bagan kerja fraksinasi dengan kromatografi kolom………….. 73
Lampiran 10. Profil KLT eluat hasil fraksinasi dari ekstrak etil asetat dengan kromatografi kolom………. 74
Lampiran 11. Profil KLT fraksi gabungan……….. 75
Lampiran 12. Bagan kerja uji aktivitas antibakteri fraksi 1 dari ekstrak etil asetat dengan metode bioautografi………. 76
Lampiran 13. Skema pengujian KHM larutan uji fraksi 1 dari ekstrak etil asetat………... 77
Lampiran 14. Hasil Uji KHM Fraksi 1 dari ekstrak etil asetat terhadap Bakteri Pseudomonas aeruginosa……….. 78
Lampiran 15. Hasil GCMS fraksi 1 dari ekstrak etil asetat……….. 79
Lampiran 16. Gambar bahan –bahan yang digunakan……… 80
UIN Syarif Hidayatullah Jakarta
BAB I
PENDAHULUAN
1.1 Latar Belakang
Penyakit infeksi merupakan salah satu masalah kesehatan yang semakin meningkat. Infeksi dapat disebabkan oleh virus, jamur, parasit dan bakteri. Staphylococcus aureus adalah jenis bakteri yang sering menimbulkan penyakit pada manusia. Infeksi oleh bakteri ini menyebabkan timbulnya penyakit dengan tanda – tanda khas, yaitu peradangan, nekrosis dan pembentukan abses. Bakteri lain yang sering menimbulkan penyakit adalah
Pseudomonas aeuruginosa. Bakteri ini sering dihubungkan dengan penyakit pada manusia. Organisme ini dapat merupakan penyebab 10 – 20 % infeksi nosokomial, sering diisolasi dari penderita neoplastik, luka dan luka bakar yang berat. Bakteri ini antara lain dapat menyebabkan infeksi pada saluran pernafasan bagian bawah, saluran kemih, dan mata. Pengobatan penyakit infeksi bakteri dengan penggunaan antibakteri. Penggunaan antibakteri secara besar – besaran dan pemakaian yang tidak sesuai aturan menjadi penyebab utama terjadinya resistensi antibakteri.
Resistensi antibakteri merupakan salah satu masalah kesehatan yang sampai saat ini belum dapat teratasi dengan baik. Perpindahan resistensi
(resistance transference) antar bakteri menjadi salah satu sebab resistensi antibakteri berkembang cepat dan sulit untuk diatasi. Penelitian – penelitian dengan berbagai kuman patogen menunjukkan bahwa pemindahan resistensi dari suatu bakteri ke bakteri lain adalah peristiwa yang umum di dunia mikroba dan dengan dicapainya perkembangan mutakhir di dalam biologi molekuler, pemindahan resistensi ini dapat dijelaskan secara rinci. Bakteri – bakteri patogen telah mampu mengembangkan sejumlah besar mekanisme untuk menghindarkan diri dari efek antibakteri dengan cara membentuk enzim yang dapat merusak antibakteri sampai pada kemampuannya untuk melakukan modifikasi dari proses metaboliknya. Situasi ini tidak statis, mekanisme yang baru yang lebih kompleks secara cepat dikembangkan mikroorganisme mengikuti diperkenalkannya dan digunakannya suatu antibakteri yang baru
UIN Syarif Hidayatullah Jakarta
(Yenny, 2007). Oleh karena itu seiring dengan berkembangnya resistensi tersebut harus diimbangi dengan penemuan sumber antibakteri baru yang dapat membunuh bakteri maupun menghambat pertumbuhannya. Penemuan sumber antibakteri tersebut dapat berasal dari alam maupun sintetik.
Indonesia adalah suatu negara kepulauan yang memiliki hutan tropis terbesar kedua di dunia, kaya dengan keanekaragaman hayati dan dikenal sebagai salah satu dari tujuh negara “megabiodiversity” kedua setelah Brazil.
Distribusi tumbuhan tingkat tinggi yang terdapat di hutan tropika Indonesia lebih dari 12 % (30.000) dari yang terdapat di muka bumi (250.000) (Taslim Ersam, 2004). Penggunaan biodiversitas tumbuhan sebagai bahan pengobatan merupakan salah satu alternatif untuk menemukan nilai manfaat dari hutan yang ada di Indonesia. Disamping itu, yang tidak kalah menariknya adalah hutan tropis Indonesia memiliki keanekaragaman hayati dapat dipandang sebagai pabrik atau industri bahan – bahan kimia hayati, yang renewable
berproduksi sepanjang tahun. Keanekaragaman hayati Indonesia adalah salah satu aset nasional dengan nilai ekonomis yang tinggi, yang merupakan
ecological specific dengan comparative advantage (Taslim Ersam, 2004). Sebagai contoh, satu spesies tumbuhan pada awalnya mempunyai nilai sebesar US$ 100, setelah diproses menjadi ekstrak kasar nilai ini dapat ditingkatkan sampai 10 kali lipat (US$ 1000). Apabila dilakukan proses lebih lanjut sampai senyawa murni dan memiliki aktivitas tertentu, nilainya menjadi berlipat ganda, menjadi US$ 109 (Achmad,1999; Backer,1995). Oleh karena itu, dibutuhkan penelitian lebih lanjut mengenai tanaman yang berasal dari hutan tropis Indonesia, khususnya tanaman – tanaman yang berpotensi mempunyai aktivitas sebagai obat.
Salah satu tanaman yang terdapat di hutan tropis Indonesia adalah
Cinnamomum sintoc. Tanaman ini tersebar di Kalimantan Barat, Kalimantan Selatan, Jawa, dan Sumatera. Kulit kayunya digunakan sebagai pengobatan tradisional untuk diare, gangguan usus dan penyembuhan luka (Soh wuu - kuang, 2011). Penelitian tentang potensi tanaman Cinnamomum sintoc di Indonesia belum banyak dilakukan. Namun penelitian lain mengenai potensi
UIN Syarif Hidayatullah Jakarta
telah banyak dilakukan. Penelitian mengenai aktivitas antibakteri dari ekstrak daun Cinnamomum iners menunjukkan fraksi etil asetat dari ekstrak daun
Cinnamomum iners terstandar memiliki aktivitas antibakteri terhadap bakteri Gram positif (Bacillus cereus, Bacillus subtilis, Salmonella typhi, methicillin resistant Staphylococcus aureus (MRSA) dan Gram negatif (Escherichia coli, Pseudomonas aeruginosa, Shigella sonnei, Pseudomonas aeruginosa) (Sabariah Ismail, 2011). Komponen senyawa dalam ekstrak cinnamon seperti
cinmamaldehyde, eugenol dan cavracol dapat menghambat pertumbuhan bakteri Helicobacter pylori (Mina Tabak, 1999). Penelitian yang dilakukan oleh Shan et al (2007) menunjukkan bahwa ekstrak Cinnamomum burmanii
Bl. yang diperoleh dari Indonesia mengandung senyawa nonvolatile (Tannin terkondensasi) yaitu 23,2 % proanthocyanidin dan 3,6 % (epi) cathecin dan sebagai tambahan cinnamaldehyde 64,1 % yang mempunyai aktivitas antibakteri terhadap bakteri patogen penyebab keracunan makanan. Bila dilihat secara kemotaksonomi, maka sangat dimungkinan bahwa
Cinnamomum sintoc juga mempunyai kandungan senyawa dan manfaat yang sama dengan Cinnamomum sp., khususnya sebagai antibakteri.
Penelitian ini bertujuan untuk mengetahui aktivitas antibakteri ekstrak
n – heksana, etil asetat, metanol daun Cinnamomum sintoc dan fraksi dari ekstrak yang mempunyai aktivitas antibakteri tertinggi terhadap bakteri
Staphylococcus aureus dan Pseudomonas aeruginosa serta mengetahui komponen senyawa yang terdapat dalam fraksi yang mempunyai aktivitas antibakteri tertinggi. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai potensi daun Cinnamomum sintoc sebagai sumber alternatif antibakteri baru, sehingga nantinya dapat dikembangkan menjadi obat antibakteri dan dapat mengatasi masalah resistensi antibakteri.
1.2 Perumusan Masalah
1. Manakah diantara ekstrak n – heksana, etil asetat dan metanol daun
UIN Syarif Hidayatullah Jakarta
2. Manakah diantara fraksi hasil fraksinasi dari ekstrak terpilih yang menunjukkan aktivitas antibakteri tertinggi terhadap bakteri
Staphylococcus aureus ATCC 25923 dan Pseudomonas aeruginosa
ATCC 27853?
3. Berapakah nilai Konsentrasi Hambat Minimum (KHM) dari fraksi yang menunjukkan aktivitas antibakteri tertinggi?
4. Apa saja komponen senyawa yang terkandung dalam fraksi yang menunjukkan aktivitas antibakteri tertinggi?
1.3 Tujuan Penelitian
1. Untuk mengetahui aktivitas antibakteri ekstrak n– heksana, etil asetat dan metanol daun Cinnamomum sintoc terhadap bakteri Staphylococcus aureus ATCC 25923 dan Pseudomonas aeruginosa ATCC 27853.
2. Untuk mengetahui aktivitas antibakteri fraksi hasil fraksinasi ekstrak terpilih terhadap Staphylococcus aureus ATCC 25923 dan Pseudomonas aeruginosa ATCC 27853.
3. Untuk mengetahui nilai Konsentrasi Hambat Minimum (KHM) dari fraksi yang menunjukkan aktivitas antibakteri tertinggi.
4. Untuk mengetahui komponen senyawa yang terkandung dalam fraksi yang menunjukkan aktivitas antibakteri tertinggi.
1.4 Manfaat Penelitian
UIN Syarif Hidayatullah Jakarta
BAB II
TINJAUAN PUSTAKA
2.1 Tanaman Kayu Sintok 2.1.1 Klasifikasi tanaman
Kingdom : Plantae
Sub kingdom : Tracheobionta Super divisi : Spermatophyte Divisi : Magnoliophyta Kelas : Magnoliopsida Sub kelas : Magnoliidae Ordo : Laurales Famili : Lauraceae Genus : Cinnamomum
Spesies : Cinnamomum sintoc Bl 2.1.2 Deskripsi
Cinnamomum sintoc dapat mencapai tinggi 27 m, dengan diameter 30 cm, kulit kayu halus berwarna coklat terang sedangkan bagian dalamnya berwarna coklat kemerahan dan memiliki bau seperti buah pala. Ranting kokoh, berbentuk silinder dengan diameter 1,5 – 2,5 mm, tidak berbulu, kering dan kehitaman. Daun opposite atau subopposite, kering kecoklatan, tidak berbulu, berbentuk ellips sampai ovatus – ellips, dengan ujung daun lancip. Buahnya berbentuk ellipsoid atau obovoid. (Soh wuu - kuang, 2011)
UIN Syarif Hidayatullah Jakarta
Gambar 2.1. Pohon Cinnamomum sintoc
(Sumber: Koleksi pribadi)
Gambar 2.2. Daun dan Batang Cinnamomum sintoc
(Sumber: Koleksi pribadi)
2.1.3 Distribusi dan Habitat
UIN Syarif Hidayatullah Jakarta
2.1.4 Nama Daerah
Secara luas tanaman ini dikenal dengan nama sintok, huru sintok (Jawa), huru sitok (Sunda), dan maang sangit atau madang lawang (Sumatera) (Lemmens, Soerianegara and Wong, 1995).
2.1.5 Kegunaan
Kulit kayu Cinnamomum sintoc umumnya dimanfaatkan sebagai obat untuk diare, gangguan usus dan serbuknya dimanfaatkan untuk mengobati luka (Soh wuu - kuang, 2011).
2.1.6 Kandungan Senyawa
Minyak daun Cinnamomum sintoc yang diperoleh dari Peninsular Malaysia mengandung safrole(23,4%) dan γ – muurolene (13,5%) sebagai komponen mayor. Minyak kulit batang Cinnamomum sintoc mengandung linalool (23,8%), sesquiterpen (25,2 %), tetradecanal (16,4%) (Jantan et al., 1994).
Penelitian yang dilakukan oleh Yopi Iskandar (2008) menunjukkan bahwa minyak atsiri kulit batang kayu sintok mengandung eugenol, (33,83%), myristicin (13,54 %) dan safrol (10,17 %) sebagai komponen utama.
2.2 Metode Ekstrakasi
UIN Syarif Hidayatullah Jakarta
siap pakai, seperti ekstrak cair dan tincture atau sebagai produk bahan yang selanjutnya dapat diproses menjadi ekstrak kering (Agoes.G, 2007).
Terdapat beberapa metode ekstraksi yang umum dan sering digunakan, antara lain (Sampurno, 2000):
A. Ekstraksi Dengan Menggunakan Pelarut
a. Cara Dingin
1.Maserasi
Maserasi adalah proses ekstraksi dengan cara merendam simplisia dengan pelarut tertentu dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan. Jumlah pelarut yang dipakai tergantung pada banyaknya sampel. Cara ini dapat menarik zat – zat berkhasiat yang tidak tahan pemanasan.
2.Perkolasi
Perkolasi adalah proses ekstraksi menggunakan alat perkolator yang dilakukan dengan cara mengalirkan cairan pelarut organik pada sampel yang sebelumnya telah dibasahi. Prinsip dari metode perkolasi adalah pelarut yang telah jenuh yang berada didalam perkolator akan digantikan oleh pelarut yang lebih baru dan segar. Ekstraksi ini membutuhkan pelarut yang lebih banyak.
b. Cara Panas
1.Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai 3 – 5 kali sehingga dapat termasuk proses ekstraksi sempurna.
2.Soxhlet
UIN Syarif Hidayatullah Jakarta
dimasukkan ke tempat tertentu pada alat soklet. Pelarut yang digunakan berada pada labu yang terletak terpisah dari sampel. Setelah semua alat soklet terpasang, kemudian dipanaskan dengan menggunakan heating mantle. Pelarut dalam labu akan menguap dan uapnya akan naik ke atas menuju tempat sampel yang tergantung. Dengan adanya pendinginan dari kondensor, uap akan menjadi cair dan melarutkan sampel, yang kemudian akan kembali ke tempat pelarut awal. Proses ini akan terus berulang (ekstraksi sinambung) sehingga proses ekstraksi terjadi dengan sempurna.
3.Digesti
Adalah proses pengekstraksian yang hampir sama dengan maserasi tapi dengan menggunakan pemanasan pada suhu 30˚ -40˚C. Cara ini digunakan untuk sampel pada suhu biasa tidak tersari dengan baik.
4.Dekoktasi Dan Infusa
Adalah sediaan cair yang dibuat dengan mengekstraksi simplisia nabati dengan air pada suhu 90˚C selama 15-20 menit untuk infus sedangkan dekoktasi 30 menit dengan suhu ≥30˚C dan temperaturnya sampai titik didih.
B. Destilasi Uap
UIN Syarif Hidayatullah Jakarta
mendidih, senyawa kandungan menguap tetap kontinu ikut terdestilasi (Sampurno, 2000).
C. Ekstraksi Cara Lain
a. Ekstraksi berkesinambungan
Adalah proses yang dilakukan berulangkali dengan pelarut yang berbeda atau resirkulasi cairan pelarut dan prosesnya tersusun berturutan beberapa kali (Sampurno, 2000).
b. Superkritikal Karbondioksida
Penggunaan prinsip superkritik untuk ekstraksi serbuk simplisia, dan umumnya digunakan gas karbondioksida (Sampurno, 2000).
c. Ekstraksi Ultrasonik
Getaran ultrasonik (>20.000 Hz) memberikan efek pada proses ekstrak dengan prinsip meningkatkan permeabilitas dinding sel, menimbulkan gelembung spontan (cavitation) sebagai stres dinamik serta menimbulkan fraksi interfase (Sampurno, 2000).
d. Ekstraksi Energi Listrik
Energi listrik digunakan dalam bentuk medan listrik, medan magnet serta electric-discharges yang dapat mempercepat proses dan meningkatkan hasil dengan prinsip menimbulkan gelembung spontan dan menyebarkan gelombang tekanan berkecepatan ultrasonik (Sampurno, 2000).
2.3 Metode Pengujian Antibakteri 2.3.1 Metode Difusi
UIN Syarif Hidayatullah Jakarta
x 10 mm) ditempatkan diatas agar terinokulasi didalam cawan petri, dan diisi dengan sampel dan standar. Setelah diinkubasi, silinder dipindahkan dan zona inhibisi yang terbentuk diukur (Choma & Grzelak, 2010).
Pada uji menggunakan hole – plate, beberapa milimeter lubang digali pada permukaan agar yang diinokulasi dan kemudian diisi sampel. Larutan senyawa uji akan berdifusi kedalam medium agar dan menghambat pertumbuhan mikroorganisme. Cawan petri dibiarkan pada suhu ruangan untuk proses inkubasi. Kemudian zona hambat yang terbentuk diukur (Shitandi, et al., 2005 dalam Choma & Grezlak, 2010). 2.3.2 Metode dilusi ditambahkan dengan mikroba uji. Larutan uji agen antimikroba pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan mikroba uji ditetapkan sebagai KHM. Larutan yan ditetapkan sebagai KHM dikultur ulang tanpa penambahan mikroba uji ataupun agen antimikroba, dan diinkubasi selama 18 – 24 jam pada suhu 37oC. Media cair yang terlihat tetap jernih setelah diinkubasi ditetapkan sebagai KBM (Pratiwi, 2008).
Metode dilusi padat serupa dengan metode dilusi cair tetapi menggunakan media padat. Keuntungan metode ini adalah satu konsentrasi agen antimikroba yang diuji dapat digunakan untuk menguji beberapa mikroba uji (Pratiwi, 2008).
2.3.3 Metode Bioautografi
UIN Syarif Hidayatullah Jakarta
daripada metode lainnya. Selain itu, sederhana, murah, hemat waktu dan tidak memerlukan peralatan yang canggih (Choma, 2010).
Menurut Choma, skrining metode bioautografi pada dasarnya untuk menguji aktivitas biologis, misalnya antibakteri, antijamur, antitumor, dan antiprotozoa zat uji. Metode deteksi ini dapat berhasil dengan dikombinasikan dengan teknik kromatografi lapis tipis (Choma, 2010).
Prosedur dalam metode bioautografi hampir sama dengan yang digunakan dalam metode difusi agar. Perbedaannya adalah senyawa yang diuji berdifusi ke media agar yang diinokulasi dari lapisan kromatografi, yang merupakan adsorben atau kertas ( Wagman, 1969; Choma, 2010).
Metode bioautografi dibedakan menjadi bioautografi kontak, bioautografi imersi atau bioautografi agar overlay, dan bioautografi langsung. Dalam bioautografi kontak, lempeng KLT atau kromatogram kertas ditempatkan pada permukaan agar diinokulasi selama beberapa menit atau jam untuk memungkinkan difusi. Selanjutnya, lempeng dipindah dan lapisan agar diinkubasi. Pertumbuhan zona hambat muncul di mana senyawa antimikroba berada dalam kontak dengan lapisan agar.
Dalam bioautografi immersion (agar overlay), lempeng pertama kali dicelupkan di medium agar atau ditutup dengan medium agar, setelah agar memadat, ditambahkan mikroorganisme yang diuji dan kemudian diinkubasi. Agar dapat berdifusi dengan baik dari senyawa uji ke permukaan agar, lempeng dapat tetap pada suhu rendah selama beberapa jam sebelum inkubasi. Metode ini merupakan kombinasi dari bioautografi kontak dan langsung, karena senyawa antimikroba yang ditransfer dari kromatogram ke media agar, seperti dalam metode kontak, tetapi lapisan agar tetap pada permukaan kromatogram selama inkubasi dan visualisasi, sebagai bioautografi langsung (Choma, 2010).
UIN Syarif Hidayatullah Jakarta
Permukaan silika dari lempeng KLT ditutupi dengan media kaldu menjadi sumber nutrisi dan memungkinkan pertumbuhan mikroorganisme secara langsung di atasnya, daerah di mana terdapat spot agen antimikroba menunjukkan zona penghambatan pertumbuhan mikroorganisme yang terbentuk. Visualisasi dari zona ini biasanya dilakukan dengan menggunakan reagen dehidrogenase untuk deteksi aktivitas, yang paling umum adalah garam tetrazolium. Dehidrogenase mengkonversi mikroorganisme hidup garam tetrazolium menjadi berwarna. Sehingga, spot krim - putih muncul dengan latarbelakang ungu pada permukaan lempeng KLT menunjukkan keberadaan agen antibakteri (Choma, 2010). 2.4 Tinjauan Tentang Bakteri
2.4.1 Karakter Bakteri
Bakteri adalah sel prokariotik yang khas; uniselular dan tidak mengandung struktur yang terbatasi membran di dalam sitoplasmanya. Bakteri dapat dibedakan dari ukuran, susunan, dan responnya terhadap antibiotik. Bentuk sel bakteri meliputi (Pelczar dkk, 1998):
a. Kokus (bulat) b. Basil (batang) c. Spirilium (spiral)
Bentuk sel menunjukkan karakteristik spesies bakteri tersebut, tetapi dapat bervariasi tergantung kondisi pertumbuhannya. Ukuran bakteri sangat kecil berkisar antara 0,5-5 μm. Struktur permukaan bakteri meliputi:
a. Flagelum
UIN Syarif Hidayatullah Jakarta
b. Pili
Pili berukuran lebih kecil, lebih pendek dari flagel. Pili hanya dapat dilihat dengan mikroskop elektron. Pili tidak berfungsi untuk alat gerak tetapi sebagai alat untuk melekat pada berbagai permukaan. c. Kapsul
Kapsul penting artinya buat bakteri maupun organisme lainnya. Bagi bakteri, kapsul merupakan penutup, pelindung dan juga berfungsi sebagai gudang makanan cadangan.
2.4.2 Bakteri Gram Positif dan Negatif
UIN Syarif Hidayatullah Jakarta
Tabel 2.1. Perbedaan ciri – ciri bakteri Gram positif dan Gram negatif (Pelczar, JM, 1988).
Ciri Gram Positif Gram Negatif
Struktur dinding sel Ada asam tekoat Tidak ada asam tekoat Kerentanan terhadap
penisilin Lebih rentan Kurang rentan
Persyaratan nutrisi Relatif rumit pada
banyak spesies Relatif sederhana Resistensi terhadap
gangguan fisik Lebih resisten Kurang resisten
2.4.3 Pertumbuhan Bakteri
UIN Syarif Hidayatullah Jakarta
2.4.3.1 Faktor Lingkungan Yang Mempengaruhi Pertumbuhan
1. Suplai Nutrisi (Suharto dkk, 1993)
Mikroba sama dengan makhluk hidup lainnya,memerlukan suplai nutrisi sebagai sumber energi dan pertumbuhan selnya. Unsur-unsur dasar tersebut adalah: karbon, nitrogen, hidrogen, oksigen, sulfur, fosfor, zat besi dan sejumlah kecil logam lainnya. Ketiadaan atau kekurangan sumber-sumber nutrisi ini dapat mempengaruhi pertumbuhan mikroba hingga pada akhirnya dapat menyebabkan kematian.
2. Suhu
Suhu merupakan salah satu faktor penting dalam mempengaruhi pertumbuhan mikroorganisme. Suhu yang berkaitan dengan pertumbuhan mikroorganisme digolongkan menjadi tiga, yaitu: a. Suhu minimum, yaitu suhu yang apabila berada di bawahnya maka
pertumbuhan bakteri terhenti.
b. Suhu optimum yaitu suhu dimana pertumbuhan berlangsung paling cepat dan optimum (Disebut juga suhu inkubasi).
c. Suhu maksimum yaitu suhu yang apabila berada di atasnya maka pertumbuhan tidak terjadi.
3. Keasaman atau Kebasaan (pH)
Setiap organisme memiliki kisaran pH masing-masing dan memiliki pH optimum yang berbeda-beda. Kebanyakan mikroorganisme dapat tumbuh pada kisaran pH 8,0 dan nilai pH di luar kisaran 2,0 sampai 10,0 biasanya bersifat merusak.
4. Ketersediaan Oksigen
Mikroorganisme memiliki karakteristik sendiri-sendiri di dalam kebutuhannya akan oksigen. Mikroorganisme dalam hal ini digolongkan menjadi:
a. Aerobik: hanya dapat tumbuh apabila ada oksigen bebas. b. Anaerob: hanya dapat tumbuh apabila tidak ada oksigen bebas. c. Anaerob fakultatif: dapat tumbuh baik dengan atau tanpa oksigen
UIN Syarif Hidayatullah Jakarta
d. Mikroaerofilik: dapat tumbuh apabila ada oksigen dalam jumlah kecil.
2.4.4 Bakteri yang Digunakan 2.4.4.1 Staphylococcus aureus
Berikut adalah klasifikasi taksonomi Staphylococcus aureus: Kingdom : Monera
Divisio : Protophyta Kelas : Schizomycetes Ordo : Eubacteriales Familia : Micrococcaceae Spesies : Staphylococcus aureus
Staphylococcus adalah sel-sel bulat yang terdapat sendiri-sendiri atau bulat-bulat atau kadang-kadang berpasangan tetapi lebih sering kelompok-kelompok yang tidak beraturan (Volk dkk, 1990).
Staphylococcus juga termasuk dalam bakteri Gram-positif, dan tidak bergerak (Bonang, 2007). Mikroba ini bersifat aerob atau anaerob fakultatif, katalase positif, oksidase negatif, famili nonmotil, tidak membentuk spora dan fermentative.
S. aureus bakteri ini bervariasi dalam pembentukan pigmennya. Pigmen dapat berwarna putih, kuning atau kuning-orange. Bakterinya bersifat patogen yang banyak terdapat pada kulit dan lapisan lendir. Pada dasarnya kebanyakan penyakit lebih banyak disebabkan oleh bakteri S.
aureus karena kemampuan organisme ini untuk menimbulkan penyakit bergantung pada kemampuannya melawan fagositosis dan efek beberapa diantara toksin dan enzim yang disekresi oleh sel (Hastowo dkk, 1992).
Batas suhu untuk pertumbuhan S. aureus adalah 15˚C dan 40˚C
UIN Syarif Hidayatullah Jakarta
2.4.4.2 Pseudomonas aeruginosa
Bakteri ini sering dihubungkan dengan penyakit pada manusia. Organisme ini dapat merupakan penyebab 10 – 20 % infeksi nosokomial. Sering diisolasi dari penderita neoplastik, luka dan luka bakar yang berat. Bakteri ini juga dapat menyebabkan infeksi pada saluran pernapasan bagian bawah, saluran kemih, mata dan lain – lainnya.
Morfologi dari bakteri ini berbentuk batang negatif Gram, berukuran 0,5 – 1,0 x 3,0 – 4,0 µ m. Umumnya mempunyai flagel polar, tetapi kadang – kadang 2 – 3 flagel. Bila tumbuh pada perbenihan tanpa sukrosa terdapat lapisan lender polisakarida ekstraseluler.
Pseudomonas aeruginosa merupakan organisme yang sangat mudah beradaptasi dan dapat memakai 80 gugus organik yang berbeda untuk pertumbuhannya dan amonia sebagai sumber nitrogen. Suhu pertumbuhan optimum adalah 35oC, tetapi dapat juga tumbuh 42oC.
Pseudomonas aeruginosa adalah satu – satu nya spesies yang menghasilkan:
1. Piosianin, suatu pigmen yang larut dalam kloroform.
2. Flouresen, suatu pigmen yang larut dalam air. Beberapa strain menghasilkan pigmen merah.
Pseudomonas aeruginosa lebih resisten terhadap desinfektan daripada bakteri lain lain. Bakteri ini menyenangi hidup dalam suasana lembab seperti pada peralatan pernafasan, air dingin, lantai, kamar mandi, tempat air, dan lain – lain.
Kebanyakan antibiotik dan antimikroba tidak efektif terhadap kuman ini. Fenol dan beta – glutaraldehid biasanya merupakan desinfektan yang efektif. Air mendidih dapat membunuh kuman ini.
UIN Syarif Hidayatullah Jakarta
2.5 Tinjauan Tentang Antibakteri 2.5.1 Aktivitas Antibakteri
Antimikroba adalah senyawa kimia yang dapat membunuh atau menghambat pertumbuhan mikroorganisme. Berdasarkan jenis mikroorganisme yang dimatikan atau dihambat pertumbuhannya, antimikroba terbagi menjadi antibakteri, antifungi, antivirus dan antiprotozoa.
Antibakteri adalah zat yang membunuh bakteri atau menekan pertumbuhan dan reproduksi mereka. Sampai saat ini, antibakteri masih merupakan salah satu obat yang paling sering digunakan (Volk dkk, 1990). Obat untuk membasmi bakteri penyebab infeksi pada manusia harus memiliki sifat toksisitas selektif setinggi mungkin. Artinya, obat tersebut haruslah bersifat sangat toksik untuk bakteri, tetapi relatif tidak toksik untuk hospes (Ganiswarna dkk, 1995).
Aktivitas suatu zat yang bersifat antibakteri dipengaruhi oleh beberapa faktor penting seperti konsentrasi bahan, pH, komposisi medium, suhu, jenis bakteri penguji dan kemampuan antibakteri untuk mengurangi dalam medium. Berdasarkan jenis daya tahan kerjanya terhadap bakteri, zat antibakteri dibagi dalam 2 kelompok yaitu bakteriostatik dan bakterisidal. Zat bakterisidal adalah zat-zat yang dapat membunuh bakteri karena daya kerjanya yang cepat dan mematikan. Sedangkan zat yang hanya menghambat pertumbuhan bakteri disebut bakteriostatik (Irianto, 2006).
2.5.2 Mekanisme Kerja Antibakteri
Secara umum mekanisme kerja antibakteri dapat dibagi atas (Hastowo dkk, 1992) :
1. Penghambatan Pertumbuhan oleh Analog
UIN Syarif Hidayatullah Jakarta
2. Penghambatan Sintesis Dinding Sel
Perbedaan struktur sel antara bakteri dan eukariot menguntungkan bagi penggunaan bahan antimikroba. Penicillin dan
Cephalosporin merupakan contoh klasik. Kedua antibiotik ini menyebabkan penghambatan pada pembentukan ikatan sebrang silang. Pada konsentrasi rendah, penicillin menghambat pembentukan ikatan glikosida, sehingga pembentukan dinding sel baru akan terganggu dapat dilihat dari bakteri dengan bentuk sel yang panjang tanpa dinding sekat. Pada konsentrasi tinggi, ikatan sebrang silang terganggu dan pembentukan dinding sel terhenti. Kepekaan bakteri terhadap
penicillin tergantung pada kemampuan mikroorganisme menghasilkan enzim beta-laktamase enzim ini dapat merusak daya kerja penicillin. 3. Penghambatan fungsi membran sel
Membran sel bakteri dan fungi dapat dirusak oleh beberapa bahan tertentu tanpa merusak sel inang. Polymixin berdaya kerja terhadap bakteri Gram-negatif, sedangkan antibiotik polyene terhadap fungi.
Polymixin dihasilkan oleh Bacillus polymyxa. Daya kerja polymixin merusak membran sel, sehingga isi sel akan keluar. Antibakteri ini berdaya kerja terhadap sel baik yang sedang tumbuh maupun yang tidak tumbuh.
4. Penghambatan sintesis protein
Beberapa antibiotik menghambat sintesis protein pada bakteri. Sebagai contoh chloramphenicol, tetracycline, dan erythomycine.
UIN Syarif Hidayatullah Jakarta
2.5.3 Antibakteri yang Digunakan Sebagai Kontrol Positif
Tetrasiklin Hidroklorida yang digunakan sebagai kontrol positif, memiliki karakteristik sebagai berikut (Depkes RI, 1995):
Rumus bangun :
Gambar 2.3. Rumus bangun tetrasiklin.
Rumus molekul : C22H24N2O8.HCl
Bobot molekul : 480,90
Pemerian :Serbuk hablur, kuning, tidak berbau, agak higroskopis. Stabil di udara tetapi pada pemaparan terhadap cahaya matahari yang kuat dalam udara lembab. Dalam larutan dengan pH lebih kecil dari 2, potensi berkurang dan cepat rusak dalam larutan alkali hidroksida.
Kelarutan :Larut dalam 10 bagian air dan dalam 100 bagian etanol (95%), praktis tidak larut dalam kloroform dan dalam eter.
Penyimpanan :Dalam wadah tertutup baik, terlindung dari cahaya. Jika dalam udara lembab terkena sinar matahari langsung, warna menjadi gelap dan dalam larutan pH tidak lebih dari 2 menjadi inaktif dan rusak pada pH 7 atau lebih. Tetrasiklin berikatan dengan ribosom subunit 30S mikrobia. Tetrasiklin menghambat sintesis protein dengan memblokir penambahan
UIN Syarif Hidayatullah Jakarta
2.6 Macam – Macam Medium
Medium yang baik untuk bakteri adalah medium yang mengandung zat-zat organik seperti rebusan daging, sayur-sayuran, sisa makanan, atau ramuan-ramuan yang dibuat oleh manusia. Medium yang dibuat oleh manusia adalah sebagai berikut (Dwidjoseputro, 1994):
2. Medium Cair
Medium cair yang biasa di gunakan adalah kaldu. Pembuatan medium ini yaitu dengan cara air murni di tambahkan dengan kaldu daging lembu dan pepton. Pepton adalah protein yang terdapat pada daging, pada air susu, pada kedelai dan pada putih telur. Medium yang telah siap tersebut ditentukan pHnya 6,8 - 7, jadi sedikit asam atau netral. pH tersebut adalah pH yang sesuai bagi kebanyakan bakteri. Setelah di ukur pHnya kaldu tersebut di saring menggunakan kertas saring lalu di masukkan ke dalam tabung reaksi dan disumbat dengan kapas, barulah dapat di masukkan ke dalam autoklaf.
3. Medium Padat
Dulu medium padat masih banyak menggunakan kentang yang di potong-potong. Kentang tersebut di potong-potong dengan menggunakan pipa besi lalu di masukkan ke dalam tabung reaksi kemudian di sumbat dengan kapas dan setelah itu di sterilkan di dalam autoklaf. Setelah dingin kentang dapat ditanami bakteri.
Lalu muncul penemuan baru dengan menggunakan kaldu yang di campur dengan sedikit agar-agar. Baru dapat di peroleh medium padat setelah di sterilkan. Agar-agar tersebut baru mencair pada suhu 95˚C. Agar-agar ialah sekedar zat pengental, dan bukan zat makanan bagi bakteri.
4. Medium yang Diperkaya
UIN Syarif Hidayatullah Jakarta
Pencampuran ini dilakukan sebelum sterilisasi, maka serum atau darah tersebut akan mengental akibat pemanasan.
5. Medium Kering
Medium ini berupa serbuk kering yang dilarutkan dalam air lalu di sterilkan. Pada medium ini tidak perlu dilakukan pemeriksaan pH karena sudah dilakukan lebih dahulu pada waktu pembuatan serbuk.
6. Medium Sintetik
Medium ini berupa ramuan-ramuan zat anorganik tertentu yang mengandung zat karbon dan nitrogen. Bakteri autotrof dapat hidup dalam medium ini. Medium ini dibuat secara eksperimental. Medium ini tidak menimbulkan zat-zat penolak, apabila masuk ke dalam tubuh hewan atau manusia.
2.7 Kromatografi
Kromatografi didefenisikan sebagai prosedur pemisahan zat terlarut oleh suatu proses migrasi diferensial dinamis dalam suatu sistem yang terdiri dari dua fase atau lebih, salah satu diantaranya bergerak secara berkesinambungan dalam arah tertentu dan didalamnya zat – zat itu menunjukkan perbedaan mobilitas disebabkan adanya perbedaan adsorpsi, partisi, kelarutan ukuran molekul atau kerapatan muatan ion (Farmakope Indonesia ed.4, 2000).
2.7.1 Kromatografi Kolom
Kromatografi kolom merupakan kromatografi cair dimana fase diam ditempatkan di dalam tabung kaca berbentuk silinder pada bagian bawah tertutup dengan katup atau keran dan fasa gerak dibiarkan mengalir ke bawah karena adanya gaya berat (Gritter, Bobbit & Schwarting, 1991). 2.7.1.1 Penyerap (fase diam)
UIN Syarif Hidayatullah Jakarta
2.7.1.2 Pelarut Pengelusi (fase gerak)
Pemilihan pelarut pengelusi perlu dilakukan untuk mengetahui pelarut atau campuran pelarut mana yang dapat menghasilkan pemisahan yang diinginkan. Hal itu dapat dilakukan dengan tiga pendekatan, yaitu penelusuran pustaka, penerapan data KLT pada pemisahan dengan kolom dan pemakaian elusi landaian umum mulai dari pelarut yang tidak menggerakkan linarut sampai pelarut yang lebih polar yang menggerakkan linarut (Gritter, Bobbit & Schwarting, 1991).
2.7.1.3 Pembuatan Kolom
Pembuatan kolom ada 2 cara, yaitu: a. Cara kering
Selapisan pasir diletakkan didalam kolom kemudian penyerap dimasukkan ke dalam tabung sedikit demi sedikit, permukaan diratakan dan dimampatkan sedikit. Setelah itu kertas saring diletakkan diatasnya dan ditambah lagi selapis pasir sehingga jika ditambahkan pelarut, permukaan penyerap tidak terganggu. Selanjutnya pelarut pengelusi dibiarkan mengalir ke bawah melalui penyerap dengan keran terbuka sampai permukaan pelarut tepat sedikit di atas bagian atas kolom (Gritter, Bobbit & Schwarting, 1991).
b. Cara basah
Selapisan pasir silika dimasukkan kedalam kolom dan sepertiga tabung diisi dengan pelarut. Kemudian suspensi fase diam dimasukkan ke dalam pelarut di dalam tabung sedikit demi sedikit atau sekaligus sambil diketuk – ketuk pada semua sisi secara perlahan – lahan agar diperoleh lapisan yang seragam. Keran dapat dibuka atau ditutup selama penambahan asal permukaan pelarut tetap di atas permukaan penyerap (Gritter, Bobbit & Schwarting, 1991).
2.7.2 Kromatografi Lapis Tipis (KLT)
UIN Syarif Hidayatullah Jakarta
kondisi jenuh bejana kromatografi, dinding bejana dilapisi dengan lembaran kertas saring, fase gerak dituang ke dalam bejana sehingga kertas saring basah dan dalam bejana terdapat fasa gerak setinggi 5 – 10 mm, bejana ditutup dan dibiarkan selama satu jam pada 20 – 25oC (Harmita, 2006).
KLT sangat bermanfaat untuk analisis obat dan bahan lain dalam laboratorium karena hanya memerlukan peralatan sederhana, waktu cukup singkat dan jumlah zat yang diperiksa cukup kecil. Di samping itu tidak diperlukan ruang besar dan teknik pengerjaannya sederhana (Harmita, 2006).
2.7.3 Kromatografi Gas – Spektrometri Massa
Kromatografi gas digunakan untuk memisahkan komponen – komponen yang dapat menguap dan hasil pemisahan dapat dilihat berupa kromatogram. Spektroskopi massa adalah metode analisa dimana sampel yang dianalisa akan diubah menjadi ion – ion gasnya dan massa dari ion – ion tersebut dapat diukur berdasarkan hasil deteksi berupa spektrum massa (Sudjadi, 2007).
UIN Syarif Hidayatullah Jakarta
UIN Syarif Hidayatullah Jakarta
BAB III
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini mulai dilakukan pada bulan Maret sampai dengan Juli 2014 di Laboratorium Mikrobiologi dan Pengendalian Hama, Pusat Penelitian (Puslit) Biomaterial LIPI Cibinong, Bogor, Jawa barat.
3.2 Alat dan Bahan 3.2.1 Alat
Alat-alat yang digunakan pada penelitian ini antara lain Erlenmeyer (Iwaki), gelas ukur (Pyrex), hammer mill, ayakan no. mesh 40, cawan petri, jarum ose, ose kapas steril, tabung reaksi, rak tabung reaksi, hot plate, vortex, autoklaf, lampu spiritus, timbangan analitik, mikroskop (Olympus CX21), LAF (Laminar Air Flow), oven, microtiter plate, Lemari pendingin, kapas steril, spatula, mikropipet, shaker incubator, kertas saring Whatman no. 1, vakum rotavapor (IKA RV 10), kromatografi kolom, plat kromatrografi lapis tipis, GCMS (Gas Cromatography – Mass Spectrometry), kertas cakram (paper disc), botol maserasi, jangka sorong. 3.2.2 Bahan
Bahan-bahan yang digunakan pada penelitian ini adalah daun
Cinnamomum sintoc yang diperoleh dari Kebun Raya Bogor, pelarut metanol, etil asetat, n – heksana, DMSO (Merck), kultur bakteri
Pseudomonas aeruginosa ATCC 27853 dan kultur bakteri Staphylococcus aureus ATCC 25923 yang diperoleh dari lab mikrobiologi fakultas kedokteran Universitas Indonesia, antibiotik tetrasiklin, pewarnaan Gram, aquadest steril, larutan NaCl fisiologis, medium NA (Nutrient Agar) (Merck), medium NB (Nutrient Broth) (Merck), p-iodonitrotetrazolium violet (INT) (Sigma aldrich), medium Brain Heart Infussion (BHI), kloroform, asam asetat anhidrida, HCl 2 N, perekasi Dragendorf, Pb asetat, NaOH 0,1 N, H2SO4 pekat, FeCl3.
UIN Syarif Hidayatullah Jakarta
3.3 Metode Penelitian
3.3.1 Pembuatan Simplisia
Sampel daun sintok (Cinnamomum sintoc) segar sebanyak 6 kg diperoleh dari koleksi tanaman Kebun Raya Bogor, Jawa barat dan diidentifikasi di Pusat Konservasi Tumbuhan Kebun Raya Bogor, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Jawa barat.
Daun sintok segar dikumpulkan dan dilakukan sortasi kemudian dibersihkan untuk menghilangkan kotoran yang melekat pada daun. Kemudian dilakukan proses pengeringan menggunakan oven pada suhu 40oC. Setelah kering, dilakukan sortasi kembali, kemudian daun dibuat menjadi serbuk menggunakan alat penggiling hammer mill, diayak menggunakan ayakan mesh no. 40 dan ditampung pada wadah tertutup. 3.3.2 Penetapan Kadar Air Simplisia (Depkes RI, 2000)
Penetapan kadar air menggunakan metode gravimetri. Krusibel porselin kosong dikonstankan terlebih dahulu dengan pemanasan pada suhu 100-105oC selama 2 jam, didinginkan dalam desikator, dan kemudian ditimbang. Sebanyak 1 g sampel ditimbang dalam krusibel yang telah diketahui beratnya, dikeringkan dalam oven pada suhu 105-110oC selama 5 jam, didinginkan dalam desikator dan selanjutnya ditimbang kembali. Perlakuan ini diulang sampai beratnya konstan. Kadar air dihitung dalam persen terhadap berat sampel awal.
3.3.3 Pembuatan Ekstrak
Setelah menjadi serbuk, dilakukan proses ekstraksi dengan cara maserasi bertingkat menggunakan pelarut yang memiliki tingkat kepolaran yang berbeda, yaitu n-heksana (non polar), etil asetat (semi polar), dan metanol (polar).
UIN Syarif Hidayatullah Jakarta
tersisa kembali ditambahkan n – heksana dan proses maserasi dilakukan kembali sampai pelarut berwarna bening. Filtrat yang diperoleh diuapkan dengan vacuum rotary evaporator hingga diperoleh ekstrak kental.
Selanjutnya ampas dimaserasi dengan pelarut etil asetat selama 2 hari dengan beberapa kali pengadukan. Kemudian hasil maserasi difiltrasi, ampas yang tersisa dimaserasi kembali dengan etil asetat sampai pelarut berwarna bening. Filtrat yang diperoleh diuapkan dengan vacuum rotary evaporator hingga diperoleh ekstrak kental.
Ampas di maserasi dengan pelarut metanol selama 2 hari dengan beberapa kali pengadukan. Kemudian hasil maserasi difiltrasi. Ampas yang tersisa kembali ditambahkan metanoldan proses maserasi dilakukan kembali sampai pelarut berwarna bening. Filtrat yang diperoleh diuapkan dengan vacuum rotary evaporator hingga diperoleh ekstrak kental.
Penguapan pelarut menggunakan vacuum rotary evaporator
dilakukan pada suhu 45oC. Ekstrak disimpan dalam lemari pendingin pada suhu 4oC untuk memperpanjang masa simpan sampai siap digunakan untuk uji aktivitas antibakteri.
Rendemen ekstrak dinyatakan dalam persen dihitung menggunakan persamaan:
Rendemen ekstrak (%) =
x 100 %
3.3.4 Pewarnaan Gram
UIN Syarif Hidayatullah Jakarta
selama 1 menit. Setelah 1 menit, kaca objek dibilas dengan air. Kaca objek dibilas dengan alkohol 96% sampai semua zat warna luntur kemudian dicuci dengan air. Kaca objek dikeringkan di atas api spiritus. Setelah kering, safranin sebanyak 1 tetes ditambahkan ke permukaan kaca objek dan didiamkan selama 45 detik. Preparat dicuci dengan air dan dikeringkan. Preparat diamati menggunakan mikroskop dengan perbesaran 100x (Surya rosa putra, 2012).
3.3.5 Uji Aktivitas Antibakteri Ekstrak n – heksana, Etil asetat dan Metanol daun Cinnamomum sintoc dengan Metode Difusi Cakram 3.3.5.1 Sterilisasi Alat dan Bahan
Sterilisasi dilakukan dengan beberapa cara, yaitu:
a. Sterilisasi dengan pemijaran, yaitu pembakaran alat – alat diatas lampu spiritus sampai pijar seperti ose, batang L, dan mulut tabung biakan. b. Sterilisasi dengan uap yang bertekanan (autoklaf), yaitu sterilisasi
dengan menggunakan suhu 121˚C selama 15 menit. Bahan – bahan seperti media NB, NA, BHI, Aquadest disterilkan dengan autoklaf dan juga alat-alat gelas seperti cawan petri, beacker glass, spreader.
3.3.5.2 Pembuatan Medium 3.3.5.2.1 Nutrien Agar (NA)
Medium yang digunakan untuk membiakkan bakteri uji adalah medium NA. Serbuk NA sebanyak 20 gram dilarutkan dalam 1 liter aquadest dan dipanaskan sampai mendidih sehingga larut. Lalu disterilkan dalam autoklaf pada suhu 121˚C selama 15 menit. Setelah agak dingin, disimpan dalam lemari pendingin dan dapat digunakan bila diperlukan dengan memanaskannya kembali dengan hot plate.
Untuk membuat agar miring, NA yang telah disterilkan dituang pada suhu 60 – 50oC kedalam tabung reaksi yang telah disterilkan sebanyak 5 ml, kemudian disumbat dengan kapas steril dan diposisikan miring sekitar 45o kemudian ditunggu sampai mengeras. 3.3.5.2.2 Nutrien Broth (NB)
UIN Syarif Hidayatullah Jakarta
dalam autoklaf pada suhu 121˚C selama 15 menit. Setelah agak dingin NB dapat disimpan dalam lemari pendingin.
3.3.5.3 Peremajaan Bakteri dan Pembuatan Kultur Kerja
Disiapkan agar miring NA steril, lalu diambil stok bakteri
Staphylococcus aureus ATCC 25923 dan Pseudomonas aeruginosa ATCC 27853 dengan menggunakan ose steril yang telah dipijarkan lalu ditanam pada permukaan agar miring dan diinkubasi selama 24 jam pada suhu 37˚C.
3.3.5.4 Pembuatan Suspensi Bakteri
Bakteri Staphylococcus aureus ATCC 25923 dan Pseudomonas aeruginosa ATCC 27853 yang telah diremajakan pada umur 24 jam diambil 1 ose dan dimasukkan dalam 10 ml NB (inokulum) lalu dikocok menggunakan shaker incubatorselama 24 jam pada suhu 37˚C.
Setelah 24 jam tabung menjadi keruh yang menunjukkan adanya pertumbuhan bakteri. Kekeruhan kultur dibandingkan dengan larutan Mc. Farland 0,5 yang setara dengan 108 CFU/ml. Kemudian dilakukan pengenceran sampai diperoleh suspensi bakteri 106 CFU/ ml dengan cara mengambil 1 ml (dari tabung 108 CFU/ml) dicampur dengan 9 ml NaCl 0,9% steril, maka akan didapat suspensi bakteri dengan kepadatan 107 CFU/ml. dilanjutkan dengan mengambil 1 ml lagi (dari tabung 107 CFU/ml) untuk dicampur dengan 9 ml Nutrient Broth sehingga didapatkan suspensi bakteri dengan kepadatan 106 CFU/ml (Bobby wahyu dkk, 2013)
3.3.5.5 Penentuan Diameter Zona Hambat
Media cair nutrient agar yang sudah disterilkan dituang secara aseptis sebanyak 20 ml pada cawan petri berdiameter 9 cm yang sudah disterilkan hingga merata, kemudian dibiarkan hingga membeku. Setelah media nutrient agar membeku, celupkan 1 ose kapas kedalam suspensi bakteri, kemudian inokulasikan bakteri yang telah diambil dengan ose tersebut pada media nutrient agar.
UIN Syarif Hidayatullah Jakarta
dilarutkan dalam DMSO 15% (15% DMSO dan 65% Aquadest) sehingga diperoleh konsentrasi 50 mg/ml. Kemudian paper disc yang telah ditetesi larutan ekstrak, ditunggu selama 10 detik sampai ekstrak tersebut menyerap pada paper disc dan diletakkan diatas permukaan lempeng agar yang telah diinokulasikan bakteri. Kontrol negatif digunakan DMSO 15%, Kontrol positif digunakan antibiotik Tetrasiklin 1000 ppm. Kemudian diinkubasi pada temperatur 37oC selama 24 jam. Zona hambat yang terbentuk diukur dengan menggunakan jangka sorong. Pengujian dilakukan sebanyak dua kali (duplo). Ekstrak yang memiliki aktivitas anitibakteri tertinggi kemudian difraksinasi menggunakan kromatografi kolom.
3.3.6 Skrining Fitokimia Ekstrak yang Memiliki Aktivitas Antibakteri Tertinggi
3.3.6.1 Pengujian Golongan Terpenoid dan Steroid (P.Lalitha et al 2012) Uji Liebermann – Burchard. Sebanyak 1 ml sampel ditambahkan kloroform, kemudian ditambahkan asam asetat anhidrida dan beberapa tetes asam sulfat pekat. Hasil uji positif untuk terpenoid bila terbentuk warna hijau gelap. Hasil uji positif untuk steroid bila terbentuk warna merah muda atau merah.
3.3.6.2 Pengujian Golongan Saponin (Harborne 1996)
Sebanyak 1 ml sampel pekat dimasukkan ke dalam tabung reaksi, dan ditambahkan 10 ml air panas lalu didinginkan. Selanjutnya dikocok dengan vortex selama kurang lebih 10 detik. Bila terdapat senyawa saponin dalam ekstrak maka akan terbentuk buih mantap selama sekitar 10 menit. Buih dikatakan mantap bila tingginya 1 – 10 cm, dan buih tidak hilang bila ditambah HCl 2 N.
3.3.6.3 Pengujian Golongan Alkaloid (Harborne 1996)
UIN Syarif Hidayatullah Jakarta
3.3.6.4 Pengujian Golongan Flavonoid (Mojab F dkk, 2003)
Satu gram sampel diekstraksi dengan 5 ml etanol kemudian tambahkan beberapa tetes HCl pekat dan 1,5 gram logam magnesium. Adanya flavonoid, diindikasikan dari terbentuknya warna pink atau merah magenta dalam waktu 3 menit.
3.3.6.5 Pengujian Golongan Fenolik (Robinson, 1991; Marliana, 2005)
Tambahkan ke dalam larutan sampel beberapa tetes larutan besi (III) klorida 10%. Adanya senyawa kelompok fenol ditandai dengan munculnya warna biru tua atau hitam kehijauan.
3.3.6.6 Pengujian Golongan Tannin (Farnsworth, 1996)
Ekstrak 0,5 gram dalam cawan ditambahkan 2 ml etanol 70 % kemudian diaduk, ditambahkan FeCl3 sebanyak 3 tetes, positif jika menghasilkan biru karakteristik, biru – hitam, hijau atau biru – hijau. 3.3.7 Penetapan Kadar Air Ekstrak yang Memiliki Aktivitas Antibakteri
Tertinggi(Depkes RI, 2000)
Penetapan kadar air menggunakan metode gravimetri. Krusibel porselin kosong dikonstankan terlebih dahulu dengan pemanasan pada suhu 100-105oC selama 2 jam, didinginkan dalam desikator, dan kemudian ditimbang. Sebanyak 1 g sampel ditimbang dalam krusibel yang telah diketahui beratnya, dikeringkan dalam oven pada suhu 105-110oC selama 5 jam, didinginkan dalam desikator dan selanjutnya ditimbang kembali. Perlakuan ini diulang sampai beratnya konstan. Kadar air dihitung dalam persen terhadap berat sampel awal.
3.3.8 Kromatografi Lapis Tipis (KLT)
UIN Syarif Hidayatullah Jakarta
dengan pelarut yang sesuai dan ditotolkan pada plat KLT menggunakan pipa kapiler.
Plat KLT dielusi di dalam masing – masing bejana KLT yang berisi fase gerak, hingga fase gerak mencapai garis tepi bagian atas, kemudian diangkat. Plat KLT dibiarkan kering dan dilihat pola pemisahannya secara langsung. Dari hasil KLT, dilihat kombinasi sistem fase gerak yang memberikan pola pemisahan terbaik.
3.3.9 Fraksinasi ekstrak yang Memiliki Aktivitas Antibakteri Tertinggi dengan Kromatografi Kolom
3.3.9.1 Penyiapan Sampel
Berdasarkan uji aktivitas antibakteri dengan metode difusi cakram, ekstrak etil asetat memiliki aktivitas antibakteri tertinggi. Sebanyak 10 gram ekstrak etil asetat daun Cinnamomum sintoc, dilarutkan dalam 7,5 ml etil asetat kemudian diadsorpsikan dengan silika (sebagai fasa diam) sebanyak 12 gram sedikit demi sedikit. Kemudian campuran silika dan larutan ekstrak diaduk dan dikering anginkan sampai pelarutnya menguap sehingga diperoleh sampel yang dapat mengalir seperti serbuk.
3.3.9.2 Penyiapan Kolom Kromatografi