AKTIVITAS ANTIBAKTERI DAN ANTIOKSIDAN EKSTRAK
AIR, ETANOL DAN N-HEKSANA TANAMAN SAYUR HITAM
(Asystasia sp.) ASAL KABUPATEN DOGIYAI-PAPUA
ROBERT DESE BOBII
G84080085
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas Antibakteri dan Antioksidan Ekstrak Air, Etanol, dan N-heksana Tanaman Sayur Hitam (Asystasia sp.) Asal Kabupaten Dogiyai-Papua adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2014
Robert Dese Bobii
ABSTRAK
ROBERT DESE BOBII. Aktivitas Antibakteri dan Antioksidan Ekstrak Air, Etanol, dan N-heksana Tanaman Sayur Hitam (Asystasia sp.) Asal Kabupaten Dogiyai Provinsi Papua. Dibimbing oleh Drs. Edy Djauhari Purwakusumah, M.Si dan Dr.Syamsul Falah, S.Hut, M.Si.
Tanaman sayur hitam (Asystasia sp.) telah digunakan oleh masyarakat di Papua sebagai sayuran dan telah diketahui dapat menyembuhkan luka. Tujuan penelitian ini untuk mengidentifikasi kandungan fitokimia, antibakteri dan antioksidan dari sayur hitam. Sayur hitam diekstrak dengan pelarut air, etanol 70%, dan n-heksana. Uji aktivitas antioksidan dilakukan dengan metode DPPH sedangkan uji antibakteri menggunakan metode kertas cakram terhadap bakteri Escherichia coli
(Gram negatif) dan Staphylococcus aureus (Gram positif). Hasil uji fitokimia dapat diketahui bahwa ekstrak air, etanol 70% dan n-heksana sayur hitam mengandung flavonoid, saponin, tanin dan steroid. Hasil penelitian antibakteri menunjukkan bahwa setiap ekstrak tidak memiliki aktivitas antibakteri terhadap
E.coli dan S. aureus. Analisis aktivitas antioksidan menunjukkan nilai IC50 ekstrak
perebusan (air), pemanasan (air), n-heksana, tanpa pemanasan (air) dan etanol 70 % berturut-turut sebesar 1286.894 ppm, 3391.667 ppm, 1098.667 ppm, 228.842 dan 263.117 ppm. Kesimpulannya, bahwa sayur hitam tidak bersifat antibakteri dan memiliki aktivitas antioksidan yang lemah.
Kata Kunci: antibakteri, antioksidan, E. coli, sayur hitam, S. aureus,
ABSTRACT
ROBERT DESE BOBII. The Activity Antibacterial and Antioxidant Extract Water, Ethanol, and N-hexane Vegetable Black (Asystasia sp.) Origin Dogiyai Regency of Papua province. Supervised by Drs. Edy Djauhari Purwakusumah, M.Si and Dr.Syamsul Falah, S.Hut, M.Si.
The black vegetable (Asystasia sp.) plants has been used by people in Papuan as vegetable and has been known to heal wounds. The purpose of this study was to identify the content of phytochemicals, antibacterial and antioxidant from black vegetable. The black vegetable extracted with water, 70% ethanol, and n-hexane solvent. Antioxidant activity of black vegetable extracts were determined by DPPH method and antibacterial activity tested by paper disc method against
Escherichia coli (Gram negative) and Staphylococcus aureus (Gram positive). The result phytochemicals showed that the black vegetable by water, ethanol 70% and n-hexane extracts contained flavonoid, saponin, tannin and steroids. Antibacterial test results showed that the extract do not have any antibacterial activity against E.coli and S. aureus. The analysis of antioxidant activity showed that the IC50 value of boiling (water), heating (water), n-hexane, without heating
(water) and ethanol 70%, respectively for 1286.894 ppm, 3391.667 ppm, 1098.667 ppm, 228 842 ppm and 263.117 ppm. The conclusion, black vegetable is do not have antibacterial activity and has a weak antioxidant activity.
AKTIVITAS ANTIBAKTERI DAN ANTIOKSIDAN EKSTRAK
AIR, ETANOL DAN N-HEKSANA TANAMAN SAYUR HITAM
(Asystasia sp.) ASAL KABUPATEN DOGIYAI-PAPUA
ROBERT DESE BOBII
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana sains
Pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul : Aktivitas Antibakteri dan Antioksidan Ekstrak Air, Etanol, dan N- heksana Sayur Hitam (Asystasia sp.) Asal Kabupaten Dogiyai-Papua. Nama : Robert Dese Bobii
NIM : G84080085
Disetujui Komisi Pembimbing
Drs. Edy Djauhari Purwakusumah, M.Si Ketua
Dr. Syamsul Falah, S.Hut, M.Si Anggota
Diketahui
Ketua Departemen Biokimia
Dr.Ir. I Made Artika, M.App., Sc NIP 19630117 198903 1 000
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas segala hikmat dan karunia yang diberikan sehingga penelitian yang berjudul uji antibakteri dan antioksidan ekstrak air, etanol, dan n-heksana sayur hitam asal kabupaten Dogiyai provinsi Papua telah selesai. Penelitian ini telah dilaksanakan di Laboratorium Pusat Studi Biofarmaka, mulai dari bulan November 2013 hingga Februari 2014.
Ucapan terimakasih yang sebanyak-banyaknya penulis ucapkan kepada Bapak Drs. Edy Djauhari, M.Si selaku pembimbing pertama dan Bapak Dr. Syamsul Falah, S.Hut.,M.Si selaku pembimbing kedua atas bimbingan, pengarahan, dan saran-saran yang diberikan selama melaksanakan penelitian maupun dalam penulisan skripsi ini. Ucapan terimakasih juga disampaikan kepada Pusat Studi Biofarmaka IPB yang telah memberikan kesempatan kepada penulis untuk dapat melakukan penelitian. Terlebih khusus kepada bapak Edy Djauhari yang membantu penulis memfasilitasi tempat penelitian sehingga penelitian dapat berjalan lancar. Tidak lupa juga penulis mengucapkan terimakasih kepada Mba Nunuk, Mba Ina, mas Endi serta Antonio atas semua bantuannya di laboratorium.
Dengan penuh rasa hormat, penulis menyampaikan banyak terimakasih buat Ayahanda Andreas Bobii (alm) dan Ibunda Martha Mote tercinta serta kaka Yosina Bobii (alm) dan om Demianus Mote (alm) yang selalu mendoakan untuk keberhasilan penulis. Khusus buat nenek Hana Agapa dan adik-adikku Jek Bobii, Melkias Bobii dan Elias Pigome tersayang, dengan sepenuh hati penulis haturkan terimakasih atas bantuan, doa, motivasi, kesabaran dan pengertiannya selama ini. Spesial kepada Adelina Warbandido, terimakasih atas doa, motivasi, dan pengertian yang diberikan selama ini. Kiranya Tuhan akan membalas semua kebaikannya. Semoga karya ilmiah ini bermanfaat bagi para pembaca dan dapat berkontribusi dalam kemajuan ilmu pengetahuan khususnya di bidang biokimia.
Bogor, Juni 2014
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
METODE PENELITIAN 2
Bahan dan Alat 2
Prosedur Penelitian 2
HASIL DAN PEMBAHASAN
Hasil 6
Pembahasan 8
SIMPULAN DAN SARAN
Simpulan 14
Saran 14
DAFTAR PUSTAKA 15
LAMPIRAN 17
DAFTAR TABEL
1 Rendemen ekstrak sayur hitam 6 2 Hasil analisis fitokimia 7 3 Hasil pengamatan zona hambat ekstrak sayur hitam 7
4 Inhibition Consentration (IC50) 8
DAFTAR GAMBAR
1 Hasil uji antibakteri S. aureus (a) dan E.coli (b) 8 2 Foto tanaman sayur hitam (Asystasia sp.) 9 3 Reaksi antioksidan dan radikal DPPH 14
DAFTAR LAMPIRAN
1 Alur penelitian 18
1
PENDAHULUAN
Papua merupakan salah satu Provinsi di Indonesia yang terletak di ufuk timur nusantara dengan hutannya yang begitu luas dan memiliki keanekaragaman hayati yang sangat beragam dan khas. Provinsi Papua terdiri dari 29 kabupaten. Salah satu diantaranya adalah kabupaten Dogiyai. Kabupaten Dogiyai merupakan salah satu kabupaten yang terletak di pegunungan tengah Papua. Kabupaten Dogiyai memiliki topografi yang bervariasi mulai dari dataran bergelombang, berbukit, dan pegunungan. Hampir 85% daerah kabupaten Dogiyai didominasi oleh pegunungan yang dipenuhi oleh hutan alami. Hal ini menggambarkan bahwa kabupaten Dogiyai memiliki sumberdaya hayati yang sangat beragam dan masih belum tersentuh oleh tangan manusia. Berbagai tanaman fenomenal pun tumbuh subur di daerah ini, seperti buah merah yang telah dikenal dan digunakan sebagai obat antikanker payudara. Demikian juga dengan sarang semut yang tidak kalah populernya sebagai sang raja herbal (Depkes, 2007).
Sekitar tiga ribu jenis tanaman di Papua telah dimanfaatkan secara turun temurun oleh masyarakat sekitar sebagai obat sejak berabad-abad yang lalu. Hal ini telah dilakukan jauh sebelum pelayanan kesehatan formal dengan obat-obatan modern menyentuh masyarakat (Deptan, 2007). Pengetahuan tentang khasiat tanaman obat ini merupakan warisan budaya masyarakat Papua yang telah dilakukan secara turun-temurun. Seiring perkembangan zaman, banyak obat-obat sintesis masuk ke kabupaten dogiyai. Namun, pengobatan menggunakan obat sintesis ini belum tersentuh oleh masyarakat yang berada di daerah yang terpencil. Bahkan pelayanan kesehatan di daerah terpencil hampir tidak ada. Jarak yang cukup jauh dan medan yang sulit menjadi kendala yang sangat berarti. Selain itu, untuk mendapatkan obat harus dibeli dengan harga yang cukup tinggi.
Kendala tersebut diatas sangatlah berarti karena masyarakat di daerah terpencil biasanya lebih memilih untuk mengobati penyakitnya dengan pengetahuan tradisional sehingga kasus kematian masyarakat akibat bakteri patogen terus meningkat terutama di daerah-daerah yang sulit di jangkau seperti di pedalaman Papua. Disamping itu, kebiasaan masyarakat pegunungan Papua yang pada umumnya adalah perokok juga dapat meningkatkan produksi radikal bebas di dalam tubuh sehingga dapat mengakibatkan penyakit degeneratif dan penuaan dini (Hariyatimi, 2004). Mengingat kendala yang telah dipaparkan diatas, maka perlu dilakukan strategi agar dapat meminimalisir hal tersebut. Salah satunya adalah dengan kembali memanfaatkan potensi tanaman obat sesuai slogan “back to nature” agar pangan dan produk kesehatan aman dikonsumsi (Deptan, 2007). Penggunaan tanaman obat secara tradisional selama ini belum sepenuhnya aman sehingga dilakukan penelitian yang memadai agar efektivitas, efisien dan keamanan obat tradisional terjamin (Depkes, 2007).
2
besar kemungkinan sayur hitam memiliki senyawa aktif sebagai antibakteri dan antioksidan.
Penelitian ini bertujuan untuk mengetahui kandungan fitokimia, aktivitas antibakteri dan aktivitas antioksidan yang terdapat di dalam tanaman sayur hitam. Secara khusus penelitian ini bertujuan untuk meningkatkan potensi lokal Papua sehingga kelak tanaman sayur hitam menjadi salah satu alternatif dalam pengobatan. Pada penelitian ini diharapkan pelarut air, etanol 70%, dan n-heksana mampu mengekstrak senyawa aktif dari tanaman sayur hitam yang diduga memiliki aktivitas antibakteri dan antioksidan. Manfaat penelitian ini ialah memberikan informasi awal mengenai kandungan tanaman sayur hitam sebagai antibakteri dan antioksidan alami sehingga dapat meningkatkan nilai guna tanaman ini.
METODE PENELITIAN
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah bagian daun dari tanaman sayur hitam. Bakteri yang digunakan pada pengujian antibakteri adalah
Staphylococcus aureus (Gram positif) dan Escherichia coli (Gram negatif). Media untuk uji antibakteri menggunakan Media Tryptic Soy Agar (TSA), Tryptic Soy Broth (TSB), Nutrient Agar (NA), dan Nutrient Broth (NB), kontrol positif yang digunakan pada uji antibakteri adalah tetrasiklin, sedangkan aquades steril sebagai kontrol negatif. Bahan lain yang digunakan adalah HCl 1-2% dan pekat, reagen Dragendorf, reagen Mayer, reagen Wagner, methanol 50%, Mg, etanol 96 %, n-heksana, kloroform, kertas saring, asam asetat anhidrad, H2SO4 pekat, NH3 10%,
FeCl3, DPPH, kapas, sarung tangan, kertas cakram, dimetil sulfoksida (DMSO).
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas, alat penguap vakum putar (rotary evaporator), kulkas, blender, eksikator, oven, autoklaf, inkubator, spektrofometer ELISA reader EPOCH, vortex, pipet, tabung Eppendorf, mikro pipet, mikro plate, jangka sorong dan kamera.
Prosedur Penelitian
Metode penelitian yang dilakukan meliputi penyiapan sampel, pengumpulan, pembuatan simplisia, determinasi, pembuatan ekstrak, penapisan fitokimia, pemeriksaan aktivitas antibakteri dan aktivitas antioksidan.
Determinasi Sayur Hitam
3
Pembuatan Simplisia dan Pembuatan Ekstrak (Handa et al. 2008)
Bahan tanaman yang diuji adalah daun tanaman sayur hitam yang telah dibersihkan dan dikeringkan di bawah terik matahari selama tiga hari. Simplisia sayur hitam digiling menggunakan alat penggiling (blender) sampai menjadi serbuk lalu di saring. Selanjutnya, serbuk sayur hitam diekstrak menggunakan metode maserasi, pemanasan, dan perebusan.
Ekstrak maserasi dilakukan menggunakan pelarut air, etanol 70%, dan n-heksana dengan perbandingan 1:10 (b/v). Sebanyak 50 gram serbuk simplisia sayur hitam dimasukkan ke dalam labu Erlenmeyer yang berisi 500 mL air. Selanjutnya, dimaserasi selama 24 jam dengan shaker pada kecepatan 98 rpm. Hasil maserasi disaring dengan menggunakan kertas saring lalu filtratnya ditampung dalam labu Erlenmeyer 1 L. Perlakuan maserasi diulang hingga dua kali menggunakan sampel daun bekas maserasi sebelumnya. Hasil maserasi dipekatkan dengan rotary evaporator hingga didapat ekstrak yang kering. Ekstrak kemudian ditimbang berat bersihnya.
Ekstrak dengan perebusan dilakukan menggunakan pelarut air dengan perbandingan 1:10 (b/v). Sebanyak 50 gram serbuk simplisia sayur hitam dimasukkan ke dalam labu Erlenmeyer yang berisi 500 mL air lalu dipanaskan pada suhu 90 0C selama beberapa menit. Selanjutnya hasil perebusan disaring dengan mengunakan kertas saring dan filtratnya ditampung dalam labu Erlenmeyer 1 L. Kemudian dipekatkan dengan rotary evaporator hingga didapat ekstrak yang kering. Ekstrak kemudian ditimbang berat bersihnya.
Perhitungan randemen ekstrak menggunakan rumus: Rendemen =
� � � � � 100%
Penentuan Kadar Air (Harborne 1996)
Cawan kosong dikeringkan dalam oven selama 15 menit lalu didinginkan dalam eksikator. Setelah dingin, cawan diambil dengan penjepit dan ditimbang untuk mengetahui bobot kosong cawan. Setelah itu, simplisia ditimbang sebanyak 2 gram dan dimasukkan dalam cawan tersebut. Lalu dikeringkan di dalam oven pada suhu 105 0C selama 3 jam. Selanjutnya didinginkan dalam desikator dan ditimbang untuk mengetahui bobot kering. Ulangi penimbangan hingga diperoleh bobot tetap/konstan.
Kadar air dihitung dengan rumus:
= � � � −( � � � ℎ )
– � 100%
Uji Komponen Fitokimia (Vinod et al. 2010)
Fraksi-fraksi yang digunakan untuk penapisan fitokimia adalah fraksi n-heksana, etanol, dan air. Metode skrining yang digunakan untuk mengetahui kandungan bahan metabolit sekunder dilakukan dengan:
Identifikasi Alkaloid. Sebanyak 1 gram ekstrak sayur hitam ditambahkan 3 tetes NH3 dan 5 ml CHCl3 lalu disaring. Selanjutnya filtrat ditambahkan H2SO4
4
Dragendorf, Mayer, dan Wagner. Jika pengujian berturut-turut menghasilkan endapan berwarna jingga, putih, dan coklat maka daun sayur hitam positif mengandung alkaloid.
Identifikasi Flavonoid. Sebanyak 1 gram ekstrak sayur hitam dilarutkan dalam 2 ml akuades dan dipanaskan selama 5 menit. Setelah itu, disaring dan diambil filtratnya lalu ditambahkan serbuk Mg dan 5 tetes HCl:EtOH (1:1). Selanjutnya tambahkan juga larutan amil alkohol. Larutan berwarna merah atau jingga yang terbentuk menunjukkan adanya flavonoid.
Identifikasi Steroid dan Triterpenoid. Sampel ekstrak sayur hitam sebanyak 1 gram dilarutkan dalam etanol panas lalu disaring, kemudian filtrat yang dihasilkan dipanaskan hingga kering. Selanjutnya ditambahkan dengan 1 ml etil eter dan 1 ml asam asetat anhidrat. Campuran ini ditambahkan dengan H2SO4
pekat sebanyak 1 tetes melalui dinding tabung. Jika hasil yang diperoleh berupa cincin kecoklatan atau violet pada perbatasan dua pelarut maka menunjukkan adanya triterpenoid, sedangkan munculnya warna hijau kebiruan menunjukkan adanya steroid.
Identifikasi Tanin. Sebanyak 1 gram ekstrak sayur hitam dilarutkan dalam 2 ml akuades dan dipanaskan selama 5 menit. Setelah itu disaring dan diambil filtratnya lalu ditambahkan 3 tetes larutan FeCl3 10%, timbulnya warna
hijau kehitaman menunjukkan adanya senyawa tannin.
Identifikasi Saponin. Ekstrak sayur hitam dalam tabung reaksi ditambah air (1:1) sambil dikocok selama 5 menit. Adanya busa yang dapat bertahan selama 5 menit menunjukkan adanya senyawa saponin.
Uji Aktivitas Antibakteri Metode Kertas Cakram (Purbowatiningrum, 2010)
Pembuatan Medium Pertumbuhan dan Pengujian. Bubuk TSA, TSB, NB, dan NA dimasukkan ke dalam labu Erlenmeyer masing-masing sebanyak 10 gram, 7.5 gram, 2 gram dan 5 gram lalu masing-masing dilarutkan dalam 250 ml aquades. Kemudian dipanaskan agar media homogen. Setelah itu medium di sterilisasi menggunakan autoklaf pada suhu 121 °C dengan tekanan 1 atm selama 15 menit.
Pembuatan Medium Agar Miring. Bubuk NA dan TSA masing-masing sebanyak 0.2 gram dan 0.4 gram dilarutkan dalam 10 ml aquades menggunakan labu Erlenmeyer. Setelah itu dihomogenkan diatas penangas air sampai mendidih. Sebanyak 5 ml dituangkan masing-masing pada 1 tabung reaksi steril dan ditutup dengan kapas. Media tersebut disterilkan dalam outoklaf pada suhu 121 oC selama 15 menit, kemudian dibiarkan pada suhu ruangan selama ± 30 menit sampai media memadat pada kemiringan 30o. Media Agar miring digunakan untuk inokulasi bakteri (Lay, 1994).
Peremajaan Bakteri. Biakan bakteri E. coli dan S. aureus sebanyak satu ose diinokulasikan ke dalam medium agar miring NA dan TSA yang telah dibuat sebelumnya secara aseptis dengan meletakkan jarum ose yang mengandung biakan pada dasar kemiringan agar dan ditarik dengan gerakan zig-zag. Bakteri E. coli diinokulasi dalam medium NA dan S. aureus diinokulasi pada media TSA.
5
NB yang terpisah. Selanjutnya masing-masing diinkubasi pada suhu 37 °C selama 30 menit. Pengujian antibakteri dilakukan dengan metode kertas cakram. Terlebih dahulu sampel sayur hitam ekstrak maserasi, pemanasan, perebusan, etanol 70%, dan n-heksana masing-masing dilarutkan dalam aquades steril dengan konsentrasi 20%, 10%, 5%, 2.5%. Selanjutnya media TSA dan NA yang telah dibuat tersebut di tuangkan ke dalam cawan Petri. Setelah media memadat, bakteri uji yang telah diremajakan diambil 1 mL dengan pipet lalu diinokulasikan kedalam medium TSA dan NA setengah padat lalu diaduk agar tercampur secara merata. Lalu media setengah padat ini dituangkan ke dalam cawan yang berisi TSA dan NA secara merata. Selanjutnya dimasukkan kertas cakram 6 mm dan ditetesi dengan larutan ekstrak dengan konsentrasi 20%, 10%, 5%, 2.5% sebanyak 10 L. Setelah itu di simpan selama 24 jam pada suhu 37 oC di ukur diameter hambatan yang terbentuk zona bening menggunakan jangka sorong.
Penetapan Nilai Konsentrasi Hambat Minimum (KHM). Setelah diketahui bahwa ekstrak memiliki aktivitas antibakteri selanjutnya dilakukan penetapan konsentrasi hambat minimum dari ekstrak tersebut. Tujuannya untuk mengetahui kadar terendah dari sampel ekstrak yang masih memberikan aktivitas antibakteri terhadap bakteri uji. Metode penetapan yang dilakukan adalah dengan metode agar padat. Sampel ekstrak dibuat dengan berbagai konsentrasi mulai dari yang besar hingga yang kecil lalu di uji aktivitas antibakterinya.
Uji Antioksidan 1,1 diphenyl-2-picryl-hydrazil (DPPH) (Modifikasi Bendra,
2012).
Pembuatan Larutan DPPH. Potensi antioksidan dari sayur hitam dilakukan dengan metode DPPH. stok larutan DPPH dilakukan dengan menimbang sebanyak 10 mg DPPH dan dilarutkan dengan etanol di dalam labu sampai 100 ml sehingga diperoleh larutan dengan konsentrasi 0.25 mM.
Pembuatan Larutan Ekstrak Uji. Larutan stok sampel dibuat dengan cara menimbang ekstrak perebusan, pemanasan, etanol, dan n-heksana masing-masing sebanyak 10 mg, kemudian dilarutkan dengan 1ml DMSO dalam tabung Eppendorf sehingga didapatkan konsentrasi 10000 ppm. Sampel dalam DMSO diambil sebanyak 4µL dan dilarutkan dalam 196 µL etanol 96%. Selanjutnya dilakukan pengenceran sehingga diperoleh sampel dengan konsentrasi akhir 1000, 500, 250, 125, dan 62,5 ppm pada mikroplate. Larutan standar yang digunakan adalah vitamin C (asam askorbat). Larutan standar dibuat dengan menimbang 10 mg vitamin C lalu dilarutkan dalam 1 mL DMSO, kocok hingga larutan dan homogen. Larutan blanko yang digunakan sebanyak 100 µL etanol dan 100 µ L DPPH.
6
Penentuan Persentase Penghambatan. Persen penghambatan dihitung dengan menggunakan rumus:
= 1− 2
1 100%
A1 = absorbansi kontrol A2 = absorbansi sampel
Nilai IC50 (Inhibition Consentration 50) merupakan bilangan yang menunjukkan
konsentrasi sampel uji yang memberikan peredaman sebesar 50% (mampu menghambat atau meredam proses oksidasi sebesar 50%). Nilai IC50 ditentukan
dengan cara dibuat kurva linear dan kurva logaritma antara konsentrasi larutan uji (sumbu x) dan % penghambatan (sumbu y).
HASIL DAN PEMBAHASAN
Hasil
Determinasi Tanaman Sayur Hitam
Determinasi tanaman sayur hitam dilakukan karena tanaman ini merupakan salah satu tanaman endemik pertama kali diteliti. Hasil determinasi diketahui bahwa tanaman sayur hitam termasuk dalam bangsa Scrophulariales, suku Acanthaceae, marga Asystasia, dan jenis Asystasia sp. Penyebutan nama
sayur hitam dalam bahasa daerah suku Mee disebut dengan “digiyo naapo” atau “ugubo”, sedangkan suku dani menyebutnya dengan “mbuna”.
Kadar Air dan Rendemen
Penentuan kadar air dilakukan agar dapat menentukan masa penyimpanan simplisia. Hasil uji kadar air simplisia sayur hitam menunjukkan bahwa persentase kadar air rerata sebesar 15.84% (Lampiran 3). Kadar air simplisia sayur hitam sebesar 15.84% dapat dikatakan kurang baik dan tidak dapat disimpan dalam waktu yang lama karena kadar air yang lebih dari 3-7 % rentan terhadap pencemaran mikroorganisme (Winarno, 1997). Rendemen ekstrak merupakan bioaktif sayur hitam yang terekstrak pada pelarut yang digunakan. Sampel sayur hitam masing-masing sebanyak 50 dicampurkan dengan pelarut dengan perbandingan 1:10 untuk pelarut air, etanol, dan n-heksana. Hasilnya, rendemen terbesar diperoleh dari ekstrak etanol 70 % sebanyak 23.064 %, sedangkan ekstrak terendah diperoleh dari ekstrak pelarut n-heksana sebesar 3.2848 % ( Tabel 1).
No Jenis Ekstrak Randemen (%) Rendemen terkoreksi (%) 1 Tanpa Pemanasan 15.1665 0.180
7
Komponen Fitokimia
Berdasarkan hasil analisis fitokimia menunjukkan bahwa dari sayur hitam sayur hitam tidak mengandung senyawa bioaktif alkaloid. Senyawa bioaktif seperti flavonoid, saponin, dan tanin terdapat pada ekstrak air dan etanol 70 %. Sedangkan senyawa bioaktif terpenoid terdeteksi pada ekstrak n-heksana. Perlakuan pemanasan membuat senyawa saponin berkurang, bahkan pada perebusan tidak terdeteksi adanya senyawa saponin ( Tabel 2 ).
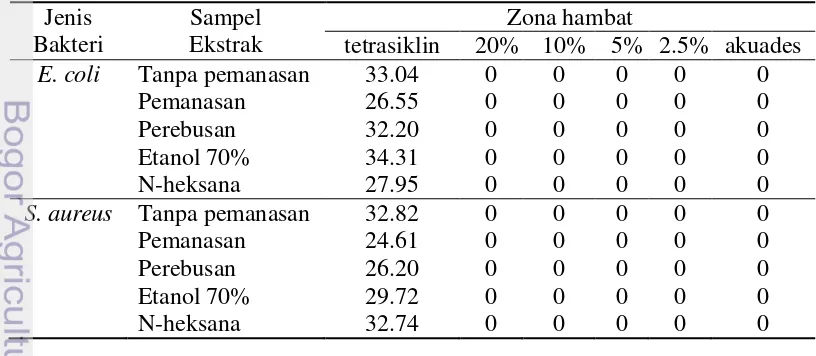
Aktivitas Antibakteri
Kontrol positif yang digunakan dalam penelitian ini adalah tetrasiklin. Diameter zona bening yang dihasilkan oleh tetrasiklin dapat diukur dengan jangka sorong. Pada gambar 1, terlihat jelas zona bening yang dihasilkan oleh kontrol positif ini. Hasil tersebut menunjukkan bahwa tetrasiklin merupakan antibakteri berspektrum luas karena dapat menghambat bakteri E.coli (Gram negatif) dan S. aureus (Gram positif). Sementara, kontrol negatif yang digunakan adalah akuades yang telah disterilkan. Hasil uji antibakteri dengan menggunakan metode kertas cakram dengan konsentrasi sampel berturut-turut sebesar 20 %, 10 %, 5 %, dan 2.5 % (Tabel 3).
menunjukkan hasil yang negatif. Hasil tersebut ketahui setelah mengamati zona bening yang terbentuk di sekitar kertas cakram yang telah dicampurkan dengan
Uji Tanpa
Tabel 2 Hasil analisis fitokimia
+ : terdapat senyawa bioaktif, - : tidak ada senyawa bioaktif
8
Gambar 1 Hasil uji antibakteri terhadap bakteri S. aureus (a) dan E.coli (b) sampel. Contoh sampel ekstrak air dengan perlakuan pemanasan dan perebusan tidak terdapat zona hambat atau zona bening (Gambar 1).
Aktivitas Antioksidan
Pada uji aktivitas antioksidan digunakan vitamin C sebagai kontrol positif. Hasil uji aktivitas antioksidan menunjukkan nilai IC50 sebesar 12.346 ppm
(Tabel 4). Nilai ini menjelaskan bahwa vitamin C sebagai senyawa yang memiliki aktivitas antioksidan yang kuat karena nilai IC50 dibawah 200 ppm (Hanani et al,
2005). Hasil pengujian sampel sayur hitam menunjukkan bahwa nilai IC50 ekstrak
perebusan (air), pemanasan (air), n-heksana, tanpa pemanasan (air) dan etanol 70 % berturut-turut sebesar 1286.894 ppm, 3391.667 ppm, 1098.667 ppm, 228.842 dan 263.117 ppm. Nilai IC50 sampel diatas apabila dibandingkan dengan vitamin
C (kontrol positif) maka nilai IC50 sampel sayur hitam memiliki nilai IC50 yang
lebih tinggi sehingga dapat diketahui bahwa nilai IC50 vitamin C lebih efektif
dalam menangkal radikal DPPH karena semakin kecil nilai IC50 menunjukkan
kemampuan antioksidan yang lebih baik dalam menangkal radikal bebas (Molyneux, 2003). Data persentase penghambatan dapat di lihat pada lampiran 8.
Pembahasan
Determinasi Tanaman Sayur Hitam
Tanaman sayur hitam merupakan salah satu tanaman endemik Papua. Tanaman ini tumbuh subur di daerah perbukitan, terutama dibawah pohon yang rindang dan sedikit terkena sinar matahari seperti di lereng gunung atau di tepi aliran air. Tanaman jenis Asystasia sp. merupakan jenis sayuran yang dikonsumsi
Sampel IC50 rerata (ppm) Ekstrak Etanol 70 % 263.117
Vitamin C 12.346
9
oleh masyarakat setempat dengan cara direbus. Selain itu, tanaman ini digunakan untuk mengobati luka dalam, luka luar, dan dapat mengobati batuk.
Secara sistematis, tanaman sayur hitam termasuk dalam family
Acanthaceae, genus Asystasia sp. (Lampiran 2). Penyebutan nama sayur ini pun berbeda-beda tiap sukunya, misalnya suku Mee (Ekagi) menyebutnya dengan nama digiyo naapo atau ugubo, sedangkan suku dani menyebutnya mbuna dan masih banyak penyebutan lainnya. Tanaman ini berkembang biak dengan tunas. Dipanen dengan cara dipetik bagian daun yang masih muda. Ciri batangnya berbuku-buku seperti bambu, tumbuh tegak dengan ketinggian 10 sampai 15 cm dari batang akar. Daunnya tumbuh secara simetris di setiap buku-bukunya, daun mudah berwarna hijau mudah sedangkan yang tua berwarna hijau tua.
Kadar Air dan Rendemen
Penentuan kadar air di dalam sayur hitam sangat diperlukan untuk mengetahui berat kering dari sayur hitam sehingga mempertahankan mutu selama penyimpanan. Bagian tanaman yang digunakan untuk menentukan kadar air adalah bagian daun dari sayur hitam (Asystasia sp.). Tanaman sayur hitam yang diuji kadar air, terlebih dahulu telah dikeringkan dari daerah asal yaitu Moanemani selama tiga hari. Penentuan kada air dilakukan untuk mengetahui ketahanan suatu bahan dalam penyimpanan (Harjadi, 1993). Oleh karena itu, terlebih dahulu sampel sayur hitam dilakukan pengujian kadar air. Pada penelitian ini, kandungan air pada sampel dihilangkan dengan cara pemanasan fisik menggunakan oven pada suhu 105 oC. Pemanasan ini bertujuan untuk menghilangkan air yang terikat secara fisik di dalam sampel sayur hitam. Persen kadar air juga digunakan untuk mengetahui persen bahan kering dan sebagai faktor koreksi suatu sampel, jika sampel yang digunakan memiliki lingkungan agrobiofisik yang berbeda, sehingga dapat dipakai untuk memperkirakan jumlah bahan yang dibutuhkan jika ingin mengekstraksi bahan langsung dalam keadaan basah sehingga dapat digunakan sebagai rendemen terkoreksi pada proses ekstraksi (Ichsan, 2011).
Persentase kadar air rerata yang terkandung di dalam simplisia sayur hitam adalah sebesar 15.84%. Persentase kadar air rerata tersebut lebih tinggi dari syarat menurut Wirarno (1997), yang menyatakan bahwa jumlah kadar air yang baik adalah sekitar 3-7 %. Pada konsentrasi kadar tersebut sampel dapat disimpan dalam jangka waktu yang cukup lama sehingga kemungkinan rusak terkena jamur
10
atau bakteri saat penyimpanan sangat kecil. Oleh sebab itu, sebaiknya simplisia sayur hitam langsung digunakan agar tidak terjadi penyimpangan atau dikeringkan kembali untuk menghindari aktivitas mikroba.
Sebelum di ekstraksi, simplisia sayur hitam terlebih dahulu digiling dengan menggunakan alat penggiling (blender) agar halus. Penghalusan simplisia dilakukan untuk mempermudah proses ekstraksi sehingga proses ekstraksi dapat berjalan secara optimal dan interaksi antara pelarut dengan komponen bioaktif dalam simplisia semakin besar. Perbandingan sampel dan pelarut (1:10) di shaker
dengan tujuan agar pelarut yang memiliki nilai perbandingan lebih tinggi dapat mengekstrak senyawa bioaktif secara optimal. Ampas (sisa) simplisia kembali dilarutkan dengan menggunakan pelarut yang sama dan dilakukan dengan prosedur yang sama seperti sebelumnya. Penggantian pelarut dilakukan agar dapat menarik atau melisis senyawa bioaktif yang terdapat di dalam simplisia sayur hitam secara maksimal. Total filtrat yang didapatkan kemudian dipekatkan dengan
rotary evaporator lalu dihitung rendemennya.
Rendemen ekstrak dihitung berdasarkan perbandingan berat akhir (berat ekstrak yang dihasilkan) dengan berat awal dikalikan 100%. Rendemen hasil ekstrak menunjukkan hasil ekstrak yang berbeda-beda sesuai dengan jenis pelarut yang digunakan. Rendemen terbesar diperoleh dari ekstrak etanol 70%, sedangkan ekstrak terendah diperoleh dari ekstrak pelarut n-heksana. Hasil ini menginformasikan bahwa komponen-komponen bioaktif yang terdapat di dalam tanaman sayur hitam lebih bersifat polar karena banyak senyawa bioaktif yang terekstrak pada pelarut polar seperti etanol 70 % dan air.
Metode yang digunakan dalam mengekstrak simplisia adalah maserasi pemanasan dan perebusan. Ekstrak daun sayur hitam (Asystasia sp.) menggunakan metode maserasi karena metode ini sangat sederhana dan baik untuk mengekstrak senyawa yang bersifat tidak tahan panas. Pada prinsipnya, metode maserasi dilakukan dengan merendam simplisia dalam pelarut sehingga mengakibatkan dinding sel tanaman sayur hitam mengalami lisis dan mengakibatkan senyawa bioaktif dalam bahan uji keluar dan terlarut dalam pelarut yang digunakan (Tiwari
et al, 2011).
Ekstrak pemanasan dan perebusan menggunakan pelarut air. Penggunaan pelarut air didasarkan atas kebiasaan masyarakat di daerah pedalaman Papua saat memasak sayur hitam. Pelarut etanol 70% digunakan karena dapat melarutkan senyawa fitokimia lebih maksimal sebab etanol 70% masih mengandung air yang cukup banyak (30%) yang membantu proses ekstrak sehingga sebagian senyawa tersebut ada yang dapat tertarik dalam etanol dan ada pula yang tertarik dalam air (Sani et al. 2014). Disamping itu, pelarut etanol juga mudah menembus dinding sel tanaman dengan cara menonaktifkan enzim oksidase polifenol sehingga dapat mengekstrak senyawa organik yang ada di dalam intrasel (Tiwari et al, 2011). Sedangkan pelarut n-heksana dilakukan untuk mengekstrak senyawa yang tidak larut di dalam air dan etanol.
11
pada jenis pelarut yang digunakan. Metode maserasi digunakan untuk mengektrak sayur hitam dengan menggunakan pelarut etanol 70%, air, dan n-heksana, sedangkan metode pemanasan dan perebusan hanya menggunakan pelarut air.
Komponen Fitokimia
Pada tahapan ini dilakukan penelitian tentang komponen fitokimia agar dapat mengetahui komponen bioaktif yang terdapat di dalam tanaman sayur hitam. Teknik penelitian yang digunakan tahapan ini adalah menggunakan teknik penapisan fitokimia. Penapisan fitokimia merupakan suatu langkah penelitian untuk mengetahui kandungan senyawa kimia secara kualitatif terhadap senyawa-senyawa bioaktif yang terdapat dalam simplisia tumbuhan. Senyawa-senyawa-senyawa tersebut merupakam senyawa organik, oleh karena itu skrining terutama ditujukan terhadap golongan senyawa organik seperti alkaloid, glikosida flavonoid, tanin, saponin, triterpenoid, dan steroid. Teknik penapisan dapat membantu langkah fitofarmakologi melalui seleksi awal pemeriksaan tumbuhan untuk membuktikan ada tidaknya senyawa kimia tertentu dalam tumbuhan tersebut (Fernworth, 1966).
Uji fitokimia dilakukan terhadap simplisia ekstrak air, etanol 70 %, dan n-heksana. Senyawa metabolit sekunder yang diuji meliputi alkaloid, flavonoid, tanin, saponin, steroid, dan triterpenoid. Hasil uji fitokimia (Tabel 2) menunjukkan bahwa sayur hitam mengandung plavonoid, saponin, tanin, steroid dan terpenoid. Senyawa flavonoid, saponin dan tanin terekstrak pada pelarut polar dalam jumlah yang banyak. Namun, jumlah saponin pada perlakuan pemanasan lebih sedikit dibandingkan tanpa pemanasan, bahkan pada perlakuan perebusan tidak terdeteksi adanya senyawa saponin sehingga dapat diketahui bahwa senyawa saponin yang terdapat di dalam sayur hitam bersifat tidak tahan terhadap panas (volatil). Pada Hasil uji fitokimia juga terdeteksi adanya kandungan steroid pada tanaman sayur hitam ekstrak pelarut nonpolar.
Perbedaan jenis pelarut yang digunakan dalam proses ekstrak memberikan hasil yang berbeda terhadap senyawa fitokimia yang terdapat pada tanaman sayur hitam (Asystasia sp). Berdasarkan hasil uji fitokimia dapat dilihat senyawa-senyawa yang bersifat nonpolar seperti triterpenoid dan steroid terekstrak ke dalam pelarut yang bersifat nonpolar (n-heksana) walaupun masih bisa terekstrak ke dalam pelarut polar seperti air. Sama halnya dengan senyawa fitokimia yang bersifat polar seperti flavonoid, saponin dan tanin yang sebagian besar terekstrak ke dalam pelarut yang bersifat polar (air dan etanol 70%) (Tiwari et al, 2011). Kepolaran senyawa flavonoid dan tanin disebabkan oleh adanya gugus hidroksil pada senyawa tersebut. Banyaknya senyawa fitokimia yang terekstrak diharapkan berkorelasi positif terhadap aktivitas farmakologi yang ditimbulkan oleh ekstrak tanaman sayur hitam.
12
radikal bebas sehingga dapat dijadikan acuan untuk melakukan penelitian tentang antioksidan (Rahmawati,2012).
Aktivitas Antibakteri
Uji aktivitas antibakteri dilakukan secara aseptik dengan menggunakan metode cakram. Terbentuknya zona bening di sekitar cakram menunjukkan bahwa ekstrak sayur hitam memiliki senyawa aktif yang bersifat antibakteri. Semakin besar zona bening maka semakin sensitif suatu senyawa antibakteri. Media yang digunakan untuk menumbuhkan bakteri uji, antara lain Tryptic Soy Agar (TSA), terlebih dahulu telah diekstrak dengan pelarut air (maserasi, pemanasan dan perebusan), etanol 70%, dan n-heksana. Masing-masing ekstrak sayur hitam dilarutkan dengan konsentrasi 20%, 10%, 5%, 2.5%. Hasil uji ekstrak sayur hitam yang diujikan terhadap bakteri E.coli dan S. aureus menunjukkan hasil yang negatif. Hasil tersebut ketahui setelah mengamati zona bening yang terbentuk di sekitar kertas cakram yang telah dicampurkan dengan sampel. Sampel ekstrak air dengan perlakuan pemanasan dan perebusan serta tidak terdapat zona hambat atau zona bening. Pada sampel ekstrak maserasi etanol 70% juga tidak terdapat zona bening di sekitar kertas cakram dan hal yang sama juga berlaku pada eksktrak n-heksana.
Pada penelitian antibakteri ini digunakan aquades steril sebagai kontrol negatif dan antibiotik tetrasiklin sebagai kontrol positif karena tetrasiklin termasuk antibiotik berspektrum luas yang dapat menghambat pertumbuhan Gram positif maupun Gram negatif dengan cara menghambat sintesis protein (Pelczar dan Chan,1988). Hasil penelitian menunjukkan bahwa antibiotik tetrasiklin yang digunakan tergolong sensitif terhadap E.coli dan S. aureus. Kesensitifan antibiotik tetrasiklin dapat di lihat dari zona hambat yang terbentuk di dalam cawan Petri konsentrasi 10.000 ppm sehingga dapat membentuk zona hambatan (Lampiran 6 dan 7).
Hasil uji fitokimia (Tabel 2) telah mengkonfirmasikan bahwa di dalam ekstrak sayur hitam terdapat senyawa metabolit sekunder seperti saponin, tanin, dan flavonoid yang berpotensi menjadi antibakteri. Menurut teori yang telah diutarakan oleh Robinson (1995), bahwa mekanisme kerja saponin sebagai antibakteri adalah dengan menurunkan tegangan permukaan sehingga mengakibatkan naiknya permeabilitas sel dan mengakibatkan senyawa intraseluler keluar, sedangkan tanin dapat bersifat antibakteri dengan menghambat reverse
transkriptase dan DNA topoisomerase sehingga sel bakteri tidak dapat terbentuk. Lalu, mekanisme kerja flavonoid bekerja dengan membentuk senyawa kompleks dengan protein ekstraseluler dan terlarut sehingga dapat merusak membran sel bakteri dan diikuti dengan keluarnya senyawa intraseluler.
13
dari hasil penelitian ini dapat diketahui bahwa ekstrak daun sayur hitam tidak memiliki aktivitas antibakteri terhadap E.coli dan S. Aureus (Lampiran 6 dan 7). Tidak terbentuknya daerah zona hambat berupa zona bening pada media dapat disebabkan karena jenis antibakteri yang terdapat dalam ekstrak sayur hitam tidak cukup potensial untuk kedua bakteri uji tersebut (Tabel 3).
Bakteri E.coli dan S. aureus digunakan sebagai bakteri uji karena bakteri tersebut banyak ditemukan di sekitar lingkungan sekitar manusia. Selain itu, kedua bakteri ini juga telah diketahui bersifat pathogen sehingga dapat menimbulkan penyakit yang berbahaya terdahadap kesehatan manusia. Bakteri
E.coli dapat menyebabkan penyakit diare terutama di daerah yang tingkat sanitasi yang rendah (Suriawiria, 1996). Sedangkan bakteri S. aureus merupakan bakteri yang dapat menyebabkan infeksi pada manusia terutama bila terdapat luka dengan permukaan terbuka (Warsa, 1994). Faktor patogenesitas dari kedua bakteri tersebut memberikan penjelasan yang sesuai sehingga penulis menggunakannya sebagai bakteri uji. Hal ini berkaitan dengan tingkat sanitasi dan pengobatan yang rendah seperti di daerah terpencil di Papua.
Aktivitas Antioksidan
Uji antioksidan dilakukan dengan metode DPPH untuk mengetahui aktivitas antioksidan dari ekstrak air, etanol 70% dan n-heksana dengan melihat nilai IC50, yaitu konsentrasi antioksidan yang mampu menghambat 50% radikal
bebas. Pengamatan terhadap radikal DPPH dengan spektofotometer uv-vis pada
panjang gelombang ( ) 517 nm karena DPPH memberikan serapan yang kuat pada
panjang gelombang tersebut (Saklani, 2011). Prinsip pengukuran secara spektrofotometri visibel adalah mengukur besarnya absorbansi pemucatan warna larutan DPPH. Dari berbagai konsentrasi larutan uji diukur persen (%) penghambatannya. Nilai penghambatan 0% berarti larutan uji tidak mempunyai daya penghambatan radikal bebas, sebaliknya nilai 100% berarti penghambatan total (Haryoto et al, 2007).
Kemampuan penghambatan radikal bebas DPPH oleh suatu antioksidan dinyatakan dengan nilai persentase dan konsentrasi dinyatakan dalam parts per million (ppm). Penghambatan radikal bebas dapat diketahui melalui nilai IC50.Nilai tersebut dapat memberikan konsentrasi penghambatan radikal bebas
sebanyak 50 % melalui persamaan garis. Data persentase penghambatan ekstrak sayur hitam menunjukkan bahwa setiap ekstrak memiliki aktivitas antioksidan karena setelah ditambahkan DPPH ke dalam setiap ekstrak yang telah dibuat dengan kosentrasi 1000, 500, 250, 125, dan 62.5 ppm menunjukkan perubahan warna dari ungu menjadi warna kuning. Sampel sayur hitam ekstrak air dengan perlakuan pemanasan dan n-heksana memiliki persentase penghambatan di bawah 50% sehingga tidak dilanjutkan untuk menghitung inhibition contentration (IC50).
14
Nilai IC50 (Inhibition Consentration) ekstrak perebusan (air), pemanasan
(air), n-heksana, tanpa pemanasan (air) dan etanol 70 % berturut-turut sebesar 1286.894 ppm, 3391.667 ppm, 1098.667 ppm, 228.842 dan 263.117 ppm sedangkan kontrol positif vitamin C memiliki IC50 sebesar 12.346 ppm. Hasil
tersebut dapat diketahui bahwa aktivitas antioksidan sayur hitam tergolong lemah dibandingkan vitamin C karena vitamin C memiliki nilai IC50 pada konsentrasi
yang lebih rendah (Tabel 4).
Hasil penelitian Reddy ( 2010) menginformasikan bahwa nilai IC50ekstrak
methanol (179.6 ppm) tanaman Asystasia gangetica lebih rendah dari vitamin C yang digunakan sebagai kontrol positif (0.65 ppm). Apabila dibandingkan dengan penelitian ini maka dapat diketahui bahwa tanaman Asystasia sp. juga memiliki nilai yang lebih rendah dari vitamin C yang digunakan sebagai pembanding (kontrol positif). Namun, nilai IC50 ekstrak tanpa pemanasan dan etanol 70%
Asystasia sp. memiliki nilai yang lebih tinggi dibandingkan tanaman Asystasia gangetica. Artinya bahwa tanaman sayur hitam memiliki aktivitas antioksidan yang lebih rendah daripada tanaman pembanding diatas.
Pada penelitian ini menggunakan radikal bebas DPPH karena merupakan radikal bebas yang stabil dan mudah dilarutkan tanpa dilarutkan dengan senyawa-senyawa lainnya. Dalam bentuk kering dan kondisi penyimpanan yang baik, senyawa radikal ini dapat disimpan dalam waktu yang cukup lama. Prinsip metode uji antioksidan dengan DPPH didasarkan pada reaksi penangkapan atom hidrogen oleh DPPH (reduksi DPPH) dari senyawa antioksidan. Reagen DPPH berperan sebagai radikal bebas yang diredam oleh senyawa antioksidan yang terkandung dalam sampel. Selanjutnya DPPH akan tereduksi menjadi senyawa diphenyl picryl hydrazine (DPPH-H). Reduksi DPPH menjadi DPPH-H menyebabkan perubahan warna pada reagen DPPH, dari ungu menjadi kuning (Lupea, et al. 2006).
SIMPULAN DAN SARAN
Simpulan
Sampel uji yang digunakan adalah bagian daun sayur hitam yang diekstrak dengan dengan air, etanol 70%, dan n-heksana. Analisis fitokimia menunjukkan bahwa senyawa saponin, tanin, flavonoid, dan steroid terdapat di dalam tanaman sayur hitam. Hasil yang didapatkan setelah melakukan uji antibakteri dengan metode cakram menunjukkan hasil yang negatif untuk semua ekstrak uji. Berdasarkan uji aktivitas antioksidan dengan metode DPPH. Nilai IC50 (Inhibition
1,1-Difenil-2-Pikrilhidrazin (nonradikal)
Gambar 5 Reaksi antioksidan dengan radikal bebas DPPH (Molineux, 2004)
15
Consentration) ekstrak perebusan (air), pemanasan (air), n-heksana, tanpa pemanasan (air) dan etanol 70 % berturut-turut sebesar 1286.894 ppm, 3391.667 ppm, 1098.667 ppm, 228.842 dan 263.117 ppm sedangkan kontrol positif vitamin C memiliki IC50 sebesar 12.346 ppm. Selain itu, ekstrak air dengan perlakuan
pemanasan dan ekstrak n-heksana tidak menunjukkan aktivitas IC50. Berdasarkan
hasil penelitian, dapat disimpulkan bahwa sayur hitam tidak bersifat antibakteri dan sayur hitam memiliki aktivitas antioksidan yang lemah.
Saran
Tanaman sayur hitam (Asystasia sp.) merupakan tanaman yang baru pertama kali diteliti sehingga perlu dilakukan uji antibakteri dengan menggunakan menggunakan metode dan jenis bakteri yang berbeda serta menggunakan metode ekstrak yang berbeda pula. Begitu juga dengan antioksidan, perlu dilakukan uji dengan menggunakan metode lain. Hasil Penelitian yang telah dilakukan dapat diketahui bahwa sampel sayur hitam tidak memiliki aktivitas antibakteri. Oleh karena itu, perlu dilakukan penelitian tentang uji aktivitas quorum sensing, uji antiinflamasi dan fungsi lainnya.
DAFTAR PUSTAKA
Astuti E.P. 2008. Pengaruh Penambahan Berbagai Tingkat Vitamin C Sebagai Antioksidan dan Lama Simpan Terhadap Ketengikan Bungkil Kacang Tanah [Skripsi]. Malang (ID): Universitas Brawijaya Malang.
Bendra A. 2012. Uji Aktivitas Antioksidan Ekstrak Daun Premna obligata
Mig.dengan Metode DPPH dan Identifikasi Golongan Senyawa Kimia Dari Fraksi Teraktif. [Skripsi]. Depok (ID): Universitas Indonesia.
[Depkes] Departemen Kesehatan. 2007. Kebijakan Obat Tradisional Nasional. Direk. Jendral Kefarmasian dan Alat Kesehatan.Jakarta (ID).Depkes.
[Deptan] Departemen Pertanian. 2007. Prospek dan Arah Pengembangan Agribisnis Tanaman Obat. Badan Penlit & Peng. Pertanian. Jakarta Selatan (ID). Deptan.
Hanani E, Mun’im A, Sekarini R. 2005. Identifikasi senyawa antioksidan dalam
spons Callyspongia sp dari kepulauan seribu. Majalah Ilmu Kefarmasian. 2(3):127-133.
Handa SS, Khanuja SPS, Longo G, Rakesh DD. 2008.Extraction Technology for Medicinal and Aromatic Plants. Trieste: United Nations Industrial Development Organization and the International Centre for Science and High Technology.
Harborne JB. 1987. Metode Fitokimia Penuntun Cara Modern Menganalisis Tumbuahan, Edisi kedua. Kosasih P. dan Iwang S.,Penerjemah. Bandung (ID).ITB Press.
16
Haryoto. Santoso B. dan Nugroho H. 2007. Aktivitas Antioksidan Fraksi Polar Ekstrak Metanol dari Kulit Batang Shorea Acuminatissima Metode DPPH.Jurnal Ilmu Dasar. 8(2):158-164.
Icshan SA. 2011. Aktivitas Ekstrak Kulit Kayu Suren (Toona sinensis Merr) sebagai Antioksidan dan Antidiabetes [skripsi]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Molyneux P. 2003. The use of the stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity. [artikel]. U.K: Polymer Chemistry, Macrophile Associates.
Monineux P. 2004. The Use fot The Stable Free Radical Diphenyl Picrylhydrazil (DPPH) for Estimating Antioksidant Activity. Songklankarin J. Sci. Technol. 26 (2) :211-219.
Parubak AS. 2013. Senyawa flavonoid yang bersifat antibakteri dari akway (Drimys beccariana Gibbs) manokwari (ID). UNIPA.
Purbowatiningrum RS dan Nies SM.2007.Aktivitas Antibakteri Rimpang Temu Putih (Curcuma mangga Vall).Jurnal Sains & Matematika. 15(2): 89-93. Pelczar, Michael J., ECS Chan.1988. Dasar-Dasar Mikrobiologi.Jakarta. UI Press. Rahmawati L. Fachrya E. Kusrini D.2012. Isolasi, Identifikasi, dan Uji Aktivitas
Antioksidan Senyawa Flavonoid Daun Binahong. Laboratorium Kimia Organik.Uninversitas Diponegoro.
Reddy SNVL, Sneha J, Anarthe and Raghavendra NM. 2010. In Vitro Antioxidant and Antidiabetic activity of Asystasia gangetica (Chinese Violet) Linn. (Acanthaceae).Intern J. of Res in Pharm and Biomed Sci.Vol. 1 (2): 72-75. Robinson T. 1995. Kandungan Organik Tumbuhan Tinggi. Edisi ke-4.
Penerjemah: Kosasih P. Bandung. ITB Press.
Saklani S, Mishra AP, Rawat A, Chandra S. 2011. Free Radical Scavenging (DPPH) and Ferric Reducting Ability (FRAP) of Aphanamixis polystachya (Wall) Parker. Int. J. Drug Dev.&Res., 3(4): 271-274.
Samson ZM. 2010. Senyawa golongan alkaloid ekstrak buah mahkota dewa
sebagai inhibitor α-glukosidase. [skripsi]. Bogor (ID): FMIPA Institut
Pertanian Bogor.
Sani RN, Nisa FC, Andriani RD, Maligan JM.2014. Analisis Rendemen dan Skrining Fitokimia Ekstrak Mikroalga. J. Pangan dan Agro. 2(2):121-126. Situmorang MH. 2011. Ekstrak Tanin dari Daun Akway (Drimys
piperita.Hook.f.) Sebagai Antibakteri [skripsi]. Manokwari (ID): Universitas Negeri Papua.
Suriawiria U.1996. Mikrobilogi Air dan Dasar-Dasar Pengelolaan Buangan Secara Biologis. Bandung. ITB Press.
Tiwari S., Gehlot S., and Gambhir IS. 2011. Centella Asiatica: Aconcise Drug Review with Probable Clinical Uses. J. Phys.& Biochem. 7:38-44.
Vinod KS, Raghuveer I, Alok S, Himanshu G. 2010. Phytochemical investigation and chromatographic evaluation of the ethanolic extract of whole plant extract of Dendrophthoe falcata (L.F.) Ettingsh. Int J. Pharm Sci& Res 1: 39-45.
Warsa UC.1994. Buku Ajar Mikrobiologi Kedokteran, Edisi Revisi. Jakarta. Bina Pura Angkasa.
17
18
Lampiran 1 Alur Penelitian
Preparasi Daun Sayur Hitam
Evaporasi Maserasi Pengujian
Kadar Air
Analisis data
Rendemen Antioksidan Fitokimia
Etanol 70% n-heksan Air
Ekstrak
Perebusan Pemanasan
19
20
Lampiran 3 Perhitungan Kadar Air Sayur Hitam Ulangan Bobot awal sampel
(gram)
Kadar air (%) Kadar air rerata (%)
1 2 15.56
2 2 15.81 15.84
3 2 16.15
Contoh Perhitungan:
Bobot Sampel = (Bobot Kering + Air) – Bobot Kosong = 28.6543-26.9175
= 2.0072 gram
Kadar Air = Bobot Sampel – Bobot Sampel Kering Bobot Sampel Kering
= 2.0072 – 1.7368 1.7368 = 15.56 %
Lampiran 4 Perhitungan rendemen ekstrak sayur hitam
Contoh Perhitungan:
Rendemen = Berat Ekstrak Pekat Bobot Sampel Kering = 7.60789
50.1623 = 15.1665 %
Rendemen terkoreksi = rendemen
100−kadar air rataan
= 15.1665
100−15.84
= 0.180
x 100% x 100%
x 100%
21
Lampiran 5 Aktivitas Antibakteri Staphylococcus aureus
Jenis Ekstrak Foto
Tanpa pemanasan
Pemanasan
22
Etanol 70%
N-heksana
Keterangan :
23
Lampiran 6 Aktivitasi Antibakteri Eschericia coli
Jenis Ekstrak Foto
Tanpa pemanasan
Pemanasan
24
Etanol 70%
N-heksana
Keterangan :
25
Lampiran 7 Contoh data absorbansi ektrak tanpa pemanasan dan etanol 70%
26
27
Lampiran 9 Perhitunganinhibition consentration (IC50)
Contoh Perhitungan ekstrak tanpa pemanasan
0 200 400 600 800 1000 1200
28
RIWAYAT HIDUP
Penulis dilahirkan di Moanemani, kabupaten Dogiyai provinsi Papua pada tanggal 04 Desember 1989 dari ayah Andreas Bobii dan Ibu Martha Mote. Penulis merupakan anak kedua dari enam bersaudara. Pendidikan formal penulis dimulai dari SD Negeri I Moanemani dan melanjutkan pendidikan di SMP Negeri 4 Nabire. Penulis lulus tahun 2007 dari SMK Pongtiku Nabire dan pada tahun yang sama diterima di Institut Pertanian Bogor (IPB) melalui jalur Beasiswa Utusan Daerah IPB (BUD).
Selama satu tahun penulis mengikuti tahap prauniversitas IPB. Lalu pada tahun 2008 penulis terpilih sebagai mahasiswa mayor Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Selama mengikuti perkuliahan, penulis pernah melakukan Praktik Lapangan (PL) di Laboratorium Mikrobiologi, Balai Penelitian Bioteknologi Perkebunan Indonesia Jl. Taman Kencana 1 Bogor selama periode Juli hingga Agustus 2012 dengan judul Penapisan Bakteri Penghasil Enzim Selulase Pada Tandan Kosong Kelapa Sawit.