PENGARUH PUPUK HAYATI DAN PUPUK P TERHADAP
KETERSEDIAAN FOSFOR DAN PERTUMBUHAN KRISAN
(Chrysanthemum sp) DI TANAH REGOSOL CIMACAN
WINDI
DEPARTEMEN ILMU TANAH DAN SUMBERDAYA LAHAN
FAKULTAS PERTANIAN
RINGKASAN
WINDI. Pengaruh Pupuk Hayati dan Pupuk P terhadap Ketersediaan Fosfor dan Pertumbuhan Krisan (Chrysanthemum sp) di Tanah Regosol Cimacan. Dibimbing oleh FAHRIZAL HAZRA dan DEWI SUKMA.
Fosfor merupakan unsur hara yang sangat dibutuhkan tanaman karena berperan dalam pertumbuhan akar semai, memperkuat pertumbuhan tanaman muda menjadi dewasa, mempercepat pembungaan, dan pemasakan buah, biji, atau gabah. Namun ketersediaan unsur ini dalam tanah sangat rendah, serta sering terdapat dalam bentuk yang tidak tersedia. Peningkatan P-tersedia perlu dilakukan pada tanah-tanah yang memiliki tingkat kesuburan yang rendah, Salah satunya adalah tanah Regosol Cimacan (PPT 1980). Berbagai cara dilakukan untuk meningkatkan jumlah unsur hara pada tanah regosol, diantaranya adalah dengan penambahan pupuk hayati dan pupuk anorganik. Penggunaan pupuk hayati yang mengandung mikroorganisme pelarut fosfat dan pemberian pupuk P dengan dosis tertentu diperlukan untuk membantu dalam meningkatkan fosfor tersedia bagi tanaman. Salah satu tanaman yang membutuhkan fosfor adalah tanaman krisan
(Chrysanthemum sp). Kebutuhan fosfor untuk tanaman krisan sangat diperlukan
untuk proses pembungaan. Bunga krisan dikenal sebagai bunga potong utama yang memiliki nilai jual tinggi.
Tujuan penelitian ini adalah mengetahui pengaruh aplikasi pupuk hayati dan pupuk P terhadap ketersediaan fosfor dan pertumbuhan krisan. Penelitian isolasi mikroorganisme untuk pembuatan pupuk hayati dilakukan di Laboratorium Bioteknologi Tanah dan aplikasi pupuk hayati dilakukan di rumah plastik “Pondok Adi Nursery”. Penelitian menggunakan rancangan acak kelompok dengan enam perlakuan dan lima ulangan. Perlakuan yang digunakan adalah 0 ml pupuk hayati + 0% P,0 ml pupuk hayati + 50% P, 0 ml pupuk hayati + 100% P, 50 ml pupuk hayati + 0% P, 50 ml pupuk hayati + 50% P, dan 50 ml pupuk hayati + 100% P. Masing-masing perlakuan dilakukan pada lahan tanam seluas 1 m2. Parameter yang diamati meliputi P-tersedia, pertumbuhan vegetatif dan generatif tanaman, serta kualitas panen.
Hasil penelitian menunjukkan pemberian pupuk hayati dan pupuk P tidak efektif meningkatkan P-tersedia dan pertumbuhan vegetatif tanaman, namun nyata meningkatkan pertumbuhan generatif tanaman. Perlakuan 50 ml pupuk hayati + 50% P nyata meningkatkan jumlah bakal bunga pada 11 MST sedangkan perlakuan 50 ml pupuk hayati + 100% P nyata meningkatkan jumlah panen pada panen tahap 3. Dengan demikian pupuk hayati dan pupuk P tidak efektif meningkatkan P-tersedia tanah dan pertumbuhan vegetatif tanaman.
SUMMARY
WINDI. Effect of Biological Fertilizer and P Fertilizer on Phosphorus Availability and Growth of Chrysanthemum (Chrysanthemum sp) in the Land Regosol Cimacan. Under direction of FAHRIZAL HAZRA and DEWI SUKMA.
Phosphorus is a nutrient that is needed because it plays a role in plant seedling root growth, strengthening the growth of young plants to mature, accelerate flowering and ripening fruit, seed, or grain. But the availability of these elements in the soil is very low, and often comes in the form that is not available. Increased P-available needs to be done on soils that have a low fertility rate, One is ground Regosol Cimacan (PPT 1980). Various methods are used to increase the amount of nutrients in the regosol, such as the addition of biological fertilizer and inorganic fertilizer. The use biological fertilizers containing phosphate solvent microorganisms and the application of fertilizer P with a certain dose is needed to assist in increasing the phosphorus available to plants. One of the plants require phosphorus is Chrysanthemum (Chrysanthemum sp). The need of phosphorus for chrysanthemum is necessary for the flowering process. Chrysanthemum flower is known as a major cut flowers have high sales value.
The purpose of this study was to determine the effect of biological fertilizer application and manure P for phosphorus availability and growth of chrysanthemum. Research isolation of microorganisms for biological fertilizer performed at the Laboratory of Soil Biotechnology and biological fertilizer application conducted in a plastic house "Pondok Adi Nursery". The study used a randomized block design with six treatments and five replications. The treatment used was 0 ml biological fertilizer + 0% P, 0 ml biological fertilizer + 50% P, 0 ml + 100% P, 50 ml biological fertilizer + 0% P, 50 ml biological fertilizer + 50% P, and 50 ml biological fertilizer + 100% P. Each treatment performed on cropping land area of 1 m2. The parameters observed were P-available, vegetative and generative plant growth and harvest quality.
The results showed biological fertilizer and P Fertilizer is not effectively increase available P and plant vegetative growth, but significantly increased the growth of generative plants. Treatment of biological fertilizer 50 ml + 50% P real increase amount of will flower on 11 MST while treatment of biological fertilizer 50 ml + 100% P significantly increased yields at harvest stage 3. Thus the biological fertilizer and P fertilizer is not effectively increase P-available soil and vegetative growth of plants.
PENGARUH PUPUK HAYATI DAN PUPUK P TERHADAP
KETERSEDIAAN FOSFOR DAN PERTUMBUHAN KRISAN
(Chrysanthemum sp) DI TANAH REGOSOL CIMACAN
WINDI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada
Departemen Ilmu Tanah dan Sumberdaya Lahan
DEPARTEMEN ILMU TANAH DAN SUMBERDAYA LAHAN
FAKULTAS PERTANIAN
Judul : Pengaruh Pupuk Hayati dan Pupuk P terhadap Ketersediaan Fosfor dan Pertumbuhan Krisan (Chrysanthemum sp) di Tanah Regosol Cimacan Nama Mahasiswa : Windi
NIM : A14080083
Disetujui
Pembimbing I Pembimbing II
Ir. Fahrizal Hazra, M.Sc Dr. Dewi Sukma, SP, M.Si NIP. 19631120198903 1 002 NIP. 19700404 199702 2 001
Diketahui
Ketua Departemen Ilmu Tanah dan Sumberdaya Lahan
Dr. Ir. Syaiful Anwar, M.Sc NIP. 19621113 198703 1 003
RIWAYAT HIDUP
Selanjutnya penulis melanjutkan pendidikan sekolah menengah pertama di SMPN 1 Bangko Bagansiapiapi, dan berhasil menamatkan pendidikan ini pada tahun 2005. Pendidikan SMA ditempuh dari tahun 2005 hingga tahun 2008 di SMAN 1 Bangko Bagansiapiapi.
Pada tahun 2008 penulis diterima sebagai mahasiswa Institut Pertanian Bogor (IPB) melalu jalur Beasiswa Utusan Daerah (BUD) yang diperoleh dari Pemerintah Daerah (PEMDA) Kabupaten Rokan Hilir. Penulis mengambil Mayor Manajemen Sumberdaya Lahan, di Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor.
Selama menjadi mahasiswa, penulis aktif sebagai asisten mata kuliah Bioteknologi Tanah (2011) Bioteknologi Tanah (2012), Biologi Tanah (2012), Pengantar Kimia Tanah (2012), Kimia Tanah (2012) Pengantar Ilmu Tanah (2012), dan Kesuburan Tanah (2012), Penulis juga menjadi anggota dari Himpunan Pelajar dan Mahasiswa Rokan Hilir (HIPEMAROHIL) periode 2008 hingga 2012. Pada tahun 2008 penulis menjadi Anggota Pengibar Bendera Pusaka (PASKIBRAKA) Institut Pertanian Bogor (IPB) dan terpilih sebagai ketua panitia penyambutan mahasiwa Riau pada acara Open House (OH) Mahasiswa IPB 2009.
KATA PENGANTAR
Puji syukur penulis ucapkan atas kehadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga penulisan skripsi dengan judul
“ Pengaruh Pupuk Hayati dan Pupuk P terhadap Ketersediaan Fosfor dan Pertumbuhan Krisan (Chrysanthemum sp) di Tanah Regosol Cimacan” ini berhasil diselesaikan. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar sarjana pada Program Studi Sarjana Manajemen Sumberdaya Lahan di Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor.
Selama proses penyelesaian skripsi ini penulis banyak mendapat pengetahuan baru, masukan, semangat, dan dorongan dari berbagai pihak. Untuk itu penulis ingin mengucapkan terimakasih kepada semua pihak yang telah membantu dalam proses penelitian hingga penyelesaian tugas akhir ini. Penulis mengucapkan terimakasih secara khusus kepada:
1. Ir. Fahrizal Hazra, M.Sc selaku dosen pembimbing pertama yang selalu membagikan ilmu, membimbing, memberi masukan dan nasehat dalam penyususnan skripsi ini, serta mengajarkan etika baik sebagai seorang peneliti.
2. Dr. Dewi Sukma, SP, M.Si selaku pembimbing kedua yang selalu menuntun, mengawasi, membagi ilmu, pengalaman serta arahan dan masukan yang berharga dalam penyususnan skripsi ini.
3. Dr. Rahayu Widyastuti, M.Sc selaku dosen penguji yang telah bersedia meluangkan waktu, memberikan kritik yang membangun dan masukkan yang baik kepada penulis untuk penyusunan skripsi ini.
4. Dr. Ir. Arief Hartono, M.Sc yang telah bersedia meluangkan waktunya untuk menjadi moderator, memberikan saran dan masukan pada seminar hasil penelitian ini.
6. Keluarga tercinta: Apak, Umak, Abang, Akak, Adik-Adik penulis atas kasih sayangnya dan senantiasa mendoakan, memberi masukan, dan menyemangati tiada henti.
7. Pemerintah Daerah (PEMDA) Kabupaten Rokan HIlir yang telah membiayai biaya pendidikan, biaya penelitian dan biaya hidup penulis dari awal hingga selesai mengikuti perkuliahan di Institut Pertanian Bogor.
8. Mas Yanto dan Bu Ari yang telah memfasilitasi, membimbing, dan memberikan nasehat dan arahan kepada penulis dalam melakukan penelitian di perkebunan bunga krisan “Pondok Adi Nursery” Desa Cimacan, Kecamatan Pacet Kabupaten Cianjur.
9. Para pekerja kebun di perkebunan krisan “ Pondok Adi Nursery” yang telah membantu dalam penelitian ini.
10.Perkebunan bunga krisan “Pondok Adi Nursery” sebagai salah satu tempat penelitian penulis.
11.Bapak dan Ibu di Laboratorium Bioteknologi Tanah, Bapak Sarjito, Bu Asih, Bu Juleha, Bu Yeti, Mbak Nia, Mbak Nina, dan Laboratorium Kimia dan Kesuburan Tanah, Pak Ade, Pak Kasmun, Pak Sukoyo, Pak Ole atas bantuannya selama penelitian di laboratorium.
12.Muhammad Furqon dan Marsa yang telah membantu dalam pengolahan data, serta Sisi, Mia, yang telah memberikan informasi yang berharga kepada penulis saat melakukan penelitian
13.Abang, Kakak, Teman, dan Adik MSL serta pihak-pihak yang tidak dapat disebutkan satu-persatu, atas kerjasama yang baik dan semangat yang diberikan.
Semoga skripsi ini bermanfaat dan dapat menjadi informasi yang berguna bagi semua pihak yang membacanya.
Bogor, September 2012
DAFTAR ISI
3.3.7. Rancangan Percobaan ... 27
3.3.8. Parameter Pengamatan ... 28
3.3.8.1 Tinggi Tanaman ... 29
3.3.8.2. Diameter Tangkai ... 29
3.3.8.3 Jumlah Daun ... 29
3.3.8.4. Warna Daun ... 29
3.3.8.5. Jumlah Bakal Bunga ... 30
3.3.8.6. Diameter Bunga Setengah Mekar Per Tangkai ... 30
3.3.8.7. Jumlah Kuntum Bunga Setengah Mekar Per Tangkai ... 30
3.3.9. Kualitas Bunga ... 30
3.3.10. Analisis Data ... 31
IV.HASIL DAN PEMBAHASAN ... 32
4.1. Seleksi Isolat ... 32
4.2. Sifat Kimia Tanah ... 37
4.2.1. Kandungan P-Tersedia Tanah ... 37
4.2.2. Reaksi Tanah (pH H2O) ... 39
4.3. Pertumbuhan Tanaman ... 41
4.3.1. Tinggi Tanaman ... 41
4.3.2. Jumlah Daun ... 44
4.3.3. Warna Daun ... 44
4.4. Kualitas Panen ... 45
4.4.1. Bobot Basah dan Tinggi Akhir ... 45
4.4.2. Jumlah Bakal Bunga ... 47
4.4.3. Jumlah Tangkai Bunga per Tahap Panen ... 48
4.4.4. Penetapan Grade Krisan ... 50
V. KESIMPULAN DAN SARAN ... 52
5.1. Kesimpulan ... 52
5.2. Saran………...…………...………….. 52
VI. DAFTAR PUSTAKA ... 53
DAFTAR TABEL
Halaman
1 Pengaruh isolat bakteri dan fungi pelarut fosfat terhadap
ketersediaan P pada media Pikovskaya cair………... 32 2 Diameter koloni bakteri pelarut P dalam inkubasi selama 5
hari……….. 33 3 Diameter miselium fungi pelarut P dalam inkubasi selama 4
hari……….. 34 4 Indeks Pelarutan (IP) fungi pelarut P dalam inkubasi selama 4
hari………... 35 5 Hasil uji antagonis mikroorganisme pelarut fosfat………... 36 6 Hasil uji total mikrob pada pupuk hayati……… 36 7 Kandungan P-tersedia dan pH tanah pada pemberian pupuk
hayati dan pupuk P………. 38
8 Pengaruh pemberian pupuk hayati dan pupuk P terhadap tinggi
tanaman krisan (cm)………... 41
9 Pengaruh pemberian pupuk hayati dan pupuk P terhadap jumlah
daun tanaman krisan………... 44 10 Pengaruh pemberian pupuk hayati dan pupuk P terhadap warna
daun pada 1 MST – 8 MST……… 45 11 Pengaruh perlakuan terhadap bobot basah dan tinggi akhir
tanaman krisan……… 46
12 Pengaruh pemberian pupuk hayati dan pupuk P terhadap jumlah
bakal bunga (buah)………. 47
13 Pengaruh pemberian pupuk hayati dan pupuk P terhadap jumlah
tangkai bunga per tahap panen………... 49
14 e Pengaruh pemberian pupuk hayati dan pupuk P terhadap
DAFTAR GAMBAR
Halaman
1 Bentuk P dalam tanah……… 9
2 Reaksi sederhana pelarutan P sukar larut dari komplek Al-P dan Fe-P…... ……… 14
3 Mekanisme pelarutan fosfat oleh asam organik ………... 14
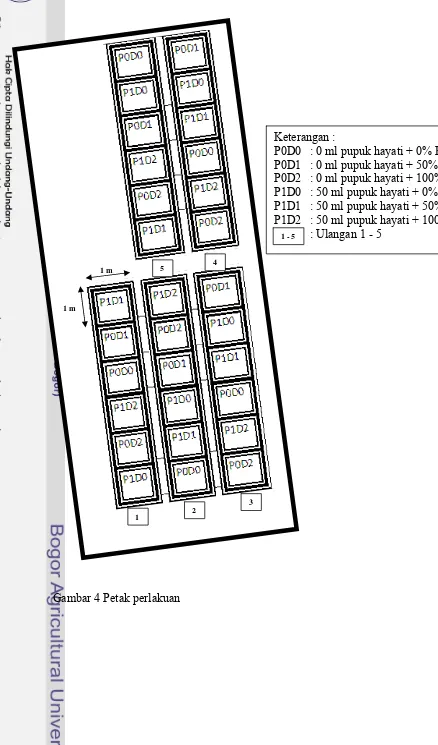
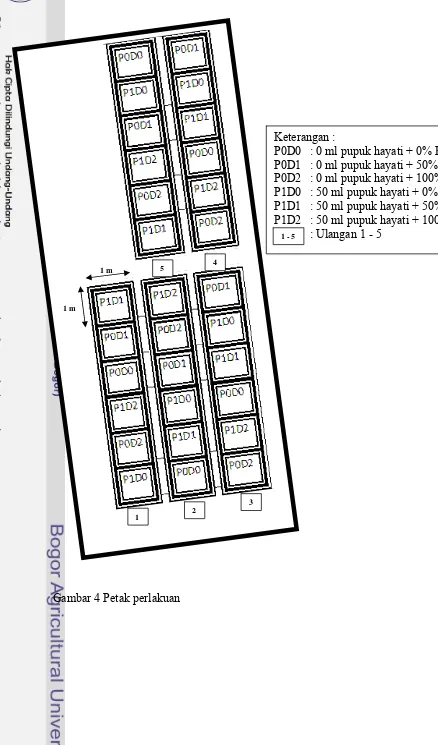
4 Petak perlakuan………..……… 28
5 Uji kualitatif bakteri pelarut fosfat………... 33
6 Ilustrasi penetapan indeks pelarutan (IP) fosfat……… 35
7 Uji kualitatif untuk penetapan Indeks Pelarutan (IP) Fosfat………. 35
8 Pertumbuhan vegetatif krisan (tinggi dan jumlah daun) 35 pada 2 MST, 4 MST, 6 MST, dan 8 MST pada setiap perlakuan……….
42
DAFTAR LAMPIRAN
Halaman
1 Hasil analisis pendahuluan tanah Regosol Cimacan………. 57
2 Hasil analisis pupuk kandang……… 57
3 Komposisi media Pikovskaya per liter aquades……… 57
4 Komposisi media Nutrient Agar (NA) per liter aquades………... 58
5 Komposisi media Potatos Dektrose Agar (PDA) per liter aquades……... 58
6 Standar Nasional Indonesia (SNI) 01 – 4478 – 1998 tentang syarat mutu bunga potong krisan segar……… 58
7 Lokasi pengambilan sampel tanah untuk sumber isolat……… 59
8 Lokasi penanaman bunga krisan……… 59
9 Peta Desa Cimacan (Lokasi penanaman bunga krisan)………. 59
10 Data tinggi akhir, diameter tangkai, jumlah kuntum, dan diameter kuntum untuk penetapan grade………... 60
I.
PENDAHULUAN
1.1. Latar belakang
Kadar P- total di dalam tanah umumnya rendah dan berbeda-beda menurut jenis tanah. Tanah-tanah muda dan perawan biasanya memiliki kadar P yang lebih tinggi daripada tanah-tanah yang tua, begitu juga penyebarannya dalam profil tanah. Kadar P anorganik makin bertambah dengan dalamnya lapisan tanah kecuali bentuk P organik. Mobilitas ion-ion fosfat dalam tanah sangat rendah karena retensinya dalam tanah sangat tinggi. Ini disebabkan retensi yang tinggi terhadap unsur P di dalam tanah menyebabkan kosentrasinya dalam larutan cepat sekali berkurang. Tetapi apabila kelarutan ini dapat diperbesar maka jumlah yang sedikit saja dari unsur ini akan segera memperlihatkan pengaruhnya yang positif terhadap pertumbuhan tanaman. Jumlah P- tersedia di tanah-tanah pertanian biasanya lebih tinggi dibandingkan dengan kadarnya pada tanah-tanah yang tidak diusahakan. Hal ini diduga karena unsur ini tidak tercuci (residunya tinggi), sedangkan yang hilang melalui produksi tahunan sangat kecil. Unsur P disebut juga kunci untuk kehidupan karena fungsinya yang sangat sentral dalam proses kehidupan. Unsur ini berperan dalam proses pemecahan karbohidrat untuk energi, penyimpanan dan peredarannya keseluruh tanaman dalam bentuk ADP dan ATP. Unsur ini juga berperan dalam pembelahan sel melalui peranan nukleoprotein yang ada dalam inti sel; selanjutnya berperan dalam meneruskan sifat-sifat kebakaan dari generasi ke generasi melalui peranan DNA (deoxyribonucleic acid). Tanpa fosfat, proses-proses tersebut tidak dapat berlangsung. Unsur ini juga menentukan pertumbuhan akar, mempercepat kematangan dan produksi buah dan biji. Tanaman umumya menyerap unsur ini dalam bentuk ion monofosfat atau fosfat primer (H2PO4).
Recovery rate dari pupuk P sangat rendah antara 10-30 %, sisanya
terhadap pertumbuhan tanaman. Tanaman yang dimaksud disini adalah krisan, yakni tanaman yang memiliki nilai jual tinggi. Salah satu cara yang bisa dilakukan untuk meningkatkan ketersediaan fosfor dalam tanah adalah dengan membuatnya tersedia dalam tanah. Usaha untuk membuat unsur ini tersedia sering dilakukan dengan mempercepat kelarutannya dalam tanah. Pelarutan unsur ini dalam tanah bisa dilakukan dengan bantuan mikroorganisme pelarut fosfat.
Banyak hal yang telah dilakukan dalam mengatasi masalah tidak tersedianya fosfor dalam tanah untuk bisa diserap oleh tanaman. Diantaranya adalah perlakuan secara fisik dan kimia yakni pemberian bahan organik, pengapuran, cara penempatan, jenis dan takaran pupuk P. Sedangkan secara biologi yakni dengan pemanfaatan mikroorganisme. Mikroorganisme pelarut-P sebagai salah satu penerapan bioteknologi akan sangat berarti dalam meningkatkan produksi pertanian dan peningkatan efektivitas pemupukan P. Penggunaan mikroorganisme pelarut–P ini juga membantu dalam mengurangi pencemaran lingkungan oleh penggunaan pupuk anorganik. Mikroorganisme pelarut fosfat ini dapat berasal dari bakteri maupun dari fungi. Menurut Tisdale et al. (1985) beberapa mikroorganisme sangat efektif dalam meningkatkan jumlah P yang tersedia bagi tanaman.
Sejumlah mikroorganisme mampu menghasilkan asam dan agen pengkhelat. Mikroorganisme ini memiliki peranan penting dalam mempengaruhi larutan tanah dan pupuk fosfat. Spesies yang termasuk dalam mikroorganisme ini adalah : Aspergillus niger, strains dari Escherichia freundi, beberapa Penicillium
dan Pseudomonas. Peranan mikroorganisme ini dalam penyerapan P dan
dilaporkan yakni, ketersediaan batuan fosfat dan fosfat tidak larut dalam air yang diinokulasikan dengan bakteri fosfat ditingkatkan.
1.2. Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mendapatkan isolat bakteri dan fungi pelarut fosfat untuk pembuatan pupuk hayati.
2. Mengetahui pengaruh pupuk hayati dan pupuk P terhadap ketersedian fosfor tanah.
3. Mengetahui pengaruh pupuk hayati dan pupuk P terhadap pertumbuhan krisan.
1.3. Hipotesis
Hipotesis yang akan diuji dalam penelitian ini adalah :
1. Terdapat mikroorganisme pelarut fosfat pada pupuk hayati
2. Pemberian pupuk hayati dan pupuk P dapat meningkatkan ketersediaan fosfor tanah.
II.
TINJAUAN PUSTAKA
2.1. Fosfor dalam Tanah
Fosfor adalah unsur yang sangat esensial untuk pertumbuhan tanaman setelah nitrogen. Namun ketersediaan unsur ini untuk tanaman dibatasi oleh perbedaan reaksi kimia khusunya pada tanah arid dan semiarid. Fosfor memainkan peranan penting dalam aktivitas fisiologi dan biokimia tanaman seperti fotosintesis, transformasi gula ke zat tepung, dan penurunan ciri-ciri genetik . Sharma (2002) dalam Mehvarz et al. (2008) melaporkan salah satu keuntungan dari pemberian tanaman dengan fosfor menghasilkan akar yang lebih dalam dan. Malakooti dan Nafisi (1995) dalam Mehrvarz et al. (2008) menyatakan bahwa pH terbaik untuk fosfor dapat diambil oleh tanaman adalah 6.5. Mineral fosfat dalam tanah dipelajari lebih intensif daripada mineral nutrisi lainnya kecuali nitrogen. Meskipun memerlukan usaha yang besar, sedikit hal pasti bisa dikatakan tentang keadaan fosfat dalam tanah. Ketidakpastian tentang kimia fosfat dalam tanah disebabkan interaksi kuat fosfat fase padat anorganik dan organik, pengambilan oleh tanaman dan mikroorganisme secara terus- menerus, seringnya kembali dari peluruhan organik, dan tingkat reaksi yang lambat (Bohn et al. 1979).
2.2. Kandungan Fosfor
Tanah perawan dan tanah-tanah muda di area yang memiliki curah hujan rendah biasanya memiliki total fosfor yang tinggi (Tisdale et al. 1985). Fosfor dalam tanah sebagian besar terdapat dalam bentuk ortofosfat. Kandungan total berkisar antara 0.02 - 0.15%, sebagian besar dari bentuk P ini berasosiasi dengan bahan organik dan di tanah mineral proporsi dari P organik terletak antara 20 - 80% dari total P.
2.3. Bentuk dan Ketersediaan
tanaman. Tanaman menyerap fosfor dalam bentuk H2PO4-, HPO4-, PO4-. Pada
umumnya bentuk H2PO4- lebih tersedia bagi tanaman daripada HPO4- dan PO4-.
Ketersediaan fosfor anorganik sangat ditentukan oleh pH tanah , jumlah dan dekomposisi bahan organik, serta kegiatan jasad mikro dalam tanah (Lal 2002
dalam Suliasih dan Rahmat 2007)
Fosfor tanah bisa dikelompokkan secara umum sebagai fosfor organik dan fosfor anorganik, tergantung pada kandungan-kandungan alamiah dimana bentuk P tersebut terjadi. Fraksi organik ditemukan dalam humus dan bahan organik yang mungkin atau tidak mungkin berasosiasi dengan humus. Ukuran P-organik dalam tanah sangat besar berkisar dari 0 hingga melebihi 0.2% (Tisdale et al. 1985). Kosentrasi fosfat yang berada pada larutan tanah berkisar antara 0.1 hingga 1 ppm (10-5 hingga 10-6 M). Fosfat tanah disebut labil atau tidak labil, tergantung dari tingkat dimana fosfat mengalami pertukaran dengan radioaktif PO4. Fraksi yang
tidak labil dipertimbangkan akan menjadi sejumlah fosfat yang tersedia bagi tanaman (Bohn et al. 1979).
2.4. P Organik Tanah
Secara alami dan reaksi dari fosfat organik tanah tidak begitu dipahami dengan baik. Tapi penjelasan berikut akan memberikan pemahaman yang baik tentang fosfat organik tanah. Bentuk fosfat organik tanah sebagian besar secara alamiah bentuk fosfat organik tanah adalah ester dari asam orthofosfat dan sejumlah mono dan diester yang telah dikarekterisasi. Ester fosfat organik diidentifikasi ke dalam lima kelas : fosfat inositol, fosfolipid, asam nukleat, nukleotida dan gula fosfat. Tiga bentuk pertama merupakan bentuk yang dominan (Tisdale et al. 1985).
Fosfat Inositol. Inositol adalah sebuah kandungan gula homosiklik,
C6H12O6, yang mana terbentuk dari sebuah rangkaian wilayah ester fosfat dari
organik dan jumlahnya sekitar seperempat dari total fosfor di tanah (Tisdale et al.
1985).
Asam nukleat. Dua perbedaan bentuk dari asam nukleat, asam ribonukleat
dan asam deoksiribonukleat, terdapat dalam semua bentuk kehidupan. Masing-masing terdiri dari unit rantai gula, baik ribose maupu deoksiribosa bergabung dengan jembatan ester fosfat. Sebuah basa nitrogen baik yang berasal dari purin maupun pirimidin diberikan ke masing-masing molekul gula. Nukleosida adalah unit-unit yang hanya mengandung satu molekul gula yang berikatan dengan satu molekul dari basa nitrogen. Fosfat berasal dari nuklosida yang disebut nukleotida (Tisdale et al. 1985).
Asam nukleat dimungkinkan dilepaskan ke dalam tanah lebih banyak dan cepat daripada fosfat inositol dan mengalami kerusakan lebih cepat. Karena tidak mungkin untuk mengisolasi asam nukleat murni dari tanah, Pengukurannya biasanya berdasarkan pada sejumlah nukleotida dari turunan purin atau pirimidin yang dibebaskan oleh hidrolisis dari fraksi bahan organik tanah. (Tisdale et al.
1985).
2.5. P Anorganik Tanah
fosfat dimulai di lingkungan seperti ini, yang mana sering memperkenankan presipitasi in situ dari bahan fosfat (Tisdale et al. 1985).
Bentuk fosfat sukar larut bila bergabung dengan Fe3+, and Al3+ pada pH rendah, lebih larut bila bergabung dengan Ca2+ dan Mg2+ pada nilai pH mendekati netral, dan sukar larut bila bergabung dengan Ca2+ pada nilai pH yang lebih tinggi ada wilayah yang lebar dalam pelarutan berbagai macam bahan fosfat ini dan ketersediaan mereka untuk tanaman biasanya paling besar dengan pH pada skala 6-7 untuk sebagian besar tanah pertanian (Tisdale et al. 1985).
2.6. Pemupukan Fosfat dan Permasalahannya
Untuk meningkatkan produksi pangan pada tanah-tanah masam seperti ultisol diperlukan penambahan P-anorganik seperti fosfat alam dan bahan organik, baik pupuk kandang maupun sisa-sisa tanaman. Pupuk fosfat seperti fosfat alam bukan hanya merupakan sumber P, tapi juga Ca, disamping itu mengandung hara esensial seperti Mg, S, Fe, Cu dan Zn (Dev 1996 dalam Noor 2003). Pupuk fosfat alam yang digunakan secara langsung umumnya memiliki kelarutan yang rendah dibandingkan dengan pupuk kimia, sehingga diperlukan suatu usaha yang dapat meningkatkan kelarutannya seperti penggunaan mikroorganisme dan bahan organik (Noor 2003).
Daya larut fosfat dalam karier fosfat yang berbeda adalah berubah-ubah. Daya larut air dari pupuk fosfat tidak selalu menjadi kriteria yang terbaik dari ketersediaaan elemen ini untuk tanaman. Kemungkinan pengukuran yang paling tepat untuk ketersediaan bagi tanaman dari elemen nutrisi adalah memperluas penyerapan oleh tanaman di bawah kondisi yang sesuai untuk tumbuh. Penentuannya tidak mudah, yakni kapan ketersediaan dari unsur pupuk harus di tentukan dengan cepat pada sejumlah besar sampel, sebagaimana dalam pengendalian pemupukan untuk tanaman (Tisdale et a.l 1985).
yang mendekati jenuh dari bahan pupuk fosfat berada di sekitar pupuk berbentuk granul dan droplet. (Tisdale et al. 1985).
2.7. Efektivitas Pemupukan Fosfat
Sejumlah sifat pupuk dan kondisi tanah mempengaruhi junlah pupuk yang diberikan ke tanah dan juga mempengaruhi efektivitasnya di dalam tanah. Menurut Tisdale et al. (1985) hal yang mempengaruhi efektivitas pemupukan fosfat adalah 1) Pengaruh dari ukuran granul, 2) Kadar air Tanah, 3) Distribusi granul, 4) Tingkat aplikasi, 5) Residu fosfat. Dibawah kondisi tropik, dimana fosfat terlarut mudah tercuci dari tanah pasir masam, maka aplikasi dari batuan fosfat diperlukan. Percobaan dengan tebu di Hawai menunjukkan bahwa batuan fosfat memiliki keefektivan yang sama dengan superfosfat (Ayers and Haghara 1961 dalam Mengel dan Kirkby 1982).
2.8. Masalah Fosfor
Sebagian tanah mengandung zat yang menyediakan total P, sebagain besar dari itu tinggal dalam bentuk iner, dan hanya kurang dari 10% dari P tanah yang masuk dalam siklus hewan-tanaman (Kucey et al. 1989 dalam Sundara et al.
2002). Akibatnya kekurangan P meluas dan sebagian besar pupuk P diperlukan untuk menjaga produksi pangan. Walaupun P dalam pupuk ini mulanya tersedia bagi tanaman, namun akhirnya itu secara cepat berekasi dengan tanah dan menjadi makin kurang tersedia untuk diambil tanaman. Penambahan ke tanah fosfat terlarut kemudian berekasi dengan komponen-komponen tanah dan membentuk senyawa yang kurang larut (Sundara et al. 2002).
seperempat hingga sepertiga unsur tersebut. Secara singkat, masalah menyeluruh dari fosfor adalah :1) jumlah sedikit yang terdapat dalam tanah 2) ketidaktersediaan fosfor yang sudah ada dalam tanah 3) adanya fiksasi fosfor yang kontras.
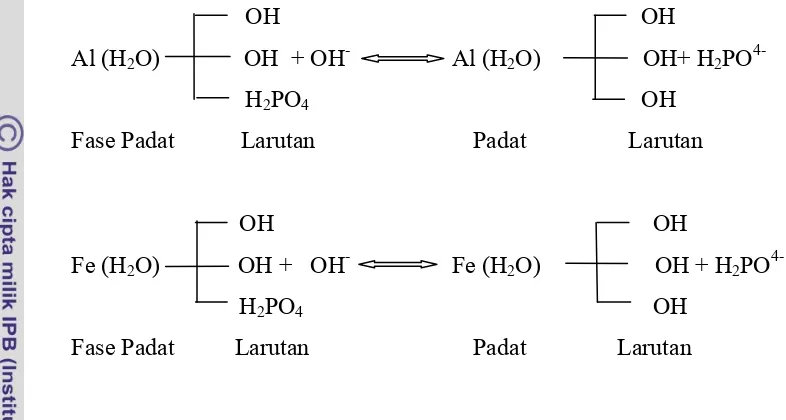
Pada tanah tua fosfat akan membentuk komplek hidrooksida Fe-P, hidrooksida Al-P, sedang pada tanah alkali mebentuk komplek Ca-P. Pada tanah Andosol akan berikatan dengan alofan membentuk alofan fosfat (Leiwakabessy 1989 dalam Lestari 1994) sedangkan pada kondisi masam ion Al dan Fe bereaksi dengan ion fosfat membentuk gaeam Fe-P atau Al-P yang tidak larut. Pupuk fosfat Ca(H2PO4)2 diberikan ke tanah akan berubah seperti gambar 1
Hanafiah (2005) menyatakan dibanding N, maka P-tersedia dalam tanah relatif cepat menjadi tidak tersedia akibat segera 1) terikat oleh kation tanah (terutama Al dan Fe pada kondisi masam atau dengan Ca dan Mg pada kondisi netral) yang kemudian mengalami presipitasi (pengendapan) atau 2) terfiksasi pada permukaan positif koloidal tanah (liat dan oksida Al/Fe) atau lewat pertukaran kation (terutama dengan OH-).
Ca(H2PO4)2 P tersedia
H2O
H3PO4 + CaHPO4 P kurang tersedia
Al (OH)3 atau Fe (OH)3
Al (OH)2H2PO4 + Fe (OH)2H2PO4 P tidak tersedia
Gambar 1 Bentuk P dalam tanah
2.9. Kebutuhan Fosfor Tanaman
Kadar kosentrasi fosfat yang terdapat dalam tanaman berkisar antara 0.1 sampai 0.4%. Jumlah tersebut lebih rendah jika dibandingkan dengan hara nitrogen dan kalium yang terdapat pada tanaman (Tisdale et al. 1985). Jika jumlah fosfat tersedia berada dalam kisaran yang normal, jumlah fosfat yang harus diaplikasikan ke tanah harus sesuai dengan jumlah yang diambil oleh tanaman. Beberapa fosfat yang bersifat labil diubah menjadi immobil. Tingkat aplikasi fosfat harus lebih tinggi dari 10 hingga 50% dari jumlah yang diambil oleh tanaman. Umumnya tingkat aplikasi yang baik untuk tanaman yakni antara 20 hingga 80 kg P/ha sesuai dengan spesies tanaman dan kondisi tanah. Tanaman dengan pertumbuhan yang tinggi, produksi bahan organik dengan jumlah yang besar, memiliki kebutuhan yang lebih tinggi terhadap fosfat. Seperti yang diaplikasikan pada tanaman jagung, produksi rumput intensif, kentang dan tebu (Mengel dan Kirkby 1982).
Jumlah P yang ada dalam larutan tanah, bahkan dalam tanah dengan ukuran tinggi dari ketersediaan fosfat hanya berkisar 0.3 hingga 3 kg P/ha. Kecepatan pertumbuhan tanaman menyerap sejumlah fosfat dalam sehari berkisar 1 kg P/ha, ini menjelaskan bahwa fosfat dalam larutan tanah harus diberikan ke tanah beberapa kali sehari dengan mobilisasi fosfat dari kelompok fosfat labil. Fosfat labil ini lebih atau kurang identik dengan isotop pertukaran fosfat. Jumlah dari bagian ini terpadat pada lapisan atas tanah (20 cm) memiliki jumlah antara 150 hinnga 500 kg P/ha. Fosfat ini memiliki tingkat desorpsi yang tinggi dalam tanah dan kapasitas penyangga fosfat yang tinggi. Berdasarkan ini, maka sebaiknya tanah mampu menjaga kosentrasi fosfat pada larutan tanah selama musim penanaman (Williams 1970 dalam Mengel & Kirkbi 1982).
2.10.Mikroorganisme Pelarut Fosfat
Kandungan anorganik yang tidak larut dari fosfor, sebagian besar tidak tersedia untuk tanaman, tapi terdapat banyak mikroorganisme yang bisa membawa fosfat ke dalam larutan. Hal ini sering kelihatan, karena sepersepuluh hingga setengah bakteri yang dites umumnya mampu melarutkan kalsium fosfat (Ca3(PO4)2) dan jumlah bakteri yang dapat melarutkan fosfat yang tidak larut
berada pada 105 hingga 107 per gram tanah. Sebagai contoh seperti bakteri yang sering melimpah pada permukaan akar (Raghu et al. 1966 dalam Alexander 1977). Spesies seperti Pseudomonas, Mycobacterium, Micrococcus, Bacillus,
Flavobacterium, Penicillium, Sclerotium, Fusarium, Aspergillus, dan lain-lainnya
sangat aktif dalam proses pengubahan fosfat yang tidak larut air menjadi larut air (Alexander 1977).
Beberapa bakteri tanah, khususnya yang termasuk dalam kelompok
Pseudomonas dan Bacillus dan fungi yang termasuk dalam kelompok Penicillium
dan Aspergillus menunjukkan kemampuan mengubah fosfat yang tidak larut
dalam tanah ke dalam bentuk larut dengan mengeluarkan asam organik seperti asam format, asetat, propionat, laktat, glikolat, fumarat, dan suksinat. Asam-asam ini menyebabkan pH lebih rendah dan memutus ikatan yang membentuk fosfat (Rao 1982).
Sebagian besar fosfat organik tanah berada dalam bentuk ester fosfat inositol, hexafosfat inositol dan beberapa di-tri dan tetrafosfat dari inositol. Beberapa fosfat organik ini diproduksi oleh tanaman, dan sebagian besar disintesis oleh mikrooragnisme (Dalal 1977 dalam Mengel dan Kirkby 1982).
2.11.Potensi Bakteri dan Fungi Melarutkan Fosfat
Beberapa bakteri tanah seperti bakteri pelarut fosfat mempunyai kemampuan untuk melarutkan P organik menjadi bentuk fosfat terlarut yang tersedia bagi tanaman. Efek pelarutan biasanya disebabkan oleh adanya produksi asam organik seperti asam asetat, asam format, asam laktat, asam oksalat, asam malat, dan asam sitrat yang dihasilkan oleh mikroba tersebut. Mikroba tersebut juga memproduksi asam amino, vitamin, dan growth promoting substance seperti IAA dan asam giberellin yang dapat meningkatkan pertumbuhan tanaman (Richardson 2001, Gyaneshwar et al. 2002; Ponmugaran 2006 dalam Suliasih 2007).
Diantara populasi bakteri tanah, bakteri pelarut fosfat merupakan pelarut yang berpotensi melarutkan fosfat antara 1 hingga 50% , sedangkan fungi pelarut fosfat hanya menunjukkan 0.1-0.5% potensi pelarutan (Chen et al. 2006 dalam
Panhwar et al. 2011).
Interaksi mikroorganisme tanah dalam tanaman di daerah perakaran bisa jadi sangat menguntungkan, netral, bervariasi atau mengganggu pertumbuhan tanaman. Keuntungan yang diperoleh dari aktivitas mikroorganisme ini termasuk produksi atau perubahan dalam kosentrasi hormon tanaman seperti IAA, Asam giberelin, sitokinin, etilen; fiksasi nitrogen, tekanan pertumbuhan dari organisme pengganggu dengan produksi siderofor, chitinase, antibiotik, dan pelarutan fosfat dan unsur lainnya (Bhadbhade et al. 2002 dalam Kukreja et al. 2010).
Pupuk biologis (bakteri pelarut fosfat) dinilai sebagai penyokong tanaman yang baik untuk mensuplai fosfor ke kadar yang sesuai. Pupuk ini diproduksi berdasarkan seleksi mikroorganisme tanah yang menguntungkan yang mana mempunyai efisiensi tinggi untuk meningkatkan pertumbuhan tanaman dengan menyediakan makanan dalam bentuk yang dapat diserap. Aplikasi dari inokulan yang disediakan oleh mikroorganisme ini meningkat, banyak mikroorganisme yang aktif dan efektif untuk daerah aktivitas akar, yang mana meningkatkan kemampuan tanaman untuk mengambil unsur hara dalam jumlah yang lebih banyak (Mehrvarz et al. 2008).
kelarutan dari kandungan anorganik fosfat, (b) mineralisasi kandungan organik dengan pelepasan fosfat anoragnik, (c) mengubah fosfat anorganik, menyediakan anion ke dalam komponen sel, sebuah proses immobilisasi analog yang terjadi dengan nitrogen, (d) berperan pada oksidasi dan reduksi dari kandungan fosfat anorganik, khususnya dalam proses immobilisasi.
Indikasi dari kegunaan mikroorganisme pelarut fosfat bisa dicapai dengan membandingkan pertumbuhan dan komposisi kimia dari pertumbuhan tanaman dengan kehadiran atau tidak hadirnya mikroorganisme. Sebagai contoh, ketika barley dibenihkan ke dalam sampel tanah steril dan nonsteril, dengan ukuran yang rendah dari ketersediaan fosfat, hasil dan kandungan fosfat ialah kekurangan di tanah nonsteril. Penurunan pertumbuhan oleh mikroflora di tanah alamiah tidak kelihatan jika fosfat yang disediakan tinggi (Benians G.J. dan D.A. Barber 1974
dalam Alexander 1977).
Bahan organik tanah mengandun P, yang mana mineralisasi dari bahan organik tanah melepaskan fosfat ke dalam larutan tanah. Fosfat yang dilepaskan dengan cara ini melibatkan keseimbangan ion fosfat yang dilepas dan ion fosfat yang diserap. Penguraian bahan organik oleh mikroba berhubungan dengan peningkatan produksi CO2 yang mana memungkinkan peningkatan larutan fosfat
tanah (Mengel dan kirkby 1982)
2.12.Mekanisme Pelarutan Fosfat
Ca-P. seperti yang diungkapkan oleh Basyaruddin (1982) dalam suatu reaksi sederhana sebagai berikut :
OH OH
Al (H2O) OH + OH- Al (H2O) OH+ H2PO
H2PO4 OH
Fase Padat Larutan Padat Larutan
OH OH
Fe (H2O) OH + OH- Fe (H2O) OH + H2PO4-
H2PO4 OH
Fase Padat Larutan Padat Larutan
Gambar 2 Reaksi sederhana pelarutan P sukar larut dari komplek Al-P dan Fe-P
Asam organik seperti asam sitrat dan asam sulfat berperan dalam meningkatkan kelarutan fosfat dalam batuan fosfat (Alexander 1977 dalam
Lestari 1994), ditegaskan oleh Leiwakabessy (1989) dalam Lestari (1994) dalam mekanisme berikut:
HNO3, H2SO4/ Asam Organik
P anorganik P Larut P tidak larut
Gambar 3 Mekanisme pelarutan fosfat oleh asam organik
Pelepasan H2PO4- menyebabkan jumlah fosfat dalam larutan tanah akan
bertambah. Mengel dan Kirkby (1982) menyatakan proses akhir dimana fosfat organik diubah menjadi tersedia dengan pemecahan fosfat anorganik dengan sejumlah reaksi fosfat. Enzim fosfat dihasilkan oleh akar tanaman tingkat tinggi oleh sejumlah mikroorganisme (Aspergillus, Penicillium, Mucor, Rhizopus,
Bacillus, Pseudomonas).
banjir, besi dalam fosfat besi yang tidak larut dapat direduksi, sebuah proses yang menunjukkan ke pembentukkan larutan besi dengan dengan pelepasan yang bersamaan dari fosfat ke dalam larutan (Patrick et al 1973 dalam Alexander 1977). Fosfat dapat juga dibuat lebih tersedia untuk diambil tanaman dengan memastikan bakteri yang membebaskan hydrogen sulfida, sebagai produk yang bereaksi dengan fosfat besi untuk menghasilkan besi sulfida pembebasan fosfat (Sperber 1957 dalam Alexander 1977). Penambahan asam nukleat murni ke dalam tanah dengan cepat mengalami defosforilasi. Sejumlah besar berbagai heterotrof dapat berkembang pada media yang mengandung nukleotida sebagai sumber tunggal dari karbon, nitrogen, dan fosfor. Mineralisasi dipengaruhi oleh pH, dan tingkat penurunan dari akibat kemasaman meningkat. Proses tranformasi dari suatu inisial depolimerisasi dari RNA oleh ribonuklease dan DNA oleh deoksiribonuklease dan pemecah fosfat berasal dari produk yang dibangun oleh depolimer enzim-enzim. Fosfor dalam sel mikroba, sebagian besar terdapat dalam bentuk RNA dan DNA, dibebaskan dengan cepat oleh beberapa organisme walaupun itu dibebaskan dengan lambat oleh organisme lainnya (Mills & Alexander 1974 dalam Alexander 1977).
2.13.Hasil-Hasil Penelitian Penggunaan Bakteri dan Fungi Pelarut Fosfat
Mikroorganisme dilibatkan dalam sejumlah proses yang mempengaruhi transformasi P tanah yang kemudian menjadi bagian integral dari bagian siklus P. Khususnya mikroorganisme tanah efektif dalam melepaskan P dari kelompok anorganik dan organik P total tanah melalui pelarutan dan mineralisasi (Hilda & Fraga 1999 dalam Y.P. Chen et al. 2006).
Mikroorganisme tanah memainkan peranan penting dalam dinamika P tanah yang berakibat ketersediaannya untuk tanaman (Richardson 2001 dalam
Khan et al. 2009).
Pseudomonas striata dan Aspergillus awamori dengan dan tanpa super fosfat dan batuan fosfat pada hasil panen gandum dan padi (Gaur et al. 1980 dalam Rao 1982). Hasilnya menunjukan bahwa peningkatan yang signifikan pada hasil panen padi yang memungkinkan ketika gandum diinokulasi dengan P. striata dengan batuan fosfat pada dosis 100 kg P2O5/ha. Hal yang sama juga terjadi, panen padi
meningkat secara signifikan saat padi diinokulasi dengan B. polymiyxa dengan batuan fosfat.
Benik dan Dey (1982) dalam Lestari (1994) mengisolasi beberapa mikroorganisme pelarut fosfat dari tanah alluvial (Fluvakuent), diperoleh dua strain fungi yaitu ACF2 (Aspergillus candidadus) dan ACF1 (Aspergillus
fumigatus), dua strain bakteri yaitu ACB5, dan ACB13 serta satu strain
Aktinomycetes yang efisien melarutkan P dari Ca3(PO4)2. Mikroorganisme
tersebut memproduksi asam oksalat dan asam tartat tanpa atau dengan asam sitrat, menunjukkan kemampuan yang tinggi melarutkan P anorganik sukar larut.
Aspergillus fumigatus mempunyai kemampuan paling tinggi melarutkan batuan
fosfat (31.5 ug). Secara umum strain ACF2 mempunyai kemampuan lebih baik
dalam melarutkan fosfat dibanding yang lain.
Dalam percobaan yang sebenarnya dalam media yang mengandung glukosa sebagai sumber karbon, Aspergillus niger mengasimilasi 0.24 hingga 0.40 bagian, Streptomyces sp. mengasimilasi 0.27 hingga 0.63, sedangkan gambaran untuk campuran flora tanah berada pada selang 0.16 hingga 0.36 bagian fosfor untuk masing-masing seratus bagian dari glukosa yang dioksidasi (Alexander 1977).
2.14.Pupuk Hayati
mikroorganisme pelarut fosfat saat ini digunakan sebagai pupuk hayati (Kannaiyan et al. 2004 dalam Sharma et al. 2007).
Pupuk hayati yang dibuat yang dibuat mengandung mikroorganisme tertentu dalam jumlah yang banyak dan mampu menyediakan hara serta membantu pertumbuhan tanaman. Pupuk hayati dapat diterima sebagai pupuk yang berharga murah dibanding pupuk kimia, dan tidak berdampak negative baik terhadap kesehatan tanah maupun lingkungan. Pupuk hayati yang banyak dikembangkan merupakan pemasok nitrogen dan fosfor. Pupuk hayati merupakan alternative bagi petani untuk memanfaatkan pasokan N2 udara yang cukup besar,
disamping memanfaatkan bentuk P tak tersedia menjadi bentuk tersedia. Melalui masukkan teknologi rendah, petani dapat memperoleh keuntungan yang lebih besar (Sutanto 2001).
2.15.Bunga Krisan
Kingdom : Plantae (tumbuh-tumbuhan) Divisi : Spermathophyta
Subdivisi : Angiospermae (biji berkeping dua) Ordo : Asterales (Compositae)
Famili : Asteraceae Genus : Chrysanthemum
Spesies : C. morifolium Ramat, C. Indicum, C. daisy dll.
Permintaan pasar akan bunga potong krisan meningkat sekitar 11.8% per tahun, berkaitan dengan hal itu upaya penyediaan benih yang bermutu di dalam negeri perlu mendapatkan prioritas (Soerojo 1991 dalam Raharjo et al. 2008). Hal itu dikarenakan usaha perluasan produksi bunga ditingkat petani selalu membutuhkan ketersediaan benih dalam jumlah yang memadai. Jika penyediaan benih tidak mampu mengimbangi lonjakan permintaan, maka produsen akan mencari alternatif dengan mengimpor bibit dari luar negeri. Bagi produsen yang tidak mampu mengimpor bibit, maka terpaksa menggunakan tanaman induk yang lama dengan resiko kualitas yang rendah. Untuk mendukung penyediaan benih bermutu tanaman krisan, Balai Penelitian Tanaman Hias telah mengembangkan teknik perbanyakan bibit dan produksi tanaman induk secara tepat (Marwoto et al.
2004 dalam Raharjo et al. 2008).
Disamping konstruksi bambu, masa hidup dari rumah kayu adalah 10 tahun. Di rumah kayu ada 20% lebih sinar yang masuk dibandingkan rumah plastik yang dibangun dengan bambu (Gunadi et al. 2006, diacu dalam Budiarto et al. 2007).
Krisan berasal dari daerah subtropis, sehingga suhu yang terlalu tinggi merupakan faktor pembatas dalam pertumbuhan tanaman. Temperatur rata-rata untuk pertumbuhan krisan berada pada suhu harian antara 17 0C sampai 30 0C. Pada fase vegetatif, kisaran suhu harian 22 sampai 28 0C pada siang hari dan tidak melebihi 26 0C pada malam dibutuhkan untuk pertumbuhan optimal krisan (Khattak &Pearson 1997 dalam PUSLITBANGHORT 2006). Suhu harian pada fase generatif 16 0C sampai 18 0C (Wiltkins et al. 1990 dalam
PUSLITBANGHORT 2006). Menurut Maswinkel dan Sulyo (2004) dalam
PUSLITBANGHORT (2006), pada suhu di atas 25 0C, proses inisiasi bunga akan terhambat dan menyebabkan pembentukan bakal bunga juga terhambat. Suhu yang terlalu tinggi juga mengakibatkan bunga yang dihasilkan cenderung berwarna hitam, pucat dan memudar.
Tingkat pemberian pupuk untuk kehidupan atau masa pemberian makanan dari krisan pada pot, berdasarkan pada nitrogen adalah 350 - 400 ppm N. Selanjutnya, 375 ppm N digunakan sebagai taraf standar (100%) untuk studi. Jumlah fosfor dan kalium dalam 375 ppm larutan pupuk N adalah 175 dan 354 ppm, untuk masinng-masing pupuk. Masing-masing perlakuan pupuk dibuat menjadi pupuk lengkap. Untuk menjaga kesamaan perbandingan dari semua unsur makro dan mikro, keragaman pemberian pupuk dilakukan secara lurus dari pupuk ke tingkat spesifik dari setiap percobaan (Chau et al. 2005).
Beberapa pengaruh pembudidayaan menunjukkan pengaruh yang kuat pada pengaruh musim daripada pengaruh-pengaruh lainnya. ‘Tara’ dikenal dalam produksi komersial untuk pertumbuhan yang lebih kuat pada suhu produksi yang lebih tinggi, yang mana ditunjukkan dengan peningkatan cabang pada percobaan diakhir musim semi dan gugur (Schoellhorn 1996).
maupun petani kecil pada ketinggian tempat 600-1200 m dpl, yaitu krisan standar dan krisan spray dengan sekitar 30 varietas. Pada daerah pusat promosi dan pemasaran bunga Rawabelong juga terlihat adanya pasokan bunga krisan jenis lokal dan Holland. Krisan Holland volumenya hampir dua kali lipat dari volume krisan lokal. Pada pasar internasional krisan juga merupakan komoditi penting. Beberapa negara berkembang telah menjadi pemasok (supplier) ke pusat eropa, seperti Columbia (32%), Zimbawe (26%), dan Afrika Selatan (15%) (Ridwan 2005).
Kedudukan Indonesia sebagai negara tropis yang memiliki sumberdaya lahan dan agroklimat yang sesuai bagi pertumbuhan tanaman hias bunga potong, telah memungkinkan tanaman krisan diproduksi sepanjang tahun. Perkembangan luas panen produksi dan produktivitas tanaman krisan pada tahun 2000 menunjukkan terjadinya peningkatan luas panen sebesar 62.20% dibandingkan dengan tahun sebelumnya. Peningkatan luas panen tersebut diimbangi dengan peningkatan produksi sebesar 55.26%, meskipun produktivitasnya menurun dari 2.05 tangkai/m2 menjadi 1.97 tangkai/m2 (Direktorat Tanaman Sayuran, Hias, dan Aneka Tanaman 2001 dalam Ridwan 2005)
Perbedaan produktivitas dan kualitas dari pemotongan dihasilkan oleh tanaman induk bunga krisan di bawah kondisi terbuka menunjukkan perbedaan dalam respon tumbuh ke lingkungan yang lebih ekstrim. Studi dilakukan di musim hujan. curah hujan yang tinggi (22.54 mm/hari) diduga tidak hanya memberikan pengaruh fisik (pukulan air hujan) tapi juga akibat negatif ke lingkungan tanaman induk, seperti peningkatan kelembaban dan kondisi air di zona akar. Disamping, kondisi berawan disiang hari yang mempengaruhi jumlah tipe cahaya matahari yang diterima oleh tanaman, ketidaksesuaian lingkungan pada kondisi terbuka mempengaruhi kondisi fisiologi tanaman kualitas pertumbuhan yang mana akhirnya menurunkan produksi bunga potong (Hiclenton dan McRae 1984 dalam Budiarto & Marwoto 2009).
diameter tanaman. Bayangan polyetilen berwarna menurunkan jumlah bunga dan hasil biomassa sementara terjadi peningkatan diameter dan tinggi tanaman. Kandungan bioaktif dalam tanaman yang sehat yang tumbuh di bawah naungan polyetilen yang berbeda, mencapai puncaknya pada tahap yang berbeda melalui studi waktu, naungan polyetilen biru mempengaruhi biomassa dan akumulasi kandungan bioaktif (Jin et al. 2012). Pemberian sukrosa di dalam larutan perendam hendaknya dilakukan pada kondisi optimal, karena pada kondisi tersebut sukrosa berfungsi sebagai substrat respirasi untuk menghasilkan energi yang akan digunakan dalam proses kehidupan sehingga kesegaran bunga akan lebih lama (Wiraatnmajaya 2007).
Petani mempunyai pilihan jenis, warna bunga, dan asal bibit yang menghasilkan benih krisan sehingga dapat memperhitungkan secara ekonomi untuk memperoleh keuntungan maksimal dalam agribisnis tanaman hias dan tentu saja harus memperhitungkan jarak transportasi asal bibit, biaya yang dikeluarkan, pemasaran, minat konsumen dalam hal dan jenis bunga yang akan dijual ke pasar (Sukiyono 2005; Bachrein 2006; dalam Masyhudi dan Suhardi 2009). Pengalaman petani dalam budidaya bunga krisan juga turut memengaruhi pertumbuhan tanaman dan produksi bunga krisan. Kemampuan petani dan pengalaman bercocok tanam lebih menguatkan usahatani dan lebih mengembangkan teknologi budidaya krisan. Teknologi budidaya krisan lebih berkembang lagi pada tahun 2006 hingga 2007 dengan berbagai usaha efisiensi dan lebih merapatkan jarak tanam menjadi 8x8 cm bahkan pucuk apikal tanaman dipotong sehingga tanaman dapat memproduksi cabang dari ketiak daun yang berjumlah 2-4 cabang. Teknik ini lebih menguntungkan karena produksi bunga dapat meningkat 2-4 kuntum percabang sehingga dapat menambah keuntungan (Masyhudi dan Suhardi 2009).
III.
BAHAN DAN METODE
3.1. Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Bioteknologi Tanah, Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor dan Rumah Plastik “Pondok Adi Nursery”, Desa Cimacan, Kecamatan Pacet, Kabupaten Cianjur, Provinsi Jawa Barat, dari November 2011 hingga Agustus 2012.
3.2. Bahan dan Alat
Bahan-bahan yang digunakan meliputi sampel tanah sebagai sumber isolat yang berlokasi di daerah sekitar pembuangan sampah sementara (Dramaga), media Pikovskaya, media Nutrient Agar (NA), Media Potatos Dektrose Agar (PDA), larutan Fisiologis, larutan PB, larutan PC, bibit tanaman krisan (varietas Reagent), pupuk kandang, urea 46% N, SP -36 36% P2O5 , dan KCl 60% K2O.
Alat-alat yang digunakan adalah gelas piala, Erlenmeyer, tabung reaksi, gelas ukur, coreborer, soil sampler, pinset, pembakar Bunsen, neraca digital (gram) autoklaf, inkubator, kertas saring, cawan petri, alat pengocok (shaker), UV
Spektrofotometer, laminair flow air cabinet, pH meter, dan peralatan pengambilan
contoh tanah.
3.3. Metode Penelitian
3.3.1. Pengambilan Contoh Tanah
Tanah yang berada di lokasi sekitar pembuangan sampah (Dramaga) diambil dari lokasinya. Sampel tanah ini akan digunakan sebagai bahan untuk memperoleh isolat mikroorganisme pelarut fosfat. Pengambilan tanah diambil pada satu titik dengan luasa 1 m2. Tanah diambil pada kedalaman ± 20 cm dari permukaan tanah secara komposit.
3.3.2. Persiapan Lahan
terdapat dalam satu rumah plastik yakni enam sampai delapan bedengan. Setiap bedengan berukuran 20 m x 1.5 m. Jumlah bedengan yang dibutuhkan dalam penelitian ini yakni 3 bedengan. Dua bedengan pertama yang berada dari pinggir area rumah plastik, masing-masing dibuat dua petakan, dimana setiap petakan terdiri atas 6 plot yang menunjukkan jumlah perlakuan dalam penelitian. Sedangkan pada bedengan ketiga dari area rumah plastik, hanya dibuat satu petakan, sehingga jumlah keseluruhan petakan yakni 5 petakan yang menunjukkan jumlah repetisi (ulangan) dalam penelitian. Setiap plot dalam petakan memiliki ukuran 1 m x 1 m, sehingga ukuran luas setiap plot yang berada disetiap petakan adalah 1 m2 . Jarak antara plot yang satu dengan plot yang lain adalah 45 cm. Pada setiap sisi plot ditutupi dengan plastik untuk mencegah longsor pada plot dan mencegah terjadinya kontaminasi antar plot. Persiapan lahan dilakukan dengan membersihkan lahan dari sisa-sisa rumput yang terdapat di permukaan lahan. Selanjutnya dilakukan pengemburan tanah dengan menggunakan cangkul.
3.3.3. Pemupukan
Pupuk majemuk NPK, diberikan dengan cara menebarkan pupuk tersebut tepat di atas lahan tanam, supaya merata (homogen)
3.3.4. Isolasi Fungi dan Bakteri
Tanah yang berasal dari lokasi sekitar pembuangan sampah pada kedalaman 20 cm, diambil ekstraknya untuk mendapatkan isolat fungi dan bakteri. Sepuluh gram tanah dilarutkan dengan 90 ml larutan fisiologis. Kemudian dikocok dengan alat pengocok (shaker) selama 20 menit. Larutan tersebut kemudian diencerkan sampai diperoleh kepekatan 10-6 untuk fungi dan 10-7 untuk bakteri. Suspensi dari pengenceran untuk fungi yakni 10-4, 10-5, dan 10-6 diambil 1 ml dan dituang ke cawan petri lalu ditambahkan medium pikovskaya steril. Sedangkan untuk bakteri suspensi dari pengenceran 10-4, 10-5, 10-6 dan 10-7, diambil 1 ml dan dituangkan ke cawan petri dan ditambahkan medium pikovskaya cair. Kemudian diinkubasi selama 48 jam pada suhu ruang.
Koloni bakteri dan fungi yang menunjukkan zona jernih di sekelilingnya diseleksi, kemudian dipindahkan pada cawan agar pikovskaya yang baru dan dinkubasi kembali.
Untuk memperoleh fungi yang benar-benar berzona jernih maka secara terus-menerus dilakukan seleksi dengan memindahkan koloni bakteri dan fungi yang tumbuh pada cawan sebelumnya ke cawan agar yang baru. Hasil pemindahan terakhir dipindahkan pada agar miring dan disimpan di lemari pendingin.
3.3.5. Pengujian Kemampuan Bakteri dan Fungi Pelarut Fosfat 3.3.5.1. Uji Kuantitatif
Isolat fungi yang diperoleh diuji kemampuannya dalam melarutkan P. Diambil 2 isolat bakteri dan 2 isolat fungi yang memiliki tingkat kemampuan yang tinggi dalam melarutkan P.
(Ca3(PO4)2). Kemudian diinkubasi selama 7 hari. Setelah masa inkubasi berakhir,
ditetapkan P-larut dengan UV spektrofotometer dengan panjang gelombang 660 nm. Hasil dari pengujian ini dipilih 2 isolat fungi dan 2 isolat bakteri yang baik dan siap dicobakan ke tanaman.
3.3.5.2. Uji Kualitatif
Selanjutnya dilakukan penentuan Indeks Pelarutan (IP) dan kecepatan tumbuh dari setiap bakteri dan fungi yang telah terseleksi. yaitu dengan menumbuhkan satu bulatan untuk masing-masing bakteri dan fungi dengan diameter tertentu pada mediua pikovskaya padat. Penentuan Indeks Pelarutan (IP) dan kecepatan tumbuh dilakukan terhadap 6 bakteri dan 6 fungi pelarut fosfat yang berhasil diisolasi. Indeks Pelarutan (IP) ditentukan dengan cara membagi diameter keseluruhan dengan diameter koloni untuk masing-masing bakteri dan fungi pelarut fosfat. Penghitungan diameter dan zona jernih terhadap bakteri dan miselium fungi ini dilakukan tiap hari yang berlangsung selama 5 hari untuk bakteri dan 4 hari untuk fungi.
3.3.5.3. Penghitungan Total Mikroorganisme Pelarut Fosfat
3.3.5.4. Uji Antagonis
Isolat-isolat yang telah terpilih yang akan diinokulasikan pada carrier
molases dilakukan uji antagonis. Uji antagonis ini dilakuakan untuk mengetahui karakteristik mikroorganisme pelarut fosfat terhadap satu sama lain. Uji ini dilakukan dengan cara menumbuhkan dua isolat bakteri dan dua isolat fungi serta kombinasi antara isolat bakteri dan fungi masing-masing pada satu media Pikovskaya. Selanjutnya dinkubasi selama ± 48 jam. Ilustrasi dan sususnan uji ini dilampirkan pada lampiran.
3.3.6. Penanaman dan Perawatan Krisan
Penanaman bunga krisan dilakukan di rumah plastik. Bibit bunga krisan diperoleh dari agen yang menjual bibit bunga krisan. Bunga krisan ditanam di atas bedengan ukuran 1x1 m untuk setiap plot perlakuan. Jarak tanam bunga krisan adalah 12.5x12.5 cm. perawatan meliputi penyiraman bunga krisan, pemberian cahaya lampu pada malam hari, pengendalian hama, dan pembuangan gulma pada lahan tanam krisan, pembuangan daun yang berada pada bagian bawah (1/3 tinggi tanaman dan pembuangan pucuk apikal.
3.3.7. Rancangan Percobaan
Gambar 4 Petak perlakuan 5
1 m
1 m 4
1 2
3
Keterangan :
3.3.8. Parameter Pengamatan
Parameter dan tata cara pengamatan terhadap bunga krisan mengacu pada Standar Nasional Indonesia (SNI) 01 – 4478 – 1998 tentang bunga krisan potong segar. Parameter pengamatan terhadap bunga krisan meliputi tinggi tanaman, diameter tangkai, jumlah daun, warna daun, jumlah bakal bunga, diameter bunga setengah mekar per tangkai, dan jumlah kuntum bunga setengah mekar per tangkai.
3.3.8.1. Tinggi Tanaman
Tinggi Tanaman diukur pada dua fase, fase I yaitu pada fase pertumbuhan vegetatif yang dilakukan sebanyak 8 kali, yaitu dari 1 MST hingga 8 MST, fase II adalah fase akhir generatif (Panen). Tinggi tanaman diukur 1 cm dari leher akar hingga sampai titik tumbuh tertinggi pada pucuk batang. Setiap ulangan diamati 5 tanaman contoh untuk pengamatan tinggi vegetatif dan 10 contoh tanaman untuk pengematan tinggi akhir.
3.3.8.2. Diameter Tangkai
Diameter tangkai diukur saat setelah panen (15-17 MST) dengan menggunakan jangka sorong ketelitian 0.1 mm. Pengukuran diameter tangkai dilakukan terhadap 5 contoh tanaman hasil panen yang dipilih secara acak pada masing-masing perlakuan
3.3.8.3. Jumlah Daun
Jumlah daun dihitung sebanyak 8 kali yaitu dari 1 MST hingga 8 MST yang merupakan fase vegetatif dari pertumbuhan tanaman. Penghitungan jumlah daun dilakukan terhadap 5 tanaman contoh pada setiap perlakuan.
3.3.8.4. Warna Daun
chart yang memiliki gradasi warna hijau meliputi kurang hijau (1), cukup hijau (2), Hijau (3), lebih hijau (4), dan sangat hijau (5). Pengamatan warna daun dilakukan terhadap 5 tanaman contoh pada setiap perlakuan.
3.3.8.5. Jumlah Bakal Bunga
Jumlah bakal bunga ditetapkan sebanyak tiga kali yaitu dari 10 MST hingga 12 MST yang merupakan fase generatif dari perkembangan tanaman. Penetapan dilakukan secara visual dengan menghitung jumlah bakal bunga yang mincul. Penghitungan jumlah bakal bunga dilakukan dengan menghitung bakal bunga yang terdapat dari pangkal tanaman hingga pucuk tanaman. Penghitungan jumlah bakal bunga dilakukan terhadap 5 tanaman contoh pada setiap perlakuan.
3.3.8.6. Diameter Bunga Setengah Mekar Per Tangkai
Bunga setengah mekar adalah mahkota bunga yang memiliki sudut 450 terhadap garis vertikal Jumlah bunga setengah mekar ditetapkan setelah panen dilakukan. Penetapan menggunakan mistar dengan ketelitian 1 mm. Pengukuran diameter bunga setengah mekar dilakukan terhadap 5 contoh tanaman hasil panen yang dipilih secara acak pada masing-masing perlakuan.
3.3.8.7. Jumlah Kuntum Bunga Setengah Mekar Per Tangkai
Jumlah kuntum bunga setengah mekar ditetapkan setelah panen dilakukan. Penetapan dilakuaknsecara visual dan menghitung. Penghitungan jumlah bakal bunga dilakukan terhadap 5 contoh tanaman hasil panen yang dipilih secara acak pada masing-masing perlakuan.
3.3.9. Kualitas Bunga
3.3.10.Analisis Data
IV.
HASIL DAN PEMBAHASAN
4.1. Seleksi IsolatSebanyak 21 isolat bakteri dan 8 fungi pelarut fosfat hasil isolasi selanjutnya dimurnikan lagi dan dipilih berdasarkan pengamatan secara visual terhadap lebar zona jernih, sehingga diperoleh enam isolat bakteri pelarut fosfat dan enam fungi pelarut fosfat., selanjutnya diuji kuantitatif untuk mengetahui kemampuan pelarutan dari bakteri dan fungi terhadap fosfat dengan sumber P dari Ca3(PO4)2 terhadap masing-masing isolat. Masing-masing dari 6 bakteri dan 6
fungi tersebut beserta P-tersedia hasil pelarutan oleh masing-masing bakteri dan fungi tersaji pada Tabel 1.
Tabel 1 Pengaruh isolat bakteri dan fungi pelarut fosfat terhadap ketersediaan P pada media Pikovskaya cair.
Berdasarkan data tabel 1 dapat diketahui bahwa bakteri yang memiliki daya larut P paling tinggi adalah B25B dengan P-larut 305.30 ppm P. Sedangkan fungi yang memiliki daya larut P paling tinggi adalah A25F dengan P-larut 775.00 ppm P. Hasil tersebut menunjukkan bahwa daya larut fungi terhadap P dengan sumber Ca3(PO4)2 yang berada pada media pikovskaya cair lebih tinggi daripada
memiliki daya larut P tinggi untuk dinokulasikan pada carrier molases 5% yang akan dijadikan pupuk hayati.
( A ) ( B )
Gambar 5 Uji kualitatif bakteri pelarut fosfat ( A ) Isolat A8B ( B ) Isolat B1B
Selanjutnya untuk mengetahui hubungan pertumbuhan dengan daya larut P dari 6 bakteri dan 6 fungi yang terpilih, dilakukan uji kualitatif. Uji kualitatif ini juga bertujuan untuk mengetahui indeks pelarutan dari masing-masing bakteri dan fungi. Pertumbuhan bakteri dan fungi yang ditunjukkan oleh data diameter koloni bakteri dan fungi yang tersaji pada Tabel 2 dan Tabel 3, ternyata daya larut P yang
Tabel 2 Diameter koloni bakteri pelarut P dalam inkubasi selama 5 hari
Kode Isolat Waktu Inkubasi (hari) Akumulasi Pertambahan Diameter 0 1 2 3 4 5
---mm---
B6B 3.13 3.63 5.63 5.81 6.38 6.69 3.56
B16B 4.00 4.75 4.94 5.38 5.94 7.31 3.31
A25B 4.00 4.88 5.00 5.00 5.00 5.25 1.25
B25B 4.63 5.63 5.88 5.94 7.06 7.06 2.44
A8B 5.00 5.00 5.00 5.00 5.25 5.50 0.50
B1B 6.00 7.38 8.25 8.44 9.88 10.13 4.13
Sedangkan isolat A8B tidak menunjukkan pertumbuhan yang signifikan dari hari pertama hingga hari terakhir inkubasi. Isolat A25B menunjukkan peningkatan pertumbuhan pada hari kesatu inkubasi dan tidak menunjukkan pertumbuhan yang kontras pada hari kedua hingga hari kelima inkubasi. Hal ini menunjukkan bahwa isolat A25B mengalami pertumbuhan yang cepat pada hari kesatu inkubasi dan pertumbuhan yang cukup stabil pada hari kedua hingga kelima inkubasi.
Pertumbuhan fungi paling tinggi terdapat pada isolat B4F, dengan nilai akumulasi pertambahan diameter miselium sebesar 82.50, sedangkan pertumbuhan fungi paling rendah terdapat pada isolat B40F dengan nilai akumulasi pertambahan diameter miselium sebesar 62.38. Dibandingkan dengan pertumbuhan bakteri pelarut fosfat, fungi pelarut fosfat memiliki pertumbuhan yang lebih cepat. Hal ini dikarenakan sifat genetik dan morfologi tubuh fungi
Tabel 3 Diameter miselium fungi pelarut P dalam inkubasi selama 4 hari
Kode Isolat 0 1 2 3 4 Waktu Inkubasi (hari) Pertambahan Diameter Akumulasi
---mm---
Pada inkubasi hari kedua, isolat B40F menunjukkan pertumbuhan tercepat dibandingkan dengan isolat lainnya. Sedangkan inkubasi hari keempat menunjukkan pertumbuhan tercepat pada isolat B4F dari isolat lainnya dibandingkan inkubasi hari ketiga.
Gambar 7 Ilustrasi penetapan Indeks pelarutan (IP) fosfat (a) diameter koloni, (b) diameter zona bening
Indeks pelarutan (IP) fungi pelarut fosfat ditunjukkan di Tabel 4. Nilai IP tertinggi bernilai 1.10 terdapat pada isolat B39F, sedangkan nilai IP terendah bernilai 1.02 terdapat pada isolat A49F dan B40F. Berdasarkan perbandingan Indeks Pelarutan (IP) fosfat oleh bakteri dan fungi, menunjukkan bahwa bakteri
Tabel 4 Indeks Pelarutan (IP) fungi pelarut P dalam inkubasi selama 4 hari
Bakteri Fungi
Kode Isolat IP Kode Isolat IP
B6B 1.11 A25F 1.05
B16B 1.48 A49F 1.02
A25B 2.82 B40F 1.02
B25B 1.60 B4F 1.05
A8B 2.60 B39F 1.10
B1B 1.64 B26F 1.03
memiliki IP yang lebih besar dari pada IP fungi. Hasil yang diperoleh dari uji kuantitatif, kualitatif (nilai Indeks Pelarutan (IP) ) fosfat ternyata tidak menunjukkan korelasi yang positif.
( A ) ( B )
Gambar 8 Uji kualitatif untuk penetapan Indeks Pelarutan (IP) fosfat: ( A ) Isolat A25B inkubasi hari ke-5( B ) Isolat B39F inkubasi hari ke-4
Hasil uji kualitatif dan nilai Indeks Pelarutan(IP) digunakan sebagai data pendukung apabila terdapat nilai yang sama pada uji kuantitatif dalam penetapan isolat yang akan dijadikan pupuk hayati
Berdasarkan hasil uji kuantitatif pada Tabel 1, maka diperoleh dua isolat bakteri dan dua isolat fungi yang memiliki daya larut P tinggi. Kedua isolat bakteri dan fungi tersebut adalah B1B, B25B untuk isolat bakteri dan A25F, B26F untuk isolat fungi. Selanjutnya bakteri dan fungi terpilih tersebut melewati uji selanjutnya, yakni uji antagonis. Uji antagonis bertujuan untuk menentukan sifat kompatibel antara mikroorganisme yang akan dijadikan pupuk hayati. Hasil uji antagonis menunjukkan antara bakteri dan fungi satu sama lain tidak saling berlawananan (non-antagonis). Artinya, bakteri dan fungi dapat saling hidup dalam satu carrier molases 5%, sehingga dapat diinokulasikan secara bersamaan ke dalam carrier tersebut. Hasil uji antagonis tersaji pada tabel 5.
Tabel 5 Hasil uji antagonis mikroorganisme pelarut fosfat.
No Kode Uji Isolat Antagonis Non-Antagonis
1 B1B X B25B - +
Hasil uji total mikrob tersaji pada tabel 6. Hasil uji total mikrob pada pupuk hayati menunjukkan bahwa pupuk hayati mengandung bakteri pelarut fosfat dengan jumlah 1.5 x 107 cfu/ml, sedangkan fungi pelarut fosfat yang terdapat dalam pupuk hayati berjumlah 5.0 x 107 cfu/ml. Jumlah tersebut memenuhi kriteria uji pupuk hayati untuk aplikasi ke lapangan yang ditetapkan oleh Departemen Pertanian (DEPTAN) N0 28/Permentan/SR.130/5/2009 tetntang uji pupuk hayati, yang mensyaratkan jumlah bakteri untuk uji pupuk hayati
Tabel 6 Hasil uji total mikroorganisme pada pupuk hayati
Jenis Isolat Jumlah cfu/ml
Bakteri Pelarut Fosfat 1.5 x 107
ke lapangan harus memenuhi jumlah ≥105 cfu/ml, sedangkan jumlah fungi pada pupuk hayati yang ingin diuji ke lapangan harus memenuhi jumlah ≥104 cfu/ml.
4.2. Sifat Kimia Tanah
4.2.1. Kandungan P-Tersedia Tanah
Kandungan P-tersedia tanah ditunjukkan oleh Tabel 7. Pada 1 MST terdapat perbedaan yang nyata pada sebagian besar perlakuan. Perlakuan 0 ml pupuk hayati + 50% pupuk P dan perlakuan 0 ml pupuk hayati + 100% pupuk P memiliki nilai P-tersedia yang lebih tinggi dan berbeda nyata dibandingkan perlakuan 0 ml pupuk hayati + 0% pupuk P. Hal yang sama juga diperoleh pada perlakuan 50 ml pupuk hayati + 50% pupuk P dan 50 ml pupuk hayati + 100% pupuk P yang memiliki nilai P-tersedia yang lebih tinggi dibandingkan dengan perlakuan 0 ml pupuk hayati + 0% pupuk P dan perlakuan 50 ml pupuk hayati + 0% pupuk P. Hal ini menunjukkan bahwa tanah yang diberikan pupuk P saja tanpa pupuk hayati baik 50% dosis rekomendasi maupun 100% dosis rekomendasi memberikan distribusi terhadap P-tersedia dalam larutan tanah dibandingkan dengan tanah yang tanpa diberikan pupuk P dan pupuk hayati. Namun antar perlakuan 0 ml pupuk hayati + 50% pupuk P dan 0 ml pupuk hayati + 100% pupuk P tidak berbeda nyata dengan perlakuan 50 ml pupuk hayati + 50% pupuk P dan perlakuan 50 ml pupuk hayati + 100% pupuk P.
Nilai P-tersedia paling rendah pada perlakuan 0 ml pupuk hayati + 0% pupuk P dikarenakan tidak adanya pemberian pupuk P dan pupuk hayati pada tanah sehingga jumlah P yang akan dilarutkan untuk menghasilkan P-tersedia pada tanah tersebut kecil. Sebaliknya nilai P-tersedia yang lebih tinggi pada perlakuan lainnya dikarenakan tanah mendapat tambahan unsur fosfat dari pupuk P dan mikroorganisme pelarut fosfat dalam pupuk hayati yang menyebabkan tingkat pelarutan fosfat untuk menghasilkan P-tersedia bagi tanaman lebih tinggi.
karena sepersepuluh hingga setengah bakteri yang diuji biasanya mampu melarutkan kalsium fosfat dan jumlah bakteri yang melarutkan fosfat yang tidak larut berada pada 105 hingga 107 per gram tanah, sebagai contoh bakteri yang sering melimpah pada permukaan akar (Raghu et al. 1966 dalam Alexander 1977). Spesies seperti Pseudomonas, Mycobacterium, Micrococcus, Bacillus,
Flavobacterium, Penicillium, Sclerotium, Fusarium, Aspergillus, dan lain-lainnya
sangat aktif dalam proses pengubahan fosfat yang tidak larut menjadi larut (Alexander 1977).
Tabel 7 Kandungan P-tersedia dan pH tanah pada pemberian pupuk hayati dan pupuk P Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama menunjukkan antar perlakuan tidak berbeda nyata pada Duncan taraf kepercayaan 95% (α = 5%)
Beberapa bakteri tanah, khususnya yang termasuk dalam kelompok
Pseudomonas dan Bacillus dan fungi yang termasuk dalam kelompok Penicillium
dan Aspergillus menunjukkan kemampuan mengubah fosfat yang tidak larut
dalam tanah ke dalam bentuk larut dengan mengeluarkan asam organik seperti asam format, asetat, propionat, laktat, glikolat, fumarat, dan suksinat. Asam-asam ini menyebabkan pH lebih rendah dan memutus ikatan yang membentuk fosfat. Selain itu hasil sekresi asam-asam organik tersebut berfungsi sebagai katalisator, pengkhelat dan memungkinkan asam-asam organik membentuk senyawa komplek dengan kation Ca2+, Mg2+, Fe2+, dan Al3+ sehingga terjadi pelarutan fosfat menjadi bentuk yang tersedia yang dapat diserap oleh tanaman (Rao 1982 dalam Wulandari 2001). Pelepasan H2PO4- menyebabkan jumlah fosfat dalam larutan
Jumlah P-tersedia mengalami penurunan pada 10 MST pada setiap perlakuan jika dibandingkan dengan 1 MST. Penurunan P-tersedia ini dikarenakan fosfat mengalami transformasi menjadi bentuk yang tidak tersedia. Fosfat tanah diikat oleh sebagian besar kation tanah, yang menyebabkan fosfat tersedia berubah menjadi bentuk yang tidak tersedia. Jumlah P-tersedia paling rendah pada 10 MST terdapat pada perlakuan 0 ml pupuk hayati + 0% pupuk P. Hal ini menunjukkan bahwa perlakuan 0 ml pupuk hayati + 0% pupuk P memiliki nilai P-tersedia yang lebih rendah bila dibandingkan dengan perlakuan yang lainnya namun tidak berbeda nyata antara setiap perlakuan. Jumlah P-tersedia yang sedikit pada perlakuan 0 ml pupuk hayati + 0% pupuk P, disebabkan tidak adanya tambahan fosfat dari pupuk P dan tambahan pupuk hayati yang mengandung mikroorganisme pelarut fosfat untuk melarutkan fosfat yang ada. Jumlah P-tersedia tertinggi yang terdapat pada perlakuan 0 ml pupuk hayati + 50% pupuk P mengindikasikan penambahan pupuk hayati pada perlakuan 50 ml pupuk hayati + 0% pupuk P, 50 ml pupuk hayati + 50% pupuk P, 50 ml pupuk hayati + 100% pupuk P belum menunjukkan pengaruh terhadap pelarutan fosfat untuk menjadi P-tersedia. Mikroorganisme pelarut fosfat yang terdapat pada pupuk hayati pada 10 MST tidak cukup berperan dalam proses pelarutan fosfat. Hal tersebut disebabkan keadaan kondisi tanah yang meyebabkan mikroorganisme pelarut fosfat tidak dapat melarutkan fosfat secara optimal.
Penurunan jumlah P-tersedia pada 10 MST pada setiap perlakuan tidak diikuti oleh penurunan pH seperti yang terlihat pada tabel 7, namun terjadi peningkatan nilai pH dibandingkan pada 1 MST. Hal tersebut disebabkan pada selang 2 MST hingga 10 MST akar tanaman giat atau aktif menghasilkan asam organik (H+) yang menyerap anion lebih besar dari pada kation, melepaskan (OH-) hasil hidrolisis pupuk P, sehingga pH meningkat.
4.2.2. Reaksi Tanah (pH H2O)