PEMURNIAN MINYAK GORENG BEKAS
ADE MURNI SURYANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PEMANFAATAN TONGKOL JAGUNG UNTUK
PEMBUATAN ARANG AKTIF SEBAGAI ADSORBEN
PEMURNIAN MINYAK GORENG BEKAS
ADE MURNI SURYANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul skripsi : Pemanfaatan Tongkol Jagung untuk Pembuatan Arang Aktif sebagai Adsorben Pemurnian Minyak Goreng Bekas
Nama : Ade Murni Suryani
NIM : G44204033
Menyetujui:
Pembimbing I, Pembimbing II,
Betty Marita Soebrata, S.Si, M.Si. Dr. Gustan Pari, M.Si, APU
NIP 131 694 523 NIP 710 005 078
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP 131 578 806
Di Indonesia, agroindustri merupakan sektor yang sangat penting dalam perindustrian nasional. Namun kegiatan pascapanen dan pengolahan hasil pertanian, termasuk pemanfaatan produk samping dan sisa pengolahannya masih kurang. Sisa pengolahan industri pertanian pada jagung akan menghasilkan limbah berupa tongkol jagung yang jumlahnya akan terus bertambah seiring dengan peningkatan kegiatan pascapanen.
Produksi jagung di Indonesia setiap tahunnya menunjukkan peningkatan. Menurut Biro Pusat Statistik (BPS) Indonesia, angka produksi jagung tahun 2004 mencapai 11,2 juta ton. Tahun 2005 meningkat menjadi 12,5 juta ton, tahun 2006 mencapai 12,13 juta ton. Tahun 2007 produksinya mencapai 14 juta ton. Disamping itu, tingkat konsumsi jagung pada tahun 2006 sekitar 3,5 juta ton, sedangkan tahun 2007 diperkirakan mencapai 4,1 juta ton (BPS 2007). Banyaknya buah jagung yang dikonsumsi menyebabkan bertambahnya limbah tongkol jagung yang dapat menyebabkan pencemaran lingkungan. Selama ini, masyarakat pedalaman cenderung memanfaatkan limbah tongkol jagung sebagai bahan bakar, dan terkesan terbuang percuma. Oleh karena itu, perlu dilakukan penelitian guna mengurangi volume limbah tongkol jagung dan meningkatkan nilai tambahnya.
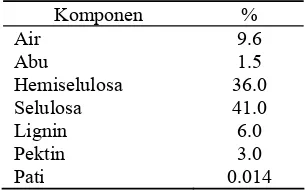
Salah satu upaya yang dilakukan untuk memanfaatkan limbah pertanian tersebut ialah diolah menjadi arang aktif yang selanjutnya diaplikasikan sebagai adsorben. Kandungan senyawa berkarbon, yaitu selulosa (41%) dan hemiselulosa (36%) yang cukup tinggi mengindikasikan bahwa tongkol jagung berpotensi sebagai bahan pembuat arang aktif. (Lorenz & Kulp 1991). Komposisi kandungan tongkol jagung dapat dilihat pada Tabel 1.
Tabel 1 Komposisi tongkol jagung
Komponen % Air 9.6 Abu 1.5 Hemiselulosa 36.0 Selulosa 41.0 Lignin 6.0 Pektin 3.0 Pati 0.014 Sumber: Lorenz & Kulp (1991).
7 kali dari daya jerap arangnya. Arang aktif mampu menyerap anion, kation, dan molekul dalam bentuk senyawa organik dan anorganik berupa larutan dan gas sehingga digunakan sebagai adsorben polutan berkadar rendah pada produk-produk industri (Pari 1996). Menurut Jaguaribe (2005) kapasitas adsorpsi yang baik jika arang aktif berbentuk serbuk atau granul. Dewasa ini arang aktif banyak dimanfaatkan oleh pihak industri dalam proses pemurnian, seperti pemurnian gula, minyak dan lemak, kimia, farmasi, dan penjernihan air untuk mengadsorpsi bau, warna, gas, dan logam yang tidak diinginkan.
Selain berfunsi sebagai media penghantar panas, minyak goreng juga berfungsi sebagai penambah rasa gurih makanan serta memperbaiki cita rasa makanan dengan membentuk warna kuning kecoklatan pada saat penggorengan. Proses pemanasan tinggi pada minyak akan menghasilkan asam lemak trans. Selain itu juga akan menghasilkan senyawa karbonil, dan peroksida yang dapat menyebabkan keracunan kronis pada manusia. Minyak goreng bekas yang terus menerus digunakan umumnya mengandung senyawa berbahaya tersebut.
Pemanfaatan minyak goreng bekas yang sudah dimurnikan tentu akan sangat membantu industri yang menggunakan minyak goreng dalam proses produksinya. Penelitian sebelumnya yang dilakukan oleh Ferry (2002) dan Rasjiddin (2006) memperlihatkan bahwa serbuk gergajian kayu campuran dan tempurung biji jambu mete dapat dijadikan sebagai bahan baku pembuatan arang aktif untuk adsorben pemurnian minyak goreng bekas karena kandungan karbonnya yang tinggi. Hasil penelitian tersebut mengindikasikan bahwa limbah pertanian seperti tongkol jagung diduga dapat diolah lebih lanjut sebagai adsorben (arang aktif) terhadap minyak goreng bekas dan diharapkan mampu meningkatkan nilai tambahnya.
TINJAUAN PUSTAKA
Jagung
Jagung merupakan salah satu jenis tanaman pangan biji-bijian dari keluarga rumput-rumputan. Jagung adalah sumber pangan kedua setelah padi. Hampir 70% dari produksinya dimanfaatkan untuk konsumsi dan sisanya untuk berbagai keperluan, baik sebagai pakan ternak maupun bahan industri (Elly LR 1992). Selain sebagai sumber karbohidrat, jagung juga ditanam sebagai pakan ternak (daun dan tongkol), diambil minyaknya (dari biji), dibuat tepung (dari biji, dikenal dengan istilah tepung jagung atau maizena), furfural, bioetanol, dan bahan baku industri (dari tepung biji dan tepung tongkolnya).
Tongkol jagung kaya akan pentosa yang dipakai sebagai bahan baku pembuatan furfural. Furfural banyak digunakan sebagai pelarut dalam industri pengolahan minyak bumi, pembuatan pelumas, dan pembuatan nilon. Selain itu berfungsi sebagai senyawa antara untuk pembuatan furfuril alkohol, tetrahidrofuran, herbisida, dan aplikasi pada pewangi (Ace 2003). Inti biji jagung juga banyak dimanfaatkan sebagai penghasil minyak jagung.
Tongkol jagung sebagian besar tersusun oleh selulosa (41%), hemiselulosa (36%), lignin (6%), dan senyawa lain yang umum terdapat dalam tumbuhan (Tabel 1). Hal ini mengindikasikan kandungan karbon yang cukup tinggi. Arang yang berasal dari tongkol jagung diaktivasi secara fisik dan kimia. Aktivasi secara kimia dengan larutan asam dan basa mengarah untuk perbesaran pori arang aktif.
Arang Aktif
Arang aktif (AA) adalah arang yang telah mengalami proses aktivasi untuk meningkatkan luas permukaannya dengan jalan membuka pori-porinya sehingga daya adsorpsinya meningkat. Luas permukaan AA berkisar antara 300 dan 3500 m2/g. Daya jerap AA sangat besar, yaitu ¼ sampai 10 kali terhadap bobot arang aktif.
AA merupakan adsorben yang baik untuk adsorpsi gas, cairan, maupun larutan. Adsorpsi oleh AA bersifat fisik, artinya adsorpsi terjadi jika gaya tarik van der Waals oleh molekul-molekul di permukaan lebih kuat daripada gaya tarik yang menjaga adsorbat tetap berada dalam fluida. Adsorpsi fisik bersifat dapat balik sehingga adsorbat
yang diadsorpsi AA dapat mengalami desorpsi (Roy 1985). Sifat ini menguntungkan untuk aplikasi industri karena AA dapat dipakai berulang melalui proses regenerasi.
Pola difraksi sinar-X menunjukkan bahwa AA berbentuk grafit, amorf, tersusun dari atom-atom karbon berikatan secara kovalen membentuk struktur heksagonal datar (Gambar 1). Susunan kisi-kisi heksagonal datar ini tampak seperti pelat-pelat datar yang saling bertumpuk dengan sela-sela di antaranya. Setiap kristal arang aktif biasanya tersusun atas 3 atau 4 lapisan atom karbon dengan sekitar 20−30 atom karbon heksagonal pada tiap lapisan (Jankowska 1991)
Gambar 1 Struktur grafit AA (Jankowska 1991).
AA dapat dibuat dari bahan yang mengandung karbon. Tulang, kulit biji, kayu keras dan lunak, kulit kayu, tongkol jagung, serbuk gergaji, sekam padi, dan tempurung kelapa ialah beberapa contoh yang umum digunakan (Pari 1996). Pembuatan AA mencakup dua tahapan utama, yaitu proses karbonisasi bahan baku dan proses aktivasi bahan terkarbonisasi tersebut pada suhu lebih tinggi. Karbonisasi merupakan proses penguraian selulosa organik menjadi unsur karbon dengan disertai pengeluaran unsur-unsur non-karbon, yang berlangsung pada suhu sekitar 600-700 °C (Kienle 1986). Proses aktivasi merupakan proses untuk menghilangkan hidrokarbon yang melapisi permukaan arang sehingga dapat meningkatkan porositas karbon (Cooney 1980 dan Guerrero et al. 1970). Aktivasi AA dapat dilakukan dengan 2 cara, yaitu proses aktivasi secara fisik dan proses aktivasi kimia. Prinsip aktivasi fisik adalah pemberian uap air atau gas CO2 kepada arang yang telah dipanaskan.
Sementara, prinsip aktivasi kimia ialah perendaman arang dalam senyawa kimia sebelum dipanaskan. Diharapkan bahan pengaktif masuk di antara sela-sela lapisan heksagonal AA dan selanjutnya membuka permukaan yang tertutup. Bahan-bahan kimia yang dapat digunakan antara lain H3PO4,
ZnCl2, NH4Cl, AlCl3, HNO3, KOH, NaOH,
MgCl2 (Kienle 1986, Sudradjat & Soleh
1994).
Penggunaan AA sebagai adsorben ditentukan oleh luas permukaan, dimensi, dan distribusinya, yang bergantung pada bahan baku, kondisi pengkarbonan, dan proses pengaktifan yang digunakan. Sekarang ini, AA telah digunakan secara luas dalam industri pangan, misalnya untuk pemurnian gula dan minyak, maupun non-pangan seperti kimia dan farmasi, umumnya sebagai bahan pengadsorpsi dan pemurni yang digunakan dalam jumlah sedikit sebagai katalis (Lampiran 1). AA juga telah banyak digunakan pada sistem penjernihan air (Sriwahyuni 2002).
Adsorpsi
Adsorpsi merupakan peristiwa terakumulasinya partikel pada permukaan. Partikel yang terakumulasi dan diserap oleh permukaan disebut adsorbat dan material tempat terjadinya adsorpsi disebut adsorben atau substrat (Atkins 1999).
Proses adsorpsi terdiri atas dua tipe, yaitu adsorpsi kimia dan fisika. Adsorpsi kimia adalah tipe adsorpsi dengan cara suatu molekul menempel ke permukaan melalui pembentukan suatu ikatan kimia. Ciri-ciri adsorpsi kimia adalah terjadi pada suhu yang tinggi, jenis interaksinya kuat, berikatan kovalen antara permukaan adsorben dengan adsorbat, entalpinya tinggi (ΔH 400 kJ/mol), adsorpsi terjadi hanya pada suatu lapisan atas (monolayer), dan energi aktivasinya tinggi (Hasanah 2006).
Adsorpsi fisika adalah tipe adsorpsi dengan cara adsorbat menempel pada permukaan melalui interaksi intermolekuler yang lemah. Ciri-ciri dari adsorpsi fisika adalah terjadi pada suhu yang rendah, jenis interaksinya adalah interaksi intermolekuler (gaya van der Waals), entalpinya rendah (ΔH <20 kJ/mol), adsorpsi dapat terjadi dalam banyak lapisan (multilayer), dan energi aktivasinya rendah (Hasanah 2006).
Adsorpsi fisika terutama disebabkan oleh gaya van der Waals dan gaya elektrostatik antara molekul yang teradsorpsi dengan atom yang menyusun permukaan adsorben. Gaya van der Waals tersebut timbul sebagai akibat interaksi dipol-dipol, yang mana pada jarak antar molekul tertentu terjadi kesetimbangan antara gaya tolak dan gaya tarik. Dalam fase cair dan fase padat terdapat gaya tarik van der Waals yang relatif lebih besar dibandingkan dengan gaya tarik dalam fase gas. Gaya van der Waals terdiri dari interaksi dipol-dipol,
interaksi dipol permanen-dipol induksi, dan interaksi dispersi (dipol sementara-dipol induksi) (Suzuki 1990, diacu dalam Hasanah 2006).
Faktor-faktor yang memengaruhi proses adsorpsi antara lain sifat fisik dan kimia adsorben seperti luas permukaan, ukuran partikel, dan komposisi kimia. Semakin kecil ukuran partikel, maka semakin besar luas permukaan padatan persatuan volume tertentu, sehingga akan semakin banyak zat yang diadsorpsi. Faktor lainnya adalah sifat fisis dan kimia adsorbat, seperti ukuran molekul dan komposisi kimia, serta konsentrasi adsorbat dalam fase cairan (Atkins 1999).
Proses adsorpsi berlangsung melalui tiga tahapan, yaitu makrotransport, mikro-transport, dan sorpsi. Makrotransport meliputi perpindahan adsorbat melalui air menuju interfase cair-padat dengan proses difusi. Mikrotransport meliputi difusi adsorbat melalui sistem makropori dan submikropori. Sorpsi merupakan istilah untuk menjelaskan kontak adsorbat terhadap adsorben. Istilah ini digunakan karena sulitnya membedakan proses yang berlangsung, apakah fisiosorpsi atau kimisorpsi. Kapasitas adsorpsi suatu adsorben untuk sebuah kontaminan dapat ditentukan dengan menghitung isoterm adsorpsi.
Isoterm Adsorpsi
Hubungan kesetimbangan antara potensial kimia adsorbat dalam gas atau cairan dan potensial kimia adsorbat di permukaan adsorben pada suhu tetap dikatakan sebagai isoterm adsorpsi. Kesetimbangan tercapai jika laju pengikatan adsorben terhadap adsorbat sama dengan laju pelepasannya (Koumanova & Antova 2002).
Tipe isoterm adsorpsi yang umum dikenal ada tiga macam, yaitu isoterm Freundlich, Langmuir, dan Brenauer-Emmet-Teller (BET). Isoterm Freundlich dan Langmuir digunakan untuk gas atau larutan dengan konsentrasi rendah. Isoterm BET merupakan modifikasi isoterm Langmuir pada tekanan tinggi (Alberty & Silbey 1992).
Isoterm Freundlich
Isoterm Freundlich mengasumsikan suatu permukaan adsorpsi yang heterogen dan perbedaan energi pada sisi aktif (Koumanova & Antova 2002).
memperkirakan adanya sisi-sisi pada permukaan yang mampu mencegah adsorpsi pada kesetimbangan tercapai, hanya ada beberapa sisi aktif saja yang mampu mengadsorpsi molekul terlarut (Jason 2004).
Persamaan Freundlich dituliskan sebagai berikut:
n
C k m
x = 1/
Persamaan dalam bentuk logaritma:
C n k m x log 1 log
log = +
keterangan:
m
x = jumlah adsorbat terjerap per unit bobot
adsorben (µg/g adsorben)
C = konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi (bpj)
k, n = konstanta empiris
Isoterm Langmuir
Isoterm Langmuir didasarkan pada asumsi bahwa sejumlah tertentu sisi sentuh adsorben terdapat pada permukaan dan memiliki energi yang sama serta adsorpsi bersifat dapat balik (Atkins 1999). Menurut Ribeiro et al. (2001), isoterm Langmuir mengasumsikan setiap tempat adsorpsi adalah ekuivalen dan kemampuan partikel untuk terikat di tempat tersebut tidak bergantung pada ditempati atau tidak ditempatinya tempat yang berdekatan dan menggambarkan permukaan adsorpsi yang homogen.
Persamaan Langmuir dituliskan sebagai berikut: C C m x β β α + = 1
Konstanta α, β dapat ditentukan dari kurva hubungan
m x
C
/
terhadap C dengan
persamaan: C m x C α β α 1 1 / = +
Isoterm Brunauer, Emmet, Teller (BET) Isoterm BET merupakan metode umum untuk menentukan luas permukaan adsorben dari data adsorpsi, dengan persamaan: cn x c cn x n
x 1 ( 1)
) 1 ( − + = −
konstanta n dan c dapat diperoleh dari kemiringan garis perpotongan kurva
hubungan ) 1 ( x n x
− terhadap x.
Minyak Goreng
Lemak dan minyak merupakan suatu trigliserida yang terbentuk dari kondensasi satu molekul gliserol dengan tiga molekul asam lemak. Lemak dan minyak sebagai bahan pangan dibagi menjadi dua, yaitu lemak yang siap dikonsumsi tanpa dimasak misalnya mentega, dan lemak yang dimasak bersam-sama bahan pangan atau dijadikan sebagai medium penghantar panas dalam memasak bahan pangan misalnya minyak goreng (Ketaren 1986). Minyak goreng adalah minyak yang telah mengalami proses pemurnian yang meliputi degumming, netralisasi, pemucatan dan deodorisasi. Secara umum komponen utama yang sangat menentukan mutu minyak adalah asam lemaknya, karena asam lemak menentukan sifat kimia maupun stabilitas minyak.
Dalam proses menggoreng, minyak berfungsi sebagai penghantar panas sehingga proses pemanasan menjadi lebih efisien dibandingkan proses pemanggangan dan perebusan. Proses penggorengan akan meningkatkan cita rasa, kandungan gizi dan daya awet serta menambah nilai kalori bahan pangan. Pada proses penggorengan oksigen dapat mengoksidasi minyak dengan cepat.
Kerusakan lemak selama proses penggorengan diakibatkan oleh kontak minyak dengan udara, pemanasan yang berlebihan, kontak minyak dengan bahan pangan dan adanya partikel-partikel yang gosong.. Kerusakan minyak akibat pemanasan dapat dilihat dari perubahan warna, kenaikan kekentalan, kenaikan kandungan asam lemak bebas, kenaikan peroksida dan penurunan bilangan iodium. Kerusakan ini akan mempengaruhi mutu dan nilai gizi serta penampilan bahan pangan yang digoreng. Persyaratan mutu minyak goreng menurut SNI (1995) disajikan pada Tabel 2.
Tabel 2 Syarat mutu minyak goreng
Ciri Nilai
Maksimum
Air 0,3%(b/b) FFA 0,3%(b/b)
Bilangan Peroksida
10 mg O2/
100g Logam Berat
Timbel (Pb) 0.1 bpj
Besi (Fe) 1.5 bpj
Tembaga (Cu) 0.1 bpj
Raksa (Hg) 0.05 bpj
Arsen (As) 0.1 bpj
Minyak Pelikan negatif Keadaan (warna, bau, dan
rasa) normal
Sumber: SNI 01-3741-1995
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah tongkol jagung usia 90 hari yang berasal dari Ciampea, standar asam laurat, dan minyak goreng bekas curah (dari penggorengan pecel lele),
Alat yang digunakan untuk membuat arang aktif adalah tungku pengarangan (drum), tungku aktivasi (retort) yang dilengkapi ketel uap, peralatan kaca, dan
software statistika SPSS versi 13.0.
Metode Penelitian
Pembuatan arang aktif diawali dengan preparasi tongkol jagung (Lampiran 2). Tongkol jagung dipotong-potong dan dicuci bersih dengan air keran yang mengalir, setelah itu dikeringudarakan di bawah sinar matahari selama 7-8 hari. Selanjutnya, tongkol jagung dikarbonisasi pada tungku pengarangan (Lampiran 3) pada suhu 500 °C selama 5 jam (Bangas & Alam 2007), lalu dilanjutkan dengan proses pengaktifan.
Pengaktifan arang aktif dilakukan dengan tiga faktor, yaitu konsentrasi bahan pengaktif (NaOH 0,50% dan NaOH 0,75%), suhu pengaktifan (700 °C dan 800 °C) dan waktu pengaktifan (60 dan 120 menit). Analisis sifat arang aktif meliputi rendemen, kadar air, kadar abu, kadar zat mudah menguap, kadar karbon terikat, daya jerap iod, daya jerap benzena, dan daya jerap kloroform (Sudradjat & Soleh 1994). Sebagai pembanding juga dilakukan analisis yang sama terhadap sifat arang aktif yang diaktivasi tanpa bahan kimia
sebagai kontrol, dan arang aktif yang dibeli di pasaran.
Setelah dianalisis, kemampuan arang aktif dikaji dengan menentukan kapasitas dan efisien adsorpsinya terhadap pemurnian minyak goreng bekas curah. Sifat minyak goreng yang dianalisis sebelum dan setelah dimurnikan adalah kadar asam lemak bebas
(free fatty acid) (FFA). Percobaan
pendahuluan dilakukan untuk mendapatkan takaran optimum arang aktif yang dibutuhkan dan waktu kontak yang diperlukan. Isoterm adsorpsi juga dikaji pada standar asam laurat dengan menggunakan isoterm Freundlich dan Langmuir.
Perancangan percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak lengkap faktorial dengan dua kali ulangan. Faktor-faktor perlakuan yang digunakan adalah konsentrasi bahan kimia pengaktif, yaitu NaOH 0,50% dan 0,75%; suhu pengaktivasi, 700 °C dan 800 °C; waktu aktivasi, 60 dan 120 menit.
Model rancangan
Yijk = µ+ Ai+ Bj+ Ck+ ABij + ACik+ BCjk+
ABCijk+ Eijk
Yijk = Nilai respon yang diamati
µ = Efek rerata yang sebenarnya Ai = Pengaruh konsentrasi NaOH taraf k-i
Bj = Pengaruh suhu pengaktifan dari taraf k-j
Ck = Pengaruh waktu pengaktifan dengan
taraf ke-k
ABi = Pengaruh interaksi antara konsentrasi
NaOH taraf ke-i dan suhu aktivasi taraf ke-j
ACik = Pengaruh interaksi antara konsentrasi
NaOH taraf ke-i dan waktu pengaktifan taraf ke-k
BCjk = Pengaruh interaksi antara suhu
pengaktivasian taraf ke-j dan waktu pengaktifan taraf ke-k
ABCijk= Pengaruh interaksi antara konsentrasi
NaOH taraf ke-i, suhu aktivasi taraf ke-j,dan waktu pengaktifan taraf ke-k
Eijk = Galat dari rancangan faktorial Pembuatan arang aktif (Ferry 2002)
Sejumlah tongkol jagung dimasukkan ke dalam tungku pengarangan (drum) dan dipanaskan dengan nyala api, bara yang terbentuk diambil dan dipadamkan dengan tanah. Arang yang terbentuk kemudian dikeringkan. AA dibuat dengan cara perendaman dengan NaOH 0,5% dan 0,75% dilanjutkan dengan HCl: HNO3 (1:1) 0,2N
Tabel 2 Syarat mutu minyak goreng
Ciri Nilai
Maksimum
Air 0,3%(b/b) FFA 0,3%(b/b)
Bilangan Peroksida
10 mg O2/
100g Logam Berat
Timbel (Pb) 0.1 bpj
Besi (Fe) 1.5 bpj
Tembaga (Cu) 0.1 bpj
Raksa (Hg) 0.05 bpj
Arsen (As) 0.1 bpj
Minyak Pelikan negatif Keadaan (warna, bau, dan
rasa) normal
Sumber: SNI 01-3741-1995
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah tongkol jagung usia 90 hari yang berasal dari Ciampea, standar asam laurat, dan minyak goreng bekas curah (dari penggorengan pecel lele),
Alat yang digunakan untuk membuat arang aktif adalah tungku pengarangan (drum), tungku aktivasi (retort) yang dilengkapi ketel uap, peralatan kaca, dan
software statistika SPSS versi 13.0.
Metode Penelitian
Pembuatan arang aktif diawali dengan preparasi tongkol jagung (Lampiran 2). Tongkol jagung dipotong-potong dan dicuci bersih dengan air keran yang mengalir, setelah itu dikeringudarakan di bawah sinar matahari selama 7-8 hari. Selanjutnya, tongkol jagung dikarbonisasi pada tungku pengarangan (Lampiran 3) pada suhu 500 °C selama 5 jam (Bangas & Alam 2007), lalu dilanjutkan dengan proses pengaktifan.
Pengaktifan arang aktif dilakukan dengan tiga faktor, yaitu konsentrasi bahan pengaktif (NaOH 0,50% dan NaOH 0,75%), suhu pengaktifan (700 °C dan 800 °C) dan waktu pengaktifan (60 dan 120 menit). Analisis sifat arang aktif meliputi rendemen, kadar air, kadar abu, kadar zat mudah menguap, kadar karbon terikat, daya jerap iod, daya jerap benzena, dan daya jerap kloroform (Sudradjat & Soleh 1994). Sebagai pembanding juga dilakukan analisis yang sama terhadap sifat arang aktif yang diaktivasi tanpa bahan kimia
sebagai kontrol, dan arang aktif yang dibeli di pasaran.
Setelah dianalisis, kemampuan arang aktif dikaji dengan menentukan kapasitas dan efisien adsorpsinya terhadap pemurnian minyak goreng bekas curah. Sifat minyak goreng yang dianalisis sebelum dan setelah dimurnikan adalah kadar asam lemak bebas
(free fatty acid) (FFA). Percobaan
pendahuluan dilakukan untuk mendapatkan takaran optimum arang aktif yang dibutuhkan dan waktu kontak yang diperlukan. Isoterm adsorpsi juga dikaji pada standar asam laurat dengan menggunakan isoterm Freundlich dan Langmuir.
Perancangan percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak lengkap faktorial dengan dua kali ulangan. Faktor-faktor perlakuan yang digunakan adalah konsentrasi bahan kimia pengaktif, yaitu NaOH 0,50% dan 0,75%; suhu pengaktivasi, 700 °C dan 800 °C; waktu aktivasi, 60 dan 120 menit.
Model rancangan
Yijk = µ+ Ai+ Bj+ Ck+ ABij + ACik+ BCjk+
ABCijk+ Eijk
Yijk = Nilai respon yang diamati
µ = Efek rerata yang sebenarnya Ai = Pengaruh konsentrasi NaOH taraf k-i
Bj = Pengaruh suhu pengaktifan dari taraf k-j
Ck = Pengaruh waktu pengaktifan dengan
taraf ke-k
ABi = Pengaruh interaksi antara konsentrasi
NaOH taraf ke-i dan suhu aktivasi taraf ke-j
ACik = Pengaruh interaksi antara konsentrasi
NaOH taraf ke-i dan waktu pengaktifan taraf ke-k
BCjk = Pengaruh interaksi antara suhu
pengaktivasian taraf ke-j dan waktu pengaktifan taraf ke-k
ABCijk= Pengaruh interaksi antara konsentrasi
NaOH taraf ke-i, suhu aktivasi taraf ke-j,dan waktu pengaktifan taraf ke-k
Eijk = Galat dari rancangan faktorial Pembuatan arang aktif (Ferry 2002)
Sejumlah tongkol jagung dimasukkan ke dalam tungku pengarangan (drum) dan dipanaskan dengan nyala api, bara yang terbentuk diambil dan dipadamkan dengan tanah. Arang yang terbentuk kemudian dikeringkan. AA dibuat dengan cara perendaman dengan NaOH 0,5% dan 0,75% dilanjutkan dengan HCl: HNO3 (1:1) 0,2N
suhu 700 °C dan 800 °C, kemudian ke dalam tungku tersebut diberi aliran uap air selama 60 dan 120 menit.
AA yang terbentuk dibiarkan dingin selama 24 jam, lalu ditimbang dan dihitung rendemennya. Sebelum AA diperlakukan lebih lanjut, AA disimpan di kantung plastik yang kering dan tertutup rapat. AA kemudian dihancurkan, digerus dengan mortar dan disaring dengan saringan berukuran 100 mesh dan selanjutnya siap untuk dianalisis kualitasnya. (Catatan: setelah ditentukan kadar airnya, AA harus disimpan di dalam oven bersuhu 105 oC).
Pemurnian minyak (Ketaren 1986)
Sebelum digunakan AA disimpan dalam oven bersuhu 105 oC selama 2 jam. Percobaan pendahuluan untuk mendapatkan jumlah AA yang dibutuhkan, dilakukan dengan cara memasukkan sejumlah AA dengan variasi bobot: 0; 0,25; 5,0; 7,5; dan 10,0% (b/v) ke dalam 25 ml standar asam laurat, kemudian dikocok dengan pengocok pada suhu kamar selama 1 jam. Setelah itu, disaring kemudian diukur kadar FFA-nya.
Penentuan waktu optimum dilakukan dengan menggunakan bobot tetap arang aktif yang diperoleh dari optimasi bobot ke dalam 25 ml standar asam laurat, kemudian dikocok dengan pengocok pada ragam waktu: 60; 90; dan 120 menit. Setelah itu, sampel disaring dan diukur kadar FFA-nya.
Bobot dan waktu optimum adsorpsi ditentukan dari kapasitas adsorpsi maksimum dari AA terbaik. Dihitung juga efisiensi adsorpsinya untuk AA terbaik. Kapasitas adsorpsi dihitung dengan persamaan:
Q =
m C C V( o− a)
Sedangkan efisien adsorpsi dihitung dengan persamaan:
Efisiensi = − ×100% o a o C C C dengan
Q = kapasitas adsorpsi per bobot karbon aktif (µg/g arang aktif)
V = volume larutan (ml)
Co = konsentrasi awal larutan (bpj)
Ca = konsentrasi akhir larutan (bpj)
m = bobot arang aktif (g)
Pencirian arang aktif
Penetapan rendemen (ASTM 1979)
Arang aktif yang diperoleh terlebih dahulu dibersihkan, kemudian ditimbang. Rendemen dihitung berdasarkan rumus:
Rendemen (%) = 100%
) 1 ( ) 1 ( x d a c b − −
a = bobot contoh sebelum pemanasan (g) b = bobot contoh setelah pemanasan (g) c = kadar air arang aktif (%)
d = kadar air arang (%)
Penetapan kadar air (SNI 1995)
Sebanyak 1 g AA ditempatkan dalam cawan porselin yang telah diketahui bobot keringnya. Cawan yang berisi sampel dikeringkan dalam oven pada suhu 105 °C selama 3 jam sampai bobotnya konstan dan didinginkan di dalam deksikator lalu ditimbang. Pengeringan dan penimbangan diulangi setiap 1 jam sampai diperoleh bobot konstan. Analisis dilakukan duplo. Perhitungan kadar air menggunakan persamaan:
Kadar air (%) =
(
)
x
100
%
a
b
a
−
a = bobot sampel sebelum pemanasan (g) b = bobot sampel sesudah pemanasan (g)
Penetapan kadar zat mudah menguap(SNI 1995)
Sebanyak +1 g AA dimasukkan ke dalam cawan porselin yang telah diketahui bobot keringnya. Selanjutnya sampel dipanaskan dalam tanur 950 °C selama 10 menit, kemudian didinginkan dalam desikator dan ditimbang. Cawan ditutup serapat mungkin. Analisis dilakukan duplo. Perhitungan kadar zat mudah menguap menggunkan persamaan:
Kadar zat mudah menguap (%) =
% 100 x a b a−
a = bobot sampel sebelum pemanasan (g) b = bobot sampel sesudah pemanasan (g)
Penetapan kadar abu(SNI 1995)
a fp iod N O S Na N B
A− × 2 2 3 ×12,693×
g
BM N NaOH
mL × ×
sampai diperoleh bobot konstan. Analisis dilakukan duplo. Perhitungan kadar abu menggunakan persamaan:
Kadar abu (%) = x100%
a b
a = bobot awal sampel (g) b = bobot sisa sampel (g)
Penetapan kadar karbon terikat (SNI 1995) Karbon dalam arang adalah zat yang terdapat pada fraksi padat hasil pirolisis, selain abu (zat anorganik) dan zat-zat atsiri yang masih terdapat pada pori-pori arang. Definisi ini hanya berupa pendekatan (SNI 1995). Perhitungan kadar karbon terikat menggunakan persamaan:
Kadar karbon terikat (%) = 100%−(b+c)
b = kadar zat mudah menguap (%) c = kadar abu (%)
Penetapan daya jerap iodin (SNI 1995) Sampel kering sebanyak 0,25 g dimasukkan ke dalam Erlenmeyer yang ditutup alumunium foil lalu ditambahkan 25 ml larutan I2 0,1N
dan dikocok selama 15 menit lalu disaring. Filtrat sebanyak 10 ml dititrasi dengan Na2S2O3 0,1N hingga berwarna kuning muda,
kemudian ditambahkan beberapa tetes amilum 1%, titrasi dilanjutkan sampai warna biru tepat hilang. Hal yang sama dilakukan terhadap blanko.
Daya jerap iodin (mg/g) =
A = volume titrasi (ml)
B = volume Na2S2O3 terpakai (ml)
fp = faktor pengenceran a = bobot AA (g)
12,693 = jumlah iod sesuai dengan 1 ml larutan Na2S2O3 0,1N
Penetapan daya jerap benzena (C6H6) dan kloroform (CHCl3) (ASTM 1979)
Sampel kering sebanyak 1 gram dimasukkan ke dalam cawan petri yang telah diketahui bobot keringnya. Cawan yang berisi contoh tersebut kemudian dimasukkan ke dalam desikator yang telah dijenuhkan dengan uap benzena/ kloroform dan diinkubasi pada suhu 19-20 °C selama 24 jam agar kesetimbangan absorpsi tercapai. Sebelum ditimbang cawan yang berisi AA tersebut dibiarkan selama 5 menit di udara terbuka
agar uap benzena/ kloroform yang menempel di cawan petri dapat dihilangkan.
Daya jerap C6H6 atau CHCl3 (%) =
% 100 x a a b−
a = bobot contoh sebelum inkubasi (g) b = bobot contoh setelah inkubasi (g)
Isoterm adsorpsi standar asam laurat oleh arang aktif
AA terbaik sejumlah bobot optimum dimasukkan ke dalam larutan standar asam laurat dengan variasi konsentrasi 2000, 3000, 4000, dan 5000 bpj, kemudian dikocok dengan pengocok pada suhu kamar selama waktu optimum. Setelah itu, sampel disaring dan diukur kadar FFA nya. Tetapan adsorpsi dihitung dengan model isoterm Freundlich dan Langmuir.
Pemurnian minyak goreng bekas Penetapan kadar asam lemak bebas/ free
fatty acid (FFA) (AOAC 1999)
Sampel minyak ditimbang ke dalam Erlenmeyer 250 ml dengan bobot antara 10 dan 20 g. Ke dalam sampel ditambahkan etanol 95% panas dan indikator fenolftalein kemudian dikocok. Larutan dititrasi dengan larutan NaOH 0,1N yang telah distandardisasi.
Kadar Asam Lemak Bebas (%) =
N = Normalitas larutan NaOH BM = Bobot molekul asam laurat g = bobot sampel yang diuji
HASIL DAN PEMBAHASAN
Arang
Kondisi fisik arang adalah berwarna hitam cukup pekat. Hasil analisis arang menunjukkan bahwa hampir semua parameter uji yang digunakan telah masuk dalam SNI 1999 kecuali pada parameter daya jerap iodin (Lampiran 6). Hal ini mengindikasikan bahwa arang yang terbuat dari tongkol jagung berpotensi untuk dijadikan arang aktif. Hampir semua parameter uji menunjukkan arang lebih baik kualitasnya jika dibandingkan dengan arang aktif komersial.
Arang Aktif
a fp iod N O S Na N B
A− × 2 2 3 ×12,693×
g
BM N NaOH
mL × ×
sampai diperoleh bobot konstan. Analisis dilakukan duplo. Perhitungan kadar abu menggunakan persamaan:
Kadar abu (%) = x100%
a b
a = bobot awal sampel (g) b = bobot sisa sampel (g)
Penetapan kadar karbon terikat (SNI 1995) Karbon dalam arang adalah zat yang terdapat pada fraksi padat hasil pirolisis, selain abu (zat anorganik) dan zat-zat atsiri yang masih terdapat pada pori-pori arang. Definisi ini hanya berupa pendekatan (SNI 1995). Perhitungan kadar karbon terikat menggunakan persamaan:
Kadar karbon terikat (%) = 100%−(b+c)
b = kadar zat mudah menguap (%) c = kadar abu (%)
Penetapan daya jerap iodin (SNI 1995) Sampel kering sebanyak 0,25 g dimasukkan ke dalam Erlenmeyer yang ditutup alumunium foil lalu ditambahkan 25 ml larutan I2 0,1N
dan dikocok selama 15 menit lalu disaring. Filtrat sebanyak 10 ml dititrasi dengan Na2S2O3 0,1N hingga berwarna kuning muda,
kemudian ditambahkan beberapa tetes amilum 1%, titrasi dilanjutkan sampai warna biru tepat hilang. Hal yang sama dilakukan terhadap blanko.
Daya jerap iodin (mg/g) =
A = volume titrasi (ml)
B = volume Na2S2O3 terpakai (ml)
fp = faktor pengenceran a = bobot AA (g)
12,693 = jumlah iod sesuai dengan 1 ml larutan Na2S2O3 0,1N
Penetapan daya jerap benzena (C6H6) dan kloroform (CHCl3) (ASTM 1979)
Sampel kering sebanyak 1 gram dimasukkan ke dalam cawan petri yang telah diketahui bobot keringnya. Cawan yang berisi contoh tersebut kemudian dimasukkan ke dalam desikator yang telah dijenuhkan dengan uap benzena/ kloroform dan diinkubasi pada suhu 19-20 °C selama 24 jam agar kesetimbangan absorpsi tercapai. Sebelum ditimbang cawan yang berisi AA tersebut dibiarkan selama 5 menit di udara terbuka
agar uap benzena/ kloroform yang menempel di cawan petri dapat dihilangkan.
Daya jerap C6H6 atau CHCl3 (%) =
% 100 x a a b−
a = bobot contoh sebelum inkubasi (g) b = bobot contoh setelah inkubasi (g)
Isoterm adsorpsi standar asam laurat oleh arang aktif
AA terbaik sejumlah bobot optimum dimasukkan ke dalam larutan standar asam laurat dengan variasi konsentrasi 2000, 3000, 4000, dan 5000 bpj, kemudian dikocok dengan pengocok pada suhu kamar selama waktu optimum. Setelah itu, sampel disaring dan diukur kadar FFA nya. Tetapan adsorpsi dihitung dengan model isoterm Freundlich dan Langmuir.
Pemurnian minyak goreng bekas Penetapan kadar asam lemak bebas/ free
fatty acid (FFA) (AOAC 1999)
Sampel minyak ditimbang ke dalam Erlenmeyer 250 ml dengan bobot antara 10 dan 20 g. Ke dalam sampel ditambahkan etanol 95% panas dan indikator fenolftalein kemudian dikocok. Larutan dititrasi dengan larutan NaOH 0,1N yang telah distandardisasi.
Kadar Asam Lemak Bebas (%) =
N = Normalitas larutan NaOH BM = Bobot molekul asam laurat g = bobot sampel yang diuji
HASIL DAN PEMBAHASAN
Arang
Kondisi fisik arang adalah berwarna hitam cukup pekat. Hasil analisis arang menunjukkan bahwa hampir semua parameter uji yang digunakan telah masuk dalam SNI 1999 kecuali pada parameter daya jerap iodin (Lampiran 6). Hal ini mengindikasikan bahwa arang yang terbuat dari tongkol jagung berpotensi untuk dijadikan arang aktif. Hampir semua parameter uji menunjukkan arang lebih baik kualitasnya jika dibandingkan dengan arang aktif komersial.
Arang Aktif
Sebelum digunakan tongkol jagung dijemur di bawah sinar matahari selama 7-8 hari dengan tujuan untuk mengurangi kandungan air. Pada analisis awal, diperoleh kadar air pada tongkol jagung sebesar 10,7% (Lampiran 4). Besarnya nilai kadar air yang diperolah sangat berpengaruh terhadap rendemen yang dihasilkan, yaitu sebesar 70,5%. Hal ini hampir sesuai dengan pendapat Lorenz dan Kulp (1991), yang menyebutkan bahwa tongkol jagung memiliki kadar air sebesar 9.60%.
Tongkol jagung selanjutnya dikarbonisasi menjadi arang menggunakan tungku pemanas (drum) dengan nyala api pada suhu antara 400 dan 500 °C selama 4 jam. Selama proses berlangsung drum dijaga dalam keadaan sistem tertutup, agar tidak ada oksigen yang masuk sehingga mencegah terbentuknya abu. Pada proses karbonisasi diharapkan terjadi proses penguraian selulosa organik menjadi unsur karbon dan pengeluaran unsur-unsur nonkarbon. Arang yang terbentuk kemudian diaktivasi. Pengaktifan arang dilakukan dengan menggunakan alat retort (tungku aktivasi) yang terbuat dari baja tahan karat, dan dilengkapi dengan alat pemanas listrik sehingga tidak ada udara yang masuk. Retort
ini juga dilengkapi dengan pengatur suhu sehingga pengaktifan menjadi lebih merata dan sempurna.
Rendemen
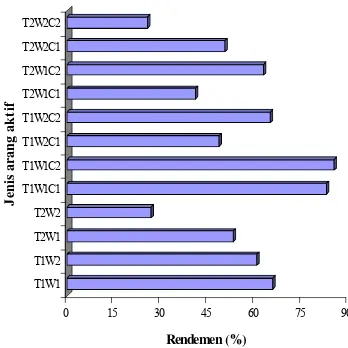
Penetapan rendemen arang aktif bertujuan untuk mengetahui jumlah arang aktif yang dihasilkan dari proses karbonasi dan aktivasi. Perhitungan rendemen didasarkan pada bobot kering oven bahan baku. Rendemen arang aktif yang dihasilkan dipengaruhi oleh cara pengaktifan. Rendemen yang dihasilkan berkisar antara 25,6% dan 84,8,%. Rendemen tertinggi terdapat pada arang yang diaktivasi pada suhu 700 ºC selama 60 menit dengan kombinasi NaOH 0,75%, sedangkan rendemen terkecil terdapat pada arang yang diaktivasi pada suhu 800 ºC dengan kombinasi NaOH 0,75 % selama 120 menit.
Hasil penelitian menunjukkan bahwa jenis bahan baku, bentuk bahan baku (serbuk atau granulat), konsentrasi NaOH dan lamanya aktivasi berpengaruh terhadap rendemen arang aktif. Hampir semua rendemen menurun setelah peningkatan suhu. Teori kinetika menyebutkan bahwa semakin tinggi suhu reaksi maka laju reaksi akan bertambah cepat. Peningkatan suhu akan mempercepat laju reaksi antara karbon dan uap air sehingga banyak karbon yang terkonversi menjadi H2O
dan CO2 dan semakin sedikit karbon yang
tersisa. Hal ini mengakibatkan rendemen arang aktif rendah (Hudaya & Hartoyo 1990).
Peningkatan waktu aktivasi cenderung dapat menurunkan rendemen (Gambar 2). Hal ini disebabkan oleh dengan semakin lama waktu aktivasi maka kemungkinan terjadinya reaksi antara arang dengan zat pengoksidasi/pengaktif membentuk CO, CO2,
dan H2 juga semakin meningkat sehingga
arang aktif yang terbentuk berkurang.
0 15 30 45 60 75 90
Rendemen (%) T1W1 T1W2 T2W1 T2W2 T1W1C1 T1W1C2 T1W2C1 T1W2C2 T2W1C1 T2W1C2 T2W2C1 T2W2C2 J en is a ra n g a k ti f
Gambar 2 Rendemen beberapa jenis AA.
Perlakuan
T1 = 700 °C C1 = NaOH 0,5% T2 = 800 °C C2 = NaOH 0,75% W1 = 60 menit TA = tanpa aktivasi W2 = 120 menit AAK =arang aktif komersial Kadar air
Penetapan kadar air AA bertujuan untuk mengetahui sifat higroskopis AA. Perhitungan kadar air AA ini didasarkan pada bobot kering oven AA. Kadar air AA yang diperoleh bekisar antara 4,4% dan 9%. Nilai ini memenuhi persyaratan Standar Indonesia (SNI 1995) (Lampiran 5), yaitu kurang dari 15%. Kadar air tertinggi terdapat pada AA yang diaktivasi pada suhu 700 ºC selama 60 menit dan dikombinasikan dengan aktivasi gas dari uap air. Kadar air terendah terdapat pada AA yang diaktivasi dengan bahan pengaktif NaOH 0,5% yang dikombinasikan dengan aktivasi gas dari uap air pada suhu 700 ºC selama 120 menit.
Gambar 3 menunjukkan bahwa perendaman dengan bahan pengaktif NaOH menyebabkan menurunnya kadar air. Hal ini mungkin disebabkan oleh natrium hidroksida yang sangat higroskopis sehingga H2O yang
(2004), bahwa bahan pengaktif yang bersifat higroskopis dapat menurunkan kadar air. Bila dibandingkan dengan arang aktif komersialpun kadar air arang aktif yang dihasilkan juga memiliki nilai yang lebih rendah. Hasil analisis ragam (Lampiran 7), menunjukkan bahwa perlakuan suhu, waktu, dan konsentrasi NaOH maupun interaksinya berpengaruh nyata pada kadar air arang aktif.
0 1 2 3 4 5 6 7 8 9 10 11 12 13
Kadar air (%) TA T1W1 T1W2 T2W1 T2W2 T1W1C1 T1W1C2 T1W2C1 T1W2C2 T2W1C1 T2W1C2 T2W2C1 T2W2C2 AAK J en is a ra n g a k ti f
Gambar 3 Kadar air (%) beberapa jenis AA.
Kadar zat mudah menguap
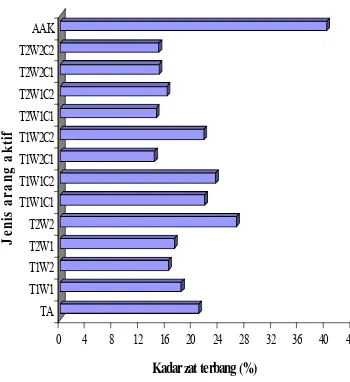
Penetapan kadar zat mudah menguap bertujuan mengetahui jumlah zat atau senyawa yang belum menguap pada proses karbonisasi dan aktivasi. Besarnya kadar zat mudah menguap mengarah kepada kemampuan daya jerap AA. Kadar zat mudah menguap yang tinggi akan mengurangi daya jerap AA tersebut. Kadar zat mudah menguap AA yang dibuat berkisar antara 14,2% dan 26,5% (Gambar 4). Hampir semua nilai tersebut telah memenuhi Standar Indonesia (SNI 1995), yaitu kurang dari 25%.
Kadar zat mudah menguap tertinggi terdapat pada AA yang diaktivasi pada suhu 800 ºC selama 120 menit, sedangkan yang terendah yaitu AA yang diaktivasi pada suhu 700 ºC selama 120 menit dengan kombinasi NaOH 0,5%. Kandungan zat mudah menguap ini praktis menunjukkan perubahan yang berarti dengan pengaruh suhu dan konsentrasi. Sementara itu, waktu aktivasi tidak berpengaruh nyata (Lampiran 8). Hasil uji Duncan (Lampiran 8) terhadap interaksi suhu , konsentrasi, dan waktu aktivasi menunjukkan bahwa suhu 700 ºC dengan kombinasi NaOH 0,5% selama 120 menit akan menghasilkan zat mudah menguap yang paling rendah, walaupun secara statistik nilai ini tidak berbeda nyata apabila dilakukan pada suhu 800 ºC.
0 4 8 12 16 20 24 28 32 36 40 44
Kadar zat terbang (%)
TA T1W1 T1W2 T2W1 T2W2 T1W1C1 T1W1C2 T1W2C1 T1W2C2 T2W1C1 T2W1C2 T2W2C1 T2W2C2 AAK J e n is a r a n g a k ti f
Gambar 4 Kadar zat mudah menguap (%) beberapa jenis AA
Kadar abu
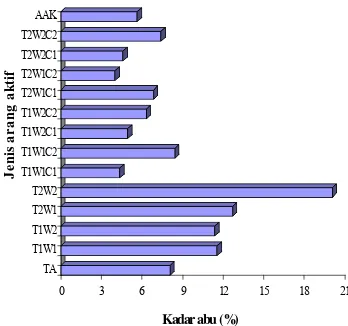
Penetapan kadar abu bertujuan menentukan kandungan oksida logam dalam AA. Kadar abu AA berkisar antara 4,4 dan 20,1%. Semua AA yang tidak diaktivasi dengan bahan pengaktif memiliki kadar abu di atas Standar Indonesia (SNI 1995), yaitu diatas 10% (Gambar 5). Sementara itu, terjadi hal yang sebaliknya untuk AA yang diaktivasi dengan bahan kimia. Hal ini mengindikasikan bahwa bahan kimia pengaktivasi berpengaruh terhadap kadar abu dari AA. Pernyataan ini diperkuat berdasarkan analisis ragam (Lampiran 9), yang menunjukkan bahwa suhu, konsentrasi, dan waktu aktivasi serta interaksi antara suhu, waktu aktivasi, dan konsentrasi berpengaruh nyata terhadap kadar abu arang aktif. Sementara itu, dari hasil uji Duncan (Lampiran 9) didapatkan bahwa AA pada suhu 800 ºC selama 60 menit dengan kombinasi NaOH 0,75% memiliki kadar abu terendah.
0 3 6 9 12 15 18 21
Kadar abu (%)
TA T1W1 T1W2 T2W1 T2W2 T1W1C1 T1W1C2 T1W2C1 T1W2C2 T2W1C1 T2W1C2 T2W2C1 T2W2C2 AAK J e n is a r a n g a k ti f
Gambar 5 Kadar abu (%) beberapa jenis AA
Kadar karbon terikat
Penetapan kadar karbon terikat bertujuan mengetahui kandungan karbon setelah proses karbonisasi dan aktivasi. Kadar karbon terikat AA berkisar antara 53,4% dan 80,9%. Jika dibandingkan dengan AA komersial hampir semua kadarnya lebih tinggi dan memenuhi Standar Indonesia (SNI 1995), yaitu kadarnya lebih dari 65%, kecuali arang yang diaktivasi tanpa perendaman bahan pengaktif pada suhu 800 ºC selama 120 menit. Informasi ini dapat dilihat pada kurva yang disajikan dalam Gambar 6. Hal ini kemungkinan terjadi karena proses pengarangan yang tidak sempurna dan berlangsung di tempat terbuka, sehingga memungkinkan proses oksidasi oleh oksigen terus berjalan dan menyebabkan arang berubah menjadi abu. Semakin tinggi kadar abu maka semakin kecil kadar karbon terikat. Hal ini juga diperkuat oleh Pari (2004), bahwa kadar karbon terikat dipengaruhi oleh kadar abu.
Kadar karbon terikat tertinggi terdapat pada arang yang diaktivasi dengan perendaman bahan pengaktif pada suhu 800 ºC selama 60 menit, sedangkan yang terendah terdapat pada arang yang diaktivasi pada suhu 800 ºC selama 120 menit. Berdasarkan analisis ragam (Lampiran 10) menunjukkan bahwa perlakuan suhu dan waktu aktivasi tidak berpengaruh nyata terhadap kadar karbon terikat arang aktif. Dari uji Duncan didapatkan bahwa aktivasi pada suhu 700 ºC, konsentrasi NaOH 0,5% selama 60 menit akan menghasilkan kadar karbon terikat tertinggi (Lampiran 10).
0 15 30 45 60 75 90
Kadar karbon terikat (%)
TA T1W1 T1W2 T2W1 T2W2 T1W1C1 T1W1C2 T1W2C1 T1W2C2 T2W1C1 T2W1C2 T2W2C1 T2W2C2 AAK Jen is ar a n g ak ti f
Gambar 6 Kadar karbon terikat (%) beberapa jenis AA
Daya jerap benzena
Daya jerap AA berkisar antara 11,4% dan 30,6%. Nilai tertinggi terdapat pada arang yang diaktivasi pada suhu 800 ºC selama 120 menit dan dikombinasikan dengan NaOH 0,5%, sedangkan yang terendah terdapat pada arang yang tidak diaktivasi. Dari Gambar 8 terlihat bahwa hampir semua nilai daya jerap benzena pada AA di atas nilai AA komersial. Standar Indonesia untuk daya jerap benzena pada AA yang berukuran serbuk belum ada. Ada kecenderungan daya jerap benzena meningkat seiring dengan lamanya aktivasi pada AA yang tanpa dan dipengaruhi bahan pengaktif (Gambar 7). Terlihat juga pada Gambar 8 bahwa bahan pengaktif NaOH mempengaruhi daya jerap benzena. Nilai daya jerap benzena AA yang diaktivasi dengan NaOH cenderung menurun jika dibandingkan yang tidak diaktivasi. Hal ini mungkin disebabkan oleh natrium tidak melebur sempurna dan tersisa sehingga menutupi permukaan AA pada saat proses karbonisasi dan aktivasi suhu 700 dan 800 ºC.
0 5 10 15 20 25 30 35
Daya jerap benzena (%) TA T1W1 T1W2 T2W1 T2W2 T1W1C1 T1W1C2 T1W2C1 T1W2C2 T2W1C1 T2W1C2 T2W2C1 T2W2C2 AAK Jen is ara n g a k ti f
Gambar 7 Daya jerap benzena beberapa jenis AA
Besarnya nilai daya jerap benzena menunjukkan kemampuan AA untuk menjerap senyawa yang bersifat nonpolar. Artinya pori-pori pada permukaan AA sedikit mengandung senyawa nonkarbon sehingga gas atau uap yang dapat diserap menjadi lebih banyak (Pari 1996).
Daya jerap kloroform
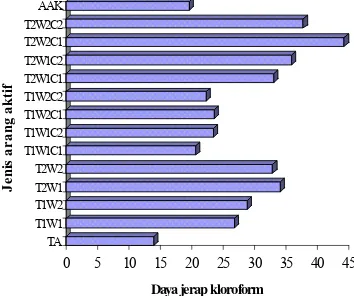
Daya jerap kloroform berkisar antara 13,%9-44,3%. Nilai tertinggi terdapat pada arang yang diaktivasi pada suhu 800 ºC selama 120 menit dan dikombinasikan dengan NaOH 0,5%, sedangkan yang terendah terdapat pada arang yang tidak diaktivasi. Hal ini mengindikasikan bahwa perendaman dengan NaOH akan memperbesar pori-pori AA sehingga daya jerapnya meningkat.
Dari Gambar 8 terlihat bahwa hampir semua nilai daya jerap kloroform di bawah 40%. Rendahnya daya jerap kloroform mungkin disebabkan oleh masih adanya senyawa nonkarbon yang menempel pada permukaan atau menutupi pori-pori AA yang tidak keluar saat proses aktivasi. Daya jerap AA terhadap kloroform dipengaruhi oleh tingkat kepolaran permukaan AA. Semakin besar daya jerap terhadap kloroform menunjukkan permukaan AA banyak mengandung senyawa yang bersifat polar seperti fenol, aldehida, dan karboksilat (Rasjiddin 2006).
Daya jerap kloroform yang dihasilkan ternyata lebih besar dari daya jerap benzena. Hal ini menunjukkan bahwa AA yang dihasilkan memiliki kemampuan yang lebih baik untuk menjerap senyawa yang bersifat polar dibandingkan dengan senyawa nonpolar.
Hasil analisis ragam (Lampiran 12) menunjukkan bahwa pelakuan suhu dan waktu aktivasi berpengaruh nyata terhadap daya
jerap kloroform arang aktif. Sementara itu, dari hasil uji Duncan (Lampiran 12) didapatkan bahwa aktivasi pada suhu 800 ºC dengan konsentrasi NaOH 0,5% selama 120 menit menghasilkan daya jerap kloroform tertinggi.
0 5 10 15 20 25 30 35 40 45
Daya jerap kloroform
TA T1W1 T1W2 T2W1 T2W2 T1W1C1 T1W1C2 T1W2C1 T1W2C2 T2W1C1 T2W1C2 T2W2C1 T2W2C2 AAK J e n is a r a n g a k ti f
Gambar 8 Daya jerap kloroform beberapa jenis AA
Daya jerap iodin
Penetapan daya jerap AA terhadap iodin merupakan persyaratan umum untuk menilai kualitas AA. Daya jerap iodin AA yang dibuat berkisar antara 359,5%-1050,5%. Nilai tertinggi terdapat pada arang yang diaktivasi pada suhu 800 ºC selama 120 menit dan dikombinasikan dengan NaOH 0,5%, sedangkan yang terendah terdapat pada arang yang tanpa diaktivasi. Dari Gambar 9 terlihat bahwa semua arang yang diaktivasi baik dengan cara fisik maupun fisik dan kimia memiliki daya jerap iodin yang telah memenuhi Standar Indonesia (SNI 1995), yaitu lebih besar dari 750 mg/g. Hal yang sama juga terjadi ketika daya jerap iodin AA dibandingkan dengan AA komersial. Namun, hanya satu AA yang memenuhi Standar Jepang (JIS 1967) karena daya jerap terhadap iodin lebih dari 1050 mg/g, yaitu arang yang diaktivasi pada suhu 800 ºC selama 120 menit dan dikombinasikan dengan NaOH 0,5%.
0 100 200 300 400 500 600 700 800 900 1000 1100 Daya jerap iodin
TA T1W1 T1W2 T2W1 T2W2 T1W!C1 T1W1C2 T1W2C1 T1W2C2 T2W1C1 T2W1C2 T2W2C1 T2W2C2 AAK J e n is a ra n g a k tif cc
Gambar 9 Daya jerap iodin beberapa jenis AA.
Berdasarkan hasil analisis ragam (Lampiran 13) didapatkan bahwa pelakuan suhu, lama aktivasi, dan konsentrasi serta interaksi ketiga perlakuan berpengaruh nyata terhadap daya jerapa iodin arang aktif. Dari hasil uji Duncan (Lampiran 13) didapatkan bahwa aktivasi 800 ºC yang dikombinasikan dengan NaOH 0,5% selama 120 menit akan menghasilkan daya jerap iod tertinggi.
Penggunaan Arang Aktif untuk Pemurnian Minyak Goreng Bekas Berdasarkan hasil pencirian AA dengan parameter daya jerap iodin, maka terpilih AA secara fisik terbaik ialah arang yang diaktivasi pada suhu 800 ºC selama 60 menit. Sementara itu, AA secara fisik dan kimia terbaik ialah arang yang diaktivasi pada suhu 800 ºC selama 120 menit dan dikombinasikan dengan perendaman NaOH konsentrasi 0, 5%. Kedua AA terbaik tersebut kemudian di uji sebagai adsorben untuk pemurnian minyak goreng bekas. Sebelumnya dilakukan uji pendahuluan untuk mendapatkan nilai bobot dan waktu optimum yang akan digunakan pada standar asam laurat. Uji pendahuluan ini menggunakan standar asam laurat karena asam laurat merupakan asam lemak bebas yang paling dominan dalam minyak goreng yang terbuat dari kelapa sawit. Nilai bobot dan waktu optimum yang didapat juga digunakan untuk penentuan isoterm adsorpsi.
Uji pendahuluan
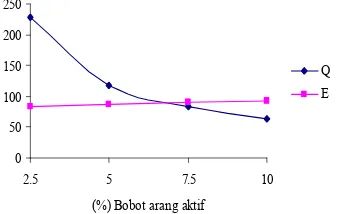
Konsentrasi asam laurat yang digunakan untuk uji pendahuluan adalah 0,3% (b/b). Konsentrasi campuran asam laurat dan AA terbaik ditentukan berdasarkan kapasitas adsorpsi dan presentase penjerapannya selama rentang waktu 60 menit untuk setiap variasi konsentrasi. Berdasarkan hasil uji pendahuluan didapatkan konsentrasi terbaik
untuk AA secara fisik maupun secara fisik dan kimia berturut turut adalah 7,04% (b/v) dan 7,08% (b/v) (Lampiran 14). Nilai ini didapatkan dari perpotongan garis kapasitas adsorpsi dan presentase penjerapan asam laurat oleh AA dalam satu kurva (Gambar 10 dan 11). 0 50 100 150 200 250
2.5 5 7.5 10
(%) Bobot arang aktif
Q E
Gambar 10 Konsentrasi optimum berdasarkan perpotongan kapasitas adsorpsi dengan efisiensi pada AA (800 ºC,60')
keterangan :
Q = Kapasitas adsorpsi (mg/ g) E = Efisiensi (%)
0 20 40 60 80 100 120 140 160 180
2.5 5 7.5 10 (%) Bobot arang aktif
Q E
Gambar 11 Konsentrasi optimum berdasarkan perpotongan kapasitas adsorpsi
dengan efisiensi pada arang aktif (800 ºC,120',0,5% NaOH)
Keterangan :
Q = Kapasitas adsorpsi (mg/ g) E = Efisiensi (%)
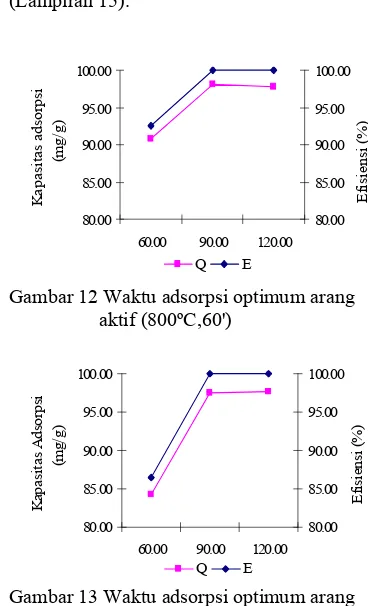
tersebut diambil sebagai waktu adsorpsi (Lampiran 15). 80.00 85.00 90.00 95.00 100.00
60.00 90.00 120.00 Waktu (menit) K a p a si ta s a d so rp si (m g/g) 80.00 85.00 90.00 95.00 100.00 Ef is ie n si ( % ) Q E
Gambar 12 Waktu adsorpsi optimum arang aktif (800ºC,60') 80.00 85.00 90.00 95.00 100.00
60.00 90.00 120.00 Waktu (menit) K a p a si ta s A d so rp si (m g /g ) 80.00 85.00 90.00 95.00 100.00 E fis ie n si ( % ) Q E
Gambar 13 Waktu adsorpsi optimum arang aktif (800ºC,120',0,5% NaOH)
Berdasarkan Gambar 12 dan 13, proses adsorpsi terlihat meningkat pada selang waktu 60-90 menit. Selanjutnya proses adsorpsi cenderung hampir stabil. Waktu untuk mencapai kapasitas adsorpsi optimum pada kedua AA tersebut adalah sama. Hal yang sama juga berlaku pada persentasi penjerapannya, yaitu 100%.
Pemurnian minyak goreng bekas
Komponen utama minyak yang sangat menentuan mutu minyak goreng adalah asam lemaknya, karena asam lemak menentukan sifat kimia maupun stabilitas minyak (Djatmiko 1974). Proses pemanasan pada minyak dapat menyebabkan minyak menjadi rusak. Salah satu parameter yang digunakan untuk melihat kerusakan minyak akibat pemanasan adalah kandungan asam lemak bebasnya.
Asam lemak bebas terbentuk karena proses oksidasi dan hidrolisis. Proses pemanasan pada suhu tinggi dan kontak minyak udara dapat mempercepat oksidasi. Sementara itu, proses hidrolisis dapat dipercepat karena adanya air. Data percobaan pemurnian minyak goreng bekas tersaji dalam Tabel 3.
Tabel 3. Hasil analisis minyak goreng bekas FFA (% b/b)
Sampel minyak AA (800°C, 60') AA (800°C, 120',0,5% NaOH) Minyak curah
awal 0.14 0.14
Minyak curah
bekas 1.62 1.62
Minyak curah bekas setelah dimurnikan
0.79 1.34
Berdasarkan Tabel 3 dapat dilihat bahwa ada penurunan kadar FFA pada sampel minyak goreng curah bekas setelah dimurnikan dengan AA sebesar 51,57% untuk AA (800 °C, 60'), dan 17,74% untuk AA (800 °C, 120',0,5% NaOH) (Lampiran 16). Hal ini menunjukkan kedua AA yang dibuat memiliki kemampuan sebagai adsorben pemurnian minyak, pernyataan ini dikuatkan oleh penelitian Pari (2004) yang menyatakan AA yang memiliki daya jerap iodin di atas 1000 mg/g dapat digunakan untuk pemurnian minyak makan. Persentasi penurunan kadar FFA AA (800 °C, 60') lebih besar dari AA (800 °C, 120', 0,5% NaOH), yaitu selisih 33,83 %.
H2COOCR CH2OH
HCOOCR + 3H2O CHOH +3RCOOH
H2COOCR CH2OH
Gambar 14 Reaksi hidrolisis trigliserida
Isoterm Adsorpsi
Isoterm adsorpsi menunjukkan hubungan kesetimbangan antara konsentrasi adsorbat dalam fluida dan pada permukaan adsorben, pada suhu tetap. Telah banyak adsorpsi yang dikembangkan untuk mendeskripsikan interaksi antara adsorben dan adsorbat. Tipe isoterm Freundlich dan Langmuir pada umumnya dianut oleh adsorpsi fase padat-cair (Atkins 1990). Data konsentrasi kesetimbangan, konsentrasi asam lemak bebas terjerap, dan bobot AA yang ditimbang, digunakan dalam pembuatan kurva regresi linier untuk tipe isoterm Freundlich (Lampiran 17) dan isoterm Langmuir (Lampiran 18).
adsorpsi asam laurat oleh AA (800 °C, 60') mengikuti tipe isoterm Freundlich, karena linieritasnya untuk tipe isoterm Freundlich lebih besar. Hasil penelitian ini dikuatkan oleh Hussein et al. (2004) yang menyatakan bahwa dengan nilai linieritas 90% dapat dinyatakan adsorpsi mengikuti jenis tipe isoterm adsorpsi tersebut. Jika isoterm yang dianut adalah isoterm Freundlich maka adsorpsi terjadi secara fisisorpsi banyak lapisan (Fourest dan Volesky 1996).
y = 0.0843x + 3.1953
R2 = 0.9228
0.00 0.50 1.00 1.50 2.00 2.50 3.00 3.50 4.00 4.50
2.97 2.89 2.75 2.60
log konsentrasi
log (
x
/m
)
Gambar 15 Isoterm Freundlich adsorpsi asam laurat oleh AA (800 °C, 60')
y = 0.0008x - 0.3185 R2 = 0.8331
0.00 0.10 0.20 0.30 0.40 0.50 0.60
0.00 200.00 400.00 600.00 800.00 1000.0 0 Konsentrasi C/ ( x /m )
Gambar 16 Isoterm Langmuir adsorpsi asam laurat oleh AA (800 °C, 60')
Hasil yang sama diperoleh pada isoterm adsorpsi asam laurat oleh AA (800 °C, 120', 0,5% NaOH), isoterm adsorpsi diduga mengikuti tipe isoterm Freundlich dengan linieritas 92,34% (Gambar 17) sedangkan isoterm Langmuir sebesar 77,89% (Gambar 18). Fakta ini menunjukkan bahwa proses adsorpsi asam laurat oleh AA (800 °C, 60') maupun AA (800 °C, 120'; 0,5% NaOH) menganut tipe isoterm Freundlich.
y = 0.0773x + 3.2406 R2 = 0.9243
2.80 3.00 3.20 3.40 3.60 3.80 4.00
2.80 2.76 2.52 2.57 log konsentrasi
log (
x
/m
)
Gambar 17 Isoterm Freundlich adsorpsi asam laurat oleh AA (800 °C, 120', 0,5% NaOH)
y = 0.0008x - 0.2066 R2 = 0.7792
0.00 0.05 0.10 0.15 0.20 0.25 0.30 0.35 0.40
0.00 200.00 400.00 600.00 800.00
Konsentrasi C/ ( x /m )
Gambar 18 Isoterm Langmuir adsorpsi asam laurat oleh AA (800°C, 120', 0,5% NaOH
Pendekatan Freundlich mengasumsikan adsorbat yang teradsorpsi membentuk lapisan
multilayer, permukaan adsorbat heterogen, artinya afinitas setiap kedudukan ikatan untuk molekul adsorbat tidak sama, ada antaraksi lateral antar molekul adsorbat, dan molekul adsorbat yang teradsorpsi terdistribusi, artinya molekul-molekul tersebut bergerak pada permukaan.
SIMPULAN DAN SARAN
Simpulan
Tongkol jagung terbukti dapat digunakan sebagai bahan baku pembuatan arang aktif (AA). Arang yang diaktivasi secara fisik dan kimia ternyata memiliki kualitas yang lebih baik dibandingkan arang yang diaktivasi hanya secara fisik berdasarkan daya jerap iodin. AA terbaik sesuai dengan cara aktivasinya terdapat pada arang yang diaktivasi pada suhu 800 °C selama 60 menit dan arang yang diaktivasi pada suhu 800 °C selama 120 menit dengan kombinasi bahan pengaktif NaOH 0,5 %. Kedua jenis adsorben ini berfungsi sebagai adsorben pemurnian minyak goreng bekas, yang dibuktikan dengan kemampuannya menurunkan kandungan asam lemak bebas sebesar 51,57 % untuk AA (800 °C, 60'), dan 17,74 % untuk AA (800 °C, 120', 0,5 % NaOH).
Tipe isoterm yang dianut oleh kedua jenis adsorben adalah isoterm Freundlich. Isoterm ini mengasumsikan molekul adsorbat yang teradsorpsi membentuk lapisan multilayer dan permukaan adsorbat adalah heterogen (memiliki energi yang berbeda).
Saran
Tahapan selanjutnya yang perlu dilakukan adalah identifikasi gugus fungsi, pola struktur kristalit, dan topografi permukaan arang aktif dari arang aktif yang dibuat. Sebaiknya AA (800 °C, 120', 0,5% NaOH) diaplikasikan pada contoh berwujud gas.
DAFTAR PUSTAKA
Ace. 2003. Pembuatan Furfural dari Tongkol Jagung: Hubungan Antara Suhu dan Waktu Proses Hidrolisis terhadap Yield [skripsi]. Jakarta: Fakultas Teknik, Universitas Indonesia.
Alberty RA, Silbey RJ. 1992. Physical Chemistry. Ed ke-1. New Atkins PW. 1999. Kimia Fisika jilid II.
Kartohadiprodjo, penerjemah; Rohhadyan T, editor. Oxford University Press. Terjemahan dari:
Physical Chemistry.
JIS. 1967. Japanese Industrial Standard. Testing Method for Powderd Avtivated Carbon. JIS K. 1474. Japanese Standard Assocation, Tokyo.
AOAC. 1999. Official Methods of Analysis of The Association of Official Analytical Chemist. AOAC inc., Washington.
ASTM. 1979. ASTM: Standard Test Method for benzena, chloroform, and iodin sorption of Activated Carbon., Philadelpia: American Society for Testing and Material.
Atkins PW. 1999. Kimia Fisika jilid II.
Kartohadiprodjo, penerjemah; Rohhadyan T, editor. Oxford University Press. Terjemahan dari:
Physical Chemistry.
Bangash FK, Alam S. 2007. Brilliant blue r adsorption from aqueous solution on activated carbon produced from corncob waste. J. Chinese Chem Soc..
54:595-606.
Barros JLM et al. 2003. Biosorption of cadmium using the fungus Aspergillus niger. Braz J Chem Eng 20:1-17.
[BPS] Badan Pusat Statistik, Indonesia. 2007. Luas Panen, Produktivitas, dan Produksi Tanaman Padi dan Palawija. Jakarta: BPS.
Cooney DO. 1980. Activated Charcoal, Antidotal, and Other Medical Uses.
New York: Marcel Dekker, Ann Arbor, Michigan.
Elly LR. 1992. Pusat Informasi Pemasaran Tanaman Pangan dan Hortikultura. Jakarta: Trubus.
Ferry J. 2002. Pembuatan arang aktif dari serbuk gergajian kayu campuran sebagai adsorben pada pemurnian minyak goreng bekas [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Intitut Pertanian Bogor, .
Guerreo AE, Collamtes MF, Reyes LA. 1970. Preparation of Activated Carbon from Coconut Cor Dust. Di dalam Coconut Research and Development, Vol 3. United Coconut Ssociation of Philippines Inc., Manila.
SIMPULAN DAN SARAN
Simpulan
Tongkol jagung terbukti dapat digunakan sebagai bahan baku pembuatan arang aktif (AA). Arang yang diaktivasi secara fisik dan kimia ternyata memiliki kualitas yang lebih baik dibandingkan arang yang diaktivasi hanya secara fisik berdasarkan daya jerap iodin. AA terbaik sesuai dengan cara aktivasinya terdapat pada arang yang diaktivasi pada suhu 800 °C selama 60 menit dan arang yang diaktivasi pada suhu 800 °C selama 120 menit dengan kombinasi bahan pengaktif NaOH 0,5 %. Kedua jenis adsorben ini berfungsi sebagai adsorben pemurnian minyak goreng bekas, yang dibuktikan dengan kemampuannya menurunkan kandungan asam lemak bebas sebesar 51,57 % untuk AA (800 °C, 60'), dan 17,74 % untuk AA (800 °C, 120', 0,5 % NaOH).
Tipe isoterm yang dianut oleh kedua jenis adsorben adalah isoterm Freundlich. Isoterm ini mengasumsikan molekul adsorbat yang teradsorpsi membentuk lapisan multilayer dan permukaan adsorbat adalah heterogen (memiliki energi yang berbeda).
Saran
Tahapan selanjutnya yang perlu dilakukan adalah identifikasi gugus fungsi, pola struktur kristalit, dan topografi permukaan arang aktif dari arang aktif yang dibuat. Sebaiknya AA (800 °C, 120', 0,5% NaOH) diaplikasikan pada contoh berwujud gas.
DAFTAR PUSTAKA
Ace. 2003. Pembuatan Furfural dari Tongkol Jagung: Hubungan Antara Suhu dan Waktu Proses Hidrolisis terhadap Yield [skripsi]. Jakarta: Fakultas Teknik, Universitas Indonesia.
Alberty RA, Silbey RJ. 1992. Physical Chemistry. Ed ke-1. New Atkins PW. 1999. Kimia Fisika jilid II.
Kartohadiprodjo, penerjemah; Rohhadyan T, editor. Oxford University Press. Terjemahan dari:
Physical Chemistry.
JIS. 1967. Japanese Industrial Standard. Testing Method for Powderd Avtivated Carbon. JIS K. 1474. Japanese Standard Assocation, Tokyo.
AOAC. 1999. Official Methods of Analysis of The Association of Official Analytical Chemist. AOAC inc., Washington.
ASTM. 1979. ASTM: Standard Test Method for benzena, chloroform, and iodin sorption of Activated Carbon., Philadelpia: American Society for Testing and Material.
Atkins PW. 1999. Kimia Fisika jilid II.
Kartohadiprodjo, penerjemah; Rohhadyan T, editor. Oxford University Press. Terjemahan dari:
Physical Chemistry.
Bangash FK, Alam S. 2007. Brilliant blue r adsorption from aqueous solution on activated carbon produced from corncob waste. J. Chinese Chem Soc..
54:595-606.
Barros JLM et al. 2003. Biosorption of cadmium using the fungus Aspergillus niger. Braz J Chem Eng 20:1-17.
[BPS] Badan Pusat Statistik, Indonesia. 2007. Luas Panen, Produktivitas, dan Produksi Tanaman Padi dan Palawija. Jakarta: BPS.
Cooney DO. 1980. Activated Charcoal, Antidotal, and Other Medical Uses.
New York: Marcel Dekker, Ann Arbor, Michigan.
Elly LR. 1992. Pusat Informasi Pemasaran Tanaman Pangan dan Hortikultura. Jakarta: Trubus.
Ferry J. 2002. Pembuatan arang aktif dari serbuk gergajian kayu campuran sebagai adsorben pada pemurnian minyak goreng bekas [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Intitut Pertanian Bogor, .
Guerreo AE, Collamtes MF, Reyes LA. 1970. Preparation of Activated Carbon from Coconut Cor Dust. Di dalam Coconut Research and Development, Vol 3. United Coconut Ssociation of Philippines Inc., Manila.
Perkebunan. Jurnal Penelitian Hasil Hutan 8(4):146-149.
Hasanah U. 2006. Proses Produksi Konsentrat Karotenoid dari Minyak Sawit Kasar dengan Metode Kromatografi Kolom Adsorpsi [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Jaguaribe EF, Medeiros LL, Barreto MCS, Araujo LP. 2005. The Performance of activated carbons from sugarcane bagasse, babassu, and coconut shells in removing residual chlorine.
Brazillian J of Chem Eng 22:41-47. http://www.abeq.org.br/bjche/vol22.h tml [31 Mar 2008].
Jankowska H, Andrzes S, Jerzy C. 1991.
Active Carbon. Ed ke-1. New York: Ellis Horwood.
Jason PP. 2004. Activated carbon and some application for the remidiation of soil and groundwater pollution. http://www.cee.vt.edu/program_areas. [8 jun 2008]
Ketaren S. 1986. Pengantar Teknologi Minyak dan Lemak Pangan. Jakarta: UI Press.
Kienle HV. 1986. Carbon. Di dalam Campbell, PT Prefferkorn R., dan Roundsaville JF. Ullman's Encyclopedia of Industrial Chemistry, 5th Completely Revised Ed. Vol A5: Cancer Chemotherapy to Ceramics Colorants. Weinheim: VHC
Koumanova B, Antova PP. 2002. Adsorption of p-chlorophenol from aqueous solution on bentonite and perlite. J Hazard Mater 90:229-234.
Lorenz KJ, Kulp K. 1991. Handbook of Cereal Science and Technology. New York: Marcel Dekker..
Pari G. 1996. Pembuatan arang aktif dari serbuk gergajian sengon dengan cara kimia. Buletin Penelitian Hasil Hutan
14:308-320.
Pari G. 2004. Kajian struktur arang aktif dari serbuk gergajian kayu sebagai adsorben emisi formaldehida kayu lapis [disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
PDII LIPI. 1998. Arang Aktif dari Tempurung Kelapa. Jakarta: PDII LIPI.
Rahmawati E. 2006. Adsorption Senyawa Klorin pada Karbon Aktif Termodifikasi ZnCl2 [Skripsi].
Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor,.
Rasjiddin I. 2006. Pembuatan arang Aktif dari Tempurung Biji Jambu Mede (Anacardium cocidentale) Sebagai Adsorben Pada Pemurnian Minyak Goreng Bekas [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
.
Ribeiro MHL, Lourenco PAS, Monteiro JP. 2001. Kinetics of Selective Adsorption of Impurities from a Crude Vegetable Oil in Hexane to activated Earths and Carbons. Eur Food Res Tehcnol
213:132-138.
Roy GM. 1985. Activated Carbon Application in The Food and Pharmaceutical Industries. Pensilvania : Technonic Pub.,
[SNI] Standar Nasional Indonesia. 1995. SNI 06-3730-1995: Arang Aktif Teknis.
Jakarta: Dewan Standardisasi Nasional
[SNI] Standard Nasional Indonesia. 1995. SNI 01-3741-1995: Syarat Mutu Minyak Goreng. Jakarta: Dewan Standardisasi Nasional.
Sriwahyuni W. 2002. Efektivitas adsorben dan koagulan-flokulan pada penjernihan air wilayah Marunda [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sudradjat R, Soleh S. 1994. Petunjuk Teknis Pembuatan Arang Aktif. Bogor: Puslitbang Hutan.
Lampiran 1 Penggunaan arang aktif dalam industri
Maksud/ Tujuan Pemurnian
I Untuk Gas
1 Pemurnian gas Desulfurisasi, menghilangkan gas beracun, bau busuk, dan
asap
2 Pengolahan LNG Desulfurisasi dan penyaringan berbagai bahan mentah dan
reaksi gas. 3 Katalisis
penjerapan
Katalisis penjerapan atau pengangkut vinil klorida dan vinil asetat
4 Lain-lain Menghilangkan bau pada kamar pendingin dan mobil.
II Untuk Zat Cair 1 Industri obat dan
makanan
Menyaring dan menghilangkan warna, bau, dan rasa yang tidak enak pada makanan.
2 Minuman ringan,
minuman keras
Menghilangkan warna dan bau
3 Kimia peminyakan Penyulingan bahan mentah, zat perantara
4 Pembersih air Menyaring/ menghilangkan bau, warna, zat pencemar dalam
air, sebagai alat pelindung dan penukuar resin dalam alat/ penyulingan
5 Pembersih air
buangan
Mengatur dan membersihkan air buangan dari pencemar, warna, bau, logam berat
6 Penambakan udang dan benur
Pemurnian, penghilangan bau dan warna
7 Pelarut yang
digunakan kembali
Penarikkan kembali berbagai pelarut, sisa metanol, etil asetat dan lain-lain
III Lain-lain
1 Pengolahan pulp Pemurnian, penghilangan bau
2 Pengolahan pupuk Pemurnian
3 Pengolahan emas Pemurnian
4 Penyaringan minyak makan dan glukosa
Menghilangkan warna, bau dan rasa tidak enak
Sumber: PDII LIPI 1998
Tongkol jagung
Arang
Serbuk arang aktif Arang aktif
• Rendemen
• Kadar air
• Kadar abu
• Kadar zat mudah menguap
• Kadar karbon terikat
• Daya jerap iodin
• Daya jerap benzena
• Daya jerap kloroform
Uji pendahuluan
Aplikasi terhadap minyak goreng bekas
Isoterm adsorpsi Lampiran 2 Alur kerja penelitian
dibersihkan dengan air keran
+ karbonisasi (T= 500°C) selama + 5 jam
direndam NaOH 0,5 dan 0,75% (24 jam) + dicuci dengan akuades
direndam HCl: HNO3 = 1: 1 (24 jam)
+ dicuci dengan akuades
dikeringkan dengan oven (T= 105°C)
suhu 750 dan 850 °C
selama 60 dan 120 menit laju alir 7,78 ml/ menit
diayak hingga 100 mesh
Lampiran 3 Gambar alat tungku pengarangan dan aktivasi
Tungku pengarangan tenaga listrik
Tungku pengarangan nyala api
Tungku aktivasi Ketel air
Lampiran 4 Kadar air tongkol jagung
Ulangan a (g) b (g) Kadar air (%)
1 38.531 34.764 10.84
2 37.306 33.649 10.87
3 39.663 35.938 10.37
Rerata 10.69
keterangan:
a: bobot sampel sebelum dikeringkan b: bobot sampel setelah dikeringkan
Contoh perhitungan: Kadar air (%) = a
b
a− × 100%
= 100
764 . 34
764 . 34 531 . 38
x
− %
Lampiran 5 Standar mutu arang aktif
Standar mutu arang aktif menurut SNI 06-3730-95 Syarat Mutu Uraian
Butiran Serbuk
Kadar zat mudah menguap (%) Maks 15 Maks 25
Kadar air (%) Maks 4,5 Maks 15
Kadar abu Maks 2,5 Maks 10
Bagian tidak mengarang 0 0
Daya serap terhadap I2 (%) Min 750 Min 750
Karbon aktif murni (%) Min 80 Min 65
Daya serap terhadap benzena (%) Min 25
Daya serap terhadap biru metilena (ml/ g) Min 60 Min 120
Bobot jenis curah (g/ ml) 0,45-0,55 0,3-0,35
Lolos mesh - Min 90
Jarak mesh (%) 90 -
Kekerasan (%) 80 -
Lampiran 6 Rekapitulasi dan perhitungan data mutu arang aktif
No Perlakuan Rende
men (%)
Kadar Air (%)
Kadar zat mudah menguap
(%)
Kadar abu (%)
Kadar C terikat
(%)
Daya jerap benzena
(%)
Daya jerap kloroform
(%)
Daya jerap iodin (mg/g)
1 Tanpa aktivasi 8.36 20.70 8.76 70.54 11.70 13.76 353.51
2 Tanpa aktivasi 8.37 21.12 7.37 71.51 11.12 14.12 365.47
3 700/ 1h 65.2 9.06 0.91 11.65 70.92 18.30 26.62 775.17
4 700/ 1h 8.95 19.09 11.43 69.48 18.78 27.01 776.48
5 700/ 2h 60.1 6.39 15.17 13.37 71.46 19.03 29.22 819.54
6 700/ 2h 5.99 17.47 9.38 73.15 19.16 28.39 821.49
7 800/ 1h 52.8 8.75 17.30 12.52 70.18 24.49 35.15 933.93
8 800/ 1h 8.68 17.07 12.87 70.10 24.25 32.95 933.93
9 800/ 2h 26.7 8.55 26.65 20.18 53.17 24.54 33.32 817.40
10 800/ 2h 8.68 26.44 19.96 53.60 24.39 32.46 850.26
11 700/ 1h/ 0.5 82.4 6.73 20.62 4.46 74.92 15.37 20.53 744.21 12 700/ 1h/ 0.5 6.72 22.93 4.25 72.82 14.57 20.69 741.27 13 700/ 1h/ 0.75 84.8 6.05 22.44 8.43 69.13 15.68 23.71 818.50 14 700/ 1h/ 0.75 6.19 24.33 8.38 67.29 15.90 23.20 802.96 15 700/ 2h/ 0,5 48.2 4.38 14.04 4.68 81.28 19.13 25.10 817.33 16 700/ 2h/ 0,5 4.40 14.39 5.19 80.42 18.28 22.11 809.33 17 700/ 2h/ 0,75