KEBERADAAN KOPROANTIGEN Fasciola gigantica
PADA RUMINANSIA:
MODEL UJI DIAGNOSTIK UNTUK HUMAN FASCIOLOSIS
SAMARANG
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Pengembangan Metode ELISA
untuk Mendeteksi Keberadaan Koproantigen Fasciola gigantica pada Ruminansia: Model Uji Diagnostik untuk Human Fasciolosis adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun
kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari
karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan
dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2011
Samarang
SAMARANG. Development of ELISA Method for Detecting Coproantigen of Fasciola gigantica in Ruminant: A Model for Human
The study was designed to develop ELISA method to detect coproantigen of
Fasciola gigantica in ruminant as a model for human fasciolosis diagnostic test. Fasciolosis Diagnostic Test. Under direction of FADJAR SATRIJA and SRI MURTINI.
Excretory Secretory (ES) antigen were isolated from adult stage of F. gigantica
incubated in the RPMI medium at 370
C for 4 hours. Each worm produced roughly 0.18 mg ES antigen. ES protein showed five protein bands with the molecular weight of 104.99, 90.05, 56.43, 47, 30.27 kDa in SDS-PAGE analysis. Polyclonal antibodies against ES antigen were raised from rabbits and chicken egg yolk. These polyclonal antibodies were used in sandwich ELISA for detection of coproantigen using IgY as capture antibody and IgG as detection antibody. Specificity and sensitivity test revealed that the ELISA have 87,5% sensitivity and 100% specificity compared to gold standard post-mortem examination.
RINGKASAN
SAMARANG. Pengembangan Metode ELISA untuk Mendeteksi Keberadaan Koproantigen Fasciola gigantica pada Ruminansia: Model Uji Diagnostik untuk
Human Fasciolosis. Dibimbing oleh FADJAR SATRIJA dan SRI MURTINI.
Cacing hati (Fasciola spp) merupakan salah satu jenis cacing parasit dari kelas Trematoda yang penting, dan menimbulkan kerugian ekonomis pada ternak ruminansia. Fasciolosis disebabkan oleh infeksi dua spesies utama dari genus
Fasciola yaitu Fasciola hepatica dan Fasciola gigantica. Selain ruminansia Fasciola
juga dapat menginfeksi hewan lain diantaranya kuda, babi, kelinci, dan tikus. Fasciolosis pada ternak mengakibatkan kerugian ekonomi yang tidak sedikit. Di Kenya, kerugian selama 16 tahun pengamatan mencapai 4 408 272 KES (shilling Kenya) atau US$. 72.272. Di Indonesia, kerugian mencapai Rp.513,6 milyar per tahun dengan prevalensi antara 60-90%. Manusia juga dapat terinfeksi oleh
Fasciola. Diperkirakan 2,4 hingga 17 juta orang di berbagai belahan dunia termasuk Asia menderita fasciolosis. Penyakit ini menyebabkan kematian pada fase akut dan menyebabkan gangguan kesehatan berupa hepatomegali dan spleniomegali pada stadium kronis.
Diagnosis fasciolosis secara konvensional berdasarkan pada penemuan telur cacing di dalam feses penderita. Diagnosis ini memiliki kelemahan yaitu tidak mampu mendeteksi infeksi pada masa prepaten (8-10 minggu pasca infeksi) serta rendahnya sensitivitas karena produksi telur yang relatif rendah setelah memasuki masa patensi. Keterbatasan ini mendorong dikembangkannya imunodiagnosis fasiolosis. Teknik diagnosis fascilosis dengan uji Enzyme Linked Immunosorbent Assay (ELISA) dan Western blot telah dikembangkan untuk mendeteksi infeksi
F. hepatica, namun ELISA yang didesain untuk mendiagnosis F. gigantica masih sangat terbatas.
Deteksi antigen cacing yang dikeluarkan bersama feses (koproantigen) merupakan pendekatan baru yang lebih sensitif dan spesifik dibanding pemeriksaan parasitologis atau deteksi antibodi parasit dalam sirkulasi darah. Penelitian koproantigen cacing dengan teknik ELISA Sandwich menggunakan antibodi monoklonal telah dilakukan oleh Estuningsih et al. (2009). Namun untuk mempersiapankan monoclonal antibodi memerlukan biaya yang tinggi. Metode deteksi ELISA dapat juga dilakukan dengan antibodi poliklonal, salah satu antibodi poliklonal yang mudah diproduksi adalah antibodi IgY. Penelitian ini dilakukan untuk mengembangkan metode ELISA menggunakan poliknonal antibodi dari kuning telur ayam dan serum kelinci, untuk mendeteksi antigen Ekskretori dan Sekretori (ES) dalam feses (koproantigen) pada ruminansia. Penelitian ini diharapkan dapat digunakan sebagai model untuk mendiagnosis fasciolosis pada manusia.
Penelitian ini dilakukan dalam lima tahap yaitu Isolasi, produksi dan karakterisasi antigen ES, Produksi dan deteksi poliklonal antibodi, Optimasi ELISA,
Uji sensitifitas dan spesifisitas, Uji coba ELISA dengan sampel feses dari lapangan.
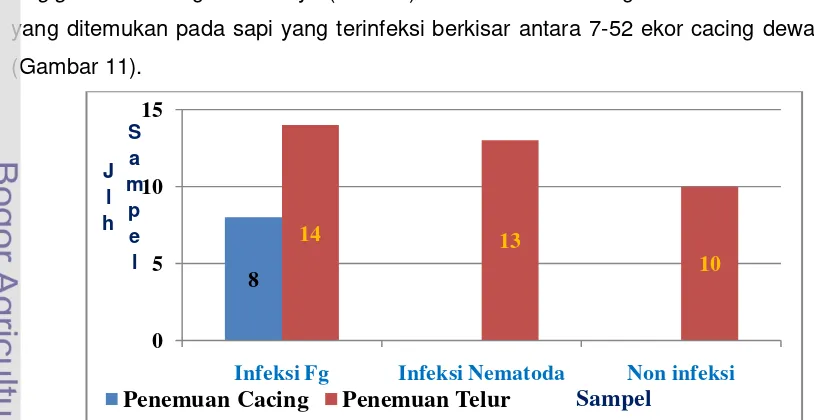
Sebanyak 38 sampel feses sapi dari RPH Palu, Bubulak, dan Purwodadi, enam sampel feses banteng dari Ujung Kulon diperiksa secara mikroskopis untuk melihat jenis infeksi sampel feses. Sampel feses dilarutkan 1:4 dengan PBS menjadi supernatan untuk mendapatkan koproantigen. Antigen ES diisolasi dari cacing
dalam medium RPMI selama empat jam pada suhu 37
Antibodi poliklonal asal kelinci dan kuning telur ayam yang diimunisasi ES
F. gigantica isolat asal kerbau digunakan sebagai antibodi pendeteksi antigen dan antibodi penangkap antigen. Antibodi poliklonal asal kelinci dan kuning telur ayam diuji kesesuaiannya terhadap antigen ES F. gigantica asal sapi dengan uji AGPT. Hasil pengujian menunjukkan bahwa antibodi mampu bereaksi dengan antigen ES
F. gigantica asal sapi yang dibuktikan dengan terbentuknya garis presipitasi.
C. ES F. gigantica asal sapi ini memiliki lima pita protein, masing-masing berat molekulnya adalah 104,99, 90,05, 56,43, 47, 30,27 kDa dengan metode SDS-PAGE.
Dua pola model pada optimasi uji ELISA Sandwich digunakan dalam penelitian ini. Model pertama adalah penggunaan IgG sebagai antibodi penangkap konsentrasi 4, 2, 1, dan 0,5 µg/ml dan IgY sebagai antibodi pendeteksi dengan konsentrasi 2 dan 1 µgl/ml. Model kedua mengggunakan IgY konsentrasi 4, 2, 1, dan 0,5 µg/ml dan IgG konsentrasi 2 dan 1 µg/ml sebagai antibodi pendeteksi. Sampel pada kedua model ini, digunakan antigen ES asal sapi dengan konsentrasi sama yaitu 5 µgl/ml. Hasil kombinasi dari optimasi kedua model uji ELISA Sandwich
ini yaitu, pertama IgG sebagai antibodi penangkap dan IgY sebagai antibodi deteksi menghasilkan jarak nilai 1,68 - 3,31 kali lipat dari nilai sampel negatif. Kedua IgY sebagai antibodi penangkap dan IgG sebagai antibodi pendeteksi, mempunyai jarak nilai 3,15 – 8,03 kali lipat dari nilai absorbansi sampel negatif. Uji ELISA untuk menentukan sensitifitas dan spesifisitas menggunakan model dengan nilai kelipatan absorbansi positif terjauh dari nilai absorbansi negatif. Kombinasi model tersebut adalah IgY sebagai antibodi penangkap dan IgG sebagai antibodi deteksi.
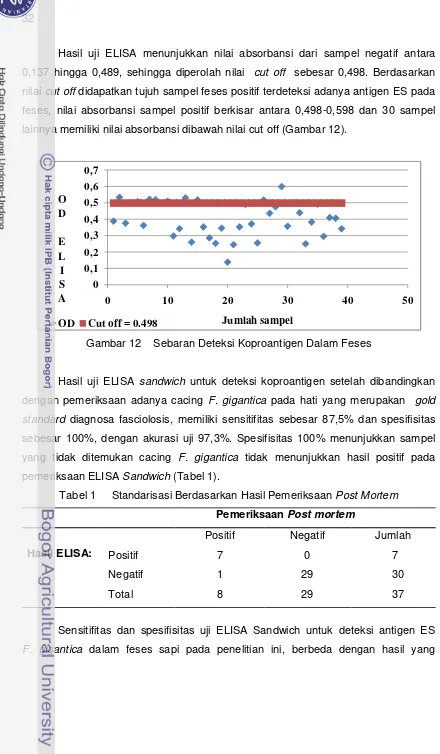
Uji spesifisitas dan sensitifitas terhadap koproantigen dilakukan pada 37 sampel feses asal sapi dari RPH. Berdasarkan hasil pemeriksaan post mortem
diperoleh delapan sampel positif terinfeksi cacing F. gigantica dewasa dan 29 sampel tidak terinfeksi cacing. Batas penentuan absorbansi untuk deteksi keberadaan ES F. gigantica (cut off) ditentukan dengan menghitung rataan absorbansi kontrol negatif (feses sapi tanpa infeksi) ditambakan dua kali standard deviasi. Hasil uji menunjukkan tingkat akurasi uji 97,3%, dengan sensitifitas uji ELISA 87,5% dan spesifisitas sebesar 100%.
Berdasarkan hasil penelitian ini disimpulkan bahwa uji ELISA Sandwich
dapat mendeteksi keberadaan koproantigen F. gigantica dengan model IgY sebagai antibodi penangkap dan IgG sebagai antibodi deteksi dengan tingkat akurasi 97,3%, berpotensi dikembangkan untuk mendeteksi human fasciolosis.
PENGEMBANGAN METODE ELISA
UNTUK MENDETEKSI KEBERADAAN KOPROANTIGEN
Fasciola gigantica
PADA RUMINANSIA:
MODEL UJI DIAGNOSTIK UNTUK
HUMAN
FASCIOLOSIS
SAMARANG
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Parasitologi dan Entomologi Kesehatan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Pengembangan Metode ELISA untuk Mendeteksi Keberadaan Koproantigen Fasciola gigantica pada Ruminansia: Model Uji
Diagnostik untuk Human Fasciolosis
Nama : Samarang
NIM : B252090031
Disetujui
Komisi Pembimbing
drh. Fadjar Satrija, M.Sc. Ph.D
Ketua Anggota
Dr. drh. Sri Murtini, M.Si
Diketahui
Ketua Program Studi/Mayor Dekan Sekolah Pascasarjana
Parasitologi dan Entomologi Kesehatan
Dr. drh. Upik Kesumawati Hadi, M.S Dr. Ir. Dahrul Syah, M.Sc. Agr
Untuk
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya
sehingga Tesis ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang
dilaksanakan sejak bulan Nopember 2009 mengenai Fasciolosis, dengan judul
Pengembangan Metode ELISA untuk Mendeteksi Keberadaan Koproantigen
Fasciola gigantica pada Ruminansia: Model Uji Diagnostik untuk Human Fasciolosis.
Terima kasih penulis ucapkan kepada Bapak drh. Fadjar Satrija, M.Sc, Ph.D.
dan Ibu Dr. drh. Sri Murtini, M.Si selaku pembimbing yang telah banyak memberi
saran dan bantuan, serta kepada Ibu Dr. drh. Elok Retnani, M.S selaku penguji luar
komisi. Kepada Ibu Dr. drh. Upik Kesumawati Hadi, M.S sebagai ketua program
studi Parasitologi dan Entomologi Kesehatan. Bapak Prof. Dr. drh. Singgih H. Sigit,
M.S serta seluruh Bapak dan Ibu dosen yang telah memberikan bantuan baik
berupa moril maupun materil. Tak lupa penulis sampaikan terima kasih kepada
Bapak Kepala Balai Litbang P2B2 Donggala yang telah memberikan izin untuk
melanjutkan studi. Kepada Kementerian Kesehatan RI khususnya Pustanserdik
yang telah memberikan beasiswa program S2. Bapak Suwandi, Bapak Darwis
selaku Kepala Rumah Potong Hewan (RPH) Palu dan RPH Kabupaten Sigi
Biromaru Sulawesi Tengah, serta Kepala dan staf di Rumah Potong Hewan Bubulak
Bogor. Bapak Sulaeman staf laboratorium Helminth Fakultas Kedokteran Hewan IPB
yang telah banyak membantu selama pengumpulan data. Ungkapan terima kasih
juga disampaikan kepada ayah, ibu, suami, anak serta seluruh keluarga, atas segala
dukungan doa dan kasih sayangnya.
Semoga tesis ini bermanfaat.
Bogor, Juli 2011
Penulis dilahirkan di Tawau (Malaysia) pada tanggal 25 Agustus 1973 dari
ayah Pawakkangi (Almarhum) dan ibu Hapi, merupakan putri kedua dari enam
bersaudara. Penulis menikah dengan Harianto Majid 11 juni 2000 dan dikaruniai
seorang putra Moh. Syahrul Harianto berusia 9 tahun.
Tahun 1991 penulis lulus dari SMA Negeri I Rappang Sulawesi Selatan,
Tahun 1995 lulus dari Akademi Penilik Kesehatan Muhammadiyah Ujung Pandang,
Pendidikan sarjana ditempuh di Sekolah Tinggi Ilmu Kesehatan (STIK) Palu, lulus
tahun 2006. Bulan September tahun 2009 penulis diterima di Program Studi
Parasitologi Dan Entomologi Kesehatan (PEK) Sekolah Pascasarjana IPB dan
menamatkannya pada tahun 2011. Beasiswa pendidikan pascasarjana diperoleh
dari Kementerian Kesehatan Republik Indonesia.
Penulis bekerja sebagai tenaga Sanitarian di Puskesmas Mabelopura, Palu
Sulawesi Tengah, sejak tahun 1998. Lulus rekruitmen tenaga peneliti di Stasiun
Lapangan Pemberantasan Vektor (SLPV) sekarang dikenal sebagai Balai Penelitian
dan Pengembangan (Litbang) Pengendalian Penyakit Bersumber Binatang (P2B2)
xiii
DAFTAR ISI
DAFTAR TABEL .. ..………. ... xiv
DAFTAR GAMBAR ..………. ... xv
DAFTAR LAMPIRAN ...………. ... xvi
PENDAHULUAN Latar Belakang .. ...………. ... 1
Rumusan Masalah ...…...………... 3
Tujuan Penelitian ………... 3
Manfaat Penelitian ..………... 3
TINJAUAN PUSTAKA Fasciola gigantica ...………. ... 5
Siklus Hidup Fasciola gigantica ... 6
Fasciolosis ..…….………... 7
Metode Diagnosis Fasciolosis ... ....……….... 9
1 Pemeriksaan secara klinis ... 9
2 Pemeriksaan secara laboratorium ... 10
Antibodi Poliklonal .………... 11
Antigen Ekskretori dan Sekretori ... 13
METODE PENELITIAN Waktu dan Tempat Penelitian ... 15
Prosedur Penelitian ... 15
1 Isolasi, Produksi dan Karakterisasi Antigen ESFg ... 15
2 Produksi Poliklonal Antibodi ... 16
3 Optimasi ELISA ... 18
4 Uji Sensitifitas dan Spesifisitas ... 19
5 Uji Coba ELISA dengan Sampel Feses dari Lapangan ... 19
HASIL DAN PEMBAHASAN Isolasi, Produksi dan karakterisasi Antigen ESFg ..………... 23
Produksi Poliklonal Antibodi ...………... 27
Optimasi ELISA ...………... 29
Sensitifitas dan Psesifisitas ... 31
Uji Coba ELISA dengan Sampel Feses dari Lapangan ………... 33
SIMPULAN DAN SARAN ... 37
DAFTAR PUSTAKA ... 39
DAFTAR TABEL
xv
DAFTAR GAMBAR
1 Perbedaan bentuk F. gigantica dengan F. hepatica …... 5
2 Siklus hidup F. gigantica ... 6
3 Hypertrophia hati pada kambing ... 8
4 Struktur IgG pada mamalia ... 12
5 Konsentrasi antigen ES F. gigantica asal sapi per ekor ... 24
6 Profil protein antigen ES F. gigantica sapi (A), ES F. gigantica kerbau (B), ES F.gigantica sapi pewarnaan silver (C) ... 25
7 Hasil AGPT serum kelinci IgG anti ESFg asal kerbau ... 27
8 Hasil AGPT kuning telur IgY ... 28
9 Hasil Konfirmasi model ELISA IgG capture ... 29
10 Hasil Konfirmasi model ELISA IgY capture ... 30
11 Hasil pemeriksaan sampel feses sapi secara mikroskopis ... 31
12 Sebaran deteksi koproantigen dalam feses ... 32
DAFTAR LAMPIRAN
1 Metode Bradford ...………... 47
2 Metode Sodium Deodecil Sulphate-Poly Acrilamide Gel Elektrophoresis (SDS-PAGE) ... 50
PENDAHULUAN
Latar Belakang
Cacing hati (Fasciola spp) merupakan salah satu jenis cacing parasit dari kelas Trematoda yang penting dan menimbulkan kerugian ekonomis pada ternak ruminansia (Velusamy et al. 2006). Fasciolosis disebabkan oleh infeksi dua spesies
utama dari genus Fasciola yaitu Fasciola hepatica dan Fasciola gigantica.
F. hepatica memiliki penyebaran kosmopolit termasuk di wilayah beriklim empat musim dan subtropik, sedangkan F. gigantica di wilayah beriklim tropis basah seperti di Asia dan Afrika. Selain ruminansia Fasciola juga dapat menginfeksi hewan lain diantaranya kuda, babi, kelinci, tikus (Nasser et al. 2008; Eslami et al. 2009).
Fasciolosis pada hewan mengakibatkan kerugian ekonomi yang tidak sedikit.
Di Indonesia, kerugian mencapai Rp.513,6 milyar per tahun dengan prevalensi
antara 60-90% (Estuningsih et al. 2004). Pengamatan selama 16 tahun di Kenya menunjukkan kerugian akibat fasciolosis mencapai 4 408 272 KES (shilling Kenya)
atau US$. 72.272. Kontribusi spesies F. gigantica terhadap total kerugian adalah 3.505.410 KES (79,5%) (Mungube 2006). Suatu studi pada peternakan sapi di
Ethiopia Selatan memperlihatkan bahwa, petani mengalami kerugian rata-rata 4000
USD pertahun dari 57 sapi yang diperiksa, akibat fasciolosis (Abunna 2010).
Fasciola dapat menginfeksi manusia dan menyebabkan zoonosis yang
dikenal dengan nama Human Fasciolosis (Garsia et al. 2009). Pada manusia diperkirakan 2,4 hingga 17 juta orang di berbagai belahan dunia menderita
fasciolosis termasuk Asia (WHO 2009). Kejadian luar biasa human fasciolosis
dilaporkan pernah terjadi di propinsi Gilan (Iran) tahun 1987, 1998 yaitu sekitar 1500
penderita (Asrafi et al. 2010). Penyakit ini menyebabkan kematian pada fase akut dan menyebabkan gangguan kesehatan yang serius akibat hepatomegali dan sirosis
hati pada stadium kronis (Mas-Coma et al. 2005, 2009; Sripa et al. 2010). Kasus fasciolosis terjadi pada masyarakat yang memiliki kebiasaan mengkonsumsi
tanaman air tanpa di masak hingga matang. Human fasciolosis lebih sering disebabkan oleh F. hepatica dibandingkan F. gigantica (WHO 2009).
Upaya menekan kerugian ekonomis dan angka kesakitan akibat kecacingan
hanya akan berhasil melalui program pengendalian kecacingan yang di dasarkan
parasit dalam tubuh akan dapat diketahui sebelum menimbulkan perubahan
patofisiologis dan mengkontaminasi lingkungan dengan telurnya. Diagnosa
fasciolosis umumnya dengan cara konvensional didasarkan pada penemuan telur
cacing yang dikeluarkan oleh cacing dewasa bersama feses. Kelemahan metode ini
adalah ketidakmampuannya untuk mendeteksi infeksi pada masa prepaten (8-10
minggu masa infeksi) serta rendahnya sensitifitas karena produksi telur yang relatif
rendah setelah memasuki masa patensi (Estuningsih et al. 2009). Pada manusia kesalahan diagnosa fasciolosis terjadi karena, telur cacing tidak ditemukan selama
pemeriksaan. Di Iran diagnosa fasciolosis telah dikecohkan dengan penyakit yang
mempunyai gejala yang sama seperti dirofilariasis (Asrafi et al. 2010), visceral leishmaniasis, hal ini terjadi terutama pada daerah endemik parasitosis karena
meremehkan penyakit penting lainnya yang bersifat sporadis (Mawlavi et al. 2010). Keterbatasan ini mendorong dikembangkannya imunodiagnosis fasiolosis
terutama F. hepatica agar diperoleh hasil diagnosis yang lebih cepat dan akurat diantaranya dengan Enzyme Linked Immunosorbent Assay (ELISA) dan dot ELISA (Kumar et al. 2008). Pengembangan ELISA ada yang diarahkan untuk mendeteksi antibodi (Zhang et al. 2005; Yadav et al. 2005) maupun antigen didalam darah atau feses (Yokanant et al. 2005). Sebaliknya ELISA yang dikembangkan untuk mendiagnosis F. gigantica masih sangat terbatas (Estuningsih 2006; Estuningsih et al. 2009). Deteksi dengan teknis imunologis yang didasarkan pada penggunaan antibodi dengan target antigen parasit yang dicari merupakan metode yang sensitif
dan spesifik. Namun, metode ini memiliki keterbatasan karena kehadiran antibodi
menunjukkan paparan parasit sebelumnya daripada keberadaan dari infeksi saat ini.
Deteksi antigen cacing yang dikeluarkan bersama feses (koproantigen)
merupakan pendekatan baru mendeteksi infeksi cacing parasit. Metode deteksi
koproantigen lebih sensitif dan spesifik dibanding pemeriksaan parasitologis atau
deteksi antibodi parasit dalam sirkulasi darah (Charlier et al. 2008). Penelitian
koproantigen cacing dengan teknik ELISA Sandwich menggunakan antibodi
monoklonal telah dilakukan oleh Estuningsih et al. (2009) namun persiapannya cukup kompleks dan butuh biaya yang tinggi. Metode deteksi ELISA juga dapat
dilakukan dengan antibodi poliklonal, salah satu antibodi poliklonal yang mudah
diproduksi adalah antibodi IgY. Pengembangan metode ELISA yang dilaksanakan
3
antibodi dari kuning telur ayam dan serum kelinci, untuk mendeteksi antigen
Ekskretori dan Sekretori (ES) dalam feses (koproantigen) pada ruminansia.
Diharapkan penelitian ini dapat digunakan sebagai model untuk mendiagnosis
fasciolosis pada manusia.
Rumusan Masalah
Diagnosis fasciolosis dengan cara konvensional mempunyai kelemahan
tidak mampu mendeteksi infeksi pada masa prepaten, serta rendahnya sensitifitas
pada masa patensi. Metode ELISA yang dikembangkan untuk mendiagnosis
fasciolosis dengan deteksi koproantigen masih sangat terbatas.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengembangkan metode ELISA sebagai teknik
diagnosis fasciolosis untuk mendeteksi antigen ES dalam feses (koproantigen) pada
ruminansia.
Manfaat Penelitian
Jangka pendek : Sebagai teknik diagnosis fasciolosis pada ruminansia baik di
lapangan maupun di tempat pelayanan kesehatan.
Jangka panjang : Menjadi dasar pengembangan model uji diagnostik pada human
TINJAUAN PUSTAKA
Fasciola gigantica
Fasciola spp lebih dikenal dengan cacing hati (liver fluke), dua spesies penting diantaranya yaitu Fasciola hepatica dan Fasciola gigantica. Berdasarkan taxonomi F. gigantica dapat diklasifikasikan sebagai berikut (Soulsby 1982) :
Phylum : Platyhelminthes
Class : Trematoda (Rudolphi 1808)
Ordo : Digenea (Van Beneden 1858)
Family : Fasciolidae (Railliet 1895)
Genus : Fasciola (Linnaeus 1758)
Species : Fasciola gigantica (Cobbold 1885)
Fasciola spp secara anatomi berbentuk pipih dorsoventral. Cacing ini
memiliki dua batil hisap berukuran hampir sama besar, yaitu batil isap ventral
(asetabulum) sejajar dengan bahu, dan batil isap oral (oral sucker) juga berfungsi sebagai mulut. Ukuran dan bentuk tubuh F. gigantica dengan F. hepatica berbeda, Cacing F. hepatica dewasa lebih pendek, kerucut kepala lebih panjang, alat reproduksi terletak lebih posterior, batil isap perut lebih kecil (Soulsby 1982). Lebih
jelasnya perbedaan kedua spesies Fasciola ini, dapat dilihat seperti pada Gambar 1.
Gambar 1 Perbedaan bentuk F. hepatica (A) dan F. gigantica (B)
(http//www.dpd.cdc.gov/dpdx)
F. gigantica mempunyai ukuran panjang tubuh berkisar 31,73-52,29 mm,
berwarna merah muda pucat, pundaknya tidak begitu nyata, telurnya berukuran
156-197 X 90-104 µm. Ukuran panjang tubuh F. hepatica yaitu 12,22-29,00 mm, berwarna coklat keabuan, pundak lebar, telurnya berukuran 130-160 X 63-90 µm, warna keemasan dengan operkulum (Periago 2006).
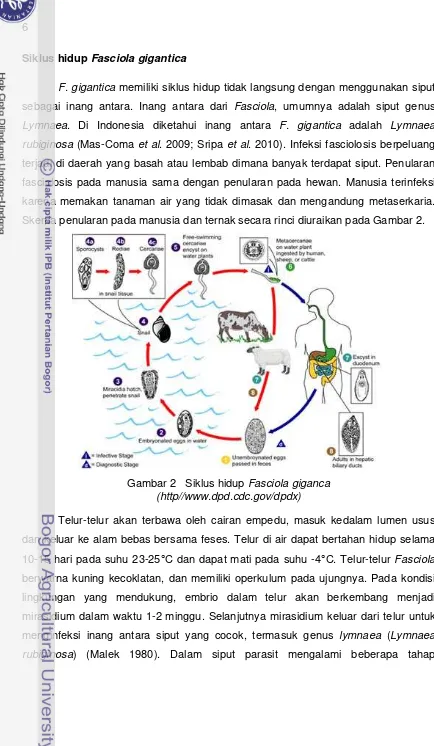
Siklus hidup Fasciola gigantica
F. gigantica memiliki siklus hidup tidak langsung dengan menggunakan siput sebagai inang antara. Inang antara dari Fasciola, umumnya adalah siput genus
Lymnaea. Di Indonesia diketahui inang antara F. gigantica adalah Lymnaea
rubiginosa (Mas-Coma et al. 2009; Sripa et al. 2010). Infeksi fasciolosis berpeluang terjadi di daerah yang basah atau lembab dimana banyak terdapat siput. Penularan
fasciolosis pada manusia sama dengan penularan pada hewan. Manusia terinfeksi
karena memakan tanaman air yang tidak dimasak dan mengandung metaserkaria.
Skema penularan pada manusia dan ternak secara rinci diuraikan pada Gambar 2.
Gambar 2 Siklus hidup Fasciola giganca (http//www.dpd.cdc.gov/dpdx)
Telur-telur akan terbawa oleh cairan empedu, masuk kedalam lumen usus
dan keluar ke alam bebas bersama feses. Telur di air dapat bertahan hidup selama
10-15 hari pada suhu 23-25°C dan dapat mati pada suhu -4°C. Telur-telur Fasciola
berwarna kuning kecoklatan, dan memiliki operkulum pada ujungnya. Pada kondisi
lingkungan yang mendukung, embrio dalam telur akan berkembang menjadi
mirasidium dalam waktu 1-2 minggu. Selanjutnya mirasidium keluar dari telur untuk
menginfeksi inang antara siput yang cocok, termasuk genus lymnaea (Lymnaea
7
perkembangan (sporokista, redia, dan serkaria). Serkaria yang keluar dari siput akan
berenang. Bila serkaria tidak termakan oleh inang defenitif, maka akan menempel
pada tumbuhan air atau permukaan lain dan terjadi enkistasi membentuk kista. Kista
ini menjadi metaserkaria (fase infektif), yang akan termakan oleh hewan atau
manusia sebagai inang definitif. Mamalia dan manusia terinfeksi karena memakan
tanaman air tawar yang mengandung metaserkaria, terutama selada air. Setelah
konsumsi, metaserkaria ekskistasi di duodenum dan bermigrasi melalui dinding
usus, rongga peritoneal, dan parenkim hati ke dalam saluran empedu, di mana
mereka berkembang menjadi dewasa. Larva masuk ke dalam hati dengan
menembus kapsula hati (kapsul glissoni) dan mengembara ke seluruh parenkim hati
selama sembilan minggu (2-3 bulan), larva masuk kedalam saluran empedu, mereka
menjadi dewasa dan menghasilkan telur. Pada manusia, pematangan metaserkaria
menjadi cacing dewasa membutuhkan waktu sekitar 3-4 bulan (Garsia et al. 2009).
Fasciolosis
Fasciolosis adalah suatu penyakit yang disebabkan oleh cacing hati
(Fasciola spp), yang hidup didalam hati dan saluran empedu pada hewan mamalia
maupun manusia. F. hepatica dan F. gigantica merupakan dua spesies utama penyebab fasciolosis. Penyakit ini juga dikenal dengan berbagai nama lain, misalnya
Distomatosis hepatik, Cattle liver fluke, Giant liver fluke (Akoso 1991). Fasciola spp sebagai penyebab kerugian ekonomi pada ternak ruminansia terutama domba dan
sapi diseluruh dunia bahkan pada manusia (Swai 2009; Mas-Coma et al. 2009). Hewan yang rentan adalah sapi dan kerbau, hewan yang kurang rentan
adalah domba, kambing dan ruminan lain, serta dapat juga menyerang babi, anjing,
kucing, kuda, kelinci dan manusia (Soulsby 1982). Pada ternak, fase migrasi larva
menyebabkan kerusakan parenkim hati yang luas, penyakit ini dikenal dengan Liver rot (Lim et al. 2008). Bentuk akut, berupa mati mendadak disertai darah yang merembes atau keluar dari hidung dan anus. Bentuk kronik tahap pertama anemia,
kelemahan otot, penurunan nafsu makan, serta bulu menjadi kering dan rontok,
akhirnya terjadi kebotakan dan hewan menjadi lemah dan kurus. Ternak domba
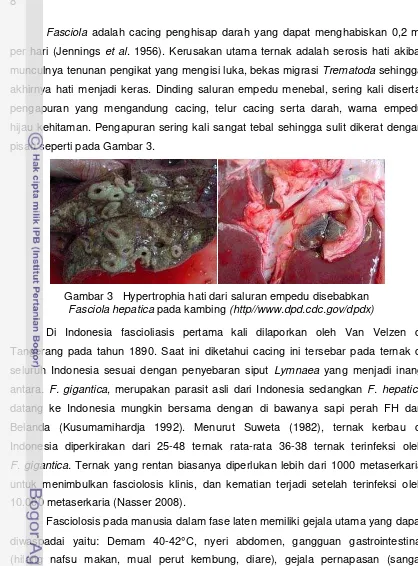
Fasciola adalah cacing penghisap darah yang dapat menghabiskan 0,2 ml per hari (Jennings et al. 1956). Kerusakan utama ternak adalah serosis hati akibat munculnya tenunan pengikat yang mengisi luka, bekas migrasi Trematoda sehingga akhirnya hati menjadi keras. Dinding saluran empedu menebal, sering kali disertai
pengapuran yang mengandung cacing, telur cacing serta darah, warna empedu
hijau kehitaman. Pengapuran sering kali sangat tebal sehingga sulit dikerat dengan
pisau seperti pada Gambar 3.
Gambar 3 Hypertrophia hati dari saluran empedu disebabkan
Fasciola hepatica pada kambing (http//www.dpd.cdc.gov/dpdx)
Di Indonesia fascioliasis pertama kali dilaporkan oleh Van Velzen di
Tangerang pada tahun 1890. Saat ini diketahui cacing ini tersebar pada ternak di
seluruh Indonesia sesuai dengan penyebaran siput Lymnaea yang menjadi inang antara. F. gigantica, merupakan parasit asli dari Indonesia sedangkan F. hepatica
datang ke Indonesia mungkin bersama dengan di bawanya sapi perah FH dari
Belanda (Kusumamihardja 1992). Menurut Suweta (1982), ternak kerbau di
Indonesia diperkirakan dari 25-48 ternak rata-rata 36-38 ternak terinfeksi oleh
F. gigantica. Ternak yang rentan biasanya diperlukan lebih dari 1000 metaserkaria untuk menimbulkan fasciolosis klinis, dan kematian terjadi setelah terinfeksi oleh
10.000 metaserkaria (Nasser 2008).
Fasciolosis pada manusia dalam fase laten memiliki gejala utama yang dapat
diwaspadai yaitu: Demam 40-42°C, nyeri abdomen, gangguan gastrointestinal
(hilang nafsu makan, mual perut kembung, diare), gejala pernapasan (sangat
jarang), hepatomegali dan splenomegali, asites, anemia, penyakit kuning. Fase ini
dapat berlangsung selama berbulan-bulan atau tahun. Proporsi asimtomatik pada
fase ini tidak diketahui. Survei di beberapa daerah menggambarkan bahwa terdapat
9
2,4 juta bahkan sampai 17 juta orang terinfeksi dengan F. hepatica di dunia (Sripa et al. 2010). Fasciolosis pada manusia, jarang ditemukan cacing dewasa, sehingga seringkali tidak ditemukan adanya telur cacing dalam feses. Identifikasi spesies
bergantung pada ukuran telur yang terdeteksi hanya 3-4 bulan setelah infeksi,
dengan dinamika pengeluaran telur berselang. Dengan demikian, mayoritas kasus
fasciolosis manusia didiagnosa melalui metode serologis. Metode ini tidak dapat
dipercaya karena menghasilkan diferensiasi spesies, meskipun demikian di negara Eropa, dipercaya bahwa fasciolosis manusia disebabkan oleh F. hepatica karena di lapangan F. hepatica adalah spesies dominan dalam ternak Eropa (Mas-coma et al. 2009).
Fasciolosis pada manusia banyak dilaporkan dari negara Eropa, Amerika,
Asia, Afrika, dan Oceania. Prevalensi penyakit pada manusia berkorelasi dengan
penyakit pada hewan. Di Asia kasus dilaporkan di Iran dengan jumlah 10.000 kasus,
sedang di Asia tenggara kasus ini bersifat sporadik. Prevalensi tertinggi fasciolosis
manusia ditemukan di wilayah Altiplano Bolivia (Mas-Coma et al. 2005). Tiga jenis situasi endemik dapat dibedakan menurut prevalensi populasi diperoleh dari
coprologikal diagnosis yaitu Hypoendemik prevalensi <1%, Mesoendemik prevalensi
1 ± 10%, Hiperendemik prevalensi > 10% (Sampaio 1990; Knobloch et al. 1985).
Metode Diagnosis Fasciolosis
1) Pemeriksaan secara klinis
Diagnosis secara klinis yaitu ditegakkan berdasarkan observasi, riwayat sakit
penderita yang mengalami pembesaran hati yang melunak, disertai sindrom demam
eosinofilik. Migrasi cacing muda dari usus ke hati dapat menimbulkan lesi ektopik di
dinding usus, jantung, bola mata, paru dan jaringan dibawah kulit, sehingga
menimbulkan keluhan setempat. Bentuk akut dapat keliru dengan penyakit antraks,
karena adanya pengeluaran darah dari hidung dan anus. Bentuk kronik pada domba
dapat keliru dengan haemonchosis karena adanya bottle jaw, anemia pada fascioliasis dapat keliru dengan anemia oleh penyebab yang lain (Akoso 1991).
2) Pemeriksaan secara laboratorium
Pemeriksaan secara laboratorium dapat dibedakan dalam beberapa metode
a Pemeriksaan secara mikroskopis atau konvensional
Fasciolosis kronis dapat didiagnosis melalui pemeriksaan telur dalam feses
dibawah mikroskop. Teknik konvensional dengan pulasan sederhana atau metode
konsentrasi, dapat dibedakan atas pengendapan (sedimentasi), pengapungan
(floating), saringan bertingkat. Metode konsentrasi adalah suatu metode yang
dirancang untuk memisahkan organisme protozoa dengan telur cacing dari kotoran
feses melalui perbedaan berat jenis (Taylor 1964). Penegakkan diagnosis pasti,
dilakukan dengan pemeriksaan feses, cairan duodenum, atau cairan empedu
hospes untuk menemukan telur cacing Fasciola dengan penghitungan jumlah telur tiap gram feses. Penemuan metaserkaria pada rumput, membantu menegakkan
diagnosis terutama fasciolosis jaringan dan fascioliasis dalam periode prepaten.
Diagnosa infeksi secara konvensional didasarkan pada penemuan telur cacing yang
dikeluarkan oleh cacing dewasa di dalam feses hewan atau manusia (Garcia et al.
2009).
b Pemeriksaan secara serologi
Pemeriksaan secara serologi didasarkan pada penggunaan antibodi dengan
target antigen parasit yang dicari, merupakan metode yang sensitive dan spesifik.
(Teledo et al. 2003; Charlier et al. 2008). Alternatif metode yang dapat digunakan yaitu enzyme linked immunosorbent assay (ELISA) ini umum digunakan untuk mendeteksi keberadaan antibodi atau antigen dalam sampel dan relatif sederhana
(Jaswir 2010).
c Pemeriksaan secara molekuler
Teknik pemeriksaan secara molekuler umumnya dilakukan dalam penelitian
dan seputar dunia laboratorium dengan teknik Polymerase Chain Reaction (PCR). PCR merupakan teknik untuk memperkuat satu salinan tunggal atau beberapa
potong DNA, sebagai primer, di beberapa kali lipat, menghasilkan ribuan sampai
jutaan gandaan urutan DNA tertentu. PCR dapat dimodifikasi secara luas untuk
berbagai macam manipulasi genetik. teknik PCR dapat digunakan untuk
11
Antibodi Poliklonal
Antibodi merupakan protein yang dibuat oleh semua spesies hewan dan
merupakan bagian dari sistem tanggap kebal terhadap substansi asing. Respon
imun (respon humoral) terjadi akibat antigen yang merupakan substansi asing
menggertak sel T sebagai helper sehingga berdiferensiasi menjadi limfokin. Limfokin berinteraksi dengan sel limfosit B, dan berdiferensiasi menjadi sel plasma dan sel
memori. Antibodi adalah molekul protein yang dihasilkan oleh sel plasma
.
Sellimfosit T yang terdiri dari sel limfosit T sitotoksik dan sel limfosit T helper. Sel limfosit T sitotoksik berperan dalam menghancurkan antigen intraseluler sedangkan
sel limfosit T helper berperan untuk membantu sel limfosit B (Black 2005). Mekanisme kerja antibodi untuk mempercepat penghancuran dan penyingkiran
antigen dengan netralisasi, presipitasi, agglutinasi, serta lisis (Guyton dan Hall
2007).
Antibodi poliklonal diperoleh dengan cara melakukan imunisasi secara
sengaja terhadap hewan dengan suatu imunogen spesifik (hiperimunisasi). Antibodi
poliklonal memiliki campuran kompleks antibodi dengan spesifitas, afinitas, dan
isotipe yang berbeda serta keterbatasan produksi karena dibatasi oleh umur hewan
yang digunakan (Zola 1987). Antibodi poliklonal memiliki reaktivitas multipel yaitu
dapat menangkap sejumlah epitop (antigen determinan) yang berbeda pada antigen.
Reaktivitas multipel antibodi poliklonal dapat menimbulkan reaksi silang. Reaksi
silang ini dapat terjadi karena epitop yang sama dimiliki oleh antigen yang berbeda
atau epitop yang secara struktur mirip atau memiliki keserupaan dengan epitop
pembuat peka (priming epitop) yang dikenali oleh antibodi (Smith 1995). Antibodi dapat digunakan sebagai reagensia untuk mengukur, mendeteksi dan memurnikan
molekul biologis bahkan untuk pengobatan.
Antibodi terdiri dari unit dasar yang disebut immunoglobulin (Ig). Ig merupakan penyusun antibodi yang memiliki dua karakteristik yaitu kimia dan biologi
(Black 2005). Ig secara kimia berupa rantai polipeptida (dua rantai ringan dan dua
rantai berat) yang tersusun dengan bentuk khusus (Gambar 4). Produksi Ig secara
biologis distimulasi oleh antigen dan memiliki reaksi yang spesifik (Barriga 1981).
Ada lima golongan Ig yaitu IgM, IgG, IgA, IgE dan IgD. Diantara lima golongan
memiliki presentasi terbanyak yaitu 70-75% di dalam serum normal dibandingkan
IgM (antibodi pertama yang muncul dalam respon primer), IgA, IgE dan IgD. IgG
memiliki struktur monomer dengan berat molekul 146.000 dalton serta merupakan
antibodi utama dari respon imun sekunder. Molekul imunoglobulin yang
berbeda dapat memiliki sifat mengikat antigen yang berbeda karena VH yang
berbeda dan daerah VL (De Buysscher dan Patterson 1995). Secara struktural, IgG
memiliki empat rantai polipeptida terbagi atas dua rantai berat identik dengan berat
molekul 50.000 dalton serta dua rantai ringan dengan berat molekul 25.000 dalton.
Antara rantai berat dan rantai ringan polipeptida dihubungkan oleh ikatan disulfida
yang terdapat pada bagian engsel (hinge region). Rantai berat dan ringan dari IgG masing-masing memiliki bagian konstan atau tetap dan bagian yang dapat berubah
atau variable, Bagian yang dapat berubah (variable) berfungsi khusus untuk melekat antigen pada struktur IgG. Bagian konstan menentukan sifat biologis IgG seperti
penyebaran IgG dalam jaringan, pelekatan IgG pada struktur jaringan spesifik,
pelekatan pada kompleks komplemen, serta kemudahan IgG dalam melewati
membran (Guyton dan Hall 2007).
Fc: Fragment crystallization, FAB: Fragment antigen binding, CH1 CH2 CH3 : constant regions, HV VL : variable domains, FV : Fragment variable, Warna hijau: Rantai berat, Warna biru: Rantai ringan, bulat biru : Carbohydrate.
Gambar 4 Struktur IgG pada mamalia (Jose 2000).
Pada ayam IgG lebih dikenal sebagai IgY. IgY merupakan antibodi humoral
utama pada unggas. Pada ayam IgA dan IgM memiliki kemiripan dengan IgA dan
13
(Tarigan 2003). IgY pada ayam tidak memiliki persamaan imunologis dengan IgG
mamalia, namun mempunyai struktur yang sama yaitu memiliki dua rantai ringan
dan dua rantai berat, urutan DNA IgY menyerupai urutan DNA pada IgE manusia
(Carlender 2002). IgY ditemukan oleh Klemperer tahun 1893, yang menggambarkan
adanya kekebalan pasif terhadap toksin tetanus yang diturunkan dari induk ke anak
ayam. IgY terdapat dalam kuning telur dan serum dalam bentuk molekul
immunoglobulin dengan konsentrasi sekitar 10-20 mg/ml (Davalos et al. 2001). IgY lebih tahan terhadap suhu dan perubahan pH dibandingkan IgG, namun sangat
sensitive terhadap denaturasi. Aktifitas IgY dapat dipertahankan jika disimpan pada
suhu 370C untuk jangka waktu enam bulan, bahkan dapat dipertahankan selama 10
tahun jika disimpan pada suhu 40C (Larsson et al. 1993). Inkubasi pada pH lebih dari 4 masih dapat ditoleransi, namun pada pH 2 suhu 370
Mekanisme pembentukan IgY dalam serum darah dan kuning telur memiliki
kemiripan dengan pembentukan IgG pada mamalia. Namun terdapat beberapa
perbedaan antara IgY dengan IgG berupa ukuran yang lebih besar, sifat keasaman,
kerapatan molekul yang lebih rendah (Higgins 1995; Szabo et al. 1998). IgY dapat mengenali lebih banyak epitop antigenik dibandingkan dengan antibodi yang
diproduksi mamalia. IgY juga mampu mengikat antibodi sekunder hingga tiga
sampai lima kali lebih kuat dari IgG. IgY tidak mengikat reseptor permukaan sel Fc,
tidak mengikat protein A dan G (Schmidt et al. 1993). Perbedaan dalam interaksi molekuler menjadi keuntungan besar untuk mengaplikasikan antibodi IgY dalam
berbagai penelitian, diagnostik kedokteran, bioteknologi serta menjadi antibodi
alternative unggulan untuk immunoglobulin konvensional (Hodek et al. 2003; Michael et al. 2010).
C aktivasi IgY menurun
drastis. Penurunan aktivitas tersebut disebabkan oleh perubahan konformasi
(Michael et al. 2010).
Antigen Ekskretori dan Sekretori (ES)
Antigen (antibody generating substances) adalah suatu senyawa atau substansi yang dapat menggertak sistem imunitas dapatan pada inang atau individu.
Antigen dapat berupa polisakarida, protein, lemak, asam inti atau lipopolisakarida,
maupun lipoprotein. Protein merupakan antigen yang terbaik karena ukuran dan
dalton bersifat antigenik. Pembentukan sifat antigenik tergantung kepada
pengulangan kelompok molekul secara regular, yang disebut epitop (antigenik determinan) pada permukaan molekul besar (Guyton dan Hall 2007).
ES merupakan antigen protektif yang dapat memicu tanggap kebal inang
definitif (McKeand et al. 1995). Selain antigen ES, parasit memiliki antigen somatik dan antigen permukaan yang dapat dikenali oleh inangnya. Antigen somatik hanya
dapat dikenali oleh inangnya jika cacing tersebut telah mati atau dihancurkan,
sedangkan antigen permukaan selalu berubah seiring dengan rangkaian
perkembangan cacing yang mengalami moulting sepanjang hidupnya sehingga
menyulitkan inang defenitif dalam memberi respon tanggap kebal. Antigen ES
mempunyai sifat yang lebih dapat dikenali oleh sistem tanggap kebal daripada
antigen somatik dan antigen permukaan, sehingga diduga lebih protektif untuk
memicu respon tanggap kebal (Chowdhury 1994).
Antigen ES mengandung glikoprotein yang menutupi kulit cacing, juga
mengandung sebagian kecil enzim, yang dilepaskan secara konstan sehingga
mempermudah migrasi ke jaringan inang (Bird 1991). Analisis dua dimensi gel
eektroforesis mengindikasikan bahwa F. hepatica melepaskan sekitar 60 protein dalam substansi ES. Di antaranya ada 29 protein yang merupakan protein esensial
cathepsin L, superoxide dismuthase, thioredoxin peroxidase, glutathione S
transferase, dan protein yang terikat pada asam lemak. Cathepsin L menempati jumlah yang paling banyak ditemukan dalam ES Fasciola sp (Ridi et al. 2007).
Fasciola sp. menghasilkan berbagai jenis antigen ES yang berbeda-beda
pada setiap stadium hidupnya yang beredar pada sirkulasi inangnya. Antigen
tersebut menjadi studi terbaik dan potensial untuk diagnostik dikenal dengan
gut-associated antigen. Molekul tersebut berasal dari usus parasit dan dilepas ke
sirkulasi inang melalui regurgitasi regular dalam pencernaan usus. Kehadiran ES
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Nopember 2009 hingga Januari 2011, di
bagian Parasitologi dan Entomologi Kesehatan (PEK), Departemen Ilmu Penyakit
Hewan & Kesmavet. Fakultas Kedokteran Hewan, Institut Pertanian Bogor, di Bogor.
Prosedur Penelitian
Pengembangan metode ELISA untuk mendeteksi keberadaan koproantigen
F. gigantica dilakukan melalui lima tahapan : 1) Isolasi, produksi dan karakterisasi antigen ES F. gigantica. 2) Produksi dan deteksi poliklonal antibodi. 3) Optimasi ELISA. 4) Uji spesifisitas dan sensitifitas. 5) Uji ELISA dengan sampel feses dari
lapangan.
Tahap 1 Isolasi,Produksi dan Karakterisasi Antigen ES F. gigantica
Cacing hati (F. gigantica) dikoleksi dari delapan hati sapi yang disembelih di Rumah Potong Hewan (RPH) Palu dan Purwodadi. Organ hati dipreparir di
sepanjang saluran empedu untuk mengeluarkan cacing. Jaringan hati dibagi
menjadi potongan-potongan kecil untuk memudahkan pengambilan cacing. Cacing
hati (F. gigantica) dewasa yang dikoleksi dari hati sapi dicuci tiga kali dalam larutan NaCl fisiologis, untuk menghilangkan sisa jaringan dan empedu yang menempel
ditubuh cacing. Kondisi fisik cacing diamati dengan mikroskop stereo atau lup.
Cacing yang masih hidup dan utuh dikumpulkan dalam wadah berisi NaCl fisiologis.
Cacing tersebut selanjutnya dipindahkan ke dalam tabung 50 ml berisi larutan
Phosphate Buffer Saline (PBS) kemudian diinkubasi pada suhu 370C selama 15-20
menit (50 cacing dalam 100 ml PBS). Cacing yang telah bersih dipindahkan ke
dalam media RPMI 1640 yang mengandung antibiotik dan diinkubasikan pada suhu
370C selama 20 menit. Cacing hati yang masih hidup dipindahkan ke dalam
medium RPMI 1640 yang baru dan diinkubasi selama 4 jam suhu 370C (dua ekor
cacing dalam 1 ml RPMI). Larutan RPMI yang mengandung antigen ES dipisahkan
dari cacingnya, kemudian disentrifugasi dengan kecepatan 1500 G pada suhu 4ºC
Supernatan hasil sentrifugasi dipekatkan dengan penambahan Ammonium sulfat
40% (w/v) sambil diaduk dengan batang pengaduk magnet selama 24 jam pada
suhu 4ºC. Ekskretosi–sekretori yang telah dipekatkan dimurnikan dengan cara
didialisis menggunakan membrane selulosa (Sigma®) dalam larutan PBS selama
empat jam, volume PBS yang digunakan sebanyak 100 kali volume larutan yang
didialisis. Buffer pendialisis diganti setiap satu jam. Hasil dialisis merupakan antigen ES yang telah dimurnikan, selanjutnya antigen ES tersebut disimpan dalam freezer -200
Konsentrasi protein antigen ES yang diperoleh diukur menggunakan metode
Bradford (1976). Karakterisasi protein antigen ES diamati dengan melarikan protein
tersebut menggunakan metode Sodium Deodecil Sulphate-Poly Acrilamide Gel
Elektrophoresis (SDS-PAGE) (Laemmli 1970).
C sampai saat akan digunakan.
Tahap 2 Produksi dan Deteksi Poliklonal Antibodi
Dalam penelitian ini digunakan dua jenis poliklonal antibodi yaitu IgG yang
berasal dari kelinci dan IgY yang berasal dari kuning telur ayam. Imunoglobulin G
anti ES F. gigantica kerbau diperoleh dengan cara menyuntikan antigen protein ES
F. gigantica asal kerbau pada dua ekor kelinci percobaan. Pada penelitian ini
digunakan dua ekor kelinci ras white New Zaeland umur dua bulan, berat badan masing-masing satu kg. Sebelum digunakan hewan coba dipelihara dan diberi obat
anti cacing agar bebas dari penyakit cacing dan ivomex® agar tidak terkena infeksi
penyakit parasit. Dosis imunisasi masing-masing kelinci adalah 150 µl/ekor. Imunisasi pertama dilakukan dengan rute intra vena (i.v). Imunisasi kedua dilakukan
seminggu setelah imunisasi pertama dengan rute subcutan menggunakan Freud
adjuvan komplit dengan perbandingan antara Antigen dan adjuvan sama banyak.
Penyuntikan ketiga sampai kelima dengan interval tiga minggu melalui rute subkutan
(s.c), menggunakan Frued adjuvan inkomplit dengan perbandingan sama.
Deteksi poliklonal antibodi dilakukan dengan, mengambil sampel serum dari
vena auricularis pada telinga, seminggu setelah penyuntikan kedua hingga minggu
ke 16. Pemeriksaan kualitatif metode Agar Gel Precipitation Test (AGPT) menurut Eisen (1973) digunakan untuk mendeteksi keberadaan antibodi anti ES dari kelinci.
Hewan coba yang telah membentuk antibodi (IgG) dalam darah terhadap antigen ES
17
37oC dengan posisi miring selama 30 menit. Kemudian disimpan dalam refrigerator
semalam pada suhu 4o
Serum yang diperoleh dimurnikan untuk mendapatkan IgG menggunakan
Montage
C. Serum dikumpulkan menggunakan mikropipet. Bila perlu,
darah disentrifus dengan kecepatan 2000 x g selama 15 menit.
®
Antibody Purification Kit and Spin Columns with PROSEP®-A Media.
Media PROSEP®-A yang digunakan dipre-ekuilibrasi menggunakan 10 ml Binding Buffer A dengan mensentrifuse spin column dengan kecepatan 500 x g selama 30 menit pada suhu 4oC. Sampel berupa serum kelinci anti ES F.gigantica kerbau disaring menggunakan 0.2 µm Steriflip-GP filter. Kemudian 10 ml serum yang telah difiltrasi ditambahkan dengan 10 ml Binding Buffer A (perbandingan 1:1 v/v) disentrifus dengan kecepatan 500 x g selama 30 menit suhu 4oC. Setelah 30 menit,
supernatan didasar tabung dibuang kemudian spin column dibilas menggunakan 20
ml Binding Buffer A yang disentrifus dengan kecepatan 500 x g selama 30 menit
pada suhu 4oC untuk menghilangkan kontaminan yang tidak terikat. Setelah itu,
sebanyak 10 ml Elution Buffer B2 ditambahkan langsung kedalam spin column
dalam tabung steril baru yang telah diisi 1,3 ml Neutralization Buffer C yang disentrifus dengan kecepatan 4500 x g selama 40 menit pada suhu 4oC. Supernatan
didasar tabung yang mengandung IgG diambil, kemudian difiltrasi menggunakan
Amicon® 30.000 yang disetrifus dengan kecepatan 4500 x g selama 25 menit pada
suhu 4oC. Supernatan berupa IgG yang tertinggal didalam filter disimpan dalam
tabung-tabung mikro volume 1.5 ml, disimpan dalam suhu -20o
Poliklonal antibodi immunoglobulin Y (IgY) dari kuning telur ayam adalah
kuning telur yang telah diproduksi pada penelitian Satrija et al. (2009). Kuning telur diperiksa secara kualitatif dengan metode AGPT sama seperti IgG, untuk
mendeteksi keberadaan poliklonal antibodi IgY. Setelah poliklonal antibodi IgY
terdeteksi secara kualitatif, selanjutnya dilakukan pemurnian menggunakan Kit
EGGstart® IgY Perrification System (PROMEGA).
C. Konsentrasi IgG
yang telah dipurifikasi diukur menggunakan spektrofotometer pada panjang 595 nm
dengan metode Bradford.
Telur yang akan dimurnikan terlebih dahulu dikondisikan dalam suhu ruang
beberapa saat sebelum dipecah kerabangnya. Kemudian kuning telur dipisahkan
dari putih telur, selanjutnya membrane vitelin kuning telur ditusuk dengan jarum steril
piala steril dan ditimbang beratnya. Larutan presipitasi A ditambahkan sebanyak tiga
kali volume kuning telur dan diaduk selama 5 menit untuk menggumpalkan lemak,
lalu sentrifuse dengan kecepatan 10.000 g, selama 15 menit pada suhu 40C.
Supernatan disaring melalui 4 lapis kain kasa steril lalu perlahan-lahan diaduk dan
ditambahkan larutan B sebanyak 1/3 dari volume filtrat. Larutan tersebut terus
diaduk selama 5 menit kemudian disentrifuse dengan kecepatan 10.000 g selama
15 menit pada suhu 40C. Pellet presipitat yang terkumpul didasar tabung
dipindahkan ke tabung lain, supernatan dibuang. Kemurnian IgY yang didapat
adalah sekitar 63%, untuk meningkatkan menjadi 90% dengan cara memproses
ulang pellet presipitat dengan penambahan larutan B sebanyak 1/3 dari volume
filtrat. Sebelum dilakukan pengulangan langkah selanjutnya, pellet presipitat yang
terkumpul ditambah dengan PBS sebanyak volume awal kuning telur. Larutan
dihomogenkan lalu di aliquot 1 ml dalam tabung mikro. Konsentrsi IgY yang telah dimurnikan dihitung menggunakan metode Bradford (1976), dan sebelum digunakan
disimpan dalam freezer -200
Tahap 3 Optimasi ELISA
C.
Optimasi uji ELISA Sandwich dilakukan berdasarkan metode Estuningsih (2006), yang dimodifikasi. IgY sebagai antibodi cupture dicoatingkan ke mikroplate ELISA dalam beberapa konsentrasi 0,5, 1, 2, dan 4 µg/ml pengenceran dengan
larutan Buffet Bicarbonate (Na2NO3). Setiap sumur mikroplate diisi 100 µl larutan IgY dan diinkubasi selama semalam pada suhu 40C. Setelah inkubasi semalam
mikroplate dibilas dengan PBS Tween 0,05% sebanyak 200 µl, pada masing-masing sumur lalu bilas dengan PBS lalu keringkan. Selanjutnya blocking dilakukan dengan mengunakan susu 5% selama satu jam pada suhu 370C. Mikroplate dicuci seperti
pada pencucian pertama, lalu sampel antigen ES F. gigantica sapi konsentrasi 5 µg/ml (1/200) sebanyak 100 µl diisi ke setiap sumur, inkubasi selama satu jam pada
suhu 370C. Kemudian dilakukan pencucian seperti langkah awal, selanjutnya IgG
sebagai antibodi deteksi konsentrasi 1 dan 2 µg/ml (1/1000; 1/500), dimasukkan
19
suhu 370
Tahap 4 Uji Spesifisitas dan Sensitifitas
C. Pencucian dilakukan kembali seperti langkah sebelumnya, selanjutnya
substrat dimasukkan pada setiap sumur dalam kondisi ruang tanpa cahaya, inkubasi
selama 10-15 menit, kemudian nilai absorbansi dibaca dengan menggunakan ELISA
reader pada panjang gelombang 615 nm.
Penentuan spesifisitas dan sensitifitas uji ELISA Sandwich yang telah dioptimasi untuk mendeteksi koproantigen F. gigantica dilakukan dengan menggunakan 37 sampel feses yang diperoleh dari sapi yang dipotong di tiga
Rumah Potong Hewan (RPH) yaitu RPH Bubulak, RPH Purwodadi dan RPH Palu.
Hasil diagnosa infeksi cacing hati dengan uji ELISA untuk mendeteksi koproantigen
dibandingkan dengan hasil pemeriksaan postmortem yang merupakan gold standard untuk menghitung spesifisitas dan sensitivitas uji dengan menggunakan tabel 2 x 2
berikut :
Gold standard
Positif Negatif
a
b
c
d
Rumus yang digunakan :
- Sensitifitas = a / (a + c) x 100%
- Spesifisitas = b / (b + d) x 100%
- Akurasi = (a + d) / (a+b+c+d) x 100% (
Mattjik dan Sumertajaya 2006)
Tahap 5 Uji Coba ELISA dengan Sampel Feses dari Lapangan
Kemampuan ELISA Sandwich dalam mendeteksi infeksi Fasciola pada
ruminansia di lapangan diuji coba dengan menggunakan 44 sampel feses terdiri dari
37 sampel feses sapi dan enam sampel feses banteng. Sampel tersebut diperoleh
dari sapi yang dipotong di RPH dan banteng dari Taman Nasional Ujung Kulon,
Banten. Hasil ELISA dibandingkan dengan pemeriksaan mikroskopik dengan
metode Mcmaster dan saringan bertingkat yang merupakan metode konvensional
untuk mendiagnosa infeksi cacing saluran pencernaan serta cacing hati.
Uji Sandwich Enzyme Linked Immunosorbent Assay (ELISA)
Supernatan sampel feses untuk uji ELISA dipersiapkan mengikuti metode
Estuningsih (2006) yang dimodifikasi. Sampel feses ditimbang sebanyak dua gram
dalam tabung reaksi, lalu dibuat suspensi dengan menambahkan 8 ml Phosphate
Buffer Saline Twee (PBST) 1% (1:4). Suspensi feses tersebut dihomogenkan
menggunakan vortex dalam kecepatan tinggi, selanjutnya disentrifugasi 5000 g
selama 10 menit pada suhu 40C, supernatan dikoleksi dan disimpan pada suhu
-200
Cawan ELISA (NUNC), dasar datar dilapisi dengan 50 µl/sumur IgY sebagai antibodi penangkap, yang telah diencerkan 1/250 dengan Buffer Bicarbonat (Na2NO3), lalu diinkubasi semalam pada suhu 4
C.
0
C. Setelah diinkubasi cawan dicuci tiga kali
dengan larutan PBST 1% dan satu kali dengan PBS. Plate yang telah dicuci
kemudian diblocking dengan skim 5% 100 µl/lubang, lalu diinkubasi selama 1 jam
pada suhu 370C. Selanjutnya cawan ELISA dicuci kembali dengan PBST 1% tiga
kali dan PBS satu kali. Supernatan feses dimasukkan sebanyak 50 µl/lubang pengenceran 1:4, selama 1 jam suhu 370C. Setiap sampel dilakukan duplikasi,
setiap cawan ELISA dibuat kontrol positif negatif. Setelah diinkubasi dan dicuci tiga
kali dengan PBST 1% dan PBS satu kali, selanjutnya IgG (1/500) sebagai antibodi
pendeteksi dimasukkan 50 µl/sumur, selama 1 jam pada suhu 37ºC. Kemudian
dilakukan pencucian seperti langkah sebelumnya dan secondary antibody
dimasukkan 50 µl/sumur yaitu IgG anti rabbit yang telah dikonjungasi dengan enzim peroksidase (IgG HRP anti rabbit), lalu diinkubasi pada suhu 370C selama 1 jam. Plate dicuci kembali dengan PBST 1% sebanyak tiga kali dan PBS satu kali, terakhir
substrat 50 µl/sumur dimasukkkan dalam kondisi tanpa cahaya. Tunggu terjadi perubahan warna sekitar 10-15 menit. Reaksi dihentikan dengan menambahkan 50
µl/lubang stop solution H2SO4 dan reaksi akan berwarna kekuningan. Optical
Density (OD) dibaca pada panjang gelombang 615 nm dengan menggunakan ELISA
reader. Nilai absorbansi sampel adalah nilai yang didapat dari pembacaan nilai
21
cut-off dihitung dari nilai rata-rata semua sampel negatif F. gigantica ditambah dengan dua kali standar deviasi.
Metode Filtrasi (Saringan bertingkat)
Metode filtrasi yang dilakukan yaitu dengan menggunakan saringan
bertingkat dari kerapatan 400, 100 dan 45 µm. Sampel feses ditimbang sebanyak empat gram, kemudian tambahkan aguades kocok hingga homogen. Larutan feses
tersebut kemudian disaring dengan menggunakan saringan yang telah disusun
berdasarkan kerapatan saringan yaitu 400, 100, dan 45 µm. Pellet yang tertinggal pada saringan pertama dan kedua dibuang, selanjutnya pada saringan ketiga
dikumpulkan dengan menyemprotkan aquades. Pellet tersebut ditampung dalam
cawan petri kemudian ditambahkan satu tetes metilen blue. Kemudian pemeriksaan dilakukan dibawah mikroskop stereo dengan pembesaran 10 x 40 mikron.
Metode McMaster
Metode McMaster adalah cara menghitung telur cacing dengan
mengggunakan kamar hitung McMaster, metode ini diperkenalkan oleh Gordon dan Whitlock (1939). Tinja ditimbang sebanyak dua gram, kemudian dilumatkan dan
dicampur larutan gula garam kira-kira 30 ml, lalu disaring ke dalam gelas piala
berskala. Air gula garam ditambahkan kembali hingga mencapai volume total
suspensi 60 ml. Larutan dikocok hingga homogen, lalu diambil dengan
menggunakan pipet dan diisikan ke dalam kamar-kamar McMaster hingga penuh
tanpa gelembung udara. Biarkan 2-3 menit hingga telur mengapung.
Telur cacing dihitung dengan menggunakan mikroskop, pada daerah yang
bergaris adalah telur yang diperoleh dalam 0,15 ml larutan. Bila banyak, jumlah
rata-rata telur dalam tiap daerah bergaris dikalikan dengan 100, sehingga akan diperoleh
banyaknya telur dalam tiap gram tinja. Pemeriksaan menggunakan mikroskop
HASIL DAN PEMBAHASAN
Isolasi, Produksi dan Karakterisasi Antigen ES F. gigantica
Sampel hati sapi terinfeksi cacing F. gigantica dikoleksi dari sapi yang dipotong di rumah potong hewan Palu dan Purwodadi. Cacing yang dikoleksi dari
hati tersebut mampu menghasilkan ES dengan konsentrasi protein antara
0,430-0,699 mg/ml. Konsentrasi protein antigen ES F. gigantica yang diperoleh hampir sama dengan penelitian sebelumnya yang dilakukan oleh Satrija et al. (2009) yaitu 0,501 mg/ml. Antigen ES F.gigantica sapi yang dihasilkan dalam penelitian ini, digunakan sebagai antigen yang akan mendeteksi keberadaan antibodi poliklonal
(IgG dan IgY). Antigen ES F. gigantica tersebut juga digunakan sebagai kontrol positif pada optimasi uji ELISA Sanwich.
Konsentrasi protein ES F. gigantica asal sapi yang dihasilkan memiliki konsentrasi cukup sebagai antigen. Persyaratan sebuah antigen yang baik agar
dapat menginduksi antibodi berkisar antara 50-1000 µg/ml. Berdasarkan
persyaratan konsentrasi tersebut maka antigen ES F. gigantica asal sapi yang dihasilkan termasuk dalam antigen yang baik digunakan untuk menginduksi antibodi.
Antigen dapat berupa polisakarida, protein, lemak, asam inti atau lipopolisakarida,
maupun lipoprotein (Guyton et al. 2007). Ciri pokok antigenisitas suatu bahan atau senyawa ditentukan dari limitasi fisikokimiawi serta derajat keasingan (Tizard 2004).
Limitasi fisikokimiawi berupa ukuran molekul yaitu besar, kaku, struktur kimia
kompleks, sedangkan derajat keasingan adalah derajat suseptibilitas antigen di
dalam tubuh (Kuby 2007).
Antigen ES yang dihasilkan dari setiap isolasi cacing F. gigantica memiliki konsentrasi berbeda-beda, hal ini terjadi karena adanya perbedaan jumlah cacing
yang diinkubasi. Jumlah antigen ES yang dieksresikan berbanding lurus dengan
jumlah cacing yang diisolasi, diketahui protein esensial menempati jumlah terbanyak
dalam ekskretori dan sekretori Fasciola sp (Ridi et al. 2007). Sehingga semakin banyak cacing yang disolasi, akan menghasilkan banyak protein ES. Rataan
0,18 mg/ml. Hasil analisis statistik menunjukkan faktor jumlah cacing yang diisolasi
berpengaruh terhadap rata-rata konsentrasi ES yang dihasilkan dengan p-value <
alpha 0,05 (0,04), dan model yang digunakan sudah cukup baik karena dapat
menjelaskan 98% (R-sq) keragaman model.
Gambar 5 Jumlah konsentrasi antigen ES yang dihasilkan F. gigantica per ekor
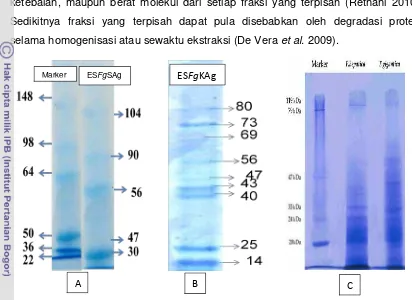
Berdasarkan elektroforesis menggunakan SDS-PAGE tampak bahwa protein
ES F. gigantica asal sapi memiliki lima pola pita protein dengan berat molekul 104,99, 90,05, 56,43, 47, dan 30,27 kDa (Gambar 6 A). Hasil pengamatan ini
berbeda dengan hasil penelitian yang telah dilakukan oleh Meshgi et al. (2008). Mesghi et al menemukan enam pita protein dengan berat molekul yaitu berkisar 42, 33, 24, 20, 16, dan 15 kDa dari ES F. gigantica (Gambar 6 C). Profil protein ES yang dihasilkan dari spesies cacing yang sama, dan inangnya pun spesiesnya
sama, tetapi berasal dari geografis berbeda dapat menghasilkan protein yang
berbeda (Gupta et al. 2003). Perbedaan profil protein ES cacing dipengaruhi oleh berbagai hal seperti teknik isolasi, analisa dan spesies parasit, spesies inang serta
geografi asal inang. Menurut Allam et al. (2002) perbedaan teknik pemisahan protein menghasilkan karakter protein yang berbeda dari cacing Fasciola spp. Perbedaan pola protein dapat pula disebabkan oleh perbedaan spesies cacing dari inang yang
sama, dan dari spesies cacing yang sama inang berbeda serta karena adanya
perbedaan geografis (Ashour et al. 1999; Karimi 2008; Meshgi et al. 2008).
Pada penelitian Mesghi ditemukan jumlah pita protein lebih banyak dari
penelitian ini. Hal ini diduga karena adanya perbedaan penggunaan pewarnaan hasil
elektroforesis, pada penelitian ini menggunakan Comassie brilliant blue sedangkan 0,12 0,17 0,26 0 0,05 0,1 0,15 0,2 0,25 0,3
7 20 52
E S m g / e k o r
25
pada penelitian Mesghi et al (2008) menggunakan pewarna perak nitrat (silver). Kemampuan deteksi dari pewarna yang digunakan, konsentrasi pewarnaan serta pH
berpengaruh terhadap keragaman pola protein, baik jumlah, intensitas, warna,
ketebalan, maupun berat molekul dari setiap fraksi yang terpisah (Retnani 2010).
Sedikitnya fraksi yang terpisah dapat pula disebabkan oleh degradasi protein
selama homogenisasi atau sewaktu ekstraksi (De Vera et al. 2009).
[image:40.612.104.516.150.450.2]
Gambar 6 Profil protein antigen ES F. gigantica asal sapi (A) pada penelitian ini, ES F.gigantica asal kerbau (B)(Satrija et al. 2009), ES F. gigantica asal sapi (C) pewarnaan Silver (Mesghi et al. 2008)
Pola pita protein dari spesies sama namun inangnya berbeda ditemukan
pada penelitian Satrija et al. (2009). Protein ES F. gigantica asal kerbau menurut Satrija et al. memiliki sembilan pita protein dengan berat molekul berkisar antara 14-80 kDa (Gambar 6 B). Antigen ES F. gigantica asal kerbau memiliki dua pita protein yang sama dengan pita protein antigen ES F. gigantica asal sapi dari penelitian ini, yaitu pada berat molekul 56 kDa dan 47 kDa. Pola pita protein yang memiliki berat
molekul sama dari tipe antigen sama, spesies cacing sama walaupun inang berbeda
kemungkinan disebabkan oleh kondisi variasi geografis yang sama (Indonesia).
Cekaman yang diperoleh diduga sama sehingga parasit dewasa menghasilkan ES
yang memiliki suatu enzim sama untuk bertahan. Pada berbagai stadium hidupnya
Marker ESFgSAg ESFgKAg
Fasciola spp menghasilkan adanya jenis antigen ES yang berbeda-beda yang dikenal dengan gut-associated antigen, berasal dari usus parasit yang di lepas ke sirkulasi inang melalui regurgitasi regular isi pencernaan usus (Shehab et al. 1999). Keragaman pola pita protein, berat molekul serta jenis protein yang ditemukan
dalam penelitian ini dari antigen ES F. gigantica akan menjanjikan nilai diagnostik pada hewan dan manusia.
Perbedaan pola pita protein juga tergantung dari tipe protein yang
dipisahkan, antara lain antigen ES, antigen, somatik atau antigen permukaan.
Antigen somatik F. gigantica asal kerbau, sapi dan domba memiliki karakter protein dengan berat molekul yang sama yaitu 34 dan 28 kDa (Yokananth et al. 2005), namun berbeda dengan berat molekul dari antigen ES F. gigantica asal sapi pada penelitian ini. Perbedaan fraksi protein dari sudut pandang taksonomik tergantung
pada tipe protein yang dipisahkan (Boynukara et al. 2004). Soulsby (1982) menyatakan bahwa antigen F. gigantica asal sapi memiliki 20 pola pita polipeptida pada kisaran berat molekul 156-14 kDa.
Pada penelitian Arora et al. (2010) dilaporkan profil polypeptide antigen somatik Paramphistomum epiclitum (PSAg) asal kerbau dengan analisis elektroforesis didapatkan 14 pola pita protein. Profil protein antigen somatik yang
diperoleh mempunyai berat molekul 95,5, 81,8, 70,8, 54,6, 51,6, 43,4, 39,8, 37,6,
35,5, 33,1, 23,7, 21,8, 16,8, dan 14,1 kDa. Berdasarkan berat molekul antigen ES
F. gigantica asal sapi, dengan berat molekul P. epiclitum asal kerbau ini, tidak memiliki persamaan, sehingga kecil kemungkinan akan tejadi reaksi silang. Antigen
ES F. gigantica asal kerbau (Satrija et al. 2009) memiliki berat molekul sama dengan antigen P. epiclitum asal kerbau ini yaitu pada satu pita protein 14 kDa. Berat molekul pada antigen ES F. gigantica asal sapi (Mesghi et al. 2008) dengan berat molekul P. epiclitum asal kerbau (Arora et al. 2010) mempunyai persamaan pada dua pita protein yaitu pada berat molekul 33 dan 16 kDa. Persamaan berat molekul
dari dua pita protein hasil penelitian Mesghi et al. dan Arora et al. kemungkinan didukung oleh variasi geografis yang sama (benua Afrika), walaupun berasal dari
tipe protein berbeda, spesies berbeda, dan inang berbeda. Secara teoritis
banyaknya perbedaan berat molekul yang didapatkan, akan kecil kemungkinan
terjadi reaksi silang antara koproantigen dari berbagai jenis cacing yang berbeda
27
Produksi Poliklonal Antibodi
Antibodi poliklonal diperoleh setelah minggu ke empat immunisasi dengan
antigen ES F. gigantica kerbau. Antibodi yang terbentuk dari serum darah kelinci (IgG anti ESFgK) dideteksi keberadaannya menggunakan uji AGPT. Keberadaa antibodi dalam serum ditandai dengan terbentuknya garis prepisitasi antara antigen
ES F. gigantica sapi dengan serum darah kelinci seperti pada Gambar 7.
Gambar 7 Hasil AGPT Serum Kelinci IgG anti ESFgK
Immunoglobulin G anti ESFg kerbau yang direaksikan dengan antigen ESFg
sapi membentuk garis presipitasi yang dapat diamati secara visual. Garis presipitasi
yang terbentuk merupakan bukti bahwa antibodi yang terdapat dalam serum darah
kelinci adalah antibodi poliklonal. Antibodi poliklonal merupakan antibodi hasil
hiperimunisasi atau imunisasi yang dilakukan secara sengaja terhadap hewan
dengan suatu imunogen yang spesifik (Zola 1987; Smith 1995). Antibodi poliklonal
merupakan kumpulan berbagai klon antibodi yang memiliki spesifisitas, afinitas, dan
isotope yang berbeda. Reaksi antara antibodi poliklonal anti ESFg kerbau dengan sejumlah epitop (antigen determinan) yang berbeda antigen ESFg sapi merupakan reaksi multiple yang dapat menyebabkan reaksi silang. Berdasarkan hasil elektroforesis antigen ESFg kerbau dan ESFg sapi yang memiliki dua pola pita protein dengan berat molekul sama sebesar 47 dan 56 kDa. Kesamaan pola pita
protein memungkinkan kedua pola pita protein ini, memiliki epitop yang sama,
sehingga antigen asal sapi dapat dikenali oleh antibodi anti ES F. gigantica kerbau. Garis presipitasi yang belum tampak pada pengujian serum kelinci pada
minggu pertama hingga minggu ketiga, disebabkan oleh konsentrasi antibodi dalam
serum darah kelinci belum dapat dideteksi melalui AGPT. Pembentukan antibodi
dapat bervariasi dan tergantung pada imunogenitas, bentuk, stabilitas stimulant, Serum kelinci (IgG anti ESFgK)
Antigen ES
spesies hewan, rute injeksi, serta sensitivitas uji yang digunakan untuk mendeteksi
antibodi (Herscowitz 1978). Konsentrasi antibodi terendah mampu dideteksi
menggunakan uji AGPT adalah 30 µg/ml (Tizzard 2004), sedangkan menurut Kuby
(2007) antibodi minimal dalam serum yang dapat dideteksi oleh uji AGPT sebesar
20 µg/ml.
Poliklonal antibodi asal kuning telur (immunoglobulin Y/IgY) yang digunakan
dalam penelitian ini diperoleh dari penelitian Satrija et al. (2009). Hasil uji AGPT terhadap kuning telur menunjukkan adanya garis presipitasi antara ES F.gigantica
asal sapi dengan IgY anti ES F.gigantica kerbau (Gambar 8). Garis presipitasi yang terbentuk pada uji tersebut karena jumlah antibodi dalam serum telah mencapai
proporsi optimal yaitu equivalence zone. Equivalence zone merupakan kondisi ketika antigen dan antibodi berada dalam proporsi yang optimal sehingga
membentuk agregasi dan sedimentasi yang dapat diamati berupa garis
presipitasi/homolog (Barriga 1981).
Gambar 8 Hasil AGPT Kuning Telur IgY
Antibodi poliklonal yang dihasilkan yaitu IgG dan IgY merupakan antibodi
poliklonal yang akan digunakan sebagai antibodi pendeteksi dan antibodi
penangkap dalam tahap optimasi ELISA Sandwich. Konsentrasi protein IgG yang diperoleh pada penelitian ini adalah 1,091 mg/ml dan IgY 1,178 mg/ml. uji ELISA
mampu mendeteksi antibodi dengan konsentrasi berkisar antara 2-10 µg/ml (Kemeny 1991). Pada penelitian ini antibodi diencerkan sehingga konsentrasi yang
digunakan berkisar antara 0,5-4 µg/ml.
Optimasi ELISA
Antigen ES
F. gigantica asal sapi Kuning telur IgY
29
Optimasi ELISA Sandwich dilakukan dengan menggunakan dua kombinasi model ELISA. Kombinasi model ELISA pertama yaitu menggunakan IgG sebagai
antibodi penangkap dan IgY sebagai antibodi pendeteksi, sedangkan model ELISA
kedua menggunakan IgY sebagai antibodi penangkap dan IgG sebagai antibodi
pendeteksi. IgG yang digunakan pada model kombinasi pertama sebagai antibodi
penangkap memiliki konsentrasi 0,5, 1, 2, dan 4 µg/ml, dan IgY sebagai antibodi
pendeteksi dengan konsentrasi 2 µg/ml dan 1 µg/ml. Antigen yang digunakan dalam
uji ini adalah ES F.gigantica asal sapi dengan konsentrasi 5 µg/ml. Konsentrasi antigen yang dapat terdeteksi dengan baik dalam uji ELISA 0,5-5 µg/ml (Kemeny
1991).
Hasil pengujian model ELISA pertama menunjukkan bahwa pada konsentrasi
IgG 4 µg/ml dan IgY dengan konsentrasi 1 µg/ml dan 2 µg/ml, didapatkan kelipatan
nilai absorbansi sampel positif sebesar 1,85 dan 3,31 kali lipat dari nilai absorbansi
sampel negatif (Gambar 9). Variasi konsentrasi IgG sebagai antibodi penangkap
menghasilkan nilai absorbansi yang berbeda. Konsentrasi IgG 2 µg/ml
menghasilkan kelipatan nilai absorbansi sampel positif sebesar 1,68 dan 1,94 kali
lipat dari nilai absorbansi negatif. Konsentrasi IgG 1 µg/ml dan 0,5 µg/ml
masing-masing menghasilkan kelipatan nilai absorbansi sampel positif sebesar 2,42 dan