EFEK ANTIBAKTERI EKSTRAK ETANOL LERAK (
Sapindus
rarak DC
) SEBAGAI ALTERNATIF BAHAN IRIGASI
SALURAN AKAR TERHADAP
Porphyromonas
gingivalis
(Penelitian
In Vitro
)
SKRIPSI
Diajukan untuk memenuhi tugas dan melengkapi syarat memperoleh gelar Sarjana Kedokteran Gigi
Oleh: VIVI LEONTARA
NIM: 100600050
FAKULTAS KEDOKTERAN GIGI
UNIVERSITAS SUMATERA UTARA
Fakultas Kedokteran Gigi
Departemen Konservasi Gigi Tahun 2014
Vivi Leontara
Efek Antibakteri Ekstrak Etanol Lerak Sebagai Alternatif Bahan Irigasi Saluran Akar terhadap Porphyromonas gingivalis (Penelitian in Vitro)
xii + 71 halaman
Porphyromonas gingivalis merupakan salah satu bakteri yang sering
ditemukan pada infeksi endodontik primer dan tumbuh dalam bentuk biofilm. Tindakan irigasi pada cleaning and shaping diperlukan untuk membantu menghilangkan biofilm tersebut, namun sampai saat ini belum ada bahan irigasi yang ideal. Buah lerak merupakan salah satu bahan alami yang sering dipakai sebagai pembersih dan dapat dikembangkan menjadi alternatif bahan irigasi saluran akar. Tujuan penelitian ini adalah untuk mengetahui efek antibakteri ekstrak etanol lerak terhadap P.gingivalis.
Sebanyak 940 gram buah lerak diekstraksi dengan pelarut etanol sehingga diperoleh ekstrak kental. Kemudian dilakukan pengenceran dalam Mueller Hinton
Broth (MHB) dengan metode dilusi sehingga diperoleh konsentrasi 100%, 50%, 25%,
12,5%, 6,25%, 3,125% dan 1,625%. Setiap konsentrasi diambil 1 ml, tambahkan 1 ml suspensi bakteri, divorteks, diinkubasi 37°C selama 24 jam. Setelah itu, setiap
Uji antibakteri pada konsentrasi 100%, 50% dan 25% menunjukkan hasil steril (0), konsentrasi 12,5% dan 6,25% terlihat pertumbuhan bakteri (1,18.103 ± 0,29.103) dan (2,62.103 ± 0,77.103) CFU/ml, konsentrasi 3,125% dan 1,625% didapat TBUD. Hasil uji statistik dengan one way ANOVA menunjukkan bahwa ekstrak etanol lerak memiliki efek antibakteri terhadap P.gingivalis (p = 0,000) dan uji LSD menunjukkan adanya perbedaan yang bermakna antara konsentrasi 100% dengan 12,5%, konsentrasi 100% dengan 6,25%, konsentrasi 50% dengan 12,5%, konsentrasi 50% dengan 6,25%, konsentrasi 25% dengan 12,5%, konsentrasi 25% dengan 6,25% dan konsentrasi 12,5% dengan 6,25% (p = 0,000), sedangkan KHM belum dapat diketahui.
Kesimpulan penelitian, ekstrak etanol lerak mempunyai efek antibakteri terhadap P.gingivalis dengan nilai KBM 25% dan KHM tidak diketahui.
EFEK ANTIBAKTERI EKSTRAK ETANOL LERAK (
Sapindus
rarak DC
) SEBAGAI ALTERNATIF BAHAN IRIGASI
SALURAN AKAR TERHADAP
Porphyromonas
gingivalis
(Penelitian
In Vitro
)
SKRIPSI
Diajukan untuk memenuhi tugas dan melengkapi syarat memperoleh gelar Sarjana Kedokteran Gigi
Oleh: VIVI LEONTARA
NIM: 100600050
FAKULTAS KEDOKTERAN GIGI
UNIVERSITAS SUMATERA UTARA
PERNYATAAN PERSETUJUAN
Skripsi ini telah disetujui untuk dipertahankan di hadapan tim penguji skripsi
Medan, 22 April 2014
Pembimbing: Tanda Tangan
Nevi Yanti, drg., M.kes
TIM PENGUJI SKRIPSI
Skripsi ini telah dipertahankan di hadapan tim penguji Pada tanggal 22 April 2014
TIM PENGUJI
KETUA : Nevi Yanti,drg.,M.Kes
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa yang telah memberikan rahmat dan karunia-Nya, sehingga skripsi ini telah selesai disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Gigi pada Fakultas Kedokteran Gigi Universitas Sumatera Utara.
Ucapan terima kasih yang sebesar-besarnya penulis sampaikan kepada orang tua tercinta yaitu Papa (Army Siregar) dan Mama (Sedjani Wartima) serta kakek (Irwan) dan nenek (Wartima) tercinta yang telah membesarkan serta memberikan kasih sayang yang tidak terbalas, doa, semangat, nasehat dan dukungan baik secara moral maupun materi kepada penulis sehingga mampu menyelesaikan skripsi ini Penulis juga mengucapkan terima kasih kepada kakak (Stern Molly Leontara) dan kedua adik (Leon Abri Siregar dan Stella Jovita Leontara) serta seluruh keluarga penulis yang selalu memberi dukungan dan masukan kepada penulis.
Dalam penulisan skripsi ini, penulis telah banyak mendapat bimbingan dan bantuan dari berbagai pihak. Untuk itu, dengan segala kerendahan hati dan penghargaan yang tulus, penulis ingin mengucapkan terima kasih yang sebesar-besanya kepada:
1. Prof. H. Nazruddin, drg., Ph.D., C.Ort, Sp.Ort. selaku Dekan Fakultas Kedokteran Gigi Universitas Sumatera Utara
2. Cut Nurliza, drg., M.Kes, selaku Ketua Departemen Ilmu Konservasi Gigi, Fakultas Kedokteran Gigi, Universitas Sumatera Utara, yang telah membantu dalam kelancaran skripsi ini.
3. Nevi Yanti, drg., M.Kes, selaku dosen pembimbing yang telah meluangkan waktu, tenaga, dan pikiran serta dengan sabar memberikan bimbingan, arahan, motivasi, nasihat dan semangat kepada penulis selama penulisan skripsi ini hingga selesai.
saran, bantuan dan masukan dalam penyelesaian skripsi ini beserta pegawai Departemen Ilmu Konservasi Gigi, Fakultas Kedokteran Gigi, Universitas Sumatera Utara atas bantuan dan motivasi sehingga skripsi ini berjalan dengan lancar.
5. Widi Prasetia, drg., selaku penasehat akademik yang telah membimbing penulis selama menyelesaikan program akademik di Fakultas Kedokteran Gigi, Universitas Sumatera Utara.
6. Seluruh staf pengajar di Fakultas Kedokteran Gigi, Universitas Sumatera Utara, yang telah mendidik, membimbing dan membantu selama menuntut ilmu di masa pendidikan.
7. Drs. Awaluddin Saragih, M.Si., Apt. selaku Kepala Laboratorium Obat Tradisional Fakultas Farmasi, Universitas Sumatera Utara dan Imam Bagus Sumantri, S.Farm, Apt. yang telah banyak membagi ilmunya, memberi semangat, masukan, meluangkan waktunya untuk diskusi serta membantu dalam penelitian ini.
8. Asisten Laboratorium Obat Tradisonal Fakultas Farmasi USU Bang Arya dan Bang Ary yang telah banyak memberikan dukungan dan bantuan selama proses ekstraksi.
9. Wahyu Hidayatiningsih, S.Si, M.Kes selaku penanggung jawab penelitian di Laboratorium Pusat Penyakit Tropis UNAIR yang telah membantu selama kegiatan penelitian di laboratorium.
10. Maya Fitria, SKM, M.Kes yang telah membantu dan meluangkan waktunya untuk berdiskusi dalam pengolahan data statistika.
11. Teman-Teman seperjuangan yang melaksanakan penulisan skripsi Di Departemen Konservasi Fakultas Kedokteran Gigi Universitas Sumatera Utara: Jocelyn, Nurul, Vika, Jessica, Fajarini, Erda, Diajeng, Sondi, Naftalia, Natrya, Faber, Iqbal, Anita atas dukungan dan bantuannya selama pengerjaan skripsi.
Kelvin, Franky, Widi, Roderick, Mery, Cindy, Ratna, Ricky, Ericko, Erwin, senior: Fifin Indah Sari, Silvia Lim, Jacky, Calvin serta seluruh teman-teman angkatan 2010, senior dan junior yang tidak dapat disebutkan namanya satu per satu atas dukungan semangat, doa dan bantuan yang telah diberikan kepada penulis selama ini.
Semoga Tuhan Yang Maha Esa membalas kebaikan dan memberikan kemudahan kepada kita. Penulis menyadari bahwa dalam penulisan skripsi ini masih terdapat banyak kekurangan, oleh karena itu penulis memohon maaf yang sebesar-besarnya apabila terdapat kesalahan selama penyusunan skripsi ini. Dengan segala kerendahan hati, penulis mengharapkan semoga hasil karya atau skripsi ini dapat memberikan sumbangan pikiran yang berguna bagi fakultas, pengembangan ilmu pengetahuan dan masyarakat.
Medan, 22 April 2014 Penulis,
DAFTAR ISI
Halaman HALAMAN JUDUL ...
HALAMAN PERSETUJUAN ... HALAMAN TIM PENGUJI SKRIPSI ...
KATA PENGANTAR ... iv
2.1.1.2 Ethylenediaminetetraacetic acid (EDTA) ... 9
2.1.1.3 Klorheksidin (CHX) ... 9
2.1.1.4 MTAD ... 10
2.1.2 Teknik Irigasi Saluran Akar ... 11
2.2 Porphyromonas gingivalis sebagai salah satu bakteri yang tergabung dalam biofilm pada infeksi endodontik primer... 15
2.3 Buah Lerak (Sapindus Rarak DC) ... 25
2.4 Kerangka Teori... 28
2.6 Hipotesis Penelitian ... 29
3.3.4 Variabel Tidak Terkendali ... 34
3.4 Definisi Operasional... 34
3.5 Bahan dan Alat Penelitian ... 36
3.7.2 Pembuatan Suspensi Bahan Uji... 39
3.7.3 Pembuatan Media Bakteri ... 40
3.7.4 Pembiakan Spesimen... 40
3.7.5 Penentuan KHM Bahan Coba ... 41
3.7.6 Penentuan KBM Bahan Coba ... 41
3.8 Analisis Data ... 42
BAB 4 HASIL PENELITIAN 4.1 Ekstrak Kental Lerak... 43
4.2 Uji Efektifitas Antibakteri ... 43
4.3 Analisis Hasil Penelitian ... 47
DAFTAR TABEL
Tabel Halaman
1 Hasil uji efektifitas antibakteri ekstrak lerak (Sapindus rarak DC) dalam pelarut etanol terhadap Porphyromonas gingivalis pada
konsentrasi 100%, 50%, 25%, 12,5%, 6,25%, 3,125%, 1,625%. ... 44 2 Uji normalitas data ekstrak etanol lerak terhadap P.gingivalis ... 47
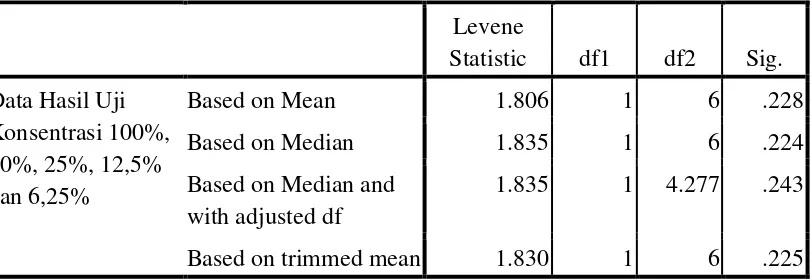
3 Uji Levene terhadap hasil data pada konsentrasi 100%, 50%, 25%,
12,5% dan 6,25% ... 47 4 Hasil uji One Way ANOVA pada konsentrasi 100%, 50%, 25%,
12,5% dan 6,25% ... 48 5 Hasil uji LSD efek antibakteri ekstak etanol lerak terhadap
DAFTAR GAMBAR
Gambar Halaman
1 Gambar sebenarnya (atas), gambar tiga dimensi (bawah). Jarum A-C (open end): (A) flat, (B) bevel, (C) notched. Jarum D-F (closed
5 Microbial biofilm pada tubulus dentin dan dinding saluran akar ... 17
6 Bakteri P.gingivalis ... 18
7 Prevalensi P.gingivalis pada infeksi endodontik kronis dengan berbagai bentuk periodontitis apikalis yang berbeda ... 20
8 Perhitungan dari 40 spesies bakteri (x105 ± SE) pada 30 kasus asimptomatik dan 30 kasus asimptomatik pada lesi kronis infeksi endodontik primer. Urutan spesies berdasarkan jumlah mean counts secara menurun dari sampel kasus simptomatik. (Mann-Whitney U test) ... 23
9 Interaksi antar bakteri dalam infeksi saluran akar dimana perkembangan dari sebagian spesies tergantung dari produk metabolisme spesies lainnya. Kehadiran suatu jenis bakteri mempengaruhi bakteri lainnya, sehingga hubungan antar setiap jenis bakteri tidak dapat dipisahkan... 24
10 Buah lerak yang berasal dari Desa Maga, Kecamatan Panyabungan Tapanuli Selatan (skala = 1cm) ... 26
11 Pencucian buah lerak ... 38
12 Penimbangan buah lerak ... 38
14 Lemari pengering ... 38
15 Potongan lerak di lemari pengering ... 38
16 Potongan lerak yang sudah kering ... 38
17 Potongan lerak diblender ... 39
18 Simplisia lerak ... 39
19 Simplisia di dalam perkolator ... 39
20 Vaccum rotavapor ... 39
21 P.gingivalis ATTCC 33277 yang telah dibiakkan secara murni pada media MHA dalam suasana anaerob ... 41
22 Ekstrak Lerak ... 43
23 Pertumbuhan bakteri pada media MHA setelah diberi bahan coba ekstrak lerak pada berbagai konsentrasi. Zona bening pada MHA pada konsentrasi (a) 100%, (b) 50%, (c) 25% menunjukkan tidak adanya pertumbuhan bateri ... 45
24 Konsentrasi (d) 12,5%, (e) 6,25%, (f) 3,125%, (g) 1,625% menunjukkan pertumbuhan bakteri masih subur yang ditandai dengan tetesan bewarna lebih keruh dibandingkan warna media. ... 46
DAFTAR LAMPIRAN
Lampiran
1 Alur Ekstraksi Lerak
2 Alur Penyiapan Suspensi Bakteri
3 Alur pengujian Efek Antibakteri Ekstrak Etanol Lerak 4 Sertifikat Hasil Uji Mikrobiologi
Fakultas Kedokteran Gigi
Departemen Konservasi Gigi Tahun 2014
Vivi Leontara
Efek Antibakteri Ekstrak Etanol Lerak Sebagai Alternatif Bahan Irigasi Saluran Akar terhadap Porphyromonas gingivalis (Penelitian in Vitro)
xii + 71 halaman
Porphyromonas gingivalis merupakan salah satu bakteri yang sering
ditemukan pada infeksi endodontik primer dan tumbuh dalam bentuk biofilm. Tindakan irigasi pada cleaning and shaping diperlukan untuk membantu menghilangkan biofilm tersebut, namun sampai saat ini belum ada bahan irigasi yang ideal. Buah lerak merupakan salah satu bahan alami yang sering dipakai sebagai pembersih dan dapat dikembangkan menjadi alternatif bahan irigasi saluran akar. Tujuan penelitian ini adalah untuk mengetahui efek antibakteri ekstrak etanol lerak terhadap P.gingivalis.
Sebanyak 940 gram buah lerak diekstraksi dengan pelarut etanol sehingga diperoleh ekstrak kental. Kemudian dilakukan pengenceran dalam Mueller Hinton
Broth (MHB) dengan metode dilusi sehingga diperoleh konsentrasi 100%, 50%, 25%,
12,5%, 6,25%, 3,125% dan 1,625%. Setiap konsentrasi diambil 1 ml, tambahkan 1 ml suspensi bakteri, divorteks, diinkubasi 37°C selama 24 jam. Setelah itu, setiap
Uji antibakteri pada konsentrasi 100%, 50% dan 25% menunjukkan hasil steril (0), konsentrasi 12,5% dan 6,25% terlihat pertumbuhan bakteri (1,18.103 ± 0,29.103) dan (2,62.103 ± 0,77.103) CFU/ml, konsentrasi 3,125% dan 1,625% didapat TBUD. Hasil uji statistik dengan one way ANOVA menunjukkan bahwa ekstrak etanol lerak memiliki efek antibakteri terhadap P.gingivalis (p = 0,000) dan uji LSD menunjukkan adanya perbedaan yang bermakna antara konsentrasi 100% dengan 12,5%, konsentrasi 100% dengan 6,25%, konsentrasi 50% dengan 12,5%, konsentrasi 50% dengan 6,25%, konsentrasi 25% dengan 12,5%, konsentrasi 25% dengan 6,25% dan konsentrasi 12,5% dengan 6,25% (p = 0,000), sedangkan KHM belum dapat diketahui.
Kesimpulan penelitian, ekstrak etanol lerak mempunyai efek antibakteri terhadap P.gingivalis dengan nilai KBM 25% dan KHM tidak diketahui.
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Bakteri memegang peranan utama dalam perkembangan dan terjadinya penyakit pulpa dan periapikal. Penyakit pulpa dan periapikal dapat terjadi karena adanya infeksi oportunis patogen oleh bakteri yang menyerang jaringan pulpa dan periapikal. Pada infeksi saluran akar, terjadi infeksi polimikrobial di mana spesies bakteri yang berbeda-beda memiliki hubungan yang erat antara satu sama lain sehingga interaksi antar bakteri merupakan hal yang tidak dapat dihindari. Bakteri-bakteri ini tumbuh dan membentuk suatu kesatuan dalam komunitas yang terintegrasi secara metabolik yang disebut dengan biofilm.1,2 Bakteri-bakteri dalam bentuk biofilm memiliki virulensi yang lebih tinggi dan cenderung lebih sulit untuk dieliminasi.1
Bakteri anaerob meliputi lebih dari 90% bakteri pada biofilm yang terbentuk pada infeksi endodontik primer.2,3 Salah satu dari bakteri anaerob tersebut adalah bakteri Porphyromonas gingivalis (P.gingivalis), yaitu bakteri obligat anaerob berpigmen hitam gram negatif yang menginfeksi jaringan periapikal.4 Bakteri ini memiliki aktifitas proteolitik, sehingga sering dihubungkan dengan proses terjadinya abses periapikal.1 Penelitian menunjukkan bahwa bakteri P.gingivalis memiliki persentase sebesar 28% - 43,3% pada pulpa dengan infeksi endodontik primer.1,5-7
P.gingivalis diketahui memiliki berbagai faktor virulensi patogenik yang berperan
dalam menyebabkan penyakit. Faktor virulensi tersebut antara lain seperti fimbriae,
capsule, extracellular vesicles, hemagglutinin, gingipain, hydrolytic enzymes dan
lipopolysaccharide (LPS).8
simptom klinis serta pembentukan abses.3 Penelitian lain juga menunjukkan bahwa infeksi silang antara P.gingivalis dengan Bacteroides forythus pada infeksi saluran akar akan meningkatkan resiko terjadinya periodontitis apikalis kronis.5 Selain itu, kombinasi dari Porphyromonas sp., Prevotella sp., dan F.nucleatum akan meningkatkan faktor resiko terjadinya flare up endodonti. Hal ini disebabkan adanya sinergi antara bakteri-bakteri tersebut, sehingga meningkatkan intensitas terjadinya inflamasi pada jaringan periapikal.9 Oleh sebab itu perlu dilakukan tindakan perawatan saluran akar untuk menghilangkan seluruh jaringan nekrotik dan mikroorganisme yang terdapat pada saluran akar yang terinfeksi.10
Tahapan penting dalam perawatan saluran akar gigi yang terinfeksi adalah preparasi biomekanis yang terdiri dari cleaning and shaping, sterilisasi dan pengisian saluran akar. Preparasi biomekanis yang baik akan menunjang proses sterilisasi dan menghasilkan pengisian yang baik sehingga didapatkan hasil yang maksimal.10 Pada proses cleaning and shaping, tindakan irigasi memegang peranan yang sangat penting karena dapat menghilangkan smear layer yang terbentuk dan mengeliminasi mikroorganisme yang ada.11 Larutan irigasi yang ideal untuk digunakan harus memiliki beberapa sifat, yaitu dapat melarutkan jaringan nekrotik dan smear layer, dapat melumasi saluran akar, membunuh mikroorganisme, memiliki tegangan permukaan yang rendah, tidak toksik dan tidak mengiritasi jaringan sehat. Faktor lain yang harus dipertimbangkan adalah mudah diperoleh, relatif murah, mudah digunakan, mudah disimpan dan dapat disimpan cukup lama.10-12 Namun, sampai saat ini belum ada satupun larutan irigasi yang memenuhi seluruh kriteria diatas.13
smear layer, korosif pada instrumen yang terbuat dari metal, kurang efektif pada saluran akar yang sempit, mempunyai bau yang kurang enakdan dapat menyebabkan reaksi alergisehingga harus hati-hati dalam penggunaannya.10,14
Ethylenediamine Tetra-Acetic Acid (EDTA) mulai digunakan sebagai bahan
irigasi sejak tahun 1957.11 Penggunaan EDTA efektif untuk mendemineralisasi permukaan dentin dan menghilangkan smear layer, namun tidak efektif untuk menghilangkan debris organik dan tidak memiliki efek antimikrobial. Oleh sebab itu, penggunaan EDTA sering dikombinasikan dengan NaOCl yang dapat melarutkan jaringan pulpa dengan baik dan memiliki efek antimikrobial.15
Larutan irigasi lainnya yang juga sering digunakan yaitu CHX karena bersifat biokompatibel dan memiliki efek antimikrobial yang luas sehingga dapat juga digunakan sebagai bahan medikamen.11 Hal ini disebabkan karena adanya perlekatan antara CHX dengan hidroksiapatit pada dentin sehingga dapat menghasilkan efek antimikrobial yang bertahan lama.11,13 CHX sangat efektif untuk melawan bakteri
E.faecalis namun kurang efektif terhadap bakteri gram negatif dan tidak dapat
melarutkan jaringan nekrotik dan debris sehingga dapat menyumbat tubulus dentin.12,13
Mixture of tetracycline isomer, acid and detergent (MTAD) merupakan bahan
irigasi berbasis antibiotik yang dikembangkan dari campuran tetracycline isomer, asam dan deterjen.11,15,16 MTAD telah dibuktikan efektif untuk mengeliminasi mikroorganisme yang resisten dan memiliki aktivitas antimikroba secara berkepanjangan.15 MTAD juga bersifat biokompatibel dan efektif untuk menghilangkan smear layer. Namun, tidak tertutup kemungkinan semakin berkembangnya bakteri yang resisten akibat penggunaan bahan irigasi berbasis antibiotik.16 MTAD juga kurang efektif dalam melarutkan jaringan organik dan penelitian secara in vitro juga melaporkan bahwa penggunaan MTAD dalam jangka panjang dapat menyebabkan stain pada jaringan keras gigi.17
utama dan fokus pembangunan JAKSTRANAS IPTEK 2010-2014 mengenai teknologi kesehatan dan obat-obatan yang program utamanya berupa penerapan teknologi produksi yang ramah lingkungan, meningkatkan pengelolaan kelestarian pemanfaatan sumber daya alam dan iklim global, karena limbah dari obat-obatan berbahan dasar alami akan lebih mudah diurai daripada limbah bahan-bahan sintetis yang dapat merusak jaringan hidup dan membutuhkan waktu yang sangat lama agar terurai secara sempurna.18
Buah lerak (Sapindus rarak DC) merupakan salah satu alternatif bahan alami yang dapat dikembangkan sebagai bahan irigasi saluran akar. Buah lerak secara tradisional sering digunakan sebagai pencuci kain batik dan emas, sebagai pembersih muka untuk menghilangkan jerawat serta dapat digunakan sebagai obat penyakit kulit, terutama penyakit kudis.19 Kandungan utama buah lerak adalah saponin triterpenoid yang merupakan senyawa aktif permukaan dan bersifat seperti deterjen.19,20 Penelitian menunjukkan bahwa buah dalam bentuk hasil ekstraksi telah dilaporkan mengandung saponin dengan kadar lebih tinggi daripada buah yang tanpa diekstrak.20
Salah satu syarat lain dari bahan irigasi yang ideal adalah memiliki tegangan permukaan yang rendah. Hasil penelitian menunjukkan bahwa ekstrak lerak 17,5% dan 20% memiliki tegangan permukaan yang sama dengan CHX 2% dan lebih rendah pada konsentrasi 25%,28 sedangkan bila dibandingkan dengan NaOCl 2,5% ekstrak etanol lerak memiliki tegangan permukaan yang lebih rendah pada konsentrasi 5% - 25%.29 Pada penelitian lain, tidak ditemukan adanya perbedaan yang bermakna antara celah mikro dan kekuatan tarik resin komposit dengan dentin yang dihasilkan ekstrak lerak dalam pelarut etanol 0,01% dengan kombinasi NaOCl 5% dan EDTA 18%.30,31
Dari uraian di atas, dapat dilihat bahwa walaupun sudah ada penelitian untuk mengetahui efek antibakteri ekstrak lerak terhadap S.mutans, F.nucleatum dan
E.faecalis, serta efek antifungal terhadap C.albicans, namun belum ada penelitian
mengenai efek antibakteri ekstrak lerak terhadap P.gingivalis sebagai salah satu bakteri yang sering ditemukan pada infeksi endodontik primer. Penelitian menunjukkan bahwa tindakan irigasi dengan metode yang tepat menggunakan larutan sodium hipoklorit (NaOCl) dan klorheksidin (CHX) dalam berbagai konsentrasi dapat mengeliminasi bakteri P.gingivalis dalam 15 detik secara signifikan.14 Oleh karena itu, perlu dilakukan pengujian efek antibakteri ekstrak lerak terhadap
P.gingivalis dengan menentukan nilai Kadar Hambat Minimum (KHM) dan Kadar
Bunuh Minimum (KBM).
1.2 Rumusan Masalah
Berdasarkan uraian di atas, maka dapat dirumuskan permasalahan berikut ini: Apakah ekstrak etanol lerak mempunyai efek antibakteri terhadap P.gingivalis sehingga dapat digunakan sebagai alternatif bahan irigasi saluran akar diukur dari nilai KHM dan KBM ekstrak etanol lerak?
1.3 Tujuan Penelitian
1.4Manfaat Penelitian
1.4.1 Manfaat Teoritis
1. Sebagai dasar untuk penelitian lebih lanjut tentang pengembangan ekstrak etanol buah lerak (Sapindus rarak DC) sebagai alternatif bahan irigasi saluran akar.
2. Hasil penelitian ini diharapkan dapat digunakan sebagai studi/ referensi tambahan tentang bahan irigasi dari ekstrak etanol lerak untuk digunakan pada perawatan saluran akar bagi bidang ilmu kedokteran gigi khususnya konservasi.
1.4.2 Manfaat Praktis
1. Sebagai pendekatan yang dilakukan untuk meningkatkan pengembangan material kedokteran gigi yang berasal dari alam sehingga limbahnya lebih mudah terurai dan bersifat biokompatibel dengan cara kerja yang berbeda dari bahan terdahulu.
2. Sebagai informasi bagi dokter gigi dalam meningkatkan pelayanan kesehatan gigi masyarakat menggunakan bahan alami yang mudah didapat dengan harga terjangkau.
BAB 2
TINJAUAN PUSTAKA
Preparasi biomekanis saluran akar adalah salah satu langkah penting dalam perawatan endodonti yang bertujuan untuk membentuk dan membersihkan sistem saluran akar sebelum dilakukan pengisian saluran akar. Saluran akar dapat dibentuk dengan instrumen tangan ataupun rotary instrument dan harus selalu disertai dengan tindakan irigasi saluran akar. Tindakan irigasi saluran akar sangat penting karena bertujuan untuk menghilangkan debris, smear layer beserta mikroorganisme dari saluran akar yang tidak dapat dijangkau hanya dengan menggunakan instrumen mekanis.11 Salah satunya adalah untuk mengeliminasi bakteri P.gingivalis yang sering ditemukan pada infeksi endodontik primer.3,11 Banyak penelitian yang dilakukan untuk mengembangkan bahan alami sebagai alternatif bahan irigasi saluran akar, salah satunya adalah lerak. Untuk itu, ekstrak lerak diharapkan dapat dikembangkan menjadi bahan irigasi saluran akar yang dapat membunuh mikroba, bersifat biokompatibel, antiinflamasi, analgetik dan mempunyai nilai tegangan permukaan yang rendah.
2.1 Irigasi Saluran Akar
saluran akar yang kompleks sehingga dapat menyebabkan kegagalan perawatan endodonti.10
2.1.1 Bahan Irigasi Saluran Akar
Sejak dulu, berbagai bahan irigasi saluran akar dalam bentuk larutan telah dikembangkan untuk memaksimalkan tindakan cleaning and shaping dalam perawatan endodonti.32 Tentu saja dalam pengembangannya, suatu bahan irigasi harus memenuhi beberapa kriteria-kriteria yang telah ditetapkan. Bahan irigasi yang ideal harus memiliki beberapa sifat, yaitu dapat melarutkan jaringan nekrotik dan
smear layer, dapat melumasi saluran akar, membunuh mikroorganisme, memiliki
tegangan permukaan yang rendah, tidak toksik dan tidak mengiritasi jaringan sehat. Faktor lain yang harus dipertimbangkan adalah mudah diperoleh, relatif murah, mudah digunakan, mudah disimpan dan dapat disimpan cukup lama.10-12 Namun, sampai saat ini belum ada satupun larutan irigasi yang memenuhi seluruh kriteria diatas.13 Oleh sebab itu, dengan perkembangan ilmu pengetahuan dan teknologi saat ini, telah sering digunakan kombinasi dari berbagai bahan irigasi tunggal untuk mengatasi kelemahan masing-masing.32
2.1.1.1 Sodium Hipoklorit (NaOCl)
digunakan, maka potensi untuk mengiritasi jaringan juga semakin besar. Oleh karena itu, jarum irigasi harus ditempatkan secara longgar agar bahan irigasi NaOCl tidak melewati foramen apikal karena dapat menyebabkan iritasi yang serius pada jaringan periapikal.13
2.1.1.2 Ethylenediaminetetraacetic acid (EDTA)
Ethylenediamine Tetra-Acetic Acid (EDTA) mulai digunakan sebagai bahan
irigasi sejak tahun 1957.11 Penggunaan EDTA efektif untuk mendemineralisasi permukaan dentin dan menghilangkan smear layer, namun tidak efektif untuk menghilangkan debris organik dan tidak memiliki efek antimikrobial. Oleh sebab itu, penggunaan EDTA sering dikombinasikan dengan NaOCl yang dapat melarutkan jaringan pulpa dengan baik dan memiliki efek antimikrobial.15 Namun, penggunaannya harus dilakukan secara terpisah karena EDTA sangat reaktif terhadap NaOCl.32 Efek EDTA pada dentin bergantung pada konsentrasi larutan dan lamanya waktu berkontak dengan dentin.33 EDTA efektif digunakan pada pH netral dan konsentrasi yang umum dipakai dalam bidang endodonti adalah 17%. Waktu yang direkomendasikan adalah irigasi dengan EDTA 17% selama 1 menit pada akhir prosedur preparasi untuk menghilangkan smear layer. Dentin yang terpapar EDTA selama lebih dari 10 menit dapat menyebabkan dentin peritubular dan intratubular terkikis berlebihan.10,11
2.1.1.3 Klorheksidin (CHX)
ini disebabkan karena adanya perlekatan antara CHX dengan hidroksiapatit pada dentin sehingga menghasilkan efek antimikrobial yang bertahan lama.11,13
CHX bersifat bakteriostatik pada konsentrasi minimal 0,2% dan bakterisidal pada konsentrasi 2% sehingga CHX 2% lebih sering digunakan sebagai bahan irigasi saluran akar.12,32,33 Beberapa penelitian menemukan bahwa CHX 2% memiliki efek antibakterial yang sedikit lebih baik dari NaOCl 5,25%.11,33 Walaupun CHX bersifat biokompatibel dan memiliki efek antibakterial yang baik, namun CHX kurang efektif terhadap bakteri gram negatif dan tidak dapat digunakan sebagai irigan tunggal karena CHX tidak dapat melarutkan jaringan nekrotik dan debris sehingga dapat menyumbat tubulus dentin.12,13 Oleh sebab itu, penggunaan CHX biasanya dikombinasikan bersama bahan irigasi lain seperti NaOCl/EDTA dan digunakan sebagai final rinse.32
2.1.1.4 MTAD
Mixture of tetracycline isomer, acid and detergent (MTAD) merupakan bahan
namun masih sangat sedikit penelitian yang membandingkan tentang keefektifannya terhadap NaOCl dan CHX sehingga belum diketahui apakah MTAD merupakan bahan irigasi yang lebih baik dari NaOCl dan CHX.12
2.1.2 Teknik Irigasi Saluran Akar
Berbagai teknik irigasi saluran akar telah dikembangkan dalam ilmu endodonti hingga saat ini. Secara garis besar, teknik irigasi saluran akar terbagi atas dua cara, yaitu secara manual dan machine assisted irrigation. Teknik irigasi saluran akar secara manual adalah teknik irigasi sederhana yang umumnya menggunakan
syringe plastik dan jarum yang dibengkokkan.10,34,35 Prinsip dari teknik ini adalah
menggunakan positive pressure dalam aplikasinya.34 Jarum irigasi dibengkokkan menjadi sudut tumpul agar dapat mencapai saluran, baik pada gigi posterior maupun gigi anterior.10 Posisi jarum hendaknya longgar di dalam kanal, hal ini bertujuan untuk memungkinkan pengaliran kembali larutan untuk membawa debris dan menghindari penekanan larutan ke dalam jaringan periapikal.10,34,35 Menurut penelitian, pada penggunaan teknik irigasi manual, bahan irigasi hanya tersebar 1 mm di bawah ujung jarum. Hal ini merupakan kekurangan dari teknik manual, mengingat ujung jarum biasanya hanya terletak di 1/3 koronal sampai 1/3 tengah sehingga penetrasi bahan irigasi kurang maksimal.34
secara umum meliputi jarum dengan ujung terbuka (open end) dan ujung tertutup
(closed end) (Gambar 1). Jarum open end terdiri dari flat, bevel, dan notched.
Sedangkan jarum closed end terdiri dari side vented, double side vented dan
multivented.34 Walaupun jenis jarum irigasi ini berbeda-beda, namun tujuan utama
dari penggunaan jarum irigasi ini tetap sama yaitu untuk membersihkan debris, smear
layer dan mengeliminasi mikroorganisme secara maksimal.13
Gambar 1.
Flow larutan irigasi dengan menggunakan jarum open end sangat berbeda bila dibandingkan dengan jarum closed end. Jarum open end mengarahkan aliran menuju ke ujung apeks, sedangkan jarum closed end lebih mengarahkan ke dinding saluran akar. Hal ini dapat terlihat dari posisi lubang jarum open end yang berada di ujung
dan closed end yang berada di lateral. Jarum open end dapat memasukkan bahan
irigasi ke jarak yang lebih jauh dan menghasilkan aliran balik larutan irigasi yang lebih baik daripada jarum closed end, namun juga tekanan apikal yang lebih tinggi sehingga resiko penetrasi bahan irigasi melewati apikal juga lebih besar. Jarum closed Gambar sebenarnya (atas), gambar tiga dimensi (bawah). Jarum A-C
(open end): (A) Flat, (B) Bevel, (C) Notched. Jarum D-F (closed end):
end lebih efisien untuk melepaskan debris dan mikroorganisme yang melekat pada dinding saluran akar, namun akibat turbulensi yang dihasilkan, aliran balik menjadi kurang baik untuk pergantian larutan irigasi.34
Pada uji coba yang dilakukan pada jarum open end, tidak ditemukan adanya kelebihan dari jarum bevel dan notched bila dibandingkan dengan jarum flat. Bahkan dikhawatirkan ujung jarum bevel yang tajam dapat memperbesar resiko terlukanya pasien maupun dokter gigi. Pada jarum closed end, juga tidak ditemukan adanya kelebihan yang bermakna antara jarum side-vented, double side-vented dan
multivented.34 Jarum close end, direkomendasikan sebagai jarum yang paling aman
untuk menghindari terjadinya ekstrusi ke apikal (Gambar 2).10,34 Namun, akibat terbatasnya penetrasi larutan irigasi dan aliran balik yang kurang baik, maka ujung jarum ini perlu ditempatkan sedekat mungkin dengan ujung apeks.34
Gambar 2.
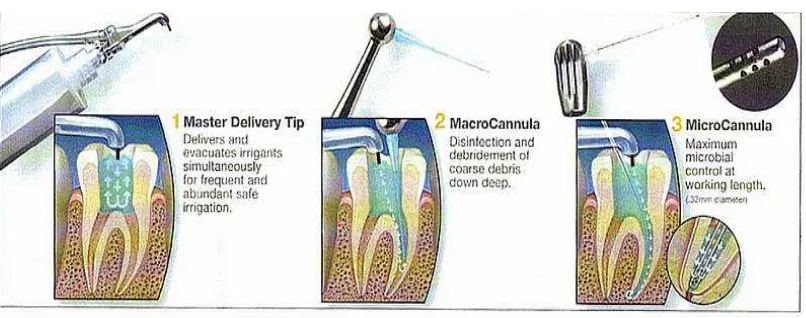
Machine asissted irrigation systems merupakan teknik irigasi saluran akar
dengan bantuan alat. Contoh dari teknik ini salah satunya adalah Endovac. Endovac memiliki tiga komponen utama, yaitu Master delivery tip, macrocannula dan
microcannula (Gambar 3). Prinsip kerja dari Endovac adalah negative pressure
dimana berbeda dengan teknik-teknik irigasi lain yang menggunakan tekanan positif. Kelebihan dari sistem negative pressure ini terdapat pada dua sistem komponen. Yang pertama adalah bahan irigasi dialirkan ke dalam kamar pulpa dalam jumlah
besar dan terus-menerus oleh Master delivery tip yang diletakkan pada bagian koronal. Yang kedua adalah dengan negative pressure, bahan irigasi akan mengalir ke bawah menuju apeks dan kemudian disedot kembali dengan bantuan Macrocannula
dan Microcannula.35,36
Gambar 3. (1) Master Dellivery Tip, (2) Macrocannula, (3) Microcannula36
Macrocannula digunakan untuk mengaspirasi debris kasar yang terdapat pada
koronal dan setengah akar, dengan memasukkannya ke dalam saluran akar semaksimal mungkin tanpa tersangkut setelah instrumentasi. Setelah makroirigasi,
microcannula dimasukkan sesuai panjang kerja untuk mengaspirasi debris halus
2.2 Porphyromonas gingivalis sebagai salah satu bakteri yang tergabung dalam biofilm pada infeksi endodontik primer
Di dalam saluran akar yang terinfeksi terdapat kumpulan berbagai jenis komunitas bakteri sehingga disebut sebagai infeksi polimikrobial. Bakteri-bakteri ini ada yang berbentuk sel-sel planktonikyang tersebar bebas dalam cairan pada saluran akar dan ada juga yang beragregasi/berkoagregasi membentuk kumpulan bakteri yang melekat pada dinding saluran akar membentuk lapisan biofilm. Biofilm dapat didefinisikan sebagai sebuah lapisan tipis dari komunitas mikroorganisme multiseluler yang terkondensasi dan melekat secara kuat pada permukaan dan terperangkap dalam matriks extracellular polymeric substance (EPS) .2,3
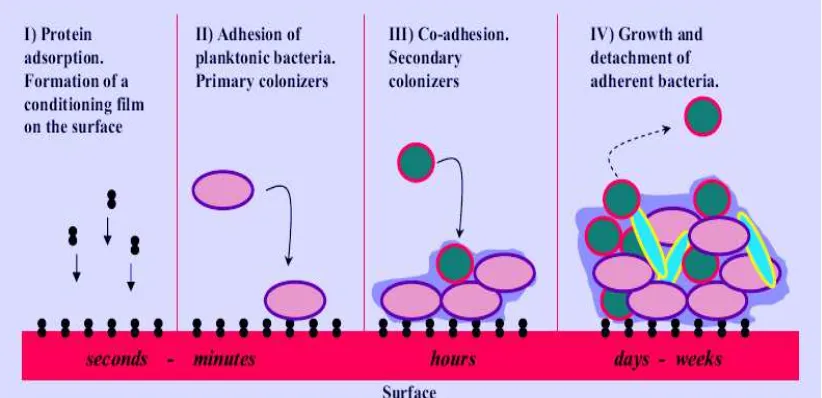
Pembentukan biofilm ini terjadi dalam empat tahap (Gambar 4). Tahap pertama adalah adsorpsi dari molekul inorganik dan organik pada permukaan solid yang membentuk conditioning film. Tahap kedua dari pembentukan biofilm melibatkan adhesi dan kolonisasi dari sel-sel planktonik pada conditioning film. Banyak faktor yang mempengaruhi perlekatan bakteri pada substrat padat. Faktor-faktor ini meliputi pH, temperatur, energi permukaan dari substrat, kecepatan aliran dari cairan melewati permukaan, ketersediaan nutrisi, lama waktu bakteri berkontak dengan permukaan, tingkat pertumbuhan bakteri, termasuk juga isi sel permukaan
dan hydrophobocity permukaan. Sifat-sifat psikokemikal seperti energi permukaan
dan charge density menentukan jenis bakteri awal yang berkolonisasi. Perlekatan
mikrobial pada substrat juga diperantarai oleh struktur permukaan bakteri seperti fimbriae, pili, flagela dan glycocalyx.37
sel-sel yang secara genetik berbeda dalam suspensi mengenali satu sama lain dan menyatu bersama yang disebut dengan co-agregasi.37
Tahap keempat terjadi pada biofilm yang telah matang yang melibatkan pelepasan mikroorganisme pada biofilm ke lingkungan sekitarnya. Pelepasan ini terdiri dari dua jenis, yaitu seeding dispersal dan clumping dispersal. Seeding
dispersal melibatkan pelepasan sel-sel bakteri planktonik akibat hidrolisis dari
matriks ekstraselular polisakarida dan mengkonversi subpopulasi sel-sel menjadi sel plaktonik yang motil. Clumping dispersal merupakan pelepasan dimana fragmen mikrokoloni terlepas dari biofilm dan terbawa dalam bentuk sekumpulan hingga tiba di lokasi baru dan mulai membentuk populasi baru. 37
Gambar 4. Tahapan pembentukan biofilm.37
Bakteri cenderung tumbuh dalam bentuk biofilm untuk dapat bertahan karena struktur biofilm dapat melindungi bakteri dari mikroorganisme lain, sistem pertahanan induk, agen antimikroba, dan pengaruh lingkungan, memberikan habitat yang lebih luas untuk berkembang, memerangkap nutrisi dan meningkatkan jumlah jenis metabolisme dan efisiensinya serta membantu pertukaran gen, dan meningkatkan patogenitas.2 Mikroorganisme dalam bentuk sel-sel planktonik dapat dengan mudah dieliminasi pada proses cleaning and shaping saat perawatan saluran akar. Namun, mikroorganisme dalam bentuk biofilm yang melekat pada dinding saluran akar, isthmus, kanal lateral dan tubulus-tubulus dentin tentu saja lebih sulit dieliminasi dan mungkin membutuhkan strategi perawatan tertentu.2,3 (Gambar 5)
Gambar 5.
Salah satu bakteri yang dapat dijumpai pada biofilm yang terbentuk pada infeksi saluran akar adalah dari golongan Porphyromonas sp., yaitu Porphyromonas
gingivalis. Porphyromonas gingivalis merupakan salah satu bakteri obligat anaerob
gram negatif yang sering diisolasi dari infeksi endodontik primer.3,4 Berdasarkan taksonominya, bakteri P.gingivalis diklasifikasikan sebagai berikut:38
Kingdom : Eubacteria
Filum : Bacteroidates
Microbial biofilm pada tubulus
Klas : Bacteroides
Ordo : Bacteroidales
Famili : Porphyromonadaceae
Genus : Porphyromonas
Spesies : Porphyromonas gingivalis
P.gingivalis (Gambar 6) merupakan bakteri obligat anaerob gram negatif
berpigmen hitam yang tidak berspora dan non-motile yang menginfeksi jaringan periapikal.4,7 Bakteri ini berukuran kecil, antara 0,5-2 μm dan berbentuk
coccobacilli.39 Bakteri golongan Porphyromonas sp. memiliki karakteristik khusus
yang memancarkan warna merah bata ketika berada di bawah sinar ultraviolet gelombang panjang dan bewarna coklat hitam ketika dikultur pada blood-containing media, sehingga bakteri ini juga dapat diidentifikasi sebagai bakteri berpigmen hitam Bacteroides.9,39
Gambar 6. Bakteri P.gingivalis39
P.gingivalis tumbuh dalam media kultur membentuk koloni berdiameter 1-2
mm, konveks, halus dan mengkilat, yang bagian tengahnya menunjukkan gambaran lebih gelap karena produsi protoheme, yaitu suatu substansi yang bertanggung jawab terhadap warna khas koloni ini. Pertumbuhannya dipengaruhi oleh adanya protein
dengan adanya NaCl 0,5-0,8% dalam darah. Produk fermentasi P.gingivalis yang utama adalah n-butirat dan asam asetat.38
Bakteri P.gingivalis lebih dikenal sebagai salah satu bakteri patogen yang memegang peranan penting dalam terjadinya penyakit periodontal. Namun, bakteri ini juga sering ditemukan pada infeksi saluran akar primer dan pada berbagai abses odontogenik yang bukan berasal dari penyakit periodontal.8 Selain itu, bakteri ini memiliki aktifitas proteolitik, sehingga sering dihubungkan dengan proses terjadinya abses periapikal.1 Keberadaan P.gingivalis pada proses infeksi endodontik mungkin dulu kurang diperhitungkan untuk waktu yang cukup lama karena bakteri ini merupakan bakteri obligat anaerob yang tidak dapat tumbuh pada media padat tanpa adanya teknik spesial.6 Pada penelitian yang dilakukan dengan metode kultur pada saluran akar yang terinfeksi, bakteri P.gingivalis ditemukan hanya memiliki prevalensi sebesar 10% - 27,3%.1,6 Namun dengan adanya perkembangan teknologi, bakteri P.gingivalis sekarang dapat diisolasi dengan metode PCR dengan hasil
P.gingivalis memiliki prevalensi sebesar 28% - 43,3% pada pulpa dengan infeksi
endodontik primer.1,5-7
Pada infeksi endodontik kronis, bakteri P.gingivalis diketahui dapat memiliki prevalensi yang lebih tinggi lagi, serta prevalensinya lebih tinggi dibandingkan dengan bakteri P.endodontalis. Hal ini dibuktikan dengan penelitian yang telah dilakukan oleh Tomazinho et al (2007), di mana P.gingivalis dan P.endodontalis masing-masing secara berurutan memiliki prevalensi sebesar 27,3% dan 9,1% dengan metode kultur dan 43,3% dan 23,3% dengan metode PCR.6 Sedangkan, berdasarkan penelitian yang dilakukan oleh Sassone et al (2007) dengan metode checkerboard
DNA–DNA hybridization, bakteri dari genus Porphyromonas yang ditemukan
Gambar 7.
Prevalensi P.gingivalis pada infeksi endodontik primer memang cukup besar, namun pada infeksi endodontik sekunder bakteri ini masih dapat ditemukan walaupun dalam jumlah yang lebih sedikit. Hal tersebut sesuai dengan penelitian Ercan et al (2006), di mana bakteri Porphyromonas spp. ditemukan memiliki prevalensi yang lebih rendah pada saluran akar dengan infeksi endodontik sekunder dibandingkan pada infeksi endodontik primer.41 Namun pada kasus periodontitis apikalis yang persisten, P.gingivalis diketahui memiliki prevalensi yang cukup tinggi. Berdasarkan penelitian yang dilakukan oleh Zhang et al (2010), didapatkan hasil bahwa
P.gingivalis memiliki prevalensi sebesar 27% pada periodontitis apikalis yang
persisten.42
Bakteri P.gingivalis merupakan spesies yang paling sering ditemukan dalam genusnya dan mungkin merupakan bakteri patogen yang paling penting dalam genusnya. Hal ini disebabkan karena bakteri P.gingivalis merupakan bakteri yang paling proteolitik dan paling patogen diantara bakteri anaerob gram negatif berpigmen hitam sehingga patogenitas bakteri ini banyak diteliti secara luas.43
0 10 20 30 40 50 60 70
Persentase
P.gingivalis
Periodontitis Apikalis Kronis Periodontitis Apikalis Akut Abses Apikalis Akut
P.gingivalis diketahui memiliki berbagai faktor virulensi patogenik yang berperan dalam menyebabkan penyakit. Faktor virulensi tersebut antara lain seperti fimbriae, capsule, extracellular vesicles, hemagglutinin, gingipain, hydrolytic enzymes,
collagenase dan lipopolysaccharide (LPS).8
Fimbriae adalah filamen tipis, bagian dari struktur bakteri yang terdapat pada permukaan bakteri dan tersusun atas molekul protein dengan diameter 5 nm.9,39 Fimbriae pada bakteri berperan pada perlekatan bakteri dengan sel induknya dan untuk interaksi dengan bakteri lainnya.9 Fimbriae P.gingivalis memiliki perlekatan yang sangat kuat pada sel epitel dan memiliki potensi yang besar menjadi virulensi, sehingga P.gingivalis yang memiliki lebih banyak fimbriae akan lebih mudah memasuki sel dendrit pada manusia daripada yang lebih sedikit fimbriaenya.44 Fimbriae pada P.gingivalis juga dapat menstimulasi sitokin dari makrofag sehingga merangsang terjadinya proses resopsi tulang.4,39,44
Sebagian besar golongan Bacteroides termasuk P.gingivalis memiliki kapsul yang tersusun dari polisakarida dan membentuk lapisan pada bagian luar dinding sel.9,44 Kapsulnya terlibat dalam adhesi atau perlekatan, pembentukan abses dan melindungi dari poses opsonisasi dan fagositosis sel inang.39,44 Collagenase merupakan faktor virulensi Porphyromonas gingivalis yang berhubungan dengan penyakit periodontal. Penelitian menyatakan keberadaan collagenase gene (prtC) yang diperiksa pada 21 strain spesies Porphyromonas dapat diisolasi pada infeksi saluran akar. Porphyromonas gingivalis dari infeksi saluran akar memiliki prtC gen, sedangkan Porphyromonas endodontalis tidak memiliki prtC gen.44
P.gingivalis juga diketahui dapat menghasilkan enzim cysteine protease,
Patogenitas yang utama dari bakteri gram negatif disebabkan oleh adanya
lipopolysacharide (LPS) pada dinding selnya. LPS adalah komponen permukaan
mayor dari bakteri gram negatif yang tersusun dari polysaccharide, core
polysaccharide dan Lipid A.39 LPS memiliki potensi yang kuat sebagai stimulator
inflamasi karena LPS mampu menembus ke dalam jaringan periradikuler dan bertindak sebagai endotoksin dalam organisme inangnya sehingga menyebabkan peradangan dan berlanjut dengan terjadinya kerusakan tulang. Penelitian menunjukkan bahwa respon radang dimulai saat LPS P.gingivalis berikatan dengan
lipoliskarida binding protein (LBP) membentuk komplek molekul CD14. Komplek
molekul ini akan dikenali oleh makrofag melalui reseptor TLR4 sehingga menstimulasi terbentuknya IL-1, IL-6 dan TNF-α, yaitu sitokin yang berperan dalam proses terjadinya resorpsi tulang.4
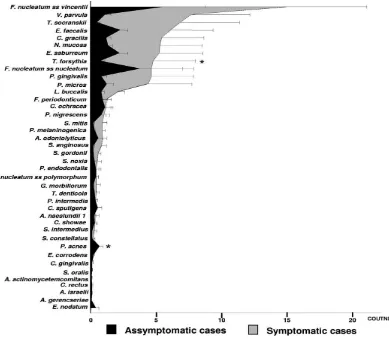
Dilihat dari patogenitasnya, keberadaan bakteri P.gingivalis juga dihubungkan dengan timbulnya rasa sakit karena sering ditemukan memiliki prevalensi yang lebih tinggi pada kasus simptomatik yang berhubungan dengan pembentukan eksudat dan rasa sakit pada palpasi. Penelitian Rocas et al. Cit Jacinto (2006) menemukan bahwa bakteri P.gingivalis memiliki prevalensi sebesar 30% pada infeksi endodontik primer yang simptomatik. Penelitian Gomes et al. Cit Jacinto (2006) juga menemukan adanya hubungan antara Porphyromonas spp. dengan rasa sensitif pada perkusi dan pembengkakkan. Pada penelitian yang dilakukan oleh Sundqvist et al. Cit Jacinto (2006) pada gigi dengan inflamasi periapikal, P.gingivalis ditemukan pada semua gigi dengan eksaserbasi akut tapi tidak pada gigi yang bebas dari rasa sakit.46 Dari hasil penelitian yang dilakukan oleh Sassone et al (2008) untuk mengetahui apakah terdapat perbedaan jumlah bakteri pada kasus infeksi endodontik primer kronis yang simptomatik dibandingkan dengan kasus yang asimptomatik, ditemukan bahwa
P.gingivalis mempunyai perbedaan mean levels yang signifikan (Gambar 8). Hal ini
Gambar 8.
Bakteri P.gingivalis tidak dapat menimbulkan infeksi pada saluran akar secara individual, namun bakteri ini mempunyai kemampuan untuk berkolonisasi dalam bentuk microbial biofilm dengan bakteri lain sehingga menimbulkan infeksi.3,5 Oleh sebab itu, risiko terjadinya virulensi semakin tinggi bila terdapat kombinasi mikroorganisme dalam jumlah yang besar, terutama dari spesies anaerob. Hal ini dapat dilihat dari kombinasi antara P.gingivalis dengan F.Nucleatum yang menunjukkan patogenitas yang lebih tinggi karena hal tersebut meningkatkan faktor perlekatan bakteri P.gingivalis terhadap sel induknya.9 Penelitian lain juga menunjukkan bahwa infeksi silang antara P.gingivalis dengan Bacteroides forythus
pada infeksi saluran akar akan meningkatkan resiko terjadinya periodontitis apikalis kronis.5 Selain itu, kombinasi dari Porphyromonas sp., Prevotella sp., dan
F.nucleatum akan meningkatkan faktor resiko terjadinya flare up endodonti. Hal ini
disebabkan adanya sinergi antara bakteri-bakteri tersebut, sehingga meningkatkan intensitas terjadinya inflamasi pada jaringan periapikal.9 Oleh sebab itu, hal ini membuktikan bahwa spesies bakteri yang berbeda-beda dalam struktur biofilm pada infeksi saluran akar memiliki hubungan yang erat sehingga interaksi antar bakteri tidak dapat dihindari. Keberadaan suatu spesies bakteri pada saluran akar dapat dipengaruhi oleh interaksi dengan spesies lainnya dan juga sebaliknya, ketidakhadiran salah satu jenis bakteri dapat mempengaruhi keberadaan bakteri lainnya termasuk P.gingivalis.2 (Gambar 9)
2.3 Buah Lerak (Sapindus rarak DC)
Sapindus rarak merupakan jenis tumbuhan yang berasal dari Asia Tenggara
yang dapat tumbuh dengan baik pada hampir semua jenis tanah dan keadaan iklim.20 Tanaman ini lebih dikenal dengan nama lerak, namun di daerah lain lerak memiliki nama yang berbeda-beda. Masyarakat Sunda menyebutnya dengan nama Rerek, di Jawa disebut Werak/Lerak, di Jambi disebut dengan Kalikea, penduduk Minang menyebutnya Kanikia, di Sumatera Selatan disebut dengan Lamuran dan di Tapanuli Selatan dikenal dengan nama buah sabun.19
Menurut taksonominya, Sapindus rarak diklasifikasikan dalam :20
Gambar 10.
Kandungan senyawa aktif yang terdapat dalam buah lerak adalah saponin 28%, senyawa alkaloid, polifenol, senyawa antioksidan dan golongan flavonoid, juga tanin.19 Dari hasil penelitian didapatkan bahwa kulit buah, biji, kulit batang dan daun lerak mengandung saponin dan flavanoid, sedangkan kulit buahnya juga mengandung alkaloida dan polifenol. Kulit batang dan daun tanaman lerak mengandung tanin. Dengan demikian, ekstrak buah lerak mengandung saponin, flavonoid, alkaloid dan polifenol. Masing-masing kandungan tersebut mempunyai efek antibakteri.19,20
Senyawa saponin dapat bekerja sebagai antimikroba sebagai surfaktan atau deterjen yang diduga akan menyerang lapisan batas sel bakteri melalui ikatan gugus polar dan non polar sehingga menyebabkan terjadinya lisis pada dinding sel bakteri. Flavonoid diduga dapat merusak membran sel karena sifatnya yang lipofilik dan kemampuannya membentuk kompleks dengan protein ekstraseluler. Senyawa fenol menghambat enzim penting mikroorganisme, sedangkan alkaloid sudah digunakan berabad-abad dalam bidang medis karena dapat melawan sel asing melalui ikatan dengan DNA sel sehingga mengganggu fungsi sel.47
Berbagai penelitian untuk mengembangkan lerak sebagai alternatif bahan irigasi saluran akar telah dilakukan. Dalam pengembangannya, diketahui bahwa
ekstrak lerak memiliki efektivitas antibakteri dan antifungal. Penelitian membuktikan bahwa ekstrak lerak 0,01% mempunyai efek antibakteri terhadap Streptococcus
mutans dan Candida albicans yang lebih baik dari NaOCl 5%.21,22 Pada penelitian
terhadap Fusobacterium nucleatum, ekstrak lerak mempunyai efek antibakteri dengan nilai Kadar Hambat Minimum (KHM) dan nilai Kadar Bunuh Minimum (KBM) 0,25%, dan 0,01% untuk saponin buah lerak.23 Sedangkan pada penelitian terhadap
Enterococcus faecalis, ekstrak lerak mempunyai efek antibakteri dengan nilai KBM
25%.24 Penelitian juga membuktikan bahwa ektrak lerak diketahui mempunyai efek analgetik pada konsentrasi 2,5%, 5%, 7,5%25 dan efek antiinflamasi pada konsentrasi 0,01%.26 Selain itu, dari penelitian terdahulu diperoleh hasil bahwa nilai LC50 ekstrak lerak berada pada konsentrasi 1,25%.27
2.4 Kerangka Teori
?
Cleaning Preparasi Biomekanis
Shaping
Teknik irigasi Bahan irigasi
Jenis bahan irigasi
NaOCl CHX EDTA MTAD
Syarat bahan irigasi
Ekstrak etanol lerak
P.gingivalis Pelarut jaringan nekrotik
dan smear layer
Tegangan permukaannya rendah
Tidak toksik
Pelumas
2.5 Kerangka Konsep
Penelitian ini dilakukan dengan menguji daya antibakteri ekstrak etanol lerak
(Sapindus rarak DC) sebagai bahan alternatif medikamen saluran akar terhadap
bakteri P.gingivalis dengan penentuan nilai Kadar Hambat Minimum (KHM) dan nilai Kadar Bunuh Minimum (KBM). Suhu inkubasi bakteri, waktu inkubasi bakteri, dan konsentrasi ekstrak etanol lerak yang digunakan dapat mempengaruhi penentuan KHM dan KBM.
2.6 Hipotesis Penelitian
Hipotesis penelitian ini adalah ekstrak etanol lerak (Sapindus rarak DC) mempunyai efek antibakteri terhadap P.gingivalis sehingga dapat digunakan sebagai alternatif bahan irigasi saluran akar dengan mencari nilai KHM dan KBM.
Ekstrak etanol lerak (Sapindus rarak DC) dengan konsentrasi 100%, 50%, 25%, 12,5%, 6,25%, 3,135% dan 1,625%.
BAB 3
METODE PENELITIAN
3.1 Rancangan Penelitian : Posttest Only Control Group Design Jenis Studi Penelitian : Eksperimental Laboratorium
3.2 Populasi, Sampel dan Besar Sampel
3.2.1 Populasi : Bakteri Porphyromonas gingivalis
3.2.2 Sampel : Koloni Porphyromonas gingivalis ATCC 33277 yang telah diisolasi dan dibiakkan dengan media Mueller Hinton Agar(MHA)
3.2.3 Besar Sampel
Penentuan besar sampel berdasarkan penelitian sebelumnya, yaitu sesuai dengan SOP (Standard Operational Prosedure) yang ada di Laboratorium Pusat Penyakit Tropis, Universitas Airlangga untuk mendapatkan hasil yang representatif. Jumlah pengulangan yang dilakukan pada penelitian ini menggunakan rumus Federer (1991):
(t – 1) (r – 1) ≥ 15 (7 -1) (r – 1) ≥ 15 6 (r -1) ≥ 15 6r – 6 ≥ 15 6r ≥ 21 r ≥ 3,5 ≈ 4 Keterangan :
t = jumlah kelompok perlakuan r = jumlah perlakuan ulang
a. Penentuan nilai MIC
Dari masing-masing konsentrasi dilakukan pengujian penentuan KHM untuk memastikan konsentrasi minimal yang dapat menghambat pertumbuhan bakteri. Pada penentuan nilai KHM, jumlah keseluruhan sampel adalah 36 sampel.
b. Penentuan nilai MBC
Kelompok yang dilanjutkan dengan pengujian penentuan KBM dan perhitungan jumlah koloni bakteri dengan metode Drop Plate Mills Misra, adalah:
Kelompok 1 : ekstrak etanol lerak 100% 4 sampel
3.3 Variabel Penelitian
Variabel bebas
Ekstrak lerak dalam pelarut etanol
Variabel tergantung
a. Jenis dan asal tumbuhan lerak (Desa Maga, Kec. Panyabungan Tapanuli Selatan)
b. Berat buah lerak
c. Lamanya waktu pengeringan buah lerak (± 7 hari)
d. Suhu di lemari pengering (± 400C) e. Kecepatan mesin penghalusan
(konstan)
f. Lamanya waktu penghalusan (± 30 detik)
g. Lamanya maserasi (3 jam)
h. Jenis etanol yang digunakan (etanol 70% )
i. Volume etanol untuk maserasi (800 ml) j. Nomor kertas penyaring (Whatmann
no. 42)
k. Kecepatan aliran perkolator (20 tetes/menit)
l. Suhu penguapan dengan rotavapor (400C)
m. Media pertumbuhan bakteri (MHB dan
MHA)
n. Suhu inkubasi (370C) o. Stem cell P.gingivalis
p. Waktu pembiakan P.gingivalis (24 jam)
q. Sterilisasi alat, bahan coba dan media r. Teknik pengisolasian dan pengkulturan s. Jumlah bahan coba yang diteteskan ke
media
t. Waktu pengamatan (24 jam)
3.3.1 Variabel Bebas
a. Jenis dan asal tumbuhan lerak (Desa Maga, Kec. Panyabungan Tapanuli Selatan)
b. Berat buah lerak (940 gr)
c. Lamanya waktu pengeringan buah lerak (± 7 hari) d. Suhu di lemari pengering (± 400C)
e. Kecepatan mesin penghalusan (22.000 rpm) f. Lamanya waktu penghalusan (± 30 detik) g. Lamanya maserasi (3 jam)
h. Jenis etanol yang digunakan (etanol 70%) i. Volume etanol untuk maserasi (800 ml) j. Nomor kertas penyaring (Whatmann no. 42) k. Kecepatan aliran perkolator (20 tetes/menit) l. Suhu penguapan dengan rotavapor (400C) m. Media pertumbuhan (Mueller Hinton Agar) n. Suhu inkubasi (370C)
o. Stem cell P.gingivalis
p. Waktu pembiakan P.gingivalis (24 jam) q. Sterilisasi alat, bahan coba dan media r. Teknik pengisolasian dan pengkulturan
s. Jumlah bahan coba yang diteteskan ke media (1 ml) t. Waktu pengamatan (24 jam)
3.3.4 Variabel Tidak Terkendali
a. Geografis tempat tumbuh lerak (kondisi tanah, iklim, curah hujan dan lingkungan sekitar tanaman)
b. Umur buah lerak
c. Perlakuan terhadap buah lerak selama tumbuh
d. Suhu dan lamanya waktu penyimpanan buah lerak setelah dipetik dari
5. Ekstrak
3.5 Bahan dan Alat Penelitian
3.5.1 Bahan Penelitian
Bahan penelitian yang dipakai adalah:
1. Buah lerak 940 gram (Desa Maga, Kec. Panyabungan Tapanuli Selatan, Indonesia)
2. Media Mueller Hinton (Difco, USA)
3. Stem cell P.gingivalis ATCC 33277 (Laboratorium Pusat Penyakit Tropis Surabaya, Indonesia)
4. Etanol 96% (Kimia Farma, Indonesia) 4 liter 5. NaCl 0,9% (Kimia Farma, Indonesia) 1 liter 6. Akuades (Kimia Farma, Indonesia) 3 liter
3.5.2 Alat Penelitian
Alat penelitian yang dipakai adalah:
1. Electronic balance (Ohyo JP2 6000, Japan dan Denver Instrument
Company, USA)
2. Timbangan (Home Line, China)
3. Alat destilasi pelarut (Electrothermal, England) 4. Blender (Waring, Japan)
5. Kertas saring (Whatman no.42, England) 6. Autoklaf (Tomy, Japan)
7. Vaccum rotavapor (Antriebs ATB, England)
8. Erlenmeyer (Pyrex, USA)
9. Vortex/whirli mixer (Iwaski model TM-100, Japan)
3.6 Lokasi dan Waktu Penelitian
3.6.1 Lokasi Penelitian
1. Laboratorium Tanaman Obat Fakultas Farmasi USU 2. Laboratorium Lembaga Pusat Penyakit Tropis UNAIR
3.6.2 Waktu Penelitian
Waktu penelitian adalah 6 bulan (Agustus 2013 – Januari 2014)
3.7 Prosedur Penelitian
3.7.1 Ekstraksi buah lerak
Gambar 11. Pencucian buah lerak Gambar 12. Penimbangan buah lerak
Gambar 13. Pemotongan daging buah lerak Gambar 14. Lemari pengering
Gambar 15. Gambar 16.
Potongan lerak di lemari pengering
Gambar 17. Potongan lerak diblender Gambar 18. Simplisia lerak
Gambar 19. Gambar 20. Vaccum rotavapor
3.7.2 Pembuatan Suspensi Bahan Uji
Ekstrak lerak dalam pelarut etanol ditimbang menggunakan electronic
balance dan massanya disesuaikan dengan konsentrasi yang diinginkan dengan cara
dilarutkan dengan media Mueller Hinton Broth (MHB). Ekstrak lerak dalam pelarut Simplisia di dalam
etanol dimulai dari konsentrasi 100% karena belum diketahui konsentrasi ekstrak yang mampu menghambat pertumbuhan P.gingivalis, jadi pengujian dimulai pada konsentrasi terbesar. Sediakan 7 buah tabung, pada masing-masing tabung berisi 1 ml MHB. Pada tabung pertama diberi 1 gr ekstrak kental lerak kemudian dicampur menggunakan vorteks sehingga didapatkan ekstrak etanol lerak dengan konsentrasi 100%. Kemudian dilakukan pengenceran berganda dengan cara mengambil setengah dari konsentrasi ekstrak etanol lerak 100% menggunakan mikropipet dan diletakkan pada tabung kedua untuk mendapatkan ekstrak etanol lerak 50% (pengenceran berganda). Cara yang sama dilakukan untuk mendapatkan konsentrasi 25%, 12,5%, 6,25%, 3,125% dan 1,625%. Masing-masing tabung tersebut kemudian diberi label sesuai konsentrasinya.
3.7.3 Pembuatan Media Bakteri
Sebelum spesimen dibiakkan, terlebih dahulu dibuat media MHA. Sebanyak 34 gram MHA dilarutkan dalam 1 liter akuades kemudian tuangkan pada tabung reaksi (20ml/tabung reaksi), lalu dipanaskan di atas tungku pemanas magnetik sampai mendidih. Setelah masak, media disterilkan dalam autoklaf selama 15 menit dengan tekanan 2 atm dan suhu 121oC, lalu simpan dalam lemari pendingin. Jika akan digunakan, media dipanaskan kembali hingga mendidih lalu dituang ke dalam petri. Kemudian media dimasukkan ke dalam inkubator selama 24 jam untuk melihat apakah ada kontaminasi bakteri atau tidak.
3.7.4 Pembiakan Spesimen
P.gingivalis yang digunakan adalah spesimen stem sel P.gingivalis ATCC
33277 yang dibiakkan secara murni pada media MHA dalam suasana anaerob pada inkubator CO2 hingga didapatkan pertumbuhan yang sehat, yang berarti bahwa bakteri tumbuh subur (Gambar 21). Ambil sebanyak 1-2 ose dari biakan murni bakteri lalu disuspensikan dengan larutan 0,9% NaCl hingga diperoleh kekeruhan sesuai 0,5 Mc Farland Standard atau setara dengan jumlah 1 x 108 CFU/ml (CFU:
Gambar 21.
3.7.5 Penentuan KHM bahan coba
Konsentrasi ekstrak etanol lerak yang diuji dalam penelitian ini dimulai dari 100%, 50%, 25%, 12,5%, 6,25%, 3,125% dan 1,625%. Dari masing-masing konsentrasi tersebut diambil 1 ml lalu dimasukkan ke dalam tabung reaksi, lalu tambahkan 1 ml suspensi bakteri dengan menggunakan mikropipet ke dalam masing-masing tabung bahan coba tersebut kemudian divorteks, lalu diinkubasi pada suhu 37oC selama 24 jam pada inkubator CO2. Amati kekeruhan yang terjadi dengan bantuan spektofotometer, lalu bandingkan tabung-tabung tersebut dengan kontrol untuk menentukan nilai KHM. Tabung dengan kekeruhan yang mulai tampak jernih merupakan KHM, yaitu konsentrasi minimal bahan coba yang mampu menghambat pertumbuhan P.gingivalis dalam media perbenihan setelah diinkubasi 24 jam.
3.7.6 Penentuan KBM bahan coba
Hasil pengujian penentuan nilai KHM dilanjutkan dengan penghitungan jumlah koloni bakteri menggunakan metode DropPlate Miles Misra. Dengan metode ini dapat dihitung jumlah bakteri hidup yang telah disuspensikan dalam bahan coba. Setelah diinkubasi pada prosedur penentuan KHM, bahan coba dari konsentrasi
seperti di atas divorteks dan diambil 50 μl untuk setiap konsentrasi lalu diteteskan ke dalam media padat (Mueller Hinton Agar). Petri direplikasi sebanyak 4 petri,
P.gingivalis ATCC 33277 yang
diamkan selama 15-20 menit sampai kering kemudian diinkubasi dalam inkubator CO2 dengan suhu 37oC selama 24 jam. Kemudian, dilakukan perhitungan jumlah koloni bakteri untuk mendapatkan nilai KBM dengan bantuan mikroskop. Jumlah koloni bakteri dihitung dengan prinsip satu sel bakteri hidup bila dibiakkan pada media padat akan tumbuh menjadi satu koloni bakteri. Apabila bentuk koloni melebar dianggap berasal dari satu koloni, bila bentuknya dua koloni bersinggungan dianggap sebagai dua koloni. Koloni P.gingivalis pada media padat berbentuk bulat dan bewarna putih keruh.
Setelah dihitung jumlah koloni bakteri pada masing-masing tetesan, dibuat rata-ratanya dan dikalikan dengan faktor pengenceran dan faktor pengali. Oleh karena pada penelitian konsentrasi yang dilakukan perhitungan jumlah koloni bakteri merupakan konsentrasi awal (sebelum dilakukan dilusi) maka faktor pengenceran x1, selain itu karena pada penetesan suspensi bahan coba dan bakteri pada media padat sebanyak 50 μl, maka hasil perhitungan harus dikali dengan faktor pengali 20 untuk mendapatkan hasil sesuai satuan standar (CFU/ml).
Contoh cara perhitungan koloni pada metode Drop Plate Miles Misra : a. Pada media padat ditetesi sebanyak 50 μl suspensi bahan coba dengan menggunakan mikropipet.
b. Kemudian hitung jumlah koloni yang ada dengan menggunakan mikroskop dan didapatlah sebanyak 5 koloni.
c. Jadi jumlah bakteri pada bahan coba tersebut adalah: 5 x 1 (faktor pengenceran) x 20 (faktor pengali) = 100 CFU / ml
3.8 Analisis Data
Data dari setiap pemeriksaan dianalisis dengan memakai uji statistik sebagai berikut:
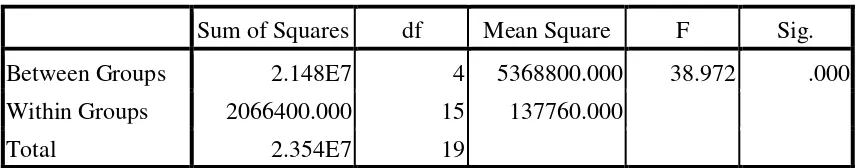
1. Uji analisis varians satu arah (ANOVA), untuk melihat efek antimikroba ekstrak Sapidus rarak terhadap pertumbuhan Porphyromonas gingivalis.
BAB 4
HASIL PENELITIAN
4.1 Ekstrak Kental Lerak
Sebanyak 940 gram buah lerak dicuci bersih kemudian dipotong-potong dan dibuang bijinya. Kemudian, kulit buah lerak dikeringkan di lemari pengering selama seminggu. Kulit buah lerak yang telah kering dihaluskan dengan blender dan diekstraksi dengan perkolator. Hasil ekstraksi diuapkan dengan alat vacuum rotary
evaporator dan dikentalkan dengan waterbath sehingga diperoleh ekstrak kental lerak
yang bewarna coklat kehitaman sebanyak 204,851 gram. Ekstrak kental ini kemudian disimpan dalam wadah tertutup (Gambar 22) dan diletakkan di dalam lemari pendingin sebelum dilakukan uji efektifitas antibakteri.
Gambar 22. Ekstrak Lerak
4.2 Uji Efektifitas Antibakteri
penentuan KHM, yang dilihat adalah tabung dengan masing-masing konsentrasi yang telah diberi perlakuan mulai berubah dari keruh menjadi jernih dengan cara membandingkan dengan kontrol. Pada penelitian ini, kekeruhan tabung tidak berubah sehingga dianggap tidak representatif untuk mengukur nilai KHM. Oleh sebab itu, nilai KHM tidak dapat diketahui.
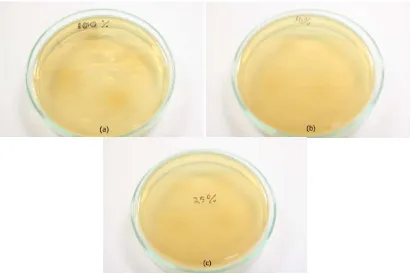
Pada penentuan KBM, hasil yang diharapkan adalah ≥ 99,9% bakteri mati pada MHA (steril). Setelah dilakukan prosedur pengujian efek antibakteri pada bahan coba ekstrak kental lerak, tidak dijumpai pertumbuhan bakteri pada konsentrasi 100%, 50% dan 25% yang berarti bahwa semua bakteri P.gingivalis mati.
Tabel 1.
Bahan Uji Konsentrasi Replikasi (CFU/ml)*
1 2 3 4
Keterangan : 0 CFU/ml = Steril, tidak dijumpai pertumbuhan bakteri. TBUD = Tidak Bisa Untuk Dihitung
CFU/ml = Colony Forming Unit per ml
* = sudah dikali dengan 20 (faktor pengali)
Tabel 1 menunjukkan bahwa pengujian efek antibakteri terhadap P.gingivalis pada bahan coba ekstrak etanol lerak pada konsentrasi 100%, 50% dan 25% adalah steril (0 CFU/ml), yang berarti bahwa setelah penanaman pada media MHA dan diinkubasi selama 24 jam tidak terlihat adanya pertumbuhan bakteri atau semua bakteri mati. Hal ini terlihat dari zona bening pada petri yang ditandai dengan tetesan bahan coba pada MHA hampir menyerupai warna MHA tersebut (Gambar 23). Sedangkan, pada pengujian efek antibakteri ekstrak lerak dalam pelarut etanol pada konsentrasi 12,5% dan 6,25% dijumpai adanya pertumbuhan koloni bakteri pada media MHA dengan jumlah yang berbeda pada setiap replikasi dengan rata-rata (1,18.103 ± 0,29.103) CFU/ml dan (2,62.103 ± 0,77.103) CFU/ml. Pada konsentrasi 3,125% dan 1,625% juga menunjukkan pertumbuhan bakteri yang masih subur dan tumpang tindih sehingga hasil yang didapat ialah TBUD. (Gambar 24)
Gambar 24. .
Karena kontrol bakteri P.gingivalis (kontrol positif) pada penelitian ini adalah TBUD, maka tidak dapat diketahui apakah jumlah bakteri yang mati pada konsentrasi 6,25% dan 12,5% adalah ≥ 99,9%, sehingga nilai KBM diambil dari konsentrasi yang membunuh 100% P.gingivalis. Oleh sebab itu, dari tabel 1 di atas dapat disimpulkan bahwa KBM ekstrak etanol lerak terhadap P.gingivalis pada penelitian ini adalah 25%. Data dari nilai hasil uji efektifitas antibakteri ekstrak etanol lerak kemudian diuji normalitasnya dengan menggunakan uji Shapiro-Wilk. Uji ini dipilih karena sampel berjumlah kurang dari 50 sampel. Dari hasil pengujian yang dilakukan terlihat bahwa nilai signifikansi p masing-masing > 0,05 yang berarti bahwa data terdistribusi normal sehingga dapat dilanjutkan dengan uji parametrik one way ANOVA dan LSD (Tabel 2).