UJI ANTIOKSIDAN DAN ANTIBAKTERI EKSTRAK AIR
DAUN KECOMBRANG (Etlingera elatior (Jack) R.M. Smith)
SEBAGAI PENGAWET ALAMI TERHADAP Escherichia
coli DAN Staphylococcus aureus
RINA NINGTYAS
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF
Staphylococcus aureus
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
RINA NINGTYAS 106095003214
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
UJI ANTIOKSIDAN DAN ANTIBAKTERI EKSTRAK AIR DAUN
KECOMBRANG (Etlingera elatior (Jack) R.M. Smith) SEBAGAI
PENGAWET ALAMI TERHADAP Escherichia coli DAN
Staphylococcus aureus
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
RINA NINGTYAS 106095003214
Menyetujui :
Pembimbing 1, Pembimbing 2,
DR. Ira Djajanegara, M.Sc Dra. Nani Radiastuti, M.Si
NIP.
19640826.199302.2.004
NIP.19650902.20011.2.001
Menget
ahui :
Ketua Prodi Biologi
telah diuji dan dinyatakan LULUS dalam Sidang Munaosah Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta pada tanggal 9 Desember 2010. Skripsi ini telah diterima Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Strata Satu Program Studi Biologi.
Menyetujui :
Penguji 1, Penguji 2,
DR. Lily Surayya Eka Putri, M.Env.Stud Dini Fardila, M.Si NIP .1969404.200501.2.005 NIP.19800330.200901.2.009
Pembimbing 1, Pembimbing 2,
DR. Ira Djajanegara, M.Sc Dra. Nani Radiastuti, M.Si NIP .19640826.199302.2.004 NIP.19650902.20011.2.001
Mengetahui :
Dekan Fakultas Sains dan Teknologi Ketua Prodi Biologi
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI BENAR-BENAR HASIL KARYA SENDIRI DAN BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI DAN LEMBAGA MANAPUN
Jakarta, Desember 2010
Penggunaan bahan pengawet dan antioksidan sintetis tidak direkomendasikan oleh Badan Pengawas Obat dan Makanan (BPOM) karena diduga dapat menimbulkan penyakit kanker (carcinogenic agent). Kecombrang (Etlingera elatior (Jack) R.M. Smith) adalah
tanaman asli Indonesia yang berpotensi sebagai pengawet alami. Tujuan penelitian ini adalah untuk mengetahui kemampuan antibakteri dan antioksidan ekstrak air daun kecombrang yang berpotensi sebagai pengawet alami. Ekstraksi dilakukan dengan maserasi menggunakan pelarut aquadest. Berdasarkan hasil penelitian diketahui bahwa
ekstrak air daun kecombrang mengandung senyawa bioaktif berdasarkan metode BSLT (Brine Shrimp Lethality Test) dengan nilai LC50 53,08 ppm. Hasil pengujian antioksidan dengan metode DPPH (1,1-difenil-2-pikrilhidrazil) diketahui aktivitas antioksidan sangat kuat dengan nilai IC50 24,394 mg/l. Aktivitas antibakteri ekstrak diamati dengan metode difusi cakram menunjukkan ekstrak dapat menghambat pertumbuhan E. coli dan S. aureus. Hasil pengujian antibakteri ekstrak air daun kecombrang terhadap S. aureus pada
konsentrasi 20%, 40%, 60%, 80% dan 100% diperoleh zona hambatan yang berbeda yaitu 8,663 mm, 14,223 mm, 15,33 mm, 20.08 mm dan 21,36 mm. Ekstrak air daun kecombrang menghambat pertumbuhan E. coli hanya pada konsentrasi 100% dengan
zona hambat sebesar 10 mm. Diameter zona hambat kloramfenikol 10 μg mendekati zona hambat diameter ekstrak air daun kecombrang pada S. aureus konsentrasi 60% sebesar
17,5 mm. Pada E. coli zona hambat kloramfenikol 10 μg sangat berbeda bila
dibandingkan dengan zona hambat ekstrak air daun kecombrang yaitu 22,66 mm. Nilai konsentrasi hambat minimum (KHM) E. coli pada konsentrasi 90%, sedangkan untuk S. aureus pada konsentrasi 15%. Identifikasi ekstrak air daun kecombrang menggunakan
GC-MS (Kromatografi gas spektroskopi massa) diperoleh 62 senyawa dengan jumlah tertinggi adalah butanadiol dan eicosane.
ABSTRACT
Antioxidant and Antibacterial Of Kecombrang Leaf Extract (Etlingera elatior (Jack)
R.M. Smith) As Natural Preservative Against Escherichia coli and Staphylococcus aureus
The use of synthetic preservatives and antioxidants are not recommended by the Food and Drug Supervisory Agency (BPOM) for allegedly can cause cancer (carcinogenic agent). Kecombrang (Etlingera elatior (Jack) RM Smith) is a plant native to Indonesia
which has the potential as a natural preservative. The purpose of this research is to determine the ability of antibacterial and antioxidant of kecombrang leaf extract as a natural preservative. The extraction was done by maceration using aquadest solvent. The
results showed that kecombrang leaf extract contain bioactive compounds based on the BSLT method (Brine Shrimp Lethality Test) with LC50 value 53,08 ppm. Antioxidants test with DPPH (1,1-difenil-2-pikrilhidrazil) method was resulted in a very strong antioxidant activity at IC50 24,394 mg/l. Antibacterial activity of extracts was observed with disc diffusion method and it showed the extract can inhibit the growth of E. coli and S. aureus. The results antibacterial testing of kecombrang leaf extract for S. aureus at
20%, 40%, 60%, 80% and 100% concentrations resulted in different inhibition zone, which were 8,663 mm, 14,223 mm, 15,33 mm, 20,08 mm and 21,36 mm respectively. However, kecombrang leaf extract inhibited E. coli growth only at concentration 100%
and the inhibition zone was 10 mm. Chloramphenicol 10 μg/l inhibition zone diameter similar to kecombrang leaf extract on S. aureus at 60% concentration, inhibition which
was 17,5 mm. The inhibition zone E. coli of chloramphenicol 10 μg was very different
compared to kecombrang leaf extract was 22,66 mm. The KHM value (Minimum Inhibitory Consentration) for E. coli at 90% concentration, while for S. aureus at 15%
concentration. There were 62 compounds identified in kecombrang leaf extract use GC-MS (Gas Chromatography Mass Spectrometer) and the highest number compound was
found butanediol and eicosane .
Assalamu’alaikum. Wr. Wb
Puji syukur penulis panjatkan kehadirat Allah S.W.T atas rahmat dan ridhonya,
penulis dapat menyelesaikan skripsi yang berjudul “Uji Antioksidan dan Antibakteri Ekstrak Air Daun Kecombrang (Etlingera elatior (Jack) R.M. Smith) Sebagai Pengawet
Alami Terhadap Escherichia coli dan Staphylococcus aureus” disusun sebagai syarat
tugas akhir pada Program Studi Biologi, Fakultas Sains dan Teknologi, Universitas Islam Negeri Syarif Hidayatullah, Jakarta.
Selama penyusunan skripsi, berbagai pihak telah banyak memberikan bantuan dan dorongan. Oleh karena itu, pada kesempatan ini disampaikan rasa hormat dan ucapan terima kasih terutama diberikan kepada :
1. Bapak DR. Syopiansyah Jaya Putra, M.Sis., selaku Dekan Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta
2. Ibu Dr. Lily Surayya E.P, M.Env.Stud., selaku Ketua Prodi Biologi Fakultas Sains
dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta 3. Ibu Priyanti, M.Si., selaku Sekretaris Program Studi Biologi.
4. Ibu Fahma Widjayanti. M.Si selaku pembimbing akademik.
5. Ibu Dr. Ira Djajanegara, M.Sc selaku dosen pembimbing I dan Ibu Dra. Nani Radiastuti, M.Si., selaku dosen pembimbing II yang telah banyak meluangkan waktu
dan tenaga untuk memberikan bimbingan, saran dan dorongan hingga terselesaikannya skripsi ini.
6. Dosen-dosen Penguji baik seminar proposal, hasil maupun sidang (Ibu Megga
R.Pikoli, M.Si, Ibu Reno Fitri, M.Si, Bapak Lao Ode Sumarlin, M.Si, Ibu Lily Surayya E.P, M.Env.Stud dan Ibu Dini Fardila, M.Si)
7. Kepala Lab. Biologi, Ibu Megga R. Pikoli, M.Si beserta Staf laboratorium k’bahri, mba’Ida, mba’Puji. Kepala Lab. Kimia beserta Staf laboratorium k’erni dan p’haris.
Kepala Lab. Pangan beserta staf laboratorium pangan k’ pipit dan mba’ prita.
8. Balitro (Balai Penelitian Obat dan Aromatik) Bogor, Herbarium Bogoriense - LIPI Cibinong, dan Laboratorium Forensik Mabes Polri, Jakarta Selatan.
9. Semua dosen yang telah mengajarkan penulis selama kuliah S1 ini, terutama dosen-dosen di Prodi Biologi yang telah memberikan ilmu yang tiada terhingga dengan
penuh kesabaran dan keikhlasan, Laboran di laboratorium utama lantai 4 yang selama ini telah memberikan ilmu dan pengalaman teknik dalam laboratorium dan tata usaha di lingkungan Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif
Hidayatullah Jakarta yang telah memberikan informasi kepada penulis.
10.Untuk Mama dan ayah tercinta yang tidak pernah lelah memberi bantuan materil dan non materil, atas segala kasih sayang tulus, doa dan motivasi yang tak terhenti
sehingga penulis dapat menyelesaikan skripsi ini. Adik-adikku (Dyas dan Nana) dan keponakan ku tersayang (Nadya) atas segala keceriaan dan senyuman yang selalu
menemani.
11.Sahabat-sahabat ku, Yelvi, Nunu, dan Iis (ayank-ayangan).
12.Adeng Hudaya, sahabat dan partner penelitian yang telah bersama dalam suka dan
duka dalam penelitian dan mengejar Januari.
14.Temen-temen dari Farmasi yang penelitian bareng (Alim, Tiwi, Yaya, Sobir, Dani, Silma, Nadia dll) dan temen2 semua dari Kimia (Pipit, Mita, Indra dll)
15. Temen2 KKN ( Muhib, Hasan, Prop, Ubaid dan Ali)
Akhirnya, penulis berdoa semoga amal baik yang telah diberikan mendapat balasan yang berlipat ganda dari Allah S.W.T. Amin. Semoga skripsi ini dapat
memberikan sumbangan pemikiran demi kemajuan dan keberhasilan bersama. Amin.
Wassalamu’alaikum Wr.Wb
Penulis
DAFTAR ISI
1.5. Manfaat Penelitian………..…… 5
BAB II TINJAUAN PUSTAKA……….….. 6
2.1. Pengawet Alami... 6
2.2. Kecombrang………... 8
2.2.1. Klasifikasi Kecombrang………... 8
2.2.2. Deskripsi Kecombrang... 9
2.2.3. Manfaat dan Kandungan Kecombrang... 10
2.3. Ekstraksi ... 11
2.4. Uji BSLT (Brine Shrimp Lethality Test)... 13
2.5. Antioksidan... 14
2.6. Antibakteri... 16
2.6.1. Mekanisme Kerja Antibakteri... 18
2.6.2. Pengukuran Aktivitas Antibakteri... 18
2.7. Kloramfenikol... 20
2.8. Bakteri Uji... 21
2.9.1. Prinsip Dasar GC-MS... 24
3.3.3.2. Persiapan Larutan Sampel yang akan diuji.... 28
3.3.3.3. Prosedur Uji Toksisitas dengan Metode BSLT……….. 28
3.3.4. Pengujian Antioksidan... 30
3.3.4.1. Pembuatan Kurva Standar... 30
3.3.4.2. Pengujian Antioksidan... 30
3.3.5. Pembuatan Medium... 31
3.3.5.1. Pembuatan Medium Nutrient Agar (NA) dan Nutrient Broth (NB)……… 31
3.3.5.2. Pembuatan Medium Mueller Hinton Agar (MHA)……… 31
3.3.6. Peremajaan Bakteri Uji dan Pembuatan Suspensi Bakteri……… 32
3.3.7. Pembuatan Inokulum... 32
3.3.8. Pengujian Antibakteri... 32
3.3.7.1. Difusi Cakram... 32
3.3.7.2. MIC (Minimum Inhibitory Consentration)…. 33 3.3.9. Analisis GCMS... 33
3.4. Analisis Data... 33
BAB IV HASIL DAN PEMBAHASAN... 34
4.1. Ekstraksi Daun Kecombrang... 34
4.2. Uji BSLT (Brine Shrimp Lethality Test)... 35
4.3. Uji Antioksidan... 38
4.4. Uji Antibakteri... 41
4.3.1. Uji Antibakteri menggunakan metode difusi cakram.. 41
4.3.2. MIC (Minimum Inhibitory Consentration)... 48
4.5. Analisis GC-MS... 51
BAB V KESIMPULAN DAN SARAN ……… 58
5.1. Kesimpulan……….…... 58
5.2. Saran……….…... 59
DAFTAR PUSTAKA... .. 60
LAMPIRAN... 68
Tabel 1. Bahan Alami di Indonesia yang Mempunyai Efek Antibakteri... 7 Tabel 2. Perhitungan Akumulasi Mati Tiap Konsentrasi... 29
Tabel 3. Perhitungan Akumulasi Hidup Tiap Konsentrasi... 29 Tabel 4. Hasil Uji BSLT Ekstrak Air Daun Kecombrang... 36 Tabel 5. Hasil Pengujian Aktifitas Antioksidan Ekstrak Air Daun
Kecombrang………. 40 Tabel 6. Hasil MIC atau Konsentrasi Hambat Minimum pada Ekstrak
Air Daun Kecombrang………. 49 Tabel 7. Hasil GC-MS Ekstrak Air Daun Kecombrang………. 52
DAFTAR GAMBAR
Halaman
Gambar1. Kecombrang (Etlingera elatior (Jack) R.M. Smith)……… 9
Gambar 2. Struktur DPPH... 16 Gambar 3. Kloramfenikol... 21 Gambar 4. Ekstraksi Daun Kecombrang (a) Serbuk daun kecombrang,
(b) Hasil ekstrak daun kecombrang……… 35 Gambar 5. Reaksi DPPH DenganAntioksidan... 38
Gambar 6. Kurva Standar BHA (Butil hidroksianisol)... 39 Gambar 7. Diameter Zona Hambat Ekstrak Air Daun Kecombrang pada
Escherichia coli dan Staphylococcus aureus……… 43
Gambar 8. Diameter Zona Hambat Bakteri Uji terhadap Kloramfenikol... 47
Gambar 9. Kromatogram Hasil GC-MS Ekstrak Air Daun Kecombrang
dengan Pelarut Etanol... 51 Gambar10. Struktur Kimia Lima Senyawa Terbanyak dengan
Similaritas Minimal 90% (1)butanediol (C4H10O2), (2) penol (C6H5O-) (3) nanodecane (C19H40), (4) Trycosane (C23H48), dan
(5) Eicosane (C20H42)………. 53
ix
Lampiran 2. Kerangka Berpikir... 69
Lampiran 3. Pengukuran Nilai LC50 Daun Kecombrang Uji BSLT... 70
. Lampiran 4. Jumlah Inokulum Bakteri... 71
Lampiran 5. Penghambatan Escherichia coli (1,67. 107 sel/ml)... 72
Lampiran 6. Penghambatan Staphylococcus aureus (2,26. 107 sel/ml)... 73
Lampiran 7. Kontrol Positip dan Kontrol Negatif... 74
Lampiran 8. Data Statistik Staphyloccocus aureus... 75
Lampiran 9. Data Statistik Escherichia coli... 76
Lampiran 10. Uji Antioksidan... 77
1
BAB I PENDAHULUAN
1.1. Latar belakang
Bahan pangan merupakan kebutuhan pokok bagi manusia di samping
pendidikan, kesehatan dan sandang lainnya yang akan terus meningkat sesuai dengan laju pertumbuhan penduduk. Namun, bahan pangan tersebut mudah mengalami perubahan yang tidak diinginkan seperti pembusukan dan ketengikan (Barus, 2009).
Kerusakan bahan pangan ini umumnya disebabkan oleh mikroorganisme melalui proses enzimates dan oksidasi, terutama yang mengandung protein dan lemak
sementara karbohidrat mengalami dekomposisi. Dalam rangka menghambat proses kerusakan pangan digunakan bahan pengawet dan antioksidan sintetis seperti formalin, asam benzoat, BHA (butilated hydroxyanisol), BHT (butylated
hidroxytoluene) dan TBHQ (tertierbutylated hydroxyanisole) (Tranggono, 1990)
Penggunaan bahan pengawet dan antioksidan sintetis tidak direkomendasikan
oleh Badan Pengawas Obat dan Makanan (BPOM) karena diduga dapat menimbulkan penyakit kanker (carcinogen agent). Karena itu perlu dicari alternatif lain yaitu bahan
pengawet dan antioksidan alami yang bersumber dari bahan alam (Barus, 2009).
Salah satu tanaman yang berpotensi sebagai pengawet alami adalah kecombrang (Etlingera elatior (Jack) R.M. Smith), yang merupakan tanaman rempah asli
tanaman ini adalah sebagai salah satu jenis sayuran dan dapat digunakan juga sebagai pengobat luka dan penghilang bau badan (Hidayat dan Hutapea, 1991).
Hasil penelitian oleh Jaafar et al. (2007) pada daun, batang, bunga dan
rimpang tanaman ini menunjukkan adanya beberapa jenis minyak esensial yang kemungkinan bersifat bioaktif. Penelitian Chan et al. (2007) ekstrak etanol dan
metanol dari daun tanaman ini memiliki aktivitas antoksidan dengan cara mengukur
Ferric-Reducing Antioxidant Power (FRAP) dan Abrorbic Acid Equivalent Capacity
(AEAC). McKeen et al. (1997) melaporkan ekstrak etanol dari daun tanaman
kecombrang ini memiliki kemampuan membunuh mikroba secara kualitatif dengan metode disc diffusion dan secara kuantitatif dengan metode tube dilution terhadap
bakteri gram positif (Bacillus cereus dan Bacillus megatrium) dan gram negatif
(Escherichia coli dan Pseudomonas aeruginosa).
BSLT (Brine Shrimp Lethality Test) adalah uji pendahuluan untuk mengetahui
adanya senyawa aktif dalam suatu ekstrak. Juniarti (2009) melakukan uji BSLT menggunakan larva udang Artemia salina sebagai pendahuluan uji antioksidan untuk
mengetahui adanya senyawa aktif dalam ekstrak daun saga dengan nilai LC50 606,736 ppm. Hasil positif dari uji ini menunjukkan adanya senyawa aktif yang berpotensi sebagai antimikroba, antioksidan, dan antikanker.
Dalam Rohman dan Riyanto (2005), ekstrak etanol daun kemuning diuji daya antioksidan dengan menggunakan metode DPPH (1,1-difenil-2-pikrilhidrazil).
Andayani et al. (2008) dan Hanani (2005) juga menguji aktifitas antioksidan dengan
3
metode ini adalah metode yang sederhana untuk evaluasi aktifitas antioksidan dari senyawa bahan alam (Fraglino, 1999)
Naufalin (2005) menguji aktifitas bunga kecombrng dengan menggunakan
metode difusi cakram sebagai pendahuluan adanya aktifitas ekstrak terhadap bakteri uji. Selanjutnya, ekstrak dilakukan uji KHM (Konsentrasi Hambat Minimum) sebagai
uji untuk mengetahui adanya konsentrasi terkecil yang dapat menghambat pertumbuhan bakteri uji. Cossentio et al. (1999) menuliskan KHM adalah konsentrasi
yang dapat menghambat 90% bakteri uji dalam waktu 24 jam. Bakteri uji yang
digunakan adalah bakteri yang biasa mengkontaminasi bahan pangan yaitu
Escherichia coli dan Staphylococcus aureus. Selain itu, kedua bakteri ini adalah
perwakilan bakteri gram negatif dan positif.
Beberapa hasil penelitian telah dilakukan dengan mengekstrak daun kecombrang (Etlingera elatior (Jack) R.M. Smith) menggunakan pelarut etanol
(McKeen et al. 1997; Habsah et al. 2005; Chan et al. 2007) dan heksana
(Widiatmojo, 2009). Oleh karena itu penelitian ini menggunakan pelarut air yang
berbeda dari penelitian sebelumnya. Selain itu, pelarut air biasa diterapkan dalam pembuatan makanan sehari-hari maupun industri makanan.
Mengingat adanya potensi dari daun kecombrang (Etlingera elatior (Jack)
R.M. Smith) sebagai pengawet alami, maka perlu dikumpulkan bukti ilmiah yang terkait dengan kemampuannya sebagai antibakteri terutama pada ekstrak airnya.
organik tidak dapat diterapkan dalam pembuatan makanan sehari-hari maupun industri makanan. Sehingga perlu dilakukan kajian menggunakan pelarut air terhadap kemampuannya sebagai antioksidan dan antibakteri.
1.2. Rumusan Masalah
1. Apakah ekstrak air daun kecombrang (Etlingera elatior (Jack) R.M. Smith)
memiliki senyawa bioaktif berdasarkan metode BSLT (Brine Shrimp Lethality
Test)?
2. Apakah ekstrak air daun kecombrang (Etlingera elatior (Jack) R.M. Smith)
memiliki aktivitas antioksidan?
3. Apakah ekstrak air daun kecombrang (Etlingera elatior (Jack) R.M. Smith)
memiliki aktivitas antibakteri terhadap Escherichia coli dan Stphylococcus
aureus?
1.3. Hipotesis
1. Ekstrak air daun kecombrang (Etlingera elatior (Jack) R.M. Smith) memiliki
senyawa bioaktif berdasarkan metode BSLT (Brine Shrimp Lethality Test).
2. Ekstrak air daun kecombrang (Etlingera elatior (Jack) R.M. Smith) memiliki
aktivitas antioksidan.
3. Ekstrak air daun kecombrang (Etlingera elatior (Jack) R.M. Smith) memiliki
5
1.4. Tujuan Penelitian
1. Untuk meneliti ekstrak air daun kecombrang (Etlingera elatior (Jack) R.M.
Smith) memiliki senyawa bioaktif berdasarkan metode BSLT (Brine Shrimp
Lethality Test).
2. Untuk mengetahui ekstrak air daun kecombrang (Etlingera elatior (Jack)
R.M. Smith) memiliki kemampuan antioksidan.
3. Untuk meneliti ekstrak air daun kecombrang (Etlingera elatior (Jack) R.M.
Smith) memiliki aktivitas antibakteri terhadap Escherichia coli dan
Staphylococcus aureus.
1.5. Manfaat Penelitian
Penelitian ini diharapkan mampu memberikan bukti ilmiah yang terkait tentang ekstrak air daun kecombrang (Etlingera elatior (Jack) R.M. Smith) terhadap
kemampuannya sebagai pengawet alami. Penggunaan pengawet alami diharapkan mengurangi penggunaan bahan pengawet sintetis yang diduga dapat menimbulkan
BAB II
TINJAUAN PUSTAKA
2.1. Pengawet Makanan
Menurut Peraturan Menteri Kesehatan Nomor 722/Menkes/Per/IX/88, yang
dimaksud dengan pengawet adalah bahan tambahan makanan yang mencegah atau
menghambat fermentasi, pengasaman atau penguraian lain terhadap makanan yang
disebabkan oleh mikroorganisme. Pengawet yang diijinkan penggunaannya dalam
makanan antara lain asam benzoat, asam propionat, asam sorbat, natrium nitrit dan
kalium sulfit (Fardiaz, 2002).
Efektivitas dari bahan pengawet ditentukan oleh konsentrasi, macam bahan
pengawet, dan lingkungan bagi bahan pengawet itu ditambahkan. Semakin tinggi
konsentrasi bahan pengawet yang diberikan semakin besar pula efektivitasnya, jika
bahan pengawet tidak membahayakan bagi kesehatan (Supardi dan Sukamto, 1999).
Menurut Food and DrugsAdministration (FDA), keamanan suatu pengawet makanan harus mempertimbangkan jumlah yang mungkin dikonsumsi dalam produk makanan
atau jumlah zat yang akan terbentuk dalam makanan dari penggunaan pengawet, efek
akumulasi dari pengawet dalam makanan dan potensi toksisitas yang dapat terjadi
dari pengawet jika dicerna oleh manusia atau hewan termasuk potensi menyebabkan
kanker (Andrew, 2006).
Pengawet kimia selama ini umum digunakan sebagai barier tambahan untuk
7
konsumen terhadap bahaya keracunan yang mungkin terjadi karena penggunaan
pengawet kimia yang berlebihan, memaksa industri pangan untuk menghindari
penggunaan pengawet kimia pada produknya, atau mencari alternatif lain yang lebih
alami untuk mempertahankan atau memperpanjang umur simpan produk.
Penelitian mengenai potensi pengawet alami yang dikembangkan dari
tanaman rempah (seperti jahe, kayu manis, andaliman, daun salam dan sebagainya)
maupun dari produk hewani (seperti lisozim, laktoperoksidase, kitosan dan
sebagainya) sendiri sebenarnya telah banyak dilakukan di berbagai perguruan tinggi
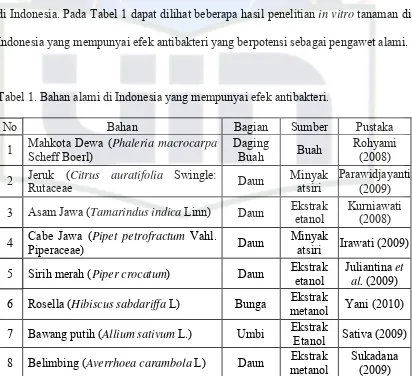
di Indonesia. Pada Tabel 1 dapat dilihat beberapa hasil penelitian in vitro tanaman di Indonesia yang mempunyai efek antibakteri yang berpotensi sebagai pengawet alami.
Tabel 1. Bahan alami di Indonesia yang mempunyai efek antibakteri.
No Bahan Bagian Sumber Pustaka
1 Mahkota Dewa (Phaleria macrocarpa Scheff Boerl)
Daging
Buah Buah
Rohyami (2008)
2 Jeruk (Citrus auratifolia Swingle:
Rutaceae Daun
4 Cabe Jawa (Pipet petrofractum Vahl.
Piperaceae) Daun 6 Rosella (Hibiscus sabdariffa L) Bunga Ekstrak
metanol Yani (2010)
7 Bawang putih (Allium sativum L.) Umbi Ekstrak
Etanol Sativa (2009)
8 Belimbing (Averrhoea carambola L) Daun Ekstrak metanol
9
Jambu biji (Psidium guajaya L.) daging buah putih dan daging buah merah
Daun Ekstrak etanol
Adnyana et al.
(2004)
10 Jambu mede (Anacardium occidentale
L) Buah Infusa
12 Lengkuas (Languas galanga Stunz.) Rimpang Minyak atsiri
Parwata dan Dewi (2008)
2.2. Kecombrang
2.2.1. Klasifikasi Kecombrang
Kecombrang memiliki beberapa nama latin, seperti Nicolaia speciosa Horan,
Nicolaia elatior Horan, Etlingera elatior, Phaeomeria maggnifica, Phaemoria spesiosa, P .intermedia Valet (Tampubolon et al. 1983). Nama-nama daerah lain tanaman ini yaitu Kala (Gayo), Puwar kijung (Minangkabau), Kecombrang (Jawa
Tengah) Horije (Sunda), Atimengo (Gorontalo), Katimbang (Makasar), Salahawa
(Seram), Petikala (Ternate), Petikala (Tidore) (Hidayat dan Hutapea, 1991),
sedangkan di luar negeri dikenal dengan ginger bud (Inggris), xiang bao jiang (Cina),
kantan (Malaysia), boca de dragon (Spanyol) dan kaa laa (Thailand).
Tumbuhan kecombrang merupakan tumbuhan yang tersebar cukup luas di
Indonesia. Penggunaan kecombrang sebagai bahan obat sangat banyak ragamnya.
Tumbuhan ini digunakan sebagai bahan pangan dan juga dapat digunakan untuk
9
2.2.2. Deskripsi Kecombrang
Tanaman kecombrang merupakan tanaman tahunan yang berbentuk semak
dengan tinggi 1-3 m. Tanaman ini mempunyai batang semu, tegak, berpelepah,
membentuk rimpang, dan berwarna hijau. Daunnya tunggal, lanset, ujung dan
pangkal runcing tetapi rata, panjang daun sekitar 20-30 cm dan lebar 5-15 cm,
pertulangan daun menyirip, dan berwarna hijau. Bunga kecombrang merupakan
bunga majemuk yang berbentuk bongkol dengan panjang tangkai 40-80 cm. Panjang
benang sari ± 7,5 cm dan berwarna kuning. Putiknya kecil dan putih. Mahkota
bunganya bertaju, berbulu jarang dan warnanya merah jambu. Biji kecombrang
berbentuk kotak atau bulat telur dengan warna putih atau merah jambu. Buahnya
kecil dan berwarna coklat. Akarnya berbentuk serabut dan berwarna kuning gelap
(Syamsuhidayat, 1991)
2.2.3. Manfaat dan Kandungan Kecombrang
Hampir seluruh bagian dari tumbuhan ini dapat dimanfaatkan. Dalam
kecombrang terkandung zat aktif seperti saponin, flavonoida, dan polifenol. Zat aktif
tersebut dikenal sebagai deodoran alami yang akan mengurangi bau badan yang
kurang enak bagi orang yang mengkonsumsinya. Kecombrang juga kaya vitamin dan
mineral. Khasiat lain dari kecombrang adalah memperbanyak ASI, dan pembersih
darah. Hal ini sangat baik bagi ibu yang sedang menyusui. Di beberapa kalangan
masyarakat, kecombrang dipercaya sebagai penetral kolesterol (Anonim, 2010). Hal
ini tidaklah mengejutkan mengingat adanya beberapa hasil penelitian yang
menunjukkan kandungan senyawa-senyawa bioaktif dari tanaman ini seperti
antibakteri, antioksidan dan antikanker.
Hasil penelitian oleh Jaffar et al. (2007) pada daun, batang, bunga dan rimpang tanaman ini menunjukkan adanya beberapa jenis minyak esensial yang
kemungkinan bersifat bioaktif. Ekstraksi minyak esensial dilakukan dengan metode
hidrodistilasi sedangkan analisanya dilakukan dengan alat GC-MS (Gas Chromatography Mass Spectrometer). Dari penelitian ini terungkap kandungan minyak esensial tertinggi adalah pada daun yaitu sebesar 0,0735%, bunga sebesar
0,0334%, batang sebesar 0,0029% dan rimpang sebesar 0,0021%. Komponen utama
minyak esensial pada daun adalah β-pinene (19,7%), caryophyllene (15,36%) dan β
-farnesene (27,9%).
11
metode disc diffusion dan secara kuantitatif dengan metode tube dilution terhadap bakteri gram positif (Bacillus cereus dan Bacillus megatrium) dan gram negatif (Escherichia coli dan Pseudomonas aeruginosa). Hasil pengujian menunjukkan adanya aktivitas antibakteri dengan konsentrasi hambatan minimum berkisar 100–800
μg/ml dan konsentrasi lethal minimum berkisar 400–800 μg/ml. Hal ini menunjukkan
potensi pemakaian daun tanaman ini sebagai pengawet makanan alami.
Ekstrak etanol dan metanol dari bunga, daun dan rhizome tanaman ini diuji aktivitas antioksidannya dengan cara mengukur Ferric-Reducing Antioxidant Power
(FRAP) dan Ascorbic Acid Equivalent Antioxidant Capacity (AEAC). Hasil penelitian tersebut megindikasikan semua ekstrak mengandung aktivitas antioksidan
dimana ekstrak yang berasal dari daun menunjukkan aktivitas tertinggi diikuti ekstrak
bunga dan terrendah adalah ekstrak rimpang (Chan et al. 2007). Dibuktikan bahwa senyawa-senyawa aktif 1,7-bis (4-hydroxyphenyl)- 2,4,6- heptatrienone,
demethoxycurcumin dan 1,7-bis (4-hydroxyphenyl)- 1,4,6-heptatrien- 3-one dari
rimpang tanaman ini mempunyai kekuatan menghambat peroksidasi pada lemak yang
lebih kuat daripada α-tocopherol sebagai kontrol positif (Habsah et al. 2005).
2.3. Ekstraksi
Ekstraksi adalah suatu proses pemisahan dari bahan padat maupun cair
dengan bantuan pelarut. Pelarut yang digunakan harus dapat mengekstrak substansi
yang diinginkan tanpa melarutkan material lainnya. Ekstraksi merupakan proses
cara. Ekstraksi menggunakan pelarut didasarkan pada kelarutan komponen terhadap
komponen lain dalam campuran (Suyitno et al. 1989).
Ekstraksi tumbuhan adalah proses penarikan zat aktif dalam tumbuhan dengan
menggunakan pelarut tertentu. Senyawa atau kandungan dalam tumbuhan memiliki
kelarutan berbeda-beda dalam pelarut yang berbeda. Pelarut-pelarut yang biasa
digunakan antara lain: kloroform, eter, aseton, alkohol, metanol, etanol dan etil asetat
(Harbone, 2006).
Metode ektraksi yang digunakan dalam penelitian ini adalah maserasi.
Maserasi digunakan untuk penyarian simplisia yang mengandung zat yang mudah
larut dalam cairan penyari. Cairan penyari yang digunakan dapat berupa air,
air-etanol, pelarut lain. Keuntungan metode ini adalah pengerjaan dan peralatan yang
digunakan sederhana dan mudah diperoleh. Namun, kerugian metode ini yaitu
pengerjaannya lama dan penyariannya kurang sempurna (Endah, 2008).
Pelarut yang digunakan dalam penelitian ini adalah air. Air adalah pelarut
yang kuat, melarutkan banyak jenis zat kimia. Zat-zat yang bercampur dan larut
dengan baik dalam air (misalnya garam-garam) disebut sebagai zat-zat "hidrofilik"
(larut air), dan zat-zat yang tidak mudah tercampur dengan air (misalnya lemak dan
minyak), disebut sebagai zat-zat "hidrofobik" (tidak larut dalam air). Kelarutan suatu
zat dalam air ditentukan oleh dapat tidaknya zat tersebut menandingi kekuatan gaya
tarik-menarik listrik (gaya intermolekul dipol-dipol) antara molekul-molekul air. Jika
suatu zat tidak mampu menandingi gaya tarik-menarik antar molekul air,
13
2.4. Uji BSLT (Brine Shrimp Lethality Test)
Metode uji Brine Shrimp Lethality Test (BSLT) diperkenalkan oleh Meyer pada tahun 1982 yang digunakan untuk memantau adanya aktifitas farmakologi
(terutama anti kanker) dari suatu fraksi atau fraksi-fraksi tanaman. Metode BSLT ini
mempunyai keunggulan: waktu pelaksanaan cepat, biaya relatif murah, praktis, tidak
memerlukan teknik aseptis, tidak memerlukan perawatan khusus, menggunakan
sampel relatif sedikit, tidak memerlukan serum hewan, hasil uji berkorelasi baik
dengan beberapa metode uji sitotoksik. Prinsip uji BSLT adalah menarik hubungan
antara konsentrasi larutan fraksi atau ekstrak terhadap respon kematian Artemia salina (Wahyono dan Rahman, 1995).
Artemia salina Leach merupakan organisme sejenis udang-udangan yang berukuran kecil dan dikenal dengan nama brine shrimp. Artemia salina Leach digunakan sebagai hewan uji untuk menentukan ketoksikan suatu senyawa dalam
ekstrak tumbuhan yang diwujudkan sebagai racun terhadap hewan uji. Senyawa
bioaktif kebanyakan bersifat toksik pada dosis tinggi. Jadi, pengujian dengan
organisme yang sederhana secara zoologis dapat digunakan secara monitor yang
meyakinkan untuk skrining dan fraksinasi dalam penemuan senyawa bioaktif yang
baru (Baraja, 2008).
konsentrasi terkecil (LC10) dan konsentrasi terbesar (LC90) yang dapat mematikan
Artemia salina.
Hasil uji BSLT akan diketahui adanya senyawa bioaktif dengan mengetahui
nilai LC50. Nilai LC50 merupakan angka yang menunjukan konsentrasi ekstrak yang
dapat menyebabkan kematian sebesar 50% dari jumlah hewan uji. Dalam Meyer
(1982 dalam Juniarti et al. 2009), suatu zat dikatakan aktif bila nilai LC50 < 1000 ppm untuk ektrak dan < 30 ppm untuk suatu senyawa.
2.5. Antioksidan
Antioksidan merupakan senyawa pemberi elektron (electron donor) atau reduktan. Senyawa ini memiliki berat molekul kecil, tetapi mampu menginaktivasi
berkembangnya reaksi oksidasi, dengan cara mencegahnya terbentuknya radikal.
Antioksidan juga merupakan senyawa yang dapat mencegah reaksi oksidasi, dengan
mengikat radikal bebas dan molekul yang sangat reaktif. Akibatnya kerusakan sel
dapat dihambat (Winarsi, 2007).
Radikal bebas adalah senyawa kimia yang memiliki satu atau lebih elektron
tidak berpasangan pada orbital terluarnya, sehingga dapat menyerang
senyawa-senyawa lain seperti DNA, membran lipid, dan protein. Radikal ini akan merebut
elektron dari molekul lain yang ada disekitarnya untuk menstabilkan diri, sehingga
spesies kimia ini sering dihubungkan dengan terjadinya kerusakan sel, kerusakan
15
Dalam Winarsi (2007), secara umum antioksidan dikelompokkan menjadi 2,
yaitu antioksidan enzimatis dan non-enzimatis. Antoksidan enzimatis misalnya enzim
Super Oksidase Dismutase (SOD), katalase, dan glutation peroksidase. Antioksidan non-enzimatis masih dibagi dalam dua kelompok lagi yaitu antioksidan larut lemak
seperti –tokoferol, karetonoid, flavonoid, quinon, dan bilirubin dan antioksidan larut
air, seperti asam askorbat, asam urat, protein pengikat logam, dan protein pengikat
heme. Antioksidan non-enzimatis dalam sayuran dan buah-buahan. Komponen yang
bersifat antioksidan dalam sayuran dan buah-buahan meliputi vitamin C, E dan
ß-karoten, flavonoid, isoflavon, antosianin, katekin, isokatekin dan asam lipoat.
Senyawa fitokimia ini membantu melindungi sel dari kerusakan oksidatif yang
disebabkan oleh radikal bebas.
Senyawa antioksidan alami tumbuhan umumnya adalah senyawa fenolik atau
polifenolik yang dapat berupa golongan flavonoid, turunan asam sinamat, kumarin,
tokoferol dan asam-asam organik polifungsional. Golongan flavonoid yang memiliki aktivitas antioksidan meliputi flavon, flavonol, isoflavon, kateksin, flavonol dan
kalkon. Sementara turunan asam sinamat meliputi asam kafeat, asam ferulat, asam
klorogenat, dan lain-lain (Pokorni et al. 2001).
Fungsi utama antioksidan digunakan sebagai upaya untuk memperkecil
terjadinya proses oksidasi dari lemak dan minyak, memperkecil terjadinya proses
kerusakan dalam makanan, memperpanjang masa pemakaian dalam industri
makanan, meningkatkan stabilitas lemak yang terkandung dalam makanan serta
satu faktor yang cukup berperan dalam kerusakan selama dalam penyimpanan dan
pengolahan makanan (Hernani dan Raharjo, 2005). Antioksidan tidak hanya
digunakan dalam industri farmasi, tetapi juga digunakan secara luas dalam industri
makanan, industri petroleum, industri karet dan sebagainya (Tahir et al. 2003).
Pemeriksaan antioksidan dalam penelitian dilakukan dengan metode DPPH
(1,1-difenil-2-pikrilhidrazil). Uji kimia ini telah digunakan secara luas pada penelitian
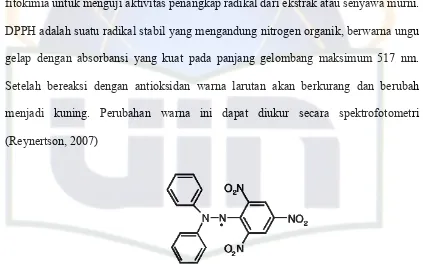
fitokimia untuk menguji aktivitas penangkap radikal dari ekstrak atau senyawa murni.
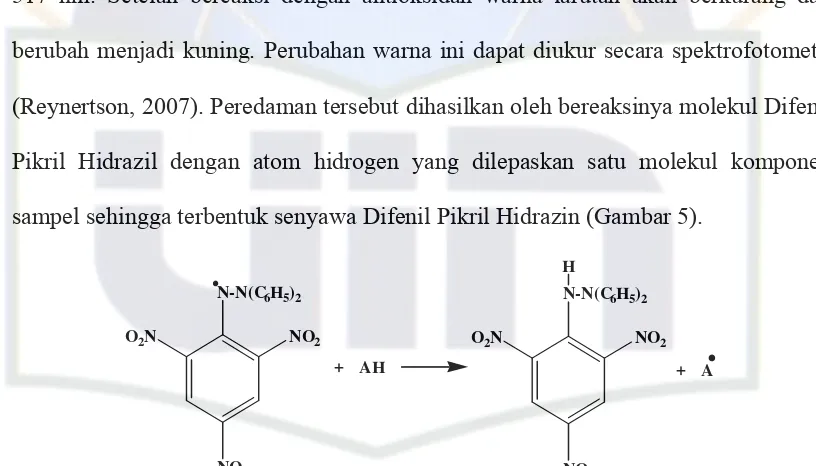
DPPH adalah suatu radikal stabil yang mengandung nitrogen organik, berwarna ungu
gelap dengan absorbansi yang kuat pada panjang gelombang maksimum 517 nm.
Setelah bereaksi dengan antioksidan warna larutan akan berkurang dan berubah
menjadi kuning. Perubahan warna ini dapat diukur secara spektrofotometri
(Reynertson, 2007)
1,1-diphenyl-2-picrylhydrazyl (DPPH) Gambar 2. Struktur DPPH
Penurunan intensitas warna yang terjadi disebabkan oleh berkurangnya ikatan
17
satu elektron oleh zat antioksidan, menyebabkan tidak adanya kesempatan elektron
tersebut untuk beresonansi (Pratimasari, 2009).
2.6. Antibakteri
Penggunaan senyawa antimikroba khususnya yang alami, secara umum
meningkat dari tahun ke tahun. Senyawa antimikroba merupakan senyawa yang
mempunyai kemampuan menghambat pertumbuhan mikroorganisme. Senyawa
antimikroba yang terkandung dalam berbagai jenis ekstrak tanaman diketahui dapat
menghambat beberapa mikroorganisme patogen maupun perusak pangan (Branen dan
Davidson, 1993).
Senyawa antimikroba yang berasal dari tanaman, sebagian besar diketahui
merupakan metabolit sekunder tanaman, terutama golongan fenolik dan terpena.
Sebagian besar metabolit sekunder dibiosintesis dari banyak metabolit primer seperti
dari asam-asam amino, asetil ko-A, asam mevalonat, dan metabolit antara (Helber,
1995). Ditambahkan oleh Nychas dan Tassou (2000), beberapa senyawa yang bersifat
antimikroba alami berasal dari tanaman diantaranya adalah fitoaleksin, asam organik,
minyak essensial (atsiri), fenolik dan beberapa kelompok pigmen tanaman atau
senyawa sejenis.
Mikroorganisme dapat menyebabkan infeksi, menimbulkan penyakit, dan
merusak bahan pangan. Mikroorganisme dapat dihilangkan, dihambat dan dibunuh
dengan cara fisik maupun kimia. Senyawa antimikroba adalah zat yang dapat
pengobatan infeksi pada manusia, hewan dan tumbuhan. Antimikroba meliputi
antifungi, antibakteri, antiprotozoa dan antivirus (Inayati, 2007).
Antibakteri adalah suatu bahan yang mematikan bentuk-bentuk vegetatif
bakteri (Pelczar dan Chan, 1988). Antibakteri adalah suatu zat yang dapat mencegah
terjadinya pertumbuhan dan reproduksi bakteri. Antibakteri merupakan senyawa yang
berfungsi sebagai bahan pengawet makanan untuk memperpanjang umur simpan
suatu makanan dengan cara menghambat pertumbuhan mikroba. Efektifitas dari suatu
bahan pengawet antibakteri ditentukan oleh konsentrasi dan jenis bahan pengawet.
Umumnya bahan pengawet makanan hanya bersifat bakteriostatik karena jumlah
yang ditambahkan ke dalam makanan sangat kecil agar tidak berbahaya bagi
kesehatan manusia (Supardi dan Sukamto, 1999).
Utami (2010) telah menguji aktivitas antibakteri distilat rimpang lengkuas
merah dan ekstrak daun mengkudu dengan metode difusi kertas cakram dengan
menggunakan konsentrasi 20%, 40%, 60%, 80% dan 100%. Khoiriyah (2010) juga
menggunakan konsentrasi yang sama untuk menguji aktivitas antibakteri dari minyak
atsiri Jahe.
2.6.1. Mekanisme Kerja Antibakteri
Mekanisme penghambatan dan kerusakan mikroorganisme oleh senyawa
antibakteri berbeda-beda. Penghambatan mikroba oleh senyawa antibakteri secara
umum dapat disebabkan oeh: (1) gangguan pada komponen penyusun sel; terutama
komponen penyusunan dinding sel, (2) reaksi dengan membran sel yang dapat
19
penghambatan terhadap sintesis protein dan (4) gangguan fungsi material genetik
(Davidson, 2001). Menurut Kanazama et al. (1995) mekanisme terjadinya proses tersebut diatas disebabkan oleh adanya pelakatan senyawa antimikroba pada
permukaan sel mikroba dan senyawa tersebut berdifusi ke dalam sel.
2.6.2. Pengukuran Aktivitas Antibakteri
Di dalam Kusmiyati dan Agustini (2006), Pengukuran aktivitas antibakteri
dapat dilakukan dengan metode difusi dan metode pengenceran. Metode difusi
merupakan salah satu metode yang sering digunakan, metode difusi dapat dilakukan 3
cara yaitu metode silinder, lubang dan cakram kertas. Metode pengenceran yaitu
mengencerkan zat antimikroba dan dimasukkan ke dalam tabung-tabung reaksi steril.
Ke dalam masing-masing tabung itu ditambahkan sejumlah mikroba uji yang telah
diketahui jumlahnya. Pada interval waktu tertentu, dilakukan pemindahan dari tabung
reaksi ke dalam tabung-tabung berisi media steril yang lalu diinkubasikan dan diamati
penghambatan pertumbuhan.
Seleksi aktivitas antibakteri dengan difusi sumur dan difusi cakram digunakan
sebagai uji pendahuluan. Metode ini dipengaruhi oleh ketebalan lapisan agar dan
volume ekstrak yang terserap dalam cakram (Dorman dan Deans, 2000). Metode
cakram kertas yaitu meletakkan cakram kertas yang telah direndam larutan uji di atas
media padat yang telah diinokulasi dengan bakteri. Setelah diinkubasi, pertumbuhan
bakteri diamati untuk melihat ada tidaknya daerah hambatan disekeliling cakram
Penghambatan mikroorganisme oleh suatu senyawa antibakteri dinyatakan
dengan nilai MIC (Minimum Inhibitory Consentration) yaitu konsentrasi terendah yang dapat menghambat pertumbuhan mikroorganisme sebanyak 90 % dari inokulum
asal selama inkubasi 24 jam (Cossentio et al., 1999). Nilai MIC dan MBC (Minimum Bactericidal Concentration) senyawa antibakteri dari ekstrak rempah-rempah maupun tanaman berbeda-beda bergantung pada jenis mikroorganisme dan senyawa
antimikroba.
Fase pertumbuhan bakteri berpengaruh terhadap sensitifitas antibakteri
terhadap senyawa antimikroba. Bakteri pada fase stasioner lebih sensitif terhadap
antibakteri (Thompson dan Hinton, 1996). Pengujian antibakteri dilakukan pada fase
midlog yaitu pertengahan fase logaritmik (eksponensial), yaitu dimana bakteri sedang aktifnya membelah diri, sehingga pengaruh senyawa antibakteri dapat dilihat dengan
adanya kematian atau hambatan pada pertumbuhan bakteri.
2.7. Kloramfenikol
Kloramfenikol merupakan suatu antibiotik spektrum luas yang berasal dari
beberapa jenis Streptomyces misalnya S. venezuelae, S. phaeochromogenes var. chloromyceticus, dan S.omiyamensis (Kurniawan, 2006). Antibiotik ini memberikan efek dengan cara bereaksi pada subunit 50S ribosom dan menghalangi aktivitas enzim
peptidil transferase. Enzim ini berfungsi membentuk ikatan peptida antara asam
21
berkembang. Sebagai akibatnya sintesis protein bakteri akan terhenti seketika
(Pratiwi, 2002).
Dalam Kurniawan (2006) dijelaskan kloramfenikol mempunyai rumus kimia
yang cukup sederhana yaitu 1-(pnitrofenil)- 2-dikloroasetamido-1,3-propandiol:
Gambar 3. Struktur kloramfenikol
Kloramfenikol adalah salah satu antibiotik yang secara kimiawi diketahui
paling stabil dalam segala pemakaian. Kloramfenikol memiliki stabilitas yang sangat
baik pada suhu kamar dan kisaran pH 2 sampai 7, stabilitas maksimumnya dicapai
pada pH 6. Pada suhu 25oC dan pH 6, memiliki waktu paruh hampir 3 tahun (Connors, 1992).
2.8. Bakteri Uji
Berdasarkan perbedaannya dalam menyerap warna, bakteri dibagi atas dua
golongan yaitu bakteri gram positif dan gram negatif. Bakteri gram positif menyerap
zat warna pertama yaitu kristal violet yang menyebabkannya berwarna ungu,
sedangkan bakteri gram negatif menyerap zat warna kedua yaitu safranin dan
kandungan peptidoglikan yang tinggi (dapat mencapai 50%) dibandingkan bakteri
gram negatif (sekitar 10%). Sebaliknya kandungan lipida dinding sel bakteri gram
positif lebih rendah sedangkan pada dinding sel bakteri gram negatif tinggi yaitu
sekitar 11-22% (Lay, 1992).
2.8.1. Escherichia coli
Escherichia coli adalah salah satu contoh dari bakteri gram negatif, berbentuk batang pendek (kokobasil), selnya berukuran 0,5-1,0 x 1,0-3,0 μm. Bakteri ini tidak membentuk spora, tidak tahan asam, sebagian besar bergerak (motil) dengan flagel
peritricus (merata tersebar ke seluruh permukaan sel) tetapi ada pula yang nonmotil,
dan beberapa strain mempunyai kapsul. Bakteri ini dapat tumbuh secara anaerob
fakultatif (umumnya bersifat kemoheterotrof). Nilai pH optimum untuk pertumbuhan
adalah 7,0-7,5 serta kisaran suhu pertumbuhannya 10oC - 40oC dengan suhu optimum 37oC. E.coli sangat sensitif terhadap panas (Fardiaz, 1983).
Khotimah (2009) telah meneliti fase pertumbuhan E. coli dengan menggunakan metode turbidimetri pada medium Nutrient Broth, diketahui fase adaptasi berlangsung dari menit ke-0 sampai menit ke-210, selanjutnya diikuti
dengan fase logaritmik berlangsung dari menit ke-210 sampai menit ke-450. Setelah
itu, bakteri berada pada fase stasioner dimana jumlah sel yang tumbuh hampir sama
dengan jumlah sel yang mati dan akhirnya bakteri mengalami penurunan jumlah sel,
hal ini diakibatkan oleh nutrisi yang semakin berkurang atau terakumulasinya limbah
23
E. coli bersifat patogen oportunis, banyak ditemukan pada manusia dan hewan sebagai penghuni normal dalam saluran pencernaan, habitat pada umumnya adalah
tanah, lingkungan aquatik, makanan, air seni, dan tinja (Fardiaz, 1983). Karena
sifatnya patogen, bakteri ini dapat menyebabkan beberapa infeksi primer pada usus
(misalnya diare pada anak), infeksi pada saluran pada kemih, pneumia, abses, dan
maningritis pada bayi yang baru lahir (Jawezt et al. 1996). 2.8.2. Staphylococcus aureus
Staphylococcus adalah salah satu perwakilan dari bakteri gram positif, bentuk kokus dengan susunan berpasangan atau bergerombol, seperti anggur. Bersifat
aerobik atau anaerobik fakultatif, katalase positif, oksidase negatif, bersifat non motil,
tidak membentuk spora. Staphylococcus tumbuh dengan cepat pada beberapa tipe media dan aktif melakukan metabolisme serta melakukan fermentasi karbohidrat.
Staphylococcus menghasilkan bermacam-macam pigmen, dari warna putih hingga kuning gelap (Brooks et al. 2005).
Fase pertumbuhan S. aureus dengan menggunakan metode turbidimetri pada medium Nutrient Broth, diketahui fase adaptasi berlangsung dari menit ke-0 sampai menit 360, selanjutnya diikuti dengan fase logaritmik berlangsung dari menit
ke-360 sampai menit ke-600. Setelah itu, bakteri berada pada fase stasioner dimana
jumlah sel yang tumbuh hampir sama dengan jumlah sel yang mati dan akhirnya
bakteri mengalami penurunan jumlah sel, hal ini diakibatkan oleh nutrisi yang
Hanya galur-galur tertentu S. aureus menghasilkan enterotoksin. Pada umumnya galur ini adalah koagulasi positif, yaitu mempunyai kemampuan
mengkoagulasi plasma darah yang diberi sitrat atau oksalat. Enterotoksin ini tahan
panas, tidak berubah walau telah didihkan selama 30 menit. Dibiarkannya makanan
yang tercemar pada suhu ruang selama 8 sampai 10 jam cukup untuk menghasilkan
toksin dalam jumlah yang memadai untuk menyebabkan keracunan makanan.
Walaupun makanan ini disimpan dalam lemari es selama berbulan-bulan, toksinnya
tidak akan termusnahkan. Jika dilakukan pemanasan kembali pada makanan tersebut,
maka tidak mengurangi kandungan toksin tersebut (Irianto, 2006)
2.9. GC-MS
2.9.1. Prinsip Dasar GC-MS
Kromatografi gas spektroskopi massa adalah teknik analisis yang
menggabungkan dua metode analisis yaitu Kromatografi Gas dan Spektroskopi
Massa. Kromatografi gas merupakan metode analisis dimana sampel terpisahkan
secara fisik menjadi bentuk molekul-molekul yang lebih kecil (hasil pemisahan dapat
dilihat berupa kromatogram). Sedangkan spektroskopi massa adalah metode analisis
dimana sampel yang akan dianalisis diubah menjadi ionnya, dan massa dari
ion-ion tersebut dapat diukur (hasil deteksi dapat dilihat berupa spektrum massa) (Lingga,
2004).
Pada GC hanya terjadi pemisahan untuk mendapatkan komponen yang
25
dapat mengidentifikasi komponen tersebut, karena bisa mendapat spektrum bobot
molekul pada suatu komponen yang dapat dibandingkan langsung dengan Library (reference) pada software. Sampel-sampel yang dapat dianalisis dengan menggunakan GCMS, harus memenuhi beberapa syarat, diantaranya (Lingga, 2004):
1) Dapat diuapkan pada hingga suhu 400oC
2) Secara termal stabil (tidak terdekomposisi pada suhu 400oC)
3) Sampel-sampel lainnya dapat dianalisis setelah melalui tahapan preparasi
khusus.
2.8.2 Proses Pemisahan Pada GC-MS
Pemisahan komponen senyawa dalam GC-MS terjadi di dalam kolom
(kapiler) GC dengan melibatkan dua fase, yaitu fase diam dan fase gerak. Fase diam
adalah zat yang ada di dalam kolom, sedangkan fase gerak adalah gas pembawa
(Helium maupun Hidrogen dengan kemurnian tinggi, yaitu ± 99,995 %) (Hermanto,
2008).
Lebih lanjut Hermanto (2008), proses pemisahan dapat terjadi karena terdapat
perbedaan kecepatan alir dari tiap molekul di dalam kolom. Perbedaan tersebut dapat
disebabkan oleh perbedaan afinitas antar molekul dengan fase diam yang ada di
dalam kolom. Selanjutnya komponen-komponen yang telah dipisahkan tersebut
masuk ke dalam ruang MS yang berfungsi sebagai detektor secara instrumentasi, MS
BAB III
METODOLOGI PENELITIAN
3.1. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi, Kimia dan Pangan
Pusat Laboratorium Terpadu UIN Syarif Hidayatullah Jakarta. Analisis GC-MS
dilaksanakan di Laboratorium Forensik Mabes Polri, Jakarta Selatan. Adapun waktu
penelitian dilaksanakan pada Bulan April sampai Oktober 2010.
3.2. Bahan dan Alat 3.2.1. Bahan
Bahan yang digunakan adalah daun kecombrang (Etlingera elatior (Jack) R.M. Smith) yang diperoleh dari Balai Tanaman Rempah dan Obat (Balitro), larva
udang (Brine Shrimp), larutan garam 10%, Nutrient Agar, Nutrient Broth, Mueller Hinton Agar, biakan bakteri Escherichia coli dan Staphylococcus aureus yang diperoleh dari Laboratorium Mikrobiologi PLT UIN Jakarta, kloramfenikol, kertas
cakram dan kertas whatman no.1.
3.2.2. Alat
Alat yang digunakan adalah belender, alat penyerbuk (grinding mill), vakum evaporator, vial, beaker glass, tabung reaksi, erlenmeyer, cawan petri, timbangan analitik, spekrofotometer, GC-MS Agilent 19091S-436 HP-5MS dan autoklaf.
3.3. Cara Kerja
Metode yang dilakukan dalam penelitian ini adalah preparasi sampel,
ekstraksi dengan maserasi, uji adanya senyawa bioaktif dengan metode BSLT (Brine Shrimp Lethality Test), pembuatan medium, peremajaan bakteri uji, pembuatan inokulum, uji antibakteri dengan metode difusi (cakram kertas), uji MIC (Minimum Inhibitory Consentration) dan Analisis senyawa menggunakan GCMS (Gas Chromatography Mass Spectrometer). Tahapan penelitian akan dilakukan sebagai berikut:
3.3.1. Preparasi Sampel
Daun kecombrang kering didapatkan dari Balai Tanaman Obat dan Aromatik
(Balitro) Bogor dan dideterminasi di Herbarium Bogoriense - LIPI Cibinong.
3.3.2. Ekstraksi
Ekstrak daun dihasilkan melalui ekstraksi yang dilakukan dengan
menggunakan metode maserasi. Daun kering diserbukkan dengan menggunakan
grinding mill, kemudian serbuk daun kecombrang direndam dengan aquabidest
selama 3 hari. Setelah itu hasil rendaman disaring dengan kertas saring Whatman
no.1. Hasilnya dipekatkan menggunakan vakum rotary evaporator dengan suhu 50oC dengan kecepatan90 rpm sehingga yang tersisa adalah ekstrak daun berupa gel.
3.3.3. Uji Senyawa Bioaktif dengan Metode BSLT (Brine Shrimp Lethality Test) 3.3.3.1. Penetasan Larva udang
Bejana disiapkan untuk penetasan larva udang. Proses pemetasan larva di
dalam bejana yang diletakkan lampu untuk menghangatkan suhu dalam penetasan,
sedangkan diruangan sebelahnya diberi larutan garam (Larutan Nacl 10% (b/v)). Ke
dalam larutan garam dimasukkan ± 50-100 mg telur udang untuk diteteskan. Pada
bagian telur ditutup dengan allumunium foil, dan lampu dinyalakan selama 48 jam
untuk menetaskan telur. Larva udang diambil dengan menggunakan pipet dan
selanjutnya akan digunakan untuk uji BSLT.
3.3.3.2. Persiapan Larutan Sampel yang akan diuji
Ekstrak sampel dibuat dalam konsentrasi 10, 100, 200, 500, dan 1000 ppm
dalam larutan garam.
3.3.3.3. Prosedur Uji Senyawa Bioaktif dengan Metode BSLT
Sebanyak 100 μL larutan garam yang mengandung larva udang sebanyak
10-12 ekor dipipet dan dimasukkan ke dalam vial. Kemudian, larutan garam tersebut
ditambahkan masing-masing sebanyak 100 μL ekstrak air daun kecombrang dengan
konsentrasi 10, 100, 200, 500 dan 1000 ppm. Untuk setiap konsentrasi dilakukan 3
kali pengulangan (triplikat). Larutan diaduk sampai homogen. Untuk kontrol
dilakukan tanpa penambahan sampel. Larutan dibiarkan selama 24 jam, kemudian
dihitung jumlah larva yang mati dan masih hidup dari tiap vial. Angka mati dihitung
dengan menjumlahkan larva yang mati dalam setiap konsentrasi (3 vial). Angka
hidup dihitung dengan menjumlahkan larva yang hidup dalam setiap konsentrasi (3
vial).
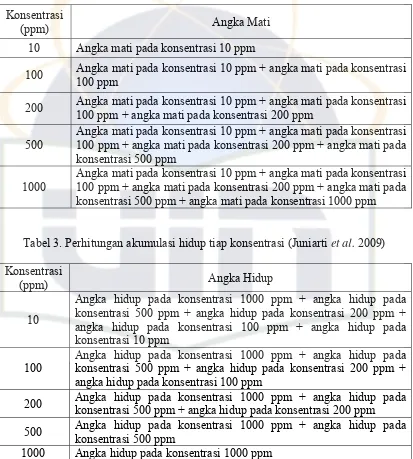
Tabel 2. Perhitungan akumulasi mati tiap konsentrasi (Juniarti et al. 2009)
Konsentrasi
(ppm) Angka Mati
10 Angka mati pada konsentrasi 10 ppm
100 Angka mati pada konsentrasi 10 ppm + angka mati pada konsentrasi 100 ppm
200 Angka mati pada konsentrasi 10 ppm + angka mati pada konsentrasi 100 ppm + angka mati pada konsentrasi 200 ppm
500
Angka mati pada konsentrasi 10 ppm + angka mati pada konsentrasi 100 ppm + angka mati pada konsentrasi 200 ppm + angka mati pada konsentrasi 500 ppm
1000
Angka mati pada konsentrasi 10 ppm + angka mati pada konsentrasi 100 ppm + angka mati pada konsentrasi 200 ppm + angka mati pada konsentrasi 500 ppm + angka mati pada konsentrasi 1000 ppm
Tabel 3. Perhitungan akumulasi hidup tiap konsentrasi (Juniarti et al. 2009) Konsentrasi
(ppm) Angka Hidup
10
Angka hidup pada konsentrasi 1000 ppm + angka hidup pada konsentrasi 500 ppm + angka hidup pada konsentrasi 200 ppm + angka hidup pada konsentrasi 100 ppm + angka hidup pada konsentrasi 10 ppm
100
Angka hidup pada konsentrasi 1000 ppm + angka hidup pada konsentrasi 500 ppm + angka hidup pada konsentrasi 200 ppm + angka hidup pada konsentrasi 100 ppm
200 Angka hidup pada konsentrasi 1000 ppm + angka hidup pada konsentrasi 500 ppm + angka hidup pada konsentrasi 200 ppm
500 Angka hidup pada konsentrasi 1000 ppm + angka hidup pada konsentrasi 500 ppm
1000 Angka hidup pada konsentrasi 1000 ppm
Selanjutnya dihitung mortalitas dengan cara: akumulasi mati dibagi jumlah
akumulasi hidup dan mati (total) dikali 100%. Nilai LC50 merupakan konsentrasi dimana zat menyebabkan kematian 50% yang diperoleh dengan menggunakan
softwear regresi. Suatu zat dikatakan aktif bila nilai LC50 < 1000 ppm untuk ektrak
dan < 30 ppm untuk suatu senyawa.
3.3.4. Uji Antioksidan
3.3.4.1. Pembuatan Kurva Standar
200 µl BHA standar konsentrasi 0 ppm, 18 ppm, 36 ppm, 72 ppm, dan 90
ppm dimasukkan masing-masing ke dalam tabung reaksi. Selanjutnya, 800 µl Tris
Hcl pH 7,4 dan 1 ml DPPH ditambahkan ke dalam tabung reaksi. Larutan dalam
tabung reaksi divortex hingga homogen dan diinkubasi 20 menit di ruang gelap.
Selanjutnya diukur jumlah antioksidan dengan melihat serapannya dengan
spekrofotometer UV-Vis pada panjang gelombang 517 nm.
3.3.4.2. Pengujian Antioksidan
200 µl sampel konsentrasi 0 ppm (kontrol), 10 ppm, 30 ppm, 50 ppm, 70 ppm,
dan 90 ppm dimasukkan masing-masing ke dalam tabung reaksi. Selanjutnya, 800 µl
Tris Hcl pH 7,4 dan 1 ml DPPH ditambahkan ke dalam tabung reaksi. Larutan dalam
tabung reaksi divortex hingga homogen dan diinkubasi 20 menit di ruang gelap.
Selanjutnya jumlah antioksidan diukur dengan melihat serapannya dengan
spekrofotometer UV-Vis pada panjang gelombang 517 nm.
Aktivitas antioksidan sampel ditentukan oleh besarnya hambatan serapan
radikal DPPH melalui perhitungan persentase inhibisi serapan DPPH dengan
menggunakan rumus :
% Inhibisi = Abs. Kontrol – Abs. Sampel x 100 % Abs. Kontrol
Ket :
Abs. kontrol : Serapan radikal kontrol
Abs. Sampel : Serapan sampel
Selanjutnya ditentukan harga IC50, yakni konsentrasi larutan uji yang memberikan peredaman DPPH sebesar 50% dengan menggunakan softewear regresi.
3.3.5. Pembuatan Medium
3.3.5.1. Pembuatan Medium Nutrient Broth (NB) dan Nutrient Agar (NA)
Sebanyak 8 gram bubuk NB atau 23 gram NA dilarutkan dalam 1 liter
aquadest dalam enlenmeyer kemudian diaduk menggunakan magnetic stirer sampai homogen. Selanjutnya larutan disterilisasi di autoklaf pada suhu 121oC selama 15 menit.
3.3.5.2. Pembuatan Medium Mueller Hinton Agar (MHA)
Sebanyak 38 gram MHA dilarutkan dalam 1 L aquadest kemudian dipanaskan dan diaduk dengan menggunakan magnetik stirer sampai homogen. Media disterilkan dengan menggunakan autoklaf pada suhu 121oC, tekanan 1,5 atm dan selama 15 menit. Setelah disterilisasi, medium Medium MHA dimasukkan ke dalam cawan petri
sebanyak 15 ml dan dibiarkan mengeras.
3.3.6. Peremajaan Bakteri Uji dan Pembuatan Suspensi Bakteri
Bakteri uji dibiakkan pada agar miring steril kemudian diinkubasi pada suhu
37oC selama 24 jam. Bakteri yang telah dibiakkan pada agar miring ditambahkan larutan fisiologis NaCl 0,9% steril sebanyak 5 ml kemudian dihomogenkan dengan
vortek
3.3.7. Pembuatan Inokulum
Suspensi bakteri uji sebanyak 1 ml dimasukkan ke dalam 100 ml medium NB.
Selanjutnya medium NB diinkubasi di shaker inkubator dengan kecepatan shaker 120 rpm, suhu ruang, sampai bakteri uji mencapai 8 jam.
3.3.8. Pengujian Antibakteri 3.3.8.1. Difusi Cakram
Pengujian ini dilakukan dengan metode difusi kertas cakram dengan
menggunakan konsentrasi 20%, 40%, 60%, 80% dan 100%. Biakan dalam NB
sebanyak 0.1 ml dimasukkan ke dalam 15 ml MHA yang sudah padat. Ekstrak
kecombrang dibuat dengan dengan berbagai konsentrasi sebanyak 0,03 ml diambil
menggunakan mikropipet 0,01 ml pada kertas cakram steril berdiameter 1,6 cm
kemudian ditanam pada medium MHA padat dalam cawan petri. Setelah itu
diinkubasi selama 24 jam pada suhu 370C. Selanjutnya diameter zona hambat diukur dan dibandingkan dengan zona hambat pada kontrol kloramfenikol 10µg.
33 3.3.8.2. MIC (Minimum Inhibitory Consentration)
Penentuan MIC dilakuan dengan metode kontak. Sebanyak 1 ml ekstrak dan
0,1 ml inokulum dimasukkan ke tabung uji yang berisi medium NB 3,9 ml yang telah
disterilkan. Selanjutnya, tabung uji diinkubasi dalam shaker incubator pada suhu kamar selama 24 jam dengan kecepatan 120 rpm. Setelah diinkubasi, media diambil
sebanyak 10 µl dan ditanam pada media NA. Setelah 24 jam dilakukan perhitungan
jumlah bakteri yang tumbuh. Nilai MIC yaitu konsentrasi minimum ekstrak yang
dapat menghambat pertumbuhan bakteri uji sebanyak 90% selama 24 jam.
3.3.9. Analisa GC-MS
Dalam penelitian ini digunakan analisa GC-MS untuk menganalisa dan
mengidentifikasi senyawa yang terdapat pada hasil ekstraksi daun kecombrang.
GCMS yang digunakan adalah Agilent 19091S-436 HP-5MS. Untuk menganalisa
hasil ekstraksi daun kecombrang sebanyak ± 0.5 µl sampel dimasukkan kedalam
kolom polar, 0.25mm, 60m, 0.25um.
3.4. Analisis Data
Semua analilisa akan diulang sebanyak tiga kali dari sampel yang berbeda dan
BAB IV
HASIL DAN PEMBAHASAN
4.1. Ekstraksi Daun Kecombrang
Ekstraksi adalah suatu proses pemisahan dari bahan padat maupun cair
dengan bantuan pelarut. Pelarut yang digunakan dalam penelitian ini adalah air.
Pelarut air adalah pelarut yang biasa digunakan dalam kehidupan sehari-hari dan
insdustri pangan. Selain itu, penggunaan pelarut air diharapkan mampu mengekstrak
zat aktif yang bersifat polar. Dalam Naufalin (2005), ekstrak heksana (nonpolar)
bunga kecombrang tidak menunjukkan aktifitas antibakteri, sedangkan ekstrak etanol
(polar) bunga kecombrang mampu menghambat aktifitas antibakteri terhadap
Staphylococcus aureus, Listeria monocytogenes, Bacillus cereus, Salmonella
Typhimurium, Escherichia coli, Aeromonas hydrophilia, dan Pseudomonas aeruginosa. Walaupun aktifitas antibakteri ekstrak etil asetat (semipolar) menunjukkan aktifitas yang lebih tinggi daripada ekstrak etanol (polar).
Hasil ekstraksi daun kecombrang (Etlingera elatior (Jack) R.M. Smith) secara maserasi dengan menggunakan air menghasilkan 59 ml ekstrak dari 90 gram serbuk
daun kecombrang kering (Gambar 4a) dalam 1500 ml pelarut air. Hasil ekstrak
berwarna kecoklatan dan penampakan cairan agak kental (Gambar 4b) dengan
35
(a) (b)
Gambar 4. Ekstraksi Daun Kecombrang (a) Serbuk daun kecombrang, (b) Hasil
ekstrak daun kecombrang
4.2. Uji BSLT (Brine Shrimp Lethality Test)
Uji BSLT adalah uji pendahuluan yang dilakukan untuk mengetahui adanya
suatu senyawa aktif didalam ekstrak, yang ditandai dengan matinya hewan uji yaitu
Artemia salina. Senyawa bioaktif kebanyakan bersifat toksik pada dosis tinggi. Jadi, pengujian dengan organisme yang sederhana secara zoologis dapat digunakan secara
monitor yang meyakinkan untuk skrining dan fraksinasi dalam penemuan senyawa
bioaktif baru (Baraja, 2008). Senyawa-senyawa tersebut kemungkinan merupakan
senyawa bioaktif yang dapatsdigunakan dalam dunia kedokteran misalnya sebagai
antikanker (Khurniasari, 2004).
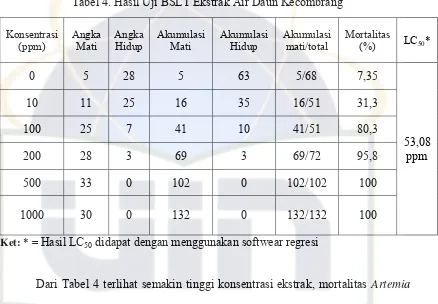
Pada Tabel 4 menunjukkan persentasi mortalitas Artemia salina sebesar 7,35% sampai 100%. Pada konsentrasi 0 ppm persentasi kematiannya sebesar 7,35%,
ppm persentasi kematiannya 100% dan 1000 ppm persentasi kematiannya sebesar
100%. Selanjutnya data tersebut dimasukkan ke dalam softwear regresi hasilnya nilai
LC50Artemia salina terhadap ekstrak air daun kecombrang adalah 53,08 ppm. Tabel 4. Hasil Uji BSLT Ekstrak Air Daun Kecombrang
Ket: * = Hasil LC50 didapat dengan menggunakan softwear regresi
Konsentrasi
Dari Tabel 4 terlihat semakin tinggi konsentrasi ekstrak, mortalitas Artemia salina juga semakin besar. Hal ini sesuai dengan Harborne (1994) yang menyebutkan bahwa semakin tinggi konsentrasi ekstrak maka sifat toksiknya akan
semakin tinggi, sehingga semakin tinggi kematian Artemia salina. Adanya larva uji dalam kontrol yang mati disebabkan karena kematian yang alami. Menurut
Nurhayati et al. (2006) Artemia yang mati pada kontrol mengalami penurunan aktivitas. Hal ini dapat dilihat dari perlakuan artemia sesaat sebelum mati. Semakin
35
Sedangkan Artemia yang mati dalam tabung percobaan karena perlakuan, mengalami disorentasi gerak (gerakaannya tidak teratur). Artemia dalam tabung ini tetap aktif bergerak, akan tetapi tetap berputar-putar dalam satu titik.
Menurut Meyer (1982 dalam Juniarti et al. 2009), suatu zat dikatakan aktif atau toksik bila nilai LC50 < 1000 ppm untuk ekstrak dan < 30 ppm untuk suatu senyawa. Nilai LC50 merupakan angka yang menunjukan konsentrasi ekstrak yang
dapat menyebabkan kematian sebesar 50% dari jumlah hewan uji. Berdasarkan uji
bioaktivitas didapatkan hasil nilai LC50 adalah 53,08 ppm, sehingga ekstrak air daun kecombrang dikatakan aktif atau memiliki senyawa aktif. Senyawa aktif ini dapat
berupa antimikroba (antibakteri dan antikapang), antioksidan dan antikanker.
Sifat aktif dari daun kecombrang disebabkan oleh kandungan senyawa yang
ada di dalamnya. Dari hasil analisa GCMS diketahui ekstrak air daun kecombrang
dengan pelarut etanol mengandung 62 komponen senyawa (Lampiran 14). Dalam
Hidayat dan Hutapea (1991), daun kecombrang mengandung saponin dan flavonoida
Sedangkan berdasarkan hasil GCMS, minyak atsiri daun kecombrang memiliki 62
komponen kimia, yang terbanyak adalah 3-carene (28,167%) dan ß-pinen
(20,937%), keduanya merupakan golongan monoterpena yang mempunyai aktivitas
antimikroba (Widiatmojo, 2009). Dalam Jaffar et al. (2007) minyak esensial daun
4.3. Uji Antioksidan
Antioksidan adalah bahan yang dalam kadar rendah dapat mencegah
terjadinya oksidasi dari substrat yang mudah teroksidasi. Metode uji antioksidan
dengan DPPH (1,1-difenil-2-pikrilhidrazil) dipilih karena metode ini adalah metode
sederhana untuk evaluasi aktivitas antioksidan dari senyawa bahan alam (Fagliano
1999). DPPH adalah suatu radikal stabil yang mengandung nitrogen organik,
berwarna ungu gelap dengan absorbansi yang kuat pada panjang gelombang maks
517 nm. Setelah bereaksi dengan antioksidan warna larutan akan berkurang dan
berubah menjadi kuning. Perubahan warna ini dapat diukur secara spektrofotometri
(Reynertson, 2007). Peredaman tersebut dihasilkan oleh bereaksinya molekul Difenil
Pikril Hidrazil dengan atom hidrogen yang dilepaskan satu molekul komponen
sampel sehingga terbentuk senyawa Difenil Pikril Hidrazin (Gambar 5).
O2N
DPPH (1,1-difenil-2-pikrilhidrazil) + Antioksidan → 1,1-Difenil-2-picrilhidrazin + Antioksidan
Gambar 5. Reaksi DPPH DenganAntioksidan
Untuk mengetahui banyaknya senyawa antioksidan dalam ekstrak daun
35
Pembuatan kurva standar dilakukan dengan menggunakan BHA (butil
hidroksianisol). Dalam Widianti (2010), BHA adalah antioksidan sintesis yang biasa
digunakan untuk lemak dan minyak makanan. BHA digunakan sebagai pembanding
pada antioksidan pada ekstrak air daun kecombrang. Hasil kurva standar dapat
dilihat pada Gambar 6.
Gambar 6. Kurva standar BHA (butil hidroksianisol)
Kurva standar juga menunjukkan bahwa terdapat hubungan yang erat antara
konsentrasi dengan persentasi inhibisi. Hal ini diperlihatkan dengan nilai r (koefisien
korelasi). Nilai r yang mendekati 1 membuktikan bahwa persamaan regresi tersebut
adalah linier dan simpangan baku yang kecil menunjukkan ketepatan yang cukup
tinggi. Nilai koefisien korelasi menyatakan bahwa terdapat korelasi antara
konsentrasi sampel dengan persentase inhibisi sebesar 0,96. Hal ini menunjukkan
bahwa lebih dari 96% keakuratan data dipengaruhi oleh konsentrasi bahan,
Tabel 5. Hasil pengujian aktifitas antioksidan ekstrak air daun kecombrang
Ket: * = Hasil LC50 didapat dengan menggunakan softwear regresi
Hasil pengujian aktifitas antioksidan ekstrak air daun kecombrang dapat
dilihat pada Tabel 5. Hasil pengujian menunjukkan bahwa semakin tinggi
konsentrasi pelarut, maka semakin tinggi persentase inhibisinya, hal ini disebabkan
pada sampel yang semakin banyak, maka semakin tinggi kandungan antioksidannya
sehingga berdampak juga pada tingkat penghambatan radikal bebas yang dilakukan
oleh zat antioksidan tersebut.
Dalam Mardawati et al. (2008), secara spesifik suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai IC50 kurang dari 50, kuat untuk IC50
bernilai 50-100, sedang jika IC50 bernilai 100-150, dan lemah jika IC50 adalah 151-200. IC50 adalah bilangan yang menunjukkan konsentrasi ekstrak (mikrogram/mililiter) yang mampu menghambat proses oksidasi sebesar 50 %.
35
Dalam Rohman dan Riyanto (2005), ekstrak etanol daun kemuning diuji daya
antioksidannya dengan metode DPPH dan hasilnya menunjukkan bahwa ekstrak
etanol daun kemuning mempunyai nilai IC50 sebesar 126,17 μg/ml, 15 kali lebih lemah dibanding dengan vitamin E (IC50 vitamin E = 8,27 μg/ml). Zuhra et al. (2008) menuliskan senyawa flavonoid dari daun katuk (Sauropus androginus (L) Merr.) memiliki nilai IC50 sebesar 80,81 μg/ml. Dalam Andayani et al. (2008), nilai IC50 dari ekstrak metanol buah tomat adalah 44,06 µg/ml. Hanani (2005) meneliti nilai
IC50 dari vitamin C dan BHT (butil hidroksitoluen) yaitu 3,45 µg/ml dan 3,81 µg/ml. Dengan membandingkan nilai IC50, maka diketahui ekstrak air daun kecombrang
memiliki kemampuan antioksidan lebih rendah dibandingkan dengan vitamin E,
vitamin C dan BHT (butil hidroksitoluen) namun lebih tinggi dibanding dengan
ekstrak etanol daun kemuning, daun katuk (Sauropus androginus (L) Merr.) dan ekstrak metanol buah tomat.
4.4. Uji Antibakteri
4.4.1. Uji Antibakteri menggunakan metode difusi cakram
Metode difusi cakram adalah uji antibakteri yang dilakukan sebagai uji
pendahuluan untuk menyeleksi adanya aktivitas antibakteri dari daun kecombrang