UJI AKTIVITAS ANTIBAKTERI (+) - KATEKIN DAN GAMBIR (Uncaria gambier Roxb.) TERHADAP BEBERAPA JENIS BAKTERI GRAM
NEGATIF DAN MEKANISMENYA
Skripsi
Diajukan sebagai salah satu syarat untuk Memperoleh gelar Sarjan Farmasi (S, Far)
OLEH :
NIM : 106102003416
MUSTIKANING AYU HAPSARI PUTRI
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
ii
Skripsi dengan judul
UJI AKTIVITAS ANTIBAKTERI (+)- KATEKIN DAN GAMBIR (Uncaria gambier Roxb.) TERHADAP BEBERAPA JENIS BAKTERI GRAM
NEGATIF DAN MEKANISMENYA
Telah disetujui, diperiksa dan dipertahakan dihadapan tim penguji oleh
Mustikaning Ayu Hapsari Putri NIM: 106102003416
Menyetujui,
Pembimbing:
1. Pembimbing I Dr. Andria Agusta ...
2. Pembimbing II Drs. M. Yanis Musdja, M.Sc, Apt. ...
Penguji:
1. Ketua Penguji Drs. M. Yanis Musdja, M.Sc, Apt. ...
2. Anggota Penguji I Azrifitria, M.Si, Apt. ...
3. Anggota Penguji II Zilhadia, M.Si, Apt. ...
4. Anggota Peguji III Sabrina, M.Si, Apt. ...
Mengetahui,
Dekan Fakultas Kedokteran Dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta
Prof. DR. (hc). dr. M.K. Tadjudin, Sp. And
iii
LEMBAR PERNYATAAN Dengan ini saya menyatakan bahwa skripsi yang berjudul :
UJI AKTIVITAS ANTIBAKTERI (+)- KATEKIN DAN GAMBIR (Uncaria
gambier Roxb.) TERHADAP BEBERAPA JENIS BAKTERI GRAM
NEGATIF DAN MEKANISMENYA
Adalah karya saya sendiri dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi atau lembaga pendidikan manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka.
Jakarta, Agustus 2010
Mustikaning Ayu Hapsari Putri
iv
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi dengan judul “Uji Aktivitas antibakteri (+)- katekin dan gambir (Uncaria gambier Roxb.) terhadap beberapa jenis bakteri gram negatif dan mekanismenya”. Skripsi ini disusun sebagai salah satu syarat untuk menyelesaikan program pendidikan tingkat sarjana Strata 1 (S1) pada program studi Farmasi, Fakultas kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Pada kesempatan ini, penulis menyampaikan rasa terima kasih yang mendalam kepada :
1. Bapak Dr. Andria Agusta dan Bapak Drs. M. Yanis Musdja, M.Sc, Apt selaku dosen pembimbing yang telah memberikan arahan, bimbingan, motivasi, nasehat dan perhatian selama penelitian dan penyusunan skripsi ini.
2. Bapak Prof. Dr (hc). Dr, M. K Tadjudin, Sp. And, selaku dekan Fakultas Kedokteran dan Ilmu Kesehatan yang telah memberikan kesempatan kepada penulis untuk melakukan penelitian.
3. Bapak Drs. M. Yanis Musdja, M.Sc, Apt sebagai Ketua program Studi Farmasi serta staf karyawan prodi Farmasi UIN yang telah memberikan kesempatan kepada penulis untuk menyelesaikan penelitian dan penyusunan skripsi ini.
4. Dosen-dosen UIN yang telah sabar mendidik dan membantu penulis sejak awal sampai penulisan skripsi ini.
5. Bapak Dr. Eko Baroto Walujo, APU sebagai kepala bidang botani, LIPI Cibinong yang telah membantu memberikan izin untuk melakukan penelitian di Laboratorium Fitokimia, Puslit Biologi, LIPI Cibinong.
v
7. Kakak Ahmad Fathoni dan Kakak Andi Saptaji Kamal dari Laboratorium Fitokimia, Bidang Botani, LIPI Cibinong yang telah membantu penulis dalam mengarahkan serta menuntun untuk melakukan penelitian.
8. Ayahanda, Teguh Sugiarto, SE dan Ibunda, Indriani widyastuti yang selalu memberikan doa, semangat, dukungan, perhatian dan kasih sayang selama penulis menyelesaikan skripsi ini.
9. Sahabat tersayang Ayu Nuki Wahyuni, teman seperjuangan Fika Fauziah dan Nuryatni, Nurul gustiari, Erni, Febriyati, Nurul Farihah, Ulfah Sadiah dan Lidya Pratiwi yang telah membantu dan menemani di Laboratorium untuk menyelesaikan penelitian.
10.Teman-teman Farmasi UIN angkatan 2006, terutama Indira Irma Anggraeni, Silma Awalia, Via Rifkia dan Nadya Kristina yang telah memberikan semangat kepada penulis sehingga dapat menyelesaikan skripsi ini.
Untuk menyempurnakan skripsi ini, penulis menerima segala saran dan kritik yang membangun. Semoga penelitian ini dapat bermanfaat bagi ilmu pengetahuan dan kesehatan masyarakat.
Jakarta, Agustus 2010
Penulis
vi ABSTRAK
UJI AKTIVITAS ANTIBAKTERI (+)- KATEKIN DAN GAMBIR (Uncaria gambier Roxb.) TERHADAP BEBERAPA JENIS BAKTERI GRAM NEGATIF DAN MEKANISMENYA
(+)- Katekin dan ekstrak air gambir (Uncaria gambier Roxb.) dilaporkan mempunyai aktivitas antibakteri. Penelitian ini ditunjukkan untuk mengetahui lebih lanjut uji aktivitas antibakteri (+)- katekin dan ekstrak air gambir terhadap Shigella flexneri, Pseudomonas aeruginosa, Eschericia coli, Proteus vulgaris dan Proteus mirabilis.. Pengujian yang dilakukan meliputi pengujian sensitivitas terhadap bakteri uji gram negatif untuk memastikan aktivitas antibakteri (+)- katekin dan ekstrak air gambir, penentuan Konsentrasi Hambat Minimum (KHM) dan analisis mekanisme penghambatannya terhadap bakteri uji gram negatif. Hasil penelitian ini menunjukkan bahwa (+)- katekin memiliki nilai KHM terhadap bakteri Shigella flexneri sebesar 7,5 mg/ml. dan mekanisme kerja (+)- katekin adalah dengan merusak membran sel, sehingga terjadi kebocoran komponen sel. Hal ini ditunjukkan oleh terdeteksinya ion Ca2+ dan ion K+ serta protein dan asam nukleat pada media sel bakteri. Sedangkan ekstrak air gambir tidak memperlihatkan aktivitas penghambatan sampai konsentrasi 25 mg/ml pada metode makrodilusi.
vii ABSTRACT
TESTING (+)- CATECHIN AND GAMBIR (Uncaria gambier Roxb.) ANTIBACTERIA ACTIVITIES TO SOME NEGATIVE BACTERIA AND THEIR MECHANISM OF INHIBITION.
(+)- Catechin and gambir water extract (Uncaria gambier Roxb.) have been reported to have antibacterial activity. The aim of this research is to evaluate antibacterial activity of (+)- catechin and gambir water extract againts some Gram negative bacteria. The experiments composed of sensitivity testing of (+)- catechin and gambir extract to Gram negative bacteria, Minimum Inhibitor Concentration (MIC), and the analysis of inhibition mechanism to Gram negative bacteria tested. The result of this research showed that MIC value of (+)- catechin against S. flexneri was 7,5 mg/ml and its inhibition mechanism was by destruction of cell membrane. It was indicated by increasing K+ ion, Ca2+ ion, protein and nucleic acid content in the medium compared to negative control treatment. While gambir water extract didn’t have inhibition activity up to 25 mg/ml of extract concentratation by macrodillution method.
viii
BAB I PENDAHULUAN 1.1 Latar Belakang ...1
1.2 Perumusan Masalah ...4
1.3 Hipotesis ...5
1.4 Tujuan Penelitian...5
1.5 Manfaat Penelitian ...5
BAB II TINJAUAN PUSTAKA 2.1 Tanaman Gambir ...6
2.1.1 Taksonomi...7
2.1.2 Morfologi ...8
2.1.3 Asal dan Tempat Tumbuh...8
2.1.4 Kandungan...9
2.1.4.1 (+)- Katekin...9
2.1.5 Khasiat dan Kegunaan...11
ix
2.3 Bakteri...13
2.4 Antimikroba...13
2.4.1 Definisi...13
2.4.2 Mekanisme Kerja………...14
2.4.3 Uji Antimikroba...17
2.5 Bakteri Uji...20
2.6 Metode Ekstraksi...22
BAB III KERANGKA KONSEP...25
BAB IV METODOLOGI PENELITIAN 4.1 Waktu dan Tempat Penelitian ...26
4.2 Prinsip Penelitian...26
4.3 Bahan...27
4.4 Mikroba Uji...27
4.5 Metode Penelitian...28
4.5.1 Penyiapan Bahan, Media dan Alat...28
4.5.2 Penentuan Diameter Hambat...33
4.5.3 Penentuan Konsentrasi Hambat Minimum...33
4.5.4 Pengujian Kebocoran Metabolit Seluler...34
4.5.5 Pengujian Kebocoran Ion-ion Logam...35
4.5.6 Pengujian Morfologi Sel dengan SEM...35
BAB V HASIL DAN PEMBAHASAN 5.1 Hasil Penelitian...37
x BAB VI KESIMPULAN DAN SARAN
6.1 Kesimpulan ...48
6.2 Saran ...48
DAFTAR PUSTAKA ...49
xi
DAFTAR GAMBAR
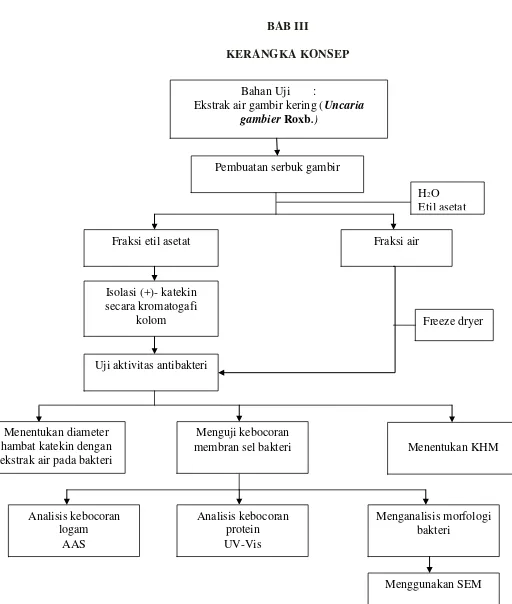
Halaman Gambar 1. Diagram alir tahapan penelitian 25
Gambar 2. Ekstrak gambir kering 37
Gambar 3. Foto KLT Fraksi Kromatografi Kolom 37
Gambar 4. Foto KLT Fraksi Gabungan Kromatografi Kolom 38
Gambar 5. Grafik pengukuran senyawa metabolit seluler 40 Gambar 6. Grafik ion-ion logam terhadap bakteri S. Flexneri 40
xii
DAFTAR LAMPIRAN
Halaman Lampiran 1. Skema pembuatan ekstrak gambir 52 Lampiran 2. Skema isolasi katekin dari gambir 53
Lampiran 3. Skema pembuatan suspensi bakteri. 54 Lampiran 4. Skema penentuan diameter hambat bakteri. 55
Lampiran 5. Skema penentuan KHM 56 Lampiran 6. Skema analisis kebocoran dinding/membran sel bakteri. 57
Lampiran 7. Skema pengamatan morfologi sel bakteri. 58 Lampiran 8. Perhitungan Konsentrasi Hambat Minimum. 59 Lampiran 9. Diameter hambat ekstrak gambir dan (+)- katekin terhadap 61
S. flexneri pada konsentrasi 7 mg/ml. Lampiran 10. Pertumbuhan bakteri S. flexneri dengan metode 63
makrodilusi. Lampiran 11. Data Hasil AAS (Ca2+ dan K+) 68
Lampiran 12. Alat-alat yang digunakan 70
xiii
DAFTAR TABEL
Halaman Tabel 1. Pengukuran diameter hambat ekstrak terhadap 38
5 bakteri gram negatif pada konsentrasi 7 mg/ml
1 BAB I
PENDAHULUAN
1.1. Latar Belakang
Tumbuhan merupakan gudang berbagai jenis senyawa kimia, mulai dari struktur dan sifat yang sederhana sampai yang rumit dan unik. Beragam jenis dan senyawa kimia yang terkandung dalam tumbuhan akan berkorelasi positif dengan khasiat dan manfaat yang dimilikinya. Upaya pencarian tumbuhan obat telah lama dilakukan, baik untuk mencari senyawa baru ataupun menambah keanekaragaman senyawa yang telah ada (Djauhariya dan Hernani, 2004).
Beberapa tahun belakangan ini telah banyak dilakukan penelitian untuk menemukan antioksidan dan antibakteri alami yang bersumber dari tanaman, khususnya tanaman asli Indonesia. Berdasarkan penelitian yang telah dilakukan pada sejumlah ekstrak tanaman yang biasa digunakan sebagai bumbu dan obat tradisional, beberapa diantaranya berpotensi sebagai sumber antioksidan. Salah satu tanaman yang diteliti adalah tumbuhan gambir (Uncaria gambier Roxb.) yang memang sejak lama digunakan masyarakat tradisional sebagai antiseptik dan obat sakit perut. Serta sebagai salah satu campuran makan sirih. Sampai saat ini belum banyak penelitian yang mengupas tentang aktivitas antibakteri yang dimiliki oleh daun gambir (Kresnawaty et al.,2009)
2
setelah Brazil dan Zaire. Di hutan tropika Indonesia tumbuh sekitar 30.000 spesies tumbuhan berbunga dan diperkirakan sekitar 3.689 spesies diantaranya merupakan tumbuhan obat. Dari sejumlah tanaman obat tersebut baru sebanyak 283 spesies tumbuhan obat yang sudah digunakan dalam industri obat tradisional (Djauhariya dan Hernani, 2004).
Kebutuhan bahan baku obat tradisional terutama yang berasal dari tumbuhan, sebagian besar masih diambil dari alam, sehingga beberapa jenis mulai langka. Sebagian besar tumbuhan bermanfaat untuk pengobatan berbagai jenis penyakit, diantaranya penyakit alergi, penyakit metabolik, dan penyakit degeneratif yang berkaitan dengan penuaan (Djauhariya dan Hernani, 2004). Spesies Uncaria gambier Roxb. merupakan salah satu tanaman tahunan penghasil getah penting yang banyak digunakan untuk keperluan industri maupun farmasi. Peranan spesies ini dari waktu ke waktu dirasakan semakin penting, namun upaya-upaya perbaikan potensi genetik tanaman tersebut sejauh ini belum mendapat perhatian yang serius (Jamsari et al.,2007). Gambir berkhasiat sebagai astringen. Dan gambir juga bermanfaat untuk mengobati disentri, luka bakar (obat luar), luka (obat luar), sariawan mulut (obat kumur), dan suara parau (obat kumur) (Utami et al., 2008).
3
melegakan kerongkongan bagi perokok di Jepang karena gambir mampu menetralisir nikotin. Sedangkan di Singapura gambir digunakan sebagai bahan baku obat sakit perut dan sakit gigi (Dhalimi, 2006).
Daun dan ranting merupakan bagian tanaman gambir yang memiliki nilai ekonomi. Senyawa-senyawa yang terkandung pada ekstrak atau getah daun dan ranting tanaman gambir memiliki potensi pemanfaatan yang beragam. Ekstrak atau getah daun dan ranting yang telah dikeringkan merupakan produk yang dikenal sebagai gambir, sedangkan dalam perdagangan dunia dikenal sebagai
gambier, cutch, catechu atau pale catechu. Senyawa utama yang terkandung di dalam gambir adalah pseudotanin katekin dan phlobatanin asam katekutanat dengan persentase masing-masing senyawa adalah 7-30% dan 22-55%. Adanya perbedaan kadar katekin pada gambir dipengaruhi oleh kondisi daun yang diekstrak (Utami et al., 2008).
4
menjadi sediaan obat. Pemanfaatan katekin untuk mencegah terjadinya plak gigi dengan cara pemberian obat kumur yang bisa diminum untuk memperoleh aktivitas antioksidan katekin (Lucida et al., 2007).
Gambir merupakan produk dari tanaman gambir (Uncaria gambier Roxb.) yang mengandung senyawa fungsional yang termasuk dalam golongan senyawa polifenol. Gambir komersial diperoleh dengan pengolahan daun gambir dengan metoda perebusan, pengepresan dan pengeringan padatan. Dalam perdagangan salah satu komponen mutu gambir ditentukan berdasarkan pada kandungan katekinnya. Ekstraksi suatu bahan pada prinsipnya dipengaruhi oleh suhu. Makin tinggi suhu yang digunakan, makin tinggi ekstrak yang diperoleh. Namun demikian, bahan hasil ekstrak dengan berbagai tingkat suhu belum tentu memberikan pengaruh yang berbeda terhadap sifat antibakterinya (Pembayun et al., 2007).
1.2 Perumusan Masalah
Pada penelitian ini yang menjadi perumusan masalah adalah :
1. Apakah (+)- katekin dan ekstrak air gambir (Uncaria gambier Roxb.) memiliki aktivitas antibakteri terhadap beberapa jenis bakteri gram negatif ? 2. Bagaimana mekanisme penghambatan pertumbuhan beberapa jenis
5
1.3 Tujuan Penelitian
1. Mengetahui aktivitas antibakteri (+)- katekin dan ekstrak air gambir terhadap beberapa jenis bakteri gram negatif.
2. Mengetahui mekanisme penghambatan pertumbuhan beberapa jenis bakteri gram negatif terhadap (+)- katekin dan ekstrak air gambir.
1.4. Hipotesis
1. (+)- katekin dan ekstrak air gambir mempunyai aktivitas antibakteri terhadap bakteri gram negatif.
2. Mekanisme penghambatan bakteri gram negatif terhadap (+)- katekin dan ekstrak air gambir melalui perusakan membran sel.
1.5. Manfaat Penelitian
1. Untuk mendapatkan gambaran mengenai aktivitas antibakteri (+)- katekin dalam pengembangan dan pemanfaatan obat tradisional.
6 BAB II
TINJAUAN PUSTAKA
2.1 Tanaman Gambir (Uncaria gambier Roxb.)
Uncaria gambier Roxb. termasuk dalam familia Rubiaceae. Ciri-ciri umum dari familia Rubiaceae adalah sebagai berikut : merupakan tanaman perdu dengan tinggi 1-3 cm. Umumnya tumbuh memanjat pada pohon atau semak yang ada di sekitarnya dengan bantuan alat pengait. Batang tegak, berkayu, bulat, percabangan simplodial dan berwarna cokelat pucat. Daun tunggal berbentuk lonjong. Letak berhadapan, tepi bergerigi, pangkal bulat, ujung meruncing, panjang 8-13 cm, lebar 4-7 cm, dan berwarna hijau. Bunga majemuk berbentuk lonceng, muncul di ketiak daun, panjang 5 cm. Mahkota bunga berjumlah 5 helai, berbentuk lonjong dan berwarna ungu. Buah berbentuk bulat telur, panjang sekitar 1,5 cm dan berwarna hitam (Utami et al., 2008).
Sedangkan tangkai dari daun tidak berambut, panjang 0,5-0,8 cm, pertulangan primer pada permukaan daun sebelah bawah menonjol. Lobus dari mahkota krem keputihan, daun pelindung tidak berambut, langset. Buah kapsul, sempit dan panjang, terbagi menjadi 2 belahan. Biji banyak, kecil, halus, berbentuk jarum dan bersayap, panjang 0,4 cm, dan berwarna kuning (BPOM RI, 2007).
7
permukaan yang baru dipatahkan cokelat muda sampai cokelat kekuningan, kadang-kadang terihat garis-garis yang lebih gelap (BPOM RI, 2007). Nama Simplisianya adalah Terra Japonica, Gele catechu, Gambir (Dalimarta., 2003)
2.1.1 Taksonomi
Taksonomi dari gambir (Uncaria gambier Roxb.) menurut (Haryanto., 2009). a. Klasifikasi
Kerajaan/Kingdom : Plantarum Divisio : Spermatophyta Sub diviso : Angiospermae Kelas/Class : Dicotyledonae Bangsa/Ordo : Rubiales Suku/Family : Rubiaceae Marga/Genus : Uncaria
Jenis/Species : Uncaria gambier Roxb. Sinonim : Ourouparia gambir Roxb
Nauclea gambir
b. Nama daerah
8
gambiri, gata, gaber. Maluku : kampir, kambir, ngambir, gaamer, gabi, tagabere, gagabere, gabere, gambe (Sirait et al.,1989).
2.1.2 Morfologi
Berasal dari Sumatera dan Kalimantan. Merupakan tanaman perdu dengan tinggi 1-3 cm. umumnya tumbuh memanjat pada pohon atau semak yang ada di sekitarnya dengan bantuan alat pengait. Batang tegak, berkayu, bulat, percabangan simplodial dan berwarna cokelat pucat. Daun tunggal berbentuk lonjong, letak berhadapan, tepi bergerigi, pangkal bulat, ujung meruncing, panjang 8-13 cm, lebar 4-7 cm, dan berwarna hijau. Bunga majemuk berbentuk lonceng, muncul di ketiak daun, panjang 5 cm. Mahkota bunga berjumlah 5 helai, berbentuk lonjong dan berwarna ungu. Buah berbentuk bulat telur, panjang sekitar 1,5 cm dan berwarna hitam (Utami et al., 2008).
2.1.3 Asal dan Tempat Tumbuh
Tanaman gambir ini merupakan tanaman perdu yang berasal dari daerah Sumatera dan Kalimantan. Tumbuhan ini tumbuh liar di hutan dan di tempat-tempat lain yang tingginya 200-900 m dari permukaan laut, tanahnya agak miring dan cukup mendapat sinar matahari. Di daerah Sumatera dan Kalimantan, tanaman gambir ini umunya ditanam orang di kebun-kebun (Mardisiswodjo et al.,
1968).
9
2.1.4 Kandungan
Kandungan Kimia
Kandungan kimia dari gambir (Uncaria gambir Roxb.) adalah katekin, kuersetin, tannin, lendir, lemak, dan malam. Gambir memiliki sifat khas pahit dan kelat (Utami et al., 2008).
Kandungan katekin ini digunakan sebagai salah satu parameter mutu gambir. Selain katekin terdapat juga proantosianidin yaitu : gambiriin A1, gambiriin A2, gambiriin A3, gambiriin B1, gambiriin B2, gambiriin B3, dan gambiriin C. kandungan lainnya adalah epikatekin, epigallo-katekin, asam tanat dan alkaloida. Adanya alkaloida ini dapat membedakan produk gambir ‘pale catechu’ dari Uncaria gambier dengan ‘black catechu’ yang diproduksi Acacia catechu. Beberapa alkaloida dari gambir yang dikenal sebagai ‘gambir fluoresen’ diantaranya adalah dihidrogambirtanin, gambirdin, gambirtanin, gambirin, isogambirin, auroparin, dan oksogambirtanin. Namun kandungan utama gambir adalah katekin. (BPOM RI, 2007).
2.1.4.1(+)- Katekin
Katekin termasuk senyawa polifenol dari kelompok flavonoid. Flavonoid biasanya banyak ditemukan pada buah-buahan, daun teh, sayuran dan juga pada
10
kepada kandungan katekinnya. Katekin adalah bagian dari flavan-3-ol yang termasuk (+)- katekin (1), (-)- katekin (2).
O
Katekin juga memiliki banyak aktivitas biologi yang penting, seperti aktivitas antitumor dan antioksidan. Flavan-3-ol, seperti epikatekin dan katekin menunjukkan klas utama dari metabolit sekunder polifenol pada tanaman. Telah ditentukan bahwa konfigurasi dan struktur dari (+)- katekin adalah (2R,3S )-3′,4′,5,7-tetrahydroksiflavan-3-ol (Wilhelm, 2008).
Uji Organoleptik gambir
• Penampakan Fisik : cairan kental (viscous liquid)
• Rasa : mula-mula pahit dan sangat kelat,
lalu agak manis.
• Aroma : lemah
Makroskopik
11
mudah patah dan berliang renik-renik, warna permukaan luar cokelat muda sampai cokelat kekuningan, kadang-kadang terlihat garis-garis yang lebih gelap (Sirait et al., 1989). Mula-mula terasa pahit, namun lama-kelamaan terasa manis dan tidak berbau (Evans, 2002).
Mikroskopik
Dilihat dalam kloralhidrat terlihat adanya pollen, sel batu besar, dinding agak tipis, lumen besar, atau kadang-kadang kecil memanjang, lumen sempit. Sel parenkim besar, dinding tipis. Hablur kalsium oksalat bentuk jarum dan bentuk prisma. Rambut penutup terdiri dari satu sel ujung runcing (Sirait et al., 1989).
Efek farmakologi
Ekstrak gambir mampu mengatasi diare karena sifat astringen dari tanin yang merupakan kandungan utama dari gambir. Selain itu gambir juga efektif dalam menghambat pertumbuhan bakteri dan alga (BPOM RI, 2007).
2.1.5 Khasiat dan Kegunaan
Gambir berkhasiat sebagai astringen. Dan gambir juga bermanfaat untuk mengobati disentri, luka bakar (obat luar), luka (obat luar), sariawan mulut (obat kumur), dan suara parau (obat kumur) (Utami et al., 2008). Uncaria gambier
12
bersifat antimikroba dan antioksidan. Di samping itu, (+)- katekin, tanin dan kuersetin juga bersifat toksik terhadap serangga, selain itu senyawa kuersetin dan tanin juga mampu berperan sebagai nematisidal (Idris., 2007).
2.2 Ekstraksi
Ekstrak bahan alam adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang ditetapkan. Sebagian besar ekstrak dibuat dengan mengekstraksi bahan baku secara perkolasi. Seluruh perkolat dipekatkan dengan mengguakan destilasi dengan pengurangan tekanan, agar kandungan utama obat sesedikit mungkin terkena panas. Ekstrak cair adalah sediaan cair simplisia nabati, yang mengandung ethanol sebagai pelarut dan pengawet (Soesilo., 1995).
Penyarian adalah proses penarikan zat pokok yang diinginkan dari bahan alam dengan menggunakan pelarut yang dipilih di mana zat yang diinginkan larut. Pemilihan pelarut yang akan digunakan dalam bahan alam tertentu berdasarkan pada daya larut zat aktif dan zat tidak aktif serta zat yang tidak diinginkan tergantung pada preparat yang diperlukan.
Proses penyarian dapat dipisahkan menjadi : 1. Pembuatan serbuk.
Umumnya penyarian akan bertambah baik bila permukaan serbuk simplisia semakin luas demikian penyarian akan lebih baik.
13
Pembasahan serbuk sebelum dilakukan penyarian dimaksudkan untuk memberikan kesempatan pada cairan penyarian untuk memasuki pori-pori dalam simplisia sehingga mempermudah penyarian selanjutnya.
3. Penyarian.
Cara penyarian dapat dibedakan menjadi infundasi, maserasi, perkolasi, dan destilasi uap. Dari keempat cara tersebut sering dilakukan modifikasi untuk memperoleh hasil yang lebih baik.
4. Pemekatan.
Pemekatan dilakukan dengan maksud untuk menghilangkan pelarut atau membuat ekstrak kering.
2.3 Bakteri
Bakteri termasuk termasuk kedalam golongan prokariota, yang strukturnya lebih sederhana dari eukariota, kecuali bahwa struktur dinding sel prokariota lebih komplek dari eukariota. Morfologi bakteri dibagi dalam 3 bentuk utama, yaitu kokus, batang/basil dan spiral. Bakteri dibagi atas bakteri yang positif Gram dan negatif Gram tergantung pada responnya bila diwarnai dengan pewarnaan menurut GRAM. Sel bakteri mula-mula diwarnai dengan zat warna kristal ungu dan iodium, lalu dicuci dengan alkohol atau aseton. Bakteri negatif Gram akan kehilangan zat warna ungunya setah dicuci dengan alkohol, sedangkan bakteri positif Gram tetap mempertahankan warna ungu meskipun telah dicuci dengan alkohol (Assani., 1993).
14
2.4 Antimikroba
2.4.1 Definisi
Antimikroba adalah suatu jenis obat yang digunakan untuk membasmi mikroba, khususnya untuk jenis mikroba yang merugikan manusia (patogen). Pada penelitian ini, mikroba yang digunakan terbatas pada beberapa spesies bakteri. Zat yang berfungsi sebagai antimikroba dapat berasal dari senyawa alami, sintetis, atau semisintetis yan pada dasarnya digunakan untuk mematikan mikroba secara langsung atau dengan menghambat pertumbuhannya (Setiabudy et al., 1995)
Berdasarkan sifat toksisitas selektif, aktivitas zat antibakteri dapat dikategorikan menjadi :
a. Bakteriostatik, yaitu antibakteri yang mempunyai kemampuan untuk
menghambat pertumbuhan bakteri sehingga jumlah sel bakteri yang hidup praktis tetap. Tetapi pertumbuhan bakteri akan berlangsung kembali bila kontak dengan obat dihentikan.
b. Bakterisidal, yaitu antibakteri yang mempunyai kemampuan untuk
membunuh bakteri dikarenakan hancurnya dinding bakteri karena lisi. Akibatnya bakteri tidak dapat bereproduksi kembali meskipun kontak dengan obat dihentikan.
2.4.2 Mekanisme Kerja Antimikroba
Setiabudy, R dan Vincent H.S. Gan, bahwa antimikroba mengganggu bagian-bagian yang peka dalam sel.
15
Obat yang termasuk kedalam kelompok ini adalah penisilin, sefalosporin, basitrasin, vankomisin, dan sikloserin. Dinding sel bakteri terdiri atas polipeptidoglikan yaitu suatu kompleks polimer mukopeptida (glikopeptida). Perbedaan struktur sel antara bakteri dan eukariot menguntungkan bagi penggunaan bahan antimikroba.
Salah satu contoh klasik yang memiliki mekanisme antimikroba seperti ini adalah penisilin. Antibiotik ini menyebabkan penghambatan pada pembentukan ikatan sebrang silang. Pada konsentrasi rendah, penisilin menghambat pembentukan ikatan glikosida, sehingga pembentukan dinding sel baru akan terganggu dapat dilihat dari bakteri dengan bentuk sel yang panjang tanpa dinding sekat. Pada konsentrasi tinggi, ikatan sebrang silang terganggu dan pembentukan dinding sel terhenti. Kepekaan bakteri terhadap penisilin tergantung pada kemampuan mikroorganisme menghasilkan enzim beta-laktamase enzim ini dapat merusak daya kerjanya
b. Antimikroba yang mengganggu/merusak membran sel
16
c. Antimikroba yang menghambat sintesis protein
Dalam kelangsungan hidup sel mikroba perlu mensintesis berbagai protein. Di ribosom sentesis protein berlangsung, dengan bantuan mRNA dan tRNA. Pada bakteri terdapat dua sub unit ribosom, yang berdasarkan konstanta seddimentasi dinyatakan sebgai ribosom 30S dan 50S. kedua komponen ini akan bersatu pada pangkal rantai mRNA menjadi ribosom 70S, sehingga dapat berfungsi pada sintesis protein. Penghambatan sintesis protein dapat terjadi dengan berbagai cara. Salah satu contoh, yaitu Streptomisin berikatan dengan komponen ribosom 30S dan menyebabkan kode pada mRNA salah dibaca oleh tRNA pada waktu sintesis protein. Akibatnya, akan terbentuk protein yang abnormal dan nonfungsional bagi sel mikroba
d. Antimikroba yang menghambat sintesis asam nukleat
Antimikroba yang termasuk kedalam golongan ini adalah rifampisin dan golongan kuinolon. Rifampisin merupakan antimikroba yang dapat bekerja dengan cara menghambat sintesis mRNA pada proses transkripsi atau menghambat replikasi DNA pada proses pembelahan sel.
e. Antimikroba yang menghambat metabolisme sel mikroba
17
sehingga pembentukan basa purin dan pirimidin pun juga akan terhambat. Karena hal tersebut, proses pertumbuhan bakteri akan terhenti dan menyebabkan kematian bakteri. Dari mekanisme kerja ini diperoleh efek bakteriostatik.
2.4.3 Uji Antimikroba
Pada uji ini diukur respons pertumbuhan populasi mikroorganisme terhadap agen antimukroba. Kegunaan uji antimikroba adalah diperolehnya suatu sistem pengobatan yang efektif dan efisien (Pratiwi., 2008). Penentuan kepekaan kuman terhadap suatu obat adalah penentuan kadar obat terkecil yang dapat menghambat pertumbuhan kuman in vitro. Beberapa cara penentuan kepekaan kuman terhadap obat-obatan yang lazim digunakan diuraikan menjadi (Bonang, G. & E.S. Koeswondo., 1982) :
a. Metode Difusi
Pada metode ini, penentuan aktivitas didasarkan pada kemampuan difusi dari zat antimikroba dalam lempeng agar yang telah diinokulasi dengan mikroba uji. Pengamatan yang akan diperoleh adalah ada atau tidaknya zona hambatan (daerah bening yang tidak memperlihatkan adanya pertumbuhan bakteri) yang akan terbentuk di sekeliling zat antimikroba pada waktu tertentu masa inkubasi). Pada metode ini dapat dilakukan dengan 3 cara, yaitu :
1) Cara Cakram (disc)
18
pada lempeng agar yang telah diinokulasi dengan mikroba uji, kemudian diinkubasi pada waktu tertentu dan suhu tertentu, sesuai dengan kondisi optimum dari mikroba uji. Biasanya, hasil dibaca setelah inkubasi selama 18-24 jam dengan suhu 37o C. Hasil pengamatan yang akan diperoleh adalah ada atau tidaknya daerah bening yang terbentuk di sekeliling kertas cakram yang menunjukkan zona hambatan pertumbuhan bakteri. Hambatan akan terlihat sebagai daerah yang tidak memperlihatkan adanya pertumbuhan kuman di sekitar cakram. Semakin besar zona hambatan yang ditunjukkan, semakin besar pula kemampuan aktivitas zat antimikroba, dan lebar daerah hambatan ini juga tergantung kepada daya resap obat kedalam agar.
2) Cara Parit (ditch)
Suatu lempeng agar yang telah dinokulasi dengan bakteri uji dibuat sebidang parit. Parit tersebuut diisi dengan zat antimikroba, kemudian diinkubasi pada waktu dan suhu optimum yang sesuai untuk mikroba uji. Hasil pengamatan yang diperoleh adalah ada atau tidaknya zona hambatan yang terbentuk di sekitar parit. Analog dengan cara cakram, besarnya zona hambatan dari zat antimikroba yang diujikan.
3) Cara Lubang (hole/cup)
19
pengamatan dengan melihat ada atau tidaknya zona hambatan di sekeliling lubang atau cawan.
b. Metode Dilusi
Metode ini dilakukan dengan mencampurkan zat antimikroba dan media agar, yang kemudian diinokulasi dengan mikroba uji. Hasil pengamatan yang akan diperoleh adalah tumbuh atau tidaknya mikroba di dalam media. Aktivitas zat antimikroba ditentukan dengan melihat konsentrasi hambat minimum (KHM), yang merupakan konsentrasi terkecil dari zat antimikroba uji yang masih memberikan efek penghambatan terhadap pertumbuhan mikroba uji. Pada metode ini dapat dilakukan melalui dua cara, yaitu :
1) Cara penipisan lempeng agar.
Dengan cara ini, zat antimikroba yang akan diuji aktivitasnya diencerkan sehingga diperoleh suatu larutan stock yang mengandung 100 µg/ml zat uji. Kemudian dari larutan stock tersebut dibuat suatu larutan seri uji dengan metode pengenceran kelipatan dua dalam media agar yang masih cair (suhu 450C - 500C), kemudian dituangkan ke dalam cawan petri. Bakteri uji diinokulasikan setelah campuran media agar dan zat uji membeku dan kering, dan diinkubasi pada kondisi optimum (waktu dan suhu) dari bakteri uji. Aktivitas zat uji ditentukan sebagai konsentrasi hambatan minimum (KHM), yaitu konsentrasi terkecil dari zat antimikroba uji yang masih dapat memberikan efek penghambatan terhadap pertumbuhan mikroba uji.
2) Cara pengenceran tabung.
20
Dibuat suatu seri larutan zat uji dengan konsentrasi tertentu dengan cara pengenceran kelipatan dua dalam media cair, kemudian diinokulasi dengan mikroba uji dan diinkubasikan (waktu dan suhu) sesuai kondisi optimum dari mikroba uji. Aktivitas zat antimikroba ditentukan sebagai konsentrasi hambatan minimum (KHM), yang merupakan pengenceran tertinggi dari seri zat antimikroba uji yang tidak menunjukkan adanya pertumbuhan mikroba.
2.5 Bakteri Uji
Pada penelitian ini digunakan 5 spesies bakteri gram negatif bersifat patogen bagi manusia, yaitu Escherichia coli, Shigella flexneri, Pseudomonas aeruginosa, Proteus vulgaris dan Proteus mirabilis.
Escherecia coli
Karsinah, Lucky H.M et al., 1993, bahwa klasifikasi dari bakteri ini adalah sebagai berikut :
Dunia : Procaryotae Divisio : Bacteria Kelas : Schizomycetes Ordo : Eubacteriales Famili : Enterobacteriaceae Genus : Escherichia
Species : Escherichia coli
Bakteri ini adalah bakteri yang banyak ditemukan di dalam usus besar manusia sebagai flora normal. Sifatnya unik karena dapat menyebabkan infeksi primer pada usus misalnya diare pada anak.
21
dapat tumbuh secara anaerob fakultatif. Nilai pH optimum untuk pertumbuhannya adalah 7,0 – 7,5 serta kisaran suhu pertumbuhannya 100C – 400C dengan suhu optimum 370C. Escherichia coli sangat tidak sensitif terhadap panas.
Pada manusia, Escherichia coli O157:H7, bisa juga menyebabkan radang usus besar. Pada proses pencernaan sedikitnya 10 organisme yang cukup dapat menyebabkan infeksi/peradangan (Campbel, G.R. et al., 2001).
Shigella flexneri
Kuman ini berbentuk batang, ukuran 0,5 – 0,7 µm x 2 – 3 µm. Fisiologi bakteri ini adalah sifat pertumbuhannya aerob dan fakultatif anaerob, pH pertumbuhannya 6,4 – 7,8 suhu pertumbuhan optimum 37o C. Sifat koloni kuman ini adalah halus, kecil, tidak berwarna. Daya tahan kuman ini adalah 2 bulan dalam es. Toleran terhadap suhu rendah dan kelembaban cukup. Kuman akan mati pada suhu 55o C.
Pseudomonas aeruginosa
Kuman ini dapat menyebabkan infeksi pada saluran pernapasan bagian bawah, saluran kemih, mata dan lain – lainnya.
Morfologi dari kuman ini adalah batang negatif Gram 0,5 – 1,0 x 3,0 – 4,0 µm. Kuman ini menyenangi hidup di tempat yang lembab seperti pada peralatan pernapasan, air dingin, lantai, kamar mandi, tempat air dan lain – lainnya. Suhu pertumbuhan optimumnya adalah 35o C, tetapi juga dapat tumbuh pada suhu 42o C.
22 Familia : Enterobacteriaceae
Genus : Proteus
Merupakan bakteri gram negatif, berbentuk batang pendek, anaerobik fakulatif dengan panjang 2-3 µm. Bakteri ini ditemukan pada feses, limbah dan tanah.
Proteus mirabilis
Familia : Enterobacteriaceae Genus : Proteus
Proteus mirabilis merupakan bakteri gram negatif yang yang dapat hidup secara anaerobik fakultatif dan dapat menyebabkan infeksi pada saluran kemih (Himps et al., 2008).
2.6 Metode Ekstraksi
23
Ada beberapa metode yang umum digunakan untuk ekstraksi yaitu (Sampurno., 2000) :
a. Ekstraksi Dengan Menggunakan Pelarut
1). Cara Dingin Maserasi
Yaitu proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar). Cara ini dapat menarik zat-zat
berkhasiat yang tahan pemanasan maupun yang tidak tahan pemanasan. Perkolasi
Adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur ruangan. Ekstraksi ini membutuhkan pelarut yang lebih banyak.
2). Cara Panas Refluks
Adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama, yaitu 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna.
Soxhlet
24 Digesti
Adalah maserasi kinetik (dengan pengadukan kontinyu) pada temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur 40-50ºC.
Infus
Adalah sediaan cair yang dibuat dengan mengekstraksi simplisia nabati dengan air pada suhu 90ºC selama 15-20 menit.
Dekok
Adalah infus pada waktu yang lebih lama dan temperatur sampai titik didih air.
b. Destilasi Uap
25 BAB III
KERANGKA KONSEP
Gambar 1. Diagram Alir Tahapan Penelitian Bahan Uji :
Ekstrak air gambir kering (Uncaria gambier Roxb.)
membran sel bakteri Menentukan KHM
26 BAB IV
METODOLOGI PENELITIAN
4.1 Waktu dan Tempat Penelitian
Penelitian ini mulai dilakukan dari bulan Mei sampai dengan Agustus 2010 di Laboratorium Fitokimia, Bidang Botani, Puslit Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong.
4.2 Prinsip Penelitian
Sampel yang digunakan pada penelitian ini adalah ekstrak air gambir kering, hasil ekstraksi dari daun dan tanaman gambir (Uncaria gambier Roxb). Ekstrak air gambir yang akan diteliti ini berasal dari Payakumbuh, Sumatera barat. (+)- Katekin diisolasi dari gambir dan kemudian diuji aktivitas antibakterinya. Begitu juga dengan ekstrak air gambir yang akan dievaluasi aktivitas antibakterinya melawan bakteri gram negatif.
a) Alat
Alat yang digunakan adalah :
27
pipet volume 1 mL, 2 mL, 5 mL, 25 mL, kertas saring, timbangan analitik (Sartorius), kapas, cawan petri diameter 6 cm dan 9 cm, alumunium foil, erlenmeyer 50 mL, 250 mL, 500 mL, tabung reaksi 10 mL dan 20 mL, shaker inkubator, freezedrier, cover slip, sentrifuge, paper disc.
4.3 Bahan
Bahan yang digunakan meliputi :
Bahan-bahan yang digunakan pada penelitian ini antara lain gambir, katekin gambir, aquadest, medium NA, Silica gel 60 for cc, 63-200m, Silica gel 60 F254, 25 TLC, plates 20x20 cm, alkohol 70%, 80%, 96% , NaSO4, glutaraldehide, Agar Mueller-Hinton (MHA), Mueller-Hinton Broth (MHB), buffer fospat pH 7, buffer caccodilate 0.2 M pH 7,2, butanol, osmium tetraoksida, tannin acid 1 %, terbutanol, emas.
4.4 Mikroba uji
Biakan bakteri Escherichia coli LIPI MC 0136, Pseudomonas aeruginosa
LIPI MC 0103, Proteus vulgaris, Proteus mirabilis dan Shigella flexneri
28
4.5 Metode Penelitian
4.5.1 Persiapan Bahan, Media dan Alat
a. Persiapan bahan uji
1. Sampel gambir
Dalam penelitian ini, sampel yang digunakan adalah ekstrak getah dari tanaman gambir (Uncaria gambier Roxb.) yang sudah dicetak. Diperoleh dari kebun Payakumbuh, Sumatera Barat.
2. Persiapan Serbuk
Bongkahan gambir dihaluskan menjadi bentuk serbuk. 3. Fraksinasi Ekstrak Air Gambir
Bongkahan gambir ditumbuk halus hingga menjadi serbuk. 500 gr serbuk gambir dilarutkan dengan air panas sebanyak 1 lt. Setelah didilarutkan, hasil rendaman yang diperoleh dipisahkan (filtrasi) dengan kertas saring sehingga menghasilkan filtrate. 250 ml fraksi air yang diperoleh di freeze drying yang kemudian akan diujikan aktivitas antibakterinya dan 250 ml lainnya akan di fraksi dengan etil asetat. Fraksinasi dengan etil asetat dilakukan berulang hingga diperoleh filtrat yang bening. Setelah diperoleh fraksi etil asetat, filtrat dipekatkan dengan
29
4. Isolasi (+)- Katekin dengan Kromatografi Kolom
Fraksi etil asetat ditimbang sebanyak 1,5 gr dan silika gel ditimbang sebanyak 150 gr. Sebelum digunakan, silika gel dikeringkan dalam oven pada suhu 100o C selama 30 menit untuk menghilangkan kadar airnya. Kloroform : metanol (4:1) dalam 2 lt (1600:400) ml disiapkan. Kemudian, silika gel disuspensikan dengan kloroform : metanol (4:1), lalu dimasukkan ke dalam kolom melalui dinding kolom sedikit demi sedikit, sambil kran kolom dibuka. Eluen dialirkan hingga silika gel mampat, eluen dibiarkan mengalir hingga batas adsorben, lalu kran ditutup dan ekstrak kental gambir dimasukkan dimana sebelumnya telah dilarutkan dalam eluen hingga diperoleh kelarutan yang spesifik. Sampel dipipet dan dimasukkan ke dalam kolom melalui dinding kolom sedikit demi sedikit, lalu kran dibuka dan diatur tetesannya, serta cairan pengelusi ditambahkan. Tetesan yang keluar ditampung sebagai fraksi-fraksi.
30
tipis yang telah ditotoli sampel dicelupkan ke dalam fase gerak kurang dari 0,5-1 cm. Setelah itu akan terjadi bercak pemisahan yang kemudian spot yang terbentuk dibandingkan dengan (+)- katekin standar. Bercak pemisahan pada kromatografi lapis tipis umumnya merupakan bercak yang tidak berwarna. Sehingga, perlu disemprotkan dengan vanilin 10% dalam H2SO4 pekat agar spot menjadi lebih jelas.
b. Sterilisasi Alat dan Bahan
Seluruh alat yang akan digunakan dicuci bersih, dikeringkan dan disterilkan terlebih dahulu. Tabung reaksi, gelas ukur dan erlenmeyer ditutup mulutnya dengan kapas. Cawan petri dibungkus dengan kertas. Kemudian semuanya dimasukkan dalam plastik tahan panas dan disterilkan dengan autoklaf pada suhu 121ºC, selama 30 menit. Jarum ose disterilkan dengan cara flambir pada nyala bunsen. Laminar Air Flow disterilkan dengan lampu UV dan disemprotkan dengan alkohol 70%. Sterilisasi Laminar ini dilakukan sebelum dan sesudah bekerja didalamnya.
c. Pembuatan Medium
1. Nutrien Agar (NA)
Agar 15,0 gm
31
Beef extract 3,0 gm
Pada pembiakan bakteri media yang digunakan Nutient agar (NA). Serbuk NA sebanyak 24 gram dilarutkan dalam 1 liter aquades dan dipanaskan sampai mendidih sehingga semuanya larut. Lalu disterilkan dalam autoklaf pada suhu 121ºC selama 15 menit. Setelah agak dingin dapat disimpan dalam lemari pendingin dan dapat digunakan jika diperlukan dengan memanaskannya kembali dalam water bath.
2. Mueller Hinton Agar (MHA)
Beef extract powder 2,0 gm Acid digest of casein 17,5 gm
Starch 1,5 gm
Agar 1,7 gm
32 3. Mueller Hinton Broth (MHB)
Casein acid hydrolysate 17,5 gm
Beef extract 2,0 gm
Starch 1,5 gm
Pembuatan suspensi yang dilakukan digunakan Mueller Hinton Broth (MHB). Dibuat dengan cara mencampurkan 0.1 gram serbuk MHB dengan 5 ml aquadest dan dihomogenkan hingga seluruh serbuk larut dalam aquadest. Larutan MHB yang telah larut disterilkan dalam autoklaf pada suhu 121ºC selama 30 menit. Setelah dingin dapat disimpan dalam lemari pendingin (Refrigerator) untuk digunakan kembali jika dibutuhkan.
d. Pembuatan Kultur Kerja
Stok bakteri gram negatif dalam agar miring nutrien diremajakan kembali pada MHA miring dengan menggunakan ose yang telah disterilkan dengan cara memijarkan pada api bunsen, kemudian diinkubasi pada suhu 37ºC selama 24 jam.
e. Pembuatan Suspensi Bakteri
33
ml medium MHB dan kemudian divortex dan dikocok dalam shaker inkubator pada suhu 37ºC selama 18-24 jam.
4.5.2 Penentuan Diameter Hambat
Penentuan diameter hambat dilakukan dengan cara : siapkan larutan uji ekstrak gambir dsn katekin masing – masing 7 mg/ml, larutan kontrol dan teteskan masing-masing konsentrasi sebanyak 10 μl pada kertas cakram steril. Kertas cakram steril
diteteskan dengan larutan uji, kemudian diletakkan pada media tersebut dan diinkubasi pada suhu 370C selama 24 jam. Pengujian dilakukan dengan tiga kali ulangan (Peoloengan et al., 2006) dan diamati diameter hambat yang terbentuk.
4.5.3 Penentuan Konsentrasi Hambat Minimum (KHM)
34
Dari prosedur tersebut dapat diketahui nilai KHM (+)- katekin dan ekstrak air gambir. Nilai KHM dinyatakan dengan konsentrasi terkecil yang masih memberikan penghambatan pertumbuhan bakteri 100% dan ditandai dengan tidak adanya bakteri uji yang tumbuh.
Hasil nilai konsentrasi KHM yang diperoleh kemudian digunakan sebagai konsentrasi untuk analisis senyawa protein, asam nukleat dan ion-ion logam pada kebocoran membran/dinding sel bakteri serta analisis morfologi membran/dinding sel bakteri.
4.5.4 Pengujian Kebocoran metabolit seluler (Chia et al 2000)
Analisis kebocoran sel dilakukan dengan menggunakan spektrofotometer dan pengukuran absorbansi dilakukan pada panjang gelombang 260 nm (untuk kandungan nitrogen dari asam nukleat) dan panjang gelombang 280 nm (untuk menentukan kandungan nitrogen dari protein).
35
(150 rpm) selama 24 jam. Setelah inkubasi, suspensi bakteri tersebut disentrifuse dengan kecepatan 3500 rpm selam 15-20 menit sehingga diperoleh filtrat dan filtrat ini selanjutnya diukur absorbansinya dengan alat spektrofotometer pada panjang gelombang 260 nm dan 280 nm.
4.5.5 Pengujian kebocoran ion-ion logam (Cox et al. 2000; Carson et
al., 2002)
Untuk analisa kebocoran ion-ion diukur dalam bentuk ion Ca2+ dan K+ yang keluar dari membran sel bakteri akibat perlakuan dengan ekstrak. Analisis kebocoran ion dilakukan pada pelet bakteri yang dipersiapkan seperti pada pengukuran kebocoran protein dan asam nukleat. Kebocoran dinyatakan dengan terukurnya ion-ion logam yang terdapat pada bakteri uji setelah dikontakkan dengan minyak atsiri pada konsentrasi 1 KHM dan 2 KHM. Kebocoran ion Ca2+ dan K+ dideteksi dengan menggunakan AAS (Atomic Absorption Spectrometre) Thermo Elemental tipe Solar MS. Larutan sel hasil kontak dengan ekstrak diambil untuk diukur kandungan ion-ionnya.
4.5.6 Pengamatan Morfologi Sel dengan SEM (Noor, 2001; Jeol,
1995)
36
Selanjutnya suspensi bakteri tersebut disentrifuse dengan kecepatan 3500 rpm selama 20 menit, cairan dibuang untuk mendapatkan masa sel bakteri (pelet), kemudian pelet dicuci dengan buffer phospat sebanyak 2 kali.
37 BAB V
HASIL DAN PEMBAHASAN
5.1. Hasil
Bahan yang digunakan pada penelitian ini merupakan ekstrak gambir kering.
Gambar 2. Ekstrak gambir kering
Isolasi senyawa (+)- katekin dari hasil fraksinasi etil asetat dengan eluen kloroform : metanol (4:1) menghasilkan ekstrak kering sebanyak 70,44 gram. Dan identifikasi senyawa (+)- katekin dengan KLT menghasilkan 1 spot dengan nilai Rf sama seperti (+)- katekin standar.
Gambar 3. Foto KLT Fraksi Kromatografi Kolom
38
dihilangkan pelarutnya kemudian dilakukan KLT lagi untuk memastikan, yang didapatkan hasil bahwa dari fraksi 9-40 merupakan senyawa (+)- katekin. Dan menghasilkan 1,2079 gram dari jumlah cuplikan 1,5 gram. Dan persentase kadar (+)- katekin sebesar 22,54 %.
Gambar 4. Foto KLT Fraksi Gabungan Kromatografi Kolom
Dari hasil penelitian yang telah dilakukan menunjukkan bahwa penentuan uji aktivitas gambir dan (+)- katekin pada konsentrasi 7 mg/ml menghasilkan diameter hambat terhadap bakteri uji, seperti yang terlihat pada table dibawah ini :
Tabel 1. Diameter hambat ekstrak air gambir dan (+)- katekin terhadap S. flexneri, P. aeruginosa LIPI MC 0103, E. coli LIPI MC 0136, P. vulgaris, P. mirabilis pada konsentrasi 7 mg/ml
39
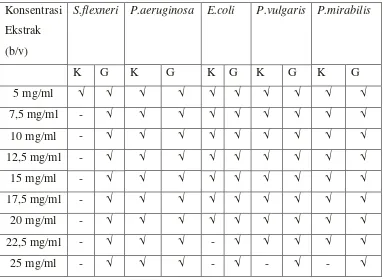
Penentuan nilai KHM dari (+)- katekin dan gambir dilakukan pada konsentrasi 5 mg/ml – 25 mg/ml (b/v) dengan interval konsentrasi 2,5 mg/ml.
Keterangan :
√ : Ada pertumbuhana bakteri - : Tidak ada pertumbuhan bakteri K : (+)- katekin
G : Ekstrak air gambir
Tabel 2. Nilai KHM ekstrak air gambir dan (+)- katekin gambir terhadap bakteri Shigella flexneri, Pseudomonas aeruginosa, Escherichia coli, Proteus vulgaris, Proteus mirabilis setelah dilakukan dengan metode makro dilusi
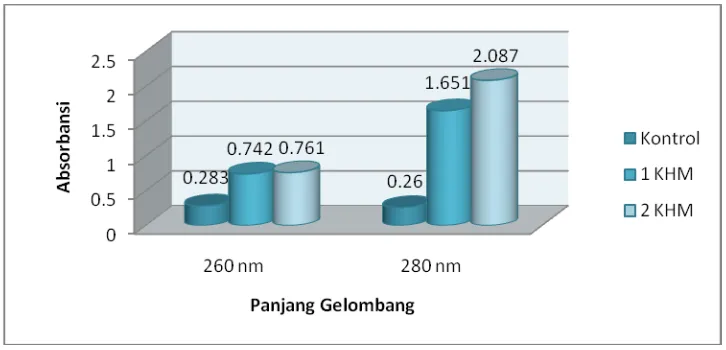
Penentuan kebocoran dinding/membran sel bakteri dianalisis dengan cara mengukur absorbansi pada panjang gelombang 260 nm (asam nukleat) dan 280 nm (protein) serta mengukur kadar ion-ion logam (Ca2+dan Konsentrasi
Ekstrak (b/v)
S.flexneri P.aeruginosa E.coli P.vulgaris P.mirabilis
40
K+) pada larutan uji setelah dikontakkan dengan konsentrasi larutan uji 1 KHM dan 2 KHM. Hasil pengukurannya dapat kita lihat pada gambar 4 dibawah ini :
Gambar 5. Grafik pengukuran senyawa metabolit seluler terhadap bakteri
Shigella flexneri
41
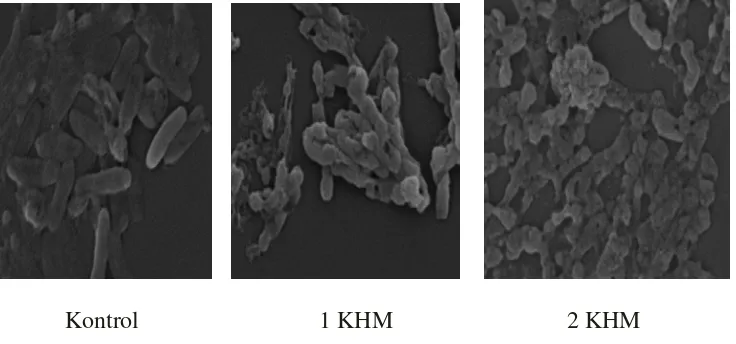
Pengamatan morfologi dinding/membran sel bakteri dilakukan dengan bantuan scanning electron microscope (SEM). Terlihat adanya perubahan pada dinding/membran bakteri setelah perlakuan pada konsentrasi 1 KHM dan 2 KHM. Hasilnya adalah sebagai berikut :
Kontrol 1 KHM 2 KHM
Gambar 7. Fotograf SEM sel S. flexneri yang diperlakukan dengan (+)- katekin. Perbesaran 15.000 x
5.2 Pembahasan
42
Dalam ekstrak produk gambir senyawa fenol total merupakan komponen terpenting terkait dengan sifat antibakterinya, sejauh ini (+)- katekin telah dilaporkan sebagai salah satu senyawa fenolik utama pada ekstrak gambir (Pembayun et al., 2007). Isolasi (+)- katekin dilakukan dengan kromatografi kolom menggunakan pelarut kloroform : metanol (4:1) sebagai eluen.
Fraksi – fraksi hasil kromatografi kolom kemudian di KLT kembali untuk memastikan bahwa fraksi yang diperoleh adalah benar (+)- katekin dengan cara membandingkan dengan (+)- katekin standar. Selanjutnya, fraksi dengan spot yang sama digabung dan diuapkan pelarutnya. Rendemen katekin yang diperoleh sebanyak 22,54 %. Hasil katekin yang diperoleh kemudian diujikan terhadap bakteri gram negatif.
Uji sensitivitas antibakteri menggunakan Shigella flexneri, Pseudomonas aeruginosa, Eschericia coli, Proteus vulgaris dan Proteus mirabilis dengan konsentrasi 7 mg/ml (Taguri et al., 2006), sedangkan untuk uji aktivitas antibakteri menggunakan konsentrasi 5 mg/ml – 25 mg/ml. Pada tabel 1, terlihat bahwa bakteri S. flexneri dan P. vulgaris
merupakan bakteri yang sensitif terhadap gambir dan katekin. Berdasarkan uji sensitifitas terhadap kelima jenis bakteri uji dengan metode difusi cakram, diketahui bahwa diameter hambat yang dihasilkan S. flexneri dan
43
gambier menghasilkan zona hambat terhadap semua strain dari
Escherichia coli O157:H7. Dan perbedaan besarnya daerah hambat ini menunjukkan bahwa setiap bakteri memiliki sensitivitas yang berbeda, semakin sensitif bakteri uji maka semakin besar diameter hambat yang dihasilkan. Ukuran zona hambat dipengaruhi oleh sensitivitas organisme, kultur media, kondisi inkubasi, konsentrasi zat antimikroba pada kertas cakram (Lorian, 1980). Zat yang menghasilkan zona hambat lebih besar tidak pasti lebih aktif dari zat yang menghasilkan zona yang lebih kecil (Brock, 1973).
Pemberian (+)- katekin dan ekstrak air gambir dengan konsentrasi 5 mg/ml; 7,5 mg/ml; 10 mg/ml; 12,5 mg/ml; 15 mg/ml; 17,5 mg/ml; 20 mg/ml; 22,5 mg/ml dan 25 mg/ml sangat mempengaruhi aktivitas pertumbuhan bakteri uji yang dapat dilihat pada tabel 2. Hasil pada tabel 2 menunjukkan bahwa gambir pada konsentrasi 5 mg/ml – 25 mg/ml belum dapat menghambat pertumbuhan bakteri, sedangkan (+)- katekin pada konsentrasi 7,5 mg/ml dapat menghambat pertumbuhan Shigella flexneri.
Untuk Eschericia coli mulai terhambat pertumbuhannya pada konsentrasi 22,5 mg/ml, Proteus vulgaris dan Proteus mirabilis pada konsentrasi 25 mg/ml, sedangkan Pseudomonas aeruginosa masih terjadi pertumbuhan. Golongan fenol dapat menghambat antibakteri karena adanya gugus OH (Cowan, 1999). Golongan fenol yang terdapat dalam gambir adalah katekin dan tanin. Dan dari hasil penelitian yang dilakukan oleh Taguri et al (2006), aktivitas antibakteri terhadap katekin pada Shigella flexneri
44
aeruginosa adalah 1333 µg/ml, Eschericia coli 2667 µg/ml, Proteus vulgaris 667 µg/ml dan Proteus mirabilis adalah 1333 µg/ml, hal ini diduga bahwa bakteri yang diisolasi dari sumber dan daerah yang berbeda memiliki sensitivitas dan aktivitas yang berbeda pula, dan metode pengujian yang juga berbeda.
Pada konsentrasi 5 mg/ml semua bakteri baik pada gambir maupun katekin masih dapat tumbuh, sehingga metode mikro dilusi diganti pada metode makro dilusi, selain ekstrak yang dihasilkan berwarna merah sehingga tidak dapat diidentifikasi dengan penambahan INT (Iodonitro Tetrazolium). Pada metode makro dilusi, aktivitas antibakteri dapat dilihat dari jenis bakteri yang tumbuh ataupun tidak tumbuh.
45
panjang gelombang 260 nm dan 280 nm. Dari gambar 5, dapat diketahui bahwa pemberian (+)- katekin pada konsentrasi 1 KHM menyebabkan terjadinya kebocoran sel yang menyebabkan terjadinya peningkatan absorbansi untuk asam nukleat (260 nm). Pada konsentrasi 1 KHM absorbansinya mengalami peningkatan dari 0.283 menjadi 0.742 dan pada konsentrasi 2 KHM terjadi peningkatan absorbansi sekitar 3 kali lipat menjadi 0.761 bila dibandingkan dengan kontrol.
Peningkatan absorbansi pada panjang gelombang 260 nm sejalan dengan peningkatan absorbansi untuk protein yaitu pada panjang gelombang 280 nm (gambar 5). Bila dibandingkan dengan peningkatan absorbansi untuk asam nukleat maka peningkatan untuk protein (280 nm) lebih tinggi. Pada panjang gelombang 280 nm, absorbansi konsentrasi 1 KHM mengalami peningkatan dari 0.260 menjadi 1.651 dan pada konsentrasi 2 KHM terjadi peningkatan sekitar 8 kali lipat menjadi 2.087 bila dibandingkan dengan kontrol.
46
aromatik, sedangkan fosfat dan gula tidak memberikan kontribusi dalam absorpsi UV (Stansfield et al., 2006).
Tidak jauh berbeda dengan pengukuran metabolit seluler yaitu asam nukleat dan protein, pengukuran ion-ion logam (Ca2+ dan K+) yang ditunjukkan pada (gambar 6) juga menunjukkan peningkatan seiring dengan meningkatnya konsentrasi KHM larutan uji/ekstrak. Pada gambar 6, terjadi peningkatan kadar ion Ca2+ dari 4.21 ppm – 5.89 ppm dan kadar ion K+ dari 52.3 ppm – 100.6 ppm. Meningkatnya ion-ion Ca2+ dan K+ yang dikeluarkan oleh sel-sel bakteri uji menunjukkan bahwa telah terjadi kerusakan pada bagian dinding sel dan membran sitoplasma.
Untuk mempertahankan diri, pada umumnya membran sel mempunyai lapisan lipid. Dari hasil penelitian yang dilakukan oleh Seok et al (1999), bakteri Lactobacillus sp pada kondisi lingkungan yang sangat asam akan menyebabkan komponen utama dari membran sel bakteri tersebut mengalami kerusakan dan akibatnya komponen-komponen intraseluler seperti Ca2+, Mg2+, K+ dan lipid akan dikeluarkan. Indikasi adanya kerusakan membran sitoplasma adalah terjadinya kebocoran kandungan sitoplasma K+ dan peningkatan kandungan K+ yang dilepaskan merupakan tanda kerusakan permeabilitas membran (Cox et al., 2001). Ca2+ dan Mg2+ berfungsi untuk menjaga kestabilan membran bakteri dan dengan adanya kebocoran ion-ion tersebut maka kestabilan membran akan terganggu yang selanjutnya akan mengakibatkan kematian bakteri.
47
mengalami perubahan dibandingkan sel normal. Kerusakan morfologi sel bakteri diamati dengan SEM dengan perbesaran 15.000 kali.
48 BAB VI
KESIMPULAN DAN SARAN
6.1. Kesimpulan
Dari hasil penelitian yang telah dilakukan dapat diambil beberapa kesimpulan sebagai berikut :
a. Kandungan (+)- katekin pada gambir 22,54 %
b. (+)- Katekin memiliki aktivitas antibakteri terhadap bakteri Shigella flexneri, dimana nilai konsentrasi hambat minimum (KHM) adalah 7,5 mg/ml (b/v).
c. (+)- Katekin memiliki mekanisme penghambatan antibakteri dengan merusak dinding/membran sel bakteri Shigella flexneri.
d. Ekstrak air gambir tidak memiliki aktivitas dan mekanisme penghambatan antibakteri terhadap Shigella flexneri, Pseudomonas aeruginosa, Eschericia coli, Proteus vulgaris dan Proteus mirabilis.
6.2. Saran
49
menimbulkan penyakit pada manusia dan diharapkan bahan uji berpotensi sebagai antibakteri terhadap bakteri jenis lain tersebut.
DAFTAR PUSTAKA
Assani, S. 1993. Ultrastruktur, Morfologi dan Pewarnaan Kuman dalam buku
Mikrobiologi Kedokteran Edisi Revisi. Jakarta : Binarupa Aksara
Bonang, S dan E.S, Koeswandono. 1982. Mikrobiologi Kedokteran Untuk Laboratorium dan Klinik. Jakarta : Gramedia
BPOM RI. 2007. Acuan Sediaan Herbal Volume ketiga Edisi Pertama. Jakarta : Direktorat Jenderal Pengawasan Obat dan Makanan.
Brock, T. D. 1973. Basic Microbiology With Applications. London: Prentice-Hall International, Inc: 72-73, 89-92.
Campbel, G.R., J. Prosser., A. Glover., and K. Killham. 2001. Detection of Escherichia coli in Soil and Water using Multiplex PCR. Journal of Applied Microbiology. 91, 1004-1010
Carson C.F., Brian J.M and Riley T.V. 2002. Mechanism of Action of Tea Tree Oil on Staphylococcus aureus Determined by Time Kill, Lyses, Leakage, and Salt Tolerance Assays and Electron Microscopy. Antimicrobial Agent and Chemotherapy 6 : 1914-1920
Chatim, A dan Suharto. 1993. Sterilisasi dan Disinfeksi dalam buku Mikrobiologi Kedokteran Edisi Revisi. Jakarta : Binarupa Aksara
Chia M. L., J. K. Preston dan C. I. Wei. 2000. Antibacterial Mechanism of Allyl Isothiocyanate. J. of Food Protection 63 (6): 727- 734.
Cox S.D., Mann C.M., Markham J.L., Bell H.C., Gustafson J.E., Warmington J.R and Wyllie S.G. 2000. The Mode of Antibacterial Action of The Essential Oil of Melaleuca Alternifolia (Tea Tree Oil). Journal of Apply Microbiology
50
Cox S. D, Cindy M. Mann, Julie L. Markham, John E. Gustafson, John R. Warmington and S. Grant Wyllie. 2001. Determining the Antimicrobial action of Tea Tree Oil.Molecules (6) : 87-91.
Cowan M. Murphy. 1999. Plants Product as Antimicrobial Agents. Journal Microbiology Review. 12 (4) : 564-582
Dalimarta, S. 2003. Atlas Tanaman Obat Indonesia Jilid 3. Jakarta : Puspaswara, Anggota Ikapi.
Davidson. P. M. dan A. L. Branen. 1993. Antimicrobial In Food (2nd). Marcel Dekker, Inc. New York.
Departemen Kesehatan Republik Indonesia. 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat. Direktorat Jenderal Pengawasan Obat dan Makanan, Jakarta:13-21.
Dhalimi, A. 2006. Permasalahan Gambir (Uncaria gambir L.) di Sumatera Barat dan Alternatif Pemecahannya. Perspektif Volume 5 Nomor 1. Juni : 46-59
Djauhariya dan Hernani. 2004. Gulma Berkhasiat Obat. Jakarta : Penebar Swadaya
Evans, W.C. 2002. Trease and Evans Pharmacognosy 15th Edition. Nottingham, U.K : W.B. Saunders
Haryanto, S. 2009. Ensiklopedia Tanaman Obat Indonesia. Yogya : Palmall
Himpsl, S. D., C. Virginia.L., J. Richard. H., David. E. J., dan Harry L.T.M. 2008. Identification of Virulence Determinants in Uropathogenic Proteus mirabilis
Using Signatur-Tagged Mutagenesis. Journal of Medical Microbiology
57(2008), 1068-1078.
Idris, H. 2007. Pemakaian Fungisida Gambir Terhadap Penyakit Bercak Fusarium
sp pada Daun Serai Wangi. Jurnal Ilmu-ilmu Pertanian Indonesia Edisi Khusus No 3 Hal 379-385
51
Jeol. 1995. Specimen Preparation Method for Scanning Electron Microscope.
JEOL Application Note. Tokyo.
Karsinah, L.H.M., Suharto dan Mardiastuti H.W. 1993. Batang Negatif Gram
dalam buku Mikrobiologi Kedokteran Edisi Revisi. Jakarta : Binarupa Aksara
Kresnawaty, I dan A. Zainuddin. 2009. Aktivitas Antioksidan dan Bakteri dari Derivat Metil Ekstrak Etanol Daun Gambir (Uncaria Gambir). Jurnal Litri
15(4)Hal.145-151
Lorian, V. 1980. Antibiotics Laboratory Medicine. Baltimore : The Williams & Wilkins Company: 17, 121-122.
Lucida, H., A. Bakhtiar dan Wina A.P.2007. Formulasi Sediaan Antiseptik Mulut dari Katekin Gambir. Jurnal Sains Teknologi Farmasi 12(1)
Maillard J. J. 2002. Bacterial Target sites for Biocide Action. J. of Applied Microbiology Symposium Supplement (92): 16 S- 27 S.
Mardisiswojo, S dan H. Rajakmangunsudarso. 1968. Cabe Puyang Warisan Nenek Moyang Cetakan ke 2. Jakarta : Depkes RI
Miksusanti., Betty, S. L. J., Bambang, P., dan Gatot, T. 2008. Kerusakan Dinding Sel Escherichia coli K1.1 Oleh Minyak Atsiri Temu Kunci (Kaempferia pandurata). Berita Biologi 9 (1).
Misra, M. 2009. The key to medicinal plants research revolves around the detection, isolation, and characterisation of antioxidants as therapeutic agents. Journal of Medicinal Plants Research Vol. 3(10).
Noor R. R. 2001. Scanning Electron Microscope. Laboratorium Pemuliaan dan Genetika Ternak. Fakultas Peternakan IPB, Bogor.
Peoloengan, M., Chairul., I. Komala., S. Salmah dan Susan. 2006. Aktivitas Antimikroba dan Fitokimia dari Beberapa Tanaman Obat. Seminar Nasional Teknologi Peternakan dan Veteriner
52
Pratiwi, S. T. 2008. Mikrobiologi Farmasi. Jakarta : Erlangga.
Sampurno. 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta : Departemen Kesehatan RI
Setiabudy, R dan Vincent H.S. Gen. 1995. Pengantar Antimikroba dalam buku
Farmakologi dan Terapi Edisi 4. Jakarta : Bagian Farmakologi FKUI
Sirait, M., E. Loho., R. B. Sutrisno., S. Prawirosujanto., M. B. Lesmono., B. Poerwodhiredjo., B. Dzulkarnain., B. Wahyudi., Abisono dan A. Hidir. 1989. Materia Medika Indonesia. Jakarta : Dirjen POM.
Soesilo, S., Andajaningsih., Richard. P., Tjartim. H dan Lucky. S. S. 1995.
Farmakope Indonesia Edisi IV. Jakarta : Direktorat Jenderal Pengawasan Obat dan Makanan.
Stansfield W. D., Colome J. S. Cano R. J. 2006. Biologi Molekuler dan Sel, Moleculer and Cell Biology. Alih Bahasa: Varian Fahmi. Jakarta: Erlangga:23
Taguri, T., Takashi. T., dan Isao.k., 2006. Antibacterial Spectrum of Plant Polyphenols and Extracts Depending upon Hydroxyphenil Structure., Biol. Pharm. Bull. 29 (11) 2226-2235
Ultee A., M. H. J. Bennik dan R. Moezelaar. 2002. The Phenolic Hydroxyl Group of Carvacrol is Essential for Action against the Food-Borne Pathogen Bacillus cereus. J. Applied and Environmental Microbiology 68 (4) : 1561-1568.
Utami, P., Novi. W., Nina. W., Dewi. D., Agung. S., Tinton D. P., Hadi. I., Lukito. A.M., Ug’t dan Iwan’S. 2008. Buku Pintar Tanaman Obat 431 Jenis Tanaman Penggempur Aneka Penyakit. Jakarta : PT. Agromedia Pustaka
Voravuthikunchai, S., Amornrat. L., Wanpen. J., Trechada. S., Souwalak. P and Thanomjit. S.2004. Effective Medicinal Plants Againts Enterohaemorrhagic
Escherichia coli O157:H7. Journal of Ethnopharmacology 94 Hal 49-54
Wilhelm, A. 2008. Photochemistry of (+)- Catechin and (-)- Epicatechin.
53
Lampiran 1. Skema pembuatan ekstrak gambir (Uncaria gambier Roxb.).
Gambir
Diserbuk
Diekstraksi dengan cara maserasi
Filtrat disaring
Filtrat dipekatkan dengan vakum evaporator
Dibekukan dan dimasukkan dalam freeze drying selama 1-2 hari
Didapat ekstrak air gambir
54
Lampiran 2. Skema isolasi katekin dari gambir dengan kromatografi kolom
Gambir
Serbuk gambir
Ekstraksi dengan etil asetat
Sebagian ekstrak di KLT, untuk mengetahui perbandingan pelarut,
lalu diisolasi dengan kolom
Hasil fraksinasi ditampung dan dievaporasi
Hasil evap di KLT kembali dan dibandingkan dengn standar katekin
Didapat (+)- katekin
55 Lampiran 3. Skema pembuatan suspensi bakteri
Bakteri uji yang telah diremajakan 24 jam
Bakteri diambil satu ose, dengan ose yang telah disterilkan
Dimasukkan kedalam tabung reaksi yang berisi 5 ml MHB steril
Suspensi bakteri digunakan untuk penentuan KHM
Suspensi bakteri digunakan untuk uji difusi cakram
Jumlah bakteri dihitung dengan metode cawan hitung Suspensi bakteri diencerkan hingga
diperoleh 105 sel bakteri/ml Diinkubasi shaker selama 24 jam
56
Lampiran 4. Skema kerja penentuan diameter hambat dengan metode difusi cakram
Media
Mueller Hinton Agar
Dituang ke cawan petri dan dibiarkan membeku
Diinokulasi dengan 1 ml suspensi bakteri
Diletakkan kertas cakram yang telah dijenuhkan lar uji dan
kontrol negatif
Diukur diameter hambat yang terbentuk
Diinkubasi pada suhu 370 C, 24 jam
57 Lampiran 5. Skema kerja penentuan KHM/MIC
Setiap erlenmeyer berisi larutan 5ml (MHA + aquades + ekstrak) yang dituang keatas media MHA Media MHA, dituang ke masing –
masing petri (petri telah dibagi 5 bagian untuk suspensi bakteri).
Setelah mengeras lalu dituang larutan yang berisi sampel di
atasnya
Setelah mengeras, diteteskan ± 1 tetes suspensi bakteri S. flexneri, P.
aeruginosa, E.coli, P. vulgaris dan
P. mirabilis dimasing-masing bagian pada petri.
Diinkubasi selama 24 jam, pada suhu 37o C
Diamati pertumbuhan bakterinya
58
Lampiran 6. Skema analisis kebocoran dinding/membran sel bakteri
10 ml suspensi bakteri
Disentrifuse 15 menit, 3500 rpm
Pellet dicuci dengan buffer fosfat, 2 kali
Ditambahkan 1 ml larutan uji 1 KHM & 2 KHM
Disentrifuse selama 15 menit, 3500 rpm
Diinkubasi shaker 24 jam Suhu 37 ºC
Disuspensikan dalam 9 ml buffer fosfat
Disaring dan cairan supernatan diambil
Diukur kadar ion K+ dan Ca2+ dengan AAS
Diukur absorban λ 260 nm dan 280 nm
59
Lampiran 7. Skema pengamatan morfologi sel bakteri
Pellet direndam dengan glutaraldehid dan buffer cocodhilate selama 4 jam.
Selanjutnya di sentrifuse dan sufernatan dibuang.
Pellet direndam kembali dengan tannin acid 1 % dalam buffer
caccodhilate selama 12 jam
Disentrifuse & supernatan dibuang dan pelet direndam dalam 2 % larutan
osmium tetraoksida selama 2-4 jam.
Dicuci lagi dengan etanol 50%,70%, 80%, 95% masing-masing selama 10
menit.
Dibiarkan 10 menit dan sentrifuse lagi 5 menit lalu supernatan dibuang.
Dicuci dengan buffer caccodhilate lalu disentrifuse dan pellet dicuci
dengan ethanol 50% dingin
Dicuci dengan ethanol absolute dan disentrifuse 5 menit sebanyak 2 kali & dicuci kembali dengan terbutanol 2
60
Lampiran 8. Perhitungan konsentrasi dengan metode makro dilusi
Konsentrasi gambir maupun katekin adalah 5 mg/ml; 7,5 mg/ml; 10 mg/ml; 12,5 mg/ml; 15 mg/ml; 17,5 mg/ml; 20 mg/ml; 22,5 mg/ml; 25 mg/ml
Larutan Induk :
25 mg/ml x 5 = 125 mg/ml = 125 µg/µl = 0,125 mg/µl
Perhitungan masing-masing konsentrasi : 1. 25 x 5 Dicoating dengan emas selama 1 jam
dalam kondisi vakum. Diamati dengan menggunakan mikroskop
electron (seri JSM-5310LV) Ditambahkan sedikit terbutanol pada
62
Maka, x MHA + (5000 – 200) = 200 µl ekstrak = 4800 µl aquades
Lampiran 9. Diameter hambat (+)- katekin dan ekstrak air gambir terhadap
Shigella flexneri, Pseudomonas aeruginosa, Eschericia coli, Proteus vulgaris dan Proteus mirabilis 7 mg/ml.
Bakteri
Shigella flexneri
Pseudomonas aeruginosa
63
Keterangan K : (+)- Katekin
G :
Gambir
Proteus vulgaris
64
Lampiran 10. Pertumbuhan bakteri Shigella flexneri, Pseudomonas aeruginosa, Eschericia coli, Proteus vulgaris dan Proteus mirabilis terhadap (+)- katekin dan ekstrak air gambir dengan metode makrodilusi.
Konsentrasi Sampel Bakteri 5 mg/ml Gambir
(+)- katekin
Konsentrasi Sampel Bakteri 7,5 mg/ml Gambir
65 Konsentrasi Sampel Bakteri 10 mg/ml Gambir
(+)- katekin
Konsentrasi Sampel Bakteri 12,5 mg/ml Gambir
66 Konsentrasi Sampel Bakteri 15 mg/ml Gambir
(+)- katekin
Konsentrasi Sampel Bakteri 17,5 mg/ml Gambir