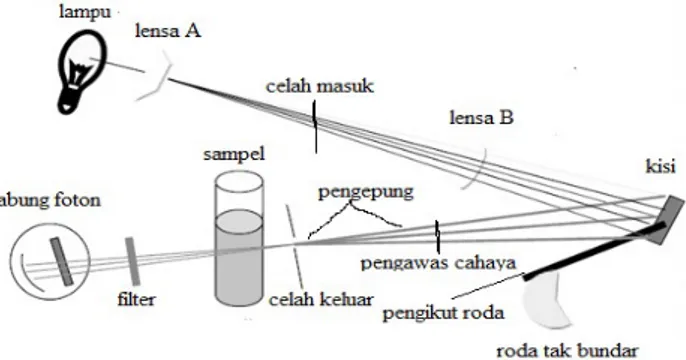
Piranti baca Pengganda
Sumber Monokromator Sampel Detektor
7.1. Tujuan Percobaan
Mengetahui metoda analisa spektrofotometri. Mengetahui aplikasi analisa pada spektrofotometri. Menentukan kadar sulfat dalam sampel.
7.2. Tinjauan Pustaka
Spektrofotometri merupakan salah satu metode dalam kimia analisis, yang umum digunakan untuk menentukan komposisi suatu sampel baik secara kuantitatif dan kualitatif yang didasarkan pada interaksi antara materi dengan cahaya. Peralatan yang digunakan dalam spektrofotometri disebut spektrofotometer.[33] Spektrofotometer sesuai
dengan namanya adalah alat yang terdiri dari spektrometer dan fotometer. Spektrometer menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau yang diabsorbsi. Jadi Spektrofotometer digunakan untuk mengukur energi secara relatif jika energi tersebut ditransmisikan, direfleksikan atau diemisikan sebagai fungsi dari panjang gelombang.[4]
Bagan Optis
Gambar 7.2.1. Komponen-komponen spektrofotometer
Komponen-komponen spektrofotometer terdiri dari: - Sumber
Sumber energi cahaya yang biasa untuk daerah tampak (dari) spektrum itu maupun daerah ultraviolet dekat dan inframerah dekat adalah sebuah lampu pijar dengan kawat rambut terbuat dari wolfram. Pada kondisi operasi biasa, keluaran lampu wolfram ini memadai dari sekitar 325 atau 350 nm ke sekitar 3 µm.
- Monokromator
Monokromator adalah piranti optis untuk memencilkan suatu berkas radiasi dari suatu sumber berkesinambungan, berkas mana mempunyai kemurnian spektral yang tinggi dengan panjang gelombang apa saja yang diinginkan. Komponen yang esensial dari sebuah monokromator adalah suatu sistem celah dan suatu unsur dispersif.
- Wadah sampel
Kebanyakan spektrofotometri melibatkan larutan, dan karenanya kebanyakan wadah sampel adalah sel untuk menaruh cairan ke dalam berkas cahaya spektrofotometer. Sel itu haruslah meneruskan energi cahaya dalam daerah spektral yang diminati. - Detektor
Dalam sebuah detektor untuk suatu spektrofotometer, kita menginginkan kepekaan yang tinggi dalam daerah spektral yang diminati, respons yang linear terhadap daya radiasi, waktu respons yang cepat, dapat digandakan, dan kestabilan tinggi. Kepekaan yang tinggi misalnya, dapat dicapai hanya dengan menerima bisingan yang meningkat.[1]
- Read out
Read out merupakan suatu sistem baca yang menangkap besarnya isyarat listrik yang berasal dari detektor.[38]
- Sel Absorpsi
Pada pengukuran di daerah tampak kuvet kaca atau kuvet kaca corex dapat digunakan, tetapi untuk pengukuran pada daerah UV harus menggunakan sel kuarsa karena gelas tidak tembus cahaya pada daerah ini. Umumnya tebal kuvet adalah 10 mm, tetapi yang lebih kecil ataupun yang lebih besar dapat digunakan. Sel yang biasa digunakan berbentuk persegi, tetapi bentuk silinder dapat juga digunakan.[4]
Jenis-jenis Spektrofotometri berdasarkan sumber cahaya yang digunakan diantaranya sebagai berikut:
1. Spektrometri Visible (spektro Vis)
Pada spektrofotometri ini yang digunakan sebagai sumber sinar/energi adalah cahaya tampak (visible). Cahaya visible termasuk spektrum elektromagnetik yang dapat ditangkap oleh mata manusia. Panjang gelombang sinar tampak adalah 380 sampai 750 nm. Sehingga semua sinar yang dapat dilihat oleh kita, entah itu putih, merah, biru, hijau, apapun.. selama ia dapat dilihat oleh mata, maka sinar tersebut termasuk ke dalam sinar tampak (visible). Sumber sinar tampak yang umumnya dipakai pada spektro visible adalah lampu Tungsten.
2. Spektrometri UV (ultraviolet)
Pada spektrofotometri UV berdasarkan interaksi sample dengan sinar UV. Sinar UV memiliki panjang gelombang 190-380 nm. Sebagai sumber sinar dapat digunakan lampu deuterium. Karena sinar UV tidak dapat dideteksi oleh mata kita, maka senyawa yang dapat menyerap sinar ini terkadang merupakan senyawa yang tidak memiliki warna.
Gambar 7.2.4. Spektrofotometer UV
3. Spektrofotometri UV-Vis
Spektrofotometri ini merupakan gabungan antara spektrometri UV dan Visible. Menggunakan dua buah sumber cahaya berbeda, sumber cahaya UV dan sumber cahaya visible. Kemudahan metode ini adalah dapat digunakan baik untuk sampel berwarna juga untuk sampel tidak berwarna.
Gambar 7.2.5. spektrofotometer UV-Vis
4. Spektrofotometri IR (Infra Red)
Gambar 7.2.6. Spektrofotometer IR (Infra Red)
Macam-macam spektrofotometri berdasarkan jenis instrumennya ada tiga, antara lain:
1. Spektrofotometer berkas tunggal
Model sel berkas tunggal kurang umum digunakan jika dibandingkan dengan berkas ganda. Berkas sinar yang konstan dari sumber akan melalui lensa pemfokus serta filter sehingga menjadi monokromatis, selanjutnya berkas sinar akan melewati larutan, sebelum menumbuk fotosel di mana berkas sinar tersebut diubah menjadi arus pada sirkuit.[4]
Gambar 7.2.6. Gambar Spektofotometer Berkas tunggal
2. Spektrofotometer berkas rangkap
Spektrofotometer perekam yang mengalurkan secara otomatis absorbans suatu sampel sebagai fungsi panjang gelombang hampir selalu berupa instrumen berkas rangkap.[1]
Gambar 7.2.7. Spektrofotometer berkas rangkap
3. Spektrofotometri diferensial.
Gambar 7.2.8. Spektrofotometri Diferensial
Hukum-hukum yang mendasari spektrofotometri adalah :
- Hukum Lambert
Menurut Hukum Lambert, serapan berbanding lurus dengan ketebalan lapisan yang disinari. Dengan bertambahnya ketebalan lapisan, serapan akan bertambah.
- Hukum Beer
Menurut Hukum Beer, yang hanya berlaku untuk cahaya monokromatis dan larutan yang sangat encer, serapan dan konsentrasi adalah proporsional.
Jika konsentrasi bertambah, jumlah molekul yang dilalui berkas sinar akan bertambah, sehingga serapan juga bertambah.
- Hukum Lambert-Beer
Cahaya yang diserap diukur sebagai absorbansi (A) sedangkan cahaya yang dihamburkan diukur sebagai transmitansi (T), dinyatakan dengan hukum lambert beer, berbunyi:
“Jumlah radiasi cahaya tampak (ultraviolet, inframerah dan sebagainya) yang diserap atau ditransmisikan oleh suatu larutan merupakan suatu fungsi eksponen dari konsentrasi zat dan tebal larutan”.
Berdasarkan hukum Lambert-Beer, rumus yang digunakan untuk menghitung banyaknya cahaya yang hamburkan:
T = IIt
0
atau %T = It
I0
x 100 %
dan absorbansi dinyatakan dengan rumus: A= - log T
dimana I0 merupakan intensitas cahaya datang dan It atau I1 adalah intensitas
cahaya setelah melewati sampel.[38]
Gambar 7.2.1. Hukum Lambert-Beer
Dalam hukum Lambert-Beer tersebut ada beberapa pembatasan yaitu:
- Sinar yang digunakan dianggap monokromatis
- Penyerapan terjadi dalam suatu volume yang mempunyai penampang luas yang sama
- Senyawa yang menyerap dalam larutan tersebut tidak tergantung terhadap yang lain dalam larutan tersebut
- Tidak terjadi peristiwa fluoresensi atau fosforisensi
Suatu larutan blanko dapat digunakan dalam satu kompartemen untuk mengkoreksi pembacaan atau spektrum sampel. Yang paling sering digunakan sebagai blanko dalam spektrofotometri adalah semua pelarut yang digunakan untuk melarutkan sampel atau pereaksi. [37]
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang mempunyai absorbansi maksimal. Untuk memilih panjang gelombang maksimal, dilakukan dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku pada konsentrasi tertentu.[2]
Ada beberapa alasan mengapa harus menggunakan panjang gelombang maksimum, yaitu:
- Pada panjang gelombang maksimal, kepekaannya juga maksimal karena pada panjang gelombang maksimal tersebut, perubahan absorbansi untuk setiap satuan konsentrasi adalah yang paling besar.
- Disekitar panjang gelombang maksimal, bentuk kurva absorbansi datar dan pada kondisi tersebut hukum Lambert-Beer akan terpenuhi.
- Jika dilakukan pengukuran ulang maka kesalahan yang disebabkan oleh pemasangan ulang panjang gelombang akan kecil sekali, ketika digunakan panjang gelombang maksimal.[2]
Penerapan spektrofotometri dalam kehidupan sehari-hari antara lain:
- untuk menentukan komposisi suatu sampel baik secara kuantitatif dan kualitatif yang didasarkan pada interaksi antara materi dengan cahaya.[33]
- untuk mengukur jumlah atau banyaknya unsur yang diteliti.
- untuk menentukan struktur suatu zat.[39]
- Dalam menganalisis pupuk NPK dibutuhkan suatu alat yang dapat mengetahui panjang gelombang. [40]
Ion sulfat adalah salah satu anion yang banyak terjadi pada air alam. Ia merupakan sesuatu yang penting dalam penyediaan air untuk umum karena pengaruh pencucian perut yang terjadi pada manusia apabila ada dalam konsentrasi yang cukup besar. Batas yang boleh digunakan untuk dikonsumsi manusia berdasarkan konsentrasi standar maksimal yang ditetapkan oleh Menteri Kesehatan RI untuk sulfat dalam air minum adalah 250 mg/l dalam air.
Sulfat penting dalam penyediaan air untuk umum maupun untuk industri, karena kecendrungan air untuk mengandungnya dalam jumlah yang cukup besar untuk membentuk kerak air yang keras pada ketel dan alat pengubah panas. Kandungan konsentrasi yang tinggi dalam air minum dapat menyebabkan perpindahan diare. Dalam studi pada orang-orang dewasa ditemukan laxative yang sangat tinggi di atas 1000 mg/l. Diare yang akut dapat menyebabkan dehidrasi, terutama pada bayi dan anak kecil yang sudah mengidap mikroba diare dalam tubuh.[34]
Pada metode penetapan sulfat ini terdiri dari penambahan larutan barium klorida encer dengan perlahan-lahan kepada suatu larutan sulfat itu yang panas, yang sedikit diasamkan dengan asam klorida. Barium sulfat memperlihatkan kecenderungan untuk meyeret turun garam-garam lain. Barium klorida dan barium nitrat mudah berkopresipitasi. Garam-garam ini akan menambah bobot sebenarnya dari barium sulfat, maka hasil-hasil yang diperoleh akan tinggi, karena barium klorida itu tak berubah pada pemijaran dan barium nitrat itu akan menghasilkan barium oksida. [34]
7.3. Tinjauan Bahan
A. Aquadest
Rumus molekul : H2O
Berat molekul : 18 gr/mol
Bentuk : cairan
Warna : tak berwarna
Bau : tak berbau
Densitas : 1 gr/cm3
pH : 7
B. Asam klorida
Rumus molekul : HCl
Berat molekul : 36,46 gr/mol
Bentuk : cairan
Warna : tak berwarna
Bau : menyengat
Densitas : 1,18 gr/cm3
pH : 3
C. Kalium sulfat
Rumus molekul : K2SO4
Berat molekul : 174,26 gr/mol
Bentuk : padat
Warna : tak berwarna
Bau : tak diketahui
Densitas : 2,66 g/cm3
pH : 5,5-8,5
D. Barium klorida
Rumus molekul : BaCl2.2H2O
Berat molekul : 208,31 gr/mol
Bentuk : padat
Warna : putih
Bau : tak berbau
pH : tak diketahui
7.4. Alat dan Bahan
A. Alat-alat yang digunakan:
- batang pengaduk
- beakerglass
- botol aquadest
- corong kaca
- cuvet
- Erlenmeyer
- gelas arloji
- karet penghisap
- neraca analitik
- labu ukur
- pipet volume
- pipet tetes
- spektrofotometer sinar tampak
B. Bahan-bahan yang digunakan:
- aquadest (H2O)
- asam klorida encer (HCl)
- barium klorida (BaCl2.2H2O)
- kalium sulfat (K2SO4)
- sampel (air kran)
7.5. Prosedur Percobaan
A. Preparasi Larutan
- membuat larutan kalium sulfat 100 ppm sebanyak 250 ml
- membuat larutan asam klorida 2 M sebanyak 50 mL. B. Menentukan panjang gelombang maksimum
- memipet larutan kalium sulfat 100 ppm sebanyak 50 mL, lalu tambahkan asam klorida untuk mengukur pH hingga 1. Kemudian tambahkan 0,2 gram padatan barium klorida
- mengocok selama kurang lebih 1 menit sampai terbentuk endapan barium sulfat dan diamkan selama 5 menit
- mengukur nilai %T dan A dari larutan 100 ppm dengan spektrofotometer sinar tampak pada panjang gelombang 410 nm sampai 520 nm
- menggunakan larutan blangko untuk mengenolkan harga %T sebelum pengukuran serapan larutan standart pada setiap penggantian panjang gelombang
- membuat kurva hubungan antara panjang gelombang dengan absorbansi (%T) dan menentukan panjang gelombang maksimum.
C. Membuat kurva kalibrasi
- melakukan pengenceran pada larutan kalium sulfat 100 ppm dengan aquadest menjadi 5, 20, 35, 50, 65, dan 80 ppm sebanyak 50 mL
- menambahkan asam klorida pada masing-masing larutan serta ditambahkan 0,2 gram padatan barium klorida
- mengocok selama kurang lebih 1 menit sampai terbentuk endapan barium sulfat, mendiamkan selama 5 menit
- mengukur besarnya transmitan pada panjang gelombang maksimum
- membuat kurva kalibrasi antara panjang gelombang dan konsentrasi.
- memipet 10 mL sampel ke dalam labu ukur 50 mL, menambahkan aquadest sampai tanda batas
- menambahkan asam klorida 2 M untuk mengukur pH hingga 1 dan menambahkan 0,2 gram padatan barium klorida
- mengocok selama kurang lebih 1 menit sampai terbentuk endapan barium sulfat, mendiamkan selama 5 menit
- mengukur besarnya transmitan pada panjang gelombang maksimum
- membuat kurva kalibrasi antara panjang gelombang dan konsentrasi.
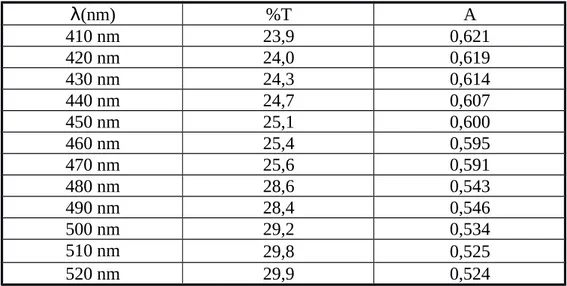
7.6. Data Pengamatan
Tabel 7.6.1. Data penentuan panjang gelombang (λ) maksimum dengan menggunakan spektrofotometer 22
A (nm) %T
410 nm 23,9
420 nm 24,0
430 nm 24,3
440 nm 24,7
450 nm 25,1
460 nm 25,4
470 nm 25,6
480 nm 28,6
490 nm 28,4
500 nm 29,2
510 nm 29,8
520 nm 29,9
Tabel 7.6.2.Data pengamatan kurva kalibrasi dengan menggunakan spektrofotometer 22
Ppm (x) %T
5 ppm 90,3
20 ppm 71,3
35 ppm 51,6
50 ppm 46,4
65 ppm 32,9
80 ppm 24,7
Air sampel 80,3
Tabel 7.7.1.Data hasil perhitungan panjang gelombang (λ) dengan menggunakan spektrofotometer 22.
λ(nm) %T A
410 nm 23,9 0,621
420 nm 24,0 0,619
430 nm 24,3 0,614
440 nm 24,7 0,607
450 nm 25,1 0,600
460 nm 25,4 0,595
470 nm 25,6 0,591
480 nm 28,6 0,543
490 nm 28,4 0,546
500 nm 29,2 0,534
510 nm 29,8 0,525
520 nm 29,9 0,524
Tabel 7.7.2. Data hasil perhitungan kurva kalibrasi dengan menggunakan spektrofotometer 22
Ppm (x) %T A
5 ppm 90,3 0,044
20 ppm 71,3 0,146
35 ppm 51,6 0,287
50 ppm 46,4 0,333
65 ppm 32,9 0,482
80 ppm 24,7 0,607
Sampel 1 80,3 0,514
Tabel 7.7.3. Data hasil penentuan kadar SO4 dalam sampel
ppm (X) A (Y) X2 X . Y
5 ppm 20 ppm 35 ppm 50 ppm 65 ppm 80 ppm 0,044 0,146 0,287 0,333 0,482 0,607 25 400 1225 2500 4225 6400 0,220 2,920 10,045 16,650 31,330 48,560 ∑X = 255 ∑Y = 1,89 ∑ X2 = 14775 ∑
X.Y = 109,725
Sampel λ = 410 A = 0,514
400 420 440 460 480 500 520 0.46
0.48 0.5 0.52 0.54 0.56 0.58 0.6 0.62 0.64
Panjang Gelombang ()
A
bs
or
ba
n
(A
)
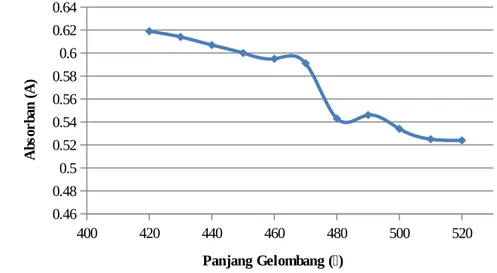
Grafik 7.8.1. Hubungan antara absorban (A) dan panjang gelombang (λ) menggunakan spektrofotometer 22
0 10 20 30 40 50 60 70 80 90
0 0.2 0.4 0.6 0.8 1
f(x) = 0x^2 + 0.01x + 0.01 R² = 0.99
Panjang Gelombang ()
A
bs
or
ba
n
(A
)
Grafik 7.8.2. Hubungan antara absorban (A) dan konsentrasi (ppm) dengan menggunakan spektrofotometer 22
7.9. Persamaan Reaksi
K2SO4 (s) + BaCl2.2H2O(s) 2KCl (aq) + BaSO4 (aq) + 2H2O (l) (kalium sulfat) (barium klorida) (kalium klorida) (barium sulfat) (air)
- Berdasarkan grafik 7.8.1. diperoleh transmitan (%T) sebesar 23,9 % dan absorban (A) sebesar 0,621 ppm pada panjang gelombang maksimum (λ) sebesar 410 nm. Panjang gelombang maksimum ini didapatkan dari transmitan yang paling kecil dan absorban yang paling besar. Hal ini sesuai dengan teori bahwa panjang gelombang yang paling sesuai ditentukan dengan membuat spektrum absorbsi, dimana panjang gelombang yang sesuai adalah yang menghasilkan absorbansi paling besar. Penambahan barium klorida berfungsi untuk memperoleh endapan barium sulfat dan menjadikan larutan keruh sehingga dapat dibaca oleh spektrofotometer.
- Berdasarkan grafik 7.8.2. data hasil perhitungan kurva kalibrasi dengan menggunakan spektrofotometer 22, konsentrasi larutan 5 ppm menghasilkan absorban sebesar 0,044, sedangkan konsentrasi larutan 80 ppm menghasilkan absorban sebesar 0,607. Hal ini sesuai dengan teori bahwa hubungan antara konsentrasi dan absorban adalah berbanding lurus.
- Berdasarkan hasil percobaan, didapatkan adanya ion sulfat yang terkandung dalam air kran yang dijadikan sebagai sampel dengan konsentrasi 50,947 ppm. Kadar sulfat yang dihasilkan bernilai positif dan sesuai dengan teori yang ada.
7.11. Kesimpulan
- Metode analisa pada spektrofotometri merupakan metoda analisa meng-gunakan cahaya monokromatik sebagai sumber cahaya. Selanjutnya cahaya akan diteruskan menuju kuvet tempat sampel diletakkan. Kemudian dibaca oleh detektor yang akan disampaikan pada layar pembaca.
- Salah satu pengaplikasian spektrofotometri dalam kehidupan sehari-hari adalah untuk menentukan zat organik dan anorganik secara kualitatif dan kuantitatif.