OPTIMASI PEREAKSI AMONIUM MOLIBDAT PADA PENETAPAN KADAR FOSFOR SECARA SPEKTROFOTOMETER SINAR TAMPAK
DENGAN METODA RESPON PERMUKAAN
SKRIPSI
OLEH :
FERI HADIYANTO 020814005
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2009
Feri Hadiyanto : Optimasi Pereaksi Amonium Molibdat Pada Penetapan Kadar Fosfor Secara Spektrofotometer Sinar Tampak Dengan Metoda Respon Permukaan, 2009
ABSTRAK
Telah dilakukan pengukuran serapan fosfor dengan spektrofotometer sinar tampak menggunakan larutan campuran 15 ml amonium molibdat, 50 ml asam sulfat, 30 ml asam askorbat, dan 5 ml kalium antimonil tartrat yang membentuk larutan berwarna biru yang dapat diukur pada panjang gelombang maksimum 700 nm.
Optimasi pengukuran serapan dilakukan dengan mengubah komposisi larutan campuran tersebut. Metode optimasi yang dipilih adalah metode respon permukaan.
Proses optimasi bisa mempengaruhi stabilitas larutan campuran. Hal ini disebabkan peningkatan pH setelah proses optimasi. Penelitian untuk memilih komposisi larutan campuran yang sensitif dan stabil telah dilakukan.
Hasil penelitian menunjukkan larutan campuran yang mengandung 21,86 ml (22,83%) amonium molibdat, 26,74 ml (27,92%) asam sulfat, 30 ml (31,33%) asam askorbat, dan 17,16 ml (17,92%) kalium antimonil tartrat dapat stabil selama satu jam. Dengan larutan standar KH2PO4, larutan campuran tersebut memiliki
sensitivitas (slope) sebesar 0,3605 dan limit deteksi 1 ppm.
ABSTRACT
The absorbance measurement of phosphorus was carried out with visible spectrophotometer by using a mixed solution of 15 ml ammonium molybdate, 50 ml sulfuric acid, 30 ml ascorbic acid, and 5 ml potassium antimony tartar which formed a blue color solution which could be measured at a maximum wavelength of 700 nm.
The absorbance measurement optimization was carried out by changing the mixed solution composition. The variable-size simplex method was chosen for optimization.
The optimization processes were able to influence the mixed solution stability. This owing to a rise in pH after optimization processes. A research for choosing a sensitive and a stable mixed solution composition had been done.
The research result showed that a mixed solution which contained 21,86 ml (22,83%) ammonium molybdate, 26,74 ml (27,92%) sulfuric acid, 30 ml (31,33%) ascorbic acid, and 17,16 ml (17,92%) potassium antimony tartar could stabilize for one hour. With a KH2PO4 standard solution, the mixed solution had a
sensitivity (slope) of 0,3605 and a detection limit of 1 ppm.
DAFTAR ISI
Halaman
JUDUL ...………... 1
ABSTRAK ...………... 2
ABSTRACT………... 3
DAFTAR ISI……….. 4
DAFTAR TABEL………..……… 7
DAFTAR GAMBAR……….……... 8
DAFTAR LAMPIRAN………..…... 9
BAB I PENDAHULUAN ..………... 10
1.1.Latar Belakang ...………. 10
1.2.Perumusan Masalah ……… 12
1.3.Hipotesis ………... 12
1.4.Tujuan Penelitian ...………. 13
BAB II TINJAUAN PUSTAKA ………... 14
2.1. Respon Permukaan ………. 14
2.1.1. Eksperimen Skrining …...………... 15
2.1.2. Rancangan Pusat Komposit ……….. 17
2.1.3. Pengujian Model ……… 19
2.2. Fosfor ……… 20
2.3. Spektrofotometri ………...… 21
2.4. Spektrofotometri Sinar Tampak ……… 21
2.5. Sensitivitas dan Limit Deteksi ……….. 22
BAB III METODOLOGI PENELITIAN ... 23
3.1. Tempat Kerja ……….…………... 23
3.2. Alat-Alat………...… 23
3.3. Bahan-Bahan …………...……….... 23
3.4. Pembuatan Pereaksi ...………... 23
3.4.1. Larutan standar fosfor 100 ppm……….… 23
3.4.2. Larutan amonium molibdat 4% (b/v)………...….. 23
3.4.3. Larutan asam sulfat 5 N……….… 23
3.4.4. Larutan asam askorbat (b/v) ………... 24
3.4.5. Larutan kalium antimonil tartrat (b/v) ……….….. 24
3.4.6. Larutan campuran ..……….... 24
3.5. Prosedur Penelitian ………... 24
3.5.1.Pengukuran Serapan Beberapa Komposisi Larutan Campuran Untuk Pembakuan Satu Faktor ... 24
3.5.2.Penentuan Proses Optimasi Masing-Masing Pereaksi dengan Larutan Standar Fosfor dengan Proses Tiga Faktor ... 25
3.5.3.Penentuan Stabilitas Larutan Campuran Terhadap Waktu dengan Percobaan Blanko ……….….. 26
3.5.4. Penentuan Waktu Kerja……….. 26
3.5.6. Penentuan Panjang Gelombang Maksimum ..……… 27
BAB IV HASIL DAN PEMBAHASAN ... 28
4.1. Pengukuran Serapan Beberapa Komposisi Larutan Campuran Untuk Pembakuan Satu Faktor ………... 28
4.2. Penentuan Proses Optimasi Masing-Masing Pereaksi dengan Larutan Standar Fosfor dengan Proses Tiga Faktor ... 29
4.2.1. Hasil Titik Optimum dari Masing Masing Faktor ... 33
4.3.Penentuan Stabilitas Serapan Larutan Campuran dengan Percobaan Blangko ... 35
4.4. Penentuan Waktu Kerja ... 36
4.5. Penentuan Panjang Gelombang Maksimum ... 37
BAB V KESIMPULAN DAN SARAN……….... 38
5.1. Kesimpulan ………..….………..…... 38
5.2. Saran………..………. 38
DAFTAR PUSTAKA………... 39
DAFTAR TABEL
Tabel Halaman
1. Ukuran Sampel untuk Fraksional Faktorial Standar ...16
2. Nama Variable dan Level untuk Eksperiment Awal ……….…. 16
3. Lembar Kerja untuk 16 Perlakuan eksperimen skrining …..………... 16
4. Model Lima Level Center Composite Design Tiga Faktor ………... 18
5. Lembar Kerja Model Lima Level Center Composite Design Tiga Faktor ...18
6. Skrining Komposisi Larutan Campuran pada Percobaan Awal dengan Larutan Standar Fosfor ………...24
7. Optimasi Komposisi Larutan Campuran dengan Larutan Standar Fosfor ... 25
8. Rentang Volume Pereaksi untuk Proses Skrining ………... 28
9. Skrining Komposisi Larutan Campuran pada Percobaan Awal dengan Larutan Standar Fosfor 6 ppm ……… 29
10. Rentang Volume Pereaksi untuk Proses Optimasi ... 30
11. Rentang Volume Pereaksi untuk Proses Optimasi menurut Kodingnya ... 30
12. Hasil Optimasi Komposisi Larutan Campuran dengan Larutan Standar Fosfor 1 ppm ……….… 30
13. Hasil Serapan Larutan Campuran Pada Titik Optimal Selama 60 Menit ... 36
DAFTAR GAMBAR
Gambar Halaman
1. Kontur plot serapan dari interaksi antara amonium dengan sulfat ... 32
2. Kontur plot serapan dari interaksi antara kalium dengan amonium ... 32
3. Kontur plot serapan dari interaksi antara kalium dengan sulfat ... 33
4. Kurva optimasi amonium vs sulfat menggunakan minitab v14.7 ... 34
5. Kurva optimasi kalium vs amonium menggunakan minitab v14.7 ... 34
6. Kurva optimasi sulfat vs kalium menggunakan minitab v14.7 ... 35
7. Kurva Waktu Kerja Larutan Standar Fosfor 1 ppm pada Panjang Gelombang 700 nm ... 36
8. Kurva Serapan Larutan Standar Fosfor 1 ppm. ... 37
DAFTAR LAMPIRAN
Lampiran Halaman 1. Perhitungan percobaan awal (skrining) ………... 41 2. Perhitungan untuk mendapatkan nilai titik optimum
dari masing-masing faktor ………..…….… 42 3. Data Penentuan Waktu Kerja …………...……… 46 4. Data Penentuan Panjang Gelombang Maksimum ………..…. 49
BAB I PENDAHULUAN
1.1.Latar Belakang
Fosfor adalah unsur kimia yang memiliki lambang P dengan nomor atom 15. Fosfor merupakan unsur penting dalam makhluk hidup. Kegunaan fosfor yang terpenting adalah dalam pembuatan pupuk, dan secara luas digunakan dalam bahan peledak, korek api, kembang api, pestisida, odol, dan deterjen (http://id.wikipedia.org).
Pemeriksaan kuantitatif untuk fosfor dilakukan secara spektrofotometri sinar tampak dengan menggunakan larutan campuran 15 ml amonium molibdat, 50 ml asam sulfat 5 N, 30 ml asam askorbat, dan 5 ml kalium antimonil tartrat yang membentuk larutan berwarna biru dan dapat diukur pada panjang gelombang maksimum 700 nm (Walinga, 1989).
Dalam medium asam, ortofosfat membentuk kompleks berwarna kuning dengan ion molibdat. Dengan adanya asam askorbat dan antimon, kompleks fosfomolibdat berwarna biru terbentuk. Warna biru dapat bervariasi tergantung dari kondisi redoks medium dan pH. Antimon ditambahkan untuk melengkapi reduksi kompleks fosfomolibdenum kuning menjadi kompleks fosfomolibdenum biru. Lebih jauh lagi, antimon meningkatkan intensitas warna biru dan menyebabkan pengukuran serapan yang lebih sensitif (Walinga, 1995). Sensitivitas merupakan slope dari kurva kalibrasi yang linear (Miller & Miller, 1988).
Berdasarkan uraian di atas dapat diketahui bahwa sensitivitas pengukuran serapan dapat tercapai dengan menambah kalium antimonil tartrat dalam komposisi larutan campuran. Selain itu, mengubah pH larutan campuran dengan mengubah komposisi asam sulfat juga dapat mengoptimasi serapan.
Perubahan pH setelah proses optimasi diduga dapat mengganggu stabilitas larutan campuran. Bagaimanapun juga, reagensia amonium molibdat yang ditambahkan pada larutan fosfat harus bersifat asam kuat (Vogel, 1985). Peneliti akan menguji stabilitas beberapa komposisi larutan campuran terhadap waktu.
Untuk mendapatkan hasil optimasi yang benar, maka diperlukan suatu metode yang dapat mengoptimasi semua faktor. Dalam hal ini peneliti menggunakan metoda respon permukaan. Metode ini menggabungkan teknik matematika dengan teknik statistika yang digunakan untuk membuat dan menganalisa suatu respon Y yang dipengaruhi oleh beberapa variabel bebas atau faktor X guna mengoptimalkan respon tersebut (Montgomery, 2001).
Metode respon permukaan meliputi beberapa faktor eksperimen untuk mempersempit dan mengoptimalkan variabel faktor X yang akan digunakan terhadap respon Y. Dengan menggunakan software minitab v14.7 nilai dari masing-masing faktor X terhadap respon Y dapat ditunjukkan telah menghasilkan optimasi (maksimal) dengan bentuk kurva tiga dimensi yg memuncak (www.chemistry-math.org).
Berdasarkan uraian di atas, peneliti tertarik untuk mengoptimasi stabilitas larutan campuran dan sensitivitasnya pada penetapan kadar fosfor secara spektrofotometri sinar tampak dengan metode respon permukaan.
1.2.Perumusan Masalah
Berdasarkan uraian di atas, maka permasalahan pada penelitian ini dapat dirumuskan sebagai berikut:
1. Berapa komposisi masing-masing pereaksi pada larutan campuran yang stabil dan menghasilkan pengukuran serapan yang sensitif pada penetapan kadar fosfor secara spektrofotometri sinar tampak.
2. komposisi masing-masing pereaksi pada larutan campuran yang stabil dan menghasilkan pengukuran serapan yang sensitif pada penetapan kadar fosfor secara spektrofotometri sinar tampak menunjukkan optimasi dengan bentuk kurva yang memuncak (maksimum).
1.3.Hipotesis
Diduga bahwa:
1. Komposisi larutan campuran mempengaruhi stabilitasnya dan sensitivitas pengukuran serapan pada penetapan kadar fosfor secara spektrofotometri sinar tampak.
2. komposisi masing-masing pereaksi pada larutan campuran yang stabil dan menghasilkan pengukuran serapan yang sensitif pada penetapan kadar fosfor secara spektrofotometri sinar tampak menunjukkan optimasi dengan bentuk kurva yang memuncak.
1.4.Tujuan Penelitian
1. Mengetahui berapa komposisi masing-masing pereaksi pada larutan campuran yang stabil dan menghasilkan pengukuran serapan yang sensitif pada penetapan kadar fosfor secara spektrofotometri sinar tampak.
2. Mengetahui bagaimana bentuk kurva optimasi yang terbentuk.
BAB II
TINJAUAN PUSTAKA
2.1. Respon Permukaan
Response Surface Methodology (RSM) merupakan kumpulan teknik matematik dan statistik yang digunakan untuk modeling dan analisis permasalahan pada respon yang dipengaruhi oleh beberapa variabel dan bertujuan memperoleh optimasi respon (Montgomery, 2001). RSM merupakan teknik statistik digunakan untuk penelitian yang mempunyai proses komplek dan dipergunakan secara luas dalam penelitian teknologi pangan. Kecocokan model orde dua Central Composite Design (CCD) banyak digunakan. Secara umum, CCD mempunyai faktorial 2k dengan banyak data (nf), sumbu (2k), dan pusat (nc).
CCD sangat efisien untuk kecocokan model orde dua. Dua parameter dalam
spesifik design adalah jarak sumbu α yang dijalankan dari pusat design dan jumlah titik pusat nc (Montgomery, 2001).
Respon permukaan menjelajah hubungan antara beberapa variabel bebas dengan suatu respon. Metode ini menggunakan satu set percobaan yang secara umum dirancang untuk mendapatkan respon yang optimal dari sekian banyak variable bebas. Untuk memperkirakan langkah pertama yg jumlah variabelnya banyak adalah menggunakan desain eksperimen yang dapat mengurangi jumlah variabel bebas yang hampir tidak memiliki efek terhadap suatu respon, umumnya dilakukan dengan eksperimen skrining (model dua level), kemudian dilanjutkan dengan rancangan eksperimen yang lebih kompleks, seperti memperkirakan
variabel bebas yang terbaik dengan rancangan pusat komposit (model lima level). Respon permukaan dapat digunakan untuk mengoptimalkan, meminimalkan atau mencapai target tertentu untuk suatu respon (http//www.wikipedia.org).
Eksperimen dengan menggunakan metode respon permukaan mempunyai tujuan (Petersen,1985) yaitu :
1. Mencari fungsi respon sebagai model yang menunjukkan hubungan antara variabel-variabel bebas dan variabel-variabel respon.
2. Menentukan nilai stasioner yaitu nilai variabel bebas yang menghasilkan respon optimal. Langkah-langkah metode respon permukaan adalah sebagai berikut : - Menentukan tujuan penelitian.
- Menentukan variabel respon yang akan diukur, variabel bebas yang berpengaruh terhadap respon dan menentukan range variabel bebas agar didapatkan hasil yang layak.
- Membuat rancangan orde pertama (Screening Design).
- Membuat model orde pertama dan menguji model untuk dapat melanjutkan ke percobaan orde kedua.
- Membuat rancangan percobaan orde kedua (Central Composite Design). - Membuat model orde kedua dan menguji apakah model sesuai dengan model yang diduga.
- Menentukan kondisi optimum dari model orde kedua yang sesuai. 2.1.1. Eksperimen Skrining (Screening Experiment)
Ekperimen skrining mengidentifikasi faktor-faktor yang memiliki efek penting dan faktor-faktor yang tidak memiliki efek penting. Tujuan dari eksperimen skrining adalah untuk mempersempit jumlah variabel.
Ekperimen ini meliputi rancangan faktorial, ukuran sampel untuk faktorial standar adalah seperti pada table berikut ini :
Table 1. Ukuran Sampel untuk Fraksional Faktorial Standar. Jumlah faktor Jumlah perlakuan
3 8
Faktor-faktor yang meliputi eksperimen skrining dan pengaturannya ditunjukkan pada table 2, sebagai contoh dengan menggunakan 4 (empat) jumlah faktor.
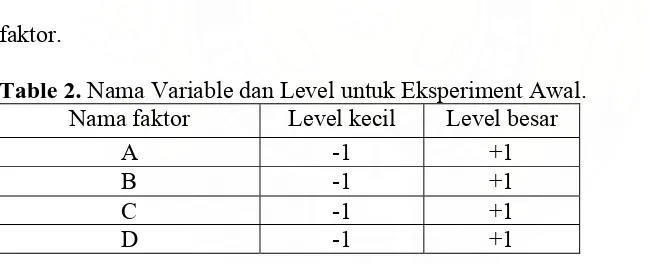
Table 2. Nama Variable dan Level untuk Eksperiment Awal. Nama faktor Level kecil Level besar
A -1 +1
B -1 +1
C -1 +1
D -1 +1
Desain eksperimen yang digunakan untuk eksperimen skrining ditunjukkan pada table 3 dengan 16 perlakuan dari 4 jumlah faktor. Dikenal sebagai desain faktorial (Haaland, 1989).
Table 3. Lembar Kerja untuk 16 Perlakuan eksperimen skrining.
6 -1 +1 -1 +1
2.1.2. Rancangan Pusat Komposit (Central Composite Design)
Central Composite Design (CCD)harus memiliki paling sedikit tiga level untuk setiap faktor, karena apabila level faktor lebih kecil dari tiga level maka koefisien kuadratik tidak dapat diduga (Peterson,1985). CCD terdiri dari rancangan faktorial 2k ditambah pengamatan pada titik pusat (center point) dan titik aksial (axial points) (Khuri and Cornell,1996). Dinyatakan dalam persamaan berikut:
Jika k = 3, maka persamaan diatas menjadi :
= 0 + 1X1 + 2X2 + 3X3 + 11X12 + 22X22 + 33X32 + 12X1 X2 + 13X1
X3 + 23X2 X3
- adalah respon
- β0, βi, βii, βij adalah koefesien dari variabel bebas.
- X adalah variabel bebas tanpa kode.
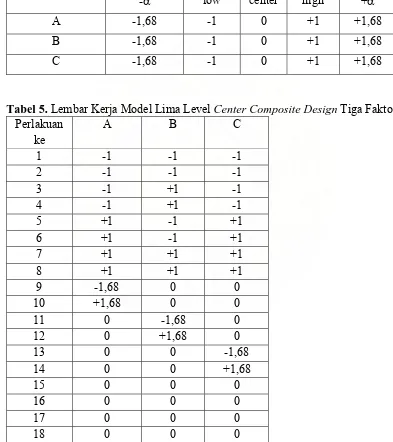
Pada tabel 4 berikut ini adalah pemodelan lima level untuk central composite 3 (tiga) faktor, dan pada tabel 5 berikut adalah lembar kerja model lima level center compositedesign 3 (tiga) faktor (Haland, 1989).
Tabel 4. Model Lima Level Center Composite Design Tiga Faktor. Level
2.1.3. Pengujian Model
Pengujian model lima level Center Composite Design dilakukan dengan analisis varians / Tabel Anova (Khuri, and Cornell, 1996) sebagai berikut:
SST = Y Y
SSmean =
SScorr = (Y– ) (Y– )
SSfact = (X _ ) (X _ )
SSr = (Y – ) (Y – X )
SSlof = (J – X ) (J – X )
SSpe = (Y – J) (Y– J)
2.2. Fosfor
Fosfor adalah unsur kimia yang memiliki lambang P dengan nomor atom 15. Fosfor berupa nonlogam, bervalensi banyak, termasuk golongan nitrogen, banyak ditemui dalam batuan fosfat anorganik dan dalam semua sel hidup tetapi tidak pernah ditemui dalam bentuk unsur bebasnya. Fosfor amatlah reaktif, memancarkan pendar cahaya yang lemah ketika bergabung dengan oksigen, ditemukan dalam berbagai bentuk, dan merupakan unsur penting dalam makhluk hidup. Kegunaan fosfor yang terpenting adalah dalam pembuatan pupuk, dan secara luas digunakan dalam korek api, kembang api, pestisida, odol, dan deterjen (http://id.wikipedia.org).
Fosfor termasuk salah satu mineral makro, yaitu mineral yang dibutuhkan tubuh manusia dalam jumlah yang besar (umumnya lebih dari 100 mg/hari). Mineral makro lainnya termasuk kalsium, magnesium, natrium, dan kalium (http://en.wikipedia.org). Perbandingan kandungan kalsium dan fosfor dalam makanan dianjurkan 1:1 (Ganiswarna, 1995).
2.3. Spektrofotometri
Spektrofotometri serapan merupakan pengukuran suatu interaksi antara radiasi elektromagnetik dan molekul atau atom dari suatu zat kimia. Teknik yang sering digunakan dalam analisis farmasi meliputi spektroskopi serapan ultraviolet, cahaya tampak, inframerah, dan serapan atom. Pengukuran spektrofotometri di dalam daerah cahaya tampak awal disebut kolorimetri; tetapi istilah “kolorimetri” lebih tepat digunakan untuk persepsi tentang warna (Ditjen POM, 1995).
Jangkauan panjang gelombang yang tersedia untuk pengukuran membentang dari panjang gelombang pendek ultraviolet sampai ke inframerah. Untuk kemudahan pengacuan, daerah spektrum ini pada garis besarnya dibagi dalam daerah ultraviolet (190 nm hingga 380 nm), daerah cahaya tampak (380 nm hingga 780 nm), daerah inframerah dekat (780 nm hingga 3000 nm), dan daerah inframerah (2,5 m hingga 40 m atau 4000 cm-1 hingga 250 cm-1) (Ditjen POM, 1995).
Spektrometer adalah alat yang menghasilkan sinar dari spektrum dan panjang gelombang tertentu, dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau yang diabsorpsi. Jadi spektrofotometer digunakan untuk mengukur energi secara relatif jika energi tersebut ditransmisikan, direfleksikan, atau diemisikan sebagai fungsi dari panjang gelombang (Khopkar, 2002).
2.4. Spektrofotometri Sinar Tampak
Spektroskopi sinar tampak adalah spektroskopi yang dilakukan menggunakan energi radiasi pada panjang gelombang antara 380 dan 800 nm.
Dikatakan spektroskopi sinar tampak karena rentang panjang gelombang ini dapat dideteksi oleh mata manusia (Bender, 1987).
Warna yang terlihat dari objek umumnya disebabkan oleh interaksi antara sinar polikromatis dan objek. Interaksi ini mengakibatkan panjang gelombang yang tidak terabsorbsi dipantulkan ke mata kita (Bender, 1987).
Konsentrasi dari suatu larutan bisa ditentukan dengan mengukur absorban pada panjang gelombang tertentu dengan menggunakan Hukum Lambert-Beer. Biasanya hukum Lambert-Beer ditulis dengan:
A = .b.c A = absorban (serapan)
= koefisien ekstingsi molar (M-1cm-1) b = tebal kuvet (cm)
c = konsentrasi (M) (Dachriyanus, 2004). Parameter radiasi yang dilewatkan melalui larutan disebut transmitan T. Hubungan antara T dengan A adalah A = - log T (Satiadarma, 2004).
2.5. Sensitivitas dan Limit Deteksi
Sensitivitas adalah slope dari kurva kalibrasi yang linear (Miller & Miller, 1988). Jika sensitivitas tinggi, maka limit deteksi rendah. Limit deteksi adalah hasil bagi tiga kali simpangan baku blangko dengan slope (http://jurnal.farmasi.ui.ac.id).
BAB III
METODOLOGI PENELITIAN
3.1. Tempat Kerja
Penelitian dilakukan di Pusat Penelitian Kelapa Sawit (PPKS). 3.2. Alat-Alat
Alat-alat yang digunakan dalam penelitian ini adalah Spektrofotometri UV-Sinar Tampak (Perkin Elmer Lambda 3 PE), neraca listrik (Mettler AE 200), dan alat-alat gelas.
3.3. Bahan-Bahan
Semua bahan yang digunakan dalam penelitian ini berkualitas pro analisis keluaran E. Merck, yaitu kalium dihidrogen fosfat, amonium molibdat, asam sulfat, asam askorbat, dan kalium antimonil tartrat.
3.4. Pembuatan Pereaksi
Pembuatan pereaksi berdasarkan Walinga (1989). 3.4.1. Larutan standar fosfor 100 ppm
Kalium dihidrogen fosfat sebanyak 0,2195 gram dilarutkan dengan 500 ml H2SO4 0,36 N.
3.4.2. Larutan amonium molibdat 4% (b/v)
Amonium molibdat sebanyak 4 gram dilarutkan dalam 100 ml air suling. 3.4.3. Larutan asam sulfat 5 N
Larutan H2SO4 96% sebanyak 70 ml diencerkan dengan air suling hingga
500 ml.
3.4.4. Larutan asam askorbat
Asam askorbat sebanyak 0,889 gram dilarutkan dalam 50 ml air suling. 3.4.5. Larutan kalium antimonil tartrat
Kalium antimonil tartrat sebanyak 0,274 gram dilarutkan dengan 100 ml air suling.
3.4.6. Larutan campuran
Larutan amonium molibdat 4% sebanyak 15 ml dicampurkan dengan asam sulfat 5 N sebanyak 50 ml, lalu ditambah dengan 30 ml larutan asam askorbat, diaduk. Kemudian dicampur dengan 5 ml larutan kalium antimonil tartrat dan diaduk.
3.5. Prosedur Penelitian
3.5.1. Pengukuran Serapan Beberapa Komposisi Larutan Campuran Untuk Pembakuan Satu Faktor.
Pembuatan larutan campuran sama dengan cara yang tertulis dalam buku Walinga (1989) tetapi komposisi larutannya disesuaikan dengan rumus rancangan faktorial standar yaitu secara skrining untuk percobaan awal dengan rentang volume berdasarkan tabel berikut ini :
Tabel 6. Skrining Komposisi Larutan Campuran pada Percobaan Awal dengan Larutan Standar Fosfor.
4 5 30 45 7
3.5.2. Penentuan Proses Optimasi Masing-Masing Pereaksi dengan Larutan Standar Fosfor dengan Proses Tiga Faktor.
Tabel 7. Optimasi Komposisi Larutan Campuran dengan Larutan Standar Fosfor. Perlakuan
ke
Ammonium molibdat (ml)
7 23 28 18
8 23 28 18
9 20,3182 27 17
10 23,6818 27 17
11 22 25,3182 17 12 22 28,6818 17
13 22 27 15,3182
14 22 27 18,6818
15 22 27 17
16 22 27 17
17 22 27 17
18 22 27 17
3.5.3. Penentuan Stabilitas Larutan Campuran Terhadap Waktu dengan Percobaan Blanko.
Dipilih larutan campuran yang telah dioptimasi. Diambil 1 ml, lalu ditambah dengan 6 ml air suling, lalu dikocok dan didiamkan selama x menit, lalu diukur serapannya secara spektrofotometri sinar tampak pada panjang gelombang 700 nm selama 1 jam.
3.5.4. Penentuan Waktu Kerja.
Larutan standar fosfor 100 ppm dipipet sebanyak 5 ml, lalu dimasukkan ke dalam labu ukur 100 ml dan dicukupkan volumenya dengan air suling sampai garis tanda (5 ppm). Dari larutan tersebut dipipet 20 ml, lalu dimasukkan ke dalam labu takar 100 ml dan dicukupkan volumenya dengan air suling sampai garis tanda (1 ppm). Dari larutan standar 1 ppm dipipet 1 ml dan ditambahkan 5 ml air suling dan 1 ml larutan campuran yang telah dipilih, lalu dikocok. Diukur
serapannya secara spektrofotometri sinar tampak pada panjang gelombang 700 nm setiap 2 menit selama 3 jam.
3.5.6. Penentuan Panjang Gelombang Maksimum
larutan standar fosfor (100 mcg/ml) dipipet sebanyak 6 ml, lalu dimasukkan kedalam labu ukur 100 ml dan dicukupkan volumenya dengan air suling sampai batas garis tanda (6 mcg/ml). Dari larutan tersebut dipipet 1 ml dan ditambahkan 5 ml air suling dan 1 ml larutan campuran, dikocok dan didiamkan selama 15 menit, lalu diukur serapannya secara spektrofotometri sinar tampak pada panjang gelombang 625-720 nm sehingga diperoleh panjang gelombang maksimum.
BAB IV
HASIL DAN PEMBAHASAN
4.1. Pengukuran Serapan Beberapa Komposisi Larutan Campuran Untuk Pembakuan Satu Faktor.
Dari perlakuan secara proses skrining diperoleh satu faktor yang akan ditentukan sebagai faktor konstan yaitu faktor yang paling tidak berpengaruh dalam meningkatkan serapan yaitu dengan menggunakan komposisi pereaksi seperti tabel berikut:
Tabel 8. Rentang Volume Pereaksi untuk Proses Skrining. Larutan Volume
terkecil
Volume tengah
Volume terbesar
Ammonium molibdat 4%
5 ml 15 ml 25 ml
asam sulfat 5 N 30 ml 50 ml 70 ml Asam Askorbat 15 ml 30 ml 45 ml Kalium antimonil tartrat 3 ml 5 ml 7 ml
Hasil dari percobaan awal yang dilakukan adalah seperti pada table 4 berikut:
Tabel 9. Skrining Komposisi Larutan Campuran pada Percobaan Awal dengan Larutan Standar Fosfor 6 ppm.
Perlakuan
Dari skrining komposisi larutan campuran pada percobaan awal diperoleh satu faktor konstan yaitu asam askorbat dengan nilai 0,005. Data perhitungan skrining dapat dilihat pada lampiran 1.
4.2. Penentuan Proses Optimasi Masing-Masing Pereaksi dengan Larutan Standar Fosfor dengan Proses Tiga Faktor.
Dari percobaan awal (skrining) dapat ditentukan tiga faktor pereaksi yang akan digunakan untuk penentuan nilai optimasi absorbansi yaitu Amonium Molibdat, Asam Sulfat, dan Kalium Antimonil
Selanjutnya penentuan volume dari masing-masing pereaksi ketiga faktor tersebut ditentukan peneliti secara estimasi dengan berdasarkan rumus rancangan pusat komposit tiga faktor (Khuri and Cornell,1996).
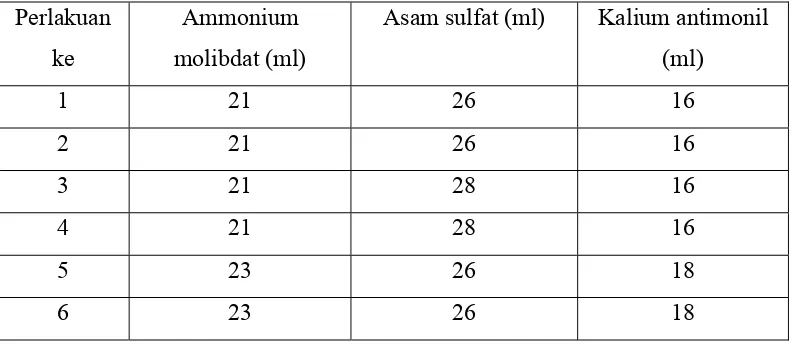
Volume tengah masing-masing pereaksi adalah 22 ml amonium molibdat, 27 ml asam sulfat, dan 17 ml kalium antimonil dengan rentang volume sebesar 1 ml pada masing-masing pereaksi sesuai tabel berikut :
Tabel 10. Rentang Volume Pereaksi untuk Proses Optimasi. Larutan Volume
Tabel 11. Rentang Volume Pereaksi untuk Proses Optimasi menurut Kodingnya. Larutan Koding terkecil Koding terbesar Ammonium molibdat 4% 20,3182 ml 23,6818 ml
asam sulfat 5 N 25,3182 ml 28,6818 ml Kalium Antimonil 15,3182 ml 18,6818 ml
Dari tabel di atas, komposisi larutan campuran yang memiliki serapan terbesar adalah komposisi yang ke-6 (serapan = 0,384) sedangkan komposisi larutan campuran yang memiliki serapan terkecil adalah komposisi yang ke-7 (serapan = 0,318). Jika dibandingkan kedua komposisi tersebut, dapat diketahui bahwa meningkatnya serapan (berkurangnya stabilitas) larutan campuran disebabkan oleh meningkatnya jumlah amonium molibdat dan menurunnya jumlah asam sulfat (meningkatnya pH) dalam komposisi larutan campuran.
Jika dibandingkan ketiga komposisi pereaksi diatas maka ammonium molibdat lebih meningkatkan serapan larutan campuran dibandingkan dengan kalium antimonil tartrat. Namun, kalium antimonil tartrat lebih meningkatkan serapan larutan campuran dibandingkan dengan asam askorbat. (Dapat diketahui dengan membandingkan komposisi ke-2 dengan ke-5, dan ke-3 dengan ke-5). Hanya perbandingan antara komposisi yang ke-14 dengan ke-15 menunjukkan bahwa asam askorbat lebih meningkatkan serapan larutan campuran daripada kalium antimonil tartrat.
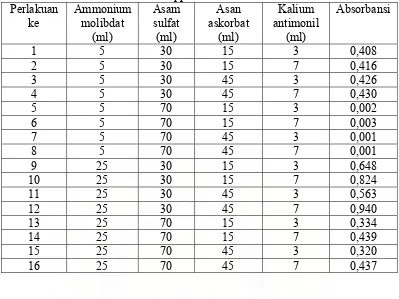
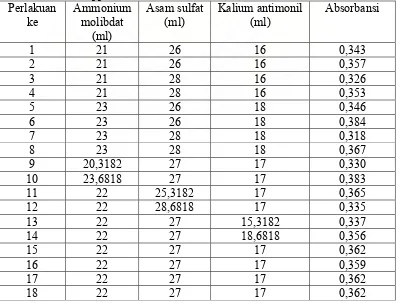
Berdasarkan percobaan, dapat diketahui bahwa faktor yang meningkatkan serapan larutan campuran adalah menurunnya jumlah asam sulfat, meningkatnya jumlah amonium molibdat dan kalium antimonil tartrat dalam komposisi larutan campuran. Dan lebih jelasnya lagi dapat digambarkan dengan contour plot berikut:
amonium
Contour Plot of absorb vs sulfat; amonium
Gambar 1. Kontur plot serapan dari interaksi antara amonium dengan sulfat.
amonium
Contour Plot of absorb vs kalium; amonium
Gambar 2. Kontur plot serapan dari interaksi antara kalium dengan amonium.
sulfat
Contour Plot of absorb vs kalium; sulfat
Gambar 3. Kontur plot serapan dari interaksi antara kalium dengan sulfat. 4.2.1. Hasil Titik Optimum dari Masing Masing Faktor.
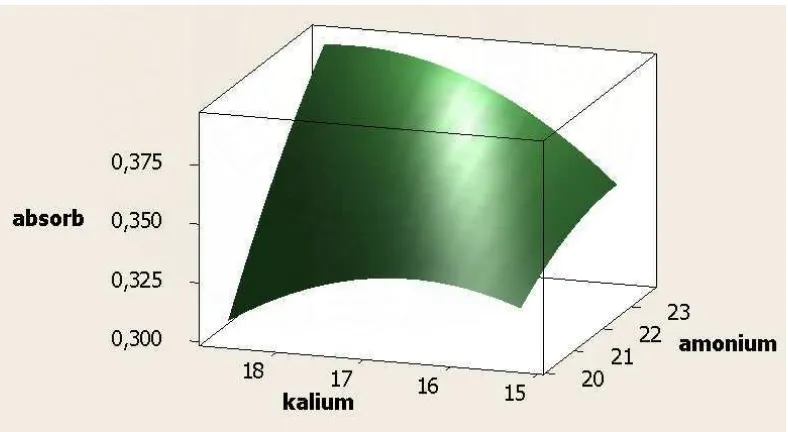
Dari beberapa komposisi larutan campuran diatas dapat ditentukan titik optimum dari masing masing faktor, data perhitungan optimasi dapat dilihat pada lampiran 2, nilai dari masing masing faktor optimum tersebut adalah :
21,86 ml untuk amonium 26,74 ml untuk sulfat 17,16 ml untuk kalium
Optimasi dari ketiga faktor diatas dibuktikan dengan bentuk kurva tiga dimensi yang membentuk puncak optimasi (chemistry-math.org) sebagai berikut :
Gambar 4. Kurva optimasi amonium vs sulfat menggunakan minitab v14.7.
Gambar 5. Kurva optimasi kalium vs amonium menggunakan minitab v14.7.
Gambar 6. Kurva optimasi sulfat vs kalium menggunakan minitab v14.7.
4.3. Penentuan Stabilitas Serapan Larutan Campuran dengan Percobaan Blangko.
Proses optimasi yang dilakukan bisa mempengaruhi stabilitas larutan campuran. Hal ini disebabkan peningkatan pH setelah proses optimasi. Maka diperlukan penelitian mengenai stabilitas larutan campuran terhadap waktu. Sebagai orientasi, dipilih komposisi larutan campuran pada titik optimal untuk dilakukan percobaan blangko.
Hasil pengukuran serapan larutan campuran yang telah dipilih pada panjang gelombang 700 nm dapat dilihat pada tabel di bawah ini:
Tabel 13. Hasil Serapan Larutan Campuran Pada Titik Optimal Selama 60 Menit. Waktu
(menit)
1 2 3 5 10 20 40 60
Serapan (A) 0,021 0,021 0,021 0,021 0,021 0,021 0,021 0,021
Berdasarkan hasil ini, terbukti bahwa komposisi larutan campuran pada titik optimal memiliki stabilitas yang baik.
4.4. Penentuan Waktu Kerja
Berdasarkan percobaan, kompleks biru fosfomolibdat yang stabil terjadi selama 22 menit setelah 146 menit. Data penentuan waktu kerja dapat dilihat pada Lampiran 4.
Gambar 7. Kurva Waktu Kerja Larutan Standar Fosfor 1 ppm pada Panjang Gelombang 700 nm.
4.5. Penentuan Panjang Gelombang Maksimum
Penentuan panjang gelombang maksimum fosfor dilakukan dengan menggunakan larutan standar fosfor 1 ppm dan komposisi larutan campuran yang telah dipilih. Data penentuan panjang gelombang maksimum dapat dilihat pada Lampiran 5.
panjang gelombang ( nm)
s
serapan ( A) vs panjang gelombang ( nm)
Gambar 8. Kurva Serapan Larutan Standar Fosfor 1 ppm.
Berdasarkan kurva di atas dapat dilihat bahwa serapan maksimum kompleks biru fosfomolibdat terjadi pada panjang gelombang 700 nm.
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Komposisi masing-masing larutan pada larutan campuran yang stabil dan menghasilkan pengukuran serapan yang sensitif pada penetapan kadar fosfor secara spektrofotometri sinar tampak adalah 21,86 ml (22,83%) amonium molibdat, 26,74 ml (27,92%) asam sulfat, 30 ml (31,33%) asam askorbat, dan 17,16 ml (17,92%) kalium antimonil tartrat dengan sensitivitas sebesar 0,3605 dengan limit deteksi 1 ppm.
2. komposisi masing-masing pereaksi pada larutan campuran yang stabil dan menghasilkan pengukuran serapan yang sensitif pada penetapan kadar fosfor secara spektrofotometri sinar tampak terbukti menunjukkan optimasi dengan bentuk kurva optimasi tiga dimensi yang memuncak (maksimum).
5.2. Saran
Peneliti merekomendasikan kepada para peneliti berikutnya untuk mencari titik optimal lainnya dengan limit deteksi yang lebih kecil dari 1 ppm.
DAFTAR PUSTAKA
- …..”Fosfor”
http://id.wikipedia.org. - …..”Macromineral”
http://en.wikipedia.org/wiki/Macromineral - …..”Response surface”.
http//www.wikipedia.org
- Bender, G.T. (1987). Principles of Chemical Instrumentation. Philadelphia: W.B.Saunders Company. Page. 34.
- Dachriyanus. (2004). Analisis Struktur Senyawa Organik Secara Spektroskopi. Padang: Andalas University Press. Hal. 1, 8.
- Ditjen POM. (1995). Farmakope Indonesia. Edisi Keempat. Jakarta: Departemen Kesehatan RI. Hal. 1061.
- Ganiswarna, S. (1995). Farmakologi dan Terapi. Edisi Keempat. Jakarta: Gaya Baru. Hal. 733.
- Haaland, perry. (1989). The Experimental Design in Biotechnology. Marcel Dekker, inc. New York. page.243.
- Khopkar, S.M. (2002). Konsep Dasar Kimia Analitik. Jakarta: Universitas Indonesia Press. Hal. 215.
- Khuri, Andre I., and John A. Cornell. (1996). Empirical Model Building and Respon Surface. New York: Marcell Dekker. page. 125 - 145.
- Miller, J.C. and Miller, J.N. (1988). Statistics For Analytical Chemistry. Second Edition. Chichester: Ellis Horwood Limited. Page. 117.
- Montgomery, D.C. (2001). Design and Analysis of Experiments. John Wiley & Sons, Inc. New York. page. 427-510.
- Satiadarma, K., dkk. (2004). Asas Pengembangan Prosedur Analisis. Edisi Pertama. Surabaya: Airlangga University Press. Hal. 48, 67.
- Vogel, A.I. (1985). Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Bagian Kedua. Edisi Kelima. Jakarta: PT Kalman Media Pustaka. Hal. 378.
- Walinga, I., et al. (1989). Plant Analysis Procedurs. Part 7. Netherlands: Waganingen Agricultural University. Page. 138-139.
- Walinga, I., et al. (1995). Plant Analysis Manual. Dordrecht: Kluwer Academic Publishers. Page. 31.
LAMPIRAN
Lampiran 1. Perhitungan percobaan awal (skrining) (+ ) – (- ) = faktor konstan
+ = absorbansi rata rata dari faktor besar. - = absorbansi rata rata dari faktor kecil.
• Ammonium 0,563 – 0,21087 = 0,352 • Asam Sulfat 0,192125 – 0,5818 = -0,389
• Asam Askorbat 0,38425 – 0,38425 = 0,005
• Kalium 0,43625 – 0,33775 = 0,098
Asam Askorbat terpilih sebagai faktor konstan karena memiliki nilai terkecil dengan mengabaikan tanda minus pada nilai faktor konstan tandingan lainnya.
Lampiran 2. Perhitungan untuk mendapatkan nilai titik optimum dari masing-masing faktor.
Parameter = 10
k = banyaknya faktor 3 f = 2k + 2k +1 15
... ( n=18 ) 18
. ....( n-1 ) 1 17
...( n-p )
9 8
( f-p ).... ...( n-f ) SScorr
SSfact SSr
SSlof SSpe
SSmean
SST
5 3 SST = Y Y
SSmean =
SScorr = (Y– ) (Y– )
SSfact = (X _ ) (X _ )
SSr = (Y – ) (Y – X )
SSlof = (J – X ) (J – X )
SSpe = (Y – J) (Y– J)
Table Anova
Sumber variasi (DK) (JK) (RJK) F Hitung Total (SST) 18 2,2423 0,124572 48851,76
Rata-rata (SSmean) 1 2,2366 2,2366 877098,0392
Koreksi (SScorr) 17 0,0057 0,000335294 149,0195
Efek faktor (SSfact) 9 0,0057 0,00063333 281,48
Residu (SSr) 8 0,000017172 0,000002146 0,9537
Ketidakcocokan (SSlof) 5 0,000010422 0,000002084 0,9262
Keslahan random (SSpe) 3 0,00000675 0,00000225
• Persaman yang dipakai:
= 0 + 1X1 + 2X2 + 3X3 + 11X12 + 22X22 + 33X32 + 12X1 X2 + 13X1
X3 + 23X2 X3
= 0,3605
• Titik optimum (stationary point)
X0 = -B-1 . b/2
b = 1 B =
2 3
11 12/2 13/2
12/2 22 23/2
13/2 23/2 33
X = 0.1423 0.2602 -0.1568
.
Amonium molibdat = X1 =21,857
Asam sulfat = X2 =26,739
Kalium antimonil = X3 =17,157
150 0,639 152 0,639 154 0,639 156 0,639 158 0,639 160 0,639 162 0,639 164 0,639 166 0,639 168 0,640 170 0,641 172 0,641 174 0,642 176 0,645 178 0,647 180 0,649
49 Lampiran 4. Data Penentuan Panjang Gelombang Maksimum.