SKRIPSI
PENETAPAN KADAR FOSFOR DALAM BUAH PETAI
(
Parkia speciosa
) SECARA SPEKTROFOTOMETRI
SINAR TAMPAK
OLEH:
MELISA
NIM 101524032
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENETAPAN KADAR FOSFOR DALAM BUAH PETAI
(
Parkia speciosa
) SECARA SPEKTROFOTOMETRI
SINAR TAMPAK
SKRIPSI
Diajukan untuk Melengkapi Salah Satu Syarat untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
MELISA
NIM 101524032
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
PENETAPAN KADAR FOSFOR DALAM BUAH PETAI (
Parkia
speciosa
) SECARA SPEKTROFOTOMETRI
SINAR TAMPAK
OLEH: MELISA NIM 101524032
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 24 November 2012
Disetujui Oleh:
Pembimbing I, Penguji,
Dra. Nurmadjuzita, M.Si., Apt. Prof. Dr. rer.nat. E. De Lux Putra., SU., Apt. NIP 194809041974122001 NIP 195306191983031001
Drs. Nurmadjuzita, M.Si., Apt. NIP 194809041974122001
Pembimbing II,
Dra. Tuty Roida Pardede., M.Si., Apt. NIP 195401101980032001
Drs. Fatur Rahman Harun, M.Si., Apt. NIP 195201041980031002
Drs. Siti Nurbaya, M.Si., Apt. NIP 195008261974122001
Medan, 24 November 2012 Fakultas Farmasi
Universitas Sumatra Utara Dekan,
KATA PENGANTAR Bismillahirrahmanirrahiim,
Puji syukur penulis ucapkan kepada Allah SWT atas segala limpahan
rahmat dan karuniaNya, sehingga penulis dapat menyelesaikan penelitian dan
penyusunan skripsi ini, serta Shalawat dan Salam kepada Nabi Allah: Rasulullah
Muhammad SAW sebagai suri tauladan dalam kehidupan.
Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar
Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatra Utara, dengan
judul:“Penetapan Kadar Fosfor dalam Buah Petai (Parkia speciosa) Secara
Spektrofotometri Sinar Tampak”.
Pada kesempatan ini dengan segala kerendahan hati penulis mengucapkan
terima kasih yang sebesar-besarnya kepada:
1. Ayahanda Syamsuddin, S.E., dan Ibunda Hj. Setiawaty yang telah memberikan
cinta dan kasih sayang yang tidak ternilai dengan apapun, doa yang tulus serta
pengorbanan baik materi maupun non-materi.
2. Ibu Dra. Nurmadjuzita, M.Si., Apt., dan bapak Drs. Fathur Rahman Harun,
M.Si., Apt., yang telah membimbing dan memberikan petunjuk serta
saran-saran selama penelitian hingga selesainya skripsi ini.
3. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan, staf pengajar dan
staf administrasi fakultas Farmasi yang telah mendidik penulis selama masa
perkuliahan dan membantu kemudahan administrasi.
4. Ibu Dra. Masria Lasma Tambunan, M.Si., Apt., selaku penasehat akademik
5. Ibu Dra. Masfria, M.S., Apt., selaku Kepala Laboratorium Kimia Farmasi
Kualitatif Fakultas Farmasi USU yang telah memberikan izin dan fasilitas
untuk penulis sehingga dapat mengerjakan dan menyelesaikan penelitian.
6. Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, S.U., Apt., selaku Kepala
Laboratorium Penelitian Fakultas Farmasi USU yang telah memberikan izin
dan fasilitas pada penulis sehingga dapat mengerjakan dan menyelesaikan
penelitian.
7. Kakanda tercinta (Yulia), serta seluruh keluarga yang selalu mendoakan dan
memberikan semangat.
8. Sahabat-sahabat ku Milva, Felisia S, dan Uci serta untuk teman seperjuangan
penelitian di laboratorium Kimia Farmasi Kualitatif dan laboratorium
Penelitian Nerdy, Pratiwi, Deva, Ade Putri, Elida, Nita dan seluruh
teman-teman Ekstensi angkatan 2010, terima kasih untuk perhatian, semangat, doa,
dan kebersamaannya selama ini.
9. Serta seluruh pihak yang telah ikut membantu penuliis namun tidak tercantum
namanya.
Penulis menyadari bahwa dalam penulisan skripsi ini masih jauh dari
kesempurnaan. oleh karena itu, dengan segala kerendahan hati penulis bersedia
menerima kritik dan saran yang membangun demi kesempurnaan skripsi ini.
Akhirnya, penulis berharap semoga skripsi ini dapat memberikan manfaat
bagi kita semua.
Medan, Juli 2012 Penulis,
PENETAPAN KADAR FOSFOR DALAM BUAH PETAI (Parkia speciosa) SECARA SPEKTROFOTOMETRI SINAR TAMPAK
ABSTRAK
Buah petai (Parkia speciosa) pada umumnya sering dikonsumsi oleh masyarakat sebagai lalapan ataupun masakan lainnya, walaupun sebagian masyarakat ada juga yang tidak menyukai petai karena aromanya yang khas. Oleh karena itu makanan ini sering dikenal sebagai makanan tradisional. Tanaman ini banyak mengandung mineral, salah satu mineral yang paling banyak yaitu fosfor. Tujuan penelitian ini adalah untuk mengetahui kadar fosfor pada buah petai jenis padi dan petai jenis papan.
Analisis kualitatif fosfor dilakukan dengan mengubahnya menjadi posfat dan diidentifikasi dengan pereaksi ammonium molibdat, terjadinya endapan kuning. Penetapan kadar dilakukan dengan spektrofotometri sinar tampak dengan penambahan pereaksi pembentuk warna posfat, warna biru yang terbentuk diukur pada panjang gelombang 717 nm.
Hasil penetapan kadar fosfor untuk petai jenis padi adalah 86,155 mg/100g, untuk petai jenis papan adalah 70,763 mg/100g. Hasil uji validasi metode yang dilakukan memberikan akurasi dan presisi yang memenuhi syarat yaitu 99,92% dengan RSD 0,13% dan batas deteksi (LOD) 0,1724 µg/ml dan batas kuanti (LOQ) 0,5747 µg/ml.
DETERMINATION OF PHOSPHORIC CONTENT IN PETAI (Parkia speciosa) WITH SPECTROPHOTOMETRY RAY
ABSTRACT
Parkia speciosa generally consumed by people as other dishes, although there are some people who do not like it due to its odor. It is often recognized as a traditional and uncommon food. This plant products mineral, one of the mineral much is producted is phosphorus. The purpose of this study was to determine levels of phosphorus in the both types: petai padi and papan.
Qualitative analysis of phosphorus carried out by turning it into phosphate and ammonium molybdate reagent identified, the yellow precipitate.
Spectrophotometric assay performed with visible light with the addition of the color-forming reagent phosphate, blue color formed was measured at a
wavelength of 717 nm.
The level of phosphorus in petai padi was 86.155 mg/100 g, for petai papan was 70.763 mg/100 g. Validation test method indicated accurate results. The limits of detection and quantittative indicated by phosphorus recovery percent (99.92%) with RSD 0,13% and LOD of 0.1724 µg/ml and LOQ of 0.5747 µg/ml.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis ... 2
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Uraian Umum ... 4
2.1.1 Taksonomi Buah Petai ... 4
2.1.2 Deskripsi Buah Petai ... 4
2.1.3 Kandungan Kimia Petai ... 5
2.1.4 Manfaat Petai ... 5
2.2 Mineral ... 5
2.2.2 Kekurangan Fosfor ... 7
2.2.3 Analisis Kualitatif Fosfor Sebagai Posfat Kompleks ... 8
2.2.4 Analisis Kualitatif Fosfor Sebagai Posfat Kompleks ... 8
2.3 Spektrofotometri Sinar Tampak dan Sinar Ultraviolet ... 8
2.4 Parameter Validasi ... 10
2.5 Uji Recovery ... 12
BAB III METODE PENELITIAN ... 14
3.1 Lokasi Penelitian ... 14
3.2 Alat-alat ... 14
3.3 Bahan-bahan ... 14
3.4 Sampel ... 14
3.5 Prosedur ... 15
3.5.1 Pembuatan Pereaksi ... 15
3.5.1.1 Larutan HNO3 5N ... 15
3.5.1.2 Larutan H2SO4 5N ... 15
3.5.1.3 Larutan Ammonium Molibdat 4% b/v ... 15
3.5.1.4 Larutan Asam Askorbat 0,1 N ... 15
3.5.1.5 Larutan Kalium Antimonil Tartrat 0,274% b/v ... 15
3.5.1.6 Larutan Pengembang Warna Fosfor ... 16
3.5.2 Proses Destruksi ... 16
3.5.2.2 Pembuatan Larutan Sampel ... 16
3.5.3 Analisis Fosfor ... 17
3.5.3.1 Analisis Kualitatif Fosfor Sebagai Posfat
Kompleks ... 17
3.5.3.2 Analisis Kuantitaf Fosfor Sebagai Posfat
Kompleks ... 17
3.5.3.2.1 Pembuatan Larutan Induk Baku
KH2PO4 ( LIB I) ... 17
3.5.3.2.1.1 Pembuatan Larutan Induk Baku
KH2PO4 ( LIB II) ... 17
3.5.3.2.2 Penentuan Waktu Kerja ... 17
3.5.3.2.3 Pembuatan Kurva Serapan Larutan
KH2PO4 ... 18
3.5.3.2.4 Pembuatan Kurva Kalibarasi Larutan
Baku Fosfor ... 18
3.5.3.2.5 Penetapan Kadar Fosfor Dalam
Sampel ... 18
3.5.4 Uji Perolehan Kembali (Recovery) ... 19
3.5.5 Penentuan Batas Deteksi dan Batas Kuantitasi .... 20
BAB IV HASIL DAN PEMBAHASAN ... 21
4.1 Destruksi Kering ... 21
4.2 Analisis Fosfor Pada Buah Petai Padi dan Buah Petai
Papan ... 21
4.2.1 Analisis Kualitatif Fosfor Sebagai Posfat
Kompleks ... 21
4.2.2 Analisis Kuantitatif Fosfor Sebagai Posfat
Kompleks ... 21
4.2.2.1 Penentuan Panjang Gelombang Serapan
4.2.2.2 Penentuan Waktu Kerja Kompleks Fosfor Molibdat Pada Panjang Gelombang
Maksimum 717 nm ... 22
4.2.2.3 Kurva kalibrasi Kompleks Molibdat ... 23
4.2.2.4 Penetapan Kadar Fosfor dalam Sampel ... 24
4.3 Analisis Data Secara Statistik ... 25
4.3.1 Analisis Variansi ... 25
4.4 Perolehan Kembali (Recovery)... 25
4.5 Simpangan Baku Relatif ... 26
4.6 Batas/Limit Deteksi (LOD) dan Batas /Limit Kuantitas (LOQ) ... 26
BAB V KESIMPULAN DAN SARAN ... 27
5.1 Kesimpulan ... 27
5.2 Saran ... 27
DAFTAR PUSTAKA ... 28
DAFTAR TABEL
Halaman
Tabel 1 : Data Serapan Kurva Kalibrasi Larutan Standar Fosfor
Pada Panjang Gelombang 717 nm ... 23
Table 2 : Kadar Mineral Fosfor Dalam Buah Petai Padi dan
DAFTAR GAMBAR
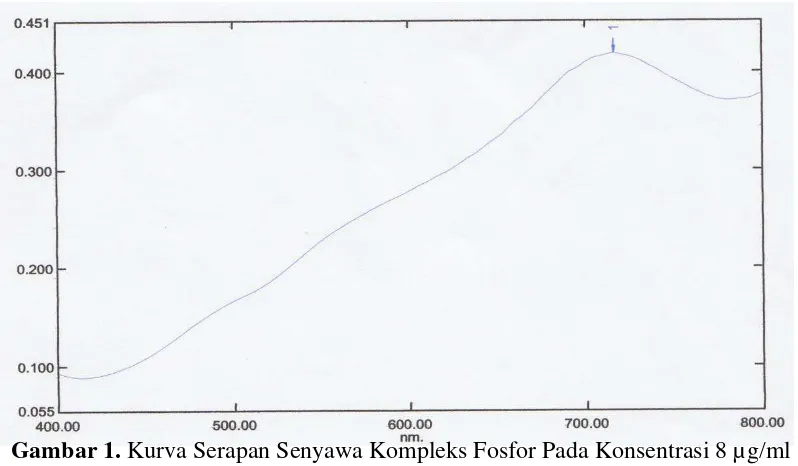
Halaman Gambar 1. Kurva Serapan Senyawa Kompleks Fosfor Pada
Konsentrasi 8 µg/ml ... 22
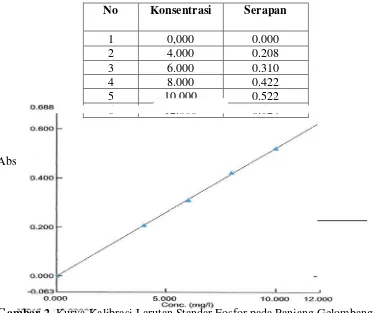
Gambar 2 Kurva Kalibrasi Larutan Standar Fosfor Pada Panjang
DAFTAR LAMPIRAN
Halaman Lampiran 1. Gambar Sampel Buah Petai Padi dan Buah Papan ... 30 Lampiran 2. Flowsheet Destruksi Kering Buah Petai ... 31 Lampiran 3. Hasil Analisis Buah Petai Padi dan Buah Petai Papan ... 33 Lampiran 4. Data Penentuan Waktu Kerja Senyawa Fosfor
Kompleks Pada Panjang Gelombang = 717 nm ... 34
Lampiran 5. Perhitungan Persamaan Regresi ... 36
Lampiran 6. Daftar Berat Sampel dan Berat Abu ... 37
Lampiran 7. Contoh Perhitungan Hasil Penetapan Kadar Fosfor
Dalam Sampel Dengan Menggunakan Persamaan
Regresi ... 38
Lampiran 8. Data Serapan Sampel, Konsentrasi, dan Kadar Fosfor
Dengan 6 Kali Replikasi ... 39
Lampiran 9. Perhitungan Kadar Fosfor Sebenarnya Dalam Buah Petai Padi dan Buah Petai Papan Secara
Spektrofotometri Sinar Tampak ... 40
Lampiran 10. Data Untuk penentuan Recovery ... 44
Lampiran 11. Perhitungan Kadar Fosfor Dalam Buah Petai Papan Setelah Penambahan Larutan Standar dan
Perhitungan Uji Perolehan Kembali (Recovery) ... 45
Lampiran 12. Data Uji Perolehan Kembali (Recovery) ... 47
Lampiran 13. Perhitungan Batas Deteksi dan Batas Kuantitasi ... 48
Lampiran 14. Perhitungan Konsentrasi Larutan Induk Baku KH2PO4 . 49
PENETAPAN KADAR FOSFOR DALAM BUAH PETAI (Parkia speciosa) SECARA SPEKTROFOTOMETRI SINAR TAMPAK
ABSTRAK
Buah petai (Parkia speciosa) pada umumnya sering dikonsumsi oleh masyarakat sebagai lalapan ataupun masakan lainnya, walaupun sebagian masyarakat ada juga yang tidak menyukai petai karena aromanya yang khas. Oleh karena itu makanan ini sering dikenal sebagai makanan tradisional. Tanaman ini banyak mengandung mineral, salah satu mineral yang paling banyak yaitu fosfor. Tujuan penelitian ini adalah untuk mengetahui kadar fosfor pada buah petai jenis padi dan petai jenis papan.
Analisis kualitatif fosfor dilakukan dengan mengubahnya menjadi posfat dan diidentifikasi dengan pereaksi ammonium molibdat, terjadinya endapan kuning. Penetapan kadar dilakukan dengan spektrofotometri sinar tampak dengan penambahan pereaksi pembentuk warna posfat, warna biru yang terbentuk diukur pada panjang gelombang 717 nm.
Hasil penetapan kadar fosfor untuk petai jenis padi adalah 86,155 mg/100g, untuk petai jenis papan adalah 70,763 mg/100g. Hasil uji validasi metode yang dilakukan memberikan akurasi dan presisi yang memenuhi syarat yaitu 99,92% dengan RSD 0,13% dan batas deteksi (LOD) 0,1724 µg/ml dan batas kuanti (LOQ) 0,5747 µg/ml.
DETERMINATION OF PHOSPHORIC CONTENT IN PETAI (Parkia speciosa) WITH SPECTROPHOTOMETRY RAY
ABSTRACT
Parkia speciosa generally consumed by people as other dishes, although there are some people who do not like it due to its odor. It is often recognized as a traditional and uncommon food. This plant products mineral, one of the mineral much is producted is phosphorus. The purpose of this study was to determine levels of phosphorus in the both types: petai padi and papan.
Qualitative analysis of phosphorus carried out by turning it into phosphate and ammonium molybdate reagent identified, the yellow precipitate.
Spectrophotometric assay performed with visible light with the addition of the color-forming reagent phosphate, blue color formed was measured at a
wavelength of 717 nm.
The level of phosphorus in petai padi was 86.155 mg/100 g, for petai papan was 70.763 mg/100 g. Validation test method indicated accurate results. The limits of detection and quantittative indicated by phosphorus recovery percent (99.92%) with RSD 0,13% and LOD of 0.1724 µg/ml and LOQ of 0.5747 µg/ml.
BAB I PENDAHULUAN
1.1Latar Belakang
Petai pada umumnya sering dikonsumsi oleh masyarakat sebagai lalapan
ataupun masakan lainnya, walaupun sebagian masyarakat ada juga yang tidak
menyukai petai karena aromanya yang khas. Oleh karena itu makanan ini sering
dikenal sebagai makanan tradisional (Setianingsih, 1995).
Berdasarkan jumlah biji pada polongnya, tanaman petai dikelompokkan
menjadi dua: yaitu petai papan dan petai padi. Petai papan ini mempunyai polong
sepanjang 25-30 cm dengan biji mencapai 15 buah, tebalnya sekitar ± 0,7 cm
dengan panjang ± 2,5 cm dan lebar ± 1,5 cm. Petai padi ukuran buahnya lebih
pendek dari petai papan. Jumlah biji tiap polong antara 10-12 buah. Ukuran
bijinya juga lebih kecil yaitu tebalnya sekitar ± 0,5 cm dengan panjang ± 2 cm dan
lebar ± 1,5 cm (Setianingsih, 1995).
Tanaman ini mengandung banyak mineral yakni : kalsium, fosfor, zat besi,
vitamin dan mineral lainnya. Kandungan mineral dalam 100 gram buah petai
adalah 95 mg kalsium; 115 mg fosfor dan 1,2 mg zat besi (Sediaoetama, 2008).
Mineral merupakan unsur yang dibutuhkan oleh tubuh manusia yang
mempunyai peranan penting dalam pemeliharaan fungsi tubuh, baik pada tingkat
sel, jaringan, organ, maupun fungsi tubuh secara keseluruhan. Unsur ini
digolongkan ke dalam mineral makro dan mineral mikro. Mineral makro adalah
mineral yang dibutuhkan tubuh dalam jumlah lebih dari 100 mg sehari, misalnya
mikro dibutuhkan kurang dari 100 mg sehari, misalnya besi, iodium, mangan,
tembaga, zink, kobalt dan fluor (Almatsier, 2004).
Fosfor merupakan salah satu mineral yang dibutuhkan oleh tubuh. Fosfor
yang dibutuhkan didalam tubuh orang dewasa yaitu 450 mg, untuk ibu hamil yaitu
kebutuhan orang dewasa ditambah 200 mg, untuk ibu menyusui yaitu kebutuhan
orang dewasa ditambah 200-300 mg, dan untuk anak-anak 350- 400 mg, (Yayuk,
dkk., 2006). Di dalam tubuh fosfor berada dalam bentuk kalsium fosfat Kristal
yang tidak larut. Fosfor mempunyai peranan dalam metabolisme karbohidrat,
lemak dan protein. Sebagai fosfolipid, fosfor merupakan komponen esensial bagi
banyak sel dan merupakan alat transpor asam lemak. Fosfor berperan pula dalam
mempertahankan keseimbangan asam-basa (Pudjiadi, S., 2000).
Berdasarkan uraian di atas, maka peneliti ingin mengetahui kadar fosfor
dalam buah petai padi dan buah petai papan yang umumnya dikonsumsi oleh
masyarakat.
1.2Perumusan Masalah
a. Berapakah kadar fosfor pada buah petai padi dan petai papan.
b. Apakah terdapat perbedaan kadar fosfor pada petai padi dan petai papan.
1.3 Hipotesis
a. Buah petai padi dan buah petai papan mengandung fosfor dalam jumlah
tertentu.
b. Terdapat perbedaan kadar fosfor pada buah petai Padi dan buah petai
1.4Tujuan Penelitian
a. Mengetahui kadar fosfor yang terdapat pada buah petai (Parkia specios).
b. Mengetahui perbedaan kadar fosfor yang terdapat pada buah petai papan
dan buah petai padi.
1.5Manfaat Penelitian
Untuk memberikan informasi kepada masyarakat mengenai kadar mineral
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Umum
Tanaman petai diperkirakan berasal dari Malaysia. Akan tetapi, sudah
lama tanaman ini tumbuh dan dibudidayakan di Indonesia, terutama di Pulau
Jawa. Tanaman ini banyak tumbuh di daerah-daerah yang mempunyai musim
kemarau yang tidak terlalu ekstrem (Endang, 1995).
2.1.1 Taksonomi Buah Petai
Adapun taksonomi buah petai yaitu sebagai berikut (Depkes, 2001) :
Divisi : Spermatophyta Subdivisi : Angiosprmae Kelas : Dicotyledonae Bangsa : Rosales Suku : Mimosaceae Marga : Parkia
Jenis : Parkia Speciosa Hassk
2.1.2 Deskripsi Buah Petai
Tanaman petai berupa pohon dengan ketinggian antara 5-25 m dan
membentuk percabangan yang banyak. Daun menyirip ganda. Karangan bunga
berbentuk bongkol yang terkulai dengan tangkai yang panjang , bunga yang masih
muda dan belum mekar bewarna hijau. Setelah dewasa dan terlihat benang sari
dan putiknya , bunga petai berubah menjadi warna kuning. Ukurannya pun
menjadi lebih besar , buah berbentuk polong panjang dan pipih. Biji tesusun rapi
dalam polong yang menggantung di pohon dan pada setiap polong terdapat
10-18 biji . Setiap biji diselaputi kulit tipis bewarna putih pada saat biji masih muda
petai yang masih muda agak lunak dan setelah tua menjadi lebih keras (Endang,
1995).
2.1.3 Kandungan Kimia Petai
Tanaman ini mengandung banyak mineral yakni : kalsium, fosfor, zat besi,
vitamin dan mineral lainnya. Kandungan mineral dalam 100 gram buah petai
adalah 95 mg kalsium; 115 mg fosfor; 1,2 mg zat besi (Sediaoetama, 2008).
2.1.4 Manfaat Petai
Bagi kesehatan, buah petai mempunyai manfaat yang nyata dalam hal: - Menurunkan tekanan darah
- Melancarkan pencernaan - Mencegah luka lambung
- Membantu untuk menghentikan merokok 2.2 Mineral
Mineral dalam tubuh manusia mengalami proses biokimia untuk
membantu proses fisiologi. Dalam sistem fisiologi manusia, unsur tersebut juga
dibagi menjadi dua bagian yaitu makroelemen, yang ditemukan dalam jumlah
relatif besar (> 0,005% dari berat badan) dan mikroelemen yang ditemukan dalam
jumlah relatif kecil (< 0,005% dari berat badan) (Darmono, 1995).
Di samping itu, mineral berperan dalam berbagai tahap metabolisme,
terutama sebagai kofaktor dalam aktivitas enzim-enzim. Yang termasuk mineral
makro antara lain: natrium, klorida, kalsium, fosfor, magnesium, dan sulfur
(Almatsier, 2004).
Secara tidak langsung, mineral banyak berperan dalam proses
pertumbuhan. Peran mineral dalam tubuh kita berkaitan satu sama lainnya, dan
kekurangan atau kelebihan salah satu mineral akan berpengaruh terhadap kerja
2.2.1 Fosfor
Fosfor merupakan mineral kedua terbanyak di dalam tubuh, yaitu 1% dari
berat badan. Kurang lebih 85% fosfor di dalam tubuh terdapat sebagai garam
kalsium fosfat yang tidak dapat larut yang terdapat di dalam tulang dan gigi.
Fosfor di dalam tulang berada dalam perbandingan 1 : 2 dengan kalsium. Fosfor
selebihnya terdapat di dalam semua sel tubuh, separuhnya di dalam otot dan di
dalam cairan ekstraseluler. Sebagai fosfolipid, fosfor merupakan komponen
struktur dinding sel. Sebagai fosfat organik, fosfor memegang peranan penting
dalam reaksi yang berkaitan dengan penyimpanan atau pelepasan energi dalam
bentuk Adenin TriPosfat (ATP) (Almatsier, 2004).
Fosfor mempunyai peranan dalam metabolisme karbohidrat, lemak, dan
protein, sebagai fosfolipid, fosfor merupakan komponen esensial bagi banyak sel
dan merupakan alat transport asam lemak. Fosfor berperan pula dalam
mempertahankan keseimbangan asam-basa (Pudjiadi, S., 2000).
Pada umumnya bahan makanan yang mengandung banyak kalsium
merupakan juga sumber fosfor, seperti susu, keju, daging, ikan, telur, dan serealia.
Biasanya kira-kira 70% dari fosfor yang berada dalam makanan dapat diserap oleh
tubuh. Penyerapan akan lebih baik bila fosfor dan kalsium dimakan dalam jumlah
yang sama (Poedjiadi, A., 2006).
Fosfor dapat diabsorpsi secara efisien sebagai fosfor bebas di dalam usus
setelah dihidrolisis dan dilepas dari makanan. Bila konsumsi fosfor rendah, taraf
absorbsi dapat mencapai 90% dari konsumsi fosfor. Fosfor dibebaskan dari
secara aktif dan difusi pasif. Terdapat sebagai fosfat anorganik atau sebagai
fosfolipida (Almatsier, 2004).
Faktor-faktor makanan lain yang menghalangi absorbsi fosfor adalah
magnesium dan antasid yang mengandung aluminium, karena membentuk garam
yang tidak larut dalam air. Angka kecukupan fosfor rata-rata sehari adalah
400-500 mg (Almatsier, 2004).
2.2.2 Kekurangan Fosfor
Konsumsi pangan kurang fosfor jarang dijumpai pada manusi; Karena
peranannya yang sangat penting dalam metabolisme pada jaringan hewan dan
tanaman, maka mineral ini umumnya terdapat dalam setiap bahan makanan
(Almatsier, 2004).
Gejala kekurangan fosfor dapat terjadi pada individu yang mendapat
nutrisi parenteral lama atau mereka yang banyak menggunakan antasida (Pudjiadi,
S., 2000). Aluminium hidroksida yang terdapat dalam antasida dapat mengikat
fosfor sehingga tidak dapat diabsorbsi. Kekurangan fosfor menyebabkan
kerusakan tulang. Gejalanya adalah rasa lelah, kurang nafsu makan dan kerusakan
tulang. Bayi prematur juga dapat menderita kekurangan fosfor, karena cepatnya
pertumbuhan tulang sehingga kebutuhan fosfor yang tidak bisa dipenuhi oleh ASI
(Almatsier, 2004).
2.2.3 Analisis Kualitatif Fosfor Sebagai Posfat Kompleks.
Analisis kualitatif fosfor sebagai posfat menurut Vogel ( 1985), dapat
dilakukan dengan pereaksi ammonium molibdat. Analisis kualitatif dilakukan
dimasukkan 5 ml larutan sampel, ditambah pereaksi ammonium molibdat 4% b/v
± 2 ml, dikocok dan didiamkan, maka akan terbentuk endapan kuning.
2.2.5 Analisis Kuantitatif Fosfor Sebagai Posfat Kompleks
Larutan sampel dipipet 10 ml, dimasukkan kedalam labu tentukur 100 ml,
ditambahkan akuades sehingga 50 ml, ditambahkan 13 ml larutan pengembang
warna fosfor, dikocok, akan terbentuk warna biru yang belum diketahui senyawa
kompleks apa yang terjadi, volume dicukupkan dengan akuades hingga garis
tanda kemudian didiamkan. Diukur serapan pada panjang gelombang maksimum
(Sinaga, 2011).
2.3 Spektrofotometri Sinar Ultraviolet dan Sinar Tampak
Spektrofotometri serapan merupakan pengukuran suatu interaksi antara
radiasi elektromagnetik dan molekul atau atom dari suatu zat kimia. Teknik yang
sering digunakan dalam analisis farmasi meliputi spektroskopi serapan ultraviolet,
sinar tampak, infra merah, dan serapan atom (Ditjen POM, 1995). Keuntungan
utama dari metode ini yaitu dapat menetapkan kadar suatu zat yang sangat kecil
(Bassett, 1991).
Spektrofotometer Ultraviolet dan Visibel adalah alat yang digunakan
untuk mengukur panjang gelombang dan intensitas sinar ultraviolet dan sinar
tampak yang diabsorbsi oleh sampel. Sinar ultraviolet dan sinar tampak memiliki
energi yang cukup untuk mempromosikan elektron pada kulit terluar ke tingkat
energi yang lebih tinggi. Spektrofotometer Ultraviolet dan Visibel biasanya
digunakan untuk molekul dan ion organik atau kompleks di dalam larutan.
Spektrum Ultraviolet dan Visibel sangat berguna untuk pengukuran secara
mengukur absorbansi pada panjang gelombang tertentu dengan menggunakan
hukum Lambert-Beer. Sinar ultraviolet berada pada rentang panjang gelombang
200-400 nm, sedangkan sinar tampak berada pada rentang panjang gelombang
400-800 nm (Dachriyanus, 2004).
Molekul yang memerlukan energi yang lebih sedikit akan menyerap pada
panjang gelombang yang lebih panjang. Senyawa yang menyerap cahaya dalam
daerah sinar tampak mempunyai elektron yang lebih mudah dipromosikan
daripada senyawa yang menyerap pada daerah ultraviolet (Fessenden dan
Fessenden, 1982).
Warna sinar tampak dapat dihubungkan dengan panjang gelombangnya.
Sinar putih mengandung radiasi pada semua panjang gelombang di daerah sinar
tampak. Sinar pada panjang gelombang tunggal (radiasi monokromatik) dapat
dipilih dari sinar putih. Spektrofotometer yang sesuai untuk pengukuran di daerah
spektrum ultraviolet dan sinar tampak terdiri atas suatu sistem optik dengan
kemampuan menghasilkan sinar monokromatis dalam jangkauan panjang
gelombang 200-800 nm (Gholib dan Rohman, 2007).
Alat spektrofotometri pada dasarnya terdiri atas sumber sinar,
monokromator, tempat sel untuk zat yang diperiksa, detektor, penguat arus, dan
alat ukur atau pencatat. Spektrofotometer dapat bekerja secara otomatik ataupun
tidak, dan dapat mempunyai sistem sinar tunggal dan ganda (Ditjen POM, 1979).
Sebagai sumber cahaya biasanya digunakan lampu hidrogen atau
deuterium untuk pengukuran pada daerah untuk ultraviolet dan lampu tungsten
untuk pengukuran pada daerah sinar tampak. Panjang gelombang dari sumber
Analisis kuantitatif secara spektrofotometri dapat dilakukan dengan
metode regresi dan pendekatan (Holme dan Peck, 1983):
1. Metode Regresi
Analisis kuantitatif dengan metode regresi dilakukan dengan menggunakan
persamaan garis regresi yang didasarkan pada harga serapan dan konsentrasi
larutan baku yang dibuat dalam berbagai konsentrasi, paling sedikit mnggunakan
lima konsentrasi yang meningkat yang dapat memberikan serapan linier,
kemudian diplot mengasilkan suatu kurva kalibrasi. Konsentrasi suatu sampel
dapat dihitung berdasarkan kurva tersebut.
2. Metode Pendekatan
Analisis kuantitatif dengan cara ini dilakukan dengan membandingkan
serapan larutan baku yang konsentrasinya diketahui dengan serapan larutan
sampel. Konsentrasi sampel dapat dihitung melalui perbandingan Cs =
Ab Cb As.
dimana As = serapan sampel, Cs = konsentrasi sampel, Ab = serapan baku, dan Cb
= konsentrasi baku.
2.4 Parameter Validasi
Validasi adalah kerja yang dicatat dalam dokumen untuk membuktikan
bahwa prosedur analisis yang diuji akan dapat memenuhi fungsi yang sesuai
dengan tujuannya dengan konsisten dan betul-betul memberikan hasil seperti yang
diharapkan. Tujuan validasi adalah agar prosedur analisis tersebut diketahui
akurasi dan variabilitasnya, gangguan yang mungkin ada teridentifikasi dan
analisis khas yang ditentukan pada validasi adalah akurasi, presisi, kespesifikan,
limit deteksi, kelinieran, dan rentang (Satiadarma, dkk., 2004).
Akurasi dari suatu metode analisis adalah kedekatan nilai hasil uji yang
diperoleh dengan prosedur tersebut dari harga yang sebenarnya. Akurasi
merupakan ukuran ketepatan prosedur analisis. Presisi dari suatu metode analisis
adalah derajat kesesuaian di antara masing-masing hasil uji, jika prosedur analisis
diterapkan berulangkali pada sejumlah cuplikan yang diambil dari suatu sampel
homogen. Presisi dinyatakan sebagai deviasi standar atau deviasi standar relatif
(koefisien variasi) (Satiadarma, dkk., 2004).
Kespesifikan dari suatu metode analisis adalah kemampuannya untuk
mengukur kadar analit secara khusus dengan akurat, di samping komponen lain
yang terdapat dalam matriks sampel. Kespesifikan sering kali dinyatakan sebagai
derajat bias dari hasil analisis sampel yang mengandung pencemaran, hasil
degradasi, senyawa sejenis yang ditambahkan atau komponen matriks,
dibandingkan dengan hasil uji sampel analit tanpa zat tambahan (Satiadarma,
dkk., 2004).
Limit deteksi dari suatu metode analisis adalah nilai parameter uji batas,
yaitu konsentrasi analit terendah yang dapat dideteksi, tetapi tidak dikuantitasi
pada kondisi percobaan yang dilakukan. Limit deteksi dinyatakan dalam
konsentrasi analit dalam sampel (Satiadarma, dkk., 2004).
Limit kuantitasi dari suatu metode analisis adalah nilai parameter
penentuan kuantitatif senyawa yang terdapat dalam konsentrasi rendah dalam
matriks. Limit kuantitasi adalah konsentrasi analit terendah dalam sampel yang
eksperimen yang ditentukan. Limit kuantitasi dinyatakan dalam konsentrasi analit
dalam sampel (Satiadarma, dkk., 2004).
Penentuan batas deteksi dapat dihitung berdasarkan pada standar deviasi
(SD) respon dan kemiringan (slope) linieritas baku dengan rumus:
SD =
) 2 (
)
( 2
− −
∑
n x x
LOD =
slope X xSY/ 3
Sedangkan untuk penentuan batas kuantitasi dapat digunakan rumus (Harmita,
2004):
LOQ =
slope X xSY/ 10
Perhitungan dapat dilihat pada Lampiran 13.
2.5 Uji Recovery
Penentuan suatu zat dalam campurannya dengan salah satu metode tertentu
selalu terbuka kemungkinan adanya gangguan komponen dalam campurannya,
sehingga kadar sebenarnya dari analit dalam sampel tidak dapat diketahui dengan
pasti. Percobaan recovery dilakukan untuk mengetahui kadar analit sebenarnya
dan ketepatan suatu metode untuk campuran tertentu. Hal ini sangat penting
dalam mengetahui kadar sebenarnya dan selanjutnya dapat dilakukan evaluasi
terhadap produk (Rosita, 1997).
Percobaan recovery suatu zat dalam suatu sampel dilakukan dengan cara,
pertama adalah menentukan kadar zat yang diinginkan dalam sampel selanjutnya
yang sama dan dianalisis dengan cara yang sama. Persen recovery dapat dicari
dengan menggunakan rumus (Harmita, 2004):
% Recovery = 100%
n ditambahka yang
baku larutan kadar
awal sampel dalam
kadar baku
penambahan setelah
kadar
BAB III
METODE PENELITIAN
Metode penelitian yang dilakukan adalah penelitian Purposif, yaitu dengan
tidak membedakan asal buah Petai tersebut
3.1 Lokasi Penelitian
Penelitian untuk uji kualitatif dilakukan di Laboratorium Kimia Farmasi
Kualitatif Fakultas Farmasi USU, sedangkan uji kuantitatif dilakukan di
Laboratorium Penelitian Fakultas Farmasi USU.
3.2 Alat-alat
Alat-alat yang digunakan antara lain: Spektrofotometer UV-Vis
(Shimadzu), neraca analitik, tanur, oven, hot plate, blender, krus porselen, botol
amber, dan alat-alat gelas.
3.3 Bahan-bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah bahan yang
berkualitas pro analis dari E. Merck yaitu asam nitrat, ammonium molibdat, asam
sulfat, asam askorbat, kalium dihidrogen fosfat, kalium antimonil tatrat kecuali air
suling dari Laboratorium Penelitian Fakultas Farmasi USU.
3.4 Sampel
Sampel yang digunakan dalam penelitian ini adalah buah petai padi dan
buah petai papan yang diperoleh dari Pasar Tradisional Setia Budi Tanjung Rejo
gambar sampel dapat dilihat pada Lampiran 1, halaman 33.
3.5 Prosedur
3.5.1.1 Larutan HNO3 5N
Larutan HNO3 65% b/v sebanyak 500 ml diencerkan dengan air suling
hingga 500 ml (Ditjen POM, 1979).
3.5.1.2 Larutan H2SO4 5 N
Dipipet 70 ml H2SO4 96% v/v, dimasukkan perlahan-lahan melalui
dinding ke dalam labu tentukur 500 ml yang telah berisi air suling setengahnya.
Dicukupkan volumenya dengan air hingga garis tanda (Lancashire, 2006).
3.5.1.3 Larutan Ammonium molibdat 4%b/v
Ditimbang seksama 20 g ammonium molibdat. Kemudian dimasukkan ke
dalam labu tentukur 500 ml, ditambah dengan air suling dan dicukupkan
volumenya dengan air suling hingga garis tanda (Lancashire, 2006).
3.5.1.4 Larutan Asam askorbat 0,1 N
Ditimbang seksama 8,8 g asam askorbat dan dilarutkan dalam labu
tentukur 500 ml dengan air suling dan dicukupkan volumenya dengan air suling
hingga garis tanda (Lancashire, 2006).
3.5.1.5 Larutan Kalium antimonil tatrat 0,274% b/v
Ditimbang seksama 0,274 g kalium antimonil tartat, dimasukkan ke dalam
labu tentukur 100 ml ditambah dengan air suling hingga garis tanda (Lancashire,
2006).
3.5.1.6 Larutan Pengembang Warna Fosfor
Dicampur 500 ml asam sulfat 5 N, 150 ml ammonium molibdat 4% b/v,
300 ml asam askorbat 0,1 N dan 50 ml kalium antimonil tatrat 0,274% b/v
3.5.2 Proses Destruksi 3.5.2.1 Destruksi Kering
Sebanyak ± 1/2 kg Buah Petai ditimbang lalu dikupas kulitnya, selanjutnya
diblender kemudian ditimbang seksama 10 g dalam krus porselen, kemudian
dipanaskan di atas hot plate sampai kering dan mengarang. Diabukan di tanur
dengan temperatur awal 100oC dan perlahan-lahan temperatur dinaikkan menjadi
500oC dengan interval 25oC setiap 5 menit. Pengabuan dilakukan selama 50 jam
dan dibiarkan hingga dingin. Abu ditambahkan 5 ml HNO3 (1:1), kemudian
diuapkan pada hot plate sampai kering, kemudian dimasukkan kembali ke dalam
tanur dengan temperatur awal 100oC dan perlahan – lahan temperatur dinaikkan
hingga suhu 500oC dengan interval 25oC. Pengabuan dilakukan selama 1 jam dan
dibiarkan hingga dingin (Helrich, 1990). Flowsheet dapat dilihat pada Lampiran 2,
halaman 34.
3.5.2.2 Pembuatan Larutan Sampel
Sampel hasil destruksi dilarutkan dalam 5 ml HNO3 (1:1), lalu dimasukkan
ke dalam labu tentukur 100 ml dan diencerkan dengan aquadest hingga garis tanda
(Helrich, 1990). Kemudian disaring dengan kertas saring Whatman No. 42 dan 5
ml filtrat pertama dibuang untuk menjenuhkan kertas saring kemudian filtrat
selanjutnya ditampung dalam botol. Filtrat ini digunakan sebagai larutan sampel
untuk analisis kualitatif dan kuantitatif. Flowsheet dapat dilihat pada Lampiran 2,
3.5.3 Analisis Fosfor
3.5.3.1 Analisis Kualitatif Fosfor Sebagai Posfat Kompleks
Analisis kualitatif fosfor dapat dilakukan dengan pereaksi ammonium
molibdat. Analisis kualitatif dilakukan pada larutan sampel.
Ke dalam tabung reaksi dimasukkan 5 ml larutan sampel, ditambah
pereaksi ammonium molibdat 4% b/v ± 2 ml, dikocok dan didiamkan, maka akan
terbentuk endapan kuning.
3.5.3.2 Analisis Kuantitatif Fosfor Sebagai Posfat Kompleks 3.5.3.2.1 Pembuatan Larutan Induk Baku KH2PO4 (LIB I)
Ditimbang 1,1 g KH2PO4 yang telah dikeringkan di dalam oven dengan
suhu 105oC, kemudian dimasukkan ke dalam labu tentukur 250 ml, ditambahkan
12,5 ml larutan HNO3 5 N, dikocok hingga larut, dicukupkan volumenya dengan
aquadest hingga garis tanda. Diperoleh konsentrasi fosfor pada Larutan Induk
Baku (LIB) I adalah 1000 µg/ml.
3.5.3.2.1.1 Pembuatan Larutan Induk Baku KH2PO4 (LIB II)
Dari LIB I dipipet 10 ml, dimasukkan ke dalam labu tentukur 250 ml, dicukupkan volumenya dengan aquadest hingga garis tanda. Diperoleh
konsentrasi fosfor pada Larutan Induk Baku (LIB) II adalah 40 µg/ml.
3.5.3.2.2 Penentuan Waktu Kerja
Dari LIB II dipipet 10 ml, dimasukkan ke dalam labu tentukur 50 ml,
ditambahkan aquadest sehingga volume larutan menjadi 25 ml, ditambahkan 6,5
ml larutan pengembang warna fosfor, dikocok, dicukupkan volume dengan
diukur serapan pada panjang gelombang maksimum 713 nm mulai menit ke-5
hingga menit tertentu dengan interval waktu 1 menit (Sinaga, 2011).
3.5.3.2.3 Pembuatan Kurva Serapan Larutan KH2PO4
Dari LIB II dipipet 10 ml, dimasukkan ke dalam labu tentukur 50 ml,
ditambahkan akuades sehingga volume larutan menjadi 25 ml, ditambahkan 6,5
ml larutan pengembang warna fosfor, dikocok, dicukupkan volume dengan
aquadest hingga garis tanda (konsentrasi 8 µg/ml), dan didiamkan kemudian
diukur serapan pada panjang gelombang 400-800 nm pada waktu kerja diperoleh.
3.5.3.2.4 Pembuatan Kurva Kalibrasi Larutan Baku Fosfor
Dari LIB II dipipet berturut-turut 5,0 ml; 7,5 ml; 10,0 ml; 12,5 ml; 15,0
ml, dimasukkan ke dalam labu tentukur 50 ml, kemudian ditambahkan akuades
sehingga volumenya masing-masing larutan menjadi 25 ml, ditambahkan 6,5 ml
larutan pengembang warna fosfor, dikocok, dicukupkan volumenya dengan
akuades hingga garis tanda (konsentrasi 4,0 µg/ml; 6,0 µg/ml; 8,0 µg/ml; 10,0
µg/ml, dan 12 µg/ml) dan didiamkan selama 20 menit kemudian diukur serapan
pada panjang gelombang maksimum.
3.5.3.2.5 Penetapan Kadar Fosfor Dalam Sampel
Larutan sampel dipipet 10 ml, dimasukkan ke dalam labu tentukur 100 ml,
ditambahkan akuades sehingga volume larutan menjadi 50 ml, ditambahkan 13 ml
larutan pereaksi pengembang warna fosfor, dikocok, dicukupkan volume dengan
akuades hingga garis tanda kemudian didiamkan. Diukur serapan pada panjang
gelombang maksimum. Nilai serapan yang diperoleh harus berada didalam
rentang nilai kurva kalibrasi larutan baku, Dengan demikian konsentrasi fosfor
Kadar fosfor dapat dihitung dengan rumus:
Kadar (mcg/g) = C x V x Fp
W
Keterangan : C = Konsentrasi larutan sampel setelah pengenceran (mcg/ml) V = Volume labu kerja (ml)
Fp = Faktor pengenceran W = Berat sampel (g)
Contoh perhitungan hasil penetapan kadar fosfor dalam sampel dapat dilihat pada
Lampiran 7, halaman 41 dan data hasil analisis kadar fosfor seluruhnya untuk
setiap jenis buah petai padi dan buah petai papan dengan 6 kali replikasi dapat
dilihat pada Lampiran 8, halaman 42.
Kadar fosfor sebenarnya dalam sampel dapat dihitung dengan rumus:
µ = x ± (t(α/2, dk)
x SD/
√
n
Keterangan: x : kadar rata-rata sampel SD : Standar Deviasi
dk : derajat kebebasan ( dk = n-1) α : tingkat kepercayaan
n : banyak data
(Walpole, 1995). Perhitungan kadar fosfor sebenarnya dalam sampel dapat dilihat
pada Lampiran 9, halaman 43, 44, 45, dan 46.
3.5.4 Uji Perolehan Kembali (Recovery)
Uji perolehan kembali atau recovery dilakukan dengan metode
penambahan larutan baku (standard addition method). Dalam metode ini, kadar
fosfor dalam sampel ditentukan terlebih dahulu, selanjutnya dilakukan penentuan
kadar fosfor dalam sampel setelah penambahan larutan standar dengan konsentrasi
tertentu (Ermer dan Miller, 2005).
Daging buah petai yang telah dihomogenkan ditimbang sebanyak 10 gram,
lalu ditambahkan 1,5 ml (150 µg/g) larutan baku fosfor, kemudian dilanjutkan
Persen perolehan kembali (ujii recovery) dapat dihitung dengan rumus di
bawah ini (Harmita, 2004):
% recovery = 100%
n ditambahka yang baku larutan kadar awal sampel dalam kadar baku penambahan setelah
kadar − ×
Perhitungan kadar fosfor dalam buah petai setelah penambahan larutan baku dan
perhitungan uji prolehan kembali pada Lampiran 11, halaman 48, dan 49 dan data
% recovery dapat dilihat pada Lampiran 12, halaman 50.
3.5.5 Penentuan Batas Deteksi dan Batas Kuantitasi
Penentuan batas deteksi dapat dihitung berdasarkan pada standar deviasi
(SD) respon dan kemiringan (slope) linieritas baku dengan rumus:
SY/X = ) 2 ( ) ( 2 − −
∑
n yi yLOD = 3 x SY/X
Slope
Sedangkan untuk penentuan batas kuantitasi dapat digunakan rumus
(Harmita, 2004):
LOQ = 10 x SY/X
Slope
BAB IV
HASIL DAN PEMBAHASAN
4.1 Destruksi Kering
Fosfor organik dalam buah petai setelah didestruksi berubah menjadi
fosfor oksida dalam valensi 3, yaitu P2O3 dan akhir destruksi akan terbentuk fosfor
oksida valensi 5, yaitu P2O5 yang bila dilarutkan dalam HNO3 5N akan menjadi
PO43-.
4.2 Analisis Fosfor pada Buah Petai Padi dan Buah Petai Papan 4.2.1 Analisis Kualitatif Fosfor Sebagai Posfat Kompleks
Analisis kualitatif fosfor dalam sampel dilakukan dengan reaksi
menggunakan ammonium molibdat 4%, terbentuk endapan kuning. Hal ini
menunjukan bahwa buah petai padi dan buah petai papan mengandung fosfor.
Hasil dapat dilihat pada Lampiran 3, halaman 35.
4.2.2 Analisis Kuantitatif Fosfor Sebagai Posfat Kompleks
4.2.2.1 Penentuan Panjang Gelombang Serapan Maksimum Senyawa Kompleks Fosfor Molibdat
Dari LIB II dipipet 10 ml, dimasukkan kedalam labu tentukur 50 ml,
ditambahkan akuades sehingga volume menjadi 25 ml kemudian untuk
pengukuran fosfor dengan Spektrofotometri Sinar Tampak dilakukan dengan
penambahan 6,5 ml larutan pengembang warna fosfor. Larutan pereaksi warna
yang digunakan campuran asam sulfat, ammonium molibdat, asam askorbat, dan
kalium antimonil tatrat. Tujuan penambahan larutan ini adalah untuk membentuk
senyawa biru dan diukur serapannya pada panjang gelombang 400-800 nm.
Hasil pengukuran menunjukkan serapan stabil pada menit ke-20 sampai
serapan senyawa kompleks fosfor molibdat dapat dilihat pada Gambar 1. Dari
gambar tersebut diperoleh panjang gelombang serapan maksimum adalah 717 nm.
Menurut literatur kompleks fosfomolibdat memberikan serapan pada daerah sinar
tampak pada panjang gelombang antara 700-723 nm (Lanchasire, 2006).
[image:38.595.108.507.191.424.2]
Gambar 1. Kurva Serapan Senyawa Kompleks Fosfor Pada Konsentrasi 8 µg/ml
Data serapan maksimum kompleks fosfor molibdat diukur pada panjang
gelombang maksimum 717 nm dan menghasilkan serapan 0,418.
4.2.2.2 Penentuan Waktu Kerja Kompleks Fosfor Molibdat pada Panjang Gelombang Maksimum 717 nm
Untuk menentukan kestabilan warna senyawa kompleks fosfor molibdat,
digunakan larutan induk baku dengan konsentrasi 8 mcg/ml dan diukur
serapannya pada panjang gelombang 717 nm mulai menit 6 sampai menit
ke-65. Hasil pengukuran menunjukkan serapan stabil pada menit ke-20 hingga menit
ke- 28. Data pengukuran waktu kerja kompleks fosfor molibdat dapat dilihat pada
Lampiran 4, halaman : 36, dan 37.
4.2.2.3 Kurva Kalibrasi Kompleks Molibdat
Kurva kalibrasi fosfor diperoleh dengan cara mengukur serapan dari satu
pengukuran serapan vs konsentrasi larutan standar tersebut dapat dilihat pada
Tabel 1 dan Gambar 2 :
Tabel 1. Data Serapan Kurva Kalibrasi Larutan Standar Fosfor pada Panjang Gelombang 717 nm
[image:39.595.116.490.179.492.2]Abs
Gambar 2. Kurva Kalibrasi Larutan Standar Fosfor pada Panjang Gelombang 717 nm.
Berdasarkan kurva kalibrasi diatas, diperoleh persamaan regresi untuk
larutan standar fosfor, yaitu y = 0,0522 x – 0,0001 dengan r (koefisien korelasi)
0,9999. Nilai koefisien korelasi ≥ 0,95 menunjukan bukti adanya korelasi linier
yang menyatakan adanya hubungan antara x dan y (Shargel dan Andrew, 1999).
Kurva ini menunjukkan terdapat korelasi yang positif antara konsentrasi (x)
dengan serapan (y) yang berarti meningkatnya konsentrasi akan meningkat pula
serapannya (Sudjana, 2005). Perhitungan persamaan regresi dapat dilihat pada
Lampiran 5, halaman 38.
No Konsentrasi Serapan
1 0,000 0.000
2 4.000 0.208
3 6.000 0.310
4 8.000 0.422
5 10.000 0.522
4.2.2.4 Penetapan Kadar Fosfor dalam Sampel
Larutan sampel diukur dengan spektrofotometer UV-VIS pada panjang
gelombang = 717 nm, pada menit ke-20, konsentrasi dapat dihitung berdasarkan
persamaan garis regresi. Data serapan dan konsentrasi larutan pengukuran dapat
dilihat pada Lampiran 8, halaman 41.
Fosfor dalam petai pada destruksi yang berupa P2O5 setelah dilarutkan
dengan HNO3 berubah menjadi PO43- yang bereaksi dengan pereaksi pengembang
warna yang membentuk komplek berwarna biru yang stabil selama 9 menit.
Pengukuran dilakukan setelah menit ke-20 pada panjang gelombang 717 nm.
Hasil analisis kuantitatif fosfor dalam buah petai padi dan buah petai papan dapat
[image:40.595.108.517.388.534.2]dilihat pada Tabel 2 di bawah ini:
Tabel 2. Kadar Mineral Fosfor Dalam Buah Petai Padi dan Papan
No. Sampel Kadar Sebenarnya
(µg/g) mg/100g
1 A 861,5521 ± 2,9644 86,155
2 B 707,6346 ± 3,6323 70,763
Keterangan :
A : Buah Petai Padi B : Buah Petai Papan
Tabel di atas menunjukkan bahwa sampel mengandung fosfor dengan
kadar yang berbeda untuk setiap jenis buah. Menurut Sediaoetama (2008), yang
terdapat pada daftar analisa bahan lauk-pauk (nabati) dalam buku yang berjudul
Ilmu Gizi, kadar fosfor dalam buah petai sebesar 115 mg/100g. Hasil di atas
menunjukkan bahwa kadar fosfor pada Buah Petai Padi lebih tinggi dibandingkan
dengan kadar fosfor pada Buah Petai Papan tidak sesuai dengan literatur. Hal ini
jenis petai yang beredar di Pasaran. Untuk membuktikan adanya perbedaan kadar
fosfor pada setiap jenis petai diperlukan analisis data secara statistik.
4.3 Analisis Data secara Statistik 4.3.1 Analisis Variansi
4.4 Perolehan Kembali (Recovery)
Uji perolehan kembali dilakukan terhadap sampel yang sama dan
dianalisis dengan cara yang sama dengan pengerjaan sampel awal dan dilakukan
penambahan larutan baku sebanyak 1,5 ml (150 µg/g). Uji perolehan kembali
dilakukan untuk mengetahui ketepatan metode yang digunakan.
Persen uji perolehan kembali pada penelitian ini menunjukkan bahwa
metode ini memberikan ketepatan yang baik, dimana diperoleh persen uji
perolehan kembali untuk fosfor pada buah petai padi dengan buah petai papan
sebesar 99,92%. Hasil persen uji perolehan kembali ini memenuhi batas-batas
yang ditentukan, yaitu 90% - 107% (Harmita, 2004).
4.5 Simpangan Baku Relatif
Dari perhitungan yang dilakukan terhadap data hasil pengukuran kadar
fosfor dalam sampel buah petai, diperoleh nilai simpangan baku, yaitu 1,1959 dan
nilai simpangan baku relatif, yaitu 0,13 %. Kriteria seksama diberikan jika metode
memberikan simpangan baku relatif 2% atau kurang (Harmita, 2004). Hasil yang
diperoleh menunjukkan bahwa metode yang dilakukan memiliki potensi yang
baik.
4.6 Batas/Limit Deteksi (LOD) dan Batas/Limit Kuantitasi (LOQ)
Dari penelitian ini diperoleh batas deteksi (LOD) sebesar 0,1724 µg/ml
fosfor pada sampel diperoleh konsentrasi terendah sebesar 7,0517 mcg/ml. Hasil
ini berada di atas batas deteksi dan batas kuantitasi. Perhitungan batas deteksi dan
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Kadar fosfor dalam Buah Petai Padi adalah 86,155 mg/100g, dan Buah
Petai Papan adalah 70,763 mg/100g.
2. Terdapat perbedaan kadar antara Buah Petai Padi dan Buah Petai Papan
yang diuji menggunakan metode Spektrofotometri Sinar Tampak.
5.2 Saran
1. Disarankan bagi yang suka dengan buah petai untuk mengkonsumsi buah
petai padi karna lebih banyak mengandung fosfor yang penting untuk
tulang dan gigi.
2. Dari hasil penelitian diatas diketahui bahwa buah petai dapat digunakan
sebagai salah satu asupan makanan untuk memenuhi kebutuhan Fosfor
DAFTAR PUSTAKA
Almatsier, S. (2004). Prinsip Dasar Ilmu Gizi. Jakarta: PT. Gramedia Pustaka Umum. Halaman 243, 245.
Bassett, J. (1991). Vogel’s Textbook of Quantitative Inorganic Analysis Including Elementary Instrumental Analysis. London: Longman Group Limited. Diterjemahkan Oleh Hadyana. (1994). Buku Ajar Vogel Kimia Analisis Kuantitatif Anorganik. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 942-943, 955-957.
Endang, S. (1995). Petai dan Jengkol. Jakarta: PT. Penebar Swadaya. Halaman 1-2.
Dachriyanus. (2004). Analisa Struktur Senyawa Organik secara Spektroskopi. Padang: Andalas Universitas Press. Halaman 1-3.
Darmono. (1995). Lingkungan Hidup dan Pencemaran. Jakarta: Penerbit Universitas Indonesia. Halaman 75, 80-81, 90.
Depkes RI. (2001). Inventaris Tanaman Obat Indonesia. Jilid Ke-dua. Jakarta: Departemen Kesehatan RI. Halaman 261
Ditjen POM. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 651, 772.
Ditjen POM. (1995). Farmakope Indonesia. Edisi Ke-empat. Jakarta: Departemen Kesehatan RI. Halaman 1061.
Ermer, J., dan Miller, J.H.M. (2005). Method Validation in Pharmaceutical Analysis. A Giude to Best Practice. Weinheim: Wiley-VCH. Halaman 89. Fessenden dan Fessenden. (1982). Organic Chemistry. Edisi Ketiga. Jilid Ke-tiga.
Diterjemah Oleh Pudjaatmaka A.H. Jakarta: Penerbit Erlangga. Halaman 437.
Gholib, I., dan Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Halaman 222.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metoda dan Cara Perhitungannya. Jakarta: Departemen Farmasi FMIPA UI. Halaman 119, 130, 131.
Helrich, K. (1990). Official Methods of Association of Official Analytical Chemist. Edisi ke-15. Arlington: Virginia USA. Halaman 42.
Holme, D.J., dan Peck, H. (1983). Analytical Biochemistry. London: Longman Inc. Halaman 40.
Lancashire, R.J. (2006). Colourimetric Determination of Phosphate.
Lehninger, A.L. (1982). Dasar-dasar Biokimia. Jilid 2. Diterjemahkan Oleh Thenawidjaja. Jakarta: Penerbit Erlangga. Halaman 45.
Pudjiadi, S. (2000). Ilmu Gizi Klinik pada Anak. Edisi Ke-empat. Jakarta: Penerbit FK UI. Halaman 421.
Rosita. (1997). Analisa Formalin dan Boraks Serta Pengaruh Terhadap Daya Simpan Bakso Sapi.Skripsi. Medan: Jurusan Farmasi. USU.
Satiadarma, K., Mulja, M., Tjahjono, D.H., dan Kartasasmita, R.E. (2004). Asas Pengembangan Prosedur Analisis. Edisi Pertama. Surabaya: Airlangga Universitas Press. Halaman 46-49.
Sediaoetama, A.D. (2008). Ilmu Gizi Untuk Mahasiswa dan Profesi di Indonesia. Jakarta: PT.Dian Rakyat. Halaman 297.
Setianingsih, E. (1995). Petai dan Jengkol. Jakarta: Penebar Swadaya. Halaman 3.
Shargel, L., dan Andrew, B.C.Y. (1999). Applied Biopharmacetics and Pharmacokinetics.Wasington: Prentice-hall International Inc. Halaman 15.
Sinaga, P.R.A. (2011). Penetapan Kadar Fosfor Dalam Buah Jambu Biji Merah (Psidium guajava) Secara Spektrofotometri Sinar Tampak. Skripsi.
Medan: Jurusan Farmasi. USU.
Sudjana. (2005). Metode Statistika. Edisi Keenam. Bandung: Penerbit Tarsito. Halaman 371.
Vogel, A.I. (1985). Analisis Anorganik Kualitatif Makro dan Semi Mikro. Edisi Kelima. Bagian II. Jakarta: PT. Kalaman Media Pustaka. Hal 378-881. Walpole, R.E. (1995). Pengantar Statistika. Penerjemah: Bambang Sumantri.
Edisi Ketiga. Jakarta: PT Gramedia Pustaka Utama. Halaman 381-397. Yayuk, F.B., Khomsan, A., dan Dwiriani, C.M. (2006). Pengantar Pangan Dan
Lampiran 1. Gambar Sampel Buah Petai Padi dan Buah Petai Papan
a. Gambar Buah Petai Padi
Lampiran 2. Flowsheet Destruksi Kering Buah Petai
Buah Petai
Diarangkan di atas hot plate
Diarangkan di atas hot plate
Diabukan di tanur selama 50 jam
Abu Hasil Destruksi Sampel yang telah mengarang
Dikeringkan kembali di atas hot plate
Diblender
Dilarutkan dengan 5 ml HNO3 (1:1) Ditimbang ± 10 gram dalam krus porselen Sampel yang telah dihaluskan
Abu
Sambungan Lampiran 2
Abu Hasil Destruksi
Dilarutkan dalam 5 ml HNO3 (1:1)
Dituangkan ke dalam labu tentukur 100 ml
Diencerkan dengan aquadest hingga garis tanda
Dimasukkan ke dalam botol
Larutan sampel
Disaring dengan kertas saring Whatman No 42 No.42
Filtrat
Dibuang 5 ml untuk menjenuhkan kertas saring
Dilakukan analisis kualitatif
Dilakukan analisis kuantitatif dengan Spektrofotometer UV-VIS pada panjang gelombang 717 nm untuk Fosfor
Lampiran 3. Hasil Analisais Kualitatif Buah Petai Padi dan Buah Petai Papan
Gambar Hasil Uji Analisis Kualitatif Keterangan:
1. Sampel Larutan Petai Padi
2. Sampel + ammonium Molibdat Endapan Kuning
3. Sampel Larutan Petai Papan
4. Sampel + ammonium Molibdat Endapan Kuning
Lampiran 4. Data Penentuan Waktu Kerja Senyawa Fosfor Kompleks pada panjang gelombang = 717 nm
No. Menit ke- Absorbansi
1. 6 0.416
2. 7 0.416
3 8 0.416
4. 9 0.417
5. 10 0.418
6. 11 0.419
7. 12 0.420
8. 13 0.421
9. 14 0.422
10. 15 0.422
11. 16 0.423
12. 17 0.424
13. 18 0.425
14. 19 0.425
15. 20 0.426
16. 21 0.426
17. 22 0.426
18. 23 0.426
19. 24 0.426
20. 25 0.426
21. 26 0.426
22. 27 0.426
23. 28 0.426
24. 29 0.427
25. 30 0.428
26. 31 0.428
27. 32 0.430
28. 33 0.431
29. 34 0.432
30. 35 0.433
31. 36 0.434
32. 37 0.434
33. 38 0.435
34. 39 0.436
35. 40 0.437
36. 41 0.437
37. 42 0.438
38. 43 0.440
39. 44 0.440
40. 45 0.441
41. 46 0.442
Sambungan Lampiran 4
43. 48 0.444
44. 49 0.444
45. 50 0.446
46. 51 0.446
47. 52 0.447
48. 53 0.449
49. 54 0.450
50. 55 0.451
51. 56 0.452
52. 57 0.452
53. 58 0.453
54. 59 0.454
55. 60 0.456
56. 61 0.457
57. 62 0.457
58. 63 0.457
59. 64 0.458
Keterangan:
Lampiran 5. Perhitungan Persamaan Regresi
No Konsentrasi (x) Absorbansi (y) Xy x2 y2
1. 0,0000 0,0000 0,0000 0,0000 0,0000
2. 4,0000 0,2080 0,8320 16,0000 0,0433
3. 6,0000 0,3100 1,8600 36,0000 0,0961
4. 8,0000 0,4220 3,3760 64,0000 0,1781
5. 10,0000 0,5220 5,2200 100,0000 0,2725
6. 12,0000 0,6240 7,4880 144,0000 0,3894
n = 6 ∑x = 40,0000 ∑y = 2,0860 ∑xy = 18,7760 ∑x2 = 360,0000 ∑y2 = 0,9793
x= 6,6667 y= 0,3477
a =
(
) (
)(
)
(
2)
(
)
2X X n Y X XY n
∑
∑
∑
∑
∑
− −a =
(
) ( )(
)
( ) ( )
240 360 6 0860 , 2 40 7760 , 18 6 − − a = 1600 2160 44 , 83 656 , 112 − −
a = 0,0522
b = y - a x
= 0,3477 – (0,0522) (6,6667) = -0,0001
Jadi persamaan regresi y = 0,0522x – 0,0001
r =
(
) (
)(
)
(
) ( )
[
2 2]
[
(
2) ( )
2]
Y Y n X X n Y X XY n
∑
∑
∑
∑
∑
∑
∑
− − −r =
(
) ( )(
)
( ) ( )
[
2]
[
(
) (
)
2]
0860 , 2 9793 , 0 6 40 360 6 0860 , 2 40 7760 , 18 6 − − − r = 218 , 29 216 , 29
Lampiran 6. Daftar Berat Sampel dan Berat Abu a. Buah Petai Padi
Sampel Berat Sampel (g) Berat Abu (g) Serapan
A1 10,001 0,1023 0,450
A2 10,002 0,1030 0,449
A3 10,003 0,1057 0,451
A4 10,004 0,1140 0,449
A5 10,017 0,1147 0,448
A6 10,002 0,1034 0,452
b. Buah Petai Papan
Sampel Berat Sampel (g) Berat Abu (g) Serapan
B1 10,001 0,1147 0,368
B2 10,005 0,1175 0,370
B3 10,009 0,1287 0,371
B4 10,008 0,1160 0,369
B5 10,006 0,1177 0,371
Lampiran 7. Contoh Perhitungan Hasil Penetapan Kadar Fosfor dalam Sampel dengan Menggunakan Persamaan Regresi
Contoh perhitungan konsentrasi fosfor dalam sampel yang beratnya 10,001 dan serapannya 0,4500
X = Konsentrasi Sampel Y = Serapan Sampel
Persamaan garis regresi yang diperoleh : Y = 0,0522 X – 0,0001
X = 0522 , 0 0001 , 0 450 , 0 +
X = 8,6226 8,µg/ml
Maka konsentrasi sampel tersebut adalah 8,6226 µg/ml.
Kadar =
W x V x C FP
Keterangan : C = Konsentrasi larutan sampel (mcg/ml) V = Volume larutan sampel (ml)
FP = Faktor pengenceran W = Berat sampel (g)
Kadar =
001 , 10 ml 10 x ml 100 x μg/ml 6226 , 8
= 862,17 µg/g
Lampiran 8. Data Serapan Sampel, Konsentrasi, dan Kadar Fosfor dengan 6 Kali Replikasi
No Perlakuan Serapan Konsentrasi
(µg/ml) Kadar (µg/g)
1. A1 0,450 8,6226 862,1737
0,449 8,6034 860,1679
0,451 8,6417 863,9108
0,449 8,6030 859,9560
0,448 8,5842 856,9631
0,452 8,6609 865,9168
2. B1 0,368 7,0517 705,0994
0,370 7,0900 708,6456
0,371 7,1091 710,2707
0,369 7,0708 706,5229
0,371 7,1091 710,4932
Lampiran 9. Perhitungan Kadar Fosfor Sebenarnya dalam Buah Petai Padi dan Buah Petai Papan Secara Spektrofotometri Sinar Tampak
a. A1 (Buah Petai Padi)
No. Kadar (µg/g) (xi - xi ) (xi - xi )2
1 862,1737 0,659 0,4342
2 860,1679 -1,3468 1,8138
3 863,9108 2,3961 5,7412
4 859,9560 -1,5587 2,4295
5 856,9631 -4,5516 20,7170
6 865,9168 4,4021 19,3780
n = 6 ∑xi = 5169,0883 xi = 861,5147
∑(xi - xi )2 = 50,5137
Standar Deviasi (SD) =
(
)
(
)
3,17845 5137 , 50 1 2 = = − −
∑
n x xi iµg/g
Pada tingkat kepercayaan 95%, α = 0,05, dk = n – 1, diperoleh nilai ttabel(α/2, dk) = 2,5706.
Data diterima jika thitung < ttabel
thitung =
(
)
n SD/
x xi− i
thitung 1 =
6 3,1784/ 659 , 0 = 0,5078
thitung 2 = -1,0379
thitung 3 = 1,8465
thitung 4 = -1,2012
thitung 5 = -3,5077 (ditolak)
Dari hasil uji statistik di atas diketahui bahwa kadar no. 5 dan 6 ditolak, sehingga dilakukan kembali uji statistik tanpa mengikutsertakan data no. 5 dan 6.
No. Kadar (µg/g) (xi - xi ) (xi - xi )2
1 862,1737 0,6216 0,3863
2 860,1679 -1,3842 1,9160
3 863,9108 2,3587 5,5634
4 859,9560 -1,5961 2,5475
n = 6 ∑xi = 3446,2084 xi = 861,5521
∑(xi - xi )2 = 10,4132
Standar Deviasi (SD) =
(
)
(
)
3 1,86304132 , 10 1 2 = = − −
∑
n x xi iµg/g
Pada tingkat kepercayaan 95%, α = 0,05, dk = n – 1, diperoleh nilai ttabel(α/2, dk) = 3,1824.
Data diterima jika thitung < ttabel
thitung =
(
)
n SD/
x xi− i
thitung 1 =
4 1,8630/ 6216 , 0 = 0,5287
thitung 2 = -1,1779
thitung 3 = -1,3576
thitung 4 = -1,3576
Kadar sebenarnya (µ) terletak antara :
µ = x µg/g ± (ttabel x SD/ n ) µg/g
= 861,5521 ± (3,1824 x 1,8630/ 4 )
b. B1 (Buah Petai Papan)
No. Kadar (µg/g) (xi - xi ) (xi - xi )2
1 705,0994 -2,5190 6,3463
2 708,6456 -1,0272 1,0551
3 710,2707 2,6523 7,0346
4 706,5229 -1,0955 1,2001
5 710,4932 2,8748 8,2644
6 704,6791 -2,9393 8,6394
n = 6 ∑xi = 4245,7109 xi = 707,6184
∑(xi - xi )2 = 32,5399
Standar Deviasi (SD) =
(
)
(
)
5 2,55105399 , 32 1 2 = = − −
∑
n x xi iµg/g
Pada tingkat kepercayaan 95%, α = 0,05, dk = n – 1, diperoleh nilai ttabel(α/2, dk) = 2,5706.
Data diterima jika thitung < ttabel
thitung =
(
)
n SD/
x xi− i
thitung 1 =
6 2,5510/ 5190 , 2 − = -2,4188
thitung 2 = 0,9863
thitung 3 = 2,5468
thitung 4 = -1,0519
thitung 5 = 2,7605 (ditolak)
thitung 6 = -2,8224 (ditolak)
Dari hasil uji statistik di atas diketahui bahwa kadar no. 5 dan 6 ditolak, sehingga dilakukan kembali uji statistik tanpa mengikutsertakan data no. 5 dan 6.
No. Kadar (µg/g) (xi - xi ) (xi - xi )2
1 705,0994 -2,5352 6,4273
2 708,6456 1,0110 1,0221
3 710,2707 2,6361 6,9490
4 706,5229 -1,1117 1,2358
n = 4 ∑xi = 2830,5386 xi = 707,6346
∑(xi - xi )2 = 15,6341
Standar Deviasi (SD) =
(
)
(
)
3 2,28286341 , 15 1 2 = = − −
∑
n x xi iµg/g
Pada tingkat kepercayaan 95%, α = 0,05, dk = n – 1, diperoleh nilai ttabel(α/2, dk) = 3,1824
Data diterima jika thitung < ttabel
thitung =
(
)
n SD/
x xi− i
thitung 1 =
4 2,2828/ 5352 , 2 − = -2,2211
thitung 2 = 0,8857
thitung 3 = 2,3095
thitung 4 = -0,9739
Kadar sebenarnya (µ) terletak antara :
µ = x µg/g ± (ttabel x SD/ n ) µg/g
= 707,6346 ± (3,1824 x 2,2828/ 4 )
Lampiran 10. Data Untuk Penentuan Recovery
Sampel Berat Sampel (g)
Baku yang Ditambahkan
(ml)
Berat Abu Serapan
R1 10,004 1,5 0,1171 0,447
R2 10,000 1,5 0,1145 0,448
Lampiran 11. Perhitungan Kadar Fosfor dalam Buah Petai Padi Setelah Penambahan Larutan Standar dan Perhitungan Uji Perolehan
Kembali (Recovery)
% Recovery =
n ditambahka yang baku jumlah awal sampel dalam analit jumlah -baku penambahan setelah analit l kadar tota x100%
Kadar P standar yang ditambahkan
= Volumelarutan standar yangditambahkan sampel berat standar larutan i konsentras x
= 1,5ml
001 , 10 μg/ml 1000 x
= 150 µg/g
Persamaan Regresi : y = 0,0522 x – 0,0001
Konsentrasi 1 = 8,5651 0522 , 0 0001 , 0 447 , 0 = + µg/ml
Konsentrasi 2 = 8,5842 0522 , 0 0001 , 0 448 ,
0 + =
µg/ml
Konsentrasi 3 = 8,5842 0522 , 0 0001 , 0 448 , 0 = + µg/ml Maka,
Kadar 1 =
g 004 , 10 10 x ml 100 x μg/ml 5651 , 8
= 856,1675 µg/g
Kadar 2 =
g 000 , 10 10 x ml 100 x μg/ml 5842 , 8
= 858,4200 µg/g
Kadar 3 =
g 005 , 10 10 x ml 100 x μg/ml 5842 , 8
= 857,9910 µg/g
Kadar rata-rata =
(
)
3 μg/g 9910 , 857 4200 , 858 1675 ,
856 + +
= 857,5261 µg/g
% Recovery = 100%
No. Kadar (µg/g) (xi - xi ) (xi - xi )2
1 856,1675 -1,3586 1,8457
2 858,4200 0,8939 0,7990
3 857,9910 0,4649 0,2161
∑xi = 2572,5785 xi = 857,5261
∑(xi - xi )2 = 2,8608
SY/X =
(
)
1,19591 -3 2,8608 1
-n
x xi 2
= =
−
∑
iµg/g
RSD = x SY/X
x 100 =
5261 , 857
1959 , 1
Lampiran 12. Data Uji Perolehan Kembali (Recovery) No. Penambahan
Standar
Berat Sampel
(g)
Serapan Konsentrasi (µg/ml)
KT (µg/g)
KA Rata-Rata (µg/g)
% Recovery
1 1,5 ml 10,004 0,447 8,5651 856,1675 707,6346 99,92
2 10,000 0,448 8,5842 858,4200
3 10,005 0,448 8,5842 857,9910
Rata-rata 857,5261
SD : RSD :
1,1959 0,13%
Keterangan:
KT : Kadar Total setelah penambahan baku KA : Kadar Awal
SD : Standard Deviation
Lampiran 13. Perhitungan Batas Deteksi dan Batas Kuantitasi y = 0,0522 x – 0,0001
x1 = 0 y1= - 0,0001
x2 = 4 y2 = 0,0522 . 4 – 0,0001 = 0,2807
x3= 6 y3= 0,0522 . 6 – 0,0001 = 0,3131
x4= 8 y4 = 0,0522 . 8 – 0,0001 = 0,4175
x5 = 10 y5 = 0,0522 . 10 – 0,0001 = 0,5219
x6 = 12 y6 = 0,0522 . 12 – 0,0001 = 0,6263
No. Konsentrasi (x)
Absorbansi
(y) yi y - yi (y-yi)
2
1 0,0000 0,0000 -0,0001 0,0001 0,00000001 2 4,0000 0,2080 0,2807 -0,0007 0,00000049 3 6,0000 0,3100 0,3131 -0,0031 0,00000961 4 8,0000 0,4220 0,4175 0,0045 0,00002025 5 10,0000 0,5220 0,5219 0,0001 0,00000001 6 12,0000 0,6246 0,6263 -0,0023 0,00000529 ∑(y-yi)2= 0,00003566
SB Residual (SY) =
(
(
)
)
(
)
= − =∑
2 6 0,000035 2 -n y -y i 20,0030
Batas Deteksi =
(
)
0522 , 0 0030 , 0 3 Slope SY x 3 =
= 0,1724 µg/ml
Batas Kuantitasi =
(
)
0522 , 0 0030 , 0 10 Slope SY x 10
Lampiran 14. Perhitungan Konsentrasi Larutan Induk Baku KH2PO4 Kadar Fosfor dalam Laruta KH2PO4 =
( )
4 2 4
2
PO KH BM
BAP x
ml V
PO KH mg
=
136 31 ml 250
g 1 , 1
x
= 1000 µg/ml (LIB I)
Dari Larutan Induk Baku I akan dibuat Larutan Induk Baku II dengan
konsentrasi 40 µg/ml sebanyak 250 ml.
V1 x C1 = V2 x C2
x x 1000 = 250 x 40
V1 = 10 ml