STUDI PERBANDINGAN PENETAPAN KADAR ETAMBUTOL HIDROKLORIDA DALAM TABLET ETAMBUTOL SECARA TITRASI BEBAS AIR DAN SPEKTROFOTOMETRI SINAR TAMPAK
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara
OLEH: CUT YULIAZURA
NIM: 071524010
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
HALAMAN PENGESAHAN
STUDI PERBANDINGAN PENETAPAN KADAR ETAMBUTOL HIDROKLORIDA DALAM TABLET ETAMBUTOL SECARA TITRASI
BEBAS AIR DAN SPEKTROFOTOMETRI SINAR TAMPAK
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara
OLEH: CUT YULIAZURA
NIM: 071524010
Medan, Oktober 2009
Disetujui oleh: Disahkan oleh:
Pembimbing I, Dekan,
(Drs. Maralaut Batubara, M.Phill., Apt.) (Prof. Dr. Sumadio Hadisahputra, Apt.) NIP 19510131 197603 1 003 NIP 19531128 198303 1 002
Disetujui oleh: Pembimbing II,
KATA PENGANTAR
Puji dan Syukur kehadirat Allah SWT yang telah melimpahkan rahmat dan
hidayah-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan
skripsi ini untuk memenuhi syarat guna mencapai gelar sarjana Farmasi pada
Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini dengan segala kerendahan hati, penulis mengucapkan
terimakasih yang tiada hentinya kepada Ibunda tercinta Safura dan Ayahanda
Teuku Zulkifli serta suami tercinta yang telah memberikan kasih sayang, doa
serta dorongan kepada penulis selama ini.
Penulis menyadari bahwa skripsi ini tidak akan terwujud tanpa adanya
bantuan dari berbagai pihak, untuk itu penulis, untuk itu penulis mengucapkan
terimakasih yang tulus kepada
1. Drs. Maralaut Batubara, M.Phill., Apt. dan Drs. Muchlisyam,
M.Si., Apt . selaku dosen pembimbing yang telah membimbing
penulis dengan penuh kesabaran dan keikhlasan selama
penelitian hingga selesainya penulisan skripsi ini.
2. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan
Fakultas Farmasi Universitas Sumatera Utara yang telah
mensahkan dan memeberikan pengarahan dalam penyusunan
skrispsi ini.
3. Bapak Dra. Sudarmi MS.i Apt, selaku dosen wali yang selama
ini telah banyak membina dan membimbing penulis selama
4. Semua mahasiswa/i khususnya stambuk 07 yang telah
memberikan semangat dan dorongan kepada penulis dalam
menyelesaikan penelitian dan penulisan skripsi ini.
Semoga Allah SWT memberikan balasan yang berlipat ganda atas segala
kebaikan yang telah diberikan. Akhirnya penulis berharap semoga skripsi ini
bermanfaat bagi kita semua. Amin
Medan, Juni 2009
Penulis
Studi Perbandingan Penetapan Kadar Etambutol Hidroklorida dalam Tablet Etambutol Secara Titrasi Bebas Air dan
Spektrofotometri Sinar Tampak
Abstrak
Titrasi bebas air adalah metode yang biasa digunakan untuk penetapan
kadar etambutol hidroklorida. Dalam kimia farmasi kualitatif salah satu reaksi
untuk identifikasi etambutol hidroklorida adalah pembentukan kompleks
berwarna antara CuSO4 dengan etambutol hidroklorida dalam suasana alkalis.
Kompleks tersebut yang diteliti sebagai salah satu metode penetapan kadar
etambutol hidroklorida dengan spektrofotometri sinar tampak. Metode ini
didasarkan pada terbentuknya produk berwarna biru dari reaksi antara etambutol
hidroklorida dengan CuSO4 dalam suasana alkalis yang stabil selama 4 menit
diukur pada panjang gelombang maksimum 620 nm.
Kadar etambutol hidroklorida dihitung menggunakan kurva baku Y =
0,000543X + 0,004667, r = 0,9998. Hasil aplikasi kedua metode tersebut setelah
diuji secara statistik melalui uji t-berpasangan tidak terdapat perbedaan yang
signifikan antara keduanya, dan hasil yang diperoleh masing-masing sampel yaitu
98,18 ± 1,41% dan 97,24 ± 4,85% untuk Arsitam tablet, 101,65 ± 1,38% dan
103,52 ± 3,95% untuk Kalbutol tablet serta 99,90 ± 2,0% dan 99,51 ± 2,83%
untuk Etibi tablet.
Hasil yang diperoleh dari kedua metode tersebut masih memenuhi syarat
Farmakope Indonesia edisi IV, yang menyebutkan bahwa tablet etambutol
hidroklorida mengandung etambutol hidroklorida tidak kurang dari 95,0 % dan
tidak lebih dari 105,0 % dari jumlah yang tertera pada etiket.
Kata kunci : etambutol hidroklorida, spektrofotmetri sinar tampak, titrasi bebas
Comparison study determination of ethambutol hydrochloride between non-aqueous titration and visible spectrophotometry
Abstract
Non-aqueous titration is one of method common used to determine
ethambutol hydrochloride. In qualitative analysis one of the reaction for
ethambutol hydrochloride identification is coloured complex formation between
CuSO4 and ethambutol hydrochloride in alkali condition and yield blue product
was stabled about 4 minutes and giving maximum absorption at 620 nm.
The concentration of ethambutol hydrochloride was calculated by using
standard curve Y = 0,000543X + 0,004667, r = 0,9998. The result from non
aqueous titration and visible spectrophotometry are 98,18 ± 1,41% and 97,24 ±
4,85% for Arsitam tablet, 101,65 ± 1,38% and 103,52 ± 3,95% for Kalbutol tablet,
99,90 ± 2,0% and 99,51 ± 2,83% for Etibi tablet. T-pair test showed nothing
significance difference from both of yield.
The results still allow Indonesian Pharmacopeia ed IV that mention
ethambutol tablet must contain etambutol hydrochloride not less about 95,0 % and
not more about 105,0% from total as described in etiquette.
Key words : ethambutol hydrochloride, visible spektrophotometry, non-aqueous
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... ii
ABSTRAK ... iii
ABSTRACT ... iv
DAFTAR ISI ... v
DAFTAR TABEL ... viii
DAFTAR GAMBAR... ix
DAFTAR LAMPIRAN ... x
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis... 2
1.4 Tujuan Penelitian ... 3
BAB II METODE PENELITIAN ... 4
2.1 Sampel... 4
2.2 Bahan-bahan ... 4
2.3 Alat-alat ... 4
2.4 Tempat Penelitian ... 4
2.5 Prosedur ... 5
2.5.1 Metode Sampling ... 5
2.5.2.1 Air bebas CO2 ... 5
2.5.2.2 HClO4 0,1 N ... 5
2.5.2.3 Hg (CH3COOH)2 6% ... 5
2.5.2.4 Indikator Kristal Violet 0,2%... 5
2.5.2.5 NaOH 0,5 N ... 6
2.5.2.6 CuSO4 0,5 N ... 6
2.5.3 Pembuatan Larutan Induk Baku Etambutol hidroklorida.... 6
2.5.3.1 Larutan Induk Baku I ... 6
2.5.4 Penetapan Kadar Etambutol Hidroklorida ... 6
2.5.4.1 Titrasi Bebas Air ... 6
2.5.4.2 Spektrofotmetri Sinar Tampak ... 7
2.6 Uji Validasi Metode Analisis ... 8
2.6.1 Uji Perolehan Kembali ... 8
2.6.1.1 Pembuatan Larutan Baku... 9
2.6.1.2 Prosedur Uji Perolehan Kembali... 9
2.6.2 Batas Deteksi dan Batas Kuantitasi ... 10
2.6.3 Analisa Data secara Statistik ... 10
2.6.4 Pengujian Beda Nilai Rata-Rata ... 11
BAB III HASIL DAN PEMBAHASAN ... 12
3.1 Penetapan Kadar Etambutol Hidroklorida ... 12
3.1.1 Titrasi Bebas Air (TBA) ... 12
3.1.1.1 Pembakuan HClO4 0,1 N ... 12
3.1.1.2 Kadar Etambutol Hidroklorida secara TBA ... 13
3.1.2.1 Panjang Gelombang Maksimum ... 14
3.1.2.2 Waktu Kerja ... 15
3.1.2.3 Kurva Kalibrasi Etambutol Hidroklorida ... 16
3.1.2.4 Kadar Etambutol Hidroklorida Secara Spektrofotometri Sinar Tampak ... 17
3.2 Batas Deteksi dan Batas Kuantitasi ... 18
3.3 Uji Perolehan Kembali ... 19
BAB IV KESIMPULAN DAN SARAN ... 20
4.1 Kesimpulan ... 20
4.2 Saran ... 20
DAFTAR PUSTAKA ... 21
DAFTAR TABEL
Halaman
Tabel 1. Nilai Qkritis pada Taraf Kepercayaan 95% ... 11 Tabel 2. Hasil Pembakuan Larutan Standar Asam Perklorat 0,1 N ... 12 Tabel 3. Kadar Etambutol Hidroklorida pada tiap Sampel Secara Titrasi
Bebas Air ... 13
DAFTAR GAMBAR
Halaman
Gambar 1. Kurva serapan etambutol BPFI dengan konsentrasi 400,0 mcg/ml yang diukur secara spektrofotometri sinar
tampak pada panjang gelombang 400 – 800 nm ... 14
Gambar 2. Kurva waktu kerja etambutol hidroklorida baku dengan
konsentrasi 800,0 mcg/ml secara spektrofotometri sinar tampak pada panjang gelombang 620nm... 15
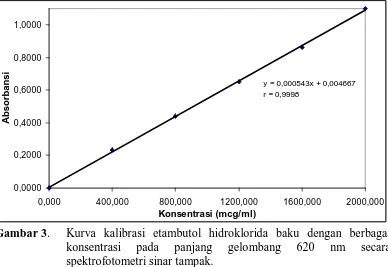
Gambar 3. Kurva kalibrasi etambutol hidroklorida baku dengan
berbagai konsentrasi pada panjang gelombang 620 nm secara spektrofotometri sinar tampak... 16
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Perhitungan Pembakuan Larutan Asam Perklorat 0,1 N...22 Lampiran 2. Data Berat Sampel, Volume Titrasi dan Kadar Etambutol
Hidroklorida pada Sampel...23
Lampiran 3. Contoh Perhitungan Kadar Etambutol Hidroklorida pada
Arsitam tablet secara Titrasi Bebas Air……….24
Lampiran 4. Perhitungan Statistik Kadar Etambutol Hidroklorida pada Arsitam tablet yang ditentukan secara Titrasi Bebas Air.…….25
Lampiran 5. Perhitungan Statistik Kadar Etambutol Hidroklorida pada Kalbutol tablet yang ditentukan secara Titrasi Bebas
Air...26
Lampiran 6. Perhitungan Statistik Kadar Etambutol Hidroklorida pada Etibi tablet yang ditentukan secara Titrasi Bebas Air...27 Lampiran 7. Data Kurva Kalibrasi Etambutol Hidroklorida BPFI
yang diukur dengan Spektrofotometri Sinar Tampak pada panjang gelombang 620 nm dan perhitungan persamaan garis regresi...28
Lampiran 8. Limit Deteksi dan Limit Kuantitasi Etambutol Hidroklorida berdasarkan data kurva kalibrasi.………..29
Lampiran 9. Perhitungan Statistik Kadar Etambutol Hidroklorida pada Arsitam tablet yang ditentukan secara Spektrofotometri Sinar Tampak pada panjang gelombang 620 nm.………30
Lampiran 10. Perhitungan Statistik Kadar Etambutol Hidroklorida pada Kalbutol tablet yang ditentukan secara Spektrofotometri Sinar Tampak pada panjang gelombang 620 nm.………31
Lampiran 11. Perhitungan Statistik Kadar Etambutol Hidroklorida pada Etibi tablet yang ditentukan secara Spektrofotometri
Sinar Tampak pada panjang gelombang 620 nm...32
Lampiran 13. Pengujian Beda Nilai Rata-Rata Kadar Etambutol Hidroklorida pada Kalbutol tablet antara hasil Titrasi
Bebas Air dan Spektrofotometri Sinar Tampak...34
Lampiran 14. Pengujian Beda Nilai Rata-Rata Kadar Etambutol Hidroklorida pada Etibi tablet antara hasil Titrasi Bebas Air dan Spektrofotometri Sinar Tampak...35
Lampiran 15. Data hasil Uji Perolehan Kembali Etambutol Hidroklorida...36
Lampiran 16. Contoh perhitungan kadar Etambutol Hidroklorida.…………37
Lampiran 17. Contoh Perhitungan Uji Perolehan Kembali Kadar Etambutol Hidroklorida pada Etibi tablet.……….38
Lampiran 18. Tabel Konsentrasi Larutan Etambutol Hidroklorida Baku dan Kurva Kalibrasi...39
Lampiran 19. Penentuan Waktu Kerja Pengukuran Etambutol Hidroklorida baku (C = 800,0 mcg/ml) dengan Spektrofotometer Sinar Tampak pada panjang gelombang 620 nm...40
Lampiran 20. Data Hasil Pengukuran Kadar Etambutol Hidroklorida dalam Sampel dan Hasil Uji Perolehan Kembali Secara Spektrofotmetri Sinar Tampak...41
Lampiran 21. Gambar sampel...43
Lampiran 22. Gambar Spektrofotometer Sinar Tampak...44
Studi Perbandingan Penetapan Kadar Etambutol Hidroklorida dalam Tablet Etambutol Secara Titrasi Bebas Air dan
Spektrofotometri Sinar Tampak
Abstrak
Titrasi bebas air adalah metode yang biasa digunakan untuk penetapan
kadar etambutol hidroklorida. Dalam kimia farmasi kualitatif salah satu reaksi
untuk identifikasi etambutol hidroklorida adalah pembentukan kompleks
berwarna antara CuSO4 dengan etambutol hidroklorida dalam suasana alkalis.
Kompleks tersebut yang diteliti sebagai salah satu metode penetapan kadar
etambutol hidroklorida dengan spektrofotometri sinar tampak. Metode ini
didasarkan pada terbentuknya produk berwarna biru dari reaksi antara etambutol
hidroklorida dengan CuSO4 dalam suasana alkalis yang stabil selama 4 menit
diukur pada panjang gelombang maksimum 620 nm.
Kadar etambutol hidroklorida dihitung menggunakan kurva baku Y =
0,000543X + 0,004667, r = 0,9998. Hasil aplikasi kedua metode tersebut setelah
diuji secara statistik melalui uji t-berpasangan tidak terdapat perbedaan yang
signifikan antara keduanya, dan hasil yang diperoleh masing-masing sampel yaitu
98,18 ± 1,41% dan 97,24 ± 4,85% untuk Arsitam tablet, 101,65 ± 1,38% dan
103,52 ± 3,95% untuk Kalbutol tablet serta 99,90 ± 2,0% dan 99,51 ± 2,83%
untuk Etibi tablet.
Hasil yang diperoleh dari kedua metode tersebut masih memenuhi syarat
Farmakope Indonesia edisi IV, yang menyebutkan bahwa tablet etambutol
hidroklorida mengandung etambutol hidroklorida tidak kurang dari 95,0 % dan
tidak lebih dari 105,0 % dari jumlah yang tertera pada etiket.
Kata kunci : etambutol hidroklorida, spektrofotmetri sinar tampak, titrasi bebas
Comparison study determination of ethambutol hydrochloride between non-aqueous titration and visible spectrophotometry
Abstract
Non-aqueous titration is one of method common used to determine
ethambutol hydrochloride. In qualitative analysis one of the reaction for
ethambutol hydrochloride identification is coloured complex formation between
CuSO4 and ethambutol hydrochloride in alkali condition and yield blue product
was stabled about 4 minutes and giving maximum absorption at 620 nm.
The concentration of ethambutol hydrochloride was calculated by using
standard curve Y = 0,000543X + 0,004667, r = 0,9998. The result from non
aqueous titration and visible spectrophotometry are 98,18 ± 1,41% and 97,24 ±
4,85% for Arsitam tablet, 101,65 ± 1,38% and 103,52 ± 3,95% for Kalbutol tablet,
99,90 ± 2,0% and 99,51 ± 2,83% for Etibi tablet. T-pair test showed nothing
significance difference from both of yield.
The results still allow Indonesian Pharmacopeia ed IV that mention
ethambutol tablet must contain etambutol hydrochloride not less about 95,0 % and
not more about 105,0% from total as described in etiquette.
Key words : ethambutol hydrochloride, visible spektrophotometry, non-aqueous
BAB I
PENDAHULUAN
1.1Latar Belakang
Dalam bidang farmasi, pemeriksaan mutu obat mutlak diperlukan agar
obat dapat sampai pada reseptor dengan kadar yang tepat, sehingga memberikan
efek terapi yang dikehendaki. (Susidarti dkk, 2008).
Tuberkulosis (TBC) adalah penyakit infeksi yang tersebar sangat luas dan
merupakan penyebab utama kematian bagi sebagian besar masyarakat Indonesia.
Penyakit ini disebabkan oleh bakteri Mycobacterium tuberculosis yang dapat
menyerang berbagai bagian tubuh antara lain paru-paru, kulit, tulang, kelenjar
getah bening, kelenjar tiroid dan saluran urogenital. Data global menunjukkan
bahwa sepertiga dari penduduk dunia pernah terkontaminasi oleh bakteri TBC,
tetapi hanya 10% dari jumlah itu yang terinfeksi. (Oekar dkk, 2007).
Salah satu jenis Obat anti tuberkulosis (OAT) yang digunakan untuk
tujuan tersebut adalah aethambutoli. Untuk hal tersebut kadar aethambutoli dalam
tablet aethambutoli harus memenuhi syarat. OAT lain yang digunakan adalah
paduan standar INH, PAS dan Streptomisin selama satu sampai dua tahun. Para
Amino Acid (PAS) kemudian diganti dengan Pirazinamid.
Uji kuantitatif untuk aethambutoli hydrochlorida (etambutol hidroklorida)
disebutkan dalam Farmakope Indonesia Edisi IV kadarnya secara titrasi bebas air
dan spektrofotometri sinar tampak belum ada disebutkan. Menurut Roth, dkk
Berdasarkan reaksi kompleks yang terbentuk antara aethambutoli hydrochlorida
(etambutol hidroklorida) dengan CuSO4
1. Apakah warna yang terbentuk dari reaksi kompleks antara CuSO
dalam suasana basa akan dimanfaatkan
dalam penetapan kadar aethambutoli hydrochlorida (etambutol hidroklorida)
secara spektrofotometri sinar tampak. Hasil yang diperoleh nantinya akan
dibandingkan dengan hasil secara titrasi bebas air.
1.2 Perumusan Masalah
4
2. Apakah reaksi kompleks yang terbentuk antara CuSO
dengan
Aethambutoli hydrochlorida (etambutol hidroklorida) dalam suasana basa
stabil dalam waktu yang lama?.
4
3. Apakah ada perbedaan hasil yang diperoleh dari penetapan kadar
Aethambutoli hydrochlorida (etambutol hidroklorida) dalam tablet
aethambutoli secara spektrofotometri sinar tampak dan titrasi bebas air? dengan
Aethambutoli hydrochlorida (etambutol hidroklorida) dalam suasana basa
dapat diukur secara kuantitatif?.
4. Apakah kadar Aethambutoli hydrochlorida (etambutol hidroklorida) yang
diperoleh memenuhi persyaratan Farmakope Indonesia edisi IV?
1.3 Hipotesis
1. Warna yang dihasilkan dari reaksi kompleks antara CuSO4
2. Reaksi kompleks yang terbentuk antara CuSO
dengan
Aethambutoli hydrochlorida (etambutol hidroklorida) dalam suasana basa
stabil dalam waktu yang lama.
4 dengan Aethambutoli
hydrochlorida (etambutol hidroklorida) dalam suasana basa dapat diukur
3. Ada perbedaan hasil yang diperoleh dari penetapan kadar Aethambutoli
hydrochlorida (etambutol hidroklorida) dalam tablet aethambutoli secara
spektrofotometri sinar tampak dan titrasi bebas air.
4. Kadar Aethambutoli hydrochlorida (etambutol hidroklorida) dalam tablet
aethambutoli memenuhi syarat Farmakope Indonesia edisi IV.
1.4Tujuan Penelitian
1. Melakukan pengukuran waktu kerja hasil reaksi kompleks antara CuSO4
2. Melakukan penetapan kadar aethambutoli hydrochlorida (etambutol
hidroklorida) baku secara spektrofotometri sinar tampak.
dengan aethambutoli hydrochlorida (etambutol hidroklorida) dalam
suasana basa
3. Melakukan penetapan kadar aethambutoli hydrochlorida (etambutol
hidroklorida) dalam tablet aethambutoli secara titrasi bebas air dan
spektrofotmetri sinar tampak.
4. Membandingkan hasil yang diperoleh dari masing-masing metode yang
BAB II
TINJAUAN PUSTAKA
2.1 Aethambutoli hydrochlorida (etambutol hidroklorida)
Aethambutoli hydrochlorida (etambutol hidroklorida) memiliki nama lain
yaitu (+)-2,2’-(Etilenadiimino)-di-1-butanol dihidroklorida juga dikenal dengan
sebutan EMB atau E, memiliki rumus molekul C10H24N2O2.2HCl dengan berat
molekul sebesar 277,23 (Ditjen POM, 1995; Anonim, 2009).
Gambar 2.1. Struktur Molekul Aethambutoli hydrochlorida (etambutol hidroklorida)
Aethambutoli hydrochlorida (etambutol hidroklorida) berbentuk serbuk
hablur putih, mudah larut dalam air, etanol dan metanol. Sukar larut dalam eter
dan kloroform. Dikenal sebagai obat antimikobakterial yang bersifat
bakteriostatik yang diberikan dalam pengobatan tuberculosis. Biasanya diberikan
kombinasi dengan obat anti tuberculosis lainnya seperti isonoazid, rifampisin dan
pirazinamid (Ditjen POM, 1995; Anonim, 2009).
Untuk identifikasi etambutol, menurut Roth dkk (1991), dapat dilakukan
dengan IR, KLT dan dengan reaksi warna yakni dengan penambahan larutan
akan menghasilkan warna biru yang merupakan akibat dari terbentuknya
kompleks etambutol dengan tembaga. Reaksi ini merupakan reaksi khas dari obat
yang mempunyai struktur 1,2-aminoalkohol atau 1,2-diamin. Kompleks etambutol
dengan tembaga mempunyai serapan maksimum pada panjang gelombang 265 nm
dan 610 nm dan lebih mungkin ditentukan secara kolorimetri.
2.2 Metode-metode kuantitatif
Kimia Farmasi Analisis melibatkan penggunaan sejumlah teknik dan
metode analisis untuk memperoleh aspek kualitatif, kuantitatif dan informasi
struktur dari suatu senyawa obat pada khususnya, dan bahan kimia pada
umumnya.
Gandjar dan Rohman (2007) menyebutkan istilah prosedur analisis
seringkali dikacaukan dengan istilah teknik dan metode analisis. Teknik analis
hanya merujuk pada pengukuran dan evaluasi hasil pengukuran. Metode analisis
merujuk pada penetapan kadar senyawa tertentu dan evaluasi hasil pengukuran,
sedangkan prosedur analisis merupakan serangkaian proses mulai dari penyiapan
sampel sampai evaluasi hasil pengukuran.
Ada beberapa proses fisika-kimia yang dapat digunakan untuk
memberikan informasi analisis. Proses ini berkaitan dengan sifat atom dan
molekul serta fenomena-fenomena yang mampu menjadikan elemen-elemen atau
senyawa-senyawa tersebut dapat dideteksi atau dapat diukur secara kuantitatif
pada kondisi yang dapat dikontrol. Proses-proses yang mendasari ini semua
2.2.1 Metode Titrimetri
Metode titirimetri masih digunakan secara luas karena merupakan metode
yang tahan, murah, dan mampu memberikan ketepatan (presisi) yang tinggi.
Keterbatasan metode ini adalah kurang spesifik.
Menurut Gandjar dan Rohman (2007) untuk dapat dilakukan analisis
volumetri harus dipenuhi syarat-syarat berikut:
1. Reaksinya harus berlangsung sangat cepat.
2. Reaksinya harus sederhana dan dapat dinyatakan dalam persamaan reaksi.
3. Harus ada perubahan yang dapat diamati pada saat titik ekivalen dicapai,
baik secara kimia maupun fisika.
4. Harus ada indikator jika syarat ketiga tidak terpenuhi.
Sebagai contoh reaksi yang cocok untuk titrasi adalah penentuan
konsentrasi larutan asam klorida melalui titasi dengan larutan natrium hidroksida.
Dalam rekasi tidak tersebut tidak ada reaksi samping, yakni:
HCl + NaOH NaCl + H2O; K =1×1014
Menurut Gandjar dan Rohman (2007), berdasarkan reaksi kimia yang
terjadi selama titrasi, volumetri dapat dikelompokkan menjadi 4 jenis:
1. Reaksi asam-basa (asidi alkalimetri = netralisasi).
Penetapan kadar ini berdasarkan pada perpindahan proton dari zat yang
bersifat asam atau basa, baik dalam lingkungan air ataupun dalam
lingkungan bebas air (TBA = titrasi bebas air).
Dasar yang digunakan adalah perpindahan elektron. Penetapan kadar
senyawa berdasarkan reaksi ini digunakan secara luas seperti
permanganometri, serimetri, iodi-iodometri serta bromometri.
3. Reaksi pengendapan (presipitasi).
Prinsip yang digunakan dalam metode ini adalah berdasarkan pada
terbentuknya endapan yang sukar larut, misalnya argentometri.
4. reaksi pembentukan kompleks.
Dasar yang digunakan adalah terjadinya reaksi pembentukan kompleks
antara zat pengkompleks dengan ion logam. Metode penetapan kadar yang
menggunakan prinsip ini adalh kompleksometri.
2.2.1.1 Tirasi bebas air
Titrasi Bebas Air (TBA) merupakan prosedur titrimetri yang paling umum
yang digunakan dalam Farmakope. Metode ini mempunyai dua keuntungan yakni
metode ini cocok untuk titrasi asam-asam atau basa-basa yang sangat lemah dan
pelarut yang digunakan adalah pelarut organik yang juga mampu untuk
melarutkan analit-analit organik.
Air dapat bersifat sebagai asam lemah dan basa lemah. Oleh karena itu,
dalam lingkungan air, air dapat berkompetisi dengan asam-asam atau basa-basa
yang sangat lemah dalam hal menerima atau memberi proton.
Adanya pengaruh kompetisi ini berakibat pada kecilnya titik infleksi pada
kurva titrasi asam sangat lemah dan basa sangat lemah sehingga mendekati batas
pH 0 dan 14. oleh karena itu deteksi titik akhir titrasi sangat sulit. Sebagai aturan
umum , basa-basa dengan pKa < 7 atau asam-asam dengan pKa > 7 tidak dapt
2.2.2 Spektrofotometri
Para kimiawan telah lama menggunakan bantuan warna sebagai bantuan
dalam mengenali zat-zat kimia. Spektrofotometri dapat dianggap sebagai suatu
perluasan pemeriksaan visual yang dengan studi lebih mendalam dari absorpsi
energi radiasi oleh macam-macam zat kimia memperkenankan dilakukannya
pengukuran ciri-ciri serta kuantitatifnya dengan ketelitian lebih besar (Day dan
Underwood, 1993).
Benda-benda bercahaya, seperti matahari atau bola lampu istrik
memancarkan suatu spektrum luas terdiri dari banyak panjang gelombang.
Panjang gelombang yang mampu mempengaruhi retina mata manusia dan
karenanya menyebabkan kesan-kesan subjektif dari penglihatan dikenal dengan
sinar tampak. Tatapi banyak dari radiasi yang dipancarkan oleh benda-benda
panas terletak di luar daerah dimana mata masih peka. Keseluruhan spektrum
kira-kira dikelompokka n seperti pada gambar berikut.
2.2.2.1 Spektrofotometri Ultraviolet dan Sinar Tampak
Dalam aspek kuantitatif, suatu berkas radiasi dikenakan pada cuplikan dan
intensitas sinar radiasi yang diteruskan diukur besarnya. Radiasi yang diserap oleh
cuplikan ditentukan dengan membandingkan intensitas sinar yang diteruskan
dengan sinar yang diserap jika tidak ada spesies penyerap lainnya.
Jika sinar monokromatik dilewatkan melalui suatu lapisan larutan dengan
ketebalan db, maka penurunan intensitas sinar (dI) karena melewati lapisan
larutan tersebut berbanding langsung dengan intensitas radiasi (I), konsentrasi
spesies yang menyerap (c) secara matematis pernyataan ini dapat dituliskan:
kIcdb dI =
− ...(1)
Persamaan di atas dapat disusun ulang dan diintegralkan dengan batas Io
(intensitas sinar mula-mula) dan I (intensitas sinar setelah melewati larutan
dengan ketebalan b).
∫
=∫
−I Io b cdb k I dI 0 ...(2) kbc Io I =−ln ...(3)
kbc e Io
I = ⋅ − ...(4)
Dengan mengubah menjadi logaritma basis 10, maka akan didapatkan persamaan:
kbc Io
I = ⋅10− ...(5)
Yang mana k =a
303 ,
2 , maka persamaan (5) di atas diubah menjadi persamaan (6)
abc
A= ...(7) Yang mana: A = absorbansi
a = absorptivitas
b = tebal kuvet (cm)
c = konsentrasi
Persamaan (7) dikenal dengan hukum Lambert-Beer. Kuantitas
spektroskopi yang diukur biasanya adalah transmitans (T = I/Io), dan absorbansi
(A); yang mana A = log 1/T.
Absorptivitas (a) merupakan suatu konstanta yang tidak tergantung pada
konsentrasi, tebal kuvet dan intensitas radiasi yang mengenai larutan sampel.
Absorptivitas tergantung pada suhu, pelarut, struktur molekul, dan panjang
gelombang radiasi. Satuan a ditentukan oleh satuan-satuan b dan c. Jika satuan c
dalam molar (M) maka absorptivitas disebut dengan absorptivitas molar dan
disimbolkan dengan ε dengan satuan M-1cm-1 atau liter.mol-1cm-1
% 1 1cm
E
. Jika c
dinyatakan dalam persen berat/volume (g/100mL) maka absorptivitas dapat ditulis
dengan juga sering ditulis dengan A1cm1% (Gandjar dan Rohman, 2007).
Sinar tampak mempunyai panjang gelombang 400-750 nm.
Spektofotometri sinar tampak digunakan untuk penetapan kadar senyawa yang
berwarna (Gandjar dan Rohman, 2007).
Menurut Gandjar dan Rohman (2007), ada beberapa hal yang harus
diperhatikan dalam analisis dengan spektrofotometri sinar tampak terutama untuk
senyawa yang tidak berwarna yang akan dianalisis yaitu:
Cara yang digunakan adalah dengan merubah menjadi senyawa lain atau
direaksikan dengan pereaksi tertentu sehingga dapat menyerap sinar tampak.
b. Waktu kerja (operating time)
Tujuannya ialah untuk mengetahui waktu pengukuran yang stabil. Waktu
kerja ditentukan dengan mengukur hubungan antara waktu pengukuran
dengan absorbansi larutan.
c. Pemilihan panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang
gelombang yang mempunyai absorbansi maksimal. Untuk memilih panjang
gelombang maksimal dilakukan dengan membuat kurva hubungan antara
absorbansi dengan panjang gelombang dari suatu larutan baku dengan
konsentrasi tertentu.
d. Pembuatan kurva baku
Dilakukan dengan membuat seri larutan baku dalam berbagai konsentrasi
kemudian absorbansi tiap konsentrasi diukur lalu dibuat kurva yang
merupakan hubungan antara absorbansi dengan konsentrasi. Kurva baku yang
lurus menandakan bahwa hukum Lambert-Berr terpenuhi.
e. Pembacaan absorbansi sampel
Absorbansi yang terbaca pada spektrofotometer hendaknya antara 0,2
sampai 0,8 atau 15% sampai 70% jika dibaca sebagai transmitan. Hali ini
disebabkan karena pada kisaran nilai absorbansi tersebut kesalahan fotometrik
2.3 Tuberkulosis
Tuberkulosis adalah penyakit menular langsung yang disebabkan oleh
kuman TB (Mycobacterium tuberculosis). Sebagian besar kuman TB menyerang
paru, tetapi dapat juga mengenai organ tubuh lainnya.
Tuberkulosis dapat menular melalui:
- Sumber penularan adalah pasien TB BTA (basil tahan asam) positif.
- Pada waktu batuk atau bersin, pasien menyebarkan kuman ke udara dalam
bentuk percikan dahak (droplet nuclei). Sekali batuk dapat menghasilkan
sekitar 3000 percikan dahak.
- Umumnya penularan terjadi dalam ruangan dimana percikan dahak berada
dalam waktu yang lama. Percikan dapat bertahan selama beberapa jam dalam
keadaan yang gelap dan lembab.
- Daya penularan seorang pasien ditentukan oleh banyaknya kuman yang
dikeluarkan dari parunya. Makin tinggi derajat kepositifan hasil pemeriksaan
dahak, makin menular pasien tersebut.
- Faktor yang memungkinkan seseorang terpajan kuman TB ditentukan oleh
konsentrasi percikan dalam udara dan lamanya menghirup udara tersebut.
Penanggulangan Tuberkulosis (TB) di Indonesia sudah berlangsung sejak
zaman penjajahan Belanda namun terbatas pada kelompok tertentu. Setelah
perang kemerdekaan, TB ditanggulangi melalui Balai Pengobatan Penyakit Paru
Paru (BP-4). Sejak tahun 1969 penanggulangan dilakukan secara nasional melalui
Puskesmas. Obat anti tuberkulosis (OAT) yang digunakan adalah paduan standar
INH, PAS dan Streptomisin selama satu sampai dua tahun. Para Amino Acid
OAT jangka pendek yang terdiri dari INH, Rifampisin dan Etambutol selama 6
bulan. Sejak tahun 1995, program nasional penanggulangan TB mulai
melaksanakan strategi DOTS dan menerapkannya pada Puskesmas secara
bertahap.
2.4 Validasi
Validasi adalah suatu tindakan penilaian terhadap parameter tertentu pada
prosedur penetapan yang dipakai untuk membuktikan bahwa parameter tersebut
memenuhi persyaratan untuk penggunaannya.
Validasi dilakukan untuk menjamin bahwa metode analisis yang dilakukan
akurat, spesifik, reprodusibel, dan tahan pada kisaran analit yang dianalisis
(Gandjar dan Rohman, 2007).
2.4.1 Perolehan Kembali
Persen perolehan kembali digunakan untuk menyatakan kecermatan.
Kecermatan merupakan ukuran yang menunjukkan derajat kedekatan hasil
analisis dengan kadar analit yang sebenarnya.
Perolehan kembali dapat dihitung dengan rumus sebagai berikut :
% perolehan kembali = −* ×100
A A F
C C C
Keterangan :
CF = konsentrasi sampel yang diperoleh setelah penambahan larutan baku
CA = konsentrasi sampel awal
2.4.2 Batas Deteksi dan Batas Kuantitasi
Batas deteksi adalah jumlah terkecil analit dalam sampel yang dapat
dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko.
Batas kuantitasi merupakan kuantitas terkecil analit dalam sampel yang masih
dapat memenuhi kriteria cermat dan seksama. Batas-batas tersebut dapat diperoleh
dari kalibrasi standar yang diukur sebanyak 6 sampai 10 kali.
Batas deteksi dan batas kuantitasi dapat dihitung dengan rumus sebagai berikut :
Batas deteksi =
Slope SB
3
Batas Kuantitasi =
Slope SB
10
Keterangan : SB = simpangan baku
2.4.3 Analisa Data secara Statistik
Kadar aethambutoli hydrochlorida (etambutol hidroklorida) yang
diperoleh perhitungan menggunakan persamaan garis regresi, diuji secara statistik
dengan uji Q.
Rumus yang digunakan:
Qhitung
terendah Nilai
tertinggi Nilai
terdekat yang
Nilai -dicurigai yang
Nilai
=
Hasil pengujian atau nilai Q yang diperoleh ditinjau terhadap daftar harga Q pada
Tabel 2, apabila Qhitung > Qkritis maka data tersebut ditolak (Gandjar dan Rohman,
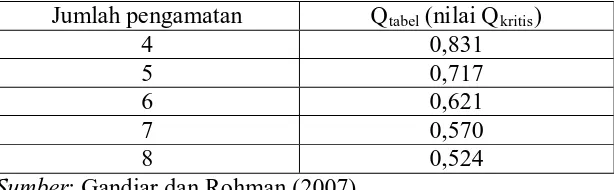
Tabel 1. Nilai Qkritis Jumlah pengamatan
pada Taraf Kepercayaan 95%
Qtabel (nilai Qkritis)
4 0,831
5 0,717
6 0,621
7 0,570
8 0,524
Sumber: Gandjar dan Rohman (2007).
3.4.3.1 Rata – Rata Kadar Aethambutoli hydrochlorida (etambutol hidroklorida)
Kadar aethambutoli hydrochlorida (etambutol hidroklorida) yang
diperoleh dari hasil pengukuran masing-masing 6 larutan sampel, ditentukan
rata-ratanya secara statistik dengan taraf kepercayaan 95% dengan rumus sebagai
berikut:
n s
t α
µ =X± 12
(Wibisono, 2005)
3.4.9.2 Pengujian Beda Nilai Rata-Rata
Untuk menguji dua metode analisis yang berbeda dilakukan
dengan uji t-berpasangan (paired t-test). Uji ini dilakukan dengan mencari selisih
setiap pasang hasil dari kedua metode. Kemudian selisihnya dirata-ratakan lalu
dicari simpangan bakunya (SD). Hasil dari kedua metode dikatakan berbeda
secara signifikan jika t hitung > t kritik pada taraf kepercayaan 95%. Nilai t hitung dapat
dicari dengan rumus:
t hitung
( )
N SDX −µ =
µ = Nilai sebenarnya (dalam hal ini nilainya = 0)
SD = Simpangan baku selisih
N = Jumlah perlakuan
BAB III
METODE PENELITIAN
Metode penelitian yang dilakukan adalah metode deskriptif karena
menggambarkan sifat dari suatu keadaan secara sistematis, yaitu untuk penetapan
kadar aethambutoli hydrochlorida baku dan aethambutoli hydrochlorida yang
terdapat pada tablet etambutol.
2.1 Sampel
Sampel yang digunakan berasal dari industri farmasi dengan tiga merek
tablet yang mengandung aethambutoli hydrochlorida yaitu Kalbutol (PT. Kalbe
Farma), Arsitam (PT. Meprofarm), Etibi (Zoja Milano) dan Aethambutoli
hydrochlorida baku (BPFI).
2.2 Bahan-bahan
Bahan-bahan yang digunakan dalam penelitian ini berkualitas p.a.
produksi E-Merck yaitu asam perklorat, raksa (II) asetat, asam asetat glasial,
kalium biftalat, natrium hidroksida, tembaga (II) sulfat, kristal violet dan yang
tidak berkualitas p.a. yaitu air suling.
2.3 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah satu unit alat
spektrofotometer uv-vis (Shimadzu mini 1240), neraca listrik (AND GF-200),
oven, desikator, dan alat-alat gelas sesuai kebutuhan
2.4 Tempat Penelitian
2.5 Prosedur
2.5.1 Metode Sampling
Metode pengambilan sampel dilakukan dengan cara sampling purposif
yang dikenal juga sebagai sampling pertimbangan dimana sampel ditentukan atas
dasar pertimbangan bahwa sampel yang tidak terambil mempunyai karakteristik
yang sama dengan sampel yang sedang diteliti ( Sudjana, 2001). Dari beberapa
nama sediaan tablet etambutol yang diamati, maka dilakukan sampling dan
sampel yang diambil adalah Arsitam, Kalbutol dan Etibi.
2.5.2 Pembuatan Pereaksi 2.5.2.1Air bebas CO
Dididihkan sejumlah air suling selama 5 menit atau lebih setelah mendidih
didiamkan sampai dingin dan ditutup (Ditjen POM, 1995).
2
2.5.2.2HClO4
Dicampurkan 8,5 ml HClO 0,1 N
4
2.5.2.3Hg (CH
70% dengan 500 ml asam asetat glasial dan
21 ml anhidrida asetat, dinginkan dan tambahkan asam asetat glasial hingga 1 liter
(Ditjen POM, 1995).
3COO)2
Dilarutkan 6,0 g raksa (II) asetat di dalam asam asetat glasial hingga 100
ml (Ditjen POM, 1995).
6% b/v
2.5.2.4Indikator Kristal Violet 0,2% b/v
Dilarutkan kristal violet 0,2 g dalam asam asetat glasial hingga 100 ml
2.5.2.5NaOH 0,5 N
1,4 g pellet NaOH dengan sedikit akuades bebas CO2, cukupkan dengan
akuades bebas CO2
2.5.2.6CuSO
hingga 100 ml (Ditjen POM, 1979).
4
Dilarutkan 6,24 g CuSO 0,5 N
4.5H2
2.5.3 Pembuatan Larutan Induk Baku Aethambutoli hydrochlorida
O dalam air suling hingga 100 ml (Ditjen,
1995).
2.5.3.1Larutan Induk Baku I
Ditimbang seksama 100 mg BPFI aethambutoli hydrochlorida kemudian
dimasukkan ke dalam labu tentukur 25 ml, dilarutkan dengan air suling hingga
larut dan cukupkan volumenya dengan air suling hingga garis tanda.
Konsentrasi larutan induk baku I = mcg mcg ml ml
mg
/ 4000 1000
25 100
= ×
2.5.4 Penetapan Kadar Aethambutoli hydrochlorida 2.5.4.1 Titrasi Bebas Air
a. Pembakuan HClO4 0,1 N
Ditimbang seksama lebih kurang 100 mg kalium biftalat yang telah
dikeringkan pada suhu 120o
Ditimbang tidak kurang dari 20 tablet lalu ditimbang seksama sejumlah
serbuk lebih kurang 50 mg, dilarutkan dalam campuran 25 ml asam asetat glasial
dan 2,5 ml Raksa (II) Asetat, ditambahkan 2 tetes indikator kristal violet dan C selama 2 jam, kemudian dilarutkan dengan 10 ml
larutan asam asetat glacial, lalu ditambahkan 2-3 tetes indikator kristal violet.
Titrasi dengan asam klorat 0,1 N dari warna ungu berubah menjadi hijau biru.
dititrasi dengan asam perklorat 0,1 N dari warna biru menjadi biru hijau.
Dilakukan penetapan blanko (Ditjen POM, 1995).
2.5.4.2 Spektrofotometri Sinar Tampak
a. Penentuan Panjang Gelombang Maksimum
Dipipet 1 ml dari larutan induk baku I Aethambutoli hydrochlorida lalu
dimasukkan kedalam labu tentukur 10 ml, ditambahkan 9 tetes CuSO4
b. Penentuan Waktu Kerja
0,5 N dan
NaOH 0,5 N hingga alkalis lalu dicukupkan volumenya dengan air suling hingga
garis tanda (kadar = 400 mcg/ml), diukur resapannya pada λ 450-750 nm dengan
menggunakan spektrofotometer sinar tampak dan menggunakan blanko. Sebagai
blanko digunakan air suling.
Dipipet 2 ml larutan induk baku I kemudian dimasukkan ke dalam labu
tentukur 10 ml, ditambahkan 9 tetes CuSO4
c. Penentuan Linieritas Kurva Kalibrasi Larutan Aethambutoli hydrochlorida
0,5 N dan NaOH 0,5 N hingga alkalis
lalu dicukupkan volumenya dengan air suling hingga garis tanda. Diukur
absorbansinya pada panjang gelombang maksimum selama 30 menit dan
diperhatikan pada menit keberapa senyawa tersebut stabil.
Dipipet larutan induk baku I ke dalam labu tentukur 10 ml masing-masing
1; 2; 3; 4; dan 5 ml lalu ditambahkan 9 tetes CuSO4 0,5 N dan NaOH 0,5 N
hingga alkalis, dicukupkan volumenya dengan air suling (konsentrasi
masing-masing 400; 800; 1200; 1600; dan 2000 mcg/ml) kemudian diukur resapannya
pada panjang gelombang maksimum berdasarkan hasil pengukuran waktu kerja
d. Penetapan Kadar Aethambutoli hydrochlorida Pada Sampel
Ditimbang tidak kurang dari 20 tablet lalu ditimbang seksama sejumlah
serbuk setara dengan lebih kurang 50 mg mengandung aethambutoli
hydrochlorida, kemudian dimasukkan ke dalam labu tentukur 25 ml lalu cukupkan
volumenya dengan air suling hingga garis tanda kemudian disaring, filtrat pertama
dibuang setelah kertas saring jenuh oleh larutan sampel dan filtrat selanjutnya
ditampung kemudian dipipet 10 ml ke dalam labu tentukur 25 ml dan
ditambahkan 9 tetes CuSO4
2.6 Uji Validasi Metode Analisis
0,5 N dan NaOH 0,5 N hingga alkalis kemudian
diukur resapannya pada panjang gelombang maksimum berdasarkan hasil
pengukuran waktu kerja dan menggunakan blanko (Modifikasi Clarke, 1991).
Dilakukan enam kali perlakuan untuk tiap sampel. Konsentrasi aethambutoli
hydrochlorida dalam sampel dihitung berdasarkan persamaan garis regresi.
Validasi dilakukan untuk menjamin bahwa metode analisis yang dilakukan
akurat, spesifik dan tahan pada kisaran analit yang akan dianalisis.
Uji validasi yang digunakan yaitu uji akurasi dengan parameter uji
perolehan kembali,batas deteksi, batas kuantitasi (WHO, 2004).
2.6.1 Uji Perolehan Kembali
Uji perolehan kembali dilakukan dengan menambahkan baku aethambutoli
hydrochlorida yang jumlahnya diketahui ke dalam sampel kemudian dianalisis
dengan perlakuan yang sama seperti pada sampel. Menurut WHO (2004),
perolehan kembali dapat dihitung dengan rumus sebagai berikut :
% perolehan kembali = * x100
C C C
A A
Keterangan:
F
C = konsentrasi sampel yang diperoleh setelah penambahan larutan baku
A C
A C*
= konsentrasi sampel awal
= konsentrasi larutan baku yang ditambahkan
2.6.1.1 Pembuatan Larutan Baku
Ditimbang seksama 25 mg BPFI aethambutoli hydrochlorida dilarutkan
dalam labu tentukur 25 ml dengan air suling kemudian dicukupkan volumenya
dengan air suling hingga garis tanda (kosentrasi 1000 mcg/ml).
2.6.1.2 Prosedur Uji Perolehan Kembali
Ditimbang seksama sejumlah serbuk (ETIBI) setara dengan lebih kurang
50 mg mengandung aethambutoli hydrochlorida, kemudian dimasukkan ke dalam
labu tentukur 25 ml lalu cukupkan volumenya dengan air suling hingga garis
tanda kemudian disaring, filtrat pertama dibuang setelah kertas saring jenuh oleh
larutan sampel dan filtrat selanjutnya ditampung kemudian dipipet 10 ml ke dalam
labu tentukur 25 ml lalu ditambahkan 10 ml larutan baku aethambutoli
hydrochlorida (konsentrasi 1000 mcg/ml) ditambahkan 9 tetes CuSO4 0,5 N dan
NaOH 0,5 N hingga alkalis kemudian diukur resapannya pada panjang gelombang
berdasarkan hasil pengukuran waktu kerja. Dilakukan enam kali perlakuan dan
konsentrasi aethambutoli hydrochlorida dalam sampel dihitung berdasarkan
2.6.2 Batas Deteksi dan Batas Kuantitasi
Batas deteksi atau Limit of Detection (LOD) adalah jumlah terkecil analit
dalam sampel yang dapat dideteksi. Batas kuantitasi atau Limit of Quantitation
(LOQ) merupakan kuantitas terkecil analit dalam sampel.
Batas deteksi dapat dihitung berdasarkan pada Standar Deviasi (SD) dari
kurva antara respon dan kemiringan (slope) dengan rumus :
SD = 2 ) ( 2 − −
∑
n Yi Y LOD = slope SD x 3Sedangkan untuk penentuan batas kuantitasi dapat digunakan rumus :
LOQ = slope SD x 10 (WHO, 2004)
2.6.3 Analisa Data secara Statistik
Kadar aethambutoli hydrochlorida yang diperoleh perhitungan
menggunakan persamaan garis regresi, diuji secara statistik dengan uji Q.
Rumus yang digunakan:
Qhitung terendah Nilai tertinggi Nilai terdekat yang Nilai -dicurigai yang Nilai =
Hasil pengujian atau nilai Q yang diperoleh ditinjau terhadap daftar harga Q pada
Tabel 2, apabila Qhitung > Qkritis maka data tersebut ditolak (Gandjar dan Rohman,
Tabel 1. Nilai Qkritis Jumlah pengamatan
pada Taraf Kepercayaan 95%
Qtabel (nilai Qkritis)
4 0,831
5 0,717
6 0,621
7 0,570
8 0,524
Sumber: Gandjar dan Rohman (2007).
Kadar aethambutoli hydrochlorida yang diperoleh dari hasil pengukuran
ditentukan rata-ratanya secara statistik dengan taraf kepercayaan 95% dengan
rumus sebagai berikut:
n s t(12 ,df )
X α
µ= ± (Wibisono, 2005)
2.6.4 Pengujian Beda Nilai Rata-Rata
Untuk menguji dua metode analisis yang berbeda dilakukan dengan uji
t-berpasangan (paired t-test). Uji ini dilakukan dengan mencari selisih setiap
pasang hasil dari kedua metode. Kemudian selisihnya dirata-ratakan lalu dicari
simpangan bakunya (SD). Hasil dari kedua metode dikatakan berbeda secara
signifikan jika t hitung > t kritik dengan taraf kpercayaan 95%. Nilai t hitung dapat
dicari dengan rumus:
t hitung
( )
N SD
X −µ
=
Keterangan:
X = Rata-rata selisih tiap pasang hasil
µ = Nilai sebenarnya (dalam hal ini nilainya = 0)
SD = Simpangan baku selisih
N = Jumlah perlakuan
BAB III
HASIL DAN PEMBAHASAN
3.1 Penetapan Kadar Etambutol Hidroklorida 3.1.1 Tirasi Bebas Air (TBA)
3.1.1.1 Pembakuan HClO4
No
0,1 N
Pembakuan larutan standar asam perklorat dilakukan secara titrasi,
menggunakan kalium biftalat dalam asam asetat glasial dengan indikator kristal
violet. Hasil pembakuan dapat dilihat pada tabel 2. (Perhitungannya dapat dilihat
[image:40.595.114.517.390.476.2]pada Lampiran 1).
Tabel 2. Hasil pembakuan larutan standar asam perklorat 0,1 N Berat Kalium
Biftalat (mg)
Volume larutan Asam perklorat 0,1 N
(ml)
Normalitas larutan Asam perklorat
1. 100,6 5,3 0,0929
2. 100,5 5,3 0,0928
3. 100,6 5,2 0,0938
Dari tabel 3.1 diatas diperoleh normalitas rata-rata larutan standar asam
perklorat adalah 0,0932 N. Pembakuan larutan standar asam perklorat bertujuan
untuk mengetahui berapa normalitas larutan standar yang dibuat agar dapat
digunakan untuk mengetahui kadar zat dalam analit.
Larutan standar asam perklorat merupakan larutan standar sekunder yang
perlu distandarisasi kembali dengan standar primer. Menurut Day (1993),
standardisasi adalah proses dimana suatu larutan ditentukan secara akurat. Larutan
standard perlu distandardisasi karena jarang reagen kimia yang diperoleh dalam
3.1.1.2 Kadar Etambutol hidroklorida Pada Sampel Secara Titrasi Bebas Air Hasil penetapan kadar etambutol hidroklorida padat tiap sampel secara
titrasi bebas air setelah dihitung secara statistik menggunakan uji Q dengan
derajat kepercayaan 95% dapat dilihat pada tabel 3 berikut (perhitungannya pada
Lampiran 4, Lampiran 5 dan Lampiran 6).
Tabel 3. Kadar etambutol hidroklorida pada tiap sampel secara titrasi bebas air
No Sampel Kadar (%) Standar Deviasi
1. Arsitam 98,18 ± 1,41 1,3467
2. Kalbutol 101,65 ± 1,38 1,3160
3. Etibi 99,90 ± 2,0 1,8710
Berdasarkan hasil yang tertera pada tabel di atas, hal tersebut
menunjukkan bahwa kadar etambutol hidroklorida yang terdapat pada tiap tablet
yang dijadikan sampel masih memenuhi syarat Farmakope Indonesia edisi IV,
yang menyebutkan bahwa tablet etambutol hidroklorida mengandung etambutol
hidroklorida tidak kurang dari 95,0 % dan tidak lebih dari 105,0 % dari jumlah
yang tertera pada etiket.
Menurut Gandjar dan Rohman (2007), titrasi bebas air (TBA) merupakan
prosedur titrimetri yang paling umum digunakan untuk uji-uji menurut
Farmakope, karena metode ini mempunyai dua keuntungan yakni: (i) metode ini
sesuai untuk menentukan kadar senyawa yang bersifat asam-asam atau basa-basa
lemah dan (ii) pelarut yang digunakan adalah pelarut organik yang juga mampu
3.1.2 Spektrofotmetri Sinar Tampak 3.1.2.1 Panjang Gelombang Maksimum
Sebelum melakukan penentuan linearitas kurva kalibrasi dan analisis kadar
etambutol hidrolklorida pada sampel, maka terlebih dahulu dilakukan penentuan
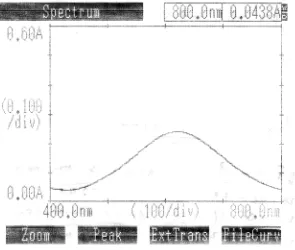
panjang gelombang maksimumnya. Kurva serapan etambutol hidroklorida BPFI
[image:42.595.167.462.280.530.2]yang diperoleh berada pada panjang gelombang 620 nm, yang dapat dilihat pada
gambar 1 di bawah ini.
Gambar 1. Kurva serapan etambutol BPFI dengan konsentrasi 400,0 mcg/ml yang diukur secara spektrofotometri sinar tampak pada panjang gelombang 400 – 800 nm.
Hal ini dilakukan karena pada panjang gelombang maksimum
kepekaannya juga maksimum dan disekitar panjang gelombang maksimum,
bentuk kurva absorbansi datar dan pada kondisi tersebut hukum Lambert-Beer
3.1.2.2 Waktu Kerja
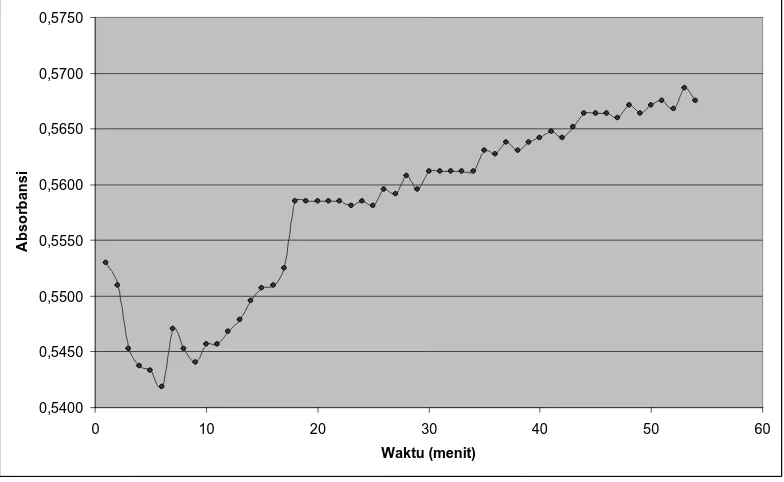
Penentuan waktu operasional (operating time) dilakukan dengan mengukur
kestabilan warna biru yang terbentuk dari penambahan tembaga (II) sufat dan
natrium hidroksida selama 30 menit, dan dipilih waktu operasional yang akan
digunakan dalam pengukuran sampel. Grafik waktu operasional dapat dilihat pada
gambar 2 berikut:
0,5400 0,5450 0,5500 0,5550 0,5600 0,5650 0,5700 0,5750
0 10 20 30 40 50 60
Waktu (menit)
A
bs
or
ba
ns
[image:43.595.116.508.282.523.2]i
Gambar 2. Kurva waktu kerja etambutol hidroklorida baku dengan konsentrasi 800,0 mcg/ml secara spektrofotometri sinar tampak pada panjang gelombang 620 nm.
Berdasarkan grafik di atas dapat ditentukan waktu yang tepat untuk
pengukuran yakni pada menit ke-18 s/d menit ke-22; menit ke-30 s/d menit ke-34
dan mnit ke-44 s/d menit ke-46. Waktu operasional ditentukan dengan mengukur
hubungan antara waktu pengukuran dengan absorbansi larutan. Menurut Gandjar
dan Rohman (2007), pada saat mulai terjadi reaksi, absorbansi suatu senyawa
diperoleh absorbansi yang stabil. Semakin lama waktu pengukuran, maka ada
kemungkinan senyawa tersebut akan mengalami kerusakan atau penguraian yang
akan menyebabkan berkurangnya intensitas warna yang juga mempengaruhi
absorbansi.
3.1.2.3Kurva Kalibrasi Larutan Etambutol hidroklorida
Pembuatan kurva kalibrasi etambutol hidroklorida BPFI dilakukan dengan
membuat seri larutan baku dengan berbagai konsentrasi yakni 400,0; 800,0;
1000,0; 1200,0; 1600,0 dan 2000,0 mcg/ml. Kurva kalibrasi etambutol
hidroklorida baku dapat dilihat pada Gambar 3 di bawah ini.
y = 0,000543x + 0,004667 r = 0,9998
0,0000 0,2000 0,4000 0,6000 0,8000 1,0000
0,000 400,000 800,000 1200,000 1600,000 2000,000
Konsentrasi (mcg/ml)
A
b
s
o
rb
a
n
s
i
Gambar 3. Kurva kalibrasi etambutol hidroklorida baku dengan berbagai konsentrasi pada panjang gelombang 620 nm secara spektrofotometri sinar tampak.
Berdasarkan kurva kalibrasi diatas diperoleh persamaan garis regresi yakni
Y = 0,000543X + 0,004667 dengan kofisien korelasi (r) sebesar 0,9998. Dari hasil
tersebut, dapat dikatakan terdapat korelasi yang positif antara kadar dengan
[image:44.595.119.507.350.617.2]Hal ini berarti terdapat 99,95 % data yang ada memiliki hubungan linear atau
mempunyai keakuratan dalam penentuan konsentrasi sebesar 99,95 %. Nilai r
yang paling baik adalah jika nilai r tersebut berada pada angka mendekati satu
(Sudjana, 2002).
3.1.2.4 Kadar Etambutol hidroklorida Pada Sampel Secara Spektrofotometri Sinar Tampak
Hasil penetapan kadar etambutol hidroklorida pada tiap sampel yang
ditentukan secara spektrofotometri sinar tampak pada panjang gelombang 620 nm
setelah dihitung secara statistik menggunakan uji Q dengan derajat kepercayaan
95% dapat dilihat pada Tabel 4.
Tabel 4. Kadar Etambutol Hidroklorida pada Sampel yang ditentukan secara spektrofotometri sinar tampak pada panjang gelombang 620 nm.
No Sampel Kadar (%) Standar Deviasi
1. Arsitam 97,24 ± 4,85 4,6217
2. Kalbutol 103,52 ± 3,95 3,7639
3. Etibi 99,51 ± 2,83 2,6980
Berdasarkan hasil yang diperoleh seperti pada tabel di atas menunjukkan
bahwa kadar etambutol hidroklorida yang terdapat pada tiap tablet yang dijadikan
sampel masih memenuhi syarat Farmakope Indonesia edisi IV, yang menyebutkan
bahwa tablet etambutol hidroklorida mengandung etambutol hidroklorida tidak
kurang dari 95,0 % dan tidak lebih dari 105,0 % dari jumlah yang tertera pada
etiket. Dari ketiga sampel tersebut kadar tertinggi diperoleh pada Kalbutol tablet
yakni mencapai 103,52 ± 3,95 % dan kadar terendah terdapat pada Arsitam tablet
yaitu 97,24 ± 4,85 %..
Menurut Roth, dkk (1991), untuk identifikasi etambutol dapat dilakukan
menghasilkan warna biru. Hasil tersebut di atas juga membuktikan bahwa reaksi
kompleks antara CuSO4 dengan etambutol hidroklorida dalam suasana alkalis
yang merupakan reaksi untuk uji kualitatif dapat digunakan untuk penetapan
kadar etambutol hidroklorida ditentukan secara spektrofotometri sinar tampak
pada panjang gelombang 620 nm.
Hasil uji t-berpasangan pada taraf kepercayaan 95% diperoleh
masing-masing thitung untuk tiap sampel berturut-turut Arsitam, Kalbutol dan Etibi adalah
0,1293, -0,2395 dan 0,0401 (perhitungannya dapat dilihat pada Lampiran 12,
Lampiran 13 dan Lampiran 14) . Ketiga hasil tersebut masih lebih kecil dari harga
tkritis
3.2 Batas Deteksi dan Batas Kuantitasi
yakni 2,5706, dengan demikian hasil yang diperoleh dari kedua metode tidak
memberikan perbedaan kadar yang signifikan.
Batas deteksi dan batas kuantitasi yang diperoleh dari penelitian ini
berturut-turut 54,1436 mcg/ml dan 181,5838 mcg/ml (hasil perhitungan dapat
dilihat pada Lampiran 8).
Batas deteksi dapat didefenisikan sebagai konsentasi analit terendah
dalam sampel yang masih dapat dideteksi, meskipun tidak selalu dapat
dikuantitasi dan batas kuantitasi didefenisikan sebagai konsentrasi analit terendah
dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat
diterima pada kondisi operasional metode yang digunakan (Gandjar dan Rohman,
2007; WHO, 2004).
Berdasarkan hasil yang diperoleh terlihat masih berada di atas batas
deteksi dan batas kuantitasi dengan kata lain kondisi operasional yang digunakan
3.3 Uji Perolehan Kembali
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil
analis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagi persen
perolehan kembali (recovery) analit yang ditambahkan. Hasil uji perolehan
kembali pada sampel etibi tablet diperoleh harga persen uji perolehan kembali
rata-rata yaitu 102,89% (hasil dan contoh perhitungannya dapat dilihat pada
Lampiran 15 dan Lampiran 17).
Kisaran rata-rata hasil uji perolehan kembali yang diizinkan untuk 100
ppm unit yang diperiksa ialah 98,0% s/d 105,0% dan standard deviasi relatif < 2
%. Dari hasil yang diperoleh tersebut maka dapat dinyatakan bahwa proses
pengujian yang dilakukan cukup baik karena didapat hasil uji yang cukup baik
pada satu sampel yang dianalisis. Dipilihnya satu sampel untuk uji perolehan
kembali karena sampelnya sejenis.
Beberapa parameter analisis yang perlu dipertimbangkan untuk
mendapatkan hasil validasi metode yang baik adalah kecermatan (accuracy),
keseksamaan (precision), selektivitas (spesifitas), linieritas dan rentang, batas
deteksi dan batas kuantitasi, ketangguhan metode (rugged-ness), dan kekuatan
BAB IV
KESIMPULAN DAN SARAN
4.1 Kesimpulan
Hasil reaksi kompleks antara CuSO4 dengan etambutol hidroklorida dalam
suasana basa stabil selama empat menit dan dapat ditentukan secara kuantitatif
dengan metode spektrofotometri sinar tampak pada panjang gelombang
maksimum 620 nm.
Hasil yang diperoleh antara metode titrasi bebas air dan spektrofotometri
sinar tampak setelah diuji secara statistik melalui uji t-berpasangan tidak terdapat
perbedaan yang signifikan antara keduanya, dan hasil yang diperoleh
masing-masing sampel yaitu 98,18 ± 1,41% dan 97,24 ± 4,85% untuk Arsitam tablet,
101,65 ± 1,38% dan 103,52 ± 3,95% untuk Kalbutol tablet serta 99,90 ± 2,0% dan
99,51 ± 2,83% untuk Etibi tablet.
Berdasarkan hasil yang diperoleh baik secara titrasi bebas air maupun
spektrofotmetri sinar tampak kadar etambutol yang terdapat pada tiap sampel
masih memenuhi syarat Farmakope Indonesia edisi IV, yang menyebutkan bahwa
tablet etambutol hidroklorida mengandung etambutol hidroklorida tidak kurang
dari 95,0 % dan tidak lebih dari 105,0 % dari jumlah yang tertera pada etiket.
4.2 Saran
Disarankan kepada peneliti lain untuk memanfaatkan reaksi warna pada
DAFTAR PUSTAKA
Day, R. A., dan Underwood, A. L. (1993). Analisa Kimia Kuantitatif. Edisi keempat. Penterjemah R. Soendoro. Jakarta: Penerbit Erlangga. Hal. 59-61.
Ditjen POM. (1979). Farmakope Indonesia. Edisi ketiga. Jakarta: Departemen Kesehatan RI. Hal. 47, 62, 82, 129-130.
Ditjen POM. (1995). Farmakope Indonesia. Edisi keempat. Jakarta: Departemen Kesehatan RI. Hal. 61-62, 1124, 1213.
Gandjar, I. G., dan Rohman, A. (2007). Kimia Farmasi Analisis. Cetakan Pertama. Yogyakarta: Pustaka Belajar. Hal. 22-23, 26-27, 141-144, 252-256.
Oekar, N. K., Kustiwa, E., dan Susilawati. (2007). Pengembangan Senyawa Bertanda 99mTc-Etambutol untuk Diagnosis Tuberkulosis. Jurnal Sains
dan Teknologi Nuklir Indonesia: Februari 2007: VIII (1): 18.
Roth, H. J., Eger, K., and Troschutz, R. (1991). Pharmaceutical Chemistry
Volume 2: Drug Analysis. London: Ellis Horwood. P. 343, 374-375.
Sudjana. (2002). Metode Statistik. Edisi Keenam. Bandung. Penerbit Tarsito. Hal 168, 371.
Susidarti, R. A,. Rianti, A., dan Martono, S. (2008). Penetapan kadar sefadroxil secara spektrofotometri visibel menggunakan pereaksi etil asetoasetat dan formaldehid. Majalah Farmasi Indonesia: 19(1): 41-47.
Wibisono, Y. (2005). Metode Statistik. Cetakan pertama. Yogyakarta: Gadjah Mada University Press. Hal. 451-452.
World Health Organization. (2004). Validation Of Analytical Procedures Used In
Lampiran 1. Perhitungan Pembakuan Larutan Asam Perklorat 0,1 N 1 mgrek kalium biftalat = 1 mgrek NaOH
N V BE biftalat kalium berat ×
= maka,
V BE biftalat kalium berat N × =
V = volume titrasi asam perklorat
N = normalitas asam perklorat
BE = berat ekivalen
BM = BE kalium bifttalat = 277,23
Berat kalium biftalat: B1 = 100,6 mg B2 = 100,5 mg B3 = 100,6 mg
Volume titrasi asam perklorat: V1 = 5,3 ml
V2 = 5,3 ml V3 0,0929 ml 5,3 204,2 mg 100,6
N1 =
× =
= 5,2 ml
Maka, 0,0928 ml 5,3 204,2 mg 100,5
N2 =
× = 0,0938 ml 5,2 204,2 mg 100,6
N3 =
× = 0,0932 3 N N N
N 1 2 3
r =
+ +
= jadi normalitas asam perklorat yang
Lampiran 2. Data Berat Sampel, Volume Titrasi dan Kadar Etambutol Hidroklorida pada Sampel.
1. Arsitam
No Berat Sampel (mg) Volume Titrasi (ml) Kadar (%)
1. 50,1 2,10 98,02
2. 50,2 2,15 100,40
3. 50,3 2,15 100,20
4. 50,1 2,15 100,60
5. 50,2 2,10 97,82
6. 50,1 2,10 98,02
2. Kalbutol
No Berat Sampel (mg) Volume Titrasi (ml) Kadar (%)
1. 50,1 2,15 100,60
2. 50,2 2,15 100,40
3. 50,3 2,20 102,77
4. 50,4 2,20 102,56
5. 50,1 2,20 103,18
6. 50,2 2,15 100,40
3. Etibi
No Berat Sampel (mg) Volume Titrasi (ml) Kadar (%)
1. 50,3 2,20 102,77
2. 50,1 2,10 98,02
3. 50,3 2,15 100,20
4. 50,2 2,15 100,40
5. 50,3 2,10 97,63
Lampiran 3. Contoh Perhitungan Kadar Etambutol Hidroklorida pada Arsitam tablet secara Titrasi Bebas Air.
Diketahui:
Berat sampel = 50,1 mg
Volume titrasi Vtitrasi = 2,10 ml Vblanko
% 100 sampel
Berat
BE N blanko) Volume
titrasi (Volume
Cetambutolhidroklorida ×
× × =
= 0,2 ml
Kadar Etambutol Hidroklorida dalam tablet Arsitam dapat dihitung berdasarkan rumus berikut:
Maka,
C1 100%
mg 50,1
277,23 N
0,0932 ml)
0,2 -ml (2,10
× ×
×
=
Lampiran 4. Perhitungan Statistik Kadar Etambutol Hidroklorida pada Arsitam tablet yang ditentukan secara Titrasi Bebas Air.
No. X
(Kadar (%)) X −X
(
)
2
X X −
1. 98,02 -1,1604 1,3465
2. 100,40 1,2187 1,4852
3. 100,20 1,0191 1,0385
4. 100,60 1,4191 2,0138
5. 97,82 -1,3556 1,8378
6. 98,02 -1,1604 1,3465
X = 99,18
∑
(
X −X)
2= 9,0683SD =
(
)
1 2 − −
∑
n X X = 5 9,0683 = 1,3467Dari 6 data yang diperoleh, data ke-4 adalah yang paling menyimpang sehingga
diuji dengan uji Q pada interval kepercayaan 95%,
Qhitung 0,0722
97,82 100,60 100,40 100,60 = − − =
nilai Qhitung < Qkritis
n SD t(12 ,df )
X α
µ = ±
(0,621), sehingga data tersebut diterima.
Rata-rata kadar etambutol hidroklorida dengan selang kepercayaan 95% pada
Arsitam tablet yang ditentukan secara Titrasi Bebas Air,
Lampiran 5. Perhitungan Statistik Kadar Etambutol Hidroklorida pada Kalbutol tablet yang ditentukan secara Titrasi Bebas Air.
No. X
(Kadar (%)) X −X
(
)
2
X X −
1. 100,60 -1,0509 1,1044
2. 100,40 -1,2513 1,5658
3. 102,77 1,1183 1,2506
4. 102,56 0,9144 0,8361
5. 103,18 1,5285 2,3364
6. 100,40 -1,2513 1,5658
X = 101,65
∑
(
X −X)
2= 8,6591SD =
(
)
1 2 − −
∑
n X X = 5 8,6591 = 1,3160Dari 6 data yang diperoleh, data ke-5 adalah yang paling menyimpang sehingga
diuji dengan uji Q pada interval kepercayaan 95%,
Qhitung 0,1476 100,40 18 , 03 1 102,77 103,18 = −− =
nilai Qhitung < Qkritis
n SD t(12 ,df )
X α
µ = ±
(0,621), sehingga data tersebut diterima.
Rata-rata kadar etambutol hidroklorida dengan selang kepercayaan 95% pada
Kalbutol tablet yang ditentukan secara Titrasi Bebas Air,
Lampiran 6. Perhitungan Statistik Kadar Etambutol Hidroklorida pada Etibi tablet yang ditentukan secara Titrasi Bebas Air.
No. X
(Kadar (%)) X −X
(
)
2
X X −
1. 102,77 2,8683 8,2271
2. 98,02 -1,8804 3,5359
3. 100,20 0,2991 0,0894
4. 100,40 0,4987 0,2487
5. 97,63 -2,2701 5,1535
6. 100,40 0,4987 0,2487
X = 99,90
∑
(
X −X)
2= 17,5032SD =
(
)
1 2 − −
∑
n X X = 5 17,5032 = 1,8710Dari 6 data yang diperoleh, data ke-1 adalah yang paling menyimpang sehingga
diuji dengan uji Q pada interval kepercayaan 95%,
Qhitung 0,4612 97,63 102,77 40 , 00 1 102,77 = − − =
nilai Qhitung < Qkritis
n SD t(12 ,df )
X α
µ = ±
(0,621), sehingga data tersebut diterima.
Rata-rata kadar etambutol hidroklorida dengan selang kepercayaan 95% pada
Etibi tablet yang ditentukan secara Titrasi Bebas Air,
Lampiran 7. Data Kurva Kalibrasi Etambutol Hidroklorida BPFI yang diukur dengan Spektrofotometri Sinar Tampak pada panjang gelombang 620 nm dan perhitungan persamaan garis regresi.
No. Konsentrasi
(mcg/ml) Absorbansi
1. 0,000 0,0000
2. 400,000 0,2340
3. 800,000 0,4380
4. 1200,000 0,6500
5. 1600,000 0,8640
6. 2000,000 1,1000
a
( )
∑
∑ ∑
( )
∑
∑
− −
= 2 2
x n x xy n y x
(
)(
) (
)
(
6000,000) (
68800000,0000)
4806,4000 6 3,2860 6000,000 2 − − = 0,000543 =
b= y−ax
004667 , 0 ) 000 , 1000 ( 000543 , 0 5477 , 0 = − =
Maka persamaan garis regresinya adalah: y = 0,000543x + 0,004667
r =
] / ) ( ) ][( / ) ( ) [( / ) )( ( 2 2 2 2 n y y n x x n y x xy Σ − Σ Σ − ∑ ∑ Σ − Σ = ] 6 / ) 2860 , 3 ( ) 6256 , 2 ][( 6 / ) 0 , 6000 ( ) 0 , 8800000 [( 6 / ) 2860 , 3 )( 0 , 6000 ( 40 , 806 4 2 2 − − − = 755 , 1520 40 , 1520 = 0,9998
No. x y x2 y2 xy
1. 0,000 0,0000 0,0000 0,0000 0,0000
2. 400,000 0,2340 160000,0000 0,0548 93,6000
3. 800,000 0,4380 640000,0000 0,1918 350,4000 4. 1200,000 0,6500 1440000,0000 0,4225 780,0000 5. 1600,000 0,8640 2560000,0000 0,7465 1382,4000 6. 2000,000 1,1000 4000000,0000 1,2100 2200,0000 ∑ 6000,000 3,2860 8800000,0000 2,6256 4806,4000
Lampiran 8. Limit Deteksi dan Limit Kuantitasi Etambutol Hidroklorida berdasarkan data kurva kalibrasi.
Persamaan garis regresi:
y = ax + b
y = 0,000543x + 0,004667
No. Konsentrasi (x)
Absorbansi
(y) yi y-yi (y-yi)²
1. 0,000 0,0000 0,0047 -0,0047 0,000022
2. 400,000 0,2340 0,2219 0,0121 0,000147
3. 800,000 0,4380 0,4391 -0,0011 0,000001
4. 1200,000 0,6500 0,6563 -0,0063 0,000039
5. 1600,000 0,8640 0,8735 -0,0095 0,000090
6. 2000,000 1,1000 1,0907 0,0093 0,000087
∑
− 2 yi)( y = 0,000386
SD = 2 ) ( 2 − −
∑
n Yi Y = 2 6 0,000386− = 0,0098
LOD = slope SD x 3 = 000543 , 0 ) 0098 , 0 ( 3 x
= 54,1436 mcg/ml
LOQ = slope SD x 10 = 000543 , 0 ) 0098 , 0 ( 10 x
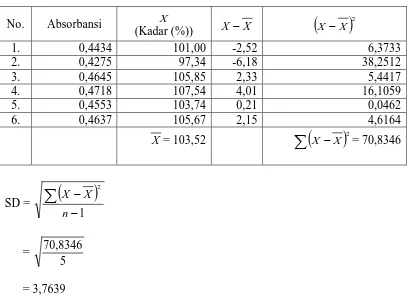
Lampiran 9. Perhitungan Statistik Kadar Etambutol Hidroklorida pada Arsitam tablet yang ditentukan secara Spektrofotometri Sinar Tampak pada panjang gelombang 620 nm.
No. Absorbansi X
(Kadar (%)) X −X
(
)
2
X X −
1. 0,4247 96,69 -1,01 1,0260
2. 0,4119 93,75 -3,96 15,6777
3. 0,4590 104,59 6,88 47,3761
4. 0,4249 96,74 -0,97 0,9349
5. 0,4073 92,69 -5,02 25,1848
6. 0,4468 101,78 4,07 16,6020
X = 97,71
∑
(
X −X)
2= 106,8015SD =
(
)
1 2 − −
∑
n X X = 5 106,8015 = 4,6217Dari 6 data yang diperoleh, data ke-1 adalah yang paling menyimpang sehingga
diuji dengan uji Q pada interval kepercayaan 95%,
Qhitung 0,2360 92,69 59 , 04 1 101,78 104,59 = − − =
nilai Qhitung < Qkritis
6 6217 , 4 . 5706 , 2 % 71 , 97 ± = µ
(0,621), sehingga data tersebut diterima.
Rata-rata kadar etambutol hidroklorida dengan selang kepercayaan 95% pada
Arsitam tablet yang ditentukan secara Spektrofotometri Sinar Tampak,
Lampiran 10. Perhitungan Statistik Kadar Etambutol Hidroklorida pada Kalbutol tablet yang ditentukan secara Spektrofotometri Sinar Tampak pada panjang gelombang 620 nm.
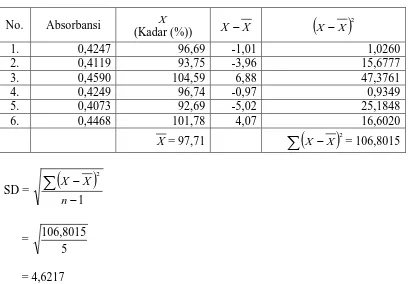
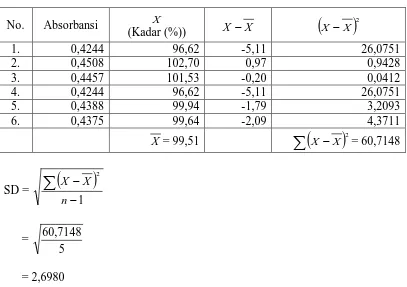
No. Absorbansi X
(Kadar (%)) X −X
(