PEMANFAATAN HIDROLISAT PATI SAGU (Metroxylon sp.) SEBAGAI SUMBER KARBON PADA FERMENTASI ETANOL OLEH
Saccharomyces cerevisiae
Oleh
ISRA DHARMA SUYANDRA F34103030
2007
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PEMANFAATAN HIDROLISAT PATI SAGU (Metroxylon sp.) SEBAGAI SUMBER KARBON PADA FERMENTASI ETANOL
OLEH Saccharomyces cerevisiae
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
ISRA DHARMA SUYANDRA F34103030
2007
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
Isra Dharma Suyandra. F34103030. Pemanfaatan hidrolisat pati sagu (Metroxylon sp.) sebagai sumber karbon pada fermentasi etanol oleh Saccharomyces cerevisiae. Di bawah bimbingan Liesbetini Hartoto dan Dwi Setyaningsih. 2007.
RINGKASAN
Sagu (Metroxylon sp.) merupakan tumbuhan asli Indonesia. Indonesia memiliki luas areal sagu terbesar di dunia dengan luas sekitar 1.128 juta hektar atau 51.2% dari luas areal sagu dunia. Namun, pemanfaatan sagu di Indonesia masih belum optimal yaitu baru sekitar 11% dari total cadangan pati sagu Indonesia (Abner dan Miftahurrohman, 2002). Sagu memiliki kandungan pati yang tinggi (Surapradja et al., 1980). Berdasarkan hasil penelitian Akyuni (2004) sagu dapat dihidrolisis menjadi hidrolisat pati sagu. Hidrolisat pati sagu memiliki kandungan gula yang tinggi dengan kandungan gula pereduksi 35.8 (b/v), Ekuivalen Dektrosa (DE) 98.99% dan Derajat Polimerisasi 1.4 sehingga berpotensi dijadikan sumber karbon pada fermentasi etanol.
Permintaan etanol dewasa ini terus meningkat seiring dengan digunakannya etanol sebagai bahan bakar nabati. Pemerintah Indonesia menargetkan pada tahun 2025 substitusi bahan bakar nabati terhadap bahan bakar minyak mencapai 5% (Instruksi Presiden Nomor 1 Tahun 2006 tentang pemanfaatan bahan bakar nabati (biofuel) sebagai bahan bakar alternatif).
Produktifitas fermentasi etanol dipengaruhi antara lain oleh jenis inokulum khamir dan konsentrasi substrat. Khamir yang biasa digunakan sebagai inokulum pada fermentasi etanol adalah Saccharomyces cerevisiae. Saccharomyces cerevisiae tersedia dalam bentuk kultur murni dan ragi roti. Pembuatan inokulum ragi roti lebih sederhana dibandingkan pembuatan inokulum kultur murni Saccharomyces cerevisiae. Disamping itu, konsentrasi substrat yang optimum akan menghasilkan etanol yang maksimum.
Penelitian ini terdiri dari dua tahap yaitu penelitian pendahuluan dan penelitian utama. Peneletian utama terdiri dari penentuan jenis konsentrasi substrat dan jenis inokulum terbaik dan fermentasi pada fermentor 2 liter. Pada penelitian pendahuluan dilakukan karakterisasi pati, produksi hidrolisat pati sagu, dan penyiapan inokulum. Analisa terhadap hidrolisat pati sagu yang dilakukan adalah total gula, kadar gula pereduksi, Ekuivalen Dekstrosa (DE) dan derajat Polimerisasi (DP). Pada fermentasi utama dilakukan fermentasi menggunakan dua jenis inokulum khamir berbeda (Saccharomyces cerevisiae dan ragi roti) dan tiga tingkat konsentrasi substrat (8, 14, 20% b/v). Pada fermentasi utama dilakukan analisa kadar etanol, kadar gula pereduksi akhir, pH dan volume CO2. Selanjutnya
hasil terbaik pada fermentasi utama dijadikan acuan pada fermentasi pada fermentor 2 L. Analisa yang dilakukan pada fermentasi menggunakan fermentor 2 L adalah etanol, biomassa, kadar gula pereduksi akhir dan volume CO2.
Selanjutnya dilakukan perhitungan kinetika fermentasi.
menghasilkan kesimpulan bahwa inokulum ragi roti yang digunakan adalah sebanyak 0.1 gram/20 ml media air bersuhu 30oC.
Hasil penelitian pada fermentasi utama memperlihatkan sagu berpotensi digunakan sebagai sumber karbon pada fermentasi etanol. Hasil penelitian juga menunjukkan bahwa kultur murni Saccharomyces cerevisiae menghasilkan kadar etanol yang lebih tinggi dibanding ragi roti. Analisa sidik ragam menunjukkan bahwa kadar gula, jenis khamir dan interaksi keduanya berpengaruh nyata terhadap kadar etanol, kadar gula pereduksi, efisiensi pemanfaatan substrat, pH, dan CO2 yang dihasilkan. Kadar etanol yang dihasilkan berkisar antara
2.32%-4.66% v/v dengan nilai gula pereduksi akhir antara 3.0-60.37 g/l, efisiensi pemanfaatan substrart 53.2%-94.71%, dan nilai pH 3.28-3.41. Perlakuan terbaik adalah fermentasi menggunakan Saccharomyces cerevisiae dengan konsentrasi substrat 14% (b/v) yang menghasilkan kadar etanol sebesar 4.66% (v/v).
Fermentasi pada fermentor 2 L menggunakan inokulum kultur murni Saccharomyces cerevisiae dengan konsentrasi substrat 14% (b/v) menghasilkan kadar etanol 4.91% (v/v). biomassa 4.2 g/l, dan kadar gula pereduksi akhir 3.803 g/l. Saccharomyces cerevisiae selama 54 jam.
Data kinetika yang dihasilkan adalah laju pertumbuhan spesifik maksimum (µmaks) 0.18 jam-1, waktu ganda sel (td) 3.36 jam, Pmaks 4.91% v/v,
Xmaks 4.4 g/l, nilai Yp/x = 6.27 g produk/g biomassa, Yp/s = 0.25 gram produk/gram
Isra Dharma Suyandra. F34103030. Utilization of Sago Starch as Carbon Sources in Etanol Fermentation by Saccharomyces cerevisiae. Supervised by Liesbetini Hartoto and Dwi Setyaningsih. 2007.
SUMMARY
Sago (Metroxylon sp) is indigenous to Indonesia. It has the biggest sago area in the world, with total area of 1.128 million hectare or 51.2 % of the world sago area. Sago utilization in Indonesia is limited about 11% (Abner dan Miftahurrohman, 2002). Sago contains high starch (Surapradja et al., 1980). Based on Akyuni (2004) sago can be hydrolysised to sago starch hydrolysate. Sago starch hydrolysat contains of high sugar whith total reducing sugar of 35.8 % (b/v), dextrose equivalent (DE) of 98.99 % and polymerization degree 1.4, so this substance potential to be used as carbon source of ethanol fermentation.
Nowadays, ethanol demands is increasing as biofuel use. Indonesian government is aiming for 5 % oil fuel substitution to biofuel in 2025. Ethanol fermentation productivity is influenced yeast type and substrate concentration. Saccharomyces cerevisiae is usually used as inokulum of ethanol fermentation and available in pure culture and bread yeast. Preparation of bread yeast inokulum is simpler than pure culture Saccharomyces cerevisiae. Besides that, optimum substrate concentration will produce maximum ethanol.
This research consisted of two level, there were preliminary research and primary research. Primary research was conducted to find type of substrate concentration and the best inokulum. Starch characterization, production of sago starch hydrolysate and inokulum preparation done in preliminary reseach. Different type of inokulums (Saccharomyces cerevisiae and bread’s yeast) were used in primary fermentation with different concentration of substrate (8 %, 14 %, 20 % w/v). Analysis in primary research as follows : ethanol content, sugar reduction content, pH, and Volume CO2. Furthermore, the best result from
primary research is used to fermentation with 2 L fermentor. Analysis in this step as follows : ethanol content, biomass, last sugar reduction content, and CO2
volume. Using data from this stage, fermentation kinetics calculation is done. Pre research result showed that total sugar content was 49.69 % (w/v), reducing sugar 35.26 % (w/v), dextrose equivalent (DE) value 98.8 % (w/v), and polymerization degree 1.4. Hydrolysate sago starch analysis showed that it contains high glucose and maltose. Preliminary research result concluded that 0.1 gram/20 ml water bread yeast inokulum was used with temperature 30° C.
Primary research result showed that sago can be used in ethanol fermentation. This result also showed that pure culture Saccharomyces cerevisiae produce higher ethanol content than bread’s yeast. Analysis varian show that sugar content and type of yeast gave significant influence to ethanol content, reducing sugar, substrate efficiency, pH, and production of CO2. Ethanol content produced
Fermentation with 2 L fermentor produced 4.91 % (v/v) ethanol content, 4.2 g/l biomass, and final sugar reduction content 3.803 g/l. Saccharomyces cerevisiae need 54 hours fermentation sugar to ethanol. Kinetic data show maximum specific grow rate 0.1882/hour, double time (td) 3.36 hour, Pmax 4.91 %
v/v, Xmax 4.4 g/l, Yp/x value = 6.275 g product/g biomass, Yp/s = 0.2459 gram
SURAT PERNYATAAN
Saya yang bertanda tangan di bawah ini menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul ”Pemanfaatan Hidrolisat Pati Sagu (Metroxylon sp.) Sebagai Sumber Karbon pada Fermentasi Etanol oleh
Saccharomyces cerevisiae” adalah hasil karya asli saya sendiri dengan arahan dosen pembimbing akademik, kecuali dengan jelas ditunjukkan rujukannya.
Bogor, September 2007
Yang membuat pernyataan,
RIWAYAT HIDUP
Penulis dilahirkan di Dangung-Dangung Kabupaten Limapuluh Kota, Sumatera Barat pada tanggal 29 April 1984 dari ayah Dharmawan Dt. Bijo dan Ibu Suryati SPdI. Riwayat pendidikan penulis dimulai pada tahun 1990 di TK Restu Ibu Ketinggian. Pada Tahun 1991 penulis melanjutkan pendidikan ke Sekolah Dasar Negeri 44 Ompek Diateh dan lulus pada tahun 1997. Tahun 1997 sampai 2000 penulis melanjutkan pendidikan di Madrasah Tsanawiyah Negeri Dangung-Dangung, kemudian melanjutkan ke Sekolah Menengah Umum Negeri I Guguk dari tahun 2000 sampai 2003. Tahun 2003 penulis melanjutkan pendidikan pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor melalui jalur USMI.
Selama menjalankan masa studi penulis aktif berorganisasi baik organisasi kampus maupun organisasi luar kampus. Oganisasi kampus yang diikuti penulis adalah Himpunan Mahasiswa Teknologi Industri (HIMALOGIN-FATETA IPB) dan Dewan Perwakilam Mahasiswa (DPM FATETA IPB). Pada periode 2005/2006 penulis menjabat sebagai Kepala Departemen HRD (Human Resources Development) HIMALOGIN. Organisasi luar kampus yang diikuti adalah Organisasi Mahasiswa Daerah (OMDA) yaitu Ikatan Kekeluargaan Mahasiswa Payakumbuh (IKMP Bogor) dan Ikatan Pelajar Mahasiswa Minang Bogor (IPMM Bogor). Penulis menjabat sebagai Ketua Ikatan Kekeluargaan Mahasiswa Payakumbuh (IKMP Bogor) pada masa bakti 2006/2007. Selain itu penulis juga aktif di Himpunan Mahasiswa Islam Cabang Bogor (HMI Cabang Bogor).
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT karena dengan rahmat dan tuntunan-Nya penulis dapat menyelesaikan penulisan skripsi yang berjudul “Pemanfaatan Hidrolisat Pati Sagu (Metroxylon sp.) Sebagai Sumber Karbon pada Fermentasi Etanol oleh Saccharomyces cerevisiae” ini dengan baik. Penulis sepenuhnya menyadari bahwa penulisan skripsi ini tidak akan selesai tanpa adanya bimbingan dan dukungan yang penuh ketulusan baik secara moril maupun materil dari semua pihak. Oleh karena itu, dalam kesempatan ini penulis mengucapkan terimakasih kepada:
1. Dr. Ir. Liesbetini Hartoto, MS selaku dosen pembimbing I dan Dr. Ir. Dwi Setyaningsih, MSi sebagai dosen pembimbing II atas bimbingan dan saran-saran yang diberikan selama penulis menyelesaikan skripsi. 2. Dr. Ir. Ika Amalia Kartika, MT, selaku dosen penguji yang telah
memberikan masukan dan saran kepada penulis.
3. Surfactan and Bioenergy Research Center (SBRC) yang telah menyediakan dana penelitian ini.
4. Kedua orang tua penulis atas doa, kasih sayang dan dukungan yang sangat berarti bagi penulis.
5. Adik-adikku; Yandri, Febri dan Ridha atas kasih sayang dan doanya. 6. Teman-teman anggota Rumah Qita dengan segala kehangatan dan
persahabatan yang tak pernah terlupakan.
7. Teman-teman TIN angkatan 40 atas segala dukungannya.
8. Keluarga Besar Ikatan Kekeluargaan Mahasiswa Payakumbuh (IKMP Bogor).
Penulis menyadari laporan penelitian ini masih jauh dari sempurna. Oleh karena itu penulis mengharapkan saran dan kritik yang membangun. Akhir kata, penulis berharap skripsi ini dapat bermanfaat bagi semua pihak yang memerlukan.
DAFTAR ISI
Halaman
KATA PENGANTAR ... iii
DAFTAR ISI ... iv
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN... viii I. PENDAHULUAN A. LATAR BELAKANG ... 1
B. TUJUAN ... 2
II. TINJAUAN PUSTAKA A. SAGU ... 3
B. HIDROLISAT PATI SAGU ... 5
C. FERMENTASI ETANOL ... 7
D. KINETIKA FERMENTASI ... 13
III. BAHAN DAN METODE A. BAHAN DAN ALAT ... 17
B. METODE PENELITIAN ... 17
1. Penelitian Pendahuluan ... 17
a. Penyiapan Media Fermentasi ... 17
b. Penyiapan Inokulum ... 18
2. Penelitian Utama a. Penentuan Konsentrasi Substrat dan Jenis Inokulum Terbaik ... 19
b. Perlakuan ... 20
c. Fermentasi Pada Fermentor 2 L... 20
PEMANFAATAN HIDROLISAT PATI SAGU (Metroxylon sp.) SEBAGAI SUMBER KARBON PADA FERMENTASI ETANOL OLEH
Saccharomyces cerevisiae
Oleh
ISRA DHARMA SUYANDRA F34103030
2007
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PEMANFAATAN HIDROLISAT PATI SAGU (Metroxylon sp.) SEBAGAI SUMBER KARBON PADA FERMENTASI ETANOL
OLEH Saccharomyces cerevisiae
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
ISRA DHARMA SUYANDRA F34103030
2007
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
Isra Dharma Suyandra. F34103030. Pemanfaatan hidrolisat pati sagu (Metroxylon sp.) sebagai sumber karbon pada fermentasi etanol oleh Saccharomyces cerevisiae. Di bawah bimbingan Liesbetini Hartoto dan Dwi Setyaningsih. 2007.
RINGKASAN
Sagu (Metroxylon sp.) merupakan tumbuhan asli Indonesia. Indonesia memiliki luas areal sagu terbesar di dunia dengan luas sekitar 1.128 juta hektar atau 51.2% dari luas areal sagu dunia. Namun, pemanfaatan sagu di Indonesia masih belum optimal yaitu baru sekitar 11% dari total cadangan pati sagu Indonesia (Abner dan Miftahurrohman, 2002). Sagu memiliki kandungan pati yang tinggi (Surapradja et al., 1980). Berdasarkan hasil penelitian Akyuni (2004) sagu dapat dihidrolisis menjadi hidrolisat pati sagu. Hidrolisat pati sagu memiliki kandungan gula yang tinggi dengan kandungan gula pereduksi 35.8 (b/v), Ekuivalen Dektrosa (DE) 98.99% dan Derajat Polimerisasi 1.4 sehingga berpotensi dijadikan sumber karbon pada fermentasi etanol.
Permintaan etanol dewasa ini terus meningkat seiring dengan digunakannya etanol sebagai bahan bakar nabati. Pemerintah Indonesia menargetkan pada tahun 2025 substitusi bahan bakar nabati terhadap bahan bakar minyak mencapai 5% (Instruksi Presiden Nomor 1 Tahun 2006 tentang pemanfaatan bahan bakar nabati (biofuel) sebagai bahan bakar alternatif).
Produktifitas fermentasi etanol dipengaruhi antara lain oleh jenis inokulum khamir dan konsentrasi substrat. Khamir yang biasa digunakan sebagai inokulum pada fermentasi etanol adalah Saccharomyces cerevisiae. Saccharomyces cerevisiae tersedia dalam bentuk kultur murni dan ragi roti. Pembuatan inokulum ragi roti lebih sederhana dibandingkan pembuatan inokulum kultur murni Saccharomyces cerevisiae. Disamping itu, konsentrasi substrat yang optimum akan menghasilkan etanol yang maksimum.
Penelitian ini terdiri dari dua tahap yaitu penelitian pendahuluan dan penelitian utama. Peneletian utama terdiri dari penentuan jenis konsentrasi substrat dan jenis inokulum terbaik dan fermentasi pada fermentor 2 liter. Pada penelitian pendahuluan dilakukan karakterisasi pati, produksi hidrolisat pati sagu, dan penyiapan inokulum. Analisa terhadap hidrolisat pati sagu yang dilakukan adalah total gula, kadar gula pereduksi, Ekuivalen Dekstrosa (DE) dan derajat Polimerisasi (DP). Pada fermentasi utama dilakukan fermentasi menggunakan dua jenis inokulum khamir berbeda (Saccharomyces cerevisiae dan ragi roti) dan tiga tingkat konsentrasi substrat (8, 14, 20% b/v). Pada fermentasi utama dilakukan analisa kadar etanol, kadar gula pereduksi akhir, pH dan volume CO2. Selanjutnya
hasil terbaik pada fermentasi utama dijadikan acuan pada fermentasi pada fermentor 2 L. Analisa yang dilakukan pada fermentasi menggunakan fermentor 2 L adalah etanol, biomassa, kadar gula pereduksi akhir dan volume CO2.
Selanjutnya dilakukan perhitungan kinetika fermentasi.
menghasilkan kesimpulan bahwa inokulum ragi roti yang digunakan adalah sebanyak 0.1 gram/20 ml media air bersuhu 30oC.
Hasil penelitian pada fermentasi utama memperlihatkan sagu berpotensi digunakan sebagai sumber karbon pada fermentasi etanol. Hasil penelitian juga menunjukkan bahwa kultur murni Saccharomyces cerevisiae menghasilkan kadar etanol yang lebih tinggi dibanding ragi roti. Analisa sidik ragam menunjukkan bahwa kadar gula, jenis khamir dan interaksi keduanya berpengaruh nyata terhadap kadar etanol, kadar gula pereduksi, efisiensi pemanfaatan substrat, pH, dan CO2 yang dihasilkan. Kadar etanol yang dihasilkan berkisar antara
2.32%-4.66% v/v dengan nilai gula pereduksi akhir antara 3.0-60.37 g/l, efisiensi pemanfaatan substrart 53.2%-94.71%, dan nilai pH 3.28-3.41. Perlakuan terbaik adalah fermentasi menggunakan Saccharomyces cerevisiae dengan konsentrasi substrat 14% (b/v) yang menghasilkan kadar etanol sebesar 4.66% (v/v).
Fermentasi pada fermentor 2 L menggunakan inokulum kultur murni Saccharomyces cerevisiae dengan konsentrasi substrat 14% (b/v) menghasilkan kadar etanol 4.91% (v/v). biomassa 4.2 g/l, dan kadar gula pereduksi akhir 3.803 g/l. Saccharomyces cerevisiae selama 54 jam.
Data kinetika yang dihasilkan adalah laju pertumbuhan spesifik maksimum (µmaks) 0.18 jam-1, waktu ganda sel (td) 3.36 jam, Pmaks 4.91% v/v,
Xmaks 4.4 g/l, nilai Yp/x = 6.27 g produk/g biomassa, Yp/s = 0.25 gram produk/gram
Isra Dharma Suyandra. F34103030. Utilization of Sago Starch as Carbon Sources in Etanol Fermentation by Saccharomyces cerevisiae. Supervised by Liesbetini Hartoto and Dwi Setyaningsih. 2007.
SUMMARY
Sago (Metroxylon sp) is indigenous to Indonesia. It has the biggest sago area in the world, with total area of 1.128 million hectare or 51.2 % of the world sago area. Sago utilization in Indonesia is limited about 11% (Abner dan Miftahurrohman, 2002). Sago contains high starch (Surapradja et al., 1980). Based on Akyuni (2004) sago can be hydrolysised to sago starch hydrolysate. Sago starch hydrolysat contains of high sugar whith total reducing sugar of 35.8 % (b/v), dextrose equivalent (DE) of 98.99 % and polymerization degree 1.4, so this substance potential to be used as carbon source of ethanol fermentation.
Nowadays, ethanol demands is increasing as biofuel use. Indonesian government is aiming for 5 % oil fuel substitution to biofuel in 2025. Ethanol fermentation productivity is influenced yeast type and substrate concentration. Saccharomyces cerevisiae is usually used as inokulum of ethanol fermentation and available in pure culture and bread yeast. Preparation of bread yeast inokulum is simpler than pure culture Saccharomyces cerevisiae. Besides that, optimum substrate concentration will produce maximum ethanol.
This research consisted of two level, there were preliminary research and primary research. Primary research was conducted to find type of substrate concentration and the best inokulum. Starch characterization, production of sago starch hydrolysate and inokulum preparation done in preliminary reseach. Different type of inokulums (Saccharomyces cerevisiae and bread’s yeast) were used in primary fermentation with different concentration of substrate (8 %, 14 %, 20 % w/v). Analysis in primary research as follows : ethanol content, sugar reduction content, pH, and Volume CO2. Furthermore, the best result from
primary research is used to fermentation with 2 L fermentor. Analysis in this step as follows : ethanol content, biomass, last sugar reduction content, and CO2
volume. Using data from this stage, fermentation kinetics calculation is done. Pre research result showed that total sugar content was 49.69 % (w/v), reducing sugar 35.26 % (w/v), dextrose equivalent (DE) value 98.8 % (w/v), and polymerization degree 1.4. Hydrolysate sago starch analysis showed that it contains high glucose and maltose. Preliminary research result concluded that 0.1 gram/20 ml water bread yeast inokulum was used with temperature 30° C.
Primary research result showed that sago can be used in ethanol fermentation. This result also showed that pure culture Saccharomyces cerevisiae produce higher ethanol content than bread’s yeast. Analysis varian show that sugar content and type of yeast gave significant influence to ethanol content, reducing sugar, substrate efficiency, pH, and production of CO2. Ethanol content produced
Fermentation with 2 L fermentor produced 4.91 % (v/v) ethanol content, 4.2 g/l biomass, and final sugar reduction content 3.803 g/l. Saccharomyces cerevisiae need 54 hours fermentation sugar to ethanol. Kinetic data show maximum specific grow rate 0.1882/hour, double time (td) 3.36 hour, Pmax 4.91 %
v/v, Xmax 4.4 g/l, Yp/x value = 6.275 g product/g biomass, Yp/s = 0.2459 gram
SURAT PERNYATAAN
Saya yang bertanda tangan di bawah ini menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul ”Pemanfaatan Hidrolisat Pati Sagu (Metroxylon sp.) Sebagai Sumber Karbon pada Fermentasi Etanol oleh
Saccharomyces cerevisiae” adalah hasil karya asli saya sendiri dengan arahan dosen pembimbing akademik, kecuali dengan jelas ditunjukkan rujukannya.
Bogor, September 2007
Yang membuat pernyataan,
RIWAYAT HIDUP
Penulis dilahirkan di Dangung-Dangung Kabupaten Limapuluh Kota, Sumatera Barat pada tanggal 29 April 1984 dari ayah Dharmawan Dt. Bijo dan Ibu Suryati SPdI. Riwayat pendidikan penulis dimulai pada tahun 1990 di TK Restu Ibu Ketinggian. Pada Tahun 1991 penulis melanjutkan pendidikan ke Sekolah Dasar Negeri 44 Ompek Diateh dan lulus pada tahun 1997. Tahun 1997 sampai 2000 penulis melanjutkan pendidikan di Madrasah Tsanawiyah Negeri Dangung-Dangung, kemudian melanjutkan ke Sekolah Menengah Umum Negeri I Guguk dari tahun 2000 sampai 2003. Tahun 2003 penulis melanjutkan pendidikan pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor melalui jalur USMI.
Selama menjalankan masa studi penulis aktif berorganisasi baik organisasi kampus maupun organisasi luar kampus. Oganisasi kampus yang diikuti penulis adalah Himpunan Mahasiswa Teknologi Industri (HIMALOGIN-FATETA IPB) dan Dewan Perwakilam Mahasiswa (DPM FATETA IPB). Pada periode 2005/2006 penulis menjabat sebagai Kepala Departemen HRD (Human Resources Development) HIMALOGIN. Organisasi luar kampus yang diikuti adalah Organisasi Mahasiswa Daerah (OMDA) yaitu Ikatan Kekeluargaan Mahasiswa Payakumbuh (IKMP Bogor) dan Ikatan Pelajar Mahasiswa Minang Bogor (IPMM Bogor). Penulis menjabat sebagai Ketua Ikatan Kekeluargaan Mahasiswa Payakumbuh (IKMP Bogor) pada masa bakti 2006/2007. Selain itu penulis juga aktif di Himpunan Mahasiswa Islam Cabang Bogor (HMI Cabang Bogor).
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT karena dengan rahmat dan tuntunan-Nya penulis dapat menyelesaikan penulisan skripsi yang berjudul “Pemanfaatan Hidrolisat Pati Sagu (Metroxylon sp.) Sebagai Sumber Karbon pada Fermentasi Etanol oleh Saccharomyces cerevisiae” ini dengan baik. Penulis sepenuhnya menyadari bahwa penulisan skripsi ini tidak akan selesai tanpa adanya bimbingan dan dukungan yang penuh ketulusan baik secara moril maupun materil dari semua pihak. Oleh karena itu, dalam kesempatan ini penulis mengucapkan terimakasih kepada:
1. Dr. Ir. Liesbetini Hartoto, MS selaku dosen pembimbing I dan Dr. Ir. Dwi Setyaningsih, MSi sebagai dosen pembimbing II atas bimbingan dan saran-saran yang diberikan selama penulis menyelesaikan skripsi. 2. Dr. Ir. Ika Amalia Kartika, MT, selaku dosen penguji yang telah
memberikan masukan dan saran kepada penulis.
3. Surfactan and Bioenergy Research Center (SBRC) yang telah menyediakan dana penelitian ini.
4. Kedua orang tua penulis atas doa, kasih sayang dan dukungan yang sangat berarti bagi penulis.
5. Adik-adikku; Yandri, Febri dan Ridha atas kasih sayang dan doanya. 6. Teman-teman anggota Rumah Qita dengan segala kehangatan dan
persahabatan yang tak pernah terlupakan.
7. Teman-teman TIN angkatan 40 atas segala dukungannya.
8. Keluarga Besar Ikatan Kekeluargaan Mahasiswa Payakumbuh (IKMP Bogor).
Penulis menyadari laporan penelitian ini masih jauh dari sempurna. Oleh karena itu penulis mengharapkan saran dan kritik yang membangun. Akhir kata, penulis berharap skripsi ini dapat bermanfaat bagi semua pihak yang memerlukan.
DAFTAR ISI
Halaman
KATA PENGANTAR ... iii
DAFTAR ISI ... iv
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN... viii I. PENDAHULUAN A. LATAR BELAKANG ... 1
B. TUJUAN ... 2
II. TINJAUAN PUSTAKA A. SAGU ... 3
B. HIDROLISAT PATI SAGU ... 5
C. FERMENTASI ETANOL ... 7
D. KINETIKA FERMENTASI ... 13
III. BAHAN DAN METODE A. BAHAN DAN ALAT ... 17
B. METODE PENELITIAN ... 17
1. Penelitian Pendahuluan ... 17
a. Penyiapan Media Fermentasi ... 17
b. Penyiapan Inokulum ... 18
2. Penelitian Utama a. Penentuan Konsentrasi Substrat dan Jenis Inokulum Terbaik ... 19
b. Perlakuan ... 20
c. Fermentasi Pada Fermentor 2 L... 20
Halaman IV. HASIL DAN PEMBAHASAN
A. PENELITIAN PENDAHULUAN ... 22
1. Persiapan Media Fermentasi ... 22
2. Pemilihan Metode Persiapan Inokulum Ragi Roti ... 24
B. PENELITIAN UTAMA 1. Penentuan Konsentrasi Substrat dan Jenis Inokulum Terbaik a. Kadar Etanol ... 25
b. Kadar Gula Pereduksi Akhir ... 28
c. Efisiensi Pemanfaatan Substrat ... 31
d. pH... 32
e. Laju Pembentukan CO2 ... 34
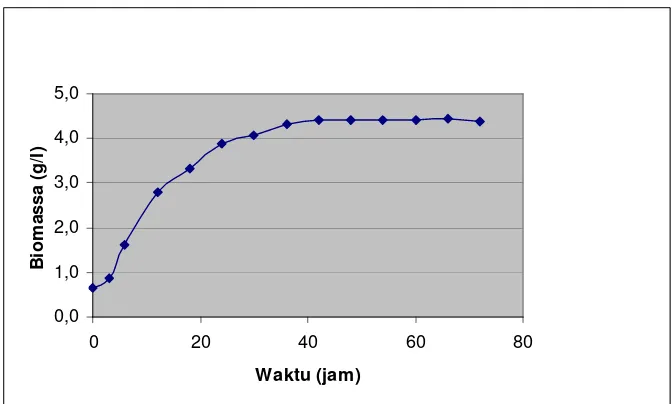
2. FERMENTASI PADA FERMENTOR 2 L a. Biomassa ... 36
b. Kurva Pertumbuhan Saccharomyces cerevisiae ... 37
c. Etanol ... 39
d. Karbondioksida (CO2) ... 41
e. Gula Pereduksi ... 43
f. Kinetika Fermentasi ... 44
V. KESIMPULAN DAN SARAN A. KESIMPULAN ... 47
B. SARAN ... 47
DAFTAR PUSTAKA ... 48
DAFTAR TABEL
Halaman
DAFTAR GAMBAR
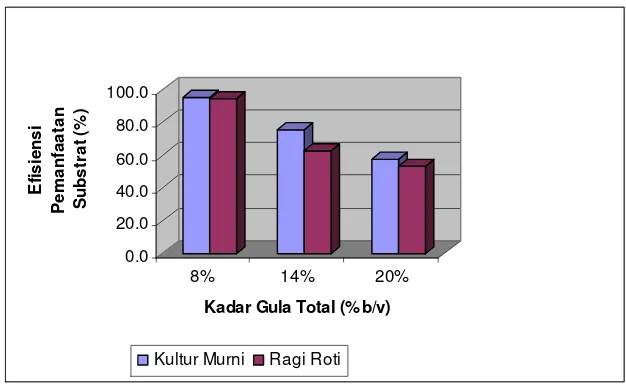
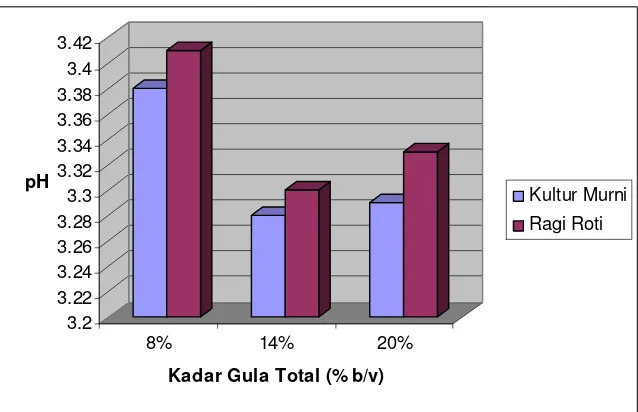
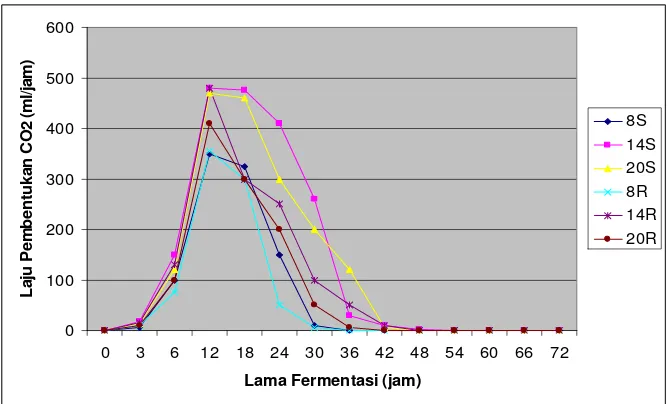
Halaman Gambar 1. Skema Embden Meyerhoff-Parnas Pathway... 11 Gambar 2. Kurva pertumbuhan mikroba pada fermentasi curah ... 14 Gambar 3. Histogram rata-rata kadar etanol cairan fermentasi... 26 Gambar 4. Histogram rata-rata kadar gula pereduksi akhir ... 29 Gambar 5. Histogram rata-rata efisiensi pemanfaatan substrat... 31 Gambar 6. Histogram rata-rata nilai pH akhir produk fermentasi... 33 Gambar 7. Pola pembentukan CO2 selama fermentasi ... 35
Gambar 8. Pola pertumbuhan Saccharomyces cerevisiae selama
Fermentasi ... 36 Gambar 9. Kurva pertumbuhan Saccharomyces cerevisiae pada media hidrolisat pati sagu ... 38 Gambar 10. Pola pembentukan etanol selama fermentasi ... 39 Gambar 11. Laju pembentukan CO2 selama fermentasi ... 41
Gambar 12. Volume CO2 yang terbentuk selama fermentasi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Diagram Alir Proses Produksi Etanol ... 51 Lampiran 2. Prosedur Karakterisasi Pati Sagu ... 52 Lampiran 3. Prosedur Pengukuran Aktivitas Enzim ... 56 Lampiran 4. Proses Hidrolisis Pati Sagu ... 57 Lampiran 5. Prosedur Analisa Hidrolisat Pati Sagu ... 58 Lampiran 6. Prosedur Pengukuran Biomassa... 60 Lampiran 7. Prosedur Pengukuran Kadar Etanol ... 61 Lampiran 8. Neraca Massa Produksi Hidrolisat Pati Sagu ... 62 Lampiran 9. Analisa Cairan Fermentasi Pada Penentuan Konsentrasi
Substrat dan Jenis Inokulum Terbaik ... 63 Lampiran 10. Analisis Keragaman Terhadap Kadar Etanol ... 64 Lampiran 11. Analisis Keragaman Terhadap Kadar Gula Pereduksi ... 65 Lampiran 12. Analisis Keragaman Terhadap Efisiensi Pemanfaatan Substrat ... 66 Lampiran 13. Analisis Keragaman Terhadap Nilai pH ... 67 Lampiran 14. Volume CO2 yang terbentuk selama fermentasi dengan
I. PENDAHULUAN
A. LATAR BELAKANG
Indonesia memiliki sumber daya alam melimpah. Salah satu kekayaan alam Indonesia adalah tumbuhan sagu (Metroxylon sp.). Luas areal tanaman sagu di Indonesia diperkirakan 1.114.000 hektar yang merupakan 50 persen dari total luas areal sagu dunia (Abner dan Miftahurrohman, 2002). Luas areal sagu yang sudah dibudidayakan baru sekitar 114.000 hektar, sedangkan lahan sagu seluas 1.000.000 hektar belum dibudidayakan secara intensif. Sagu dapat tumbuh di daerah rawa atau tanah marginal yang sulit ditumbuhi oleh tanaman penghasil karbohidrat lainnya (Flach, 1983. dalam Haryanto dan Pangloli, 1992). Sagu memiliki kandungan pati yang besar. Menurut Rumalatu (1981) dalam Haryanto dan Pangloli (1992) pada umur panen sagu sekitar 11 tahun ke atas empulur sagu mengandung 15-20 persen pati.
Potensi sagu yang besar ini belum di eksploitasi secara optimal. Sangat rendahnya pemanfaatan areal sagu dalam bidang pangan yang hanya sekitar 10% dari total areal sagu nasional disebabkan oleh kurangnya minat masyarakat dalam mengelola sagu.
Pati sagu dapat dihidrolisis menjadi hidrolisat pati sagu dan diolah menjadi sirup glukosa. Hidrolisat pati sagu memiliki kandungan gula yang tinggi sehingga berpotensi dijadikan sebagai sumber karbon pada fermentasi etanol (Akyuni, 2004).
Permintaan etanol dewasa ini terus meningkat seiring dengan digunakannya etanol sebagai bahan bakar nabati. Pemerintah Indonesia menargetkan pada tahun 2025 substitusi bahan bakar nabati terhadap bahan bakar minyak mencapai 5% (Instruksi Presiden Nomor 1 Tahun 2006 tentang pemanfaatan bahan bakar nabati (biofuel) sebagai bahan bakar alternatif). Selain itu, etanol banyak digunakan dalam industri kimia, kosmetika, minuman, dan pelarut.
tinggi, mampu hidup pada suhu tinggi, tetap stabil selama kondisi fermentasi dan dapat bertahan hidup pada pH rendah (Rehm dan Reed, 1981). Amerine et al. (1960) menyatakan bahwa Saccharomyces cerevisiae sering digunakan dalam fermentasi etanol sebab mampu menghasilkan etanol dalam jumlah yang tinggi pada media yang sesuai. Disamping itu, pada fermentasi harus digunakan substrat dengan konsentrasi optimum untuk pertumbuhan khamir. Karena pada konsentrasi substrat yang optimum akan dihasilkan etanol dengan jumlah yang maksimum.
Saccharomyces cerevisiae tersedia dalam bentuk kultur murni dan ragi. Ragi biasanya digunakan dalam pembuatan roti (baker’s yeast) dan pembuatan minuman beralkohol (brewing yeast dan wine yeast). Pada fermentasi menggunakan kultur murni diperlukan penyiapan inokulum secara khusus dan membutuhkan biaya yang relatif tinggi. Sementara itu, Saccharomyces cerevisiae dalam bentuk ragi dapat langsung digunakan sebagai inokulum pada fermentasi etanol. Ragi roti dijual bebas di pasaran sehingga mudah didapatkan dan banyak digunakan oleh rumah tangga. Sedangkan ragi yang digunakan dalam pembuatan minuman beralkohol (brewing yeast dan wine yeast) dijual terbatas untuk industri minuman beralkohol.
B. TUJUAN
Tujuan penelitian ini adalah:
1. Memanfaatkan hidrolisat pati sagu sebagai sumber karbon pada fermentasi etanol.
2. Mendapatkan konsentrasi total gula yang terbaik untuk fermentasi etanol.
3. Membandingkan hasil fermentasi antara kultur murni Saccharomyces cerevisiae dan ragi roti.
II. TINJAUAN PUSTAKA
A. SAGU
Sagu adalah tanaman berbiji tunggal (monokotil) yang berasal dari keluarga Palmae, marga Metroxylon, ordo Spadiciflorae. Metroxylon merupakan salah satu keluarga Palmae yang memiliki kandungan pati cukup tinggi dibandingkan palma lain (Flach, 1997).
Tanaman sagu digolongkan secara garis besar menjadi dua yaitu sagu yang berbuah dan berbunga hanya sekali dan sagu yang berbuah dan berbunga dua kali atau lebih (Soerjono, 1980). Golongan sagu yang berbuah dan berbunga hanya sekali bernilai ekonomi tinggi karena memiliki kandungan pati yang tinggi. Jenis sagu yang termasuk dalam golongan tersebut adalah Metroxylon rumphii Martius, Metroxylon sagus Rottboll, Metroxylon sylvester Martius dan Micracantum Martius. Menurut Satrapradja et al. (1980), di Indonesia biasanya dijumpai satu atau dua macam pohon sagu saja yaitu M. Sagus dan M. rumphii.
Bagian terpenting dalam tanaman sagu adalah batang sagu karena merupakan tempat penyimpanan cadangan makanan (karbohidrat) yang dapat menghasilkan pati sagu. Tinggi batang sagu dewasa mencapai 10 m (Ruddle et al., 1978). Ukuran dari batang sagu dan kandungan patinya tergantung pada jenis sagu, umur dan habitatnya. Pada umur panen sekitar 11 tahun ke atas empulur sagu mengandung pati sekitar 15-20 persen (Rumalu, 1981. dalam Haryanto dan Pangloli, 1992). Setiap pohon sagu dapat menghasilkan tepung sagu berkisar antara 50-450 kg tepung sagu basah (Satrapradja et al., 1980).
Sagu (Metroxylon sp.) merupakan tumbuhan asli Indonesia. Selain di Indonesia sagu hanya ditemukan di beberapa negara lain seperti Papua New Guinea, Malaysia, Thailand, dan Filipina (Ruddle, 1978). Indonesia memiliki areal sagu terbesar dengan luas sekitar 1.114 juta hektar atau 50% dari 2.18 juta hektar sagu dunia, disusul Papua New Guenia 43.3% (Abner dan Miftahorrahman, 2002).
Sagu merupakan salah satu sumber karbohidrat potensial disamping beras, khususnya bagi sebagian besar masyarakat di kawasan Timur Indonesia seperti Irian Jaya dan Maluku. Beberapa produk olahan dari pati sagu antara tumbuhan penghasil karbohidrat lainnya sulit tumbuh. Pemanfaatan sagu di Indonesia belum maksimal. Indonesia jauh tertinggal dari Malaysia dan Thailand yang hanya memiliki areal sagu seluas 1.5% dan 0.2% dari total luas areal sagu dunia. Sistem pengolahan sagu di Indonesia masih sangat rendah yang ditandai dengan kapasitas dan produktivitas pengolahan yang masih rendah. Hal ini disebabkan oleh sebagian besar tujuan pengolahan sagu hanya untuk memenuhi kebutuhan keluarga. Cara sederhana tersebut menghasilkan rendemen yang rendah dan kurang efisien
Di pasaran internasional tepung sagu digunakan sebagai bahan substitusi tepung terigu untuk pembuatan biskuit, mie, sirup berkadar fruktosa tinggi, industri perekat, dan industri farmasi. Pemanfaatan dan nilai tambah sagu pada tingkat petani masih sangat sederhana..
Sagu memiliki kandungan karbohidrat, protein, lemak, kalsium, dan zat besi yang tinggi. Dengan kandungan tersebut, sagu berpotensi dijadikan sebagai bahan baku sirup glukosa yang dapat meningkatkan nilai tambah sagu.
amilopektin akan mempengaruhi sifat pati. Semakin tinggi kadar amilosa maka pati bersifat kurang kering, kurang lekat dan mudah menyerap air (higroskopis).
Pati sagu memiliki granula yang berbentuk elips agak terpotong dengan ukuran granula sebesar 20-60 µm dan suhu gelatinisasinya berkisar 60-72oC (Knight, 1989). Sedangkan menurut Wirakartakusumah et al. (1986) suhu gelatinisasi pati sekitar 72-90oC.
B. HIDROLISAT PATI SAGU
Hidrolisat pati sagu adalah cairan jernih dan kental dengan komponen utamanya glukosa yang diperoleh dari hidrolisis pati. Hidrolisis pati menjadi glukosa dapat dilakukan dengan bantuan asam atau enzim pada waktu, suhu dan pH tertentu. Berbagai cara hidrolisis pati telah banyak dikembangkan diantaranya yaitu hidrolisis asam, hidrolisis enzim dan kombinasi asam dan enzim (Tjokroadikoesomo, 1986).
Pembuatan hidolisat pati sagu secara enzimatis dapat menghasilkan rendemen dan mutu sirup glukosa yang lebih tinggi dibandingkan hidrolisis secara asam. Pada hidrolisis secara enzimatis ikatan pati dipotong sesuai dengan jenis enzim yang digunakan, sedangkan apabila menggunakan asam pemotongan dilakukan secara acak.
Pada pembuatan hidrolisat pati sagu terdapat tiga tahapan dalam mengkonversi pati yaitu tahap gelatinisasi, likuifikasi dan sakarifikasi. Tahap gelatinisasi merupakan pembentukan suspensi kental dari granula pati, tahap likuifikasi yaitu proses hidrolisis pati parsial yang ditandai dengan menurunnya viskositas dan sakarifikasi yaitu proses lebih lanjut dari hidrolisis untuk menghasilkan glukosa (Chaplin dan Buckle, 1990).
-(1,6) glikosidik tidak dapat diputus oleh α-amilase, tetapi dapat dibuat menjadi cabang-cabang yang lebih pendek (Nikolov dan Reilly, 1991). Enzim
α-amilase umumnya diisolasi dari Bacillus amyloquefaciens, B. licheniformis, Aspergillus oryzae, dan A. niger. Nilai pH optimum untuk aktivitas enzim ini sekitar 6 dengan suhu optimum 60oC. Jika suhu semakin ditingkatkan maka pH optimum pun semakin meningkat sampai sekitar tujuh (Tjokroadikoesomo,1986).
Pada likuifikasi pati biasanya α-amilase yang digunakan adalah yang memiliki aktivitas tinggi, sehingga dosis enzim yang digunakan sekitar 0.5-0.6 kg/ton pati atau 1500 U/kg substrat kering (Chaplin dan Bucke, 1990). Enzim
α-amilase komersial dibuat oleh Novo Industri A/S antara lain dengan nama Termamyl yang memiliki ketahanan terhadap suhu sekitar 95-110oC. Stabilitas Termamyl tergantung pada suhu, konsentrasi Ca2+, kandungan ion dan ekuivalen dekstrosa. Dosis α-amilase yang biasa digunakan antara 0.5 sampai 0.6 kg Termamyl 102 L per ton pati kering. Satu kNU (kilo Novo α -amilase Unit) adalah jumlah enzim yang dapat menghidrolisis 5.26 pati (gram standar) per jam suhu 37oC, pH 5.6 pada kondisi standar (Kearsley dan Dzeidzic,1995).
Setelah terjadi likuifikasi, selanjutnya bahan akan mengalami proses sakarafikasi oleh enzim amiloglukosidase. Amiloglukosidase merupakan eksoenzim yang terutama memecah ikatan α-(1,4) dengan melepaskan unit-unit glukosa dari ujung non reduksi molekul amilosa dan amilopektin untuk memproduksi β-D-Glukosa. Nama trivial yang sering digunakan pada enzim ini adalah amiloglukosidase (AMG), glukoamilase, dan gamma-amilase (Kulp, 1975). Amiloglukosidase ditemukan pada tahun 1950-an dan digunakan secara luas pada teknologi bioproses pati dan industri makanan. Kegunaan yang luas dan spesifik menyebabkan amiloglukosidase digunakan pada produksi gula cair (Nikolov dan Reilly, 1991).
Amiloglukosidase yang umumnya digunakan pada tahap sakarifikasi berasal dari Aspergillus niger. Pada kondisi yang sesuai, enzim amiloglukosidase ditambahkan dengan dosis berkisar 1.65-0.80 liter enzim per ton pati dengan dosis sebesar 200 U/kg pati (Chaplin dan Buckle, 1990). Amiloglukosidae yang berasal dari Novo yaitu AMG tersedia dalam bentuk cair dengan aktivitas 200, 300 atau 400 AGU g-1. Satu AGU (Amiloglukosidase Unit) adalah jumlah enzim yang menghidrolisis 1 µmol maltosa per menit pada suhu 25oC dan kondisi standar (Kearsley dan Dziedzic, 1995).
C. FERMENTASI ETANOL
Menururt Prescot dan Dunn (1959), etanol dapat diproduksi dari gula melalui fermentasi pada kondisi tertentu. Sedangkan pati dan karbohidrat lainnya dapat dihidrolisa menjadi gula kemudian difermentasi untuk membentuk etanol. Etanol merupakan nama kimia untuk alkohol dengan rumus kimia C2H5OH. Bioetanol adalah cairan biokimia dari proses
fermentasi gula dari sumber karbohidrat menggunakan bantuan mikroorganisme. Proses produksi etanol berbahan baku karbohidrat dapat dilihat pada Lampiran 1.
Mikroorganisme yang dipakai dalam fermentasi etanol adalah khamir. Khamir yang biasa digunakan untuk menghasilkan etanol adalah Saccharomyces cerevisiae. Saccharomyces cerevisiae sering dipakai pada fermentasi etanol karena menghasilkan etanol yang tinggi, toleran terhadap kadar etanol yang tinggi, mampu hidup pada suhu tinggi, tetap stabil selama kondisi fermentasi dan dapat bertahan hidup pada pH rendah (Rehm dan Reed, 1981).
digunakan Saccharomyces cerevisiae yang memiliki sifat antara lain menghasilkan karbondioksida yang tinggi serta mampu memberikan tekstur dan rasa roti yang baik. Sementara Saccharomyces cerevisiae yang digunakan untuk produksi alkohol memiliki sifat antara lain mampu menghasilkan etanol yang tinggi (Peppler 1989).
Ragi roti mengandung sel hidup (viable cell) Saccharomyces cerevisiae (Retledge, 2001). Ragi roti biasanya berbentuk kering dengan berat kering 95% atau bentuk basah dengan berat kering 25-29%. Ragi roti biasanya digunakan sebagai zat pengembang adonan dan untuk memberikan tekstur serta rasa yang khas pada roti. Sementara itu ragi pada minuman beralkohol (brewing yeast dan wine yeast) digunakan sebagai inokulum pada pembuatan minuman beralkohol. Menurut Peppler (1979) ragi yang paling banyak digunakan dan tersedia banyak di pasaran adalah ragi roti. Galur Saccharomyces cerevisiae yang digunakan berbeda antara ragi roti dan ragi untuk industri alkohol (Retledge, 2001).
Khamir memerlukan medium dan lingkungan yang sesuai untuk pertumbuhan dan perkembang-biakannya. Unsur-unsur dasar yang dibutuhkan adalah karbon, hidrogen, oksigen, fosfor, zat besi dan magnesium. Unsur karbon banyak diperoleh dari dari gula, sumber nitrogen didapatkan dari amonia, asam amino, peptida, pepton, nitrat atau urea tergantung pada jenis khamir. Fosfor merupakan unsur penting dalam kehidupan khamir terutama dari pembentukan alkohol dari gula.
Pada permulaan proses fermentasi, khamir memerlukan oksigen untuk pertumbuhannya sehingga fermentasi terjadi secara aerob. Setelah terbentuk CO2, reaksi akan berubah menjadi anaerob. Alkohol yang terbentuk akan
menghalangi fermentasi lebih lanjut setelah tercapai konsentrasi antara 13-15% volume. Konsentrasi alkohol akan menghalangi fermentasi tergantung pada suhu dan jenis khamir yang digunakan (Prescot dan Dunn, 1959).
pada setiap keadaan yang memungkinkan karena energi yang dihasilkan pada respirasi jauh lebih besar dibandingkan energi yang dihasilkan pada fermentasi (Barnett et al., 2000). Bila terdapat udara pada proses fermentasi maka etanol yang dihasilkan lebih sedikit karena terjadi respirasi yang mengakibatkan terjadinya konversi gula menjadi karbondioksida dan air.
Suhu optimum pertumbuhan khamir adalah pada suhu 25o-30oC dan maksimum pada 35oC-47oC. Sedangkan pH optimum adalah 4-5. Batas minimal aw untuk khamir biasa adalah 0.88-0.94 sedangkan untuk khamir
osmofilik dapat tumbuh pada aw yang lebih rendah yaitu sekitar 0.32-0.65.
Namun demikian banyak juga khamir osmofilik yang pertumbuhannya terhenti pada aw 0.78 seperti pada larutan garam ataupun sirup (Frazier dan
Westhoff, 1978).
Menurut Casida (1968) pH pertumbuhan khamir yang baik adalah pada rentang antara 3-6. Perubahan pH dapat mempengaruhi pembentukan hasil samping fermentasi. Nilai pH pertumbuhan berhubungan positif dengan pembentukan asam piruvat. Pada pH tinggi maka lag fase akan lebih singkat dan aktifitas fermentasi akan meningkat. Pengaruh pH pada pertumbuhan khamir juga tergantung pada konsentrasi gula dan etanol. Nilai pH dapat diturunkan menggunakan asam sitrat, sedangkan untuk menaikkan pH dapat digunakan natrium benzoat.
Paturau (1981) menyatakan bahwa fermentasi etanol memakan waktu 30-72 jam. Prescott dan Dunn (1959) menyatakan bahwa waktu fermentasi etanol adalah 3-7 hari.
Amerine dan Cruess (1960) menyatakan bahwa proses pemecahan gula menjadi etanol dan CO2 dilakukan oleh sel khamir. Enzim yang berperan
Secara teoritis konversi molekul gula menjadi 2 molekul etanol dan 2 molekul CO2 menururt persamaan Gay Lussac sebagai berikut
C6H12O6 2 C2H5OH + 2 CO2
(gula) (etanol) (karbondioksida)
Berdasarkan persamaan di atas dapat dijelaskan bahwa 51,1% gula diubah menjadi etanol dan 49.9% diubah menjadi karbondioksida. Akan tetapi hasil ini kebanyakan tidak dapat dicapai karena adanya hasil sampingan. Pada kenyataannya hanya 90-95% dari nilai ini yang dapat dicapai. Konsentrasi alkohol yang dihasilkan dalam fermentasi tergantung pada jenis khamir yang dipakai dan kadar gula. Sedangkan konsentrasi produk samping dipengaruhi oleh suhu, aerasi, kadar gula dan keasaman (Underkofler dan Hickey, 1954). Produk samping yang dihasilkan antara lain asam piruvat dan asam laktat.
Pada kondisi anaerob, metabolisme glukosa menjadi etanol melalui jalur Embden Meyerhoff-Parnas yang merupakan reaki-reaksi fosforilasi dan defosforilasi dengan ATP dan ADP sebagai donor aseptor fosfat, reaksi pemecahan C6 menjadi 2 molekul C3 yang terforforilasi, reaksi
oksidasi-reduksi dan reaksi dekarboksilasi. Skema Embden Meyerhoff-Parnas Pathway dapat dilihat pada Gambar 1.
Glukosa mengalami fosforilasi menjadi glukosa-6-P dan fruktosa-6-P dengan ATP sebagai donor fosfat. Fruktosa-6-P kemudian diubah menjadi fruktosa 1,6-di-P menggunakan ATP sebagai donor fosfat. Fruktosa-1,6-di-P kemudian dipecah menjadi dua molekul C3 yang terfosforilasi yaitu
asetaldehid dan CO2 yang kemudian akan mengalami reaksi oksidasi
membentuk etanol.
Gambar 1. Skema Embden Meyerhoff-Parnas Pathway (Prescott dan Dunn, 1959).
ATP ADP ATP ADP
Glukosa Glukosa-6-P Fruktosa-6-P Fruktosa-1,6-Di-P
NADH+H+ NAD+ 1.3-Di-P-Asam Gliserat
ATP
ADP
H2O
3-P-Asam Gliserat 2-P-Asam Gliserat Fenol-Asam-Piruvat
CO2
NAD+ NADH+H+ Asam Piruvat Etanol Asetaldehida
Keterangan : ATP = Adenosin Trifosfat ADP = Adenin Difosfat
NAD = Nikotinamida Adenin Dinukleotida NADP = Nikotinamida Adenin Dinukleotida Fosfat NADPH = Nikotinamida Adenin Dinukleotida Tereduksi
Glukosa mengalami fosforilasi menjadi glukosa-6-P dan fruktosa-6-P dengan ATP sebagai donor fosfat. Fruktosa-6-P kemudian diubah menjadi fruktosa 1,6-di-P menggunakan ATP sebagai donor fosfat. Fruktosa-1,6-di-P kemudian dipecah menjadi dua molekul C3 yang terfosforilasi yaitu
dihidroksiaseton fosfat dan gliseraldehida-3-P. Dihidroksi aseton fosfat selanjutnya teroksidasi menjadi gliserolfosfat kemudian diubah menjadi gliserol yang merupakan metabolit sekunder. Gliseraldehid-3-P tereduksi membentuk asam 1,3-di-fosfogliserat kemudian mengalami defosforilasi menjadi 3-P-asam gliserat dengan melepaskan fosfat dan aseptor fosfat ADP membentuk ATP. Selanjutnya, 3-P-asam gliserat membentuk 2-P-asam gliserat kemudian terbentuk asam fosfoenol piruvat dengan menghasilkan ATP. Melalui reaksi dekarboksilasi, asam piruvat akan membentuk asetaldehid dan CO2 yang kemudian akan mengalami reaksi oksidasi
membentuk etanol.
Penambahan inokulum khamir dapat dilakukan dalam berbagai bentuk diantaranya dalam bentuk suspensi atau dalam bentuk kering. Banyaknya suspensi khamir yang ditambahkan dalam fermentasi skala besar adalah sekitar 1-3 % (Prescott dan Dunn, 1959). Menurut Undekofler dan Hickey (1954) paling sedikit penambahan inokulum aktif pada pembuatan anggur adalah sekitar 1% apabila substrat yang digunakan bersih dan bebas dari khamir yang tidak diinginkan. Sementara itu, Rinaldy (1987) menggunakan konsentrasi inokulum 10% (v/v).
Dalam fermentasi skala industri, sumber karbon yang biasanya digunakan adalah karbohidrat yang dapat diperoleh dari berbagai jenis pati seperti jagung, serelia, kentang dan sagu. Sumber karbon lain juga bisa didapatkan dari hasil pertanian yang banyak mengandung selulosa antara lain jerami padi, tongkol jagung, bagas, limbah kayu dan kertas. Sebelum digunakan, bahan-bahan tersebut harus dihidrolisis lebih dulu baik secara kimia maupun secara enzimatis (Hartoto, 1992).
Sumber nitrogen yang dapat digunakan dalam proses fermentasi diantaranya corn step liquor, ekstrak gandum atau tauge, hidrolisat kasein, dan ekstrak khamir. Vogel (1983) membedakan sumber nitrogen menjadi sumber organik dan anorganik. Yang termasuk sumber nitrogen organik adalah corn steep liquor, urea, protein, ekstrak khamir dan tepung ikan, sedangkan sumber nitrogen anorganik adalah gas amonia, amonium hidroksida dan amonium sulfat.
Menurut Hartoto (1992) sumber nitrogen yang biasa digunakan untuk fermentasi skala besar adalah garam amonium, urea atau amonia. Pemilihan ammonium sebagai sumber nitrogen disebabkan oleh faktor ekonomis yaitu harga yang relatif murah dan mudah didapatkan. Pupuk NPK dan ZA mempunyai harga yang relatif murah dan mudah didapatkan.
D. KINETIKA FERMENTASI
Pertumbuhan mikrobial ditandai dengan peningkatan jumlah dan massa sel, sedangkan kecepatan pertumbuhan tergantung pada lingkungan fisik dan kimianya (Reed dan Rehm, 1983). Kinetika fermentasi mempelajari perkembangbiakan mikroba yang ditunjukkan oleh kenaikan konsentrasi biomassa karena konsumsi substrat. Pada saat yang bersamaan dihasilkan produk, baik metabolit primer maupun sekunder (Mangunwidjaja dan Suryani, 1994).
berakhir dan tidak dilakukan lagi penambahan komponen substrat selama fermentasi berlangsung (Rachman, 1989).
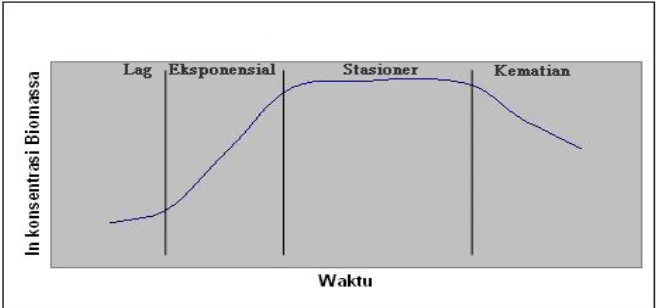
Pada fermentasi secara curah, pertumbuhan mikroba secara umum mengikuti pola seperti disajikan pada Gambar 2.
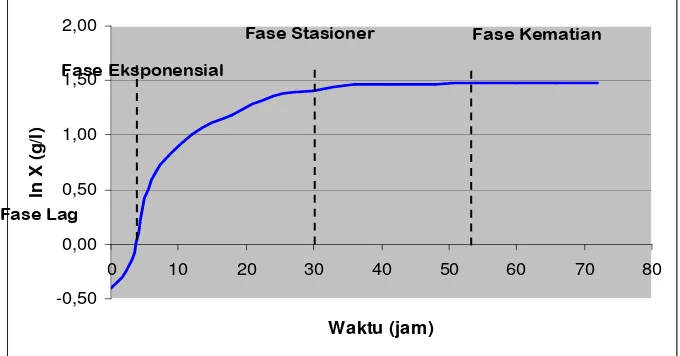
Gambar 2. Kurva pertumbuhan mikroba pada sistem curah (Stanburry dan Whitaker, 1984)
Fase lag merupakan masa penyesuaian mikroba sejak inokulum diinokulasi ke dalam media fermentasi. Pada fase lag terjadi pertumbuhan lambat dimana sel mempersiapkan diri melakukan pembelahan sehingga peningkatan jumlah sel berjalan lambat. Cepat atau lambatnya fase lag tergantung kepada kualitas, kuantitas, dan umur kultur yang diinokulasikan (Moat, 1979).
Pada fase eksponensial terjadi pertumbuhan cepat dimana jumlah sel bertambah secara eksponensial terhadap waktu. Menurut Rehm dan Reed (1981) pada fase eksponensial kondisi lingkungan berubah karena substrat dan nutrien dikonsumsi sementara metabolik dihasilkan.
Pada keadaan lingkungan tertentu pertumbuhan mikrobial dapat dinyatakan dengan persamaan berikut
Pada kondisi yang sesuai maka penurunan massa sel sangat kecil sehingga
α dapat diabaikan sehingga persamaan 1 menjadi :
Integrasi dari persamaan 2 untuk menghasilkan nilai peningkatan massa sel pada suatu selang waktu tertentu adalah :
x1 x2 dx = t1t2µ dt
x
akan diperoleh persamaan :
ln ( x2 ) = µ∆t atau ln x2 = ln x1 + µ∆t x1
Laju pertumbuhan spesifik (µ) bersifat tidak konstan tergantung pada kondisi lingkungan fisik dan kimianya. Nilai maksimum (µmaks) dicapai pada kondisi pasokan substrat dan nutrien masih berlebih serta konsentrasi zat-zat metabolik yang menghambat pertumbuhan masih rendah.
Menurut Wang et al. (1979), koefisien hasil sel hidup terhadap sumber karbon dinyatakan sebagai Yx/s, koefisien konversi nutrien dalam substrat menjadi produk pada periode tertentu dinyatakan sebagai Yp/s. Sedangkan koefisien produk terhadap jumlah sel hidup dinyatakan sebagai Yp/x.
Keterangan : x : konsentrasi sel t : waktu fermentasi
µ : laju pertumbuhan spesifik
: laju lisis sel yang menghambat pertumbuhan
dx = µx - αx ………(1) dt
Perhitungan yang biasa digunakan untuk proses pembentukan produk yang berasosiasi dengan pertumbuhan sel adalah sebagai berikut
Yx/s = ∆X Yp/s = ∆P Yp/x = ∆P
∆S ∆S ∆X
III. BAHAN DAN METODE
A. BAHAN DAN ALAT
Bahan-bahan yang digunakan pada penelitian ini adalah pati sagu (Metroxylon sp) yang didapatkan dari Bogor, enzim α-amilase (Termamyl) dan enzim amiloglukosidase (AMG) yang didapatkan dari Novo Industri. Bahan-bahan kimia untuk pembuatan dan analisa hidrolisat pati sagu yaitu CaCO3, HCL, NaOH, larutan iod, larutan kanji, H2SO4, larutan KI, pereaksi
DNS (3,5 asam dinitrosalisitat), larutan standar glukosa, etanol, dan akuades. Sementara itu bahan-bahan yang diperlukan untuk fermentasi adalah kultur murni Saccharomyces cerevisiae, ragi roti merk Fermipan, PDA (Potato Dekstrose Agar), GYE (Glucose Yeast Extract) untuk media perkembangbiakan, pupuk NPK dan ZA sebagai sumber nutrien dalam media fermentasi etanol.
Alat yang digunakan pada penelitian ini meliputi peralatan gelas, shaker, otoklaf, spektofotometer, desikator, oven, cawan porselen, cawan alumunium, termometer, pH-meter, buret, pipet, dan Soxhlet Apparatus. Peralatan untuk fermentasi adalah fermentor kapasitas 2 liter, pH-meter, gelas ukur, labu erlenmeyer, dan jarum ose.
B. METODE PENELITIAN
Penelitian ini dilakukan dalam dua tahap, yaitu penelitian pendahuluan dan penelitian utama.
1. Penelitian Pendahuluan
a. Penyiapan Media Fermentasi
Hidrolisis pati sagu dilakukan menggunakan metode enzimatis (Akyuni, 2004). Enzim yang digunakan sebelumnya dihitung aktivitasnya agar jumlah enzim yang digunakan sesuai dengan dosis yang diperlukan. Prosedur pengukuran aktivitas enzim dapat dilihat pada Lampiran 3. Hidrolisat pati sagu yang dihasilkan kemudian diuji kadar gula total, kadar gula pereduksi, Ekuivalen dekstrosa (DE), derajat polimerisasi (DP) dan pH. Diagram alir proses hidrolisis pati sagu diperlihatkan pada Lampiran 4, prosedur analisa hidrolisat pati sagu diperlihatkan pada Lampiran 5.
b. Penyiapan Inokulum
1. Penyiapan Inokulum Saccharomyces cerevisiae
Kultur murni Saccharomyces cerevisiae dibiakkan pada agar miring PDA selama 48 jam dengan kondisi aerobik dan suhu kamar sebelum diinokulasi pada media cair GYE (Rinaldy, 1987). Kultur hasil biakan pada PDA selanjutnya dibiakkan pada media GYE sebelum dipakai pada fermentasi. Pembiakkan dilakukan dengan menginokulasi sebanyak 1 jarum ose ke dalam 20 ml media GYE dalam labu erlenmeyer 100 ml. Waktu inkubasi adalah selama 24 jam pada suhu kamar dengan kondisi aerobik. Hasil biakan digunakan sebagai inokulum pada fermentasi utama. Jumlah sel yang terkandung di dalam inokulum dihitung menggunakan hemasitometer.
2. Pemilihan Metoda Penyiapan Inokulum Ragi roti
1. Ragi roti ditimbang sesuai keperluan. 2. Ragi roti dimasukkan ke dalam air hangat.
3. Ragi roti ke dimasukkan ke dalam media fermentasi.
Untuk mendapatkan bobot (gram) ragi roti yang setara dengan 1 ose kultur murni Saccharomyces cerevisiae maka dilakukan penghitungan jumlah sel pada inokulum dari beberapa perlakuan. Perlakuan yang dilakukan adalah
1. Menumbuhkan 1 gram ragi roti pada 20 ml media GYE selama 24 jam.
2. Menumbuhkan 0.1 gram ragi roti pada 20 ml media GYE selama 24 jam .
3. Mencampurkan 0.1 gram ragi roti dengan 20 ml air suhu 30oC.
Jumlah ragi roti dan metode yang digunakan pada fermentasi utama adalah perlakuan yang menghasilkan jumlah sel inokulum yang sama dengan jumlah sel inokulum kultur murni Saccharomyces cerevisiae.
2. Penelitian Utama
proses fermentasi. Fermentasi berlangsung pada suhu kamar dengan lama fermentasi 72 jam. Pengamatan dilakukan pada awal dan akhir fermentasi yang meliputi analisa kadar etanol, biomassa, gula pereduksi akhir dan CO2. Prosedur analisagula pereduksi sama dengan
analisa hidrolisat pati, prosedur pengukuran biomassa dapat dilihat pada Lampiran 6 dan prosedur pengukuran kadar etanol dapat dilihat pada Lampiran 7.
b. Perlakuan
Perlakuan yang diterapkan pada penelitian ini adalah:
1. Perlakuan konsentrasi gula yang berbeda yaitu 8% (b/v), 14% (b/v) dan 20% (b/v).
2. Perlakuan jenis inokulum yang berbeda yaitu kultur murni Saccharomyces cerevisiae dan ragi roti.
c. Fermentasi Pada Fermentor 2 L
Perlakuan terbaik dari penelitian ini digunakan sebagai media fermentasi pada fermentor 2 liter. Pada fermentasi ini dilakukan analisa biomassa, kadar etanol, volume CO2, dan gula pereduksi.
Prosedur analisagula pereduksi sama dengan analisa hidrolisat pati. Prosedur analisa biomassa dijelaskan pada Lampiran 6 dan prosedur pengukuran kadar etanol dapat dilihat pada Lampiran 7. Fermentasi dilakukan selama 72 jam dengan pengamatan tiap 3 jam sampai jam ke-6, selanjutnya dilakukan pengamatan setiap 6 jam.
3. Rancangan Percobaan
pereduksi sisa, efisiensi pemanfaatan substrat dan pH. Model yang digunakan adalah berdasarkan Hanafiah (2005), sebagai berikut;
Yij = µ + αi + βj + αi βj + εij
Yij =
µ = Efek rata-rata yang sebenarnya
αi = Efek dari taraf ke i konsentrasi gula
βj = Efek dari taraf ke j jenis inokulum
εij =
Model tersebut dianalisis sidik ragamnya menggunakan perangkat lunak SAS.
Variabel respon karena pengaruh bersama taraf konsentrasi gula taraf ke i dan jenis inokulum taraf ke j
IV. HASIL DAN PEMBAHASAN
A. PENELITIAN PENDAHULUAN a. Persiapan Media Fermentasi
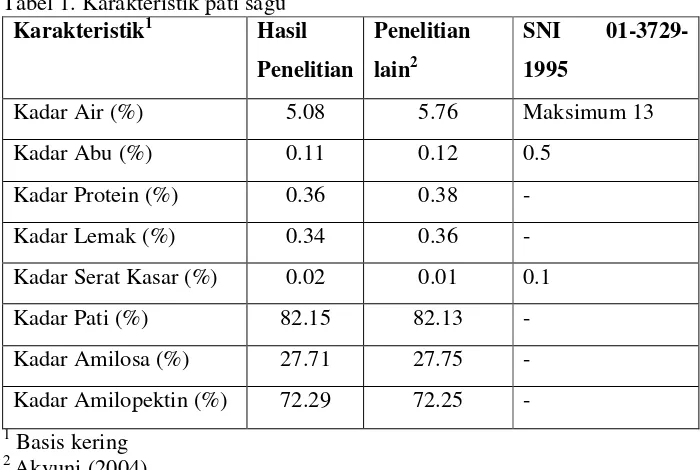
Penelitian pendahuluan terdiri dari analisa proksimat pati sagu, hidrolisis pati sagu dan analisa hidrolisat pati sagu. Analisa proksimat pati sagu terdiri dari analisa kadar air, kadar abu, kadar protein, kadar lemak, kadar pati, kadar serat kasar, kadar amilosa, dan kadar amilopektin. Hasil analisa proksimat kadar pati sagu (Metroxylon sp.) dapat dilihat pada
sagu pada penentuan rasio pati sagu dengan air yang ditambahkan untuk menghasilkan substrat yang diinginkan.
Abu merupakan zat organik yang dihasilkan dari proses pembakaran yang dikenal sebagai unsur mineral. Kadar abu hasil penelitian mencapai 0.11 %. Kadar abu dari pati sagu yang dihasilkan memiliki kandungan mineral atau zat anorganik yang rendah. Pada pembuatan hidrolisat pati sagu, kadar abu pati dapat mempengaruhi proses hidrolisis pati karena kandungan mineral pada pati yang tinggi dapat menghambat proses hidrolisis pati.
Kadar lemak dan kadar protein hasil pengujian sagu adalah 0.34 % dan 0.36%. Kadar protein yang terkandung dalam pati dapat mempengaruhi warna sirup glukosa. Reaksi yang terjadi antara gula pereduksi dengan protein pada suhu tinggi akan menghasilkan warna coklat atau disebut juga reaksi browning.
Serat kasar adalah residu dari bahan makanan atau pertanian setelah diperlakukan dengan asam atau alkali mendidih (Fardiaz, et al., 1986. dalam Sudiaman, 1990). Kadar serat kasar pati sagu mencapai 0.02%. Nilai kadar serat kasar pati sagu yang digunakan dalam penelitian ini kecil karena adanya proses pengayakan. Kadar serat kasar yang tinggi dapat menurunkan efisiensi proses hidrolisis dan mempengaruhi kerja enzim sehingga perlu adanya penambahan dosis enzim.
Kadar pati merupakan sifat fisik yang berpengaruh terhadap pembuatan sirup glukosa. Kadar pati sagu yang digunakan adalah 82.15%. Pati memiliki dua komponen yaitu amilosa dan amilopektin. Kadar amilosa yang terdapat pada pati sagu adalah sebesar 27.71% dan kadar amilopektin sebesar 72.29%. Rasio amilosa dan amilopektin berpengaruh pada jumlah dosis enzim yang ditambahkan. Ikatan -1,6 glikosidik yang terdapat pada amilopektin dapat dihidrolisis oleh amiloglukosidase sedangkan ikatan -1,4 glikosidik hanya akan dipotong oleh amilase.
digunakan enzim amiloglukosidase dengan aktivitas 8.931 U/ml. Jumlah ml enzim yang digunakan dalam produksi hidrolisat pati sagu dapat ditentukan dari aktivitas enzim tersebut.
Neraca massa produksi hidrolisat pati sagu dapat dilihat pada Lampiran 8.
Analisa hidrolisat pati sagu yang dilakukan meliputi kadar gula total, kadar gula pereduksi, Dektrose Ekuivalen (DE), Derajat Polimerisasi (DP) serta pH. Dari hidrolisis pati sagu dihasilkan nilai gula pereduksi 352.6 g/l, total gula 496.6 g/l. Nilai DP hidrolisat pati sagu adalah 1.4 dan nilai DE hidrolisat adalah 98.9%. Hidrolisat pati sagu yang dihasilkan memiliki pH 6.10.
Ekuivalen dektrosa merupakan rasio gula pereduksi hidrolisat dengan gula pereduksi hidrolisis sempurna. Gula pereduksi yang dihasilkan sebagai persen D-glukosa yaitu 35.26% (b/v). Nilai ekuivalen dekstrosa yang diperoleh dari sirup glukosa adalah sekitar 98,8% (b/v). Tingginya nilai ekuivalen dekstrosa disebabkan karena semakin banyaknya pati yang terkonversi menjadi glukosa. Derajat Keasaman (pH) hidrolisat pati sagu adalah sebesar 6.12. Pada penelitian Akyuni (2004) dihasilkan nilai pH 7.01. Hal ini disebabkan karena pada penelitian tersebut dilakukan penyaringan menggunakan arang aktif. Sementara itu pada penelitian ini tidak dilakukan penyaringan menggunakan arang aktif.
b. Pemilihan Metoda Penyiapan Inokulum Ragi Roti
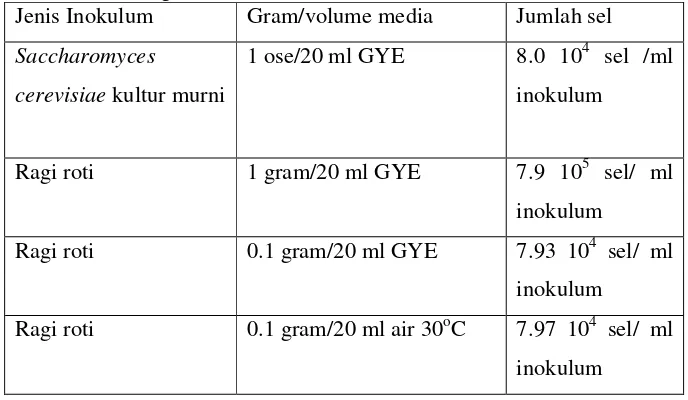
Hasil penghitungan sel dan metode persiapan inokulum pada ragi roti dapat dilihat pada Tabel 2.
Tabel 2. Perhitungan sel dan metode inkubasi inokulum.
Jenis Inokulum Gram/volume media Jumlah sel Saccharomyces
cerevisiae kultur murni
1 ose/20 ml GYE 8.0 104 sel /ml inokulum
Ragi roti 1 gram/20 ml GYE 7.9 105 sel/ ml inokulum
Ragi roti 0.1 gram/20 ml GYE 7.93 104 sel/ ml inokulum
Ragi roti 0.1 gram/20 ml air 30oC 7.97 104 sel/ ml inokulum
B. PENELITIAN UTAMA
i. Penentuan Konsentrasi Substrat dan Jenis Inokulum Terbaik
Penelitian utama dilakukan dengan mengkombinasikan perlakuan konsentrasi substrat dan jenis inokulum. Analisa cairan fermentasi pada penentuan konsentrasi dan jenis inokulum terbaik dapat dilihat pada Lampiran 9. Hasil penelitian fermentasi etanol dapat dijelaskan sebagai berikut
a. Kadar Etanol
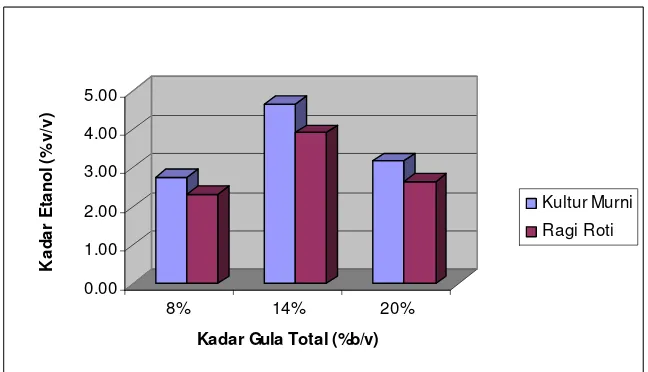
0.00
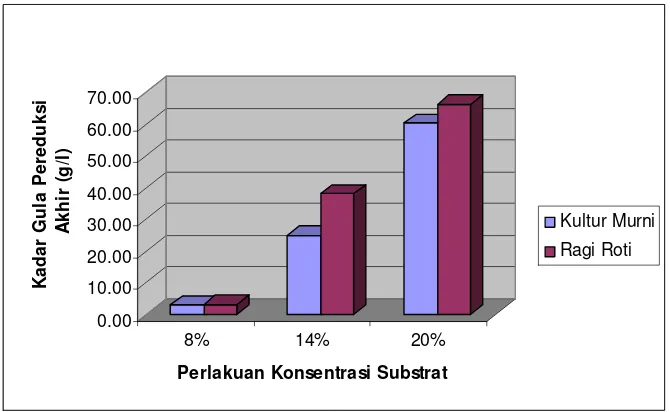
Gambar 3. Histogram kadar etanol cairan fermentasi
Gambar 3 memperlihatkan bahwa kadar etanol tertinggi diperoleh pada fermentasi menggunakan hidrolisat pati sagu 14% (b/v). Pada konsentrasi gula 8% (b/v) didapatkan kadar etanol yang lebih rendah dibandingkan perlakuan konsentrasi gula 14% (b/v). Pada konsentrasi gula 20% (b/v) juga dihasilkan kadar etanol yang lebih rendah dibandingkan perlakuan menggunakan substrat 14% (b/v). Hal ini sesuai dengan laporan Casida (1968) yang menyatakan bahwa kadar total gula optimum untuk fermentasi etanol adalah 10-18% (b/v), sedangkan di atas dan di bawah kadar gula optimum kecepatan fermentasi akan menurun dan jumlah etanol yang dihasilkan juga akan berkurang.
Hasil analisa sidik ragam menunjukkan bahwa konsentrasi substrat, jenis inokulum dan interaksi keduanya berpengaruh nyata terhadap kadar etanol cairan hasil fermentasi. Hasil uji Duncan menunjukkan perlakuan terbaik yaitu fermentasi menggunakan konsentrasi substrat 14 % (b/v) berbeda nyata dengan perlakuan lain. Analisis keragaman terhadap kadar etanol dapat dilihat pada Lampiran 10.
adalah mengubah gula menjadi etanol dan karbondioksida. Clark dan Mackie (1984) menyatakan bahwa khamir sangat peka etanol. Konsentrasi etanol 1-2 % (v/v) sudah mengganggu fermentasi dan pada konsentrasi etanol 10% (v/v) laju pertumbuhan khamir akan berhenti sama sekali. Sedangkan menurut Prescott dan Dunn (1981), kadar etanol maksimal yang bisa dihasilkan sebelum fermentasi benar-benar berhenti adalah 13% (v/v). Mangunwidjaja dan Suryani (1994) menambahkan bahwa konsentrasi 40 g/l etanol akan menjadi penghambat baik untuk pertumbuhan biomassa maupun produksi etanol. Pada penelitian ini didapatkan kadar etanol 2.32-4.66 %(v/v). Pada konsentrasi etanol 4.66% (v/v) ini diduga sudah terjadi penghambatan sehingga fermentasi berhenti. Selain itu, kadar etanol yang terhitung sebenarnya lebih kecil dibandingkan kadar etanol yang sebenarnya terkandung dalam cairan fermentasi. Hal ini disebabkan karena pengukuran kadar etanol dilakukan menggunakan metode destilasi. Menurut Amerine dan Ough (1979) distilasi etanol akan menyebabkan kehilangan etanol sebanyak 0.6-1.5 % (v/v).
Perbedaan kadar etanol pada masing-masing perlakuan disebabkan oleh perbedaan konsentrasi total gula yang diberikan. Semakin tinggi konsentrasi total gula semakin tinggi kadar etanol yang dihasilkan. Hal ini disebabkan karena semakin tinggi konsentrasi total gula semakin banyak substrat (sumber karbon) yang dapat dikonsumsi. Namun, penggunaan substrat yang berlebihan akan menjadi penghambat pada pertumbuhan dan pembentukan produk oleh khamir (Rehm dan Reed, 1983).
Saccharomyces cerevisiae yang digunakan berbeda antara ragi roti dan ragi untuk produksi alkohol.
Hasil penelitian yang dilakukan Rinaldy (1987) dan Daulay (1999) memberikan kadar etanol tertinggi sebesar 1.16 % (v/v) dan 2.63 % (v/v) menggunakan substrat onggok singkong dengan hidrolisis menggunakan asam. Hasil tersebut menunjukkan bahwa kultur murni Saccharomyces cerevisiae mampu mengkonsumsi hidrolisat pati sagu lebih baik dibandingkan onggok singkong sebagai sumber karbon dalam media fermentasi. Hal ini disebabkan karena hidrolisat pati sagu mampu menghasilkan gula pereduksi yang lebih tinggi dibandingkan onggok singkong. Akyuni (2004) menyatakan bahwa hidrolisis pati sagu hasil hidrolisis secara enzim memiliki derajat polimerisasi (DP) sekitar 1.4. Nilai DP yang terbentuk ini menunjukkan bahwa produk yang terbentuk adalah glukosa dan maltosa. Derajat polimerisasi pada glukosa memiliki nilai 1 (DP1) dan maltosa memiliki nilai 2 (DP2). Menurut Retledge dan Kristiansen (2001) Saccharomyces cerevisiae mampu melakukan fermentasi glukosa dan maltosa menjadi etanol.
b. Kadar Gula Pereduksi Akhir
Selama fermentasi, sel akan mengkonversi sumber karbon menjadi biomassa dan produk. Hal ini ditandai dengan berkurangnya kadar gula yang digunakan sebagai sumber karbon. Kadar gula pereduksi akhir menunjukkan kadar gula pereduksi setelah fermentasi selesai.
Histogram rata-rata kadar gula pereduksi akhir diperlihatkan pada
Gambar 4. Histogram rata-rata kadar gula pereduksi akhir
Kadar gula pereduksi yang tersisa berkisar antara 3.00 g/l sampai 60.37 g/l. Kadar gula pereduksi sisa terbesar diperoleh pada perlakuan menggunakan ragi roti dengan konsentrasi gula 20% (b/v), sementara kadar gula pereduksi sisa terkecil diperoleh pada perlakuan menggunakan kadar gula 8% (b/v) dengan inokulum kultur murni Saccharomyces cerevisiae. Pada kadar gula 8% (b/v) baik menggunakan kultur murni maupun ragi roti diperoleh gula pereduksi sisa sebesar 3.0 g/l dan 3.2 g/l. Sementara kadar etanol yang dihasilkan lebih kecil dibandingkan perlakuan menggunakan kadar gula 14% (v/v). Kecilnya kadar etanol yang dihasilkan ini mengindikasikan bahwa kadar gula 8% (b/v) pada substrat belum cukup untuk memenuhi kebutuhan khamir pada proses fermentasi, sehingga fermentasi tidak berjalan optimal dan menghasilkan produk etanol yang rendah.