Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains
VENNY GENIA PRAMUDHITA. Seleksi Isolat Aktinomisetes Penghasil Protein
Antibakteri. Dibimbing oleh EMAN KUSTAMAN dan ALINA AKHDIYA.
Bakteriosin merupakan protein antibakteri yang mudah diuraikan oleh enzim
protease dalam pencernaan manusia, sehingga banyak digunakan sebagai pengawet
alami. Kelompok bakteri Aktinomisetes mampu memproduksi bakteriosin. Akan tetapi
bakteriosin dari Aktinomisetes belum banyak diteliti. Penelitian ini bertujuan untuk
mendapatkan isolat Aktinomisetes yang dapat menghasilkan protein antibakteri seperti
bakteriosin, mengetahui sifat protein antibakteri dan bobot molekulnya.
Seleksi 90 isolat Aktinomisetes dengan metode
menghasilkan 19
isolat Aktinomisetes yang mampu melawan bakteri patogen
dan
(EPEC). Dari 19 isolat Aktinomisetes yang terseleksi didapatkan lima isolat yang
paling baik aktivitas antibakterinya yaitu A7.5, A46.3, A51.3, A62.1, dan A64.3.
Kelima isolat tersebut dikarakterisasi lebih lanjut senyawa antibakterinya dengan
presipitasi amonium sulfat 80%. Endapan hasil presipitasi amonium sulfat 80%
dikarakterisasi dengan
(PAGE), perlakuan panas 87
o
C selama 10 menit dan perlakuan enzim proteinase K.
Produce an Antibacterial Protein. Under the direction of EMAN KUSTAMAN and
ALINA AKHDIYA.
Bacteriocin was highly specific antibacterial protein and commonly used as
commercial food preservatives because it was rapidly digested by proteinase in human
digestive tract. Actinomycetes can produce bacteriocin which is rarely studied rather
than other bacteria. The aim of this research is to get the isolate as some Actinomycetes
wich produce antibacterial protein such as bacteriocin and to know the characteristic of
antibacterial protein.
The screening of 90 Actinomycetes isolates using dual culture
method resulted that 19 isolates were able to inhibit the pathogenic bacteria
such as
,
, Enteropatogenik
(EPEC) and
. The antibacterial
substances of five Actinomycetes isolates (A7.5, A46.3, A51.3, A62.1 and
A64.3) from 19 selected isolates are precipited by 80% ammonium
sulphate. Polyacrilamide Gel Electrophoresis (PAGE), proteinase K and
87
oC heat treatment were done in antibacterial substances had been
precipitated using 80% ammonium sulphate.
Judul Skripsi : Seleksi Isolat Aktinomisetes Penghasil Protein Antibakteri
Nama
: Venny Genia Pramudhita
NIM
: G44102021
Disetujui
Komisi Pembimbing
Ir. Eman Kustaman
Alina Akhdiya M.Si
Ketua
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP. 131 473 999
dengan judul Seleksi Isolat Aktinomisetes Penghasil Protein Antibakteri. Penelitian ini
dilaksanakan mulai bulan Februari sampai Desember 2006 di Laboratorium
Mikrobiologi dan Biokimia Balai Besar Bioteknologi dan Sumber Daya Genetika
Pertanian (BB Biogen) Bogor.
Ucapan terima kasih penulis tujukan terutama kepada Bapak Ir. H. Eman
Kustaman sebagai pembimbing dari Program Studi Biokimia, Ibu Alina Akhdiya, M.Si
selaku pembimbing di lapangan, Ayah, Bunda dan adik tercinta atas do’a<do’anya.
Penulis juga berterima kasih kepada seluruh staf laboratorium BB. Biogen antara lain
mba Susi, mba Kiki, mba Liesya, pak Joko, pak Jajang dan pak Eep atas segala bantuan
dan fasilitas yang telah diberikan. Terima kasih juga kepada teman<teman Al
Muthmainnah, Fahrizan, Febri, Yayu, dan Indah serta semua pihak atas bantuan dan
dukungannya
Semoga karya ilmiah ini dapat bermanfaat.
Penulis dilahirkan di Majalengka Jawa Barat pada tanggal 13 Juni 1984 dari
ayahanda Ojo Sujana dan ibunda Uum Umayah. Penulis merupakan anak pertama dari
dua bersaudara.
Tahun 2002 penulis lulus dari SMU Negeri I Majalengka dan lolos seleksi
masuk IPB dengan jalur USMI (Undangan Seleksi Masuk IPB) pada program studi
Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Aktinomisetes ... 1
Antibakteri ... 2
... 3
... 3
Enteropatogenik
(EPEC)... 3
... 4
BAHAN DAN METODE
Bahan dan Alat ... 4
Metode Penelitian ... 4
HASIL DAN PEMBAHASAN
Seleksi Isolat Aktinomisetes Penghasil Protein Antibakteri... 6
Hasil Presipitasi Amonium Sulfat 80% ... 8
Hasil Perlakuan Panas dan Enzim ...10
Hasil Penentuan Bobot Molekul Pita Protein ...11
SIMPULAN DAN SARAN...13
DAFTAR PUSTAKA ...13
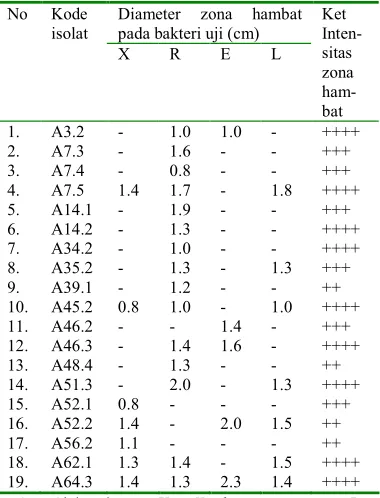
1 Diameter zona hambat isolat Aktinomisetes hasil seleksi uji antibakteri ... 7
2 Diameter zona hambat hasil presipitasi dengan Ammonium Sulfat 80%
tanpa perlakuan ... 9
3 Diameter zona hambat supernatan 2<PBS dengan berbagai perlakuan... 10
4 Bobot molekul pita protein hasil presipitasi lima isolat Aktinomisetes
terpilih... 12
1 Hasil seleksi isolat Aktinomisetes A7.5, A51.3, A62.1 terhadap
bakteri uji
... 7
2 Hasil seleksi isolat Aktinomisetes A64.3 terhadap bakteri uji
... 8
3 Hasil seleksi isolat Aktinomisetes A46.3 terhadap bakteri uji
... 8
4 Zona hambat supernatan 2<PBS kelima isolat Aktinomisetes
terpilih terhadap
... 9
5 Zona hambat supernatan 1<PBS kelima isolat Aktinomisetes
terpilih terhadap
... 9
6 Zona hambat endapan 2<air kelima isolat Aktinomisetes
terpilih terhadap
... 9
7 Zona hambat hasil presipitasi ammonium sulfat<enzim
proteinase K pada
... 10
8 Zona hambat hasil presipitasi ammonium silfat<perlakuan
panas 87
oC selama 10 menit pada
... 10
9 Zona hambat hasil presipitasi ammonium sulfat
tanpa perlakuan pada
... 10
10 Hasil elektroforesis PAGE pada isolat A51.3, A7.5 dan A64.3 ... 12
11 Hasil elektroforesis PAGE pada isolat A62.1... 12
1 Alur metode penelitian ... 16
2 Alur metode presipitasi ammonium sulfat... 17
3 Daftar isolat Aktinomisetes yang diseleksi uji antibakteri ... 18
4 Gambar hasil uji antibakteri supernatan kasar kelima isolat terpilih ... 21
5 Gambar hasil uji antibakteri setelah presipitasi amonium sulfat 80%
terhadap lima isolat Aktinomisetes terpilih ... 21
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains
VENNY GENIA PRAMUDHITA. Seleksi Isolat Aktinomisetes Penghasil Protein
Antibakteri. Dibimbing oleh EMAN KUSTAMAN dan ALINA AKHDIYA.
Bakteriosin merupakan protein antibakteri yang mudah diuraikan oleh enzim
protease dalam pencernaan manusia, sehingga banyak digunakan sebagai pengawet
alami. Kelompok bakteri Aktinomisetes mampu memproduksi bakteriosin. Akan tetapi
bakteriosin dari Aktinomisetes belum banyak diteliti. Penelitian ini bertujuan untuk
mendapatkan isolat Aktinomisetes yang dapat menghasilkan protein antibakteri seperti
bakteriosin, mengetahui sifat protein antibakteri dan bobot molekulnya.
Seleksi 90 isolat Aktinomisetes dengan metode
menghasilkan 19
isolat Aktinomisetes yang mampu melawan bakteri patogen
dan
(EPEC). Dari 19 isolat Aktinomisetes yang terseleksi didapatkan lima isolat yang
paling baik aktivitas antibakterinya yaitu A7.5, A46.3, A51.3, A62.1, dan A64.3.
Kelima isolat tersebut dikarakterisasi lebih lanjut senyawa antibakterinya dengan
presipitasi amonium sulfat 80%. Endapan hasil presipitasi amonium sulfat 80%
dikarakterisasi dengan
(PAGE), perlakuan panas 87
o
C selama 10 menit dan perlakuan enzim proteinase K.
Produce an Antibacterial Protein. Under the direction of EMAN KUSTAMAN and
ALINA AKHDIYA.
Bacteriocin was highly specific antibacterial protein and commonly used as
commercial food preservatives because it was rapidly digested by proteinase in human
digestive tract. Actinomycetes can produce bacteriocin which is rarely studied rather
than other bacteria. The aim of this research is to get the isolate as some Actinomycetes
wich produce antibacterial protein such as bacteriocin and to know the characteristic of
antibacterial protein.
The screening of 90 Actinomycetes isolates using dual culture
method resulted that 19 isolates were able to inhibit the pathogenic bacteria
such as
,
, Enteropatogenik
(EPEC) and
. The antibacterial
substances of five Actinomycetes isolates (A7.5, A46.3, A51.3, A62.1 and
A64.3) from 19 selected isolates are precipited by 80% ammonium
sulphate. Polyacrilamide Gel Electrophoresis (PAGE), proteinase K and
87
oC heat treatment were done in antibacterial substances had been
precipitated using 80% ammonium sulphate.
Judul Skripsi : Seleksi Isolat Aktinomisetes Penghasil Protein Antibakteri
Nama
: Venny Genia Pramudhita
NIM
: G44102021
Disetujui
Komisi Pembimbing
Ir. Eman Kustaman
Alina Akhdiya M.Si
Ketua
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP. 131 473 999
dengan judul Seleksi Isolat Aktinomisetes Penghasil Protein Antibakteri. Penelitian ini
dilaksanakan mulai bulan Februari sampai Desember 2006 di Laboratorium
Mikrobiologi dan Biokimia Balai Besar Bioteknologi dan Sumber Daya Genetika
Pertanian (BB Biogen) Bogor.
Ucapan terima kasih penulis tujukan terutama kepada Bapak Ir. H. Eman
Kustaman sebagai pembimbing dari Program Studi Biokimia, Ibu Alina Akhdiya, M.Si
selaku pembimbing di lapangan, Ayah, Bunda dan adik tercinta atas do’a<do’anya.
Penulis juga berterima kasih kepada seluruh staf laboratorium BB. Biogen antara lain
mba Susi, mba Kiki, mba Liesya, pak Joko, pak Jajang dan pak Eep atas segala bantuan
dan fasilitas yang telah diberikan. Terima kasih juga kepada teman<teman Al
Muthmainnah, Fahrizan, Febri, Yayu, dan Indah serta semua pihak atas bantuan dan
dukungannya
Semoga karya ilmiah ini dapat bermanfaat.
Penulis dilahirkan di Majalengka Jawa Barat pada tanggal 13 Juni 1984 dari
ayahanda Ojo Sujana dan ibunda Uum Umayah. Penulis merupakan anak pertama dari
dua bersaudara.
Tahun 2002 penulis lulus dari SMU Negeri I Majalengka dan lolos seleksi
masuk IPB dengan jalur USMI (Undangan Seleksi Masuk IPB) pada program studi
Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Aktinomisetes ... 1
Antibakteri ... 2
... 3
... 3
Enteropatogenik
(EPEC)... 3
... 4
BAHAN DAN METODE
Bahan dan Alat ... 4
Metode Penelitian ... 4
HASIL DAN PEMBAHASAN
Seleksi Isolat Aktinomisetes Penghasil Protein Antibakteri... 6
Hasil Presipitasi Amonium Sulfat 80% ... 8
Hasil Perlakuan Panas dan Enzim ...10
Hasil Penentuan Bobot Molekul Pita Protein ...11
SIMPULAN DAN SARAN...13
DAFTAR PUSTAKA ...13
1 Diameter zona hambat isolat Aktinomisetes hasil seleksi uji antibakteri ... 7
2 Diameter zona hambat hasil presipitasi dengan Ammonium Sulfat 80%
tanpa perlakuan ... 9
3 Diameter zona hambat supernatan 2<PBS dengan berbagai perlakuan... 10
4 Bobot molekul pita protein hasil presipitasi lima isolat Aktinomisetes
terpilih... 12
1 Hasil seleksi isolat Aktinomisetes A7.5, A51.3, A62.1 terhadap
bakteri uji
... 7
2 Hasil seleksi isolat Aktinomisetes A64.3 terhadap bakteri uji
... 8
3 Hasil seleksi isolat Aktinomisetes A46.3 terhadap bakteri uji
... 8
4 Zona hambat supernatan 2<PBS kelima isolat Aktinomisetes
terpilih terhadap
... 9
5 Zona hambat supernatan 1<PBS kelima isolat Aktinomisetes
terpilih terhadap
... 9
6 Zona hambat endapan 2<air kelima isolat Aktinomisetes
terpilih terhadap
... 9
7 Zona hambat hasil presipitasi ammonium sulfat<enzim
proteinase K pada
... 10
8 Zona hambat hasil presipitasi ammonium silfat<perlakuan
panas 87
oC selama 10 menit pada
... 10
9 Zona hambat hasil presipitasi ammonium sulfat
tanpa perlakuan pada
... 10
10 Hasil elektroforesis PAGE pada isolat A51.3, A7.5 dan A64.3 ... 12
11 Hasil elektroforesis PAGE pada isolat A62.1... 12
1 Alur metode penelitian ... 16
2 Alur metode presipitasi ammonium sulfat... 17
3 Daftar isolat Aktinomisetes yang diseleksi uji antibakteri ... 18
4 Gambar hasil uji antibakteri supernatan kasar kelima isolat terpilih ... 21
5 Gambar hasil uji antibakteri setelah presipitasi amonium sulfat 80%
terhadap lima isolat Aktinomisetes terpilih ... 21
Kelompok bakteri Aktinomisetes merupakan bakteri yang banyak menghasilkan antibakteri. Beberapa contoh senyawa yang bersifat antibakteri adalah antibiotik dan bakteriosin. Antibiotik merupakan metabolit sekunder (Suwandi 2000). Sekitar 70% antibiotik telah ditemukan dari Aktinomisetes
terutama (Suwandi 1993).
Antibiotik yang dihasilkan Aktinomisetes mampu menghambat pertumbuhan bakteri lain. Menurut Lisdar (1997) yang diacu dalam Suarsana (2001) Aktinomisetes juga mampu memproduksi bakteriosin (43%) yang bersifat bakterisidal dan bakteriostatik. Akan tetapi bakteriosin dari Aktinomisetes belum banyak diteliti dibandingkan dengan bakteriosin dari bakteri lain seperti kelompok bakteri asam laktat (BAL), Bacillus, dan Staphylococcus. Sehingga menggali potensi bakteriosin dari kelompok bakteri Aktinomisetes merupakan sesuatu yang menarik. Apalagi manfaat dari bakteriosin yang besar banyak digunakan dalam bidang industri makanan dan minuman yaitu sebagai pengawet alami yang aman dikonsumsi manusia karena mudah diuraikan enzim pencernaan (Joerger . 2000, diacu dalam Hoover & Chen 2003).
Selain dalam bidang industri makanan dan minuman, kemampuan Aktinomisetes dalam menghasilkan antibiotik dan bakteriosin juga dapat dimanfaatkan dalam bidang lain yaitu dalam bidang medis dan pertanian. Pada bidang medis, antibakteri digunakan untuk pengobatan berbagai penyakit infeksi yang disebabkan bakteri, misalnya antibiotik streptomisin yang diisolasi dari biakan Streptomises, merupakan anti tuberkulosis. Sifat antibakteri ini juga dapat digunakan untuk mengatasi diare pada anak< anak yang disebabkan
enteropatogenik (EPEC) dan penyakit listeriosis yang disebabkan
. Sedangkan pada bidang non medis misalnya bidang pertanian, mikrob penghasil antibakteri dapat digunakan sebagai agen biokontrol bagi mikrob patogen tanaman. Contoh penggunaan mikrob sebagai biokontrol yaitu pada penyakit layu bakteri
yang disebabkan dan
penyakit hawar daun bakteri pada padi yang disebabkan
Begitu besarnya potensi Aktinomisetes dalam memproduksi antibakteri dan keberadaannya yang melimpah di alam dapat menjadi salah satu alternatif untuk mengatasi
pengawet alami dalam bidang industri yang berkembang dari waktu ke waktu. Penggalian potensi Aktinomisetes sebanyak<banyaknya dari alam untuk berbagai keperluan hidup manusia merupakan salah satu pemanfaatan sumber daya alam yang melimpah dan beraneka ragam.
Penelitian ini bertujuan untuk mendapatkan isolat Aktinomisetes penghasil protein antibakteri yang mampu menghambat
bakteri ,
, Enteropatogenik
(EPEC) serta .
Hipotesis penelitian ini adalah beberapa isolat Aktinomisetes hasil seleksi mampu mensekresikan protein antibakteri yang
mampu menghambat ,
, Enteropatogenik (EPEC) serta
!"# $ #%&"&%
Aktinomisetes termasuk kelompok bakteri gram positif, memiliki bentuk morfologi berfilamen (benang< benang halus), pleomorfisme (banyak bentuk) dan tumbuh dalam koloni yang bercabang<cabang luas dengan hifa dasar yang pendek, sempit dengan miselium yang berdiameter kecil berukuran 0.05<2 Gm (Dindal 1990). Bentuk koloni aktinomisetes berbentuk bulat dengan elevasi timbul dan cembung, tepian rata dan tidak beraturan serta permukaan bertepung, licin, kasar, atau keriput. Warna koloninya juga bermacam<macam, bahkan ada koloni yang dapat mengubah warna medium serta menghasilkan bau menyerupai tanah yang disebut geomisin (Indriasari 1999). Berdasarkan klasifikasinya, aktinomisetes
termasuk kelas , ordo
yang dikelompokkan menjadi
4 familia yaitu ,
, , dan
(Kanti 2004).
kelompok mikroorganisme yang mampu mendegradasi bahan organik tanah yang kompleks. Selain itu, aktinomisetes juga merupakan sumber utama penghasil antibiotika. Tidak kurang dari 80% antibiotik yang beredar di pasar dunia adalah antibiotik yang berasal dari jenis aktinomisetes. Famili aktinomisetes yang paling banyak dan terkenal menghasilkan antibiotik yaitu yang menghasilkan streptomisin sebagai obat antituberkulosis.
"#' !"&(#
Antibakteri merupakan senyawa kimia yang dapat membunuh atau menghambat pertumbuhan bakteri (Setyaningsih 2004). Beberapa senyawa yang dapat bersifat antibakteri adalah antibiotik dan bakteriosin.
Antibiotik sebagai salah satu senyawa antibakteri, merupakan metabolit sekunder. Metabolit <metabolit sekunder dihasilkan dalam alur metabolisme oleh enzim dan tidak diperlukan untuk pertumbuhan maupun pemeliharaan sel (Schlegel 1976). Akan tetapi antibiotik ini bermanfaat dalam memenangkan persaingan dengan mikrob lain dalam mendapatkan substrat yang sama untuk pertumbuhan. Karena sifatnya tersebut, antibiotik dapat diaplikasikan dalam bidang medis dan pertanian. Namun dalam bidang pertanian, sifat antagonis dari antibiotik tidak dapat dibuktikan di dalam tanah karena produksinya yang sangat sedikit dan dapat menghambat pertumbuhan organisme penghasil antibiotik sendiri.
Antibiotik menurut Zehner dan Mass 1972 yang diacu dalam Hasim 2004 adalah substansi yang dihasilkan organisme hidup yang dalam konsentrasi rendah dapat menghambat atau membunuh organisme lainnya. Sedangkan menurut Selman Walksman (1928) yang diacu dalam Suwandi (2000) antibiotik adalah substansi kimia yang diperoleh dari mikroorganisme yang dalam larutan encer mempunyai kemampuan menghambat pertumbuhan dan membinasakan mikroba lain. Antibiotik dapat dihasilkan oleh alga, lumut, tumbuhan tingkat tinggi, hewan tingkat rendah, vertebrata, dan mikroorganisme. Produksi antibiotik oleh mikroorganisme khususnya bakteri , banyak
2078 jenis antibiotik yang dihasilkan (Betina 1983, diacu dalam Hasim 2004).
Antibiotik dari aktinomisetes dapat dibagi dalam 3 golongan yaitu aminoglikosida, makrolida dan golongan obat antitumor (Hasim 2004). Golongan aminoglikosida mengandung gugus amino dan glikosida. Aminoglikosida bekerja secara langsung pada ribosom bakteri dan akan menghambat sintesa protein sehingga mengganggu translasi pesan genetik bakteri tersebut. Contoh antibiotik golongan ini adalah streptomisin, neomisin, peromomisin, kanamisin, gentamisin, dan tobramisin.
Golongan kedua yaitu golongan makrolida. Struktur golongan ini terdiri atas cincin lakton yang besar dinamakan makrolid, gugus keton, dan glikosida. Cara kerja golongan makrolid ini antara lain dengan menghambat sintesis protein Contoh<contoh antibiotik ini adalah pikromisin, eritromisin, karbomisin, oleandomisin, spiramisin, josamisin, dan tilosin. Golongan ketiga yaitu golongan obat antitumor. Contohnya aktinomisin D, mitomisin C dan antraksiklin, bleomisin, stretonigrin, mitramisin, kromomisin dan olivomisin. Mekanisme kerja aktinomisin D, mitomisin C dan antraksiklin yaitu mengganggu fungsi DNA. Sedangkan bleomisin dan stretonigrin memecahkan ikatan rantai DNA. Mitramisin, kromomisin dan olivomisin berinteraksi dengan DNA (Salas & Mendez 1998, diacu dalam Hasim 2004).
Senyawa lainnya yang bersifat antibakteri adalah bakteriosin. Bakteriosin pertama kali ditemukan oleh A. Gratia pada tahun 1925 yaitu berupa protein beracun yang mampu menghambat pertumbuhan bakteri (Hoover & Chen 2003). Bakteriosin merupakan substansi protein yang memilki bobot molekul kecil dan memiliki aktivitas bakterisidal yang diproduksi oleh bakteri (Tagg 1976; Klaenhamer 1988, diacu dalam Prasad 2005). Beberapa contoh bakteriosin diantaranya yaitu Bacillocin 490 merupakan bakteriosin dari Bacillus yang berukuran 2 kDa (Martirani . 2002) dan bakteriosin dari Staphylococci yang berukuran antara 856<1400 Da (Suarsana 2003).
McAuliffe 2001, diacu dalam Hoover & Chen 2003). Ada juga bakteriosin yang gen klasternya berlokasi di kromosom (Banerjee & Hansen 1998, diacu dalam Hoover & Chen 2003). Kebanyakan bakteriosin disintesis dengan tahapan: pembentukan prepeptida dari gen yang mengkode prepeptida dalam operon , modifikasi reaksi, pemecahan kepala peptida (proteolitik) dan memindahkan prepeptida yang sudah dimodifikasi dengan translokasi menyebrangi membran sitoplasma sehingga menghasilkan propeptida matang yaitu bakteriosin. Pemecahan kepala peptida dapat dilakukan lebih dahulu atau setelah mengirimnya ke luar sel. Menurut Klaenhamer (1993) dan Nes (1996) yang diacu dalam Hoover dan Chen (2003) bakteriosin digolongkan dalam 3 kelas yaitu Kelas I yang berbobot molekul <5kDa, Kelas II berbobot molekul < 10 kDa, dan Kelas III yang berbobot molekul >30 kDa. Sintesis bakteriosin untuk masing<masing kelas memiliki perbedaan dalam modifikasi reaksi dan pembentukan prebakteriosin awal (prepeptida).
Bakteriosin bersifat antibiotik, namun tidak seperti antibiotik, bakteriosin dihasilkan oleh bakteri melalui metabolisme primer dan mudah diuraikan enzim protease dalam saluran pencernaan manusia (Joerger . 2000, diacu dalam Hoover & Chen 2003). Sehingga bakteriosin tidak bereaksi alergi terhadap manusia. Berbeda dengan antibiotik yang dapat menimbulkan alergi bagi orang yang hipersensitif (Cleveland . 2001, diacu dalam Hoover & Chen 2003). Salah satu bentuk bakteriosin yang baru<baru ini ditemukan yaitu BLIS (Bacteriocin<Like Inhibitory Substances) dari !
VIB 295. BLIS bekerja sebagai penghambat interstrain dan interspesies. Sama seperti bakteriosin, BLIS juga merupakan protein. BLIS adalah suatu polipeptida (~32kDa) yang dikode dalam bentuk kromosom (Prasad 2005).
merupakan bakteri gram negatif yang menyebabkan penyakit penting pada padi yaitu penyakit Hawar Daun Bakteri (HDB) (Swings J 1990, diacu dalam Hifni 1986). Penyakit ini adalah penyakit utama padi sawah terutama di daerah tropis. Penyebarannya luas dan telah dilaporkan dari berbagai daerah di Asia, Afrika (Ou 1972, diacu dalam Hifni 1986), Australia (Aldrick,
Amerika selatan (Lozano 1977, diacu dalam Hifni 1986). Di Indonesia penyakit HDB pertama kali ditemukan menyerang tanaman padi di Muara Jawa Barat. Kerugian yang diakibatkan HDB terus meningkat karena varietas padi unggul yang dianjurkan seperti IR 64 bersifat peka terhadap HDB meskipun di satu sisi ia tahan terhadap wereng coklat (Hifni 1986).
Bakteri adalah
nama pengganti dari bakteri
(Smith 1986 diacu dalam Yadi 2000).
merupakan bakteri gram negatif penyebab penyakit layu bakteri (" # ) (Yabuuchi 1995, diacu dalam Yadi 2000). Penyakit ini menyerang lebih dari 200 spesies tanaman (Gillings 1993, diacu dalam Yadi . 2000) dan merupakan kendala utama produksi kacang tanah dan sayuran solonaceae. Selain itu, penyakit ini juga sulit dikendalikan karena patogennya memiliki kemampuan yang cepat dalam merubah jenis infeksinya dan menunjukkan ciri reaksi biokimia dan fisiologi serta ekologi yang heterogen (Yadi . 2000).
"&($) "$*& #! + ,
Enteropatogenik +EPEC)
merupakan bakteri gram negatif strain yang enteropatogenik dan menyebabkan penyakit diare. Penyakit diare didominasi oleh bakteri enteropatogen diaregenik, dengan frekuensi terbanyak EPEC dan disusul oleh
$ (ETEC).
EPEC biasa menyerang organ<organ pencernaan, dapat menyebabkan meningitis pada bayi, neonatus dan menyebabkan diare akut pada anak<anak berumur di bawah dua tahun. EPEC masuk ke tubuh melalui makanan dan minuman yang tidak bersih dan sehat.
EPEC melekat erat dengan permukaan mukosa dan sebagian dikelilingi oleh pedestals pada permukaan eritrosit dan pada area pelekatan EPEC, mikrovili (jonjot usus halus) menjadi hilang. Maka hilangnya mikrovili usus menyebabkan hilangnya kemampuan usus dalam menyerap air dari sisa makanan yang sedang dicerna sehingga menyebabkan diare.
merupakan bakteri gram positif yang tidak berspora dan dikenal sebagai penyebab penyakit listeriosis (Cossart & Bierne 2001, diacu dalam Kane V 2001). Listeriosis merupakan penyakit yang dapat menyerang hampir setiap organ tubuh. Yang paling rentan terhadap penyakit ini adalah bayi baru lahir, usia lanjut (diatas 70 tahun) dan orang yang memiliki gangguan system kekebalan. Infeksi paling banyak terjadi pada bulan Juli<Agustus (Rahmi 2002).
Gejala<gejala listeriosis pada orang dewasa adalah meningitis yaitu infeksi pada selaput pembungkus otak dan
( ). Meningitis menyebabkan demam dan kaku kuduk, jika tidak diobati bisa menyebabkan penurunan kesadaran, koma, dan kematian.
juga dapat menginfeksi mata menjadi merah dan nyeri. Apabila infeksi sampai ke katup jantung maka dapat menyebabkan gagal jantung. Pada ibu hamil listeriosis dapat menginfeksi membran yang melindungi janin sehingga menyebabkan keguguran (Rahmi 2002).
Listeriosis biasanya terjadi karena manusia mengkonsumsi hasil olahan susu atau sayuran mentah yang terkontaminasi. Kontaminasi dapat berasal dari proses pengolahan makanan yang kurang bersih. Bahan makanan yang didinginkan sangat mudah diserang bakteri ini karena
bakteri dapat hidup di
setiap lingkungan (Cossart & Berne 2001, diacu dalam Kane V 2001). Bakteri ini dapat tumbuh di dalam usus burung, laba<laba, binatang air berkulit keras (krustasea) serta mamalia selain manusia. Listeriosis dapat diatasi dengan pengobatan oleh antibiotik (Rahmi 2002).
agar, (NB), ekstrak ragi, (pati polar), glukosa, CaCO32H2O,
kacang kedelai yang sudah dihaluskan, NaCl, tripton, sukrosa, bacto pepton, K2HPO4,
MgSO4.7H2O, ammonium sulfat, etanol,
akuades, alkohol 70%, buffer PBS (
" %% ) pH 7.4, enzim proteinase K,
pewarnaan silver kit, buffer elektroforesis, akrilamid, bisakrilamid, Tris, glisin, Tris HCl, gliserol, bromphenolblue, spirtus, isolat Aktinomisetes koleksi B.B.Biogen, biakan
, biakan , biakan
enteropatogenik (EPEC), dan .
Alat<alat yang digunakan adalah cawan petri, tabung reaksi, tabung reaksi ulir, tabung sentrifus, gelas piala, lup inokulasi, autoklaf, inkubator, # ! , spektrofotometer uv< vis, mesin penggoyang (shaker), sentrifus
" & dan ' , ruang pendingin
( ), % # % ,
kapas, plastik tahan panas, tusuk sate, label, karet, erlenmeyer, neraca analitik, sudip, pipet, tisu, korek api, kertas pembungkus, alumunium foil, kompor gas, panci dan bunsen.
&"$.& & & #"#
& '/ " &.#
Media peremajaan
dan sp. Media yang digunakan adalah media NA (* )yaitu sebanyak 8 g
NB(* " )dan 3% bacto agar yang
dilarutkan dalam 1 L akuades. Kemudian diautoklaf pada suhu 121 0C, tekanan 1 atm selama 15 menit. Setelah itu lalu dituangkan ke dalam cawan petri steril dan dibiarkan sampai membeku.
Media peremajaan EPEC. Media yang digunakan adalah media Luria Betani (LB) dengan komposisi 2 g NaCl, 1 g ekstrak ragi, 2 g tripton dan 4 g bacto agar yang dilarutkan dalam 700 ml akuades. Kemudian dipanaskan sampai larut untuk kemudian dibagi<bagi ke dalam tabung reaksi ulir sebagai agar miring. Lalu diautoklaf pada suhu 1210C, tekanan 1 atm selama 15 menit.
Media peremajaan
Media yang digunakan adalah
bacto agar yang dilarutkan dalam 1 L akuades. Kemudian diautoklaf pada suhu 121 oC, tekanan 1 atm selama 15 menit. Lalu disimpan pada papan miring sampai membeku.
Media peremajaan dan produksi senyawa antibakteri dari aktinomisetes. Media peremajaan yang digunakan adalah media
YSA (+ )dan media NA
(* ). Media YSA dengan
komposisi 2 g ekstrak ragi , 10 g soluble starch, dan 15 g bacto agar yang dilarutkan dalam 1 L akuades dan diautoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit. Kemudian dituang ke dalam cawan petri steril dan dibiarkan sampai membeku. Media NA (* ) dengan komposisi 8 g NB
(* " ) dan 2% agar yang dilarutkan
dalam 1 L akuades. Kemudian diautoklaf pada suhu 1210C, tekanan 1 atm selama 15 menit. Setelah itu lalu dituangkan ke dalam cawan petri steril dan dibiarkan sampai membeku. Sedangkan media produksinya adalah media
dengan komposisi 20 g 10 g glukosa, 3 g CaCO32H2O, dan 15
g kacang kedelai yang sudah dihaluskan. Semua bahan tersebut dilarutkan dalam 1L akuades.
Media uji. Media yang digunakan adalah media NA (* ) dengan komposisi 8 g NB (* " ) dan 2% agar yang dilarutkan dalam 1 L akuades. Kemudian diautoklaf pada suhu 121 0C, tekanan 1 atm selama 15 menit. Setelah itu lalu dituangkan ke dalam cawan petri steril dan dibiarkan sampai membeku.
Media kultur cair bakteri uji. Media yang
digunakan untuk dan
sp adalah NB dengan komposisi 8 g
NB (* " ) yang dilarutkan dalam 1
L akuades. Kemudian diautoklaf pada suhu 1210C, tekanan 1 atm selama 15 menit. Untuk digunakan media SPB dengan komposisi 20 g sukrosa, 5 g bacto pepton, 0.5 g K2HPO4, 0.25 g
MgSO4.7H2O yang dilarutkan dalam 1 L
akuades dan dibagi ke dalam tabung reaksi uril masing<masing 10 ml. Kemudian diautoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit. Sedangkan pada EPEC digunakan media LB cair dengan komposisi 2 g NaCl, 1 g ekstrak ragi, 2 g tripton dan 4 g agar yang dilarutkan dalam 700 ml akuades dan dibagi ke dalam tabung reaksi uril masing<masing 10 ml. Kemudian diautoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit.
larutan A yaitu stok akrilamid yang berisi larutan 30% akrilamid dan 0.8% bis akrilamid. (2) Larutan B yaitu 4x buffer sparating yang berisi 18.2 g Tris dilarutkan dalam 100ml air bebas ion sampai ber<pH 8.8. (3) Larutan C yaitu 4x buffer stacking, sebanyak 6 g Tris HCl dilarutkan dalam 100 ml air bebas ion sampai pH 6.8. (4) Larutan ammonium persulfat 10% sebanyak 5 ml dibuat dari 0.5 g ammonium persulfat dalam 5 ml air. (5) Buffer elektroforesis dibuat dari 3 g Tris 25mM dan 14.4 g glisin 192 mM yang dilarutkan oleh dalam air bebas ion sampai 1L dan pH 8.8. (6) 5x buffer sampel dibuat dari 3.1 ml Tris HCl 1M pH 6.8, 5ml gliserol, 0.5ml 1% bromphenolblue dan 1.4 ml air.
&(& 0 !"&(#
Peremajaan isolat Aktinomisetes pada media YSA dan media NA. Sebanyak 90 isolat aktinomisetes diremajakan dengan metode cawan gores. Isolat Aktinomisetes digoreskan pada permukaan media NA dalam cawan petri dengan lup inokulasi dengan goresan yang rapat. Kemudian diinkubasi selama 5 hari pada suhu ruang (27oC).
Peremajaan kultur bakteri
, , EPEC
dan . Biakan bakteri
tersebut digoreskan pada media agar peremajaan masing<masing bakteri, kemudian diinkubasi pada suhu ruang selama 16<18 jam.
Pembuatan kultur cair
, , EPEC
dan Dengan
menggunakan lup inokulasi, kultur bakteri diambil dan dibiakkan pada media kultur cair masing<masing. Kemudian diinkubasikan pada suhu ruang di mesin penggoyang selama 16<18 jam. Setelah itu diukur kerapatannya berdasarkan metode Mc Farland Nephelometer 1985 yaitu menggunakan tabung no 5 atau 0.5 % BaCl yang setara dengan jumlah bakteri sebanyak 1.5 x 109/ ml.
0# "#' !"&(# .& * &"$.&
+ /.#( 122 ,
Isolat aktinomisetes yang telah tumbuh subur di media cawan agar diambil dengan
& lalu diletakkan pada sumur agar
10/ ml sebanyak 100Ml. Kemudian
dari kertas saring dicelupkan pada senyawa antibakteri yang akan diuji dan diletakkan pada permukaan media NA yang telah mengandung sebaran bakteri uji. Lalu diinkubasi pada suhu ruang selama 24 jam untuk kemudian diamati zona hambatnya.
( !"&(#% %# & 3 4 "#' !"&(# .& * (&%#)#" %# $ #/ / 5 " 6 7
Bagian supernatan dilarutkan dengan ammonium sulfat 80% yaitu sebanyak 52.3 gram untuk 100 ml larutan (Harris ELV and Angal S 1989) sedikit demi sedikit sambil diaduk dengan selama 1 jam dalam suhu 4oC sampai didapatkan presipitat. Kemudian disentrifus 12000 rpm selama 15 menit dan diambil pelletnya. Pelletnya didialisis dengan PBS ( " %%
) dalam keadaan dingin. Kemudian disentrifus lagi 12000 rpm, 4 oC, selama 15 menit. Lalu didapat supernatan 1<PBS dan endapan 1<PBS. Endapannya dilarutkan dalam sedikit PBS lalu disentrifus kembali dan didapat supernatan 2<PBS dan endapan 2<air karena endapan yang didapatkan dilarutkan dalam air. Kemudian masing< masing bagian tersebut diuji anti bakteri dengan metoda Kirby Bauer. Supernatan 2<PBS diberi perlakuan panas 87oC 10 menit, tidak diberi perlakuan, dan perlakuan enzim proteinase K yaitu sebanyak 50 Ml sampel supernatan 2< PBS dicampur dengan 10 Ml enzim proteinase K dan diinkubasi pada suhu 37o C selama kurang dari 4 jam. Kemudian diuji antibakteri dengan metode Kirby Bauer.
( !"&(#% %# & 3 4 "#' !"&(# .& *
+ ,
Selanjutnya, senyawa antibakteri yang telah dikarakterisasi terbatas dan menunjukkan zona hambat yang jernih dan luas dielektroforesis
(PAGE) untuk mengetahui bobot molekul protein aktif. Gel elektroforesis dibuat dengan ketebalan 0.75mm dan 1mm yang terdiri dari stacking gel yang berada di paling atas dan sparating gel yang ada di bawahnya. Gel sparating dibuat sebesar 7.5% yaitu dengan komposisi larutan A x/3 ml,
dan 5 Ml TEMED. Setelah gelnya disusun lalu dibuat sumur gel diatas stacking gel. Sampel disiapkan sebanyak 20 Ml dan dicampurkan dengan 5 Ml 5x sampel buffer lalu diinjeksikan ke dalam sumur yang telah dibuat bersama markernya dan diberi arus 100 V. Setelah selesai, gel dibuka dan diberi pewarnaan dengan silver kit.
Alur metode percobaan ini dapat dilihat dalam Lampiran 1 dan Lampiran 2.
& &!%# %$ " !"# $ #%&"&% & *- %# "#' !"&(#
Seleksi isolat Aktinomisetes penghasil antibakteri dilakukan terhadap bakteri isolat Aktinomisetes koleksi laboratorium Balai Besar Bioteknologi dan Sumber Daya Genetika Pertanian (B.B. Biogen) Sebanyak 90 isolat Aktinomisetes diseleksi uji antibakteri terhadap 4 bakteri uji yaitu :
bakteri ,
&
(EPEC), dan
Isolat < isolat Aktinomisetes ini belum diuji lebih lanjut karena merupakan hasil eksplorasi B.B. Biogen dari berbagai sumber yaitu dari tanaman bawang merah, terung< terungan, jagung, tembakau, pisang, markisa, benalu api, kopi, kubis, jati, kentang, sawah dan pertanian organik. Adapun asal daerahnya berasal dari Lembang, Malang, Cibinong< Bandung, Serang, Banten, Temanggung, Brastagi<Medan, Makassar, Purworwjo, Nganjuk, Kupang, dan Karawang. Kesembilan puluh isolat Aktinomisetes hasil eksplorasi ini belum diidentifikasi lebih lanjut sehingga isolat<isolat ini hanya diberi kode angka untuk memudahkan dalam penggunaanya. Sembilan puluh isolat Aktinomisetes yang diseleksi uji antibakteri dapat dilihat pada Lampiran 3. Bakteri uji yang digunakan sebanyak 4
jenis yaitu ,
&
( ,) dan
Keempat bakteri ini merupakan koleksi B.B. Biogen. Keempat bakteri uji tersebut dipilih karena bersifat patogen terhadap tanaman
( dan
Seleksi isolat Aktinomisetes dilakukan secara kualitatif dengan metode uji antibakteri yaitu dengan menumbuhkan isolat Aktinomisetes dengan bakteri uji secara bersama<sama dalam satu cawan yang mengandung nutrisi dalam bentuk padat atau agar dengan diusahakan kondisi lingkungannya sama dan mendukung pertumbuhan. Hasil seleksi isolat Aktinomisetes ditunjukkan pada Tabel 1.
Tabel 1 menunjukan kesembilan belas isolat yang mampu menghambat pertumbuhan bakteri uji. Hanya satu isolat yang mampu menghambat keempat bakteri uji yaitu isolat A64.3 Sedangkan isolat lain yang menghambat 3 bakteri uji yaitu isolat A62.1, A52.2, A45.2, dan A7.5. Isolat yang menghambat 2 bakteri uji adalah A3.2, A35.2, A46.3, dan A51.3. Isolat yang menghambat 1 bakteri uji yaitu A7.3, A7.4, A14.1, A14.2, A34.2, A39.1, A46.2, A48.4, A52.1, dan A56.2. Isolat A64.3 mampu menghambat keempat bakteri uji dengan diameter zona hambat masing<masing untuk Xanthomonas, Ralstonia, EPEC, dan Listeria yaitu 1.4 cm, 1.3 cm, 2.3 cm, dan 1.4 cm. Isolat A64.3 ini berasal dari daerah Karawang Jawa Barat Pada Tabel 1 sebanyak 5 isolat Aktinomisetes dipilih untuk diuji lebih lanjut. Pemilihan 5 isolat tersebut didasarkan pada kualitas daya antibakteri yang dimilikinya yaitu bersifat membunuh dengan zona yang sangat luas terhadap beberapa bakteri uji. Lima isolat yang dipilih adalah A7.5, A46.3, A51.3, A62.1,dan A64.3. Kelima isolat ini memiliki zona antibakteri yang paling luas dan memiliki intensitas yang paling baik yaitu zona hambatnya terlihat jernih dibandingkan dengan isolat lainnya.
Isolat Aktinomisetes hasil seleksi memiliki kemampuan berbeda dalam menghambat setiap bakteri uji. Kemampuan isolat Aktinomisetes dalam menghambat bakteri uji dapat digolongkan menjadi dua yaitu bersifat bakterisidal dan bakteriostatik. Bakterisidal yaitu bersifat membunuh bakteri dan bakteriostatik yaitu menghambat pertumbuhan bakteri tapi tidak sampai membunuhnya. Kemampuan antibakteri yang baik adalah bersifat bakterisidal dan sensitif karena dengan kedua sifat ini maka bakteri uji atau patogen yang digunakan akan mati dalam zona hambat yang luas meskipun dengan kuantitas antibakteri yang minim.
antibakteri
A= Aktinomisetes, X= , R=
, E= patogenik,
L= , ++= bakteriostatik keruh,
+++= bakteriostatik jernih, ++++= bakterisidal jernih
Gambar 1 menunjukkan isolat A51.3, A7.5, dan 62.1 dengan diameter zona hambat yang jernih dan luas. Adapun dua isolat lainnya yaitu A64.3 dan A46.3. Kedua isolat ini juga memiliki keunggulan dibandingkan isolat lainnya. Isolat A64.3 mampu menghambat semua bakteri uji dengan zona yang jernih dan luas yaitu salah satunya terhadap bakteri uji
(Gambar 2). Gambar 3 menunjukan isolat A46.3 dengan zona hambat yang luas dan jernih meski tidak terhadap semua bakteri uji seperti A64.3.
Gambar 1 Hasil seleksi isolat Aktinomisetes A7.5, A51.3, A62.1 terhadap bakteri uji
Diameter zona hambat pada bakteri uji (cm)
No Kode
isolat
X R E L
Gambar 2 Hasil seleksi isolat Aktinomisetes A64.3 terhadap bakteri uji
Gambar 3 Hasil seleksi isolat Aktinomisetes A46.3 terhadap bakteri uji
.
%# (&%#)#" %# $ #/ / 5 " 6 7
Kelima isolat terpilih kemudian ditumbuhkan pada media produksi
dan diambil filtratnya. Filtratnya sebagian diuji antibakteri dan sebagian lagi dipresipitasi dengan amonium sulfat. Hasil uji antibakteri pada supernatan tidak menunjukkan aktivitas zona hambat untuk semua isolat kecuali isolat A46.3. Isolat A46.3 memperlihatkan zona hambat pada setiap bakteri uji dengan sifat bakteriostatik yaitu sebesar 0.9 cm terhadap Ralstonia, 1.3 cm terhadap Xanthomonas, 0.9 cm terhadap EPEC, dan 0.8 cm terhadap Listeria (Lampiran 4). Sedangkan hasil uji antibakteri pada presipitasi ammonium sulfat menunjukkan aktivitas antibakteri yang baik. Hal ini mungkin disebabkan karena senyawa aktif tersebut adalah suatu protein, sehingga ketika belum diendapkan maka aktivitas antibakterinya tidak begitu terlihat.
Filtrat dipresipitasi dengan amonium sulfat 80% dalam kondisi dingin. Amonium sulfat 80% merupakan garam berkonsentrasi tinggi yang dapat mengendapkan protein aktif yang diharapkan. Hasil presipitasi amonium sulfat disentrifus lalu endapannya didialisis dengan buffer PBS ( " %% ) agar garam amonium sulfat tidak lagi berada dalam
(Lehninger 1982).
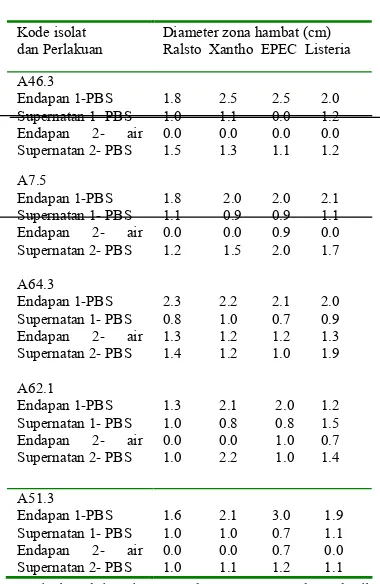
Membersihkan garam berkonsentrasi tinggi dari protein aktif sangat penting agar hasil dari uji antibakteri tidak menjadi bia s sebab garam berkonsentrasi tinggi pun dapat mematikan bakteri. Bakteri dapat mati karena dinding atau membran sel bakteri sebagian besar tersusun atas protein sehingga protein penyusun dinding selnya akan mengendap oleh garam berkonsentrasi tinggi dan sel akan pecah. Prinsip pengendapan protein oleh garam dimaksudkan untuk menurunkan kelarutan protein dengan mengkondisikan protein tersebut berada pada titik isolistriknya (Poedjiadi A 1994). Setelah didialisis kemudian disentrifus kembali dengan kecepatan 12000 rpm selama 15 menit, 4oC. Supernatan dan endapan yang didapat masing< masing dilarutkan dalam PBS, menghasilkan endapan 1<PBS dan supernatan 1<PBS. Endapan 1<PBS dilarutkan dalam PBS, disentrifus kembali sehingga menghasilkan supernatan 2<PBS dan endapan yang dilarutkan dalam air sehingga menghasilkan endapan 2<air. Endapan 1<PBS, supernatan 1< PBS, supernatan 2<PBS, dan endapan 2<air diuji aktivitas antibakteri.
sulfat 80% setelah dialisis tanpa perlakuan
A= isolat Aktinomisetes,Endapan 1<PBS= endapan hasil presipitasi yang dilarutkan dalam sedikit larutan PBS,
Supernatan 1<PBS= supernatan hasil presipitasi dalam larutan PBS, hasil sentrifus ke<1, Endapan 2<air= endapan hasil presipitasi yang dilarutkan dalam air, hasil sentrifus ke<2, Supernatan 2<PBS= supernatan hasil presipitasi dalam larutan PBS, hasil sentrifus ke<2, PBS= " %%
Supernatan 2<PBS menunjukkan zona hambat yang jernih (Gambar 4) dibandingkan endapan 1<PBS (Gambar 5) dan endapan 2<air (Gambar 6). Untuk hasil uji antibakteri supernatan 2<PBS terhadap bakteri uji lainnya dapat dilihat pada Lampiran 5. Pada Gambar 4 hampir semua senyawa aktif dari kelima isolat menunjukkan aktivitas bakterisidal dengan luas yang berberda<beda dan paling luas ditunjukkan isolat A46.3 yaitu 1.5 cm. Gambar 5 memperlihatkan zona hambat hasil presipitasi endapan 1<PBS dari setiap isolat. Semua isolat kecuali isolat A46.3 memberikan zona hambat yang bersifat bakteriostatik yaitu hanya menghambat pertumbuhan bakteri uji sehingga zona hambat yang terlihat tidak jernih. Hanya satu zona hambat yang jernih yaitu A46.3 dengan diameter 1.8 cm.
Pada endapan 2<air yang ditunjukkan dalam Gambar 6 memerlihatkan zona hambat
karena sebaran bakteri ujinya tipis juga. Sedangkan pada isolat lainnya tidak menghasilkan aktivitas antibakteri sebaik isolat A64.3. Bahkan pada isolat A46.3 zona hambat pada semua bakteri uji adalah 0 cm.
Gambar 4 Zona hambat supernatan 2<PBS kelima isolat Aktinomisetes terpilih terhadap
8
9 1 :9 ;
81 ;
9: ;
Gambar 5 Zona hambat endapan 1<PBS kelima isolat Aktinomisetes terpilih terhadap 9: ; 9 1 !$ "($ 81 ; 8 :9 ;
Gambar 6 Zona hambat endapan 2<air kelima isolat Aktinomisetes terpilih terhadap
Kode isolat dan Perlakuan
Diameter zona hambat (cm) Ralsto Xantho EPEC Listeria
A46.3 Endapan 1<PBS Supernatan 1< PBS Endapan 2< air Supernatan 2< PBS
1.8 2.5 2.5 2.0
1.0 1.1 0.0 1.2
0.0 0.0 0.0 0.0
1.5 1.3 1.1 1.2
A7.5 Endapan 1<PBS Supernatan 1< PBS Endapan 2< air Supernatan 2< PBS
A64.3 Endapan 1<PBS Supernatan 1< PBS Endapan 2< air Supernatan 2< PBS
1.8 2.0 2.0 2.1
1.1 0.9 0.9 1.1
0.0 0.0 0.9 0.0
1.2 1.5 2.0 1.7
2.3 2.2 2.1 2.0
0.8 1.0 0.7 0.9
1.3 1.2 1.2 1.3
1.4 1.2 1.0 1.9
A62.1 Endapan 1<PBS Supernatan 1< PBS Endapan 2< air Supernatan 2< PBS
1.3 2.1 2.0 1.2
1.0 0.8 0.8 1.5
0.0 0.0 1.0 0.7
1.0 2.2 1.0 1.4
A51.3 Endapan 1<PBS Supernatan 1< PBS Endapan 2< air Supernatan 2< PBS
1.6 2.1 3.0 1.9
1.0 1.0 0.7 1.1
0.0 0.0 0.7 0.0
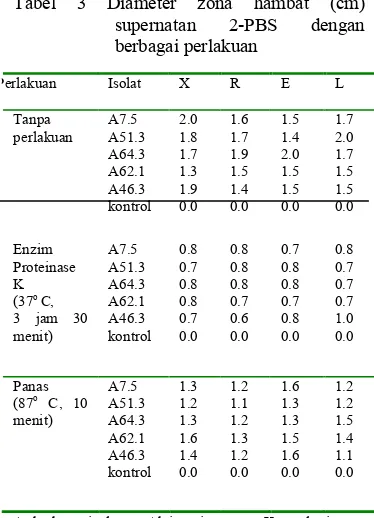
perlakuan yaitu perlakuan panas 87oC, enzim proteinase K dan tanpa perlakuan apa<apa sebagai pembanding dari kedua perlakuan tersebut. Hasil dari ketiga perlakuan pada sampel supernatan 2<PBS tersebut ditampilkan pada Tabel 3.
Tabel 3 memperlihatkan perbedaan luas zona hambat pada tiap perlakuan. Pada perlakuan enzim, hampir semua isolat menunjukkan penurunan aktivitas antibakteri yaitu dengan menunjukkan zona hambat yang lebih kecil dibandingkan zona hambat tanpa perlakuan. Hal ini memperlihatkan bahwa senyawa antibakteri yang disekresikan oleh isolat aktinomisetes tersebut adalah suatu protein antibakteri, karena terbukti bahwa protein tersebut rusak oleh enzim proteinase K (Gambar 7). Sedangkan pada perlakuan panas 87o C selama 10 menit, aktivitas antibakterinya masih cukup baik yaitu dilihat dari luas zona hambatnya yang tidak terlalu berkurang (Gambar 8) dibandingkan dengan zona hambat tanpa perlakuan (Gambar 9). Tabel 3 Diameter zona hambat (cm)
supernatan 2<PBS dengan berbagai perlakuan
A=kode isolat Aktinomisetes, Kontrol=air ,
X= , R=
E=Enteropatogenik , L=
dan 1.7 cm serta pada perlakuan enzim yaitu 0.8 cm, 0.8 cm, 0.8 cm, dan 0.7 cm. Untuk isolat lainnya dapat dilihat pada Tabel 3.
Kontrol
Gambar 7 Zona hambat hasil presipitasi amonium sulfat< enzim proteinase K pada
kontrol
Gambar 8 Zona hambat hasil presipitasi amonium silfat<perlakuan panas 87o C selama 10 menit pada
.
Gambar 9 Zona hambat hasil presipitasi amonium sulfat tanpa perlakuan pada
Perlakuan Isolat X R E L
Tanpa perlakuan A7.5 A51.3 A64.3 A62.1 A46.3 kontrol 2.0 1.8 1.7 1.3 1.9 0.0 1.6 1.7 1.9 1.5 1.4 0.0 1.5 1.4 2.0 1.5 1.5 0.0 1.7 2.0 1.7 1.5 1.5 0.0 Enzim Proteinase K (37o C,
3 jam 30
[image:30.612.322.502.178.675.2] [image:30.612.126.313.408.667.2]menurut Tagg 1976; Klaenhamer 1988 diacu dalam Prasad 2005 bahwa telah ditemukan protein yang bersifat bakterisidal dan diproduksi oleh bakteri yang dinamakan bakteriosin. Bakteriosin yang dihasilkan bersifat aktif pada suhu 50<100 oC pH 3<8 dan menurun aktivitasnya dengan enzim proteolitik salah satunya protease (Suarsana 2003) dan menurut Zaria (1993) yang diacu dalam Suarsana (2003) bakteriosin yang dihasilkan staphylococci koagulase negatif bersifat stabil pada pemanasan 40<100 oC, inaktif dengan enzim proteolitik dan memiliki bobot molekul 856<1400Da, serta Bacillocin 490 dari Bacillus dilaporkan memiliki ukuran 2 kDa (Martirani . 2002). Sifat kelima isolat Aktinomisetes pada Tabel 3 yang stabil pada suhu 87o C dan menurun aktivitasnya oleh enzim proteinase K sama dengan sifat bakteriosin tersebut. Berdasarkan kesamaan sifat protein aktif kelima isolat Aktinomisetes ini maka dapat diduga bahwa protein aktif ini adalah bakteriosin.
%# & & "/ $'$" $ &!/ #" ($"&#
Karakterisasi lebih lanjut dilakukan dengan
(PAGE). Elektroforesis PAGE merupakan elektroforesis dalam keadaan sampel tidak terdenaturasi. Visualisasi pita protein dilakukan dengan pewarnaan silver kit. Teknik pewarnaan ini dipilih karena konsentrasi protein dalam sampel sangat rendah. Dengan menggunakan pewarnaan silver kit yang memiliki sensitivitas tinggi yaitu sampai 2 ng protein dalam satu pita (Bollag . 1996) diharapkan pita protein dapat terlihat. Elektroforesis dilakukan dengan arus sebesar 100 Volt selama 1 jam.
Sampel yang dielektroforesis adalah supernatan 2<PBS karena sampel tersebut memberikan aktivitas uji antibakteri yang paling baik. Semua sampel protein aktif dari kelima isolat Aktinomisetes dielektroforesis pada gel poliakrilamid 7.5% dan ketebalan 0.75mm. Semua sampel hasil presipitasi dari kelima isolat Aktinomisetes memperlihatkan pita protein yang berbeda ketebalannya dan semuanya memiliki pita protein lebih dari satu pita.
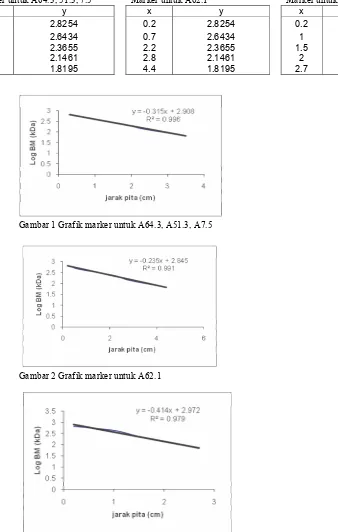
Profil elektroforesis senyawa protein dari isolat A51.3, A64.3, A7.5 dapat dilihat dalam Gambar 10. Isolat A51.3 pada Gambar 10
menghasilkan 3 pita protein. Masing< masing pita memiliki Bobot Molekul (BM) yang berbeda. Untuk mengetahui besarnya BM tiap pita maka dibandingkan dengan pita penanda atau Marker (M). Marker yang digunakan merupakan campuran dari protein bakteri yang telah diketahui BMnya yaitu 669 kDa, 440 kDa, 232 kDa, 140 kDa dan 66 kDa.
Perhitungan BM protein isolat A51.3, 7.5, dan 64.3 dilakukan dengan grafik regresi linier berdasarkan jarak markernya (Gambar1 dalam Lampiran 6). Besarnya BM hasil perhitungan untuk pita protein isolat A51.3 yaitu 605.48 kDa dan 79.45 kDa. Isolat A64.3 memiliki pita protein dengan BM 272.6 kDa, 189.7 kDa, dan 85.43 kDa. Isolat A7.5 dengan 3 pita protein yaitu 563.12 kDa, 235.8 kDa dan 63.91 kDa. Profil elektroforesis untuk dua isolat lainnya yaitu A62.1 dan A46.3 masing< masing ditunjukkan dalam Gambar 11 dan Gambar 12. Hasil elektroforesis untuk isolat A62.1 memperlihatkan 3 pita protein (Gambar 11) dan isolat A46.3 juga menunjukkan 3 pita protein (Gambar 12).
Perhitungan bobot molekul (BM) dari masing<masing pita protein dari isolat A62.1 dihitung dengan persamaan linier dari markernya (Gambar 2 dalam Lampiran 5). Pita<pita protein isolat A62.1 memiliki BM 478.9 kDa, 180.45 kDa, dan 57.78 kDa. Sedangkan pita<pita protein dari isolat A46.3 dihitung dengan persamaan linier dari markernya (Gambar 3 dalam Lampiran 5) yaitu ada 3 pita dengan BM 641.44 kDa, 299.14 kDa, dan 126.82 kDa. Bobot Molekul semua pita protein dari setiap isolat Aktinomisetes dapat dilihat dalam Tabel 4.
Pita<pita protein yang dihasilkan oleh kelima isolat Aktinomisetes A7.5, A51.3, A64.3, A46.3, dan A62.1 pada
140 66
A51.3 A64.3 M A 7.5
BM(kDa) 669 440 232 140 66 M A62.1 BM (kDa) 669 440 232 140 66 M A46.3
Gambar 10 Hasil elektroforesis PAGE pada isolat A51.3, A7.5 dan A64.3.
Gambar 11 Hasil elektroforesis PAGE pada isolat A62.1.
Gambar 12 Hasil elektroforesis PAGE pada isolat A46.3.
Hasil elektroforesis senyawa protein aktif dari kelima isolat dalam Tabel 4 menunjukkan bobot molekul (BM) yang semuanya berkisar diatas 30 kDa sehingga protein aktif tersebut adalah bakteriosin yang masuk pada bakteriosin Kelas III. Bakteriosin digolongkan dalam 3 kelas yaitu Kelas I yang berbobot molekul <5kDa, Kelas II berbobot molekul < 10 kDa, dan Kelas III yang berbobot molekul >30 kDa. Bakteriosin Kelas III belum dapat terkarakterisasi dengan baik karena ukurannya yang sangat besar. (Klaenhamer 1993 & Nes 1996, diacu dalam Hoover & Chen 2003). Karakteristik protein aktif atau bakteriosin yang didapatkan dari isolat A51.3, A46.3, A64.3, A62.1, dan A7.5 memiliki sifat tahan panas atau stabil pada suhu 87oC, menurun aktivitasnya oleh enzim proteinase K, dan memiliki bobot molekul lebih dari 30 kDa.
Bakteriosin merupakan metabolit sekunder karena bagi sel yang memproduksinya bakteriosin adalah senyawa protein yang berguna untuk mempertahankan diri dari serangan bakteri lain dan sangat penting bagi adaptasi sel terhadap lingkungan. Selain berfungsi sebagai pertahanan diri, bakteriosin juga dapat membahayakan sel yang memproduksinya karena dapat melisis protein sehingga sel menjadi mati. Untuk melindungi diri dari bakteriosin maka sel memproduksi suatu protein imunitas yaitu bersifat kationik yang terdiri dari 51< 254 asam amino. Protein imunitas ini akan melindungi membran sel
[image:32.612.151.305.81.259.2] [image:32.612.334.512.113.323.2] [image:32.612.157.308.297.463.2] [image:32.612.154.307.507.675.2]& Holo 2000, diacu dalam Hoover & Chen 2003).
Mekanisme kerja dari bakteriosin secara umum yaitu melalui pembentukan pori dalam membran sel target. Sel target adalah sel organisme yang sensitif terhadap bakteriosin. Pembentukan pori diawali dengan penempelan (inisiasi) bakteriosin pada reseptornya. Lipid anionik dalam membran sitoplasma adalah reseptor utama bagi bakteriosin. Kemudian bakteriosin diadsorpsi ke dalam selubung sel bakteri target. Pori yang terbentuk akan mengganggu
! % sehingga muatan di dalam dan di luar membran menjadi seimbang. Akibatnya senyawa<senyawa yang dibutuhkan sel target dari luar sel tidak bisa masuk dan akhirnya sel target pun bisa mati. Selain itu beberapa jenis bakteriosin juga mengganggu sintesis DNA, sintesis RNA dan protein dari sel target dengan cara membloknya (Hoover & Chen 2003).
# )/
Hasil seleksi uji aktivitas antibakteri dari 90 isolat Aktinomisetes terhadap 4 bakteri uji
,
&
(EPEC), dan
menghasilkan 19 isolat Aktinomisetes yang mampu menghambat keempat bakteri tersebut. Dari 19 isolat ini terpilih 5 isolat yang paling luas zona hambatnya dan paling baik kemampuan bakterisidalnya yaitu A7.5, A62.1, A64.3, A46.3 dan A51.3. Karakterisasi senyawa antibakteri menunjukkan bahwa senyawa aktif dari kelima isolat Aktinomisetes A7.5, A62.1, A64.3, A46.3 dan A51.3 adalah suatu protein aktif seperti bakteriosin karena kesamaan sifat yang dimiliki keduanya. Sifat protein aktif atau bakteriosin dari kelima isolat Aktinomisetes terpilih ini yaitu stabil pada suhu 87oC selama 10 menit dan menurun aktivitasnya dengan enzim proteinase K. Pita protein yang dihasilkan berjumlah lebih dari satu pita dan berbobot molekul lebih dari 30 kDa. Bobot molekul terkecil terdapat pada isolat A62.1 sebesar 57.78 kDa dan bobot molekul terbesar dihasilkan oleh isolat A64.3 sebesar 641.4 kDa.
Senyawa antibakteri hasil presipitasi amonium sulfat 80% dari isolat Aktinomisetes sebaiknya dimurnikan dan dipisahkan masing< masing fraksi proteinnya. Kemudian setiap fraksi protein diuji antibakteri. Fraksi protein yang menunjukkan kemampuan aktivitas antibakteri terhadap bakteri uji selanjutnya dielektroforesis sehingga bobot molekulnya dapat diketahui.
Atlas RM. 1997. %
Second Edition. Iowa : WNC Brown. Bollag DM, Rozycji MD, Edelste SJ. 1996.
. New York: Willey<Liss.
Dindal DL. 1990. " .
Kanada: John Willey Sons. Harris ELV, Angal S.1989.
% . New York: Oxford
University Press.
Hasim. 2004. Menanam rumput, memanen antibiotik.http://bidiversitylipi.org/modul es.php?name=content&pa=showpage&pi d=32.
Hifni HR. 1986. Kelompok bakteri
!
berdasar varietasnya pada varietas padi. 6 (2):74<76.
Hoover DG, Chen H. 2003. Bacteriocin and their food applications. , !
! # - - % .
Vol 2
Indriasari V. 1998. Eksplorasi Aktinomisetes dari sedimen ekosistem air hitam serta uji daya hambatnya terhadap
dan KCAM
11823.http://www.icbb.org/indonesia/pen elitian/penelitian 05.htm.
Juniastuti 2003. Perbedaan pola hemaglutinasi diargenik (EPEC dan
ETEC) dengan flora
" Inggris: Worth Publisher. Martirani L, Mario V, Gino N, Maurilio D.
2002. Purification and partial characterization of Bacilocin 490, a novel bacteriocin produced by a thermophilic strain of" %
, - I; 1. Italy: Biomed Central. Miyadoh S, Otoguro M. 2004. . &
/ , % %
Bogor: Biotechnology Centre LIPI.
Pelczar MJ, Chan ECS.1986. 0 1 0
& . Hadioetomo RS,
penerjemah. Jakarta: UI Press.
Terjemahan dari: %
.
Prasad . 2005. A novel bacteriocin<like substance (BLIS) from a pathogenic
strain of ! .
Vol 151 part 9 pages 2815<3145. USA:Society for General Microbiology Pub.
Poedjiadi A. 1994. 0 1 0 " & . Jakarta: UI Press.
Rahmi. 2002. Faktor penyebab stillbirth.
2 / &
http://cyberwomen.cbn.net.id/detil.asp?ka tegori=mother&newsno=314.
Schlegel HG. 1976. & 3
4 (/ )
Yogyakarta: Gajah mada University Press.
Suarsana I, Iwan H, Suartini N. 2001. Aktivitas invitro senyawa antimikroba
dari 5! Vol.2 (1)
2001.
Suarsana I. 2003. Sifat kimiawi bakteriosin yang dihasilkan oleh bakteri . 5! Vol 4(4) 2003.
Sudir T, Wahyuni, Suparyono. 1998. Pengendalian hayati penyakit hawar
pelepah padi Khun
dengan bakteri antagonis.2 &
6 Bogor:
Balitpa.
Suwandi U. 1993. Skrining mikroorganisme penghasil antibiotik. , 0
4 & No.89199346.
http://www.kalbefarma.com.files/cdk/file s/19perkembanganantibiotik083.html. Suwandi U. 2000. Perkembangan antibiotik.
, 0 4 & No.127,
200043.http://www.kalbefarma.com.files/ cdk/files/19perkembanganantibiotik083.h tml.
Yadi S, Suhendar MA, Mahmud M. 2000. Pendektesian bakteri
menggunakan teknik polimerase berantai dan pemberdayaan strain menggunakan hibridisasi DNA.
" " Vol 5 No 1 April 2000.
sentrifus 15000 rpm, 30 menit, 4
OC
sentrifus 12000 rpm 15 menit, 4
OC
sentrifus 12000 rpm 15 menit, 4
OC
supernatan 2<PBS
tanpa
perlakuan
perlakuan
panas 87
oC
perlakuan enzim
proteinase K
50 Ml sampel +10 Ml
enzim proteinase K
dan diinkubasi pada
suhu 37
oC,4 jamuji antibakteri
(PAGE)
penentuan bobot
molekul pita protein
seleksi isolat dengan uji antibakteri
produksi antibakteri dalam media cair
supernatan
presipitasi dengan
amonium sulfat 80%
Uji antibakteri
Sentrifus 12000 rpm, 4
oC, 10 menit
Sentrifus 12000 rpm, 4
oC, 10 menit
Sentrifus 12000 rpm
10 menit, 4
oC
dilarutkan
dalam air
Supernatan
Presipitasi oleh amonium
sulfat 80%
Pellet
Dialisis dengan buffer PBS
Supernatan 1<PBS
Endapan 1<PBS
Dilarutkan dalam PBS
Supernatan 2<PBS
Endapan
3 A3.2 1 1 Lembang, Kresmen putih
4 A3.4 Lembang, Kresmen putih kemerahan
5 A3.5 Lembang, Kresmen merah muda kecoklatan
6 A3.6 Lembang, Kresmen merah muda kecoklatan
7 A3.8 Lembang, Kresmen abu<abu
8 A7.1 Lembang, terung<terungan putih tulang
9 A7.2 Lembang, terung<terungan hitam
10 A7.3 1.6 Lembang, terung<terungan coklat
11 A7.4 0.8 Lembang, terung<terungan kuning
12 A7.5 1.4 1.7 1.8 Lembang, terung<terungan putih
13 A7.7 Lembang, terung<terungan putih
14 A9.2 Lembang, terung<terungan coklat muda
15 A13.1 Lembang (Benalu api) putih
16 A14.1 1.9 Lembang (Benalu api) kuning kecoklatan
17 A14.2 1.3 Lembang (Benalu api) putih jadi hitam
18 A15.2 Lembang (Benalu api) putih
19 A15.4 Lembang (Benalu api) krem keunguan
20 A19.1 Baji,Batu Malang (jagung) abu kecoklatan
21 A22.1 Desa Drawati, Malang putih keabuan
22 A24.1 Desa Drawati, Malang krem
23 A25.1 Cibinong, Ds. Sukamantri,Bandung putih keabuan
24 A26.1 Cibinong, Ds. Sukamantri,Bandung putih keabuan
25 A26.2 Cibinong, Ds. Sukamantri,Bandung abu kecoklatan
27 A31.2 Gn. Sugih Anyer, Banten putih kekuningan
28 A31.3 Gn. Sugih Anyer, Banten putih kekuningan
29 A34.1 Ds. Koper Tegal Kedung Bulak, Kec Cikande Serang abu kehitaman
30 A34.2 1 Ds. Koper Tegal Kedung Bulak, Kec Cikande Serang putih agak merah muda
31 A34.3 Ds. Koper Tegal Kedung Bulak, Kec Cikande Serang kuning
34 A35.6 Ds. Kalodran kec.Walantaka Serang Banten putih kekuningan
35 A37.1 Ds. Wates Telu Kec. P.Merak, temanggung putih
36 A37.2 Ds. Wates Telu Kec. P.Merak, temanggung abu<abu
37 A39.1 1.2 Ds. Jetis Kel.Dangkel Kec. Parakan Temanggung (tembakau) krem
38 A39.2 Ds. Jetis Kel.Dangkel Kec. Parakan Temanggung (tembakau) putih keunguan
39 A40.2 Ds. Jetis Kel.Dangkel Kec. Parakan Temanggung (tembakau) kuning kecoklatan
40 A43.1 Ds. Menayu, Kel. Bulu kec. Bulu, Temanggung (tembakau kemlaka) coklat muda
41 A43.2 Ds. Menayu, Kel. Bulu kec. Bulu, Temanggung (tembakau kemlaka) krem
42 A43.3 Ds. Menayu, Kel. Bulu kec. Bulu, Temanggung (tembakau kemlaka) putih
43 A44.1 Ds. Menayu, Kel. Bulu kec. Bulu, Temanggung (tembakau kemlaka) putih tulang
44 A45.2 0.8 1 1 Brastagi Medan (markisa) krem
45 A45.3 Brastagi Medan (markisa) abu<abu
46 A46.1 Brastagi Medan (pisang) krem kebiruan
47 A46.2 1.4 Brastagi Medan (pisang) abu kehitaman
48 A46.3 1.4 1.6 Brastagi Medan (pisang) abu<abu
49 A47.1 Brastagi Medan (kubis) putih kecoklatan
50 A47.2 Brastagi Medan (kubis) krem kehitaman
51 A47.3 Brastagi Medan (kubis) putih kecoklatan
52 A48.1 Brastagi Medan (kopi) krem
53 A48.2 Brastagi Medan (kopi) putih kecoklatan
54 A48.4 1.3 Brastagi Medan (kopi) coklat kehitaman
55 A49.1 Brastagi Medan (kentang) putih keabuan
56 A49.2 Brastagi Medan (kentang) abu<abu
57 A50.1 Brastagi Medan (pertanian organik) putih abu
58 A51.1 Sudangm Makasar (jati) putih
59 A51.3 2 1.3 Sudangm Makasar (jati) putih licin
60 A52.1 0.8 Kp. Balitser, Maros Makasar (ekosistem jali<jali) merah bata
65 A56.2 1.1 Balittas Malang merah bata
66 A57.2 Purworejo (sawah) abu kehitaman
67 A57.3 Purworejo (sawah) putih
68 A58.1 Nganjuk (bawang merah) puth keabuan
69 A58.2 Nganjuk (bawang merah) putih keabuan
70 A58.3 Nganjuk (bawang merah) kuning
71 A58.4 Nganjuk (bawang merah) abu<abu
72 A58.5 Nganjuk (bawang merah) abu<abu
73 A58.6 Nganjuk (bawang merah) abu<abu
74 A59.1 Kel. Namosan, Kec. Alak Kodya Kupang NTT putih
75 A60.1 Kel. Pasir Panjang, Kec. Kelapa Lima kodya Kupang NTT putih kekuningan
76 A60.2 Kel. Pasir Panjang, Kec. Kelapa Lima kodya Kupang NTT putih kecoklatan
77 A61.1 Kel. Kelapa Lima Kodya Kupang NTT abu<abu
78 A61.2 Kel. Kelapa Lima Kodya Kupang NTT kuning
79 A61.3 Kel. Kelapa Lima Kodya Kupang NTT merah bata
80 A62.1 1.3 1.4 1.5 Ds. Balok Kec. Kupang barat NTT putih licin kekuningan
81 A62.3 Ds. Balok Kec. Kupang barat NTT abu<abu
82 A63.1 Kel. Alak Kec. Alak kodya Kupang NTT abu<abu
83 A63.2 Kel. Alak Kec. Alak kodya Kupang NTT kuning
84 A63.3 Kel. Alak Kec. Alak kodya Kupang NTT kuning
85 A64.1 Karawang putih kecoklatan
86 A64.2 Karawang putih merah muda
87 A64.3 1.4 1.3 2.3 1.4 Karawang abu kehitaman
88 A65.1 Karawang putih keabuan
89 A65.2 Karawang kuning lemah
Terhadap Enteropatogenik
(
EPEC).
Terhadap
Terhadap
Lampiran 5 Gambar hasil uji antibakteri setelah presipitasi amonium solfat 80%
dari kelima isolat Aktinomisetes terpilih
Supernatan 2<PBS
terhadapEnteropatogenik
(
EPEC)
Supernatan 2<PBS pada
Supernatan 2<PBS terhadap
Supernatan 2<PBS tanpa perlakuan
pada EPEC.
Supernatan 2<PBS tanpa perlakuan
pada
Supernatan 2<PBS dengan perlakuan
panas 87
oC,10 menit pada
Supernatan 2<PBS dengan perlakuan
panas 87
oC, 10 menit pada EPEC.
Marker untuk A64.3, 51.3, 7.5 Marker untuk A62.1 Marker untuk A46.3
Gambar 1 Grafik marker untuk A64.3, A51.3, A7.5
Gambar 2 Grafik marker untuk A62.1
[image:43.612.155.493.121.653.2] [image:43.612.174.388.364.653.2] [image:43.612.177.374.367.486.2]