STUDI ADSORPSI KITOSAN MAGNETIK NANOPARTIKEL TERHADAP LOGAM KROM (Cr) DENGAN
SPEKTROSKOPI SERAPAN ATOM
TESIS
Oleh :
MELANY NUR INTAN RAJAGUKGUK 087006004/KM
PROGRAM MAGISTER ILMU KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
LEMBAR PERSETUJUAN
Judul Tesis :
Studi Adsorpsi Kitosan Magnetik Nanopartikel
Terhadap Logam Krom (Cr) dengan Spektroskopi
Serapan Atom
Nama
: Melany Nur Intan Rajagukguk
NIM :
087006004
Program Studi
: Ilmu kimia
Menyetujui Komisi Pembimbing
(Prof.Dr.Harry Agusnar, M.Sc.,M.Phil) Prof.Dr. Harlem Marpaung
Ketua Anggota
Ketua Program Studi
(Prof.Basuki Wirjosentono, MS,Ph.D) (Prof.Dr.Eddy Marlianto.M.Sc) NIP. 195204181980021001 NIP. 195503171986011001
STUDI ADSORPSI KITOSAN MAGNETIK NANOPARTIKEL TERHADAP LOGAM KROM (Cr) DENGAN
SPEKTROSKOPI SERAPAN ATOM
TESIS
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Magister Sains dalam Program Studi Ilmu Kimia pada Fakultas Matematika Dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Oleh
MELANY NUR INTAN RAJAGUKGUK 087006004 / KIM
PROGRAM MAGISTER ILMU KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Telah diuji pada Tanggal : 17 Mei 2010
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Harry Agusnar, MSc, M.Phil Anggota : 1. Prof. Dr. Harlem Marpaung
2. Prof. Basuki Wirjosentono, MS, Ph.D. 3. Prof. Dr. Zul Alfian, MSc
PERNYATAAN
STUDI ADSORPSI KITOSAN MAGNETIK NANOPARTIKEL TERHADAP LOGAM KROM (Cr) DENGAN
SPEKTROSKOPI SERAPAN ATOM
TESIS
Dengan ini saya menyatakan bahwa dalam tesis ini tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kemagisteran di suatu perguruan tinggi dan sepanjang pengetahuan saya tidak terdapat karya serta pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Medan, Juni 2010 Penulis
STUDI ADSORPSI KITOSAN MAGNETIK NANOPARTIKEL TERHADAP LOGAM KROM (Cr) DENGAN
SPEKTROSKOPI SERAPAN ATOM
ABSTRAK
Telah dilakukan penelitian tentang penggunaan kitosan magnetik nanopartikel sebagai bahan adsorben untuk menurunkan konsentrasi ion Cr3+ dengan melihat penyerapan optimum pada variasi pH, waktu kontak dan konsentrasi.
Penelitian didahului dengan pembuatan nanomagnetik Fe3O4 dengan mencampurkan
Fe2+ dan Fe3+ dengan perbandingan 1:2 pada suhu 800C dalam suasana basa. Penelitian kemudian dilanjutkan dengan pembuatan nanomagnetik kitosan dengan mencampurkan kitosan dan nanomagnetik dengan perbandingan 1:1 pada temperatur kamar, diikuti dengan penambahan paraffin dan CMC sebagai pengemulsi dan glutaraldehid untuk memberikan ikatan silang pada kitosan. Untuk mengetahui keberhasilan reaksi yang terjadi setiap sampel diuji dengan SEM dan FTIR. Adsorpsi Ion Cr3+ dilakukan dengan menambahkan adsorben ke dalam larutan ion Cr3+, kemudian diaduk dan disaring. Setelah itu masing-masing filtrat dapat dianalisis secara kuantitatif dengan menggunakan spektroskopi serapan atom.
Hasil penelitian yang diperoleh dari data SEM dan FTIR menunjukkan pembuatan nanomagnetik dan kitosan magnetik nanopartikel telah berhasil dilakukan. Nanomagnetik kitosan mampu menurunkan kadar Cr3+ sebesar 98.44% pada pH 5 dengan waktu kontak 30 menit. Selain itu, nanomagnetik Fe3O4 mampu melindungi
kitosan dari pengaruh pH asam, terbukti dari penyerapan nanomagnetik kitosan > 90% pada rentang pH asam.
STUDY ADSORPTION OF CHITOSAN MAGNETIC NANOPARTICLES IN CHROME BY ATOMIC ABSORPTION SPECTROSCOPY
ABSTRACT
The using chitosan magnetic nanoparticle as adsorbent to decrease chrome(III) ion level with varation of pH, contact time and concentration had been studied.
The fisrt step in this study was making nanomagnetic Fe3O4 with blending Fe2+ and
Fe3+ with comparison 1 : 2 at 800C in base condition. The second was making chitosan magnetic nanoparticle with comparison 1:1 at room temperature, then adding paraffin and CMC as the emulsion and Glutaraldehyde for making crosslinking in chitosan. For knowing the successful of reaction, each samples were analyzed by SEM and FTIR spectroscopy. Adsorption of chrome(III) has been done by adding adsorbent to the chrome(III) ion solution, then mixing and filtering the solution. The concentration of chrome(III) ion was measured by atomic absorption spectroscopy. The result of this research showed that the preparation of chitosan magnetic nanoparticle was success. Nanomagnetic chitosan decreasing chrome(III) ion level for 98.44% at pH 5 for 30 minutes. Beside it, nanomagnetic can protection chitosan at acid condition because all of the adsorption from nanomagnetic chitosan more than 90% at acid condition.
KATA PENGANTAR
Puji syukur kepada Tuhan Yang Maha Kuasa atas segala berkat dan rahmat-nya sehingga penulis dapat menyelesaikan penulisan tesis yang berjudul “Studi Adsorpsi Nanomagnetik Kitosan Nanopartikel terhadap Logam Krom (Cr) dengan Spektroskopi Serapan Atom”.
Pada kesempatan ini, penulis mengucapkan terima kasih yang sebesar-besarnya kepada Rektor Universitas Sumatera Utara, Prof. Dr. dr. Syahril Pasaribu, DTM & H. MSc (CTM). Sp.A(K) atas kesempatan dan fasilitas yang diberikan kepada saya untuk menyelesaikan pendidikan Program Magister.
Direktur Sekolah Pascasarjana Universitas Sumatera Utara, Prof. Dr. Ir. Chairunnisa B., MSc, dan Ketua Program Studi Kimia Prof. Basuki Wirjosentono, MS, Ph.D atas kesempatan yang diberikan kepada saya sebagai mahasiswa Program Magister pada sekolah pascasarjana Universitas Sumatera Utara.
Terimakasih yang tak terhingga serta penghargaan yang setinggi-tingginya kepada : Prof. Dr. Harry Agusnar, MSc., M.Phil selaku Pembimbing Utama dan Prof. Dr. Harlem Marpaung selaku anggota Komisi Pembimbing yang setiap saat penuh perhatian memberikan bimbingan, motivasi, dan saran sehingga tesis ini dapat diselesaikan.
Serta tidak lupa penulis ucapkan terima kasih yang sebesar-besarnya kepada : 1. Prof. Basuki Wirjosentono, MS, Ph.D., Prof. Dr. Zul Alfian, M.Sc., Dr.
Hamonangan Nainggolan selaku penguji yang telah banyak memberikan saran dan masukan untuk menyelesaikan tesis ini, untuk itu penulis ucapkan terima kasih.
3. Bapak Prof. Dr. Harlem Marpaung selaku kepala Laboratorium Kimia Analitik yang telah membantu dan memberikan kemudahan penulis melakukan penelitian hingga selesainya tesis ini. Kepada Bapak saya ucapkan terimakasih.
4. Bapak/Ibu Dosen Pascasarjana Ilmu Kimia yang telah mengajarkan dan memberikan bekal ilmu pengetahuan kepada penulis. Kepada Bapak/Ibu saya ucapkan terimakasih.
5. Orangtua yang sangat saya sayangi, Drs. M.H. Rajagukguk dan H. Simamora Purba serta buat adikku tercinta Maruli Y.A. Rajagukguk, Devi, Doddy, Hilton, Andy, Yohanna dan lainnya yang telah banyak memberikan kasih sayang, perhatian, motivasi, bantuan baik secara materil maupun doa dalam penyelesaian penelitian dan tesis ini.
6. Buat semua keluarga besarku dimanapun berada yang selalu memberikan perhatian, motivasi dan bantuan baik secara materil maupun doa dalam penyelesaian penelitian dan tesis ini.
7. Teman-teman angkatan 2008 (Andy, Kak Ani, Edi, Bang Maniur, Kak Wiwid, Bu Yuni), Bapak Bagus dan Kak Rahmita atas segala kebersamaannya serta segala perhatian dan dukungan yang telah diberikan.
8. Bapak/Ibu angkatan 2008 program guru-guru, Pak Suyoto, Kak Widia, Kak Nadima dan lainnya atas segala kebersamaan dan bantuannya dalam melaksanakan penelitian.
9. Sri Pratiwi, Bang Bobby dan Bang Man sebagai laboran Laboratorium Kimia Analitik dan Lembaga Penelitian, serta semua asisten Laboratorium Kimia Analitik yang membantu penulis dalam pelaksanaan penelitian.
Serta buat seluruh sahabat-sahabatku, terutama buat belahan hatiku Saut Sitanggang yang selalu setia mendoakan, memotivasi dan mendukung penulis sehingga penulis dapat menyelesaikan penelitian dan tesis ini.
Akhirnya semoga tesis ini bermanfaat bagi penelitian dan kemajuan ilmu pengetahuan untuk masa yang akan datang.
Hormat Penulis
DAFTAR RIWAYAT HIDUP
Penulis lahir tanggal 28 January 1985 di Medan, Sumatera Utara, anak dari Drs. M.H. Rajagukguk dan H. Simamora Purba sebagai anak pertama dari dua bersaudara.
DAFTAR ISI
Halaman
ABSTRAK... i
ABSTRACT... ii
KATA PENGANTAR... iii
RIWAYAT HIDUP... vi
DAFTAR ISI…..………. vii
DAFTAR GAMBAR..……… x
DAFTAR TABEL... xi
DAFTAR LAMPIRAN... xii
BAB I Pendahuluan... 1
2.3 Faktor-faktor yang mempengaruhi penyerapan ion logam oleh Kitosan ... 11
BAB III Metodologi Penelitian ... 22
3.2 Peralatan ... 22
3.3 Prosedur Kerja ... 23
3.3.1 Pembuatan nanomagnetik Fe3O4... 23
3.3.2 Pembuatan nanomagnetik kitosan-Fe3O4 ... 23
3.3.3 Persiapan Larutan Stok... 23
3.3.4 Adsorpsi Nanomagnetik kitosan terhadap logam krom ... 24
3.3.4.1 Pengaruh pH ... 24
3.3.4.2 Pengaruh waktu kontak ... 24
3.3.4.3 Pengaruh konsentrasi logam krom... 24
3.3.5 Skema Kerja ... 25
3.3.5.1 Pembuatan nanomagnetik Fe3O4... 25
3.3.5.2 Pembuatan nanomagnetik kitosan-Fe3O4 ... 26
3.3.5.3 Persiapan Larutan Cr ... 27
3.3.5.4 Adsorpsi Nanomagnetik kitosan terhadap logam Krom………. 27
3.3.4.5.1 Pengaruh pH ... 27
3.3.4.5.2 Pengaruh waktu kontak ... 28
3.3.4.5.3 Pengaruh konsentrasi logam krom... 29
BAB IV Hasil dan Pembahasan ... 30
4.1 Pembuatan nanomagnetik Fe3O4... 30
4.2 Pembuatan nanomagnetik Kitosan-Fe3O4... 31
4.3 Adsorpsi Nanomagnetik Kitosan terhadap Logam Cr(III)... 31
4.3.1 Kalibrasi Larutan Standar Logam Cr(III)... 31
4.3.2 Pengaruh Variasi pH... 33
4.3.3 Pengaruh Variasi Waktu Kontak ... 35
4.3.4 Pengaruh Variasi Konsentrasi logam Cr(III)... 37
4.4.Studi Analisis... 39
4.4.1 Analisis SEM... 39
BAB V Saran dan Kesimpulan... 45
5.1 Kesimpulan... 45
5.2 Saran... 45
DAFTAR GAMBAR
Nomor Judul Halaman
1. Kitin……….. 5
2. Deasetilasi Kitin menjadi kitosan………. 7 3. Nanomagnetik yang melekat pada batang magnet……… 29 4. Kurva Kalibrasi Serapan Terhadap Konsentrasi Larutan Krom… 32 5. Kurva Variasi pH Terhadap Persen Penyerapan Ion Logam…… 34 6. Kurva Variasi Waktu Kontak Sampel Terhadap Penyerapan Ion
Logam……… 36 7. Kurva Variasi Konsentrasi Larutan Krom Terhadap Penyerapan
Ion Logam……… 38
8. Analisis SEM Nanomagnetik dengan perbesaran 2000 x………. 39 9. Analisis SEM Nanomagnetik Kitosan dengan perbesaran 2000 x 40 10. Analisis FTIR Kitosan………... 41
11. Analisis FTIR Nanomagnetik Fe3O4………. 41
DAFTAR TABEL
Nomor Judul Halaman
1. Data kalibrasi Larutan Standar Cr(III) dengan konsentrasi
0.08-1.0 ppm……… 32
DAFTAR LAMPIRAN
Nomor Judul Halaman
1. Data karakterisasi Kitosan yang digunakan……… 49 2. Penentuan persamaan garis regresi dengan metode kurva kalibrasi... 50 3. Data kalibrasi Larutan Standar Cr(III) dengan konsentrasi 0.08-1.0
Ppm……… 51 4. Data adsorpsi nanomagnetik kitosan terhadap logam krom dengan
variasi Ph……… 52
5. Data adsorpsi nanomagnetik kitosan terhadap logam krom dengan
variasi waktu kontak……….. 53 6. Data adsorpsi nanomagnetik kitosan terhadap logam krom dengan
STUDI ADSORPSI KITOSAN MAGNETIK NANOPARTIKEL TERHADAP LOGAM KROM (Cr) DENGAN
SPEKTROSKOPI SERAPAN ATOM
ABSTRAK
Telah dilakukan penelitian tentang penggunaan kitosan magnetik nanopartikel sebagai bahan adsorben untuk menurunkan konsentrasi ion Cr3+ dengan melihat penyerapan optimum pada variasi pH, waktu kontak dan konsentrasi.
Penelitian didahului dengan pembuatan nanomagnetik Fe3O4 dengan mencampurkan
Fe2+ dan Fe3+ dengan perbandingan 1:2 pada suhu 800C dalam suasana basa. Penelitian kemudian dilanjutkan dengan pembuatan nanomagnetik kitosan dengan mencampurkan kitosan dan nanomagnetik dengan perbandingan 1:1 pada temperatur kamar, diikuti dengan penambahan paraffin dan CMC sebagai pengemulsi dan glutaraldehid untuk memberikan ikatan silang pada kitosan. Untuk mengetahui keberhasilan reaksi yang terjadi setiap sampel diuji dengan SEM dan FTIR. Adsorpsi Ion Cr3+ dilakukan dengan menambahkan adsorben ke dalam larutan ion Cr3+, kemudian diaduk dan disaring. Setelah itu masing-masing filtrat dapat dianalisis secara kuantitatif dengan menggunakan spektroskopi serapan atom.
Hasil penelitian yang diperoleh dari data SEM dan FTIR menunjukkan pembuatan nanomagnetik dan kitosan magnetik nanopartikel telah berhasil dilakukan. Nanomagnetik kitosan mampu menurunkan kadar Cr3+ sebesar 98.44% pada pH 5 dengan waktu kontak 30 menit. Selain itu, nanomagnetik Fe3O4 mampu melindungi
kitosan dari pengaruh pH asam, terbukti dari penyerapan nanomagnetik kitosan > 90% pada rentang pH asam.
STUDY ADSORPTION OF CHITOSAN MAGNETIC NANOPARTICLES IN CHROME BY ATOMIC ABSORPTION SPECTROSCOPY
ABSTRACT
The using chitosan magnetic nanoparticle as adsorbent to decrease chrome(III) ion level with varation of pH, contact time and concentration had been studied.
The fisrt step in this study was making nanomagnetic Fe3O4 with blending Fe2+ and
Fe3+ with comparison 1 : 2 at 800C in base condition. The second was making chitosan magnetic nanoparticle with comparison 1:1 at room temperature, then adding paraffin and CMC as the emulsion and Glutaraldehyde for making crosslinking in chitosan. For knowing the successful of reaction, each samples were analyzed by SEM and FTIR spectroscopy. Adsorption of chrome(III) has been done by adding adsorbent to the chrome(III) ion solution, then mixing and filtering the solution. The concentration of chrome(III) ion was measured by atomic absorption spectroscopy. The result of this research showed that the preparation of chitosan magnetic nanoparticle was success. Nanomagnetic chitosan decreasing chrome(III) ion level for 98.44% at pH 5 for 30 minutes. Beside it, nanomagnetic can protection chitosan at acid condition because all of the adsorption from nanomagnetic chitosan more than 90% at acid condition.
BAB I PENDAHULUAN 1.1 Latar Belakang
Logam krom (Cr) merupakan salah satu logam berat yang sering digunakan dalam bidang perindustrian. Penggunaan logam krombiasanya terdapat pada industri pelapisan logam, industri cat dan zat warna tekstil. Logam kromjuga digunakan untuk mengeraskan baja, pembuatan baja tahan karat dan membentuk banyak alloy (logam campuran) yang berguna seperti ferrokromium. Logam krom dibutuhkan oleh tubuh manusia dalam jumlah kecil, tetapi dalam dosis yang lebih tinggi dapat menjadi racun. Dalam tubuh logam krom biasanya berada dalam keadaan sebagai ion Cr3+. Krom dalam dosis tinggi dapat menyebabkan kanker paru-paru, kerusakan hati (liver) dan ginjal. Jika kontak dengan kulit menyebabkan iritasi dan jika tertelan dapat menyebabkan sakit perut dan muntah (Pellerin,2006).
Berbagai teknik dan proses telah dikembangkan untuk memisahkan ion-ion logam berat yang sangat berbahaya dari dalam air, diantaranya yaitu dengan penukaran ion, pengendapan kimia, dan dengan adsorbsi (penyerapan). Adsorbsi merupakan metode yang aman, tidak memberikan efek samping yang membahayakan kesehatan, tidak memerlukan peralatan yang rumit dan mahal, serta mudah pengerjaannya (Liu, 2009). Pada metode adsorbsi logam menjadi adsorbat yang akan diserap oleh adsorben yaitu bahan padat dengan luas permukaan yang besar.
tidak beracun dan dapat terbiodegradasi. Kitosan juga memiliki gugus fungsi yang dapat digunakan sebagai ligan untuk berkoordinasi dan bereaksi (Marganof, 2002). Selain karena karakteristik kitosan yang istimewa, pemanfaatan kitosan juga didukung oleh bahan bakunya yang berlimpah. Kitosan diperoleh dari deasetatilasi kitin yang merupakan salah satu material penyusun eksoskleton dari serangga dan golongan krustaceae seperti udang, kepiting dan udang (Ogawa, 2004).
Di Propinsi Sumatera Utara, khususnya di kota Medan, kulit udang belum dimanfaatkan secara maksimal, hanya sebagian kecil saja yang diolah menjadi beberapa produk seperti campuran terasi, kerupuk, dan pakan ternak (Yunizal, 2001) Modifikasi kitosan telah banyak dilakukan untuk meningkatkan daya serapnya terhadap ion logam. Meriatna (2008), meneliti penggunaan membran kitosan yang mampu menurunkan kadar logam krom(III) sebesar 99,87%. Agusnar (2006), telah meneliti ikatan silang kitosan dengan glutaraldehid sebagai pelapis filter fiber glass untuk menyerap logam krom(III) sebesar 99,7%. Aritonang, S. (2009), telah meneliti kitosan nanopartikel untuk menurunkan konsentrasi Cu2+ sebesar 93,66%.
gugus fungsi yang aktif dan istimewa untuk berbagai aplikasi. Erdawati (2008), telah meneliti penggunaan kitosan nanopartikel untuk penyerapan ion Ni(II), sedangkan Liu (2008) menggunakan kitosan nanomagnetik untuk penyerapan ion Pb2+, Cd2+, san Hg2+, Ni2+, dan Cu2+.
Banyak metoda yang dapat digunakan untuk menentukan konsentrasi logam yang diinginkan, diantaranya dengan spektrofotometri UV-VIS dan Spektroskopi Serapan Atom. Spektroskopi Serapan Atom (SSA) merupakan metode yang tepat untuk menganalisa zat pada konsentrasi yang cukup rendah. SSA mempunyai beberapa kelebihan seperti kecepatan analisis, ketelitian yang cukup baik, dan cara kerjanya yang spesifik sehingga tidak memerlukan pemisahan terlebih dahulu (Khopkar, 2003).
1.2 Rumusan Permasalahan
Berdasarkan uraian diatas maka dapat diambil rumusan masalah yaitu :
1. Apakah nanomagnetik kitosan mampu untuk menurunkan konsentrasi logam krom(III).
2. Berapakah kapasitas adsorpsi maksimum nanomagnetik kitosan terhadap logam krom(III) dengan menggunakan SSA.
1.3 Tujuan Penelitian
1. Mengetahui kondisi optimum pada penyerapan nanomagnetik kitosan terhadap logam krom(III).
2. Menentukan kapasitas adsorpsi nanomagnetik kitosan terhadap Logam krom(III) dengan SSA.
1.4 Manfaat Penelitian
Memberikan informasi mengenai pemanfaatan nanomagnetik kitosan yang dapat digunakan untuk penanggulangan pencemaran oleh logam krom(III).
1.5 Lokasi Penelitian
Analisis SEM di laboratorium Geologi Kuarter (PPGL) ITB, dan Analisis FTIR di Laboratorium Kimia Organik FMIPA UGM.
1.6 Metodologi Penelitian
Penelitian ini bersifat eksperimen laboratorium. Bahan yang digunakan adalah kitosan komersil. Nanomagnetik dibuat dengan mencampurkan FeCl3 dan FeSO4
dengan perbandingan 2:1 pada suasana basa selama 1 jam pada suhu 800C. Pembuatan nanomagnetik kitosan dilakukan dengan mencampurkan nanomagnetik Fe3O4 dengan larutan kitosan 2% dalam asam asetat 5% dengan perbandingan 1:1.
BAB II
TINJAUAN PUSTAKA 2.1 Kitin
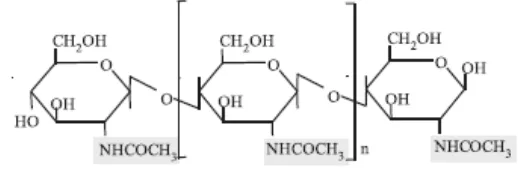
Nama kitin berasal dari bahasa Yunani yaitu chiton, pertama kali diberikan oleh Odier pada tahun 1823, yang artinya sampul atau baju. Kitin merupakan polisakarida linear yang mengandung N-asetil-D-glukosamina yang terikat β, dimana pada hidrolisis akan menghasilkan 2-amino-2-deoksi-D-glukosa. Rumus umumnya adalah (C8H13O5N)n atau (203)n. Secara kimiawi, kitin merupakan polimer
(1-4)-2-asetamido-2-deoksi-β-D-glukosamin (Marganof, 2002)
Gambar 1. Kitin
Kitin merupakan polisakarida yang paling berlimpah persediaanya di alam setelah selulosa. Kitin merupakan salah satu material penyusun eksoskeleton dari serangga dan golongan krustacea yang dapat diuraikan dengan enzim kitinase (Ogawa et.al, 2004).
Kitin dapat diperoleh dari tulang sotong, kulit udang, kulit kepiting dan cangkas blangkas. Cangkang udang mengandung protein (25%-40%), kitin (15%-20%), dan kalsium karbonat (45%-50%). Cangkang kepiting mengandung protein (15,6%-32,2%), dan kalsium karbonat (53,7%-78,4%). Pada umumnya isolasi kitin dilakukan dari cangkang udang dan kepiting karena mudah diperoleh dan memiliki kandungan kitin yang cukup besar (Marganof, 2002).
Menurut metode Alimuniar dan Zainuddin (1992), bahan seperti kulit udang terlebih dahulu dicuci bersih, kemudian direndam dengan NaOH selama 24 jam. Selanjutnya dilakukan pencucian hingga pH netral. Kemudian dilakukan perendaman kembali dengan HCl 2 M selama 24 jam. Setelah itu dicuci dengan air suling hingga pH netral. Selanjutnya kitin yang dihasilkan dikeringkan pada temperatur kamar.
Menurut Widodo, dkk (2005), kitin mempunyai kadar nitrogen yang tidak lebih dari 70% dan memiliki kelarutan yang sangat rendah di dalam air dan pelarut-pelarut lainya. Selain itu, karena reaktivitas kimianya yang rendah maka pengolahan kitin sangat sulit dan terbatas.
2.2 Kitosan
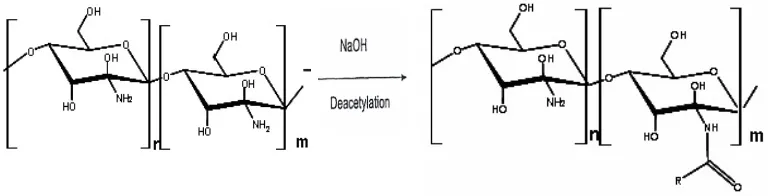
Gambar 2. Deasetilasi kitin menjadi kitosan
Berbagai metode digunakan untuk menyediakan kitosan dengan derajat deasetilasi tertentu. Pada metode Alimuniar dan Zainuddin (1992), pembuatan kitosan dilakukan dengan merendam kitin dalam larutan NaOH 40% dan dibiarkan selama 6 hari. Kemudian disaring dan dicuci sampai pH netral. Kitosan yang diperoleh dikeringkan pada temperatur kamar.
Besarnya derajat deasetilasi dapat membedakan kitin dan kitosan, Proton Laboratories Inc. menyatakan bahwa kitin memiliki derajat deasetilasi > 70% sedangkan kitosan memiliki derajat deasetilasi ≥ 70% (Nuraida, 2000). Akibat proses deasetilasi, persentase nitrogen dalam polimer kitosan lebih banyak daripada polimer kitin, yaitu ≥ 7% (Widodo dkk, 2005).
Kitosan adalah padatan amorf putih yang bersifat tidak larut didalam air, tetapi sedikit larut didalam HCL, HNO3, H3PO4, dan disamping itu, kitosan juga bersifat
polielektrolit sehingga dapat dengan mudah berinteraksi dengan zat-zat organik lainya seperti protein. Dengan demikian, kitosan relatif lebih banyak digunakan pada berbagai bidang industri terapan dan industri kesehatan daripada kitin (Marganof, 2002).
digunakan sebagai absorben pada ion logam transisi dan spesies organik. Hal ini disebabkan oleh adanya gugus amino (-NH2) dan gugus hidroksil (-OH) dari rantai
kitosan yang dapat dijadikan sebagai tempat untuk berkoordinasi dan bereaksi (Juang, 2002). Atom nitrogen pada gugus amina menyediakan pasangan elektron bebas yang dapat bereaksi dengan kation logam. Gugus amina primer pada kitosan memungkinkan kitosan menjadi mudah mengalami modifikasi kimia dan membentuk garam dengan asam. Pada pH asam, gugus amino terprotonisasi sehingga meningkatkan kelarutan kitosan yang bersifat tidak larut dalam pelarut alkali dan pada pH netral (Bernkop dkk, 2004).
Secara keseluruhan, aplikasi dan fungsi kitosan adalah sebagai berikut :
a. Pengolahan limbah, kitosan berfungsi sebagai bahan koagulasi/ flokulasi untuk limbah cair, penghilang ion-ion metal dari limbah
b. Bidang Pertanian, kitosan berfungsi sebagai bahan antimikrobial dan sebagai pupuk
c. Industri tekstil, kitosan berfungsi sebagai serat tekstil, meningkatkan ketahanan warna
d. Bidang Bioteknologi, kitosan berfungsi sebagai bahan immobilasi enzim e. Kosmetik, kitosan berfungsi sebagai bahan untuk rambut dan kulit
f. Bidang biomedis, berfungsi untuk mempercepat penyembuhan luka, bahan campuran obat (drug delivery), menurunkan kadar kolesterol
Sifat kationik, biologi dan sifat larutan kitosan adalah sebagai berikut : a. Sifat Kationik :
o Jumlah muatan positif tinggi: satu muatan per unit gugus glukosamin, jika banyak material bermuatan negatif (seperti protein) maka muatan positif kitosan berinteraksi kuat dengan permukaan negatif.
o Flokulan yang baik: gugus NH3+ berinteraksi dengan muatan negatif dari
koloid.
o Mengikat ion-ion logam ( Fe, Cu, Cd, Hg, Pb, Cr, Ni, dll) b. Sifat biologi :
o Dapat terdegradasi secara alami o Polimer alami
o Nontoksik c. Sifat Kimia :
o Linear poliamin (poli D-glukosamin) yang memiliki gugus amino yang baik untuk reaksi kimia dan pembentukkan garam dengan asam.
o Gugus amino yang reaktif.
o Gugus hidroksil yang reaktif (C3-OH, C6-OH) yang dapat membentuk
senyawa turunannya.
aplikasi biomedis. Untuk memperoleh hasil yang diinginkan, parameter ini dapat dimodifikasi. Derajat deasetilasi dapat diturunkan dengan reasetilasi sedangkan berat molekul melalui depolimerisasi menggunakan asam.
2.3 Faktor-Faktor yang Mempengaruhi Penyerapan Ion Logam oleh Kitosan Pada kitosan ada beberapa faktor yang dapat mempengaruhi proses penyerapan ion logam, diantaranya :
o Berat Molekul dan Derajat Deasetilasi Kitosan
Berat molekul dan derajat deasetilasi memainkan peranan yang penting dalam proses kelarutan dan penyerapan. Kitosan merupakan hasil dari deasetilasi kitin, yaitu proses pergantian gugus amida menjadi amina. Derajat deasetilasi kitin dan kitosan dapat diperoleh dari spektra FTIR masing-masing senyawa (Khan dkk, 2002).
Pertambahnya nilai derajat deasetilasi menyebabkan bertambahnya jumlah gugus amina bebas sehingga menurunkan berat molekulnya. Dengan bertambahnya gugus amina bebas maka bertambah juga tempat untuk berkoordinasi dan bereaksi (Milot dkk, 1998)
o Ukuran Kitosan
Kitosan biasanya dihasilkan dalam bentuk kepingan atau serbuk. Kedua bentuk ini mudah hancur dan mengembang menyebabkan kapasitas serapan dan kuantitas serapan menurun sehingga tidak stabil dalam larutan berair (Rorrer, 1993)
terhadap logam Ni(II) meningkat dari 86,95 mg/gram oleh kitosan menjadi 477,8 mg/gram.
o pH Kitosan
Maruca, dkk (1982) mengatakan bahwa kapasitas serapan kitosan terhadap ion Cr(III) menurun jika pH diturunkan. Hal ini terjadi akibat adanya persaingan ion hidronium dan gugus amina dalam penyerapan ion logam.
o Temperatur
Mckay, dkk (1989) telah melakukan penelitian dengan menggunakan serbuk kitosan untuk menyerap ion logam Cu2+, Hg2+, Ni2+, dan Zn2+ secara isoterm dan pemanasan pada temperatur 25-60 0C pada pH netral. Hasil yang diperoleh yaitu terjadinya penurunan kapasitas penyerapan dengan pertambahan temperatur.
o Waktu Penyerapan
Pengaruh waktu optimum terhadap proses penyerapan ion logam sangat berpengaruh terhadap kadar serapan. Quian, dkk (2000) melaporkan bahwa dengan waktu 8 menit didapati hasil proses penyerapan ion logam Se(VI) sebanyak 95%.
2.4 Magnetik Nanopartikel
Fe3O4 merupakan nanopartikel magnetik yang telah digunakan sesuai dengan sifat
spesifiknya yaitu superparamagnetik, tidak beracun dan ukuran kecil, dan ukurannya yang kecil. Fe3O4 dihasilkan dari endapan campuran FeCl2.4H2O dan FeCl3.6H2O
dalam suasana basa (dengan kehadiran NH4Cl), reaksinya menurut Dung (2009)
adalah sebagai berikut :
FeCl2.4H2O + FeCl3.6H2O + 8 NH4OH Fe3O4 + 8 NH4Cl + 20 H2O
Magnetik nanopartikel digunakan untuk melapisi beberapa surfaktan untuk anti penggumpalan yang diakibatkan oleh interaksi dipol magnet antara partikel. Magnetik nanopartikel biasanya terdiri dari pusat magnet dan cangkang polimer yang mempunyai gugus fungsi yang aktif dan istimewa untuk berbagai aplikasi.
Aplikasi yang paling terkenal dari teknologi magnetik yaitu kromatografi bioafinitas, penanggulangan limbah air, penghentian enzim atau biomolekul lain, dan preparasi uji imunologi.
Erdawati (2008) telah meneliti penggunaan kitosan nanomagnetik untuk penyerapan ion logam Ni(II), sedangkan Liu, dkk (2008) menggunakan kitosan nanomagnetik untuk penyerapan ion logam Pb2+, Cd2+, Hg2+, Ni2+, dan Cu2+.
2.5 Adsorpsi
Adsorben adalah bahan padat dengan luas permukaan dalam yang besar. Permukaan yang luas ini terbentuk karena banyaknya pori yang halus pada padatan tersebut. Adsorben dapat berbentuk granulat ( ukuran butiran sebesar beberapa mm) atau bentuk serbuk sesuai dengan tujuan penggunaannya. Beberapa bahan yang dapat digunakan sebagai adsorben diantaranya yaitu : karbon aktif, silika gel, dan zeolit (Mc. Cabe dkk, 1999).
Adsorpsi yang terjadi karena adanya gaya tarik dari permukaan adsorban dan energi kinetik molekul adsorbat, dapat berupa adsorpsi fisika, adsorpsi kimia dan adsorpsi isoterm. Pada adsorpsi fisika terjadi gaya vanderwaals antara molekul adsorbat dan adsorban untuk berikatan. Hal ini terjadi terjadi akibat perbedaan energi gaya tarik elektrostatik sehingga adsorpsi fisika merupakan reversibel, sedangkan adsorpsi kimia merupakan interaksi antara elektron-elektron pada permukaan adsorben dengan molekul-molekul adsorbat membentuk ikatan yang lebih kuat dibandingkan dengan adsorpsi fisika dimana prosesnya berlangsung secara irreversibel (Bernasconi, 1995). Proses adsorpsi berlangsung dalam tiga tahap yaitu : pergerakan molekul-molekul adsorbat menuju permukaan adsorben, penyebaran molekul-molekul adsorbat ke dalam rongga-rongga adsorben dan penarikan molekul-molekul adsorbat oleh permukaan aktif membentuk ikatan yang sangat cepat (Metcalf dan Edy, 1979)
2.6 Studi Analisis
A. Spektroskopi Serapan Atom
panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau yang diabsorpsi. Jadi spektrofotometer digunakan untuk mengukur energi secara relatif jika energi tersebut ditransmisikan, direfleksikan atau diemisikan sebagai fungsi dari panjang gelombang (Day dan Underwood, 2002). Spektroskopi Serapan Atom (SSA) merupakan metode yang tepat untuk menganalisa zat pada konsentrasi yang cukup rendah. SSA mempunyai beberapa kelebihan seperti kecepatan analisis, ketelitian yang cukup baik, dan cara kerjanya yang spesifik sehingga tidak memerlukan pemisahan terlebih dahulu (Khophar, 2003).
Metode SSA berprinsip pada absorpsi cahaya oleh atom. Atom-atom menyerap cahaya tersebut pada panjang gelombang tertentu, tergantung pada sifat dari unsurnya. Misalnya kromium menyerap pada panjang gelombang 357, 9 nm, sedangkan kadmium pada panjang gelombang 228,8 nm (Kurnianta,2002). Cahaya pada panjang gelombang ini mempunyai cukup energi untuk mengubah tingkat elektronik suatu atom. Transisi elektronik suatu unsur bersifat spesifik. Dengan absorpsi energi, berarti memperoleh lebih banyak energi sehingga suatu atom yang pada keadaan dasar akan dinaikkan ke tingkat eksitasi.
nilai absorbansinya 0.004 sedangkan batas deteksi adalah konsentrasi suatu unsur dalam larutan yang memberikan signal setara dengan dua kali deviasi standar dari suatu segi pengukuran standar yang konsentrasinya mendekati blanko (Day, 2002). SSA pada umumnya terdiri dari tiga komponen utama, yaitu sumber radiasi, pembakar dan nyala. Seperangkat sumber yang dapat memberikan garis emisi yang tajam dari suatu unsur spesifik tertentu dikenal sebagai lampu pijar Hollow cathode. Lampu ini berisi gas mulia yang bertekanan rendah dan memiliki dua elektroda, satu diantaranya berbentuk silinder dan terbuat dari unsur yang sama dengan unsur yang dianalisis (Gary, 1986).
Pembakar dan nyala pada SSA disesuaikan dengan karakteristik unsur yang dianalisa. Nyala terdiri dari bahan bakar dan oksidan. Umumnya bahan bakar yang digunakan adalah propana, butana, hidrogen, dan asetilen sedangkan oksidatornya adalah udara, oksigen, N2O dan asetilen. Logam-logam yang mudah diuapkan umumnya
memerlukan nyala pada suhu yang lebih rendah, sedangkan untuk unsur-unsur yang tidak mudah diatomisasi memerlukan suhu yang lebih tinggi. Suhu yang tinggi dapat dicapai dengan menggunakan suatu oksidator bersama dengan gas pembakar, seperti untuk atomisasi unsur alkali yang kerap kali membentuk refaktori harus menggunakan campuran asetilena udara.
B. FTIR (Fourier Transform Infra-Red)
digunakan untuk mengidentifikasi sampel yang belum dikenal, menentukan kualitas sampel dan untuk menentukan berapa jumlah sampel dalam campuran.
Derajat deasetilasi juga dapat ditentukan dari spektra FTIR, dimana derajat deasetilasi menunjukkan persentase perbandingan serapan gugus N-H dengan gugus C=O dari amida. Proses deasetilasi pada kitosan mengakibatkan berkurangnya kuantitas gugus C=O dari amida sehingga absorbansi gugus C=O dari amida juga akan mengalami penurunan. Berdasarkan Proton Laboratories Inc.(Nuraida, 2000) yang menyatakan bahwa kitosan memiliki derajat deasetilasi ≥ 70%, sedangkan kitin memiliki derajat deasetilasi < 70%. Dengan mengetahui derajat deasetilasi maka polimer kitin dan kitosan dapat dibedakan.
C. SEM (Scanning Electron Microscope)
Kata mikroskop (microscope) berasal dari bahasa Yunani, yaitu kata micron=kecil dan scopos=tujuan, yang maksudnya adalah alat yang digunakan untuk melihat obyek yang terlalu kecil untuk dilihat oleh mata secara langsung.
Mikroskop elektron ditemukan tahun 1932 untuk melihat benda berukuran di bawah 200 nanometer. Mikroskop elektron menggunakan sinar elektron yang panjang gelombangnya lebih pendek dari cahaya sehingga mikroskop elektron mempunyai kemampuan pembesaran obyek (resolusi) yang lebih tinggi dibanding mikroskop optik.
prinsip menembakkan elektron ke lapisan tipis sampel, yang selanjutnya informasi tentang komposisi struktur dalam sampel tersebut dapat terdeteksi dari analisis sifat tumbukan, pantulan maupun fase sinar elektron yang menembus lapisan tipis tersebut. Sedangkan SEM bekerja berdasarkan prinsip scan sinar elektron pada permukaan sampel, yang selanjutnya informasi yang didapatkan diubah menjadi gambar.
2.7 Krom (Cr)
Krom adalah logam berwarna abu-abu, berkilau, keras yang ditemukan pada tahun 1797 oleh Vauquelin. Bijih utama krom adalah kromit, yang ditemukan di Zimbabwe, Rusia, Selandia Baru, Turki, Iran, Albania, Finlandia, Republik Demokrasi Madagaskar, dan Filipina. Logam ini biasanya dihasilkan dengan mereduksi krom oksida dengan aluminum.
Krom digunakan untuk mengeraskan baja, pembuatan baja tahan karat dan membentuk banyak alloy (logam campuran) yang berguna. Kebanyakan digunakan dalam proses pelapisan logam untuk menghasilkan permukaan logam yang keras dan indah dan juga dapat mencegah korosi. Krom memberikan warna hijau emerald pada kaca dan secara luas digunakan sebagai katalis dalam bidang industri.
Logam krom(III) merupakan logam berat yang berbahaya dan beracun, dimana pada konsentrasi tinggi dapat membahayakan lingkungan. Adapun sifat-sifat yang dimiliki oleh krom adalah (Darmono,1995) :
o Logam yang mengkilap dan titik cairnya tinggi dan banyak dipergunakan di industri baja.
o Dapat larut dalam asam kecuali nitrit dan tidak larut dalam air.
o Pada tingkat konsentrasi 10 ppm dalam air, krom diperkirakan toksik bagi beberapa alga
b. Sifat fisik krom
o Titik lebur 19030C pada tekanan 1 atm o Titik didih 26420C pada 1 atm
o Massa jenis 650 g/cm3
Logam krom(III) (Cr) adalah salah satu jenis polutan logam berat yang bersifat toksik, dalam tubuh logam krom(III) biasanya berada dalam keadaan sebagai ion Cr3+. Krom dapat menyebabkan kanker paru-paru, kerusakan hati (liver) dan ginjal. Jika kontak dengan kulit menyebabkan iritasi dan jika tertelan dapat menyebabkan sakit perut dan muntah.
2.8 Interaksi Logam dengan Kitin dan Kitosan
Folsom (1986) mengemukakan bahwa interaksi antara ion logam dengan ligan pada umumnya berasal dari alam, berlangsung melalui proses pertukaran kation, yang secara garis besar dibedakan menjadi tiga kelompok yaitu :
o Interaksi pertukaran kation menengah melibatkan ion Mn(II), Fe(II), Co(II), Ni(II), Cu(II) dan Pb(II). Kation-kation ini menunjukkan afinitas kuat dengan ligan yang mengandung O, N dan S dan di dalam sistem perairan, logam ini membentuk senyawa kompleks yang stabil sehingga tidak ditemukan dalam ion bebas.
o Interaksi pertukaran kation lambat yang melibatkan ion logam Cu(II), Cr(III), Ti(II), Cd(II), Ag(II) dan Hg(II). Kation-kation ini memiliki afinitas yang kuat dengan ligan yang mengandung nitrogen dan sulfur.
Kemampuan kitin dan kitosan untuk mengadakan interaksi dengan ion logam disebabkan senyawa tersebut mengandung gugus fungsional utama, yaitu amida dan amina. Amida merupakan gugus aktif yang mempunyai ikatan rangkap parsial sebagai akibat adanya ikatan rangkap pada gugus karbonilnya, sedangkan gugus aktif amina tidak memiliki ikatan rangkap. Kitin dan kitosan memiliki kemampuan mengikat ion-ion logam karena elektron nitrogen yang terdapat dalam gugus-gugus amino tersubstitusi dapat memantapkan ikatan dengan ion-ion logam transisi.
Interaksi kitosan dengan ion logam terjadi karena proses pengkompleksan dimana penukaran ion, penyerapan dan pengkhelatan terjadi selama proses berlangsung. Kitosan menunjukkan affinitas yang tinggi pada logam transisi golongan tiga, begitu pula pada logam yang bukan golongan alkali dengan konsentrasi rendah. (Muzzarelli, 1997).
Inoue (1993) mengatakan bahwa sifat penyerapan ion logam yang sangat baik oleh kitosan dengan selektif dan kapasitas yang tinggi disebabkan oleh :
o Gugus amina primer dengan aktivitas yang tinggi
o Struktur rantai polimer kitosan yang fleksibel yang dapat membentuk konfigurasi untuk pengompleksan kitosan dengan in logam.
Ion logam yang terserap terjadi berdasarkan mekanisme penukaran kation ion logam valensi n terserap dan dapat menyingkirkan sejumlah n ion H+. Mekanisme reaksi penyrapan ini yaitu :
o Protonasi gugus amina primer.
BAB III
METODOLOGI PENELITIAN 3.1. Bahan- Bahan
Adapun bahan-bahan yang digunakan dalam penelitian ini adalah : Kitosan Fluka
Cr(NO)3.9H2O p.a (E. Merck)
FeCl3.6H2O
FeSO4.7H2O
NaOH HCl Aquades
Asam asetat glacial p.a (E. Merck) Paraffin
CMC
Glutaraldehid 25% p.a (E.Merck) 3.2 Peralatan
3. 3 Prosedur Kerja
3.3.1. Pembuatan nanomagnetik Fe3O4
Nanomagnetik Fe3O4 disediakan dengan mencampurkan FeCl3 dan FeSO4
dengan perbandingan 2:1. Tambahkan NaOH sehingga pH menjadi 9. Aduk selama 1 jam pada suhu 800C. Pisahkan endapan yang terbentuk dengan penyaringan. Bilas endapan dengan etanol dan kemudian dengan aquades. Keringkan pada suhu 600C di dalam oven dan simpan di tempat yang kering.
3.3.2. Pembuatan nanomagnetik Kitosan- Fe3O4
Nanomagnetik Fe3O4 ditambahkan ke dalam larutan kitosan 2% dalam
asam asetat 5% dengan perbandingan 1:1. Aduk campuran sambil tambahkan setetes demi setetes larutan pengemulsi yang mengandung 30 ml parafin dan 0.5 ml CMC. Aduk selama 5 jam pada suhu kamar. Kemudian tambahkan secara perlahan 50 mL Glutaraldehid 25% dan diaduk sampai terbentuk endapan. Endapan nanomagnetik yang terbentuk didiamkan dan disaring. Bilas endapan nanomagnetik kitosan dengan etanol. Keringkan pada suhu 300C di dalam oven dan simpan di tempat yang kering. 3.3.3. Persiapan Larutan Stok Cr(III)
Larutan stok Cr(III) diperoleh dari larutan standar Cr(NO3)3.9H2O 1000
3.3.4. Adsorpsi Nanomagnetik Kitosan terhadap Logam krom(III) 3.3.4.1. Pengaruh pH
100 mg nanomagnetik kitosan dicampurkan dengan larutan 200 mL logam krom(III) dengan konsentrasi 10 ppm. Untuk penentuan pH optimum campuran tersebut diatur dengan variasi pH 3 sampai 6 dengan menggunakan NaOH 0,1M dan HCl 0,1M. Campuran diaduk selama 20 menit. Endapan yang terbentuk disaring dan diukur kadar logam krom(III) yang terkandung dalam filtratnya menggunakan SSA. 3.3.4.2. Pengaruh waktu kontak
100 mg nanomagnetik kitosan dicampurkan dengan 200 mL larutan logam krom(III) dengan konsentrasi 10 ppm. Campuran dikondisikan pada pH optimum yang didapatkan dari prosedur diatas. Pengadukan dilakukan dengan variasi waktu 10, 20, 30, 40, 50, dan 60 menit. Endapan yang terbentuk disaring dan diukur kadar logam krom(III) yang terkandung dalam filtratnya menggunakan SSA.
3.3.4.3. Pengaruh konsentrasi logam krom(III)
3.3.5. Skema Kerja
3.3.5.1. Pembuatan nanomagnetik Fe3O4
FeCl3 + FeSO4 (2 :1)
+ NaOH hingga pH 9
Aduk selama 1 jam pada T 800C
Saring endapan yang terbentuk
Bilas dengan aquades Bilas dengan etanol
3.3.5.2. Pembuatan nanomagnetik Kitosan- Fe3O4
Tambahkan 50 mL Glutaraldehid 25%
Aduk sampai terbentuk endapan Larutan Kitosan 2% dalam asam asetat 5%
+ Nanomagnetik Fe3O4 (1:1)
Campuran nanomagnetik Fe3O4-Kitosan
+ Medium dispersi ( 30 mL parafin + 0.5mL CMC)
Cuci dengan etanol
Keringkan pada T 300C hari dan simpan di tempat yang kering
3.3.5.3. Persiapan Larutan Cr(III) 3.3.5.3. Persiapan Larutan Cr(III)
Larutan standar
aliquot
Larutan Cr(III) 2,4,6,8 dan 10 ppm
3.3.5.4. Adsorpsi Nanomagnetik Kitosan terhadap Logam krom(III) 3.3.5.4. Adsorpsi Nanomagnetik Kitosan terhadap Logam krom(III) 3.3.5.4.1. Pengaruh variasi pH
3.3.5.4.1. Pengaruh variasi pH
Aduk selama 20 menit
3.3.5.4.2. Pengaruh variasi waktu kontak
Ukur kadar Krom filtrat dengan SSA 100 mg Nanomagnetik
Atur pH pada pH optimum dengan NaOH 0.1 M dan HCl 0.1 M
+ 200 mL larutan Logam krom(III) 10 ppm
Aduk campuran dengan variasi waktu kontak 10-60 menit
3.3.5.4.3. Pengaruh variasi konsentrasi Logam Cr(III)
Ukur kadar Krom filtrat dengan SSA 100 mg Nanomagnetik
Atur pH pada pH optimum dengan NaOH 0.1 M dan HCl 0.1 M
+ 200 mL larutan Logam krom(III) dengan konsentrasi 0.5,1,5,10,20,40, dan
Aduk campuran pada waktu kontak optimum
BAB IV
HASIL DAN PEMBAHASAN
4.1. Pembuatan nanomagnetik Fe3O4
Nanomagnetik Fe3O4 dibuat dengan mereaksikan Fe2+ dari FeSO4.7H2O
dengan Fe3+ dari FeCl3.6H2O pada suasana basa dengan reaksi sebagai berikut :
Fe2+ + 2Fe3+ + 8 NaOH Fe3O4 + 8 Na+ + 4 H2O
Dari reaksi di atas dihasilkan campuran dengan dua fase yang tidak saling campur. Lapisan bawah adalah Fe3O4 yang berupa endapan yang berwarna hitam pekat dan
bersifat magnetik karena dapat melekat pada batang magnetik seperti yang ditunjukkan pada gambar dibawah ini :
Gambar 4.1. Nanomagnetik yang melekat pada batang magnet
4.2. Pembuatan nanomagnetik Kitosan-Fe3O4
Pembuatan nanomagnetik kitosan-Fe3O4 didahului dengan pembuatan larutan
kitosan 2% dalam asam asetat 5%, dimana kitosan dapat larut dengan sempurna walau sudah didiamkan beberapa saat. Kitosan yang digunakan mempunyai karakterisasi pada Lampiran 1.
Penambahan paraffin dan CMC sebagai surfaktan dan bahan pengemulsi pada campuran kitosan dan nanomagnetik ditujukan untuk menjaga sifat magnetik dari nanomagnetik pada saat reaksi berlangsung.
4.3. Adsorpsi Nanomagnetik Kitosan terhadap Logam Cr(III)
Penentuan adsorpsi nanomagnetik kitosan terhadap logam Cr(III) diamati dari tiga variasi yaitu variasi pH, variasi waktu kontak dan variasi konsentrasi logam Cr(III). Sisa konsentrasi logam Cr(III) yang tidak terserap oleh nanomagnetik kitosan dapat diamati menggunakan Spektroskopi Serapan Atom dengan mengukur serapan sisa logam Cr(III) dan dengan persamaan garis regresi dapat ditentukan konsentrasi logam Cr(III) yang tidak terserap.
4.3.1. Kalibrasi Larutan Standar Logam Cr(III)
Tabel 4.1. Data kalibrasi Larutan Standar Cr(III) dengan konsentrasi 0.08-1.0
Data serapan logam krom(III) dapat ditunjukkan pada Tabel 4.1 merupakan pengolahan data dari Lampiran 3 dan dari serapannya dapat ditentukan persamaan garis regresinya yang ditunjukkan pada Gambar 4.2. Persamaan garis regresi diberikan langsung dari data SSA dan dapat juga ditentukan dengan perhitungan pada Lampiran 2.
Kurva kalibrasi diatas dibuat dari konsentrasi 0.08 – 1 ppm karena diharapkan serapan atau konsentrasi larutan krom sisa yang tidak diserap kitosan berada pada rentang tersebut.
4.3.2. Pengaruh Variasi pH
Penentuan pengaruh variasi pH terhadap penyerapan nanomagnetik kitosan terhadap logam Cr(III) dilakukan dengan konsentrasi logam Cr(III) 10 ppm dengan waktu kontak masing-masing 20 menit, dimana variasi pH dilakukan dari pH asam sampai dengan pH basa yaitu pH 3-6.
Data pada Tabel 4.2 di bawah ini merupakan pengolahan dari data yang diperoleh dari Lampiran 4 dengan mengurangkan konsentrasi awal larutan Krom dengan konsentrasi Krom dari data pengukuran SSA.
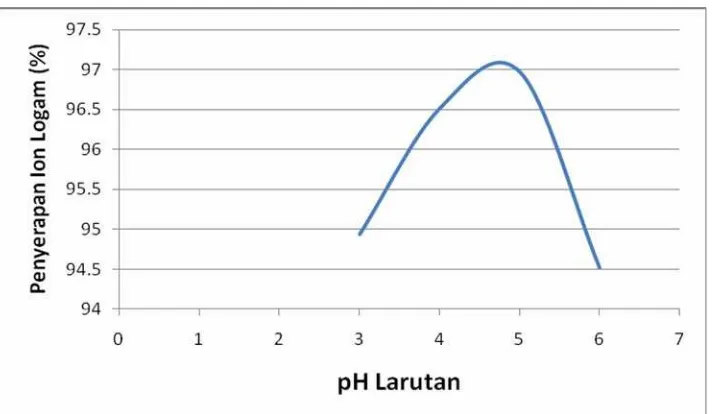
Gambar 4.3. Kurva Variasi pH Terhadap Persen Penyerapan Ion Logam
Dari kurva variasi pH diatas dapat diamat penyerapan kitosan terhadap logam krom(III) pada kondisi asam dan basa. Dari data yang ada dapat diambil kesimpulan bahwa pH optimum untuk penyerapan logam krom(III) oleh kitosan nanomagnetik adalah berkisar pada pH 5.
Adanya variasi pH tetap akan mengurangi penyerapan kitosan walaupun dengan rentang yang tidak terlalu besar. Pada pH yang terlalu asam, gugus amina pada kitosan terprotonasi sehingga mengurangi penyerapan logam krom(III). Di lain pihak, pada pH terlalu basa terjadi reaksi logam krom(III) dengan gugus OH- dari basa sehingga membentuk endapan yang mengakibatkan berkurangnya logam krom(III) yang dapat diserap kitosan.
4.3.3. Pengaruh Variasi Waktu Kontak
Variasi waktu kontak dilakukan dengan menggunkan larutan Krom 10 ppm pada konsidi pH optimum yaitu pH 5. Data pada Tabel 4.3 merupakan pengolahan dari data yang diperoleh dari Lampiran 5 dengan mengurangkan konsentrasi awal larutan Cr dengan konsentrasi dari data pengukuran SSA.
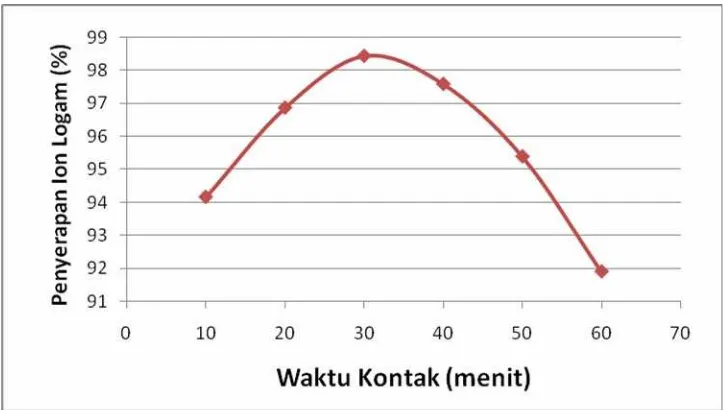
Gambar 4.4. Kurva Variasi Waktu Kontak Sampel Terhadap Penyerapan Ion Logam
Variasi waktu kontak antara nanomagnetik kitosan dengan logam krom(III) ditujukan untuk melihat waktu kesetimbangan adsorpsi nanomagnetik kitosan terhadap larutan krom.
Dari data yang ada peristiwa adsorpsi menurun setelah waktu kontak lebih besar dari 30 menit karena pada saat ini nanomagnetik kitosan sudah mengalami proses desorpsi atau penguraian kembali logam krom(III) dari nanomagnetik kitosan.
4.3.4. Pengaruh Variasi Konsentrasi logam Cr(III)
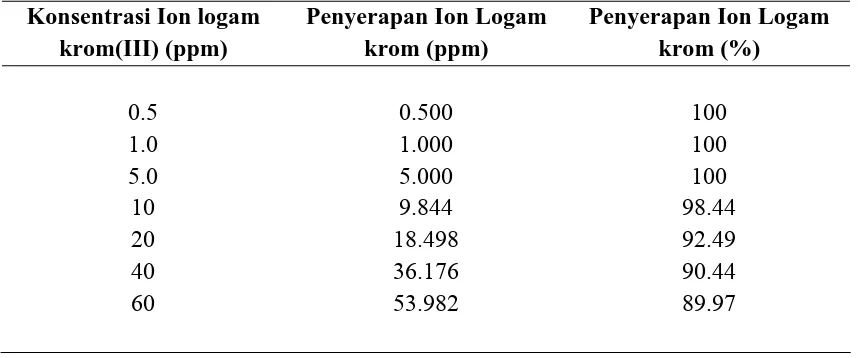
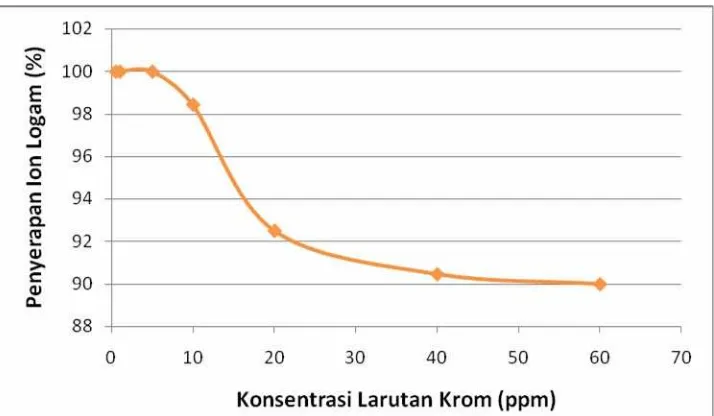
Variasi konsentrasi logam krom(III) dilakukan pada konsidi pH optimum yaitu pH 5 dan waktu kontak optimum yaitu 30 menit. Data pada tabel 4.4. merupakan pengolahan dari data yang diperoleh dari Lampiran 6 dengan mengurangkan konsentrasi awal larutan Cr dengan konsentrasi dari data pengukuran SSA.
Gambar 4.5. Kurva Variasi Konsentrasi Larutan Krom Terhadap Penyerapan Ion Logam
4.4. Studi Analisis 4.4.1 Analisis SEM
Analisis SEM dilakukan untuk melihat permukaan penampang melintang dan membujur suatu specimen secara mikroskopis dengan perbesaran 2000 x sehingga topografi pada pori-pori permukaan terlihat dengan jelas seperti ditunjukkan pada Gambar 4.6, dimana seluruh permukaan nanomagnetik dapat terlihat dengan jelas.
Gambar 4.7. Analisis SEM Nanomagnetik Kitosan dengan perbesaran 2000 x
4.4.2 Analisis FTIR
Analisis FTIR dilakukan untuk melihat gugus-gugus yang ada pada sampel dari serapannya pada bilangan gelombang tertertu dan perubahan gugus yang ada setelah adanya reaksi dengan senyawa lain.
Gambar 4.8. Analisis FTIR Kitosan
Gambar 4.10 Analisis FTIR Nanomagnetik Kitosan
Dari Gambar 4.8, 4.9, 4.10 dan 4.11 diatas dapat diamati serapan gugus-gugus tertentu pada bilangan gelombang yang telah disesuaikan dengan literatur dan digambungkan dalam Tabel 4. 5.
Tabel 4.5. Data FTIR masing-masing sampel Gugus Fungsi
Tabel 4.5. menampilkan serapan gugus yang ada pada setiap sampel. Dari tabel 4.5, dapat diamati bahwa gugus-gugus fungsi yang seharusnya ada pada kitosan terdapat pada sampel kitosan, kitosan nanomagnetik dan nanomagnetik kitosan yang telah menyerap krom.
adanya amida dari kitin yang tidak mengalami deasetilasi.Hal itu disebabkan karena derajat deasetilasi setiap variasi kitosan < 100% seperti yang tertera pada Lampiran 1 yaitu data karakterisasi kitosan yang digunakan.
Pada daerah 3650-2400 cm-1 terdapat ulur O-H yang berimpitan dengan N-H. Untuk membedakan serapan O-H dan N-H dapat dilihat dari bentuk puncaknya. N-H mempunyai satu puncak lebar dan lebih tajam, sedangkan O-H mempunyai satu atau dua puncak tajam yang lebih lemah. Keberadaan ulur O-H dan N-H diperjelas dengan adanya serapan tekuk N-H dan serapan tekuk O-H.
Pada FTIR nanomagnetik, tidak terdapat gugus-gugus yang terdapat pada kitosan. Daerah serapan yang dapat diamati yaitu berkisar pada bilangan gelombang 563.21 cm-1 yang menyatakan adanya ikatan Fe dengan O.
Pada FTIR nanomagnetik kitosan, dapat diamati adanya penambahan serapan pada kitosan yaitu pada bilangan gelombang 586.36 cm-1 yang menunjukkan bahwa reaksi antara nanomagnetik dengan kitosan telah berhasil membentuk nanomagnetik kitosan.
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Dari hasil penelitian yang telah dilakukan dapat disimpulkan bahwa :
1. Nanomagnetik kitosan mampu menurunkan kadar konsentrasi logam krom(III) sebanyak 98.44% pada pH 5 dan waktu kontak selama 30 menit.
2. Kondisi optimum dari penyerapan kitosan nanomagnetik adalah pada pH 5 dan waktu kontak selama 30 menit.
3. Nanomagnetik kitosan mampu melindungi kitosan dari pengaruh pH, terbukti penyerapan nanomagnetik kitosan > 90% pada rentang pH asam dan basa.
5.2 Saran
Daftar Pustaka
Agusnar, H. 2006. Penggunaan Glutaraldehid Kitosan untuk Penurunan Konsentrasi Ion Logam Ni2+ dan Cr3+ Menggunakan Ekstraksi Fasa Padat. Disertasi FMIPA. Universitas Sumatera Utara.
Aritonang, P.S. 2009. Studi Penggunaan Kitosan Nanopartikel sebagai Bahan Penyalut pada Zeolit Alam untuk Menurunkan Konsentrasi Ion Cu2+ dalam Larutan Teh Hitam. Tesis. FMIPA. Universitas Sumatera Utara.
Alimuniar, A., & Zainuddin, R., 2004. An Economical technique for producing chitosan. Elsevier Applied Science, 627-63.
Anisa, M., Daar, S.A. & Singer, A.P. 2003. Nanotechnology 14 R9-13. Doi:10.1088/0957-4484/14/3/201. Journal of Nanoscience and Nanotechnology.
Bernasconi,G., 1995. Teknologi Kimia Bagian 2. PT. Pradnya Pramita. Jakarta.
Bernkop, A., Hornof, M., Guggi, D., 2004. Thiolated chitosans. European Journal of Pharmaceutics and Biopharmaceutics, 9-17. Ausria.
Darmono. 1995. Logam dalam Sistem Biologi Mahluk Hidup. UI-Press. Jakarta.
Day, R.A. & Underwood, A.L. 2002. Analisis Kimia Kuantitatif. Diterjemahkan oleh Sopyan, I. Erlangga. Jakarta.
Dung, K.T.D., Hai, H.T., Phuc, H.L., Long, D.B., Vinh, K.L., Truc, N.P., 2009. Preparation and characterization of magnetic nanoparticles with chitosan coating. Journal of Physics: Conference Series 187. Vietnam.
Erdawati. 2008. Kapasitas Adsorpsi Kitosan dan Nanomagnetik Kitosan terhadap Ion Ni(II). Jurusan Kimia FMIPA Universitas Negeri Jakarta. Jakarta.
Gary D.C. 1986. Analytical Chemistry. 4th ed. John Wiley & Sons, Inc. United State of America.
Juang, S.R., Wu, C.f., & Tseng, L.R. 2002. Use of chemically modified chitosan beads for sorption and enzyme immobilation. Advances in Environmental Research. Taiwan.
Khan A.T., Peh, K.K. & Ching, S.H. 2002. Reporting degree of deacetylation values of chitosan : the influence of analytical methods. Journal Pharm Pharmaceut Sci. Malaysia.
Khopkar, S.M., 2003. Konsep Dasar Kimia Analitik. Diterjemahkan oleh Saptorahardjo. UI-Press. Jakarta.
Kumar, Ravi, N., & Majeti. 2000. A Review of chitin and chitosan applications. Reactive & Functional Polymers 46, 1-27.
Kurnianta, M. J., 2002. Profil Kandungan Logam Berat Cadmium (Cd) dan Krom (Cr) dalam Daging Kupang Beras (Tellina versicolo). Universitas Jember.
Liu, X., Hu,Q., Fang, Z., Zhang, X.,Zhang, B., 2009. Magnetic chitosan Nanocomposites : A Useful Recyclable Tool for Heavy Metal Ion Removal.
Marganof. 2002. Potensi Limbah Udang sebagai Penyerap Logam Berat (Timbal, Kadmium, dan Tembaga) di Perairan.
Maruca, S., Suder, B.J., & Wightman, J.P. 1982. Interaction of heavy metal with chitin and chitosan-III chromium. Journal Applied Science. Vol 27.
Mc.Cabe, Smith, J., Peter, H., 1999. Operasi Teknik Kimia. Jilid 2. Erlangga. Jakarta.
Meriatna. 2008. Penggunaan Membran Kitosan untuk Menurunkan Kadar Logam krom(III) (Cr) dan Nikel (Ni) dalam Limbah Cair Industri Pelapisan Logam. Tesis. FMIPA. Universitas Sumatera Utara.
Metcalf and Eddy Inc. 1979. Wastewater engineering treatment disposal reuse. Mc-Graw Hill. Second Ed. pp.121-124
Millot, C., Mcbrien, J., Allen, S., & Guibal, E. 1998. Influence of psicochemical and structural characteristic of chitosan falkes on molybdate sorption. Journal Applied Polymer Science. Vol 68. 571-580.
Muzzareli, R.A.A., 1997. Chitin. Perganon Press. New York.
Nuraida. 2000. Berbagai ragam Pemanfaatan Polimer. FMIPA. Universitas Sumatera Utara.
Ogawa, Kozo, Yui, Toshifumi, &Kenji O. 2004. Three D Structures of chitosan. International Journal of Biological Macromolecules 34, 1-8.
Pellerin & Susan, M.B. 2006. Reflection on hexavalent chromium: Health hazards of an industrial heavyweight. http/www.nickel & chromium hazard/millennium ark water purification. Httm.
Quian, S., Huang, G., Jiang, J., He. F., and Wang, Y. 2000. Studies of adsorption behavior of crosslinked chitosan for Cr(VI), Se(VI). Journal Applied Polymer Science. Vol 77(14). Pp. 3216-3219.
Rorrer, G.L., & Way, J.D. 1999. Chitosan beads to remove heavy metals from wastewater. Oregon State University.
Lampiran 1.
Lampiran 2
Penentuan persamaan garis regresi dengan metode kurva kalibrasi
No. Xi Yi Xi-X Yi-Y (Xi-X)2 (Yi-Y)2 (Xi-X)(Yi-Y)
1. 0.08 0.0072 -0.43333 -0.01368 0.18777 0.00019 0.005928 2. 0.2 0.0112 -0.31333 -0.00968 0.09817 0.00009 0.003033 3. 0.4 0.0175 -0.11333 -0.00338 0.01284 0.00001 0.003830 4. 0.6 0.0236 0.08667 0.00272 0.00751 0.00751 0.000024 5. 0.8 0.0297 0.28667 0.00088 0.08218 0.08218 0.000779 6. 1.0 0.0361 0.48667 0.01522 0.23685 0.23685 0.007471 Σ 3.08 0.1253 0.00002 -0.00792 0.62532 0.32683 0.021001
Dimana : X rata-rata : X = =
= 0.513333
Y rata-rata : Y = == 0.02088
Persamaan garis regresi dapat diturunkan dari persamaan garis : Y =aX + b Dimana : a = slope
b = intersept
a = = = 0.03
b = Y – aX
= 0.0072 – (0.03)(0.08) = 0.004
Lampiran 3
Data kalibrasi Larutan Standar Cr(III) dengan konsentrasi 0.08-1.0 ppm Hasil Data Pengukuran SSA
No. Konsentrasi Logam
krom(III) (ppm) Serapan Rata-rata Konsentrasi Rata
Lampiran 4
Data adsorpsi nanomagnetik kitosan terhadap logam krom(III) dengan variasi pH
Hasil Data Pengukuran SSA No. pH Logam
krom(III) Serapan Rata-rata Konsentrasi Rata
Lampiran 5
Data adsorpsi nanomagnetik kitosan terhadap logam krom(III) dengan variasi waktu kontak
Hasil Data Pengukuran SSA No. Waktu kontak
(menit) Serapan Rata-rata Konsentrasi Rata
Lampiran 6
Data adsorpsi nanomagnetik kitosan terhadap logam krom(III) dengan variasi Konsentrasi Logam krom(III)
Hasil Data Pengukuran SSA No. Konsentrasi Logam
krom(III) (ppm) Serapan Rata-rata Konsentrasi Rata