Lampiran 2. Daun Pirdot (Saurauia vulcani Korth)
Lampiran 4. Ekstrak Metanol dan Etil Asetat Daun Pirdot (Saurauia vulcani Korth)
A. Ekstrak Metanol Daun Pirdot (Saurauia vulcani Korth)
Lampiran5. Hasil Skrining Fitokimia Ekstrak Metanol Daun Pirdot
(Saurauia vulcani Korth)
Lampiran 6. Hasil Skrining Fitokimia Ekstrak Etil Asetat Daun Pirdot
(Saurauia vulcani Korth)
Lampiran 7. Hasil Skrining Fitokimia Ekstrak Metanol Dan Etil Asetat Daun Pirdot Terhadap Uji Terpenoid
Lampiran 5. Hasil Uji Aktivitas Antioksidan Ekstrak Metanol dan Etil Asetat Daun Pirdot
Lampiran 5.1 Perhitungan % Peredaman Ekstrak Metanol Daun Pirdot
% Peredaman =Ablanko−Asampel Ablanko
x 100 %
` 1. Konsentrasi 20 ppm
% Peredaman =0,991−0,146
0,991 x 100 % = 85,267%
2. Konsentrasi 40 ppm
% Peredaman =0,991−0,134
0,991 x 100 % = 86,478%
3. Konsentrasi 60 ppm
% Peredaman =0,991−0,125
0,991 x 100 % = 87,386 %
4. Konsentrasi 80 ppm
% Peredaman =0,991−0,116
Peredaman radikal ekstrak metanol daun pirdot :
Sampel Absorbansi % Peredaman
Blanko 0,991 -
20 ppm 0,146 85,267
40 ppm 0,134 86,478
60 ppm 0,125 87,386
80 ppm 0,116 88,294
Perhitungan Nilai IC50 Ekstrak Metanol Daun Pirdot
X y Xy x2
0 0,00 0,00 0
20 85,627 1705,34 400
40 86,478 3459,12 1600
60 87,386 5243,16 3600
80 88,294 7063,52 6400
200 ∑y = 347,425 ∑xy = 17471,14 ∑x2 = 12000
Dimana : x = Konsentrasi y = % Peredaman
a = n(∑xy)−(∑x)(∑y) n(∑x2)−(∑x)2
= 5(17471,14)−(200)(347,425) 5(12000)−(200)2
= 87355,7−69485 60000−40000
= 17870,7 20000
b = (∑x
2)(∑y)−(∑x)(∑xy)
n(∑x2)−(∑x)2
= (12000)(347,425)− (200)(17471,14) 5(12000)−(200)2
= 4169100−3494228 60000−40000
= 674872 20000
= 33,743
Jadi persamaan garis regresi Y = 0,893X +33,743 Nilai IC50 :
50 = 0,893X + 33,743 0,893X = 50 – 33,743 0,893X = 16,257 X = 18,193
Lampiran 5.2 Perhitungan % Peredaman Ekstrak Etil Asetat Daun Pirdot
% Peredaman =Ablanko−Asampel Ablanko
x 100 %
1.Konsentrasi 20 ppm
% Peredaman =0,991−0,132
0,991 x 100 % = 86,680%
2.Konsentrasi 40 ppm
% Peredaman =0,991−0,125
0,991 x 100 % = 87,386%
3. Konsentrasi 60 ppm
% Peredaman =0,991−0,120
0,991 x 100 % = 87,891%
4.Konsentrasi 80 ppm
% Peredaman =0,991−0,113
0,991 x 100 % = 88,957 %
Peredaman radikal ekstrak etil asetat daun pirdot
Sampel Absorbansi % Peredaman
Blanko 0,991 0
20 0,132 86,680
40 0,125 87,386
60 0,120 87,891
Perhitungan Nilai IC50 Ekstrak Etil Asetat Daun Pirdot
X y xy x2
0 0,00 0,00 0
20 86,680 1733,6 400
40 87,386 3495,44 1600
60 87,891 5273,46 3600
80 88,597 7087,76 6400
∑x = 200 ∑y = 350,554 ∑xy = 17590,26 ∑x2 = 12000
Dimana : x = Konsentrasi y = % Peredaman
a = n(∑xy)−(∑x)(∑y) n(∑x2)−(∑x)2
= 5(17590,26)−(200)(350,554) 5(12000)−(200)2
= 0,892
b = (∑x
2)(∑y)−(∑x)(∑xy)
n(∑x2)−(∑x)2
= (12000)(350,554)−(200)(17590,26) 5(12000)−(200)2
= 34,429
Jadi persamaan garis regresi Y = 0,892X + 34,429 Nilai IC50 :
Lampiran 6. Stokiomerti Pembuatan Larutan DPPH 0,3mM Dalam Labu Takar 100 ml
Dimana : Mr DPPH = 394,32
M = ���
�
mM = ����
��
LangkahI
:
Mencarijumlahmoldari DPPH 0,3 mM0,3mM
=
���� 100 ��mmol = 0,3 mM x 100 ml mmol = 30 mmol
LangkahII : Mencari Massa dari DPPH 0,3 mM Massa =mol x Mr
Massa = 30 mmol x 394,32 �� ����
Massa = 11,83 mg
DAFTAR PUSTAKA
Achmad, S.A., 1985. Kimia Organik bahan Alam.Departemen Pendidikan dan Kebudayaan. Universitas Terbuka : Jakarta
Arifin, Syamsul. 1986. Buku Materi Pokok Kimia Organik Bahan Alam. Universitas Terbuka : Jakarta
Adiastuti, P. C.2007. Penelitian Pendahuluan Kandungan Kimia Daun Pirdot
(Saurauia vulcani Korth). Skripsi. Depok : UI
Agoes, G. 2007. Teknologi Bahan Alam. Bandung : ITB Press.
Ajizah, A. 2004 .Sensitivitas Salmonella Typhimurium Terhadap Ekstrak Daun Psidium Guajava L. Jurnal Bioscientiae. Volume 1. Nomor1. Halaman 36. Apak, R Guclu, K, Ozyurek, M and Karademir, S. E. 2007. Comparative
Evaluation of Various Total Antioxidant Capacity Assay Applied to Phenolic Compounds with The CUPPRAC Assay Molecules. Pages : 1496-1547.
Astarina. 2013. Skrining fitokimia Ekstrak Metanol Rimpang Bangle (Zingiber
purpuren Roxb). Bali : Universitas Undayana. Junal Farmasi Undayana.
Atun, S. 2003. Pemanfaatan Bahan Alam Bumi Indonesia Menuju Riset yang Berkualitas Internasional. Jurusan Kimia FMIPA Universitas Yogyakarta. Bilbiana, L dan Hastowo, S. 1992. Mikrobiologi. Jakarta : Rajawali Press.
Buckle, K.A., Edwards, R. A.,Fleet, G.H danWootton, M. 2007. Ilmu Pangan. Penterjemah Hari Purnomo dan Adiono.Jakarta:Universitas Indonesia. Chamber, H. F. 2007. Dasar Farmakologi Terapi. Jilid 2. Edisi 10. Diterjemahkan
oleh Cucu., Ella, E., Winny, R.S., Amalia, H dan Juli, M. Jakarta : Penerbit Buku Kedokteran EGC
Crozier, A., Clifford, M.N and Ashihara, H. 2006. Plant Secondary Metabolites. UK: Blackwell Publishing ltd.
Cui, K., Xiaoling luo.,Keyixu., V. Murthy M.R. 2004. Di dalam Roking, 2007. Identifikasi Golongan Senyawa dan Aktivitas Antioksidan Ekstrak Metanol Serta Fraksi Aktif Daun Pirdot. Jurnal Obat Bahan Alam (12) Dachriyanus. 2004. Analisis Struktur Senyawa Organik secara Spektroskopi.
Depkes RI. 2000 .Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan Pertama. Jakarta: Direktorat Jenderal Pengawasan Obat & Makanan.
Dewi, F,K., 2010. Aktivitas Antibakteri Ekstrak Etanol Buah Mengkudu
(Morindacitrifolia, Linneaus) terhadap Bakteri Pembusuk Daging Segar,
Skripsi.Universitas Sebelas Maret.
Erawati. 2002. Uji Aktivitas Antioksidan Ekstrak Daun Garciniadaedalanthera Pierre Dengan Metode DPPH (1,1-Difenil Pikrilhidrazil) dan Identifikasi Golongan Senyawa Kimia dari Fraksi Paling Aktif, Skripsi Sarjana Farmasi Universitas Indonesia.
Erlyani, 2012. Identifikasi Kandungan Metabolit Sekunder Dan Uji Antioksidan Ekstrak Metanol Tandan Bunga Jantan Enau (Arenga Pinnata
Merr.).Jurnal Skripsi Jurusan F.MIPA FKIP Unhalu. Halaman 5.
Fardiaz, S. 1992. Mikrobiologi Pangan I. Jakarta : PT. Gramedia Pustaka Umum. Gaman, P. M. 1992. Ilmu Pangan. Edisi Kedua. Yogyakarta : Gajah Mada
University Press.
Ganiswara, S.G. 1995. Farmakologi dan Terapi. Edisi IV. Gaya baru. Jakarta. Giannella R.A. 1996. “Salmonella”. Di Baron S et. Al (eds). Baron’s Medical
Microbiology ( 4th ed.ed). University of texas Medical Branch.
Hagerman, A. E. 2002. Tannin Handbook. Department of Chemistry and Biochemistry, Miami University.
Harborne, J.B. 1987. Metode Fitokimia Penuntun Cara Modern Menganalisis Tumbuhan. Penerjamah : Kosasih Padmawinata dan Iwang Soediro. Edisi Ketiga. Bandung : ITB Press.
Hariana, A. 2015. 262 Tumbuhan Obat dan Khasiatnya. Cetakan ke-2 (edisi revisi). Jakarta: Penebar swadaya.
Hawley, L.B. 2003. Intisari Mikrobiologi dan Penyakit Infeksi. Jakarta : Hipokrates.
Hirota, A., Taki, S., Kawai, S., Yano, M dan Abe. 2000. 1,1-Diphenyl-2-Picryl-Hydrazil Radical Scavenging Compounds from Soybean Miso and Antiproliferative Activity of isoflavanes Soybean Miso Toward the Cancer Cell Lines. Biosci. Biotechnol. Biochem. 64(5): 1038-1040.
Ionita , P. 2005. Is DPPH Stable Free Radical a Good Scavenger for Oxygen Active species. Chem. Pap. 59 (1) Romania. Pages 11-16.
Iswari, K. 2011. Kulit Manggis Berkhasiat Tinggi. Cetakan I. Jakarta : Penerbit APMK
Jawetz,E. J. L., Melnick and E.A Adelberg. 1996. Mikrobiologi Kedokteran. Edisi ke-20, Jakarta: Penerbit Buku Kedokteran EGC.
Jodi A, Lindsay. 2008. Staphylococcus : Molecular Genetic. Inggris. Caister Academic Press.
Kalt W., Forney, C. F., Martin, A., & Prior, R. L., 1999. Antioxidant Capacity, Vitamin C, Phenolics, and Anthocyanins After Fresh Storage of Small Fruits. Journal of Agricultural and Food Chemistry.
Kardono, LBS.2003.Kajian Kandungan Kimia Mahkota Dewa (Phaleria Marcocarpa). Jakarta: Pusat Penelitian dan Pengembangan Farmasi dan Obat Tradisional Badan Penelitian dan Pengembangan Kesehatan.P.56 Khopkar, S. M. 2007. Konsep Dasar Kimia Analitik. Jakarta : UI Press.
King S, Metzger WI. 1968. A New Plating Medium for The Isolation of Enteric Pathogens. I. Hektoen enteric agar. Appl Microbial 16(4) :577-578.
Khunaifi, M. 2010. Uji Antibakteri Ekstrak Daun Binahong (Anredera cordifolia (Ten.) Steenis) Terhadap Bakteri Staphylococcus aureus dan Pseudomonas aeruginosa.
Kosasih, E. N. 2004. Peran Antioksidan Pada Lanjut Usia. Jakarta : Pusat Kajian Nasional Majalah Lanjut Usia.
Kumalaningsih, S. 2006. Antioksidan Alami Penangkal Radikal Bebas, Sumber Manfaat, Cara Penyediaan dan Pengolahan. Surabaya : Trubus Agrisarana. Lenny, S. 2006. Senyawa Terpenoida dan Steroida. Karya Ilmiah. Medan :
Universitas Sumatera Utara.
Lisa ,A. S and Anne T. R. 1998. Essential of Diagnostic Microbiologi. Inggris. Delmar Cengage Lerning.
Malheiros, A., Filho, V. C., Schmitt, C. B., Yunes, R. A., Escalante, A., Svetaz, L., Zacchino,S. & Monache, F. D., 2006, Antifingal Activity of Drimane Sesquiterpenes from Drymisbrasiliensis using Bioassay-guided Fractionation, Journal of Pharmacy and Pharmaceutical Science, 8 (2),335-339.
Maulida, D. 2010. Skripsi Ekstraksi Antioksidan (LIKOPEN) Dari Buah Tomat Dengan Menggunakan Solven Campuran, n-Heksana, Aseton dan Etanol. Universitas Diponegoro Semarang.
Miquel, F.A.W. 1859. Flora Van Nederlandsch Indie. Bij Fried Fleisher, Leiipzig: 479
Miryanti, Y.I.P., Sapei, L., Budiono, K dan Indra, S. 2011. Ekstraksi Antioksidan Dari Kulit Buah Manggis (Garcinia mangostana L). Bandung : Lembaga penelitian dan Pengabdian Kepada Masyarakat Universitas Katolik Parahyangan.
Molyneux, P. 2004. The Use of The Stable Free Radical Dyphenylpycrilhydrazil (DPPH) for Estimating Antioxidant Activity. Journals science and
thecnology : 26:211-219.
Mosquera. 2007. Antioxidants Activity of Twenty Five Plants from Colombian Biodiversity. Rio de Janeiro : Memorias Oswaldo Cruz. Vol 102 (5) : 631-634.
Nasution, P., Roza, RM dan Fitmawati. 2008. Aktivitas Antibakteri Ekstrak Daun Benalu (Scurulla sp) yang Tumbuh Pada Beberapa Inang Terhadap Pertumbuhan Salmonella Typhi. Pekanbaru : Fakultas Matematika dan Ilmu Pengetahuan Alam.
Pardede, A., Manjang, Y., dan Efdi, M. 2013. Skrining Fitokimia Ekstrak Metanol Dari Kulit Batang Manggis (Gracinia cymosa). Jurnal Kimia FMIPA
Universitas Andalas. Volume 6. Nomor 2. Halaman 60-66
Pelczar, M. J., dan Chan, E. C.S. (1998). Dasar-Dasar Mikrobiologi II. Jakarta : Penerbit UI-Press.
Pinder, A.R. 1960. The Chemistry of Terpenes. London: Chapmann and Hall Ltd.
Pokornya, J. N. Yanishlieva and N. Gordon. 2001. Antioxidant in Food. Woodhead Publishing Limited : England.
Prajitno, Arief. 2007. Uji Sensitifitas Flavonoid Rumput Laut (Eucheuma Cottoni) Sebagai Bioaktif Alami Terhadap Bakteri Vibrio Harveyi. Skripsi.Fakultas Perikanan. Universitas Brawijaya.
Pratiwi, Sylvia. T. 2008. Mikrobiologi Farmasi. Jakarta : Erlangga
Rasyid, A. 2012. Identifikasi Senyawa Metabolit Sekunder – Serta Uji Aktivitas Antibakteri dan Antioksidan Ekstrak Metanol Teripang Stichopus Hermanii, Jurnal Ilmu dan Teknik Kelautan Tropis, Vol.4, No.2, Halaman 360-368
Roking. 2007. Identifikasi Golongan Senyawa dan Aktivitas Antioksidan Ekstrak Metanol Serta Fraksi Aktif Daun Pirdot (Saurauia vulcani Korth). Skripsi.Depok : UI
Rohman, A. 2007. Kimia Farmasi Analisis. Yogyakarta : Pustaka Pelajar.
Sabir, A. 2005. Aktivitas Antibakteri Flavonoid Propolis Trigona sp Terhadap Bakteri Streptococcus Mutans (In Vitro). Majelis Ked.Gigi.
Salisbury, J.W. dan Ross. 1995. Fisiologi Tumbuhan. Jilid 2. Bandung : ITB Sangi, M., Runtunewe, M.R.J.,Simbala,H.E.I dan Makang V.M.A. 2008. Analisa
Fitokimia Tumbuhan Obat di Kabupaten Minahasa Utara. Chem. Prog. 1 (1):47-53
Sastrohamidjojo, H. 1996. Sintesis Bahan Alam. Yogyakarta : Gadjah Mada University Press.
Setiabudi, R dan Gan, V. H. S. 1995. Farmakologi dan Terapi. Edisi 4. Bagian Farmakologi FK UI : Jakarta 571-583.
Silalahi, J. 2006. Antioksidan dalam Diet dan Karsinogenesis. Cermin Dunia Kedokteran. 153:42-47.
Sine, Y. 2012. Uji Aktivitas Antibakteri Ekstrak Daun Tanaman Ketapang (Terminaliacatappa L.) dan Daun Tanaman Jambu Biji ( Psidium guajava L.) Terhadap Pertumbuhan Bakteri Aeromonas hydrophila.
Sirait, M. 2007. Penentuan Fitokimia dalam Farmasi. Bandung : ITB.
Soejarto, D.D. 1980. Fieldiana Botany Revision of South American Saurauia
(Actinidiaceae). Field Museum of Natural History, Chicago: 1-18.
Syahrurachman, Agus. 1993. Buku Ajar Mikrobiologi Kedokteran Edisi Revisi. Jakarta : Bina Rupa Aksara
Taylor WI., Schelhart D. 1970. Isolation of Shigellae. 8. Comparison Xylose Lysine Deoxycholate Agar, hetoen enteric agar, salmonella-sigella agar, and eosin Methylene blue agar with stool specimens. Appl Microbial 21 :32-37.
Tortora, GJ., Funke BR., Case CL. 2001. Microbiology an Introduction. Edisi Ketujuh. California : Addison Wesley Longman, Inc. Halaman 86-88. Widyastuti, N. 2010. Pengukuran Aktivitas Antioksidan dengan Metode
CUPRAC, DPPH, dan FRAP serta korelasinya dengan Fenol dan Flavonoida pada Enam Tanaman, Skripsi Sarjana Sains IPB.
BAB 3
METODE PENELITIAN
3.1Alat-Alat
Peralatan yang digunakan dalam penelitian ini meliputi : Spektrofotometri UV-Visible SP-300
Rotari Evaporator Buchi
Oven Fischer Scientific
Inkubator Fiber Scientific
Lemari Pendingin Toshiba
Blender
Alat-alat gelas yang biasa digunakan dilaboratorium Tabung reaksi
Glass Beaker Gelas Erlenmeyer Corong pisah Botol vial
Neraca analitis Mettler AE 200
Desikator Simax Czechoslovakia
Pipet mikro Eppendorf
Kapas
Aluminium foil Kertas cakram Jarum ose
Autoklaf Yamata SN 20
Kuvet
3.2Bahan-Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah : Daun Pirdot (Saurauia vulcani Korth)
Etanol p.a Merck
Metanol Etil Asetat Aquadest
Pereaksi Wagner Pereaksi Maeyer Pereaksi Bouchardat Pereaksi Dragendorf FeCl3 5%
CeSO4 1% dalam H2SO4 10%
Logam Mg HCl pekat HCl 2N
DPPH (2,2-diphenyl-1-picryl-hydrazil) p.a Aldrich
DMSO (dimetilsulfoksida) p.a Fisons
Nutrient Broth (NB) p.a Oxoid
Nutrient Agar (NA) p.a Oxoid
Mueller Hinton Agar (MHA) p.a Oxoid
Bakteri Staphylococcus aureus Bakteri Escherichia coli
3.3 Prosedur Penelitian
3.3.1 Penyediaan Sampel
Bahan yang digunakan dalam penelitian ini adalah Daun Pirdot yang diperoleh dari Daerah Tigarunggu, Kabupaten Simalungun, Sumatera Utara. Daun Pirdot dipisahkan dari batang dan buahnya. Sampel dikeringkan dalam ruangan selama ±5 hari kemudian dihaluskan dengan blender.
3.3.2 Analisa Kadar Air
Ditimbang 2 gram sampel lalu dikeringkan dalam oven pada suhu 105̊ C- 110̊ C selama 2 jam, lalu didinginkan dalam desikator selama 30 menit. Kemudian ditimbang. Diulangi pengeringan sampai diperoleh berat tetap.
3.3.3 Pembuatan Ekstrak Metanol dan Etil asetat dari Daun Pirdot (Saurauia vulcani Korth)
Ditimbang serbuk daun Pirdot sebanyak 200 g, dimaserasi dengan menggunakan pelarut metanol selama 2×24 jam. Kemudian disaring. Dilakukan pengulangan hingga larutan berwarna jernih. Filtrat yang diperoleh diuapkan dengan menggunakan rotarievaporator dan ekstrak pekat metanol yang diperoleh dipekatkan kembali pada penangas air sampai diperoleh ekstrak bebas dari pelarut metanol dan ditimbang. Ekstrak kering yang dihasilkan diuji skrining fitokimia, aktivitas antioksidan dan antibakteri. Dilakukan hal yang sama untuk ekstrak etil asetat.
3.3.4 Skrining Fitokimia
1. Alkaloid
2. Flavonoida
Ekstrak metanol dan etil asetat daun pirdot masing-masing dimasukkan kedalam 2 tabung reaksi. Tabung I ditetesi NaOH 10%, jika terbentuk larutan warna biru violet maka positif mengandung flavonoida. Tabung II ditambah serbuk Mg dan HCl pekat,jika terbentuk larutan warna jingga maka positif mengandung flavonoida.
3. Tanin
Ekstrak metanol dan etil asetat daun pirdot masing-masing dimasukkan kedalam tabung reaksi,kemudian ditambah dengan FeCl3 5%. Jika terbentuk larutan warna
biru kehitaman maka positif mengandung tanin. 4. Terpenoida
Ekstrak metanol dan etil asetat daun pirdot masing-masing dimasukkan dalam tabung reaksi kemudian ditambah dengan CeSO4 1% dalam H2SO4 10%. Jika
terbentuk endapan warna merah kecoklatan maka positif mengandung terpenoida. 5. Saponin
Ekstrak metanol dan etil asetat daun pirdot masing-masing ditambah 10 ml aquades, kemudian dikocok kuat-kuat. Jika muncul busa yang stabil maka positif mengandung saponin.
3.3.5 Uji aktivitas Antioksidan Ekstrak Metanol dan Etil Asetat Daun Pirdot
3.3.5.1 Pembuatan Larutan DPPH 0,3 mM
Larutan DPPH 0,3 mM dibuat dengan melarutkan 11.83 mg serbuk DPPH dengan etanol p.a dalam labu takar 100 ml, kemudian dihomogenkan.
3.3.5.2 Pembuatan Variasi Konsentrasi Ekstrak Metanol dan Etil Asetat Daun Pirdot
3.3.5.3 Uji Aktivitas Antioksidan
a. Uji Aktivitas Antioksidan Larutan Blanko
Sebanyak 2,5 ml etanol p.a ditambahkan ke dalam 1 ml larutan DPPH 0,3 mM dalam tabung reaksi, dihomogenkan dan dibiarkan selama 30 menit pada ruang gelap. Kemudian diukur absorbansinya dengan panjang gelombang 515 nm.
b. Uji Aktivitas Antioksidan Sampel
Sebanyak 2,5 ml ekstrak metanol daun pirdot 20 ppm dimasukkan ke dalam 1 ml larutan DPPH 0,3 mM dalam tabung reaksi,dihomogenkan dan dibiarkan dalam ruang gelap selama 30 menit. Lalu diukur absorbansinya dengan panjang gelombang maksimum 515 nm. Dilakukan perlakuan yang sama untuk konsentrasi 40,60 dan 80 ppm. Dilakukan perlakuan yang sama untuk ekstrak etil asetat.
3.3.6 Uji aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun Pirdot
3.3.6.1 Pembuatan Media Mueller Hinton Agar (MHA)
Sebanyak 19 g serbuk Mueller Hinton Agar dimasukkan dalam erlenmeyer lalu dilarutkan dengan 500 ml aquadest dan dipanaskan hingga semua larut dan mendidih. Lalu disterilkan di autoklaf pada suhu 121̊ C selama 15 menit.
3.3.6.2 Pembuatan Media Nutrient Agar (NA)
Sebanyak 7 g nutrient agar dimasukkan dalam erlenmeyer lalu dilarutkan dalam 250 ml aquadest dan dipanaska hingga semua larut dan mendidih . Lalu disterilkan di autoklaf pada suhu 121̊ C selama 15 menit.
3.3.6.3 Pembuatan Media Agar Miring dan Stok Kultur Bakteri
Kedalam tabung reaksi yang steril dimasukkan 3 ml media nutrient agar steril, didiamkan pada temperatur kamar sampai memadat pada posisi miring
nutrient agar miring dengan cara menggores , kemudian diinkubasi pada suhu 35 ̊C selama 18-24 jam. Hal yang sama juga dilakukan pada biakan bakteri Escherichia
coli, Staphylococcus epidermidis dan Salmonella thypi.
3.3.6.4 Penyiapan Inokulum Bakteri
Sebanyak 3,25 g nutrient broth dilarutkan dengan 250 ml aquadest dalam erlenmeyer dan dipanaskan hingga semua larut dan mendidih , kemudian disterilkan di autoklaf pada suhu 121̊ C selama 15 menit dan didinginkan. Lalu koloni bakteri Staphylococcus aureus diambil dari stok kultur menggunakan jarum ose steril kemudian disuspensikan ke dalam 10 ml media nutrient broth steril dalam tabung reaksi dan diinkubasikan pada suhu 35̊ C selama 3 jam,lalu diukur panjang gelombang dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 540-600 nm. Hal yang sama dilakukan untuk koloni bakteri
Escherichia coli, Staphylococcus epidermidis dan Salmonella thypi.
3.3.6.5 Pembuatan Variasi Konsentrasi Ekstrak Metanol dan Etil Asetat Daun Pirdot
Ekstrak Metanol dan Etil Asetat dibuat dalam berbagai konsentrasi dengan menimbang ekstrak masing-masing sebanyak 100 mg,200 mg,300 mg,400 mg,500 mg, kemudian dilarutkan masing-masing dengan 1 ml DMSO. Konsentrasi ekstrak adalah 100 mg/ml,200 mg/ml,300 mg/ml,400 mg/ml dan 500 mg/ml.
3.3.6.6 Uji Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun Pirdot
Sebanyak 0,1 ml inokulum Staphylococcus aureus dimasukkan ke dalam cawan petri steril, setelah itu dituang media Mueller Hinton Agar sebanyak 15 ml dengan suhu 45-50̊ C dihomogenkan sampai media dan bakteri tercampur rata,kemudian dibiarkan sampai media memadat. Dimasukkan kertas cakram yang telah direndam dengan ekstrak metanol dan etil asetat dengan berbagai variasi konsentrasi kedalam cawan petri yang telah berisi bakteri , kemudian diinkubasi dalam inkubator pada suhu 35̊ C selama 18-24 jam. Selanjutnya diukur diamater zona hambat di sekitar kertas cakram dengan jangka sorong. Dilakukan perlakuan yang smaa terhadap bakteri Escherichia coli, Staphylococcus epidermidis dan
3.4Bagan Penelitian
3.4.1 Ekstraksi Serbuk Daun Pirdot dengan Pelarut Metanol
Daun Pirdot
Dikeringkan Dihaluskan
Serbuk Daun Pirdot
Ditimbang Sebanyak 200 gram
Dimaserasi dengan 2 liter metanol selama 2x24 jam
Disaring
Dipekatkan
Ekstrak Pekat Metanol Daun Pirdot
Dilakukan perlakuan yang sama untuk ekstraksi serbuk daun pirdot dengan pelarut etil asetat.
3.4.2 Analisa Kadar Air
Hasil
2 gram serbuk daun pirdot
dikeringkan dalam oven pada suhu 1050C-1100C
selama 2 jam
didinginkan dalam desikator selama 30 menit ditimbang
3.4.3 Skrining Fitokimia Ekstrak Metanol dan Etil Asetat Daun Pirdot
Alkaloid Flavonoid Tanin Terpenoid Saponin
3.4.4 Uji Aktivitas Antioksidan Ekstrak Metanol Daun Pirdot (Saurauia vulcani
Korth)
1. Pembuatan Variasi Konsentrasi Ekstrak Metanol Daun Pirdot
0,025 gram ekstrak metanol daun pirdot
dimasukkan ke dalam labu takar 25 ml
Ditambahkan etanol p.a sampai garis batas
Dihomogenkan
25 ml larutan 1000 ppm
Dipipet sebanyak 5 ml
Dimasukkan ke dalam labu takar 50 ml
Ditambahkan etanol p.a hingga garis batas
Dihomogenkan
50 ml larutan 100 ppm
Dibuat variasi konsentrasi 20, 40, 60 dan 80 ppm
dipipet 5 ml
etil asetat daun pirdot.
2. Pembuatan Larutan DPPH 0,3 Mm
Hasil
11,85 mg DPPH
dimasukkan ke dalam labu takar 100 ml ditambahkan etanol p.a hingga gari batas
dihomogenkan
3. Pengukuran Absorbansi Larutan Blanko dan Ekstrak Metanol dan Etil Asetat Daun Pirdot
a. PengukuranAbsorbansi Larutan Blanko
Hasil
1 ml DPPH 0,3 mM
dimasukkan ke dalam tabung reaksi ditambahkan 2,5 ml etanol p.a
dihomogenkan
b. Pengukuran Absorbansi Ekstrak Metanol dan Etil Asetat Daun Pirdot
1 ml larutan DPPH 0,3 mM
Dimasukkan ke dalam tabung reaksi Ditambahkan 2,5 ml ekstrak metanol
daun pirdot sesuai dengan variasi konsentrasi Dihomogenkan
Dibiarkan selama 30 menit pada ruang gelap
Diukur absorbansi pada panjang gelombang maksimum 515 nm
Hasil
Dilakukan perlakuan yang sama untuk pengujian aktivitas antioksidan ekstrak etil asetat daun pirdot.
3.4.5 Uji Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat DaunPirdot
1. Pembuatan Media Mueller Hinton Agar (MHA)
19 gram media MHA (Mueller Hinton Agar)
Dilarutkan dengan 500 ml aquadest di dalam labu erlenmeyer
Dipanaskan dan diaduk hingga larut dan mendidih
Disterilkan di dalam autoklaf
pada suhu 121oC selama 15 menit
2. Pembuatan Stok Kultur Bakteri
Dilarutkan dengan 250 ml aquadest kedalam gelas erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf
pada suhu 121oC selama 15 menit
Media NA (Nutrient Agar) steril
Dituangkan kedalam tabung reaksi sebanyak 3 ml
Dibiarkan pada temperatur kamar sampai memadat pada
posisi miring membentuk
sudut 30-45O
Diambil biakan bakteri Staphylococcus aureus dari strain utama dengan jarum ose lalu digoreskan pada media NA
yang telah memadat
Diinkubasi pada suhu 35oC
selama 18-24 jam
Stok Kultur Bakteri
7 gram Media NA ( Nutrien Agar)
Dilakukan hal yang sama untuk bakteri Staphylococcus epidermidis, Escherichia
3. Penyiapan Inokulum Bakteri
3,25 gram NB (Nutrien Broth)
Dialarutkan dengan 250 ml aquadest ke dalam gelas erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu
121oC selama 15 menit
Media NB (Nutrien Broth) Steril
Dituangkan ke dalam tabung reaksi sebanyak 5 ml
Diambil koloni bakteri dari stok kultur
bakteri Staphylococcus aureus dengan jarum ose
Disuspensikan ke dalam Nutrien Broth (NB)
Diinkubasi pada suhu 35oC selama 2-3 jam
Diukur kekeruhan larutan pada panjang gelombang 580-600 nm sampai diperoleh transmitan 25 ( disamakan kekeruhan dengan standard Mcfarland )
Hasil
Dilakukan hal yang sama untuk bakteri Staphylococcus epidermidis, Escherichia
4. Pengujian Aktivitas Antibakteri Ekstrak Metanol Dan Etil Asetat Daun Pirdot
0,1 ml Inokulum Bakteri
Dimasukkan ke dalam cawan petri steril
Ditambah dengan 15 ml media Muller
Hinton Agar (MHA) dengan suhu 45-50oC
Dihomogenkan sampai media dan bakteri tercampur rata
Dibiarkan sampai media memadat
Dimasukkan kertas cakram yang sudah direndam dengan ekstrak metanol daun pirdot dengan berbagai konsentrasi kedalam cawan petri yang telah berisi bakteri
Diinkubasi selama 18-24 jam pada suhu 35oC
Diukur diameter zona bening di sekitar cakram dengan jangka sorong
Hasil
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Penentuan Kadar Air Serbuk DaunPirdot
Sampel daunPirdot dilakukan analisa kadar air untuk mengetahui kandungan air yang masih terkandung dalam sampel yang telah dikeringkan. Kadar air daun pirdot diperoleh dari hasil perhitungan sebagai berikut :
Berat sampel = 2 g Berat setelah pemanasan = 1,813 g
Kehilangan bobot = 2 g – 1,813g=0,187 g
Kadar air serbuk daunpirdot =Kehilangan bobot
berat sampel
x
100%=
0,187g2 g
x
100%=
9,35 %4.1.2 Ekstraksi Daun Pirdot
Ekstraksi daun pirdot dilakukan secara maserasi menggunakan pelarut metanol dan etil asetat sehingga diperoleh dengan perhitungan sebagai berikut :
Kadar Ekstrak Metanol Daun Pirdot
Berat serbuk metanol = 200 gram Berat ekstrak metanol = 29,83 gram
Kadar ekstrak metanol daun Pirdot = Berat ekstrak
Berat sampel kering x 100 %
= 29,83 gram
200 gram x 100 %
Kadar Ekstrak Etil Asetat Daun Pirdot
Berat serbuk etilasetat = 200 gram Berat ekstrak etil asetat = 10,95gram
Kadar ekstrak etil asetat daun pirdot = Berat ekstrak
Berat sampel kering x 100 %
= 10,95 gram
200 gram x 100 %
= 5,475 %
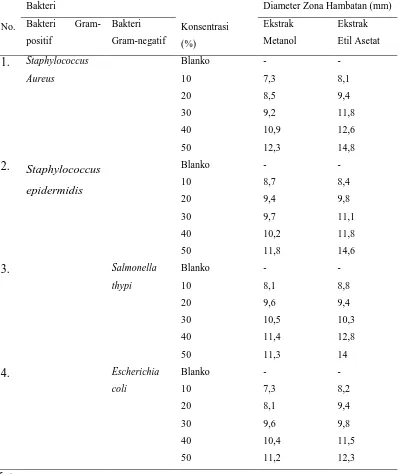
Tabel 4.1. HasilSkrining Fitokimia Ekstrak Metanol dan Etil Asetat Daun Pirdot
No Parameter Pereaksi
Sampel Ekstrak Metanol
Ekstrak Etil Asetat
1 Alkaloida Dragendrorf - -
Bouchardat - -
Mayer - -
Wagner - -
2 Flavonoida NaOH 10 % + +
Mg + HCl pekat + +
3 Tanin FeCl3 5% + -
4 Terpenoid CeSO4 1 % dalam
H2SO4 10 % + +
5 Saponin Aquadest + -
Keterangan :
- = Tidak terdeteksi adanya senyawa metabolit sekunder + = Terdeteksi adanya senyawa metabolit sekunder
4.1.4 Hasil Uji Aktivitas Antioksidan Ekstrak Metanol dan Etil Asetat Daun Pirdot
Ekstrak metanol daun pirdot dilakukan uji aktivitas antioksidan dengan metode DPPH radikal bebas untuk memperoleh nilai IC50 menggunakan spektrofotometer
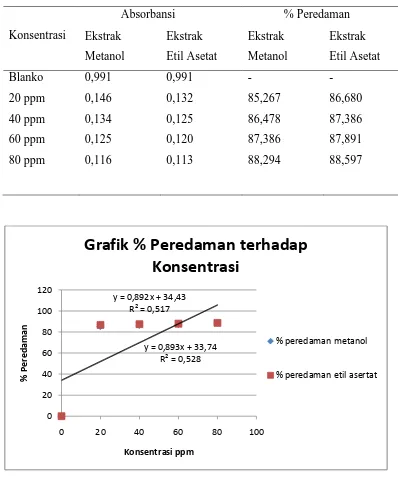
Tabel 4.2 Hasil Pengukuran Absorbansi Ekstrak Metanol dan Ekstrak Etil Asetat Daun Pirdot
Konsentrasi
Absorbansi % Peredaman
Ekstrak
Gambar 4.1 Grafik % Peredaman Vs Konsentrasi Ekstrak Metanol dan Etil Asetat Daun Pirdot.
Persamaan garis regresi dan nilai IC50 yang diperoleh dari ekstrak metanol dan etil
asetat daun pirdotdapat ditunjukkan pada Tabel 4.3 dibawah ini.
y = 0,893x + 33,74
Grafik % Peredaman terhadap
Konsentrasi
% peredaman metanol
Tabel 4.3 Persamaan Garis Regresi dan Nilai IC50 yang diperoleh dari ekstrak
metanol dan etil asetat daun pirdot.
No Sampel Persamaan Garis Regresi IC50
1. Ekstrak Metanol y =0,893x + 33,74 R2 = 0,528
18,193 ppm
2. Ekstrak Etil Asetat y = 0,892x + 34,43 R2 = 0,517
17,454 ppm
4.1.5 Hasil Uji Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun Pirdot
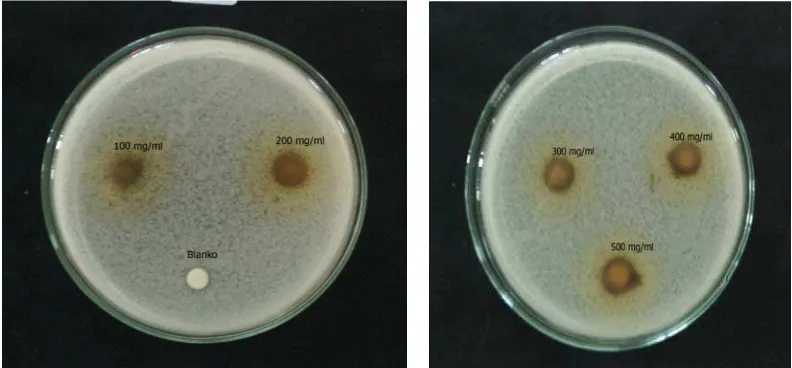
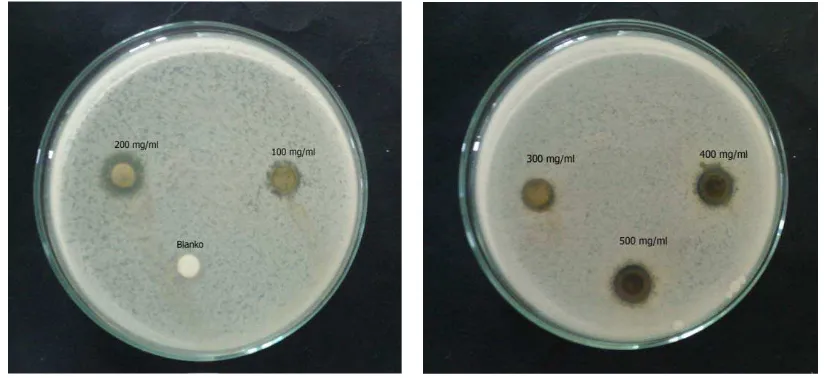
a. Hasil Uji Aktivitas Antibakteri Ekstrak Metanol Daun Pirdot
Aktivitasantibakteri ekstrak metanol daun Pirdotditunjukkandenganterbentuknya zona hambat pada pertumbuhan beberapa bakteri yaitu Escherichia coli,
Staphylococcus epidermidis, Salmonella thypidan Staphylococcus aureus seperti
yang ditunjukkan pada Tabel 4.4 dan gambar 4.2; 4.3; 4.4 dan 4.5dibawahini :
Gambar 4.3Zona hambat bakteri Staphylococcus aureus.
Gambar 4.4 Zona hambat bakteriSalmonellathypi
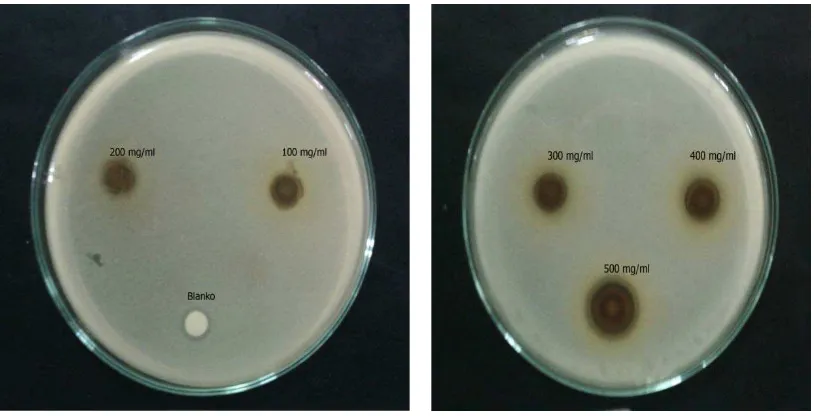
b. Hasil Uji Aktivitas Antibakteri Ekstrak Etil Asetat Daun Pirdot.
Aktivitas antibakteri ekstrak etil asetat daun Pirdot ditunjukkan dengan terbentuknya zona hambat pada pertumbuhan beberapa bakteri yaitu Escherichia
coli, Staphylococcus aureus, Staphylococcus epidermidis dan salmonella thypi
seperti yang ditunjukkan pada Tabel 4.4 dan gambar 4.6; 4.7; 4.8; 4.9 dibawah ini:
Gambar 4.6Zona hambat bakteri Staphylococcus epidermidis.
Gambar 4.8Zona hambat bakteri Salmonellathypi.
Tabel 4.4. Hasil Uji Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun
4.2 Pembahasan
4.2.1 Penentuan Kadar Air Daun Pirdot
Dari hasil penelitian diperoleh kadar air untuk simplisia daun pirdot adalah sebesar 9,35%. Simplisia dinilai cukup aman bila mempunyai kadar air ±10 %. Tujuan dari penentuan kadar air adalah untuk mengetahui batasan maksimal atau rentang besarnya kandungan air didalam bahan. Hal ini terkait dengan kemurnian dan adanya kontaminan dalam simplisia tersebut. Dengan demikian, penghilangan kadar air hingga jumlah tertentu berguna untuk memperpanjang daya tahan bahan selama penyimpanan (Harborne, 1987). Dan juga proses pengeringan didalam prosedur percobaan bertujuan untuk mencegah kerusakan yang ada dalam tanaman sehingga dapat disimpan dalam waktu yang lama dan juga bertujuan untuk mencegah penjamuran pada sampel ,dimana jamur (kapang) dapat berkembang dengan baik dalam simplisia dengan kadar air sekitar 18% (Miryanti
et al, 2011).
4.2.2 Ekstraksi Daun Pirdot
4.2.3 Skrining Fitokimia Kandungan Senyawa Metabolit Sekunder Ekstrak Metanol dan Etil Asetat Daun Pirdot
Skrining fitokimia merupakan tahap pendahuluan dari suatu penelitian yang bertujuan untuk memberikan gambaran tentang golongan senyawa yang terkandung dalam tumbuhan. Berdasarkan hasil skrining fitokimia, golongan senyawa yang terkandung dalam ekstrak metanol adalah flavonoid, tanin, saponin dan terpenoida, sedangkan dalam ekstrak etil asetat adalah flavonoid dan terpenoid dapat dilihat dari Tabel 4.1.
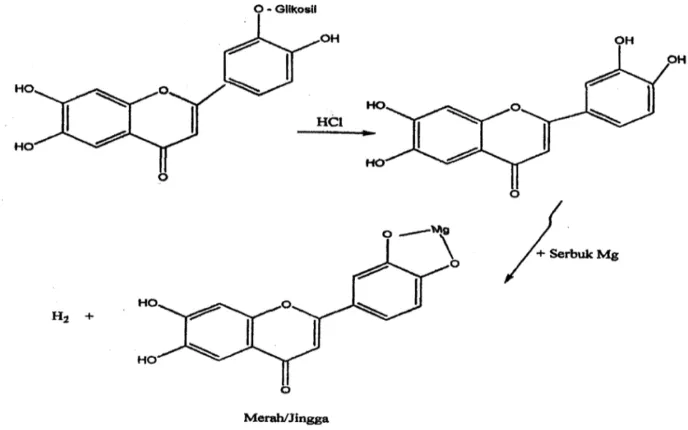
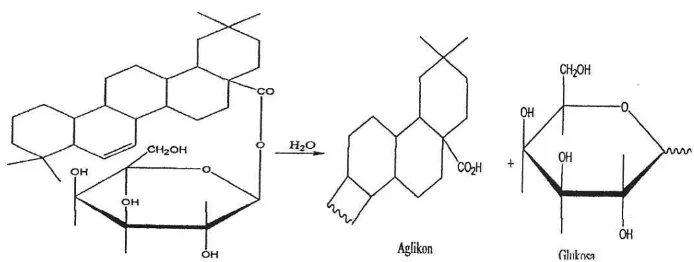
Pada ujiflavonoidapadagambar 4.10, penambahan NaOH pada ekstrak metanol dan etil asetat daun pirdot menghasilkan perubahan warna menjadi biru violet yang menunjukkan kandungan golongan flavonoid. Sedangkan penambahan HCl pekat digunakan untuk menghidrolisis flavonoid menjadi aglikonnya yaitu dengan menghidrolisis O-glikosil. Glikosil akan terganti oleh H+ dari asam karena sifatnya yang elektrofilik. Glikosida berupa gula dapat dijumpai yaitu glukosa, galaktosa, dan ramnosa. Serbuk Mg menghasilkan senyawa yang kompleks yang berwarna merah atau jingga (Sangi et al, 2008).
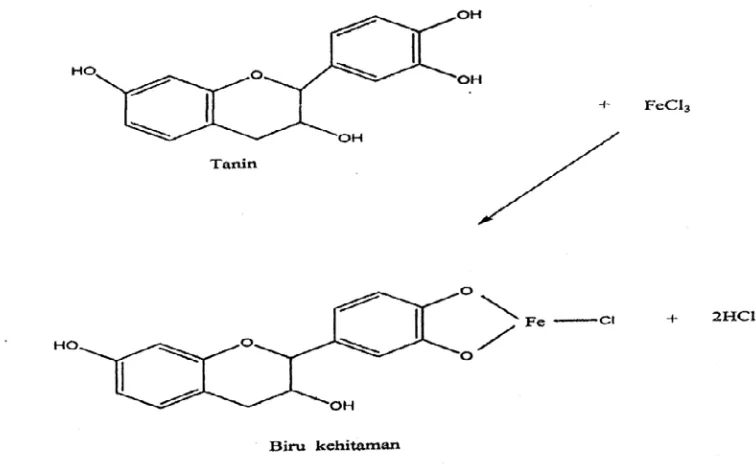
Pengujian tanin padagambar 4.11, dilakukan dengan penambahan larutan FeCl3
5% pada ekstrak metanol daun pirdot sehingga menghasilkan hasil yang positif dan terbentuk warna biru kehitaman. Pada penambahan larutan FeCl3 5%
diperkirakan larutan ini bereaksi dengan salah satu gugus hidroksil yang ada pada senyawa tanin. Pereaksi FeCl3 dipergunakan secara luas untuk mengidentifikasi
senyawa fenol termasuk tanin (Robinson, 1995).
Gambar 4.11Reaksi uji tanin dengan FeCl3 ( Robinson, 1995)
Gambar 4.12 Reaksi hidrolisis saponin dalam air (Robinson, 1995)
Analisis senyawaterpenoid didasarkan pada kemampuan senyawa tersebut membentuk warna dengan penambahan CeSO4 1% dalam H2SO4 10%. Hasil yang
diperoleh menunjukkan hasil positif dengan perubahan warna menjadi merah kecoklatan yang menunjukkan kandungan golongansenyawaterpenoida.
Dari hasil skrining fitokimia ekstrak metanol daun pirdot memberikan hasil positif terhadap golongan senyawa flavonoida, tanin, saponin dan terpenoida dan hasil negatif untuk golongan senyawa alkaloid. Sementara itu untuk ekstrak etil asetat memberi hasil positif terhadap senyawa flavonoid dan terpenoid dan hasil negatif terhadap golongan senyawa alkaloid, tannin dan saponin.Ekstrak metanol daun pirdot mengandung golongan senyawa flavonoid, tanin, saponin dan terpenoida yang dapat tertarik dalam pelarut metanol. Hal ini disebabkan karena metanol merupakan pelarut yang memiliki gugus polar (-OH) dan gugus nonpolar (-CH3) sehingga dapat menarik analit-analit yang bersifat polar,
4.2.4 Uji Aktivitas Antioksidan Ekstrak Metanol dan Etil Asetat Daun Pirdot
Uji aktivitas antioksidan ekstrak metanol dan etil asetat daun Pirdot dengan metode DPPH dengan menggunakan alat spektrofotometri UV Visible. Adapun mekanisme utama peredaman radikal DPPH adalah sebagai berikut:
DPPH• + AH DPPH-H + A•
Pada uji DPPH, peredaman radikal DPPH diikuti dengan pematauan penurunan absorbansi pada panjang gelombang maksimum yang terjadi karena pengurangan radikal oleh antioksidan AH atau reaksi dengan spesi radikal (R) yang ditandai dengan berubahnya warna ungu pada larutan menjadi warna kuning pucat, data yang sering dilaporkan sebagai IC50 merupakan konsentrasi
antioksidan yang dibutuhkan untuk 50 % peredaman radikal DPPH pada periode waktu tertentu (15 – 30 menit) (Pokornya et al, 2001). DPPH merupakan suatu molekul radikal bebas yang distabilkan oleh bentuk resonansi seperti ditunjukkan pada gambar 4.13.
Tabel 4.2 dan 4.3 menujukkan telah terjadi peredaman radikal bebas DPPH setelah penambahan ekstrak metanol dan etil asetat daun pirdot, dimana semakin tinggi konsentrasi maka % peredaman semakin besar yang ditandai dengan menurunnya absorbansi. Dari persamaan Y = ax + b dapat diketahui oleh nilai IC50 dengan memasukkan nilai 50 sebagai sumbu Y, sehingga diperoleh berapa
besar nilai x yang akan mempresentasikan besaran IC50. Dari perhitungan
diperoleh nilai IC50 untuk ekstrak metanol dan etil asetat masing-masing sebesar
18,193 ppm dan 17,454 ppm.
Hasil skrining fitokimia menunjukkan ekstrak metanol dan etil asetat daun pirdot mengandung golongan senyawa kimia berupa flavonoida dan tanin. Flavonoida dan tanin merupakan senyawa fenol yang bersifat sebagai antioksidan (Harbone, 1996). Senyawa – senyawa polifenol mengandung gugus hidroksil yang dapat bertindak sebgai donor hidrogen terhadap radikal bebas (Silalahi, 2006).Reaksi DPPH denganturunanfenoldapatdilihatpadaGambar 4.14.
Gambar 4.14 Reaksi DPPH dengan turunan fenol ( Silalahi, 2006)
pada reaksi netralisasi radikal bebas yang mengawali proses oksidasi atau pada penghentian reaksi radikal berantai yang terjadi (Silalahi,2006). Flavonoid lebihkuatberperansebagaiantioksidanjikadibandingkandengantanin
(Crozier,2006).Ekstraketilasetatlebihkuatsebagaiantioksidandibandingkandengan methanol halinididugakarenalebihbanyaknyakandungan flavonoid yang terdapatpadaekstraketilasetatdibandingkandengan methanol.
Dari literatur dapat diketahui bahwa jika nilai IC50 yang dihasilkan kurang
dari 50, maka senyawa tersebut dapat dikatakan memiliki aktivitas antioksidan yang sangat kuat. Oleh karena itu berdasarkan perhitungan yang diperoleh dapat dikatan bahwa senyawa antioksidan yang terdapat dalam ekstrak metanol dan etil asetat daun pirdot sama-sama memiliki aktivitas antioksidan yang sangat kuat. Tingkat kekuatan senyawa antioksidan menggunakan metode DPPH dapat digolonganpadatabel 4.5 dibawahini:
Tabel 4.5 Penggolongantingkatkekuatanantioksidanmenggunakanmetode DPPH
Intensitas Nilai IC50
Sangat kuat <50 mg/L
Kuat 50-100 mg/L
Sedang 101-150 mg/L
Lemah >150 mg/L
(Ionita, 2005).
4.2.5 Uji Aktivitas Antibakteri Ekstrak Metanol dan Etil Asetat Daun Pirdot
Pada penelitian ini menggunakan bakteri patogen yang berasal dari gram positif dan gram negatif. Bakteri patogen yang digunakan adalah Staphylococcus aureus,
Staphylococcus epidermidis, salmonella thypidan Escherichia coli.
Berdasarkan Clinical and Laboratory Standars Institute (2012) bahwa suatu senyawa memiliki aktivitas antibakteri dengan zona hambat ≤ 14 mm lemah (resistant), 15 hingga 19 mm sedang (intermediate) dan ≥ 20 mm kuat.
Hasil uji aktivitas antibakteri dari ekstrak metanol dan etil asetat dalammenghambat pertumbuhan bakteri Staphylococcus aureus,Staphylococcus
epidermidis, salmonella thypi dan Escherichia colipada tabel 4.4 memperlihatkan
bahwa ekstrak metanolmemiliki aktivitas antibakteri dengan kategori lemah pada konsentrasi 50% dengan zona hambat masing-masing sebesar 11,8 mm; 11,3 mm; 12,3 dan 11,2 mm terhadap bakteri Staphylococcus aureus,Staphylococcus
epidermidis, salmonella thypi dan Escherichia coli.
Sedangkanekstraketilasetatmemilikiaktivitasantibakteridengankategorisedangpada konsentrasi 50% dengan zona hambat masing-masing sebesar 14,8 mm dan 14,6 mm terhadap bakteri Staphylococcus aureus dan Staphylococcus epidermidis
dankategorilemahuntukbakteriSalmonella thypidanEschericia coli denganzonahambatmasing-masing 14 mm dan 12,3 mmpadakonsentrasiekstrak
50%.Adanya perbedaan diameter zona hambat pada kedua bakteri menunjukkan bahwa terdapat perbedaan sentivitas ekstrak pada mikroba uji tersebut. Senyawa yang bersifat sebagai antimikroba dapat menyebabkan kerusakan pada dinding sel serta kerusakan pada membran sel berupa denaturasi protein dan lemak yang menyusun membran sel.Ekstrak metanol dan etil asetat daun pirdotlebih efektif menghambat pertumbuhan bakteri gram positif Staphylococcus aureusdan
Staphylococcus epidermidis dibandingkan dengan bakteri gram negatif
Escherichia colidanSalmonella thypi.
Jawetz, et al (2005) menyatakan bahwa aktivitas antibakteri dipengaruhi oleh beberapa faktor, yaitu konsentrasi ekstrak dan jenis bakteri yang dihambat. Penelitian ini menunjukkan semakin tinggi konsentrasi ekstrak metanol dan etil asetat daun pirdotmaka jumlah senyawa antibakteri yang dilepas semakin besar, dan dapat diketahui bahwa bakteri Staphylococcus aureus, Staphylococcus
berbanding lurus satu sama lain. Hal ini dinyatakan bahwa bakteri gram positif yang membran luarnya terdiri dari lapisan peptidoglikan yang lebih banyak dibandingkan gram negatif yang membran luarnya terdiri dari lipopolisakarida yaitu lipid, polisakarida dan protein, selain itu dinding sel bakteri gram positif terdapat asam teikoat yang mengandung alkohol (gliserol atau ribitol) (Pratiwi, 2008). Dinding sel bakteri gram negatif mengandung peptidoglikan jauh lebih sedikit daripada gram positif sehingga permeabilitas bakteri gram positif lebih rendah dibandingkan permeabilitas bakteri gram negatif. Dengan permeabilitas yang rendah maka zat aktif dari ekstrak metanol dan etil asetat daun pirdot akan mengalami kesulitan untuk menembus membran sel bakteri gram positif sehingga efek bakterinya, kurang optimal peptidoglikan pada sel bakteri yang sedang tumbuh dan menyebabkan kematian sel.
Berdasarkan data hasil uji menunjukkan bahwa ekstrak etil asetat daun pirdot mempunyai aktivitas antibakteri lebih besar dibandingkan ekstrak metanol. Halinididugakarena ekstrak etil asetat mempunyai kadar flavonoid yang lebih besar.Rohman (2006) melaporkan bahwa pelarut etilasetat sangat cocok untuk mengekstraksi senyawa fenolik. Keefektifan antibakteri pada ekstrak etil asetat diduga berkaitan dengan sifat etil asetat yang semi polar sehingga banyak komponen bioaktif yang larut di dalamnya terutama golongan isoflavon, flavon, flavanon, dan flavonol termetoksilasi yang tidak larut dalam pelarut polar yang juga efektif sebagai antibakteri (Monanche, 1996) . Flavonoid mempunyai aktivitas antibakteri karena dapat membentuk kompleks dengan protein ekstra seluler, protein terlarut, dan kompleks dengan dinding sel.Komponen ekstrak etil asetat yang mengandung percabangan gugus fenol maupun alkohol dapat melarutkan fosfolipid. Kondisi asam oleh adanya fenol dapat berpengaruh terhadap pertumbuhan bakteri Staphylococcus aureus, Staphylococcus
epidermidis, Escherichia coli dan Salmonella thypi (Jawetz et al, 1996).Flavonoid
dinding sel Gram positif bersifat lebih polar. Aktivitas penghambatan ekstrak daun pirdot pada bakteri Gram positif menyebabkan terganggunya fungsi dinding sel sebagai pemberi bentuk sel dan melindungi sel dari lisisosmotik. Dengan terganggunya dinding sel akan menyebabkan lisis pada sel (Dewi, 2010).
Volk dan Wheeler (1998) dalam Prajitno (2007) menjelaskan bahwa senyawa flavonoid dapat merusak membran sitoplasma yang dapat menyebabkan bocornya metabolit penting dan menonaktifkan sistem enzim bakteri. Kerusakan ini memungkinkan nukleotida dan asam amino merembes keluar dan mencegah masuknya bahan-bahan aktif kedalam sel, keadaan ini dapat menyebabkan kematian bakteri. Pada perusakan membran sitoplasma, ion H+ dari senyawa fenol dan turunannya (flavonoid) akan menyerang gugus polar (gugus posfat) sehingga molekul fosfolipida akan terurai menjadi gliserol, asam karboksilat dan asam posfat. Hal ini mengakibatkan fosfolipida tidak mampu mempertahankan bentuk membran sitoplasma akibatnya membran sitoplasma akan bocor dan bakteri akan mengalami hambatan pertumbuhan dan bahkan kematian.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Berdasarkan uji skrining fitokimia ekstrak metanol daun pirdot mengandung senyawa flavonoida, terpenoida, tanin dan saponin sedangkan ekstrak etil asetat daun pirdot mengandung senyawa flavonoida dan terpenoida.
2. Hasil uji aktivitas antioksidan ekstrak metanol dan etil asetat daun pirdot termasuk golongan antioksidan yang sangat kuat dimana kedua ekstrak tersebut memiliki nilai IC50 masing-masing sebesar 18,29 ppm
dan 17,66 ppm.
3. Hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak metanol dikategorikan lemah terhadap bakteri S.aureus, S.epidermidis, S.thypi dan E.coli pada konsentrasi 50% dengan zona hambat masing-masing sebesar 12,3 mm; 11,8 mm; 11,3 mm; dan 11,2 mm. Sedangkan untuk eksrtak etil asetat dikategorikan sedang terhadap bakteri S.aureus dan
S.thypi pada konsentrasi 50% dengan zona hambat masing-masing
sebesar 14,8 mmdan 14,6 mm dan kategori lemah terhadap bakteri
S.thypi dan E.coli pada konsentrasi 50% dengan masing-masing zona
hambat sebesar 14 mm dan 12,3 mm 5.2 Saran
1. Perlu dilakukan penelitian lebih lanjut isolasi dan elusidasi struktur komponen kimia senyawa yang bersifat antioksidan dan antibakteri dari daun Pirdot (Saurauia vulcani Korth)
BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Pirdot (Saurauia vulcani Korth)
Tumbuhan pirdot seperti terlihat pada Gambar 2.1 dan hasil identifikasi yang dilakukan di laboratorium Herbarium Medanense, Universitas Sumatera Utara, adalah sebagai berikut :
Dunia : Plantae
Divisio (Divisi) : Magnoliophyta (Spermatophyta) Class (Kelas) : Magnoliospida (Dicotyledonae) Ordo (Bangsa) : Ericales
Familia (Suku) : Actinidiaceae Genus (Marga) : Saurauia
Spesies (Individu) : Saurauia vulcani Korth Nama Daerah : Pirdot (Sumatera Utara)
Saurauia yang dikenal dengan nama cepcepan di daerah Kabupaten Karo merupakan tanaman kecil, perdu, tangkai daun menggugurkan daunnya setiap tahun, daun memiliki dua sisi yang berbeda bagian atas berwarna hijau bagian bawah berwarna coklat pucat, pangkal daun bertoreh dan berlekuk seperti jantung membulat telur sampai lonjong, ujung daun meruncing, tepi daun bergerigi, permukaan daun muda banyak memiliki bulu sesudah dewasa tidak berbulu, helai daun tebal dan kaku, bunga berbentuk cawan terletak pada ketiak daun, letak daun pada batang melingkar 3/4 , daun-daun pelindung membulat telur sampai lonjong meruncing, memiliki 5 tangkai kepala putik (Miquel, 1859).
Genus saurauia hidup pada daerah lembab atau daerah basah seperti dekat air terjun, aliran sungai, jurang, gunung yang lembab, daerah hutan hujan, hutan lumut, dan daerah yang berawan (mendung). Kebanyakan spesies hidup pada tanah yang berpasir, banyak humus, tanah liat, jarang terdapat pada batu (Soejarto, 1980). Daun pirdot digunakan sebagai obat luka dan diabetes dalam pengobatan tradisional (Adiastuti, 2007).
2.2 Seyawa Metabolit Sekunder
prekursor bagi sintesis obat baru atau prototipe obat beraktivitas tertentu (Rasyid,2012). Identifikasi ini merupakan uji fitokimia. Metode yang dilakukan merupakan metode uji berdasarkan yang telah dimodifikasi. Uji yang dilakukan antara lain uji flavonoid, senyawa fenolik, alkaloid, saponin, tanin dan terpenoid (Harbone, 1987).
2.2.1 Flavonoid
Flavanoid merupakan senyawa polar yang umunya mudah larut dalam pelarut polar yang umumnya mudah larut dalam pelarut polar seperti etanol, metanol, dan aseton (Markham, 1998).
Flavonoid merupakan golongan terbesar dari senyawa fenol, senyawa fenol mempunyai sifat efektif menghambat pertumbuhan virus, bakteri, dan jamur. Khunaifi (2010) menambahkan bahwa senyawa-senyawa flavonoid umumnya bersifat antioksidan banyak telah digunakan sebagai komponen bahan baku obat-obatan. Senyawa flavonoid dan turunannya memiliki dua fungsi fisiologi tertentu, yaitu sebagai bahan kimia untuk mengatasi serangan penyakit (sebagai antibakteri) dan anti virus bagi tanaman. Para peneliti lain juga menyatakan pendapat sehubungan dengan mekanisme kerja dari flavonoid dalam menghambat pertumbuhan bakteri,antara lain bahwa flavanoid terjadinya kerusakan permeabilitas dinding sel bakteri (Sabir, 2008). Flavonoida pada tumbuhan berfungsi dalam pengaturan fotosintesis, kerja antimikroba dan antivirus dan kerja terhadap serangga (Robinson, 1995). Adapun fungsi flavonoida dalam kehidupan manusia yaitu sebagai stimulant pada jantung, hesperidin mempengaruhi pembuluh darah kapiler. Flavon terhidrolisasi bekerja sebagi diuretik dan antioksidan pada lemak (Sirait, 2007).
Efek flavonoid terhadap macam-macam organisme sangat banyak macamnya dan dapat dijelaskan mengapa tumbuhan yang mengandung flavonoid dipakai dalam pengobatan tradisional. Flavonoid dapat bekerja sebagai inhibitor kuat pernapasan. Beberapa flavonoid menghambat fosfodiesterase. Flavonoid lain menghambat aldoreduktase, monoamonia oksidase, protein kinase, balik
Kerangka dasar karbon pada flavonoid merupakan kombinasi antara jalur sikhimat dan jalur asetat-malonat yang merupakan dua jalur utama biosintesis cincin aromatik. Cincin A dari struktur flavonoid berasal dari jalur poliketida (jalurasetat-malonat), yaitu kondensasi tiga unit asetat atau malonat, sedangkan cincin B dan tiga atom karbon dari rantai propan berasal dari jalur fenil propanoid (jalur sikhimat) (Achmad, 1985).
Markham (1988) menyatakan bahwa flavonoid pertama yang dihasilkan pada alur biosintesis flavonoid ialah khalkon, dan semua bentuk lain diturunkan darinya melalui berbagai alur (Gambar 2.2). Semua golongan flavonoid saling berkaitan, Karena berasal dari alur biosintesis yang sama. Cincin A terbentuk karena kondensasi ekor-kepala dari tiga unit asam asetat-malonat atau berasal dari jalur poliketida. Cincin B serta satu atau tiga atom karbon dari rantai propan yang merupakan kerangka dasar C6 – C3 berasal dari jalur asam sikimat (Manitto, 1981).
Berikut merupakan alur biosintesis flavonoid:
2.2.2 Alkaloid
Alkaloid merupakan senyawa kimia bersifat basa yang mengandung satu atau lebih atom nitrogen, umumnya tidak berwarna, dan berwarna jika mempunyai struktur kompleks dan bercincin aromatik. Alkaloid pada umumnya juga mempunyai kereaktifan fisiologi yang menonjol, sehingga oleh manusia alkaloida sering dimanfaatkan sebagai pengobatan. Secara kimia, alkaloid merupakan suatu golongan heterogen. Secara fisik, alkaloida dipisahkan dari kandungan tumbuhan lainnya sebagai garamnya dan sering diisolasi sebagai kristal hidroklorida atau pikrat (Harbone, 1987).
Alkaloid merupakan golongan zat tumbuhan sekunder yang terbesar. Alkaloid memiliki kemampuan sebagai antibakteri. Mekanisme yang diduga adalah dengan cara mengganggu komponen penyusun peptidoglikan pada sel bakteri,sehingga lapisan dinding sel terbentuk secara utuh dan menyebabkan kematian sel tersebut (Robinson, 1995).
Menurut Hegnauer, alkaloid dikelompokkan sebagai berikut : a. Alkaloid sesungguhnya
Alkaloid sesungguhnya adalah racun, senyawa tesebut menunjukkan aktivitas phisiologi yang luas, hampir tanpa terkecuali bersifat basa ; lazim menggunakan nitrogen dalam cincin heterosiklis, diturunkan dari asam amino, biasanya terdapat dalam tanaman sebagai garam basa organik. Beberapa perkecualian terhadap aturan tersebut adalah kolkhisin dan asam aristolokhat yang bersifat bukan basa dan tidak memiliki cincin heterosiklis dan alkaloid kuartener yang bersifat agak asam.
b. Protoalkaloid
c. Pseudoalkaloida
Pseudoalkaloida tidak diturunkan dari prekursor asam amino. Senyawaini biasanya bersifat basa. Ada dua seri alkaloid yang penting dalam kelas ini, yaitu alkaloid stereoidal (contoh, konnesin) dan purin (contoh, kafein ) (Sastrohamidjojo, 1996).
Biosintesis Benzylisoquinoline alkaloid dimulai dengan tahap
dekarboksilasi, orto-hidroksilasi dan deaminasi yang mengkonversi tirosin baik
dopamin dan 4-hidroksifenil acetaldehid (4-HPAA) (Gambar 2.3). Molekul klon
untuk senyawa aromatik asam dekarboksilase l-amino (TYDC) yang
mengkonversi tirosin dan dopa menjadi tirosin dan dopamin, masing-masing,
telah diisolasi. Kondensasi Norcoclaurine sintase (NCS) dengan dopamin dan
4-HPAA menghasilkan (S)-norcoclaurine, yang merupakan prekursor pusat untuk
semua benzylisoquinoline alkaloid pada tanaman. (S)-Norcoclaurine dikonversi
ke (S)-reticuline oleh 6-O-metiltransferase (6OMT), N-metiltransferase (CNMT),
hidroksilase P450 (CYP80B) dan 4-O-metiltransferase (4 OMT). Molekul klon
telah diisolasi untuk semua enzim yang terlibat dalam konversi (S)-norcoclaurine
ke (S)-reticuline, yang merupakan cabang-titik menengah dalam biosintesis
berbagai jenis benzylisoquinoline alkaloid. Intermediet dari jalur (S)-reticuline
juga berfungsi sebagai prekursor untuk lebih dari 270 dimer alkaloid
bisbenzylisoquinoline seperti (+)-Tubokurarin. Molekul klon untuk oksidasi P450
(CYP80A) dengan (R) N-metilcoclaurine ke (R) atau (S) N-metilcoclaurine untuk
menghasilkan bisbenzylisoquinoline alkaloid, yang masing-masing telah diisolasi
dari barberry (Berberis stolonifera). Banyak pekerjaan telah difokuskan pada jalur
cabang yang mengarah ke benzophenanthridine alkaloid, seperti sanguinarine,
alkaloid protoberberine, seperti berberin, dan morphinan alkaloid , seperti morfin .
Sebagian besar enzim yang terlibat dalam jalur ini , dimana ada lima enzim sesuai
dengan molekul klon , telah diisolasi ( Gambar 2.3 ) . Langkah pertama yang
dilakukan dalam biosintesis benzophenanthridine dan protoberberine alkaloid
melibatkan konversi (S)-reticuline ke (S)-scoulerine oleh jembatan enzim
berberin (BBE) . (S)-Scoulerine dapat dikonversi ke (S)-stylopine oleh dua
oksidase P450 . Setelah N-metilasi (S)-stylopine oleh metiltransferase tertentu,
dihydrosanguinarine, yang teroksidasi untuk menghasilkan sanguinarine. Eksudat
dari banyak sepsis Papaveraceae, seperti Sanguinaria Canadensis dan Eschsholzia
californica, berwarna merah karena akumulasi sanguinarine dan alkaloid
benzophenanthridine lainnya. Dalam beberapa tanaman, terutama berberidaceae
dan Ranunculaceae, (S)-scoulerine termetilasi oleh SAM
scoulerine-9-O-metiltransferase (SOMT) untuk menghasilkan (S)-tetrahydrocolumbamine
(Gambar2.3). Molekuler Klon untuk SOMT dan P450 (S)-synthase canadine
(CYP719A), yang mengubah (S)-tetrahydrocolumbamine ke (S)-canadine, telah
diisolasi. (S)-Canadine teroksidasi untuk menghasilkan berberin. Pada beberapa
spesies papaver, (S)-reticuline yang epimeris ke (R)-reticuline sebagai langkah
pertama dalam biosintesis alkaloid morphina. Selanjutnya, (R)-reticuline diubah
dalam dua langkah ke (7S)-salutaridinol oleh enzim P450 dan sebuah oksidoreduk
tase NADPH. Morphina alkaloid tebain dihasilkan dari (7S)-salutaridinol melalui
asetil koenzim A: salutaridinol-7-O-asetiltransferase (SAT). Tebain diubah
menjadi codeinone, dengan mereduksi codeine oleh enzim NADPH
codeinnonereduktase (COR). Molekuler SAT dan COR telah diisolasi dari opium
poppy. Tahap ahir, kodein demetilasi untuk menghasilkan morfin (Crozier et al,
Berikut merupakan alur biosintesis dari alkaloid :
2.2.3 Terpenoid
Terpenoid adalah senyawa alam yang terbentuk dengan proses biosintesis, terdistribusi luas dalam dunia tumbuhan dan hewan. Terpenoid ditemui tidak saja pada tumbuhan tingkat tinggi namun juga pada terumbu karang dan mikroba. Struktur terpenoid dibangun oleh molekul isoprena, CH2=C(CH3)-CH=CH2,
kerangka terpenoid terbentuk dari dua atau lebih banyak satuan unit isoprena (C5).
Terpenoid yang disebut juga isoprenoid, diklasifikasikan atas jumlah unit isoprena yang membangunnya, dengan demikian ada yang terdiri atas dua (C10), tiga (C15),
empat (C20), enam (C30), atau delapan (C40) isoprena. Terpenoid dapat juga
dikelompokkan menjadi monoterpen, seskuiterpen, diterpen, triterpen dan tetraterpen. Senyawa terpenoid berkisar dari senyawa volatil, yaitu komponen minyak atsiri, yang merupakan mono dan seskuiterpen (C10 dan C15), senyawa
yang kurang volatil, yakni diterpen (C20), sampai senyawa nonvolatil seperti
triterpenoid dan sterol (C30) seperti karatenoid (Sirait, 2007).
Beberapa hasil penelitian menunjukkan bahwa senyawa terpenoid dapat menghambat pertumbuhan dengan mengganggu proses terbentuknya membran dan atau dinding sel,membran atau dinding sel tidak terbentuk atau terbentuk tidak sempurna (Ajizah, 2004).
Secara umum biosintesa terpenoida terjadinya dengan 3 tahap reaksi dasar yaitu: 1. Pembentukan isoprena aktif berasal dari asam asetat melalui asam mevalonat. Asam asetat setelah diaktifkan oleh koenzim A (Ko-A) melakukan kondensasi jenis Claisen menghasilkan Asetoasetil Ko-A. Senyawa ini dengan Asetil Ko-A melakukan kondensasi jenis Aldol menghasilkan rantai karbon bercabang sebagaimana ditemukan pada asam mevalonat yang terlihat pada gambar 2.4 (Pinder,1960).
Gambar 2.4 Pembentukan Asam Mevalonat (Pinder, 1960)
2. Penggabungan kepala dan ekor dua unit isoprena akan membentuk mono-, seskui-, di-, sester-, dan poli- terpenoida.
Penggabungan ini terjadi karena serangan elektron dari ikatan rangkap IPP terhadap atom karbon dari DMAPP yang kekurangan elektron diikuti oleh penyingkiran ion pirofosfat mengasilkan Geranil Pirofosfat (GPP) yaitu senyawa antarsemua senyawa monoterpenoida. Penggabungan selanjutnya antara satu unit IPP dan GPP dengan mekanisme yang sama menghasilkan Farnesil Pirofosfat (FPP) yang merupakan senyawa antara bagi semua senyawa seskuiterpenoida. Senyawa diterpenoida diturunkan dari Geranil – Geranil Pirofosfat (GGPP) yang berasal dari kondensasi antara satu unit IPP dan GPP dengan mekanisme yang sama terlihat pada gambar 2.5 (Pinder, 1960).
+
3. Penggabungan ekor dan ekor dari unit C15 atau unit C20 menghasilkan
triterpenoida dan steroida.
Triterpenoida (C30) dan tetraterpenoida (C40) berasal dari dimerisasi C15 atau C20
dan bukan dari polimerisasi terus-menerus dari unit C5. Yang banyak diketahui
ialah dimerisasi FPP menjadi skualena yang merupakan triterpenoida dasar dan sumber dari triterpenoida lainnya dan steroida yang terlihat pada gambar 2.6. Siklisasi dari skualena menghasilkan tetrasiklis triterpenoida lanosterol ( Pinder, 1960).
Farsenil Pirofosfat (TPP)
OPP
Skualen
Gambar 2.6 Pembentukan Skualen (Triterpenoida Dasar) (Pinder, 1960)
2.2.4 Saponin
Saponin merupakan glukosida yang larut dalam air dan etanol,tetapi tidak larut dalam eter. Saponin bekerja sebagai antibakteri dengan mengganggu stabilitas membran sel bakteri sehingga menyebabkan sel bakterilisis,jadi mekanisme kerja saponin termasuk dalam kelompok antibakteri yang mengganggu pemeabilitas membran sel bakteri, yang mengakibatkan kerusakan membran sel dan menyebabkan keluarnya berbagai kompone penting dari dalam sel bakteri yaitu protein, asam nukleat dan nukleotida (Ganiswarna,1995).
2.2.5 Tanin
Tanin merupakan salah satu metabolit sekunder yang dapat digunakan tumbuhan untuk melindungi dari serangan bakteri dari cendawan (Salisbury, 1995).
Apabila tanin direaksikan dengan air membentuk larutan koloid yang memberikan reaksi asam dan reaksi yang tajam (Harborne, 1996). Tanin memiliki peranan fisiologis yang kompleks mulai dari pengendap protein hingga pengkhelat logam. Tanin juga dapat berfungsi sebagai antioksidan biologis (Hagerman, 2002).
Secara kimia terdapat dua jenis tanin yang tersebar tidak merata dalam dunia tumbuhan yaitu tanin terkondensasi (Proantosianidin) dan tanin terhidrolisis (Hydrolyzable tannin) (Harbone, 1987). Kedua golongan tanin menunjukkan reaksi yang berbeda dalam larutan garam Fe (III). Tanin terkondensasi menghasilkan warna hijau kehitaman sedangkan tanin terhidrolisis memberikan biru kehitamanan.
1. Tanin terhidrolisis
HO
Gambar 2.7 Biosintesis Galotanin (Crozieret al, 2006)
Selain membentuk galotanin, dua asam galat akan membentuk tanin terhidrolisis yang disebut elagitanin. Elagitanin sederhana disebut juga ester asam
hexahydroxydiphenic (HHDP) (Hagerman, 2002). Senyawa ini dapat terpecah
2. Tanin terkondensasi
Tanin terkondensasi secara biosintesis dapat dianggap terbentuk dengan cara kondensasi katekin tunggal (galokatekin) yang membentuk senyawa dimer dan kemudian oligimer yang lebih tinggi. Proantosianidin merupakan nama lain dari tanin terkondensasi karena jika direaksikan dengan asam panas, beberapa ikatan karbon penghubung satuan terputus dan dibebaskanlah monomer antosianidin (Harborne, 1987).Tanin jenis ini biasanya tidak dapat dihidrolisis. Tanin jenis ini kebanyakan terdiri dari polimer flavonoid yang merupakan senyawa fenol. Nama lain dari tanin ini adalah proantosianidin. Proantosianidin merupakan polimer dari flavonoid, salah satu contohnya adalah Sorghum procyanidin (tertera pada Gambar 2.5), senyawa ini merupakan trimer yang tersusun dari epiccatechin dan
catechin (Hagerman, 2002).Senyawa ini jika dikondensasi maka akan
HOOC
( Flavon) Naringenin( Flavanon) Genistein( Isoflavon)
Daidzein
( Flavonol) Dihidrokamferol( Dihidroflavanol)
O
( Tanin Terkondensasi )
2.3 Ekstraksi
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati dan simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yangtersisa diperlakukan sedemikian hingga memenuhi baku yang ditetapkan. Ekstraksi adalah suatu proses pemisahan kandungan senyawa kimia dari jaringan tumbuhan atau hewan dengan menggunakan penyari tertentu (Depkes RI, 2000). Berdasarkan prinsipnya, proses ekstraksi dapat berlangsung bila terdapat kesamaan dalam sifat kepolaran antara senyawa yang diekstraksi dengan senyawa pelarut. Suatu zat memiliki kemampuan terlarut yang berbeda dalam pelarut yang berbeda. Hal ini menunjukkan adanya interaksi antara zat terlarut dengan pelarut. Senyawa polar akan larut dalam pelarut polar, begitu juga sebaliknya. Sifat penting yang harus diperhatikan dalam pemilihan pelarut adalah kepolaran senyawa yang dilihat dari gugus polarnya (seperti OH, COOH, dan lain sebagainya). Hal ini yang perlu diperhatikan dalam pemilihan pelarut adalah selektivitas, kemampuan untuk mengekstrak, toksisitas, kemudahan untuk diuapkan, dan harga (Harbone, 1987).
Metode ekstraksi dengan menggunakan pelarut dapat dilakukan dengan beberapa cara :
1. Maserasi
2. Perkolasi
Perkolasi berasal dari kata “colore”artinya menyerkai dan “per”artinya menembus. Dengan demikian,perkolasi adalah suatu cara penarikan simplisia dengan menggunakan alat yang disebut perkolator dimana simplisia terendam dalam cairan penyari, zat-zat akan terlarut dan larutan tersebut akan menetes secara beraturan (Syamsuni,2006). Prosesnya terdiri dari tahapan pengembangan bahan, tahap perendaman antara, tahap perkolasi sebenarnya (penetesan/penampungan perkolat) sampai diperoleh ekstrak (Depkes,2000). Keuntungan dari metode perkolasi ini adalah proses penarikan zat berkhasiat dari tumbuhan lebih sempurna,sedangkan kerugiannya adalah membutuhkan waktu yang lama dan peralatan yang digunakan mahal (Agoes,2007).
3. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan pelarut akan terdestilasi menuju pendingin dan akan kembali ke labu (Depkes,2000).
4. Sokletasi
Sokletasi adalah ekstraksi kontinu menggunakan alat soklet,dimana pelarut akan terdestilasi dari labu menuju pendingin,kemudian jatuh membasahi dan merendam sampel yang mengisi bagian tengah alat soklet setelah pelarut mencapau tinggi tertentu maka akan tirin ke labu destilasi, demikian berulang-ulang (Depkes,2000).
5.Infudasi
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air atau bejana infus tercelup dalam penangas air mendidih pada temperatur 96 o C selama 15-20 menit (Depkes,2000).
6.Dekoktasi
2.4 Radikal bebas
Radikal bebas adalah atom atau senyawa yang kehilangan pasangan elektronnya (Kumalaningsih, 2006). Radikal bebas adalah atom atau molekul yang tidak stabil dan sangat reaktif karena mengandung satu atau lebih elektron tidak berpasangan pada orbital terluarnya. Untuk mencapai kestabilan atom atau molekul, radikal bebas akan bereaksi dengan molekul di sekitarnya untuk memperoleh pasangan elektron (Maulida, 2010). Radikal bebas dapat dihasilkan dari metabolisme tubuh sendiri, dan bisa pula lewat eksternal seperti lingkungan sekitar kita (Iswari, 2011).
Rangkaian reaksi yang membentuk radikal bebes dapat dibagi menjadi tiga langkah yang berbeda yaitu inisiasi, propagasi, terminasi. Inisiasi adalah proses awal dimana jenis radikal tertentu akan bereaksi dengan asam lemak dalam tubuh membentuk radikal alkil (R•).
Tahap selanjutnya propagasi dimana radikal alkil dapat bereaksi dengan oksigen menghasilkan radikal peroksil (ROO•) kemudian radikal peroksil selanjutnya bereaksi dengan asam lemak tubuh membentuk peroksida lipid (ROOH)dan radikal alkil (R•). Pada tahap terminasi radikal peroksil dapat bereaksi dengan sesama peroksil menghasilkan senyawa yang tidak bersifat radikal, radikal alkil juga dapat bereaksi dengan sesamanya membentuk senyawa yang tidak radikal, peroksil dapat bereaksi dengan alkoksil membentuk senyawa yang tidak radikal. Berikut gambaran rangkaian pembentukan radikal bebas dalam tubuh:
1. Inisiasi
X•+ RH R• + X H 2. Propagasi
R• + O2 ROO•
3. Terminasi
ROȮ• + ROO• ROOR non radikal ROO•+ R• ROOR non radikal R• + R• R 2 non radikal
Keterangan:
R• : Radikal Alkil ROOH : Lipid Peroksida ROO• : Radikal Peroksida X• : Jenis Radikal Bebas
RH : Asam Lemak Dalam Tubuh
(Cui K et al, 2004,di dalam Roking,2007). 2.5 Antioksidan
Antioksidan adalah senyawa yang mempunyai struktur molekul yang dapat memberikan elektronnya kepada molekul radikal bebas dan dapat memutus reaksi berantai dari radikal bebas (Kumalaningsih, 2006).
menyebabkan atom atau molekul sangat terpengaruh oleh medan magnet. Energi untuk memutuskan ikatan kovalen berasal dari panas, radiasi elektromagnetik atau reaksi redoks berlebihan. Hilang atau bertambahnya satu elektron pada molekul lain menyebabkan terjadinya radikal bebas baru dan mengakibatkan perubahan dramatis secara fisik dan kimiawi dalam tubuh manusia. Mula-mula diransang (initiation) terjadinya radikal bebas, kemudian radikal bebas cenderung bertambah banyak membentuk (propagasi) rantai reaksi dengan molekul lain. Senyawa reaksi berantai ini mempunyai massa paruh yang lebih panjang dan potensial menyebabkan kerusakan sel. Fase inisiasi dan propagasi dapat dinetralisir oleh antioksidan yang berasal dari endogen dan eksogen (Kosasih, 2004).
Menurut Kosasih (2004), antioksidan tubuh dikelompokkan menjadi tiga yaitu : 1. Antioksidan primer yang berfungsi untuk mencegah pembentuk senyawa
radikal baru karena dapat merubah radikal bebas yang ada menjadi molekul yang berkurang dampak negatifnya, sebelum radikal bebas ini sempat bereaksi.
Contoh : enzim superoksida dismutase (SOD) yang berfungsi sebagai pelindung hancurnya sel-sel dalam tubuh karena radikal bebas.
2. Antioksidan sekunder adalah senyawa yang berfungsi menangkap senyawa serta mencegah terjadinya reaksi berantai.
Contoh: Vitamin E, C dan beta karoten yang diperoleh dari berbagai buah. 3. Antioksidan tersier adalah senyawa yang memperbaiki kerusakan sel-sel dan
jaringan yang disebabkan radikal bebas.