ISOLASI DAN PEMURNIAN XANTORIZOL DARI TEMU
LAWAK (
Curcuma xanthorrhiza
Roxb.)
WINA APRIANI SUTISNA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
WINA APRIANI SUTISNA. Isolasi dan Pemurnian Xantorizol dari Temu Lawak
(Curcuma
xanthorrhiza
Roxb.)
.
Dibimbing
oleh
LATIFAH
KOSIM
DARUSMAN dan RUDI HERYANTO.
Xantorizol adalah komponen aktif utama dalam minyak atsiri temu lawak.
Xantorizol berfungsi sebagai antifungi, antibakteri, antioksidan dan anti-inflamasi.
Xantorizol sebelumnya telah berhasil diisolasi dengan menggunakan berbagai
metode, salah satunya yaitu metode Asriani (2010) dengan cara ekstraksi pelarut
(etanol 96%), asetilasi, Kromatografi Lapis Tipis Preparatif (KLTP) dan
deasetilasi yang menghasilkan xantorizol dengan kemurnian 99%. Xantorizol
yang diperoleh masih belum murni karena ditemukan adanya campuran dengan
senyawa lain. Penelitian ini melakukan isolasi xantorizol menggunakan tiga
metode modifikasi dari metode Asriani. Metode modifikasi I yaitu melakukan dua
kali ekstraksi, yaitu menggunakan pelarut etanol dan heksana. Metode modifikasi
II yaitu melakukan tiga kali ekstraksi, yaitu menggunakan pelarut etanol, heksana,
dan dietil eter. Metode modifikasi III yaitu melakukan dua kali ekstraksi
menggunakan pelarut etanol dan heksana serta melakukan KLTP tahap II pada
ekstrak hasil deasetilasi. Metode modifikasi I dan II masing-masing menghasilkan
xantorizol dengan kemurnian 78.1 dan 80.1% untuk ekstrak etanol, serta 80.1 dan
88.1% untuk ekstrak heksana. Metode modifikasi III berhasil mengisolasi
xantorizol dengan kemurnian yang paling tinggi yaitu 94.3%. Hasil analisis
GC-MS menunjukkan salah satu dari dua puncak yang muncul yaitu pada waktu
retensi 11.44 menit dengan luas area 94.3% dan BM 218.0 adalah xantorizol.
Hasil ketiga metode modifikasi masih lebih rendah dari metode Asriani, sehingga
metode Asriani masih lebih baik dan lebih efisien.
ABSTRACT
WINA APRIANI SUTISNA. Isolation and Purification of Xanthorrhizol from
Temu Lawak (Curcuma xanthorrhiza Roxb.). Under direction of LATIFAH
KOSIM DARUSMAN and RUDI HERYANTO.
Xanthorrhizol is the main active component in the essential oil of temu lawak
(Curcuma xanthorriza
Roxb.). Xanthorrhizol has antifungal, antibacterial,
antioxidant, and anti-inflammatory activities. Xanthorrhizol is isolated by Asriani
(2010) using solvent extraction (ethanol 96%), acetylation, Preparative Thin
Layer Chromatography (PTLC), and deacetylation, which produce xanthorrhizol
with 99% purity. The xanthorrhizol obtained is not pure because there are still
other compounds in the mixture. This research perfoms xanthorrhizol isolation
using three different modifications based on Asriani
’s
method. The modified
method I conducts two-times extraction: ethanol and hexane extractions. The
modified method II conducts three-times extraction: ethanol, hexane, and diethyl
ether extractions. The modified method III conducts two-times extraction using
ethanol and hexane as solvents, and also conduct PTLC phase II in order to
extract the deacetylated product. The modification method I and II produce
xanthorrhizol with purity 78.1 and 80.1 % for ethanol extract, and 80.1 and 88.1
% for hexane extract, respectively. Modified method III is able to isolate
xanthorrhizol with the highest purity, i.e. 94.3%. GC-MS analysis to the product
shows that one of the two peaks appeared at the retention time of 11.44 minutes
with an area of 94.3% and MW 218.0 is xanthorrhizol. The results from all of
these modified methods
were lower than Asriani’s method
, which comes to the
conclusion that Asriani
’s
method is better and more efficient.
ISOLASI DAN PEMURNIAN XANTORIZOL DARI TEMU
LAWAK (
Curcuma xanthorrhiza
Roxb.)
WINA APRIANI SUTISNA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Isolasi dan Pemurnian Xantorizol dari Temu Lawak (Curcuma
xanthorrhiza Roxb.)
Nama : Wina Apriani Sutisna
NIM : G44070032
Disetujui
Pembimbing I,
Pembimbing II,
Prof Dr. Ir. Latifah K. Darusman, MS
Rudi Heryanto, S.Si., M.Si
NIP 19530824 197603 2 001 NIP 19760428 200501 1 002
Diketahui
Ketua Departemen Kimia,
Prof. Dr. Ir. Tun Tedja Irawadi, MS.
NIP 19501227 197603 2 002
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT karena atas rahmat
dan pertolongan-Nya penulis dapat menyelesaikan karya tulis yang berjudul
Isolasi dan Pemurnian Xantorizol dari Temu Lawak (Curcuma Xanthorrhiza
Roxb.). Penelitian ini dilaksanakan dari bulan Mei 2011 sampai Februari 2012
yang bertempat di Laboratorium Kimia Analitik, Departemen Kimia, Institut
Pertanian Bogor, dan Pusat Studi Biofarmaka Bogor.
Penulis mengucapkan terima kasih banyak kepada Prof. Dr. Ir. Latifah K.
Darusman, MS selaku pembimbing pertama dan Rudi Heryanto, S.Si, M.Si selaku
pembimbing kedua atas bimbingan yang telah diberikan kepada penulis selama
penelitian dan penyusunan karya ilmiah ini. Terima kasih penulis ucapkan kepada
Pusat Studi Biofarmaka yang telah memberikan kesempatan kepada penulis untuk
meneliti dalam materi temu lawak. Terima kasih juga atas bantuan yang telah
diberikan oleh para staf Laboratorium Kimia Analitik (Pak Eman, Bu Nunung,
Pak Dede, Pak Engkos) dan staf Laboratorium Biofarmaka (Mba Wiwi, Bu
Nunuk, Pak Zaim, Mas Antonio, Mas Endi, Mba Ina) yang telah membantu dalam
teknis penelitian. Kemudian terima kasih penulis ucapkan untuk rekan-rekan kerja
di Laboratorium Kimia Analitik (Pita, Ilfa, Hanifah, Ichsan, Niati, Kak Redo, Mba
Meysi, Teh Diah, Teh Irma) yang telah ikut memberikan bantuan teknis, serta tak
lupa untuk Mamah, Bapak, dan keluarga yang senantiasa mendoakan penulis.
Semoga tulisan ini dapat bermanfaat bagi penulis maupun bagi pembaca.
Bogor, Juni 2012
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 5 April 1989 dari Bapak Entis
Sutisna dan Ibu Nuni Rusmini. Penulis merupakan putri kedua dari dua
bersaudara.
Tahun 2001 penulis menyelesaikan sekolah di SDN Ciwidey II dan pada
tahun 2004 penulis menyelesaikan sekolah di SMPN 1 Ciwidey. Tahun 2007
penulis lulus dari SMAN 1 Ciwidey dan pada tahun yang sama lulus seleksi
masuk IPB melalui jalur Undangan Seleksi Masuk IPB pada Program Studi
Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
METODE ... 3
Bahan dan Alat ... 3
Lingkup Kerja ... 3
HASIL DAN PEMBAHASAN ... 4
Metode Modifikasi I ... 4
Metode Modifikasi II ... 8
Metode Modifikasi III ... 10
Perbandingan Hasil Isolasi Metode Asriani dengan Metode Modifikasi ... 11
SIMPULAN DAN SARAN ... 12
Simpulan ... 12
Saran ... 12
DAFTAR PUSTAKA ... 12
DAFTAR GAMBAR
Halaman
1 Tanaman Temu Lawak... 2
2 Irisan Rimpang Temu Lawak ... 2
3 Struktur Kimia Xantorizol ...
24 Perbandingan Spektrum FTIR Ekstrak Etanol dan Ekstrak Heksana
Metode Modifikasi I Sebelum dan Setelah Asetilasi ... 5
5 Skema Reaksi Asetilasi Xantorizol ...
56 Profil KLTP Ekstrak Etanol dan Ekstrak Heksana ...
67 Perbandingan Spektrum FTIR Ekstrak Etanol dan Ekstrak Heksana
Metode Modifikasi I Sebelum dan Setelah Deasetilasi ... 7
8 Profil KLT Ekstrak Etanol dan Ekstrak Heksana Hasil Deasetilasi ... 8
9 Perbandingan Spektrum FTIR Ekstrak Etanol dan Ekstrak Heksana
Metode Modifikasi II Sebelum dan Setelah Asetilasi ... 9
10 Profil KLT Dugaan Xantorizol Ekstrak Etanol dan Ekstrak Heksana
Metode Modifikasi II ... 9
11 Perbandingan Spektrum FTIR Ekstrak Etanol dan Ekstrak Heksana
Metode Modifikasi II Sebelum dan Setelah Deasetilasi ... 10
12 Profil KLT Dugaan Xantorizol Hasil KLTP Tahap II ... 11
DAFTAR LAMPIRAN
Halaman
1 Bagan Alir Penelitian.. ... 15
2 Data Kadar Air ... 16
3 Profil Kromatogram Standar Xantorizol 100 ppm ... 17
4 Profil Kromatogram Ekstrak Etanol Metode Modifikasi I ... 18
5 Profil Kromatogram Ekstrak Heksana Metode Modifikasi I ... 19
6 Profil Kromatogram Ekstrak Etanol Metode Modifikasi II ... 20
7 Profil Kromatogram Ekstrak Heksana Metode Modifikasi II ... 21
8 Profil Kromatogram Standar Xantorizol 50 ppm ... 22
9 Profil Kromatogram Dugaan Xantorizol Ekstrak Etanol Metode
Modifikasi I ... 23
10 Profil Kromatogram Dugaan Xantorizol Ekstrak Heksana Metode
Modifikasi I ... 24
11 Profil Kromatogram Dugaan Xantorizol Ekstrak Etanol Metode
Modifikasi II ... 25
12 Profil Kromatogram Dugaan Xantorizol Ekstrak Heksana Metode
Modifikasi II ... 26
13 Profil HPLC Standar Xantorizol 50 ppm ... 27
14 Profil HPLC Dugaan Xantorizol Ekstrak Heksana Metode Modifikasi III .... 28
15 Data Hasil Analisis GC-MS ... 29
PENDAHULUAN
Tanaman obat merupakan komoditas yang sangat spesifik, karena persyaratan standar mutu ditetapkan sesuai dengan kandungan senyawa aktif yang berkhasiat obat. Salah satu jenis tanaman obat yang potensial untuk dikembangkan adalah temu lawak (Kiswanto 2009). Di antara tanaman obat yang termasuk suku Zingiberaceae, simplisia temu lawak merupakan bahan yang terbanyak dipakai di dalam negeri untuk pabrik jamu atau obat tradisional. Konsumsi rata-rata simplisia temu lawak adalah 219.973 kg/tahun, jahe 182.045 kg/tahun, dan kencur 53.904 kg/tahun. Selain digunakan di dalam negeri, simplisia temu lawak juga diekspor ke Singapura, Jerman, dan Taiwan (Syukur & Hernani 2002).
Produk setengah jadi dari tanaman temu lawak adalah simplisia, pati, minyak, dan
ekstrak. Produk industrinya adalah
makanan/minuman, kosmetika, sirup, instan, bedak, tablet dan kapsul (Deptan 2005).
Secara tradisional, temu lawak sangat populer digunakan sebagai pelengkap ramuan jamu. Temu lawak berkhasiat sebagai penurun kolesterol, merangsang keluarnya ASI (Santosa & Gunawan 1999), memperlancar produksi empedu, menghilangkan rasa nyeri, menurunkan panas badan, membunuh bakteri, mengobati jerawat, dan mencegah penyakit hati (MTIC 2002).
Rimpang temu lawak sejak lama dikenal sebagai bahan ramuan obat. Aroma dan warna khas dari rimpang temu lawak adalah berbau tajam dan daging umbinya berwarna kekuning-kuningan (Mahendra 2005). Kandungan minyak atsiri dalam rimpang terdiri atas kurkumin, kamfer, glukosida, zat
pati, felandren, mirsen,
isofuranogermacreene, dan xantorizol (Duryatmo 2003). Beberapa penelitian menunjukkan bahwa komponen aktif utama dalam minyak atsiri temu lawak yang juga merupakan senyawa khas dari rimpang temu lawak adalah xantorizol (Asriani 2010). Xantorizol mempunyai kemampuan sebagai antifungi (Rukayadi et al. 2006), antibakteri (Rukayadi & Hwang 2006), antioksidan dan antiinflamasi (Lim et al. 2005), antikanker (Ceah et al. 2006, 2009), serta berpotensi untuk menanggulangi flu burung (Darusman
et al. 2007).
Isolasi xantorizol sebelumnya telah dilakukan oleh Hwang (2000) menggunakan metode ekstraksi pelarut (metanol 75%), kolom kromatografi, serta reaksi asetilasi dan deasetilasi. Akan tetapi rendemen yang
dihasilkan masih rendah. Asriani (2010) melakukan modifikasi pada metode Hwang yaitu dengan mengganti pelarut yang digunakan dengan etanol 96% dan tanpa melalui tahap kolom kromatografi untuk menghindari kehilangan sampel yang cukup besar, proses asetilasi dilakukan terhadap ekstrak kasar sebelum pemurnian untuk memperoleh xantorizol dengan rendemen yang lebih besar, serta pemurnian dilakukan menggunakan Kromatografi Lapis Tipis Preparatif (KLTP). Secara garis besar, metode Asriani adalah ekstraksi pelarut (etanol 96%), asetilasi, deasetilasi, dan KLTP.
Rendemen yang dihasilkan dari metode Asriani ini adalah 0.140% (b/b), lebih besar daripada metode Hwang, yaitu hanya 0.064% (b/b). Akan tetapi, metode Asriani (2010) belum berhasil memisahkan xantorizol dengan baik, karena masih diperoleh campuran dengan senyawa lain yang tidak diketahui identitasnya. Pada penelitian ini dilakukan isolasi xantorizol menggunakan tiga metode modifikasi dari metode Asriani (2010).
TINJAUAN PUSTAKA
Temu Lawak (Curcuma Xanthorrhiza Roxb.) dan Komposisi Kimianya
Temu lawak (Curcuma Xanthorrhiza
Roxb) (Gambar 1) dikenal dengan temu lawak (Jawa), koneng gede (Sunda), dan temulabak (Madura). Temu lawak banyak ditemukan di hutan-hutan daerah tropis (Mahendra 2005). Curcuma berasal dari kata Arab kurkum yang berarti kuning, sedangkan
xanthorrhiza berasal dari kata Yunani xantos
yang berarti kuning dan rhiza yang berarti akar. Dalam bahasa Indonesia disebut temu lawak yang berarti akar kuning. Dalam klasifikasi botani, temu lawak termasuk dalam dunia plantae, divisi spermatophyta, subdivisi angiospermae, genus Curcuma, dan spesies
Curcuma Xanthorrhiza Roxb (Widiastuty 2006).
Gambar 1 Tanaman temu lawak (Anonim 2010)
Temu lawak termasuk jenis tumbuhan herba yang batang pohonnya berbentuk batang semu dan tingginya dapat mencapai 2 meter (Mahendra 2005). Rimpang temu lawak sejak lama dikenal sebagai bahan ramuan obat. Rimpang temu lawak berukuran besar, bercabang-cabang, dan berwarna coklat kemerahan atau kuning tua. Daging rimpang berwarna jingga tua atau kecoklatan, beraroma tajam yang menyengat dan rasanya pahit (MTIC 2002). Gambar irisan rimpang temu lawak dapat dilihat pada Gambar 2.
Temu lawak secara tradisional telah banyak digunakan di negara-negara Asia Tenggara sebagai pangan dan obat-obatan (Rukayadi et al. 2006). Rimpang temu lawak digunakan sebagai obat kejang, malaria, mencret, kurang nafsu makan, kurang darah, cacar air, radang lambung, getah empedu
terganggu, cacingan, kekurangan air susu, eksema, sembelit, kencing darah, ayan, radang ginjal, demam kuning, pelepas gas dalam perut, anti-HIV (Syukur dan Hernani 2002), pelembab pada kosmetik (Tilaar et al. 2008), dan anti jerawat (Batubara 2008).
Gambar 2 Irisan rimpang temu lawak (Suryandari 2008)
Menurut Kiswanto (2009), kandungan kimia rimpang temu lawak yang memberi arti pada penggunaannya sebagai sumber bahan pangan, bahan baku industri, atau bahan baku obat dapat dibedakan atas beberapa fraksi, yaitu fraksi pati, kurkuminoid, dan minyak atsiri.
Xantorizol dan Aktivitas Biologisnya
Xantorizol adalah komponen khas minyak atsiri dari rimpang temu lawak yang termasuk ke dalam kelompok terpena teroksigenasi. Xantorizol memiliki rumus molekul C15H22O
dengan bobot molekul sebesar 218.335 g/mol. Nama IUPAC-nya 5-(1,5-dimetilheks-4-enil)-2-metilfenol. Rumus struktur xantorizol dapat dilihat pada Gambar 3.
pengobatan candidiasis (Rukayadi et al.
2006), dapat mencegah dan menghilangkan biofilm yang dibentuk oleh Streptococcus mutans (Rukayadi & Hwang 2006; Kim et al.
2002), antimetastatik (Choi et al. 2005), antioksidan dan antiinflamasi (Lim et al.
2005), detoksifikasi, neuroprotektif, dan
antiaging (Hwang 2008), serta kombinasinya dengan kurkumin dapat menghambat sel kanker payudara MDA-MB-231 (Cheah et al. 2009). Selain itu, temu lawak berpotensi pula untuk menanggulangi flu burung (Darusman 2007).
Ekstraksi
Salah satu metode ekstraksi yang sering digunakan adalah metode maserasi. Maserasi merupakan proses perendaman sampel dengan pelarut organik yang digunakan pada suhu ruangan. Proses ini sangat menguntungkan dalam isolasi senyawa bahan alam karena dengan perendaman sampel tumbuhan akan terjadi pemecahan dinding dan membran sel akibat perbedaan tekanan antara di dalam dan di luar sel sehingga metabolit sekunder yang ada dalam sitoplasma akan terlarut dalam pelarut organik dan eksraksi senyawa akan sempurna karena dapat diatur lama perendaman yang dilakukan (Lenny dan Zuhra 2005).
Hwang (2000) melakukan ekstraksi xantorizol dengan menggunakan pelarut metanol 75%, sedangkan Asriani (2010) melakukan ekstraksi dengan menggunakan pelarut etanol 96%. Rendemen ekstrak yang lebih besar diperoleh dengan menggunakan metode Asriani (2010), namun masih terdapat senyawa pengganggu pada hasil akhirnya. Cheah et al. (2009) berhasil mengisolasi xantorizol dengan menggunakan pelarut dietil eter namun metode yang digunakan masih kurang efisien.
Kromatografi Lapis Tipis (KLT)
Beberapa metode kromatografi memberikan cara pemisahan paling kuat di
laboratorium kimia. Kata “kromatografi”
mengandung makna warna namun tidak ada hubungan langsung kecuali senyawa pertama yang dipisahkan dengan cara ini adalah pigmen hijau tumbuhan (Gritter et al. 1991). Kromatografi digunakan untuk memisahkan substansi campuran menjadi komponen-komponennya. Seluruh bentuk kromatografi bekerja berdasarkan prinsip ini. Semua
kromatografi memiliki fase diam (dapat berupa padatan, atau kombinasi cairan-padatan) dan fase gerak (berupa cairan atau gas). Fase gerak mengalir melalui fase diam dan membawa komponen-komponen yang terdapat dalam campuran. Komponen-komponen yang berbeda bergerak pada laju yang berbeda (Clark 2007).
KLT dipakai secara luas untuk pemisahan analitik dan preparatif. KLT preparatif digunakan untuk menghasilkan fraksi murni senyawa. Telah banyak penelitian yang dilakukan menggunakan KLT preparatif untuk isolasi dan pemurnian bahan-bahan alam, diantaranya pemurnian moniliformin dari jagung putih halus (Burmeister et al 1979), isolasi komponen antimikroba dari
Sphaeranthus indicus (Sangeetha et al 2010), dan isolasi triterpenoid glikosida dari kulit
Terminalia Arjuna (Patnaik 2007). Asriani (2010) menggunakan KLT preparatif untuk memisahkan xantorizol terasetilasi dengan pelarut heksana:etil asetat (10:1), namun masih ditemukan senyawa pengganggu pada hasil akhirnya.
METODE
Bahan dan Alat
Alat-alat yang digunakan adalah alat-alat kaca, pipet ukur, hot plate, shaker, oven, rotavapor, instrumen Kromatografi Cair Kinerja Tinggi (KCKT/HPLC), instrumen
Fourier Transformation-Infra Red (FT-IR), dan Gas Chromatography-Mass Spectrophotometry (GC-MS).
Bahan-bahan yang digunakan adalah simplisia temu lawak, etanol 96%, etanol p.a., natrium sulfat anhidrat, silika gel, dietil eter, heksana teknis, heksana p.a., etil asetat, petroleum eter, resin penukar kation jenis Amberlite IR 120 tipe H+, HCl 6 M, metanol, HCl, KOH, dan standar xantorizol.
Lingkup Kerja
Penelitian terdiri dari beberapa tahap (Lampiran 1).
Penentuan Kadar Air (AOAC 2000)
dalam oven bersuhu 105ºC hingga bobotnya konstan.
Metode Modifikasi I
a. Ekstraksi
Sebanyak 250 gram simplisia temu lawak diekstraksi dengan cara maserasi dengan pelarut etanol 96% (v/v) selama 6 jam sambil sesekali diaduk, kemudian didiamkan sampai 24 jam. Maserat dipisahkan, dan proses diulang dua kali dengan jenis dan jumlah pelarut yang sama. Semua maserat dikumpulkan dan disaring dengan kertas saring. Kemudian ditambahkan natrium sulfat anhidrat untuk menghilangkan kandungan air yang masih ada. Selanjutnya disaring kembali sebanyak dua kali dan diuapkan dengan penguap vakum. Ekstrak kasar yang sudah dipekatkan membentuk dua fase sehingga dilakukan partisi menggunakan metode Sajuthi (2001) dengan cara menambahkan 200 ml heksana. Fase heksana dan fase etanol kemudian dianalisis kandungan xantorizolnya dengan metode HPLC. Sistem HPLC yang digunakan ialah kolom C18, detektor UV-Vis, volume injeksi 10 µL, elusi gradien (elusi
H3PO4dan metanol), dan suhu kolom 40˚C.
b. Asetilasi
Ekstrak kental yang diperoleh selanjutnya diasetilasi menggunakan prosedur yang sama dengan prosedur asetilasi metode Asriani yaitu dengan cara melarutkannya ke dalam piridin:asetat anhidrat (1:1, v/v) dengan perbandingan sampel dan pelarut 1:20 (b/v) dan direaksikan selama 24 jam pada suhu kamar. Produk asetilasi kemudian dicirikan dengan KLT dan FTIR.
c. Kromatografi Lapis Tipis (KLT) Preparatif Senyawa hasil asetilasi yang diperoleh difraksinasi lanjut dengan KLT preparatif menggunakan eluen heksana:etil asetat (10:1, v/v).
d. Deasetilasi
Deasetilasi dilakukan dengan cara melarutkannya ke dalam metanol, lalu ditambahkan KOH hingga konsentrasi 3-7%, kemudian dimasukkan ke dalam resin penukar kation selama 3 jam sehingga diperoleh senyawa xantorizol. Pencirian dilakukan dengan menggunakan KLT, FTIR, dan HPLC. Metode Modifikasi II
Metode modifikasi II ini sama seperti metode modifikasi I, namun setelah diekstraksi dengan heksana dilakukan ekstraksi kembali dengan dietil eter
menggunakan metode Najib (2008). Ekstrak etanol dan heksana masing-masing dilarutkan dalam dietil eter (1:5), kemudian diaduk dengan pengaduk magnetik. Fraksi yang larut dalam dietil eter dikeluarkan dari labu, dan ke dalam labu ditambahkan lagi dietil eter yang baru lalu diaduk. Proses partisi ini dilakukan hingga pelarut dietil eter yang ditambahkan menjadi bening. Fraksi larut dietil eter dikumpulkan dan diuapkan untuk selanjutnya dilakukan proses asetilasi, KLTP, dan deasetilasi.
Metode Modifikasi III
Metode modifikasi III merupakan tambahan dari metode modifikasi I, yaitu dilakukan KLTP tahap II menggunakan eluen yang sama pada ekstrak hasil deasetilasi dari metode modifikasi I. Hasil KLTP dicirikan dengan KLT analitik, HPLC, dan GC-MS.
HASIL DAN PEMBAHASAN
Metode Modifikasi I
Penentuan kadar air
Penentuan kadar air simplisia temu lawak yang digunakan dilakukan selama 10 hari, yaitu sampai bobot sampel konstan. Berdasarkan data pada Lampiran 2, diperoleh kadar air sampel sebesar 12.81%. Kadar air temu lawak yang diperoleh digunakan untuk mengetahui bobot temu lawak kering yang sebenarnya sehingga persen rendemen xantorizol dan ekstrak kasarnya dapat diketahui.
Ekstraksi temu lawak
Ekstraksi 250 g temu lawak dengan etanol 96% menghasilkan ekstrak kasar etanol sebanyak 25.6436 gram (11.86%). Hasil ekstraksi tersebut membentuk dua fase disebabkan kandungan lemak yang besar sehingga tidak dapat dilakukan analisis HPLC untuk mengetahui kandungan xantorizol awalnya. Oleh karena itu dilakukan partisi dengan heksana menggunakan metode Sajuthi (2001) dan diperoleh ekstrak dalam fraksi etanol sebanyak 7.8847 gram (30.75%), sedangkan ekstrak dalam fraksi heksana sebanyak 9.1121 gram (35.53%).
yang digunakan sebesar 100 ppm dengan profil kromatografi pada Lampiran 3. Hasil analisis HPLC dari masing-masing ekstrak menunjukkan kandungan xantorizol dalam fraksi heksana lebih besar daripada fraksi etanol. Pada Lampiran 4 dan 5 dapat dilihat bahwa area peak xantorizol pada fraksi heksana sebesar 1332780, sedangkan pada fraksi etanol hanya sebesar 639406. Dengan demikian, jika dibandingkan dengan area peak standar xantorizol, kandungan xantorizol pada fraksi etanol dan heksana masing-masing adalah 312.1 ppm dan 8132.6 ppm.
Asetilasi
Asetilasi masing-masing ekstrak menggunakan piridin:asetat anhidrat (1:1, v/v) menghasilkan ekstrak etanol sebanyak 3.6885 gram dan ekstrak heksana sebanyak 6.7686 gram. Skema reaksi asetilasi xantorizol dapat dilihat pada Gambar 5.
Gambar 5 Skema reaksi asetilasi xantorizol (Cheah et al 2009)
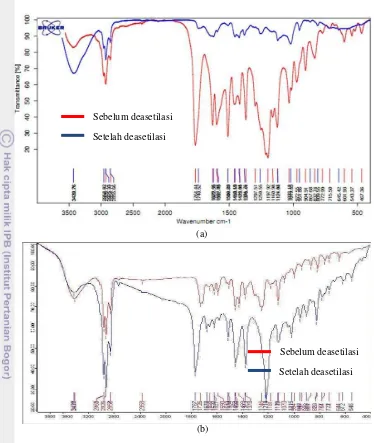
Gambar 4 Perbandingan spektrum FTIR ekstrak etanol (a) dan ekstrak heksana (b) metode modifikasi I sebelum dan setelah asetilasi
Sebelum asetilasi Setelah asetilasi
Sebelum asetilasi Setelah asetilasi
(a)
(b)
Dugaan xantorizol terasetilasi Perbandingan spektrum IR sebelum dan setelah asetilasi dapat dilihat pada Gambar 4. Hasil analisis FTIR untuk ekstrak etanol setelah asetilasi menunjukkan adanya serapan pada bilangan gelombang 1764 cm-1 yang mempresentasikan adanya gugus asetil, sedangkan pada spektrum sebelum asetilasi tidak ditemukan. Begitu pula dengan hasil analisis FTIR dari ekstrak heksana, terdapat serapan pada bilangan gelombang 1767 cm-1, sedangkan pada spektrum sebelum asetilasi tidak ditemukan. Selain itu, jika dilihat dari keberadaan gugus –OH, pada spektrum ekstrak etanol dan heksana sebelum asetilasi terdapat serapan yang lebar pada bilangan gelombang 3400 cm-1, sedangkan pada spektrum ekstrak setelah asetilasi juga ditemukan namun intensitasnya jauh lebih kecil.
Reaksi asetilasi xantorizol juga dapat diduga berdasarkan efek konjugasi dan induksi dari gugus-gugus fungsi yang terlibat. Gugus asetil dari anhidrida asetat akan cenderung memilih terikat pada gugus fenol dibandingkan terikat pada cincin benzena dari struktur xantorizol. Hal ini dikarenakan efek induksi dari atom oksigen (O) yang lebih dominan dibandingkan efek konjugasi. Kromatografi Lapis Tipis Preparatif (KLTP)
Ekstrak etanol dan heksana hasil asetilasi selanjutnya difraksinasi dengan KLTP menggunakan eluen heksana:etil asetat (10:1). Hasil kromatografi dapat dilihat pada Gambar 6. Hasil KLTP ekstrak etanol menghasilkan 8 fraksi, sedangkan ekstrak heksana menghasilkan 12 fraksi.
Terlihat spot dugaan xantorizol terasetilasi berwarna kuning dengan nilai Rf sebesar 0.75
(6a) dan 0.71 (6b). Larik tersebut dikerok, lalu dilarutkan dalam etanol dan diuapkan dengan rotavapor untuk memperoleh fraksi xantorizol terasetilasi dari masing-masing ekstrak. Deasetilasi
Fraksi xantorizol terasetilasi selanjutnya dideasetilasi dengan menggunakan resin penukar kation jenis Amberlite IR 120 tipe H+ sehingga menghasilkan fraksi dugaan xantorizol dengan prinsip menukarkan kembali ion asetil yang diperoleh dari hasil asetilasi dengan ion H+ yang berasal dari resin. Fraksi dugaan xantorizol tersebut dikarakterisasi dengan FTIR, HPLC, dan KLT analitik. Perbandingan spektrum IR ekstrak etanol dan heksana sebelum dan setelah asetilasi dapat dilihat pada Gambar 7. Hasil analisis FTIR ekstrak etanol menunjukkan adanya kembali serapan yang lebar pada bilangan gelombang 3439.26 cm-1 yang menunjukkan terbentuknya kembali gugus – OH xantorizol. Kemudian telah hilangnya gugus asetil ditunjukkan dengan hilangnya pula serapan pada daerah 1700 cm-1. Hal ini menunjukkan bahwa reaksi deasetilasi berhasil dengan baik. Spektrum IR ekstrak heksana menunjukkan masih adanya serapan dengan intensitas cukup besar pada daerah serapan 1700 cm-1, sedangkan pada daerah serapan 3300 cm-1 terdapat serapan cukup lebar namun tidak terlalu berbeda dengan serapan sebelum deasetilasi. Dengan demikian xantorizol pada ekstrak heksana belum terdeasetilasi seluruhnya.
Hasil analisis HPLC dugaan xantorizol dari ekstrak etanol dan heksana dapat dilihat pada Lampiran 9 dan 10. Berdasarkan hasil kromatogram ekstrak etanol, terlihat peak dugaan xantorizol dengan luas area cukup besar pada waktu retensi 6.384 menit. Sama halnya pada kromatogram ekstrak heksana, terlihat peak dugaan xantorizol yang besar pada waktu retensi 6.394. Jika dibandingkan dengan kromatogram standar xantorizol (Lampiran 8) yang menunjukkan waktu retensi xantorizol adalah 6.407 menit, maka metode ini diduga berhasil mengisolasi xantorizol.
Diketahui bahwa xantorizol pada ekstrak etanol memiliki persen area peak sebesar 78.15%, sedangkan xantorizol pada ekstrak heksana memiliki persen area peak sebesar 80.09%. Kemudian dari data luas area xantorizol masing-masing ekstrak diperoleh konsentrasi xantorizol pada ekstrak etanol sebesar 138.24 ppm sedangkan pada ekstrak Gambar 6 Profil KLTP (a) ekstrak etanol dan
Dugaan xantorizol (b)
heksana sebesar 706.15 ppm.
Dengan demikian xantorizol yang diperoleh pada ekstrak heksana memiliki kemurnian dan konsentrasi yang lebih tinggi dibandingkan pada ekstrak etanol. Namun berdasarkan perhitungan dengan standar, ekstrak etanol memiliki kemurnian 87.5%, sedangkan ekstrak heksana hanya 61.43%.
Hasil KLT analitik dugaan xantorizol dapat dilihat pada Gambar 8. Spot dugaan xantorizol pada ekstrak etanol memiliki nilai Rf sebesar 0.49, sedangkan pada ekstrak heksana memiliki nilai Rf 0.51. Hasil KLT dari kedua ekstrak menunjukkan masih adanya dua spot lain dengan nilai Rf 0.75 dan 0.81, sehingga metode modifikasi I ini belum berhasil mengisolasi xantorizol dengan murni. Spot lain yang muncul tersebut diduga salah
satunya adalah xantorizol yang masih terasetilasi karena belum optimalnya proses deasetilasi yang dilakukan. Berdasrkan hasil perhitungan diketahui kandungan xantorizol total pada sampel adalah 3.9 x 10-5 %.
Metode modifikasi I ini awalnya Sebelum deasetilasi
Setelah deasetilasi
Gambar 8 Profil KLT (a) ekstrak etanol dan (b) ekstrak heksana hasil deasetilasi Gambar 7 Perbandingan spektrum FTIR ekstrak etanol (a) dan ekstrak heksana (b)
metode modifikasi I sebelum dan setelah deasetilasi (a)
(b)
merupakan verifikasi dari metode Asriani. Akan tetapi, hasil ekstraksi dengan etanol menghasilkan ekstrak kasar yang membentuk dua fase sehingga dilakukan partisi dengan heksana dan ternyata xantorizol justru lebih banyak terlarut di dalam heksana dibandingkan etanol. Hal ini menyebabkan tidak dapat dilakukannya verifikasi metode Asriani.
Metode Modifikasi II
Ekstraksi 250 g temu lawak dengan etanol 96% menghasilkan ekstrak kasar etanol sebanyak 27,1933 gram. Sama halnya dengan metode modifikasi I, hasil ekstraksi tersebut membentuk dua fase sehingga dilakukan partisi dengan heksana dan dihasilkan ekstrak dalam fraksi etanol sebanyak 6.4100 gram (23.57%), sedangkan ekstrak dalam fraksi heksana sebanyak 8.5787 gram (31.55%). Begitu pula dengan hasil analisis HPLC dari masing-masing ekstrak, kandungan xantorizol dalam fraksi heksana lebih besar daripada fraksi etanol. Pada Lampiran 6 dan 7 dapat dilihat bahwa area peak xantorizol pada fraksi heksana sebesar 1480080, sedangkan pada fraksi etanol hanya sebesar 676609. Dengan demikian, kandungan xantorizol pada fraksi etanol dan heksana masing-masing adalah 330.3 ppm dan 9031.5 ppm. Hal ini disebabkan sifat xantorizol yang cenderung non-polar sehingga lebih terlarut ke dalam pelarut non-polar.
Masing-masing ekstrak diekstraksi ulang dengan dietil eter menggunakan metode Najib (2008). Hal ini bertujuan untuk menghilangkan kemungkinan senyawa yg lebih non-polar dari xantorizol. Ekstraksi ulang dengan dietil eter menghasilkan ekstrak sebanyak 2.1010 gram (32.78%) untuk ekstrak etanol, dan 0.2828 gram (3.30%) untuk ekstrak heksana.
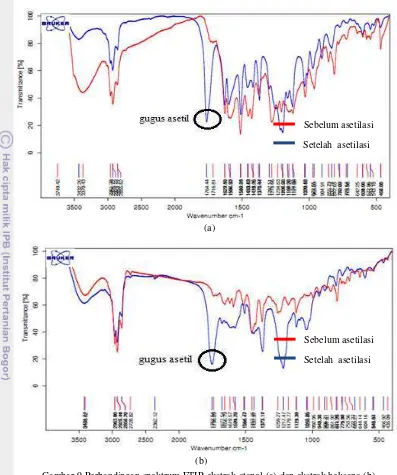
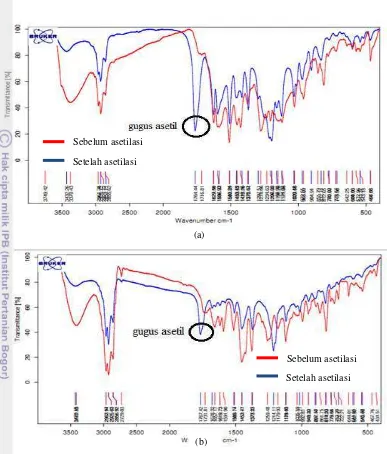
Asetilasi masing-masing ekstrak dilakukan menggunakan metode yang sama dengan Asriani (2010), yaitu menggunakan piridin:asetat anhidrat (1:1, v/v). Dihasilkan ekstrak etanol sebanyak 1.8067 gram (85.99%) dan ekstrak heksana sebanyak 0.2253 gram (79.67%). Ekstrak sebelum dan sesudah asetilasi dianalisis dengan FTIR. Hasil analisis FTIR untuk ekstrak etanol dan heksana sebelum dan setelah asetilasi dapat dilihat pada Gambar 9.
Hasil analisis FTIR untuk ekstrak etanol setelah asetilasi menunjukkan adanya serapan pada bilangan gelombang 1765 cm-1 yang mempresentasikan adanya gugus asetil,
sedangkan pada spektrum sebelum asetilasi tidak ditemukan. Begitu pula dengan hasil analisis FTIR dari ekstrak heksana, terdapat serapan pada bilangan gelombang 1752 cm-1, sedangkan pada spektrum ekstrak sebelum asetilasi tidak ditemukan. Selain itu, sama halnya dengan ekstrak hasil metode modifikasi I, pada spektrum ekstrak etanol dan heksana sebelum asetilasi terdapat serapan yang lebar pada bilangan gelombang 3400 cm-1, sedangkan pada spektrum ekstrak setelah asetilasi juga ditemukan namun intensitasnya jauh lebih kecil. Hal ini menunjukkan bahwa proses asetilasi berhasil dilakukan namun efisiensi reaksi tidak mencapai 100%.
Ekstrak etanol dan heksana hasil asetilasi selanjutnya difraksinasi dengan KLTP menggunakan eluen yang sama dengan metode Asriani (2010), yaitu heksana:etil asetat (10:1). Hasil KLTP menunjukkan terdapat 9 fraksi pada ekstrak etanol dan 11 fraksi pada ekstrak heksana. Terlihat spot dugaan xantorizol dengan nilai Rf sebesar 0.71. Larik tersebut dikerok, lalu dilarutkan dalam etanol dan diuapkan dengan rotavapor untuk memperoleh fraksi xantorizol terasetilasi dari masing-masing ekstrak.
Fraksi xantorizol terasetilasi selanjutnya dideasetilasi menggunakan resin penukar kation jenis Amberlite IR 120 sehingga menghasilkan fraksi dugaan xantorizol. Setelah itu fraksi dugaan xantorizol tersebut dikarakterisasi dengan KLT analitik, FTIR dan HPLC. Hasil KLT analitik dari kedua ekstrak dapat dilihat pada Gambar 10. Spot dugaan xantorizol pada ekstrak etanol memiliki nilai Rf 0.47, sedangkan pada ekstrak heksana memiliki nilai Rf sebesar 0.54. Spot dugaan xantorizol pada ekstrak etanol memiliki nilai Rf lebih kecil karena laju elusi tidak lurus. Laju elusi sempat berbelok ke samping kiri.
Dugaan xantorizol
(a) (b)
Jika dilihat dari serapan gugus asetil, pada
spektrum ekstrak etanol sudah tidak terdapat serapan pada daerah 1760 cm-1, namun pada ekstrak heksana masih terdapat serapan dengan intensitas rendah. Hal ini menunjukkan masih terdapatnya xantorizol yang belum terdeasetilasi.
Hasil analisis HPLC ekstrak etanol dan heksana metode modifikasi dapat dilihat pada Lampiran 11 dan 12. Berdasarkan hasil kromatogram ekstrak etanol, terlihat peak
dugaan xantorizol dengan luas area cukup besar pada waktu retensi 6.365 menit. Sama halnya pada kromatogram ekstrak heksana, terlihat peak dugaan xantorizol yang besar pada waktu retensi 6.369. Jika dibandingkan dengan kromatogram standar xantorizol Gambar 9 Perbandingan spektrum FTIR ekstrak etanol (a) dan ekstrak heksana (b)
metode modifikasi II sebelum dan setelah asetilasi
Sebelum asetilasi Setelah asetilasi (a)
(b)
Gambar 10 Profil KLT fraksi dugaan xantorizol (a) ekstrak etanol dan (b) ekstrak heksana metode modifikasi II
(Lampiran 8) yang menunjukkan waktu retensi xantorizol sebesar 6.047 menit, maka metode modifikasi II ini diduga berhasil mengisolasi xantorizol. Diketahui bahwa xantorizol pada ekstrak etanol memiliki persen area peak sebesar 80.09%, sedangkan xantorizol pada ekstrak heksana memiliki persen area peak sebesar 88.07%. Kemudian dari data luas area xantorizol masing-masing ekstrak diperoleh konsentrasi xantorizol pada ekstrak etanol sebesar 105.10 ppm sedangkan pada ekstrak heksana sebesar 267.50 ppm. Namun berdasarkan perhitungan dengan menggunakan data kromatogram standar, xantorizol pada ekstrak etanol hanya memiliki kemurnian 62.5%, sedangkan pada ekstrak
heksana hanya 65%. Xantorizol pada ekstrak heksana memiliki konsentrasi dan kemurnian yang lebih tinggi dibandingkan ekstrak etanol. Berdasarkan hasil perhitungan xantorizol dari kedua ekstrak, diketahui kandungan xantorizol total pada sampel adalah
1.7 x 10
-5 %. Dengan demikian metode ini b erhasil mengisolasi xantorizol namun belum 100% murni.Metode Modifikasi III
Metode modifikasi III ini merupakan tambahan dari metode modifikasi I, yaitu dilakukan KLTP tahap II pada ekstrak hasil deasetilasi dari metode modifikasi I. Ekstrak Sebelum deasetilasi
Setelah deasetilasi
Gambar 11 Perbandingan spektrum FTIR ekstrak etanol (a) dan ekstrak heksana (b) metode modifikasi II sebelum dan setelah deasetilasi
Sebelum deasetilasi Setelah deasetilasi
heksana dipilih karena memiliki kemurnian dan konsentrai yang lebih tinggi dibandingkan ekstrak etanol. KLTP tahap II ini masih menggunakan eluen yang sama yaitu heksana:etil asetat (10:1). Hasil KLTP tahap II dicirikan dengan KLT analitik, HPLC, dan GC-MS. Profil KLT fraksi dugaan xantorizol hasil KLTP tahap II dapat dilihat pada Gambar 12. Terlihat bahwa hanya ada satu spot pada hasil KLT tersebut yang diduga adalah xantorizol dengan nilai Rf sebesar 0.42, sehingga metode ini diduga berhasil mengisolasi xantorizol dengan murni.
Gambar 12 Profil KLT dugaan xantorizol hasil KLTP tahap II
Berdasarkan hasil analisis HPLC pada Lampiran 14, terlihat satu peak yang luas pada waktu retensi 6.360 menit dengan luas area sebesar 97.604%. Jika dibandingkan dengan kromatogram standar xantorizol (Lampiran 13), waktu retensi xantorizol adalah 6.366 menit dengan luas area sebesar 95.258%. Hal ini menunjukkan metode ini berhasil mengisolasi xantorizol dengan kemurnian yang lebih tinggi daripada standar xantorizol yang digunakan. Namun berdasarkan hasil perhitungan dengan menggunakan data kromatogram standar xantorizol, diketahui kemurnian xantorizol yang diperoleh adalah 90%. Kemudian pada hasil analisis HPLC terlihat masih adanya dua peak lain yang muncul yaitu pada waktu retensi 2.454 dan 3.991 menit dengan persen area masing-masing sebesar 1.435% dan 0.961%. Jika diperhatikan, pada semua hasil analisis HPLC baik standar xantorizol maupun sampel, selalu muncul peak pada waktu retensi sekitar 2.4 menit, sehingga diduga peak yang muncul tersebut merupakan pelarut. Dengan demikian hasil analisis HPLC menunjukkan bahwa xantorizol yang diisolasi masih belum murni karena masih ditemukan campuran dengan satu senyawa lain yang belum teridentifikasi
Hal ini dibuktikan pula dengan hasil analisis GC-MS pada Lampiran 15. Berdasarkan hasil analisis, diperoleh dua puncak pada waktu retensi 11.36 dan 11.44
menit. Puncak pada waktu retensi 11.4 menit dipastikan merupakan xantorizol dengan BM 218.0, sedangkan puncak pada waktu retensi 11.36 teridentifikasi sebagai senyawa 2-etoksikarbonil benzotiazol. Jika dibandingkan dengan puncak pada waktu retensi 11.36, puncak xantorizol memiliki luas area yang jauh lebih besar yaitu 6930703, sedangkan puncak pada waktu retensi 11.36 hanya memiliki luas area 422232, sehingga jika xantorizol tersebut dianggap murni 100%, maka pengotor pada isolat tersebut sebesar 6.09%. Akan tetapi berdasarkan perhitungan total keseluruhan, diperoleh luas area sebesar 94.26% untuk xantorizol, dan 5.74% untuk senyawa 2-etoksikarbonil benzotiazol. Puncak lain yang muncul tersebut memiliki waktu retensi yang cukup berdekatan dengan xantorizol. Hal ini menunjukkan senyawa tersebut memiliki kepolaran yang hampir sama dengan xantorizol sehingga sulit dipisahkan. Dengan demikian metode modifikasi III ini pun belum berhasil mengisolasi xantorizol dengan kemurnian 100%, yaitu hanya diperoleh xantorizol dengan kemurnian 97.60%.
Perbandingan Hasil Isolasi Xantorizol menggunakan Metode Asriani dengan
Metode Modifikasi
Perbandingan kemurnian dan rendemen xantorizol hasil isolasi menggunakan metode Asriani dengan metode modifikasi dapat dilihat pada tabel di bawah ini.
Tabel 1 Data kemurnian dan rendemen xantorizol hasil isolasi dengan metode Asriani dan metode modifikasi
Metode Kemurnian (%)a Kemurnian (%)b Rendemen (%) Asriani Ekstrak etanol
99.5 - 0.1400
Modifikasi I
Ekstrak
etanol 78.1 87.50 0.0061
Ekstrak
heksana 80.1 61.43 0.0426 Modifikasi II
Ekstrak
etanol 80.1 62.50 0.0033
Ekstrak
heksana 88.1 65.00 0.0013 Modifikasi III
Ekstrak
heksana 97.6 90.00 0.0090 a
berdasarkan persen area (HPLC)
b
Berdasarkan data pada tabel di atas, terlihat bahwa kemurnian xantorizol yang paling tinggi dihasilkan dengan metode Asriani, yaitu 99.5%. Contoh perhitungan kemurnian dan rendemen dari masing-masing metode modifikasi dapat dilihat pada Lampiran 16. Tambahan proses ekstraksi dengan heksana maupun dietil eter yang dilakukan pada metode modifikasi I dan II belum dapat memisahkan xantorizol dengan baik, begitu pula halnya dengan KLTP tahap II yang dilakukan pada metode modifikasi III. Pada isolat tersebut masih ditemukan campuran dengan satu senyawa lain yang kepolarannya hampir sama dengan xantorizol. Senyawa tersebut teridentifikasi sebagai senyawa 2-etoksikarbonil benzotiazol (Gambar 13).
Berdasarkan hasil analisis GC-MS, senyawa 2-etoksikarbonil benzotiazol tersebut memiliki nilai Rf yang lebih kecil daripada xantorizol. Kolom yang digunakan pada instrumen GC-MS adalah kolom HP-5 yang merupakan jenis kolom non-polar. Dengan demikian dapat diketahui bahwa senyawa tersebut bersifat lebih polar daripada xantorizol karena keluar dari kolom lebih dulu dibandingkan xantorizol. Xantorizol hasil isolasi dengan metode Asriani (2010) juga menunjukkan masih adanya campuran dengan satu senyawa lain yang belum teridentifikasi. Berdasarkan hasil analisis KLT-nya, senyawa tersebut memiliki nilai Rf yang lebih kecil dibandingkan xantorizol. Senyawa tersebut lebih lama tertahan pada silika gel sehingga dapat diketahui bahwa senyawa tersebut lebih polar daripada xantorizol. Dengan demikian dapat diduga bahwa senyawa yang belum teridentifikasi pada hasil isolasi dengan metode Asriani adalah senyawa yang sama dengan hasil isolasi dari metode modifikasi III yaitu senyawa 2-etoksikarbonil benzotiazol.
Penyebab tidak murninya xantorizol yang dihasilkan diduga karena belum optimalnya proses asetilasi dan deasetilasi yang dilakukan sehingga xantorizol belum terasetilasi dan terdeasetilasi seluruhnya, juga diduga karena terbentuknya senyawa turunan xantorizol. Meskipun menghasilkan xantorizol dengan
kemurnian paling tinggi dibandingkan metode modifikasi lainnya, namun metode modifikasi III pun belum bisa menghasilkan xantorizol dengan kemurnian 100% dan masih lebih rendah dari metode Asriani. Berdasarkan data rendemen xantorizol yang dihasilkan pun, masih jauh lebih tinggi metode Asriani. Jika dibandingkan dengan data dari kromatogram xantorizol ekstrak kasar, diketahui telah banyak xantorizol yang hilang selama proses isolasi. Hal ini disebabkan tahapan proses yang lebih banyak dibandingkan metode Asriani. Dengan demikian metode Asriani masih lebih baik dan lebih efisien.
SIMPULAN DAN SARAN
Simpulan
Ketiga metode modifikasi yang dilakukan berhasil mengisolasi xantorizol namun belum 100% murni karena masih ditemukan campuran dengan senyawa lain. Kemurnian xantorizol yang paling tinggi dihasilkan dengan menggunakan metode modifikasi III. Akan tetapi hasil tersebut masih lebih rendah dibandingkan dengan metode Asriani. Dengan demikian metode Asriani masih lebih baik dan lebih efisien daripada metode modifikasi yang digunakan.
Saran
Perlu dilakukan optimasi reaksi asetilasi dan deasetilasi untuk memastikan xantorizol berhasil terasetilasi dan terdeasetilasi kembali seluruhnya.
DAFTAR PUSTAKA
Anonim. 2010. Temu lawak. Earthcare Enterprises. [terhubung berkala]. http://www.earthcare.com.au/slides/temula wak.htm. [8 Desember 2011].
AOAC. 2000. Official Methods of Analysis of The Association Official Analytical Chemists. Washington DC: AOAC International.
Asriani D. 2010. Isolasi xantorizol dari temu lawak terpilih berdasarkan nomor harapan Gambar 13 Struktur molekul 2-etoksikarbonil
[tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Batubara I, Mitsunaga T, Ohashi H. 2008. Antiacne potency of Temu Lawak. The First International Symposium on Temu Lawak. Bogor, 27-29 Mei. Bogor: Pusat Studi Biofarmaka. Hlm. 93-101.
Burmeister HR, Ciegler A, Fesonder RF. 1979. Moniliformin, a metabolite from
Fusarium monoliforme NRRL 6332: purification and toxicity. Applied and Environmental Microbiology 37 (1): 11-13.
Cheah et al. 2009. Combined xanthorrhizol-curcumin exhibits synergistic growth inhibitory activity via apoptosis induction in human breast cancer cells MDA-MB-231. Cancer Cell International 9:1.
Choi et al. 2005. Xanthorrhizol, a natural sesquiterpenoid from Curcuma xanthorrhiza, has an anti-metastatic potential in experimental mouse lung metastasis model. Biochemical and Biophysical Research Communications
326:210–217
Clark J. 2007. Kromatografi lapis tipis. Situs Kimia Indonesia. [terhubung berkala].
http://www.chem-is-try.org/materi_kimia/instrumen_analisis/ kromatografi1/kromatografi_lapis_tipis/. [8 Februari 2011].
Darusman et al. 2007. Potensi temu lawak terstandar untuk menanggulangi flu burung. [terhubung berkala]. http://www.repository.ipb.ac.id/bitstream/ handle/123456789/.../2007lkd_latif.doc?... 2. [8 Februari 2011].
[Deptan] Departemen Pertanian. 2005. Prospek dan Arah Pengembangan Agribisnis Tanaman Obat. Jakarta: Badan Litbang Pertanian.
Duryatmo S. 2003. Aneka Ramuan Berkhasiat dari Temu-Temuan. Jakarta: Puspa Swara.
Hwang JK. 2000. Xanthorrizol: A new bioactive natural compound. Seoul: Departement of Biotechnology, Yonsei University.
Hwang JK. 2008. Industrial potential of
Curcuma xanthorrhiza as antibacterial and anti-inflammatory agents. The First International Symposium on Temu Lawak. Bogor, 27-29 Mei. Bogor: Pusat Studi Biofarmaka. Hlm. 19-28.
Kiswanto Y. 2009. Perubahan kadar senyawa bioaktif rimpang temu lawak dalam penyimpanan. Yogyakarta: Fakultas Teknologi Pertanian Institut Pertanian.
Lenny S, Zuhra CF. 2005. Isolasi dan uji bioaktivitas kandungan kimia utama puding merah dengan metode uji brine shrimp. Jurnal Komunikasi Penelitian: 17 (5).
Lim et al. 2005. Antioxidant and antiinflammatory activities of xanthorrhizol in hippocampal neurons and primary cultured microglia. J Neurosci Res
82 (6):831-8.
Mahendra B. 2005. 13 Jenis Tanaman Obat Ampuh. Jakarta: Penebar Swadaya.
[MTIC] Martha Tilaar Inovation Center. 2002.
Budi Daya Secara Organik Tanaman Obat Rimpang. Jakarta: Penebar Swadaya.
Najib A. 2008. Isolasi dan identifikasi komponen kimia ekstrak dietil eter daun senggani (Melastoma malabathricum L.).
Majalah Farmasi dan Farmakologi 12(1).
Patnaik T, Dey RK, Gouda P. 2007. Isolation of triterpenoid glycoside from bark of
tissues. E-Journal of Chemistry 4(4): 474-479.
Rukayadi Y, Hwang JK. 2005. In vitro activity of xanthorrhizol against
Streptococcus mutans biofilms. Lett Appl Microbiol 42(4):400-4.
Rukayadi Y, Yong D, Hwang JK. 2006. In vitro anticandidal activity of xanthorrhizol isolated from Curcuma xanthorrhiza
Roxb. Journal of Antimicrobial Chemotherapy doi:10.1093/jac/dkl132.
Sajuthi D. 2001. Ekstraksi, fraksinasi, karakterisasi, dan uji hayati in vitro
senyawa bioaktif daun dewa (Gynura pseudopina (Linn.) DC.) sebagai antikanker, tahap II. Buletin Kimia (1): 75-79.
Sangeetha et al 2010. Isolation an antimicrobial compound from
Sphaeranthus indicus against human pathogens. International Journal of Biotechnology and Biochemistry 6 (4): 569-577.
Santosa D, Gunawan D. 1999. Ramuan Tradisional untuk Penyakit Kulit. Jakarta: Penebar Swadaya.
Syukur C dan Hernani. 2002. Budi Daya Tanaman Obat Komersial. Jakarta: Penebar Swadaya.
Tilaar et al. 2008. Research of Curcuma xanthorrhiza extract for cosmetic use. The First International Symposium on Temu Lawak. Bogor, 27-29 Mei. Bogor: Pusat Studi Biofarmaka. Hlm.86-89.
Lampiran 1 Bagan alir penelititan
Keterangan:
Metode Asriani
Modifikasi I
Modifikasi II
Modifikasi III
Dimaserasi dengan dietil eter
KLT Preparatif (heksana:etil asetat 10:1)
Deasetilasi
KLTP Tahap II (heksana:etil asetat
10:1)
Dimaserasi dengan dietil eter
Asetilasi
Fraksi Xantorizol Terasetilasi
Xantorizol Sampel temu lawak
Ditambahkan Na2SO4 anhidrat, disaring dan
diuapkan (40°C) Dimaserasi 6 jam dengan EtOH (96%, v/v),
didiamkan 24 jam, dan disaring (3x ulangan)
Diekstraksi dengan heksana
Ekstrak etanol cair
Ekstrak etanol Ekstrak heksana
Ekstrak etanol pekat
Lampiran 2 Kadar Air
Sampel Temu Lawak Metode Modifikasi I dan III
Ulangan Bobot wadah
kosong (g)
Bobot
basah (g)
Bobot
akhir (g)
Bobot kering
(g)
Kadar air
(%)
1
1,9487
3,0004
4,5678
2,6191
12,7083
2
1,9613
3,0071
4,5418
2,5805
14,1864
3
1,9498
3,0061
4,5473
2,5975
13,5924
Rerata
13,4957
Sampel Temu Lawak Metode Modifikasi II
Ulangan Bobot wadah
kosong (g)
Bobot
basah (g)
Bobot
akhir (g)
Bobot kering
(g)
Kadar air
(%)
1
1,9531
3,0072
4,5760
2,6229
12,7793
2
1,9336
3,0138
4,5341
2,6005
13,7136
3
1,9288
3,0000
4,5704
2,6416
11,9467
Rerata
12,8132
Contoh Perhitungan:
Ulangan 1 metode modifikasi I
Kadar air =
=
Lampiran 3 Profil kromatogram standar xantorizol 100 ppm
Lampiran 4 Profil kromatogram ekstrak etanol metode modifikasi I
Kadar xantorizol (ppm) =
x [standar] x fp
=
x 100 ppm x 10
= 312.1 ppm
Lampiran 5 Profil kromatogram ekstrak heksana metode modifikasi I
Kadar xantorizol (ppm) =
x [standar] x fp
=
x 100 ppm x 25 x 5
= 8132.6 ppm
Kadar xantorizol total (%) =
Lampiran 6 Profil kromatogram ekstrak etanol metode modifikasi II
Kadar xantorizol (ppm) =
x [standar] x fp
=
x 100 ppm x 10
Lampiran 7 Profil kromatogram ekstrak heksana metode modifikasi II
Kadar xantorizol (ppm) =
x [standar] x fp
=
x 100 ppm x 25 x 5
= 9031.5 ppm
Kadar xantorizol total (%) =
Lampiran 9 Profil kromatogram dugaan xantorizol ekstrak etanol (metode
modifikasi I)
Kadar xantorizol (ppm) =
x [standar]
=
x 5 ppm
Lampiran 10 Profil kromatogram dugaan xantorizol ekstrak heksana (metode
modifikasi I)
Kadar xantorizol (ppm) =
x [standar]
=
x 50 ppm
= 706.15 ppm
Kadar xantorizol total (%) =
Lampiran 11 Profil kromatogram dugaan xantorizol ekstrak etanol (metode
modifikasi II)
Kadar xantorizol (ppm) =
x [standar]
=
x 50 ppm
Lampiran 12 Profil kromatogram dugaan xantorizol ekstrak heksana (metode
modifikasi II)
Kadar xantorizol (ppm) =
x [standar]
=
x 50 ppm
= 267.50 ppm
Kadar xantorizol total (%) =
5 0 1 0 0 1 5 0 2 0 0 2 5 0 3 0 0 3 5 0 4 0 0 4 5 0 5 0 0 5 5 0 0
1 0 0 0 2 0 0 0 3 0 0 0 4 0 0 0 5 0 0 0 6 0 0 0 7 0 0 0 8 0 0 0 9 0 0 0
m / z - - > A b u n d a n c e
S c a n 8 1 2 ( 1 1 . 4 4 2 m i n ) : X A N T H O R I Z O L U L A N G 1 . D 1 3 6
2 1 8
9 1
5 5 1 6 1
2 8 1 3 4 1
2 5 3 3 1 5 3 7 74 0 5
1 9 3 4 2 94 5 1 4 7 95 0 35 2 95 5 3
5 0 1 0 0 1 5 0 2 0 0 2 5 0 3 0 0 3 5 0 4 0 0 4 5 0 5 0 0 5 5 0
0 1 0 0 0 2 0 0 0 3 0 0 0 4 0 0 0 5 0 0 0 6 0 0 0 7 0 0 0 8 0 0 0 9 0 0 0
m / z - - > A b u n d a n c e
# 1 4 1 8 0 8 : X a n t h o r r h i z o l $ $ P h e n o l , 5 - ( 1 , 5 - d i m e t h y l - 4 - h e x e n y . . . 1 3 6
2 1 8
9 1
4 1 1 6 1
Lampiran 15 Data hasil analisis GC-MS
6 . 0 0 8 . 0 0 1 0 . 0 0 1 2 . 0 0 1 4 . 0 0 1 6 . 0 0 1 8 . 0 0 2 0 . 0 0 1 0 0 0 0 0
2 0 0 0 0 0 3 0 0 0 0 0 4 0 0 0 0 0 5 0 0 0 0 0 6 0 0 0 0 0 7 0 0 0 0 0 8 0 0 0 0 0 9 0 0 0 0 0
T i m e - - > A b u n d a n c e
T I C : X A N T H O R I Z O L U L A N G 1 . D
Lanjutan Lampiran 15
Area Percent Report
Data Path : C:\MSDChem\1\data\
Data File : XANTHORIZOL ULANG 1.D Acq On : 27 Feb 2012 9:54
Operator : WINA
Sample : XANTHORIZOL Misc : S1 IPB
ALS Vial : 1 Sample Multiplier: 1
Integration Parameters: autoint1.e Integrator: ChemStation
Method : C:\MSDCHEM\1\METHODS\UMUM.M Title :
Signal : TIC
peak R.T. first max last PK peak corr. corr. % of # min scan scan scan TY height area % max. total --- --- ---- ---- --- --- --- --- --- 1 11.357 798 802 807 PV 27630 422232 6.09% 5.742% 2 11.442 807 812 823 PV 460150 6930703 100.00% 94.258%
Sum of corrected areas: 7352935
UMUM.M Thu Mar 29 08:20:49 2012
Library Search Report
Search Libraries: C:\Database\wiley7n.l Minimum Quality: 0
Unknown Spectrum: Apex
Integration Events: Chemstation Integrator - autoint1.e
Pk# RT Area% Library/ID Ref# CAS# Qual
_____________________________________________________________________________ 1 11.36 5.74 C:\Database\wiley7n.l
2-ethoxycarbonylbenzothiazole $$ 2 125243 032137-76-1 47 -Benzothiazolecarboxylic acid, eth
yl ester (CAS) $$ Ethyl 2-benzothi azolecarboxylate
Benzenamine, 2,4,6-trimethyl- 30419 000088-05-1 43
4-(Diethylaminomethyl)-2,5-dimethy 125798 042900-96-9 43 lphenol
2 11.44 94.26 C:\Database\wiley7n.l
Xanthorrhizol $$ Phenol, 5-(1,5-di 141808 030199-26-9 87
methyl-4-hexenyl)-2-methyl-, (R)- (CAS) $$ (R)-2-(1',5'-DIMETHYLHEX- 4'-ENYL)-5-METHYLPHENOL $$ o-Creso l, 5-(1,5-dimethyl-4-hexenyl)-, (- )- $$ (-)-Xanthorrhizol $$ (R)-(-) -Xanthorrhizol
2-Ethyl-.delta.(1(2))-Bicyclo[4.3. 65096 059562-89-9 50 0]nonenone-3 $$ 5H-Inden-5-one, 4-
ethyl-1,2,3,6,7,7a-hexahydro- (CAS
3,4-Dimethyl-o-phenylenediamine $$ 31289 041927-01-9 49 1,2-Benzenediamine, 3,4-dimethyl-
Lampiran 16 Data kemurnian dan rendemen xantorizol dari ketiga metode
modifikasi
Metode
Bobot
Xantorizol
a(gram)
Bobot
Xantorizol
b(gram)
Bobot
Xantorizol
c(gram)
Bobot temu
lawak
(gram)
Kemurnian
(%)
Rendemen
(%)
Modifikasi I
Etanol
Heksana
0.0007
0.0035
0.0008
0.0057
0.0133
0.0921
216.26
216.26
87.5
61.4
0.0061
0.0426
Modifikasi II
Etanol
Heksana
0.0005
0.0013
0.0008
0.0020
0.0073
0.0029
217.97
217.97
62.5
65.0
0.0033
0.0013
Modifikasi III
Heksana
0.0009
0.0010
0.0194
216.26
90.0
0.0090
Ket:
abobot xantorizol hasil perhitungan dari konsentrasi ppm xantorizol
b
bobot xantorizol sebenarnya yang diperoleh
c
bobot total xantorizol yang seharusnya diperoleh
Contoh perhitungan kemurnian (ekstrak etanol modifikasi I):
Kemurnian (%) =
x 100 %
=
x 100% = 87.5 %
Contoh perhitungan rendemen (ekstrak etanol modifikasi I):
Rendemen (%) =
x 100%
`
=
ABSTRAK
WINA APRIANI SUTISNA. Isolasi dan Pemurnian Xantorizol dari Temu Lawak
(Curcuma
xanthorrhiza
Roxb.)
.
Dibimbing
oleh
LATIFAH
KOSIM
DARUSMAN dan RUDI HERYANTO.
Xantorizol adalah komponen aktif utama dalam minyak atsiri temu lawak.
Xantorizol berfungsi sebagai antifungi, antibakteri, antioksidan dan anti-inflamasi.
Xantorizol sebelumnya telah berhasil diisolasi dengan menggunakan berbagai
metode, salah satunya yaitu metode Asriani (2010) dengan cara ekstraksi pelarut
(etanol 96%), asetilasi, Kromatografi Lapis Tipis Preparatif (KLTP) dan
deasetilasi yang menghasilkan xantorizol dengan kemurnian 99%. Xantorizol
yang diperoleh masih belum murni karena ditemukan adanya campuran dengan
senyawa lain. Penelitian ini melakukan isolasi xantorizol menggunakan tiga
metode modifikasi dari metode Asriani. Metode modifikasi I yaitu melakukan dua
kali ekstraksi, yaitu menggunakan pelarut etanol dan heksana. Metode modifikasi
II yaitu melakukan tiga kali ekstraksi, yaitu menggunakan pelarut etanol, heksana,
dan dietil eter. Metode modifikasi III yaitu melakukan dua kali ekstraksi
menggunakan pelarut etanol dan heksana serta melakukan KLTP tahap II pada
ekstrak hasil deasetilasi. Metode modifikasi I dan II masing-masing menghasilkan
xantorizol dengan kemurnian 78.1 dan 80.1% untuk ekstrak etanol, serta 80.1 dan
88.1% untuk ekstrak heksana. Metode modifikasi III berhasil mengisolasi
xantorizol dengan kemurnian yang paling tinggi yaitu 94.3%. Hasil analisis
GC-MS menunjukkan salah satu dari dua puncak yang muncul yaitu pada waktu
retensi 11.44 menit dengan luas area 94.3% dan BM 218.0 adalah xantorizol.
Hasil ketiga metode modifikasi masih lebih rendah dari metode Asriani, sehingga
metode Asriani masih lebih baik dan lebih efisien.
ABSTRACT
WINA APRIANI SUTISNA. Isolation and Purification of Xanthorrhizol from
Temu Lawak (Curcuma xanthorrhiza Roxb.). Under direction of LATIFAH
KOSIM DARUSMAN and RUDI HERYANTO.
Xanthorrhizol is the main active component in the essential oil of temu lawak
(Curcuma xanthorriza
Roxb.). Xanthorrhizol has antifungal, antibacterial,
antioxidant, and anti-inflammatory activities. Xanthorrhizol is isolated by Asriani
(2010) using solvent extraction (ethanol 96%), acetylation, Preparative Thin
Layer Chromatography (PTLC), and deacetylation, which produce xanthorrhizol
with 99% purity. The xanthorrhizol obtained is not pure because there are still
other compounds in the mixture. This research perfoms xanthorrhizol isolation
using three different modifications based on Asriani
’s
method. The modified
method I conducts two-times extraction: ethanol and hexane extractions. The
modified method II conducts three-times extraction: ethanol, hexane, and diethyl
ether extractions. The modified method III conducts two-times extraction using
ethanol and hexane as solvents, and also conduct PTLC phase II in order to
extract the deacetylated product. The modification method I and II produce
xanthorrhizol with purity 78.1 and 80.1 % for ethanol extract, and 80.1 and 88.1
% for hexane extract, respectively. Modified method III is able to isolate
xanthorrhizol with the highest purity, i.e. 94.3%. GC-MS analysis to the product
shows that one of the two peaks appeared at the retention time of 11.44 minutes
with an area of 94.3% and MW 218.0 is xanthorrhizol. The results from all of
these modified methods
were lower than Asriani’s method
, which comes to the
conclusion that Asriani
’s
method is better and more efficient.
PENDAHULUAN
Tanaman obat merupakan komoditas yang sangat spesifik, karena persyaratan standar mutu ditetapkan sesuai dengan kandungan senyawa aktif yang berkhasiat obat. Salah satu jenis tanaman obat yang potensial untuk dikembangkan adalah temu lawak (Kiswanto 2009). Di antara tanaman obat yang termasuk suku Zingiberaceae, simplisia temu lawak merupakan bahan yang terbanyak dipakai di dalam negeri untuk pabrik jamu atau obat tradisional. Konsumsi rata-rata simplisia temu lawak adalah 219.973 kg/tahun, jahe 182.045 kg/tahun, dan kencur 53.904 kg/tahun. Selain digunakan di dalam negeri, simplisia temu lawak juga diekspor ke Singapura, Jerman, dan Taiwan (Syukur & Hernani 2002).
Produk setengah jadi dari tanaman temu lawak adalah simplisia, pati, minyak, dan
ekstrak. Produk industrinya adalah
makanan/minuman, kosmetika, sirup, instan, bedak, tablet dan kapsul (Deptan 2005).
Secara tradisional, temu lawak sangat populer digunakan sebagai pelengkap ramuan jamu. Temu lawak berkhasiat sebagai penurun kolesterol, merangsang keluarnya ASI (Santosa & Gunawan 1999), memperlancar produksi empedu, menghilangkan rasa nyeri, menurunkan panas badan, membunuh bakteri, mengobati jerawat, dan mencegah penyakit hati (MTIC 2002).
Rimpang temu lawak sejak lama dikenal sebagai bahan ramuan obat. Aroma dan warna khas dari rimpang temu lawak adalah berbau tajam dan daging umbinya berwarna kekuning-kuningan (Mahendra 2005). Kandungan minyak atsiri dalam rimpang terdiri atas kurkumin, kamfer, glukosida, zat
pati, felandren, mirsen,
isofuranogermacreene, dan xantorizol (Duryatmo 2003). Beberapa penelitian menunjukkan bahwa komponen aktif utama dalam minyak atsiri temu lawak yang juga merupakan senyawa khas dari rimpang temu lawak adalah xantorizol (Asriani 2010). Xantorizol mempunyai kemampuan sebagai antifungi (Rukayadi et al. 2006), antibakteri (Rukayadi & Hwang 2006), antioksidan dan antiinflamasi (Lim et al. 2005), antikanker (Ceah et al. 2006, 2009), serta berpotensi untuk menanggulangi flu burung (Darusman
et al. 2007).
Isolasi xantorizol sebelumnya telah dilakukan oleh Hwang (2000) menggunakan metode ekstraksi pelarut (metanol 75%), kolom kromatografi, serta reaksi asetilasi dan deasetilasi. Akan tetapi rendemen yang
dihasilkan masih rendah. Asriani (2010) melakukan modifikasi pada metode Hwang yaitu dengan mengganti pelarut yang digunakan dengan etanol 96% dan tanpa melalui tahap kolom kromatografi untuk menghindari kehilangan sampel yang cukup besar, proses asetilasi dilakukan terhadap ekstrak kasar sebelum pemurnian untuk memperoleh xantorizol dengan rendemen yang lebih besar, serta pemurnian dilakukan menggunakan Kromatografi Lapis Tipis Preparatif (KLTP). Secara garis besar, metode Asriani adalah ekstraksi pelarut (etanol 96%), asetilasi, deasetilasi, dan KLTP.
Rendemen yang dihasilkan dari metode Asriani ini adalah 0.140% (b/b), lebih besar daripada metode Hwang, yaitu hanya 0.064% (b/b). Akan tetapi, metode Asriani (2010) belum berhasil memisahkan xantorizol dengan baik, karena masih diperoleh campuran dengan senyawa lain yang tidak diketahui identitasnya. Pada penelitian ini dilakukan isolasi xantorizol menggunakan tiga metode modifikasi dari metode Asriani (2010).
TINJAUAN PUSTAKA
Temu Lawak (Curcuma Xanthorrhiza Roxb.) dan Komposisi Kimianya
Temu lawak (Curcuma Xanthorrhiza
Roxb) (Gambar 1) dikenal dengan temu lawak (Jawa), koneng gede (Sunda), dan temulabak (Madura). Temu lawak banyak ditemukan di hutan-hutan daerah tropis (Mahendra 2005). Curcuma berasal dari kata Arab kurkum yang berarti kuning, sedangkan
xanthorrhiza berasal dari kata Yunani xantos
yang berarti kuning dan rhiza yang berarti akar. Dalam bahasa Indonesia disebut temu lawak yang berarti akar kuning. Dalam klasifikasi botani, temu lawak termasuk dalam dunia plantae, divisi spermatophyta, subdivisi angiospermae, genus Curcuma, dan spesies
Curcuma Xanthorrhiza Roxb (Widiastuty 2006).
Gambar 1 Tanaman temu lawak (Anonim 2010)
Temu lawak termasuk jenis tumbuhan herba yang batang pohonnya berbentuk batang semu dan tingginya dapat mencapai 2 meter (Mahendra 2005). Rimpang temu lawak sejak lama dikenal sebagai bahan ramuan obat. Rimpang temu lawak berukuran besar, bercabang-cabang, dan berwarna coklat kemerahan atau kuning tua. Daging rimpang berwarna jingga tua atau kecoklatan, beraroma tajam yang menyengat dan rasanya pahit (MTIC 2002). Gambar irisan rimpang temu lawak dapat dilihat pada Gambar 2.
Temu lawak secara tradisional telah banyak digunakan di negara-negara Asia Tenggara sebagai pangan dan obat-obatan (Rukayadi et al. 2006). Rimpang temu lawak digunakan sebagai obat kejang, malaria, mencret, kurang nafsu makan, kurang darah, cacar air, radang lambung, getah empedu
terganggu, cacingan, kekurangan air susu, eksema, sembelit, kencing darah, ayan, radang ginjal, demam kuning, pelepas gas dalam perut, anti-HIV (Syukur dan Hernani 2002), pelembab pada kosmetik (Tilaar et al. 2008), dan anti jerawat (Batubara 2008).
Gambar 2 Irisan rimpang temu lawak (Suryandari 2008)
Menurut Kiswanto (2009), kandungan kimia rimpang temu lawak yang memberi arti pada penggunaannya sebagai sumber bahan pangan, bahan baku industri, atau bahan baku obat dapat dibedakan atas beberapa fraksi, yaitu fraksi pati, kurkuminoid, dan minyak atsiri.
Xantorizol dan Aktivitas Biologisnya
Xantorizol adalah komponen khas minyak atsiri dari rimpang temu lawak yang termasuk ke dalam kelompok terpena teroksigenasi. Xantorizol memiliki rumus molekul C15H22O
[image:47.595.325.504.159.289.2] [image:47.595.322.509.497.656.2]dengan bobot molekul sebesar 218.335 g/mol. Nama IUPAC-nya 5-(1,5-dimetilheks-4-enil)-2-metilfenol. Rumus struktur xantorizol dapat dilihat pada Gambar 3.
pengobatan candidiasis (Rukayadi et al.
2006), dapat mencegah dan menghilangkan biofilm yang dibentuk oleh Streptococcus muta