TAMBAHAN MINYAK IKAN DAN VITAMIN E
DALAM PAKAN YANG DIPELIHARA PADA
SALINITAS MEDIA BERBEDA
S U R I A D A R W I S I T O
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi dengan judul "Kinerja reproduksi ikan nila (Oreochromis niloticus) yang mendapat tambahan minyak ikan dan vitamin E dalam pakan yang dipelihara pada salinitas media berbeda", adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir disertasi ini.
Bogor, Desember 2006
Suria Darwisito NRP. C061020031
mendapat tambahan minyak ikan dan vitamin E dalam pakan yang dipelihara pada salinitas media berbeda. Dibimbing oleh Muhammad Zairin Junior, Djadja Subardja Sjafei, Wasmen Manalu, dan Agus Oman Sudrajat.
Penelitian ini dilakukan untuk mengkaji pengaruh kombinasi minyak ikan dan vitamin E dalam pakan pada kualitas telur dan larva nila yang dipelihara pada salinitas media berbeda. Penelitian ini dilakukan melalui dua tahapan utama. Tahap pertama adalah pengaruh kombinasi miyak ikan dosis 10, 20, 30, dan 40 g/kg pakan dengan vitamin E dosis 50, 100, 150, dan 200 mg/kg pakan. Tahap kedua adalah kombinasi dari hasil pakan terbaik pada tahap pertama terhadap kualitas telur dan larva, dengan salinitas media 0, 10, 20, dan 300/00. Induk ikan uji yang diseleksi dan
digunakan dalam penelitian ini adalah 320 ekor induk betina dan 320 ekor induk jantan dengan tingkat kematangan gonad induk betina II (TKG II). Ikan diberi pakan uji dua kali setiap hari (pagi dan sore) secara at satiation. Parameter kualitas air untuk penelitian tahap I dan penelitian tahap II seperti temperatur, oksigen, pH, amoniak, dan CO2 diamati setiap minggu. Parameter yang diamati pada penelitian tahap
pertama dan penelitian tahap kedua adalah indeks gonad somatik, diameter telur, fekunditas, jumlah induk yang memijah, derajat tetas telur, ketahanan hidup larva, asam lemak n-3 dan vitamin E pada telur dan larva, serta pengukuran estradiol-17ß, tingkat kerja osmotik dan glukosa darah. Hasil penelitian pada tahap pertama menunjuk kan bahwa kombinasi dari minyak ikan dosis 30 g/kg pakan dengan vitamin E dosis 150 mg/kg pakan memberikan kinerja reproduksi terbaik. Kemudian, hasil penelitian tahap kedua mengindikasikan bahwa kinerja reproduksi terbaik terjadi pada salinitas 100/00.
niloticus) supplemented with fish oil and vitamin E in diets and reared at different salinity. Supervised by Muhammad Zairin Junior, Djadja Subardja Sjafei, Wasmen Manalu, and Agus Oman Sudrajat.
This research was conducted to study the effect of combination of fish oil and vitamin E supplemented in diet on the quality of eggs and larvae of Nile tilapia, reared at different salinity. The research was carried out in two phases. The first phase was to study the effect of combination between fish oil at the dose of 10, 20, 30, and 40 g/kg of diet and vitamin E at dose of 50, 100, 150, and 200 mg/kg of diet; while the second phase was to study the effect of the best combination diet resulted of the first phase on eggs and larval quality at different salinity level; namely 0, 10, 20, 300/00. Three hundreds and twenty pairs of broodstock (female at stage of maturity II)
were selected and used for this experiment. The fish were fed with the experimental diet twice a day (in the morning and afternoon) at satiation. Water quality parameters such as temperature, dissolved oxygen, pH, ammonia, and carbon dioxide were monitored once a week. Parameters observed at the first phase as well as at the second phase of the experiment consisted of gonad somatic index, egg diameter, fecundity, number of spawning broodstock, hatching rate, survival rate of larvae, n-3 fatty acid, vitamin E on egg and larvae, measurement of estradiol-17ß, osmotic regulation and blood glucose. Result from the first phase showed the combination between fish oil (30 g/kg diet) and vitamin E (150 mg/kg diet) gave the best reproduction performance. At the second phase, the best reproduction performance was obtained at the salinity of 100/00.
TAMBAHAN MINYAK IKAN DAN VITAMIN E
DALAM PAKAN YANG DIPELIHARA PADA
SALINITAS MEDIA BERBEDA
S U R I A D A R W I S I T O
Disertasi sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Departemen Budi Daya Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
© Hak cipta milik Institut Pertanian Bogor tahun 2006 Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam
Nama Suria Darwisito NRP. : C. 061020031
Disetujui oleh:
1. Komisi Pembimbing
Prof. Dr. Muhammad Zairin Jr. MSc. Dr. Ir. Djadja Subardja Sjafei. Ketua Anggota
Prof. Dr. Wasmen Manalu. Dr. Ir. Agus Oman Sudrajat, MSc.
Anggota Anggota
Diketahui,
2. Ketua Program Studi 3. Dekan Sekolah Pascasarjana Ilmu Perairan
Prof.Dr. H. Enang Harris, MS. Prof.Dr.Ir. Khairil A. Notodiputro, MS.
pasangan Bapak Itman Surjadi dan Ibu Darminah sebagai anak ke-dua dari enam bersaudara. Pendidikan sarjana ditempuh pada Fakultas Perikanan Program Studi Budi Daya Perairan, Jurusan Manajemen Sumber Daya Perairan, Universitas Sam Ratulangi, dan lulus pada tahun 1985. Selanjutnya, penulis diangkat menjadi staf pengajar Fakultas Perikanan sejak tahun 1987 pada Program Studi Budi Daya Perairan, Jurusan Manajemen Sumber Daya Perairan. Pada tahun 1991 penulis melanjutkan studi ke program Master Science (S2) di Fakultas Perikanan, Universitas Nagasaki, Japan, dan lulus pada tahun 1994. Selanjutnya, pada tahun 2002 penulis memperoleh kesempatan untuk melanjutkan studi ke program doktor (S3) pada Program
Pengasih lagi Maha Penyayang, karena atas izin dan limpahan karunia-Nya sehingga penulisan laporan disertasi dengan judul Kinerja reproduksi ikan nila (Oreochromis niloticus) yang mendapat tambahan minyak ikan dan vitamin E dalam pakan yang dipelihara pada salinitas media berbeda dapat diselesaikan. Laporan disertasi ini disusun sebagai salah satu syarat untuk memperoleh gelar Doktor pada Program Studi Ilmu Perairan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan ucapan terima kasih yang tulus kepada Prof.Dr.Ir.Muhammad Zairin Jr., M.Sc., Dr.Ir. Djadja Subardja Sjafei, Prof. Dr. Ir. Wasmen Mana lu dan Dr. Ir. Agus Oman Sudrajat, M.Sc., selaku komisi pembimbing, serta Dr.Ir. Ing Mokoginta M.S., Dr. Dedi Jusadi, dan Dr.Ir.Yulfiperius M.Si., yang telah memberi saran dan masukan serta memperluas wawasan keilmuan penulis dalam penyusunan laporan disertasi. Ungkapan terima kasih juga penulis sampaikan kepada Drs. Soetrisno kepala Instalasi Balai Riset Perikanan Budidaya Air Tawar, Cibalagung Bogor, yang telah memberi bantuan penggunaan fasilitas tempat penelitian dan bantuan tenaga teknis lapangan. Terima kasih juga penulis sampaikan kepada Bapak Wasjan dan Bapak Ranta selaku teknisi Laboratorium Nutrisi Ikan dan Laboratorium Hama dan Penyakit Ikan Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Ungkapan terima kasih kepada kedua orang tua dan mertua, serta istri tercinta Masita Paputungan beserta puteri tersayang Yumiko A. Ramadini yang selalu mendoakan dan juga merupakan sumber inspirasi dan spirit. Terima kasih saya sampaikan juga kepada sponsor beasiswa pendidikan pascasarjana dari Departemen Pendidikan Nasional Republik Indonesia (BPPS). Semoga segala usaha dan perhatian yang diberikan kepada penulis akan mendapat balasan yang setimpal dari Allah SWT amin.
Semoga karya ilmiah ini dapat bermanfaat bagi yang memerlukannya.
Bogor, Desember 2006
DAFTAR TABEL ... i
DAFTAR GAMBAR ... iii
DAFTAR LAMPIRAN ... vi
PENDAHULUAN ... 1
Latar Belakang ... 1
Pendekatan Masalah ... 3
Tujuan Penelitian... 6
Manfaat Penelitian ... 6
Hipotesis ... 6
TINJAUAN PUSTAKA ... 7
Reproduksi dan Perkembangan Gonad Ikan Nila ... 7
Peranan Hormon dalam Perkembangan Go nad ... 10
Vitamin E ... 11
Asam Lemak Linolenat n-3 dan Linoleat n-6 ... 13
Kebutuhan Vitamin E dan Asam Lemak... 15
Salinitas dan Osmoregulasi ... 16
Glukosa Darah sebagai Indikator Respons terhadap Stres ... 19
BAHAN DAN METODE ... 22
Penelitian Tahap I ... 22
Waktu dan Tempat ... 22
Pakan Uji ... 22
Rancangan Percobaan ... 25
Ikan Uji ... 25
Media Percobaan ... 26
Pemeliharaan Induk dan Pengambilan Data ... 27
Prosedur Pengambilan Sampel Darah ... 28
Parameter Uji yang Diamati ... 28
Pengukuran Estradiol-17ß ... 29
Analisis Kimia ... 30
Analisis Data ... 31
Penelitian Tahap II ... 31
Rancangan Percobaan ... 31
Jenis Pakan ... 31
Ikan Uji ... 31
Wadah Percobaan ... 32
Sumber Air ... 32
Adaptasi Ikan Uji ... 33
Pengukuran Tingkat Kerja Osmotik (TKO) ... 36
Analisis Data ... 37
HASIL DAN PEMBAHASAN ... 38
Hasil Pengamatan I: Pengaruh Pemberian Kombinasi Minyak Ikan dan Vitamin E Berbeda dalam Pakan untuk Memperbaiki Kualitas Te lur, dan Larva serta Kinerja Reproduksi ... 38
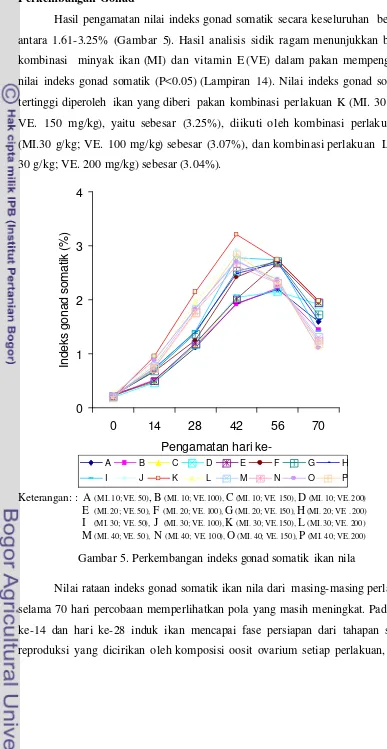
Perkembangan Gonad ... 39
Diameter Telur ... 46
Fekunditas ... 49
Jumlah Induk yang Memijah ... 51
Derajat Tetas Telur ... 55
Ketahanan Hidup Larva ... 58
Kandungan Asam Lemak n-3 dan Vitamin E dalam Telur dan Larva 61
Pembahasan ... 63
Hasil Pengamatan II: Pengaruh Konsentrasi Estradiol-17ß Plasma Darah dalam Proses Pematangan Gonad ... 69
Pembahasan ... 72
Hasil Pengamatan III: Kinerja Reproduksi Perbaikan Kualitas Telur dan Larva Ikan Nila yang Dipelihara pada Salinitas Media Berbeda ... 74
Pematangan Gonad ... 74
Diameter Telur ... 76
Fekunditas ... 78
Jumlah Induk Memijah ... 79
Derajat Tetas Telur ... 80
Ketahanan Hidup Larva ... 81
Tingkat Kerja Osmotik (TKO) ... 82
Pengaruh Tingkat Kerja Osmotik pada Jumlah Induk Memijah ... 83
Pengaruh Tingkat Kerja Osmotik pada Derajat Tetas Telur ... 84
Pengaruh Tingkat Kerja Osmotik pada Ketahanan Hidup Larva ... 84
Pembahasan ... 85
Hasil Pengamatan IV: Pengaruh Salinitas Media Berbeda pada Kinerja Reproduksi serta Efek Lanjut dari Pascastres ... 91
Pembahasan ... 93
KESIMPULAN DAN SARAN ... 96
DAFTAR PUSTAKA ... 97
DAFTAR TABEL
Halaman
1. Ciri-ciri sekunder induk jantan dan induk betina ikan nila ... 7
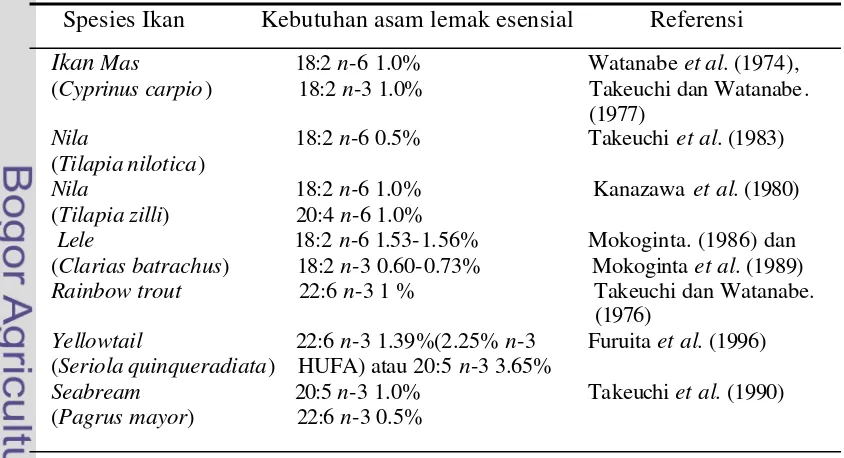
2. Kebutuhan asam lemak esensial pada berbagai jenis ikan ... 14
3. Hormon yang mempengaruhi kadar glukosa darah ... 21
4. Komposisi bahan pakan uji (%) ... 23
5. Komposisi proksimat, kandungan vitamin E, dan asam lemak pakan uji ... 24
6. Rancangan percobaan kombinasi minyak ikan (MI) dan vitamin E (VE) pada ikan nila ... 25
7. Kualitas air selama percobaan ... 33
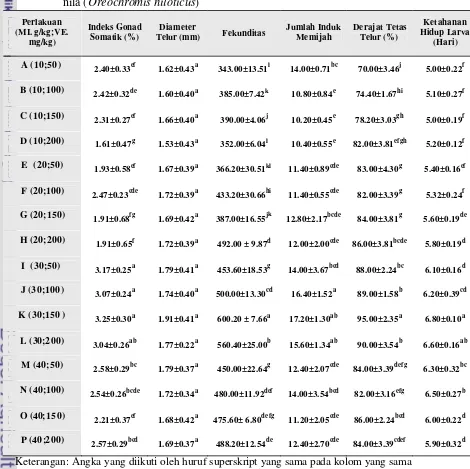
8. Nilai rataan indeks gonad somatik, diameter telur, fekunditas, jumlah induk yang memijah, derajat tetas telur, dan ketahanan hidup larva ikan nila (Oreochromis niloticus) ... 38
9. Jumlah kumulatif induk ikan nila yang memijah selama penelitian . 52
10. Kandungan asam lemak n-3 dan vitamin E (mg/kg) dalam telur, larva 0 hari (LoHr) dan larva 2 hari (L2Hr) (% area) pada ikan nila 62
11. Nilai rataan kadar estradiol-17ß (ng/ml) ikan nila ....………... 69
12. Nilai rataan indeks gonad somatik (%), diameter telur (mm), fekunditas (butir/ekor), jumlah induk memijah (ekor), derajat tetas telur (%), dan ketahanan hidup larva (hari) pada ikan nila ... 74
13. Diameter telur masing- masing perlakuan (mm/butir) pada salinitas media berbeda untuk ikan nila ... 77
14. Fekunditas yang dihasilkan masing- masing perlakuan pada salinitas media berbeda untuk ikan nila ... 78
15. Jumlah kumulatif induk ikan nila yang memijah ... 79
16. Derajat tetas telur yang dihasilkan masing- masing perlakuan pada ikan nila ... 80
18. Tingkat kerja osmotik (mOsm/L H2O) masing- masing
perlakuan selama percobaan pada ikan nila ... 82
DAFTAR GAMBAR
Halaman
1. Skema pendekatan masalah kinerja reproduksi ikan nila (Oreochromis niloticus) yang mendapat tambahan minyak ikan
dan vitamin E dalam pakan pada salinitas media berbeda ... 5
2. Induk ikan nila (Oreochromis nilotica) ... 8
3. Perbedaan lubang genital organ reproduksi ikan nila jantan dan
betina ... 8
4. Tata letak wadah percobaan secara acak ... 26
5. Perkembangan indeks gonad somatik ikan nila ... 39
6. Hubungan antara penambahan dosis minyak ikan dan indeks
gonad somatik pada ikan nila ... 40
7. Hubungan antara penambahan dosis vitamin E dan indeks gonad
somatik pada ikan nila ... 41
8. Hubungan antara penambahan kombinasi dosis minyak ikan dan
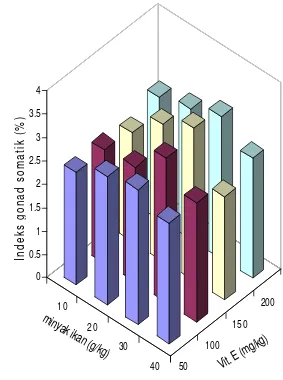
vitamin E terhadap indeks gonad somatik pada ikan nila ... 42
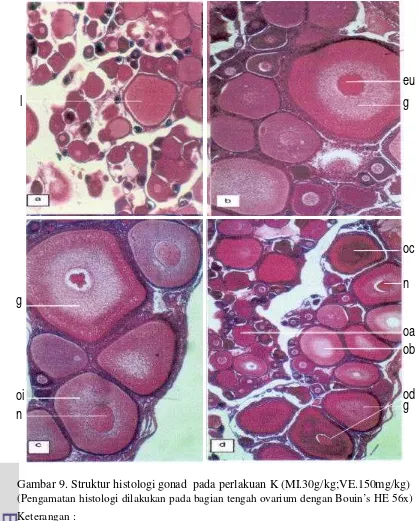
9. Struktur histologi gonad pada perlakuan K (MI.30g/kg;VE.150
mg/kg) ... 43
10. Gambaran histologi testis ikan nila (Oreochromis niloticus) ... 45
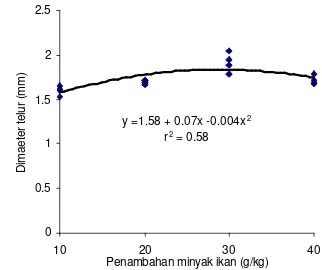
11. Hubungan antara penambahan dosis minyak ikan dan diameter telur pada ikan nila ... 47
12. Hubungan antara penambahan dosis vitamin E dan diameter
telur pada ikan nila ... 47
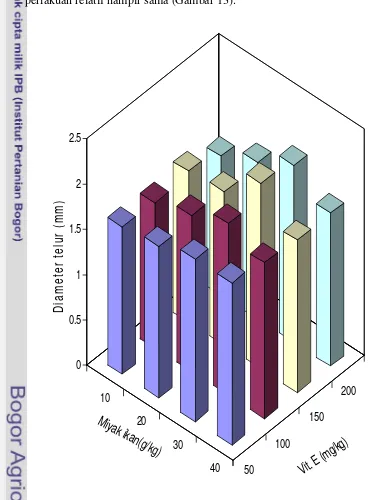
13. Hubungan antara penambahan dosis kombinasi minyak ikan dan
vitamin E terhadap diameter telur pada ikan nila ... 48
14. Hubungan antara penambahan dosis minyak ikan dan fekunditas
pada ikan nila ... 49
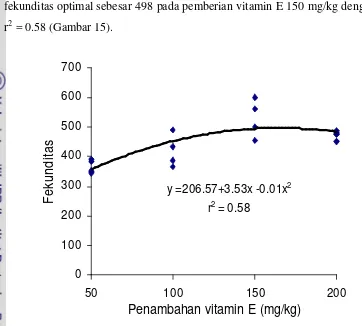
15. Hubungan antara penambahan dosis vitamin E dan fekunditas
16. Hubungan antara penambahan kombinasi dosis minyak ikan dan
vitamin E terhadap fekunditas pada ikan nila ... 51
17. Hubungan antara penambahan dosis minyak ikan dan jumlah
induk yang memijah pada ikan nila ... 53
18. Hubungan antara penambahan dosis vitamin E dan jumlah induk
yang memijah pada ikan nila ... 54
19. Hubungan antara penambahan kombinasi dosis minyak ikan dan
vitamin E terhadap jumlah induk yang memijah pada ikan nila ... 55
20. Hubungan antara penambahan dosis minyak ikan dan derajat
tetas telur pada ikan nila ... 56
21. Hubungan antara penambahan dosis vitamin E dan derajat tetas
telur pada ikan nila ... 57
22. Hubungan antara penambahan kombinasi dosis minyak ikan dan
vitamin E terhadap derajat tetas telur pada ikan nila ... 58
23. Hubungan antara penambahan dosis minyak ikan dan ketahanan
hidup larva pada ikan nila ... 59
24. Hubungan antara penambahan dosis vitamin E dan ketahanan
hidup larva pada ikan nila ... 60
25. Hubungan antara penambahan kombinasi dosis minyak ikan dan
vitamin E terhadap ketahanan hidup larva pada ikan nila ... 61
26. Hubungan antara penambahan dosis minyak ikan (MI) dan vitamin E (VE) terhadap jumlah induk memijah (JIM), derajat tetas telur (DTT), dan kelangsungan hidup larva (KHL) pada
ikan nila ... 63
27. Kadar estradiol-17ß plasma darah ikan nila ... 70
28. Hubungan antara penambahan dosis minyak ikan dan
estradiol-17ß pada ikan nila ... 71
29. Perkembangan indeks gonad somatik pada ikan nila ... 75
30. Hubungan antara salinitas media berbeda dan indeks gonad
somatik pada ikan nila ... 76
31. Hubungan antara salinitas media berbeda dan diameter telur
32. Hubungan antara salinitas media berbeda dan fekunditas
pada ikan nila ... 78
33. Hubungan antara salinitas media berbeda dan jumlah induk
memijah pada ikan nila ... 79
34. Hubungan antara salinitas media berbeda dan derajat tetas telur
pada ikan nila ... 80
35. Hubungan antara salinitas media berbeda dan ketahanan hidup
larva pada ikan nila ... 81
36. Hubungan antara salinitas media berbeda dan tingkat kerja
osmotik pada ikan nila ... 82
37. Hubungan antara tingkat kerja osmotik media (mOsm/L H20)
dan jumlah induk yang memijah pada ikan nila ... 83
38. Hubungan antara tingkat kerja osmotik media (mOsm/L H20)
dan derajat tetas telur pada ikan nila ... 84
39. Hubungan antara tingkat kerja osmotik media (mOsm/L H20)
dan ketahanan hidup larva pada ikan nila ... 85
40. Perkembangan glukosa darah ikan nila selama percobaan ... 91
41. Hubungan antara salinitas media berbeda dan glukosa darah
DAFTAR LAMPIRAN
Halaman
1. Komposisi vitamin mix dan mineral mix ... 106
2. Komposisi minyak ikan ... 107
3. Analisis bahan baku pakan uji ... 108
4. Prosedur analisis asam lemak (Takeuchi 1988) ... 109
5. Prosedur histologis gonad ... 111
6. Prosedur pengukuran osmolaritas media dan plasma darah ikan nila ... 114
7. Hasil analisis kandungan asam lemak dan vitamin E pakan uji .... 115
8. Distribusi frekuensi diameter telur ikan nila ... 116
9. Nilai rataan diameter telur pada setiap perlakuan (mm/butir) ikan nila ... 117
10. Nilai rataan fekunditas pada setiap perlakuan (butir/ekor) ikan nila ... 118
11. Nilai rataan derajat tetas telur pada setiap perlakuan (%) ikan nila ... 119
12. Nilai rataan ketahanan hidup larva pada setiap perlakuan (hari) ikan nila ... 120
13. Hasil analisis statistik pengaruh minyak ikan (MI) dan vitamin E (VE) terhadap diameter telur (DT) pada ikan nila ... 121
14. Hasil analisis statistik pengaruh minyak ikan (MI) dan vitamin E (VE) terhadap gonad somatik indeks (GSI) pada ikan nila ... 124
15. Hasil analisis statistik pengaruh minyak ikan (MI) dan vitamin E (VE) terhadap fekunditas (FEKDTS) pada ikan nila ... 127
16. Hasil analisis statistik pengaruh minyak ikan (MI) dan vitamin E (VE) terhadap jumlah induk yang memijah (JIM) pada ikan nila 130
18. Hasil analisis statistik pengaruh minyak ikan (MI) dan vitamin E (VE) terhadap ketahanan hidup larva (KHL) pada ikan nila ... 136
19. Hasil analisis statistik pengaruh salinitas media berbeda
terhadap diameter telur (DT) pada ikan nila ... 139
20. Hasil analisis statistik pengaruh salinitas media berbeda
terhadap gonad somatik indeks (GSI) pada ikan nila ... 140
21. Hasil analisis statistik pengaruh salinitas media berbeda
terhadap fekunditas (FEKDTS) pada ikan nila ... 141
22. Hasil analisis statistik pengaruh salinitas media berbeda
terhadap jumlah induk memijah (JIM) pada ikan nila ... 142
23. Hasil analisis statistik pengaruh salinitas media berbeda
terhadap derajat tetas telur (DTT) pada ikan nila ... 143
24. Hasil analisis statistik pengaruh salinitas media berbeda
terhadap ketahanan hidup larva (KHL) pada ikan nila ... 144
25. Hasil analisis statistik pengaruh salinitas media berbeda
terhadap tingkat kerja osmotik air laut (OSA) pada ikan nila 145
26. Hasil analisis statistik pengaruh salinitas media berbeda
terhadap tingkat kerja osmotik darah (OSD) pada ikan nila .... 146
27. Hasil analisis statistik pengaruh salinitas media berbeda
PENDAHULUAN
Latar Belakang
Ikan nila (Oreochromis niloticus) merupakan salah satu jenis ikan yang bernilai
ekonomis tinggi. Permintaan komoditas ini, baik benih maupun ikan konsumsi, dari
tahun ke tahun cenderung terus meningkat seiring dengan peningkatan pertambahan
jumlah penduduk. Budidaya ikan nila adalah salah satu aktifitas pemeliharaan yang
paling cepat pertumbuhannya dengan laju pertumbuhan dari tahun 1970-2002 naik
sebesar 13.4 %. Hasil produksi ikan nila dunia pada tahun 1990 meningkat dari
383.654 mt menjadi 1.505.804 mt pada tahun 2002 dan sebagai penyumbang 6 % dari
total produksi finfish dunia (FAO 2004). Ikan nila adalah salah satu komoditas ekspor
ikan budidaya yang memiliki nilai jual cukup baik dengan ukuran konsumsi 500-800
gr/ekor dalam bentuk filet telah di ekspor ke Amerika, Saudi Arabia, Hongkong dan
Singapura (Wardoyo 2005).
Kegiatan usaha budidaya ikan nila umumnya masih dilakukan di perairan
tawar, sementara dengan semakin meningkatnya jumlah penduduk menyebabkan
areal budidaya semakin berkurang. Oleh sebab itu perlu dilakukan pengembangan
usaha budidaya yang diarahkan ke perairan laut, karena ikan nila mempunyai
kemampuan untuk hidup dan berkembang biak pada salinitas yang lebar (eurihaline).
Indonesia mempunyai potensi budidaya laut cukup besar berdasarkan hitungan ada
sekitar 5 km dari garis pantai ke arah laut dengan potensi lahan budidaya diperkirakan
sekitar 24.53 juta ha (Sukadi 2002).
Ikan nila mempunyai prospek sangat baik untuk budidaya di perairan laut,
kare na rasa dagingnya lebih enak, gurih dan kenyal. Selain itu media air laut
merupakan desinfektan bagi sebagian parasit dan bakteri yang menyebabkan penyakit
pada ikan (Wardoyo 2005). Untuk memperoleh benih ikan nila yang diproduksi dari
air laut maka dilakukan penelitian dengan pendekatan nutrisi dan salinitas. Beberapa
laporan hasil penelitian telah membuktikan bahwa kecukupan nutrisi pakan meliputi
protein, karbohidrat, asam lemak, dan vitamin dalam suatu formulasi pakan ikan
adalah merupakan salah satu faktor paling penting yang membatasi produksi larva
dan kualitas larva. Dimana komposisi lipid induk ikan memainkan peranan sangat
penting dalam pemijahan, kelangsungan hidup dan pertumbuhan larva. Kandungan
highly unsaturated fatty acid (HUFA) pakan induk sangat mempengaruhi fekunditas,
fertilitas, penetasan, viabilitas telur dan pertumbuhan larva (El-Sayed et al. 2005).
Dalam upaya meningkatkan dan mengoptimalkan proses pematangan gonad,
kualitas telur dan larva, penelitian ini mencoba mengkombinasikan suatu proses
pendekatan nutrisi, yaitu dengan menambahkan vitamin E dan asam lemak esensial
dalam formula pakan. Kombinasi tersebut diharapkan akan lebih mengoptimalkan
proses reproduksi sehingga diharapkan input materi pakan yang masuk dapat secara
optimal diserap telur dan pada akhirnya dapat meningkatkan kualitas telur dan larva
(Yuan-you Li et al. 2005; Sau et al. 2004).
Asam lemak esensial terutama kelompok asam lemak linoleat dan linolenat,
umumnya merupakan bagian dari fosfolipid dari membran sel (Linder 1992). Untuk
memperbaiki rendahnya mutu telur dan kualitas telur telah dicoba dengan
penambahan vitamin E dan implan vitamin E (Prijono 1994 dan Prijono et al. 1997).
Hasil percobaan penambahan vitamin E dan implan vitamin E pada ikan Bandeng
ternyata dapat memperbaiki tingkat pembuahan dan derajat tetas sebesar 96 %.
Selanjutnya telah diketahui bahwa ikan membutuhkan vitamin E 50-100 mg/kg dan
100-200 mg/kg pakan induk nila Oreochromis nilotica dan rohu Labeo rohita
(Gomez-Marquez et al. 2003; Sau et al. 2004) serta kebutuhan asam lemak n-3
HUFA sebesar 2.40-3.70 % dalam pakan induk Plectorhynchus cinctus (Yuan-you Li
et al. 2005).
Ikan nila termasuk golongan organisme akuatik yang bersifat eurihaline.
Artinya, ikan nila mempunyai kemampuan untuk hidup dan berkembang biak pada
media dengan kisaran salinitas antara 0 o/oo - 35 o/oo. Ikan nila tidak dapat melakukan
proses reproduksi pada salinitas media lebih dari 30 o/oo (Watanabe 1985;
Fineman-Kalio 1988). Pada kondisi salinitas media dengan tingkat tekanan osmotik yang
berada di luar kisaran isosmotik, ikan nila akan melakukan kerja osmotik untuk
berjalan sempur na, termasuk dalam proses pertumbuhan dan reproduksi. Sekalipun
demikian pengaruh salinitas terhadap reproduksi dan kebutuhan nutrisi belum
sepenuhnya diketahui. Dengan demikian, penelitian ini penting dilakukan untuk
mengkaji kinerja reproduksi ikan nila yang mendapat tambahan minyak ikan dan
vitamin E dalam pakan yang dipelihara pada salinitas media berbeda.
Pendekatan Masalah
Asam lemak esensial dan vitamin E adalah unsur nutrien yang harus ada
dalam pakan karena dibutuhkan sebagai bahan struktur somatik, gonadik, dan
penentu kualitas telur. Ketika dalam perkembangannya telur tidak memperoleh
asupan asam lemak dan vitamin E yang optimal akan timbul dampak negatif, antara
lain:
(1) Terganggunya sintesis vitelogenin di hati sehingga mengakib atkan
kualitas telur menjadi rendah.
(2) Rendahnya kandungan fosfolipid yang diserap oleh oosit dalam proses
vitelogenesis.
(3) Kurangnya energi dalam proses vitelogenesis yang sangat dibutuhkan untuk
mendukung proses perkembangan gonad.
(4) Tidak terjadi distribusi materi nutrien yang merata ke seluruh bagian dalam
telur yang merupakan bahan awal dari perkembangan gonad.
Asam lemak esensial dan vitamin E dapat melindungi unit-unit lemak telur dari
kerusakan oleh proses oksidasi, yang pada akhirnya dapat meningkatkan produksi
benih yang berkualitas. Indikator produksi benih yang berkualitas adalah diameter
telur besar, derajat tetas telur dan ketahanan hidup larva lebih tinggi. Asam lemak
esensial dan vitamin E dibutuhkan secara bersamaan untuk pematangan gonad ikan.
Kadar vitamin E pakan akan bergantung pada kandungan asam lemak esensial pakan.
Semakin tinggi kebutuhan asam lemak pakan maka kebutuhan vitamin E juga
semakin tinggi. Asam lemak esensial sangat dibutuhkan dalam proses reproduksi
ikan, terutama untuk meningkatkan kualitas dan kuantitas telur. Penambahan asam
dan pertumbuhan Tilapia nilotica dan penambahan 1% 18:2 n-6 atau 20:4 n-6 pada
Tilapia zilii (Kanazawa et al. 1980 dan Takeuchi et al. 1983). Sesungguhnya, asam
lemak dibutuhkan dalam jumlah optimum karena asam lemak esensial tidak dapat
disintesis dalam tubuh ikan sehingga pemenuhan kebutuhan asam lemak esensial
hanya melalui substitusi. Secara umum ikan laut membutuhkan n-3 HUFA,
sedangkan ikan air tawar termasuk ikan nila juga membutuhkan n-3 dan n-6 untuk
proses reproduksi.
Verakunpirya et al, (1996) menyatakan bahwa vitamin E sangat berperan dalam
perkembangan gonad dan juga mempengaruhi kualitas telur yang dihasilkan. Pada
ikan ekor kuning, penambahan vitamin E sebanyak 200 mg/kg pakan induk
menghasilkan fertilisasi telur, penetasan telur, dan jumlah larva yang tertinggi.
Kuning telur berasal dari vitelogenin yang disintesis dalam jaringan hati kemudian
dilepaskan ke dalam sistem pembuluh darah, dan selanjutnya vitelogenin dipecah
menjadi dua komponen, yaitu fosvitin dan lipovitelin yang tersimpan dalam kuning
telur.
Derajat tetas telur dipengaruhi oleh kandungan lipoprotein dalam telur. Kadar
lipoprotein dalam telur sangat bergantung pada kadar lipoprotein dalam darah dan
kelancaran proses vitelogenesis. Kekurangan zat-zat yang dibutuhkan dalam proses
vitelogenesis, antara lain asam lemak esensial dan vitamin E, menyebabkan proses
vitelogenesis tidak berjalan dengan sempurna. Kerja hormon juga diperlukan untuk
mempercepat dan meningkatkan proses sintesis vitelogenin dan penyerapan oleh
oosit.
Ikan nila termasuk golongan organisme akuatik yang bersifat eurihalin, artinya
mempunyai kemampuan untuk bertahan hidup pada media dengan kisaran salinitas
yang lebar. Pada kondisi media dengan tekanan osmotik yang berada di luar kisaran
isosmotik, ikan nila melakukan kerja osmotik untuk keperluan osmoregulasi. Untuk
Pakan + Vitamin E
Minyak Ikan
Ikan
Salinitas
Protein/ Energi
Vitamin E/ Asam Lemak
Salinitas Optimal SGR
Reproduktif
Lipoprotein dan Fosfolipid
Vitellogenin
Tingkat Kematangan
Gonad
Lipoprotein Vitamin E Tingkat
Kematangan Telur
Kualitas Telur dan Larva
+ +
+
+
+
-
-
- -
-
Input Proses Output
Tujuan Penelitian
1. Mengkaji kombinasi formula pakan yang terbaik melalui penambahan minyak ikan dan vitamin E dalam menstimulasi kinerja reproduksi
2. Mengkaji pengaruh estradiol-17ß plasma darah dalam proses pematangan gonad.
3. Mengkaji pengaruh salinitas media berbeda pada perbaikan kualitas telur dan larva, serta menentukan tingkat tekanan osmotik optimum yang mampu memberikan performans reproduksi ikan nila yang maksimum.
4. Mengkaji pengaruh salinitas media berbeda serta efek lanjut dari
pascacekaman pada kinerja reproduksi.
Manfaat Penelitian
Hasil penelitian ini dapat digunakan sebagai acuan dan informasi dasar kombinasi formula pakan yang tepat pada induk ikan nila sehingga dapat meningkatkan kualitas telur, kualitas larva, dan ketersediaan benih secara kontinu.
Hipotesis
1. Penambahan minyak ikan dan vitamin E dengan kombinasi yang tepat (optimal) dalam pakan dapat meningkatkan kualitas vitelogenin serta kandungan fosfolipid telur, yang kalau tetap terjaga selama proses vitelogenesis berlangsung akan meningkatkan kualitas telur, larva, dan ketahanan hidup larva ikan nila.
TINJAUAN PUSTAKA
Reproduksi dan Perkembangan Gonad Ikan Nila
Klasifikasi ikan nila menurut Trewavas (1982), adalah sebagai berikut :
Filum : Chordata
Sub Filum : Vertebrata
Kelas : Osteichthyes
Sub Kelas : Acanthoptherigi
Ordo : Percomorphi
Sub Ordo : Percoidea
Famili : Cichlidae
Genus : Oreochromis
Spesies : Oreochromis niloticus
Pada genus Oreochromis, induk ikan betina mengerami telur dan larvanya dalam rongga mulut, menjaga dan membesarkan larvanya sendiri, dan secara alami ikan nila dapat memijah sepanjang tahun di daerah tropis. Pada umumnya pemijahan ikan nila terjadi pada setiap musim hujan, yaitu 6 – 7 kali/tahun. Ikan nila mencapai fase dewasa pada umur 4 – 5 bulan, dan masa pemijahan produktif induk adalah pada umur 1,5 – 2,0 tahun dengan bobot di atas 500 g/ekor.
Jenis kelamin ikan nila dapat dibedakan pada saat berumur 3-6 bulan, berdasarkan ciri sekunder induk ikan nila jantan dan induk betina (Tabel 1).
Tabel. 1 Ciri-ciri sekunder induk jantan dan induk betina ikan nila
Faktor Pembeda Induk Jantan Induk Betina
Bentuk badan Lebar dan lebih ramping Pendek dan gemuk
Kelamin sekunder Tubuh berwarna hitam kelam dan pada bagian dagu berwarna putih serta pada bagian ujung sirip ekor berwarna merah cerah
Tubuh berwarna hitam dan dagunya berwarna putih
Jumlah lubang genital Satu, berfungsi sebagai saluran pengeluaran urin dan sperma
Dua, berfungsi sebagai saluran urin dan saluran pengeluaran telur
Alat kelamin Berbentuk tonjolan memanjang dan meruncing
Berbentuk membundar
Gambar 2. Induk ikan nila (Oreochromis nilotica) (a) Induk jantan, (b) Induk betina a
b
JANTAN BETINA
Sirip punggung depan Sirip punggung belakang
Sirip ekor
Sirip dada
Sirip perut Sirip dubur
Proses pemijahan ikan nila berlangsung sangat cepat, yaitu dalam waktu 50 – 60 detik mampu menghasilkan 20 – 40 butir telur yang telah dibuahi. Pemijahan terjadi beberapa kali dengan pasangan yang sama atau berbeda hingga membutuhkan waktu 20 – 60 menit. Telur ikan nila berdiameter 2,8 mm, berwarna abu-abu, kadang-kadang berwarna kuning, tidak lengket, dan tenggelam di dasar perairan. Telur yang telah dibuahi dierami dalam mulut (mouth breeder) induk betina kemudian menetas setelah 4 – 5 hari (Gomez-Marquez et al. 2003).
Dadzie dan Wangila (1980) mengk lasifikasikan tingkat kematangan ovarium ikan nila menjadi 5 tingkat. Pada kematangan gonad tingkat I: ovarium masih kecil, transparan, dan oosit muda hanya terlihat dengan menggunakan mikroskop. Pada kematangan gonad tingkat II, ovarium berwarna kuning terang, dan oosit dapat terlihat dengan mata. Pengamatan secara histologis memperlihatkan bahwa ovarium terdiri atas oosit muda dan oosit yang berisi protoplasma yang belum berkuning telur. Pada kematangan gonad tingkat III, ovarium besar, berwarna kuning gelap, dan ada oosit yang mulai mengandung kuning telur. Pada kematangan gonad tingkat IV, ovarium besar, berwarna cokelat, banyak oosit berukuran maksimal dan mudah dipisahkan. Pada kematangan gonad tingkat V, ovarium berwarna kuning terang, ukurannya berkurang karena telur yang sudah matang telah dilepaskan. Ovarium berisi oogonia, oosit berprotoplasma, dan sedikit oosit mengandung kuning telur, dan banyak dijumpai folikel pecah.
Peranan Hormon dalam Perkembangan Gonad
Hormon adalah zat yang disintesis pada kelenjar tanpa saluran dan disekresikan ke dalam aliran darah untuk dikirim ke bagian organ target (Djojosoebagio 1996). Estradiol-17ß adalah salah satu hormon steroid turunan kolesterol, yang berperan penting dalam proses vitelogenesis (Cerda et al. 1996). Estradiol-17ß diproduksi oleh lapisan granulosa pada folikel yang disekresikan ke aliran darah. Sebagian akan menuju hati dan sebagian akan memberikan rangsang balik ke hipotalamus dan hipofisa. Estradiol-17ß yang menuju hati akan berperan dalam proses pembentukan vitelogenin yang merupakan komponen utama kuning telur. Rangsangan yang diberikan estradiol-17ß kepada hipotalamus adalah memacu pelepasan gonadotropin releasing hormon (GnRH) yang selanjutnya hormon ini merangsang hipofisa untuk melepaskan gonadotropin yang berperan dalam merangsang ovulasi pada oosit.
Selanjutnya sintesis vitelogenin (prekursor kuning telur) dalam hati disebut vitelogenesis. Vitelogenin diangkut dalam darah menuju oosit, dan diserap secara selektif, dan selanjutnya disimpan sebagai kuning telur. Vitelogenin merupakan glikofosfoprotein yang mengandung kira-kira 20% lemak, terutama fosfolipid, trigliserida, dan kolesterol. Pada ikan betina, ovari memberikan respons terhadap peningkatan konsentrasi gonadotropin dengan cara tidak langsung dalam bentuk peningkat produksi estrogen. Androgen dapat merangsang vitelogenesis, setelah androgen dikonversi menjadi estrogen, sehingga terjadi juga vitelogenesis yang menyebabkan indeks gonad somatik ikan meningkat (Schulzt 1984; Cerda et al. 1996).
Fenomena penimbunan materi kuning telur oleh oosit ikan dibagi menjadi dua fase, yakni sintesis kuning telur dalam oosit (vitelogenesis endogen) dan penimbuman prekursor (bahan perintis) kuning telur yang disintesis di luar oosit (vitelogenesis eksogen) (Matty 1985). Gelembung kuning telur positif-PAS (mukopolisakarida atau glikoprotein) umumnya merupakan struktur yang pertama muncul dalam sitoplasma oosit selama pertumbuhan sekunder oosit, dan pertama kali muncul di zona terluar dan zona midcortical pada oosit. Ketika vitelogenesis berlangsung, sebagian besar sitoplasma telur matang ditempati oleh banyak gelembung kuning telur yang padat dan dikelilingi oleh selapis membran pembatas.
Vitamin E
Vitamin E merupakan vitamin yang tidak larut dalam air namun larut dalam minyak, lemak, aseton, alkohol, kloroform, benzena, ataupun pelarut lemak lainnya. Di alam terdapat 6 jenis vitamin E, yaitu alfa, beta, gama, delta, eta, dan zeta tokoferol (Marthin et al. 1990). Selanjutnya dikatakan bahwa dari jenis-jenis vitamin E tersebut a-tokoferol (5, 7, 8 trimetil tokol) dengan rumus kimianya C29H50O2 merupakan jenis vitamin E terpenting dengan keaktifan paling tinggi.
Fungsi vitamin E yang paling nyata adalah sebagai antioksidan dan antiradikal bebas, terutama untuk asam lemak tidak jenuh pada fosfolipid dalam membran sel. Vitamin E sebagai antioksidan dapat melindungi vitamin A, vitamin C, dan asam lemak tak jenuh yang labil dari proses oksidasi oleh oksigen, yaitu mulai dari pencernaan, metabolisme, penimbunan, dan penyimpanan dalam jaringan atau fungsi vitamin E dapat disebut sebagai pembersih radikal bebas. Vitamin E berperan dalam proses kerja enzim amino-levulinic acid synthetase, aktivitas glutathione peroxidase, mencegah he molisis sel darah merah, mencegah peroksidase lipid racun terhadap membran, melancarkan absorpsi asam amino, dan berperan dalam pemasakan mitosis sel.
juga bahwa fungsi vitamin E dalam sistem tersebut menjaga kestabilan selaput-selaput mikrosom dari serangan radikal bebas. Seme ntara itu diketahui pula bahwa pada ikan Atlantik salmon, vitamin E diangkut dari jaringan perifer ke gonad melalui hati bersama lipoprotein plasma (Lix et al. 1994).
Lebih jauh lagi, defisiensi vitmain E berpengaruh pada kualitas telur, seperti terliha t dari rendahnya jumlah telur yang terbuahi pada red sea bream (Watanabe et al. 1991). Ternyata dengan penambahan vitamin E sebanyak 200 mg/kg pakan induk akan meningkatkan jumlah larva yellowtail yang dihasilkan. Selanjutnya Effendie (1979) menyatakan bahwa pada proses reproduksi, sebelum terjadi pemijahan, sebagian besar hasil metabolisme diutamakan untuk perkembangan gonad. Pada masa reproduksi, a-tokoferol akan didistribusikan ke jaringan adiposa oosit. Sebelum sampai ke jaringan tersebut, a-tokoferol bersama asam lemak berantai panjang yang berbentuk misel terlebih dahulu diabsorbsi pada segmen usus (Rastogi 1976 dan Machlin 1990). Selanjutnya a-tokoferol diangkut ke hati dalam bentuk kilomikron, dan ke jaringan tepi dalam lipoprotein. Fosfolipid mitokondria, retikulum endoplasma dan membran plasma mempunyai afinitas spesifik untuk a-tokoferol, dan vitamin berkumpul pada tempat ini (Martin et al. 1990).
Vitamin E memainkan peranan yang sangat penting dalam reproduksi ikan (Takeuchi et al. 1981). Diduga vitamin E banyak mempengaruhi fungsi fisiologis seperti pemijahan, fertilisasi, maupun penetasan telur yang dihasilkan (Watanabe et al. 1984). Verakunpiya et al. (1996) mengemukakan bahwa vitamin E adalah vitamin yang berperan penting dalam perkembanga n gonad. Kandungan vitamin E 24.5 IU/g pakan memberikan hasil terbaik untuk pematangan gonad ikan yellow tail. Pada umumnya konsentrasi vitamin E yang tinggi terdapat pada sel telur dan konsentrasi yang rendah terdapat pada lapisan jaringan gonad sesaat setelah induk memijah.
ditambah vitamin E dl-a-tokoferol asetat 200 mg/kg pakan maka daya apung telur meningkat menjadi 77.9%. Telur red sea bream disebut normal apabila telur tersebut mengapung di permukaan air dan abnormal bila tenggelam (Watanabe et al. 1984). Selanjutnya Watanabe et al. (1984) mengevaluasi pemberian vitamin E (dl-a-tokoferol asetat) 0.441, 1.473, 0.647, 0.420 dan 0.402 mg/g pakan dalam pakan induk red sea bream. Hasilnya terjadi penyimpanan vitamin E dalam lemak telur berturut -turut sebesar 9.70, 13.40, 15.90, 20.10 dan 12.40%. Tingkat penyimpanan tersebut terlihat berkorelasi dengan vitamin E dalam pakan. Selanjutnya dijelaskan bahwa vitamin E dalam pakan yang terbaik (0.420 mg/g pakan) menghasilkan derajat tetas telur 95% dan larva normal 95.7%.
Sehubungan dengan reproduksi, beberapa hasil penelitian pada beberapa spesies hewan jelas menunjukkan bahwa hewan jantan yang defisien vitamin E mengalami degenerasi epitel tub uh sehingga produksi sperma berhenti. Pada hewan betina, kemungkinan adanya kegagalan fungsi uterus dengan tidak adanya perkembangan pembuluh darah yang memungkinkan koseptus diimplantasikan ke dalam dinding uterus. Kegagalan ini dapat menyebabkan fetus, dan implantasi tersebut tidak terjadi (Linder 1992).
Asam Lemak Linolenat n-3 dan Linoleat n-6
Martin et al. (1990) menyatakan bahwa asam lemak esensial, terutama arakidonat merupakan prekursor prostaglandin (PGF a yang dapat mempengaruhi replikasi sel. Selain dapat mempengaruhi replikasi sel, beberapa jenis prostaglandin lainnya mempunyai fungsi induksi dan pengaturan transport ion, terutama pada bagian insang yang berhubungan dengan proses pengaturan mineral yang berhubungan dengan osmoregulasi.
Beberapa kelompok asam lemak bersifat hidrofobik, atau tidak larut dalam air pada membran sel (Bell et al. 1986). Namun demikian, beberapa fosfolipid, spingolipid (lipid polar) mengandung gugus asam lemak polar (Martin 1990) yang dapat larut dalam air. Sifat fisik dari membran sel ini ditentukan oleh fosfolipid yang ada pada membran, komposisi asam lemak pada fosfolipid, dan interaksinya dengan kolesterol dan protein. Penelitian yang telah dilakukan oleh Watanabe (1988), menunjukkan bahwa pemberian asam lemak n-3-HUFA pada ikan rainbow trout meningkat retensi protein dan efisiensi pakan dibandingkan dengan yang tidak
diberi asam lemak n-3 HUFA. Hasil penelitian lainnya menunjukkan bahwa
pemberian asam lemak n-3 HUFA dalam pakan ikan mas efektif menurunkan
lipogenesis, glikolisis, dan degradasi asam amino dalam hati ikan (Shikata dan Simeno 1994).
[image:32.596.97.519.519.748.2]Untuk lebih lengkap dan jelas penelitian mengenai asam lemak esensial yang telah dilaporkan oleh beberapa peneliti disajikan pada Tabel 2.
Tabel 2. Kebutuhan asam lemak esensial pada berbagai jenis ikan Spesies Ikan Kebutuhan asam lemak esensial Referensi Ikan Mas 18:2 n-6 1.0% Watanabe et al. (1974),
(Cyprinus carpio) 18:2 n-3 1.0% Takeuchi dan Watanabe.
(1977)
Nila 18:2 n-6 0.5% Takeuchi et al. (1983)
(Tilapia nilotica)
Nila 18:2 n-6 1.0% Kanazawa et al. (1980) (Tilapia zilli) 20:4 n-6 1.0%
Lele 18:2 n-6 1.53-1.56% Mokoginta. (1986) dan (Clarias batrachus) 18:2 n-3 0.60-0.73% Mokoginta et al. (1989) Rainbow trout 22:6 n-3 1 % Takeuchi dan Watanabe.
(1976)
Yellowtail 22:6 n-3 1.39%(2.25% n-3 Furuita et al. (1996)
(Seriola quinqueradiata) HUFA) atau 20:5 n-3 3.65%
Kebutuhan Vitamin E dan Asam Lemak
Sebagai antioksidan, vitamin E (a-tokoferol) mencegah terjadinya oksidasi pada unit-unit asam lemak, terutama asam lemak tidak jenuh (Machlin 1990) dan fosfolipid membran sel (Linder 1992). Selanjutnya Halver 1985 GDQ Halver 989 juga menyatakan bahwa pada tingkat seluler, vitamin E d-a-tokoferol mempunyai peranan sebagai antioksidan pada asam lemak tidak jenuh (Polyunsaturated fatty acid) yang berada pada membran sel sehingga meningkatkan efisiensi permeabilitas membran tersebut. Sifat vitamin E (a-tokoferol) yang hanya larut dalam lemak menyebabkan transpor vitamin ini dalam tubuh sejalan dengan transpor lemak (Machlin 1990). Pada masa reproduksi a-tokoferol bersama asam lemak berantai panjang yang berbentuk misel terlebih dahulu diabsorbsi pada segmen usus (Rastogi 1976 dan Machlin 1990).
Vitamin E dan asam lemak esensial dibutuhkan secara bersamaan untuk pematangan go nad ikan, dan dosis vitamin E dalam pakan akan bergantung pada kandungan asam lemak esensial yang ada dalam pakan tersebut. Semakin tinggi kandungan asam lemak esensial pakan, kebutuhan vitamin E meningkat pula (Cahu et al. 1991; Watanabe et al. 1991; Prawirokusumo 1991). Namun demikian, dalam konsentrasi asam lemak yang berbeda, kisaran kebutuhan vitamin E untuk induk rainbow trout adalah antara 30 GDQ 50 mg/kg pakan (Cho et al. 1985). Hubungan antara konsumsi asam lemak tidak jenuh (PUFA) dan vitamin E didasarkan fakta bahwa asam-asam lemak esensial tersebut adalah yang paling mudah dioksidasi, dan berada pada bagian dinding sel tempat penyimpanannya pada tubuh.
penyusunan ransum, kekurangan vitamin dapat menyebabkan gangguan pertumbuhan dan kelangsungan hidup ikan. Kebutuhan umum ikan akan vitamin dalam pakan untuk mencegah defisiensi adalah sebagai berikut, vitamin A 1.000-2.000 IU, Vitamin D 1 600-2000 IU, dan vitamin E 30-50 mg (Cho et al. 1985).
Salinitas dan Osmoregulasi
Salinitas dapat didefinisikan sebagai jumlah total bahan padatan dalam gram yang terlarut dalam satu kilogram air laut jika seluruh karbonat telah teroksidasi, bromine, dan iodine digantikan oleh khlorin, dan seluruh bahan organik telah teroksidasi sempurna. Salinitas dinyatakan dalam gram per kilogram air laut, part per thousand (ppt) dan menggunakan tanda (o/oo).
Boyd (1982) mendefinisikan salinitas sebagai konsentrasi total dari semua ion yang terlarut dalam air. Salinitas adalah bobot garam- garam organik halogen yang terlarut dalam satu kilogram air, bila semua bromida dan iodida disetarakan dengan klorida dan semua karbonat disetarakan dengan oksidanya. Salinitas dapat dinyatakan sebagai konsentrasi total semua ion yang terlarut dalam air.
Salinitas berhubungan erat dengan tekanan osmotik dan tekanan ionik air, sebagai media internal maupun eksternal. Oleh karena itu, gradien salinitas berkaitan erat dengan gradien tekanan osmotik maupun tekanan ionik air dan hal ini sangat mempengaruhi komposisi biota air, terutama di perairan estuaria. Salinitas air laut relatif konstan atau dengan kata lain komposisi dan konsentrasi ionnya relatif konstan serta lebih besar daripada air tawar.
Sifat osmotik air bergantung pada seluruh ion yang terlarut dalam air tersebut. Semakin besar jumlah ion terlarut dalam air, semakin tinggi tingkat salinitas dan kepekatan osmotik larutan sehingga akan menyebabkan makin bertambah besar tekanan osmotik medium. Ion-ion yang dominan dalam menentukan tekanan osmotik (osmolaritas) air laut adalah Na+ dan Cl -, dengan kandungan 30.61 % dan 55.04 % dari total seluruh ion- ion yang terlarut dalam air (Harvey 1976).
akan mengakibatkan pelarut dalam sel keluar dari sel dan menyebabkan sel mengkerut. Kedua adalah keadaan hipotonik, yaitu keadaan saat konsentrasi zat terlarut di lingkungan lebih rendah daripada konsentrasi zat terlarut dalam sel. Keadaan ini akan mengakibatkan pelarut di lingkungan masuk ke dalam sel yang menyebabkan sel mengembang. Ketiga adalah keadaan isotonik, yaitu keadaan saat konsentrasi zat terlarut di lingkungan seimbang dengan konsentrasi zat terlarut dalam sel. Keadaan ini merupakan kondisi keseimbangan osmotik.
Selanjutnya, salinitas media menentukan keseimbangan pengaturan tekanan osmotik cairan tubuh, dan mempunyai pengaruh penurunan pada metabolisme, tingkah 1aku, pertumbuhan, dan kemampuan bereproduksi. Ikan-ikan air tawar mempunyai tekanan osmotik cairan tubuh yang lebih besar dibandingkan dengan tekanan osmotik cairan media sehingga garam-garam dalam tubuh cenderung keluar, sedangkan air cenderung masuk ke da1am tubuh. Hal yang sebaliknya terjadi pada ikan- ikan air laut. Supaya sel-sel organ tubuh dapat berfungsi dengan baik untuk melakukan proses fisiologis, sel-sel tersebut harus berada dalam kondisi yang seimbang antara tekanan osmotik internal dan tekanan eksternalnya.
Untuk itu, diperlukan suatu proses pengaturan tekanan osmotik internal dengan tekanan osmotik eksternal. Pengaturan tekanan osmotik cairan tubuh agar proses-proses fisiologis tubuh dapat berjalan normal dinamakan osmoregulasi. Tekanan osmotik ikan atau organisme akuatik lainnya ditentukan oleh tingkat salinitas medianya sehingga ikan akan melakukan penyesuaian terhadap salinitas melalui proses osmoregulasi. Tekanan osmotik terjadi karena adanya perbedaan konsentrasi pelarut dan yang larut pada dua sisi lapisan permeabel.
Osmoregulasi pada organisme akuatik dapat terjadi dalam dua cara yang
berbeda (Gilles dan Jeuniaux 1979). Pertama sebagai usaha untuk menjaga osmokonsentrasi cairan di luar sel agar tetap konstan terhadap apa pun yang terjadi pada salinitas medium di luar selnya. Kedua sebagai usaha untuk memelihara isosmotik cairan dalam sel terhadap cairan luar sel.
dari segi ekofisiologis, organisme akuatik dapat dibagi menjadi dua golongan berdasarkan mekanisme fisiologisnya terhadap osmoregulasi lingkungan media yang berbeda. (1) Osmokonformer, yaitu organisme yang secara osmotik labil, tidak mempunyai kemampuan mengatur kand ungan garam serta osmolaritas dalam cairan internalnya sehingga osmolaritas cairan tubuhnya berubah dan menyesuaikan kondisi osmolaritas media hidupnya. (2) Osmoregulator, yaitu organisme yang mempunyai mekanisme fisiologis untuk menjaga kemantapan milieu interiornya dengan cara mengatur osmolaritas konsentrasi osmotik antara cairan intrasel dan cairan ekstraselnya.
Pada umumnya organisme akuatik di laut mempunyai osmolaritas darah (tekanan osmotik cairan internal) yang berkisar antara 380 dan 450 mOsm/kg, sedangkan tekanan osmotik di luar berkisar antara 800 dan 1200 mOsm/kg sehingga air dalam tubuh akan senantiasa berdiffusi keluar (Bone and Marshall 1982). Apabila ikan air laut menghadapi perubahan keadaan lingkungan seperti peningkatan tekanan osmotik media hidupnya, ikan tersebut secara konstan akan kehilangan air dan ion- ion lewat membran filamen insang dan melalui pembuangan urine. Sebagai kompensasi terhadap kehilangan air tersebut, ikan air laut meminum air laut dalam jumlah yang banyak. Dengan demikian, sejumlah garam juga akan ikut terambil dan terserap pada saluran pencernaan bersama-sama dengan air.
Glukosa Darah sebagai Indikator Respons terhadap Stres
Stres adalah suatu respons fisiologis yang terjadi pada saat hewan berusaha untuk mempertahankan atau memelihara homeostatis. Penyebab stres dapat berasal dari perubahan lingkungan dan respons organisme lain (Adams 1990). Bila ikan mengalami stres, ikan tersebut menanggapinya dengan mengembangkan suatu kondisi hemeostatis yang baru dengan merubah metabolismenya. Respons terhadap stres ini biasanya dikontrol oleh sistem endokrin melalui kortisol (Barton et al. 1980) dan katekholamin (Woodward 1982). Pada umumnya stres disebabkan oleh adanya rangsangan sistem neuroendokrin secara bertingkat dengan melibatkan katekolamin dan aktivasi poros hipotalamus – hipofisis – interrenal.
Stres dapat juga dideteksi pada keseimbangan hidromineral, yaitu menyebabkan kelebihan air pada ikan air tawar dan kehilangan air pada ikan yang hidup di air laut. Stres juga dapat mempengaruhi sistem imunitas, yaitu menurunkan kemampuan imunitas yang akan berdampak buruk pada reproduksi. Dampak pada reproduksi meliputi tingkat kematangan gonad, waktu pemijahan (ovulasi), kualitas gamet, dan kualitas progeni. Mazeaud dan Mazeaud (1981) menyatakan bahwa adanya stres pada ikan- ikan elasmobranchi dan teleostei menyebabkan peningkatan kadar glukosa darah. Bahkan dikatakan pula bahwa pada kegiatan budi daya seperti penangkapan dan penanganan sebagian besar akan menyebabkan hiperglisemia. Pengukuran kadar glukosa darah dapat digunakan sebagai parameter stres yang sederhana, efektif, dan memadai untuk berbagai macam stresor, sementara itu pengukuran kortikosteroid dan katekholamin biayanya sangat mahal dan tidak praktis dalam aplikasi untuk pembenihan ikan.
Tingkat glukosa darah dapat menjadi indikator terjadinya awal stres pada ikan. Stres juga mempengaruhi tingginya tingkat glukosa darah, karena tingkat glukosa darah sangat sensitif terhadap hormon yang mengatur stres. Keberadaan glukosa darah ditentukan oleh ketersedian pakan, waktu akhir makan, simpana n glikogen hati, stadia perkembangan, dan musim (Mazeaud dan Mazeaud 1981). Stres menyebabkan peningkatan kortisol plasma, dimana tingkat kortisol yang tinggi mempengaruhi limfosit dan sistem kekebalan seluler serta menghasilkan hambatan pada sistem kekebalan.
Stres menyebabkan peningkatan sekresi kortisol (glukokortikoid). Dengan demikian, stres dapat meningkatkan glukosa darah. Beberapa mekanisme yang berperan dalam mempertahankan kestabilan glukosa darah adalah glukoneogenesis, lipolisis, glikogenesis, dan lipogenesis. Homeostatis kadar glukosa dalam darah dipertahankan oleh beberapa mekanisme, yaitu mekanisme yang mengatur kecepatan konversi glukosa menjadi glikogen atau lemak yang disimpan, dan mekanisme yang mengatur pelepasan kembali dari bentuk simpanan untuk dikonversi menjadi glukosa yang masuk ke dalam darah. Oleh karena itu, dengan banyaknya mekanisme yang berperan dalam mempertahankan homeostatis glukosa darah, kestabilan glukosa darah menjadi sangat penting bagi kesehatan bahkan kehidupan (Piliang dan Djojosoebagio 2000).
meregulasi glukosa darah adalah insulin, glukagon, tiroid, epinefrin, dan hormon steroid (Piliang dan Djojosoebagio 2000) (Tabel 3).
Tabel 3. Hormon yang mempengaruhi kadar glukosa darah
___________________________________________________________________ Hormon Sekresi Kelenjar Pengaruhnya/Fungsi Kadar Glukosa Darah ___________________________________________________________________ Insulin Pankreas Transpor glukosa Turun
Tiroid Tiroid Absorbsi glukosa dari usus Naik Glukagon Pankreas Glikogenolisis di hati Naik Epinefrin Adrenal Glikogenolisis hati dan otot Naik
BAHAN DAN METODE
Penelitian Tahap I
Waktu dan Tempat
Penelitian dilaksanakan di Balai Riset Perikanan Budidaya Air Tawar (BRPBAT) Cibalagung, Bogor, Jawa Barat, yang di mulai dari bulan September 2004-Maret 2005. Untuk proses pembuatan pakan, analisis proksimat, dan pembuatan preparasi histologis gonad dilakukan di Laboratorium Nutrisi Ikan dan Kesehatan Ikan, Jurusan Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis vitamin E dan asam lemak dilakukan di Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian Bogor dan di Laboratorium Terpadu Analisa Kimia Institut Pertanian Bogor. Selanjutnya, pengukuran estradiol-17ß plasma darah dilakukan di Balai Penelitian Ternak Ciawi Bogor. Pengukuran tingkat kerja osmotik (TKO) dilakukan di Laboratorium Anatomi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Pengukuran glukosa darah dan kualitas air dilakukan di Laboratorium Limnologi dan di Laboratorium Lingkungan Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pakan Uji
Tabel 4. Komposisi bahan pakan uji (%)
Jumlah bahan pakan (%) Komposisi bahan
A B C D E F G H I J K L M N O P
Tepung ikan 35.000 35.000 35.000 35.000 35.000 35.000 35.00 35.000 35.000 35.000 35.000 35.00 35.000 35.000 35.000 35.000
Dekstrin 32.050 32.050 32.050 32.050 32.050 32.050 32.050 32.050 32.050 32.050 32.050 32.050 32.050 32.050 32.050 32.050
Gelatin 9.200 9.200 9.200 9.200 9.200 9.200 9.200 9.200 9.200 9.200 9.200 9.200 9.200 9.200 9.200 9.200
Selulosa 9.495 9.490 9.485 9.480 9.395 9.390 9.385 9.380 9.295 9.290 9.285 9.280 9.195 9.190 9.185 9.180
Minyak jagung 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500
Minyak ikan 0.100 0.100 0.100 0.100 0.200 0.200 0.200 0.200 0.300 0.300 0.300 0.300 0.400 0.400 0.400 0.400
Mineral mix 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500 4.500
Vit. Mix tanpa vit. E 3.150 3.150 3.150 3.150 3.150 3.150 3.150 3.150 3.150 3.150 3.150 3.150 3.150 3.150 3.150 3.150
Vitamin E 0.005 0.010 0.015 0.020 0.005 0.010 0.015 0.020 0.005 0.010 0.015 0.020 0.005 0.010 0.015 0.020
CMC* 2.000 2.000 2.000 2.000 2.000 2.000 2.000 2.000 2.000 2.000 2.000 2.000 2.000 2.000 2.000 2.000
J u m l a h 100.00 100.00 100.00 100.00 100.00 100.00 100.00 100.00 100.00 100.00 100.00 100.00 100.00 100.00 100.00 100.00
*
Tabel 5. Komposisi proksimat, kandungan vitamin E, dan asam lemak pakan uji
______________________________________________________________________________________________________________
Pakan Percobaan (Perlakuan vitamin E dan minyak ikan)
Kandungan (%) ______________________________________________________________________________________________
A B C D E F G H I J K L M N O P
Protein 31.90 31.73 31.58 31.33 31.36 31 .79 31.52 31.34 31.39 31.71 31.51 31.37 31 .30 31.75 31 .55 31.38 BETN * 45 .51 45.70 45.21 45.14 45.37 45.63 44.14 45.00 44.41 41.65 43.37 43.66 45.06 44.57 44 .15 43.23 Lemak 5.47 5.46 5.42 5.48 6.16 6.04 6.37 6.19 6.44 6.52 6 .37 6.48 6.52 6.5 9 6.48 7.16 Serat kasar 7 .34 6 .76 7.6 5 8.04 7.70 6.75 7.77 7.43 7.36 8.05 6.74 7.45 6.32 6 .71 5 .76 6.46 Kadar abu 9.78 10.35 10.14 10.01 9.41 9.79 10.20 10.04 10.40 12.07 12.01 11.04 10.80 10.38 12.06 11.77 DE**(kkal/g pakan) 269.73 269.53 267.46 266.89 273.08 274.26 272.27 272.33 273.05 267.92 270.31 271.43 275.01 275.93 273.29 275.90 C/P 8.46 8.50 8.47 8.52 8.71 8.63 8.64 8.69 8.70 8.45 8.58 8.65 8.79 8.69 8.66 8.79 Kadar n-6 2 .38 2.66 2.06 2.23 2.62 2.32 2.51 2.49 3.74 2.86 2.32 2.13 2.46 2.50 2.78 2.53 Kadar n-3 1.29 1.63 1 .47 1.23 2.21 2.22 2.11 1.65 2.15 3.68 3.47 3.2 4 3.17 2.31 3.13 2.27 Rasio Al. n-3/n-6 0 .54 0.61 0.71 0.55 0.84 0.96 0.8 4 0.66 0.58 1.29 1.50 1.52 1 .29 0.92 1.13 0.90 ? HUFA 1.11 0.99 0.73 0 .76 0 .92 1 .59 1.63 1.04 1.04 1.14 1.46 1.36 1.00 1.73 1.32 1.38 ? PUFA 3.67 4 .29 3.53 3.46 4.83 4.54 4.62 4.14 5.89 6.54 5 .79 5.36 5.63 4.81 5.91 4.80 Vitamin E (mg/g) 1891 2115 2648 3154 2318 2531 3126 3415 2694 2962 3092 3895 2452 3296 3862 3985
*
BETN = Bahan estrak tanpa nitrogen
**
Rancangan Percobaan
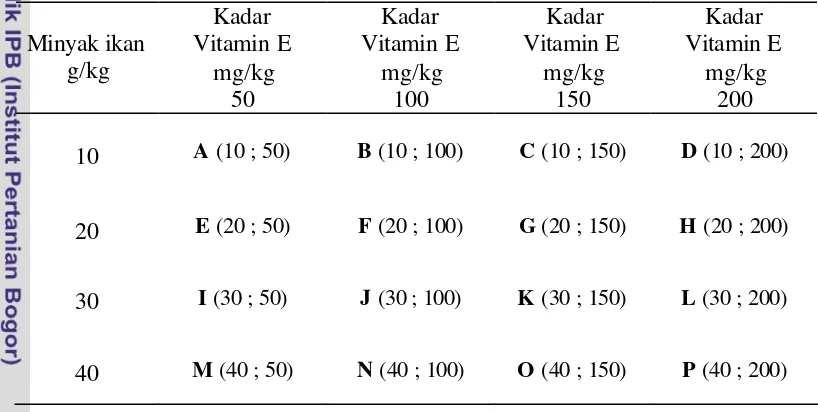
[image:43.596.100.509.275.481.2]Rancangan percobaan yang digunakan pada penelitian tahap I adalah model eksperimental dengan menggunakan rancangan acak lengkap (RAL), dengan pola faktorial 4 x 4. Faktor pertama adalah pengaruh penambahan dosis minyak ikan dengan level 10, 20, 30, dan 40 g/kg pakan. Faktor kedua adalah pengaruh penambahan dosis vitamin E dengan level 50, 100, 150, dan 200 mg/kg pakan. Keseluruhan percobaan terdiri atas 16 kombinasi perlakuan (Tabel 6).
Tabel 6. Rancangan percobaan kombinasi minyak ikan (MI) dan vitamin E (VE) pada ikan nila
Minyak ikan g/kg
Kadar Vitamin E
mg/kg 50
Kadar Vitamin E
mg/kg 100
Kadar Vitamin E
mg/kg 150
Kadar Vitamin E
mg/kg 200
10 A (10 ; 50) B (10 ; 100) C (10 ; 150) D (10 ; 200)
20 E (20 ; 50) F (20 ; 100) G (20 ; 150) H (20 ; 200)
30 I (30 ; 50) J (30 ; 100) K (30 ; 150) L (30 ; 200)
40 M (40 ; 50) N (40 ; 100) O (40 ; 150) P (40 ; 200)
Ikan Uji
Media Percobaan
[image:44.596.99.519.118.623.2]Untuk percobaan digunakan16 unit jaring berukuran 2.0 x 2.0 x 2.0 m3. Semua perlakuan diletakkan dalam satu unit kolam dengan luas 50 x 20 x 1.5 m3 yang dilengkapi saluran pemasukan dan saluran pengeluaran air dengan debit air 30 l/detik. Untuk lebih jelas media percobaan disajikan pada Gambar 4.
Gambar 4. Tata letak wadah percobaan secara acak
Keterangan: : A (MI. 10; VE. 50), B(MI. 10; VE. 100), C(MI. 10; VE. 150), D(MI. 10; VE. 200) E (MI. 20; VE. 50), F (MI. 20; VE. 100), G (MI. 20; VE. 150), H (MI. 20; VE . 200) I (MI. 30; VE. 50), J (MI. 30; VE. 100), K(MI. 30; VE. 150), L(MI. 30; VE. 200) M(MI. 40; VE. 50), N(MI. 40; VE. 100), O(MI. 40; VE. 150), P(MI. 40; VE. 200)
Pemeliharaan Induk dan Pengambilan Data
Telur hasil pemijahan secara alami dari tiap induk ikan dikumpulkan dengan menggunakan egg collector kemudian dipindahkan ke dalam akuarium untuk diinkubasi sampai telur menetas. Untuk mengamati kualitas larva yang dihasilkan dari penetasan telur dipelihara dan tidak diberi makan sampai larva tersebut mati. Sehingga dapat dilihat berapa lama larva tersebut bisa bertahan hidup tanpa diberi pakan.
Untuk melihat perkembangan gonad ikan yang dipelihara, dilakukan pengambilan sampel 2 minggu sekali, yang diambil secara acak 1 ekor ikan dari tiap perlakuan. Pengambilan data meliputi penimbangan bobot ikan, kanulasi telur, dan pengambilan sampel darah. Untuk penelitian tahap I ini, untuk setiap perlakuan ikan yang diamati adalah 5 ekor sebagai ulangan dan untuk keperluan pengambilan gonad setiap perlakuan diambil 1 ekor untuk awal, pertengahan, dan akhir penelitian. Pada saat pemeriksaan pematangan telur, induk yang telurnya matang segera dipindahkan ke akuarium pemijahan, dan selanjutnya pemijahan dilakukan secara alami. Telur hasil pemijahan dari tiap induk dikumpulkan kemudian dipindahkan ke akuarium untuk diinkubasi sampai menetas.
Penimbangan dilakukan dengan menggunakan timbangan analitik, yang dilakukan pada awal penelitian, kemudian dilanjutkan 14 hari berikutnya, dan pada akhir penelitian dilakukan pada semua perlakuan dan ulangan. Perubahan yang terjadi pada gonad diamati secara histologis. Sampel gonad diambil pada awal, pertengahan, dan akhir penelitian sebanyak 1 ekor ikan untuk masing-masing perlakuan. Jaringan gonad diambil dan difiksasi dengan larutan Bouin, dan dilanjutkan dengan prosedur penyiapan sediaan histologis gonad (Lampiran 3).
genital induk ikan betina. Telur yang diambil kemudian difiksasi dengan alkohol 70% dan formalin 5%, kemudian diukur diameternya di bawah mikroskop yang dilengkapi dengan mikrometer, dengan pembesaran 40 kali. Jumlah telur yang diambil dan diukur diameternya adalah 100 butir. Data fekunditas telur diperoleh dengan menghitung jumlah total telur yang dipijahkan untuk setiap individu. Derajat tetas telur, yaitu total telur yang dipijahkan dalam akuarium inkubasi sampai menetas, dihitung dari total telur yang menetas. Untuk mendapatkan data kualitas larva, maka larva yang dihasilkan dari penetasan telur selanjutnya dipelihara dan tidak diberi pakan sampai mortalitas larva mencapai 80%. Angka tersebut dihitung dari jumlah larva yang hidup dan larva yang mati.
Prosedur Pengambilan Sampel Darah
Pengambilan sampel darah untuk pengukuran kandungan estradiol-17ß dilakukan pada awal penelitian yaitu hari ke-0 (awal percobaan), hari ke-14 dan seterusnya diambil secara teratur dengan interval waktu 14 hari sampai akhir penelitian. Sebanyak 1 ml sampel darah diambil dari bagian pangkal ekor dengan menggunakan spuit 1.5 ml yang telah diberi antikoagulan ( citrate-phosphate-dextrose solution, Sigma C-7165). Sampel darah dimasukkan ke dalam tabung polietilen dan disentrifus selama 5 menit dengan kecepatan 6000 rpm. Plasma darah diambil dan dipindahkan ke dalam tabung polietilen baru, dan selanjutnya disimpan dalam freezer (- 20oC) sampai dilakukan analisis dengan menggunakan radioimmunoassay (RIA).
Parameter Uji yang Diamati
Parameter uji yang diamati untuk mengetahui kinerja reproduksi ikan nila adalah indeks gonad somatik (IGS), diameter telur, fekunditas, jumlah induk yang memijah (JIM), derajat tetas telur (DTT), dan ketahan hidup larva (KHL).
Indeks gonad somatik(IGS)
Bobot gonad (g)
Fekunditas
(G x X) F = --- W Q
Keterangan :
F : Fekunditas (butir telur/gr bobot tubuh) G : Bobot telur individu/gonad (g)
X : Jumlah telur sampel (butir) Q : Bobot telur sampel (g) W : Bobot tubuh individu (g).
Jumlah induk memijah (JIM)
? Induk yang memijah (ekor)
JIM (%) = --- x 100 ? Induk yang dipijahkan (ekor)
Derajat tetas telur (DTT)
? telur menetas
DTT (%) = --- x 100 ? telur ditetaskan
Ketahanan hidup larva
? larva hidup pada akhir percobaan KHL (hari) = --- x 100 ? larva pada awal tebar
Pengukuran Estradiol-17ß
dan diberi label. Disiapkan juga 14 buah tabung Ab-Coated estradiol yang digunakan sebagai tabung kalibrator A (MB = maximum binding) 0 pg/ml, B 20 pg/ml, C 50 pg/ml, D 150 pg/ml, E 500 pg/ml, F 1800 pg/ml dan G 3600 pg/ml masing-masing dengan duplikatnya dan diberi label, serta beberapa buah tabung tertutup antibodi lain yang digunakan untuk kontrol dan sampel. Sebanyak 100 µl dari setiap kalibrator A nol dipipet ke dalam tabung NSB dan A serta duplikatnya, dan dari kalibrator B sampai G dipipet ke dalam setiap tabung dan duplikatnya yang telah diberi label. Sebanyak 100 µl kontrol dan sampel dipipet ke dalam setiap tabung yang telah disiapkan sebelumnya. Pada setiap tabung tersebut ditambahkan 1.0 ml 125? estradiol, dan dikocok dengan mempergunakan vorteks, kemudian diinkubasikan selama 3 jam pada suhu kamar. Dengan menggunakan rak busa, isi seluruh tabung (kecuali tabung T) dituangkan dan dibiarkan mengalir selama 2 atau 3 menit. Kemudian tabung digoreskan keras-keras pada kertas absorban untuk menghilangkan semua butiran residu. Setelah itu dikalibrasikan dan sampel dihitung dengan alat penghitung gamma selama 1 menit (CPM = counts per minute). Gamma counter yang digunakan adalah model 600B Gammatec ll The nucleus Inc. OAK RIDGE, TN-USA dan Mini Assay Type 6 – 20 Instrument USA. Untuk memperoleh nilai konsentrasi estradiol dari gambaran logit- log kurva kalibrasi, pertama adalah dengan menghitung jumlah bersih (net counts) dari setiap pasang tabung dengan rumus Jumlah bersih = rata-rata CPM – rata-rata NSB CPM. Dilanjutkan dengan menentukan persentase yang terikat (percent bound) dari setiap pasang tabung kalibrator dan sampel : Persentase terikat = (jumlah bersih/jumlah MB bersih) x 100%. Berikutnya dibuat grafik logit- log, dimana persentase ikatan sebagai sumbu y (y axis) dan konsentrasi kalibrator sebagai sumbu x (x axis).
Analisis Kimia
Analisis Data
Data yang diperoleh dianalisis menggunakan analisis sidik ragam dan dilanjutkan dengan uji respons. Untuk mengetahui pengaruh kombinasi vitamin E dan asam lemak n