DIFERMENTASI OLEH
Trichoderma harzianum
Rifai
UNTUK PAKAN NILA
Oreochromis
sp
NUR INDARIYANTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Bungkil Inti Sawit dan Onggok yang Difermentasi Oleh Trichoderma harzianum Rifai Pada Pakan Nila Oreochromis sp” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Maret 2011
Cake (PKC) and Tapioca Waste Fermented by Trichoderma harzianum for Tilapia Oreochromis sp Diet. Under the Advisory by DEDI JUSADI, NUR BAMBANG PRIYO UTOMO
Utilization of palm kernel cake (PKC) and tapioca waste (TW) as fish diet is limited due to the high fiber content. The experiment consisted of two step. The aim of first experiment was to evaluate the reduction of crude fiber from the mixture of 80% PKC and 20% TW fermented by Trichoderma harzianum with incubation period of 6, 8 and 10 days respectively. An inoculum dose was 5%, and the number of T. harzianum colonies were 2.6x106 CFU/ml. The result showed that the highest crude fiber reduction was achieved in the incubation period of 8 days, reaching 44.28%. The fermentation process could also increased the glucose content. The aim of second experiment was to evaluate the digestibility of fermented PKC-TW (FPKC-TW) for tilapia. Digestibility test was conducted on tilapia with an average initial weight of 41.27 ± 2.16 g and reared in each aquarium (40x50x35 cm) for 15 days. The result showed that digestibility of fermented 80% PKC-20%TW was higher than unfermented PKC. Based on the results of this study, it can be concluded that the use ofT. harzianum reduced the fiber content of PKC-TW, thereby increasing the digestibility.
dan Onggok yang Difermentasi olehTrichoderma harzianum Rifai untuk Pakan Ikan Nila Oreochromis sp. Dibimbing oleh DEDI JUSADI dan NUR BAMBANG PRIYO UTOMO
Bungkil Inti Sawit (BIS) merupakan hasil samping dari pengolahan kelapa sawit, sedangkan onggok merupakan limbah pabrik tepung tapioka. Penggunaan BIS dan onggok sebagai bahan pakan ikan terkendala oleh kandungan seratnya yang tinggi, karena ikan mempunyai keterbatasan dalam mencerna serat kasar. Penelitian ini dirancang dengan tujuan untuk menurunkan serat kasar campuran BIS dan onggok dengan menggunakan kapang Trichoderma harzianum, sehingga dapat meningkatkan kecernaan. Penelitian dibagi dalam dua tahap, Tahap I bertujuan untuk mengevaluasi penurunan serat kasar campuran 80% Bungkil inti sawit (BIS) dan 20% onggok yang difermentasi oleh Trichoderma harzianumdengan masa inkubasi 6, 8 dan 10 hari, masing-masing 3 kali ulangan. Dosis inokulum 5% dengan jumlah koloniT.harzianum 2,6x106 CFU/ml. Hasil penelitian menunjukkan bahwa penurunan serat kasar tertinggi dicapai pada masa inkubasi 8 hari yaitu 44,28%. Proses fermentasi juga dapat meningkatkan kandungan glukosa. Tujuan penelitian Tahap II untuk mengevaluasi kecernaan Bungkil Inti Sawit Onggok Fermentasi (BISOF) pada ikan nila. Uji kecernaan dilakukan pada ikan nila dengan berat awal rata-rata 41,27±2,16 g dan kepadatan 5 ekor/akuarium yang dipelihara di dalam akuarium (40x50x35 cm)selama 15 hari. Hasil menunjukkan bahwa kecernaan BISOF lebih tinggi dibandingkan dengan BIS tanpa fermentasi. Berdasarkan hasil penelitian ini dapat disimpulkan bahwa penggunaan T. harzianum dapat menurunkan serat kasar campuran BIS dan onggok, sehingga meningkatkan kecernaan.
mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
DIFERMENTASI OLEH
Trichoderma harzianum
Rifai
UNTUK PAKAN NILA
Oreochromis
sp
NUR INDARIYANTI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada Program Studi Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Nur Indariyanti
NRP : C151080071
Disetujui
Komisi Pembimbing
Dr. Dedi Jusadi Dr. Nur Bambang Priyo Utomo
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Akuakuktur
Prof. Dr.Enang Harris Dr. Dahrul Syah
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Tema yang dipilih dalam penelitian ini adalah pengolahan pakan dan aplikasinya, dengan judul Evaluasi Kecernaan Campuran Bungkil Inti Sawit dan Onggok yang Difermentasi oleh Trichoderma harzianum Rifai untuk Pakan Nila Oreochromissp.
Pelaksanaan penelitian dan penulisan tesis ini tidak terlepas dari bantuan dan bimbingan berbagai pihak. Pada kesempatan ini, penulis menyampaikan
terima kasih yang sebesar-besarnya kepada :
1. Bapak Dr. Ir. Dedi Jusadi, MSc, dan Bapak Dr. Ir. Nur Bambang Priyo
Utomo, MSi, selaku pembimbing atas semua pengarahan, koreksi dan bimbingan yang telah diberikan kepada penulis.
2. Ibu Dr. Ir. Widanarni, M.Si selaku Penguji Luar Komisi
3. Departemen Pendidikan Nasional Direktorat Jenderal Pendidikan Tinggi (DIKTI) yang telah memberikan beasiswa Program Pasca Sarjana
4. Direktur Politeknik Negeri Lampung yang telah memberikan izin studi.
5. Yayasan Toyota dan Astra (YTA) yang telah memberikan bantuan dana penelitian kepada penulis.
6. Ayahnda (Suwarno Purnomo (alm) dan ibunda atas do’a, kasih sayang dan dukungan moril maupun materil kepada penulis selama ini.
7. Suami tercinta atas kasih sayang, kesabaran, pengertian dan motivasi yang tiada hentinya, serta kepada keempat anak-anakku tersayang Mufti Aslam Al Ghifari, Aisyah Azzahra, Adzkia Khoirunnisa dan Afina Alma Zahrani yang setia mendampingi penulis dalam cinta dan doa.
Akhir kata, semoga apa yang telah diberikan kepada penulis akan mendapatkan imbalan dari-Nya sebagai amal ibadah. Semoga tesis ini bermanfaat
Bogor, Maret 2011
Penulis dilahirkan di Bantul Yogyakarta pada tanggal 15 Januari 1970. Penulis merupakan anak keempat dari lima bersaudara. Pendidikan Sarjana ditempuh di Fakultas Peternakan Jurusan Perikanan Universitas Diponegoro. Sejak tahun
DAFTAR ISI Kebutuhan Nutrisi Ikan Nila ... 4
Serat Dalam Bahan Pakan Ikan... 5
Kecernaan Pakan Pada Ikan ... 8
Kelapa Sawit dan Hasil Sampingnya ... 9
Kandungan Nutrien Bungkil Inti Sawit... 10
Pemanfaatan Bungkil Inti Sawit Untuk Pakan... 11
Onggok ... 12
Fermentasi ... 12
Hidrolisis selulosa oleh kapang... 13
KapangTrichoderma harzianumRifai ... 14
BAHAN DAN METODE Tahap I Fermentasi Campuran BIS dan Onggok ... 15
Pembuatan inokulum padat ... 15
Fermentasi Campuran BIS dan Onggok ... 16
Tahap II Uji Kecernaan Pada Ikan Nila ... 17
Uji Kecernaan Pakan ... 17
Parameter yang Diukur ... 19
Analisis Data... 19
HASIL DAN PEMBAHASAN Hasil Tahap I : Fermentasi Campuran BIS dan Onggok ... 20
Jumlah koloni kapangTrichoderma harzianum... 20
Hasil pembuatan inokulum padat... 21
Hasil uji enzim selulase ... 22
Penampilan makroskopis BISOF ... 22
Kandungan nutrisi hasil fermentasi ... 23
Pembahasan... 23
Hasil Tahap II : Uji Kecernaan Pada Ikan Nila... 26
Pembahasan... 27
KESIMPULAN ... 29
DAFTAR PUSTAKA... 30
DAFTAR TABEL
Halaman
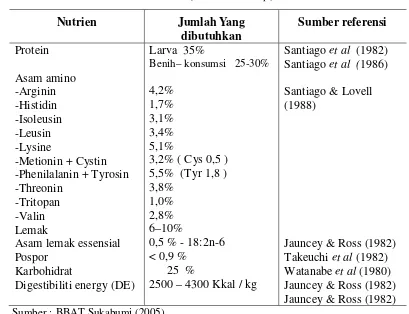
1 Kebutuhan nutrisi ikan nila (Oreochromis sp)... 4
2 Kandungan nutrien pada bungkil inti sawit ... 10
3 Komposisi pakan acuan dan pakan uji kecernaan (%) ... 18
4 Hasil proksimat pakan (% bobot kering) ... 18
5 Kandungan fraksi serat pakan (% bobot kering) ... 18
6 Jumlah spora kapangTrichoderma harzianumselama pertumbuhan... 20
7 Rataan kandungan nutrisi pada masing-masing perlakuan sebelum dan setelah fermentasi (% bobot kering... 23
8 Persentase penurnan kandungan serat kasar dan lemak (%)... 23
DAFTAR GAMBAR
Halaman
1 Hubungan antara lignin, selulosa dan lignin ... 6
2 Skema penguraian komponen dinding sel ... 7
3 Proporsi dalam proses pengolahan kelapa sawit ... 10
4 Mekanisme hidrolisis selulosa secara enzimatis ... 13
5 Bagan alur proses fermentasi... 16
6 Biakan kapangTrichoderma harzianum... 20
7 Inokulum padatTrichoderma harzianum... 21
8 Hasil uji enzim selulase ... 22
9 Penampilan makroskopis BISOF pada inkubasi 4-10 hari ... 22
PENDAHULUAN
Latar Belakang
Sumber bahan baku pakan alternatif untuk pakan ikan di antaranya adalah hasil-hasil ikutan produk agro industri, antara lain bungkil inti sawit (BIS) dan onggok. Bahan baku tersebut merupakan limbah pabrik yang ketersediaannya sepanjang waktu dan tidak bersaing dengan kebutuhan manusia.
Sampai saat ini Indonesia masih menempati posisi teratas sebagai negara produsen crude palm oil (CPO) terbesar di dunia. Indonesia, Malaysia dan Nigeria merupakan 3 negara di dunia yang memproduksi 84% minyak kelapa sawit dunia (Jaelani dan Firahmi 2007). Produksi crude palm oil (CPO) Indonesia pada tahun 2009 mencapai 19.4 juta ton per tahun (Direktorat Jenderal Perkebunan 2010). Sedangkan produksi bungkil inti sawit Indonesia pada tahun 2009 diperkirakan mencapai 2.1 juta ton (Handoko 2010).
BIS berpotensi sebagai pakan ruminansia dan non ruminansia. Faktor pembatas pada BIS adalah tingginya kandungan serat kasar yang mencapai16– 30,5% (Sundu et al.2004; Jaelani dan Firahmi 2007; Siregar 1995). Serat kasar perlu diturunkan karena kemampuan ikan dalam mencerna serat kasar terbatas.
Secara umum batas toleransi ikan terhadap kandungan serat kasar dalam pakan
sampai 8%. Kandungan serat yang terlalu tinggi akan menekan pertumbuhan
(Buhler and Halver, 1961; Leary and Lovell, 1975; Edwardset al., 1977; Hiltonet al., 1983; Poston, 1986dalamNRC 1993).
Onggok merupakan limbah pabrik tepung tapioka yang belum
termanfaatkan secara optimal. Ketersediaan onggok terus meningkat sejalan
meningkatnya produksi tapioka. Produksi singkong Indonesia pada tahun 2009
mencapai 21.7 juta ton dan menghasilkan limbah dari pengolahan tapioka berupa
onggok sebesar 2.8 juta ton (BPS 2010).
Salah satu upaya untuk menurunkan serat kasar pada BIS yaitu melalui
penerapan teknologi fermentasi substrat padat dengan kapang (mikrob).
Pencampuran BIS dan onggok dimaksudkan agar media fermentasi mempunyai
kandungan nutrien yang seimbang terutama karbon dan nitrogen untuk menunjang
selulase. Onggok merupakan sumber karbon yang cukup potensial untuk media fermentasi BIS karena mengandung karbohidrat 60-80 % dari berat kering, meskipun masih memerlukan suplementasi zat gizi seperti nitrogen dan unsur-unsur mineral lainnya (Tjiptadi dan Sutamiharja 1985).
Salah satu kapang yang dapat digunakan sebagai inokulum dalam fermentasi BIS dan onggok adalah Trichoderma harzianum Rifai. Menurut Ginting dan Krisnan (2006 ), fermentasi BIS dengan T. harzianum memberikan hasil yang terbaik dibandingkan dengan T. viridae dan T. koningii, karena dapat menurunkan serat kasar sebesar 33,1 %. Hasil penelitian Illuyemi et al. (2005) juga menunjukkan bahwa fermentasi BIS denganT. harzianumdapat menurunkan kandungan selulosa sebesar 49,18%. Iyayi dan Aderolu (2004) melaporkan bahwa fermentasi BIS denganT. viridae selama 14 hari mampu menurunkan kandungan serat kasar dari 14,45% menjadi 9,17%.
Menurut Zahari dan Alimon (2004), penggunaan BIS untuk bahan baku ikan catfish maksimal 30%, dan untuk tilapia maksimal 20%. Lim et al (2001) melaporkan bahwa BIS dapat digunakan dalam pakan Oreochromis mosambicus mencapai 30%. Sedangkan Amri (2007) melaporkan, bahwa penggunaan bungkil inti sawit yang difermentasi dengan Rhizopus oligosporus sebanyak 18%, dengan kandungan serat kasar 8,14% dalam pakan ikan mas memperlihatkan jumlah konsumsi pakan, pertambahan berat tertinggi dan menurunkan konversi pakan.
Perumusan Masalah
Permasalahan bahan baku nabati dari limbah olahan agro industri seperti bungkil inti sawit (BIS) dan onggok adalah tingginya kandungan crude fiber (serat kasar). Untuk mengatasi hal tersebut salah satu upaya yang dapat
merupakan suatu kompleks enzim (multi komponen ) yang terdiri dari beberapa enzim yang bekerja bertahap atau bersama-sama menguraikan selulosa menjadi D glukosa (Kim et al. 1994). Fermentasi dengan T. harzianum diharapkan dapat menurunkan kandungan serat kasar, sehingga dapat memperbaiki mutu BIS dari segi daya cerna.
Tujuan Penelitian
1. Mengevaluasi penurunan serat kasar campuran BIS dan onggok yang telah difermentasi dengan kapangT. harzianum
2. Mengevaluasi kecernaan campuran BIS dan onggok yang telah difermentasi dengan kapangT. harzianum untuk pakan nila.
Manfaat Penelitian
1. Memanfaatkan limbah pengolahan sawit dan tapioka untuk pakan ikan sebagai alternatif penggunaan bahan baku pakan lokal.
TINJAUAN PUSTAKA
Kebutuhan Nutrisi Ikan Nila
Untuk pertumbuhan dan perkembangbiakan serta kelangsungan hidupnya ikan memerlukan pakan yang cukup dari segi kualitas dan kuantitas. Pakan yang bermutu baik, salah satunya ditentukan oleh kandungan gizi (protein, karbohidrat, lemak, vitamin dan mineral) dalam komposisi yang tepat (seimbang).
Ikan nila adalah ikan omnivora yang cenderung herbivora sehingga lebih mudah beradaptasi dengan jenis pakan yang dicampur dengan sumber bahan nabati seperti bungkil kedelai, teung jagung, tepung biji kapuk, tepung enceng gondok, tepung alfafa (Sayed 1999).
Protein merupakan nutrien yang sangat dibutuhkan oleh ikan untuk perbaikan jaringan tubuh yang rusak, pemeliharaan protein tubuh untuk pertumbuhan, materi untuk pembentukan enzim dan beberapa jenis hormon dan juga sebagai sumber energi (NRC 1993).
Tabel 1 Kebutuhan nutrisi ikan nila (Oreochromis sp)
Menurut Watanabe (1988) kebutuhan ikan akan protein dipengaruhi oleh beberapa faktor seperti ukuran ikan, suhu air, kadar pemberian pakan, energi dalam pakan dan kualitas protein.
Karbohidrat merupakan salah satu sumber energi dalam makanan ikan. Karbohidrat sebagian besar didapat dari bahan nabati, sedangkan kadarnya dalam makanan ikan berkisar antara 10-50%. Karbohidrat dalam pakan disebut dengan BETN atau Bahan Ekstrak Tanpa Nitrogen atau NFE (Nitrogen Free Extract). BETN ini mengandung karbohidrat, gula, pati dan sebagian besar berasal dari hemiselulosa. Daya cerna karbohidrat sangat bervariasi tergantung dari kelengkapan molekul penyusunnya. Kandungan karbohidrat pakan yang dapat dimanfaatkan secara optimal untuk ikan omnivora pada kisaran 30-40%, dan untuk ikan karnivora berkisar 10-20% (Furuichi 1988).
Serat Dalam Bahan Pakan Ikan
Istilah serat makanan (dietary fiber) harus dibedakan dengan istilah serat
kasar (crude fiber) yang biasa digunakan dalam analisa proksimat bahan pangan. Serat makanan adalah bagian dari bahan pangan yang tidak dapat dihidrolisis oleh enzim-enzim pencernaan. Sedangkan serat kasar merupakan fraksi karbohidrat
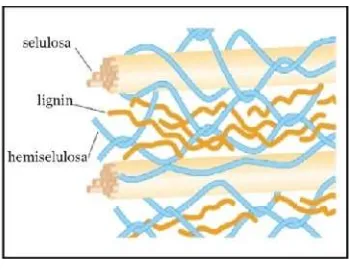
yang telah dipisahkan dengan bahan ekstrak tanpa nitrogen (BETN) yang tidak larut dalam basa dan asam encer setelah pendidihan selama 30 menit (Tillman 1998). Serat kasar merupakan penyusun utama dinding sel tumbuhan yang terdiri dari selulosa, hemiselulosa dan lignin.
Fungsi utama selulosa pada nutrisi ialah untuk menyediakan bahan bulky dan tidak dapat dicerna yang dapat meningkatkan efisiensi kerja saluran usus yang dapat disamakan dengan fungsi serat dalam makanan (Piliang dan Djojosoebagio 2006). Selulosa pakan dalam jumlah yang berlebihan mempunyai pengaruh menurunkan pertumbuhan serta efisiensi pakan.
Gambar 1 Hubungan antara lignin, selulosa dan hemiselulosa.
Seperti hewan monogastrik lainnya, kemampuan ikan dalam mencerna
serat kasar dibatasi oleh kemampuan mikroflora dalam ususnya untuk mensekresikan selulase (Bureau et al. 1999). Apabila jumlah serat kasar berlebih dalam pakan akan menyebabkan proporsi makanan yang dapat dicerna menjadi berkurang, seperti menurunkan penyerapan lemak, sehingga total bobot kering pakan juga berkurang (Sutardi 1997). Akibatnya daya cerna ikan terhadap pakan yang diberikan akan menurun yang menyebabkan kinerjanya menjadi kurang bagus (De Silva dan Anderson 1995).
Kemampuan hewan dalam mencerna serat kasar bergantung pada banyaknya bakteri yang dikandung dalam alat pencernaannya (Guillaume 1999). Hewan monogastrik pemakan hijauan yang memiliki lambung sederhana serta caecum dan kolon yang besar memiliki kesamaan fungsi dengan rumen pada sapi dan domba (Cheeke 1982). Menurut Kirchgessener (1986) peningkatan kandungan serat kasar dalam komposisi pakan menurunkan kecernaan nutrisi.
Meskipun serat kasar tidak mengandung nutrisi penting tetapi fungsinya sebagai pengatur ekskresi sisa makanan sangatlah penting. Serat kasar membantu mempercepat ekskresi sisa-sisa makanan melalui saluran pencernaan. Dalam keadaan tanpa serat, feses dengan kandungan air rendah akan lebih lama tinggal dalam saluran usus yang dapat menyebabkan gangguan pada gerakan peristaltik pada usus besar sehingga ekskresi feses menjadi lebih lamban. Sebaliknya, pakan dengan serat kasar tinggi dapat mengurangi berat badan karena serat makanan akan tinggal dalam saluran pencernaan dalam waktu relatif singkat sehingga absorpsi zat makanan berkurang. Selain itu, serat kasar tinggi akan memberikan rasa kenyang karena komposisi karbohidrat kompleks yang menghentikan nafsu makan sehingga mengakibatkan turunnya konsumsi makanan (Piliang 2006).
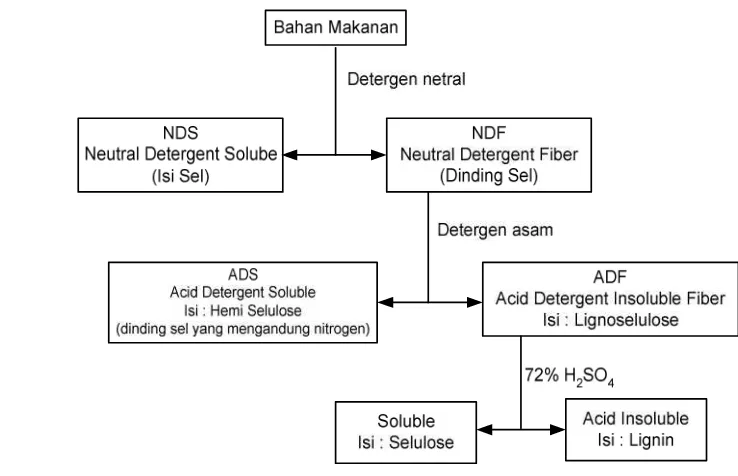
Fraksi serat kasar diukur berdasarkan kelarutannya dalam larutan detergent yang membagi menjadi isi sel dan dinding sel atau Neutral Detergent Fiber (NDF) dan fraksi yang tidak larut adalah lignoselulosa yang disebut Acid Detergent Fiber (ADF) dan fraksi yang larut yaitu hemiselulosa dan sedikit protein dinding sel. Van Soest et al. (1991) menguraikan mengenai komponen dinding sel menjadi fraksi-fraksi seperti tersaji pada Gambar 2.
Kecernaan Pakan Pada Ikan
Kecernaan adalah bagian pakan yang dikonsumsi dan tidak dikeluarkan menjadi feses (Maynard et al. 1979). Kapasitas lambung dan laju pakan dalam saluran cerna merupakan variabel dari kecernaan. Ikan yang berbobot lebih kecil akan mengosongkan sejumlah pakan (prosentase bobot tubuh perjam) dari dalam lambungnya lebih cepat dibanding ikan yang berbobot lebih besar. Akan tetapi semakin besar ukuran ikan, kecernaan komponen serat semakin baik. Selain faktor ukuran ikan, nilai kecernaan dipengaruhi oleh komposisi pakan, jumlah konsumsi, status fisiologi, dan manajemen pemberian pakan.
Menurut Affandi et al. (2009) dalam proses pencernaan tidak semua komponen pakan yang dimakan dapat terserap, karena pada kenyataannya ada sebagian pakan yang tidak dapat tercerna. Bagian tersebut akan dikeluarkan dari dalam tubuh ikan berupa feses. Penentuan nilai kecernaan suatu bahan makanan adalah membandingkan kadar nutrien atau energi pakan dengan energi feses yang dinyatakan dalam satuan persen.
Kemampuan cerna ikan terhadap suatu jenis makanan tergantung kepada faktor fisik dan kimia makanan, jenis makanan, umur ikan, sifat fisik dan kimia air serta jumlah enzim pencernaan pada sistem pencernaan gastrointestinal (NRC 1983). Secara umum daya cerna untuk protein berkisar 70-90%, untuk karbohidrat berkisar 5-15%, dan untuk tepung selulosa dan glukosa 1%. Daya cerna ikan terhadap karbohidrat sangat rendah, tergantung pada spesies ikannya (Zonnelveld et al.1991). Pakan yang berasal dari bahan nabati biasanya lebih sedikit dicerna dibanding dengan bahan hewani. Hal ini dikarenakan bahan nabati memiliki serat kasar yang sulit dicerna dan mempunyai dinding sel kuat yang sulit dipecahkan
(Hepher 1988).
Indikator adalah bahan yang bersifat inert yang berarti dapat ditemukan kembali di dalam feses, dengan kriteria : (1) harus tidak dapat diabsorbsi, (2) harus tidak disamarkan oleh proses pencernaan, (3) harus secara fisik sama atau bergabung dengan bahan pakan yang akan diuji dan (4) metode pengambilan sampel digesta harus spesifik dan sensitif (Maynardet al.1979).
Indikator yang mempunyai sifat tersebut adalah Chromium oxide (Cr2O3). Jumlah kromium yang digunakan dalam penentuan kecernaan adalah 0,5-1,0%. Keuntungan dari penggunaan indikator ini adalah feses yang telah dikumpulkan dapat dianalisa kandugan nutriennya sehingga dapat diketahui koefisien daya cerna suatu nutrien dalam pakan tersebut (Takeuchi 1988).
Kelapa Sawit dan Hasil Sampingnya
Kelapa sawit (Elaeis guineensis Jacq.) merupakan tanaman daerah hutan hujan tropik (10° dari katulistiwa) yang berasal dari Afrika Barat. Habitat alami kelapa sawit adalah di daerah beriklim panas yang lembab pada ketinggian 500 m di atas permukaan laut dengan suhu optimum pertumbuhan antara 22 °C–32 °C serta curah hujan rata-rata antara 1 600 mm (minimum) sampai 2 500–3 500 mm
per tahun (Schultz 2001).
Ada 2 macam metode untuk proses ekstraksi minyak yaitu menggunakan
mesin expeller secara mekanis dan ekstraksi solvent secara kimia. Metode
expeller akan menghasilkan BIS yang mempunyai kandungan minyak (5-12%)
lebih tinggi dibandingkan dengan BIS yang dihasilkan dari proses ekstraksi
solvent (0,5-3%). Pada umumnya metode solvent menghasilkan BIS dengan nilai
serat kasar dan protein yang lebih tinggi dibandingkan metode expeller
(Wanasuria 2008).
Menurut Devendra (1998) yang diacu dalamSinurat (2003), bahwa dalam proses pengolahan buah sawit menjadi crude palm oil(CPO) akan menghasilkan hasil samping berupa lumpur sawit, bungkil inti sawit dan serabut sawit yang
berpotensi untuk digunakan sebagai bahan pakan (Gambar 3). Minyak kelapa
Gambar 3 Proporsi hasil pengolahan buah sawit menjadi minyak sawit (Devandra 1998dalamSinurat 2003).
Kandungan Nutrien Bungkil Inti Sawit
Bungkil inti sawit mempunyai kandungan nutrien yang cukup baik untuk dijadikan sebagai bahan pakan. Menurut Jaelani dan Firahmi ( 2007) kandungan protein kasar bungkil inti sawit adalah 16,5-17,69%, lemak kasar 5,69-9,46% dan kandungan serat kasarnya 24,22-30,50%. Kandungan nutrisi BIS secara lengkap dapat dilihat pada Tabel 2.
Tabel 2 Kandungan nutrien pada bungkil inti sawit
Nutrien A B C
SF F
Kadar Air (%) 10,4 5,50–12,00 10,72 10,55
Protein kasar (%) 16,8 14,50–19,60 16,5 20,12
BETN 35 46,70–58,80 -
-Serat Kasar 24 13,00–20,00 19,24 24,22 Lemak 9,5 5,00– 8,00 5,69 4,97 Abu (%) 4,3 5,00– 8,00 4,69 4,18 NDF (%) 70,07* 66,80–78,90 -
-Keterangan: BETN = Bahan ekstrak tanpa nitrogen; NDF =Neutral detergent fibre. A = Simanjuntak (1998)
B = Alimon (2005
Pemanfaatan Bungkil Inti Sawit (BIS) untuk Pakan
Penelitian pemanfaatan BIS telah banyak dilakukan untuk bahan baku pakan ternak (unggas, kambing, sapi, kelinci, ayam). Sedangkan penelitian pemanfaatan BIS dalam bidang akuakultur belum sebanyak dalam bidang peternakan.
Mirwandhono dan Siregar (2004) melaporkan bahwa fermentasi menggunakan Aspergillus niger (3% dari bahan kering BIS secara nyata mampu meningkatkan kandungan protein dari 15,03% menjadi 18,50%. Selanjutnya dilaporkan bahwa penggunaan 2% Aspergillus niger pada fermentasi BIS secara nyata meningkatkan kandungan energi bruto pada BIS yaitu dari 1 661 kkal/kg (BIS sebelum fermentasi) menjadi 1 837 kkal/kg (setelah fermentasi).
Hasil penelitian juga menunjukkan bahwa pakan dengan bahan baku limbah sawit yang difermentasi dengan enzim rumen dapat digunakan untuk pembesaran ikan nila, meskipun belum dapat menyamai pakan yang menggunakan bungkil kedelai. Namun dari segi harga, pakan ini lebih murah sehingga dapat dijadikan sebagai pakan alternatif (Hadadi et al. 2007).
Menurut Zahari dan Alimon ( 2004), penggunaan BIS untuk bahan baku ikan catfish maksimal 30 %, dan untuk tilapia maksimal 20%. Limet al(2001) melaporkan bahwa BIS dapat digunakan dalam pakanOreochromis mosambicus mencapai 30%. Sedangkan Amri (2007), menyatakan bahwa penggunaan bungkil inti sawit yang difermentasi dengan Rhizopus oligosporus sebanyak 18% dalam pakan ikan mas secara nyata meningkatkan jumlah konsumsi pakan, pertambahan berat tertinggi, dan menurunkan konversi pakan.
Jaelani (2007) melaporkan bahwa penggunaan BIS yang difermentasi
Onggok
Onggok merupakan hasil sampingan industri tapioka. Komponen penting yang terdapat dalam onggok adalah kandungan zat organik berupa pati. Onggok berpotensi sebagai bahan pakan karena mengandung karbohidrat atau pati sekitar 60-80% dari berat kering. Onggok cukup potensial digunakan sebagai sumber karbon dalam fermentasi padat, meskipun masih memerlukan suplementasi zat gizi seperti nitrogen dan unsur-unsur mineral lainnya (Sumantiet al.2005).
Sianida dapat bersifat racun apabila diberikan dalam jumlah yang tinggi dalam pakan (Parrakasi 1990). Kandungan total HCN ubi kayu dapat hilang hingga lebih dari 86% selama pengeringan dengan sinar matahari. Sjofjan et al. (2001) menyatakan fermentasi campuran onggok dan kotoran ayam dengan A. niger, Rhizopus oligosporus atau Saccaromyces cerevisiae dapat memperbaiki nutrisi campuran onggok dan kotoran ayam tersebut.
Fermentasi
Fermentasi adalah proses penguraian unsur organik kompleks terutama karbohidrat untuk menghasilkan energi melalui reaksi enzim yang dihasilkan oleh mikroorganisme, yang biasanya terjadi dalam keadaan anaerob dan diiringi dengan pembebasan gas. Simanjuntak (1998) melaporkan bahwa fermentasi dapat dilakukan untuk meningkatkan nutrien pada bahan yang berkualitas rendah, fermentasi merupakan salah satu cara pengolahan dalam rangka pengawetan bahan serta cara untuk mengurangi bahkan menghilangkan zat racun yang terkandung pada suatu bahan.
Menurut jenis mediumnya proses fermentasi dibagi menjadi dua yaitu fermentasi medium padat dan fermentasi medium cair. Pada fermentasi medium padat yang digunakan tidak larut tetapi cukup mengandung air untuk keperluan mikroorganisme, sedangkan fermentasi medium cair adalah proses fermentasi yang substratnya larut atau tersuspensi di dalam fase cair (Hardjoet al. 1989).
kualitas bahan pakan kasar. Dengan pengukusan menyebabkan pengembangan serat sehingga memudahkan untuk dicerna oleh enzim mikroorganisme. Uap akan menghancurkan ikatan antara selulosa, hemiselulosa dan lignin sedangkan komposisi kimianya tidak berubah. Pengukusan mampu meningkatkan ketersediaan energi karena meningkatnya kelarutan selulosa dan hemiselulosa dan atau pembebasan substansi terhidrolisis dari lignin dan silika (Murniet at .2008).
Hidrolisis Selulosa oleh Kapang
Aplikasi hidrolisis menggunakan enzim secara sederhana dilakukan dengan mengganti tahap hidrolisis asam dengan tahap hidrolisis enzim selulosa. Hidrolisis enzimatis memiliki beberapa keuntungan dibandingkan hidrolisis asam, antara lain: tidak terjadi degradasi gula hasil hidrolisis, kondisi proses yang lebih lunak (suhu rendah, pH netral), berpotensi memberikan hasil yang tinggi, dan biaya pemeliharaan peralatan relatif rendah karena tidak ada bahan yang korosif (Hamelincket al. 2005).
Degradasi selulosa oleh kapang merupakan hasil kerja sekelompok enzim selulolitik yang bekerja secara sinergis (Howard et al. 2003). Hidrolisis selulosa oleh enzim selulase terjadi dalam dua tahap. Tahap awal merupakan tahap aktivasi, kemudian dilanjutkan dengan tahap hidrolisis seperti tersaji pada Gambar 4.
Gambar 4 Mekanisme hidrolisis selulosa secara enzimatis (Muchtadiet al.1992).
Aktivasi selulosa disebabkan oleh enzim non hidrolisis C1, dan hidrolisis selulosa yang telah diaktifkan oleh enzim Cx. Hidrolisis selulosa secara efektif
memerlukan enzim β -glukosidase yang memecah selobiosa menjadi 2 molekul glukosa (Perez et al. 2002). Proses hidrolisis oleh kapang adalah terjadinya degradasi terhadap dinding sel yang diselaputi oleh lignin, selulosa dan
hemiselulosa. Akibat hidrolisis sebagian lignin akan terdegradasi, selulosa dan
KapangTrichoderma harzianumRifai
KlasifikasiTrichoderma harzianummenurut Frazier dan Westhoff (1978) adalah divisi Thallophyta, kelas Deuteromycetes, famili Moniliaceae dan ordo Moniliales.
Koloni kapang yang tua berwarna hijau tua dan bentuknya bola-bola
konidia yang berwarna hijau yang melekat satu sama lain. Ciri spesifik kapang ini adalah (1) miselium septat, (2) konidia bercabang banyak, septat dan ujung percabanganya merupakan sterigma, membentuk konidia bulat atau oval, berwarna hijau terang dan berbentuk bola-bola (Fardiaz 1998).
Trichoderma adalah salah satu kapang tanah yang tersebar luas (kosmopolitan) di lahan-lahan pertanian dan perkebunan. Trichoderma merupakan salah satu jamur yang bersifat selulolitik yang potensial menghasilkan selulase dalam jumlah yang relatif banyak untuk mendegradasi selulosa. Trichoderma menghasilkan enzim kompleks selulase yang dapat merombak selulosa menjadi selobiosa hingga menjadi glukosa. Trichoderma spp. memiliki kemampuan untuk menghasilkan berbagai enzim ekstraseluler, khususnya selulase yang dapat mendegradasi polisakarida kompleks (Harman 2006). Trichoderma adalah salah satu kapang perombak selulosa yang mempunyai kombinasi enzim C1 dan Cx (Wiseman 1981).
Menurut Schmidt (2006) Trichoderma merupakan kapang selulolitik yang memiliki potensi yang baik mendekomposisi selulosa dan hemiselulosa dibandingkan lignin. Hal ini juga dilaporkan oleh Samingan (2009) bahwa T. harzianummampu mendekomposisi selulosa lebih tinggi dibandingkan lignin.
BAHAN DAN METODE
Penelitian terdiri dari dua tahap yaitu Tahap I: Fermentasi Bungkil Inti Sawit dan Onggok denganTrichoderma harzianum. Tahap II: Uji kecernaan pada ikan nila dengan pakan yang mengandung BIS (Bungkil Inti Sawit) dan BISOF (Bungkil Inti Sawit dan Onggok Fermentasi).
Tahap I: Fermentasi Campuran BIS dan Onggok
Penelitian tahap I bertujuan untuk mendapatkan fermentasi terbaik dari campuran BIS dan onggok oleh T. harzianum. BIS dan onggok yang digunakan dalam penelitian ini berasal dari Lampung. Penelitian Tahap I dilakukan di Laboratorium Mikrobiologi Pusat Penelitian Biologi LIPI Cibinong. Pengeringan inokulum dilakukan di SEAFAST Center IPB, analisis proksimat dan serat (Van Soest 1991) dilakukan di Laboratorium Ilmu dan Teknologi Pakan Fakultas Peternakan IPB.
Peremajaan kapangT.harzianum
Isolat (biakan murni) yang digunakan adalah Trichoderma harzianum Rifai LIPIMC 732 (koleksi Laboratorium Mikrobiologi LIPI Cibinong). Media pertumbuhan kapang yang digunakan adalah Potato Dextrose Agar (PDA) dan basal media (nutrien) terdiri dari NH4)2SO4,yeast extract, KH2PO4,MgSO4.7H2O, CaCl2.2H2O. Isolat T. harzianum ditanam pada media miring yang dilakukan di dalamlaminar air flow,kemudian disimpan pada suhu ruang selama 7-10 hari.
Pembuatan inokulum padatT. harzianum
Isolat yang telah matang spora ditambahkan 9 ml akuades steril secara aseptik, dengan menggunakan jarum ose steril spora dikerik hingga terlepas dari miselia sehingga terbentuk suspensi spora, selanjutnya suspensi spora dimasukkan dalam erlenmeyer volume 250 ml yang berisi onggok yang telah disterilkan. Selanjutnya ditambahkan akuades steril sampai kadar air 60% dan diaduk sampai homogen. Erlenmeyer kemudian ditutup dengan kapas yang dilapisi plastik dan diinkubasi selama 7 hari.
Uji enzim selulase
Uji enzim selulase dilakukan dengan menggunakan substrat karboksi metil selulosa. Aktivitas enzim ditentukan dengan menghitung konsentrasi produk glukosa yang terbentuk. Konsentrasi diukur secara spektrofotometri menurut metode Somogy Nelson.
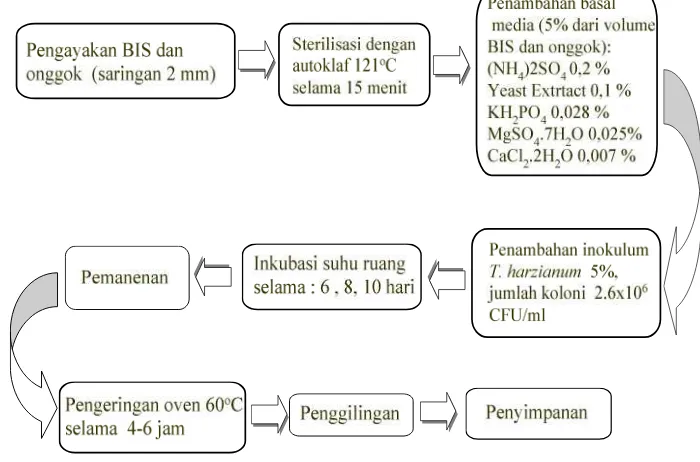
Fermentasi campuran BIS dan onggok
Sebelum difermentasi, BIS dan onggok diayak menggunakan saringan ukuran 2 mm, kemudian ditimbang dengan komposisi 80 g BIS dan 20 g onggok. BIS dan onggok dicampur sampai homogen, dan dimasukkan dalam plastik tahan panas, kemudan disterilisasi pada suhu 121 oC selama 15 menit. Campuran BIS-onggok didinginkan dan ditempatkan di nampan plastik dengan ketebalan ± 2 cm, kemudian ditambahkan larutan basal media sebanyak 5% dari volume, selanjutnya penambahan inokulum T. harzianumsebanyak 5% dari berat BIS dan onggok (substrat) dengan kepadatan 2,6x106CFU/ml. Substrat kemudian diaduk sampai homogen dan ditambah air steril hingga kadar air mencapai 60-70 %, selanjutnya nampan ditutup denganplastik wrap. Proses fermentasi campuran BIS dan onggok seperti ditunjukkan pada Gambar 5, dengan perlakuan :
Gambar 5 Bagan alur proses fermentasi.
Substrat yang telah difermentasi kemudian dipanen, dikeringkan dalam oven pada suhu 60 oC selama 4-6 jam, kemudian digiling. Penampilan secara visual BISOF selama fermentasi diamati secara makroskopis. Pengukuran peubah dilakukan terhadap bahan sebelum fermentasi dan sesudah fermentasi meliputi
kandungan bahan kering, protein kasar, lemak, serat kasar, abu (Takaeuchi 1988) dan fraksi serat (Van Soest 1991).
Rancangan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) dengan 3 perlakuan dan 3 ulangan. Data hasil fermentasi BIS yang diperoleh dianalisis menggunakan analisis sidik ragam (anova). Untuk melihat kecenderungan dari pengaruh masing-masing perlakuan dilakukan uji Jarak Berganda Duncan (Steel & Torrie 1995).
Tahap II: Uji Kecernaan pada Nila
Uji kecernaan pakan
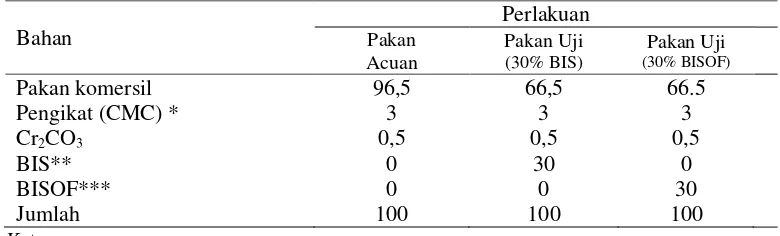
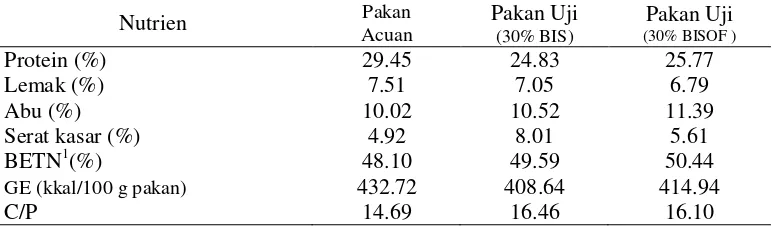
Uji kecernaan bahan dilakukan berdasarkan metode yang dikemukakan oleh Watanabe (1988), yaitu terdiri dari pakan acuan (references diet) yang terdiri dari 100% pakan komersil, pakan uji (test diet) yang terdiri dari 70% pakan acuan dan 30% bahan yang akan diuji (Tabel 3). Semua pakan perlakuan dibuat dalam bentuk pelet kering. Pakan yang telah dibuat kemudian dianalisis kembali untuk mengetahui komposisi nutrien pakan. Tabel 4 dan 5 menunjukkan hasil análisis proksimat pakan dan fraksi serat. Pakan diberikan dua kali sehari secara at satiation(sekenyangnya).
Percobaan menggunakan 9 akuarium masing-masing berukuran 40x50x35 cm yang dilengkapi aerasi dan heater diatur pada suhu 30 oC. Untuk menjaga kualitas air, dilakukan penyiponan dan penggantian air. Berat rata-rata ikan nila yang digunakan 41,27±2,16 g, dengan kepadatan 5 ekor per akuarium. Ikan diaklimasi selama 1 minggu dengan diberi pakan uji. Pada hari ke 8, feses mulai dikumpulkan dan pengumpulan feses selama 15 hari. Pengambilan feses dengan penyiponan dilakukan segera setelah ikan mengeluarkan feses untuk menghindari pencucian feses. Feses ditampung dan disimpan dalam freezer. Feses yang telah terkumpul dikeringkan di dalam oven bersuhu 110 °C selama 4-6 jam. Selanjutnya dilakukan analisis kandungan protein, serat kasar, Cr2O3, kalsium, fosfor, energi. Pengukuran kadar Cr2O3 menggunakan spektrofotometer yang memiliki panjang gelombang 350 nm.
Tabel 3 Komposisi pakan acuan dan pakan uji kecernaan (%)
Bahan
Tabel 4 Hasil proksimat pakan (% bobot kering)
Serat kasar (%) 4.92 8.01 5.61
BETN1(%) 48.10 49.59 50.44
GE (kkal/100 g pakan) 432.72 408.64 414.94
C/P 14.69 16.46 16.10
Tabel 5 Kandungan fraksi serat pakan (% bobot kering)
Fraksi serat (%) Pakan
Parameter kecernaan yang diukur adalah kecernaan total dan kecernaan nutrien yang meliputi kecernaan protein, kalsium, fosfor, energi. Nilai kecernaan nutrien dan kecernaan total dihitung berdasarkan persamaan yang dikemukakan oleh Takeuchi (1988) :
Kecernaan nutrien = [1-a/a’x b’/b]*100 Kecernaan total = [1-a/a’]*100 Energi tercerna = Ep-{Ef x n/n’}
Kecernaan Energi = [Energi tercerna/Energi Pakan] x 100% Keterangan :
a = % Cr2O3dalam pakan a’ = % Cr2O3dalam feses b = % nutrien dalam pakan b’ = % nutrien dalam feses
Ep = Energi pakan (kkal/100 g pakan) Ef = Energi feses (kkal/100 g pakan) n = mg Cr2O3/g pakan
Sedangkan nilai kecernaan masing-masing bahan uji yang digunakan dapat dihitung dengan menggunakan persamaan yang dikemukakan oleh Watanabe (1988), yaitu :
Kecernaan bahan = (ADT-0,7 AD)/0,3 Keterangan :
ADT = nilai kecernaan pakan uji AD = nilai kecernaan pakan acuan
Analisis Data
HASIL DAN PEMBAHASAN
Tahap I: Fermentasi Campuran BIS dan Onggok
Jumlah koloni kapangTrichoderma harzianum
Kultur murni kapang T. harzianum Rifai LIPIMC 732 diperoleh dari Laboratorium Mikrobiologi Pusat Penelitian Biologi LIPI Cibinong. Biakan inokulum kapangT. harzianumpada media PDA terlihat pada Gambar 6. Tabel 6 menunjukkan rata-rata jumlah koloni kapangT. harzianum.
Gambar 6 Biakan kapangTrichoderma harzianumRifai LIPI MC 732
Tabel 6 Jumlah spora Trichoderma harzianumselama pertumbuhan
Umur pertumbuhan Jumlah koloni
(jam) (CFU/ml)
24 belum terlihat
30 2,03x105
36 2,25x105
42 3,55x105
48 1,90x106
54 2,15x106
60 2,60x106
66 2,60x106
Penghitungan Total Plate Count (TPC) dilakukan pada isolat yang telah ditumbuhkan pada media PDA dalam cawan petri berdiameter 9 cm, dan diinkubasi 48-72 jam pada suhu kamar. Penghitungan jumlah spora dan viabilitas spora dilakukan setiap 6 jam dan dimulai pada 24 jam pertama, karena sampai pada 24 jam pertama belum terlihat pertumbuhan koloni kapang yang berarti. Hal ini disebabkan masih dalam fase adaptasi dan pertumbuhan awal. Jumlah koloni kapang mulai konstan (stationary phase), dicapai pada umur 60 jam yakni mencapai jumlah koloni 2,6 x 106CFU/ml.
Jumlah awal sel yang tinggi akan mempercepat fase adaptasi. Mulai umur pertumbuhan 30 jam, jumlah koloni kapang semakin banyak hingga pada umur 60 jam masa pertumbuhan, tercapai jumlah koloni yang maksimal. Setelah 60 jam jumlah koloni tidak bertambah lagi. Hal ini disebabkan kapang sudah memasuki fase statis. Pada fase stationary ini jumlah populasi sel tetap karena jumlah sel yang tumbuh sama dengan jumlah sel yang mati.
Hasil pembuatan inokulum padat
Gambar 7 menunjukkan hasil pembuatan inokulum padat. Pemanenan inokulum padat dilakukan pada hari ke 7, kemudian dikeringkan dengan pengeringan hampa (vacuum dry) pada suhu 400C. Penyimpanan inokulum padat menggunakan caravacuum.
Hasil Uji Enzim Selulase
Hasil uji enzim selulase menunjukkan hasil positif karena terbentuknya warna merah bata pada tabung reaksi 1, 2 dan 3 (inokulum padat), sedangkan pada tabung reaksi kontrol (K= substrat tanpa penambahan T. harzianum) berwarna kuning atau negative (Gambar 8).
Gambar 8 Hasil uji enzim selulase.
Penampilan makroskopis BISOF (Bungkil Inti Sawit Onggok Fermentasi)
Penampilan secara makroskopis, pertumbuhan kapang T. harzianum pada 24 jam pertama fermentasi belum terlihat pertumbuhan hifa. Pertumbuhan hifa dimulai pada umur 48 jam dengan adanya titik-titik putih di permukaan media fermentasi, kemudian pertumbuhan hifa terlihat seperti kapas putih tipis di permukaan. Selanjutnya pada jam ke 120, mulai terjadi perubahan warna dari putih kapas menjadi putih kehijauan dan selanjutnya hijau muda. Perubahan warna terus berlangsung menjadi hijau tua pada jam ke 192, dan jam 240 warna hijau tua dan kusam. Penampilan makroskopis BISOF selama inkubasi seperti ditunjukkan pada Gambar 9.
Kandungan nutrisi hasil fermentasi
Tabel 7 menunjukkan bahwa pada masa inkubasi 6 dan 8 hari terjadi penurunan serat kasar, namun pada masa inkubasi 10 hari terjadi peningkatan serat kasar. Persentase penurunan serat kasar tertinggi dicapai pada perlakuan T8 yaitu 44,28% (Tabel 8). Selama masa inkubasi 6, 8 dan 10 hari terjadi penurunan lemak secara konsisten. Penurunan lemak tertinggi dicapai pada masa inkubasi 10 hari sebesar 38,6 % (Tabel 8).
Tabel 7 Rataan kandungan nutrisi pada masing-masing perlakuan sebelum dan setelah difermentasi (% bobot kering)
Kandungan nutrisi (%) Perlakuan
SF T6 T8 T10
Abu 4,85 5,08±0,11a 5,06±0,14a 5,27±0,10b
Protein kasar 12,35 14,94±0,14a 15,74±0,12b 16,16±0,16c
Serat kasar 16,78 11,23±0,21b 9,35±0,22a 10,93±0,07b
Lemak 9,04 6,09±0,17b 5,70±0,10a 5,55±0,80a
BETN 56,98 62,67±0,38a 64,15±0,11b 62,09±0,29a
- Glukosa 1,049 1,401 1,576 1,565
Keterangan : Huruf superskrip di belakang nilai standar deviasi yang berbeda pada setiap baris menunjukkan adanya perbedaan nyata antara perlakuan (p<0.05)
SF = Sebelum fermentasi T6 = Inkubasi 6 hari T8 = Inkubasi 8 hari T10 = Inkubasi 10 hari
Tabel 8 Persentase penurunan kandungan serat kasar dan lemak (%)
Komponen Perlakuan
T6 T8 T10
Serat kasar 33,07 44,28 34,86
Lemak 32,63 36,94 38,6
PEMBAHASAN
Hasseltine (1977) dalamNagai (1979) juga menekankan bahwa fermentasi substrat padat harus dalam bentuk yang memungkinkan berlangsungnya sirkulasi udara. Butiran substrat padat harus sedikit berongga (retak) supaya spora dapat menempel dengan cepat pada permukaan butiran substrat dan segera setelah germinasi, penetrasi ke dalam butiran akan berlangsung dengan cepat pula.
Fermentasi BIS dengan kapang T harzianum menyebabkan perubahan kandungan beberapa nutrien. Kandungan serat kasar mengalami penurunan secara konsisten pada masa inkubasi 6 dan 8 hari. Persentase penurunan serat kasar tertinggi dicapai pada masa inkubasi 8 hari yaitu sebesar (44,28%). Hal ini dikarenakan aktivitas enzim selulase T. harzianum mencapai titik optimum, sehingga mampu mendegradasi selulosa menjadi glukosa (Kim et al. 1994). Peningkatan glukosa tertinggi dicapai pada masa inkubasi 8 hari, seperti ditunjukkan pada Tabel 7. Lama inkubasi 10 hari, terjadi peningkatan kandungan serat kasar, hal ini disebabkan berkurangnya enzim selulase dan kehilangan dari sejumlah padatan lainnya (Shutleff & Aoyagi 1979). Lama inkubasi 8 hari merupakan masa inkubasi yang optimal untuk menurunkan serat kasar. Hasil ini memperkuat simpulan Ginting dan Krisnan (2006) bahwa penurunan serat kasar BIS yang optimal diperkirakan tercapai pada lama fermentasi antara 6-9 hari.
Hasil penurunan serat kasar pada penelitian ini lebih tinggi dari yang dilaporkan oleh Ginting dan Krisnan (2006), dengan menggunakan BIS dan kapang yang sama terjadi penurunan serat kasar 33%, sedangkan Siregar (2004) melaporkan penurunan serat kasar sebesar 13,27% pada fermentasi BIS dengan T. viridae.
Apabila dibandingkan dengan hasil penelitian Pamungkas (2010), yang melakukan penelitian yang sama dengan penambahan enzim cairan rumen
domba, penurunan serat kasarnya mencapai 56,47%. Perbedaan hasil tersebut diduga disebabkan perbedaan sumber enzim yang digunakan. Hal ini dikarenakan jenis enzim selulase dari genus Trichoderma hanya sedikit memproduksi enzim selobiase (β -glukosidase) yang akan menghidrolisis selobiosa menjadi glukosa. Enzim selulase utama yang dihasilkan dari genus
T. harzianum menghasilkan enzim C1(β exoglukanase) 0,307U/ml, dan Cx (β -endoglukanase) sebesar 0,655U/ml (Wizna et al. 2007). Penurunan serat kasar menggunakan T. harzianum membutuhkan masa inkubasi yang lebih lama dibandingkan dengan menggunakancrude enzyme (enzim kasar) secara langsung. Hal ini dikarenakan dalam pertumbuhannya, kapang mengalami beberapa fase
antara lain: fase lag (adaptasi) untuk menyesuaikan dengan kondisi lingkungan
sekitarnya, fase pertumbuhan awal, fase logaritmik, fase statis dan fase kematian.
Kapang mempunyai waktu generasi yang lebih lama dibandingkan dengan bakteri
dan khamir (Fardiaz 1988). Oleh karena itu untuk penurunan serat kasar BIS perlu
dicoba penggunaan crude enzyme (enzim kasar) dari T. harzianum, agar masa inkubasi lebih efektif.
Kandungan NDF, ADF, selulosa, lignin, hemiselulosa
Gambar 15 menunjukkan bahwa pada masa inkubasi 8 hari (T8), terjadi
penurunan fraksi ADF, selulosa dan lignin, sedangkan fraksi NDF dan
hemiselulosa mengalami peningkatan. Analisis fraksi serat hanya dilakukan pada
perlakuan T8, dengan pertimbangan penurunan serat kasarnya tertinggi (44,28%).
Gambar 10 Kandungan fraksi serat sebelum dan setelah fermentasi selama 8 hari.
Fermentasi dengan T. harzianum dapat menurunkan fraksi serat ADF, selulosa dan lignin, namun NDF dan hemiselulosa mengalami peningkatan. Terjadinya penurunan ADF, selulosa dan lignin menunjukkan kemampuan T. harzianum kapang dalam menghasilkan enzim selulase untuk mendegradasi komponen selulosa.T. harzianumadalah fungi yang menghasilkan enzim selulase dan dapat menghidrolisis selulosa (Hamelincket al.2005).
Kandungan NDF pada BISOF terjadi peningkatan, dikarenakan pertumbuhan kapang yang ikut menyumbangkan dinding sel. Gandjar et al. (2006) menyatakan bahwa salah satu komponen dinding sel kapang adalah kitin (polisakarida). Peningkatan NDF juga terjadi pada fermentasi BIS dengan Trichoderma reesei (Jaelani et al.2008). Menurut Daud (1995), kandungan NDF di atas 52% mengindikasikan bahwa tinggi akan komponen dinding sel, sedangkan Chong et al. 1998 melaporkan bahwa kandungan NDF dari BIS berkisar 67,95-74,25%.
Tahap II: Uji Kecernaan Pada Ikan Nila
Tabel 9 menunjukkan bahwa nilai kecernaan pakan acuan lebih baik dibandingkan dengan pakan uji. Penggantian sebagian pakan acuan dengan 30% BIS dan 30% BISOF menurunkan kecernaan dari pakan tersebut. Namun demikian kecernaan total BISOF yang ditambahkan 30% masih jauh lebih tinggi daripada penambahan BIS 30%. Ini menunjukkan bahwa BISOF mempunyai kecernaan lebih baik. Data ini didukung oleh kecernaan bahan BISOF (54,72%) dibandingkan BIS (30,75%).
Tabel 9 Nilai kecernaan total, protein, fosfor, kalsium, energi dan bahan
Kecernaan (%)
Total 72,92±0,92a 60,27±0,18b 67.46±0,13c
Protein 88,71±0,19a 80,19±0,52b 86,85±0,2b
Fosfor 64,04±1,70a 53,6±0,48b 61,12±0,38c
Kalsium 69,10±0,70a 53,03±0,15b 63,93±1,30c
Energi 84,44±0,55a 69,4±0,4b 75,47±0,70c
Bahan - 30,75±3,07 54,72±0,61
PEMBAHASAN
Terjadinya penurunan serat kasar pada BISOF dapat meningkatkan kecernaan nutrien dan bahan tersebut. Perbedaan kecernaan BIS dan BISOF diduga karena kualitas bahannya terutama kandungan serat kasar. Hal ini didukung data perbedaan serat kasar yang signifikan antara BIS dan BISOF (Tabel 7). Perbedaan serat kasar dalam pakan akan mempengaruhi kecernaan
nutrien, karena serat kasar menghambat kerja enzim pencernaan. Kecernaan yang tinggi pada BISOF menyebabkan kerja enzim di saluran usus ikan nila lebih rendah, sehingga nutrien yang diserap lebih banyak. Ikan mempunyai keterbatasan untuk mencerna serat, hal ini berkaitan dengan terbatasnya ketersediaan enzim selulolitik dalam saluran pencernaan. Menurut Fitriliyani (2010), enzim selulase yang dihasilkan dalam saluran pencernaan ikan nila sebesar 0,0176 unit/ml/menit, enzim amilase sebesar 0,2341 unit/ml/menit dan enzim protease 0,425 unit/ml/menit. Profil aktivitas enzim pada saluran pencernaan ikan nila tersebut merupakan indikator dari kemampuan mencerna dan memanfaatkan nutrisi dalam pakan.
Serat kasar terdiri dari selulosa dan lignin yang sulit dicerna. Komponen tersebut dalam saluran pencernaan hanya dapat dihidrolisis oleh enzim selulase. Menurut Clarke & Bouchop (1977) dalam Affandi et al. (2009), menyimpulkan bahwa aktivitas enzim selulase ada hubungannya dengan kebiasaan ikan mengkonsumsi bagian dari tumbuhan yang sedang mengalami penghancuran.
kandungan serat kasar lebih dari 8%, secara visual fesesnya lebih banyak dikeluarkan dan lebih cepat diekskresikan dibandingkan pakan uji BISOF, yang mempunyai kandungan serat kasar lebih rendah (5,61%).
Fakta menunjukkan bahwa kandungan nutrisi dalam serat kasar rendah, namun keberadaannya dalam pakan mutlak diperlukan. Kandungan serat kasar dalam jumlah sedikit dapat meningkatkan gerak peristaltik usus, namun apabila jumlahnya berlebih maka menyebabkan proses penyerapan makanan menjadi tidak efisien (Guillameet al. 1999). Kirchgessener (1986) juga melaporkan bahwa peningkatan kadar serat kasar dalam komposisi pakan akan menurunkan kecernaan nutrisi. Sesuai pendapat Cho et al. (1985) yang menyatakan bahwa serat kasar yang tinggi menyebabkan porsi ekskreta lebih besar, sehingga menyebabkan semakin berkurangnya penyerapan protein yang dapat dicerna.
Selain itu, serat kasar tinggi akan memberikan rasa kenyang karena komposisi karbohidrat kompleks yang menghentikan nafsu makan sehingga mengakibatkan turunnya konsumsi makanan (Piliang 2006). Keberadaan serat kasar yang semakin meningkat menyebabkan terganggunya penyerapan nutrien. Hal ini terjadi karena adanya peningkatan viskositas digesta dan berpengaruh pada kesempatan nutrien untuk dicerna dan diserap oleh saluran pencernaan menjadi lebih singkat (Choct et al.1996). NRC (1983) juga menyatakan bahwa tingginya serat kasar pada pakan dapat mempengaruhi kecernaan nutrien lainnya.
Penggantian sebagian pakan acuan dengan BIS dan BISOF 30%, kecernaannya belum setara dengan pakan acuan. Untuk itu perlu penelitian lebih lanjut mengenai jumlah BIS dan BISOF sebagai bahan pengganti pakan acuan, hingga memiliki tingkat kecernaan yang setara.
Kecernaan bahan BISOF lebih baik dibandingkan dengan BIS, karena
KESIMPULAN
DAFTAR PUSTAKA
Affandi R., Sjafei DS, Rahardjo MF, Sulistiono. 2009. Fisiologi Ikan Pencernaan dan Penyerapan Makanan. IPB Press.
Alexander,M. 1977. Introduction to Soil Microbiology.2th .John Willey and Sons.New York.
Amri M. 2007. Pengaruh bungkil kelapa sawit pada pakan ikan mas (Cyprinus carpio). Jurnal Ilmu-ilmu Pertanian Indonesia Volume 9, No.1. Hlm 71-76.
[BPS] Biro Pusat Statistik.2010. Produksi Tanaman Pangan Nasional.
Bureau DP, Harris AM, Cho CY. 1999. Apparent digestibility of endered animal protein ingredients for rainbow trout (Oncorhynchus mykiss). Aquaculture
180 (3-4):345-358.
Cheeke PR. 1981. The significance of fiber in rabit In Meeting Word Food Needs.Journal of Applied Rabbit Research. Vol 3.
Cho CY, Cowey CB, Watanabe R. 1985. Finfish Nutrition in Asia Methodological Approaches Research Center Ottawa 154 pp.
Choct Met al.1996. Increased small intestinal fermentation is partly responsible for the anti nutritive activity of non starch polysaccharides in chickens. Br Poult Sci37:609–621.
Chong et al. 1999. Physical and chemical characteristics of Malaysian palm kernel cake (PKC) Proc.20thMSAP Conf.27-28 July.Putrajaya. Malaysia
Sci Food Agric59:151–160.
Daud MJ. 1995. Technical innovation in the utilization of local feed resources for more efficient animal production. Proceeding, 17th Annual. Conference.
Kuala Lumpur, Malaysia
[Ditjenbun] Direktorat Jendral Perkebunan. 2010. Komoditi Perkebunan; Kelapa Sawit. [terhubung berkala] http://database.go.id/bdsp/newkom.asp [1 Januari 2010].
De Silva SS, Anderson TA. 1995. Fish nutrition in aquaculture. London: Chapman & Hall.
Fitriliyani I.2010. Peningkatan kualitas nutrisi tepung daun lamtoro dengan penambahan ekstrak enzim cairan rumen domba untuk pakan ikan nila
Oreochromis sp.[disertasi]. Bogor. Sekolah Pascasarjana Institut Pertanian Bogor.
Frazier WC, and Westhoff DC. 1978. Food Microbiology. New Delhi : McGraw Hill Book Publ. Co.
Furuichi M. 1988. Fish Nutrition. P. 1-78. In Fish Nutrition and Mariculture. JICA Text book. The General Aquaculture Course. T. Watanabe (Ed). Departement of Aquatic Bioscience, Tokyo University of Fisheries.
Gandjar I, Sjamsuridzal W, Oetari A. 2006. Mikologi Dasar dan Terapan. Yayasan Obor Indonesia. Jakarta.
Ginting SP, Krisnan R. 2006. Pengaruh fermentasi menggunakan beberapa strain
Trichoderma dan masa inkubasi berbeda terhadap komposisi kimiawi bungkil inti sawit. Seminar Nasional Teknologi Peternakan dan Veteriner Hal 939:944.
Guillaume J, Kaushik S, Bergot P, Metailler. 1999. Nutrition and Feeding of Fish and Crustaceans. Springer-Praxia Book in Aquaculture and Fisheries. Chichester. UK.
Hadadi Aet al. 2007. Pemanfaatan limbah sawit untuk bahan pakan ikan.Jurnal Budidaya Air TawarVol 4: 1 Mei 2007 (11-18).
Hamelinck et al. 2005. Ethanol from lignocellulosic biomass: techno-economic performance in short-, middle- and long-term. Biomass and Bioenergy, Vol. 28, pp. 384-410.
Hardjo SS, Indrasti NS, Tajuddin B. 1989. Biokonversi : Pemanfaatan Limbah Industri Pertanian. Pusat Antar Universitas Pangan dan Gizi. IPB.
Harman GE. 2006. Trichoderma spp., including T. harzianum, T. viridae, T.koningii, T.hamatum and other spp. Deuteromycetes, Moniliales ( asexualclassification system).http://www.nysaes.cornell.edu/ent/biocontrol / pathogens/Trichoderma.html.
Handoko H. 2010. Isolasi dan karakterisasi enzim pendegradasi serat peningkat kualitas bungkil inti sawit untuk pakan ayam pedaging [tesis]. Bogor. Sekolah Pascasarjana Institut Pertanian Bogor.
Howard RL, Masoko P, Abotsi E. 2003. Enzyme activity of Phanerochaete chrysosporium cellobiohydrolase (CBHI.1) expressed as a heterologous protein fromEscherichia coli.African J. Botechnol.2(9): 296-300.
Iluyemi FB, Hanafi MM, Radziah O, Kamarudin MS. 2005. Fungal solid state culture of palm kernel cake.J. Biortech 97: 477-482.
Iyayi EA, Aderolu ZA. 2004. Enhancement of the feeding value of some agroindustrial by products for laying hens after their solid state fermentation withTrichoderma viride.African J Biotechnol3:182–185.
Jaelani A, Firahmi N, 2007. Kualitas sifat fisik dan kandungan nutrisi bungkil inti sawit dari berbagai proses pengolahan crude palm oil (CPO). Al ‘Ulum
Vol.33 No.3 Halaman 1-7.
Jaelani A. 2007. Peningkatan kualitas bungkil inti sawit oleh kapangTrichoderma reeseisebagai pendegradasi polisakarida mannan dan pengaruhnya terhadap penampilan ayam pedaging [disertasi]. Bogor. Sekolah Pascasarjana Institut Pertanian Bogor.
Jaelani A, Piliang WG, Suryahadi, Rahayu I. 2008 Hidrolisis bungkil inti sawit (Elaeis guineensis Jacq) oleh kapang Trichoderma reesei sebagai pendegradasi polisakarida mannan.Animal ProductionVol 10:1 Hlm 42-49.
Juhasz T, Kozma K, Zsolt S, Reczey K. 2003. Production of β-glucosidase in mixed culture of Aspergillus niger BJMF 1305 and Trichoderma reesei
RUT C30.J. Food Tehnol Biotechnol41: 49-53.
Kim DW, Jeong YH, Jang JK, Lee. 1994. Purification and chararaterization of endoglucanase and exoglucanase component from Trichoderma viridae.
J.Ferment. Bioeng.77 (4):363-369.
Kirchgessener M, Kurzinger H, Schwartz FJ. 1986. Digestibility of crude nutrients in different feedsand estimation of their energy contents for carp (Cyprinus carpio L)Aquaculture58:185-194.
Lim HA, Ng WK, Lim SL, Ibrahim CO. 2001.Contamination of palm kernel meal with Aspergillus flavus affects its nutritive value in pelleted feed for tilapia
Oreochromis mossambicus.Aquaculture Research32:895-905.
Maynard LA, Loosli JK, Hintz HF, Warner RG. 1979.Animal Nutrition.Seventh Edition McGraw-Hill Book Company. New Delhi 602 pp.
Muchtadi D, Palupi NS, Astawan M. 1992. Enzim Dalam Industri Pangan. PAU IPB Bogor.
Murni et al. 2008. Metode Pengolahan Limbah untuk Pakan Ternak. Laboratorium Makanan Ternak Fakultas Peternakan. Universitas Jambi
Nagai S. 1979. Control of Solid State Cultivation, Proc. GIAM-V Bangkok. (NRC) National Research Council. 1983. Nutrient Requirements of Warm Water
Fishes and Shellfish. Reved Edition. National Academy Press, Washington D.C.
(NRC) National Research Council. 1993.Nutrient Requirements Of Fish. National Academy Press,Washington, D.C.
Parrakasi. 1990. Ilmu Nutrisi dan Makanan Ternak Monogastrik. Angkasa. Bandung.
Perez et al. 2002. Biodegradation and biological treatments of cellulose, hemicelluloses and lignin: overview.Int Microbiol.5:53-63.
Piliang W, Djojosoebagio SA. 2006. Fisiologi Nutrisi Volume I. IPB Press Jakarta.
Samingan. 2009. Suksesi fungi dan dekomposisi serasah daun Acacia mangium
Willd dalam kaitan dengan keberadaan Ganoderma dan Trichoderma di lantai hutan akasia (disertasi). Bogor. Sekolah Pascasarjana Institut Pertanian Bogor.
Sayed EA. 1999. Alternative dietary protein sources for farmed tilapia
Oeochromisspp.Aquaculture179 : 149-168.
Simanjuntak SDD. 1998. PenggunaanAspergillus nigeruntuk meningkatkan nilai gizi bungkil inti sawit dalam ransum broiler [tesis]. Bogor: Sekolah Pascasarjana Institut Pertanian Bogor.
Sinurat AP. 2003. Pemanfaatan lumpur sawit untuk bahan pakan unggas.
Wartazoa13:39–47.
Siregar Z. 1995. Pengaruh suplementasi enzim selulosa pada ransum yang mengandung bungkil inti sawit terhadap penampilan ayam pedaging strain bromo. [Tesis ]. Malang . Program Pascasarjana Universitas Brawijaya.
Schmidt O. 2006. Wood and Free Fungi : Biology, Damage, Protection and Use . Hamburg: Springer.
Sjofjan O , Aulanni’am, Irfan D, Surisdiarto. 2001. Perubahan kandungan bahan
Shurtleff W and Aoyagi A. 1979. The Book of Tempeh: A Soy Food from Indonesia. New York: Harper and Row
Steel RGD, Torrie JH. 1995. Prinsip dan Prosedur Statistika: Suatu Pendekatan Biometrik. Sumantri B, penerjemah; Jakarta: Gramedia Pustaka Utama Cetakan ke-4. Terjemahan dari:Principles and Procedures of Statistics.
Sumanti DM, Tjahjadi C, Herudiyanto M, Sukarti T. 2005. Mekanisme produksi minyak sel tunggal dengan sistem fermentasi padat pada media onggok-ampas tahu dengan menggunakan kapang Aspergillus terreus . J. Teknologi dan Industri PanganVol XVI, No.1 Tahun 2.
Sundu B, Kumar A, Dingle JG. 2004. Perbandingan dua produk enzim komersial pencerna beta mannan pada ayam pedaging yang mengkonsumsi bungkil kelapa sawit dengan level yang berbeda. Prosiding Seminar Nasional Pemanfaatan Sumber Daya Hayati Berkelanjutan. Hlm:19–25. Palu:Tadulako Univ Pr.
Sutardi, 1997. Landasan Ilmu Nutrisi. Departemen Ilmu Nutrisi dan Makanan Ternak. Fakultas Peternakan IPB. Bogor.
Takeuchi T. 1988. Laboratory work-chemical evaluation of dietary nutrients, p. 179-233. In Watanabe T. (ed): Fish Nutrition and Mariculture. Tokyo. Departement of Aquatic Biosciences Tokyo Univercity of Fisheries. JICA.
Tillman AD, Hartadi H, Reksohadiprodjo S, Lebdosukodjo S. 1998. Ilmu Makanan Ternak Dasar. Yogjakarta : Gajah Mada University Press.
Tjiptadi W, Sutamiharja RTM. 1985. Pemanfaatan Limbah Padat IndustriTapioka
Sebagai Bahan Makanan Manusia. Laporan Riset Unggulan Terpadu II/1984. FATETA, IPB. Bogor.
Van Soest PJ, Robertson JB, Lewis BA. 1991.Methods for dietary fiber and non-starch polysaccharides in relation to animal nutrition. J. Dairy Sci. 74:3583-3597.
Wanasuria S, 2008. Seberapa Penting Bungkil Inti Sawit Dalam Pakan. http://www.Feed Indonesia.net/index.php/palm Kernel Cake (diakses pada tanggal 16 Juli 2009)
Watanabe T. 1988. Fish Nutrition and Mariculture, JICA Text Book. The General Aquaculture Course. Departement of Aquatic Bioscience. Tokyo University of Fisheries. Tokyo.
Wizna, H. Abbas, Y. Rizal, A. Dharma & I. P. Kompiang. 2007. Selection and identifi cation of cellulase-producing bacteria isolated from the litter of mountain and swampy forest.J. Microbiology Indonesia1: 135-139.
Zahari W, Alimon AR. 2004. Use of palm kernel cake and oil palm by products in compound feed.Palm Oil Dev40:5–9.
Lampiran 1. Prosedur Analisa Proksimat Pakan dan Feses
1. Analisa Kadar Air (Takeuchi 1988).
1. Cawan dipanaskan pada suhu 105° C selama 3 jam
2. Bahan seberat A gram dimasukkan ke dalam cawan dan ditimbang (X gram)
3. Cawan yang sudah berisi bahan dimasukkan dalam oven pada suhu 105° C selama 3 jam, kemudian didinginkan dalam eksikator selama minimal 30 menit dan ditimbang (Y gram)
4. Prosedur no.3 diulangi, jika sudah tidak ada perubahan bobot pakan maka pengukuran selesai
5. Persentase (%) kadar air :
[
(X-Y) / A]
x 100%2. Analisa Kadar Abu (Takeuchi 1988).
1. Cawan porselen dipanaskan dengan muffle furnace pada suhu 600° C
selama 1 jam, kemudian dibiarkan sampai suhu muffle furnace turun menjadi 110° C. selanjutnya, cawan porselen dikeluarkan dan didinginkan dalam eksikator selama 30 menit atau lebih. Setelah dingin, cawan
ditimbang (A gram)
2. Sampel dimasukkan kemudian ditimbang (B gram) dengan ketelitian 4 desimal
3. Kemudian dianaskan kembali dalam muffle furnace pada suhu 600° C selama 24 jam
4. Cawan porselen dikeluarkan lalu didinginkan dalam eksikator selama 30 menit, kemudian timbang (C gram)
3. Analisa Kadar Protein (Metode Kjehdal, Takeuchi 1988)
1. Menimbang 0,5-1,0 gram bahan, kemudian dimasukkan ke dalam labu kjehldahl. Salah satu labu tidak perlu dimasukkan bahan ke dalamnya karena akan digunakan sebagai blanko
2. Ditambahkan 3 gram katalis (K2SO4+ CuSO4. 5H2O) dengan rasio 9:1 dan 10 ml H2SO4pekat
3. Labu dipanaskan selama 3-4 jam hingga cairan dalam labu berwarna hijau, setelah itu pemanasan dilanjutkan 30 menit lagi
4. Kemudian larutan didinginkan kemudian ditambahkan air destilasi sebanyak 30 ml. Larutan dimasukkan ke dalam labu takar dan ditambahkan air destilata hingga volume larutan menjadi 100 ml
5. Menyiapkan labu destilasi dan diisi 5 ml larutan no. 4 lalu ditambahkan NaOH 30%
6. Labu Erlenmeyer diisi 10 ml H2SO4 0,05 N dan ditambahkan 2-3 tetes indikator (Methyl red) yang disiapkan untuk menampung NH3 yang dibebaskan dari bahan pada prosedur no. 4 selama proses destilasi berlangsung
7. Pemanasan dengan uap terhadap labu destilasi (no. 4) dilakukan minimal 10 menit setelah kondensasi
8. Larutan dalam labu Erlenmeyer dititrasi dengan larutan NaOH 0,05 N 9. Persentase (%) kadar protein:
Vs = volume titran NaOH 0,05 N (ml) untuk sampel Vb = volume titran NaOH 0,05 N (ml) untuk blanko F = faktor koreksi dari 0,05 N larutan NaOH S = bobot sampel (g)
* = setiap ml 0,05 N NaOH ekivalen dengan 0,0007 g nitrogen ** = faktor pengali nitrogen
4. Analisa Kadar Lemak (Metode Ether Ekstrasi : Takeuchi 1988)
1. Labu ekstraksi dipanaskan pada suhu 110° C selama 1 jam, kemudian didinginkan selama 30 menit dalam eksikator. Panaskan kembali selama 30 menit, lalu dinginkan, kemudian timbang (A gram). Proses terus diulang sampai tidak ada perbedaan bobot labu lebih dari 0,3 miligram 2. Bahan sebanyak 1-2 gram dimasukkan ke dalam tabung filter, lalu
dipanaskan pada suhu 90-100° C selama 2-3 jam
3. Kemudian tabung filter ditempatkan ke dalam labu ekstraksi dari alat soxchlet, kemudian disambungkan kondensor labu ekstraksi pada no. 1 yang telah diisi 100 ml petroleum ether
4. Ether dipanaskan pada labu ekstraksi dengan menggunakan water bath bersuhu 70° C selama 16 jam
5. Panaskan labu ekstraksi pada suhu 100° C, kemudian timbang (B gram) 6. Persentase (%) kadar lemak :
[
(B-A) / berat sampel]
x 100%5. Analisa Kadar Serat Kasar (Takeuchi 1988)
1. Kertas filter dipanaskan dalam oven selama 1 jam pada suhu 110oC, lalu didinginkan dalam eksikator lalu ditimbang (X1).
2. Sampel ditimbang 0,5 g (A), dimasukkan ke dalam erlenmeyer 250 ml. 3. H2SO4 0,3 N sebanyak 50 ml dimasukkan ke dalam erlenmeyer lagi
kemudian dipanaskan selama 30 menit. Setelah itu NaOH 1,5 N sebanyak 25 ml dimasukkan ke dalam erlenmeyer lagi kemudian dipanaskan selama 30 menit.
4. Larutan dan bahan yang telah dipanaskan kemudian disaring dalam corong buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi. 5. Larutan dan bahan yang ada pada corong buchner dibilas secara
berturut-turut dengan 50 ml air panas, H2SO4 0,3 N, air panas 50 ml, dan 25 ml aseton.
6. Kertas saring dan isinya dimasukkan ke dalam cawan porselen, dikeringkan selama 1 jam kemudian didinginkan dalam eksikator dan ditimbang (X2).
7. Kemudian dipanaskan dalam tannur 600oC hingga berwarna putih, dinginkan dalam eksikator dan ditimbang (X3).
Prosentase serat kasar (%) = 100 A
X3 X1
X2− −
6.Analisa Cr2O3Pakan dan Feses (Watanabe, 1988)
1. Sampel sebanyak 0,1-0,2 gram dan 5 ml asam niric dimasukkan ke dalam labu kjehldahl, kemudian dipanaskan selama 30 menit sampai volume larutan menjadi 1 ml, lalu didinginkan
2. Larutan asam perklorat sebanyak 3 ml ditambahkan ke dalam labu pada prosedur 1, lalu dipanaskan kembali hingga menimbulkan asap putih. Larutan yang semula berwarna hijau akan berubah menjadi kuning atau jingga
3. Kemudian dianaskan kembali selama 10 menit kemudian dinginkan
4. Larutan yang telah dingin dipindahkan ke dalam gelas ukur bervolume 100 ml, kemudian diencerkan hingga volume larutan tepat 100 ml
5. Absorban larutan diukur dengan menggunakan spektrofotometer pada panjang gelombang 350 nm (y)
6. Persamaan hubungan Cr2O3dengan absorbansi; y = 0,2089x + 0,0032
Keterangan; x = Cr2O3
7.Analisis Mineral (Reitzet al. 1960) A. Preparasi Sampel (Wet Ashing)
1. sampel ditimbang61 g dimasukkan ke dalam erlenmeyer 125 ml.
2. Ditambahkan larutan HNO3 65% (pa) sebanyak 5 ml tiap sampel (pengerjaan diruang asam).
3. Dibiarkan selama 1 jam tanpa pemanasan diruang asam, kemudian dipanaskan diatas hot plate 800C selama 4-6 jam.
4. Didiamkan selama satu malam setelah pemanasan.
5. Ditambahkan 0,4 ml H2SO4 (pa), kemudian dipanaskan kembali sampai
larutan mengental (61 jam).
6. Ditambahkan 62 tetes campuran HNO3 : HClO4sampai larutan berubah
warna, dari coklat menjadi kuning, kemudian pemanasan dilanjutkan selama 15 menit, ditambahkan 0,6 ml HCl (p) dan 2 ml aquades, dipanaskan kembali selama 15 menit.
7. Tiap sampel dimasukkan ke dalam labu takar 100 ml.
B. Analisa Fosfor (P)
1. Dibuat standard P sebanyak 5 deret standard, yaitu 0, 2 , 3, 4 dan 5 ppm.
2. Dipipet sampel ke dalam tabung reaksi sebanyak61 ml.
3. Ditambahkan larutan C (campuran 10 ml amonium molibdat 10 % +
aquadest + 5 g FeSO4.7H2O + aquades sampai 100 ml) sebanyak 2 ml setelah semua standar dan sampel dipipet dan dijadikan 3 ml, lalu
ditambahkan 2 ml larutan C sehingga totalnya menjadi 5 ml, diaduk
(vortex) lalu dibaca spektrofotometer denganλ= 660 nm.
C. Analisa Ca
1. Dibuat larutan standar untuk Ca:2,4 dan 6 ppm
2. Ke dalam tabung reaksi , sampel yang sudah dipreparasi (wet ashing dipipet sebanyak 0,1 ml lalu ditambahkan 0.05 ml larutan Cl3Ia.7H2O dan aquades sebanyak 4.9 ml keudian diaduk (vortex) dan ditutup