Rudiyanti, S., dan Ekasari, A.D. (2009). Pertumbuhan Dan Survival Rate Ikan Mas (Cyprinus carpio Linn) Pada Berbagai Konsentrasi Pestisida Regent 0,3 G. Jurnal Saintek Perikanan. (5)1: 40.
Rumampuk, D.N., Tilaar, S., Wullur S. (2010). Median Lethal Concentration (LC-50) Insektisida Diklorometan Pada Nener Bandeng (Chanos-chanos forks). Manado: Fakultas Perikanan dan Ilmu Kelautan. Universitas Sam Ratulangi. Jurnal Perikanan dan Kelautan. 6(2): 88.
Saanin, H. (1984). Taksonomi dan Kunci Identifikasi Ikan. Buku 2. Bandung: Penerbit Binacipta. Hal. 39.
Saragih, I.F.C. (2012). Isolasi Senyawa Flavonoid dari Daun Tumbuhan Lagundi (Vitex trifolia L.). Skripsi. Medan. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Sumatera Utara.
Setyawaty, D. (2002). Studi Pengaruh Ekstrak Daun Sirih (Piper betle Linn) dalam Pelarut Aquades, Etanol, dan Metanol Terhadap Perkembangan Larva Nyamuk Culex quinquefasciatus. Skripsi. Bogor: Institut Pertanian Bogor.
Soemirat, J. (2005). Toksikologi Lingkungan. Yogyakarta: Gadjah Mada University Press.
Thompson, R.C.M. (1971). Pesticides and Freshwater Fauna. Academic Press, London and New York.
Untung, K. (1993). Pengantar Pengelolaan Hama Terpadu. Yogyakarta: Gadjah Mada University Press. Hal. 23.
Wudianto, R. (1994). Petunjuk Penggunaan Pestisida. Jakarta: Penebar Swadaya. Wulandari, W., Sukiya., dan Suhandoyo. (2013). Efek Insektisida Decis terhadap
UJI LETHAL CONCENTRATION (LC50)
EKSTRAK ETANOL DAUN LEGUNDI (Vitex trifolia L.) PADA IKAN NILA (Oreochromis niloticus)
Abstrak
Latar belakang: penggunaan pestisida untuk membasmi hama mengganggu kualitas air dan membunuh ikan. Pengendalian hama umumnya masih dilakukan dengan menggunakan pestisida sintetik. Salah satu tanaman yang dapat dimanfaatkan sebagai pestisida nabati yaitu daun legundi (Vitex trifolia L.). Bagian tanaman yang dapat digunakan adalah daun dan batang.
Tujuan: untuk mengetahui tingkat toksik dan melihat nilai LC50 ekstrak etanol
daun legundi pada ikan nila.
Metode: penelitian meliputi penyiapan sampel, pembuatan ekstrak etanol daun legundi, penyiapan hewan percobaan, pengamatan gejala toksik ikan, pengamatan kematian ikan dan pengukuruan LC50. Pengujian ini menggunakan ikan nila
sebanyak 150 ekor dibagi dalam 5 kelompok. Empat kelompok diberi ekstrak etanol daun legundi konsentrasi 5; 50; 500 dan 5000 ppm serta kelompok kontrol (0 ppm). Pengamatan dilakukan selama 6 hari dengan 3 kali pengulangan, data dianalisis statistik dengan metode One Sample T-Test menggunakan Statistical Program Service Solution (SPSS) versi 17.0.
Hasil: gejala toksik ikan nila diperoleh pada kelompok konsentrasi 50; 500 dan 5000 ppm. Sedangkan pada konsentrasi 0 ppm dan 5 ppm tidak ditemukan gejala apapun. Hasil pengamatan terhadap kematian hewan menunjukkan pada konsentrasi 0 ppm dan 5 ppm tidak terjadi kematian ikan nila. Pada konsentrasi 50 ppm terjadi kematian ikan nila sebesar 16,67% dan konsentrasi 500 ppm terjadi kematian ikan nila sebesar 70% sedangkan pada konsentrasi 5000 ppm terjadi kematian ikan nila sebesar 100%. Nilai LC50 yang diperoleh 224,74 ppm yang
dianalisis statistik dengan uji One Sample T-Test menunjukkan bahwa terdapat perbedaan bermakna antar nilai LC50 0,041 (p < 0,05).
Kesimpulan: penelitian ini membuktikan bahwa daun legundi (Vitex trifolia L.) mempunyai potensi sebagai pestisida nabati karena termasuk kategori praktis tidak toksik dimana nilai LC50 ekstrak etanol daun legundi (Vitex trifolia L.)
adalah 224,74 ppm berada pada kisaran LC50 > 100 ppm.
THELETHAL CONCENTRATION (LC50) TEST OF
ETHANOL EXTRACT OF Vitex trifolia L. LEAVES ON TILAPIA (Oreochromis niloticus)
Abstract
Background: the use of pesticides to exterminate pests disrupts water quality and kills fish. Generally, the pest control still use synthetic pesticides. One of the plants that can be used as a botanical pesticide is Vitex trifolia L. Parts of plants that can be used are its leaves and stems.
Purpose: the aim of this study was to determine the level of toxic and determine LC50 value of ethanol extract of Vitex trifolia L. leaves on tilapia.
Method: the research included sample preparation, the production of ethanol extract of Vitex trifolia L. leaves, the preparation of animal experiments, the fish toxic symptoms observations, the fish mortality observations and LC50
measurement. This test used 150 tilapias divided into 5 groups. Four groups were given with ethanol extract of Vitex trifolia L. leaves concentrations of 5; 50; 500 and 5000 ppm and the control group (0 ppm). The observations were done for 6 days with 3 repetitions, the obtained data then statistically analyzed by One Sample T-Test method using the Statistical Program Service Solution (SPSS) version 17.0.
Result: the symptoms of tilapia toxic effect was obtained on the group concentration of 50; 500 and 5000 ppm. Whereas on the group concentration of 0 ppm and 5 ppm were not found any symptoms. The observation of the animals death showed that there was not any death of tilapia at concentrations of 0 ppm and 5 ppm. At the concentration of 50 ppm, 16.67% tilapias were death and 70% at the concentration of 500 ppm, whereas 100% at the concentration of 5000 ppm. The obtained LC50 values of 224.74 ppm were analyzed statistically with One
Sample T-Test showed that there were significant differences between the LC50
value 0.041 (p < 0.05).
Conclusion: this study proved that Vitex trifolia L. leaves was potential as a botanical pesticide because it had practically non toxic category which was the LC50 values of ethanol extract of Vitex trifolia L. leaves was in the range of
224.74 ppm LC50 > 100 ppm.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Salah satu penyebab pencemaran lingkungan adalah sebagai akibat adanya limbah yang dibuang ke dalam lingkungan (Soemirat, 2005). Limbah yang masuk ke perairan, salah satunya adalah limbah yang berasal dari pertanian yakni pestisida. Berbagai pestisida digunakan sebagai pengendali hama untuk meningkatkan produksi pertanian. Pestisida yang masuk dalam jumlah yang besar dapat bersifat racun bagi biota-biota yang hidup di perairan, antara lain adalah ikan-ikan. Pestisida sering digunakan sebagai pilihan utama untuk memberantas organisme pengganggu tanaman sebab mempunyai daya bunuh yang tinggi, penggunaannya mudah dan hasilnya cepat diketahui. Pengendalian hama umumnya masih dilakukan dengan menggunakan pestisida sintetik (Wudianto, 1994). Penggunaan pestisida yang tidak bijaksana akan mengakibatkan dampak negatif, seperti timbulnya strain hama yang resisten, resurgensi hama, dan pencemaran lingkungan (Untung, 1993).
adalah menurunnya kekebalan tubuh terhadap penyakit dan terhambatnya pertumbuhan (Thompson, 1971). Sebagai contoh adalah ikan nila (Oreochromis niloticus) termasuk ikan yang mudah untuk dibudidayakan dan mampu bertahan hidup di perairan yang kondisinya sangat jelek, karena itu ikan nila sering dijadikan sebagai petunjuk adanya perubahan faktor-faktor yang mempengaruhinya terutama pengaruh kualitas air (Wulandari, dkk., 2013).
Alternatif yang dapat dicobakan adalah dengan menggunakan pestisida yang berasal dari tumbuhan karena mudah terurai di alam. Apabila diperoleh suatu cara yang tepat, maka bahan dari tumbuhan tersebut dapat dikembangkan menjadi usaha tani industri (Kardinan, 2005). Salah satu tanaman yang dapat dimanfaatkan sebagai pestisida nabati yaitu daun legundi, bagian tanaman yang dapat digunakan daun dan batang. Daun legundi mengandung minyak atsiri dan alkaloid. Kandungan alkaloid pada daun adalah 8,7% dan kandungan minyak atsiri pada daun berkisar 0,28% (Heyne, 1978). Simplisia daun legundi (Vitex trifolia L.) mengandung senyawa alkaloid, flavonoid, saponin, triterpenoid, glikosida, dan tanin (Apandi, 2014). Senyawa fenolik, glikosida dan saponin dapat berfungsi sebagai larvasida (Setyawaty, 2002). Ekstrak daun legundi dapat berfungsi sebagai insektisida terhadap larva Aedes aegypti (Andesfha, 2004). Namun dampak penggunaan pestisida ini pada lingkungan belum dilakukan, maka peneliti tertarik untuk melakukan penelitian mengenai uji LC50 terhadap pengaruh ekstrak
1.2 Perumusan Masalah
Berdasarkan latar belakang diatas, maka perumusan masalah pada penelitian ini adalah:
a. apakah ekstrak etanol daun legundi (EEDL) berpengaruh terhadap gejala toksisitas ikan nila?
b. apakah ada perbedaan persentase kematian ikan nila pada tiap konsentrasi ekstrak etanol daun legundi (EEDL)?
c. apakah ekstrak etanol daun legundi (EEDL) termasuk kategori toksik terhadap ikan nila?
1.3Hipotesis
Berdasarkan perumusan masalah diatas, maka hipotesis pada penelitian ini diduga:
a. ekstrak etanol daun legundi (EEDL) berpengaruh terhadap gejala toksisitas ikan nila.
b. terdapat perbedaan persentase kematian ikan nila pada tiap konsentrasi ekstrak etanol daun legundi (EEDL)
c. ekstrak etanol daun legundi (EEDL) termasuk kategori tidak toksik.
1.4Tujuan Penelitian
Adapun tujuan penelitian ini untuk mengetahui:
b. persentase kematian ikan nila pada tiap konsentrasi ekstrak etanol daun legundi (EEDL).
c. tingkat toksik dari ekstrak etanol daun legundi (EEDL) yang diukur dengan penilaian LC50.
1.5Manfaat Penelitian
Adapun manfaat penelitian ini adalah:
a. dapat memberikan informasi mengenai efek toksik pada pestisida alami dari ekstrak etanol daun legundi pada ikan nila.
b. dapat memberikan informasi mengenai batasan keamanan konsentrasi pestisida alami dari ekstrak daun legundi.
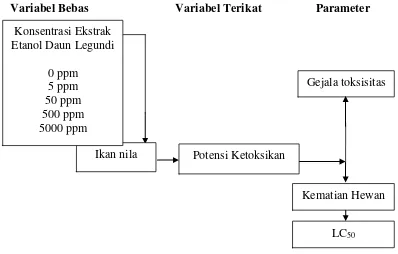
1.6 Kerangka Pikir Penelitian
Kerangka pikir penelitian ini adalah sebagai berikut terdapat pada gambar:
Variabel Bebas Variabel Terikat Parameter
Gejala toksisitas
Potensi Ketoksikan Ikan nila
Kematian Hewan
LC50
Konsentrasi Ekstrak Etanol Daun Legundi
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Sistematika Tumbuhan
Sistematika tumbuhan legundi adalah sebagai berikut (Integrated Taxonomic Information System, 2011):
Kingdom : Plantae
Divisi : Traecheophyta Subdivisi : Spermatophytina Kelas : Magnoliopsida Bangsa : Lamiales Suku : Lamiaceae Marga : Vitex
Jenis : Vitex trifolia L.
2.1.2 Nama Daerah
2.1.3 Nama Lain
Vitex trifolia L. memiliki nama lain: hand of Mary, dangla (Filipina); galumi (Indonesia); lenggundi (Malaysia); khon thiso (Thailand) (Orwa, dkk., 2009).
2.1.4 Morfologi Tumbuhan
Legundi tumbuh pada tempat-tempat yang tandus, panas dan berpasir. Ditemukan tumbuh liar di hutan jati, hutan sekunder, semak belukar atau dipelihara sebagai tanaman pagar. Di jawa, legundi dapat tumbuh sampai ketinggian 1.000 m dari permukaan laut.
Tanaman legundi merupakan perdu, tumbuh tegak, tinggi 1 – 4 m, batang berambut halus. Daun mejemuk menjari beranak daun tiga, bertangkai, helaian anak daun berbentuk bulat telur, ujung dan pangkal runcing. Tepi rata, pertulangan menyirip, permukaan atas berwarna hijau, permukaan bawah berambut rapat warna putih, panjang 4 – 9,5 cm, lebar 1,75 – 3,75 cm. Bunga majemuk berkumpul dalam tandan, berwarna ungu muda, keluar dari ujung tangkai. Buah bulat. Daun berbau aromatik khas dan dapat digunakan untuk menghalau serangga atau kutu lemari. Perbanyakan dengan setek batang (Dalimartha, 2008).
2.1.5 Khasiat Tumbuhan
Efek farmakologis legundi diantaranya sebagai obat influenza, demam, migren, sakit kepala (cephalgia), sakit gigi, sakit perut, diare, mata merah, rematik, beri-beri, batuk, luka terpukul, luka berdarah, muntah darah, haid tidak teratur dan pembunuh serangga. Akar legundi mempunyai efek farmakologis mencegah kehamilan dan perawatan setelah bersalin. Bijinya untuk obat pereda, penyegar badan dan perawatan rambut. Buah legundi digunakan untuk obat cacing dan peluruh haid. Sementara daunnya untuk analgesik, antipiretik, obat luka, diuretik, karminatif, pereda kejang, menormalkan siklus haid dan pembunuh kuman (Hariana, 2008).
2.2 Ekstraksi
Ekstraksi adalah proses penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak larut dengan pelarut cair (Depkes RI, 2000). Hasil dari ekstraksi disebut dengan ekstrak yaitu sediaan kental yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian sehingga memenuhi baku yang telah ditetapkan (Ditjen POM, 1995).
Menurut Depkes RI (2000), ada beberapa metode ekstraksi yang sering digunakan antara lain yaitu:
a. Cara dingin 1. Maserasi
Maserasi yang dilakukan pengadukan secara terus-menerus disebut maserasi kinetik sedangkan yang dilakukan pengulangan penambahan pelarut setelah dilakukan penyarian terhadap maserat pertama dan seterusnya disebut remaserasi. 2. Perkolasi
Perkolasi adalah proses penyarian simplisia menggunakan alat perkolator dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus-menerus sampai diperoleh perkolat. b. Cara panas
1. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan pelarut pada temperatur titik didihnya dalam waktu tertentu dimana pelarut akan terkondensasi menuju pendingin dan kembali ke labu.
2. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada temperatur lebih tinggi dari temperatur kamar, yaitu secara umum dilakukan pada temperatur 40-50°C.
3. Sokletasi
4. Infudasi
Infudasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90°C selama 15 menit.
5. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90°C selama 30 menit.
2.3 Uji Toksisitas
Uji toksisitas adalah suatu uji untuk mendeteksi efek toksik suatu zat pada sistem biologi dan untuk memeperoleh data dosis-respon yang khas dari sediaan uji. Data yang diperoleh dapat digunakan untuk memberi informasi mengenai derajat bahaya sediaan uji tersebut sehingga dapat ditentukan dosis penggunaannya. Uji toksisitas menggunakan hewan uji berguna untuk melihat adanya reaksi biokimia, fisiologik dan patologik terhadap suatu sediaan uji. Uji toksisitas dapat memberikan petunjuk adanya toksisitas relatif dan membantu identifikasi efek toksik bila terjadinya pemaparan (BPOM RI, 2011).
Pengujian toksisitas konvensional pada hewan coba sering mengungkapkan serangkaian efek akibat pajanan toksikan dalam berbagai dosis untuk berbagai masa pajanan. Pengujian toksisitas juga penting untuk menunjukkan organ sasaran, system, atau toksisitas khusus yang membutuhkan pengujian lebih lanjut. Penelitian toksikologi biasanya dibagi menjadi tiga kategori:
2. Uji toksisitas jangka pendek (dikenal dengan subkronik) dilakukan dengan memberikan bahan tersebut berulang-ulang, biasanya setiap hari atau lima kali seminggu, selama jangka waktu kurang lebih 10% dari masa hidup hewan, yaitu tiga bulan untuk tikus atau mencit dan satu atau dua tahun untuk anjing. Namun, beberapa pengujian bias dilakukan menggunakan jangka waktu yang lebih pendek yaitu pemberian zat selama 28 hari.
3. Uji toksisitas jangka panjang dilakukan dengan memberikan bahan kimia berulang-ulang selama masa hidup hewan coba atau sekurang-kurangnya sebagian besar dari masa hidupnya, misalnya 18 bulan untuk mencit, 24 bulan untuk tikus, dan 7-10 tahun untuk anjing dan monyet (Lu, 1994).
2.3.1 Uji Toksisitas Akut
Uji toksisitas akut adalah suatu pengujian untuk mendeteksi efek toksik yang muncul dalam waktu singkat setelah pemberian sediaan uji yang diberikan secara oral dalam dosis tunggal, atau dosis berulang yang diberikan dalam waktu 24 jam (BPOM RI., 2011).
Prinsip uji toksisitas akut yaitu sediaan uji dalam beberapa tingkat dosis diberikan pada beberapa kelompok hewan uji dengan satu dosis perkelompok, kemudian dilakukan pengamatan terhadap adanya efek toksik dan kematian. Hewan yang mati selama percobaan dan yang hidup sampai akhir percobaan diotopsi untuk dievaluasi adanya gejala-gejala toksik (BPOM RI., 2011).
yang dapat digunakan untuk merancang uji toksisitas selanjutnya serta untuk memperoleh nilai LD50 atau LC50 suatu sediaan (BPOM RI., 2011).
2.3.2 Lethal Concentration (LC50)
LC50 merupakan konsentrasi yang menyebabkan kematian sebanyak 50%
dari organisme uji yang dapat diestimasi dengan grafik dan perhitungan, pada suatu waktu pengamatan tertentu, misalnya LC50 48 jam, LC50 96 jam sampai
waktu hidup hewan uji. Uji toksisitas diklasifikasikan sebagai berikut: Klasifikasi menurut waktu, yaitu uji hayati jangka pendek (short term bioassay), jangka menengah (intermediate bioassay) dan uji hayati jangka panjang (long term bioassay). Klasifikasi menurut metode penambahan larutan atau cara aliran larutan, yaitu uji hayati statik (static bioassay), pergantian larutan (renewal biossay), mengalir (flow through bioassay). Klasifikasi menurut maksud dan tujuan penelitian adalah pemantauan kualitas air limbah, uji bahan atau satu jenis senyawa kimia, penentuan toksisitas serta daya tahan dan pertumbuhan organisme uji (Rossiana, 2006). Untuk mengetahui efek zat pencemar terhadap biota dalam suatu perairan, perlu dilakukan suatu uji toksisitas zat pencemar terhadap biota yang ada yaitu dalam bentuk Lethal Concentration (LC50). Jadi, uji toksisitas
2.4 Pestisida
Pestisida adalah bahan kimia untuk membunuh hama, baik insekta, jamur maupun gulma, sehingga pestisida dikelompokkan menjadi: insektisida (pembunuh insekta), fungisida (pembunuh jamur) dan herbisida (pembunuh tanaman pengganggu/gulma). Pestisida telah secara luas digunakan untuk tujuan memberantas hama dan penyakit tanaman dalam bidang pertanian. Pestisida juga digunakan di rumah tangga untuk memberantas nyamuk, lalat, kecoa dan berbagai serangga penganggu lainnya, akan tetapi pestisida ini secara nyata banyak menimbulkan keracunan pada makhluk hidup (Djunaedy, 2009).
Dewasa ini bermacam-macam jenis pestisida telah diproduksi dengan usaha mengurangi efek samping yang dapat menyebabkan berkurangnya daya toksisitas pada manusia, tetapi sangat toksik pada serangga. Bila dihubungkan dengan pelestarian lingkungan maka penggunaan pestisida perlu diwaspadai karena akan membahayakan kesehatan bagi manusia maupun makhluk hidup lainnya (Djunaedy, 2009).
Pestisida alami merupakan hasil ekstraksi bagian tertentu dari tanaman baik dari daun, buah, biji atau akar yang memiliki senyawa atau metabolit sekunder dan memiliki sifat racun terhadap hama dan penyakit tertentu (Djunaedy, 2009).
2.5 Keracunan Pestisida
dari keracunan tersebut, yang membedakannya adalah waktu terjadinya keracunan dan organ target yang terkena (Ngatidjan, 2006).
Bahan-bahan racun pestisida masuk ke dalam tubuh organisme (jasad hidup) berbeda-beda menurut situasi paparan. Mekanisme masuknya racun pertisida tersebut dapat melalui melalui kulit luar, mulut dan saluran makanan, serta melalui saluran pernapasan. Melalui kulit, bahan racun dapat memasuki pori-pori atau terserap langsung ke dalam sistem tubuh, terutama bahan yang larut minyak (Ngatidjan, 2006).
Keracunan ini menimbulkan gejala keracunan setelah waktu yang relatif lama karena kemampuannya menumpuk (akumulasi) dalam lemak yang terkandung dalam tubuh. Racun ini juga apabila mencemari lingkungan (air, tanah) akan meninggalkan residu yang sangat sulit untu dirombak atau dirubah menjadi zat yang tidak beracun karena kuatnya ikatan kimianya. Ada di antara racun ini yang dapat dirombak oleh kondisi tanah tapi hasil rombakan masih juga merupakan racun. Demikian pula halnya, ada yang dapat terurai di dalam tubuh manusia atau hewan tapi menghasilkan metabolit yang juga masih beracun (Ngatidjan, 2006).
pestisida tersebut tidak terjadi seketika itu juga, melainkan sedikit demi sedikit. Sisa yang tertinggal inilah yang kemudian diserap sebagai residu. Jumlah residu pestisida dipengaruhi oleh suhu, kelembaban, jasad renik, sinar matahari dan jenis dari pestisida tersebut (Pohan, 2004).
Pengaruh secara langsung maupun secara tidak langsung akibat adanya pencemaran pestisida akan mengganggu kualitas air, sehingga kelangsungan hidup dan pertumbuhan ikan juga akan terganggu. Pengaruh secara langsung disebabkan oleh akumulasi pestisida dalam organ-organ tubuh akibat tertelan bersama-sama makanan yang terkontaminasi, atau akibat rusaknya organ-organ pernafasan sehingga dapat mematikan ikan budidaya dalam jangka waktu tertentu, sedangkan secara tidak langsung dampaknya terhadap manusia adalah menurunnya kekebalan tubuh terhadap penyakit dan terhambatnya pertumbuhan (Thompson, 1971).
2.6 Ikan Nila
Ikan nila selama ini dikenal dengan nama ilmiah Tilapia nilotica, namun menurut klasifikasi terbaru pada tahun 1982 nama ilmiah ikan nila berubah menjadi Oreochromis niloticus. (Kordi, 2004).
2.6.1 Klasifikasi Ikan Nila
Klasifikasi ikan nila (Oreochromis niloticus) adalah sebagai berikut : Filum : Chordata
Ordo : Percomorphi SubOrdo : Percoidea Famili : Cichlidae Genus : Oreochromis
Spesies : Oreochromis niloticus (Saanin, 1984).
2.6.2 Morfologi Ikan Nila
Ikan nila (Oreochromis nilotica) memiliki ciri morfologi, yaitu berjari-jari keras, sirip perut torasik, letak mulut subterminal dan berbentuk meruncing. tanda lainnya yang dapat dilihat dari ikan nila adalah warna tubuhnya hitam dan agak keputihan. Bagian bawah tutup insang berwarna putih, sedangkan pada nila lokal, putih agak kehitaman bahkan ada yang kuning. Sisik ikan nila besar, kasar dan tersusun rapi. Sepertiga sisik belakang menutupi sisi bagian depan. Tubuhnya memiliki garis linea lateris yang terputus antara bagian atas dan bawahnya. Line lateralis bagian atas memanjang mulai dari tutup insang hingga belakang sirip punggung sampai pangkal sirip ekor. Ukuran kepalanya relative kecil dengan mulut berada di ujung kepala serta mempunyai mata yang besar (Asnawi, 1986).
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode eksperimental dengan tahapan penelitian meliputi penyiapan sampel, pembuatan ekstrak etanol daun legundi (EEDL), penyiapan hewan percobaan, pengamatan gejala toksik ikan, pengamatan kematian ikan dan pengukuran LC50. Data dianalisis dengan uji One Sample T-test
untuk melihat perbedaan nyata antar nilai LC50. Analisis statistik ini
menggunakan program SPSS (Statistical Product and Service Solution) versi 17.0 dengan taraf kepercayaan 95%. Penelitian ini dilaksanakan di Laboratorium Farmakologi Fakultas Farmasi, Universitas Sumatera Utara.
3.1 Alat dan Bahan
3.1.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah akuarium ukuran 40cm x 20 cm x 30 cm sebanyak 5 buah, aerator sebanyak 5 buah, selang, gayung plastik, spuit, gelas ukur 500 ml sebanyak 1 buah, gelas ukur 250 ml sebanyak 1 buah, gelas ukur 10 ml sebanyak 1 buah, jirigen 5 liter sebanyak 3 buah dan neraca digital (Vibra).
3.1.2 Bahan
2.7 Hewan Percobaan
Hewan percobaan yang akan digunakan adalah 220 ekor ikan nila mempunyai ukuran panjang tubuh 5,48 ± 0,04 cm. Sebelum pengujian, hewan percobaan diaklimasi terlebih dahulu selama 7-14 hari dengan tujuan menyeragamkan makanan dan hidupnya dengan kondisi yang sama serta menghilangkan stres akibat transportasi sehingga dianggap memenuhi syarat untuk penelitian.
Dua minggu sebelum pengujian dilakukan, hewan percobaan harus dipelihara dan dirawat dengan sebaik-baiknya pada akuarium yang mempunyai ventilasi baik dan selalu dijaga kebersihannya. hewan yang sehat ditandai dengan gerakan yang lincah (Ditjen POM, 1979).
3.3 Pengumpulan dan Pengolahan Bahan Tumbuhan
3.3.1 Pengambilan dan Pengolahan Sampel
Pengambilan dan pengolahan sampel telah dilakukan oleh Frans Apandi (2014) dalam penelitian uji aktivitas antihipertensi ekstrak etanol daun legundi (Vitex trifolia L.) pada tikus hipertensi yang diinduksi dengan epinefrin. Pada penelitian ini digunakan tumbuhan yang sama sehingga pengambilan dan pengolahan sampel tidak dilakukan kembali.
3.3.2 Pembuatan Ekstrak Etanol Daun Legundi (EEDL)
epinefrin. Pada penelitian ini digunakan tumbuhan yang sama sehingga pembuatan ekstrak tidak dilakukan kembali. Cara pembuatan: Sebanyak 500 g serbuk daun legundi dan 3 L etanol. Dimasukkan ke dalam bejana tertutup selama 3 jam. Pindahkan massa sedikit demi sedikit ke dalam perkolator sambil tiap kali ditekan hati-hati, tuangi dengan etanol secukupnya sampai cairan mulai menetes dan diatas simplisia masih terdapat selapis cairan etanol, tutup perkolator, biarkan selama 24 jam. Biarkan cairan menetes dengan kecepatan 1 ml per menit, tambahkan berulang-ulang etanol secukupnya sehingga selalu terdapat selapis cairan etanol diatas simplisia, hingga diperoleh 80 bagian perkolat. Peras massa, campurkan cairan perasan ke dalam perkolat, tambahkan etanol secukupnya hingga diperoleh 100 bagian. Pindahkan ke dalam bejana, tutup, biarkan selama 2 hari ditempat sejuk, terlindung cahaya, kemudian disaring (Ditjen POM, 1979). Seluruh perkolat digabung dan dipekatkan dengan bantuan alat rotary evaporator sampai diperoleh ekstrak kental.
3.4Tahap Pengujian
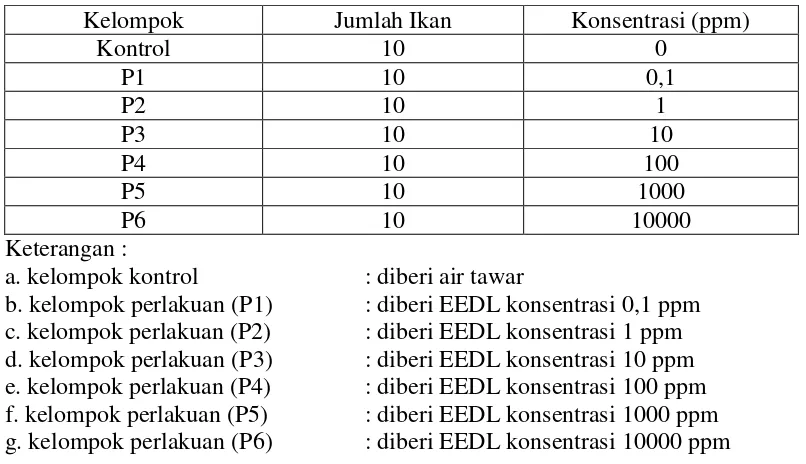
3.4.1 Uji Pendahuluan
Percobaan pada tahap pendahuluan ini bertujuan untuk mencari kisaran konsentrasi krisis bahan uji yang akan digunakan untuk uji toksistias LC50. Hewan
waktu pengamatan segera dikeluarkan dari media uji untuk menghindari kemungkinan perubahan kualitas air yang bukan disebabkan oleh bahan uji. Hewan uji diamati tiap konsentrasi dan dihitung secara kumulatif dalam tiap hari. Amati pula tingkah laku hewan uji dalam wadah yang diberi perlakuan (Rumampuk dkk., 2010).
Tabel 3.1 Konsentrasi Uji Pendahuluan.
Kelompok Jumlah Ikan Konsentrasi (ppm)
Kontrol 10 0
b. kelompok perlakuan (P1) : diberi EEDL konsentrasi 0,1 ppm c. kelompok perlakuan (P2) : diberi EEDL konsentrasi 1 ppm d. kelompok perlakuan (P3) : diberi EEDL konsentrasi 10 ppm e. kelompok perlakuan (P4) : diberi EEDL konsentrasi 100 ppm f. kelompok perlakuan (P5) : diberi EEDL konsentrasi 1000 ppm g. kelompok perlakuan (P6) : diberi EEDL konsentrasi 10000 ppm
Setelah diberikan bahan uji kemudian diamati gejala toksik dan dilihat jumlah kematian hewan. Kemudian ditentukan konsentrasi yang akan digunakan sebagai acuan untuk melakukan uji LC50.
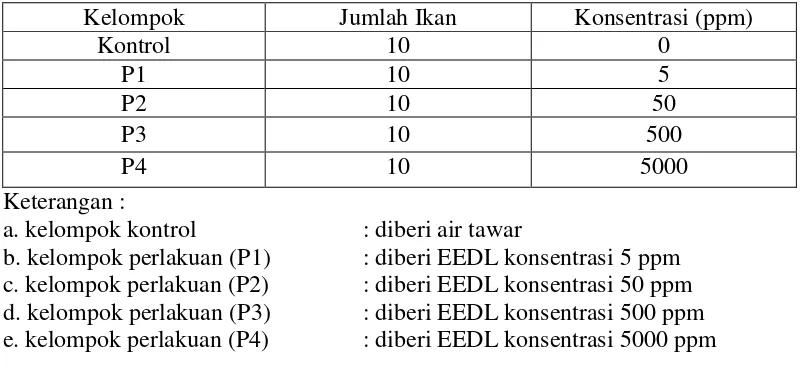
3.4.2 Uji LC50
Hewan uji sebanyak 10 ekor dimasukkan ke dalam setiap wadah percobaan (5 wadah uji) yang berisi 10 L air tawar dan bahan uji dengan konsentrasi yang telah ditentukan, setiap perlakuan dilakukan tiga kali pengulangan. Pengamatan dilakukan pada hari ke-1, 2, 3, 4, 5, 6 dan hewan yang mati dicatat. Hewan uji diamati pada tiap konsentrasi dan dihitung secara kumulatif.
Tabel 3.2 Konsentrasi Uji LC50.
Kelompok Jumlah Ikan Konsentrasi (ppm)
Kontrol 10 0
b. kelompok perlakuan (P1) : diberi EEDL konsentrasi 5 ppm c. kelompok perlakuan (P2) : diberi EEDL konsentrasi 50 ppm d. kelompok perlakuan (P3) : diberi EEDL konsentrasi 500 ppm e. kelompok perlakuan (P4) : diberi EEDL konsentrasi 5000 ppm
3.4.3 Pengamatan
Pengamatan terhadap hewan uji dilakukan selama 6 hari dengan pengulangan sebanyak 3 kali. Pengamatan yang dilakukan adalah gejala toksik dan kematian hewan uji.
3.4.3.1 Gejala Toksik
melihat hilang serta hilangnya kesadaran, kehilangan keseimbangan secara total ditandai dengan gerakan ikan yang tiba-tiba berposisi diagonal dengan kepala langsung mengarah ke permukaan, fase kematian dimana ikan mati karena kelumpuhan organ pernafasan dan tahap terakhir adalah rigor mortis yang ditandai dengan pengerasan seluruh tubuh dan sirip (Metelev, dkk., 1983).
3.4.3.2 Kematian Hewan
Ikan nila diamati kematiannya dari hari pertama sampai hari terakhir. Pengamatan kematian hewan dianalisis statistik dengan uji One Sample T-Test pada program Statistic Product and Service Solutions (SPSS) versi 17.0.
3.4.3.3 Analisis Data
BAB IV
HASIL DAN PEMBAHASAN
4.1 Bahan Baku Ekstrak
Pada penelitiaan ini digunakan ekstrak etanol daun legundi yang sama dengan ekstrak yang digunakan Frans Apandi (2014) pada penelitian yang berjudul uji aktivitas antihipertensi ekstrak etanol daun legundi (Vitex trifolia L.) pada tikus hipertensi yang diinduksi dengan epinefrin. Oleh karena itu, identifikasi, skrining fitokimia sampel dan karakterisasi tidak dilakukan lagi. Hasil identifikasi tumbuhan yang dilakukan di Pusat Penelitian dan Pengembangan LIPI Bogor, menunjukkan bahwa tumbuhan yang diteliti adalah Vitex trifolia L., famili Lamiacea (Apandi, 2014).
Ekstrak etanol daun legundi (EEDL) disimpan di dalam lemari pendingin dalam wadah tertutup rapat sehingga EEDL terhindar dari kontaminasi zat-zat asing. Penyimpanan di dalam lemari pendingin bertujuan untuk mencegah tumbuhnya jamur. EEDL yang digunakan berwarna hijau kelabu, bau aromatik khas, rasa pahit (Apandi, 2014). Hasil karakterisasi dan skrining fitokimia simplisia daun legundi, dapat dilihat pada lampiran 1 halaman 32.
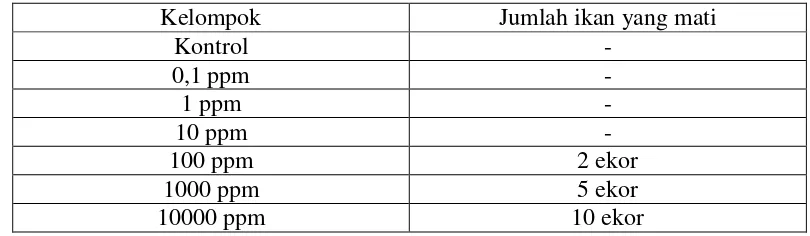
4.2 Hasil Uji Pendahuluan
Tabel 4.1 Hasil Uji Pendahuluan Pemberian Ekstrak Etanol Daun Legundi
pada Ikan Nila.
Kelompok Jumlah ikan yang mati
Kontrol -
0,1 ppm -
1 ppm -
10 ppm -
100 ppm 2 ekor
1000 ppm 5 ekor
10000 ppm 10 ekor
Pada uji pendahuluan yang dilakukan selama 6 hari terlihat bahwa adanya kematian pada ikan nila pada kelompok konsentrasi 100 ppm sebanyak 2 ekor, 1000 ppm mengalami kematian ikan nila sebanyak 5 ekor dan 10000 ppm mengalami kematian ikan nila sebanyak 10 ekor.
4.3 Hasil Uji LC50
Hasil pengujian LC50 ini menunjukkan bahwa jumlah kematian ikan nila
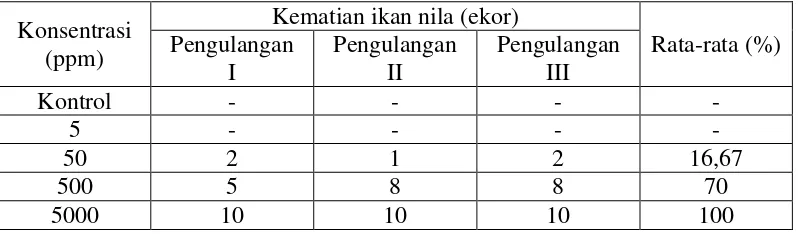
Tabel 4.2 Hasil Uji LC50 Terhadap Kematian Ikan Nila.
Dari tabel 4.2 dapat dilihat bahwa pada konsentrasi 0 ppm dan 5 ppm tidak terjadi kematian ikan nila. Pada konsentrasi 50 ppm terjadi kematian ikan nila sebesar 16,67 % dan konsentrasi 500 ppm terjadi kematian ikan nila sebesar 70 % sedangkan pada kosentrasi 5000 ppm terjadi kematian ikan nila sebesar 100 %. Kematian ikan nila meningkat seiring dengan peningkatan konsentrasi ekstrak etanol daun legundi (EEDL).
4.4 Hasil Pengamatan Gejala Toksik
Hasil pengamatan gejala toksik dapat dilihat pada tabel dibawah ini:
Tabel 4.3 Hasil Pengamatan Gejala Toksik pada Ikan Nila.
Konsentrasi Gejala Toksik
2 = Cenderung berada di dasar
3 = Penurunan respon terhadap sentuhan 4 = Hilangnya kesadaran
5 = Rigor mortis (Pengerasan seluruh tubuh dan sirip)
Ikan dapat menunjukkan reaksi terhadap perubahan fisik air maupun terhadap adanya senyawa pencemar yang terlarut dalam batas konsentrasi tertentu. Terlihat pada tabel 4.3 pemberian EEDL pada kelompok ikan nila konsentrasi dari 0 ppm (kontrol) dan 5 ppm tidak ditemukan gejala apapun sedangkan konsentrasi 50 ppm; 500 ppm dan 5000 ppm ditemukan gejala toksik yang berbeda antar perlakuan. Gejala toksik akan sangat membantu mendiagnosa adanya kelainan pada ikan. Konsentrasi 50 ppm hanya terlihat menunjukkan gejala cenderung berada di dasar dan penurunan respon terhadap sentuhan. Konsentrasi 500 ppm menunjukkan ikan tidak mau makan, cenderung berada di dasar, penurunan respon terhadap sentuhan dan hilangnya kesadaran. Konsentrasi 5000 ppm juga menunjukkan ikan tidak mau makan, cenderung berada di dasar, penurunan respon terhadap sentuhan, hilangnya kesadaran dan rigor mortis. Hal ini dapat disimpulkan bahwa sifat dan intensitas gejala keracunan akan sangat bergantung pada jenis racun, jumlah racun yang masuk ke dalam tubuh, lamanya tubuh mengalami keracunan dan keadaan tubuh organisme yang keracunan (Koesman, 1983).
4.5 Hasil Penentuan Nilai LC50 Terhadap Kematian Ikan Nila
Toksisitas bahan uji dapat ditentukan dengan menganalisa besarnya (dalam persen) kematian organisme uji (Boyd, 1990). Pada penelitian ini menggunakan lima konsentrasi yaitu 5 ppm, 50 ppm, 500 ppm dan 5000 ppm serta 0 ppm sebagai kontrol. Berikut hasil data LC50 dari kematian ikan nila yang
Tabel 4.4 Nilai LC50 Ekstrak Etanol Daun Legundi pada Ikan Nila.
Waktu Nilai LC50
Pengulangan I 316,22 ppm
Pengulangan II 199,52 ppm
Pengulangan III 158,49 ppm
Rata-rata 224,74 ppm
Nilai LC50 rata-rata adalah 224,74 ppm, menunjukkan bahwa ekstrak
etanol daun legundi yang diteliti memiliki kadar toksik yang secara praktis tidak toksik, karena berada dalam kisaran LC50: > 100 ppm (Kamrin, 1997).
Menurut Kamrin (1997), nilai LC50 ikan terbagi dalam beberapa kategori
yang dapat dilihat pada tabel dibawah ini:
Tabel 4.5 Kategori Nilai LC50 Ikan.
Kategori Toksisitas Nilai LC50 (mg/L)
Sangat Sangat Toksik < 0,1
Sangat Toksik 0,1-1
Cukup Toksik > 1-10
Sedikit Toksik 10-100
Praktis Tidak Toksik > 100
4.6 Hasil Analisa Data
Data analisa statistik menggunakan program SPSS (Statistical Product and Service Solution) versi 17.0 dengan taraf kepercayaan 95% dengan uji One Sample T-Test dapat dilihat pada Tabel 3.6.
Tabel 4.6 Hasil Data Analisa Statistik dengan Uji One Sample T-Test.
One-Sample Statistics
N Mean Std. Deviation Std. Error Mean
One-Sample Test
Test Value = 0
T Df Sig. (2-tailed) Difference Mean
95% Confidence Interval of the
Difference
Lower Upper
LC50EEDL 4,757 2 ,041 224,74333 21,4557 428,0310
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian uji lethal concentration (LC50) ekstrak etanol daun
legundi (Vitex trifolia L.) pada ikan nila (Oreochromis niloticus) yang telah dilaksanakan, maka kesimpulan dari penelitian ini adalah:
a. ekstrak etanol daun legundi (EEDL) pada konsentrasi kontrol (0 ppm) dan 5 ppm tidak terpengaruh terhadap gejala toksisitas pada ikan nila, sedangkan pada konsentrasi 50 ppm; 500 ppm dan 5000 ppm terlihat berpengaruh terhadap gejala toksik ikan nila, seperti tidak mau makan, cenderung berada di dasar, penurunan respon terhadap sentuhan, hilangnya kesadaran dan rigor mortis.
b. persentase kematian ikan nila pada konsentrasi 50 ppm sebesar 16,67 % dan pada konsentrasi 500 ppm sebesar 70 % sedangkan pada konsentrasi 5000 ppm mengakibatkan kematian 100 % pada ikan nila.
c. nilai LC50 ekstrak etanol daun legundi adalah 224,74 ppm yang berarti
praktis tidak toksik (LC50: > 100 ppm).
5.2 Saran
Rudiyanti, S., dan Ekasari, A.D. (2009). Pertumbuhan Dan Survival Rate Ikan Mas (Cyprinus carpio Linn) Pada Berbagai Konsentrasi Pestisida Regent 0,3 G. Jurnal Saintek Perikanan. (5)1: 40.
Rumampuk, D.N., Tilaar, S., Wullur S. (2010). Median Lethal Concentration (LC-50) Insektisida Diklorometan Pada Nener Bandeng (Chanos-chanos forks). Manado: Fakultas Perikanan dan Ilmu Kelautan. Universitas Sam Ratulangi. Jurnal Perikanan dan Kelautan. 6(2): 88.
Saanin, H. (1984). Taksonomi dan Kunci Identifikasi Ikan. Buku 2. Bandung: Penerbit Binacipta. Hal. 39.
Saragih, I.F.C. (2012). Isolasi Senyawa Flavonoid dari Daun Tumbuhan Lagundi (Vitex trifolia L.). Skripsi. Medan. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Sumatera Utara.
Setyawaty, D. (2002). Studi Pengaruh Ekstrak Daun Sirih (Piper betle Linn) dalam Pelarut Aquades, Etanol, dan Metanol Terhadap Perkembangan Larva Nyamuk Culex quinquefasciatus. Skripsi. Bogor: Institut Pertanian Bogor.
Soemirat, J. (2005). Toksikologi Lingkungan. Yogyakarta: Gadjah Mada University Press.
Thompson, R.C.M. (1971). Pesticides and Freshwater Fauna. Academic Press, London and New York.
Untung, K. (1993). Pengantar Pengelolaan Hama Terpadu. Yogyakarta: Gadjah Mada University Press. Hal. 23.
Wudianto, R. (1994). Petunjuk Penggunaan Pestisida. Jakarta: Penebar Swadaya. Wulandari, W., Sukiya., dan Suhandoyo. (2013). Efek Insektisida Decis terhadap
Lampiran 1. Hasil karakterisasi dan skrining fitokimia simplisia dan ekstrak daun
legundi
Menurut Apandi (2014), hasil karakterisasi dan skrining fitokimia simplisia dan ekstrak daun legundi adalah sebagai berikut:
Tabel Hasil Karakterisasi Simplisia dan Ekstrak Daun Legundi
No. Parameter Hasil (%) Persyaratan
MMI (%)
Kadar abu tidak larut dalam asam
5,92
Tabel Hasil Pemeriksaan Skrining Fitokimia Serbuk Simplisia dan Ekstrak Daun Legundi
No. Golongan Senyawa Hasil
Lampiran 2. Tumbuhan legundi (Vitex trifolia L.)
Sumber: Saragih (2012)
Lampiran 3. Simplisia daun legundi
Lampiran 4. Perhitungan Konversi Ekstrak ke Berat Basah Daun
Berat basah = 1500 g
Berat serbuk kering = 575,2 g Simplisia yang di ekstraksi = 500 g Hasil ekstraksi = 155,7 g
Rendemen = 31,14 %
575,2/500 x 155,7 gram = 179,11 g 1500 gram berat basah 179,11 g
Ekstrak yang digunakan untuk penelitian 10 gram dalam 1 liter akuades 10/179,11 x 1500 gram = 83,74 g
Jadi 10 gram ekstrak dalam 1 liter air yang digunakan setara dengan 83,74 gram berat basah daun. Penelitian sebelumnya menunjukkan konsentrasi efektif daun legundi yang digunakan sebagai insektisida sebesar 15 % (Iskandar, dkk., 2010).
X = 15 g x 83,74 g = 1256,1 g = 1,2561 kg
Kesetaraan penggunaan 15 gram dalam 1,2561 kg daun basah: 15 g/1256,1 g = 0,0119 g daun basah
Hasil ekstraksi: 0,0119 g x 31,14% = 0,0037 g/100 mL = 37 ppm
Penggunaan dari 15 g/100 mL daun basah setara dengan 37 ppm. Nilai LC50 yang didapat pada penelitian ini 224,74 ppm. Jadi, penggunaan daun legundi
Lampiran 6. Bagan Alur Penelitian
Diamati selama 6 hari dengan 3 kali pengulangan
Lampiran 7. Perhitungan Pembuatan Ekstrak Daun Legundi Sampel yang digunakan 10 g ekstrak dalam 1 L akuades
= = = 10.000 ppm
a.Konsentrasi 0 ppm
x 10.000 mL = 0 mL b.Konsentrasi 5 ppm
x 10.000 mL = 5 mL c.Konsentrasi 50 ppm
x 10.000 mL = 50 mL
d.Konsentrasi 500 ppm
x
10.000 mL = 500 mLe.Konsentrasi 5000 ppm
Lampiran 8. Hasil Pengamatan Sesudah Pemberian Ekstrak Etanol Daun Legundi
Uji Pendahuluan