LAPORAN PRAKTEK KERJA PROFESI
FARMASI INDUSTRI
di
PT. UNIVERSAL PHARMACEUTICAL INDUSTRIES
MEDAN
Disusun Oleh :
Maria Lalo Yudianto, S. Farm. 093202044
PROGRAM PENDIDIKAN PROFESI APOTEKER
FAKULTAS FARMASI
KATA PENGANTAR
Puji syukur ke hadirat Tuhan Yang Maha Esa atas rahmat dan karunia-Nya
sehingga penulis dapat menyelesaikan Praktek Kerja Profesi di PT. Universal Pharmaceutical Industries Medan.
Praktek Kerja Profesi ini merupakan salah satu syarat yang diwajibkan
bagi mahasiswa tingkat apoteker di Fakultas Farmasi USU Medan dalam
menyelesaikan studinya. Laporan Praktek Kerja Profesi ini disusun berdasarkan
materi yang disampaikan oleh pihak PT. Universal Pharmaceutical Industries
Medan dan tinjauan langsung ke bagian produksi dan pengawasan mutu.
Pada kesempatan ini penulis mengucapkan terima kasih yang
sebesar-besarnya kepada:
1. Bapak pimpinan PT. Universal Pharmaceutical Industries Medan yang
telah berkenan memberikan izin untuk pelaksanaan Praktek Kerja Profesi.
2. Ibu Dra. Ganda Simorangkir, Apt. selaku Kepala Bagian Produksi PT.
Universal Pharmaceutical Industries Medan, yang telah memberikan
bimbingan dan pengarahan selama pelaksanaan Praktek Kerja Profesi.
3. Ibu Dra. Deak Santi Rea Simorangkir, Apt. selaku Kepala Bagian
Pengawasan Mutu PT. Universal Pharmaceutical Industries Medan.
4. Bapak Prof. Dr. Sumadio Hadisahputra, Apt. selaku Dekan Fakultas
Farmasi USU Medan.
5. Bapak Drs. Wiryanto, MS., Apt., selaku koordinator Program Pendidikan
Profesi Apoteker Fakultas Farmasi USU Medan yang telah memberikan
fasilitas dan sarana kepada penulis untuk melaksanakan Praktek Kerja
6. Seluruh staf dan karyawan PT. Universal Pharmaceutical Industries
Medan atas bantuan dan kerjasama yang diberikan selama Praktek Kerja
Profesi.
7. Staf pengajar dan Staf administrasi Fakultas Farmasi yang telah mendidik
penulis selama di perguruan tinggi dan membantu kemudahan
administrasi.
8. Orang tua dan teman-teman yang memberikan bantuan moral dan materil
selama pelaksanaan Praktek Kerja Profesi (PKP) berlangsung.
9. Serta pihak-pihak yang telah ikut membantu penulis namun tidak
tercantum namanya.
Penulis berharap semoga laporan ini dapat memberikan gambaran yang
benar dan jelas mengenai seluk beluk PT. Universal Pharmaceutical Industries
Medan. Namun penulis menyadari bahwa laporan ini masih jauh dari sempurna,
oleh karena itu penulis sangat mengharapkan kritik dan saran yang bersifat
membangun.
Penulis berharap semoga laporan pelaksanaan Praktek Kerja Profesi ini
dapat berguna bagi perkembangan pendidikan profesi Apoteker.
Medan, Mei 2010
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR GAMBAR ... vii
DAFTAR TABEL ... viii
DAFTAR LAMPIRAN ... ix
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
BAB II TINJAUAN PT. UNIVERSAL PHARMACEUTICAL INDUSTRIES ... 3
2.1 Sejarah ... 3
2.2 Visi dan Misi ... 3
2.3 Lokasi dan Sarana Produksi ... 4
2.4 Kebijakan Mutu ... 5
2.5 Cara Pembuatan Obat yang Baik ... 6
2.5.1. Personalia ... 7
2.5.1.1 Struktur Organisasi ... 7
2.5.1.2. Pelatihan ... 12
2.5.2. Bangunan ... 12
2.5.4. Sanitasi dan Higiene ... 14
2.5.5. Produksi ... 15
2.5.6. Pengawasan Mutu ... 25
2.5.6.1. Pemeriksaan dan Pengujian Bahan Awal ... 25
2.5.6.2. Pemeriksaan dan Pengujian Produk dalam Proses ... 28
2.5.6.3. Pemeriksaan dan Pengujian Obat Jadi ... 33
2.5.7 Inspeksi Diri dan Audit Mutu ... 34
2.5.8 Penanganan Keluhan Terhadap Produk Penarikan Kembali Produk dan Produk Kembalian ... 35
2.5.9. Dokumentasi ... 36
2.6. Kualifikasi dan Validasi ... 36
BAB III KEGIATAN DI INDUSTRI FARMASI ... 40
3.1 Keterlibatan Dalam Produksi ... 40
3.2 Tinjauan ke Bagian-bagian Lain ... 40
BAB IV PEMBAHASAN ... 45
BAB V KESIMPULAN DAN SARAN ... 48
5.1 Kesimpulan ... 48
5.2 Saran ... 48
DAFTAR PUSTAKA ... 49 ..
LAMPIRAN... 50
DAFTAR GAMBAR
Halaman
Gambar 2.1. Struktur Organisasi PT. Universal Pharmaceutical Industries.. 7
Gambar 2.2. Alur Karyawan Masuk ke Ruang Produksi ... 19
Gambar 2.3. Alur Proses Bahan Awal Sampai Dengan Obat Jadi ... 20
Gambar 2.4. Alur Proses Pengolahan Kapsul ... 21
Gambar 2.5. Alur Proses Pengolahan Cairan Obat Luar ... 22
Gambar 2.6. Alur Proses Pengolahan Sirup ... 23
DAFTAR TABEL
Halaman
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Prosedur Tetap Pelatihan Karyawan ... 50
Lampiran 2. Jadwal Pelatihan Karyawan ... 51
Lampiran 3. Program Pelatihan ... 52
Lampiran 4. Pelaksanaan Pelatihan ... 54
Lampiran 5. Persyaratan Standar Lingkungan Produksi ... 58
Lampiran 6. Prosedur Tetap Cara Pemakaian Alat ... 59
Lampiran 7. Prosedur Tetap Pembersihan Alat ... 60
Lampiran 8. Prosedur Tetap Program Pembersihan Ruangan ... 61
Lampiran 9. Prosedur Tetap Sanitasi Bangunan ... 62
Lampiran 10. Prosedur Tetap Penerapan Higiene Perorangan ... 63
Lampiran 11. Prosedur Tetap Penimbangan dan Penyerahan Bahan Baku ... 65
Lampiran 12. Kartu Persediaan Bahan Baku ... 66
Lampiran 13. Kartu Persediaan Obat Jadi ... 67
Lampiran 14. Rencana Induk Validasi ... 68
Lampiran 15. Etiket ... 69
BAB I PENDAHULUAN I.1 Latar Belakang
Kesehatan masyarakat merupakan salah satu modal pokok dalam rangka
pertumbuhan dan kehidupan bangsa. Untuk mewujudkan hal ini secara optimal,
diselenggarakanlah upaya kesehatan, dan untuk mendukungnya didirikan sarana
kesehatan yang salah satunya adalah industri farmasi.
Industri farmasi merupakan salah satu tempat dimana apoteker melakukan
pekerjaan kefarmasian terutama yang menyangkut pengadaan, pengendalian mutu
sediaan farmasi, penyimpanan, pendistribusian, dan pengembangan obat. Sasaran
utama industri farmasi adalah memproduksi obat jadi dengan mengutamakan
keamanan, keefektifan, kualitas, dan harga yang terjangkau oleh masyarakat.
Persaingan antar industri farmasi semakin meningkat dengan berlakunya
perdagangan bebas di tahun 2010, baik berasal dari industri farmasi yang sudah
lama berdiri, maupun dari industri farmasi yang baru berdiri. Industri-industri ini
senantiasa berusaha meningkatkan daya saingnya melalui pembaharuan, baik dari
segi manajemen, kebijakan, maupun teknologi produksinya agar dihasilkan
produk farmasi bermutu, berkhasiat, aman dan terjangkau.
PT. Universal Pharmaceutical Industries merupakan industri farmasi yang
telah memiliki sertifikat CPOB. Penerapan CPOB dalam seluruh proses dan
kegiatan di PT. Universal Pharmaceutical Industries ini terkait dengan adanya
kesadaran bahwa sebuah perusahaan farmasi memiliki tanggung jawab moral
Profesi apoteker merupakan profesi yang terlibat dalam menentukan maju
dan berkembangnya industri farmasi. Apoteker sebagai penanggung jawab
industri farmasi harus tahu dan mampu menerapkan kegiatan produksi dan
pengawasan mutu sesuai Cara Pembuatan Obat yang Baik dalam industri farmasi.
Oleh karena itu, para calon apoteker perlu mengenal dan memahami peran
apoteker di industri farmasi melalui Praktek Kerja Profesi.
Dengan terlaksananya Praktek Kerja Profesi ini, diharapkan kelak calon
apoteker dapat memperoleh gambaran mengenai bagaimana mengelola industri
farmasi dengan baik, dan mampu mengembangkan atau meningkatkan peranan
apoteker di industri farmasi.
I.2 Tujuan
Adapun tujuan Praktek Kerja Profesi di PT. Universal Pharmaceutical
Industries Medan adalah:
1. Melihat gambaran nyata peran Apoteker, penerapan CPOB dan mencari
bekal yang cukup untuk memasuki dunia kerja yang sesungguhnya
khususnya di industri farmasi.
2. Mengetahui dan memahami proses pengelolaan industri farmasi dan
keterkaitan dengan profesi lainnya.
3. Memotivasi dan membekali diri dengan pengetahuan dan keterampilan
BAB II
TINJAUAN UMUM INDUSTRI FARMASI 2.1. Sejarah
PT. Universal Pharmaceutical Industries didirikan pada tahun 1975 dan
mendapatkan sertifikat Cara Pembuatan Obat yang Baik pada tahun 1995. Saat ini
dalam pembinaan untuk mendapatkan current Good Manufacturing Practice
(cGMP).
Kegiatan PT. Universal Pharmaceutical Industries meliputi pengadaan,
penyediaan, penyaluran, dan pengembangan obat yang dibutuhkan oleh
masyarakat. Bentuk sediaan yang telah diproduksi sampai saat ini terdiri dari 5
jenis yaitu: sediaan tablet non antibiotika, cairan oral antibiotika non beta laktam,
cairan oral non antibiotika, cairan obat luar non antibiotika dan kapsul keras
antibiotika non beta laktam.
2.2 Visi dan Misi
A. Visi
PT. Universal Pharmaceutical Industries berkomitmen untuk selalu
memproduksi obat-obat yang memenuhi standar mutu dan akan selalu berusaha
untuk menjunjung tinggi komitmen tersebut.
B. Misi
Industri farmasi adalah industri yang menyadari bahwa kesalahan yang
kecil dalam pembuatan obat dapat menyebabkan hal yang membahayakan
terhadap konsumen. Oleh karena itu, semua aspek dalam pembuatan obat harus
terjaga kebenarannya dan pelaksanaannya baik proses pengolahan dan proses
2.3 Lokasi dan Sarana Produksi
PT. Universal Pharmaceutical Industries salah satu perusahaan swasta
nasional yang berlokasi di jalan K.L. Yos Sudarso No.347 BB Km 6,5 Tanjung
Mulia, Medan, Sumatera Utara.
Sumber arus listrik berasal dari Perusahaan Listrik Negara (PLN) dan
apabila arus terputus digunakan generator. Sumber air berasal dari air PDAM dan
sumur pompa. Bangunan penunjang lainnya terdiri dari kamar mandi dan pos
jaga.
Ruang produksi pada PT. Universal Pharmaceutical Industries meliputi
ruang produksi tablet, ruang produksi kapsul, ruang produksi sirup, ruang
produksi steril. Setiap tahapan dalam proses produksi misalnya penimbangan,
pencampuran, pengemasan dilakukan dalam ruangan yang terpisah.
Gudang bahan baku, gudang kemasan, ruangan produksi dan obat jadi
dibuat sedemikian rupa sehingga proses produksi berjalan efektif, waktu relatif
singkat dan kemungkinan terjadinya pencemaran silang dapat dihindari.
Keadaan ruangan produksi adalah sebagai berikut:
a. Lantai
Lantai ruangan produksi tablet, kapsul dan sirup terbuat dari semen yang
dilapisi epoksi sehingga lantai mempunyai permukaan yang rata, mudah
dibersihkan, tidak menahan partikel, tahan terhadap detergen dan desinfektan.
b. Dinding
Dinding ruangan terbuat dari tembok yang dilapisi dengan epoksi sehingga
terhadap detergen, desinfektan, tidak menahan partikel dan tidak menjadi tempat
bersarangnya binatang kecil.
c. Langit-langit
Langit-langit ruangan terbuat dari beton yang dilapisi epoksi sehingga
permukaan langit-langit menjadi licin dan rata, kedap air, mudah dibersihkan,
tahan terhadap detergen, tidak menahan partikel.
d. Pengaturan udara
Aliran udara yang digunakan dalam ruangan produksi tablet, kapsul dan
sirup telah melalui sistem AHU (Air Handling Unit). Tekanan udara diatur
sedemikian rupa sehingga tekanan udara pada koridor lebih tinggi daripada ruang
pengolahan.
2.4 Kebijakan Mutu
Industri farmasi adalah industri yang memiliki spesifikasi tersendiri
dimana konsumen tidak mempunyai kesempatan untuk melakukan pemilihan
terhadap produk, dalam hal ini obat-obatan yang akan digunakan sehingga
kesalahan kecil dalam pembuatan obat dapat menyebabkan hal yang
membahayakan konsumen. Pemerikasaan yang dilakukan terhadap obat yang
diproduksi adalah pemeriksaan terhadap contoh dari setiap bets produksi, bukan
terhadap semua hasil bets produksi.
Berdasarkan hal tersebut di atas maka semua aspek dalam pembuatan obat
harus benar-benar terjaga kebenaran dan pelaksanaanya baik dalam proses
pengolahan dan proses pengawasan mutu. Pencapaian mutu yang sesuai dengan
standar hanya dapat diperoleh dengan melaksanakan seluruh aspek dalam Cara
dengan yang ditetapkan oleh pemerintah, dengan satu tujuan untuk menghasilkan
produk obat-obatan yang memenuhi standar mutu secara menyeluruh dan
berkesinambungan.
Untuk dapat melaksanakan hal tersebut PT. Universal Pharmaceutical
Industries membuat suatu komitmen sebagai acuan untuk selalu memproduksi
obat-obatan yang memenuhi standar mutu dan akan selalu berusaha untuk
menjunjung tinggi komitmen tersebut.
2.5 Cara Pembuatan Obat yang Baik
Industri farmasi diwajibkan melaksanakan CPOB berdasarkan keputusan
Menteri Kesehatan RI No. 43/MenKes/SK/II/1988 tanggal 2 Pebruari 1988
ditetapkan Pedoman Cara Pembuatan Obat yang Baik dan keputusan DirJen
Pengawasan Obat dan Makanan DepKes RI No. 04510/A/SK/XII/1989 tentang
Petunjuk Operasional Penerapan Cara Pembuatan Obat yang Baik.
Cara Pembuatan Obat yang Baik menyangkut seluruh aspek produksi dan
pengendalian mutu dan bertujuan:
a. Untuk menjamin bahwa produk obat senantiasa memenuhi persyaratan
mutu yang telah ditentukan sesuai dengan tujuan penggunaannya.
b. Sebagai pedoman yang jelas bagi semua pihak yang terlibat dalam
pembuatan obat.
c. Untuk menjamin konsistensi mutu obat dalam setiap pembuatannya.
Pelaksanaan CPOB di PT. Universal Pharmaceutical Industries meliputi
berbagai aspek, yaitu: personalia, bangunan, peralatan, sanitasi dan higiene,
produksi, pengawasan mutu, inspeksi diri, dokumentasi serta kualifikasi dan
2.5.1. Personalia
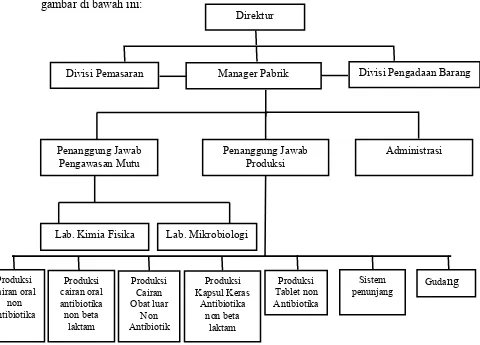
2.5.1.1. Struktur Organisasi
Struktur organisasi perusahaan hendaklah sedemikian rupa, sehingga
bagian produksi dan bagian pengawasan mutu dipimpin oleh orang yang berbeda
yang mempunyai tanggung jawab masing-masing.
Prinsip struktur organisasi PT. Universal Pharmaceutical Industries sudah
sesuai dengan syarat CPOB yaitu telah memisahkan bagian produksi dan
pengawasan mutu yang masing-masing penanggungjawabnya adalah seorang
apoteker dan tidak saling bertanggungjawab antara satu dengan yang lain.
Struktur organisasi di PT. Universal Pharmaceutical Industries ditunjukkan pada
gambar di bawah ini:
Divisi Pemasaran Manager Pabrik
Administrasi Penanggung Jawab
Produksi Penanggung Jawab
Pengawasan Mutu
Lab. Kimia Fisika Lab. Mikrobiologi
Produksi
Divisi Pengadaan Barang
Gudang
Sistem penunjang
Direktur
Jumlah karyawan di PT. Universal Pharmaceutical Industries ± 75 orang
yang terdiri dari: bagian pengolahan 15 orang, bagian pengawasan mutu 4 orang,
teknisi 2 orang, bagian gudang 6 orang, bagian pengemasan 40 orang, satpam 3
orang dan bagian administrasi 3 orang.
Penanggungjawab produksi dan pengawasan mutu bersama-sama
bertanggung jawab dalam menyusun dan mengesahkan prosedur-prosedur tertulis,
pemantauan dan pengawasan lingkungan pembuatan obat, kebersihan pabrik dan
validasi proses produksi, kalibrasi alat-alat pengukur, latihan personalia,
pemberian persetujuan terhadap pemasok bahan dan kontraktor, pengamanan
produk dan bahan terhadap kerusakan dan pemunduran mutu serta dalam
penyimpanan catatan-catatan.
Untuk menunjang tugas-tugasnya, penanggungjawab tiap-tiap bagian
menunjuk tenaga terampil dalam jumlah sesuai untuk melaksanakan supervisi
langsung di bagian produksi dan pengawasan mutu. Tiap supervisor
bertanggungjawab kepada penanggung jawab produksi dan pengawasan mutu.
Setiap bagian dalam struktur organisasi mempunyai tugas dan tanggungjawab
secara tertulis yang ditandatangani oleh masing-masing karyawan yang
bersangkutan sebagai pegangan dalam melaksanakan tugas-tugasnya. Berikut ini
contoh tugas dan tanggung jawab beberapa jabatan di PT. Universal
Pharmaceutical Industries:
a. Penanggung jawab produksi
Pengetahuan, keterampilan dan kemampuan
Penanggung jawab produksi harus seorang apoteker, mempunyai
mempunyai pengetahuan mengenai mesin-mesin produksi CPOB,
mempunyai keterampilan penguasaan bahasa Inggris yang baik.
Uraian tugas secara umum
Bertanggung jawab dalam memproduksi obat-obatan dengan kualitas yang
baik dan dibuat dengan memperhatikan pelaksanaan CPOB dalam batas
waktu dan biaya yang telah ditetapkan.
Ruang lingkup tugas dan tanggung jawab
- Bertanggung jawab atas terlaksananya pembuatan obat mulai dari
penimbangan bahan baku sampai pengiriman obat ke gudang obat
jadi.
- Memimpin dan mengarahkan secara teknis dan administrasi semua
pelaksanaan tugas di gudang, penimbangan, pengolahan dan
pengemasan.
- Bertanggung jawab untuk memeriksa catatan pengolahan bets dan
catatan pengemasan bets dan menjamin produksi dilaksanakan
sesuai dengan prosedur pengolahan induk dan prosedur
pengemasan induk.
- Jika ada kegagalan produksi mendiskusikannya dengan
penanggungjawab pengawasan mutu dan mencari sebab dan jalan
keluarnya.
- Bertanggung jawab agar alat-alat/mesin-mesin untuk keperluan
produksi dipakai dengan benar.
- Turut membantu pelaksanaan inspeksi CPOB dan menjaga
- Menyusun rencana poduksi.
- Menjaga kebersihan di daerah produksi.
- Bertanggung jawab atas latihan karyawannya dan
pengembangannya serta menjaga disiplin semua karyawan yang
dibawahinya.
- Membuat anggaran tahunan untuk bagian produksi
- Mengusahakan perbaikan biaya produksi
Hubungan kerja keluar
- Menjaga hubungan kerja dengan penanggung jawab pengawasan
mutu, manajer pabrik, dan kepala bagian teknik
- Berhubungan dengan pemerintah
b. Penanggung jawab Pengawasan Mutu
Pengetahuan, keterampilan dan kemampuan
Penangung jawab pengawasan mutu harus seorang apoteker mempunyai
pengalaman dan pengetahuan dalam bidang analisis kimia dan
mikrobiologi, pemeriksaan bahan pengemas dan CPOB, serta
keterampilan penguasaan bahasa Inggris yang baik.
Uraian Tugas secara Umum
Bertanggungjawab atas mutu yang dihasilkan oleh industri sesuai dengan
peraturan pemerintah.
Ruang lingkup tugas dan tanggung jawab
- Memimpin dalam melaksanakan tugas di laboratorium dalam
- Menetapkan mutu dari bahan awal, produk antara, produk ruahan,
dan obat jadi.
- Bertanggungjawab dan menjamin bahwa semua pemeriksaan
dilakukan dengan metode yang benar dan telah disetujui.
- Mengadakan penelitian untuk meningkatkan mutu obat dan
bekerjasama dengan bagian produksi.
- Bertanggungjawab atas pengadaan dan pembelian alat-alat serta
bahan pereaksi di laboratorium.
- Bertanggungjawab untuk pengembangan dan pelatihan karyawan,
menjaga disiplin dan melakukan evaluasi tahunan atas semua
karyawan yang dibawahinya.
- Bertanggungjawab agar alat-alat untuk analisis dipakai serta dijaga
dengan benar, dikalibrasi dan senantiasa tersedia suku cadangnya.
- Bertanggungjawab atas pelaksanaan inspeksi CPOB dan menjamin
pelaksanaan CPOB dengan benar.
- Membuat laporan bulanan.
- Bersama-sama dengan penangungjawab produksi melakukan
kualifikasi/validasi alat maupun proses.
- Memastikan bahwa semua prosedur analisa disimpan dengan baik
dan benar.
- Membuat anggaran tahunan bagian pengawasan mutu.
Hubungan kerja keluar
- Menjaga hubungan yang baik dengan direktur, manajer pabrik, dan
penanggung jawab produksi
- Berhubungan dengan pemerintah.
2.5.1.2. Pelatihan
Demi menunjang kelancaran seluruh proses yang ada di PT.Universal
Pharmaceutical Industries maka dilakukan serangkaian pelatihan kepada
karyawan mengenai tugas dan tanggungjawabnya masing-masing sesuai dengan
prinsip CPOB. Untuk itu apoteker di PT.Universal Pharmaceutical Industries
bertanggungjawab dalam menyusun materi pelatihan dan jadwal pelatihan.
Pelatihan dilakukan secara berkesinambungan dan frekuensi yang
memadai untuk menjamin agar karyawan terbiasa melakukan tugas dan
tanggungjawabnya sesuai CPOB. Contoh prosedur tetap pelatihan karyawan,
jadwal pelatihan karyawan, program pelatihan dan pelaksanaan pelatihan di
PT.Universal Pharmaceutical Industries ditunjukkan pada Lampiran 1,2,3, dan 4.
2.5.2 Bangunan
Bangunan PT. Universal PI telah dibangun sesuai dengan persyaratan yang
telah ditetapkan oleh CPOB. Gedung permanen berlantai tiga, dan standar
tiap-tiap ruangan dibuat sesuai dengan tingkat penggunaanya dan telah memenuhi
persyaratan. PT.Universal PI mempunyai tiga kelas ruangan/area, yaitu:
a. Black Area
Black Area merupakan ruangan, dimana pada ruangan ini seluruh produk
obat sudah dalam keadaan tertutup dalam kemasan primer, dan pada
konstruksi bangunan. Contoh area ini yaitu kantor, loker, gudang bahan
baku, gudang obat jadi, gudang bahan pengemas primer dan sekunder,
ruang pencucian botol, ruang administrasi gudang, ruang pengemasan
sekunder, dan laboratorium kimia fisika.
b. Grey Area
Grey Area merupakan area produksi dimana proses produksi berlangsung.
Pada area ini kebebasan telah dikurangi, yaitu barang atau karyawan tidak
bebas memasuki area ini. Dilakukan penanganan khusus terhadap udara,
rancang bangun dan konstruksi ruangan, seperti lantai dan langit-langit
tidak boleh bercelah dan tahan terhadap bahan kimia, dinding harus
terbuat dari beton dan dicat dengan cat yang tahan dicuci, serta pintu dan
peralatan lainnya tidak boleh terbuat dari kayu. Sebelum memasuki grey
area, karyawan harus terlebih dahulu mencuci tangan dan kaki serta
menggunakan pakaian khusus dan bersih. Contoh area ini yaitu ruang
penimbangan bahan baku, ruang pengolahan sirup, ruang pengemasan
primer sirup, ruang pengolahan tablet, ruang pencetakan tablet, ruang
pengemasan primer tablet, dan ruang In Process Control (IPC).
c. White Area
White Area merupakan area produksi untuk sediaan steril. Untuk
memasuki white area, karyawan harus mencuci tangan dan kaki serta
mengganti pakaian dari grey area dengan pakaian khusus yang steril.
Peralatan yang digunakan harus disterilkan terlebih dahulu, demikian juga
ruangan harus dibersihkan dengan desinfektan. Contoh area ini yaitu
Di setiap area yang berbeda dibuat ruangan antara yang tujuannya untuk
mencegah kontaminasi udara. Persyaratan standar lingkungan produksi
ditunjukkan pada Lampiran 5.
2.5.3 Peralatan
Peralatan yang digunakan dalam pembuatan obat harus memiliki rancang
bangun dan konstruksi yang tepat, ukuran yang memadai, ditempatkan dengan
tepat dan harus terkualifikasi sehingga mutu setiap obat terjamin secara seragam
untuk setiap bets. Hal ini berguna untuk mempermudah pembersihan dan
perawatannya.
Pada PT. Universal PI tiap peralatan diberi nomor kode untuk
mempermudah kegiatan pembersihan, penggunaan, perawatan serta
dokumentasinya. Prosedur tertulis untuk pembersihan peralatan dan wadah yang
digunakan dalam pembuatan diletakkan atau ditempel dekat dengan peralatan. Hal
ini dilakukan untuk mencegah terjadinya kesalahan kerja. Apoteker bertugas
membuat jadwal pembersihan dan perawatan alat serta mendokumentasikan
catatan tersebut. Contoh prosedur tetap pemakaian dan pembersihan alat
ditunjukkan pada Lampiran 6 dan 7.
2.5.4 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap
aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personalia,
bangunan, peralatan, bahan produksi serta wadahnya, dan setiap hal yang dapat
merupakan sumber pencemaran produk. Sumber pencemaran dihilangkan melalui
suatu program sanitasi dan higiene yang menyeluruh dan terpadu. Tujuan sanitasi
PT. Universal PI telah melakukan sanitasi ruangan, bangunan dan
peralatan, hal ini telah dilakukan dengan membuat prosedur pembersihan alat dan
ruangan. Contoh prosedur tetap pembersihan ruangan dan sanitasi bangunan
ditunjukkan pada Lampiran 8 dan 9.
Selain itu juga dilakukan pemeriksaan kesehatan pada seluruh karyawan.
Jadwal pemeriksaan kesehatan juga disusun dan didokumentasikan. Pemeriksaaan
kesehatan ini bertujuan untuk menjamin higiene perorangan yang secara langsung
menjamin mutu produk yang dihasilkan. Sebagai pedoman dalam pelaksanaan
higiene perorangan disusun suatu prosedur tetap penerapan higiene perorangan
yang ditunjukkan pada Lampiran 10.
2.5.5 Produksi
Proses produksi di PT. Universal PI meliputi pengolahan bahan awal
sampai terbentuknya obat jadi. Produksi harus dilaksanakan mengikuti prosedur
yang telah ditetapkan sehingga menjamin obat yang dihasilkan sesuai dengan
spesifikasi yang telah ditentukan.
Sebelum melaksanakan suatu produksi dilakukan perencanaan produksi
yang dilakukan sekali seminggu. Perencanaan produksi dibuat sesuai dengan
kebutuhan obat yang akan didistribusikan dari bagian pemasaran. Perencanaan
produksi bertujuan untuk menghindari kegagalan pelaksanaan produksi yang
terjadi karena sesuatu hambatan yang dapat diantisipasi sebelumnya, misalnya
jumlah bahan baku yang dibutuhkan, jumlah bahan pengemas, serta kesiapan
Sistem penomoran bets satu siklus produksi secara rinci diperlukan untuk
memastikan bahan produk antara, produk ruahan, dan produk jadi setiap bets
dapat mudah dikenali.
Dalam proses produksi setiap sediaan harus dilengkapi dengan:
a. Dokumen produksi induk, untuk disimpan sebagai pedoman, meliputi
spesifikasi, komposisi, penimbangan, penentuan hasil tiap-tiap tahap, dan
pengujian terhadap sediaan.
b. Prosedur tetap pengolahan induk, memuat semua hal meliputi spesifikasi,
komposisi, peralatan, dan cara pelaksanaan tahap demi tahap. Kemudian
prosedur tersebut diturunkan menjadi prosedur pengolahan bets dan bila
telah digunakan dalam proses pengolahan akan menjadi catatan
pengolahan bets. Catatan ini merupakan riwayat lengkap dari satu bets
sediaan.
Bahan baku yang digunakan dalam proses pengolahan diberikan oleh
gudang bahan baku. Penimbangan dilaksanakan sesuai dengan surat permintaan
dari bagian pengolahan yang disetujui oleh penanggung jawab produksi. Untuk
dapat melaksanakan proses penimbangan dengan benar dan sama secara
berkesinambungan dibuatlah suatu prosedur tetap penimbangan dan penyerahan
bahan baku yang ditunjukkan pada Lampiran 11.
Gudang PT.Universal PI terdiri dari bangunan parmanen yang terletak
dilantai satu, yang berfungsi untuk menyimpan bahan awal dan obat jadi. Semua
bahan harus disimpan dengan memakai alas secara benar dan teratur untuk
gudang dan juga untuk memudahkan prinsip-prinsip pemasukan dan pengeluaran
bahan dalam gudang. Pembagian gudang PT. Universal PI terdiri dari:
a. Gudang bahan baku
Gudang berada dalam satu atap dengan gudang bahan pengemas dan
gudang obat jadi. Tetapi diberi batas yang jelas antara satu bagian
dengan bagian yang lainnya. Untuk menyimpan bahan-bahan yang
berwadah kecil disimpan dalam rak lemari. Untuk bahan-bahan yang
dalam jumlah besar penyimpanannya satu sama lain harus terpisah
dengan jelas. Semua bahan baku yang masuk kedalam gudang dicatat
dalam kartu sediaan bahan baku. Untuk tata cara penerimaan dan
pengeluaran bahan baku disediakan suatu prosedur tetap tertulis
penerimaan, penyimpanan, dan penyerahan bahan awal. Contoh kartu
persediaan bahan baku ditunjukkan pada Lampiran 12.
b. Gudang bahan pengemas
Fungsi gudang ini adalah untuk menyimpan bahan-bahan pengemas
seperti etiket, kotak, dan brosur. Bahan–bahan pengemas tersebut
disimpan dengan menggunakan rak-rak berdasarkan jenis bahan.
Bahan-bahan pengemas seperti botol dan tutupnya, serta karton yang biasanya
dalam jumlah besar disimpan dalam ruangan yang terpisah. Setiap bahan
pengemas yang masuk ke gudang harus dicatat di kartu persediaan bahan
pengemas.
c. Gudang obat jadi
Fungsi gudang ini adalah untuk tempat menyimpan obat jadi yang telah
syarat-syarat yang ditentukan. Tiap-tiap jenis obat diberi batas yang jelas dan
diatur dengan baik sehingga memenuhi syarat penyimpanan First In
First Out (FIFO). Semua obat jadi yang masuk ke gudang dicatat pada
kartu persediaan obat jadi. Contoh kartu persediaan obat jadi
ditunjukkan pada Lampiran 13.
d. Gudang karantina
Fungsi gudang ini adalah untuk tempat penyimpanan bahan awal dan
Alur karyawan masuk ke ruang produksi ditunjukkan pada gambar di
bawah ini:
Pintu Masuk/Keluar
Koridor
Loker Pria Loker Wanita
Ruang Antara
Koridor
Bagian Produksi Cairan Obat
Luar
Bagian Produksi
Sirup
Bagian Produksi
Tablet
Bagian Produksi
Kapsul
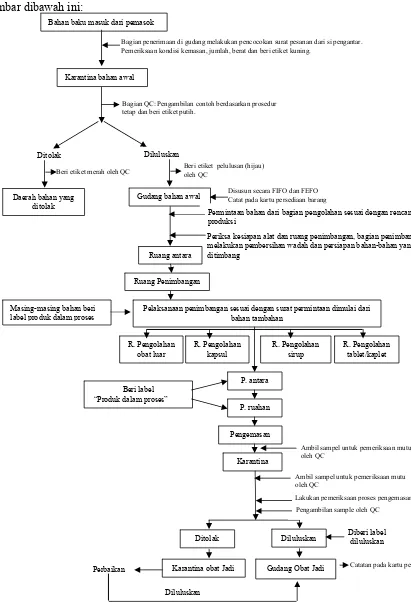
Alur proses bahan awal sampai dengan obat jadi ditunjukkan pada
gambar dibawah ini:
Karantina bahan awal
Bagian penerimaan di gudang melakukan pencocokan surat pesanan dari si pengantar. Pemeriksaan kondisi kemasan, jumlah, berat dan beri etiket kuning.
Bahan baku masuk dari pemasok
Ditolak Diluluskan
Beri etiket merah oleh QC
Daerah bahan yang ditolak
Beri etiket pelulusan (hijau) oleh QC
Gudang bahan awal Disusun secara FIFO dan FEFO Catat pada kartu persediaan barang
Permintaan bahan dari bagian pengolahan sesuai dengan rencana produksi
Ruang antara
Periksa kesiapan alat dan ruang penimbangan, bagian penimbangan melakukan pembersihan wadah dan persiapan bahan-bahan yang akan ditimbang
Bagian QC: Pengambilan contoh berdasarkan prosedur tetap dan beri etiket putih.
Ruang Penimbangan Masing-masing bahan beri
label produk dalam proses
Pelaksanaan penimbangan sesuai dengan surat permintaan dimulai dari bahan tambahan
Karantina obat Jadi
Diluluskan
Gudang Obat Jadi
Lakukan pemeriksaan proses pengemasan Pengambilan sample oleh QC
Diberi label diluluskan
Catatan pada kartu persediaan Ambil sampel untuk pemeriksaan mutu oleh QC
Karantina
Ambil sampel untuk pemeriksaan mutu oleh QC
Beri label “Produk dalam proses”
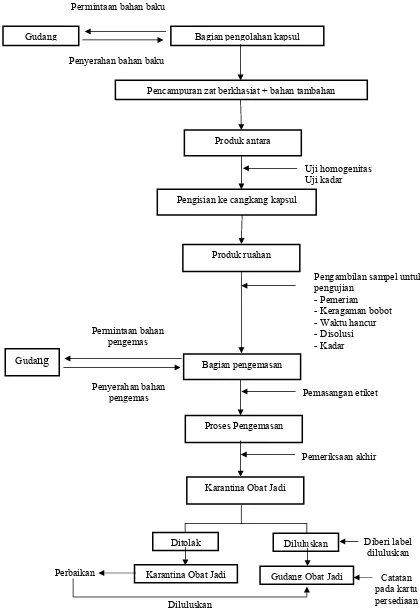
Alur proses pengolahan kapsul ditunjukkan pada gambar dibawah ini:
Penyerahan bahan baku
Uji homogenitas Uji kadar Pengisian ke cangkang kapsul
Pemeriksaan akhir Pemasangan etiket
Proses Pengemasan Penyerahan bahan
Pencampuran zat berkhasiat + bahan tambahan Permintaan bahan baku
Bagian pengolahan kapsul Gudang
Pengambilan sampel untuk pengujian
- Pemerian
- Keragaman bobot - Waktu hancur - Disolusi - Kadar Gudang
Karantina Obat Jadi
Ditolak Diluluskan
Karantina Obat Jadi Catatan
pada kartu persediaan Gudang Obat Jadi
Perbaikan
Diluluskan
Diberi label diluluskan
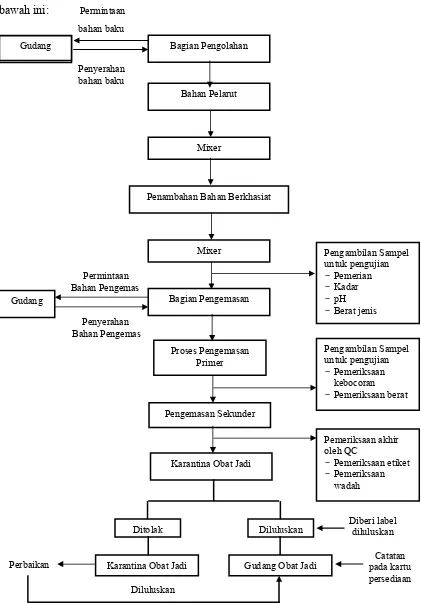
Alur proses pengolahan cairan obat luar ditunjukkan pada gambar di
Gudang Gudang
Bahan Pelarut
Mixer
Penambahan Bahan Berkhasiat
Mixer
Gudang Bagian Pengemasan
Proses Pengemasan Primer
Karantina Obat Jadi
Pemeriksaan akhir oleh QC
-Pemeriksaan etiket -Pemeriksaan
wadah
Ditolak Diluluskan
Karantina Obat Jadi Gudang Obat Jadi Diluluskan -Pemeriksaan berat Bagian Pengolahan
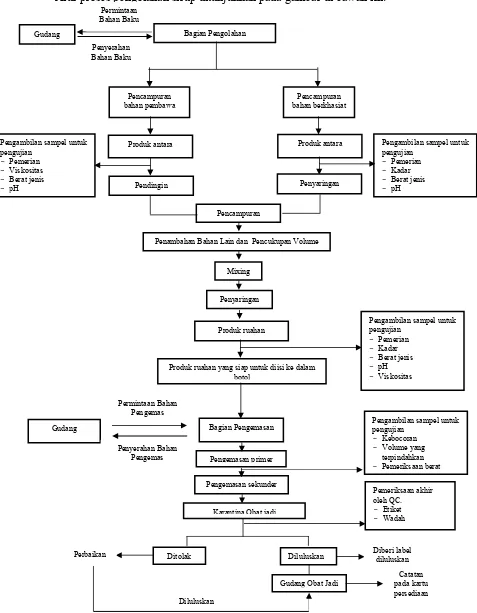
Alur proses pengolahan sirup ditunjukkan pada gambar di bawah ini:
Produk antara Produk antara
Pendingin Penyaringan
Produk ruahan
Produk ruahan yang siap untuk diisi ke dalam botol
Penambahan Bahan Lain dan Pencukupan Volume
Pengambilan sampel untuk pengujian
Gudang Obat Jadi
Catatan pada kartu persediaan Diberi label
diluluskan
Pengambilan sampel untuk pengujian
Pengambilan sampel untuk pengujian
- Pemerian
- Viskositas - Berat jenis
- pH
Pengambilan sampel untuk pengujian
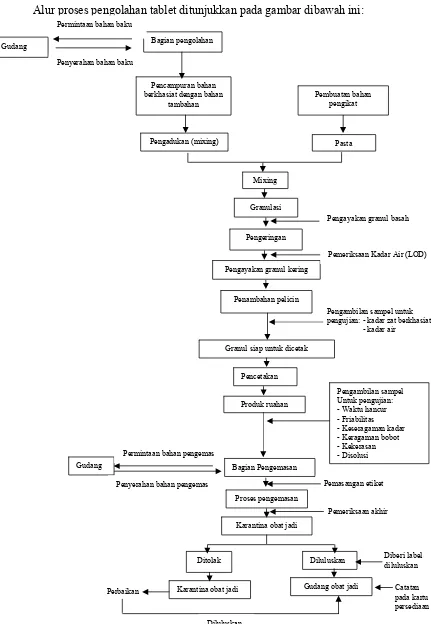
Alur proses pengolahan tablet ditunjukkan pada gambar dibawah ini:
Bagian pengolahan
Penyerahan bahan baku
Pengadukan (mixing) Pencampuran bahan berkhasiat dengan bahan
tambahan Permintaan bahan baku
Gudang
Pengayakan granul basah
Pengayakan granul kering
Pemeriksaan Kadar Air (LOD) Pengeringan
Penambahan pelicin
Pengambilan sampel untuk pengujian: - kadar zat berkhasiat - kadar air
Granul siap untuk dicetak
Pencetakan
Produk ruahan
Bagian Pengemasan
Karantina obat jadi Proses pengemasan
Pengambilan sampel Untuk pengujian: - Waktu hancur - Friabilitas - Keseragaman kadar - Keragaman bobot - Kekerasan - Disolusi
Pemasangan etiket
Pemeriksaan akhir Penyerahan bahan pengemas
Permintaan bahan pengemas Gudang
Diberi label diluluskan Diluluskan
Gudang obat jadi Karantina obat jadi
Diluluskan
2.5.6 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari Cara Pembuatan
Obat Yang Baik untuk memberikan kepastian bahwa produk secara konsisten
mempunyai mutu yang sesuai dengan tujuan pemakaiannya. Keterlibatan dan
komitmen semua pihak yang berkepentingan pada semua tahap merupakan
keharusan untuk mencapai sasaran mutu mulai dari awal pembuatan sampai
kepada distribusi produk jadi.
Pengawasan mutu obat harus dilaksanakan melalui sistem pengawasan
yang terencana dan terpadu. Pengawasan mutu hendaklah mencakup semua
kegiatan analitis yang dilakukan di laboratorium, pemeriksaan dan pengujian
bahan awal, produk antara, produk ruahan dan produk jadi, uji stabilitas, program
pemantauan lingkungan, validasi, penanganan sampel pertinggal, menyusun dan
memperbaharui spesifikasi bahan dan produk serta metode pengujiannya.
Sesuai dengan ketentuan dalam Pedoman Cara Pembuatan Obat yang
Baik, maka Departemen/Bagian Pengawasan Mutu memiliki kewenangan khusus
untuk memberikan keputusan akhir meluluskan atau menolak atas mutu bahan.
Pemeriksaan dilakukan terhadap bahan awal (bahan baku, bahan pengemas, dan
etiket) dan produk dalam proses (produk antara dan produk ruahan) serta obat
jadi.
2.5.6.1 Pemeriksaan dan Pengujian Bahan Awal.
Bahan awal berupa bahan baku, bahan pengemas dan etiket yang telah
diterima dari pemasok diberi label kuning, kemudian dikarantina. Bagian
pengawasan mutu mengambil contoh bahan awal yang akan diperiksa kemudian
pengawasan mutu dan sedang diperiksa. Contoh label kuning dan putih dapat
dilihat pada Lampiran 15.
Pemeriksaan untuk bahan awal meliputi:
a. Bahan Baku
Pemeriksaan bahan baku meliputi pemeriksaan organoleptis (bentuk,
warna, bau, rasa), pemeriksaan secara kimia (kuantitatif, pH), serta
pemeriksaan secara fisika (kelarutan, berat jenis, viskositas, titik lebur).
b. Kemasan
Pemeriksaan kemasan meliputi pemeriksaan ukuran (panjang, lebar,
diameter, dan tebal), berat atau keseragaman berat, serta kerusakan dan
kebocoran.
c. Etiket
Pemeriksaan etiket meliputi pemeriksaan ukuran (panjang, lebar, diameter
dan tebal), kebenaran tulisan, desain, warna, kerapian cetakan serta
tanda-tanda khusus misalnya obat bebas, obat bebas terbatas, obat keras dan
sebagainya.
a.1 Sampel bahan baku diambil dengan menggunakan alat thief sampler
untuk sampel padat dan dip tubes untuk sampel bahan cair dan setengah padat.
Pengambilan sampel bahan awal hendaklah mengikuti tiga pola berikut ini:
1. Pola n: hanya jika bahan yang diambil sampelnya diperkirakan homogen
dan diperoleh dari pemasok yang disetujui. Sampel dapat diambil dari bagian
manapun dari wadah (umunya lapisan atas).
Dimana n = 1 + √N n = jumlah wadah yang dibuka/diambil sampel
Catatan: Apabila N≤ 4, maka sampel diambil dari tiap wadah.
2. Pola p: jika bahan homogen, diterima dari pemasok yang disetujui dan
tujuan utama adalah untuk pengujian identitas.
Dimana p = 0,4 √N N = jumlah wadah yang diterima
p = jumlah wadah yang dibuka/diambil sampel
berdasarkan pembulatan di atas.
3. Pola r: jika bahan diperkirakan tidak homogen dan diterima dari pemasok
yang belum dikualifikasi. Pola ini dapat digunakan untuk produk herbal yang
digunakan sebagai bahan awal.
Dimana r = 1,5√N N = jumlah wadah yang diterima atau diambil
r = jumlah sampel yang diambil berdasarkan
pembulatan ke atas.
Pola pengambilan sampel yang digunakan oleh PT. Universal PI adalah pola n.
Bila bahan baku telah memenuhi syarat diberi label hijau pada wadahnya sebagai
tanda bahwa bahan baku tersebut dapat digunakan. Contoh label hijau dapat
dilihat pada Lampiran 15.
Bahan baku yang telah lulus pemeriksaan disimpan secara FIFO (First In
First Out) dan FEFO (First Expired First Out) di gudang bahan baku. Untuk
bahan baku yang tidak memenuhi syarat diberi label merah pada wadahnya
sebagai tanda bahwa bahan tersebut tidak boleh dipakai untuk diproduksi dan
akan dikembalikan kepada pemasok. Contoh label merah dapat dilihat pada
a.2 Pola pengambilan sampel bahan pengemas hendaklah memperhatikan
hal berikut: jumlah yang diterima, mutu yang dipersyaratkan, sifat bahan (bahan
pengemas primer dan/atau bahan pengemas cetak), metode produksi dan
pengetahuan tentang pelaksanaan sistem Pemastian Mutu dipabrik pembuat bahan
pengemas berdasarkan audit.
Pola pengambilan sampel.
Jumlah unit sampel yang diperiksa sesuai dengan jumlah yang ditetapkan dalam
pola pengambilan sampel. Apabila jumlah unit yang ditemukan cacat sama atau
kurang dari angka numerik pelulusan maka lots atau bets bersangkutan diluluskan.
Apabila jumlah unit yang ditemukan cacat sama atau lebih dari angka numerik
penolakan maka lot atau bets bersangkutan ditolak.
2.5.6.2 Pemeriksaan dan Pengujian Produk Dalam Proses.
Pemeriksaan produk dalam proses meliputi pemeriksaan terhadap proses
yaitu produk antara dan produk ruahan. Bagian pengawasan mutu akan
mengawasi bahan produk yang akan diperiksa. Pengawasan selama
berlangsungnya proses pengolahan ini bertujuan untuk mencegah terlanjur
diproduksinya obat yang tidak memenuhi spesifikasi. Pengawasan dilakukan
dengan cara mengambil contoh dan mengadakan pemeriksaan dan pengujian
terhadap produk yang dihasilkan pada langkah-langkah tertentu dari proses
pengolahan. Pemeriksaan yang dilakukan untuk sediaan selama proses
pengolahannya, meliputi:
1. Produk antara
Pemeriksaan granul kering untuk sediaan tablet menggunakan alat
dianalisis sudah kering, sistem akan berhenti dan hasilnya akan terlihat pada layar
monitor.
Pemeriksaan homogenitas granul dilakukan untuk sediaan kapsul
sedangkan pemeriksaan terhadap pemerian, viskositas, pH, berat jenis dan kadar
dilakukan untuk sediaan sirup.
2. Produk ruahan
Pemeriksaan yang dilakukan adalah pemeriksaan kadar zat berkhasiat,
waktu hancur, disolusi, keseragaman kandungan, keragaman bobot untuk sediaan
tablet dan kapsul serta pemeriksaan pemerian, viskositas, pH, berat jenis dan
kadar untuk sediaan sirup. Seluruh pemeriksaan yang dilakukan berdasarkan
masing-masing monografi sediaan sesuai Farmakope Indonesia edisi IV.
3. Pemeriksaan obat jadi
Pemeriksaan obat jadi meliputi pemerian (warna, bau, rasa, bentuk tablet),
diameter, bobot rata-rata, keseragaman sediaan, kekerasan, waktu hancur,
friabilitas dan ketebalan yang dilakukan pada saat pencetakan tablet. Setelah
seluruh tablet selesai dicetak dilakukan pemeriksaan kembali terhadap:
i. Pemerian
Dilakukan secara visual, meliputi warna, bau, rasa dan bentuk tablet.
ii. Keseragaman sediaan
Ditetapkan dengan salah satu dari dua metode, yaitu keragaman bobot atau
keseragaman kandungan. Metode keragaman bobot digunakan pada tablet yang
mengandung zat aktif sebesar 50 mg atau lebih, 50% atau lebih dari bobot
sediaan. Jika zat aktif pada tablet tersebut kurang maka digunakan metode
Cara kerja:
a. Keragaman bobot
Timbang dengan teliti 10 tablet, satu demi satu, dan dihitung bobot
rata-rata. Dari hasil penetapan kadar diperoleh seperti tertera pada masing-masing
monografi, hitung jumlah zat aktif masing-masing dari 10 tablet dengan anggapan
zat aktif terdistribusi homogen.
b. Keseragaman kandungan
Timbang dengan teliti 10 tablet, satu demi satu, seperti tertera pada
masing-masing monografi. Jika jumlah zat aktif dalam satuan dosis tunggal
kurang dari yang dibutuhkan dalam penetapan kadar, atur derajat pengenceran
dari larutan dan atau volume alikuot sehingga kadar zat aktif dalam larutan akhir
lebih kurang sama seperti yang tertera pada prosedur Penetapan Kadar; atau jika
penetapan kadar dilakukan secara titrasi, gunakan titran yang lebih encer, bila
perlu digunakan volume titran yang memadai seperti yang tertera pada titrimetri.
Kriteria:
Keseragaman sediaan dipenuhi jika jumlah kadar zat aktif pada masing-masing
dari 10 tablet terletak antara 85,0–115,0% dari yang tertera pada etiket dan
simpangan baku relatif ≤ 6,0%. Jika 1 tablet terletak di luar rentang 85,0–115,0%
dan tidak ada satupun yang terletak diantara rentang 75,0–125,0% dari yang
tertera pada etiket, atau jika simpangan baku relatif > 6,0% atau kedua kondisi
tidak terpenuhi dilakukan 20 tablet tambahan. Persyaratan dipenuhi jika tidak
lebih dari 1 tablet dari 30 tablet terletak direntang 85,0–115,0% yang tertera pada
etiket dan tidak ada 1 tablet pun yang terletak diluar rentang 75,0–125.0% dari
iii. Waktu hancur
Pemeriksaan menggunakan Desintegration tester.
Cara kerja:
Ke dalam masing-masing tabung dimasukkan 1 tablet, masukkan 1 cakram pada
tiap tabung dan jalankan alat. Gunakan air bersuhu 37°C ± 2°C sebagai media,
kecuali dinyatakan lain dalam masing-masing monografi. Jika semua tablet tidak
hancur secara merata, ulangi pengujian dengan 12 tablet lainnya. Pengujian
memenuhi syarat bila tidak kurang dari 16 tablet dari 18 tablet yang diuji harus
hancur semua.
iv. Disolusi
Pemeriksaan menggunakan Dissolution tester.
Cara kerja:
Masukkan sejumlah volume media disolusi seperti yang tertera pada
masing-masing monografi dalam satu wadah, pasang alat, biarkan media disolusi hingga
27°C ± 0,5°C dan angkat termometer. Masukkan 1 tablet ke dalam alat, hilangkan
gelembung udara dari permukaan sediaan yang diuji dan segera jalankan alat pada
kecepatan yang tertera pada masing-masing monografi. Dalam interval waktu
yang ditetapkan atau pada tiap waktu yang dinyatakan, ambil cuplikan pada
daerah pertengahan antara permukaan media disolusi dan bagian atas keranjang
berputar atau alat dayung, tidak kurang 1 cm dari dinding wadah. Lakukan
penetapan seperti yang tertera pada masing-masing monografi. Kecuali
dinyatakan lain dari masing-masing monografi persyaratan dipenuhi apabila
jumlah zat aktif yang terlarut dalam sediaan yang diuji sesuai dengan tabel
memenuhi S1 dan S2, harga Q adalah jumlah zat aktif yang terlarut seperti yang
tertera pada masing-masing monografi, dinyatakan dalam peresentase kadar pada
etiket, dengan demikian mempunyai arti yang sama dengan Q. Kriteria
penerimaan uji disolusi ditunjukkan pada tabel 2.1:
Tabel 2.1 Kriteria Penerimaan Uji Disolusi
Tahap Jumlah yang diuji Kriteria penerimaan
S1 6 Tiap unit sediaan tidak kurang
dari Q + 5%
S2 6 Rata-rata dari unit sediaan (S1 +
S2) adalah ≥Q dan tidak satu unit pun sediaan yang <Q-15%
S3 12 Rata-rata dari 24 unit (S1 + S2 + S3
) dan tidak ada 2 unit sediaan yang <Q-15%, serta tidak satu pun yang <Q-25%.
v. Kekerasan tablet
Alat yang digunakan adalah Strong Cobb, pengujian dilakukan terhadap 6 tablet.
Cara kerja:
Sebuah tablet diletakkan mendatar 2 sisi alat. Tekan tombol start (S), maka kedua
sisi akan menjepit tablet hingga tablet pecah. Pada alat akan tertera angka yang
menunjukkan kekerasan tablet. Tablet dinyatakan memenuhi syarat bila
mempunyai kekerasan 4-8 kg.
vi. Friabilitas
Alat yang digunakan Roche friabilitor.
Cara kerja:
Timbang 20 tablet, catat beratnya misal a gram. Masukkan ke dalam alat dan
20 tablet tadi dan bersihkan dari debu. Timbang kembali beratnya misalnya b
gram. Rumus untuk menghitung friabilitas:
Friabilitas = a – b x 100% = x%
a
Kehilangan berat tidak boleh lebih dari 0,8% (x < 0,8)
vii. Kadar zat berkhasiat
Pemeriksaan kadar zat berkhasiat dilakukan berdasarkan masing-masing
monografi sesuai Farmakope Indonesia edisi IV ataupun Farmakope lainnya.
viii. Diameter dan tebal tablet, diukur dengan menggunakan alat caliper.
2.5.6.3 Pemeriksaan Akhir Obat Jadi
Pemeriksaan yang dilakukan pengawasan mutu meliputi identifikasi dan
kontrol jumlah selama pengemasan. Setelah obat dikemas maka dilakukan
pemeriksaan yang meliputi kontrol, jumlah dan kebenaran isi, kerapian
pengemasan, dan kelengkapan lainnya. Apabila telah memenuhi syarat maka
bagian pengawasan menempel label finished pack analysis pada boks yang
ditanda tangani dan ditanggung jawabi oleh analis yang bersangkutan.
Pemeriksaan ini dilakukan untuk memastikan mutu produk yang dikemas telah
sesuai dengan pengemasannya. Bagian pengemasan obat jadi akan mengirimkan
produk yang sudah selesai dikemas ke gudang obat jadi.
Mutu produk obat jadi tidak hanya ditentukan oleh hasil akhirnya saja
tetapi dibangun dari keseluruhan tahap proses produksi. Oleh karena itu perlu
adanya pengawasan mutu mulai dari bahan baku dan bahan kemas, penimbangan,
pengolahan, pengemasan, dan penyimpanan obat jadi untuk menjamin mutu obat
yang dihasilkan sesuai dengan spesifikasi yang telah ditetapkan. Selain itu juga
sampai satu tahun setelah habis masa edarnya. Terhadap contoh pertinggal
senantiasa dilakukan pengujian secara berkala sampai masa simpannya habis.
2.5.7 Inspeksi Diri dan Audit Mutu
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek
produksi dan pengawasan mutu industri farmasi memenuhi ketentuan Cara
Pembuatan Obat yang Baik. Program inspeksi diri hendaklah dirancang untuk
mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan
perbaikan yang diperlukan. Inspeksi diri hendaklah dilakukan secara rutin, dan
disamping itu, pada situasi khusus, misalnya dalam hal penarikan kembali obat
jadi atau terjadi penolakan yang berulang.
Hendaklah dibuat daftar inspeksi diri yang menyajikan standar persyaratan
minimal dan seragam. Daftar ini hendaklah berisi pertanyaan mengenai CPOB
yang mencakup antara lain:
1. Personalia
2. Pemeliharaan Bangunan termasuk fasilitas personil dan peralatan
3. Penyimpanan bahan awal dan bahan jadi
4. Produksi
5. Sanitasi dan Higiene
6. Pengawasan mutu
7. Dokumentasi
8. Validasi dan kalibrasi alat
9. Prosedur penarikan kembali obat jadi dan penanganan keluhan
Manajemen hendaklah membentuk tim inspeksi diri yang paling sedikit
terdiri dari tiga anggota yang berpengalaman dalam bidangnya masing-masing
dan memahami CPOB. Anggota tim dapat dibentuk dari dalam atau luar
perusahaan. Tiap anggota hendaklah independen dalam melakukan inspeksi dan
evaluasi. Inspeksi diri yang menyeluruh hendaklah dilakukan minimal satu kali
dalam setahun. Frekuensi inspeksi diri hendaklah tertulis dalam prosedur tetap
inspeksi diri.
2.5.8 Penanganan Keluhan Terhadap Produk Penarikan Kembali Produk dan Produk Kembalian.
Keluhan dan laporan dapat menyangkut kualitas, efek samping yang
merugikan atau masalah medis lain. Semua laporan dan keluhan hendaklah
diselidiki dan dievaluasi serta diambil tindak lanjut yang sesuai.
Penarikan kembali obat jadi dapat berupa penarikan kembali satu atau
beberapa batch atau seluruh obat jadi tertentu dari semua mata rantai distribusi.
Penarikan kembali dilakukan apabila ditemukan adanya produk yang tidak
memenuhi persyaratan kualitas atau atas dasar pertimbangan adanya efek samping
yang tidak diperhitungkan yang merugikan kesehatan. Penarikan kembali seluruh
obat jadi tertentu dapat merupakan tindak lanjut penghentian pembuatan satu jenis
obat jadi yang bersangkutan. 2.5.9 Dokumentasi
Dokumentasi pembuatan obat merupakan bagian dari sistem informasi
yang meliputi spesifikasi, prosedur, metode dan instruksi, catatan dan laporan
serta jenis dokumentasi lain yang diperlukan dalam perencanaan pelaksanaan,
Sistem dokumentasi dilakukan untuk menggambarkan riwayat lengkap
dari setiap batch suatu produk sehingga memungkinkan penyelidikan serta
penelusuran kembali terhadap batch produk yang bersangkutan. Dokumen ini
disimpan sampai waktu 2 tahun setelah masa expired date dari produk yang
bersangkutan.
2.5.10 Kualifikasi dan Validasi
Validasi adalah tindakan pembuktian yang terdokumentasi dengan cara
yang sesuai bahwa tiap bahan, proses prosedur, kegiatan, sistem, perlengkapan
atau mekanisme yang digunakan dalam produksi dan pengawasan akan senantiasa
mencapai hasil yang diinginkan.
Validasi proses dapat dilakukan dengan beberapa cara, antara lain:
a. Validasi prospektif yang berdasarkan protokol validasi yang dilakukan
sebelum produk dipasarkan.
b. Validasi concurrent yang berdasarkan data yag diperoleh selama proses
terkini, dimana proses tersebut telah berjalan tetapi belum pernah
divalidasi.
c. Validasi retrospektif yang berdasarkan kajian dan analisis data historis.
d. Validasi ulang yang berdasarkan kajian data pengulangan validasi, antara
lain periodik dan perubahan yang signifikan dalam proses.
Tujuan pelaksanaan validasi adalah untuk pemastian mutu, penghematan
biaya dan untuk pengendalian mutu produk yang dihasilkan aman dan terjamin
mutunya oleh suatu tim validasi yang dapat bekerja sesuai tanggung jawabnya.
validasi yang menguraikan program kegiatan validasi di pabrik secara
keseluruhan berdasarkan cara pembuatan obat yang baik.
Tujuan pembuatan rencana induk validasi adalah:
1. Mengidentifikasi hal-hal yang akan di validasi
2. Menetapkan cara-cara pemeriksaan
3. Menguraikan dengan jelas prosedur dan protokol pemeriksaan
4. Menetapkan penanggung jawab pelaksanaan pemeriksaan
5. Membuat laporan pemeriksaan dan dokumentasi
Rencana induk validasi tersebut memuat:
a. Organisasi dari tim validasi
b. Ruang lingkup yang harus divalidasi, yaitu fasilitas/bangunan, sistem
penunjang yang kritis, peralatan (kualifikasi instalasi, kualifikasi
operasional, kualifikasi kinerja), kalibrasi instrument, kualifikasi operator,
metoda analisa, prosedur pengolahan, prosedur pengemasan dan prosedur
pembersihan.
c. Format dokumen: format protokol dan laporan validasi, perencanaan dan
jadwal pelaksanaan.
d. Pengendalian perubahan.
e. Acuan dokumen yang digunakan.
Contoh rencana induk validasi ditunjukkan pada Lampiran 14.
Validasi untuk mesin, peralatan produksi dan sarana penunjang disebut
kualifikasi. Kualifikasi tersebut adalah langkah pertama dalam melaksanakan
a. Kualifikasi Desain/ Design Qualification (DQ)
Kualifikasi desain adalah unsur pertama dalam melakukan validasi
terhadap fasilitas, sistem atau peralatan baru.
b. Kualifikasi Instalasi/ Instalation Qualification (IQ)
Kualifikasi hendaklah dilakukan terhadap fasilitas, sistem dan peralatan
baru atau yang dimodifikasi, mencakup:
• Instalasi peralatan, pipa dan sarana penunjang hendaklah sesuai dengan
spesifikasi dan gambar teknik yang didesain.
• Pengumpulan dan penyusunan dokumen pengoperasian dan perawatan
peralatan dari pemasok.
• Ketentuan dan persyaratan kalibrasi.
• Verifikasi bahan konstruksi
c. Kualifikasi Operasional/ Operational Qualification (OQ)
Kualifikasi operasional hendaklah dilakukan setelah kualifikasi instalasi
selesai dilaksanakan, dikaji dan disetujui. Kualifikasi operasional hendaklah
mencakup:
• Kalibrasi
• Prosedur pengoperasian dan pembersihan
d. Kualifikasi Kinerja/ Performance Qualification (PQ)
Kualifikasi kinerja hendaklah dilakukan setelah kualifikasi operasional
selesai dilaksanakan, dikaji dan disetujui. Kualifikasi kinerja hendaklah
mencakup:
• Pengujian dengan menggunakan bahan baku, bahan pengganti yang
memenuhi spesifikasi atau produk simulasi.
BAB III
KEGIATAN DI INDUSTRI FARMASI 3.1 Keterlibatan Dalam Produksi
Pelatihan Praktek Kerja Profesi Apoteker (PKPA) di PT. Universal
Pharmaceutical Industries, dilaksanakan selama 3 minggu dari tanggal 1-21 Mei
2010.
Kegiatan yang dilakukan berupa:
1. Tutorial yang diadakan oleh bidang Pengendalian Mutu dan Produksi.
2. Pelaksanaan tugas khusus pada salah satu bidang di PT. Universal
Pharmaceutical Industries.
3. Tinjauan ke lapangan.
3.2 Tinjauan ke Bagian-bagian Lain 3.2.1 Sistem AHU (Air Handling Unit)
Sistem AHU adalah suatu sistem pengendalian udara yang masuk dan
keluar ruang produksi. Sistem ini mengatur suhu, tekanan, kelembapan dan
kebersihan udara.
Sistem ini berfungsi untuk:
1. Mencegah kontaminasi dalam proses pembuatan obat.
2. Mencegah pencemaran lingkungan oleh produksi.
3. Mengatur kelembapan, suhu dan kelembapan relatif ruangan.
4. Suhu udara di ruangan produksi diatur dengan cara melewati udara yang
masuk melalui kondensor yang telah dialiri air dingin dari unit Chiller
yang ada di unit utilities II, sehingga akan dihasilkan udara yang
produksi PT. Universal Pharmaceutical Industries diatur dengan katup
dumper.
Tekanan udara tersebut dapat dibedakan menjadi 3 macam:
1. Tekanan udara normal, yaitu tekanan untuk ruangan produksi di luar
produksi β-laktam dan produk steril. Tekanan udara di dalam ruangan
produksi sama besar dengan tekanan udara luar.
2. Tekanan udara positif, yaitu tekanan untuk ruangan steril atau aseptis.
Tekanan di dalam ruang produksi lebih besar daripada tekanan udara di
luar ruangan, diatur dengan membuka katup dumper. Tekanan udara
positif bertujuan agar obat-obat yang diproduksi tidak tercemar oleh debu
atau jasad renik dari luar ruangan produksi.
3. Tekanan udara negatif yaitu tekanan untuk ruangan produksi β-laktam.
Tekanan di dalam ruang produksi lebih kecil daripada tekanan di luar
ruang yang diatur dengan membuka katup dumper.
Sistem Pengolahan Udara dapat dilihat pada Lampiran 16.
3.2.2 Sistem Pengolahan air
Untuk memenuhi suplai air murni (Purified water), dalam kasus ini dibagi
dalam 3 tahapan:
1. Tahap I : Pre Treatment System
Sumber air : Air PAM
Tahap pre treatment :
- Iron dan Manganese Filter
- Sand Filter
- Activated Carbon Filter
2. Tahap II : Sistem utama pengolahan air
- Reverse Osmosis
- Mixed bed (Cation and Anion Exchanger)
Tipe air yang digunakan dalam industri farmasi:
1. Purified Water
Air yang digunakan untuk produk-produk non parenteral (solid dosage
form, semi solid form dan liquid)
2. Water for injection
Air untuk obat parenteral
3.2.2 Pengolahan Limbah 2.7 Pengelolaan Limbah
Limbah di PT. Universal PI terdiri atas limbah padat dan cair. Limbah
padat berasal dari debu yang terkumpul dari sistem pengendalian debu dan
sisa-sisa debu produksi; sisa-sisa material pengemas (kertas, karton, plastik, kaleng, botol,
dan aluminium foil); bahan baku dan produk yang rusak, substandard, dan
kadaluarsa; produk kembalian dan contoh pertinggal yang telah melewati batas
masa simpan; serta sampah kantor. Sedangkan limbah cair berasal dari pencucian
peralatan produksi dan sisa kegiatan analisa laboratorium.
Untuk mengendalikan limbah padat berupa debu yang berasal dari semua
proses produksi tablet dan kapsul, PT. Universal PI menggunakan dust collector
untuk menghisap debu. Debu yang terkumpul dari saringan dust collector
Limbah padat yang berupa sampah domestik seperti sisa-sisa material
pengemas dikumpulkan di dalam bak sampah kemudian dibakar dan diangkut
oleh petugas kebersihan PEMKO Medan. Produk-produk yang rusak, kadaluarsa
dan contoh pertinggal yang telah melewati batas masa simpan dimusnahkan
dengan cara dibakar.
Limbah cair dialirkan melalui parit penampungan limbah. Proses
pengelohan limbah cair ini terdiri dari:
a. Bak ekualisasi
Bak ini berguna untuk mengurangi variasi laju alir maupun konsentrasi
dan juga berfungsi sebagai bak penahan buangan dengan konsentrasi atau kondisi
ekstrim yang dapat menggangu proses pengolahan berikutnya.
b. Bak netralisasi
Bak ini berguna untuk mengatur kondisi pH sedemikin rupa sehingga
proses pengolahan berikutnya berada pada kondisi optimal. Pada bak ini akan
dilakukan pengontrolan sebagai berikut:
i. Jika limbah cair yang diperiksa mempunyai pH asam (pH<7), maka akan
ditambahkan air kapur ke dalam bak agar diperoleh pH netral.
ii. Jika limbah cair yang diperiksa mempunyai pH basa (pH>7), maka akan
ditambahkan asam fosfat ke dalam bak agar diperoleh pH netral.
c. Bak aerasi
Pada bak ini terdapat dua buah aerator yang berfungsi untuk menyediakan
oksigen bagi pertumbuhan mikroba pada lumpur aktif yang bersifat aerobik dan
diperlukan untuk menghasilkan kontak antara mikroba dengan limbah sehingga
mikroba dapat menguraikan bahan-bahan organik dalam limbah.
d. Bak sedimentasi
Setelah melalui bak aerasi, limbah akan dialirkan ke bak sedimentasi
untuk diendapkan. Setelah lumpur mengendap, air limbah akan dialirkan ke bak
berikutnya yaitu bak biokontrol, sementara lumpur akan dipompakan kembali ke
dalam bak aerasi.
e. Bak biokontrol
Bak biokontrol berisi limbah yang telah mengalami proses pengolahan,
Limbah yang terdapat pada bak ini berada dalam kondisi pH netral, tidak
berwarna, tidak berbau dan sebagai kontrol digunakan ikan hidup untuk
memantau bahwa limbah yang dihasilkan tidak beracun dan tidak berbahaya
BAB 1V PEMBAHASAN
PT. Universal Pharmaceutical Industries merupakan perusahaan farmasi
yang telah mendapatkan sertifikat CPOB untuk setiap produk yang dihasilkan.
Ruang lingkup CPOB meliputi seluruh aspek produksi dan pengendalian mutu
yang bertujuan untuk menjamin khasiat, keamanan dan mutu obat yang
diproduksi sesuai dengan tujuan penggunaannya.
Tinjauan terhadap penerapan CPOB pada PT. Universal PI sudah
terlaksana sesuai aspek-aspek CPOB yang dinamis, yang dijabarkan sebagai
berikut:
1. Personalia
Penanggung jawab bagian produksi dan bagian pengawasan mutu telah
dipimpin oleh orang yang berbeda dan bertanggung jawab di bidangnya
sesuai job description yang telah ditetapkan. Keseluruhan personalia juga
mendapat pelatihan secara berkesinambungan mengenai tugas dan
tanggung jawabnya masing-masing sesuai dengan prinsip CPOB, yang
bertujuan untuk menjamin karyawan melakukan pekerjaannya dengan
baik.
2. Bangunan
Bangunan mempunyai konstruksi sesuai rancangan CPOB untuk
menghindari kontaminasi silang antar produk, sehingga pelaksanaan
proses produksi sesuai dengan ruangan dan alat yang digunakan untuk
3. Peralatan
Peralatan yang digunakan dalam proses produksi ditempatkan dengan
benar, sehingga jarak antara satu alat dengan alat lain ditata dengan rapi
utntuk memudahkan karyawan dalam bekerja, sehingga waktu yang
digunakan selama proses produksi cukup efisien. Pemeliharaan peralatan
dipantau secara rutin oleh masing-masing operator mesin dan teknisi untuk
bersama-sama mengatasi kerusakan dan perbaikan peralatan.
4. Sanitasi dan Higiene.
Seluruh karyawan yang berhubungan dengan proses pengolahan
diwajibkan untuk menggunakan pakaian khusus produksi yang dilengkapi
dengan masker, tutup kepala, sepatu dan sarung tangan selama berada
dalam ruang produksi. Semua karyawan menjalani pemeriksaan kesehatan,
baik sebelum diterima menjadi karyawan maupun selama bekerja. Sanitasi
ruangan dilakukan pada awal dan akhir jam kerja dengan menggunakan
larutan desinfektan. Pembersihan peralatan juga dilakukan pada awal dan
akhir jam kerja. Proses pembersihan sanitasi dan higiene dilakukan sesuai
protap.
5. Produksi
Setiap produksi dilaksanakan dengan mengikuti prosedur tetap yang dapat
menjamin produk obat jadi memenuhi spesifikasi yang telah ditentukan.
Kegiatan produksi meliputi penimbangan, pengolahan, pengemasan,
pengendalian dan evaluasi, dimana semua kegiatan tersebut diarsipkan ke
dalam sebuah dokumen yang disebut dokumen produksi. Selama produksi
6. Pengawasan mutu
Pelaksanaan kegiatan pengawasan mutu dilaksanakan dengan alat dan
instrumen yang sudah terkalibrasi dan tervalidasi sehingga mutu produk
yang dihasilkan dijamin kualitasnya. Pengawasan mutu dilakukan sejak
pemilihan bahan baku, In Process Control (IPC) sampai produk tersebut
dipasarkan.
7. Dokumentasi
Semua proses kegiatan di industri dicatat dalam masing-masing dokumen
maupun catatan tertentu. Dokumentasi ini berfungsi sebagai penghubung
antar personil dalam departemen yang berbeda. Masing-masing dokumen
tersedia bagi semua pihak yang terkait dan diarsipkan secara teratur
sehingga memudahkan penelusurannya bila diperlukan.
8. Sistem Penunjang
Sistem pengaturan udara (Air Handling Unit) dan pengolahan air telah
beroperasi dengan baik. Setiap waktu yang telah ditetapkan
dilakukan pemeriksaan operasional oleh teknisi terhadap sistem AHU dan
pengolahan air.
Proses pengolahan limbah dan tolak ukurnya telah sesuai dengan baku
mutu lingkungan.
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Berdasarkan hasil Praktek Kerja Profesi di PT Universal Pharmaceutical
Industries, disimpulkan bahwa:
a. PT Universal Pharmaceutical Industries telah menerapkan Cara
Pembuatan Obat yang Baik.
b. PT Universal Pharmaceutical Industries telah melakukan pelatihan CPOB
kepada para karyawan sehingga dapat bekerja sesuai dengan yang
diharapkan.
c. PT Universal Pharmaceutical Industries memproduksi sediaan dalam
bentuk tablet, kapsul, sirup dan cairan obat luar.
5.2 Saran
1. Diharapkan PT Universal Pharmaceutical Industries pada masa yang akan
datang lebih melengkapi peralatan yang mendukung pelaksanaan produksi.
2. Diharapkan agar manajemen PT Universal Pharmaceutical Industries
dapat memberikan kesempatan kembali kepada mahasiswa apoteker
DAFTAR PUSTAKA
Badan POM. (2006). Pedoman Cara Pembuatan Obat yang Baik. Jakarta.
Badan POM. (2009). Petunjuk Operasional Penerapan Cara Pembuatan Obat
yang Baik. Jakarta.
Departemen Kesehatan RI. (2009). Undang-undang Kesehatan No. 32. Jakarta.
Departemen Kesehatan RI. (1979). Farmakope Indonesia. Edisi III. Jakarta.
Departemen Kesehatan RI. (1995). Farmakope Indonesia. Edisi IV. Jakarta.
Departemen Kesehatan RI. (1990). Permenkes RI No. 157/Menkes/Per/III/1990
tentang Analisa Dampak Lingkungan. Jakarta.
Priyambodo, B (2007). Manajemen Farmasi Industri. Edisi I. Yogyakarta: Global
Lampiran 15. Etiket
PT. UNIVERSAL
PHARMACEUTICAL INDUSTRIES MEDAN
BAGIAN PENGAWASAN MUTU
DITOLAK Nama Produk/Bahan
No. Batch/Lot Pabrik Pemasok No. Penerimaan Barang Jumlah
No. Sertifikat Analisis Tanda Tangan
PT. UNIVERSAL
PHARMACEUTICAL INDUSTRIES MEDAN
BAGIAN PENGAWASAN MUTU
DILULUSKAN TANGGAL: Nama Produk/Bahan
No. Batch/Lot Pemasok/Pembuat No. Laporan Penerimaan
Jumlah……… No. wadah……….. Dari ………….. No. Sertifikat Analisis
Uji Ulang Pada Tanggal Tanda Tangan
PT. UNIVERSAL
PHARMACEUTICAL INDUSTRIES MEDAN
BAGIAN PENGAWASAN MUTU
KARANTINA BAHAN BAKU Nama Produk/Bahan
No. Batch/Lot Pabrik/Pemasok No. Penerimaan Barang Jumlah
No. Sertifikat Analisis Tanggal: No. wadah
BAGIAN PENGAWASAN MUTU
SAMPEL DIAMBIL UNTUK PEMERIKSAAN Nama Produk/Bahan
No. Batch/Lot Pabrik/Pemasok No. Penerimaan Barang Jumlah
No. Sertifikat Analisis Tanggal: No. wadah
Dari……….
Lampiran 16. Sistem AHU (Air Handling Unit)
PRE
MEDIUM
PRE
MEDIUM
BLOWER BLOWER
AC AC
HEPA
+ + + RA + + RA
WHITE GREY BLACK
Dokumen Produksi Induk Tanggal Berlaku 12 Mei 2010 Disusun oleh
Kepala Bag.Produksi Tanggal: 2 Mei 2010
Diperiksa oleh
Kepala Bag. Peng. Mutu Tanggal: 8 Mei 2010
Disetujui oleh
Kepala Bag. Peng. Mutu Tanggal: 9 Mei 2010
Mengganti
Kekuatan/Dosis : Tiap tablet mengandung 500 mg Parasetamol Bentuk Sediaan : Tablet/Oral
DAFTAR ISI
Daftar isi --- 1
Ketentuan Umum --- 2
Komposisi dan Formula Pengolahan --- 3
Spesifikasi:
Daftar Peralatan --- 5
Penimbangan --- 6
Proses Pengolahan --- 6
Proses Pengemasan --- 8
Persyaratan dan Pengawasan --- 9