LAPORAN HASIL PENELITIAN
Profil Kondisi Sterilitas dan Uji Kepekaan Antibiotik Terhadap
Bakteri yang Ditemukan pada Peralatan Medis Instalasi
Perawatan Intensif RSUP. H. Adam Malik
Oleh :
VINISIA
060100092
FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
LEMBAR PENGESAHAN
Judul Penelitian : Profil Kondisi Sterilitas dan Uji Kepekaan Antibiotik Terhadap Bakteri yang Ditemukan pada Peralatan Medis Instalasi Perawatan Intensif RSUP. H. Adam Malik
__________________________________________________________________ Nama : Vinisia
NIM : 060100092
__________________________________________________________________ Pembimbing Penguji I
(dr. Mistar Ritonga, Sp.F) (dr. Amira Permatasari, Sp.P) NIP : 19520408 198903 1 001 NIP: 19691107 199903 2 002 Penguji II
(dr. Rina Amelia, MARS) NIP : 19760420 200312 2 002
Medan, 1 Desember 2009 Dekan
Fakultas Kedokteran Universitas Sumatera Utara
ABSTRAK
Masih tingginya angka kejadian infeksi nosokomial terutama di negara-negara berkembang dan negara miskin perlu mendapat perhatian khusus. Pemasangan alat-alat medis invasif merupakan salah satu faktor penting yang mempengaruhi terjadinya infeksi (Utama, 2006). Sterilitas ruangan serta peralatan sangat diperlukan untuk mencegah terjadinya infeksi. Tingginya tingkat resistensi antibiotik turut berperan dalam meningkatkan angka morbiditas.
Penelitian ini menggunakan metode penelitian survei dengan jenis penelitian deskriptif, dimana sampel berupa peralatan medis pada Instalasi Perawatan Intensif Dewasa RSUP. H. Adam Malik
Ditemukan adanya mikroorganisme pada peralatan medis dan juga udara yaitu Aspergillus sp, Bacillus subtilis, Staphylococcus albus, Staphylococcus aureus, Klebsiella pneumoniae, dan Pseudomonas aeruginosa. Dari hasil uji kepekaan antibiotik, 12 jenis antibiotik telah resisten dari 24 jenis antibiotik dan 1 jenis antibiotik hampir resisten.
Adanya bakteri dan jamur pada peralatan medis dan juga udara pada UPI tentu akan meningkatkan risiko terjadinya infeksi nosokomial serta resistensi terhadap antibiotik dapat memperburuk penyakit yang diderita pasien. Oleh karena itu, diperlukan adanya uji sterilitas secara berkala serta optimalisasi pemakaian antibiotik.
ABSTRACT
The frequent incidence of nosocomial infection especially in developing and poor country need a special concern. The use of invasive medical equipment is one of the factors that lead to an infection (Utama, 2006). The sterility of room and medical equipment is needed to prevent infection. The high rate of antibiotic resistance also contribute to rise the morbidity of patient.
Researcher use survey research method with descriptive approach. The sample is medical equipment in RSUP. H. Adam Malik adult intensive care unit.
Microorganism was found in medical equipment and also found in the air, the microorganism are Aspergillus sp, Bacillus subtilis, Staphylococcus albus, Staphylococcus aureus, Klebsiella pneumoniae, and Pseudomonas aeruginosa. From the sensitivity test, 12 antibiotics from 24 antibiotics are resistant and 1 antibiotic almost resistant.
The bacteria and fungi that found in medical equipment and in the air will rise the risk of nosocomial infection. The antibiotic resistance will aggravate the disease of patient. Therefore sterility test need to be done periodically and also optimizing the use of antibiotic.
KATA PENGANTAR
Terima kasih saya ucapkan kepada Tuhan Yang Maha Esa karena atas berkat dan anugerahNya saya dapat menyelesaikan penulisan Laporan Hasil Penelitian ini. Tidak lupa terima kasih saya ucapkan juga kepada dosen-dosen yang telah membimbing dan mengajar saya selama ini. Terima kasih kepada dr. R. Lia Kusumawati, M.Sc, Sp. MK dan dr. Mistar Ritonga, Sp.F yang telah membimbing saya selama pembuatan mulai dari proposal hingga laporan hasil penelitian. Terima kasih kepada keluarga dan segenap teman-teman yang telah mendukung saya selama ini.
Saya menyadari bahwa laporan hasil penelitian ini masih jauh dari sempurna. Saya sangat berharap saran dan kritik dari pembaca agar saya dapat menyempurnakan lagi laporan hasil penelitian ini. Kepada semua yang membaca saya mengucapkan terima kasih karena telah meluangkan waktu untuk membaca proposal penelitian ini.
Medan, 16 November 2009
DAFTAR ISI
Lembar Pengesahan i
Abstrak ii
Kata Pengantar iv
Daftar Isi vi
Daftar Singkatan viii
Daftar Tabel ix
Daftar Gambar x
BAB 1 PENDAHULUAN 1
1.1.Latar Belakang 1
1.2.Rumusan Masalah 3
1.3.Tujuan Penelitian 4
1.4.Manfaat Penelitian 4
BAB 2 TINJAUAN PUSTAKA 6
2.1. Infeksi Nosokomial 6
2.2. Disinfektan 13
2.3. Sterilisasi Rumah Sakit Dan Metodenya 20
BAB 3 KERANGKA KONSEP DAN DEFINISI OPERASIONAL 24
3.1. Kerangka Konsep 24
3.2. Variabel/Definisi Operasional 24
BAB 4 METODE PENELITIAN 26
4.1. Jenis Penelitian 26
4.2. Waktu dan Tempat Penelitian 27
4.3. Populasi dan Sampel 27
4.4. Teknik Pengumpulan Data 28
4.5. Pengolahan dan Analisa Data 29
BAB 5 HASIL PENELITIAN DAN PEMBAHASAN 37
5.1. Hasil Penelitian 37
5.1.1. Deskripsi Lokasi Penelitian 37 5.1.2. Deskripsi Peralatan yang Dijadikan Sampel 38
5.1.3. Bakteri Yang Ditemukan 38
5.2. Pembahasan Hasil Penelitian 42
5.2.1. Bakteri Yang Ditemukan 42
5.2.2. Hasil Uji Kepekaan Antibiotik 44
BAB 6 KESIMPULAN DAN SARAN 47
6.1. Kesimpulan 47
6.2. Saran 47
DAFTAR PUSTAKA 49
DAFTAR SINGKATAN
CSSD : Central Sterile Supply Department
DTT : Disinfeksi Tingkat Tinggi
EMB : Eosin Methylen Blue
EPIC : European Prevalence of Infection In Intensive Care
ISS : Instalasi Sterilisasi Sentral
KBM : Kadar Bunuh Minimum
KHM : Kadar Hambat Minimum
MSA : Manitol Salt Agar
NNIS : National Nosocomial Infection Surveillance System
RSUP : Rumah Sakit Umum Pusat
IPI : Instalasi Perawatan Intensif
USG : Ultrasonography
WHO : World Health Organization
DAFTAR TABEL
Tabel 2.1. Dugaan Kuman Penyebab Infeksi Nosokomial tahun 2000 12
Tabel 2.2. Klasifikasi Disinfeksi 19
Tabel 4.1. Waktu Penelitian 27
Tabel 4.2. Hasil Uji Triple Sugar Iron 33
Tabel 4.3. Zona Hambat Pada Berbagai Antimikroba 36
Tabel 5.1. Deskripsi Peralatan Medis 38
Tabel 5.2. Hasil Uji Reaksi Biokimia 39
Tabel 5.3. Urutan bakteri dan jamur terbanyak yang ditemukan pada
DAFTAR GAMBAR
Gambar 2.1. Faktor Ekstrinsik Terjadinya Infeksi Nosokomial 9 Gambar 2.2. Berbagai Faktor Yang Mempengaruhi Terjadinya
Infeksi Nosokomial 10
Gambar 4.1. Nutrient Agar Plates 28
Gambar 4.2. Sterile Swabs 28
Gambar 4.3. Cara Penggoresan Pada Medium Kultur 29 Gambar 5.1.Pertumbuhan Staphylococcus aureus dan Staphylococcus
ABSTRAK
Masih tingginya angka kejadian infeksi nosokomial terutama di negara-negara berkembang dan negara miskin perlu mendapat perhatian khusus. Pemasangan alat-alat medis invasif merupakan salah satu faktor penting yang mempengaruhi terjadinya infeksi (Utama, 2006). Sterilitas ruangan serta peralatan sangat diperlukan untuk mencegah terjadinya infeksi. Tingginya tingkat resistensi antibiotik turut berperan dalam meningkatkan angka morbiditas.
Penelitian ini menggunakan metode penelitian survei dengan jenis penelitian deskriptif, dimana sampel berupa peralatan medis pada Instalasi Perawatan Intensif Dewasa RSUP. H. Adam Malik
Ditemukan adanya mikroorganisme pada peralatan medis dan juga udara yaitu Aspergillus sp, Bacillus subtilis, Staphylococcus albus, Staphylococcus aureus, Klebsiella pneumoniae, dan Pseudomonas aeruginosa. Dari hasil uji kepekaan antibiotik, 12 jenis antibiotik telah resisten dari 24 jenis antibiotik dan 1 jenis antibiotik hampir resisten.
Adanya bakteri dan jamur pada peralatan medis dan juga udara pada UPI tentu akan meningkatkan risiko terjadinya infeksi nosokomial serta resistensi terhadap antibiotik dapat memperburuk penyakit yang diderita pasien. Oleh karena itu, diperlukan adanya uji sterilitas secara berkala serta optimalisasi pemakaian antibiotik.
ABSTRACT
The frequent incidence of nosocomial infection especially in developing and poor country need a special concern. The use of invasive medical equipment is one of the factors that lead to an infection (Utama, 2006). The sterility of room and medical equipment is needed to prevent infection. The high rate of antibiotic resistance also contribute to rise the morbidity of patient.
Researcher use survey research method with descriptive approach. The sample is medical equipment in RSUP. H. Adam Malik adult intensive care unit.
Microorganism was found in medical equipment and also found in the air, the microorganism are Aspergillus sp, Bacillus subtilis, Staphylococcus albus, Staphylococcus aureus, Klebsiella pneumoniae, and Pseudomonas aeruginosa. From the sensitivity test, 12 antibiotics from 24 antibiotics are resistant and 1 antibiotic almost resistant.
The bacteria and fungi that found in medical equipment and in the air will rise the risk of nosocomial infection. The antibiotic resistance will aggravate the disease of patient. Therefore sterility test need to be done periodically and also optimizing the use of antibiotic.
BAB 1 PENDAHULUAN
1.1Latar Belakang
Infeksi terkait dengan perawatan kesehatan melalui pemasangan alat-alat medis yang invasif di Instalasi Perawatan Intensif merupakan salah satu faktor penting yang mengancam pemulihan pasien selama perawatan kesehatan berlangsung. Pasien – pasien ini mempunyai risiko yang tinggi untuk mendapatkan infeksi nosokomial. Pada umumnya pasien di Instalasi Perawatan Intensif memiliki faktor risiko berupa penyakit yang mendasarinya serta gangguan imun, sehingga pemasangan alat invasif berlama-lama dapat mempermudah pasien untuk mendapatkan infeksi nosokomial (Lipalosaan dkk, 2006) dan (Darmadi, 2008).
Tujuh faktor risiko untuk infeksi nosokomial di Instalasi Perawatan Intensif adalah:
1. Meningkatnya lama perawatan di Instalasi Perawatan Intensif (>48 jam).
2. Pemasangan ventilasi mekanis. 3. Diagnosis trauma pada pasien. 4. Pemasangan kateter vena sentral.
5. Pemasangan kateter pada arteri pulmonal. 6. Pemasangan kateter urin.
7. Profilaksis ulkus karena stress.
Infeksi nosokomial banyak terjadi di seluruh dunia dengan kejadian terbanyak di negara miskin dan negara yang sedang berkembang karena penyakit-penyakit infeksi masih menjadi penyebab utama. Suatu penelitian yang dilakukan oleh WHO menunjukkan bahwa sekitar 8.7% dari 55 rumah sakit dari 14 negara di Eropa, Timur tengah, dan Asia Tenggara dan Pasifik terdapat infeksi nosokomial dengan Asia Tenggara sebanyak 10% (Utama, 2006).
Instalasi Perawatan Intensif pada 46 rumah sakit di Argentina, Brazil, Colombia, India, Meksiko, Moroko, dan Peru didapatkan dari 21.069 pasien yang dirawat di Instalasi Perawatan Intensif selama 137.740 hari (dihitung secara agregat), 3095 mengalami infeksi terkait alat yang digunakan, dengan keseluruhannya 14.7% atau 22.5 infeksi per 1000 hari rawat inap di Instalasi Perawatan Intensif. Pneumonia terkait ventilator merupakan yang terbanyak, sebanyak 41%, diikuti dengan kateter vena sentral sebanyak 30%, dan infeksi traktus urinarius sebanyak 29%. Didapatkan juga 84% Staphylococcus aureus disebabkan oleh Methicillin-resistant strains, 51% dari isolat Enterobacteriaceae resisten terhadap ceftriaxone, dan 59% dari isolat Pseudomonas aeruginosa resisten terhadap florokuinolon. Angka mortalitas secara kasar didapatkan 35.2% untuk infeksi terkait pemasangan kateter vena sentral dan 44.9% terkait pneumonia terkait pemasangan ventilator.
Seperti yang dilaporkan oleh Vincent, dkk (1996) penelitian yang dilakukan oleh European Prevalence of Infection In Intensive Care (EPIC) mendapatkan 20.6% dari 10.038 pasien di 1417 Instalasi Perawatan Intensif di Eropa tahun 1992. Dengan peneumonia merupakan terbanyak (46.9%), infeksi saluran napas bawah (17.8%), infeksi traktus urinarius (17.6%), dan infeksi melalui aliran darah (12%). Mikroorganisme terbanyak yang ditemukan adalah Enterobacteriaceae (34.4%), Staphylococcus aureus (30.1%), Pseudomonas aeruginosa (28.7%), Staphylococcus koagulase negatif (19.1%), dan jamur (17.1%) .
koagulase negatif merupakan mikroorganisme yang paling banyak ditemukan sebanyak 36%, Enterococcus sebanyak 16%, dan Staphylococcus aureus sebanyak 13% (Richards, 1999).
Di Indonesia, penelitian yang dilakukan Suwarni. A (1999) di semua rumah sakit di Yogyakarta tahun 1999 menunjukkan bahwa proporsi kejadian infeksi nosokomial berkisar 0%-12% dengan rata-rata kseluruhan 4.26%. Untuk rata-rata lama perawatan 4.3-11.2 hari, dengan rata-rata 6.7 hari. Setelah diteliti lebih lanjut ternyata didapatkan angka kuman lantai ruang perawatan mempunyai hubungan yang bermakna dengan kejadian infeksi nosokomial (Utama, 2006). Namun, di Indonesia sendiri belum ada data akurat mengenai tingkat infeksi nosokomial. Pemerintah telah berupaya untuk mencegah infeksi nosokomial melalui Keputusan Menteri Kesehatan Nomor 270/Menkes/III/2007, namun bagaimana hasil dari kebijakan ini belum ada laporan yang akurat (Farid, 2007).
Masih tingginya tingkat kejadian infeksi nosokomial terutama di negara-negara berkembang dengan berbagai hal sebagai faktor presdiposisi terjadinya infeksi nosokomial, salah satunya adalah sterilitas peralatan medis yang digunakan membuat saya terpicu untuk melakukan penelitian ini. Dimana pada penelitian ini peneliti melakukan uji sterilitas terhadap peralatan medis Instalasi Perawatan Intensif dewasa serta menguji kepekaan bakteri yang saya temukan. Alasan peneliti memilih Instalasi Perawatan Intensif dewasa adalah karena banyak peralatan medis invasif yang digunakan dan Instalasi Perawatan Intensif dewasa memiliki jumlah pasien terbanyak. Dari berbagai penelitian didapatkan infeksi nosokomial paling sering terjadi di Instalasi Perawatan Intensif dibandingkan bagian lain di rumah sakit.
1.2. Rumusan Masalah
kepekaan bakteri penyebab terhadap antibiotik, dan uji sterilitas berkala. RSUP. H. Adam Malik memiliki pusat pengendalian infeksi nosokomial, namun belum pernah dilakukan penelitian mengenai tingkat kejadian infeksi nosokomial di Instalasi Perawatan Intensif. Uji sterilitas secara berkala juga dilakukan setiap satu tahun dan hasilnya tidak pernah dipublikasikan. Oleh karena itu, pada penelitian ini peneliti akan melihat bagaimana profil sterilitas dari peralatan medis yang terdapat di Instalasi Perawatan Intensif RSUP. H. Adam Malik serta bagaimana hasil uji kepekaan dari bakteri yang ditemukan terhadap antibiotika.
1.3. Tujuan Penelitian
Tujuan umum dari penelitian ini adalah :
1. Mengetahui profil sterilitas dari peralatan medis yang terdapat di Instalasi Perawatan Intensif RSUP. H. Adam Malik Medan.
2. Mengetahui kepekaan bakteri yang ditemukan terhadap antibiotika. Tujuan khusus dari penelitian ini adalah :
1. Mengetahui pola bakteri yang ditemukan, yaitu mengelompokkan bakteri berdasarkan jumlah dan tempat ditemukannya.
2. Mengetahui jenis-jenis antibiotika yang masih sensitif dan yang telah resisten terhadap kuman yang ditemukan.
1.4. Manfaat Penelitian Bagi Rumah Sakit :
1. Memberikan masukan bagi rumah sakit tingkat sterilitas ruang perawatan intensif dewasa.
2. Memberikan gambaran pola bakteri yang ditemukan dan bagaimana kepekaannya.
3. Memberikan masukan bagi rumah sakit untuk meningkatkan pemeliharaan sterilitas ruangan dan peralatan medis yang digunakan. 4. Memberikan masukan bagi rumah sakit untuk melakukan penelitian
Bagi Pasien :
1. Membantu mengurangi angka kesakitan pasien akibat infeksi nosokomial.
2. Memberikan kontribusi pada pasien untuk mencegah perpanjangan lama rawat dan mengurangi biaya tambahan perawatan pasien jika mengalami infeksi nosokomial.
Bagi Peneliti :
1. Menambah wawasan peneliti mengenai pola bakteri terbanyak yang ditemukan dan pola kepekaannya yang nantinya dapat digunakan ketika terjun ke dunia klinis.
BAB 2
TINJAUAN PUSTAKA
2.1. Infeksi Nosokomial
Infeksi adalah suatu organisme pada jaringan atau cairan tubuh yang disertai suatu gejala klinis baik lokal maupun sistemik (Utama, 2006). Infeksi yang terjadi di rumah sakit dan menyerang penderita-penderita yang sedang dalam proses asuhan keperawatan, serta gejala-gejala yang dialami baru muncul selama seseorang itu dirawat atau selesai dirawat disebut infeksi nosokomial. Infeksi nosokomial terjadi karena adanya transmisi mikroba patogen yang bersumber dari lingkungan rumah sakit dan perangkatnya. Rumah sakit merupakan salah satu tempat dimana kita dapat menemukan mikroba patogen. Rumah sakit merupakan depot bagi berbagai macam panyakit yang berasal dari penderita maupun dari pengunjung yang bersifat karier. Kuman penyakit ini dapat hidup dan berkembang di lingkungan rumah sakit seperti udara, lantai, makanan, benda-benda medis ataupun non medis (Darmadi, 2008). Banyaknya mikroba patogen di rumah sakit disebabkan karena :
1. Rumah sakit merupakan tempat perawatan segala macam jenis penyakit.
2. Rumah sakit merupakan “gudangnya” mikroba patogen.
3. Mikroba patogen yang ada umumnya telah kebal terhadap antibiotik. Bila sanitasi rumah sakit tidak terjamin dengan baik, maka semakin besar risiko terjadinya ancaman infeksi nosokomial pada penderita-penderita yang menjalani proses perawatan. Kesadaran akan risiko infeksi nosokomial di rumah sakit di Indonesia dirintis kira-kira dua dasawarsa terakhir. Rumah sakit yang menetapkan quality assurance telah memiliki Panitia Medik Pengendalian Infeksi Nosokomial yang berfungsi untuk mencegah dan mengendalikan infeksi nosokomial (Darmadi, 2008).
yang sedang dalam proses perawatan di rumah sakit merupakan beban tambahan secara fisik dan psikologis bagi pasien. Secara fisik, beban tersebut akan terasa lebih berat karena adanya penyakit tambahan di samping penyakit dasarnya sehingga lama hari perawatan semakin panjang. Secara psikologis demikian juga. Pasien-pasien yang menjalani rawat inap ini perlu dilindungi dan dijauhkan dari kemungkinan terjangkitnya infeksi nosokomial melalui sebuah kebijaksanaan rumah sakit (Utama, 2006).
Untuk keseragaman pemahaman, diperlukan adanya definisi atau batasan infeksi nosokomial. Infeksi nosokomial menyangkut dua hal pokok, yaitu penderita yang sedang dalam proses asuhan keperawatan di rumah sakit dan adanya transmisi mikroba patogen ke penderita yang sedang dalam proses asuhan keperawatan tersebut. Setiap penyakit memiliki masa inkubasi yang berbeda, oleh karena itu perlu adanya penjabaran lebih spesifik mengenai manifestasi klinis. Manifestasi klinis seperti telah disebutkan dapat muncul selama pasien dalam proses perawatan ataupun setelah selesai menjalani proses perawatan / setelah pasien keluar dari rumah sakit. Kadang terjadi penularan / infeksi, namun tidak ada manifestasi klinis. Dalam hal ini sangat diperlukan penilaian laboratorium.
Suatu infeksi dapat dikatakan didapat dari rumah sakit apabila memiliki kriteria sebagai berikut (Darmadi, 2008 dan Utama, 2006) :
1. Pada waktu penderita mulai dirawat di rumah sakit tidak didapatkan tanda-tanda klinik dari infeksi tersebut.
2. Pada waktu penderita mulai dirawat di rumah sakit tidak sedang dalam masa inkubasi dari infeksi tersebut.
3. Tanda-tanda klinik infeksi tersebut timbul sekurang-kurangnya setelah 3x24 jam sejak mulai perawatan. Secara umum, pasien yang masuk rumah sakit dan menunjukkan tanda infeksi kurang dari 72 jam menunjukkan bahwa masa inkubasi penyakit telah terjadi sebelum pasien masuk rumah sakit (infeksi buka n berasal dari rumah sakit). 4. Infeksi tersebut bukan merupakan sisa atau residual dari infeksi
5. Bila saat mulai dirawat di rumah sakit sudah ada tanda-tanda infeksi, dan terbukti infeksi tersebut didapat penderita ketika dirawat di rumah sakit yang sama pada waktu yang lalu, serta belum pernah dilaporkan sebagai infeksi nosokmial.
6. Penderita yang sedang dalam proses asuhan keperawatan di rumah sakit dan kemudian menderita keracunan makanan dengan penyebab bukan produk bakteri tidak termasuk infeksi nosokomial.
7. Untuk penderita yang telah keluar dari rumah sakit dan kemudian timbul tanda-tanda infeksi, dapat digolongkan sebagai infeksi nosokomial apabila infeksi tersebut dapat dibuktikan berasal dari rumah sakit.
8. Infeksi yang terjadi pada petugas pelayanan medis serta keluarga / pengunjung tidak termasuk infeksi nosokomial.
Mikroba patogen yang menimbulkan infeksi nosokomial akan masuk ke penjamu melalui port d’entrée dan setelah melewati masa inkubasi akan timbul reaksi sistemik pada penderita berupa manifestasi klinik ataupun laboratorium. Bakteremia merupakan respon sistemik penderita terhadap infeksi, di mana mikroba atau toksinnya berada di dalam aliran darah dan menimbulkan reaksi sistemik berupa reaksi inflamasi. Proses inflamasi dapat berlanjut hingga menimbulkan sepsis
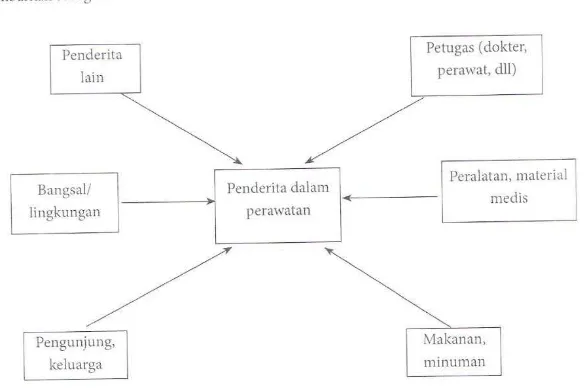
Gambar 2.1. Faktor Ekstrinsik Terjadinya Infeksi Nosokomial
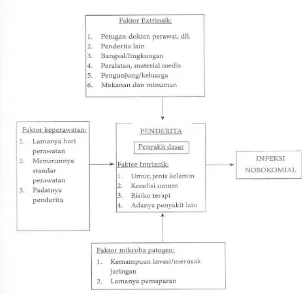
Menurut Darmadi (2008) dan Trilla (2005) selain faktor ekstrinsik yang telah dijabarkan, terdapat faktor-faktor lain yang juga berperan memberi peluang timbulnya infeksi nosokomial, faktor-faktor tersebut adalah sebagai berikut :
1. Faktor-faktor yang ada pada diri penderita (faktor intrinsik) seperti umur, jenis kelamin, kondisi umum penderita, risiko terapi, atau adanya penyakit lain yang menyertai penyakit dasar (multipatologi) beserta komplikasinya. Faktor-faktor ini merupakan presdiposisi.
2. Faktor keperawatan seperti lamanya hari perawatan, menurunnya standard pelayanan perawatan, serta padatnya penderita dalam satu ruangan.
3. Faktor mikroba patogen seperti tingkat kemampuan invasi serta tingkat kemampuan merusak jaringan, lamanya pemaparan antara sumber penularan (reservoir) dengan penderita.
Gambar 2.2. Berbagai Faktor Yang Mempengaruhi Terjadinya Infeksi Nosokomial
Mikroba patogen agar dapat menimbulkan penyakit infeksi harus bertemu penjamu yang rentan dan melalui tiga tahap. Tahap pertama mikroba patogen bergerak menuju ke penjamu / penderita dengan mekanisme penyebaran (mode of transmission) terdiri dari penularan langsung dan tidak langsung (Darmadi, 2008). Penularan langsung : melalui droplet nuclei yang berasal dari petugas, keluarga / pengunjung, dan penderita lainnya. Kemungkinan lain berupa darah saat transfusi darah.
minuman yang disajikan untuk penderita. Water-borne yaitu penyebaran / penularan mikroba patogen melalui air, namun kemungkinannya kecil sekali karena air di rumah sakit biasanya sudah melalui uji baku. Air-borne yaitu penyebaran / penularan mikroba patogen melalui udara, peluang terjadinya infeksi melalui cara ini cukup tinggi karena ruangan / bangsal yang tertutup secara teknis kurang baik ventilasi dan pencahayaannya.
Dari semua kemungkinan penyebaran / penularan mikroba patogen, maka penyebab infeksi nosokomial yang paling sering dilaporkan adalah tindakan invasif melalui penggunaan berbagai instrumen medis (vehicle-borne).
Tahap kedua adalah upaya dari mikroba patogen untuk menginvasi ke jaringan / organ penjamu (pasien) dengan cara mencari akses masuk (port d’entrée) seperti adanya kerusakan / lesi kulit atau mukosa dari rongga hidung, mulut, orifisium uretra, dan sebagainya.
Tahap ketiga adalah mikroba patogen berkembang biak (melakukan multiplikasi) disertai dengan tindakan destruktif terhadap jaringan, walaupun ada upaya perlawanan dari penjamu. Akibatnya terjadilah reaksi infeksi yang mengakibatkan perubahan morfologis dan gangguan fisiologis jaringan.
Reaksi infeksi yang terjadi pada penjamu disebabkan adanya sifat spesifik dari mikroba patogen tersebut, yaitu (Darmadi, 2008) dan (Pratiwi, 2008) :
1. Infektivitas yaitu kemampuan mikroba patogen untuk menginvasi yang merupakan langkah awal melakukan serangan ke penjamu melalui akses masuk yang tepat dan selanjutnya mencari jaringan yang cocok untuk melakukan multiplikasi.
2. Virulensi yaitu langkah mikroba patogen untuk melakukan tindakan desturktif terhadap jaringan dengan cara menggunakan enzim perusaknya, sehingga menentukan luasnya kerusakan jaringan.
3. Antigenisitas yaitu kemampuan mikroba patogen merangsang timbulnya mekanisme pertahanan imun melalui terbentuknya antibodi. 4. Toksigenisitas yaitu kemampuan mikroba patogen dalam
5. Patogenisitas yaitu gabungan dari sifat infektivitas, virulensi, antigenisitas serta toksigenitas mikroba patogen yang dinilai sebagai derajat keganasan mikroba patogen atau respon tubuh terhadap masuknya mikroba patogen ini.
Manifestasi klinis yang timbul dapat berupa gejala (symptom) seperti demam, merasa lemah, dan terasa tidak enak (malaise), penurunan nafsu makan, dan sebagainya. Manifestasi khusus timbul berdasarkan organ yang terserang.
Berikut adalah kuman penyebab infeksi nosokomial yang sering ditemukan
Tabel 2.1. Dugaan Kuman Penyebab Infeksi Nosokomial Tahun 2000
terkena infeksi nosokomial sehubungan dengan peningkatan angka kesakitan dan angka kematian serta biaya perawatan. Secara keseluruhan angka rata-rata infeksi pada pasien yang menderita penyakit parah mencapai 40% dan mungkin lebih tinggi lagi 50% hingga 60% pada pasien yang berada di Instalasi Perawatan Intensif lebih dari lima hari (Weinstein, 1998).
Instalasi Perawatan Intensif adalah tempat di mana pasien yang sakit parah dirawat dan tingginya angka kematian. Infeksi nosokomial dan kematian di Instalasi Perawatan Intensif prevalensinya lebih tinggi dibanding tempat lainnya di rumah sakit. Penyakit yang mendasarinya, gangguan mekanisme pertahanan imun, penggunaan alat medis yang invasif, pengobatan imunosupresif, penggunaan antibiotik, dan kolonisasi kuman yang resisten menyebabkan pasien rentan terkena infeksi nosokomial. 25% infeksi yang terjadi di rumah sakit terjadi pada pasien di Instalasi Perawatan Intensif. Infeksi nosokomial di Instalasi Perawatan Intensif 5-10 kali lebih tinggi dibandinhkan unit lainnya (Trilla, 2005).
2.2. Disinfektan
Pencegahan dan pengendalian infeksi nosokomial sangat terkait dengan uapaya untuk mengeliminasi mikroba patogen. Penderita akan selalu terancam oleh kehadiran mikroba patogen yang bersarang pada benda-benda di sekitarnya, seperti peralatan medis dan non medis yang ada di ruang perawatan. Bahkan udara juga ikut memberikan kontribusi terjadinya infeksi noskomial, termasuk juga petugas yang merawat pasien (Kurniadi, 1993).
Pentingnya kesadaran akan keadaan di mana bebas dari segala mikroba patogen menyebabkan diperlukan adanya upaya untuk mengeliminasi mikroba patogen dari segala peralatan, terutama peralatan yang langsung digunakan pada prosedur atau tindakan medis serta mikroba patogen yang melekat pada petugas. Demikian juga untuk setiap prosedur atau tindakan medis / perawatan yang dilakukan pada pasien, yang akan berisiko untuk masuknya mikroba patogen ke tubuh penderita. Oleh karena itu, diperlukan adanya antiseptik dan disinfektan.
menghambat pertumbuhan atau mematikan berbagai mikroba patogen, namun memiliki aplikasi dan efektivitas yang berbeda-beda (Darmadi, 2008). Berikut adalah beberapa istilah yang perlu diketahui untuk menghindari terjadinya kerancuan :
1. Aseptik merupakan kondisi relatif aman dari mikroba patogen setelah dilakukan eliminasi terhadap mikroba patogen baik yang ada di jaringan hidup ataupun objek / benda mati.
2. Disinfeksi merupakan tindakan / upaya untuk mendestruksi atau membunuh mikroba patogen (bentuk vegetatif bukan endospora bakteri) dengan memanfaatkan bahan kimia, baik yang ada pada jaringan hidup ataupun pada benda mati.
3. Antisepsis merupakan upaya membuat kondisi bebas mikroba pada jaringan hidup dengan menggunakan bahan kimia (antiseptik) atau membuat keadaan bebas mikroba patogen pada jaringan hidup dengan cara disinfeksi.
4. Disinfektan merupakan bahan kimia untuk disinfeksi pada benda mati. 5. Antiseptik merupakan bahan kimia untuk tujuan antisepsis.
Untuk lebih memudahkan dapat dilihat gambar berikut : Jaringan hidup : menggunakan antiseptik
Disinfeksi
Benda mati : menggunakan disinfektan
Oleh karena pada penelitian ini hanya akan dilakukan uji sterilisasi pada benda mati, maka hanya akan dibahas mengenai disinfektan.
1. Mempunyai spektrum luas.
2. Daya absorpsinya rendah pada karet, zat-zat sintetis, dan bahan lainnya.
3. Tidak korosif (bereaksi secara kimiawi terhadap alat-alat medis). 4. Toksisitasnya rendah pada petugas.
5. Baunya tidak merangsang.
Peralatan medis yang telah selesai digunakan pada berbagai prosedur dan tindakan medis dapat dipastikan terkena bahan organik seperti pus, darah, potongan jaringan tubuh, serta terkontaminasi oleh mikroba patogen. Oleh karena itu diperlukan adanya tindakan disinfektan.
Sebelum proses disinfeksi dilakukan, peralatan medis harus diproses lebih dahulu melalui dua fase (Darmadi, 2008) dan (Ekawati, 2006), yaitu :
1. Fase dekontaminasi yang bertujuan untuk menginaktivasi serta mengurangi jumlah mikroba patogen yang ada serta agar peralatan medis lebih aman saat ditangani oleh petugas pada fase berikutnya (fase pembersihan). Secara teknis dikerjakan dengan merendam peralatan medis dalam larutan klorin 0.3% selama 10 menit.
2. Fase pembersihan yaitu fase pembebasan peralatan medis secara fisik dari kotoran, darah, pus, potongan jaringan tubuh yang melekat pada peralatan medis, serta mikroba patogen yang tersisa dengan cara menyikat / menggosok. Selanjutnya diikuti proses mencuci dengan larutan sabun atau deterjen, membilas dengan air bersih, serta mengeringkannya.
Setelah kedua fase ini lalu akan diikuti dengan fase disinfeksi dengan disinfektan yang digunakan diharapkan cukup efektif untuk membunuh mikroba patogen yang ada.
Efektivitas disinfektan ditentukan oleh beberapa faktor, yaitu :
2. Faktor peralatan medis seperti perlakuan pada fase sebelumnya dimana faktor pembersihan sangat penting dalam proses disinfeksi agar berlangsung optimal. Beban kandungan materi organik pada peralatan mempengaruhi beban kerja disinfektan karena ada materi organik yang mengikat zat disinfektan. Struktur fisik yang rata atau rumit mempengaruhi kerja disinfektan. Larutan mineral yang menempel pada peralatan medis ada yang dapat mengikat zat disinfektan seperti kalsium dan magnesium.
3. Lamanya kontak antara zat disinfektan dengan mikroba patogen juga mempengaruhi kerja disinfektan.
4. Tingkat keasaman dan kebasaan (pH) disinfektan mempengaruhi, ada yang bekerja optimal pada suasana asam atau basa.
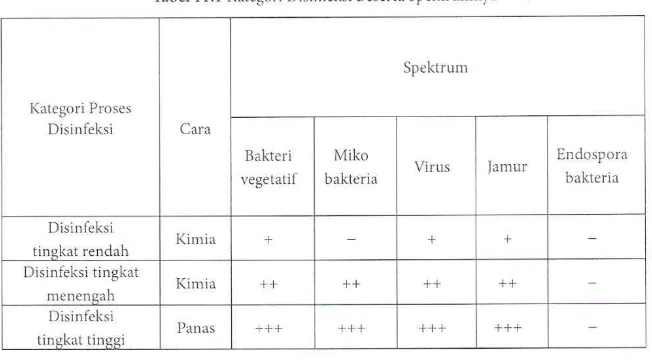
Bahan kimia disinfektan sangat berpengaruh pada unsur protein mikroba patogen. Hanya endospora yang mampu bertahan terhadap efek kimia disinfektan. Beberapa disinfektan yang banyak digunakan antara lain alkohol, klorin dan derivatnya, formaldehid, glutaraldehid, dan fenol (Pratiwi, 2008).
Alkohol yang biasa digunakan adalah etil dan isopropil alkohol dengan konsentrasi optimal 60-90%. Cukup efektif untuk membunuh semua mikroba patogen dan tidak korosif terhadap logam, namun dapat merusak bahan-bahan dari karet atau plastik. Alkohol cepat menguap sehingga waktu kontak sangat singkat, kecuali dengan merendamnya. Alkohol banyak dipakai untuk disinfektan peralatan seperti termometer oral / rektal, probe, USG, ambu bag.
Klorin dan derivatnya memiliki efek kerja yang cepat dan kemampuannya menginaktivasi mikroba cukup luas. Sangat bermanfaat untuk dekontaminasi peralatan medis, sarung tangan termasuk juga peralatan nonmedis. Dapat menyebabkan korosi bila konsentrasinya lebih dari 0.5% dengan waktu pemaparan lebih dari 20 menit.
terinaktivasi oleh materi organik. Pada konsentrasi yang tinggi bersifat karsinogenik.
Glutaraldehid merupakan derivat formaldehid, bersifat iritatif pada kulit, mata, dan pernafasan. Tidak bersifat korosif terhadap bahan metal. Baunya sangat menyengat sehingga diperlukan ventilasi ruangan yang baik. Yang sering digunakan adalah glutaraldehid 2% dengan nama dagang cidex.
Fenol umumnya digunakan untuk disinfeksi lantai, dinding, serta permukaan meja dan sebagainya. Nama dagangnya adalah lysol, kreolin.
Seiring dengan perkembangan jaman, maka bahan untuk disinfeksi tidak hanya digunakan disinfektan dari bahan kimia. Saat ini telah berkembang teknik disinfeksi dengan menggunakan energi panas (termis), yaitu melalui panasnya air (dengan direbus) dan melalui panasnya uap (dengan dikukus). Kedua cara ini disebut disinfeksi tingkat tinggi. Efektivitasnya untuk membunuh mikroba patogen lebih tinggi, namun dengan pengecualian endospora bakteri (Darmadi, 2008) dan (Ekawati, 2006).
Proses untuk disinfeksi tingkat tinggi (DTT) dengan cara merebus adalah sebagai berikut :
1. Sediakan sebuah bejana lengkap dengan tutupnya.
2. Isi dengan air dan masukkan peralatan logam dengan baik. 3. Catat ketika air mendidih dan rebus selama 20 menit.
4. Setelah selesai direbus, pindahkan peralatan yang telah di-DTT ke dalam sebuah kontainer yang telah di-DTT juga apabila tidak akan segera digunakan.
Sedangkan cara mengukus adalah sebagai berikut :
1. Sediakan satu set panci, yaitu 2-4 buah panci, panci paling bawah digunakan untuk merebus air.
3. Jumlah panci berlubang yang digunakan disesuaikan dengan kebutuhan dan panci yang teratas harus selalu memakai tutup selama dalam proses.
4. Tempatkan peralatan medis yang akan di-DTT ke dalam panci berlubang.
5. Kukus selama 20 menit, dihitung mulai saat air mendidih.
6. Pindahkan panci yang berlubang ke panci lain yang tidak berlubang agar air dapat mengalir dan ditampung, tindakan ini bertujuan untuk mempercepat proses pengeringan.
7. Pindahkan peralatan medis yang telah di-DTT ini ke dalam kontainer yang telah di-DTT juga dan peralatan tersebut telah siap digunakan.
Dengan demikian dikenal dua macam cara disinfeksi untuk peralatan medis, yaitu dengan cara kimiawi dan dengan memanfaatkan energi panas (DTT). Selain itu, juga ada pembagian lainnya, yaitu dengan melihat spektrum mikroba patogen yang akan terbunuh oleh proses disinfeksi, yaitu :
Tabel 2.2. Klasifikasi Disinfeksi
Menurut Dr. E. H. Spaulding dalam Darmadi (2008) peralatan medis / perawatan dikelompokan berdasarkan risiko infeksi yang mungkin timbul saat digunakan peralatan tersebut, yaitu :
1. Peralatan kritis, yaitu peralatan / instrumen medis yang digunakan untuk kontak dengan jaringan tubuh steril atau masuk ke dalam sirkulasi darah. Contohnya peralatan bedah, kateter jantung. Peralatan ini memerlukan metode sterilisasi secara mutlak.
2. Peralatan semikritis, yaitu peralatan medis yang kotak dengan selaput mukosa. Contohnya peralatan napas anastesi, endotracheal tube, sistoskop. Untuk peralatan ini dapat digunakan dapat didisinfeksi dengan metode sterilisasi mutlak atau dengan DTT.
2.3. Sterilisasi Di Rumah Sakit dan Metodenya
Sterilisasi merupakan suatu proses dengan metode tertentu yang mana dapat memberikan hasil akhir yaitu suatu keadaan yang tidak dapat ditemukan lagi adanya mikroorganisme hidup. Metode sterilisasi sangat banyak, namun alternatif yang dipilih tergantung pada keadaan serta kebutuhan setempat. Metode apapun harus tetap menjaga kualitas serta hasil sterilisasi. Kualitas hasil sterilisasi harus terjaga mengingat risiko kontaminasi kembali saat penyimpanan dan terutama saat akan digunakan dalam tindakan medis.
Pada bagian sebelumnya telah dijelaskan metode kimiawi dan pemanfaatan energi panas, namun kedua metode tersebut tidak dapat mengeliminasi endospora bakteri. Untuk peralatan medis kritis diperlukan metode sterilisasi tingkat tinggi dimana endospora bakteri juga tidak boleh ditemukan. Metode sterilisasi tingkat tinggi tersebut akan dibicarakan pada bagian ini. Jumlah dan jenis peralatan medis kritis yang digunakan oleh berbagai unit di rumah sakit sangat banyak dan harus tersedia setiap saat selama 24 jam penuh. Semakin banyak kegiatan medis yang memanfaatkan peralatan ini, semakin tinggi juga kegiatan sterilisasi yang harus dilakukan. Kegiatan sterilisasi ini memiliki unit pelaksanaan tersendiri yaitu Central Sterile Supply Department (CSSD) atau Instalasi Sterilisasi Sentral (ISS) (Nasra, 2007). Dengan adanya unit kerja ini, maka terdapat stradardisasi prosedur kerja dan jaminan mutu hasil sterilisasi. Garis besar kegiatan CSSD / ISS secara berurutan adalah sebagai berikut (Darmadi, 2008) :
1. Dekontaminasi, yaitu peralatan medis yang terkontaminasi didisinfeksi terlebih dahulu untuk meminimalisasi jenis dan jumlah mikroba patogen yang ada.
2. Pembersihan yaitu peralatan medis dibersihkan untuk membebaskan materi organik yang menempel seperti darah, jaringan tubuh, dan sebagainya kemudian dilanjutkan dengan proses pengeringan.
4. Proses sterilisasi, yaitu peralatan medis yang telah terbungkus / terkemas selanjutnya menjalani sterilisasi sesuai dengan metode yang telah dipilih.
5. Penyimpanan, yaitu setelah selesai proses sterilisasi peralatan medis disimpan dan harus dijaga kualitas sterilitasnya.
6. Pendistribusian, yaitu peralatan medis yang siap dipakai selanjutnya didistribusikan ke unit-unit yang memerlukannya.
Pemilihan metode sterilisasi berdasarkan berbagai kriteria, yaitu sebagai berikut :
1. Mudah pengoperasiannya / pelaksanaannya, namun harus tetap efektif. 2. Waktu pemaparan yang relatif pendek.
3. Tidak mempengaruhi / merusak peralatan medis.
4. Biaya yang murah, baik saat investasi ataupun pemeliharaannya. 5. Aman bagi petugas pelaksana.
Berikut beberapa metode sterilisasi, yaitu metode uap panas bertekanan tinggi, metode panas kering, dan metode gas kimia (Darmadi, 2008).
Metode uap panas bertekanan tinggi mempunyai prinsip dasar berupa uap panas pada suhu, tekanan, dan waktu pemaparan yang efektif membunuh mikroba patogen dengan cara denaturasi protein enzim dan membran sel mikroba. Peralatan yang digunakan adalah sebuah bejana dengan tutupnya yang dilengkapi dengan manometer, termometer, termostat, dan pengatur tekanan sehingga suhu dan tekanan uap panas dapat diatur. Sterilisator dengan metode uap panas disebut autoclave, dengan cara kerja sebagai berikut :
1. Peralatan medis seperti instrumen, sarung tangan, linen dimasukkan dalam kamar (chamber) dan diletakkan di atas rak-rak yang tersedia. 2. Uap panas yang berasal dari pemanasan air dialirkan ke dalam kamar
(chamber) sehingga mendesak udara di dalam kamar. Pemanasan air dilanjutkan hingga 121oC karena adanya kenaikan tekanan.
4. Setelah 20 atau 30 menit, katup pengatur tekanan dibuka sehingga tekanan uap menurun dan diikuti dengan penurunan suhu.
Metode ini banyak digunakan karena aman, efektif, dan mudah pelaksanaannya. Ada tiga jenis autoclave, perbedaannya terletakpada durasi / waktu sterilisasi :
1. Autoclave kilat (Quick Autoclave)
2. Autoclave gaya berat (Gravity Displacement Autovlave) 3. Autoclave pervacum
Metode panas kering memiliki prinsip dasar yaitu melalui mekanisme konduksi, panas akan diabsorpsi oleh permukaan luar dari peralatan yang disterilkan. Lalu panas akan merambat ke bagian yang lebih dalam dari peralatan tersebut sampai suhu untuk sterilisasi tercapai dengan merata. Mikroba terbunuh dengan cara oksidasi, di mana protein mikroba akan mengalami koagulasi. Sterilisasi ini memakai udara panas pada oven, sebuah bejana yang udara di dalamnya harus dipanaskan dengan cara :
1. Pemanasan udara dalam oven dengan gas atau listrik dapat mencapai suhu 160-180oC.
2. Durasi untuk sterilisasi 1-2 jam karena daya penetrasinya tidak sebaik uap panas.
3. Digunakan untuk sterilisasi alat-alat dari gelas seperti tabung reaksi, labu, cawan petri.
Metode ini banyak digunakan dan mudah, namun memerlukan energi yang lebih besar.
Metode gas kimia memakai etilen oksida membunuh mikroba melalui reaksi kimia yaitu reaksi alkilisasi di mana terjadi penggantian gugus atom hidrogen sel mikroba dengan gugus alkil sehingga mengganggu metabolisme dan reproduksi sel. Proses sterilisasi menggunakan autoclave pada suhu 36-60oC serta konsentrasi gas <400 mg/liter. Prosesnya sebagai berikut :
2. Setelah selesai pemaparan dengan gas etilen dioksida dilanjutkan tahap aerasi / pertukaran udara yaitu membuang gas etilen oksida pada sterilisator dan peralatan medis.
Metode ini digunakan untuk sterilisasi peralatan medis dari plastik, alat-alat optik, pacemaker, dan alat-alat lain yang sulit disterilkan dengan metode lain. Afinitas gas ini sangat tinggi hingga bisa timbul residu pada peralatan medis sehingga dapat timbul iritasi pada kulit dan mukosa karena bersifat toksik.
Selain gas etilen oksida dapat digunakan juga formaldehid yang membunuh mikroba dengan cara mengikat gugus asam amino dari protein mikroba. Digunakan formaline autoclave pada suhu 70oC. Masukkan peralatan medis lalu alirkan gas formaldehid ke dalam kamar dengan konsentrasi 15 mg/m3. Metode ini hanya untuk sterilisasi yang terbatas seperti kateter, sarung tangan, dan sebagainya. Gas formaldehid baunya sangat menyengat dan dapat menyebabkan iritasi pada kulit, mata, dan saluran napas.
BAB 3
KERANGKA KONSEP DAN DEFINISI OPERASIONAL
3.1. Kerangka Konsep
Pengambilan swab dan diinokulasikan pada Blood agar dan Mc’Conkey dari peralatan medis di Instalasi Perawatan Intensif RSUP. H. Adam Malik Medan
Kultur dengan dieramkan pada 37oC selama 24 jam
Identifikasi bentuk bakteri dengan pewarnaan gram
Identifikasi spesies dengan menumbuhkan bakteri pada media MSA dan EMB serta uji reaksi biokimia
Uji kepekaan antibiotika dengan metode difusi
Bakteri dikelompokkan berdasarkan jumlah dan tempat ditemukannya serta kepekaannya terhadap antibiotika
3.2. Variabel / Definisi Operasional Definisi Operasional :
terus-menerus, dan kegiatan pendukung kehidupan serta terapi pasti pada penderita dengan penyakit / kondisi yang mengancam kehidupan. 2. Swab merupakan suatu cara untuk mengambil sampel bakteri dengan
menggoreskan kapas lidi steril pada objek (peralatan medis). Pada penelitian ini swab diambil satu kali untuk setiap peralatan.
3. Peralatan medis merupakan segenap peralatan yang digunakan dalam proses asuhan keperawatan pasien, peralatan medis yang dijadikan sampel dalam pemelitian ini adalah peralatan medis yang sedang digunakan pasien.
4. Kultur merupakan pembiakan kuman dengan menggunakan media yang sesuai.
5. Pewarnaan gram merupakan cara untuk mengidentifikasi bakteri dengan mewarnai bakteri menggunakan zat warna dasar (counter stain).
6. Identifikasi spesies merupakan suatu cara untuk mengetahui spesies dari bakteri yang ditemukan baik dengan menumbuhkan bakteri pada media yang selektif ataupun menggunakan uji reaksi biokimia. Media MSA untuk menumbuhkan bakteri kokus, sedangkan media EMB untuk menumbuhkan bakteri batang.
7. Uji kepekaan merupakan suatu cara untuk melihat sensitivitas kuman terhadap antibiotik tertentu. Uji kepekaan dengan metode difusi, yaitu menggunakan cakram amtibiotik untuk menghambat pertumbuhan bakteri.
BAB 4
METODE PENELITIAN
4.1. Jenis Penelitian
Dalam penelitian ini, peneliti menggunakan metode penelitian survei (Survey Research Method). Penelitian tidak dilakukan terhadap seluruh objek / populasi, namun peneliti hanya akan mengambil sebagian dari keseluruhan objek / populasi yang dapat mewakili keseluruhan objek / populasi. Perwakilan dari objek / populasi ini disebut sampel. Dalam penelitian survei, hasil dari penelitian tersebut harus dapat digeneralisasi untuk keseluruhan populasi sehingga hasil penelitian menunjukkan hasil dari keseluruhan populasi.
Metode survei ini terbagi atas beberapa jenis lagi, yaitu penelitian yang bersifat deskriptif dan yang bersifat analitik. Dalam penelitian ini digunakan jenis penelitian deskriptif. Dalam penelitian survei deskriptif, penelitian bertujuan untuk mendeskripsikan atau menguraikan suatu keadaan di dalam komunitas atau dalam masyarakat (Notoadmojo, 2005).
4.2. Waktu dan Tempat Penelitian
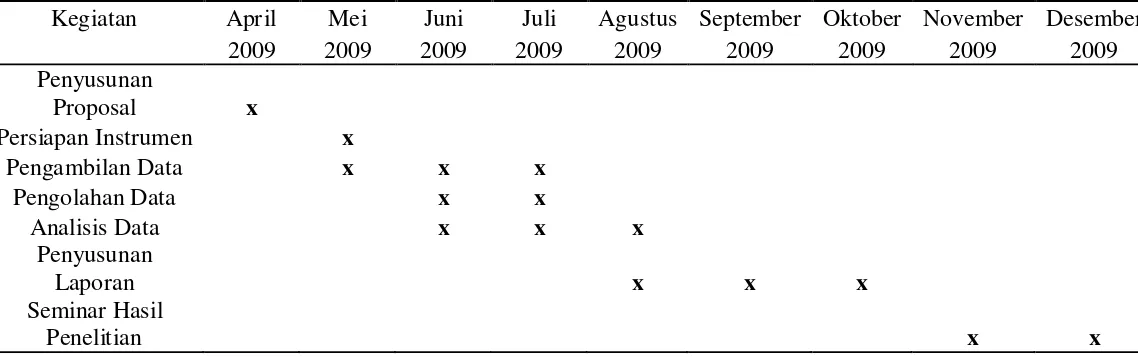
Berikut adalah jadwal kegiatan penelitian :
Tabel 4.1. Waktu Penelitian
Kegiatan April Mei Juni Juli Agustus September Oktober November Desember
2009 2009 2009 2009 2009 2009 2009 2009 2009
Tempat dilakukan penelitian adalah di Instalasi Perawatan Intensif Dewasa RSUP. H. Adam Malik Medan. Peneliti memilih RSUP. H. Adam Malik sebagai tempat dilakukannya penelitian karena RSUP. H. Adam Malik merupakan rumah sakit rujukan yang banyak menerima pasien dengan berbagai macam kasus, termasuk yang memerlukan perawatan intensif. Oleh karena itu, kesempatan untuk terjadi infeksi nosokomial di Instalasi Perawatan Intensif cukup tinggi.
4.3. Populasi dan Sampel
Intensif dewasa. Jumlah titik pengambilan sampel tergantung pada jumlah pasien yang dirawat dan banyaknya peralatan medis yang digunakan.
4.4. Teknik Pengumpulan Data
Mikroorganisme dapat ditemukan di lingkungan sekitar kita, baik di udara atau di air, di permukaan sebuah benda, pakaian, meja, di tanah, di lantai, di mukosa, dan lain sebagainya. Intinya mikroorganisme dapat kita temukan di mana saja di lingkungan sekitar kita. Di rumah sakit, di mana pasien-pasien rentan harus diproteksi terhadap infeksi nosokomial, konsentrasi dan distribusi mikroorganisme yang ada di lingkungan sekitar adalah suatu hal yang sangat penting. Monitoring secara berkala sterilitas lingkungan perlu dilakukan sebagai salah satu upaya pengendalian infeksi nosokomial (Morello dkk, 2002).
Peralatan yang dibutuhkan : 1. Nutrient agar plates
Gambar 4.1. Nutrient Agar Plates
2. Sterile swabs
Gambar 4.2. Sterile Swabs
1. Sebelum memulai pengambilan sampel, bagi agar plate menjadi beberapa bagian dengan dilabel menggunakan spidol. Hal ini bertujuan untuk menghemat penggunaan agar plate apabila jumlah agar plate tidak banyak. Pada penelitian ini media yang digunakan adalah blood agar dan media mc’conkey.
2. Lembabkan swab pada agar yang tersedia. Ketika akan menarik keluar swab dari agar plate tekan swab pada dinding dari dalam plate untuk memeras kelebihan cairan.
3. Ambil kultur dari tempat yang diinginkan seperti tempat tidur dengan menggosok dan memutar swab, dengan luas area minimal 10 cm2. 4. Buat goresan dengan menggunakan swab tersebut. Jangan lupa untuk
menandai setiap label dengan nama peralatan yang diswab.
Gambar 4.3. Cara Penggoresan Pada Medium Kultur
5. Lalu eramkan dalam inkubator 37oC selama 24 jam.
6. Setelah keesokan harinya buatlah pewarnaan gram lalu lakukan pengamatan mikroskopis dari pewarnaan tersebut.
4.5. Pengolahan dan Analisa Data
Sebelum dilakukan pewarnaan, sediaan yang mengadung bakteri terlebih dahulu difiksasi (dilekatkan) pada permukaan gelas objek yang bersih dan bebas dari lemak. Fiksasi ini harus dilakukan dengan baik agar hasil pewarnaan mudah diamati dengan mikroskop, yaitu bakteri tersebar secara merata, tidak terlalu tebal, tidak terdapat kotoran lain yang berasal dari gelas objek dan sediaan bakteri tidak terhapus atau terbuang pada prosedur pewarnaan yang akan dilakukan.
Berikut tata cara fiksasi menurut Utama, dkk (2006):
1. Bersihkan gelas objek dengan kain bersih agar tidak berlemak atau dapat juga dengan melayangkan gelas objek di atas api.
2. Dinginkan gelas objek dan beri label dengan spidol.
3. Teteskan satu tetes akuades atau garam faal pada gelas objek.
4. Pijarkan ose / sengkelit dan dinginkan sebentar. Lalu ambil sediaan yang akan diperiksa dengan ose tersebut dan suspensikan dengan akuades atau garam faal tadi. Sebarkan seluas 1-2 cm2. Pijarkan kembali ose yang telah digunakan untuk mengambil sediaan.
5. Keringkan sediaan dengan membiarkannya di udara dan lewatkan di atas api sebanyak tiga kali dengan sisi yang terdapat sediaan menghadap ke atas sehingga tidak terkena api.
6. Perhatikan ketika mengambil koloni untuk sediaan jangan sampai terambil medianya. Usahakan agar sediaan merata dan tidak tebal. Teknik pelaksanaan pewarnaan gram menurut Utama, dkk (2006) :
1. Ambil sediaan yang sudah terfiksasi.
2. Tuangkan zat warna ungu kristal hingga menggenangi sediaan. Yang biasa dipakai adalah ungu kristal (1 menit) atau karbol-gentian violet (5 menit).
3. Cuci dengan air kran selama 5-10 detik.
4. Genangi kembali dengan larutan lugol selama 1 menit. 5. Cuci dengan air kran selama 5-10 detik.
6. Bilas dengan alkohol 96% selama 30 detik atau aseton alkohol selama 10 detik dan jika dengan aseton selama 3 detik.
8. Genangi dengan fuchsin-air atau safranin selama 1-2 menit. 9. Cuci dengan air kran lalu keringkan.
10.Sediaan siap diperiksa di bawah mikroskop.
Setelah dilakukan pewarnaan gram, maka dilakukan pemeriksaan mikroskopis dengan mikroskop untuk menentukan bentuk bakteri apakah berbentuk batang atau kokus. Selanjutnya, untuk bakteri yang berbentuk kokus akan dikultur kembali dengan menggunakan media MSA (Mannitol Salt Agar). MSA merupakan agar yang selektif dan digunakan untuk membedakan spesies Staphylococcus dengan spesies Micrococcus. Media ini mengandung 7,5% garam yang berfungsi untuk menyeleksi mikroorganisme yang dapat tumbuh pada lingkungan yang tinggi kadar garamnya. Perubahan warna menjadi kuning mengindikaasikan adanya perubahan pH menjadi lebih asam yang merupakan tanda adanya fermentasi manitol. Warna merah menandakan tidak ada fermentasi manitol. Staphylococcus aureus mengubah agar menjadi warna kuning, sedangkan Staphylococcus albus tidak mengubah warna agar (tetap berwarna merah).
a. Positif (kuning) tanpa gas : Staphylococcus aureus b. Positif dengan gas : Eschericia coli, Proteus vulgaris c. Negatif : Pseudomonas aeruginosa
2. Fermentasi laktosa :
a. Positif (kuning) tanpa gas : Staphylococcus aureus b. Positif dengan gas : Eschericia coli
c. Negatif : Pseudomonas aeruginosa, Proteus vulgaris 3. Fermentasi sukrosa :
a. Positif (kuning) tanpa gas : Staphylococcus aureus b. Positif dengan gas : Proteus vulgaris
c. Negatif : Eschericia coli dan Pseudomonas aeruginosa
Pada tes Indol organisme diinokulasikan ke dalam media yang berisi tryptone yang kaya akan asam amino triptofan. Tes indol positif apabila mikroorganisme dapat memproduksi triptofanase yang memecah triptofan menghasilkan indol dan produk lainnya. Ketika reagen kovac dimasukkan, maka akan terbentuk warna merah jambu gelap. Tes indol harus dibaca dalam 48 jam inkubasi karena indol dapat terdegradasi apabila diinkubasin terlalu lama (Norman, 2005 ; Reynolds, 2002).
acetyl-methyl red akan menghasilkan warna pink berarti tes VP positif (Reynolds, 2002).
Tes sitrat menggunakan media simmon sitrat untuk melihat apakah bakteri dapat tumbuh menggunakan sitrat sebagai sumber karbon dan energi. Media ini mengandung brothymol blue sebagai indicator pH (6-7,6). Brothymol blue akan berwarna kuning pada pH sekitar 6 dan akan berubah menjadi biru pada pH lebih alkali sekitar 7,6.
Tes urease digunakan untuk melihat adanya enzim urease yang dapat memecah urea menjadi ammonia. Amonia bersifat basa sehingga akan meningkatkan pH. Perubahan pH ini dapat dideteksi dengan fenol merah, perubahan dari kuning menjadi pink menandakan tes positif, tidak ada perubahan warna menandakan tes negative (Norman,2005).
Triple Sugar Iron digunakan untuk melihat apakah dihasilkan hydrogen disulfide dari fermantasi dari glukosa, laktosa, dan sukrosa. Perubahan warna menjadi hitam ketika indikator dimasukkan menandakan adanya hydrogen disulfide (Norman, 2005).
Tabel 4.2. Hasil Uji Triple Sugar Iron
Warna Slant Interpretasi
Merah
Tidak memfermentasi laktosa dan sukrosa
Kuning memfermentasi laktosa dan sukrosa
Warna Butt Interpretasi
Merah Tidak memfermentasi glukosa
Kuning Memfermentasi glukosa dan dihasilkan pH yang asam
Pembentukan gas
adanya retakan, gelembung, atau terdesaknya bagian slant ke atas
Hitam diproduksi hidrogen disulfida
Uji kepekaan / uji resistensi bertujuan untuk mengetahui apakah suatu bakteri peka (sensitif) atau tidak peka (resisten) terhadap suatu antimikroba sehingga dalam pengobatan suatu penyakit infeksi dapat dipilih suatu antimikroba yang sensitif untuk mengatasi infeksi tersebut. Pada uji kepekaan, ditentukan Kadar Hambat Minimum (KHM) dan Kadar Bakterisidal Minimum (KBM) untuk mengetahui apakah suatu antimikroba menghambat pertumbuhan bakteri (bakteriostatik) atau mematikan bakteri (bakterisidal). Namun, pada penelitian ini peneliti tidak menentukan KHM dan KBM. Peneliti hanya melihat kepekaan dari antibiotik.
Terdapat beberapa cara uji kepekaan bakteri terhadap antimikroba, yaitu cara pengenceran (dilution method) / cara kuantitatif dan cara difusi (diffusion method) / cara kualitatif. Cara pengenceran ada yang memakai media cair (broth) dan ada yang memakai media padat, sedangkan cara difusi ada yang memakai kertas cakram dan ada yang memakai tablet. Pada penelitian ini dipakai cara difusi karena dibandingkan dengan cara pengenceran lebih mudah dan murah (Utama dkk, 2006).
Untuk mendapatkan hasil yang akurat perlu diperhatikan ketebalan media, jumlah bakteri yang disemai, jarak antara cakram antimikroba, dan hal lainnya. Berikut prosedur pelaksanaan uji kepekaan bakteri terhadap antimikroba dengan cara difusi :
1. Siapkan lempeng agar (Mueller Hinton Agar), tebal lempeng agar lebih kurang 4 mm dan bisa disimpan pada suhu 4oC. Bila permukaan agar basah, keringkan dulu dengan memasukkannya ke dalam inkubator 37oC selama setengah jam.
2. Gunakan ose / sengkelit untuk mengambil bakteri dari koloninya dan masukkan ke dalam tabung reaksi yang berisi medium cair NaCl dan eramkan selama 30 menit pada suhu 36o-37oC. Gunakan standar Mc’Farlan untuk melihat apakah bakteri yang kita tumbuhkan dalam media cair ini sudah cukup atau kurang.
dalam tabung reaksi. Semaikan pada permukaan medium agar hingga rata (dioleskan 2 arah). Atau dengan cara lain yaitu menggenangi lempeng agar dengan medium cair yang berisi bakteri dan isap kelebihan cairan dengan pipet isap steril. Biarkan lempeng agar tersebut mengering selama 3-5 menit (tidak boleh lebih dari 15 menit). 4. Letakkan cakram antimikroba di atas permukaan lempeng agar dengan
pinset steril atau dengan alat / dispenser khusus untuk itu. Tekan sedikit cakram agar melekat dengan baik pada permukaan lempeng agar. Lalu eramkan pada suhu 37oC selama 18-24 jam.
5. Daerah di sekitar cakram yang tidak ditumbuhi bakteri (terlihat bersih) diukur dengan alat kaliper (jangka sorong atau milimeter). Ukur lebar daerah inhibisi disekitar cakram untuk menentukan peka, kurang peka, atau resisten.
BAB 5
HASIL PENELITIAN DAN PEMBAHASAN
5.1. Hasil Penelitian
5.1.1. Deskripsi Lokasi Penelitian
5.1.2. Deskripsi Peralatan yang Dijadikan Sampel
Tabel 5.1. Deskripsi Peralatan Medis
Peralatan medis Jumlah Selang Ventilator 4
Selang Infus 4
Mesin EKG 4
Mesin Ventilator 2 Kateter Urin 2 Ranjang Kosong 2 Lemari Obat 1
Botol Obat 3
Meja Dorong 1 Pendingin Udara 2 Alat Sensitisasi 1
Suction 1
5.1.3. Bakteri yang Ditemukan
Dari koloni-koloni yang tumbuh dan dilakukan pewarnaan gram ditemukan adanya bakteri kokus pada 20 sediaan. Untuk membedakan spesies kokus tersebut, maka bakteri kokus tersebut ditumbuhkan lagi pada agar MSA (Manitol Salt Agar) dan ditemukan Staphylococcus aureus pada 10 sediaan dan Staphylococcus albus pada 10 sediaan. Berikut adalah gambar pertumbuhan Staphylococcus aureus (merah jambu) dan Staphylococcus albus (kuning) pada agar MSA.
Gambar 5.1. Pertumbuhan Staphylococcus aureus dan Staphylococcus
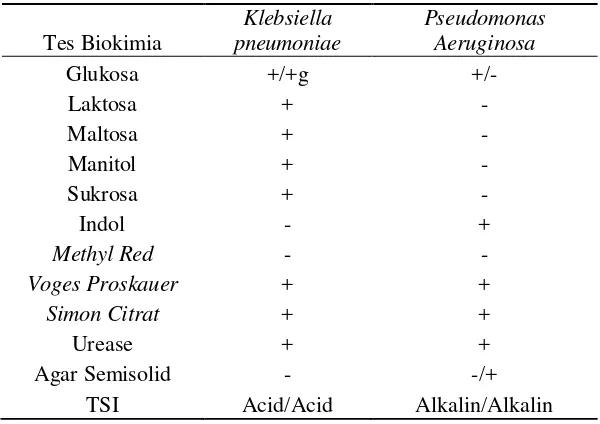
Dari hasil pewarnaan gram yang dilakukan ditemukan adanya bakteri batang pada 14 sediaan. Dari 14 sediaan tersebut 13 sediaan adalah Bacillus subtilis dan terdapat 2 sediaan yang dicurigai adalah spesies batang yang lain oleh karena itu dilakukan uji reaksi biokimia untuk melihat spesies dari bakteri batang yang ditemukan. Secara makroskopis dilihat dari koloni bakteri batang yang tumbuh di media EMB (Eosin Methylen Blue) terlihat adanya koloni yang berlendir yang merupakan tanda khas dari Klebsiella pneumoniae. Setelah dilaklukan uji reaksi biokimia yang ditemukan adalah Pseudomonas aeruginosa dan Klebsiella pneumoniae. Berikut adalah hasil uji reaksi biokimia yang dilakukan :
Tabel 5.2.Hasil uji reaksi biokimia
Tes Biokimia
TSI Acid/Acid Alkalin/Alkalin
Tabel 5.3. Urutan bakteri dan jamur terbanyak yang ditemukan pada peralatan
medis di IPI Dewasa RSUP. H. Adam Malik
Selang Ventilator Selang Infus Monitor EKG Mesin Ventilator
Staphylococcus albus Staphylococcus aureus Bacillus subtilis
Staphylococcus albus Staphylococcus
aureus Bacillus subtilis Staphylococcus aureus
Bacillus subtilis Staphylococcus albus Aspergillus sp
Aspergillus sp Aspergillus sp Staphylococcus albus
Klebsiella
pneumoniae Pseudomonas aeruginosa
Kateter Urin Ranjang Kosong Lemari Obat Botol Obat
Staphylococcus albus
Staphylococcus
aureus Bacillus subtilis Staphylococcus albus
Aspergillus sp Bacillus subtilis Aspergillus sp Aspergillus sp
Bacillus subtilis
Meja Dorong Pendingin Udara Alat Sensitisasi Suction
Staphylococcus
albus Bacillus subtilis
Staphylococcus
Tabel 5.4. Persentase Bakteri yang ditemukan
Spesies Jumlah yang ditemukan dari 26 sampel Persentase
Bacillus subtilis 13 50%
Staphylococcus albus 10 38,46%
Staphylococcus aureus 10 38,46%
Aspergillus sp 9 34,6%
Klebsiella pneumoniae 1 3,8%
Pseudomonas
5.1.4. Hasil Uji Kepekaan Antibiotik
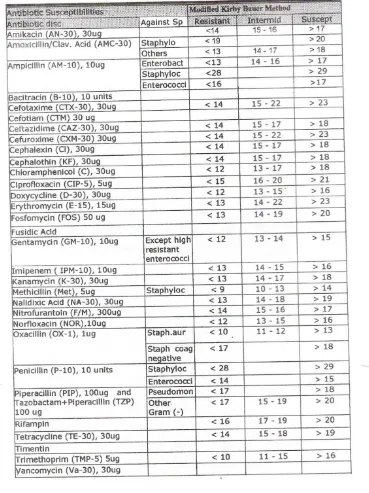
Dari hasil uji kepekaan antibiotik dengan metode difusi terhadap 24 jenis antibiotik (22 jenis antibiotik untuk bakteri kokus dan 13 jenis antibiotik untuk bakteri batang), didapatkan hasil sebagai berikut :
Tabel 5.5. Hasil uji kepekaan antibiotik terhadap bakteri kokus
Antibiotik
Chloramphenicole 2 3
Piperacilline 3 3
Tabel 5.6. Hasil uji kepekaan antibiotik terhadap bakteri batang
Antibiotik
Pseudomonas
aeruginosa Klebsiella pneumoniae
Clindamycin x x
Chloramphenicole 1 1
Piperacilline x x 2 = hampir resisten
3 = resisten
X = tidak dilakukan uji kepekaan
Dari 24 jenis antibiotik terdapat beberapa antibiotik yang sudah resisten, antibiotik tersebut adalah ampicillin, amoxicillin, methicillin, azithromycin, oxacillin, chloramphenicole, piperacillin, cefepime, tetracycline, cefotaxime, dan sulfametoxazole. Sedangkan, ceftazidime sudah hampir resisten.
5.2. Pembahasan Hasil Penelitian 5.2.1. Bakteri yang Ditemukan
Dari tabel 5.3 pada peralatan-peralatan medis peneliti menemukan bahwa Bacillus subtilis adalah mikroorganisme yang paling banyak peneliti temukan. Bacillus subtilis ditemukan pada 13 sampel dari 26 sampel atau 50%. Pada urutan kedua dan ketiga adalah bakteri kokus, yaitu Staphylococcus albus dan Staphylococcus aureus yang masing-masing ditemukan pada 10 sampel dari 26 sampel atau sekitar 38,46 %. Pada urutan keempat, mikroorganisme yang ditemukan bukanlah bakteri melainkan jamur. Jamur yang ditemukan adalah Aspergillus sp sebanyak 9 sampel dari 26 sampel atau sekitar 34,6%. Urutan kelima dan keenam adalah Klebsiella pneumoniae dan Pseudomonas aeruginosa yang masing-masing ditemukan pada 1 sampel dari 31 sampel atau 3,2%.
Dari hasil penelitian ini, mikroorganisme yang paling banyak ditemukan adalah bakteri. Bakteri terbanyak yang ditemukan adalah Bacillus subtilis, dimana bakteri ini adalah bakteri kontaminan yang biasa dapat ditemukan di debu. Bakteri ini normalnya tidak tergolong patogen pada manusia, namun pada pasien-pasien dengan penurunan sistem imun, bakteri ini dapat masuk ke dalam tubuh dan menyebabkan septicemia. Sedangkan, di urutan kedua dan ketiga terdapat bekteri golongan kokus, yaitu Staphylococcus albus dan Staphylococcus aureus. Staphylococcus albus tidak bersiat patogen pada manusia dan biasanya merupajan flora normal pada mukosa mulut dan juga hidung. Staphylococcus aureus merupakan bakteri yang patogen pada manusa dan menyebabkan infeksi yang menghasilkan pus. Pada urutan keempat ditemukan adanya jamur yaitu Aspergillus sp , jamur ini sangat mudah ditemukan di alam dan tersebar di mana-mana. Pada orang yang mengalami penurunan sistem imun jamur ini dapat menyebabkn infeksi lokal maupun sistemik. Pada urutan kelima dan keenam ditemukan Klebsiella pneumoniae dan Pseudomona aeruginosa. Kedua bakteri batang ini merupakan patogen yang banyak menyebabkan infeksi nosokomial pada orang yang mengalami imunosupresi.
peneliti menemukan yang terbanyak adalah bakteri yang bersifat kontaminan dan kurang patogen terhadap manusia , sedangkan pada penelitian di tempat yang berbeda, banyak ditemukan bakteri yang bersifat patogen dan banyak menyebabkan infeksi nosokomial. Ditemukannya bakteri yang bersifat kontaminan seperti Bacillus subtilis dan Aspergillus sp menunjukkan bahwa ruangan tersebut tidaklah steril, hal ini dapat dilihat dari banyaknya debu yang ditemukan pada peralatan medis. Tidak adekuatnya kebijakan untuk menjaga sterilitas ruangan menjadi pemicu utama penyebab hadirnya bakteri-bakteri tersebut. Keluarga pasien serta mahasiswa yang bebas keluar masuk ruangan merupakan penyebab dari penyebaran bakteri dari luar ruangan ke dalam serta bakteri yang berasal dari tubuh pengunjung sendiri. Ditemukannya bakteri-bakteri yang bersifat patogen menunjukkan bahwa peralatan-peralatan medis yang dipasang pada pasien tidak diganti secara berkala sehingga terjadi kolonisasi bakteri dan dapat menjadi pemicu bagi terjadinya infeksi baik infeksi local maupun infeksi sistemik.
Perbedaan-perbedaan antara pola bakteri yang ditemukan pada penelitian ini dengan penelitian di tempat lain dapat menunjukkan perbedaan dalam kebijakan rumah sakit. Tidak adanya bakteri kontaminan yang ditemukan menunjukkan bahwa sterilitas ruangan sudah baik, hanya saja peralatan medis mungkin tidak diganti secara berkala sehingga terjadi kolonisasi bakteri.
5.2.2. Hasil Uji Kepekaan Antibiotik
Dari 24 jenis antibiotik yang diuji kepekaannya, 12 jenis antibiotik masih sensitif, 11 jenis antibiotik resisten, dan 1 jenis antibiotik hampir resisten. Berikut antibiotik yang telah resisten (lihat tabel 5.4 dan 5.5) :
2. Staphylococcus albus : ampicillin, amoxicillin, kanamycin, methicillin, gentamycin, azithromycin, penicillin, oxacillin, piperacillin, cefepime, tetracycline, cefotaxime. Sedangkan, erythromycin dan chloramphenicole sudah hampir resisten.
3. Pseudomonas aeruginosa : ampicillin, amoxicillin, cefepime, cefotaxime.
4. Klebsiella pneumoniae : ampicillin, amoxicillin, cefepime, cefotaxime, sulfometoxazole. Sedangkan, ceftazidime sudah hampir resisten.
Pemakaian antibiotik merupakan salah satu terapi yang paling sering diberikan pada Instalasi Perawatan Intensif. Penggunaan antibiotik banyak menimbulkan resistensi mikroorganisme terhadap antibiotik tersebut. Oleh karena itu, mencegah pemakaian antibiotik yang tidak diperlukan dan mengoptimalisasi penggunaan anti mikroba dapat memberikan hasil yang bagus pada pasien dan mengurangi terjadinya resistensi. Adanya program untuk memantau penggunaan antibiotik dan efektivitasnya di Instalasi Perawatan Intensif sangat penting untuk mencegah terjadinya resistensi. Terdapat langkah-langkah pencegahan resistensi mulai dari pencegahan infeksi, mendiagnosa dan mengobati dengan efektif, menggunakan antibiotik dengan benar, dan mencegah transmisi/penularan penyakit.
Untuk mencegah terjadinya infeksi dapat dilakukan pemberian vaksinasi dan mencegah penggunaan kateter atau peralatan invasive lainnya secara berlamaan. Dalam mendiagnosa seorang pasien, kita harus bisa dengan tepat mendeteksi penyakit yang diderita oleh pasien serta berdiskusi dengan para ahli dalam mengobati suatu penyakit. Dalam menggunakan antibiotik dengan benar terdapat beberapa hal yang perlu diperhatikan :
1. Lakukan pengontrolan dalam menggunakan antibiotik 2. Gunakan data-data yang ada mengenai sensitivitas antibiotik 3. Obati infeksi bukan kontaminasi
Microbial culture result
Kolonisasi Patogen
Tidak berbahaya Sensitif Resisten
BAB 6
KESIMPULAN DAN SARAN
6.1. Kesimpulan
1. Setelah dilakukan uji sterilitas terhadap peralatan medis di instalasi perawatan intensif RSUP. H. Adam Malik ditemukan keseluruhan peralatan medis tersebut dalam keadaan tidak steril dan juga udara di ruangan tersebut tidak steril.
2. Mikroorganisme yang terbanyak ditemukan adalah bakteri yaitu Bacillus subtilis, Staphylococcus albus, Staphylococcus aureus, Klebsiella pneumonia, dan Pseudomonas aeruginosa. Pada penelitian ini, ditemukan juga jamur, yaitu Aspergillus sp.
3. Dari hasil uji kepekaan antibiotik dari 24 jenis antibiotik, yaitu 22 jenis antibiotik untuk bakteri kokus dan 13 jenis antibiotik untuk bakteri batang ditemukan 9 jenis antibiotik telah resisten terhadap bakteri kokus dan 4 jenis antibiotik telah resisten terhadap bakteri batang.
6.2. Saran
Bagi Instalasi Perawatan Intensif RSUP. H. Adam Malik :
1. Perlu dilakukan suatu program untuk memeriksa secara berkala sterilitas dari ruang perawatan di IPI.
2. Gunakanlah hasil antibiotik secara rasional sesuai dengan hasil uji kepekaan.
3. Adanya pemantauan dalam penggunaan antibiotik dan efektivitasnya. 4. Hentikan penggunaan antibiotik yang telah resisten.
5. Hindari penggubaab alat medis invasif secara berlamaan.
DAFTAR PUSTAKA
Darmadi. 2008. Infeksi Nosokomial : Problematika Dan Pengendaliannya. Jakarta : Penerbit Salemba Medika
Ekawati, R., 2006. Prinsip Pencegahan Infeksi. Jakarta : Universitas Gunadarma. Available from :
retno_ekawaty.staff.gunadarma.ac.id/Downloads/files/11254/PRINSIP+P ENCEGAHAN+INFEKSI.ppt
Encyclopedia Britannica. 2009. Encyclopedia Britannica Online. Available from : Farid. 2007. Infeksi Nosokomial Masalah Serius bagi Pengelola Rumah Sakit.
Jakarta :Rumah Sakit Pelni. Available from :
Jawetz, E. et al. 1996. Mikrobiologi Klinik. Jakarta : Penerbit Buku Kedokteran EGC
Khan, Z. U., et al. 2000. Bilateral Pulmonary Aspergilloma Caused by an Atypical Isolate of Aspergillus terreus. Kuwait : Department of Microbiology Kuwait University. Available from :
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC86655/
Kurniadi, H. 1993. Upaya Pencegahan Infeksi Nosokomial di RS Mitra Keluarga. Jakarta. Jakarta : Rumah Sakit Mitra Keluarga. Available from :
Lipalosaan. P., Alakokko. T., Lavila. J., 2006. Intensive Care Acquired Infection is An Independent Risk Factor for Hospital Mortality. Jakarta : Critical Care. Available from : http://www.ccform.com/content/10/2/1266
Morello, J. A., Mizer, H. E., Granato, P. A., 2002. Laboratory Manual and Workbook in Microbiology : Application to Patient Care. 7th ed. USA: the McGraw Hill Companies
Nasra. 2007. Central Sterile Supply Department Activity. Sultanate of Oman : Ministry of Health. Available from :
http://www.royalhospital.med.om/index.php?option=com_content&task=v iew&id=97&Itemid=76
Norman, Lourdes. 2005. Biochemical test for identifying unknown. Available from :
Notoadmojo, S. 2005. Metodologi Penelitian Kesehatan. Edisi revisi. Jakarta : Penerbit Rineka Cipta
Paterson, D.L. et al. 2002. Community-Acquired Klebsiella pneumoniae Bacteremia: Global Differences in Clinical Patterns. Available from : http://www.cdc.gov/ncidod/eid/vol8no2/01-0025.htm
Pratiwi, S. T. 2008. Mikrobiologi Farmasi. Jakarta: Penerbit Erlangga
Reynolds, Jackie. 2002. Biochemical Test Media for Laboratory Unknown Identification. Richardland College, Dallas Texas : Math and Science Division. Available from :