PEMERIKSAAN KADAR ETAMBUTOL DALAM PLASMA DARAH PASIEN TB MENGGUNAKAN KROMATOGRAFI CAIR
KINERJA TINGGI
SKRIPSI
OLEH:
DESI DEWI NATALIA HUTAJULU NIM 071524012
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PEMERIKSAAN KADAR ETAMBUTOL DALAM PLASMA DARAH PASIEN TB MENGGUNAKAN KROMATOGRAFI CAIR
KINERJA TINGGI SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
DESI DEWI NATALIA HUTAJULU NIM 071524012
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Pembimbing II,
(Prof. Dr. M. Timbul Simanjuntak, M.Sc., Apt.) NIP 19521204198002 1001
LEMBAR PENGESAHAN SKRIPSI
PEMERIKSAAN KADAR ETAMBUTOL DALAM PLASMA DARAH PASIEN TB MENGGUNAKAN KROMATOGRAFI CAIR
KINERJA TINGGI OLEH:
DESI DEWI NATALIA HUTAJULU NIM 071524012
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara
Pada Tanggal : September 2010
Medan, September 2010 Fakultas Farmasi Universitas Sumatera Utara
Dekan,
(Prof. Dr. Sumadio Hadisahputra., Apt.) NIP. 195311281983031002 Pembimbing I,
(Drs.David Sinurat, M.Si., Apt) NIP 194912281978031002
Panitia Penguji,
(Dr. Karsono, Apt.)
NIP 195409091982011001
(Drs. David Sinurat, M.Si., Apt.) NIP 194912281978031002
(Drs. Muchlisyam, M.Si., Apt.) NIP 195006221980021001
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa yang telah melimpahkan anugerah dan kemurahanNya sehingga penulis dapat menyelesaikan skripsi yang berjudul "Pemeriksaan Kadar Etambutol Dalam Plasma Darah Pasien TB Menggunakan kromatografi Cair Kinerja Tinggi". Skripsi ini diajukan sebagai salah satu syarat guna memperoleh gelar Sarjana Farmasi dari Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis hendak menyampaikan rasa hormat dan terimakasih yang sebesar-besarnya kepada Bapak Drs. David Sinurat, M.Si., Apt. dan Bapak Prof. Dr. M. Timbul Simanjuntak, M.Sc., Apt. yang telah banyak memberikan bimbingan dan bantuan selama penelitian dan penulisan skripsi ini berlangsung. Ucapan terimakasih juga penulis sampaikan kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt. selaku Dekan Fakultas Farmasi Universitas Sumatera Utara dan dosen pembimbing akademik yang telah memberikan fasilitas, bimbingan dan masukan selama masa pendidikan dan penelitian, juga kepada Bapak Dr. Karsono, Apt., Bapak Drs. Muchlisyam, M.Si., Apt dan Bapak Drs. Saiful Bahri, MS, Apt., selaku dosen penguji yang telah memberikan masukan dalam penyusunan skripsi ini.
PEMERIKSAAN KADAR ETAMBUTOL DALAM PLASMA DARAH PASIEN TB MENGGUNAKAN KROMATOGRAFI CAIR
KINERJA TINGGI
Abstrak
Tuberkulosis adalah penyakit infeksi yang disebabkan oleh Mycobacterium tuberculosis. Etambutol adalah salah satu obat yang dikonsumsi oleh pasien pada pengobatan fase intensif.
Dalam penelitian ini, pemeriksaan kadar etambutol dalam plasma darah pasien TB secara Kromatografi Cair Kinerja Tinggi (KCKT) metode fase balik menggunakan kolom ODS C18, dan sistem elusi isokratik, fase gerak yang digunakan campuran buffer fosfat pH 7,4 dengan asetonitril perbandingan fase gerak 90 : 10 dengan laju alir 0,8 ml/menit, dan pengukuran dilakukan pada panjang gelombang 202 nm dengan detektor ultraviolet. Etambutol terelusi pada waktu retensi 18,107 menit. Batas deteksi dan batas kuantifikasi berturut-turut adalah 0,0936 mM dan 0,2838 mM.
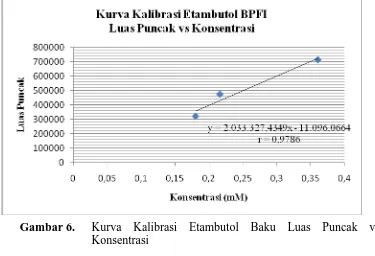
Luas puncak dengan berbagai konsentrasi diperoleh persamaan regresi Y = 2033327,435X -11096,066 dengan koefisien korelasi (r) = 0,9786.
Berdasarkan pada pemeriksaan ini, maka kadar etambutol dalam plasma darah pasien tuberkulosis adalah sebesar 0,2946 mM.
Kata kunci: Pemeriksaan kadar, Etambutol, Kromatografi Cair Kinerja Tinggi
EXAMINATION OF ETAMBUTOL LEVEL IN BLOOD PLASMA OF TUBERCULOSIS PATIENT BY HIGH PERFORMANCE LIQUID
CHROMATOGRAPHY
Abstract
Tuberculosis is a disease an infectious caused Mycobacterium tuberculosis. Etambutol is one of drug that consumed by the patient in the intensive phase of treatment.
In this research, examination of etambutol in blood plasma of TB patient by High Perfomance Liquid Chromatography (HPLC) method reversed phase using C18 ODS column, and an isocratic solvent programme, mobile phase was the mixture of phosphate buffer pH 7,4 with asetonitril ratio 90:10 at the flow rate 0,8 ml/minute, and measuring is done at wavelength 202 nm with ultraviolet detector. Etambutol was eluted at 18,107 min. Limit of detection and limit of quantitation are 0,0936 mM and 0,2838 mM, respectively.
Peak area with several concentration is got regression aquation Y= 2033327,435X-11096,066 with correlation coefficient (r) = 0,9786.
Based on this examination, the level of etambutol in blood plasma of tuberculosis patient is 0,2946 mM.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
BAB I PENDAHULUAN ... 1
1.1Latar Belakang ... 1
1.2Perumusan Masalah ... 3
1.3Hipotesis ... 4
1.4Tujuan Penelitian ... 4
1.5Manfaat Penelitian ... 4
1.6Alur Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Tuberkulosis ... 6
2.2 Etambutol Hidroklorida ... 7
2.3 Monitoring Terapi Obat ... 8
2.5 Kromatografi ... 12
2.6 Kromatografi Cair Kinerja Tinggi ... 15
2.6.1 Cara Kerja KCKT ... 15
2.6.2 Komponen KCKT ... 16
2.6.2.1 Wadah Fase Gerak pada KCKT ... 16
2.6.2.2 Fase Gerak pada KCKT ... 17
2.6.2.3 Pompa pada KCKT ... 18
2.6.2.4 Injektor ... 18
2.6.2.5 Kolom ... 19
2.6.2.6 Fase Diam pada KCKT ... 19
2.6.2.7 Detektor ... 20
2.6.3 Elusi Gradien dan Isokratik ... 21
BAB III METODOLOGI PENELITIAN ... 22
3.1Alat ... 22
3.2Bahan ... 22
3.3Pengambilan Sampel ... 23
3.4Rancangan Penelitian ... 23
3.4.1Penyiapan Bahan ... 23
3.4.1.1Pembuatan Plasma Darah Pasien TB ... 23
3.4.1.2Pembuatan Plasma Kontrol ... 23
3.4.1.3Pembuatan Pereaksi ... 24
3.4.1.3.1Aqua Bebas CO2 ... 24
3.4.1.3.4Buffer Fosfat pH 7,4 ... 24
3.4.1.4Pembuatan Fase Gerak ... 24
3.4.1.5Pembuatan Larutan Induk Baku Etambutol ... 25
3.4.2Prosedur Analisis ... 25
3.4.2.1Penyiapan Alat KCKT ... 25
3.4.2.2Penentuan Garis Alas (Base Line) ... 25
3.4.2.3Penyuntikan Fase Gerak ... 25
3.4.2.4Penyuntikan Plasma Kontrol ... 26
3.4.2.5Analisis Kualitatif ... 26
3.4.2.6Analisis Kuantitatif ... 27
3.4.2.6.1Penentuan Linearitas Kurva Kalibrasi Baku Pembanding Etambutol ... 27
3.4.2.6.2Pemeriksaan Kadar Etambutol Dalam Plasma Darah Pasien TB ... 28
3.4.3Penentuan Batas Deteksi dan Batas Kuantifikasi ... 28
BAB IV HASIL DAN PEMBAHASAN ... 30
BAB V KESIMPULAN DAN SARAN ... 36
5.1Kesimpulan ... 36
5.2Saran ... 36
DAFTAR PUSTAKA ... 37
DAFTAR GAMBAR
Halaman Gambar 1. Struktur Rumus Bangun Etambutol ... 7
Gambar 2. Kurva Serapan Etambutol Baku 1000 ppm Secara
Spektrofotometri UV ... 30 Gambar 3. Kromatogram Hasil Penyuntikan Etambutol Baku ... 31 Gambar 4. Kromatogram Hasil Penyuntikan Sampel ... 33 Gambar 5. Kromatogram Hasil Penyuntikan Sampel yang telah di-spike dengan Larutan Baku Pembanding Etambutol
untuk Uji Kualitatif ... 34 Gambar 6. Kurva Kalibrasi Etambutol Baku Luas Puncak versus
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Gambar Alat KCKT dan Syringe 50 μl ... 39
Lampiran 2 Gambar Perangkat Penelitian Lainnya ... 40
Lampiran 3 Plasma Kontrol ... 44
Lampiran 4 Fase Gerak ... 45
Lampiran 5 Kromatogram Penyuntikan Larutan Etambutol Baku, Fase Gerak Buffer Fosfat pH 7,4 : Asetonitril (90 : 10) ... 46
Lampiran 6 Kromatogram Penyuntikan Plasma Kontrol ... 47
Lampiran 7 Kromatogram Penyuntikan Sampel Darah Pasien TB ... 48
Lampiran 8 Kromatogram Penyuntikan Sampel Darah Pasien TB yang telah di-Spike dengan Larutan Baku Pembanding Etambutol ... 49
Lampiran 9 Kromatogram Penyuntikan Larutan Etambutol Baku Pada Pembuatan Kurva Kalibrasi ... 50
Lampiran 10 Perhitungan Persamaan Regresi dan Kurva kalibrasi Etambutol Baku yang diperoleh secara KCKT pada λ 202 nm ... 53
Lampiran 11 Perhitungan Konsentrasi Obat Etambutol ... 55
Lampiran 12 Perhitungan Batas Deteksi dan Batas Kuantifikasi Etambutol 56
Lampiran 13 Data Pasien ... 57
Lampiran 14 Sertifikat Analisis Etambutol ... 58
Lampiran 15 Surat Persetujuan Komisi Etik ... 59
Lampiran 16 Pembuatan Plasma dari Sampel Darah pasien TB ... 60
Lampiran 17 Pembuatan Plasma Kontrol ... 61
Lampiran 18 Pembuatan Larutan Induk Baku Etambutol ... 62
Lampiran 20 Pembuatan Linearitas Kurva Kalibrasi Baku
Pembanding Etambutol ... 64 Lampiran 21 Pemeriksaan Kadar Etambutol dalam Plasma Darah
PEMERIKSAAN KADAR ETAMBUTOL DALAM PLASMA DARAH PASIEN TB MENGGUNAKAN KROMATOGRAFI CAIR
KINERJA TINGGI
Abstrak
Tuberkulosis adalah penyakit infeksi yang disebabkan oleh Mycobacterium tuberculosis. Etambutol adalah salah satu obat yang dikonsumsi oleh pasien pada pengobatan fase intensif.
Dalam penelitian ini, pemeriksaan kadar etambutol dalam plasma darah pasien TB secara Kromatografi Cair Kinerja Tinggi (KCKT) metode fase balik menggunakan kolom ODS C18, dan sistem elusi isokratik, fase gerak yang digunakan campuran buffer fosfat pH 7,4 dengan asetonitril perbandingan fase gerak 90 : 10 dengan laju alir 0,8 ml/menit, dan pengukuran dilakukan pada panjang gelombang 202 nm dengan detektor ultraviolet. Etambutol terelusi pada waktu retensi 18,107 menit. Batas deteksi dan batas kuantifikasi berturut-turut adalah 0,0936 mM dan 0,2838 mM.
Luas puncak dengan berbagai konsentrasi diperoleh persamaan regresi Y = 2033327,435X -11096,066 dengan koefisien korelasi (r) = 0,9786.
Berdasarkan pada pemeriksaan ini, maka kadar etambutol dalam plasma darah pasien tuberkulosis adalah sebesar 0,2946 mM.
Kata kunci: Pemeriksaan kadar, Etambutol, Kromatografi Cair Kinerja Tinggi
EXAMINATION OF ETAMBUTOL LEVEL IN BLOOD PLASMA OF TUBERCULOSIS PATIENT BY HIGH PERFORMANCE LIQUID
CHROMATOGRAPHY
Abstract
Tuberculosis is a disease an infectious caused Mycobacterium tuberculosis. Etambutol is one of drug that consumed by the patient in the intensive phase of treatment.
In this research, examination of etambutol in blood plasma of TB patient by High Perfomance Liquid Chromatography (HPLC) method reversed phase using C18 ODS column, and an isocratic solvent programme, mobile phase was the mixture of phosphate buffer pH 7,4 with asetonitril ratio 90:10 at the flow rate 0,8 ml/minute, and measuring is done at wavelength 202 nm with ultraviolet detector. Etambutol was eluted at 18,107 min. Limit of detection and limit of quantitation are 0,0936 mM and 0,2838 mM, respectively.
Peak area with several concentration is got regression aquation Y= 2033327,435X-11096,066 with correlation coefficient (r) = 0,9786.
Based on this examination, the level of etambutol in blood plasma of tuberculosis patient is 0,2946 mM.
BAB I PENDAHULUAN
1.1 Latar Belakang
Diperkirakan sekitar sepertiga penduduk dunia telah terinfeksi oleh Myobacterium tuberculosis. Pada tahun 1995, diperkirakan 95% kasus TB dan 98% kematian akibat TB di dunia, terjadi pada negara-negara berkembang (Anonima, 2006).
Indonesia sebagai negara ke-3 terbesar di dunia dalam jumlah penderita TB setelah India dan Cina telah berkomitmen mencapai target dunia dalam penanggulangan tuberkulosis (Anonima, 2006).
Resistensi merupakan masalah utama dalam pengobatan tuberkulosis (Zubaidi, 2001). Masalah pada penyakit ini disebabkan jumlah penderitanya yang banyak dan penyebaran penyakitnya yang mudah (melalui kuman yang dibatukkan oleh penderita ke udara). Selain itu masalah yang terpenting adalah tingkat kepatuhan penderita terhadap pengobatan yang rendah. Hal ini timbul karena umumnya penderita menghentikan pengobatannya ketika mereka sudah tidak merasakan gejala penyakitnya dan menganggap bahwa penyakitnya telah sembuh, padahal penyakit ini memerlukan pengobatan jangka panjang yang teratur (Ekonoruliyanto, 2008).
disembuhkan dengan obat–obat ini. Walaupun demikian, kadang terpaksa digunakan obat lain yang kurang efektif karena pertimbangan resistensi atau kontraindikasi pada penderita. Antituberkulosis sekunder adalah etionamid, paraaminosalisilat, sikloserin, amikasin, kapreomisin, dan kanamisin (Zubaidi, 2001).
M. Tuberculosis sensitif terhadap etambutol. Etambutol tidak efektif untuk kuman lain. Obat ini tetap menekan pertumbuhan kuman tuberkulosis yang telah resisten terhadap isoniazid. Kerjanya menghambat sintesis metabolit sel sehingga metabolisme sel terhambat sel mati. Karena itu obat ini hanya aktif terhadap sel yang bertumbuh dengan khasiat tuberkulostatik (Zubaidi, 2001). Etambutol merupakan serbuk putih yang stabil pada temperatur kamar. Untuk mengetahui stabilitasnya telah dilakukan penelitian stabilitas in vitro pada temperatur 30oC, 40oC, dan 70oC oleh Chuluq, dkk (2004). Diperoleh bahwa kadar etambutol pada penyimpanan selama 7 hari tidak berubah atau stabil.
kemampuan elusi menurun dengan meningkatnya polaritas pelarut. Fase gerak yang paling sering digunakan untuk pemisahan dengan fase terbalik adalah campuran larutan bufer dengan metanol atau campuran air dengan asetonitril. Fase diam yang paling populer digunakan adalah oktadesilsilan (ODS atau C18) dan kebanyakan pemisahannya adalah fase terbalik (Gandjar, 2007).
Pemeriksaan etambutol dalam plasma darah pasien TB menggunakan kromatografi cair kinerja tinggi dengan fase gerak buffer fosfat pH 7,4 : asetonitril (90 : 10) berdasarkan fase gerak buffer fosfat pH 7,4 dan metanol (96,8 : 3,2) (Revankar, et.al., 1994). Penulis melakukan modifikasi fase gerak dimulai dengan buffer fosfat pH 7,4 : metanol (96,8 : 3,2), buffer fosfat pH 7,4 : metanol (94 : 6), buffer fosfat pH 7,4 : metanol (80 : 20), kemudian menggunakan fase gerak buffer fosfat pH 7,4 : asetonitril (95 : 5),dan buffer fosfat pH 7,4 : asetonitril (90 :10).
Berdasarkan uraian di atas maka penulis tertarik melakukan penelitian untuk mengetahui kadar etambutol dalam tubuh pasien TB menggunakan KCKT.
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas perumusan masalah penelitian yaitu: 1. Apakah pemeriksaan kadar etambutol dalam plasma darah pasien TB
dapat dilakukan secara KCKT menggunakan kolom ODS C18 dengan fase gerak campuran buffer fosfat pH 7,4 : asetonitril (90 : 10)?
1.3 Hipotesis
Berdasarkan perumusan masalah diatas maka dibuat hipotesis sebagai berikut:
1. Kadar etambutol dalam plasma darah pasien TB dapat diperiksa secara KCKT menggunakan kolom ODS C18 dengan fase gerak campuran buffer fosfat pH 7,4 : asetonitril (90 : 10).
2. Etambutol dalam plasma darah pasien TB berada dalam keadaan stabil pada temperatur kamar.
1.4 Tujuan Penelitian
Tujuan dilakukan penelitian ini yaitu:
1. Untuk memeriksa kadar etambutol dalam plasma darah pasien TB secara KCKT menggunakan kolom ODS C18 dengan fase gerak campuran buffer fosfat pH 7,4 : asetonitril (90 : 10).
2. Untuk mengetahui stabilitas etambutol dalam plasma darah pasien TB pada temperatur kamar.
1.5 Manfaat Penelitian
1.6 Alur Penelitian
Obat TB Diberikan Pasien Penderita TB Diambil Darah Pasien TB
Plasma Darah Diukur
Alat KCKT Dianalisis
BAB II
TINJAUAN PUSTAKA 2.1 Tuberkulosis
Tuberkulosis, singkatnya TBC, adalah suatu penyakit menular yang paling sering (sekitar 80%) terjadi di paru-paru. Penyebabnya adalah suatu basil Gram-positif tahan-asam dengan pertumbuhan sangat lamban, yakni Mycobacterium tuberculosis (dr. Robert Koch, 1882). Gejala TBC antara lain batuk kronik,
demam, berkeringat waktu malam, keluhan pernapasan, perasaan letih, malaise, hilang nafsu makan, turunnya berat badan, dan rasa nyeri di bagian dada. Dahak penderita berupa lendir (mucoid), purulent, atau mengandung darah. Setelah terjadi infeksi melalui saluran pernafasan, di dalam gelembung paru (alveoli) berlangsung reaksi peradangan setempat dengan timbulnya benjolan benjolan kecil (tuberkel) (Tjay dan Rahardja, 2002).
Pengobatan infeksi kuman tahan asam masih merupakan persoalan dan tantangan dalam bidang kemoterapi. Menurut Zubaidi (2001), faktor yang mempersulit pengobatan ialah :
1. Kurangnya daya tahan hospes terhadap mikobakteria. 2. Kurangnya daya bakterisid obat yang ada.
2.2 Etambutol Hidroklorida (Ditjen POM, 1995)
CH2OH H
CH3CH2 C NHCH2CH2NH C CH2CH3 .2HCl
H CH2OH
Gambar 1. Struktur rumus bangun etambutol (+)-2,2’-(Etilenadiimino)-di-1- butanol dihidroklorida [1070-11-7]
Rumus Molekul : C10H24N2O2.2HCl
BM : 277,23
Pemerian : Serbuk hablur, putih
Kelarutan : Mudah larut dalam air, larut dalam etanol, sukar larut dalam eter dan dalam kloroform
Derivat etilendiamin ini berkhasiat spesifik terhadap M. Tuberculosa, tetapi tidak terhadap bakteri lain. Mekanisme kerjanya berdasarkan penghambatan sintesa RNA pada kuman yang sedang membelah, juga menghindarkan terbentuknya mycolic acid pada dinding sel (Tjay dan Rahardja, 2002).
dapat berperan sebagai depot etambutol yang kemudian melepaskannya sedikit demi sedikit ke dalam plasma (Zubaidi, 2001).
Etambutol jarang menimbulkan efek samping. Dosis harian sebesar 15 mg/kgBB menimbulkan efek toksik yang minimal. Pada dosis ini kurang dari 2% penderita akan mengalami efek samping yaitu penurunan ketajaman penglihatan, ruam kulit, dan demam. Efek samping lain ialah pruritis, nyeri sendi, gangguan saluran cerna, malaise, sakit kepala, pening, bingung, dan mungkin juga halusinasi. Rasa kaku dan kesemutan di jari sering terjadi (Zubaidi, 2001).
Efek sampingnya yang terpenting adalah neuritis optica (radang saraf mata) yang mengakibatkan gangguan penglihatan, antara lain kurang tajamnya penglihatan dan buta warna terhadap merah–hijau. Reaksi toksis ini baru timbul pada dosis besar (di atas 50 mg/kg/hari) dan bersifat reversibel bila pengobatan segera dihentikan, tetapi dapat menimbulkan kebutaan bila pemberian obat dilanjutkan. Sebaiknya, jangan diberikan kepada anak kecil, karena kemungkinan gangguan penglihatan (visus) sulit dideteksi. Dianjurkan untuk memeriksakan mata secara periodik, terutama kepekaannya terhadap warna (Tjay dan Rahardja, 2002).
2.3 Monitoring Terapi Obat
Pemantauan konsentrasi obat dalam darah atau plasma meyakinkan bahwa dosis yang telah diperhitungkan benar-benar telah melepaskan obat dalam plasma dalam kadar yang diperlukan untuk efek terapetik. Untuk beberapa obat, kepekaan reseptor pada individu berbeda, sehingga pemantauan kadar obat dalam plasma diperlukan untuk membedakan penderita yang menerima terlalu banyak
obat dan penderita yang sangat peka terhadap obat (Shargel, 1988).
Tujuan dari proses pemantauan terapi obat adalah menyesuaikan terapi
obat pada karakteristik pasien individu, memaksimalkan manfaat dan meminimalkan risiko. Respon terhadap terapi obat adalah suatu fenomena yang kompleks dan dipengaruhi oleh obat yang digunakan pasien yang diterimanya dari dokter yang menulisnya. Sifat-sifat biofarmasi, farmakologi, dan farmakokinetik sangat penting dipertimbangkan. Sekarang ini, telah diterima bahwa ada rentang konsentrasi plasma optimal yang di dalamnya diharapkan efek terapi dapat terjadi pada kebanyakan pasien yang menerima obat tertentu. Jika konsentrasi plasma melewati rentang terapi optimal tersebut, suatu konsentrasi toksik minimal tercapai yang pada konsentrasi itu efek samping atau toksik yang tidak diinginkan dapat berkembang secara klinik pada kebanyakan pasien (Siregar dan Endang, 2004).
Berbagai sifat farmakokinetik seperti absorpsi, distribusi, metabolisme, ekskresi, dan durasi kerja harus dipertimbangkan apabila mendesain suatu
regimen obat (Siregar dan Endang, 2004). Faktor pasien seperti umur, kelamin, bobot tubuh, penyakit, fungsi ginjal
merupakan variabel penting untuk dipertimbangkan dalam menyeleksi terapi obat
dan pemantauan respon pasien (Siregar dan Endang, 2004). Status penyakit pasien merupakan faktor penting lain untuk
dipertimbangkan, apabila memantau terapi. Misalnya, adalah penting untuk memantau konsentrasi plasma secara berhati –hati pada pasien dengan penyakit
ginjal dan mengadakan penyesuaian dosis yang tepat (Siregar, dan Endang, 2004). Pemantauan konsentrasi obat dalam plasma memungkinkan untuk
penyesuaian dosis obat secara individual dan juga untuk mengoptimasi terapi. Dengan adanya perubahan fungsi fisiologik sehubungan dengan penyakit, pemantauan konsentrasi obat dalam plasma dapat memberikan petunjuk untuk kemajuan keadaan penyakit dan memungkinkan peneliti mengubah dosis obat yang lebih sesuai. Namun demikian, secara klinik keputusan dan pengamatan medik adalah paling penting sebagai keputusan terapi dan jangan semata–mata didasarkan pada konsentrasi obat dalam plasma (Shargel, 1988).
2.4 Darah dan Plasma
Plasma darah merupakan bagian cair darah. Cairan ini didapat dengan membuat darah tidak beku dan sel darah disentrifugasi. Serum darah adalah cairan
bening yang memisah setelah darah dibekukan (Mutschler, 1999). Darah cair atau plasma darah adalah cairan darah berbentuk
butiran-butiran darah. Di dalamnya terkandung benang-benang fibrin/fibrinogen yang berguna untuk menutup luka yang terbuka. Menurut anonimb (2009), isi kandungan plasma darah manusia:
1. Gas oksigen, nitrogen dan karbondioksida. 2. Protein seperti fibrinogen, albumin dan globulin. 3. Enzim.
4. Antibodi. 5. Hormon. 6. Urea. 7. Asam urat.
8. Sari makanan dan mineral seperti glukosa, gliserin, asam lemak, asam amino, kolesterol.
2.5 Kromatografi
Kromatografi didefenisikan sebagai prosedur pemisahan zat terlarut oleh suatu proses migrasi diferensial dinamis dalam sistem yang terdiri dari dua fase atau lebih, salah satu diantaranya bergerak secara berkesinambungan dalam arah tertentu dan didalamnya zat–zat itu menunjukkan perbedaan mobilitas disebabkan adanya perbedaan dalam adsorbsi, partisi, kelarutan, tekanan uap, ukuran molekul atau kerapatan muatan ion. Teknik kromatografi umum membutuhkan zat terlarut terdistribusi diantara dua fase, satu diantaranya diam (fase diam), yang lainnya bergerak (fase gerak). Fase gerak membawa zat terlarut melalui media, sehingga zat tersebut terpisah dari zat terlarut lain, yang terelusi lebih awal atau lebih akhir. Umumnya zat terlarut dibawa melewati media pemisah oleh aliran suatu pelarut berbentuk cairan atau gas yang disebut eluen (Ditjen POM, 1995).
Berdasarkan fase gerak, yang dapat berupa zat cair atau gas, kita dapat menggolongkan kromatografi menjadi kromatografi cair (KC) dan kromatografi gas (KG). Berdasarkan fase diam, yang dapat berupa zat cair atau zat padat, kita dapat menggolongkan kromatografi menjadi kromatografi partisi dan kromatografi jerap (Gritter, 1991).
Menurut Gandjar, (2007), kromatografi dapat dibedakan atas berbagai macam tergantung atas pengelompokannya. Berdasarkan pada mekanisme pemisahannya, kromatografi dibedakan menjadi:
5. Kromatogarfi eksklusi ukuran 6. Kromatografi afinitas
Berdasarkan pada alat yang digunakan, kromatografi dapat dibagi atas: 1. Kromatografi kertas
2. Kromatografi lapis tipis
3. Kromatografi cair kinerja tinggi 4. Kromatografi gas
Pemakaian Kromatografi
Menurut Gritter (1991), pemakaian kromatografi ada tiga yaitu :
1. Pemakaian untuk tujuan kualitatif mengungkapkan ada atau tidak adanya senyawa tertentu dalam cuplikan
2. Pemakaian untuk tujuan kuantitatif menunjukkan banyaknya masing-masing komponen campuran
3. Pemakaian untuk tujuan preparatif untuk memperoleh komponen campuran dalam jumlah memadai dalam keadaan murni
Puncak Asimetri
Baik tailing maupun fronting tidak dikehendaki karena dapat menyebabkan pemisahan kurang baik dan data retensi kurang reprodusibel (Gandjar, 2007). Menurut Gandjar, (2007), adanya puncak, yang asimetri dapat disebabkan oleh hal-hal berikut:
2. Interaksi yang kuat antara solut dengan fase diam dapat menyebabkan solut sukar terelusi sehingga dapat menyebabkan terbentuknya puncak yang mengekor.
3. Adanya kontaminan dalam sampel yang dapat muncul terlebih dahulu sehingga menimbulkan puncak mendahului (fronting).
Untuk menentukan tingkat asimetri puncak dilakukan dengan menghitung faktor asimetri atau disebut juga dengan tailing factor (TF) yang dinyatakan dengan rasio antara lebar setengah tinggi puncak. Kromatogram yang memberikan harga TF =1 menunjukkan bahwa kromatogram tersebut bersifat setangkup atau simetris. Harga TF > 1 menunjukkan bahwa kromatogram mengalami pengekoran (tailing). Semakin besar harga TF maka kolom yang dipakai semakin kurang efisien. Dengan demikian harga TF dapat digunakan untuk melihat efisiensi kolom kromatografi (Gandjar,2007).
2.6 Kromatogarafi Cair Kinerja Tinggi
Kromatografi cair kinerja tinggi atau KCKT atau biasa juga disebut dengan HPLC (High Perfomance Liquid Chromatography) dikembangkan pada akhir tahun 1960-an dan awal 1970-an. KCKT paling sering digunakan untuk: menetapkan kadar senyawa-senyawa tertentu seperti asam amino, asam-asam nukleat, dan protein-protein dalam cairan fisiologis, menentukan kadar senyawa-senyawa aktif obat, produk hasil samping proses sintesis, atau produk-produk degradasi dalam sediaan farmasi; memonitor sampel-sampel yang berasal dari lingkungan; memurnikan senyawa dalam suatu campuran; memisahkan polimer dan menentukan distribusi berat molekulnya dalam suatu campuran; kontrol kualitas; dan mengikuti jalannya reaksi sintetis (Gandjar, 2007).
2.6.1 Cara Kerja KCKT
Kromatografi merupakan teknik yang mana solut atau zat-zat terlarut terpisah oleh perbedaan kecepatan elusi, dikarenakan solut-solut ini melewati suatu kolom kromatografi. Pemisahan solut-solut ini diatur oleh distribusi dalam fase gerak dan fase diam. Penggunaan kromatografi cair membutuhkan penggabungan secara tepat dari berbagai macam kondisi operasional seperti jenis kolom, fase gerak, panjang dan diameter kolom, kecepatan alir fase gerak, suhu kolom, dan ukuran sampel (Gandjar, 2007).
melalui katup. Linarut terbawa ke dalam kolom, dipisahkan, dan keluar dalam efluen melalui detektor (Gritter, 1991).
Secara teori, pemisahan kromatografi yang paling baik akan diperoleh jika fase diam mempunyai luas permukaan sebesar-besarnya, jadi memastikan kesetimbangan yang baik antara fase. Persyaratan kedua agar pemisahan baik ialah fase gerak bergerak dengan cepat sehingga difusi sekecil-kecilnya. Untuk memperoleh permukaan fase diam yang luas, pada sebagian besar situasi kromatografi, maka penyerap atau penyangga berupa serbuk halus. Untuk memaksa fase gerak bergerak cepat melalui fase diam yang terbagi pada serbuk halus harus digunakan tekanan tinggi (Gritter, 1991).
2.6.2 Komponen KCKT
2.6.2.1Wadah Fase Gerak pada KCKT
Wadah fase gerak harus bersih dan lembam (inert). Wadah pelarut kosong ataupun labu laboratorium dapat digunakan sebagai wadah fase gerak. Fase gerak sebelum digunakan harus dilakukan degassing (penghilangan gas) yang ada pada fase gerak, sebab adanya gas akan berkumpul dengan komponen lain terutama di pompa dan detektor sehingga akan mengacaukan analisis. Pada saat membuat pelarut untuk fase gerak, maka sangat dianjurkan untuk menggunakan pelarut bufer, dan reagen dengan kemurnian yang sangat tinggi, dan lebih terpilih lagi jika pelarut-pelarut yang akan digunakan untuk KCKT berderajat KCKT (HPLC grade). Adanya pengotor dalam reagen dapat menyebabkan gangguan pada sistem
2.6.2.2Fase Gerak pada KCKT
Fase gerak atau eluen biasanya terdiri atas campuran pelarut yang dapat bercampur yang secara keseluruhan berperan dalam daya elusi dan resolusi. Untuk fase normal (fase diam lebih polar darpada fase gerak), kemampuan elusi meningkat dengan meningkatnya polaritas pelarut. Sementara untuk fase terbalik (fase diam kurang polar daripada fase gerak), kemampuan elusi menurun dengan meningkatnya polaritas pelarut (Gandjar, 2007).
Pada kromatografi cair, susunan pelarut atau fase gerak merupakan salah satu peubah yang mempengaruhi pemisahan. Berbagai macam pelarut dipakai dalam semua ragam KCKT, tetapi ada beberapa sifat yang diinginkan yang berlaku umum.
Menurut Edward dan Stevenson, (1991), fase gerak haruslah: a. Murni, tanpa cemaran.
b. Tidak bereaksi dengan kemasan. c. Sesuai dengan detektor.
d. Dapat melarutkan cuplikan.
e. Mempunyai viskositas yang rendah.
f. Memungkinkan memperoleh kembali cuplikan dengan mudah, jika diperlukan.
g. Harganya wajar.
2.6.2.3 Pompa pada KCKT
Pompa yang cocok digunakan untuk KCKT adalah pompa yang mempunyai syarat sebagaimana syarat wadah pelarut yakni pompa harus inert terhadap fase gerak. Bahan yang umum dipakai untuk pompa adalah gelas, baja tahan karat, Teflon, dan batu nilam. Pompa yang dgunakan sebaiknya mampu memberikan tekanan sampai 5000 psi dan mampu mengalirkan fase gerak dengan kecepatan alir 3 ml/ menit. Untuk tujuan preparatif, pompa yang digunakan harus mampu mengalirkan fase gerak dengan kecepatan 20 ml/menit (Gandjar, 2007).
Tujuan penggunaan pompa atau sistem penghantaran fase gerak adalah untuk menjamin proses penghantaran fase gerak berlangsung secara tepat, reprodusibel, konstan, dan bebas dari gangguan. Ada 2 jenis pompa dalam KCKT yaitu: pompa dengan tekanan konstan, dan pompa dengan aliran fase gerak yang konstan (Gandjar, 2007).
2.6.2.4 Injektor
Cuplikan harus dimasukkan ke dalam pangkal kolom (kepala kolom), diusahakan agar sesedikit mugkin terjadi gangguan pada kemasan kolom. Menurut Edward dan Stevenson (1991), ada tiga ragam utama injektor:
dipakai pada tekanan sampai 60-70 atmosfer. Sayang sekali, septum tidak dapat dipakai untuk semua pelarut KC. Selain itu, partikel kecil terlepas dari septum dan cenderung menyumbat.
c. Katup jalan-kitar: jenis injektor ini, biasanya dipakai untuk menyuntikkan volum yang lebih besar dari 10 µl dan sekarang dipakai dalam sistem yang diotomatkan. (Volum yang lebih kecil dapat disuntikkan secara manual memakai adaptor khusus). Pada kedudukan mengisi, jalan-kitar cuplikan diisi pada tekanan atmosfer. Jika katup dijalankan (dibuka), cuplikan di dalam jalan-kitar teralirkan ke dalam kolom.
2.6.2.5 Kolom
Kolom merupakan jantung kromatograf. Keberhasilan atau kegagalan analisis bergantung pada pilihan kolom dan kondisi kerja yang tepat. Menurut Edward dan Stevenson (1991), kolom dapat dibagi menjadi dua kelompok:
a. Kolom analitik: garis tengah-dalam 2-6 mm. Panjang bergantung pada jenis kemasan, untuk kemasan, untuk kemasan pelikel biasanya panjang kolom 50-100 cm, untuk kemasan mikropartikel berpori biasanya 10-30 cm.
b. Kolom preparatif: umumnya bergaris tengah 6 mm atau lebih besar dan panjang 25-100 cm.
2.6.2.6 Fase Diam pada KCKT
benzen. Oktadesil silika (ODS atau C18) merupakan fase diam yang paling banyak
digunakan karena mampu memisahkan senyawa-senyawa dengan kepolaran yang rendah, sedang, maupun tinggi (Gandjar, 2007).
2.6.2.7 Detektor
Detektor diperlukan untuk mengindera adanya komponen cuplikan di dalam efluen kolom dan mengukur jumlahnya. Detektor yang baik sangat peka, tidak banyak berderau, rentang tanggapan liniernya lebar, dan menanggapi semua jenis senyawa. Detektor yang merupakan tulang punggung kromatografi cair kecepatan tinggi modern (KCKT) ialah detektor UV 254 nm (Edward dan Stevenson, 1991).
Detektor pada KCKT dikelompokkan menjadi 2 golongan yaitu: detektor universal (yang mampu mendeteksi zat secara umum, tidak bersifat spesifik, dan tidak bersifat selektif) seperti detektor indeks bias dan detektor spektrometri massa; dan golongan detektor yang spesifik yang hanya akan mendeteksi analit secara spesifik dan selektif, seperti detektor UV-Vis, detektor fluoresensi, dan elektrokimia. Menurut Gandjar (2007), idealnya, suatu detektor harus mempunyai karakteristik sebagai berikut:
1. Mempunyai respon terhadap solut yang cepat dan reprodusibel
2. Mempunyai sensitifitas yang tinggi, yakni mampu mendeteksi solut pada kadar yang sangat kecil
3. Stabil dalam pengoperasiannya
5. Signal yang dihasilkan berbanding lurus dengan konsentrasi solut pada kisaran yang luas
6. Tidak peka terhadap perubahan suhu dan kecepatan alir fase gerak
2.6.3 Elusi Gradien dan Isokratik
Menurut Putra (2007), elusi pada KCKT dapat dibagi menjadi dua sistem yaitu:
1. Sistem elusi isokratik. Pada sistem ini, elusi dilakukan dengan satu macam atau lebih fase gerak dengan perbandingan tetap (komposisi fase gerak tetap selama elusi).
2. Sistem elusi gradien. Pada sistem ini, elusi dilakukan dengan campuran fase gerak yang perbandingannya berubah-ubah dalam waktu tertentu
BAB III
METODOLOGI PENELITIAN
Penelitian ini merupakan penelitian deskriptif dan pengukuran dilakukan dengan menggunakan alat KCKT. Penelitian ini dilakukan di Laboratorium Biofarmasi dan di Laboratorium Penelitian Fakultas Farmasi USU.
3.1 Alat
Alat-alat yang digunakan pada penelitian ini adalah timbangan, beaker gelas, neraca analitis (Baecho), pipet tetes, tabung sentrifugasi, rak tabung, gelas ukur, alat vortex (Health HVM-400), alat sentrifugasi (Health HC 1120T), termos es, spuit 1 ml, spuit 3 ml, politube, mikropipet, batang pengaduk, vial 2 ml, satu unit alat KCKT Agilent 1120 Compact LC, kolom ODS, wadah solven, injektor, syringe 50 µl, pompa vakum (Gast DOA-PG04-BN), sonifikator (Branson 1510), kertas membran filter whatman cellulosa nitrate 0,45 µm, penyaring PTFE 0,2 µm, penyaring PTFE 0,5 µm. (Gambar alat dapat dilihat pada Lampiran 1 dan 2 Halaman 39).
3.2 Bahan
Halaman 58), kalium dihidrogen fosfat p.a (E. Merck), aquabidest (PT. Ika parmindo putra mas), Heparin sodium inject (PT. B. Braun Medical Indonesia).
3.3 Pengambilan Sampel
Sampel yang diperiksa dalam penelitian ini adalah plasma darah pasien penderita TB yang sedang menjalani perawatan di klinik Dr. Zainuddin Amir, DSP (ahli penyakit saluran pernapasan) di Jl. Jemadi Medan. Pasien yang diambil darahnya adalah pasien yang telah mengkonsumsi obat TB kurang dari 2 bulan atau sedang menjalani fase intensif. (Data pasien dapat dilihat pada Lampiran 13 Halaman 57). Waktu pengambilan darah adalah 2 jam setelah pasien meminum obat.
3.4 Rancangan Penelitian 3.4.1 Penyiapan Bahan
3.4.1.1 Pembuatan Plasma Darah Pasien TB
Darah pasien diambil sebanyak 5 ml, kemudian dimasukkan ke dalam venoject yang telah terbasahi heparin. venoject yang berisi darah disentrifugasi
dengan kecepatan 4000 putaran permenit selama 5 menit. Diperoleh dua lapisan yaitu lapisan atas yang merupakan plasma dan lapisan bawah berupa endapan. Diambil lapisan atas (plasma).
3.4.1.2 Pembuatan Plasma Kontrol
darah disentrifugasi dengan kecepatan 4000 putaran permenit selama 5 menit. Diperoleh dua lapisan yaitu lapisan atas yang merupakan plasma dan lapisan bawah berupa endapan. Diambil lapisan atas (plasma).
3.4.1.3 Pembuatan Pereaksi 3.4.1.3.1 Aqua Bebas CO2
Dibuat dengan mendidihkan air untuk injeksi segar selama tidak kurang dari 10 menit sambil mencegah hubungan dengan udara sesempurna mungkin, didinginkan, dan segera digunakan (Ditjen POM, 1972).
3.4.1.3.2 Natrium Hidroksida (NaOH) 0,2 N
Dilarutkan 8,0 g NaOH dengan air bebas CO2 sampai 1000,0 ml (Ditjen POM, 1979).
3.4.1.3.3 Kalium Dihidrogen Fosfat 0,2 M
Dilarutkan 27,218 g kalium dihidrogen fosfat dalam air bebas CO2 secukupnya hingga 1000,0 ml (Ditjen POM, 1979).
3.4.1.3.4 Buffer Fosfat pH 7,4
Dibuat dengan mencampur 50,0 ml kalium dihidrogenfosfat 0,2 M dengan 39,1 ml natrium hidroksida 0,2 N, dan diencerkan dengan air bebas karbondioksida P hingga 200,0 ml (Ditjen POM, 1979).
3.4.1.4 Pembuatan Fase Gerak
membran filter whatman cellulosa nitrate 0,45 µm. Asetonitril disaring melalui penyaring PTFE 0,5 µm. Kemudian diawaudarakan selama ± 20 menit menggunakan sonifikator.
3.4.1.5Pembuatan Larutan Induk Baku Etambutol
Ditimbang seksama sejumlah 10 mg Etambutol baku lalu dimasukkan ke dalam labu ukur 10 ml, dilarutkan dengan fase gerak (buffer posfat pH 7,4 : asetonitril dengan perbandingan (90 : 10) sehingga diperoleh konsentrasi 3,6071 mM (1.000 mcg/ml).
3.4.2 Prosedur Analisis
3.4.2.1 Penyiapan Alat KCKT
Alat dihubungkan dengan sumber listrik, kemudian alat dihidupkan dengan menekan tombol power. Diatur panjang gelombang menjadi 202 nm. Dipurging untuk menghilangkan gelembung pada selang, kemudian dialirkan fase gerak hingga laju alir 0,8 ml/menit. Biarkan hingga kondisi alat stabil.
3.4.2.2 Penentuan Garis Alas (Base Line)
Setelah dialirkan fase gerak selama 30 menit, dilihat absorbansi apakah telah stabil, jika telah stabil absorbansi di nol kan dengan cara click to balance.
3.4.2.3 Penyuntikan Fase Gerak
diputar ke posisi load dan disuntikkan fase gerak ke dalam injektor dengan menggunakan penyuntik mikroliter, injektor diputar ke posisi inject. (Hasil penyuntikan fase gerak dapat dilihat pada Lampiran 4 halaman 45).
3.4.2.4 Penyuntikan Plasma Kontrol
Dipipet 300 µl plasma, dimasukkan ke dalam politube dan ditambahkan 600 µl asetonitril untuk mengendapkan protein lalu divortex. Disentrifugasi dengan kecepatan 4000 putaran permenit selama 5 menit. Dipisahkan supernatan dari endapan dan dikumpulkan. Disaring dengan penyaring PTFE diameter 0,2 µm, lalu diinjeksikan ke dalam sistem KCKT dengan volume penyuntikan 20 µl dengan laju aliran (flow rate) 0.8 ml/menit, deteksi pada panjang gelombang 202 nm. Dilihat kromatogram yang terbentuk dan waktu retensinya. (Kromatogram dapat dilihat pada Lampiran 6 halaman 47).
3.4.2.5 Analisis Kualitatif
Analisis kualitatif etambutol dapat dilakukan dengan membandingkan waktu retensi yang sama dari kromatogram pada penyuntikan sampel dengan kromatogram pada penyuntikan larutan baku pembanding etambutol. (Kromatogram larutan baku pembanding dapat dilihat pada Lampiran 5 halaman 46).
dinyatakan mengandung etambutol jika terjadi peningkatan tinggi dan luas puncak
pada kromatogram hasil spiking dengan waktu retensi yang sama seperti pada
kromatogram penyuntikan larutan baku pembanding. (Kromatogram penyuntikan sampel darah pasien TB yang telah di-spike dengan larutan baku pembanding dapat dilihat pada Lampiran 8 halaman 49).
3.4.2.6 Analisis Kuantitatif
3.4.2.6.1 Penentuan Linieritas Kurva Kalibrasi Baku Pembanding Etambutol Dipipet larutan induk baku etambutol baku sebanyak 500 µl; 600 µl; 1ml; masing-masing dimasukkan ke dalam labu ukur 10 ml, dicukupkan dengan fase gerak sampai garis tanda sehingga diperoleh konsentrasi 0,1803 mM (50mcg/ml); 0,2164 mM (60mcg/ml); 0,3607 mM (100mcg/ml). Dari masing-masing konsentrasi dipipet 10 µl, dimasukkan ke dalam vial yang telah dikalibrasi 2 ml, kemudian ditambahkan plasma sampai garis tanda, divortex lalu didiamkan selama 5 menit. Dipipet 300 µl, dimasukkan ke dalam politube dan ditambahkan 600 µl asetonitril untuk mengendapkan protein lalu di vortex. Disentrifugasi dengan kecepatan 4000 putaran per menit selama 5 menit. Supernatan yang diperoleh diambil dengan menggunakan spuit kemudian disaring dengan penyaring PTFE diameter 0,2 µm, lalu diinjeksikan ke dalam sistem KCKT dengan volume penyuntikan 20 µl dengan laju aliran (flow rate) 0.8 ml/menit, deteksi pada panjang gelombang 202 nm.
garis regresi linier. (Kromatogram dan data perhitungan dapat dilihat pada Lampiran 9 halaman 50 dan Lampiran 10 halaman 53).
3.4.2.6.2 Pemeriksaan Kadar Etambutol Dalam Plasma Darah Pasien TB Dipipet 300 µl plasma pasien ditambahkan 600µl asetonitril untuk mengendapkan protein lalu di vortex. Disentrifugasi dengan kecepatan 4000 putaran per menit selama 5 menit. Supernatan yang diperoleh diambil dengan menggunakan spuit kemudian disaring dengan penyaring PTFE diameter 0,2 µm, lalu diinjeksikan ke dalam sistem KCKT dengan volume penyuntikan 20 µl dengan laju aliran (flow rate) 0.8 ml/menit, deteksi pada panjang gelombang 202 nm. Dilihat kromatogram yang terbentuk dan waktu retensinya. Dihitung kadar obat dalam plasma dengan menghitung luas puncak. (Kromatogram dan data perhitungan kadar dapat dilihat pada Lampiran 7 halaman 48 dan Lampiran 11 halaman 55).
3.4.2 Penentuan Batas Deteksi dan Batas Kuantifikasi
LOD =
slope SD 3 , 3 x
LOQ = slope
SD 10x
Standar deviasi (SD) dapat ditentukan berdasarkan pada standar deviasi blanko, pada standar deviasi residual dari garis regresi.
Standar deviasi residual (Sy) =
2 n
) y y
( i 2
− −
∑
(Harmita, 2004).BAB IV
HASIL DAN PEMBAHASAN
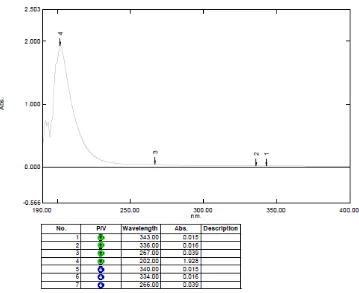
[image:44.595.129.488.365.658.2]Pemeriksaan etambutol dalam plasma darah pasien TB dilakukan secara Kromatografi Cair Kinerja Tinggi (KCKT) dengan menggunakan kolom ODS C18, fase gerak buffer posfat pH 7,4 : asetonitril (90 : 10) pada panjang gelombang 202 nm. Panjang gelombang analisis ditentukan dengan membuat kurva serapan etambutol baku menggunakan spektrofotometer UV. Spektrum hasil pengukuran etambutol baku dapat dilihat pada Gambar 2.
Dari kurva serapan ini, diperoleh kesimpulan bahwa etambutol memberi
serapan maksimum pada panjang gelombang 202 nm.
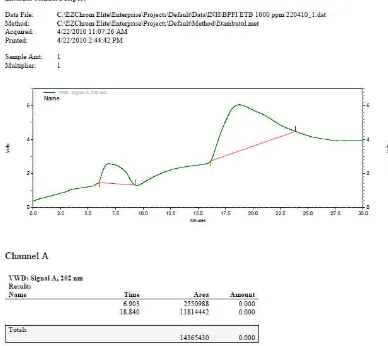
[image:45.595.112.500.242.588.2]Untuk mengetahui waktu retensi dari etambutol terlebih dahulu dilakukan penyuntikan larutan baku, sehingga diperoleh waktu retensi etambutol baku 18.840 menit. Kromatogram hasil analisis KCKT ini dapat dilihat pada Gambar 3.
Gambar 3. Kromatogram Hasil Penyuntikan Etambutol Baku
dilakukan setelah 2 jam pasien mengkonsumsi obat. Etambutol diabsorbsi dengan baik dari usus. Setelah menelan obat ini 25 mg/kg, kadar puncak obat dalam darah berkisar 2-5 µg/ml yang dicapai dalam waktu 2-4 jam. Lebih kurang 20% dari obat ini diekskresikan dalam tinja dan 50% di urin dalam bentuk utuh (Jawetz, 1998). Efek sampingnya yang terpenting adalah neuritis optica (radang saraf mata) yang mengakibatkan gangguan penglihatan, antara lain kurang tajamnya penglihatan dan buta warna terhadap merah–hijau (Tjay dan Rahardja, 2002).
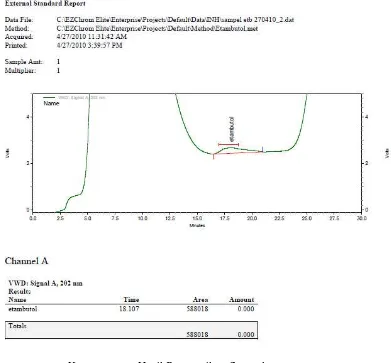
Gambar 4. Kromatogram Hasil Penyuntikan Sampel
Gambar 5. Kromatogram Hasil Penyuntikan Sampel yang telah di-spike dengan Larutan Baku Pembanding Etambutol untuk Uji Kualitatif.
Kurva kalibrasi etambutol baku dibuat dengan konsentrasi 0,1803 mM (50 mcg/ml); 0,2164 mM (60 mcg/ml); 0,3607 mM (100 mcg/ml), diperoleh hubungan yang linier dengan koefisien korelasi (r) = 0,9786 dan persamaan regresi Y = 2033327,435X – 11096,066 dengan data penyuntikan larutan etambutol baku. Kurva kalibrasi dapat dilihat pada Gambar 6 di bawah ini:
Gambar 6. Kurva Kalibrasi Etambutol Baku Luas Puncak vs Konsentrasi
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Pemeriksaan kadar etambutol dalam plasma darah pasien TB dapat dilakukan dengan cara kromatografi cair kinerja tinggi (KCKT) menggunakan kolom ODS-C18 dengan fase gerak campuran buffer fosfat pH 7,4:asetonitril (90:10), dengan laju alir 0,8 ml/menit pada panjang gelombang 202 nm. Kadar etambutol dalam plasma darah pasien adalah 0,2946 mM.
Etambutol dalam plasma darah pasien TB berada dalam keadaan stabil pada temperatur kamar.
5.2 Saran
DAFTAR PUSTAKA
Anonima. (2006). Pedoman Nasional Penanggulangan Tuberkulosis. Edisi 2. Cetakan Pertama. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. v, 3, 4.
Anonimb. (2008). Defenisi/Pengertian, Plasma Darah dan Fungsi Alat Sistem Transportasi Manusia. Tanggal akses 19 Maret 2009. Dikutip dari http://www. Organisasi.org/taxonomy.
Ditjen POM. (1972). Farmakope Indonesia Edisi II. Jakarta: Departemen Kesehatan RI. Hal. 667.
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI. Hal.14, 320, 688.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 61-62, 1002.
Chuluq, A.C., Abijoso, dan Sidharta, B. (2004). Pengembangan Paket Obat SOT (Sediaan Obat Tunggal) untuk Pengobatan Tuberkulosa. Buletin Penelitian Kesehatan. 32(3): 127-129.
Ekonoruliyanto. (2008). Penanggulangan TBC Dengan Strategi DOTS. Tanggal akses 20 Januari 2009. Dikutip dari http://www. fildza.wordpress.com. Ernest, Mutschler. (1999). Dinamika Obat. Penerjemah: Mathilda B, Widianto
dan Anna Setiadi Ranti. Edisi V. Cetakan Ketiga. Bandung. Penerbit ITB. Hal. 416.
Gandjar, G.I., dan Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Hal. 468.
Gritter, R.J, Bobbit, J.M, dan Schwarting, A.e. (1985). Introduction of Chromatograpy. Penerjemah: K. Padmawinata. Pengantar Kromatografi.Edisi III.Bandung: Penerbit ITB. 4, 10, 12, 14-15.
Hadjar, I., (1985). Pengantar Farmakokinetik. Cermin Dunia Kedokteran. (37): 26.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Majalah Ilmu Kefarmasian. Volume I (3): 129.
Junqueira, L.C., dan Carneiro, J. (1982). Histologi Dasar (Basic Histology). Edisi III. Alih Bahasa Adji Dharma. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 255.
Johnson, E. L., dan Stevenson R. (1991). Dasar Kromatografi Cair. Bandung: Penerbit ITB. Hal. 236.
Muchtar, A.(1985). Monitoring Kadar Terapeutik Obat. Cermin Dunia Kedokteran (37): 13-14.
Putra, E.D.L. (2007). Dasar-Dasar Kromatografi Cair Kinerja Tinggi. Medan: Fakultas Farmasi Universitas Sumatera Utara. Hal. 43, 82-88.
Revankar SN, Desai ND, Vaidya, AB, Bhatt AD, Anjaneluyu B., (1994). Determination of Pyrazinamide in Human by High Performance Liquid Chromatography. J. Postgrad Med. 40(1): 7.
Shargel, L. (1988). Biofarmasetika dan Farmakokinetika Terapan. Penerjemah: Fasich dan Sjamsiah. Edisi II. Surabaya: Airlangga University Press. Hal. 35.
Siregar, C.J.P., dan Endang, K. (2004). Farmasi Klinik Teori dan Terapan. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 120, 122.
Snyder dan Kirkland. (1979). Introduction to Modem Liquid Chromatography. Second Edition. New York: John Wiley and Sons, Inc. Hal. 546.
Tjay, T.H., dan Rahardja, K. (2002). Obat-obat Penting. Edisi V. Cetakan Kedua. Jakarta: Penerbit PT Elex Media Komputindo. Hal. 145,152.
Yukitaka Nakano, Hitoshi Nohta, Hideyuki Yoshida, Kenichiro Todoroki, Tetsuya Saita, Hiroshi Fujito, Masato Mori, Masatoshi Yamaguchi., (2002). Liquid Chromatographic Determination of Ethambutol in Serum Samples Based on Intramolecular Excimer-Forming Fluorescence Derivation. Analytical Sciences Vol (24): 489.
Syringe 50 µl Lampiran 1. Gambar Alat KCKT dan Syringe 50 µl
Ultrasonic cleaner
Sentrifuge Lampiran 2. (Lanjutan)
Lampiran 9. Kromatogram Penyuntikan Larutan Etambutol Baku pada Pembuatan Kurva Kalibrasi
Lampiran 9. (Lanjutan)
Lampiran 9. (Lanjutan)
Lampiran 10. Perhitungan Persamaan Regresi dan Kurva Kalibrasi Etambutol Baku yang Diperoleh Secara KCKT pada λ 202 nm
Data Luas Puncak dari Penyuntikan Larutan Etambutol Baku Konsentrasi 0,1803 – 0,3607 mM dalam Plasma
Konsentrasi Etambutol
Luas area Etambutol
ppm (mcg/ml) mM
50 0,1803 319889
60 0,2164 473452
100 0,3607 713413
Data Kalibrasi Etambutol Baku Luas Puncak (y) terhadap Konsentrasi (x)
No. Konsentrasi Etambutol (mM) (x) Luas Puncak Etambutol (y)
x.y x2 Y2
1 0,1803 319889 57675,987 0,03250809 102328972321
2 0,2164 473452 102455,013 0,04682896 224156796304
3 0,3607 713413 257328,069 0,13010449 508958108569
Σ 0,7574 1506754 417459,069 0,20944154 835443877194
Rata-rata 0,2524 502251,333
a =
( )( )
( )
x nx n y x xy / / 2 2
∑
∑
∑
∑
∑
− − =(
)(
)
(
0,7574)
/3 20944154 , 0 3 / 1506754 7574 , 0 069 , 417459 2 − − = 1912183 , 0 20944154 , 0 160 , 380405 069 , 417459 − − = 0182233 , 0 909 , 37053a = 2033327,435 Y = a X + b b = Y – aX
= 502251,333 - 513347,400 = -11096,066
Sehingga diperoleh persamaan regresi Y = 2033327,435 X - 11096,066
Untuk mencari hubungan kadar (X) dengan luas puncak (Y) digunakan pengujian koefisien korelasi (r)
r =
( )( )
( )
(
)
(
( )
)
[
∑
−∑
∑
∑
∑
∑
−∑
]
− n y y n x x n y x xy / / / 2 2 2 2r =
(
)(
)
(
)
(
)
(
(
)
)
[
0,20944154 0,7574 /3 835443877194 1506754 /3]
3 / 1506754 7574 , 0 069 , 417459 2 2 − − − r =
(
)(
)
[
0,20944154 0,191218253 835443877194 756769205505,333]
160 , 380405 069 , 417459 − − − r =(
)(
)
[
0,018223287 78674671688,667]
909 , 37053 r = 378 , 37864 909 , 37053Lampiran 11. Perhitungan Konsentrasi Obat Etambutol
Dari persamaan regresi Y = 2033327,435 X - 11096,066 maka, konsentrasi obat 588018 = 2033327,435 X - 11096,066
2033327,435 X = 588018 + 11096,066 X =
2033327,435 588018 + 11096,066
Lampiran 12. Perhitungan Batas Deteksi dan Batas Kuantifikasi Etambutol
Persamaan garis regresi Etambutol Baku: Y = aX + b
Y = 2033327,435 X - 11096,066
NO X (mM) Y Yi (Y-Yi)2
1 0,1803 319889 355512,870 1269060122
2 0,2164 473452 428915,991 1983456141
3 0,3607 713413 722325,139 79426228,16
Σ(Y-Yi)2= 3331942490,996
SD = n-2
√ Σ(y-yi)2
= 3-2 √ 3331942490,996 = 1 57722,981 = 57722,981
LOD = 3,3 x SD Slope
=
2033327,435 3,3 x 57722,981 = 0,0936 mM
LOQ = 10 x SD Slope
=
2033327,435 10 x 57722,981
Lampiran 13. Data Pasien
Nama : Hervapi Umur : 27 tahunp Jenis Kelamin : Laki-laki Berat Badan : 51 kg
Lampiran 16. Pembuatan Plasma dari Sampel Darah Pasien TB
Diambil darahnya sebanyak 5 ml melalui vena
Dimasukkan ke dalam venoject yang telah terbasahi heparin
Dipisahkan supernatan dari endapan Disentrifugasi dengan kecepatan 4000 putaran per menit selama 5 menit Pasien TB
Darah + heparin di dalam venoject
Lapisan atas (plasma)
Lapisan bawah (endapan)
Lampiran 17. Pembuatan Plasma Kontrol
Dimasukkan ke dalam venoject yang telah terbasahi heparin
Dipisahkan supernatan dari endapan Disentrifugasi dengan kecepatan 4000 putaran per menit selama 5 menit Diambil darahnya sebanyak 5 ml melalui vena
Donatur (Dewasa dan Sehat)
Darah + heparin di dalam venoject
Lapisan atas (plasma)
Lapisan bawah (endapan)
Lampiran 18. Pembuatan Larutan Induk Baku Etambutol
Dimasukkan ke dalam labu ukur 10 ml
Etambutol Baku
Ditimbang sebanyak 10 mg
Dilarutkan dengan fase gerak
Dicukupkan sampai garis tanda
Lampiran 19. Penyuntikan Plasma Kontrol
Dipipet sebanyak 300 µl Dimasukkan ke dalam politube
Supernatan Endapan
Plasma
Ditambahkan 600 µl asetonitril, lalu divortex Disentrifugasi dengan kecepatan 4000 putaran per menit selama 5 menit
Dipisahkan menggunakan spuit
Disaring menggunakan PTFE ø 0,2 µm
Lampiran 20. Pembuatan Linearitas Kurva Kalibrasi Baku Pembanding Etambutol
Ditambahkan plasma ke dalam vial sampai garis tanda
Dipipet sebanyak 300 µl
Dipipet sebanyak 500 μl; 600 μl; 1 ml
Supernatan Endapan
LIB I Etambutol
Dimasukkan ke dalam labu ukur 10 ml
Dicukupkan dengan fase gerak sampai garis tanda
Larutan Etambutol dengan konsentrasi 0,1803 mM; 0,2164 mM; 0,3607 mM
Dipipet sebanyak 10 µl
Divortex lalu didiamkan selama 5 menit
Ditambahkan 600 µl asetonitril lalu divortex Disentrifugasi dengan kecepatan 4000 putaran per menit selama 5 menit Dimasukkan ke dalam vial yang telah dikalibrasi 2 ml
Lanjutan:
Supernatan
Dipisahkan menggunakan spuit Disaring menggunakan PTFE ø 0,2
Diinjeksikan ke dalam sistem KCKT sebanyak 20 µl
Kromatogram
Diperoleh Rt dan luas puncak
Hasil
Lampiran 21. Pemeriksaan Kadar Etambutol dalam Plasma Darah Pasien TB
Dipipet sebanyak 300 µl Dimasukkan ke dalam politube
Supernatan Endapan
Plasma pasien TB
Ditambahkan 600 µl asetonitril, lalu divortex Disentrifugasi dengan kecepatan 4000 putaran per menit selama 5 menit
Dipisahkan menggunakan spuit
Disaring menggunakan PTFE ø 0,2 µm
Diinjeksikan ke dalam sistem KCKT sebanyak 20 µl Kromatogram plasma +
obat
Diperoleh Rt dan luas puncak Dihitung konsentrasi yang didapat
![Gambar 1. Struktur rumus bangun etambutol (+)-2,2’-(Etilenadiimino)-di-1- butanol dihidroklorida [1070-11-7]](https://thumb-ap.123doks.com/thumbv2/123dok/323806.29387/21.595.115.454.127.227/gambar-struktur-rumus-bangun-etambutol-etilenadiimino-butanol-dihidroklorida.webp)