PEMERIKSAAN KADAR ISONIAZID DALAM PLASMA DARAH PASIEN TB MENGGUNAKAN KROMATOGRAFI CAIR KINERJA
TINGGI (KCKT) DENGAN BAKU DALAM NIKOTINAMID
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: SUJI FANINA NIM 050804072
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Pembimbing II,
(Dr. Karsono, Apt.)
NIP 19540909198201 1 001
LEMBAR PENGESAHAN SKRIPSI
PEMERIKSAAN KADAR ISONIAZID DALAM PLASMA DARAH PASIEN TB MENGGUNAKAN KROMATOGRAFI CAIR KINERJA
TINGGI (KCKT) DENGAN BAKU DALAM NIKOTINAMID OLEH:
SUJI FANINA NIM 050804072
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara
Pada Tanggal: Agustus 2010
Medan, Agustus 2010 Fakultas Farmasi Universitas Sumatera Utara
Dekan,
(Prof. Dr. Sumadio Hadisahputra., Apt.) NIP. 19531128198303 1 002 Pembimbing I,
(Prof. Dr. M. Timbul Simanjuntak, M.Sc., Apt.) NIP 19521204198002 1 001
Panitia Penguji,
(Prof. Dr. Sumadio Hadisahputra., Apt.) NIP. 19531128198303 1 002
(Prof. Dr. M. Timbul Simanjuntak, M.Sc., Apt.) NIP 19521204198002 1 001
(Dr. Kasmirul Ramlan Sinaga, MS., Apt.) NIP 19550424198303 1 003
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa yang telah melimpahkan anugerah dan kemurahanNya sehingga penulis dapat menyelesaikan skripsi yang berjudul " Pemeriksaan Kadar Isoniazid Dalam Plasma Darah Pasien Tb Menggunakan Kromatografi Cair Kinerja Tinggi (KCKT) Dengan Baku Dalam Nikotinamid". Skripsi ini diajukan sebagai salah satu syarat guna memperoleh gelar Sarjana Farmasi dari Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis hendak menyampaikan rasa hormat dan terimakasih yang sebesar-besarnya kepada Bapak Prof. Dr. M. Timbul Simanjuntak, M.Sc., Apt. Dan Bapak Dr. Karsono, Apt., yang telah banyak memberikan bimbingan dan bantuan selama penelitian dan penulisan skripsi ini berlangsung. Ucapan terimakasih juga penulis sampaikan kepada Dekan Fakultas Farmasi Universitas Sumatera Utara, Bapak Prof. Dr. Sumadio Hadisahputra, Apt., yang telah memberikan fasilitas selama masa pendidikan dan penelitian, juga kepada Bapak Dr. Kasmirul Ramlan Sinaga, MS., Apt., dan Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, SU., Apt., selaku dosen penguji yang telah memberikan masukan dalam penyusunan skripsi ini.
Dalam kesempatan ini, penulis ingin menyampaikan rasa terimakasih dan penghargaan yang tulus kepada kedua orang tua, adikku Tio, atas doa, semangat, dan dorongan dalam menyelesaikan skripsi ini. Juga kepada Kak Desi, Kak Fentimalia, Anggelia, Yuli, Kak Irus, Bang Anton, yang selalu ada memberi semangat dan pikiran selama penelitian dan penyusunan skripsi ini. Tidak lupa penulis ingin mengucapkan terimakasih kepada teman-teman stambuk 2005, staf dan para asisten di Laboratorium Biofarmasi dan Laboratorium Penelitian, yang tidak dapat disebutkan namanya satu persatu, atas segala dorongan motivasi dan bantuannya kepada penulis sehingga skripsi ini dapat selesai .
Medan, Agustus 2010 Penulis,
PEMERIKSAAN KADAR ISONIAZID DALAM PLASMA DARAH PASIEN TB MENGGUNAKAN KROMATOGRAFI CAIR KINERJA
TINGGI (KCKT) DENGAN BAKU DALAM NIKOTINAMID
Abstrak
Dalam penelitian ini dilakukan pemeriksaan kadar isoniazid dalam plasma darah pasien tuberkulosis secara Kromatografi Cair Kinerja Tinggi (KCKT) metode fase balik menggunakan kolom ODS C18 dan sistem elusi isokratik, fase gerak yang digunakan campuran buffer phosfat pH 7,4:metanol (96,8:3,2) dengan laju alir 0,8 ml/menit, pengukuran dilakukan pada panjang gelombang 254 nm dan digunakan baku dalam nikotinamid
Hasil uji identifikasi yang dilakukan terhadap sampel plasma diperoleh waktu retensi isoniazid yakni 18,56 menit dan waktu retensi nikotinamid yakni 23,927 menit. Batas deteksi dan batas kuantifikasi masing masing adalah 3,263941 mM dan 9,8909 mM.
Perbandingan luas area puncak isoniazid dengan luas puncak nikotinamid pada berbagai konsentrasi dengan koefisien korelasi (r) = 0,9482 dan dari hasil perhitungan diperoleh persamaan regresi Y = 0,004639904 x + 0,001832305
Hasil pemeriksaan kadar isoniazid dalam plasma darah pasien tuberkulosis adalah 0.92193 mM
EXAMINATION CONTENT OF BLOOD PLASMA IN PATIENT ISONIAZID TB USING HIGH PERFORMANCE LIQUID
CHROMATOGRAPHY (HPLC) WITH INTERNAL STANDARD NICOTINAMIDE
Abstract
In this research, examination of the body levels of isoniazid in blood plasma tuberculosis by High Performance Liquid Chromatography (HPLC) method using a reversed phase C18 ODS column and an isocratic solvent programme, mobile phase was the mixture of phosfat buffer pH 7,4:methanol (96.8:3.2) with a flow rate 0,8 ml / min, measurement were done at a wavelength of 254 nm and used nicotinamide as an internal standart
The result of identification test is done for plasma patient is got peak isoniazid with retension time 18,560 minute and nicotinamide with retension time 23,927 minute. Limid of detection and limid of quantification are 3,263941 mM dan 9,8909 mM resfectively.
Comparison of peak area of isoniazid and nicotinamide at different concentrations with correlation coefficients (r) = 0,9482, and calculation results obtained from the regression equation Y = 0.004639904 x + 0.001832305
The assessment levels of isoniazid blood plasma in tuberculosis patient is 0,92193 mM
DAFTAR GAMBAR
Halaman
Gambar 1. Rumus Bangun Isoniazid ... 7
Gambar 2. Rumus Bangun Nikotinamid ... 8
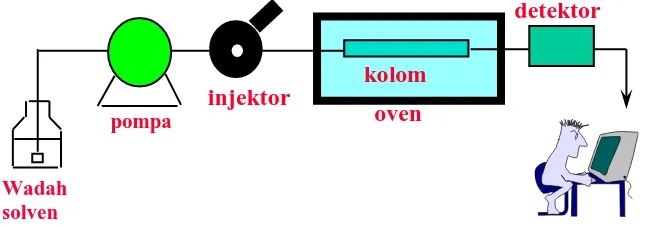
Gambar 3. Komponen KCKT ... 14
Gambar 4. Injektor ... 16
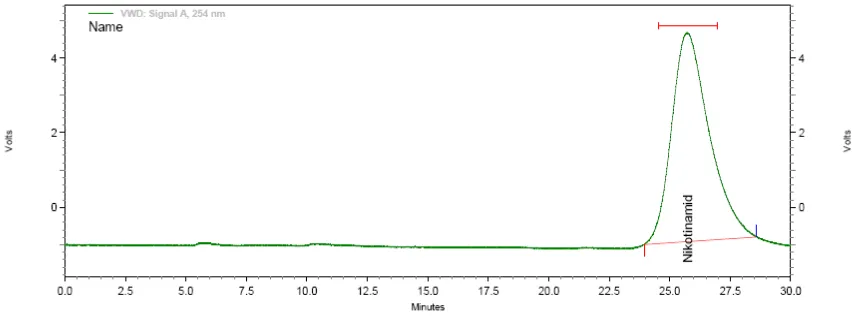
Gambar 5. Kromatogram ... 18
Gambar 6. Kromatogram Hasil Penyuntikan Isoniazid Baku ... 30
Gambar 7. Kromatogram Hasil Penyuntikan Nikotinamid Baku ... 30
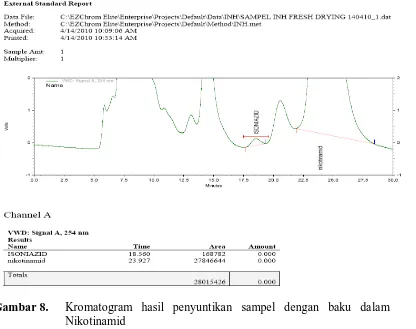
Gambar 8. Kromatogram Hasil Penyuntikan sampel dengan Baku Dalam Nikotinamid ... 31
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Gambar Alat KCKT dan Syringe 50 µl ... 37
Lampiran 2. Gambar Perangkat Penelitian Lainnya ... 38
Lampiran 3. Gambar Plasma Kontrol ... 41
Lampiran 4. Fase Gerak ... 42
Lampiran 5. Kromatogram dari Larutan Isoniazid Baku, Fase Gerak Buffer Posfat pH 7,4: Metanol (96,8:3,2) ... 43
Lampiran 6. Kromatogram dari Larutan Nikotinamid, Fase Gerak Buffer Fosfat pH 7,4: Metanol (96,8:3,2) ... 44
Lampiran 7. Kromatogram dari Plasma Kosong ... 45
Lampiran 8. Kromatogram Penyuntikan Sampel Plasma Pasien TB ... 46
Lampiran 9. Kromatogram Hasil Penyuntikan Larutan Isoniazida Baku pada Pembuatan Kurva Kalibrasi ... 47
Lampiran 10. Perhitungan Persamaan Regresi dan Kurva Kalibrasi Isoniazid Baku yang Diperoleh Secara KCKT pada λ 254 nm 52 Lampiran 11. Perhitungan Konsentrasi Obat Isoniazid ... 54
Lampiran 12. Perhitungan Batas Deteksi dan Batas Kuantifikasi Isoniazid .. 55
Lampiran 13. Data Pasien... 56
Lampiran 14. Sertifikat Analisis Isoniazid ... 57
Lampiran 15. Sertifikat Analisis Nikotinamid... 58
Lampiran 16. Surat Persetujuan Komisi Etik ... 59
Lampiran 17. Pembuatan Plasma Darah Pasien TB ... 60
Lampiran 18. Pembuatan Plasma Kontrol ... 61
Lampiran 19. Pembuatan Larutan Induk Baku Isoniazid ... 62
Lampiran 20. Pembuatan Larutan Induk Nikotinamid ... 63
PEMERIKSAAN KADAR ISONIAZID DALAM PLASMA DARAH PASIEN TB MENGGUNAKAN KROMATOGRAFI CAIR KINERJA
TINGGI (KCKT) DENGAN BAKU DALAM NIKOTINAMID
Abstrak
Dalam penelitian ini dilakukan pemeriksaan kadar isoniazid dalam plasma darah pasien tuberkulosis secara Kromatografi Cair Kinerja Tinggi (KCKT) metode fase balik menggunakan kolom ODS C18 dan sistem elusi isokratik, fase gerak yang digunakan campuran buffer phosfat pH 7,4:metanol (96,8:3,2) dengan laju alir 0,8 ml/menit, pengukuran dilakukan pada panjang gelombang 254 nm dan digunakan baku dalam nikotinamid
Hasil uji identifikasi yang dilakukan terhadap sampel plasma diperoleh waktu retensi isoniazid yakni 18,56 menit dan waktu retensi nikotinamid yakni 23,927 menit. Batas deteksi dan batas kuantifikasi masing masing adalah 3,263941 mM dan 9,8909 mM.
Perbandingan luas area puncak isoniazid dengan luas puncak nikotinamid pada berbagai konsentrasi dengan koefisien korelasi (r) = 0,9482 dan dari hasil perhitungan diperoleh persamaan regresi Y = 0,004639904 x + 0,001832305
Hasil pemeriksaan kadar isoniazid dalam plasma darah pasien tuberkulosis adalah 0.92193 mM
EXAMINATION CONTENT OF BLOOD PLASMA IN PATIENT ISONIAZID TB USING HIGH PERFORMANCE LIQUID
CHROMATOGRAPHY (HPLC) WITH INTERNAL STANDARD NICOTINAMIDE
Abstract
In this research, examination of the body levels of isoniazid in blood plasma tuberculosis by High Performance Liquid Chromatography (HPLC) method using a reversed phase C18 ODS column and an isocratic solvent programme, mobile phase was the mixture of phosfat buffer pH 7,4:methanol (96.8:3.2) with a flow rate 0,8 ml / min, measurement were done at a wavelength of 254 nm and used nicotinamide as an internal standart
The result of identification test is done for plasma patient is got peak isoniazid with retension time 18,560 minute and nicotinamide with retension time 23,927 minute. Limid of detection and limid of quantification are 3,263941 mM dan 9,8909 mM resfectively.
Comparison of peak area of isoniazid and nicotinamide at different concentrations with correlation coefficients (r) = 0,9482, and calculation results obtained from the regression equation Y = 0.004639904 x + 0.001832305
The assessment levels of isoniazid blood plasma in tuberculosis patient is 0,92193 mM
BAB I PENDAHULUAN 1.1 Latar Belakang
Tuberkulosis (TB) masih merupakan masalah kesehatan baik di Indonesia maupun di dunia dan merupakan penyebab kematian. WHO menyatakan bahwa sekitar sepertiga penduduk dunia telah pernah terinfeksi oleh kuman tuberkulosis dalam hidupnya. Setiap tahunnya ada sekitar empat juta penderita baru tuberkulosis yang menular, ditambah dengan sejumlah sama penderita baru tuberkulosis yang tidak menular. Artinya, setiap tahun di dunia ini akan ada sekitar 8 juta penderita tuberkulosis yang baru, dan akan ada sekitar tiga juta orang yang meninggal setiap tahunnya karena penyakit ini (Anonima, 2009).
Ada lebih dari 500.000 kasus tuberkulosis yang resisten terhadap berbagai jenis obat (multidrug-resistant tuberculosis/TB-MDR) pada tahun 2007. Jumlah itu berdasarkan angka yang diterbitkan WHO dalam laporan global tuberkulosis kontrol 2009. Namun, WHO mengatakan, kurang dari 30.000 kasus TB-MDR yang dicatat pada 2007, hanya 1% dari seluruh populasi kasus TB-MDR sedunia, menerima pengobatan yang sesuai (Anonimb, 2008).
menggunakan tiga obat yaitu INH, rifampisin dan pirazinamid (Tjay dan Rahardja, 2002).
Isoniazid, derivat asam isonikotinat ini berkhasiat tuberkulostatik paling kuat terhadap M. tuberculosis (dalam fase istirahat) dan bersifat bakterisid terhadap kuman yang berada intraselular dalam makrofag maupun di luar sel (ekstraselular). Isoniazid masih tetap merupakan obat kemoterapi terpenting terhadap berbagai tipe tuberkulosa dan selalu dalam bentuk multi terapi dengan rifampisin dan pirazinamid (Tjay dan Rahardja, 2002). Isoniazid pada penyimpanan temperatur 30, 40, 70oC stabilitasnya tidak berubah (Chuluq, dkk., 2004).
Analisis isoniazid dapat dilakukan secara nitrimetri, bromometri, spektofotometri dan kromatografi cair kinerja tinggi. Kadar obat dalam cairan biologis umumnya sangat kecil sehingga metode yang dapat digunakan untuk menetapkan kadarnya terbatas. KCKT yang selain mampu mendeteksi dan menentukan kadar, juga mampu melakukan pemisahan. Sehingga dapat digunakan untuk menentukan kadar obat dalam cairan biologi (Hadjar, 2009). Maka digunakan metode secara kromatografi cair kinerja tinggi untuk memeriksa kadar isoniazid dalam plasma.
dan metanol sebagai fase gerak dengan mengubah panjang gelombang menjadi 254 nm.
Baku dalam digunakan karena pemakaiannya secara tepat dapat memperkecil galat yang disebabkan oleh penyiapan cuplikan, peralatan dan cara (Johnson dan Stevenson, 1991). Nikotinamid memiliki struktur yang mirip dengan isoniazid maka digunakan nikotinamid sebagai baku dalam.
Berdasarkan informasi di atas penulis tertarik untuk melakukan penelitian mengenai kadar isoniazid di dalam tubuh pasien TB menggunakan metode KCKT.
1.2Perumusan Masalah
Berdasarkan latar belakang di atas perumusan masalah penelitian yaitu: 1. Apakah pemeriksaan kadar isoniazid dalam plasma darah pasien TB dapat
dilakukan secara KCKT menggunakan kolom ODS C18 dengan fase gerak campuran buffer fosfat pH 7,4:metanol (96,8:3,2) dengan menggunakan baku dalam nikotinamid.
2. Bagaimana kondisi isoniazid dalam plasma darah pasien TB pada temperatur kamar?
1.3 Hipotesis
Berdasarkan perumusan masalah diatas maka dibuat hipotesis sebagai berikut:
buffer fosfat pH 7,4:metanol (96,8:3,2) dengan menggunakan baku dalam nikotinamid.
2. Isoniazid dalam plasma darah pasien TB berada dalam keadaan stabil pada temperatur kamar
1.4 Tujuan Penelitian
Tujuan dilakukan penelitian ini yaitu:
1. Untuk memeriksa kadar isoniazid dalam plasma darah pasien TB secara KCKT menggunakan kolom ODS C18 dengan fase gerak campuran buffer fosfat pH 7,4:metanol (96,8:3,2) dengan menggunakan baku dalam nikotinamid
2. Untuk mengetahui stabilitas isoniazid dalam plasma darah pasien TB pada temperatur kamar
1.5 Manfaat Penelitian
1.6 Alur Penelitian
Obat TB Diberikan Pasien Penderita TB Diambil Darah Pasien TB
Plasma Darah Diukur
Alat KCKT Dianalisis
BAB II
TINJAUAN PUSTAKA
2.1 Tuberkulosis
Tuberkulosis, singkatnya TB adalah suatu penyakit menular yang paling sering (sekitar 80%) terjadi di paru paru. Penyebabnya adalah suatu basil gram positif tahan asam dengan pertumbuhan sangat lambat, yakni Mycobacterium tuberculosis (Kock, 1882). Gejala TB antara lain batuk kronis, demam,
berkeringat waktu malam, keluhan pernafasan, perasaan letih, dan rasa nyeri di bagian dada. Dahak penderita berupa lendir, purulent atau mengandung darah (Tjay dan Rahardja, 2002).
Setelah terjadi infeksi melalui saluran pernafasan, di dalam gelembung paru (alveoli) berlangsung reaksi peradangan setempat dengan timbulnya benjolan benjolan kecil (tuberkel). Sering kali sistem tangkis tubuh yang sehat dapat memberantas basil dan caranya adalah menyelubunginya dengan jaringan pengikat. Infeksi primer ini lazimnya menjadi abses terselubung dan berlangsung tanpa gejala, hanya jarang disertai batuk dan sesak nafas (Tjay dan Rahardja, 2002).
Infeksi dapat pula menyebar melalui darah dan limfa ke organ lain, antara lain ginjal, tulang dan pada anak anak ke otak dengan menimbulkan radang selaput otak (tuberkulosis meningitis) (Tjay dan Rahardja, 2002).
basil dan dibatukkan oleh penderita TB terbuka atau adanya kontak antara tetes tetes ludah tersebut dengan luka di kulit (Tjay dan Rahardja, 2002).
2.2 ISONIAZID
Gambar 1. Rumus Bangun Isoniazid
Rumus molekul: C6H7N3O Berat molekul : 137,14
Pemerian : Hablur putih atau tidak berwarna atau serbuk hablur putih, tidak berbau, perlahan lahan dipengaruhi oleh udara dan cahaya Titik lebur : 170°C - 173°C
Kelarutan : Mudah larut dalam air, agak sukar larut dalam etanol,
Isoniazid langsung diserap dalam saluran cerna. Pemberian dosis oral sebesar 300 mg (5 mg/kg untuk anak anak) menghasilkan konsentrasi plasma puncak 3 – 5 µg/ml dalam 1 – 2 jam (Shargel, 1988).
2.3 Nikotinamid
Gambar 2. Rumus Bangun Nikotinamid Rumus molekul : C6H6N2O Berat molekul : 122.12 g mol−1 Titik lebur : 128-131 C
2.4 Farmakokinetik
Untuk itu faktor farmakokinetik perlu diketahui oleh seorang dokter untuk menetapkan dosis optimum bagi pasien pasien dengan berpedoman pada kadar obat dalam plasma atau serum. Data farmakokinetik juga penting untuk obat yang memperlihatkan batas keamanan yang sempit, artinya efek toksis dapat terjadi pada kadar yang sedikit lebih tinggi dari kadar terapinya (Simamora, 1997).
2.5 Pemantauan obat terapetik
Dalam pemberian obat obat yang poten kepada penderita, sudah seharusnya mempertahankan kadar obat dalam plasma berada dalam batas yang dekat dengan konsentrasi terapetik. Berbagai metode farmakokinetik dapat digunakan untuk menghitung dosis awal atau aturan dosis. Biasanya, aturan dosis awal dihitung secara empirik atau diperkirakan setelah mempertimbangkan dengan hati hati farmakokinetika obat yang diketahui, kondisi patofisiologik penderita dan riwayat penggunaan obat dari penderita (Shargel, 1988).
Karena perubahan antar penderita dalam hal absorpsi, distribusi dan eliminasi obat maupun perubahan kondisi patofisologik penderita, maka dalam beberapa rumah sakit telah ditetapkan adanya pelayanan pemantauan terapetik obat (TDM) untuk menilai respons penderita terhadap aturan dosis yang dianjurkan. Fungsi dari pelayanan TDM dicantumkan berikut ini.
Memilih obat.
Merancang aturan dosis.
Menilai respons penderita.
Menentukan perlunya pengukuran konsentrasi obat dalam serum.
Melakukan penilaian sacara farmakokinetik kadar obat.
Menyesuaikan kembali aturan dosis.
Memantau konsentrasi obat dalam serum.
Menganjurkan adanya persyaratan khusus. Pengukuran Konsentrasi Obat dalam Serum
Sebelum cuplikan darah diambil dari penderita, praktisi hendaknya menetapkan apakah diperlukan pengukuran konsentrasi obat dalam serum. Dalam beberapa hal respons penderita tidak dapat dikaitkan dengan konsentrasi obat dalam serum. Sebagai contoh, alergi dan rasa ringan tidak dapat dikaitkan dengan dosis (Shargel, 1988).
Sebagian besar anggapan yang dibuat oleh praktisi menyatakan bahwa konsentrasi obat dalam serum berkaitkan dengan efek terapetik dan/atau efek toksik obat. Untuk banyak obat, studi klinik telah menunjukan bahwa ada suatu rentang efektif terapetik dari konsentrasi obat dalam serum. Oleh karena itu, pengetahuan tentang konsentrasi obat dalam serum dapat menjelaskan mengapa seorang penderita tidak memberikan reaksi terhadap terapi obat, atau mengapa penderita mengalami suatu efek yang tidak diinginkan. Sebagai tambahan, praktisi mungkin ingin menjelaskan ketelitian dari aturan dosis (Shargel, 1988).
Dalam banyak hal cuplikan darah tunggal tidak mencukupi oleh karena itu beberapa cuplikan darah diperlukan untuk menjelaskan kecukupan aturan dosis. Dalam praktek, konsentrasi palung serum lebih mudah diproleh daripada cuplikan puncak atau selama pemberian dosis ganda. Sebagai tambahan, mungkin ada keterbatasan dalam hal jumlah cuplikan darah yang dapat diambil, keseluruhan volume darah yang diperlukan untuk penetapan kadar, dan waktu untuk melakukan analisi obat. Praktisi yang melakukan pengukuran konsentrasi serum hendaknya juga mempertimbangkan biaya penetapan kadar, risiko, dan ketidaksenangan penderita, dan kegunaan informasi yang diperoleh (Shargel, 1988).
2.6 Plasma
2.7 Teori Kromatografi
Kromatografi cair kinerja tinggi (KCKT) merupakan sistem pemisahan dengan kecepatan dan efisiensi yang tinggi. Hal ini karena didukung oleh kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang sangat sensitif dan beragam. KCKT mampu menganalisa berbagai cuplikan secara kualitatif maupun kuantitatif, baik dalam komponen tunggal maupun campuran (Ditjen POM, 1995).
KCKT merupakan teknik pemisahan yang diterima secara luas untuk analisis dan pemurnian senyawa tertentu dalam suatu sampel pada sejumlah bidang antara lain; farmasi, lingkungan dan industri-industri makanan.
Kegunaan umum KCKT adalah untuk pemisahan sejumlah senyawa organik, anorganik, maupun senyawa biologis, analisis ketidakmurnian (impurities) dan analisis senyawa-senyawa yang tidak mudah menguap (nonvolatil). KCKT paling sering digunakan untuk: menetapkan kadar senyawa-senyawa tertentu seperti asam-asam amino, asam-asam nukleat dan protein-protein dalam cairan fisiologis, menentukan kadar senyawa-senyawa aktif obat dan lain-lain.
Kelebihan KCKT antara lain:
−Mampu memisahkan molekul-molekul dari suatu campuran
−Resolusinya baik
−Mudah melaksanakannya
−Kecepatan analisis dan kepekaannya tinggi
−Dapat dihindari terjadinya dekomposisi/kerusakan bahan yang dianalisis
−Kolom dapat digunakan kembali
−Mudah melakukan rekoveri cuplikan
−Tekniknya tidak begitu tergantung pada keahlian operator dan reprodusibilitasnya lebih baik
−Instrumennya memungkinan untuk bekerja secara automatis dan kuantitatif
−Waktu analisis umumnya singkat
−Kromatografi cair preparatif memungkinkan dalam skala besar
−Ideal untuk molekul besar dan ion.
Keterbatasan metode KCKT adalah untuk identifikasi senyawa, kecuali jika KCKT dihubungkan dengan spektrometer massa (MS). Keterbatasan lainnya adalah jika sampelnya sangat kompleks, maka resolusi yang baik sulit diperoleh (Munson, 1991).
2.7.1 Cara Kerja KCKT
2.7.2 Komponen KCKT
Gambar 3. Komponen KCKT
2.7.2.1 Wadah Fase Gerak
Wadah fase gerak harus bersih dan lembam (inert). Wadah pelarut kosong ataupun labu laboratorium dapat digunakan sebagai wadah fase gerak. Wadah ini biasanya dapat meampung fase gerak antara 1 sampai 2 liter pelarut.Fase gerak sebelum digunakan harus dilakukan degassing(penghilangan gas) yang ada pada fase gerak, sebab adanya gas akan berkumpul dengan komponen lain terutama dipompa dan detektor sehingga akan mengacaukan analisis (Rohman, 2007)
2.7.2.2 Pompa
Pompa yang cocok digunakan untuk KCKT adalah pompa yang mempunyai syarat sebagaimana syarat wadah pelarut yakni pompa harus inert terhadap fase gerak. Bahan yang umum dipakai untuk pompa adalah gelas, baja tahan karat, Teflon, dan batu nilam. Pompa yang dgunakan sebaiknya mampu memberikan tekanan sampai 5000 psi dan mampu mengalirkan fase gerak dengan kecepatan alir 3 ml/ menit.
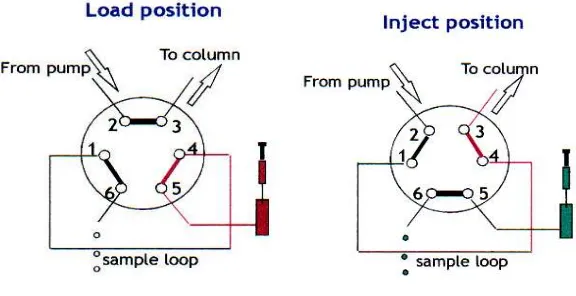
2.7.2.3 Injektor
Cuplikan harus dimasukkan kedalam pangkal kolom (kepala kolom), diusahakan agas sesedikit mungkin terjadi gangguan pada kemasan kolom.
Ada tiga jenis dasar injektor, yaitu:
a. Hentikan aliran/stop flow: aliran dihentikan, injeksi dilakukan pada kinerja atmosfir, sistem tertutup, dan aliran dilanjutkan lagi. Teknik ini bisa digunakan karena difusi di dalam aliran kecil dan resolusi tidak dipengaruhi. b. Septum: injektor-injektor langsung ke aliran fase gerak umumnya sama
dengan yang digunakan pada kromatografi gas. Injektor ini dapat digunakan pada kinerja sampai 60-70 atmosfir. Tetapi septum ini tidak tahan dengan semua pelarut-pelarut kromatografi cair. Disamping itu, partikel kecil dari septum yang terkoyak (akibat jarum injektor) dapat menyebabkan penyumbatan.
Gambar 4. Injektor
2.7.2.4 Kolom
Kolom adalah jantung kromatografi. Berhasil atau gagalnya suatu analisis tergantung pada pemilihan kolom dan kondisi percobaan yang sesuai. Kolom dapat dibagi menjadi dua kelompok:
1. Kolom analitik: diameter khas adalah 2-6 mm. Panjang kolom tergantung pada jenis kemasan. Untuk kemasan pelikel biasanya panjang kolom 50-100 cm. Untuk kemasan mikropartikel berpori, umumnya 10-30 cm. Dewasa ini ada yang 5 cm.
2. Kolom preparatif: umumnya memiliki diameter 6 mm atau lebih besar dan panjang kolom 25-100 cm.
2.7.2.5 Detektor
Suatu detektor dibutuhkan untuk mendeteksi adanya komponen cuplikan dalam aliran yang keluar dari kolom. Detektor-detektor yang baik memiliki sensitifitas yang tinggi, gangguan (noise) yang rendah, kisar respons linier yang luas, dan memberi tanggapan/respon untuk semua tipe senyawa. Suatu kepekaan yang rendah terhadap aliran dan fluktuasi temperatur sangat diinginkan, tetapi tidak selalu dapat diperoleh.
Detektor yang paling banyak digunakan dalam kromatografi cair modern kecepatan tinggi adalah detektor spektrofotometer UV 254 nm. Bermacam-macam detektor dengan variasi panjang gelombang UV-Vis sekarang menjadi populer karena mereka dapat digunakan untuk mendeteksi senyawa-senyawa dalam rentang yang luas. Detektor indeks refraksi juga secara luas digunakan, terutama dalam kromatografi eksklusi, tetapi umumnya kurang sensitif dari pada detektor spektrofotometer UV. Detektor lainnya, antara lain: detektor fluometer, detektor ionisasi nyala, detektor elektrokimia dan lain-lain juga telah digunakan.
2.7.2.6 Pengolahan Data
Gambar 5. Kromatogram
Guna kromatogram: 1. Kualitatif
Waktu retensi selalu konstan dalam setiap kondisi kromatografi yang sama dapat digunakan untuk identifikasi.
2. Kuantitatif
Luas puncak proporsional dengan jumlah sampel yang diinjeksikan dan dapat digunakan untuk menghitung konsentrasi.
3. Kromatogram dapat digunakan untuk mengevaluasi efisiensi pemisahan dan kinerja kolom (kapasitas ‘k’, selektifitas ‘α’, jumlah pelat teoritis ‘N’, jarak setara dengan pelat teoritis ‘HETP’ dan resolusi ‘R’).
2.7.2.7 Fase Gerak
Fase gerak atau eluen biasanya terdiri atas campuran pelarut yang dapat bercampur yang secara keseluruhan berperan dalam daya elusi dan resolusi. Daya
elusi dan resolusi ini ditentukan oleh polaritas keseluruhan pelarut, polaritas fase diam, dan sifat komponen-komponen sampel (Johnson & Stevenson, 1991).
Dalam kromatografi cair komposisi pelarut atau fase gerak adalah satu variabel yang mempengaruhi pemisahan. Terdapat keragaman yang luas dari fase gerak yang digunakan dalam semua mode KCKT, tetapi ada beberapa sifat-sifat yang diinginkan yang mana umumnya harus dipenuhi oleh semua fase gerak. Fase gerak harus:
• Murni; tidak ada pencemar/kontaminan
• Tidak bereaksi dengan pengemas
• Sesuai dengan detektor
• Melarutkan cuplikan
• Mempunyai viskositas rendah
• Mudah rekoveri cuplikan, bila diinginkan
• Tersedia diperdagangan dengan harga yang pantas
Umumnya, pelarut-pelarut dibuang setelah digunakan karena prosedur pemurnian kembali membosankan dan mahal. Dari semua persyaratan di atas, 4 persyaratan pertama adalah yang paling penting.
Gelembung udara (degassing) yang ada harus dihilangkan dari pelarut, karena udara yang terlarut keluar melewati detektor dapat menghasilkan banyak noise sehingga data tidak dapat digunakan (Putra, 2007).
Elusi Gradien dan Isokratik
Sistem elusi gradien. Pada sistem ini, elusi dilakukan dengan campuran fase gerak yang perbandingannya berubah-ubah dalam waktu tertentu (komposisi fase gerak berubah-ubah selama elusi) (Putra, 2007).
2.7.3 Baku Dalam
Baku dalam terutama merupakan ragam yang berguna karena pemakaiannya secara tepat dapat memperkecil galat yang disebabkan oleh penyiapan cuplikan, peralatan dan cara.
Ada beberapa persyaratan yang harus dipenuhi oleh senyawa baku yakni: a. harus terpisah sama sekali dari puncak cuplikan
b. harus terelusi dekat dengan puncak yang diukur
c. konsentrasi dan tanggapan detektornya harus sama dengan konsentrasi dan tanggapan detektor puncak yang diukur
d. tidak boleh bereaksi dengan komponen cuplikan e. tidak terdapat dalam cuplikan asal
BAB III
METODOLOGI PENELITIAN
Penelitian ini merupakan penelitian deskriptif dan pengukuran dilakukan dengan menggunakan KCKT. Penelitian ini dilakukan di Laboratorium Biofarmasi Fakultas Farmasi USU dan di Laboratorium Penelitian Farmasi USU.
3.1 Alat
Alat-alat yang digunakan pada penelitian ini adalah timbangan, beaker gelas, neraca analitis (Baecho), pipet tetes, tabung sentrifugasi, rak tabung, gelas ukur, alat vortex (Health HVM-400), alat sentrifugasi (Health HC 1120T), termos es, spuit 1 ml, spuit 3 ml, politube, mikropipet, batang pengaduk, vial 2 ml, satu unit alat KCKT Agilent 1120 Compact LC, kolom ODS C18, wadah solven, injektor, syringe 50 µ l, sonifikator (Branson 1510) pompa vakum (Gast DOA-PG04-BN), kertas membran filter whatman Cellulose Nitrate 0,45 µ m, penyaring PTFE 0,2 µm. (Gambar alat dapat dilihat pada Lampiran 1 dan 2 halaman 37 dan 38).
3.2 Bahan
(sertifikat analisis dapat dilihat pada Lampiran 15 halaman 58), aquabidest (PT. Ikapharmindo Putramas), Heparin sodium inject (PT. B. Braun Medical Indonesia).
3.3 Pengambilan Sampel
Sampel yang diperiksa dalam penelitian ini adalah plasma darah pasien penderita TB yang sedang menjalani perawatan di klinik Dr. Zainuddin Amir Jl. Jemadi Medan. Pasien yang diambil darahnya adalah pasien yang telah mengkonsumsi obat TB kurang dari 2 bulan atau sedang menjalani fase intensif. (Data pasien dapat dilihat pada lampiran 13 halaman 56). Waktu pengambilan darah adalah 2 jam setelah meminum obat.
3.4 Rancangan Penelitian 3.4.1 Penyiapan Bahan 3.4.1.1 Pembuatan Pereaksi 3.4.1.1.1 Aqua Bebas CO2
Dibuat dengan mendidihkan air untuk injeksi segar selama tidak kurang dari 10 menit sambil mencegah hubungan dengan udara sesempurna mungkin, didinginkan, dan segera digunakan (Ditjen POM, 1972).
3.4.1.1.2 Natrium Hidroksida (NaOH) 0,2 N
3.4.1.1.3 Kalium Dihidrogen Fosfat 0,2 M
Dilarutkan 27,218 g kalium dihidrogen fosfat dalam air bebas CO2 secukupnya hingga 1000,0 ml (Ditjen POM, 1979).
3.4.1.1.4 Buffer Fosfat pH 7,4
Dibuat dengan mencampur 50,0 ml kalium dihidrogenfosfat 0,2 M dengan 39,1 ml natrium hidroksida 0,2 N, dan diencerkan dengan air bebas karbondioksida P hingga 200,0 ml (Ditjen POM, 1979).
3.4.1.2 Pembuatan Plasma Darah Pasien
Darah pasien diambil sebanyak 5 ml melalui vena, kemudian dimasukkan ke dalam venoject yang sudah terbasahi heparin. Venoject yang berisi darah disentrifugasi dengan kecepatan 4000 putaran permenit selama 5 menit. Diperoleh dua lapisan yaitu lapisan atas yang merupakan plasma dan endapan. Diambil lapisan atas (plasma).
3.4.1.3 Pembuatan Plasma Kontrol
Darah diambil dari donatur (dewasa dan sehat) sebanyak 5 ml melalui vena, kemudian dimasukkan ke dalam venoject yang sudah terbasahi heparin. Venoject yang berisi darah disentrifugasi dengan kecepatan 4000 putaran permenit
3.4.1.4 Pembuatan Fase Gerak
Fase gerak terdiri dari campuran buffer fosfat pH 7,4 dan metanol dengan perbandingan 96,8:3,2 . Fase gerak dibuat sebanyak 500 ml dengan mencampurkan buffer fosfat pH 7,4 sebanyak 484 ml dan metanol sebanyak 16 ml. Sebelum digunakan fase gerak disaring melalui penyaring membran whatman cellulose nitrate 0,45 µ m. Kemudian diawaudarakan selama ± 20 menit menggunakan sonifikator.
3.4.1.5 Pembuatan Larutan Induk
3.4.1.5.1 Pembuatan Larutan Induk Baku Isoniazid
Ditimbang seksama sejumlah 5 mg isoniazid baku lalu dimasukkan ke dalam labu tentukur 10 ml, dilarutkan dengan fase gerak (buffer fosfat pH 7,4:metanol dengan perbandingan 96,8:3,2) sehingga diperoleh konsentrasi 3.6459 mM (500 mcg/ml).
2.4.1.6.2 Pembuatan Larutan Induk Nikotinamid
Ditimbang seksama 20 mg nikotinamid lalu dimasukkan ke dalam labu tentukur 10 ml, dilarutkan dengan fase gerak (buffer posfat pH 7,4:metanol dengan perbandingan 96,8:3,2) hingga diperoleh larutan dengan konsentrasi 16,3 mM (2.000 mcg/ml).
3.4.2 Prosedur Analisis
3.4.2.1 Penyiapan Alat KCKT
Dipurging untuk menghilangkan gelembung pada selang, kemudian dialirkan fase gerak hingga laju alir 0,8 ml/menit. Biarkan hingga kondisi alat stabil.
3.4.2.2 Penentuan Garis Alas (Base Line)
Setelah dialirkan fase gerak selama 30 menit, dilihat absorbansi apakah telah stabil, jika telah stabil absorbansi di nol kan dengan cara click to balance.
3.4.2.3 Penyuntikan Fase Gerak
Untuk mengetahui kebersihan injektor, maka dilakukan penyuntikan fase gerak dengan cara: tekan single run, tulis nama sampel dan tekan OK. Injektor diputar ke posisi load dan disuntikkan fase gerak ke dalam injektor dengan menggunakan penyuntik mikroliter, injektor diputar ke posisi inject (kromatogram hasil penyuntikan plasma kosong dapat dilihat pada lampiran 4 halaman 42).
3.4.2.4 Penyuntikan Plasma Kontrol
3.4.2.5 Analisis Kualitatif
Analisis kualitatif isoniazid dapat dilakukan dengan membandingkan waktu retensi yang sama dari kromatogram pada penyuntikan sampel dengan kromatogram pada penyuntikan larutan baku pembanding isoniazid (kromatogram hasil penyuntikan larutan baku dapat dilihat pada lampiran 5 halaman 43).
3.4.2.6 Analisis Kuantitatif
Kurva kalibrasi dibuat dengan menggunakan rasio luas puncak antara bahan obat dengan baku dalam yang terukur oleh detektor versus konsentrasi bahan obat untuk memperoleh garis regresi linier (kromatogram dapat dilihat pada lampiran 9 halaman 47 dan data perhitungan dapat dilihat pada lampiran 10 halaman 52).
3.4.2.6.2 Pemeriksaan Kadar Isoniazid Dalam Plasma Darah Pasien TB Kedalam plasma darah pasien ditambahkan 50 µ m nikotinamid 16,3 mM (2.000 mcg/ml). Didiamkan selama 5 menit. Dipipet 300 µl ditambahkan 600 µ l metanol untuk mengendapkan protein lalu divortex. Disentrifugasi dengan kecepatan 4000 putaran per menit selama 5 menit. Supernatan yang diperoleh diambil dengan menggunakan spuit kemudian disaring dengan penyaring PTFE diameter 0,2 µm, lalu diinjeksikan ke dalam sistem KCKT dengan volume penyuntikan 20 µ l dengan laju aliran (flow rate) 0,8 ml/menit, deteksi pada panjang gelombang 254 nm. Dilihat kromatogram yang terbentuk dan waktu retensinya. Dihitung kadar obat dalam plasma dengan menghitung luas areanya puncak (kromatogram dapat dilihat pada lampiran 8 halaman 46 dan data perhitungan dapat dilihat pada lampiran 9 halaman 47).
3.4.3 Penentuan Batas Deteksi dan Batas Kuantifikasi
dalam sampel yang masih dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan.
LOD =
Standar deviasi (SD) dapat ditentukan berdasarkan pada standar deviasi blanko, pada standar deviasi residual dari garis regresi (Rohman, 2007)
Standar deviasi residual (Sy) =
2
BAB IV
HASIL DAN PEMBAHASAN
Analisis isoniazid dalam plasma secara Kromatografi Cair Kinerja Tinggi (KCKT) fase balik telah dilakukan oleh Revankar, S.N.,et al.,(1994) menggunakan fase gerak buffer fosfat pH 7,4 dan metanol (96,8:3,2 v/v) pada panjang gelombang 268 nm dan baku dalam nikotinamid. Menurut Gandjar dan Rohman (2007), panjang gelombang yang dipilih biasanya 254 nm karena kebanyakan senyawa obat menyerap di 254 nm. Menurut Munson (1991), detektor ini tanggap terhadap banyak obat dan kepekaannya memadai bagi penetapan sediaan obat dan kebanyakan cairan biologi. Berdasarkan hal tersebut maka pemeriksaan kadar isoniazid dalam plasma darah pasien TB dilakukan secara KCKT dengan menggunakan kolom ODS C18, fase gerak buffer posfat pH 7,4:metanol (96,8:3,2 v/v) dan panjang gelombang 254 nm dengan baku dalam nikotinamid.
Gambar 6. Kromatogram hasil penyuntikan isoniazid baku
Gambar 7. Kromatogram hasil penyuntikan nikotinamid baku
Gambar 8. Kromatogram hasil penyuntikan sampel dengan baku dalam Nikotinamid
Sampel darah diambil dari pasien penderita TB yang berumur 25 tahun dengan berat badan 49 kg. Pasien berada dalam pengobatan selama 1 bulan. Dosis yang diminum oleh pasien adalah 225 mg. Pengambilan darah dilakukan setelah 2 jam pasien mengkonsumsi obat.
Untuk suatu obat yang diberikan dalam dosis oral berulang waktu yang diperlukan untuk mencapai keadaan tunak bergantung pada waktu paruh eliminasi obat. Dari segi klinik, waktu yang diperlukan untuk mencapai 99% dari konsentrasi tunak dalam plasma adalah 6,6 waktu paruh eliminasi (Shargel, 1988).
Isoniazid di dalam tubuh mengalami proses asetilasi menjadi asetil isoniazid dan proses hidrolisis yang dihidrolisa menjadi asam nikotinad (Tjay dan Rahardja, 2002). Namun pada temperatur kamar, isoniazid berada dalam kondisi stabil. Kestabilan isoniazid ditunjukkan pada kromatogram sampel dimana pada kromatogram tidak ditemukan adanya puncak lain.
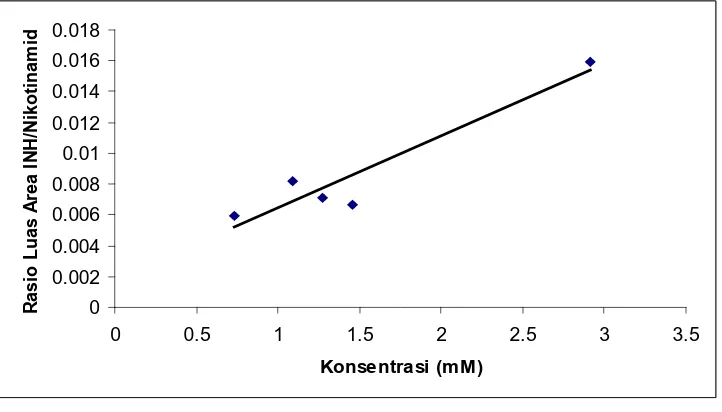
Penentuan linieritas kurva kalibrasi isoniazid baku ditentukan berdasarkan rasio luas puncak isoniazid dengan luas puncak nikotinamid pada konsentrasi 0,7292 mM (100mcg/ml); 1,0938 mM (150mcg/ml); 1,2761 mM (175mcg/ml); 1,4584 mM (200mcg/ml); 2,9167 mM (400mcg/ml), diperoleh hubungan yang linier dengan koefisien korelasi (r) = 0,9482 dan persamaan regresi y = 0,004639904 x + 0,001832305 dengan data penyuntikan larutan isoniazid baku. Kurva kalibrasi dapat dilihat pada gambar di bawah ini:
0
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Kadar isoniazid dalam plasma darah pasien dapat diperiksa dengan cara kromatografi cair kinerja tinggi (KCKT) menggunakan kolom ODS-C18 dengan fase gerak campuran buffer posfat pH 7,4:metanol (96,8 :3,2), dengan laju alir 0,8 ml/menit pada panjang gelombang 254 nm menggunakan baku dalam nikotinamida. Kadar yang diperoleh adalah 0,92193mM
2. Kondisi isoniazid dalam plasma pasien TB stabil pada temperatur kamar
5.2 Saran
Disarankan kepada peneliti selanjutnya agar melakukan validasi metode sehingga diperoleh hasil yang lebih baik.
Anonima. (2009). Terus Berjuang Lawan TBC. Tanggal akses 18 April 2009. Dikut ip dari http
Anonimb. (2008). Kemajuan Diagnosis dan Pengobatan TB-MDR dan TB-XDR Ternyata Lamban. Tanggal akses 20 April 2009. Dikutip dari
http:/
Chambers, H.F. (2004). Obat Antimikrobakteri. Dalam: Farmakologi Dasar dan Klinik. Buku Ketiga. Edisi kedelapan. Editor: Bagian Farmakologi Fakultas Kedokteran Universitas Airlangga. Jakarta: Penerbit Salemba Medika. Hal. 98.
Ditjen POM. (1972). Farmakope Indonesia Edisi II. Jakarta: Departemen Kesehatan RI. Hal. 667.
Ditjen POM. (1979). Farmakope Indonesia Edisi III. Jakarta: Departemen Kesehatan RI. Hal. 746, 748, 755.
Gandjar, G.I., dan Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Hal. 333-388, 468.
Hadjar, M. M. (1985 ), Teknik Analisis Obat Dalam Cairan Biologis Dengan GLC dan HPLC. Majalah Cermin Dunia Kedokteran. Volume (37): 26
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Majalah Ilmu Kefarmasian. Volume I (3): 129.
Junqueira, L.C., dan Caneiro, J. (1982). Histologi Dasar. Edisi Ketiga. Alih BahasaAdji Dharma. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 254-255.
Johnson, E. L. dan Stevenson, R (1978). Basic Lliquid Chromatography. California:Varian. Hal. 246-247.
Munson, J.W. (1991). Pharmaceutical Analysis Modern Methods. Part B. Penerjemah Harjana. Analisis Farmasi Metode Modern. Parwa B., Penerbit Airlangga University Press. Surabaya. Hal. 14,43.
Revankar SN, Desai ND, Vaidya, AB, Bhatt AD, Anjaneluyu B., (1994). Determination of Pyrazinamide in Human by High Performance Liquid Chromatography. J. Postgrad Med. 40(1): 7-9.
Tjay, T.H., dan Raharja, K. (2002), Tuberkulostatika dalam Obat Obat Penting. Edisi Kelima. Cetakan Kedua. Jakarta: Penerbit PT. Elex Media Komputindo. Hal.
Zubaidi, Yusuf. (2001). Tuberkulostatik dan Leprostatik dalam Farmakologi dan Terapi. Edisi 4. Editor. Ganiswarna, S.G. Jakarta: Penerbit Fakultas Kedokteran Indonesia. Hal. 602.
Alat KCKT
Lampiran 2. Gambar Perangkat Penelitian Lainnya
Ultrasonic cleaner
sentrifugasi Lampiran 2. (Lanjutan)
Lampiran 2. (Lanjutan)
Lampiran 9. Kromatogram Penyuntikan Larutan Isoniazida Baku pada Pembuatan Kurva Kalibrasi
Lampiran 9. (Lanjutan)
B. Kromatogram dari Larutan Isoniazid Baku Konsentrasi 1,0938 mM (150 mcg/ml)
Lampiran 9. (Lanjutan)
Lampiran 9. (Lanjutan)
Lampiran 9. (Lanjutan)
Lampiran 10. Perhitungan Persamaan Regresi dan Kurva Kalibrasi Isoniazid Baku yang Diperoleh Secara KCKT pada λ 254 nm
Data rasio luas puncak dari penyuntikan larutan isoniazid baku konsentrasi 0,7292 mM – 2,9167 mM dalam plasma dengan baku dalam nikotinamid konsentrasi 16,3 mM
Data kalibrasi isoniazid baku, rasio luas puncak isoniazid dengan nikotinamid (Y) terhadap konsentrasi (X)
NO X Y XY X2 Y2
1 0,7292 0,00596 0,004343 0,531733 0,000035478700960 2 1,0938 0,00818 0,008948 1,196398 0,000066928761000 3 1,2761 0,00709 0,009047 1,628431 0,000050259592360 4 1,4584 0,00664 0,009688 2,126931 0,000044129449000 5 2,9167 0,01597 0,046583 8,507139 0,000255082423690
Σ 7,4742 0,043841 0,07861 13,99063 0,000451879 Rata-rata 1,49484 0,008768
Konsentrasi Luas Area Puncak Rasio INH/NIKO
y = a x + b b = y – a.x
= 0,006011 – (0,004639904).(1,4948) = 0,006011 – 0,006935728
= 0,001832305
Sehingga diperoleh persamaan regresi y = 0,004639904 x + 0.001832305
Lampiran 11. Perhitungan Konsentrasi Obat Isoniazid Konsentrasi obat:
Luas puncak isoniazid (sampel) = 168.782 Luas puncak nikotinamid (baku dalam = 27.846.644 Maka rasio luas puncak sampel dan baku dalam (Y) = 0,00611
Y = 0,004639904 x + 0,001832305
0,00611 = 0,004639904 x + 0,001832305 0,004277694 = 0,004639904 x
X = 0,92193mM = 0,00092193 M = 0,00092193 x 137,14 = 0,1264 gr/L
Lampiran 12. Perhitungan Batas Deteksi dan Batas Kuantifikasi Isoniazid Persamaan garis regresi Isoniazid BPFI:
y = a x + b
y = 0,004639904 x + 0,001832305
N0 X Y Yi (Y-Yi)2
1 0,7292 0,0059564 0,005215723 0,000000548602418329 2 1,0938 0,008181 0,006907432 0,000001621975450624 3 1,2761 0,0070894 0,007753286 0,000000440745948769 4 1,4584 0,006643 0,008599193 0,000003826694965636 5 2,9167 0,0159713 0,029503208 0,000183112534120464
Lampiran 13. Data Pasien
Nama : Rommel
Umur : 25 tahun Jenis Kelamin : Laki-laki Berat Badan : 49 kg
Lampiran 17. Pembuatan Plasma dari Sampel Darah Pasien TB
Diambil darahnya sebanyak 5 ml melalui vena
Dimasukkan ke dalam venoject yang telah terbasahi 0,5 ml heparin
Dipisahkan supernatan dari endapan Disentrifugasi dengan kecepatan 4000 putaran per menit selama 5 menit Pasien TB
Darah + heparin di dalam venoject
Lapisan atas (plasma
Lapisan bawah (endapan)
Lampiran 18. Pembuatan Plasma Kontrol
Diambil darahnya sebanyak 5 ml melalui vena Dimasukkan ke dalam venoject yang
telah terbasahi 0,5 ml heparin
Dipisahkan supernatan dari endapan Disentrifugasi dengan kecepatan 4000 putaran per menit selama 5 menit Donatur (dewasa dan sehat)
Darah + heparin di dalam venoject
Lapisan atas (plasma)
Lapisan bawah (endapan
Lampiran 19. Pembuatan Larutan Induk Baku Isoniazid Isoniazid Baku
Ditimbang sebanyak 5 mg
Dimasukkan ke dalam labu tentukur 10 ml
Dilarutkan dengan fase gerak Dicukupkan sampai garis tanda LIB isoniazid konsentrasi
Lampiran 20. Pembuatan Larutan Induk Nikotinamid Nikotinamid
Ditimbang sebanyak 20 mg
Dimasukkan ke dalam labu ukur 10 ml Dilarutkan dengan fase gerak
Dicukupkan sampai garis tanda LIB Nikotinamid
Lampiran 21. Penyuntikan Plasma Kontrol
Dipipet sebanyak 300 µ l Dimasukkan ke dalam politube
Supernatan Endapan
Plasma
Ditambahkan 600 µ l methanol, lalu divortex Disentrifugasi dengan kecepatan 4000 putaran per menit selama 5 menit
Dipisahkan menggunakan spuit
Disaring menggunakan PTFE ø 0,2 µm
Lampiran 22. Penentuan Linieritas Kurva Kalibrasi Baku Pembanding Isoniazid
Dipipet sebanyak 200 μl; 300 μl; 350 μl; 400 μl; 800 μl
Supernatan Endapan
LIB Isoniazid
Dimasukkan ke dalam vial yang telah dikalibrasi 1 ml
Dicukupkan dengan fase gerak sampai garis tanda
Larutan isoniazid dengan 0,7292mM; 1,0938mM; 1,2761mM; 1,4584mM: 2,9167mM.
Dipipet sebanyak 10 µ l
Dimasukkan plasma ke dalam vial 2 ml sampai garis tanda Divortex lalu didiamkan selama 5 menit
Dipipet sebanyak 300 µ l
Ditambahkan 600 µ l metanol lalu divortex Disentrifugasi dengan kecepatan 4000 putaran per menit selama 5 menit Ditambah sebanyak 50 µl nikotinamid ke masing-masing vial
Dimasukkan ke dalam vial yang telah dikalibrasi 2 ml
Lanjutan:
Supernatan
Dipisahkan menggunakan spuit Disaring menggunakan PTFE ø 0,2
Diinjeksikan ke dalam sistem KCKT sebanyak 20 µ l Kromatogram
Diperoleh Rt dan luas puncak
Hasil
Lampiran 23. Pemeriksaan Kadar Isoniazid Dalam Plasma Darah Pasien
Didiamkan selama 5 menit Diambil 300 µ l plasma
Ditambahkan 50 µ m nikotinamid 16,3 mM (2.000 mcg/ml), divortex
Dimasukkan ke dalam politube
Supernatan Endapan
Plasma pasien
Ditambahkan 600 µ l metanol, lalu divortex Disentrifugasi dengan kecepatan 4000 putaran per menit selama 5 menit
Dipisahkan menggunakan spuit
Disaring menggunakan PTFE ø 0,2 µm
Diinjeksikan ke dalam sistem KCKT sebanyak 20 µL Kromatogram plasma +
obat
Diperoleh Rt dan luas puncak Dihitung konsentrasi yang didapat