PEMERIKSAAN KADAR PIRAZINAMIDA DALAM PLASMA DARAH PASIEN TB MENGGUNAKAN KROMATOGRAFI CAIR KINERJA TINGGI DENGAN FASE GERAK BUFFER FOSFAT pH 7,4 : METANOL
DAN BAKU DALAM NIKOTINAMID
SKRIPSI
OLEH:
ANGGELIA PANGARIBUAN NIM 050804042
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PEMERIKSAAN KADAR PIRAZINAMIDA DALAM PLASMA DARAH PASIEN TB MENGGUNAKAN KROMATOGRAFI CAIR KINERJA TINGGI DENGAN FASE GERAK BUFFER FOSFAT pH 7,4 : METANOL
DAN BAKU DALAM NIKOTINAMID
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk meperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
ANGGELIA PANGARIBUAN NIM 050804042
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Pembimbing II,
(Prof. Dr. M. Timbul Simanjuntak, M.Sc., Apt.) NIP 19521204198002 1 001
LEMBAR PENGESAHAN SKRIPSI
PEMERIKSAAN KADAR PIRAZINAMIDA DALAM PLASMA DARAH PASIEN TB MENGGUNAKAN KROMATOGRAFI CAIR KINERJA TINGGI DENGAN FASE GERAK BUFFER FOSFAT pH 7,4 : METANOL
DAN BAKU DALAM NIKOTINAMID OLEH:
ANGGELIA PANGARIBUAN NIM 050804042
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara
Pada Tanggal : Agustus 2010
Medan, Agustus 2010 Fakultas Farmasi Universitas Sumatera Utara
Dekan,
(Prof. Dr. Sumadio Hadisahputra., Apt.) NIP. 19531128198303 1 002 Pembimbing I,
(Dr. Karsono, Apt.)
NIP 19540909198201 1 001
Panitia Penguji,
(Dr. Rosidah, M.Si., Apt.) NIP 19510326197802 2 001
(Dr. Karsono, Apt.)
NIP 19540909198201 1 001
(Dr. Kasmirul Ramlan Sinaga, MS., Apt.) NIP 19550424198303 1 003
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa yang telah melimpahkan
anugerah dan kemurahanNya sehingga penulis dapat menyelesaikan skripsi yang
berjudul "Pemeriksaan Kadar Pirazinamida Dalam Plasma Darah Pasien TB
Menggunakan kromatografi Cair Kinerja Tinggi Dengan Fase Gerak Buffer Fosfat
pH 7,4 : Metanol dan Baku Dalam Nikotinamid". Skripsi ini diajukan sebagai
salah satu syarat guna memperoleh gelar Sarjana Farmasi dari Fakultas Farmasi
Universitas Sumatera Utara.
Tuberkulosis (TB) merupakan masalah kesehatan, baik dari sisi angka
kematian (mortalitas), angka kejadian penyakit (morbiditas), maupun diagnosis
dan terapinya. Kasus TB ini meningkat disebabkan tingginya angka resistensi
terhadap obat TB. Penyebab utama terjadinya kegagalan pengobatan tuberkulosis
adalah penderita tidak mematuhi ketentuan dan lamanya pengobatan secara teratur
untuk mencapai kesembuhan. Pirazinamida digunakan dalam fase pengobatan
awal untuk aktivitas bakterisidnya. Pirazinamida merupakan suatu obat garis
depan yaitu sebagai agen “sterilisator” aktif untuk melawan sisa-sisa organisme
intraseluler yang dapat mengakibatkan kekambuhan. Tujuan penelitian ini adalah
untuk memeriksa kadar pirazinamida dalam plasma darah pasien TB. Hasil
penelitian ini diharapkan dapat digunakan sebagai uji pendahuluan untuk
kepentingan pemantauan terapi obat dalam darah pasien yang berpenyakit TB
guna membantu dalam penyesuaian dosis obat sehingga diperoleh pengobatan
yang optimal.
Pada kesempatan ini penulis hendak menyampaikan rasa hormat dan
terimakasih yang sebesar-besarnya kepada Bapak Dr. Karsono, Apt. Dan Bapak
Prof. Dr. M. Timbul Simanjuntak, M.Sc., Apt., yang telah banyak memberikan
bimbingan dan bantuan selama penelitian dan penulisan skripsi ini berlangsung.
Ucapan terimakasih juga penulis sampaikan kepada Dekan Fakultas Farmasi
Universitas Sumatera Utara, Bapak Prof. Dr. Sumadio Hadisahputra, Apt., yang
telah memberikan fasilitas selama masa pendidikan dan penelitian, juga kepada
Ibu Dr. Rosidah, M.Si., Apt., Bapak Dr. Kasmirul Ramlan Sinaga, MS., Apt., dan
Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, SU., Apt., selaku dosen penguji
Dalam kesempatan ini, penulis ingin menyampaikan rasa terimakasih dan
penghargaan yang tulus kepada kedua orang tua, abang Martin, dan kedua adekku,
Arisa dan Yosafat atas doa, semangat, dan dorongan dalam menyelesaikan skripsi
ini. Juga kepada Yuliari, Suji, Desi, Fenti, Ka Irus, Bang Anton, yang selalu ada
memberi semangat dan pikiran selama penelitian dan penyusunan skripsi ini.
Tidak lupa penulis ingin mengucapkan terimakasih kepada teman-teman stambuk
2005, staf dan para asisten di Laboratorium Biofarmasi dan Laboratorium
Penelitian, yang tidak dapat disebutkan namanya satu persatu, atas segala dorongan
motivasi dan bantuannya kepada penulis sehingga skripsi ini dapat selesai .
Medan, Agustus 2010
Penulis,
PEMERIKSAAN KADAR PIRAZINAMIDA DALAM PLASMA DARAH PASIEN TB MENGGUNAKAN KROMATOGRAFI CAIR KINERJA TINGGI DENGAN FASE GERAK BUFFER FOSFAT pH 7,4 : METANOL
DAN BAKU DALAM NIKOTINAMID
Abstrak
Tuberculosis merupakan suatu penyakit yang disebabkan adanya infeksi
oleh bakteri Mycobacterium tuberculosis. Pirazinamida adalah salah satu obat
yang digunakan dalam pengobatan tahap awal untuk aktivitas bakterisidnya.
Metode kromatografi cair kinerja tinggi (KCKT) fase balik dengan deteksi
ultraviolet dilakukan untuk memeriksa kadar pirazinamida dalam plasma.
Nikotinamid digunakan sebagai baku dalam. Obat dideteksi pada panjang
gelombang 254 nm. Pemisahan pirazinamida dan nikotinamid dilakukan pada
kolom ODS C18. Fase gerak terdiri dari buffer fosfat (pH 7,4) dan metanol
(96,8:3,2 v/v) dan dielusi pada laju 0,8 ml/menit. Pirazinamida dan nikotinamid
terelusi pada waktu retensi 20,660 menit dan 24,313 menit. Sedangkan batas
deteksi dan batas kuantifikasi berturut-turut adalah 1,4253 mM dan 4,3189 mM.
Kalibrasi dan analisis dilakukan berdasarkan pada rasio luas puncak
pirazinamida dan nikotinamid. Kurva kalibrasi linier pada jarak konsentrasi
2,4368 - 6,4982 mM dengan koefisien korelasi (r) yaitu 0,9725.
Berdasarkan hasil pemeriksaan ini, maka kadar pirazinamida dalam
plasma darah pasien tuberkulosis adalah sebesar 2,4537 mM.
EXAMINATION OF PYRAZINAMIDE LEVEL IN BLOOD PLASMA OF TUBERCULOSIS PATIENT BY HIGH PERFORMANCE LIQUID
CHROMATOGRAPHY USING PHOSPHATE BUFFER pH 7,4 : METHANOL AND NICOTINAMIDE
AS INTERNAL STANDARD
Abstract
Tuberculosis is a disease caused by an infection with the bacteria
Mycobacterium tuberculosis. Pyrazinamide is one of the drug used in the initial
phase of treatment for its bactericidal activity.
A reversed phase high performance liquid chromatography (HPLC)
method with ultraviolet detection was developed for the examination of
pyrazinamide level in plasma. Nicotinamide is used as an internal standard. Drug
were detected at 254 nm. The separation of Pyrazinamide and nicotinamide was
performed on C18 ODS colomn. Mobile phase composed of phosphate buffer (pH
7,4) and methanol (96,8:3,2 v/v) and eluted at 0,8 ml/min. Pirazinamide and
nicotinamide was eluted at 20,660 min and 24,313 min, respectively. Limit of
detection and limit of quantitation are 1,4253 mM and 4,3189 mM, respectively.
Calibration and analysis is based on pyrazinamide/nicotinamide peak area
ratio. Calibration curve was linear over the concentration range 2,4368 - 6,4982
mM with the correlation coefficient (r) = 0,9725.
Based on this examination, the level of pyrazinamide in blood plasma of
tuberculosis patient is 2,4537 mM.
2.5 Kromatografi ... 15
2.5.1 Teori Kromatografi ... 15
2.5.2 Parameter dalam Kromatografi ... 16
2.5.2.1 Tinggi dan Luas Puncak ... 16
2.5.3 Kromatografi Cair Kinerja Tinggi ... 20
2.5.3.1 Jenis-jenis Kromatografi Cair Kinerja Tinggi ... 22
2.5.3.2 Komponen Kromatografi Cair Kinerja Tinggi ... 23
2.5.3.2.1 Wadah Fase Gerak ... 23
2.5.4 Metode Kuantifikasi dengan Baku dalam ... 27
2.5.5 Nikotinamid ... 29
BAB III METODOLOGI PENELITIAN ... 30
3.1 Alat ... 30
3.2 Bahan ... 30
3.4 Rancangan Penelitian... 31
3.4.1.5.1 Pembuatan Larutan Induk Baku Pirazinamida ... 33
3.4.1.5.2 Pembuatan Larutan Induk Baku Nikotinamida ... 33
3.4.1.5.2.1 Pembuatan Larutan Induk Pertama ... 33
3.4.2.6.1 Penentuan Linearitas Kurva Kalibrasi
Baku Pembanding Pirazinamida ... 35
3.4.2.6.2 Pemeriksaan Kadar Pirazinamida Dalam Plasma Darah Pasien TB ... 36
3.4.3 Penentuan Batas Deteksi dan Batas Kuantifikasi ... 37
BAB IV HASIL DAN PEMBAHASAN ... 38
BAB V KESIMPULAN DAN SARAN ... 43
5.1 Kesimpulan ... 43
5.2 Saran ... 43
DAFTAR PUSTAKA ... 44
DAFTAR GAMBAR
Halaman
Gambar 1 Rumus bangun pirazinamida ... 8
Gambar 2 Skematis hasil sentrifugasi darah dengan penambahan Antikoagulan ... 14
Gambar 3 Pengukuran efisiensi kromatografi dari puncak Gaussian ... 18
Gambar 4 Menghitung besarnya tailing factor pada kromatogram... 20
Gambar 5 Sistem KCKT isokratik ... 23
Gambar 6 Rumus bangun nikotinamid ... 29
Gambar 7 Kromatogram Hasil Penyuntikan Pirazinamida Baku ... 39
Gambar 8 Kromatogram Hasil Penyuntikan Nikotinamid Baku ... 39
Gambar 9 Kromatogram Hasil Penyuntikan Sampel dengan Baku Dalam Nikotinamid ... 41
DAFTAR LAMPIRAN
Lampiran 5 Kromatogram Penyuntikan Larutan Pirazinamida Baku, Fase Gerak Buffer Fosfat pH 7,4 : Metanol (96,8:3,2) ... 53
Lampiran 6 Kromatogram Penyuntikan Larutan Nikotinamid Baku, Fase Gerak Buffer Fosfat pH 7,4 : Metanol (96,8:3,2) ... 54
Lampiran 7 Kromatogram Penyuntikan Plasma Kontrol ... 55
Lampiran 8 Kromatogram Penyuntikan Sampel Plasma Darah Pasien TB . 56
Lampiran 9 Kromatogram Penyuntikan Larutan Pirazinamida Baku pada Pembuatan Kurva Kalibrasi ... 57
Lampiran 10 Perhitungan Persamaan Regresi dan Kurva Kalibrasi Pirazinamida Baku yang Diperoleh Secara KCKT pada λ 254 nm ... 62
Lampiran 11 Perhitungan Konsentrasi Obat Pirazinamida... 64
Lampiran 12 Perhitungan Batas Deteksi dan Batas Kuantifikasi Pirazinamida ... 65
Lampiran 13 Data Pasien ... 66
Lampiran 14 Sertifikat Analisis Pirazinamida ... 67
Lampiran 15 Sertifikat Analisis Nikotinamid ... 68
Lampiran 16 Surat Persetujuan Komisi Etik ... 69
Lampiran 17 Pembuatan Plasma dari Sampel Darah Pasien TB ... 70
Lampiran 19 Pembuatan Larutan Induk Baku Pirazinamida ... 72
Lampiran 20 Pembuatan Larutan Induk Baku Pertama Nikotinamid ... 73
Lampiran 21 Pembuatan Larutan Induk Baku Kedua Nikotinamid ... 74
Lampiran 22 Penyuntikan Plasma Kontrol ... 75
Lampiran 23 Pembuatan Linearitas Kurva Kalibrasi Baku Pembanding Pirazinamida ... 76
PEMERIKSAAN KADAR PIRAZINAMIDA DALAM PLASMA DARAH PASIEN TB MENGGUNAKAN KROMATOGRAFI CAIR KINERJA TINGGI DENGAN FASE GERAK BUFFER FOSFAT pH 7,4 : METANOL
DAN BAKU DALAM NIKOTINAMID
Abstrak
Tuberculosis merupakan suatu penyakit yang disebabkan adanya infeksi
oleh bakteri Mycobacterium tuberculosis. Pirazinamida adalah salah satu obat
yang digunakan dalam pengobatan tahap awal untuk aktivitas bakterisidnya.
Metode kromatografi cair kinerja tinggi (KCKT) fase balik dengan deteksi
ultraviolet dilakukan untuk memeriksa kadar pirazinamida dalam plasma.
Nikotinamid digunakan sebagai baku dalam. Obat dideteksi pada panjang
gelombang 254 nm. Pemisahan pirazinamida dan nikotinamid dilakukan pada
kolom ODS C18. Fase gerak terdiri dari buffer fosfat (pH 7,4) dan metanol
(96,8:3,2 v/v) dan dielusi pada laju 0,8 ml/menit. Pirazinamida dan nikotinamid
terelusi pada waktu retensi 20,660 menit dan 24,313 menit. Sedangkan batas
deteksi dan batas kuantifikasi berturut-turut adalah 1,4253 mM dan 4,3189 mM.
Kalibrasi dan analisis dilakukan berdasarkan pada rasio luas puncak
pirazinamida dan nikotinamid. Kurva kalibrasi linier pada jarak konsentrasi
2,4368 - 6,4982 mM dengan koefisien korelasi (r) yaitu 0,9725.
Berdasarkan hasil pemeriksaan ini, maka kadar pirazinamida dalam
plasma darah pasien tuberkulosis adalah sebesar 2,4537 mM.
EXAMINATION OF PYRAZINAMIDE LEVEL IN BLOOD PLASMA OF TUBERCULOSIS PATIENT BY HIGH PERFORMANCE LIQUID
CHROMATOGRAPHY USING PHOSPHATE BUFFER pH 7,4 : METHANOL AND NICOTINAMIDE
AS INTERNAL STANDARD
Abstract
Tuberculosis is a disease caused by an infection with the bacteria
Mycobacterium tuberculosis. Pyrazinamide is one of the drug used in the initial
phase of treatment for its bactericidal activity.
A reversed phase high performance liquid chromatography (HPLC)
method with ultraviolet detection was developed for the examination of
pyrazinamide level in plasma. Nicotinamide is used as an internal standard. Drug
were detected at 254 nm. The separation of Pyrazinamide and nicotinamide was
performed on C18 ODS colomn. Mobile phase composed of phosphate buffer (pH
7,4) and methanol (96,8:3,2 v/v) and eluted at 0,8 ml/min. Pirazinamide and
nicotinamide was eluted at 20,660 min and 24,313 min, respectively. Limit of
detection and limit of quantitation are 1,4253 mM and 4,3189 mM, respectively.
Calibration and analysis is based on pyrazinamide/nicotinamide peak area
ratio. Calibration curve was linear over the concentration range 2,4368 - 6,4982
mM with the correlation coefficient (r) = 0,9725.
Based on this examination, the level of pyrazinamide in blood plasma of
tuberculosis patient is 2,4537 mM.
BAB I PENDAHULUAN
1.1Latar Belakang
Insidensi tuberkulosis (TB) dilaporkan meningkat secara drastis pada
dekade terakhir ini di seluruh dunia. Demikian pula di Indonesia, tuberkulosis/TB
merupakan masalah kesehatan, baik dari sisi angka kematian (mortalitas), angka
kejadian penyakit (morbiditas), maupun diagnosis dan terapinya. Hasil survei
Kesehatan Rumah Tangga Depkes RI tahun 1992, menunjukkan bahwa
tuberkulosis/TB merupakan penyakit kedua penyebab kematian (Anonim1, 2008).
Kasus TB ini meningkat disebabkan tingginya angka resistensi terhadap
obat TB. Resistensi ini disebabkan antara lain karena pemakaian obat anti
tuberkulosis (OAT) tunggal, kombinasi OAT yang tidak memadai, dan pemakaian
yang tidak teratur. Penyebab utama terjadinya kegagalan pengobatan tuberkulosis
adalah penderita tidak mematuhi ketentuan dan lamanya pengobatan secara teratur
untuk mencapai kesembuhan, terutama pemakaian obat secara teratur pada 2
bulan fase awal (Chuluq, dkk., 2004).
Penggunaan Obat Anti TB yang dipakai dalam pengobatan TB adalah
antibotik dan anti infeksi sintetis untuk membunuh kuman Mycobacterium.
Aktifitas obat TB didasarkan atas tiga mekanisme, yaitu aktifitas membunuh
bakteri, aktifitas sterilisasi, dan mencegah resistensi. Obat yang umum dipakai
adalah isoniazid, etambutol, rifampisin, pirazinamida, dan streptomisin.
Kelompok obat ini disebut sebagai obat primer (Crofton, dkk., 2002). Isoniazid
isoniazid-rifampisin yang diberikan selama 9 bulan akan menyembuhkan 95-98% kasus
tuberkulosis yang disebabkan oleh strain yang peka (yang rentan). Tambahan
pirazinamida pada kombinasi ini untuk 2 bulan pertama akan mempersingkat lama
terapi sampai menjadi 6 bulan tanpa kehilangan efikasinya (Chamber, H.F., 2004).
Pirazinamida merupakan obat bakterisidal yang kuat. Terutama efektif
untuk membunuh TB yang berada di dalam sel-sel. Sangat berguna untuk
pengobatan jangka pendek (Crofton, dkk., 2002). Pirazinamida digunakan dalam
fase pengobatan awal untuk aktivitas bakterisidnya yaitu mencegah secara
perlahan metabolisme basilnya yang menyebabkan penurunan tingkat
kekambuhan setelah pengobatan kemoterapi (Becker,et.all., 2007). Pirazinamida
merupakan suatu obat garis depan yaitu sebagai agen “sterilisator” aktif untuk
melawan sisa-sisa organisme intraseluler yang dapat mengakibatkan kekambuhan
(Chamber, H.F., 2004).
Kadar obat dalam cairan biologis yang umumnya sangat kecil membatasi
metoda-metoda yang dapat digunakan untuk menetapkan kadarnya. Selain itu,
dalam cairan biologis obat ada bersama-sama dengan metabolit-metabolitnya
dengan struktur kimia yang hampir mirip. Metode analisis obat dalam cairan
biologis mempunyai arti yang sangat penting. Masalah-masalah yang
berhubungan dengan studi ketersediaan hayati obat, pengembangan obat baru,
penyalahgunaan obat, farmakokinetika klinik dan riset obat –obatan, semuanya
menuntut adanya metode analisis obat dalam sampel biologis dengan kepekaan,
kespesifikan, kecepatan, ketepatan dan ketelitian yang tinggi, tetapi dengan biaya
selain mampu mendeteksi dan menetapkan kadar, juga sekaligus mampu
melakukan pemisahan (Hadjar, 1985).
Metode kromatografi cair kinerja tinggi (KCKT) merupakan metode yang
sangat populer untuk menetapkan kadar senyawa obat baik dalam bentuk sediaan
maupun dalam sampel hayati. Hal ini disebabkan karena KCKT merupakan
metode yang memberikan sensitifitas yang tinggi. Selain itu, KCKT memiliki
banyak keuntungan antara lain cepat, resolusinya baik, mudah melaksanannya,
detektor yang sensitif dan beragam sehingga mampu menganalisa berbagai
cuplikan secara kualitatif maupun kuantitatif (Rohman, 2007).
Pemeriksaan pirazinamida dalam plasma secara kromatografi cair kinerja
tinggi fase balik telah dilakukan dengan menggunakan fase gerak buffer fosfat pH
7,4 dan metanol (96,8:3,2 v/v) pada panjang gelombang 268 nm dengan laju alir
1,5 ml/menit dan menggunakan baku dalam nikotinamid (Revankar, et al., 1994).
Penggunaan metanol dalam analisis dinilai lebih baik daripada asetonitril
dikarenakan metanol secara umum akan memberikan selektifitas yang lebih baik
(Kromidas, 2005). Analisis dilakukan pada panjang gelombang 254 nm karena
kebanyakan senyawa obat menyerap di 254 nm (Rohman, 2007). Detektor ini
tanggap terhadap banyak obat dan kepekaannya memadai bagi penetapan sediaan
obat dan kebanyakan cairan biologi (Munson, 1991).
Salah satu alasan utama digunakannya baku internal adalah jika suatu
sampel memerlukan perlakuan sampel yang sangat signifikan. Jika baku internal
ditambahkan pada sampel sebelum dilakukan preparasi sampel, maka baku
Berdasarkan hal tersebut maka penulis tertarik melakukan penelitian untuk
mengetahui kadar pirazinamida dalam tubuh pasien penderita tuberkulosis
menggunakan KCKT.
1.2Perumusan Masalah
Berdasarkan latar belakang di atas perumusan masalah penelitian yaitu:
1. Apakah pemeriksaan kadar pirazinamida dalam plasma darah pasien TB
dapat dilakukan secara KCKT menggunakan kolom ODS C18 dengan fase
gerak campuran buffer fosfat pH 7,4 : metanol (96,8:3,2) dan
menggunakan baku dalam nikotinamid?
2. Bagaimana kondisi pirazinamida dalam plasma darah pasien TB pada
temperatur kamar?
1.3Hipotesis
Berdasarkan perumusan masalah diatas maka dibuat hipotesis sebagai
berikut:
1. Kadar pirazinamida dalam plasma darah pasien TB dapat diperiksa secara
KCKT menggunakan kolom ODS C18 dengan fase gerak campuran buffer
fosfat pH 7,4 : metanol (96,8:3,2) dan menggunakan baku dalam
nikotinamid.
2. Pirazinamida dalam plasma darah pasien TB berada dalam keadaan stabil
1.4Tujuan Penelitian
Tujuan dilakukan penelitian ini yaitu:
1. Untuk memeriksa kadar pirazinamida dalam plasma darah pasien TB
secara KCKT menggunakan kolom ODS C18 dengan fase gerak campuran
buffer fosfat pH 7,4 : metanol (96,8:3,2) dan menggunakan baku dalam
nikotinamid.
2. Untuk mengetahui stabilitas pirazinamida dalam plasma darah pasien TB
pada temperatur kamar.
1.5Manfaat Penelitian
Manfaat penelitian ini adalah sebagai uji pendahuluan untuk kepentingan
pemantauan terapi obat dalam darah pasien yang berpenyakit TB guna membantu
dalam penyesuaian dosis obat sehingga diperoleh pengobatan yang optimal.
1.6Alur Penelitian
Obat TB Diberikan Pasien Penderita TB Diambil Darah Pasien TB
Plasma Darah Diukur
BAB II
TINJAUAN PUSTAKA
2.1 Tuberkulosis
Salah satu penyebab kematian utama yang disebabkan oleh infeksi adalah
Tuberkulosis (TB). TB merupakan ancaman bagi penduduk Indonesia. Pada tahun
2004, sebanyak seperempat juta orang bertambah penderita baru dan sekitar
140.000 kematian setiap tahunnya (Depkes RI, 2005).
Tuberkulosis, singkatnya TB, adalah suatu penyakit menular yang paling
sering (sekitar 80%) terjadi di paru-paru. Penyebabnya adalah suatu basil
Gram-positif tahan asam dengan pertumbuhan sangat lamban, yakni Mycobacterium
tuberculosis. Penyakit TB ditularkan dari orang ke orang, terutama melalui
saluran pernafasan dengan mengisap atau menelan tetes-tetes ludah/dahak
(droplet infection), yang mengandung basil dan dibatukkan oleh penderita. Atau,
adanya kontak antara tetes-tetes ludah/dahak tersebut dan luka di kulit (Tjay dan
Rahardja, 2002).
Gejala TB pada orang dewasa umumnya penderita mengalami batuk dan
berdahak terus-menerus selama 3 minggu atau lebih, batuk darah atau pernah
batuk darah. Adapun gejala-gejala lain dari TB pada orang dewasa adalah sesak
nafas dan nyeri dada, badan lemah, nafsu makan dan berat badan menurun, rasa
kurang enak badan (malaise), berkeringat malam walaupun tanpa kegiatan,
demam meriang lebih dari sebulan (Depkes RI, 2005).
Obat Anti Tuberkulosis yang digunakan dalam program pengobatan TB
(S) dan ethambutol (E). Pengobatan penderita harus didahului oleh pemastian
diagnosis melalui pemeriksaan radiologik, dan laboratorium terhadap adanya
Bakteri Tahan Asam (BTA) pada sampel sputum penderita (Girsang, 2002).
Menurut Depkes RI (2005), pengobatan TB diberikan dalam 2 tahap,
yaitu tahap intensif dan lanjutan.
1. Tahap Intensif
• Pada tahap intensif (awal) penderita mendapat obat setiap hari dan
perlu diawasi secara langsung untuk mencegah terjadinya kekebalan
obat.
• Bila pengobatan tahap intensif tersebut diberikan secara tepat, biasanya
penderita menular menjadi tidak menular dalam kurun waktu 2
minggu.
2. Tahap Lanjutan
• Pada tahap lanjutan penderita mendapat jenis obat lebih sedikit, namun
dalam jangka waktu yang lebih lama.
• Tahap lanjutan penting untuk membunuh kuman persister (dormant)
sehingga mencegah terjadinya kekambuhan.
Tahap intensif terdiri dari HRZE diberikan setiap hari selama 2 bulan. Kemudian
diteruskan dengan tahap lanjutan yang terdiri dari HR diberikan tiga kali
seminggu selama 4 bulan (Depkes RI, 2005).
Pemakaian obat anti tuberkulosis (OAT) jangka pendek sesuai
rekomendasi WHO, yaitu berdasarkan kategori dan klasifikasi penyakit, sangat
penting. Obat anti TB yang digunakan sesuai dengan program pemerintah guna
dijamin dapat sembuh. Tujuan pengobatan adalah untuk menjamin kesembuhan
dan mencegah terjadinya resistensi primer yang dapat merugikan penderita serta
menyulitkan kesembuhan (Girsang, 2002).
Penyebab utama terjadinya kegagalan pengobatan tuberkulosis adalah
penderita tidak mematuhi ketentuan dan lamanya pengobatan secara teratur untuk
mencapai kesembuhan, terutama pemakaian obat secara teratur pada 2 bulan fase
awal (Chuluq, dkk., 2004).
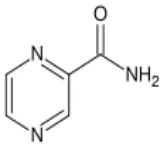
2.2 Pirazinamida (Ditjen POM, 1995). Nama Kimia: Pirazinkarboksamida
Rumus Molekul:
Berat Molekul: 123,11
Pemerian: Serbuk hablur, putih hingga praktis putih; tidak berbau atau praktis
tidak berbau.
Kelarutan: Agak sukar larut dalam air; sukar larut dalam etanol, dalam eter dan
dalam kloroform.
Titik lebur: Antara 188o dan 191o.
Gambar 1. Rumus bangun pirazinamida
Pirazinamida adalah suatu obat antituberkulosis sintetik peroral yang
dan rifampin. Pirazinamida bersifat bakterisidal terhadap organisme yang aktif
membelah diri. Pirazinamida harus dihidrolisis secara enzimatik menjadi asam
pirazinoat yang merupakan bentuk aktif dari pirazinamida. Pirazinamida aktif
terhadap basil tuberkulosis dalam lingkungan asam lisosome dan dalam makrofag
(Mycek, dkk., 2001).
Pirazinamida adalah salah satu obat garis depan yang ditentukan untuk
pengobatan Mycobacterium tuberculosis. Dianggap sebagai prodrug dari asam
pirazinoat, yang dipercaya sebagai inhibitor aktif M. tuberculosis. Asam
pirazinoat merupakan metabolit aktif utama dari pirazinamida, yang dihasilkan
oleh liver mikrosomal deamidase kemudian asam pirazinoat ini selanjutnya
dihidroksilasi menjadi 5-asam hidroksipirazinoat oleh xantin oksidase. Jalur
metabolit lainnya, pirazinamida dioksidasi langsung menjadi
5-hidroksipirazinamida oleh xantin oksidase. Ketiga metabolit pirazinamida ini
terutama diekskresikan dalam urin (Wu dan Tsai, 2007).
Analog pirazin dari nikotinamida ini bekerja bakterisid (pada suasana
asam: pH 5-6) atau bakteriostatis, tergantung pada pH dan kadarnya di dalam
darah. Spektrum kerjanya sangat sempit dan hanya meliputi M. tuberculosis.
Khasiatnya diperkuat oleh INH. Obat ini khusus digunakan pada fase intensif
(Tjay dan Rahardja, 2002).
Konsentrasi serum 30-50 μg/mL pada 1-2 jam setelah pemberian oral
dicapai dengan dosis 25 mg/kg/hari. Pirazinamida dapat dengan baik diserap dari
saluran cerna dan secara luas didistribusikan pada jaringan tubuh, termasuk
selaput otak yang terinfeksi. Waktu paruhnya adalah 8-11 jam. Pirazinamida
isoniazid dan rifampin dalam pemberian jangka pendek (yaitu 6 bulan) sebagai
suatu agen sterilisator aktif untuk melawan sisa-sisa organisme-organisme
intraseluler yang dapat mengakibatkan kekambuhan (Chamber, H.F., 2004).
Efek sampingnya yang sering kali terjadi dan berbahaya adalah kerusakan
hati dan ikterus (hepatotoksis), terutama pada dosis di atas 2 g sehari. Pengobatan
harus segera dihentikan bila ada tanda-tanda kerusakan hati (Tjay dan Rahardja,
2002).
2.3 Pemantauan Terapi Obat
Keberhasilan terapi dengan obat sangat bergantung pada rancangan aturan
dosis. Suatu aturan dosis yang dirancang tepat, merupakan usaha untuk mencapai
konsentrasi obat optimum pada reseptor untuk menghasilkan respon terapetik
yang optimal dengan efek merugikan yang minimum (Shargel, 2005).
Pemantauan Terapi Obat secara klinik adalah evaluasi sistematik dan
prospektif dari regimen obat dan kemajuan klinik pasien. Sasaran utama dari
pemantauan terapi obat adalah untuk mengoptimasi terapi obat, dengan
memastikan secara efektif, efikasi terapi, meminimalkan toksisitas, dan memberi
solusi masalah yang merusak/mengurangi akses seorang pasien ke, atau patuh
pada suatu regimen terapi obat tertentu (Charles dan Endang, 2006).
Tujuan dari proses pemantauan terapi obat adalah menyesuaikan terapi
obat pada karakteristik pasien individu, memaksimalkan manfaat dan
meminimalkan resiko. Sifat-sifat biofarmasi, farmakologi, dan farmakokinetik
sangat penting dipertimbangkan. Indeks terapi, merupakan batas aman antara
farmakokinetik seperti absorpsi,distribusi, metabolisme, ekskresi, dan durasi kerja
harus dipertimbangkan apabila mendesain suatu regimen obat (Charles dan
Endang, 2006).
Pengaturan obat berbeda dari satu individu terhadap individu lainnya, dan
hal ini dapat membuat terapi obat menjadi tidak efektif atau toksik jika hanya
berdasarkan pada dosis. Untuk memahami signifikasi pemantauan terapi obat,
maka perlu mengembangkan pemahaman yang menyeluruh terhadap pengaturan
obat, yakni cara tubuh untuk menangani senyawa asing yaitu obat. Mekanisme
yang digunakan oleh tubuh untuk menangani obat dapat dijelaskan dalam empat
proses umum, absorpsi, distribusi, metabolisme, dan ekskresi (Bittikofer, 1985).
a. Absorpsi
Molekul obat harus dalam keadaan bebas untuk diabsorbsi dalam saluran
gastrointestinal. Perhatian utama pada variabilitas absorpsi obat yakni interaksi
obat dengan kandungan saluran gastrointestinal. Pergerakan gastrointestinal
sering dipengaruhi oleh obat dan kebanyakan perlambatan pengosongan lambung
akan menurunkan absorpsi obat (Niazi, 1979).
b. Distribusi
Distribusi obat mengawali kerja obat dan dalam beberapa hal menentukan
intensitas kerja. Faktor yang mempengaruhi distribusi obat termasuk komposisi
tubuh, protein plasma dan ikatan sel darah merah, dan keadaan hemodinamik
individu (Niazi, 1979).
c. Biotransformasi
Faktor paling penting dalam respon obat diantara individu dikarenakan
jumlah enzim yang ada, efek genetik, dan faktor keadaan fisiologis dan penyakit
(Niazi, 1979).
d. Ekskresi
Walaupun semua rute ekskresi obat sangatlah penting, hanya ekskresi
renal dan biliari yang berperan terhadap kondisi yang cukup untuk membuat
perbedaan dalam respon obat (Niazi, 1979).
Secara klinik, pemantauan individual dalam farmakokinetika obat sering
terjadi. Pemantauan konsentrasi obat dalam darah atau plasma meyakinkan bahwa
dosis yang telah diperhitungkan benar-benar telah melepaskan obat dalam plasma
dalam kadar yang diperlukan untuk efek terapetik. Untuk beberapa obat, kepekaan
reseptor pada individu berbeda, sehingga pemantauan kadar obat dalam plasma
diperlukan untuk membedakan penderita yang menerima terlalu banyak obat dan
penderita yang sangat peka terhadap obat. Dengan demikian pemantauan terapi
konsentrasi obat dalam plasma memungkinkan untuk penyesuaian dosis obat
secara individual dan juga untuk mengoptimasi terapi (Shargel, 2005).
Tinggi rendahnya kadar obat dalam cairan darah merupakan hasil dari
besarnya dosis yang diberikan, dan pengaruh-pengaruh proses-proses alami dalam
tubuh mulai dari absorpsi, distribusi, metabolisme sampai ekskresi obat. Manfaat
penerapan farmakokinetika bagi kepentingan penanganan penderita adalah untuk
tuntunan penentuan aturan dosis (dosage regimen) yang menyangkut besarnya
dosis dan interval pemberian dosis, terutama untuk obat-obat dengan lingkup
2.4 Darah dan Plasma
Darah (plasma atau serum) merupakan cairan tubuh yang paling sering
dipakai dalam penelitian farmakokinetika. Menurut Cahyati (1985), ini mudah
dimengerti karena:
a. Kebanyakan obat sampai ke reseptornya melalui darah.
b. Tidak mudah mendapatkan jaringan tubuh lain dari organisme hidup,
khususnya manusia.
Darah terdiri atas sel-sel dan cairan yang mengisi sirkulasi tertutup yang
mengalir dalam gerak teratur tanpa arah, didorong terutama oleh kontraksi ritmis
jantung. Darah dibentuk dari 2 bagian: bentuk elemen, atau sel-sel darah dan
plasma, fase cair di mana yang pertama tersuspensi. Bentuk elemen adalah
eritrosit, atau sel darah merah; trombosit; dan leukosit, atau sel darah putih. Darah
yang dikumpulkan dan dicegah dari pembekuan dengan menambahkan
antikoagulan (heparin, sitrat, dan sebagainya), bila disentrifuge akan terpisah,
menjadi lapisan-lapisan yang menggambarkan heterogenitasnya (Junqueira dan
Carneiro, 1982).
Menurut Anonim2 (2008), ketika sampel darah diambil, kemudian diberi
perlakuan dengan penambahan zat antikoagulasi, dan kemudian diputar dalam alat
sentrifugasi maka akan terbentuk:
• Plasma
• Sel darah merah yang menempati lapisan bawah
Gambar 2. Skematis hasil sentrifugasi darah dengan penambahan antikoagulan
Darah lengkap manusia adalah darah yang telah diambil dari donor
manusia yang dipilih dengan pencegahan-pencegahan pendahuluan aseptik yang
ketat. Ditambahkan ion sitrat atau heparin sebagai antikoagulasi. Darah yang
dikumpulkan disimpan pada temperatur antara 1oC–10oC, dipertahankan konstan
dengan kisaran 2oC. Tanggal kadaluarsa tidak lebih dari 21 hari setelah tanggal
pengambilan bila sitrat yang digunakan sebagai antikoagulasi dan tidak lebih dari
48 jam bila heparin digunakan (Ansel, 2005).
Antikoagulan diperlukan jika analisis harus dilakukan pada plasma.
Kebanyakan obat dapat dipantau dengan baik dalam plasma atau serum. Jika
plasma digunakan, maka heparin biasanya dianjurkan sebagai antikoagulan
(Bittikofer, 1985).
Cairan transluen, kekuningan dan sedikit kental yang terletak di atas bila
hematokrit diukur adalah plasma darah. Plasma adalah suatu larutan aqueous yang
mengandung zat-zat dengan berat molekul besar dan kecil yang merupakan 10%
volumenya. Protein-protein plasma merupakan 7% dan garam-garam anorganik
0,9%, sisanya yang 10% terdiri atas beberapa senyawa organik dari berbagai
asal-asam amino, vitamin, hormom, lipid, dan sebagainya (Junqueira dan Carneiro,
1982).
Plasma
Sel darah putih (lapisan kekuning-kuningan)
Mengumpulkan spesimen darah
Bahan atau spesimen yang paling umum dianalisa dalam laboratorium
adalah darah, yang diperoleh dari vena atau dengan penusukan kulit. Lengan
merupakan daerah yang biasanya digunakan untuk penusukan vena. Suatu turniket
diikatkan mengelilingi lengan, berdasarkan pada daerah yang dipilih untuk
penusukan vena, sekitar 7 hingga 10 cm diatasnya; pasien mengepalkan
tangannya. Lalu pilih daerah penusukan vena, kemudian dibersihkan dengan cepat
selama beberapa waktu lalu biarkan kering. Hal ini perlu untuk mencegah
hemolisis eritrosit oleh alkohol. Tekan kulit 2 atau 3 cm dibawah daerah
penyuntikan dengan ibu jari, bersamaan dengan itu genggam lengan dengan
keempat jari lainnya. Ini berguna untuk menstabilkan vena dan mengurangi
pergerakannya. Luruskan posisi jarum membentuk sudut 15o dengan vena dan
masukkan. Tarik alat penyedot sampai diperoleh jumlah darah yang diinginkan.
Kain pengikat dilepaskan dan pasien membuka tangannya. Perlahan tarik jarum,
dan letakkan pembalut pada daerah penyuntikan, beri sedikit tekanan. Setiap
spesimen harus terindentifikasi dengan tepat dengan nama pasien, tanggal, waktu
pengambilan, dan informasi lain yand dibutuhkan (Lotspeich, 1985).
2.5 Kromatografi
2.5.1 Teori Kromatografi
Kromatografi didefenisikan sebagai prosedur pemisahan zat terlarut oleh
suatu proses migrasi diferensial dinamis dalam sistem yang terdiri dari dua fase
atau lebih, salah satu diantaranya bergerak secara berkesinambungan dalam arah
adanya perbedaan dalam absorpsi, partisi, kelarutan, tekanan uap, ukuran molekul,
atau kerapatan muatan ion. Teknik kromatografi umumnya membutuhkan zat
terlarut terdistribusi di antara dua fase, satu diantaranya diam (fase diam) yang
lainnya bergerak (fase gerak) (Ditjen POM, 1995).
Pemisahan secara kromatografi yang berhasil baik berkaitan dengan
mengkompromikan daya pisah kromatografi, beban cuplikan, dan waktu analisis
atau kecepatan. Tujuan kromatografi ialah memisahkan komponen cuplikan dalam
waktu yang masuk akal, menjadi pita atau puncak, ketika cuplikan itu bergerak
(Johnson dan Stevenson, 1991).
2.5.2 Parameter dalam Kromatografi 2.5.2.1 Tinggi dan Luas Puncak
Untuk kromatografi yang melibatkan kolom, kuantifikasi dapat dilakukan
dengan luas puncak atau dengan tinggi puncak. Tinggi puncak atau luas puncak
berbanding langsung dengan banyaknya solut yang dikromatografi, jika dilakukan
pada kisaran detektor yang linier (Johnson dan Stevenson, 1991).
1. Metode tinggi puncak
Metode yang paling sederhana untuk pengukuran kuatitatif adalah dengan tinggi
puncak. Tinggi puncak diukur sebagai jarak dari garis dasar ke puncak
maksimum. Metode ini hanya digunakan jika perubahan tinggi puncak linier
dengan perubahan konsentrasi (Johnson dan Stevenson, 1991).
2. Metode luas puncak
Prosedur penentuan luas puncak serupa dengan tinggi puncak. Suatu teknik untuk
mengukur luas sebagai hasil kali tinggi puncak dan lebar pada setengah tinggi
(W1/2) (Johnson dan Stevenson, 1991).
Tinggi dan luas puncak berkaitan secara proporsional dengan kadar atau
jumlah analit tertentu yang terdapat dalam sampel (memiliki informasi
kuantitatif). Namun demikian, luas puncak lebih umum digunakan dalam
perhitungan kuantitatif karena lebih akurat/cermat daripada perhitungan
menggunakan tinggi puncak (Ornaf dan Dong, 2005).
2.5.2.2Faktor Retensi
Faktor retensi (k) merupakan satuan pengukuran retensi senyawa tertentu
pada pada sistem kromatografi tertentu. Didefenisikan sebagai :
Dimana VR adalah volume retensi analit, V0 adalah volume fase cairan pada
sistem kromatografi, tR adalah waktu retensi analit, dan t0 adalah waktu yang
didefenisikan sebagai waktu retensi analit yang tidak tertahan. Faktor retensi ini
sangatlah tepat sekali karena tidak tergantung pada ukuran kolom dan laju alir
fase gerak. Perlu diperhatikan bahwa kondisi kromatografi lainnya secara
signifikan mempengaruhi faktor retensi (Kazakevich dan LoBrutto, 2007).
2.5.2.3Efisiensi
Menurut Rohman (2007), tujuan umum pada kromatografi adalah pemisahan
yang cukup dari suatu campuran yang akan dipisahkan. Untuk kolom
kromatografi, jumlah lempeng atau plate number (N) yang didasarkan pada
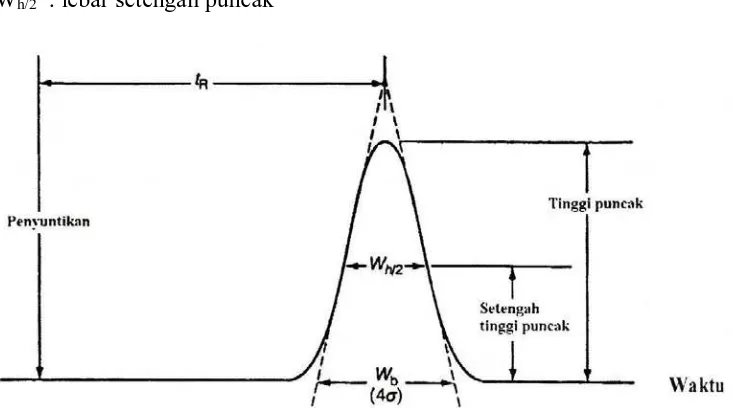
Dengan menganggap profil puncak kromatogram adalah sesuai kurva Gaussian,
σt : standar deviasi lebar puncak
Wb : lebar puncak
Wh/2 : lebar setengah puncak
Gambar 3. Pengukuran efisiensi kromatografi dari puncak Gaussian
2.5.2.4Selektivitas
Kemampuan sistem kromatografi dalam memisahkan/membedakan analit
yang berbeda dikenal sebagai selektifitas (α). Selektifitas ditentukan dengan
Selektifitas umumnya tergantung pada sifat analit itu sendiri, interaksinya dengan
permukaan fase diam serta jenis fase gerak yang digunakan (Kazakevich dan
LoBrutto, 2007).
2.5.2.5Resolusi
Resolusi (R) merupakan derajat pemisahan dari dua puncak analit yang
bersebelahan (Ornaf dan Dong, 2005). Dirumuskan sebagai:
2.5.2.6 Faktor Asimetri
Profil konsentrasi solut yang bermigrasi akan simetris jika rasio distribusi
solut konstan selama di kisaran konsentrasi keseluruhan puncak. Meskipun
demikian, kurva akan berubah menjadi 2 jenis puncak asimetris yakni membentuk
puncak yang berekor (tailing) dan adanya puncak pendahulu (fronting) jika ada
perubahan rasio distribusi solut ke arah yang lebih besar. Baik tailing maupun
fronting tidak dikehendaki karena dapat menyebabkan pemisahan kurang baik dan
data retensi kurang reprodusibel (Rohman, 2007).
Menurut Rohman (2007), adanya puncak, yang asimetri dapat disebabkan
oleh hal-hal berikut:
1. Ukuran sampel yang dianalisis terlalu besar. Jika sampel terlalu besar
maka fase gerak tidak mampu membawa solut dengan sempurna
2. Interaksi yang kuat antara solut dengan fase diam dapat menyebabkan
solut sukar terelusi sehingga dapat menyebabkan terbentuknya puncak
yang mengekor.
3. Adanya kontaminan dalam sampel yang dapat muncul terlebih dahulu
sehingga menimbulkan puncak mendahului (fronting).
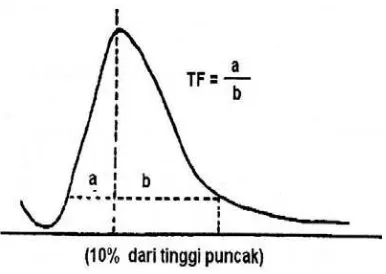
Untuk menentukan tingkat asimetri puncak dilakukan dengan menghitung
faktor asimetris atau disebut juga dengan tailing factor (TF) yang dinyatakan
dengan rasio antara lebar setengah tinggi puncak. Kromatogram yang memberi
harga TF = 1 menunjukkan bahwa kromatogram tersebut bersifat setangkup atau
simetris. Harga TF > 1 menunjukkan bahwa kromatogram mengalami pengekoran
(tailing). Semakin besar harga TF maka kolom yang dipakai kurang efisien
(Rohman, 2007).
Gambar 4. Menghitung besarnya tailing factor pada kromatogram
2.5.3 Kromatografi Cair Kinerja Tinggi
Kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi, dan
menjadi suatu sistem pemisahan dengan kecepatan dan efisiensi yang tinggi.
Metode ini dikenal sebagai kromatografi cair kinerja tinggi. Teknologi kolom
didasarkan atas penggunaan kolom berlubang kecil (diameter dalam antara 2 mm
hingga 5 mm) dan isi kolom berupa partikel kecil (3 µ m hingga 50 µ m). Oleh
karena itu sering digunakan jumlah zat uji yang kecil (umumnya lebih kecil dari
200 µg) (Ditjen POM, 1995).
Kromatografi Cair Kinerja Tinggi atau KCKT atau biasa juga disebut
dengan HPLC (High Performance Liquid Chromatography) dikembangkan pada
akhir tahun 1960-an dan awal tahun 1970-an. Kegunaan umum KCKT adalah
untuk pemisahan sejumlah senyawa organik, anorganik, maupun senyawa
biologis. KCKT paling sering digunakan untuk menetapkan kadar
senyawa-senyawa tertentu seperti asam-asam amino, asam-asam nukleat, dan
protein-protein dalam cairan fisiologis; menentukan kadar senyawa-senyawa aktif obat,
produk hasil samping proses sistetis, atau produk-produk degradasi dalam sediaan
farmasi (Rohman, 2007).
Kromatografi merupakan teknik yang mana solut atau zat-zat terlarut
terpisah oleh perbedaan kecepatan elusi, dikarenakan solut-solut ini melewati
suatu kolom kromatografi. Pemisahan solut-solut ini diatur oleh distribusi solut
dalam fase gerak dan fase diam (Rohman, 2007).
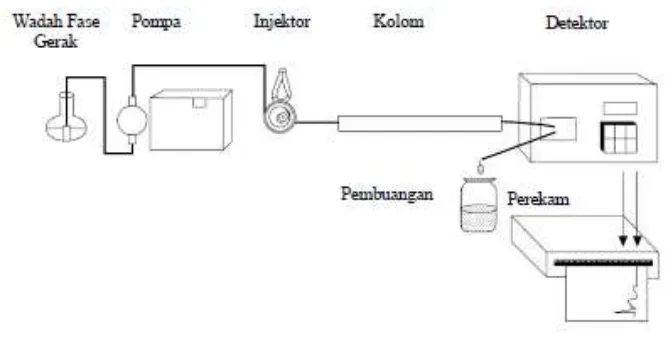
Pada dasarnya alat kromatografi cair terdiri dari sistem pompa, tempat
penyuntikan analit, kolom kromatografi, detektor, penguat sinyal, dan perekam
2.5.3.1 Jenis-jenis Kromatografi Cair Kinerja Tinggi
Proses pemisahan dalam KCKT dapat dilakukan dengan berbagai mode
kromatografi yaitu sebagai berikut:
a. Kromatografi padatan-cairan (kromatografi adsorpsi)
Pemisahan biasanya menggunakan fase normal dengan fase diam silika gel dan
alumina, meskipun demikian sekitar 90% kromatografi ini menggunakan silika
sebagai fase diamnya. Fase gerak yang digunakan berupa pelarut non polar yang
ditambah dengan pelarut polar seperti air atau alkohol rantai pendek untuk
meningkatkan kemampuan elusinya, misal n-heksana ditambah dengan metanol
(Rohman, 2007). Dengan mode ini dapat dipisahkan antioksidan, vitamin, steroid,
barbiturat, zat warna, amina, hidrokarbon, fenol, alkaloida, lipida, asam-asam
amino, dan alkohol-alkohol (Hadjar, 1985).
b. Kromatografi cairan-cairan (kromatografi partisi)
Fase diam berupa cairan yang disalutkan atau diikatkan secara kimia pada solid.
Komponen sampel yang dipisahkan berpartisi di antara fase diam dan fase gerak
(Hadjar, 1985). Fase diam yang paling populer digunakan adalah oktadesilsilan
(ODS atau C18) dan kebanyakan pemisahan adalah fase terbalik. Sebagai fase
gerak adalah campuran metanol atau asetonitril dengan air atau dengan larutan
buffer (Rohman, 2007).
c. Kromatografi penukar ion
Kromatografi ini menggunakan fas ediam yang dapat menukar kation atau anion
media air karena sifat ionisasinya. Dalam beberapa hal digunakan pelarut
campuran misalnya air-alkohol (Roman, 2007).
d. Kromatografi pasangan ion
kromatografi ini merupakan bentuk khusus dari kromatografi cairan-cairan yang
digunakan untuk pemisahan senyawa obat yang dapat terionisasi seperti
sulfonamida, karboksilat dan sulfonat (Hadjar, 1985).
2.5.3.2 Komponen Kromatografi Cair Kinerja Tinggi
Sistem KCKT sederhana terdiri dari wadah fase gerak, pompa bertekanan
tinggi, injektor, kolom, detektor, dan perekam. Gambar ilustrasi dapat dilihat pada
gambar 5 (McMaster, 2007).
Gambar 5. Sistem KCKT isokratik
2.5.3.2.1 Wadah fase gerak
Wadah fase gerak terbuat dari bahan yang inert terhadap fase gerak. Bahan
yang umum digunakan adalah gelas dan baja anti karat. Pelarut yang digunakan
dengan penyaring mikrometer sebelum digunakan pada sistem KCKT. Degassing
digunakan untuk menghilangkan gas terlarut dalam fase gerak dan menghilangkan
gas terlarut dalam fase gerak dan mengurangi kemungkinan gelembung yang
terbentuk pada pompa atau detektor selama proses pemisahan (Putra, 2007).
Fase gerak atau eluen biasanya terdiri atas campuran pelarut yang dapat
bercampur yang secara keseluruhan berperan dalam daya elusi dan resolusi. Untuk
fase normal (fase diam lebih polar daripada fase gerak), kemampuan elusi
meningkat dengan meningkatnya polaritas pelarut. Sementara untuk fase terbalik
(fase diam kurang polar daripada fase gerak), kemampuan elusi menurun dengan
meningkatnya polaritas pelarut (Rohman, 2007).
Menurut Johnson dan Stevenson (1991), fase gerak haruslah:
a. Murni, tanpa cemaran.
b. Tidak bereaksi dengan kemasan.
c. Sesuai dengan detektor.
d. Dapat melarutkan cuplikan.
e. Mempunyai viskositas rendah.
f. Memungkinkan memperoleh kembali cuplikan dengan mudah, jika
diperlukan.
g. Harganya wajar.
Menurut Putra (2007), elusi pada KCKT dapat dibagi menjadi dua sistem
yaitu:
a. Sistem elusi isokratik: elusi dilakukan dengan satu macam atau lebih fase
b. Sistem elusi gradien: elusi dilakukan dengan campuran fase gerak yang
perbandingannya berubah-ubah dalam waktu tertentu.
2.5.3.2.2 Pompa
Pompa yang cocok digunakan untuk KCKT adalah pompa yang
mempunyai syarat sebagaimana syarat wadah pelarut yakni pompa harus inert
terhadap fase gerak. Bahan yang umum dipakai adalah gelas, baja tahan karat,
teflon, dan batu nilam. Tujuan penggunaan pompa atau sistem penghantaran fase
gerak adalah untuk menjamin proses penghantaran fase gerak berlangsung secara
tepat, reproduksibel, konstan, dan bebas dari gangguan. Ada dua jenis pompa
dalam KCKT yaitu pompa dengan tekanan konstan, dan pompa dengan aliran fase
gerak yang konstan. Tipe pompa dengan aliran fase gerak yang konstan sejauh ini
lebih umum dibandingkan dengan pompa dengan tekanan tetap (Rohman, 2007).
2.5.3.2.3 Injektor
Sampel-sampel cair dan larutan disuntikkan secara langsung ke dalam fase
gerak yang mengalir di bawah tekanan menuju kolom menggunakan alat
penyuntik yang terbuat dari tembaga tahan karat dan katup teflon yang dilengkapi
dengan keluk sampel internal atau eksternal (Rohman, 2007).
Menurut Johnson dan Stevenson (1991), ada tiga jenis dasar injektor,
yaitu:
a. Aliran-henti: aliran dihentikan, penyuntikan dilakukan pada tekanan atmosfer;
sistem ditutup, dan aliran dilanjutkan lagi. Cara ini dapat dipakai karena difusi
b. Septum: ini adalah injektor langsung pada aliran, yang sama dengan injektor
yang lazim dipakai pada kromatografi gas. Injektor tersebut dapat dipakai
pada tekanan sampai sekitar 60-70 atmosfer. Septum tidak dapat dipakai pada
semua pelarut KC. Selain itu, partikel kecil terlepas dari septum dan
cenderung menyumbat.
c. Katup jalan-kitar: jenis injektor ini biasanya dipakai untuk menyuntikkan
volum yang lebih besar dari 10 μl dan sekarang dipakai dalam sistem yang
diotomatkan. Pada kedudukan mengisi, jalan-kitar cuplikan diisi pada tekanan
atmosfer. Jika katup dibuka, cuplikan di dalam jalan-kitar teralirkan ke dalam
kolom.
2.5.3.2.4 Kolom
Kolom adalah jantung kromatografi. Berhasil atau tidaknya suatu analisis
tergantung pada pemilihan kolom dan kondisi percobaan yang sesuai. Kolom
umumnya dibuat dari stainless steel dan biasanya dioperasikan pada temperatur
kamar (Putra, 2007).
Menurut Edward dan Stevenson (1991), kolom dapat dibagi menjadi dua
kelompok:
a. Kolom analitik: garis tengah-dalam 2-6 mm. Panjang bergantung pada
jenis kemasan, untuk kemasan, untuk kemasan pelikel biasanya panjang
kolom 50-100 cm, untuk kemasan mikropartikel berpori biasanya 10-30
cm.
b. Kolom preparatif: umumnya bergaris tengah 6 mm atau lebih besar dan
2.5.3.2.5 Fase Diam
Kebanyakan fase diam pada KCKT berupa silika yang dimodifikasi secara
kimiawi, silika yang tidak dimodifikasi, atau polimer-polimer stiren dan divinil
benzen. Permukaan silika adalah polar dan sedikit asam karena adanya residu
gugs silanol (Si-OH). Oktadesil silika (ODS atau C18) merupaka fase diam yang
paling banyak digunakan karena mampu memisahkan senyawa-senyawa dengan
kepolaran rendah, sedang, maupun tinggi (Rohman, 2007).
2.5.3.2.6 Detektor
Suatu detektor dibutuhkan untuk mendeteksi adanya komponen cuplikandi
dalam aliran yang keluar dari kolom. Detektor yang baik memiliki sensitifitas
yang tinggi, gangguan (noise) yang rendah, kisaran respon linear yang luas, dan
memberi tanggapan/respon untuk semua tipe senyawa. Detektor yang paling
banyak digunakan dalam KCKT adalah detektor spektrofotometer uv 254 nm.
Bermacam-macam detektor dengan variasi panjang gelombang uv-vis sekarang
menjadi poluler karena dapat digunakan untuk mendeteksi senyawa-senyawa
dalam rentang yang luas (Putra, 2007).
2.5.4 Metode Kuantifikasi dengan Baku Dalam
Baku dalam terutama merupakan ragam yang berguna karena
pemakaiannya secara tepat dapat memperkecil galat yang disebabkan oleh
penyiapan cuplikan, peralatan, dan cara. Secara singkat, cara ini mencakup
penambahan senyawa baku yang jumlahnya diketahui. Kemudian campuran itu
senyawa baku dan luas puncak komponen yang diminati, kita dapat menentukan
susunan (Johnson dan Stevenson, 1991).
Salah satu alasan utama digunakannya baku internal adalah jika suatu
sampel memerlukan perlakuan sampel yang sangat signifikan. Jika baku internal
ditambahkan pada sampel sebelum dilakukan preparasi sampel, maka baku
internal dapat mengoreksi hilangnya sampel-sampel ini (Rohman, 2007).
Menurut Rohman (2007), syarat-syarat suatu senyawa dapat digunakan
sebagai baku internal adalah:
- Terpisah dengan baik dari senyawa yang dituju atau puncak-puncak yang lain
- Mempunyai waktu retensi yang hampir sama dengan analit.
- Tidak terdapat dalam sampel.
- Mempunyai kemiripan sifat-sifat dengan analit dalam tahapan-tahapan
penyiapan sampel.
- Tidak mempunyai kemiripan secara kimiawi dengan analit.
- Tersedia dalam perdagangan dengan kemurnian yang tinggi.
- Mempunyai respon detektor yang hampir sama dengan analit pada konsentrasi
yang digunakan.
Kebanyakan baku dalam merupakan senyawa yang secara kimia
menyerupai obat yang akan diperiksa. Semakin struktur kimianya menyerupai
obat, maka semakin baik kontrol variasi yang dicapai. Idealnya, baku dalam
ditambahkan dalam jumlah dan konsentrasi yang sama pada semua sampel dan
baku yang digunakan dalam pembuatan kurva kalibrasi. Dalam kromatografi,
rasio tinggi puncak atau luas puncak (senyawa terhadap baku dalam) biasanya
(tinggi atau luas puncak) untuk obat dan baku dalam digunakan dalam kalibrasi
dan pengujian (Smyth, 1992).
2.5.5 Nikotinamida (Ditjen POM, 1995)
Baku dalam yang digunakan yakni Nikotinamida.
Nama Nimia: Piridina-3-karboksamida
Rumus Molekul: C6H6N2O
Berat Molekul: 122,1
Pemerian: Hablur atau serbuk hablur, tidak berwarna atau putih; berbau lemah
dan khas
Kelarutan: Larut dalam 1 bagian air, dalam 1,5 bagian etanol; sukar larut dalam
kloroform dan dalam eter.
Gambar 6. Rumus bangun nikotinamid
Dengan metode baku internal, kurva baku dihasilkan dengan
mempersiapkan beberapa larutan baku yang mengandung konsentrasi yang
berbeda dari senyawa yang dituju dengan ditambah sejumlah konsentrasi tertentu
yang tetap dari larutan baku internal (Rohman, 2001).
BAB III
METODOLOGI PENELITIAN
Penelitian ini merupakan penelitian deskriptif dan pengukuran dilakukan
dengan menggunakan alat KCKT. Penelitian ini dilakukan di Laboratorium
Biofarmasi dan di Laboratorium Penelitian Fakultas Farmasi USU.
3.1 Alat
Alat-alat yang digunakan pada penelitian ini adalah timbangan, beaker
gelas, neraca analitis (Baecho), pipet tetes, tabung sentrifugasi, rak tabung, gelas
ukur, alat vortex (Health HVM-400), alat sentrifugasi (Health HC 1120T), termos
es, spuit 1 ml, spuit 3 ml, politube, mikropipet, batang pengaduk, vial 2 ml, satu
unit alat KCKT Agilent 1120 Compact LC, kolom ODS C18, wadah solven,
injektor, syringe 50 µ l, pompa vakum (Gast DOA-PG04-BN), sonifikator
(Branson 1510), kertas membran filter whatman Cellulose Nitrate 0,45 µ m,
penyaring PTFE 0,2 µm. (Gambar alat dapat dilihat pada Lampiran 1 dan 2
halaman 21).
3.2 Bahan
Bahan bahan yang digunakan dalam penelitian yaitu: metanol p.a. (E.
Merck), NaOH p.a. (E. Merck), plasma darah pasien TB, plasma kontrol (gambar
dapat dilihat pada Lampiran 3 halaman 25), kalium dihidrogen fosfat p.a (E.
Merck), Baku Pirazinamida ARS (ASEAN Reference Substance) (sertifikat
Drugs PVT. LTD.) (sertifikat analisis dapat dilihat pada Lampiran 15 halaman
42), aquabidest (PT. Ikapharmindo Putramas), Heparin sodium inject (PT. B.
Braun Medical Indonesia).
3.3 Pengambilan Sampel
Sampel yang diperiksa dalam penelitian ini adalah plasma darah pasien
penderita Tuberkulosis (TB) yang sedang menjalani perawatan di klinik Dr.
Zainuddin Amir, DSP (Ahli Penyakit Saluran Pernapasan) di Jl. Jemadi, Medan.
Pasien yang diambil darahnya adalah pasien yang telah mengkonsumsi obat TB
kurang dari 2 bulan atau sedang menjalani fase intensif. (Data pasien dapat dilihat
pada Lampiran 13 halaman 40). Waktu pengambilan darah adalah 2 jam setelah
meminum obat.
3.4 Rancangan Penelitian 3.4.1 Penyiapan Bahan
3.4.1.1 Pembuatan Plasma Darah Pasien TB
Darah pasien diambil sebanyak 5 ml, kemudian dimasukkan ke dalam
venoject yang telah terbasahi heparin. Venoject yang berisi darah disentrifugasi
dengan kecepatan 4000 putaran permenit selama 5 menit. Diperoleh dua lapisan
yaitu lapisan atas yang merupakan plasma dan lapisan bawah berupa endapan.
3.4.1.2 Pembuatan Plasma Kontrol
Darah diambil dari donatur (dewasa dan sehat) sebanyak 5 ml, kemudian
dimasukkan ke dalam venoject yang telah terbasahi heparin. Venoject yang berisi
darah disentrifugasi dengan kecepatan 4000 putaran permenit selama 5 menit.
Diperoleh dua lapisan yaitu lapisan atas yang merupakan plasma dan lapisan
bawah berupa endapan. Diambil lapisan atas (plasma).
3.4.1.3 Pembuatan Pereaksi 3.4.1.3.1 Aqua Bebas CO2
Dibuat dengan mendidihkan air untuk injeksi segar selama tidak kurang
dari 10 menit sambil mencegah hubungan dengan udara sesempurna mungkin,
didinginkan, dan segera digunakan (Ditjen POM, 1972).
3.4.1.3.2 Natrium Hidroksida (NaOH) 0,2 N
Dilarutkan 8,0 g NaOH dengan air bebas CO2 sampai 1000,0 ml (Ditjen
POM, 1979).
3.4.1.3.3 Kalium Dihidrogen Fosfat 0,2 M
Dilarutkan 27,218 g kalium dihidrogen fosfat dalam air bebas CO2
secukupnya hingga 1000,0 ml (Ditjen POM, 1979).
3.4.1.3.4 Buffer Fosfat pH 7,4
Dibuat dengan mencampur 50,0 ml kalium dihidrogenfosfat 0,2 M dengan
39,1 ml natrium hidroksida 0,2 N, dan diencerkan dengan air bebas
3.4.1.4 Pembuatan Fase Gerak
Fase gerak terdiri dari buffer fosfat pH 7,4 dan metanol dengan
perbandingan 96,6:3,2. Fase gerak dibuat sebanyak 500 ml dengan
mencampurkan buffer fosfat pH 7,4 sebanyak 484 ml dan metanol sebanyak 16
ml. Sebelum digunakan fase gerak disaring melalui penyaring membran filter
whatman Cellulose Nitrate 0,45 µ m. Kemudian diawaudarakan selama ± 20 menit
menggunakan sonifikator.
3.4.1.5 Pembuatan Larutan Induk Baku
3.4.1.5.1 Pembuatan Larutan Induk Baku Pirazinamida
Ditimbang seksama sejumlah 10 mg Pirazinamida baku lalu dimasukkan
ke dalam vial yang telah dikalibrasi ad 1 ml, dilarutkan dengan fase gerak (buffer
fosfat pH 7,4:metanol dengan perbandingan 96,8:3,2) sehingga diperoleh
konsentrasi 81,2281 mM (10.000 mcg/ml).
3.4.1.5.2 Pembuatan Larutan Induk Baku Nikotinamid 3.4.1.5.2.1 Pembuatan Larutan Induk Baku Pertama
Ditimbang seksama sejumlah 10 mg Nikotinamid lalu dimasukkan ke
dalam labu 10 ml, dilarutkan dengan fase gerak (buffer fosfat pH 7,4:metanol
dengan perbandingan 96,8:3,2) hingga diperoleh larutan dengan konsentrasi
8,1900 mM (1.000 mcg/ml).
3.4.1.5.2.2 Pembuatan Larutan Induk Baku Kedua
Dipipet larutan induk pertama sebanyak 1,5 ml ke dalam labu 10 ml, diencerkan
dengan fase gerak (buffer fosfat pH 7,4:metanol dengan perbandingan 96,8:3,2)
3.4.2 Prosedur Analisis
3.4.2.1 Penyiapan Alat KCKT
Alat dihubungkan dengan sumber listrik, kemudian alat dihidupkan
dengan menekan tombol power. Diatur panjang gelombang menjadi 254 nm.
Dipurging untuk menghilangkan gelembung pada selang, kemudian dialirkan fase
gerak hingga laju alir 0,8 ml/menit. Biarkan hingga kondisi alat stabil.
3.4.2.2 Penentuan Garis Alas (Base Line)
Setelah dialirkan fase gerak selama 30 menit, dilihat absorbansi apakah
telah stabil, jika telah stabil absorbansi di nol kan dengan cara click to balance.
3.4.2.3 Penyuntikan Fase Gerak
Untuk mengetahui kebersihan injektor, maka dilakukan penyuntikan fase
gerak dengan cara: tekan single run, tulis nama sampel dan tekan OK. Injektor
diputar ke posisi load dan disuntikkan fase gerak ke dalam injektor dengan
menggunakan penyuntik mikroliter, injektor diputar ke posisi inject. (Hasil
penyuntikan fase gerak dapat dilihat pada Lampiran 4 halaman 26).
3.4.2.4 Penyuntikan Plasma Kontrol
Dipipet 300 µl plasma, dimasukkan ke dalam politube dan ditambahkan
600 µ l metanol untuk mengendapkan protein lalu divortex. Disentrifugasi dengan
kecepatan 4000 putaran permenit selama 5 menit. Dipisahkan supernatan dari
endapan dan dikumpulkan. Disaring dengan penyaring PTFE diameter 0,2 µm,
dengan laju aliran (flow rate) 0.8 ml/menit, deteksi pada panjang gelombang 254
nm. Dilihat kromatogram yang terbentuk. (Kromatogram dapat dilihat pada
Lampiran 7 halaman 29).
3.4.2.5 Analisis Kualitatif
Analisis kualitatif pirazinamida dan nikotinamid dapat dilakukan dengan
membandingkan waktu retensi yang sama dari kromatogram pada penyuntikan
sampel dengan kromatogram pada penyuntikan larutan baku pembanding
pirazinamida dan nikotinamid. (Kromatogram larutan baku pembanding dapat
dilihat pada Lampiran 5 halaman 27 dan Lampiran 6 halaman 28).
3.4.2.6 Analisis Kuantitatif
3.4.2.6.1 Penentuan Linieritas Kurva Kalibrasi Baku Pembanding Pirazinamida
Dipipet larutan induk baku Pirazinamida sebanyak 30 µ l; 40 µ l; 50 µ l; 60
µ l; 80 µl, masing-masing dimasukkan ke dalam vial yang telah dikalibrasi 1ml,
dicukupkan dengan fase gerak sampai garis tanda sehingga diperoleh konsentrasi
2,4368 mM (300 mcg/ml); 3,2491 mM (400 mcg/ml); 4,0614 mM (500 mcg/ml);
4,8736 mM (600 mcg/ml); 6,4982 mM (800 mcg/ml). Dari masing-masing
konsentrasi dipipet sebanyak 10 µl, dimasukkan ke dalam vial yang telah
dikalibrasi 2 ml, ditambahkan 50 μl larutan nikotinamid konsentrasi 1,2285 mM
(150 mcg/ml) kemudian ditambahkan plasma sampai garis tanda, divortex lalu
didiamkan selama 5 menit. Dipipet 300 µ l, dimasukkan ke dalam politube dan
ditambahkan 600 µ l metanol untuk mengendapkan protein lalu divortex.
Supernatan yang diperoleh diambil dengan menggunakan spuit kemudian disaring
dengan penyaring PTFE diameter 0,2 µm, lalu diinjeksikan ke dalam sistem
KCKT dengan volume penyuntikan 20 µ l dengan laju aliran (flow rate) 0.8
ml/menit, deteksi pada panjang gelombang 254 nm.
Kurva kalibrasi dibuat dengan menggunakan rasio luas puncak antara
bahan obat dengan baku dalam yang terukur oleh detektor versus konsentrasi
bahan obat untuk memperoleh garis regresi linier. (Kromatogram dapat dilihat
pada Lampiran 9 halaman 31 dan data perhitungan dapat dilihat pada Lampiran 10
halaman 36).
3.4.2.6.2 Pemeriksaan Kadar Pirazinamida Dalam Plasma Darah Pasien TB Kedalam plasma darah pasien ditambahkan 50 µ m nikotinamid 16,3 mM
(2.000 mcg/ml). Didiamkan selama 5 menit. Dipipet 300 µl, dimasukkan ke dalam
politube dan ditambahkan 600 µ l metanol untuk mengendapkan protein lalu
divortex. Disentrifugasi dengan kecepatan 4000 putaran per menit selama 5 menit.
Supernatan yang diperoleh diambil dengan menggunakan spuit kemudian disaring
dengan penyaring PTFE diameter 0,2 µm, lalu diinjeksikan ke dalam sistem
KCKT dengan volume penyuntikan 20 µ l dengan laju aliran (flow rate) 0.8
ml/menit, deteksi pada panjang gelombang 254 nm. Dilihat kromatogram yang
terbentuk dan waktu retensinya. Dihitung kadar obat dalam plasma dengan
menghitung luas puncaknya. (Kromatogram dapat dilihat pada Lampiran 8
halaman 30 dan data perhitungan kadar dapat dilihat pada Lampiran 11 halaman
3.4.3 Penentuan Batas Deteksi dan Batas Kuantifikasi
Batas deteksi (Limit of detection/LOD) didefenisikan sebagai konsentrasi analit terendah dalam sampel yang masih dapat dideteksi. Batas kuantifikasi
(Limit of quantification/LOQ) didefenisikan sebagai konsentrasi analit terendah
dalam sampel yang masih dapat ditentukan dengan presisi dan akurasi yang dapat
diterima pada kondisi operasional metode yang digunakan.
LOD =
Standar deviasi (SD) dapat ditentukan berdasarkan pada standar deviasi blanko,
pada standar deviasi residual dari garis regresi (Rohman, 2007).
Standar deviasi residual (Sy) =
(Data perhitungan batas deteksi dan batas kuantifikasi dapat dilihat pada
BAB IV
HASIL DAN PEMBAHASAN
Analisis Pirazinamida dalam plasma secara Kromatografi Cair Kinerja
Tinggi (KCKT) fase balik telah dilakukan oleh Revankar, S.N.,et al.,(1994)
menggunakan fase gerak buffer fosfat pH 7,4 dan metanol (96,8:3,2 v/v) pada
panjang gelombang 268 nm dan baku dalam nikotinamid. Menurut Gandjar dan
Rohman (2007), panjang gelombang yang dipilih biasanya 254 nm karena
kebanyakan senyawa obat menyerap di 254 nm. Menurut Munson (1991),
detektor ini tanggap terhadap banyak obat dan kepekaannya memadai bagi
penetapan sediaan obat dan kebanyakan cairan biologi. Berdasarkan hal tersebut
maka pemeriksaan kadar pirazinamida dalam plasma darah pasien TB dilakukan
secara KCKT dengan menggunakan kolom ODS C18, fase gerak buffer posfat pH
7,4:metanol (96,8:3,2 v/v) dan panjang gelombang 254 nm dengan baku dalam
nikotinamid.
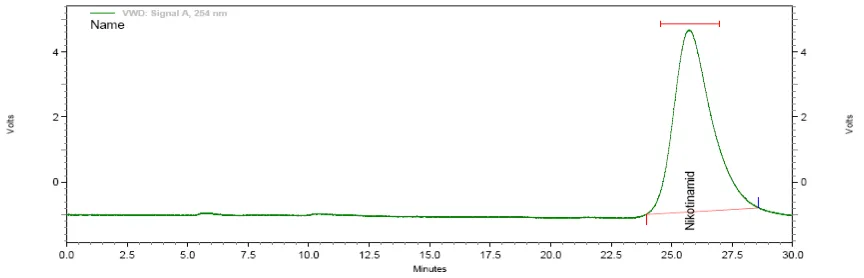
Untuk mengetahui waktu retensi dari pirazinamida dan nikotinamid
terlebih dahulu dilakukan penyuntikan larutan baku. Dari hasil penyuntikan
diperoleh waktu retensi larutan baku pirazinamida yaitu 21,663 menit dan waktu
tambat larutan baku nikotinamid yaitu 25,740 menit. Kedua kromatogram hasil
Gambar 7. Kromatogram hasil penyuntikan Pirazinamida baku
Gambar 8. Kromatogram hasil penyuntikan Nikotinamid baku
Sampel darah diambil dari seorang pasien TB yang sedang menjalani
tahap intensif selama ± 1 bulan. Dosis yang diminum oleh pasien adalah 1200 mg.
Pengambilan darah dilakukan 2 jam setelah pasien mengkonsumsi obat.
Pirazinamida dapat dengan baik diserap dari saluran cerna dan secara luas
didistribusikan pada jaringan tubuh. Waktu paruhnya adalah 8-11 jam (Chambers,
H.F.,2004). Resorpsinya cepat dan hampir sempurna; kadar maksimal dalam
Untuk suatu obat yang diberikan dalam dosis oral berulang waktu yang
diperlukan untuk mencapai keadaan tunak bergantung pada waktu paruh eliminasi
obat. Dari segi klinik, waktu yang diperlukan untuk mencapai 99% dari
konsentrasi tunak dalam plasma adalah 6,6 waktu paruh eliminasi (Shargel, 2005).
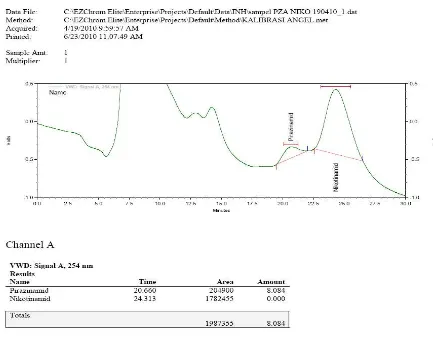
Dari hasil penyuntikan sampel diperoleh waktu retensi pirazinamida yaitu
20,660 menit dan nikotinamid yaitu 24,313 menit. Waktu retensi ini berdekatan
dengan waktu retensi pirazinamida baku dan nikotinamid baku. Kromatogram
hasil analisis sampel secara KCKT dapat dilihat pada Gambar 9.
Pirazinamida di dalam tubuh dihidrolisis oleh enzim pirazinamidase yang
berasal dari basil TB menjadi asam pirazinoat yang aktif sebagai tuberkulostatik
(Tjay dan Rahardja, 2002; Istiantoro, 2009). Pada temperatur kamar, pirazinamida
dalam plasma pasien TB berada dalam kondisi stabil. Hal ini dapat dilihat pada
Gambar 9. Kromatogram Hasil Penyuntikan Sampel dengan Baku Dalam Nikotinamid
Penentuan linieritas kurva kalibrasi ditentukan berdasarkan luas puncak
karena puncak yang dihasilkan asimetris. Pengukuran luas puncak biasanya lebih
dipilih pada puncak yang asimetris. Biasanya ketepatan metode menggunakan
nilai luas puncak sedikit dipengaruhi oleh perubahan dalam instrumen dan
parameter kromatografi (Snyder dan Kirkland, 1979). Menurut Kromidas (2005),
hampir semua peraturan menyatakan dengan tegas bahwa perhitungan dapat
dilakukan menggunakan metode luas puncak seperti tinggi puncak.
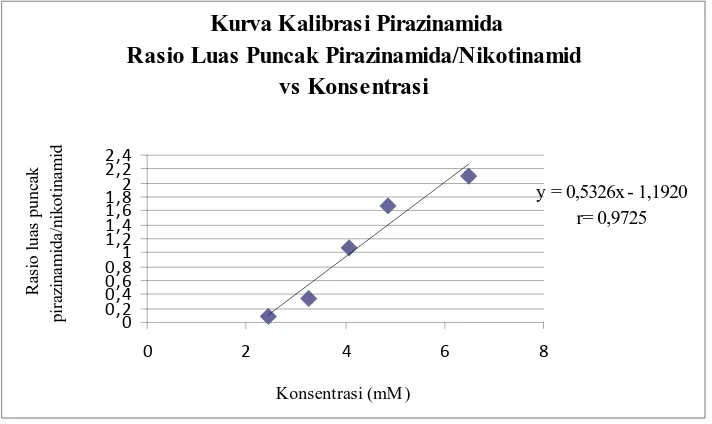
Kurva kalibrasi pirazinamida baku dibuat dengan konsentrasi 2,4368 mM
(600 mcg/ml) dan 6,4982 mM (800 mcg/ml). Dari kurva kalibrasi diperoleh
hubungan yang linier antara luas puncak dan konsentrasi dengan koefisien
korelasi (r)= 0,9725 dan persamaan regresi y = 0,5326x – 1,1920 dengan data
penyuntikan larutan baku pirazinamida. Kurva kalibrasi dapat dilihat pada
Gambar 10.
Kurva Kalibrasi Pirazinamida
Rasio Luas Puncak Pirazinamida/Nikotinamid vs Konsentrasi
Gambar 10. Kurva Kalibrasi Pirazinamida Baku Rasio Luas Puncak Pirazinamida/Nikotinamid versus Konsentrasi
Pada penyuntikan kalibrasi diperoleh waktu retensi antara 19,547-19,980 menit.
Kadar sampel dapat dihitung menggunakan persamaan regresi y = 0,5326x
– 1,1920 yaitu dengan mensubsitusikan y dengan harga rasio luas puncak. Hasil
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Pemeriksaan kadar pirazinamida dalam dalam plasma darah pasien TB
dapat dilakukan dengan cara kromatografi cair kinerja tinggi (KCKT)
menggunakan kolom ODS C18 dengan fase gerak campuran buffer fosfat pH
7,4:metanol (98,9:3,2), dengan laju alir 0,8ml/menit pada panjang gelombang 254
nm dan menggunakan baku dalam nikotinamid. Kadar yang diperoleh adalah
2,4537 mM.
Pirazinamida dalam plasma darah pasien TB berada dalam keadaan stabil
pada temperatur kamar.
5.2 Saran
Disarankan kepada peneliti selanjutnya agar melakukan validasi metode