PRODUKSI EMBRIO SECARA
IN VITRO
MENGGUNAKAN
SEMEN BEKU SAPI SIMMENTAL (
Bos taurus
) DAN
BRAHMAN (
Bos indicus
)
ALIF IMAN FITRIANTO
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Produksi Embrio Secara In Vitro Menggunakan Semen Beku Sapi Simmental (Bos taurus) dan Brahman (Bos indicus) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ALIF IMAN FITRIANTO. Produksi Embrio Secara In Vitro Menggunakan Semen Beku Sapi Simmental (Bos taurus) dan Brahman (Bos indicus). Dibimbing oleh ANNY ROSMAYANTI dan ARIEF BOEDIONO.
Produksi embrio secara in vitro merupakan salah satu aplikasi bioteknologi reproduksi yang dapat meningkatkan populasi, produktifitas, dan mutu ternak sapi di Indonesia. Penerapan metode ini digunakan untuk memanfaatan ovarium sebagai sumber oosit di rumah potong hewan, sehingga menjadi suatu produk yang sangat berharga berupa embrio. Penelitian ini bertujuan untuk mengetahui bangsa sapi yang mempunyai kemampuan perkembangan lebih baik dan mengetahui pengaruh musim terhadap produksi embrio secara fertilisasi in vitro. Berdasarkan hasil penelitian menunjukan bahwa semen sapi brahman memiliki kemampuan lebih baik dibandingkan sapi simmental dalam produksi embrio secara in vitro, tingkat pembelahan embrio, pembentukan blastosit hari ke-6, 7, 8, dan 9, serta total blastosis yang memiliki perbedaan nyata (P<0.05). Menggunakan semen sapi brahman yang memiliki kemampuan lebih baik, kemudian fertilisasi secara in vitro dilakukan pada dua musim yang berbeda yaitu musim kemarau dan musim penghujan. Berdasarkan hasil penelitian menunjukan bahwa musim kemarau lebih baik digunakan sebagai waktu fertilisasi secara in vitro dibandingkan musim penghujan pada sapi brahman yang memiliki perbedaan nyata (P<0.05).
Kata kunci: embrio sapi brahman, musim, produksi embrio in vitro
ABSTRACT
ALIF IMAN FITRIANTO. In Vitro Embryo Production Using Simmental Cattle (Bos taurus) and Brahman Cattle (Bos indicus) Frozen Semen. Supervised by ANNY ROSMAYANTI and ARIEF BOEDIONO.
In vitro embryo production is one of biotechnology application to increase the population, productivity, and quality of cattle in Indonesia. The implementation of this method is used to utilize ovary as a source of valuable product oocytes at slaughterhouse, to produce embryo in vitro. The research aims to know which cattle that had better developmental capability and study the influence of season to in vitro embryo production. The result indicate that brahman cattle sperm has better ability than simmental cattle sperm on in vitro embryo production, embryo cleavage rate, blastocyst formation day 6th, 7th, 8th, and 9th, as well as significant differences (P<0.05). By using brahman cattle sperm which has a better capabilities, in vitro fertilization then conducted in two different season, the dry and rainy season. The result indicated that in vitro embryo production by using brahman cattle sperm is better (P<0.05) conducted at dry season than rainy season.
.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
PRODUKSI EMBRIO SECARA
IN VITRO
MENGGUNAKAN
SEMEN BEKU SAPI SIMMENTAL (
Bos taurus
) DAN
BRAHMAN (
Bos indicus
)
ALIF IMAN FITRIANTO
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT, atas segala limpahan nikmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian ini dengan baik. Shalawat dan salam penulis sampaikan kepada junjungan Nabi Muhammad SAW, keluarga, dan para sahabat. Tema yang dipilih dalam penelitian adalah “Produksi Embrio Secara In Vitro Menggunakan Semen Beku Sapi Simental (Bos taurus) dan Brahman (Bos indicus)”.
Penulis mengucapkan terima kasih dan penghargaan setinggi-tingginya kepada:
1. Kedua orang tua Bapak Casmudi dan Ibu Taryumi, adikku Nurul Huda, serta
segenap keluarga besar penulis atas segala do’a, semangat, dan kasih sayang
yang selalu diberikan kepada penulis.
2. Prof Drh Arief Boediono, PhD PAVet (K) dan Anny Rosmayanti SPt selaku pembimbing sekripsi yang telah memberikan pengarahan, ilmu, dan bimbingan kepada penulis. Drh Isdoni, M Biomed selaku pembimbing akademik yang selalu memberikan pengarahan dan bimbingan selama proses perkuliahan.
3. Dr Drh Amrozi dan keluarga besar Sorcherry Riding Club yang telah menjadi keluarga kedua penulis selama menjalani studi perkuliahan.
4. Ir Tri Harsi, MP, Fahrudin Darlian, SPt, Laelatul Choiriyah, AMd, beserta seluruh staf Balai Embrio Ternak Cipelang atas izin dan fasilitas yang diberikan selama penelitian.
5. Penulis juga mengucapkan terima kasih kepada Talita Fauziah Milani atas segala bentuk dukungan dan motivasinya, teman satu penelitian G Andri Hermawan, M Faris Firdaus, Annisa Hasby Fauzia, dan Ika Septiana Anggun Puspita, seluruh keluarga besar Fakultas Kedokteran Hewan IPB dan seluruh pihak yang telah membantu kelancaran studi penulis, baik selama kuliah maupun dalam penyelesaian sekripsi ini.
Semoga karya ilmiah ini bermanfaat khususnya bagi penulis, dan bagi ilmu pengetahuan.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Tempat dan Waktu Penelitian 2
HASIL DAN PEMBAHASAN 5
SIMPULAN DAN SARAN 9
Simpulan 9
Saran 9
DAFTAR PUSTAKA 10
DAFTAR TABEL
1 Tingkat produksi embrio hasil fertilisasi in vitro menggunakan semen
sapi simmental dan brahman 5
2 Tingkat produksi embrio hasil fertilisasi in vitro pada musim kemarau
dan penghujan menggunakan semen sapi brahman 8
DAFTAR GAMBAR
1 Kualitas oosit hasil koleksi dari ovarium 3
PENDAHULUAN
Latar Belakang
Peningkatan jumlah penduduk berbanding lurus dengan meningkatnya kebutuhan pangan dalam negeri khususnya pangan asal hewan yaitu daging sapi. Hingga saat ini untuk memenuhi kebutuhan pangan Indonesia masih mengandalkan impor dari negara lain baik berupa ternak hidup maupun daging beku. Dirjen Peternakan dan Kesehatan Hewan Kementerian Pertanian mencatat pada tahun 2011 konsumsi daging sapi nasional mencapai 449 ribu ton. Produksi dalam negeri yang menopang konsumsi hanya mencapai 292 ribu ton, sehingga sisanya sebanyak 34.9% masih impor (Ditjennak 2012).
Sementara itu, Badan Pusat Statistik (BPS) memproyeksikan pada tahun 2013 konsumsi daging Indonesia sebesar 521 ribu ton, meningkat sebesar 7.4% dibandingkan proyeksi tahun 2012 yaitu sebesar 485 ribu ton. Proporsi jumlah impor sebesar 17.45% pada tahun 2012 dan 13.83% pada tahun 2013 (BPS 2010). Tingginya persentase nilai impor yang dilakukan mengindikasikan rendahnya jumlah produksi daging sapi lokal dibandingkan kebutuhan konsumsi dalam negeri. Untuk mengatasi hal ini, pemerintah Indonesia telah berupaya untuk dapat memenuhi kebutuhan daging sapi dalam negeri. Pemerintah Indonesia telah dua kali mencanangkan program swasembada daging sapi yakni pada tahun 2005 dicanangkan program swasembada daging sapi (PSDS) tahun 2010, dan yang kedua adalah pencanangan program percepatan swasembada daging sapi (P2SDS) 2010, dan direvisi sebelum tahun 2009 P2SDS menjadi tahun 2014 (BPS 2011).
Penerapan bioteknologi perlu dilakukan untuk mendukung program pemerintah dalam meningkatkan produksi daging sapi nasional. Berbagai rekayasa teknologi reproduksi telah banyak berkembang pesat dalam tiga dekade terakhir, teknik ini meliputi fertilisasi in vitro (FIV), manipulasi embrio, pembentukan gamet dan embrio, thawing dan transfer embrio (Madihah et al. 2006).
2
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui kemampuan spermatozoa sapi simmental (Bos taurus) dan brahman (Bos indicus) dalam melakukan fertilisasi, dan mengetahui pengaruh musim terhadap produksi embrio in vitro.
METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan di laboratorium produksi embrio in vitro Balai Embrio Ternak Cipelang, Bogor. Penelitian ini dilakukan pada Juni 2013 dan Februari 2014, meliputi proses pelatihan teknik produksi embrio secara in vitro dan pengambilan data sekunder produksi embrio secara in vitro pada tahun 2011.
Produksi embrio secara in vitro merupakan rangkaian proses biologi yang berkaitan satu sama lain. Rangkaian tersebut meliputi koleksi oosit, maturasi oosit in vitro, fertilisasi in vitro, dan kultur embrio in vitro.
Koleksi Oosit
Koleksi oosit dilakukan dengan metode aspirasi folikel pada ovarium sapi yang diambil dari rumah potong hewan (sapi bali, ongole, brahman, dan simmental) tanpa membedakan bangsa sapi. Ovarium segera setelah dipotong dimasukkan dalam medium yang berisi laktat ringer dengan antibiotik (streptomycin (Sigma Cat.#S1277) 100 mg/L dan penicillin (Sigma Cat.#4687) 100.000 IU/L) pada suhu ±37.5°C, kemudian dibawa ke laboratorium dengan dimasukkan ke dalam termos untuk menjaga suhu tetap stabil. Koleksi oosit dilakukan dengan cara aspirasi menggunakan syringe 5 ml dan jarum suntik ukuran 18-G yang sebelumnya telah diisi 0.5-1 PBS (Phosphate Buffered Saline) yang telah disuplementasi dengan Fetal Calf Serum (FCS; Sigma Cat.#F2442). Oosit yang telah terkumpul kemudian diletakkan dalam cawan petri bergaris berukuran 90x90x10 mm. Pencarian oosit dilakukan di bawah mikroskop stereo, dan hanya oosit dengan kualitas A dan B yang dilanjutkan pada proses maturasi in vitro.
3
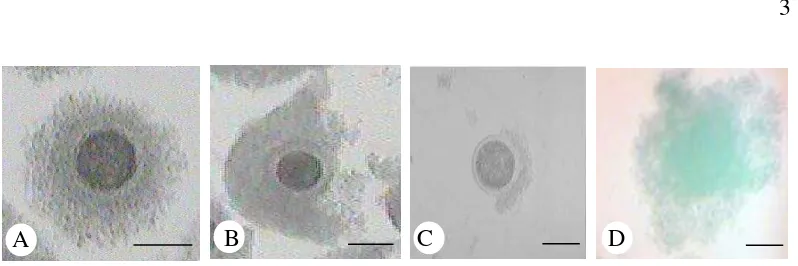
Gambar 1 Kualitas oosit hasil koleksi dari ovarium: A) Oosit A, memiliki ooplasma yang homogen dan adanya sel-sel kumulus oophorus yang mengelilingi oosit secara penuh; B) Oosit B; memiliki ooplasma homogen, namun hanya sebagian oosit yang dikelilingi sel-sel kumulus oophorus; C) Oosit C, tidak terdapat sel-sel kumulus oophorus yang mengelilingi oosit; D) Oosit D, memiliki ooplasma yang tidak homogen dan sel-sel kumulus oophorus telah menyebar atau expand. Bar: 100 μm. (Dokumentasi Balai Embrio Ternak). Maturasi Oosit
Maturasi oosit secara in vitro dilakukan dalam drop/tetes dengan medium maturasi yang terdiri dari Tissue Culture Medium 199 (TCM-199; Gibco Cat.#11150-042) ditambahkan dengan FCS 10%, streptomycin 100 mg/L dan penicillin 100.000 IU/L, dan mineral oil (Sigma Cat.#M.8410). Proses maturasi dilakukan secara berkelompok dengan jumlah oosit sebanyak 40-100 oosit tiap drop dengan volume media sebanyak 5 μL/oosit. Kemudian diinkubasi dalam inkubator CO2, dengan kadar CO2 5%, suhu 38.5°C, dan kelembaban 90%, dengan periode inkubasi 18-24 jam.
Fertilisasi In Vitro
Spermatozoa yang digunakan untuk penelitian adalah semen beku sapi simmental dan sapi brahman, yang didapatkan dari Balai Inseminasi Buatan Lembang. Semen beku di thawing menggunakan air hangat dengan suhu 37°C, kemudian dicuci dengan medium Sperm Washing Solution (SWS, Brackett dan Oliphant solution, Na caffeine benzoate 0.942 g, dan heparin (Sigma Cat. #D4776) sebanyak 50µL, kemudian disentrifugasi dengan kecepatan 1.800 rpm, suhu 38°C, selama 5 menit, prosedur ini dilakukan sebanyak 2 kali. Sedimen atau supernatan yang terbentuk kemudian diencerkan dengan medium Sperm Diluting Solution (SDS, Brackett dan Oliphant solution 10 mL dengan 200 mg Bovine Serum Albumin (BSA; Sigma Cat. #A8806) 0.3%), dan dilakukan penghitungan konsentrasi dalam Neubaur Chamber, sehingga konsentrasinya 12.5x106/mL. Konsentrasi spermatozoa yang digunakan dalam metode FIV berkisar antara 0.5-5x106/mL (Gordon 2003). Oosit yang telah dimaturasi kemudian dicuci menggunakan medium Oocyte Washing Solution (Brackett dan Oliphant solution dan BSA).
Fertilisasi in vitro dilakukan dalam drop SDS dengan volume tiap drop
100 μL dalam inkubator CO2 5% pada suhu 38.5ºC, dengan meletakkan (20-25) oosit dalam drop/tetes berisi spermatozoa. Fertilisasi dilakukan selama 5 jam, kemudian zigot dibersihkan dari spermatozoa dan sel kumulus, kemudian medium
4
diganti menggunakan medium CR1aa + FCS 10% dan diinkubasikan kembali selama 6-9 hari dalam inkubator CO2 5% pada suhu 38.5ºC dimana embrio telah mencapai tahap blastosis.
Kultur dan Evaluasi Embrio
Sel telur yang telah terbuahi atau zigot mengalami pembelahan awal menjadi 2, 4, dan 8 sel hingga mengalami kompaksi dan disebut dengan morula, kemudian morula berkembang menjadi blastosis yang memiliki stuktur terdiri atas Inner Cell Mass (ICM), trofoblast, blastosul, dan zona pelusida. Evaluasi jumlah embrio dilakukan pada hari ke-2 untuk melihat embrio tahap pembelahan ≥2 sel, kemudian evaluasi jumlah embrio tahap blastosis dilakukan pada hari ke-6, 7, 8, dan 9. Embrio yang mencapai tahap blastosis dicatat dan dikeluarkan dari drop kultur untuk menghindari perhitungan ganda. Embrio yang berkembang pada hari ke-6, 7, 8, dan 9 dijumlahkan seluruhnya menjadi total pembentukan embrio tahap blastosis.
Penelitian ini dilakukan dua tahap. Tahap I, keberhasilan produksi embrio secara in vitro yang dilakukan dengan membandingkan potensi spermatozoa yang berasal sapi simmental dan brahman. Pada tahap II, produksi secara in vitro dilakukan pada musim yang berbeda (kemarau dan penghujan), dengan menggunakan semen dari sapi terbaik yang dihasilkan dari penelitian tahap I.
Analisis Data
5
HASIL DAN PEMBAHASAN
Hasil penelitian untuk membandingkan produksi embrio secara in vitro menggunakan semen beku sapi simmental dan brahman terdapat pada Tabel 1. Tabel 1 Tingkat produksi embrio hasil fertilisasi in vitro menggunakan semen sapi
simmental dan brahman
Jenis semen
Simmental Brahman
Oosit difertilisasi 690 752
Pembelahan n(%±SB)* 317(45.94±12.28)a 485(64.49±12.27)b Blastosis n(%±SB)**
Hari ke-6 8(2.52±4.24) a 46(9.48±4.13) b Hari ke-7 93(29.34±9.97) a 174(35.88±10.6) b Hari ke-8 44(13.88±6.68) a 65(13.40±6.07) b Hari ke-9 6(1.89±2.23) a 20(4.12±2.11)b Total blastosis n(%±SB)** 151(47.63±3.18)a 305(62.89±8.45) b
Keterangan: Superskrip yang berbeda pada baris yang sama menunjukkan berbeda nyata (P<0.05) *persentase diperoleh berdasarkan oosit difertilisasi
**persentase diperoleh berdasarkan embrio tahap pembelahan
Keberhasilan tingkat fertilisasi diasumsikan sama dengan banyaknya jumlah zigot yang membelah walaupun ada kemungkinan terjadinya proses partenogenesis. Hasil pengamatan untuk melihat jumlah embrio pada fase pembelahan ≥2 sel dilakukan pada hari ke-2, dimana diperoleh embrio berkembang mencapai tahap 2, 4, dan 8 sel. Tingkat perkembangan embrio
mencapai tahap ≥2 sel diperoleh nilai lebih tinggi (P<0.05) bila menggunakan spermatozoa sapi brahman dibandingkan sapi simmental.
Berdasarkan hasil tersebut menunjukkan bahwa sapi brahman memiliki kemampuan lebih baik dalam melakukan fertilisasi in vitro daripada sapi simmental. Hal ini karena sapi brahman memiliki kemampuan dalam beradaptasi yang lebih baik dengan berbagai lingkungan dibandingkan sapi simmental. Sapi brahman memiliki daya tahan terhadap panas lebih baik dibandingkan sapi Eropa. Hal tersebut sesuai dengan laporan Sudarmono dan Sugeng (2008), bahwa sapi brahman cocok dengan kondisi Indonesia. Kelompok sapi zebu, seperti sapi brahman mudah beradaptasi terhadap lingkungan panas dan pakan yang sederhana (Phillips 2001). Sapi bangsa Bos indicus lebih unggul dalam hal adaptasi, yaitu resisten pada kondisi lingkungan yang kurang baik (Gorbani et al. 2009). Sapi simmental merupakan sapi yang didatangkan dari luar negeri dengan iklim sub tropis, sehingga harus beradaptasi dengan iklim tropis Indonesia yang cenderung panas. Sapi simmental adalah bangsa Bos taurus (Talib dan Siregar 1999), berasal dari daerah Simme di negara Swiss tetapi sekarang berkembang lebih cepat di benua Eropa dan Amerika.
6
perbedaan kemampuan dalam fertilisasi juga dapat dipengaruhi oleh perbedaan bangsa pejantan yang digunakan untuk membuahi (Ward et al. 2001). Setelah sperma masuk ke dalam oosit, kromatin sperma akan mengalami renovasi yang luas dan mengakibatkan reorganisasi dari genom jantan menjadi pronukleus jantan sehingga akan bertemu dengan pronukleus betina yang dihasilkan oleh oosit. Pronukleus betina dan jantan akan mengalami sintesis DNA sebelum memasuki proses mitosis yang pertama, sehingga terjadi pembelahan embrio yang pertama menjadi dua sel (Gambar 2).
Rendahnya jumlah zigot yang membelah dapat dipengaruhi oleh kegagalan fertilisasi yang disebabkan oleh beberapa hal antara lain: tingkat maturasi oosit yang kurang sempurna (Moore dan Trounson 1977), kegagalan pembentukan pronukleus jantan yang diakibatkan kegagalan spermatozoa mengalami kondensasi dalam sitoplasma oosit (Crozet et al. 1995), dan proses kapasitasi dan reaksi akrosom yang kurang memadai (Bearden dan Fuquay 2000). Fertilitas pejantan secara in vitro mempengaruhi waktu dan durasi replikasi DNA, sedangkan genotipe betina tidak ikut mengatur waktu terjadinya replikasi DNA. Hal tersebut membuktikan bahwa pejantan pada sapi mempengaruhi waktu dan durasi replikasi DNA selama siklus sel pertama, dan pada akhirnya mempengaruhi waktu pembelahan pertama (Comizzoli et al. 2000).
Lingkungan juga sangat berperan terhadap perkembangan pembelahan awal dari embrio. Lingkungan yang mempengaruhi pembelahan awal embrio antara lain kecukupan nutrisi dalam medium kultur, kecukupan CO2, dan kestabilan suhu dan pH, dalam hal ini diatur oleh inkubator CO2. Hal ini sesuai dengan pendapat Leese et al. (1999), banyaknya jumlah sel yang membelah juga dipengaruhi oleh kestabilan inkubator, karena temperatur inkubator yang tidak stabil akan mempengaruhi hasil fertilisasi in vitro.
Faktor lain yang dapat mempengaruhi tingkat pembelahan dalam produksi embrio antara lain, variasi kondisi oosit, kualitas oosit, semen, konsentrasi bahan kimia dan waktu aktivasi oosit (Korkmaz 2012), media dan kultur yang digunakan setiap fase produksi embrio in vitro (Cevik et al. 2009), dan fertilitas pejantan (Ward et al. 2001).
Tingkat pembentukan blastosis menggunakan spermatozoa sapi simmental dan sapi brahman pada hari ke-6, 7, 8, 9, dan total jumlah blastosis menunjukan berbeda nyata (P<0.05). Puncak pembentukan blastosis pada kedua bangsa sapi tersebut terjadi pada hari ketujuh. Hal ini sesuai dengan laporan Ward et al. (2001), yang menyatakan bahwa puncak pembentukan blastosis rata-rata terjadi pada hari ketujuh setelah fertilisasi pada setiap pejantan yang digunakan.
7 positif terhadap jumlah zigot yang berkembang menjadi blastosis pada ruminansia, hal ini dikarenakan tingginya tekanan O2 dalam saluran reproduksi betina, sehingga harus disesuaikan ketika menggunakan teknik fertilisasi in vitro (Lonergan et al. 1999a).
Pembentukan embrio tahap blastosis dipengaruhi oleh pembelahan embrio pada fase pembelahan ≥2 sel yang dievaluasi pada hari ke-2. Hal tersebut berpengaruh terhadap pembentukan total blastosis, dimana produksi embrio menggunakan spermatozoa sapi brahman memiliki kemampuan yang lebih baik dalam pembentukan blastosis dibandingkan dengan menggunakan spermatozoa sapi simmental. Menurut Lonergan et al. (1999b), embrio yang membelah lebih awal memiliki perbedaan jumlah pembentukan blastosis yang tinggi bila dibandingkan dengan embrio yang membelah lebih akhir.
Rendahnya jumlah embrio yang mencapai tahap blastosis diakibatkan oleh adanya hambatan perkembangan, seperti dilaporkan Keskintepe dan Brackett (1994), dan Crozet et al. (1995), hambatan perkembangan tersebut karena material mRNA spesifik yang berperan pada masa kritis dari periode kompaksi dan diferensiasi blastosis terakumulasi pada tahap akhir perkembangan folikel. Pada tahap tersebut oosit telah mengalami sintesa faktor maternal yang diperlukan untuk menunjang proses maturasi, fertilisasi, dan perkembangan embrio tahap awal (Boediono et al. 2000). Menurut laporan Gordon (1994), fase penting dalam perkembangan awal embrio mamalia adalah saat terjadi kompaksi sel, kejadian ini akan bervariasi menurut spesiesnya. Seidel dan Garner (2002), menduga waktu kompaksi dari embrio sapi terjadi pada fase 16 sel, tetapi kebanyakan peneliti berpendapat bahwa waktu kompaksi dari embrio sapi terjadi pada fase 32 sel atau lebih (Prather dan First 1988; Bondioli et al. 1990; Van Soom et al. 1992). Van Soom et al. (1992) menyatakan bahwa kompaksi sel pada embrio sapi biasanya terjadi antara hari kelima sampai keenam setelah fertilisasi.
Tahapan yang penting dalam perkembangan awal embrio adalah perubahan dari fase morula ke blastosis, pada fase ini menghasilkan dua tipe sel, yaitu Inner Cell Mass (ICM) dan sel trophoblast. Sel trophoblast akan berkembang menjadi jaringan extraembryonic, sedangkan ICM akan menjadi fetus yang kemudian berkembang menjadi tiga bentuk lapisan sel perkembangan embrio (endoderm, mesoderm dan ektoderm) (Gordon 1994).
8
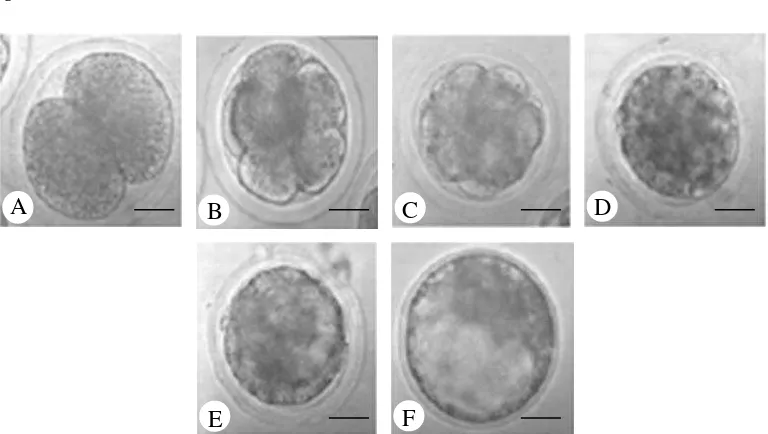
Gambar 2 Perkembangan embrio hasil fertilisasi in vitro: A) Embrio tahap pembelahan 2 sel; B) Pembelahan >4 sel; C) Morula; D) Kompak morula; E) Early blastosis; F) Blastosis. Bar: 30 μm. (Dokumentasi Balai Embrio Ternak)
Semen sapi brahman memiliki kemampuan yang lebih baik dalam produksi embrio secara fertilisasi in vitro, oleh karena itu dilakukan uji lebih lanjut mengenai pengaruh musim terhadap tingkat pembentukan blastosis dalam produksi embrio secara fertilisasi in vitro. Berdasarkan pengujian pada sapi brahman yang difertilisasi in vitro pada musim kemarau dan penghujan diperoleh hasil sesuai dengan Tabel 2.
Tabel 2 Tingkat produksi embrio hasil fertilisasi in vitro pada musim kemarau dan penghujan menggunakan semen sapi brahman
Kemarau Penghujan
Oosit difertilisasi 532 536
Pembelahan n(%±SB)* 361(67.86±10.94)a 140(26.12±10.20)b Blastosis n(%±SB)**
Hari ke-6 35(9.70±4.17)a 8(5.71±10.34)b Hari ke-7 145(40.17±6.74)a 23(16.43±14.70)b Hari ke-8 46(12.74±3.60)a 9(6.43±9.15)b Hari ke-9 14(3.88±1.88)a 6(4.29±7.64)a Total blastosis n(%±SB)** 240(66.48±6.55)a 46(32.86±9.08)b
Keterangan: Superskrip yang berbeda pada baris yang sama menunjukkan berbeda nyata (P<0.05) *persentase diperoleh berdasarkan jumlah oosit difertilisasi
**persentase diperoleh berdasarkan jumlah embrio tahap pembelahan
Berdasarkan hasil penelitian diperoleh bahwa musim memberikan pengaruh terhadap tingkat produksi embrio yang dihasilkan pada sapi brahman. Tingkat produksi embrio hasil fertilisasi secara in vitro menggunakan semen sapi brahman, pada embrio tahap pembelahan hari ke-2 dan total jumlah blastosis menunjukan hasil yang berbeda nyata (P<0.05) antara musim penghujan dan musim kemarau, dimana musim kemarau lebih baik dibandingkan musim penghujan. Pembentukan embrio tahap blastosis pada hari ke-6, 7, dan 8
A B C
E
D
9 menunjukan hasil yang berbeda nyata (P<0.05), sedangkan pada hari ke-9 menunjukan hasil yang tidak berbeda nyata (P>0.05).
Perbedaan hasil pembentukan blastosis yang diperoleh pada musim kemarau dan penghujan dikarenakan adanya perbedaan intensitas cahaya. Ketika musim penghujan intensitas cahaya menjadi rendah karena tingginya curah hujan, hal tersebut mengakibatkan terganggunya regulasi hormon dalam tubuh sapi yang mengakibatkan penurunan kualitas oosit. Ronnberg et al. (1990) melaporkan bahwa aktivitas steroidogenik ovarium yang ditaksir menggunakan konsentrasi serum estrogen (E2), diperoleh hasil menurun selama gelap (musim penghujan) dan fase luteal konsentrasi gonadotropin juga menurun, hal ini dikarenakan meningkatnya konsentrasi melatonin pada serum dan cairan folikel. Boediono et al. (1997) melaporkan bahwa tingkat kehamilan melalui assisted reproductive technology (ART) tertinggi pada wanita terjadi pada musim panas.
Embrio tahap blastosis yang terbentuk pada hari ke-6, 7, dan 8, menunjukan hasil yang lebih baik pada musim kemarau dibandingkan pada musim penghujan. Hal ini dikarenakan kualitas oosit pada musim penghujan lebih buruk yang disebabkan oleh penurunan aktivitas steroidogenik ovarium akibat peningkatan konsentrasi melatonin pada serum dan cairan folikel.
Evaluasi hari ke-9 perkembangan embrio tahap blastosis diperoleh hasil yang tidak berbeda nyata (P>0.05). Hal ini dikarenakan adanya perbedaan kromosom seks pada embrio. Boediono et al. (2003) melaporkan bahwa embrio jantan pada produksi embrio in vitro terbentuk lebih awal dibandingkan embrio betina. Hal ini yang mengakibatkan tingginya embrio yang terbentuk pada awal perkembangan, yaitu hari ke-2, 6, 7, dan 8 yang diduga sebagai embrio jantan, dan terjadi penurunan pada hari ke-9 dikarenakan jumlahnya yang terus berkurang.
SIMPULAN DAN SARAN
Simpulan
Semen sapi brahman (Bos indicus) memiliki kemampuan lebih baik dibandingkan semen sapi simmental (Bos taurus) dalam produksi embrio secara in vitro, tingkat pembelahan embrio, pembentukan blastosis hari ke-6, 7, 8, dan 9, serta pembentukan blastosis total. Pelaksanaan produksi embrio pada sapi brahman (Bos indicus) lebih baik dilakukan pada musim kemarau dibandingkan dengan musim penghujan.
Saran
10
DAFTAR PUSTAKA
Bearden HJ, Fuquay JW. 2000. Applied Animal Reproduction. 5th Ed. New Jersey (US): Prentice Hall.
Boediono A, Damayanti T. 1996. Dari limbah rumah potong hewan bisa dihasilkan anak sapi . Spektrum. 10: 32-33.
Boediono A, Kuramoto T, Sugioka M, Umebeyashi T, Fukuda K. 1997. The outcome of assisted reproductive technology (ART) program in different season. Proceeding of the 10th World Congress of in Vitro Fertilization and Assisted Reproduction. Vancouver, Canada.
Boediono A, Rusiyantono Y, Mohamad K, Djuwita I, Harliatien. 2000. Developmental competence of caprine oocyte after in vitro maturation, fertilization and culture. Media Veteriner. 7 (4): 11-17.
Boediono A, Suzuki T, Godke RA. 2003. Comparation of hybrid and purebredin vitro-derived cattle embryos during in vitro culture. Animal Reproduction Science. 78: 1-11.
Bondioli KR, Westhusin ME, Looney CR. 1990. Production of identical bovine off-spring by nuclear transfer. Theriogenology. 33: 165-174.
[BPS] Badan Pusat Statistik Jakarta. 2010. Proyeksi Penyediaan Daging Sapi 2010-2014 Indonesia. Jakarta (ID): BPS.
[BPS] Badan Pusat Statistik Jakarta. 2011. Program Percepatan Swasembada Daging Sapi (P2SDS) 2014 Indonesia. Jakarta (ID): BPS.
Cevik M, Sagirkaya H, Tas A, Akkoc T, Bagis H, Arat S. 2009. Comparing in bovine zygote. J Biol Reprod. 62: 1677-1684.
Crozet N, Ahmed-Ali M, Dubos MP. 1995. Developmental competence of goat oocyte from follicles of different size categories following maturation, fertilization and culture in vitro. J Reprod Fert. 103: 293-298.
[Ditjennak] Direktorat Jenderal Peternakan. 2012. Pasokan Daging Sapi 2012 Aman [internet]. [diunduh 2013 Des 12]. Tersedia pada http://www. association with testis biometry traits in Iranian Holstein bull. AfricanJ of MicrobiolRes. 3: 809-814.
Gordon I. 1994. Laboratory Production of Cattle Embryos. Cambridge (GB): United Kingdom.
11 Keskintepe L, Brackett BG. 1994. In vitro developmental competence of in vitro matured bovine oocytes fertilized and cultured in completely defined media. J Biol Reprod. 55 (2): 333-339.
Korkmaz O, Kuplulu S, Agca Y, Polat IM. 2012. Effect of oocyte quality and activation protocols on bovine embryo development following intracytoplasmic sperm injection. Turk. J Anim Sci. 36 (1). doi: 10.3906/vet-1105-44.
Krisher RL, Lane M, Bavister BD. 1999. Development competence and metabolism of bovine embryos cultured in semi-defined and defined culture media. JBiol Reprod. 60: 1345-1352.
Leese HJ, Conaghan J, Hardy K, Handyside AH, Martin KL, Winson RML. 1999. Gamete and Embryo Quality. The Parthenon Publishing Group, p: 125-138.
Lonergan P, O'Kearney-Flynn M, Boland MP. 1999a. Effect of protein supplementation and presence of an antioxidant on the development of bovine zygotes in synthetic oviduct fluid medium under high or low oxygen tension. Theriogenology. 51 (8): 1565-76.
Lonergan P, Khatir H, Piumi F, Rieger D, Humblot P, Boland MP. 1999b. Effect of time interval from insemination to first cleavage on the developmental characteristics, sex ratio and pregnancy rate after transfer of bovine embryos. J Reprod and Fert. 117: 159-167.
Madihah, Kusumaningtyas H, Boediono A, Sumarsono SH. 2006. Kualitas, kemampuan, implantasi, dan viabilitas in-vivo embrio mencit (Mus musculus) galur swiss webster setelah pembekuan dengan metode vitrifikasi. Biota. 11 (2): 72-79.
Moore WT, Trounson AO. 1977. Hormonal and Follicular Factors Affecting Maturation Of Sheep Oocytes In Vitro And Yhier Subsequent Developmental Capacity. J Reprod Fert. 49: 101-109.
Phillips CJ. 2001. Principles of Cattle Production. New York (US): CABI Publishing.
Prather RS, First NL. 1988. A review of early mouse embryogenesis and its applications to domestic species. J Anim Sci. 66: 2626-2635.
Ronnberg L, Kaupilla A, Leppaluoto J, Martikainen H, Vakkuri O. 1990. Cireadian and Seasonal Variation in human preovulatory follicular fluid melatonin concentration. J Clin Endocrinol Metab. 71: 493-496.
Seidel GE Jr, Garner DL. 2002. Current status of sexing mammalian spermatozoa. Reproduction. 124: 733-743.
Sobari I, Trilaksana B, Suatha IK. 2012. Estimasi dinamika populasi dan produktivitas sapibali di kabupaten kepulauan Yapen, Provinsi Papua. Buletin Peternakan. 34 (3): 169-177.
Steeves TE, Gardner DK. 1999. Temporal and differential effects of amino acids on bovine embryo development in culture. Biol Reprod. 61: 731-740. Sudarmono AS, Sugeng YB. 2008. Sapi Potong. Jakarta (ID): Penebar Swadaya. Talib C, Siregar AR. 1999. Faktor-faktor yang mempengaruhi pertumbuhan pedet
12
Van Soom A, Van Vlanenderen V, Mahmoudzadeh AR, Deluyker H, de Kruif A. 1992. Compaction rate of in vitro fertilized bovine embryos related to the internal from insemination to first cleavage. Theriogenology. 38: 905-919. Ward F, Rizos D, Corridan D, Quinn K, Boland M, Lonergan P. 2001. Paternal
Influence on the Time of First Embryonic Cleavage Post Insemination and the Implications for Subsequent Bovine Embryo Development In vitro and Fertility In vivo. MolReprod and Dev. 60: 47-55.
13
RIWAYAT HIDUP
Penulis dilahirkan di Pemalang, Jawa Tengah, pada tanggal 16 April 1992 sebagai putra pertama dari pasangan Bapak Casmudi dan Ibu Taryumi. Penulis bersekolah di SD Negeri 01 Wonogiri, SMP Negeri 01 Ampelgading, dan lulus dari SMA Negeri 01 Comal pada tahun 2010, kemudian penulis melanjutkan studi nya di Institut Pertanian Bogor sebagai mahasiswa Kedokteran Hewan melalui jalur Undangan Seleksi Masuk IPB (USMI).