1
PEMBENTUKAN BLASTOSIS PADA EMBRIO SAPI YANG
DIFERTILISASI SECARA IN VITRO DENGAN SEMEN
SAPI BALI (Bos javanicus) DAN SEMEN SAPI
SIMMENTAL (Bos taurus)
SKRIPSI
FAHRUDIN DARLIAN
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2013
2
RINGKASAN
Fahrudin Darlian. D14086007. 2013. Pembentukan Blastosis Pada Embrio Sapi
yang Difertilisasi Secara In Vitro dengan Semen Sapi Bali (Bos javanicus) dan Semen Sapi Simmental (Bos taurus). Skripsi. Departemen Ilmu Produksi dan
Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor. Pembimbing Utama : Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc. Pembimbing Anggota : Muhammad Imron, S.Pt., M.Si.
Kebutuhan daging sapi dalam negeri terus meningkat, dan sampai saat ini kebutuhan tersebut sebagian besar masih dipenuhi dari luar negeri. Peningkatan dan percepatan populasi ternak lokal dapat dilakukan dengan aplikasi bioteknologi reproduksi kelahiran ganda dengan Transfer Embrio (TE). Fertilisasi in vitro merupakan salah satu pengembangan bioteknologi reproduksi yang dapat digunakan sebagai alternatif untuk meningkatkan populasi, produktifitas, dan mutu ternak sapi di Indonesia. Sapi Bali (Bos javanicus) merupakan plasma nutfah asli Indonesia yang merupakan salah satu sapi penghasil daging yang cukup baik dan mudah beradaptasi dengan lingkungan, dan juga memiliki tingkat fertilitas yang baik. Peningkatan populasi sapi Bali dapat dilakukan dengan produksi embrio secara in vitro. Tujuan penelitian ini adalah untuk mengetahui kemampuan sperma sapi Bali (Bos javanicus) dalam melakukan fertilisasi secara in vitro dan pengaruhnya terhadap pembelahan sel sampai pada tahap blastosit, yang dibandingkan dengan sapi Simmental (Bos taurus).
Penelitian ini telah dilaksanakan pada bulan Mei sampai dengan Juni 2012 di Laboratorium Balai Embrio Ternak Cipelang, Bogor. Ovarium sebagai sumber oosit diperoleh dari RPH. Oosit yang telah dimaturasi, difertilisasi dengan menggunakan sperma sapi Bali dan Simmental yang merupakan perlakuan dalam penelitian ini. Peubah yang diamati dalam penelitian ini adalah tingkat pembelahan pada hari kedua, pembentukan morula pada hari kelima dan pembentukan blastosit pada hari ke-6, 7, 8 dan 9. Data hasil penelitian ini diolah dengan analisis chi-kuadrat.
Hasil penelitian menunjukkan bahwa sapi Bali memiliki kemampuan yang lebih baik dibandingkan dengan sapi Simmental dalam melakukan fertilisasi secara in vitro. Hal tersebut dilihat dari tingkat pembelahan embrio, pembentukan morula dan blastosit total yang berbeda nyata (P<0,05). Tingkat Pembelahan pada sapi Bali dan Simmental berturut-turut 58,68% dan 50,76%; pembentukan morula berturut-turut 56,03% dan 53,00%; pembentukan blastosit total berturut-turut 43,97% dan 40,00%. Tingkat pembentukan blastosit pada hari ke-6 menunjukkan perbedaan yang nyata (P<0,05), sedangkan pada hari ke-7, 8, dan 9 tidak berbeda nyata (P>0,05). Pembentukan blastosit pada hari ke-6 pada sapi Bali dan Simmental yaitu berturut-turut 8,56% dan 4,00%; sedangkan pada hari ke-7, 8, dan 9 berturut-turut 19,07% vs. 20,00%; 11,28% vs. 13,50%; dan 5,06% vs. 2,50. Kesimpulan dari penelitian ini adalah sperma sapi Bali memiliki kemampuan yang lebih baik dibandingkan dengan sapi Simmental dalam melakukan fertilisasi secara in vitro, pembelahan embrio, pembentukan morula, pembentukan blastosit hari keenam dan blastosis total (P<0,05), sedangkan pembentukan blastosis pada hari ketujuh, kedelapan, dan kesembilan tidak berbeda nyata (P>0,005).
3
ABSTRACT
Blastocyst Formation of Bovine Embryo Following In Vitro Fertilization Using Bali Cattle (Bos javanicus) Semen and Simmental Cattle (Bos taurus) Semen
Darlian, F., C. Sumantri., and M. Imron
In vitro fertilization is one of reproductive biotechnology which can be used to increase population, productivity, and quality of cattle in Indonesia. Bali cattle (Bos javanicus) is one of native cattle from Indonesia, which have good carcass, meat production, which has adapted with invironment, and also have good fertility. Development of Bali cattle population can be accived through Embryo Transfer (ET) using IVF embryo production. The aim of this study was to determine the ability of Bali cattle semen (Bos javanicus) and compared with Simmental cattle semen (Bos taurus) to fertilized and its effect on cleavage rate until the blastocyst stage. This study was conducted in May and June 2012 at laboratory IVF production of Balai Embrio Ternak Cipelang, Bogor. Matured oocytes will be fertilized using Bali cattle semen and Simmental cattle semen, which have been capacitated before. Comparisons between bulls for cleavage, morula, and blastocyst rate, were analyzed using Chi-square analysis. The results indicate that Bali cattle can produced higher cleavage rate, morula rate, and blastocyst rate compared with Simmental cattle for in vitro embryo production. Embryo cleavage rate, morula rate and blastocyst rate were significantly different (P>0,05). The competence of embryo development from the blastocyst rate at day 6 was significantly different (P<0,05) but blastocyst rate at day 7, 8, and 9 were not significantly different (P>0,05).
4
PEMBENTUKAN BLASTOSIS PADA EMBRIO SAPI YANG
DIFERTILISASI SECARA IN VITRO DENGAN SEMEN
SAPI BALI (Bos javanicus) DAN SEMEN SAPI
SIMMENTAL (Bos taurus)
FAHRUDIN DARLIAN D14086007
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2013
5 Judul : Pembentukan Blastosis Pada Embrio Sapi yang Difertilisasi Secara In Vitro dengan Semen Sapi Bali (Bos javanicus) dan Semen Sapi Simmental (Bos taurus)
Nama : Fahrudin Darlian NIM : D14086007
Menyetujui,
Pembimbing Utama, Pembimbing Anggota,
(Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc.) (Muhammad Imron, S.Pt., M.Si.) NIP: 19591212 198603 1 004 NIP: 19731130 199803 1 001
Mengetahui: Ketua Departemen,
Ilmu Produksi dan Teknologi Peternakan
(Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc.) NIP: 19591212 198603 1 004
6
RIWAYAT HIDUP
Penulis dilahirkan di kota Ponorogo pada tanggal 13 Mei 1983. Penulis adalah anak dari keluarga Bapak Khafid Patok dan Ibu Siti Fachrudiyah.
Jenjang pendidikan penulis diawali pada tahun 1991 dengan bersekolah SD Negeri Kradenan dan lulus pada tahun 1996. Pada tahun yang sama penulis melanjutkan ke SLTP Negeri 1 Jetis dan lulus pada tahun 1999. Selanjutnya pada tahun 1999 penulis melanjutkan ke SPP-SPMA Pemerintah Kabupaten Ponorogo dan lulus pada tahun 2002.
Pada tahun 2002 penulis diterima sebagai mahasiswa Bidang Studi Teknisi Usaha Ternak Unggas, Program Studi Produksi Ternak, Departeman Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) hingga lulus tahun 2005. Pada tahun 2008 penulis diterima sebagai mahasiswa di Program Alih Jenis Fakultas Peternakan, Institut Pertanian Bogor untuk melanjutkan studi pendidikan sarjana.
7
KATA PENGANTAR
Puji Syukur Alhamdulillah penulis panjatkan kepada Allah SWT atas segala rahmat, nikmat dan hidayah-Nya sehingga dapat menyelesaikan penulisan skripsi ini. Skripsi ini berjudul “Pembentukan Blastosis Pada Embrio Sapi yang Difertilisasi Secara In Vitro dengan Semen Sapi Bali (Bos javanicus) dan Semen Sapi Simmental (Bos taurus)”.
Penelitian ini dilakukan dengan latar belakang bahwa sapi Bali merupakan plasma nutfah asli Indonesia yang dapat dijadikan sebagai sumber daging sapi untuk memenuhi kebutuhan daging sapi dalam negeri. Kebutuhan daging dalam negeri sebagian besar masih dipenuhi dari luar negeri (impor), baik dalam bentuk sapi hidup ataupun daging. Melihat fenomena tersebut pemerintah mencanangkan program untuk mengangkat eksistensi ternak lokal dan meningkatkan kualitas serta kuantitas dari ternak lokal tersebut. Peningkatan dan percepatan jumlah populasi dapat dilakukan dengan memanfaatkan bioteknologi reproduksi Transfer Embrio (TE).
Fertilisasi in vitro merupakan salah satu pengembangan bioteknologi reproduksi yang dapat digunakan sebagai alternatif untuk meningkatkan populasi, produktifitas, dan mutu ternak sapi lokal di Indonesia. Pemanfaatan teknologi fertilisasi in vitro ini dapat dihasilkan embrio pada berbagai tahap perkembangan dalam jumlah yang besar dan waktu yang singkat.
Penelitian tentang kemampuan fertilisasi secara in vitro bagi sapi pejantan dari eropa (Bos taurus) di Indonesia telah banyak dilakukan, dan hasil penelitian tersebut memberikan hasil yang cukup baik. Penelitian tentang kemampuan fertilisasi secara in vitro pada sapi pejantan lokal khususnya sapi Bali belum pernah dilaporkan. Berdasarkan uraian diatas, pada penelitian ini dilakukan untuk mengetahui kemampuan fertilisasi pejantan sapi Bali (Bos javanicus) secara in vitro dan dibandingkan dengan sapi Simmental (Bos taurus).
Akhir kata, penulis mengucapkan terimakasih yang sebesar-besarnya pada seluruh pihak yang membantu terselesaikannya tulisan ini. Semoga skripsi ini bermanfaat bagi semua pihak yang membacanya.
Bogor, Januari 2013
8 DAFTAR ISI
Halaman
RINGKASAN ... i
ABSTRACT ... ii
LEMBAR PERNYATAAN ... iii
LEMBAR PENGESAHAN ... iv
RIWAYAT HIDUP ... v
KATA PENGANTAR ... vi
DAFTAR ISI ... vii
DAFTAR TABEL ... ix DAFTAR GAMBAR ... x DAFTAR LAMPIRAN ... xi PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan ... 2 TINJAUAN PUSTAKA ... 3
Sapi Bali (Bos javanicus) ... 3
Spermatogenesis ... 4
Proses Perkembangan Folikel (Folikulogenesis) dalam Ovarium ... 6
Fertilisasi In Vitro ... 7
Maturasi Oosit ... 7
Kapasitasi Sperma ... 8
Fertilisasi ... 9
Kultur Embrio ... 10
Perkembangan dan Pembelahan Embrio ... 11
Pengaruh Persilangan dan Heterosis ... 12
Kelahiran Ganda (Twinning) ... 13
MATERI DAN METODE ... 14
Lokasi dan Waktu ... 14
Materi ... 14
Bahan ... 14
Alat-alat ... 14
Bahan Kimia ... 14
Prosedur ... 15
Koleksi Ovarium dan Teknik Koleksi Oosit ... 15
Maturasi Oosit In Vitro ... 15
Fertilisasi In Vitro ... 16
9
Rancangan dan Analisis Data ... 16
Peubah ... 16
Analisis Data ... 17
HASIL DAN PEMBAHASAN ... 19
KESIMPULAN DAN SARAN ... 25
Kesimpulan ... 25
Saran ... 25
UCAPAN TERIMA KASIH ... 26
DAFTAR PUSTAKA ... 27
10 DAFTAR TABEL
Nomor Halaman
1. Jumlah Ovarium, Jumlah Oosit yang Diperoleh dan Rataan
Perolehan Oosit/Ovarium ... 19 2. Tingkat Pembelahan Zigot >2 sel pada Sapi Bali dan Simmental ... 20 3. Tingkat Pembentukan Morula dan Blastosis pada Sapi Bali dan
Simmental ... 21 4. Tingkat Pembentukan Blastosis pada Hari ke-6, 7, 8, dan 9 pada
11
DAFTAR GAMBAR
Nomor Halaman
1. Proses Spermatogenesis ... 5 2. Proses Folikulogenesis ... 6 3. Perkembangan Embrio Sapi ... 11
12 DAFTAR LAMPIRAN
Nomor Halaman
1. Jumlah Zigot yang Membelah >2 Sel pada Hari Kedua ... 31 2. Uji Khi-Kuadrat Jumlah Zigot yang Membelah >2 Sel pada Hari
Kedua pada Zigot yang Difertilisasi dengan Semen Sapi Bali dan
Simmental ... 31 3. Jumlah Pembentukan Morula pada Hari Kelima ... 32 4. Uji Khi-Kuadrat Jumlah Pembentukan Morula pada Hari Kelima
pada Embrio yang Difertilisasi dengan Semen Sapi Bali dan
Simmental ... 32 5. Jumlah Pembentukan Blastosis pada Hari Keenam ... 33 6. Uji Khi-Kuadrat Jumlah Pembentukan Blastosis Hari Keenam pada
Embrio yang Difertilisasi dengan Semen Sapi Bali dan Simmental ... 33 7. Jumlah Pembentukan Blastosis pada Hari Ketujuh ... 34 8. Uji Khi-Kuadrat Jumlah Pembentukan Blastosis Hari Ketujuh pada
Embrio yang Difertilisasi dengan Semen Sapi Bali dan Simmental ... 34 9. Jumlah Pembentukan Blastosis pada Hari Kedelapan ... 35 10. Uji Khi-Kuadrat Jumlah Pembentukan Blastosis Hari Kedelapan
pada Embrio yang Difertilisasi dengan Semen Sapi Bali dan
Simmental ... 35 11. Jumlah Pembentukan Blastosis pada Hari Kesembilan ... 36 12. Uji Khi-Kuadrat Jumlah Pembentukan Blastosis Hari Kesembilan
pada Embrio yang Difertilisasi dengan Semen Sapi Bali dan
Simmental ... 36 13. Jumlah Pembentukan Blastosis Total ... 37 14. Uji Khi-Kuadrat Jumlah Pembentukan Blastosis Total pada
Embrio yang Difertilisasi dengan Semen Sapi Bali dan Simmental . 37 15. Jumlah Ovary yang Diperoleh, Betina yang Dipotong, Oosit yang
13
PENDAHULUAN Latar Belakang
Dewasa ini permintaan kebutuhan daging sapi di Indonesia terus meningkat.Sampai saat ini kekurangan pemenuhan kebutuhan daging masih penuhi dari luar negeri baik berupa impor ternak hidup maupun daging beku.Melihat fenomena tersebut pemerintah mencanangkan Program Swasembada Daging Sapi dan Kerbau (PSDSK).Program tersebut dilakukan salah satunya dengan mengangkat eksistensi ternak lokal dan meningkatkan kualitas serta kuantitas dari ternak lokal tersebut.Peningkatan dan percepatan jumlah populasi dimasyarakat telah banyak dilakukan dengan teknologi inseminasi buatan (IB), tetapi hal tersebut ternyata belum cukup.Salah satu upaya untuk membantu percepatan populasi sapi dalam negeri adalah dengan memanfaatkan teknologi reproduksi transfer Embrio (TE), dengan program transfer embrio populasi ternak dapat ditingkatkan dengan kelahiran ganda melalui sinergi IB dan TE maupun dengan TE 2 embrio.
Produksi embrio secara in vivo telah banyak dilaporkan, akan tetapi aplikasi teknologi ini masih sangat terbatas. Hal tersebut dikarenakan harga hormon untuk superovulasi cukup mahal dan membutuhkan ketrampilan khusus dalam melakukannya.Selain itu tingginya tingkat perbedaan dan respon yang tidak dapat diduga dari masing-masing donor menjadi faktor pembatas yang penting terhadap efisisnsi dan profitabilitas teknologi ini (Durocher, 2006).
Fertilisasi in vitro merupakan salah satu pengembangan bioteknologi reproduksi yang dapat digunakan sebagai alternatif untuk meningkatkan populasi, produktifitas, dan mutu ternak sapi di Indonesia.Pemanfaatan teknologi fertilisasi in vitro ini dapat dihasilkan embrio pada berbagai tahap perkembangan dalam jumlah yang besar dan waktu yang singkat, serta berguna untuk meningkatkan daya reproduksi sapi betina produktif maupun setelah masa produksinya habis, yaitu dengan memanfaatkan ovarium dari sapi betina tersebut setelah dipotong.Sapi betina produktif yang terlanjur dipotong maupun sapi betina yang sudah tidak produktif dapat dimanfaatkan ovariumnya untuk teknologi produksi embrio secara in vitro.
Sapi Bali (Bos javanicus) merupakan plasma nutfah asli Indonesia yang harus dilestarikan, karena sapi bali merupakan salah satu sapi penghasil daging yang cukup baik dan mudah beradaptasi dengan lingkungan, bahkan masih mempunyai
14 kemampuan adaptasi yang baik pada wilayah beriklim kering dengan tingkat cekaman iklim dan lingkungan pakan yang berat. Sapi Bali juga merupakan sapi asli Indonesia yang memiliki tingkat fertilitas yang baik.Melihat keunggulan-keunggulan tersebut sapi Bali sangat baik dikembangkan untuk memenuhi kebutuhan daging dalam negeri. Peningkatan populasi sapi Bali dapat dilakukan dengan produksi embrio secara in vitro, untuk itu perlu dipelajari tentang kemampuan sperma sapi Bali dalam melakukan fertilisasi secara in vitro, dan kemampuan perkembangan embrio yang dihasilkan.
Tujuan
Penelitian ini bertujuan untuk mengetahui kemampuan sperma sapi Bali (Bos javanicus) dibandingkan dengan sapi Simmental (Bos taurus)dalam melakukan fertilisasi secara in vitro dan pengaruhnya terhadap pembelahan sel sampai pada tahap blastosis.
15
TINJAUAN PUSTAKA Sapi Bali (Bos javanicus)
Sapi Bali (Bos javanicus) diduga berasal dari hasil domestikasi banteng liar (Bibos banteng). Payne dan Rollinson (1973) menduga asal mula sapi Bali adalah dari Pulau Bali mengingat tempat ini merupakan pusat distribusi sapi Bali di Indonesia. Nozawa (1979) menduga gen asli sapi Bali berasal dari Pulau Bali yang kemudian menyebar luas ke daerah Asia Tenggara, dengan kata lain bahwa pusat gen sapi Bali adalah di Pulau Bali.
Sapi Bali mempunyai ciri-ciri fisik yang seragam, dan hanya mengalami perubahan kecil dibandingkan dengan leluhur liarnya (banteng).Warna sapi betina dan anak atau sapi muda biasanya cokelat muda dengan garis hitam tipis terdapat di sepanjang tengah punggung. Warna sapi jantan adalah cokelat ketika muda tetapi kemudian warna ini berubah agak gelap pada umur 12-18 bulan sampai mendekati hitam pada saat dewasa, kecuali sapi jantan yang dikastrasi akan tetap berwarna coklat. Pada kedua jenis kelamin terdapat warna putih pada bagian belakang paha (pantat), bagian bawah (perut), keempat kaki bawah (white stocking) sampai di atas kuku, bagian dalam telinga, dan pada pinggiran bibir atas (Payne dan Rollinson, 1973; Hardjosubroto dan Astuti, 1993).
Kemampuan produksi sapi Bali dapat dilihat dari beberapa indikator sifat-sifat produksi seperti bobot lahir, bobot sapih, bobot dewasa, laju pertambahan bobot badan, sifat-sifat karkas (persentase karkas dan kualitas karkas), maupun sifat reproduksi seperti dewasa kelamin, umur pubertas, jarak beranak (calving interval), persentase beranak. Beberapa sifat produksi dan reproduksi tersebut merupakan sifat penting/ekonomis yang dapat dipergunakan sebagai indikator seleksi (Handiwirawan dan Subandriyo, 2004).Pubertas sapi Bali dicapai pada kisaran umur 20–24 bulan untuk sapi betina sedangkan pada sapi jantan dicapai pada umur 24–28 bulan (Pane,1991).Beberapa peneliti telah melaporkan bahwa sapi Bali mempunyai tingkat kesuburan yang sangat baik, walaupun dalam kondisi lingkungan yang kurang baik sapi Bali masih mampu mempertahankan sifat ini. Menurut Pane (1991) tingkat kebuntingan (conception rate) sapi Bali mencapai 85,9%, persentase beranak berkisar antara 70%-81%,meskipun tidak jelas namun terdapat bulan-bulan dimana banyak terjadi perkawinan. Pane (1991) melaporkan bahwa terdapat kenaikan perkawinan
16 pada bulan Agustus sampai Januari dan tertinggi pada bulan Oktober dan Nopember, sementara itu bulan Pebruari sampai dengan Juni merupakan bulan-bulan dengan perkawinan lebih rendah dan bulan dimana perkawinan paling rendah yaitu pada bulan Mei.
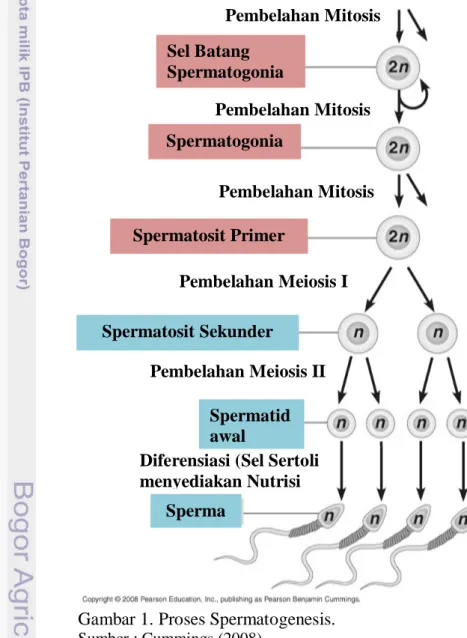
Spermatogenesis
Menurut Russell (1990) proses spermatogenesis merupakan proses yang kompleks dan berlangsung terus menerus untuk menghasilkan spermatozoa yang haploid dari suatu sel spermatogonia yang diploid. Proses ini terdiri dari tiga tahap, yaitu tahap proliferasi (spermatositogenesis), tahap miosis dan fase diferensiasi (spermiogenesis). Proses proliferasi sel induk spermatogonia tipe A yang belum berdeferensiasi akan mengalami mitosis untuk menghasilkan dua spermatogonia tipe A yang sama. Bagian penting dari fase ini adalah fase ketika spermatogonia akan didaur ulang, karena ada beberapa spermatogonia hasil pembelahan yang tidak berkembang dan mengalami degenerasi dan terjadi apoptosis sel, sehinggamemberi tempat bagi spermatogonia yang lain yang tidak mengalami degenerasi (Senger, 2003).
Proses meiosis dihasilkan spermatosit sekunder dari spermatosit primer. Selama fase ini, keragaman genetic yang akan dibawa oleh spermatozoa matang nantinya bergantung pada replikasi DNA dan crossing over, sehingga tidak ada dua sperma yang memiliki sifat identik. Pada fase ini, dihasilkan spermatid yang bersifat haploid (n). Pada proses diferensiasi atau spermiogenesis, spermatid yang semula berbentuk bulat akan mengalami transformasi bentuk dengan keberadaan kepala yang mengandung materi genetik, ekor dan midpiece yang mengandung mitochondrial helix. Keseluruhan germ-cell yang belum dewasa akan berada pada membrane basal tubuli seminiferi (Senger, 2003).
Spermatogenesis dipengaruhi oleh faktor-faktor endogen dan eksogen. Faktor endogen meliputi hormonal, psikologis, dan genetik. Faktor eksogen dapat berupa bahan kimia dan obat-obatan, suhu, radiasi sinar-X, getaran ultrasonic, vitamin, gizi, trauma dan peradangan. Berlangsungnya spermatogenesis pada tubulus seminiferus melibatkan hipotalamus, hipofisis dan testis. Gonadotropin Releasing Hormone (GnRH) hipotalamus merangsang hipofisis anterior untuk mensekresikan Luteinizing Hormone (LH) dan Follicle Stimulating Hormone (FSH).
17 LH memberikan rangsangan untuk perkembangan sel Leydig yang akan memproduksi hormon testosteron, sedangkan FSH berpengaruh langsung terhadap perkembangan sel sertoli dalam tubulus seminiferus dan meningkatkan sintesis protein pengikat hormon androgen atau Androgen Binding Protein (ABP). ABP merupakan glikoprotein yang mengikat testosteron.Testosteron yang dihasilkan oleh sel Leydig diangkut dengan konsentrasi yang tinggi ke tubulus seminiferus (Lachland et al., 1996).
Gambar 1. Proses Spermatogenesis.
Sumber : Cummings (2008) Sperma
Diferensiasi (Sel Sertoli menyediakan Nutrisi Spermatosit Sekunder Pembelahan Meiosis I Pembelahan Meiosis II Spermatid awal Spermatosit Primer Pembelahan Mitosis Pembelahan Mitosis
Sel Tunas Primordia pada Embrio
Pembelahan Mitosis Sel Batang
Spermatogonia
18
Proses Perkembangan Folikel (Folikulogenesis) dalam Ovarium
Perkembangan folikel atau folikulogenesis terjadi pada masa prenatal dan postnatal. Proses awal perkembanganfolikel terjadi pada masa prenatal. Proses awal perkembangan folikel terjadi pada masa prenatal (Wandji et al., 1996). Folikulogenesis dimulai dengan perekrutan folikel primordial pada folikel yang sedang tumbuh dan berakhir dengan ovulasi atau mati karena atresia. Folikulogenesis dapat dibagi menjadi dua tahap. Tahap pertama, disebut fase preantral atau gonadotropinindependen, ditandai oleh pertumbuhan dan diferensiasi oosit. Tahap kedua, disebut fase antral atau gonadotropin-dependent, ditandai dengan peningkatan yang luar biasa dari ukuran folikel itu sendiri (sampai kira-kira 25-30 mm). Tahap preantral dikendalikan oleh faktor-faktor pertumbuhan yang diproduksi secara lokal melalui mekanisme autokrin / parakrin. Tahap kedua diatur oleh FSH dan LH serta oleh faktor pertumbuhan. Faktor pertumbuhan memberikan pengaruh yang besar karena dapat merangsang proliferasi sel dan memodulasi aksi gonadotropin (Williams dan Erickson, 2012).
Gambar 2.Proses Folikulogenesis.
Sumber : (Picton et al., 1998)
Proses folikulogenesis terjadi dalam korteks ovarium. Folikulogenesis dapat dianggap sebagai proses untuk mencapai tingkat yang lebih tinggi dari organisasi melalui proliferasi sel dan cytodiferensiasi. Proses ini mencakup empat peristiwa perkembangan utama: 1) perekrutan folikel primordial, 2) perkembangan folikel preantral, 3) seleksi dan pertumbuhan folikel antral, dan 4) atresia folikel (Williams dan Erickson, 2012). 1 Pembentukan folikel primordia (35 µm) 2 Pengerahan dan pertumbuhan folikel (46-200 µm) 3 Pembentukan rongga antral (200-500 µm) 4 Pertumbuhan dan Pematangan folikel de Graaf
(>6000 µm) Pengembangan antrum Perkembangan Folikel 1 PGC 2 Oogonia 3 Permulaan Meiosis 4 Oosit diploid (2n4C) Perkembangan Oosit 5
Pertumbuhan oosit secara meiosis : Replikasi dan redistribusiorganel sitoplasma Transkripsi, translasi, dan Pentimpanan mRNA
Sintesis zona pellucida
6 Oosit Matang
(2n4C) Blokade Meiosis
19 Folikel primordial mengandung oosit yang berada dalam tahap profase I, tetapi belum menyelesaikan pembelahan meiosis pertamanya sampai mencapai masa pubertas. Folikel yang mengandung oosit akan mengalami perkembangan ketika hewan mencapai masa pubertas. Sel epitel yang mengelilingi oosit berubah menjadi epitel kubus sebaris dan disebut dengan folikel primer (Wandji et al., 1996).Folikel primer berkembang menjadi folikel sekunder dengan karakteristik telah bertambahnya sel epitel yang mengelilingi oosit sampai dengan 5 lapis sel. Zona pelusida mulai terbentuk pada folikel sekunder, sebagai suatu lapisan tipis di sekeliling oosit (Rachmawati, 2011).
Folikel tersier merupakan folikel antral yang akan berkembang menjadi folikel de Graaf. Folikel ini memiliki karakteristik telah terbentuknya antrum folikuli, yaitu ruangan yang terbentuk akibat perkembangan sel-sel folikuler.Antrum folikuli pada awalnya terpisah, tetapi kemudian bersatu menjadi suatu ruangan berbentuk bulan sabit. Antrum folikuler terus membesar hingga mendesak sel telur menuju tepian folikel hingga akhirnya terjadi proses ovulasi (Rachmawati, 2011).
Fertilisasi In vitro Maturasi Oosit
Maturasi oosit merupakan proses biologi yang kompleks dimana oosit primer menjadi oosit sekunder yang siap difertilisasi. Proses ini merupakan peristiwa pembelahan meiosis dari profase pada meiosis I ke metaphase pada meiosis II (Tornell et al., 1991).Beberapa faktor yang sangat berkompeten dalam keberhasilan pematangan oosit adalah morfologi kumulus, ukuran folikel, kesehatan folikel, stimulasi ovarium, prosedur penanganan oosit sebelum mulai inkubasi dan lamanya oosit diinkubasi (Sirard dan Blondin, 1996). Menurut Chian et al. (1994) oosit yang matang akan ditandai dengan keadaan oosit yang sulit dipisahkan secara individu dan pengebangan sel-sel kumulus yang melebar dan cerah serta adanya badan kutub I. Fungsi sel kumulus sangat penting pada proses maturasi sel telur secara in vitro.Sel telur yang tanpa kumulus, setelah proses maturasi akan banyak kehilangan protein, sedangkan pada sel telur dengan sel kumulus intact protein akan tertahan. Penghilangan sel-sel kumulus pada awal maturasi In vitro akan menurunkan potensi perkembangan oosit (Maedomari et al., 2007). Kualitas oosit sangat mempengaruhi hasil akhir produksi embrio in vitro, oosit dengan kualitas A dan B saja yang dipilih
20 untuk proses maturasi in vitro. Menurut Saito(1995), oosit yang dikoleksi dikelompokkan dalam tiga kategori yaitu :Kategori A,adalah oosit yang dikelilingi oleh sel-sel kumulus yang banyak (lebih dari 3 lapis) dan kompak dengan ooplasma yang homogeny; Kategori B,adalah oosit yang hanya sebagian permukaan oosit yang dilapisi oleh sel-sel kumulus atau hanya dikelilingi oleh kurang dari 3 lapis sel-sel kumulus dengan ooplasma yang homogeny; dan Kategori C,adalah oosit yang tidak dilapisi oleh sel-sel kumulus (denuded oocyte) atau oosit yang dikelilingi oleh sel-sel kumulus yang sangat sedikit.
Suhu yang ideal untuk maturasi In vitroadalah 38,5°C (NLBC, 2005). Sirard dan Blodin (1996) yang menyatakan bahwa maturasi sel telur secara In vitroberlangsung antara 18-24 jam. Menurut Chian et al.(1994) waktu maturasi yang terlalu lama dapat menghasilkan oosit yang terlalu tua dan mengakibatkan terganggunya proses fertilisasi in vitrodan akan mempengaruhi perkembangan embrio selanjutnya.
Media maturasi yang dikenal memiliki kemampuan baik untuk pematangan oosit secara In vitro adalah TCM-199 dengan berbagai modifikasinya. TCM-199 diperkaya dengan garam earl, sodium bicarbonate, hepes, pyruvate, laktat, asam amino dan vitamin adalah salah satu standar medium untuk pematangan oosit sapi dan domba (Rutledge et al., 1997).Penambahan 5% CO2 perlu dilakukan untuk menjaga media
tetap stabil, serta perlu ditambahkan antibiotika untuk mencegah kontaminasi jasad renik dan pertumbuhan mikroorganisme di dalam medium yang dapat mengganggu perkembangan oosit.
Kapasitasi Sperma
Kapasitasi sperma adalah rangkaian proses biokimia dan reaksi fisiologis pada spermatozoa (Gordon, 1994). Sedangkan menurut Furuya et al.(1992), kapasitasi adalah perubahan biokimia yang menyebabkan reaksi akrosom (acrosome reaction/AR) pada sperma sebagai respon dari zona pelusida oosit.Menurut Kato dan Iritani (1991) kapasitasi sperma sebelum dilakukan fertilisasi in vitrobertujuan untuk meningkatkan aktivitas dan pergerakan sperma serta untuk menghilangkan sifat stabil dari membran plasma tersebut.
Menurut Gordon (1994) kapasitasi spermatozoa in vitrodapat dilakukan antara lain dengan cara menginkubasi sperma pada medium yang kadar ionik dan pH sesuai,
21 menambah kalsium ionophore atau dilaurylfosfatidylcholine liposome, prainkubasi sperma dengan glycosaminoglycans dan heparin. Konsentrasi sperma lxl06/ml yang telah dikapasitasi dalam BO medium yang ditambahkan 10 µl/ml heparin menyebabkan sperma dapat menembus 85%-95% sel telur (Kato dan Iritani, 1991).
Hasil penelitian Im et al. (1995) menyatakan bahwa pada BO medium digunakan Heparin 0,1 IU/mL dan kafein 5mM sebagai agen kapasitasi, sedangkan pada TALP medium digunakan Heparin 0,1 IU/mL, hypotaurine 10 µM, epinephrine 1 µM dan penicillamine 20 µM sebagai agen kapasitasi sperma. Oosit yang diinseminasi dengan sperma yang dikapasitasi dengan medium fertilisasi yang menggunakan BO medium menghasilkan persentase yang terfertilisasi sebesar 67,4% dan yang membelah 23,3%.
Fertilisasi
Fertilisasi adalah suatu proses yang komplek dimana terjadi penggabungan dua gamet, perubahan jumlah kromosom somatic (n menjadi 2n) dan awal dari pertumbuhan individu baru (Gordon, 1994). Hafez dan Hafez (2000) mendefinisikan fertilisasi sebagai penyatuan materi DNA paternal dan maternal pada embrio. Selanjutnya dijelaskan bahwa proses fertilisasi secara in vivo maupun in vitropada mamalia prinsipnya hampir sama yaitu melalui rangkaian tiga proses yang terdidri dari migrasi sperma pada sel-sel kumulus, penempelan sperma dan migrasi melalui zona pellucida, dan penempelan dan penetrasi sperma pada zona pellucida serta penyatuan garnet. Menurut McGeady et al. (2006) fertilisasi merupakan proses bertemunya sel sperma dengan sel telur. Sel telur diaktivasi untuk memulai perkembangannya dan inti sel dari dua gamet akan bersatu untuk menyempurnakan proses reproduksi seksual. Penetrasi spermatozoa ke dalam membrane vitelin mengaktifasi sel telur untuk melengkapi proses miosisnya dan mengeluarkan badan kutub kedua. Kromosom yang terkandung dalam pronukleus jantan haploid bersatu dengan kromosom dalam pronukleus betina. Proses penyatuan kedua kromososm tersebut disebut dengan singami. Sebagai konsekuensi dari fertilisasi, jumlah kromosom kembali menjadi diploid, jenis kelamin suatu individu ditentukan, dan variasi biologis dihasilkan dari integrasi karakteristik herediter paternal dan maternal.
22 Menurut Sumantri et al. (1997) lama waktu fertilisasi yang baik adalah 5 jam. Semakin lama waktu fertilisasi akan menurunkan persentase pembentukan blastosis yang dihasilkan dan meningkatkan persentase polyspermia. Lama fertilisasi yang tepat akan menghasilkan jumlah oosit yang terfertilisasi menjadi optimal sehingga perkembangan embrio dapat berjalan dengan baik (Chian et al., 1994). Menurut Hunter (1995) ada beberapa faktor yang harus dipertimbangkan agar fertilisasi in vitro dapat berhasil. Faktor-faktor tersebut meliputi : sumber dan kondisi sperma, kualitas oosit yang diperoleh dan pemilihan medium (medium maturasi, fertilisasi dan kultur), volume mikro drop yang yang digunakan untuk biakan dan konsentrasi sperma di dalamnya serta kondisi peralatan dan medium yang benar-benar aseptik untuk menghindari terjadinya kontaminasi.
Kultur Embrio
Embrio berkembang lebih lambat dalam medium kimiawi pada kultur in vitro dibandingkan dengan in vivo, hal ini menunjukkan bahwa saluran reproduksi menjadi faktor spesifik yang diperlukan dalam pertumbuhan dan perkembangan optimal pada sel telur (Pratt, 1987). Kemampuan sel telur untuk bertahan dalam kultur in vitro tergantung pada spesies, tahap perkembangan sel telur, kandungan fisik dan biokimia pada media, suhu penyimpanan, tingkat pendinginan dan penghangatan sel telur, serta teknik penyimpanan dan transfer sel telur.
CR1aa mengandung media minimum dasar penting yang merupakan campuran dari asam amino, vitamin, garam-garam anorganik, ribonucleosides dan deoxyribonucleosides. Komponen utama yang lain dari CR1aa adalah medium basal eagle, yang merupakan campuran suplemen asam amino tambahan, vitamin dan garam-garam anorganik (Rosenkrans et al., 1993; Sagirkaya et al., 2004). Situmorang et al. (1998) melaporkan bahwa perbandingan ko-cultur BOEC (Bovine Oviduct Epithelial Cells) dan CRlaa, mengasilkan angka blastosis pada hari ketujuh dan delapan adalah 10% dan 8,8% untuk zigot yang dikultur dengan BOEC, dibandingkan dengan yang dikultur dalam CRlaa adalah 22% dan 18% masing-masing pada hari ketujuh dan kedelapan.
23
Perkembangan dan Pembelahan Embrio
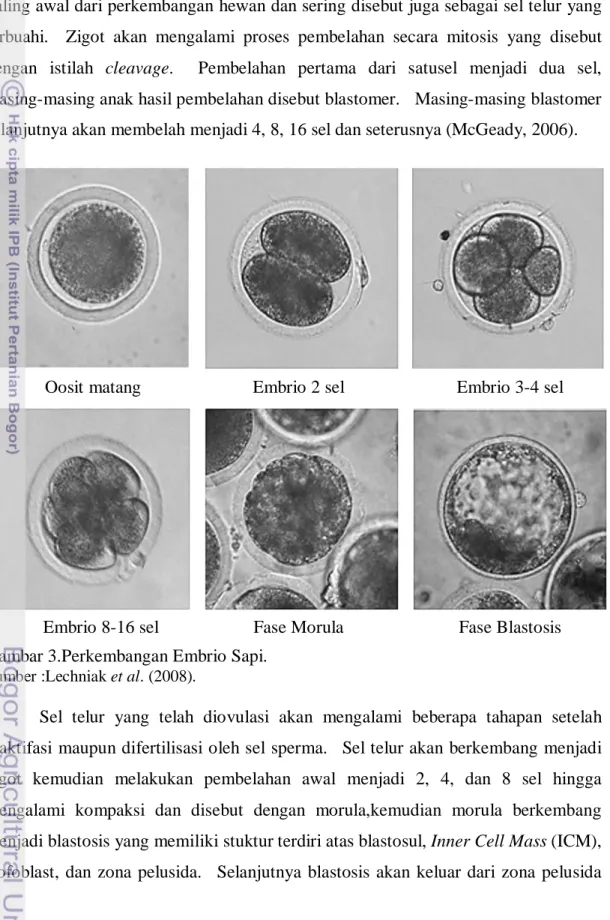
Proses perkembangan embrional pada mamalia diawali dengan terjadinya pembuahan sel telur oleh sperma sehingga terbantuk zigot. Zigot merupakan bentuk paling awal dari perkembangan hewan dan sering disebut juga sebagai sel telur yang terbuahi. Zigot akan mengalami proses pembelahan secara mitosis yang disebut dengan istilah cleavage. Pembelahan pertama dari satusel menjadi dua sel, masing-masing anak hasil pembelahan disebut blastomer. Masing-masing blastomer selanjutnya akan membelah menjadi 4, 8, 16 sel dan seterusnya (McGeady, 2006).
Gambar 3.Perkembangan Embrio Sapi.
Sumber :Lechniak et al. (2008).
Sel telur yang telah diovulasi akan mengalami beberapa tahapan setelah diaktifasi maupun difertilisasi oleh sel sperma. Sel telur akan berkembang menjadi zigot kemudian melakukan pembelahan awal menjadi 2, 4, dan 8 sel hingga mengalami kompaksi dan disebut dengan morula,kemudian morula berkembang menjadi blastosis yang memiliki stuktur terdiri atas blastosul, Inner Cell Mass (ICM), trofoblast, dan zona pelusida. Selanjutnya blastosis akan keluar dari zona pelusida
Oosit matang Embrio 2 sel Embrio 3-4 sel
24 (hatching) untuk kemudian berimplantasi pada dinding uterus (Hogan, 1994).
Kecepatan pembelahan embrio sangat bervariasi pada spesies hewan. Pada mencit dan mamalia lainnya kecepatan pembelahan tergantung dari strainnya, namun secara umum akan menghabiskan waktu 3,5 hari untuk perkembangan dari mulai tahap pembelahan sel (cleavage)sampai dengan tahap blastosis (Kispert dan Gossler, 2004).
Pada mamalia, pembelahan awal terjadi selama 24 jam kemudian pembelahan selanjutnya terjadi pada interval setiap 12 jam hingga hari ketiga. Berbeda dengan pembelahan in vivo, proses pembelahan pada in vitro mengalami pelambatan sehingga membutuhkan waktu 48 jam setelah fertilisasi. Sinkronisasi pembagian blastomer pun terjadi pada tahap awal sehingga dapat ditemukan tahapan tiga, lima, enam, atau tujuh blastomer pada proses secara in vitro (McGeady et al., 2006).
Pengaruh Persilangan dan Heterosis
Persilangan ada 2 macam yaitu silang dalam (inbreeding) dan silang luar. Silang dalam (inbreeding) adalah persilangan antarternak yang memiliki hubungan keluarga yang lebih dekat jika dibandingkan dengan rataan hubungan kekerabatan kelompok tempat ternak tersebut berada. Hubungan kekerabatan tersebut bisa hubungan langsung maupun hubungan kolateral. Silang dalam mengakibatkan adanya peningkatan derajat homozigositas dan menurunkan derajat heterozigositas. Laju peningkatan homozigositas akibat silang dalam pada suatu individu tergantung dari seberapa dekat hubungan kekerabatan kedua tetuanya(Noor, 2008).
Silang luar merupakan persilangan antarternak yang memiliki hubungan kekerabatan lebih jauh dari rataan hubungan kekerabatan kelompok asal ternak. Silang luar berpengaruh dalam meningkatkan proporsi gen-gen heterozigot dan menurunkan proporsi gen homozigot. Pada umumnya heterozigositas akan meningkatkan daya hidup embrio yang akan meningkatkan jumlah anak per kelahiran. Pada babi, peningkatan litter size dapat meningkat 0,5-1 anak per kelahiran. Peningkatan ini disebabkan oleh heterosis pada ternak hasil persilangan yang tetuanya adalah ternak murni. Pada sapi dan domba perhitungan berdasarkan jumlah anak yang dilahirkan per 100 betina yang dikawinkan. Peningkatan sifat ini dapat mencapai 5%-10% pada sapi hasil persilangan.
25
Kelahiran Ganda (Twinning)
Kelahiran ganda bertujuan untuk meningkatkan efisiensi biologis dan ekonomis dari ternak sapi betina.Berbagai penelitian melaporkan bahwa kelahiran ganda dapat meningkatkan efisiensi biologis dan ekonomis pada sapi potong sebesar 20%-25% (Gordon, 1994). Program kelahiran ganda adalah salah satu inovasi rekayasa bioteknologi yang diharapkan bisa mempercepat peningkatan populasi ternak sapi potong sekaligus upaya untuk menghasilkan sapi potong dengan kualitas genetik unggul. Program kelahiran ganda (twinning) dapat dilakukan melalui kombinasi Inseminasi Buatan (IB) dan Transfer Embrio (TE) atau dengan TE dua embrio(Suzuki et al., 1994). Suzuki et al. (1994) melaporkan bahwa TE baik menggunakan embrio yang diproduksi secara in vivo maupun in vitro, pada resipien yang telah di IB sebelumnya merupakan metode yang paling efektif untuk meningkatkan jumlah pedet.
Lu dan Polge (1991) melaporkan bahwa keberhasilan tingkat kebuntingan sebesar 77% dan keberhasilan tingkat kelahiran ganda sebesar 65%. Balai Embrio Ternak (2011) melaporkan bahwa keberhasilan tingkat kebuntingan sebesar 36,78% dan keberhasilan tingkat kelahiran ganda sebesar 43,52%.
26
MATERI DAN METODE Lokasi dan Waktu
Penelitian ini dilakukan di Laboratorium Produksi Embrio In Vitro Balai Embrio Ternak Cipelang, Bogor. Penelitian dimulai pada bulan Meisampai dengan Juni 2012.
Materi Bahan
Bahan yang digunakan dalam penelitian adalah ovarium sapi brahmancross sebanyak 121 ovarium dari 64 ekor betina yang dipotong.Ovarium sebagai sumber sel telur (oosit) yang diperoleh dari Rumah Pemotongan Hewan (RPH). Semen sapi yang digunakan adalah semen sapi Bali (nomor lot 19959) dari BBIB Singosari dan semen sapi Simmental (nomor lot 60757) dari BIB Lembang.
Alat-alat
Alat yang digunakan dalam penelitian ini adalah termos, termometer, alkohol, gunting, kapas, pinset, beaker glass, tissue steril, syringe 5 ml, jarum suntik (18 G), water bath, hot plate, cawan petri, pipet pasteur, mikroskop stereo, inkubator CO2,
sentrifuge, Neubeur chamber, bunsen, erlenmeyer,mikrofilter ukuran 0,22 µL, alluminium foil, kertas label, spidol, timbangan analitik.
Bahan-bahan Kimia
Bahan kimia yang digunakan dalam penelitian ini adalah TCM-199 (Gibco Cat.#11150-042), FCS (Fetal Calf Serum, Sigma Cat.#F 2442), Na Pyruvate (Gibco Cat.#11840-030), Mineral Oil (Sigma Cat.#M.8410), NaCl, KC1, NaHCO3,
NaH2PO4.2H2O, Na Lactate (60% syrop, Sigma Cat.#L.1375), CaCI2.2H2O,
MgCl2.2H2O, Pennisilin (Sigma Cat.#4687), Streptomisin (Sigma Cat.#S1277),
Phenol Red, BSA Fraction V (Sigma Cat. #A2085), BSA fatty acid free(Sigma Cat. # A8806), NaH2PO4, Heparin (Sigma Cat. #D4776), 100 X MEM non essential amino
acid (Sigma Cat. #M7145), 50 X BME amino acid (Sigma Cat. #B6766), dan PBS (Phospate Buffer Saline).
27
Prosedur Koleksi Ovarium dan Teknik Koleksi Oosit
Ovarium sapi dikoleksi dari Rumah Pemotongan Hewan (RPH), segera setelah sapi betina dipotong, kemudian ovarium ditempatkan dalam media yang berisi Laktat Ringer yang di suplementasi dengan antibiotik (streptomycin 100 mg/L dan penicillin 100.000 IU/L) pada suhu + 37,5 °C,kemudian dibawa ke laboratorium,untuk menjaga suhu tetap stabil ovarium dimasukkan dalam termos tahan panas.Setelah sampai dilaboratorium ovarium segera diproses dengan melakukan pencucian ovarium sebanyak 2-3 kali dengan menggunakan saline fisiologis dan ditempatkan pada gelas piala, kemudian disimpan di atas hot plate dengan suhu 38,5°C. Ovarium dibersihkan dan dikeringkan dengan kertas tissue steril, kemudian mulai dilakukan pengambilan dan pengumpulan oosit dengan metode aspirasi. Metode aspirasi dilakukan dengan menggunakan syringe 5 ml dan jarum suntik berukuran 18-G yang berisi larutan PBS (Phosphate Buffered Saline, Sigma) yang telah disuplementasi dengan calf serum 10%. Folikel yang berukuran 2-6 mm ditusuk dan diaspirasi dengan cairan folikelnya, folikel yang besar dan follikel yang berisi darah (bloody follicles) tidak diaspirasi, kemudian hasil aspirasi diletakkan di cawan petri bergaris yang berukuran 90 x 90 mm, untuk memudahkan pencarian dan koleksi oosit. Pencarian oosit dilakukan dibawah mikroskop stereo, oosit hasil pencarian dipindahkan ke cawan petri berdiameter 5 cm, setiap pemindahan oosit dilakukan dengan menggunakan pipet pasteur dan hanya oosit dengan kategori A dan B saja yang diambil untuk pematangan in vitro.
Maturasi Oosit InVitro
Oosit hasil koleksi dilakukan pencucian dengan menggunakan medium TCM-199 sebanyak 3 kali. Kemudian oosit ditempatkan dalam drop maturasi dengan medium TCM-199 dengan jumlah media yang dibutuhkan sebanyak 5 µL medium maturasi tiap satu oosit dan ditutup dengan mineral oil, medium tersebut sebelumnya telah diequilibrasi di dalam inkubator 5% CO2, suhu 38,5 °C, dan kelembaban 90%
paling sedikit 2 jam. Proses maturasi berlangsung selama + 18-24 jam. Maturasi dilakukan secara berkelompok, dengan jumlah oosit sebanyak 40-100 oosit tiap drop dengan volume media sebanyak 5 µL/oosit.
28
Fertilisasi In vitro
Semen beku yang digunakan untuk fertilisasi in vitroadalah semen dari bangsa sapi Bali dan sapi Simmental yang merupakan perlakuan dalam penelitian ini. Semen beku dicairkan dengan air hangat dengan suhu 37 °C, kemudian dicuci dengan medium BO (Brackett and Oliphant) ditambah 10 mM kafein dan 4 µg/mL heparin yang merupakan agen kapasitasi, kemudian disentrifugasi dengan kecepatan 1800 rpm selama 5 menit, prosedur ini dilakukan sebanyak 2 kali. Sedimen yang terbentuk ditambahkan larutan pencuci sebanyak 300 µL dan dilakukan penghitungan konsentrasi sperma, untuk selanjutnya diencerkan dengan konsentrasi 12,5 x 106 sperma/mL. Campuran sperma tersebut dibuat drop dengan volume tiap drop 100 µL pada cawan petri kemudian ditutup dengan mineral oil dan diinkubasi selama minimal 1 jam pada inkubator 5% CO2, suhu 38,5 °C dan kelembaban 90%. Oosit yang telah
matang dipindahkan ke dalam drop campuran sperma tersebut agar terjadi fertilisasi. Proses fertilisasi dilakukan selama 5 jam. Setelah 5 jam difertilisasi, zigot dicuci dan dipisahkan dari sperma.
Kultur dan Evaluasi Embrio
Zigot yang telah dicuci dan dan dipisahkan dari sperma dikultur dengan media kultur CRlaa yang disuplementasi dengan calf serum 5% dan antibiotik (penisilin dan streptomisin). Zigot yang telah dicuci dikultur dalam inkubator 5% CO2, suhu 38,5 °C
dan kelembaban 90%, hari saat dilakukan fertilisasi dihitung sebagai hari ke-0. Setelah 48 jam (2 hari) dilakukan pengamatan terhadap pembelahan embrio yaitu pembelahan >2 sel, pengamatan morula pada hari kelima, sedangkan pengamatan blastosis dilakukan pada hari ke-6 (H6), hari ke-7 (H7), hari ke-8 (H8), dan hari ke-9 (H9).
Rancangan dan Analisis Data Peubah
Peubah yang diamati dalam penelitian ini adalah :
a. Pembelahan sel pada hari Kedua, yaitu menghitung secara langsung jumlah zigot yang membelah >2sel pada hari kedua (48 jam) setelah fertilisasi. Jumlah zigot yang membelah dihitung sebagai oosit yang terfertilisasi.
29 Tingkat pembelahan = ∑
∑ x 100%
b. Tingkat Pembentukan Morula, yaitu menghitung secara langsung embrio yang mencapai fase morula pada hari kelima.
Tingkat Pembentukan Morula = ∑
∑ x 100%
c. Tingkat Pembentukan Blastosis, yaitu menghitung secara langsung embrio yang mencapai fase blastosis. Penghitungan embrio yang mencapai fase blastosis dilakukan pada hari ke-6 (H-6), 7 (H-7), 8 (H-8) dan 9 (H-9). Blastosis Total merupakan akumulasi jumlah pembentukan blastosis yang terjadi pada hari keenam sampai kesembilan.
Tingkat Pembentukan Blastosis H-6 = ∑
∑ x 100%
Tingkat Pembentukan Blastosis H-7 = ∑
∑ x 100%
Tingkat Pembentukan Blastosis H-8 = ∑
∑ x 100%
Tingkat Pembentukan Blastosis H-9 = ∑
∑ x 100%
Tingkat Pembentukan Blastosis Total = ∑
∑ x 100%
Analisis Data
Hasil penelitian ini diolah dengan analisis data enumerasi chi-kuadrat yang menurut Gaspersz (1991) dinyatakan dengan istilah uji Khi-kuadrat (Chi-square test). Dijelaskan lebih lanjut bahwa data enumerasi bukan diperoleh melalui hasil pengukuran yang menggunakan alat ukur tertentu, melainkan dihitung. Data hasil penelitan merupakan nilai frekuensi pengamatan, dan dihitung menurut Gaspersz (1991), dengan formula :
E =
B K
T
Keterangan :Bi = Total frekuensi pengamatan pada baris ke-i
Kj = total frekuensi pengamatan pada kolom ke-j
30 Dengan menggunakan uji khi-kuadrat dengan formula berikut ini.
= (O − E ) E ,
Keterangan : = nilai Khi-kuadrat
Oij = frekuensi pengamatan (observasi)
Eij = frekuensi yang diharapkan mengikuti hipotesis yang dirumuskan
Bila < , ; maka tidak ada pengaruh perlakuan (tidak nyata) dan bila > , ; maka ada pengaruh perlakuan (nyata).
31
HASIL DAN PEMBAHASAN
Ovarium dan Perolehan Oosit per Ovarium
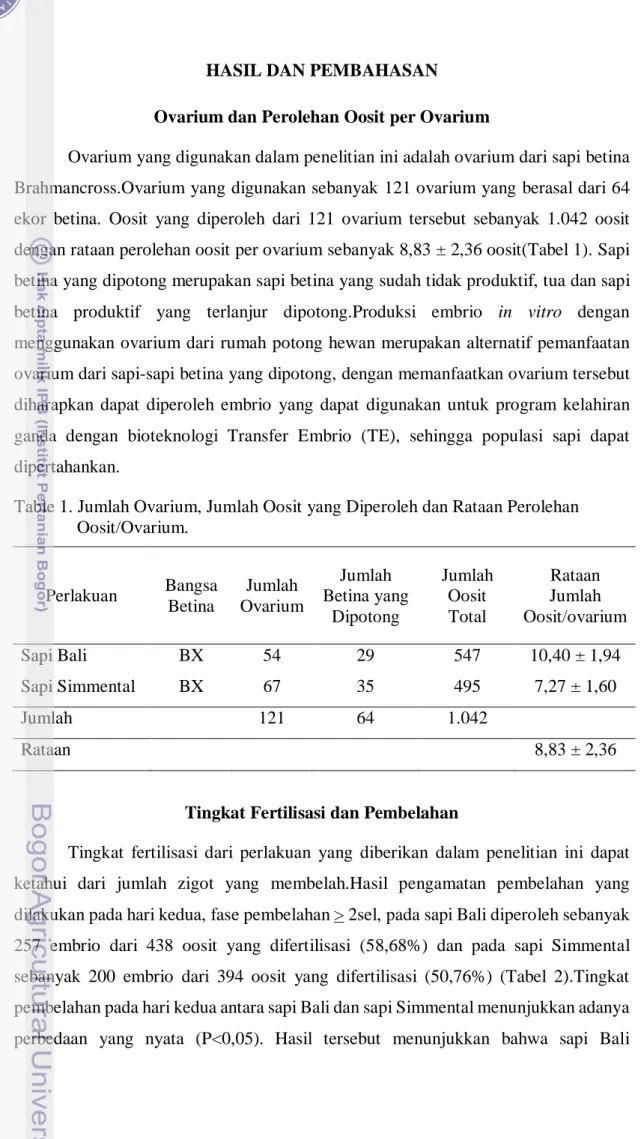
Ovarium yang digunakan dalam penelitian ini adalah ovarium dari sapi betina Brahmancross.Ovarium yang digunakan sebanyak 121 ovarium yang berasal dari 64 ekor betina. Oosit yang diperoleh dari 121 ovarium tersebut sebanyak 1.042 oosit dengan rataan perolehan oosit per ovarium sebanyak 8,83 ± 2,36 oosit(Tabel 1). Sapi betina yang dipotong merupakan sapi betina yang sudah tidak produktif, tua dan sapi betina produktif yang terlanjur dipotong.Produksi embrio in vitro dengan menggunakan ovarium dari rumah potong hewan merupakan alternatif pemanfaatan ovarium dari sapi-sapi betina yang dipotong, dengan memanfaatkan ovarium tersebut diharapkan dapat diperoleh embrio yang dapat digunakan untuk program kelahiran ganda dengan bioteknologi Transfer Embrio (TE), sehingga populasi sapi dapat dipertahankan.
Table 1. Jumlah Ovarium, Jumlah Oosit yang Diperoleh dan Rataan Perolehan Oosit/Ovarium. Perlakuan Bangsa Betina Jumlah Ovarium Jumlah Betina yang Dipotong Jumlah Oosit Total Rataan Jumlah Oosit/ovarium Sapi Bali BX 54 29 547 10,40 ± 1,94 Sapi Simmental BX 67 35 495 7,27 ± 1,60 Jumlah 121 64 1.042 Rataan 8,83 ± 2,36
Tingkat Fertilisasi dan Pembelahan
Tingkat fertilisasi dari perlakuan yang diberikan dalam penelitian ini dapat ketahui dari jumlah zigot yang membelah.Hasil pengamatan pembelahan yang dilakukan pada hari kedua, fase pembelahan > 2sel, pada sapi Bali diperoleh sebanyak 257 embrio dari 438 oosit yang difertilisasi (58,68%) dan pada sapi Simmental sebanyak 200 embrio dari 394 oosit yang difertilisasi (50,76%) (Tabel 2).Tingkat pembelahan pada hari kedua antara sapi Bali dan sapi Simmental menunjukkan adanya perbedaan yang nyata (P<0,05). Hasil tersebut menunjukkan bahwa sapi Bali
32 mempunyai kemampuan yang lebih baik dalam melakukan fertilisasi secara in vitro dibandingkan dengan sapi Simmental.Perbedaan tersebut kemungkinan disebabkan oleh faktor lingkungan dari kedua pejantan. Sapi Bali merupakan sapi asli Indonesia yang memiliki tingkat adaptasi yang cukup baik terhadap lingkungannya, sedangkan sapi Simmental merupakan sapi eksotik yang didatangkan dari luar negeri yang iklimnya sub tropis, sehingga sapi Simmental tersebut harus beradaptasi dengan lingkungan tropis yang cenderung panas. Menurut Pane (1991) sapi Bali masih mampumempertahankan tingkat fertilitasnya dengan baik pada lingkungan yang kurang baik.
Tabel 2.Tingkat Pembelahan Zigot>2 sel pada Sapi Bali dan Simmental.
Perlakuan Ooosit difertilisasi n
Pembelahan 2 sel n (%±SB)
Semen Sapi Bali 438 257(58,68±8,51)a
Semen SapiSimmental 394 200(50,76±12,84)b
Keterangan : Superskrip yang berbeda pada kolom yang sama menunjukkan berbeda nyata (P<0,05) Menurut Ward et al. (2001), pejantan mempengaruhi pembelahan awal dari embrio. Setelah sperma masuk ke dalam oosit, kromatin sperma akan mengalami renovasi yang luas dan mengakibatkan reorganisasi dari genom jantan menjadi pronuklei jantan. Pronuklei betina dan jantan akan mengalami sintesis DNA sebelum memasuki proses mitosis yang pertama, yang berpuncak pada pembelahan embrio yang pertama menjadi dua sel. Comizzoli et al. (2000) melaporkan bahwa fertilitas pejantan secara in vitro mempengaruhi waktu dan durasi replikasi DNA, sedang genotipe betina tidak ikut mengatur waktu terjadinya replikasi DNA.Hal tersebut membuktikan bahwa pejantan pada sapi mempengaruhi waktu dan durasi replikasi DNA selama siklus sel pertama, dan pada akhirnya mempengaruhi waktu pembelahan pertama.Tingkat pembelahan pada sapi Bali lebih baik dibandingkan dengan sapi Simmental.
Hal tersebut tidak sesuai dengan hasil penelitian Barros et al. (2006) yang membandingkan tingkat pembelahan embrio dan pembentukan blastosis pada oosit yang difertilisasi menggunakan bangsa pejantan Nelore (B. t. indicus) dan crossbreed (indicus vs. taurus), dalam penelitian tersebut dilaporkan bahwa tingkat pembelahan
33 embrio dan pembentukan blastosis yang dihasilkan tidak berbeda nyata pada kedua bangsa pejantan yang digunakan.
Menurut Duque et al. (2003) dan Kuran et al. (2002) faktor epigenetik memberikan peranan yang penting dalam perkembangan awal embrio, seperti ion, substrat energi, asam amino, vitamin, faktor pertumbuhan, sitokin dan hormon. Faktor lain yang dapat mempengaruhi tingkat produksi embrio antara lain, kondisi individu oosit yang bervariasi, semen, media dan kultur yang digunakan setiap fase produksi embrio in vitro (Cevik et al., 2009), fertilitas pejantan (Ward et al., 2001), kualitas oosit, konsentrasi bahan kimia dan waktu aktivasi oosit (Korkmaz, 2012).
Tingkat Pembentukan Morula dan Blastosis
Pembentukan morula yang diperoleh pada sapi Bali sebanyak 144 embrio dari 257 embrio yang membelah (56,03%) dan pada sapi Simmental sebanyak 106 embrio dari 200 embrio yang membelah (53,00%) (Tabel 3).Tingkat pembentukan morula pada sapi Bali dan sapi Simmental berbeda nyata (P<0,05).Hal tersebut menunjukkan bahwa sapi Bali mempunyai kemampuan yang lebih baik dibandingkan dengan sapi Simmental dalam perkembangan embrio sampai tahap pembentukan morula.
Tabel 3.Tingkat Pembentukan Morula dan Blastosis pada Sapi Bali dan Simmental.
Perlakuan Zigot yang membelah n Morulla n (%±SB) Blastosis n (%±SB)
Semen Sapi Bali 257 144(56,03±16,55)a 113(43,97±13,84)a
Semen Sapi Simmental 200 106 (53,00±11,81)b 80 (40,00±10,63)b
Keterangan : Superskrip yang berbeda pada kolom yang sama menunjukkan berbeda nyata (P<0,05) Pembentukan blastosis total yang diperoleh pada sapi Bali sebanyak 113 embrio dari 257 embrio yang membelah (43,97%) dan pada sapi Simmental sebanyak 80 embrio dari 200 embrio yang membelah (40,00%) (Tabel 3). Hasil uji statistik menunjukkan bahwa pembentukan blastosis total pada sapi Bali dan sapi Simmental berbeda nyata (P<0,05). Hal tersebut menunjukkan bahwa sapi Bali mempunyai kemampuan yang lebih baik dibandingkan dengan sapi Simmental dalam perkembangan embrio sampai tahap pembentukan blastosis.
Pembentukan morula dan blastosis dipengaruhi oleh tingkat pembelahan pada hari kedua. Tingkat pembelahan pada bangsa sapi Bali lebih tinggi dibandingkan
34 dengan bangsa sapi Simmental, hal tersebut juga berpengaruh pada tingkat pembentukan morula dan blastosis.Lonergan et al.(1999) melaporkan bahwa terbukti adanya perbedaan tingkat pembentukan blastosis yang lebih tinggi dari embrio yang membelah lebih awal dibandingkan dengan embrio yang membelah lebih akhir. Meskipun perkembangan awal dari embrio dapat ditentukan oleh oosit, tetapi hal itu tidak begitu eksklusif.
Fase penting dalam perkembangan awal embrio mamalia adalah saat terjadi kompaksi sel, kejadian ini akan bervariasi menurut spesiesnya (Gordon, 1994). Seidel (1983) menduga waktu kompaksi dari embrio sapi terjadi pada fase 16 sel, tetapi kebanyakan peneliti sependapat bahwa waktu kompaksi dari embrio sapi terjadi pada fase 32 sel atau lebih (Prather dan First, 1988; Bondioli et al., 1990; Van Soom et al., 1992). Van Soom et al. (1992) menyatakan bahwa kompaksi sel biasanya terjadi antara hari kelima sampai keenam setelah fertilisasi.
Perubahan dari fase morula ke blastosis merupakan tahapan yang penting dalam perkembangan awal embrio, pada proses ini menghasilkan dua tipe sel, yaitu Inner cell mass (ICM) dan sel trophoblast. Sel trophoblast atau tropectoderm, akan berkembang menjadi jaringan plasenta dan bergabung dengan selaput extraembryonic, sedangkan ICM akan berkembang menjaditiga bentuk lapisan sel perkembangan embrio (endoderm, mesoderm dan ectoderm) (Gordon, 1994).
Tabel 4.Tingkat Pembentukan Blastosis pada hari ke-6, 7, 8, dan 9 pada Sapi Bali dan Sapi Simmental Perlakuan Zigot membelah n Pembentukan Blastosis Hari VI n (%±SB) Hari VII n (%±SB) Hari VIII n (%±SB) Hari IX n (%±SB) Sapi Bali 257 22 (8,56±3,80)a 49 (19,07±11,91)a 29 (11,28±3,53)a 13 (5,06±4,06)a Sapi Simmental 200 8 (4,00±4,78)b 40 (20,00±8,93)a 27 (13,50±8,87)a 5 (2,50±2,72)a Keterangan : Superskrip yang berbeda pada kolom yang sama menunjukkan berbeda nyata (P<0,05)
Perkembangan pembentukan blastosis pada hari keenam pada sapi Bali dan sapi Simmental memberikan perbedaan yang nyata (P<0,05), sedangkan pada hari ketujuh sampai kesembilan tidak berbeda nyata (P>0,05), walaupun hasil pembentukan blastosis pada sapi Bali selalu lebih besar dibanding sapi Simmental. Hal ini menunjukkan bahwa sapi Bali mempunyai kemampuan perkembangan pembentukan blastosis yang lebih cepat bila dibandingkan dengan sapi Simmental
35 (Tabel 4). Puncak pembentukan blastosis pada kedua bangsa terjadi pada hari ketujuh, baik pada embrio yang difertilisasi dengan sperma sapi Bali maupun sapi Simmental. Hasil ini sesuai dengan hasil penelitian Ward et al. (2001) yang menyatakan puncak pembentukan blastosis rata-rata terjadi pada hari ketujuh setelah fertilisasi pada setiap pejantan yang digunakan.
Hasil penelitian ini memberikan informasi bahwa sapi Bali (Bos javanicus) memiliki kemampuan yang lebih baik dengan sapi Simmental (Bos taurus) dalam melakukan fertilisasi secara in vitro, pembelahan sel, pembentukan morula dan blastosis.Embrio hasil fertilisasi dengan semen pejantan sapi Bali memiliki kecepatan dan kemampuan perkembangan yang yang lebih baik pada hari keenam, sedangkan pada hari ketujuh sampai kesembilan tidak berbeda.
Krisher et al. (1999) menunjukkan bahwa medium kultur dapat mempengaruhi metabolisme embrio yang dihasilkan, tetapi tidak jelas berapa banyak hal tersebut dapat mempengaruhi metabolisme embrio. Selain itu, beberapa faktor dapat mempengaruhi tingkat produksi embrio komersial, seperti variasi kondisi individu oosit donor, semen, media dan kultur yang digunakan setiap fase dalam produksi embrio in vitro. Media kultur harus diganti pada interval tertentu untuk melindungi embrio dari toksisitas (Keskintepe dan Brackett, 1996; Steeves dan Gardner, 1999).
Hasil penelitian ini dapat digunakan sebagai acuan dalam melakukan produksi embrio in vitro komersil pada sapi Bali secara massal, tentunya dengan mutu genetik yang harus tetap dijaga. Dengan adanya embrio sapi Bali ini akan memudahkan distribusi sapi Bali ke seluruh Indonesia, karena pengangkutan dan transportasi embrio lebih mudah bila dibandingkan dengan ternak hidup. Kelangsungan hidup dan populasi dari sapi Bali dapat dipertahankan dan ditingkatkan, denganmemproduksi embrio sapi Bali secara massal, baik dengan metode in vitro maupun in vivo.
Pengaruh Bangsa Pejantan yang Berbeda
Persentase pembelahan sel, pembentukan morula dan blastosis antar sapi Bali dan sapi Simmental berbeda nyata (P<0,05). Hal tersebut menunjukkan bahwa bangsa pejantan mempengaruhi pembelahan sel, pembentukan morula dan blastosis. Lonergan et al. (1999) menyatakan bahwa pejantan mempengaruhi waktu pembelahan awal pada perkembangan oosit. Sumantri et al. (1997) menyatakan bahwa variasi
36 individu sapi dan bangsa pejantan dapat menyebabkan terjadinya perbedaan dalam perkembangan embrio. Ward et al. (2001) juga menyatakan bahwa pembelahan awal oosit sangat bervariasi antar pejantan yang digunakan dalam fertilisasi in vitro.
Hasil pembentukan blastosis total yang diperoleh lebih besar pada oosit yang difertilisasi dengan semen sapi Bali (43,97±13,84) dibandingkan dengan oosit yang difertilisasi dengan semen sapi Simmental (40,00±10,63). Hasil dari kedua perlakuan tersebut masih lebih tinggi bila dibandingkan dengan penyataan Gordon (1994) yang menyatakan bahwa pada produksi embrio sapi secara in vitro, sekitar dua pertiga oosit gagal mencapai tahap blastosis. Hal tersebut kemungkinan dikarenakan adanya pengaruh heterosis pada tingkat embrional, karena bangsa pejantan dari kedua pejantan yang digunakan berbeda dengan bangsa betina yang digunakan, yaitu Brahman Cross (BX), namun kemungkinan tersebut perlu diuji lebih lanjut. Pada perkawinan diatas disebut persilangan antar bangsa (crossbreeding). Menurut Noor (2008) persilangan antar bangsa akan meningkatkan proporsi gen-gen yang heterozigot. Pada umumnya hetrozigositas akan meningkatkan daya hidup embrio yang tentunya akan meningkatkan jumlah anak per kelahiran. Peningkatan ini disebabkan oleh heterosis pada ternak hasil persilangan yang tetuanya adalah ternak murni. Peningkatan sifat ini dapat mencapai 5%-10% pada sapi hasil persilangan.
37
KESIMPULAN DAN SARAN Kesimpulan
Sapi Bali (Bos javanicus) memiliki kemampuan yang lebih baik (P<0,05) dibandingkan dengan sapi Simmental (Bos taurus) dalam melakukan fertilisasi secara in vitro, tingkat pembelahan, pembentukan morula, dan blastosis, serta perkembangan pembentukan blastosis pada hari keenam, tetapi perkembangan pembentukan blastosis pada hari ketujuh sampai kesembilan tidak berbeda nyata (P>0,05).
Saran
Diperlukan studi lebih lanjut mengenai fertilisasi secara in vitro dengan menggunakan ovarium dan Pejantan dari sapi Bali, lama waktu yang tepat untuk fertilisasi secara in vitro pada sapi Bali.
38
UCAPAN TERIMA KASIH
Puji syukur penulis ucapkan kepada Allah SWT atas segala rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi ini. Skripsi ini berjudul “Pembentukan Blastosis Pada Embrio Sapi yang Difertilisasi Secara In Vitro dengan Semen Sapi Bali (Bos javanicus) dan Semen Sapi Simmental (Bos taurus)”.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Bapak Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc.sebagai dosen pembimbing utama dan pembimbing akademik serta Bapak Muhammad Imron, S.Pt., M.Si. sebagai dosen pembimbing anggota yang telah banyak memberi ilmu, membantu sejak penelitian hingga penyelesaian skripsi ini. Dosen penguji sidang Bapak Dr. Jakaria, S.Pt., M.Si. dan Dr. Ir. Asep Sudarman, M.Rur.Sc., serta dosen penguji seminar Ibu Dr. Ir. Sri Darwati, M.Si terima kasih atas ilmu dan masukkannya. Penulis juga ucapkan terimakasih kepada Ibu Ir. Rini Herlina Mulyono, M.Si. atas bimbingannya.
Penulis ucapkan terima kasih kepada bapak dan ibu tercinta, yang telah banyak memberikan dukungan moral, spiritual, material, dan kasih sayangnya yang tak tergantikan oleh apapun sehingga penulis dapat menyelesaikan kewajiban belajar selama ini. Penulis juga ingin mengucapkan terima kasih kepada Kepala Balai Embrio Ternak Cipelang, Ibu Ir. Hj. Tri Harsi, MP. yang telah memberi kesempatan kepada penulis untuk melakukan penelitian di Balai Embrio Ternak Cipelang (BET Cipelang). Tak lupa juga penulis sampaikan terimakasih kepada teman-teman Alih Jenis Fapet yang selalu memberi inspirasi, semangat, dan hiburan. Penulis ucapkan terima kasih juga kepada teman-teman di Laboratorium Produksi Embrio BET Cipelang (Pak Ilyas, Mbak Lela, Mbak Tyas, Teh Anny, Pak Agus, Mas Paryoto, Teh Neneng, Teh Lilis, Mas Kusnadi, Ineu, Pak Jodi, Uwak, Weni, Mas Radito dan masih banyak lagi yang tidak dapat disebut satu persatu).
Terakhir penulis ucapkan terima kasih kepada semua dosen dan pegawai di Fakultas Peternakan Institut Pertanian Bogor. Semoga skripsi ini bermanfaat bagi semua pihak.
Bogor, Januari 2013
39
DAFTAR PUSTAKA
Balai Embrio Ternak. 2011. Laporan optimalisasi kelahiran kembar Hasil TE 2010-2011. BET Cipelang. Bogor.
Barros, C.M., M.F. Pegorer, J.L.M. Vasconselos, B.G. Eberhardt, & F.M. Monteiro. 2006. Importance of sperm genotype (indicus versus taurus) for fertility and embryonic development at elevated temperatures. Theriogenology 65 : 210-218.
Bondioli, K.R., M.E. Westhusin, & C.R. Looney. 1990. Production of identical bovine off-spring by nuclear transfer. Theriogenology.33 : 165-174.
Cevik, M., H. Sagirkaya, A. Tas, T. Akkoc, H. Bagis, & S. Arat. 2009. Comparing in vitro embryonic development of bovine oocytes cultured in G1.2/G2.3 Sequential Cultured Media and CR1aa Medium. J. of Anim. and Vet.Advance. 8 (6) : 1185-1189.
Chian, R.C., K. Niwa, & M.A. Sirard.1994.Effects of cumulus cells on male pronuclear formation and subsequent early development of bovine oocytes in vitro.Theriogenology.41 : 1499-1508.
Comizzoli, P., B. Marquant-Le Guienne, Y. Heyman, & J.P. Renard. 2000. Onset the first S-phase is determined by a parental effect during the G1-phase in bovine zigates. Biol. Reprod.62 : 1677-1684.
Cummings, PB. 2003. Oogenesis-spermatogenesis. http://www.esu.edu/~milewski/ intro_biol_one_lect/weblinks/oogenesis-spermatogenesis.html [9 Oktober 2012]
Durocher, J., N. Morin, & P. Blodin. 2006. Effect of hormonal stimulation on bovine follicular response and oocyte development competence in a commercial operation. Theriogenology 65 : 102-115.
Duque, P., E. Gomez, E. Diaz, N. Facal, C. Hidalgo, & C. Diez. 2003. Use of two replacement of serum during bovine embryo culture in vitro. Theriogenology.59 : 889-899.
Funahashi, H., & B.N. Day. 1993. Effects of duration of exposure to hormones supplement on cytoplasmic maturation of pig oocytes in vitro. J. Reprod. Fert.98 : 179-185.
Furuya, S., Y. Endo, M. Oba, Y. Matsui, S. Nozawa, & S. Suzuki. 1992. Protein phosphorylatin regulates the Mouse sperm acrosome reaction induced by zona pellucida. J. Assist. Reprod Genet. 9 : 384-390.
Gaspersz, V. 1991.Teknik analisis dalam penelitian percobaan.Bandung :Penerbit Tarsito Bandung.
Gordon, I. 1994. Laboratory Production of Cattle Embryos. Cambridge. United Kingdom.
Hafez, E.S.E., & B. Hafez. 2000. Reproduction in farm Animals. 7th ed. Philadelphia, USA.
40 Handiwirawan & Subandriyo. 2004. Potensi dan keragaman sumberdaya genetik sapi
bali. Wartazoa 14 : 3.
Hardjosubroto, W. & J.M. Astuti. 1993. Buku Pintar Peternakan. PT Gramedia Widiasarana Indonesia.Jakarta.
Hogan, B., F. Constantini, & E. Lacy. 1994. Manipulating the Mouse Embryo : A Laboratory Manual. New York : Cold Spring Harbor Laboratory.
Hunter, R.H.F. 1995.Phisiology and technology of reproduction in female domestic animal. Academic Press, New York.
Ijaz, A.,& A.G. Hunter. 1989. Induction of bovine sperm capacitation by TEST-yolk semen extender. J. Dairy Sci.72 : 2683-2690.
Im, K.S., H.J. Kim, K.M. Chung, H.S. Kim, & K.W. Park.1995. Effects of ovary type, oocyte grade, hormone, sperm concentration and fertilization medium on in vitro maturation, fertilization, and development of bovine follicular oocytes.AJAS.8 : 123-127.
Kato, H., & A. Iritani. 1991. In vitro fertilization in cattle. International Symposium on Animal Biotechnology.Oktober 15-17, 1991.Kyoto International Community House.
Kispert, A., & A. Gossler. 2004. Introduction to early mouse development. In : The Laboratory Mouse. Elsevier,USA.
Korkmaz, O., S. Kuplulu, Y. Agca, & I.M. Polat.2012. Effect of oocyte quality and activation protocols on bovine embryo development following intracytoplasmic sperm injection. Turk.J. Anim. Sci. 36 (1).doi : 10.3906/ vet-1105-44.
Keskintepe, L., & B.G. Brackett.1996. In vitro developmental competence of in vitro matured bovine oocytes fertilized and cultured in completely defined media. Biol. Reprod. 55 (2) : 333-339.
Krisher, R.L., M.Lane, & B.D. Bavister. 1999. Development competence and metabolism of bovine embryos cultured in semi-defined and defined culture media.Biol. Reprod.60 : 1345-1352.
Kuran, m., J.J. Robinson, D.S. Brown, & T.G. Mcevoy. 2002. Development, amino acid utilization and cell allocation in bovine embryos after in vitro production in contrasting culture system. Reprod. 124 : 155-165.
Kwan, PWL. 2002. Histology of the male reproduction system. http://ocw.tufts.edu/data/4/532443.pdf [24 Februari 2010].
Lachland, M.R.L., N.G. Wreford, L.O. Donnell, D.M. Krester, &D.M. Robertson. 1996. Endocrine regulation of spermatogenesis; independent roles for testosterone and FSH. J. Endoc 148 : 1-9.
Lonergan, P., H. Khatir, F. Piumi, D. Rieger, P. Humblot,& M. P. Boland. 1999. Effect of time interval from insemination to first cleavage on the developmental characteristics, sex ratio and pregnancy rate after transfer of bovine embryos. J. Reprod.and Fert.117 : 159-167.