SKRIPSI
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN UJI TOKSISITAS DARI EKSTRAK UMBI KELADI TIKUS (tuber Typhonii)
DENGAN METODE BRINE SHRIMP LETHALITY TEST (BST) OLEH:
PIPI SAPUTRI NASUTION 050804059
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN UJI TOKSISITAS DARI EKSTRAK UMBI KELADI TIKUS (tuber Typhonii)
DENGAN METODE BRINE SHRIMP LETHALITY TEST (BST)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
PIPI SAPUTRI NASUTION 050804059
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN UJI TOKSISITAS DARI EKSTRAK UMBI KELADI TIKUS (tuber Typhonii)
DENGAN METODE BRINE SHRIMP LETHALITY TEST (BST) OLEH:
PIPI SAPUTRI NASUTION 050804059
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal : Desember 2010
Pembimbing I, Panitia Penguji,
Dr. M. Pandapotan Nst, MPS., Apt. Dr. Marline Nainggolan, MS., Apt. NIP : 194908111976031001 NIP : 195709091985112001 Pembimbing II,
Dr. M. Pandapotan Nst, MPS., Apt. NIP : 194908111976031001
Dra. Herawaty Ginting, M.Si., Apt. NIP : 19511223198032002
Dra. Aswita Hafni Lubis, M.Si., Apt. NIP : 195304031983032001
Drs. Rasmadin Mukhtar, M.S., Apt. NIP : 195304031983032001
Medan, Desember 2010 Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji dan syukur kepada Allah SWT karena kasih sayang dan hidayah-Nya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul ”Karakterisasi Simplisia, Skrining Fitokimia, dan Uji Toksisitas dari Ekstrak Umbi Keladi Tikus (tuber Typhonii) dengan Metode Brine Shrimp Lethality Test (BST). Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Ucapan terima kasih dan penghargaan yang tulus kepada Ayahanda H. Bahran Effendy Nasution dan Ibunda Hj. Suaidah Lubis yang tercinta, kakanda Efrida nasution dan adinda St. Bajora, Andri kurnia, Imam Hidayat dan abanganda Umar Ansor serta kepada semua keluarga atas perhatian, nasehat dan dorongan semangat serta dukungan doa yang tiada ternilai harganya.
Dengan segala ketulusan hati penulis juga menyampaikan terima kasih kepada Bapak DR. M. Pandapotan Nasution, MPS, Apt., dan Dra. Herawati Ginting, M.Si., Apt., yang telah membimbing penulis dengan penuh kesabaran dan tanggung jawab selama melakukan penelitian hingga selesainya penulisan skripsi ini.
Pada kesempatan ini penulis juga mengucapkan terima kasih kepada: 1. Bapak Dekan Fakultas Farmasi Prof. Dr. Sumadio Hadisahputra, Apt., yang
telah memberikan fasilitas kepada penulis sehingga dapat menyelesaikan skripsi ini.
2. Bapak Dr.Edy Suwarso SU.Apt., sebagai Dosen wali yang telah banyak membimbing penulis selama masa perkuliahan.
3. Ibu Dr. Marline Nainggolan, MS., Apt, Dra. Aswita Hafni Lubis, M.Si., Apt, Drs. Rasmadin Mukhtar, M.S., Apt yang telah memberikan masukan dan saran kepada penulis sehingga dapat menyelesaikan skripsi ini.
5. Bapak/Ibu staf pengajar Fakultas Farmasi USU yang telah memberikan didikan dan bimbingan selama penulis menuntut ilmu di Fakultas Farmasi USU
6. Kepada teman-teman terutama Denny satria yang telah banyak membantu saya dan sahabatku serta rekan Farmasi yang tidak dapat disebutkan satu persatu yang selalu menjadi teman berbagi suka duka, membantu dan memberi dorongan semangat kepada penulis untuk menyelesaikan skripsi ini.
Penulis menyadari bahwa tulisan ini masih banyak kekurangan, oleh karena itu sangat diharapkan kritik dan saran yang bersifat membangun dari pembaca. Akhirnya penulis berharap semoga skripsi ini bermanfaat bagi semua orang.
Medan, 01 Desember 2010 Penulis,
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN UJI TOKSISITAS DARI EKSTRAK UMBI KELADI TIKUS (tuber Typhonii)
DENGAN METODE BRINE SHRIMP LETHALITY TES (BST)
Abstrak
Keladi tikus termasuk tumbuhan semak yang banyak digunakan untuk pengobatan tradisional. Tanaman keladi tikus adalah tumbuhan semak sejenis talas dengan tinggi 25 cm hingga 30 cm, menyukai tempat lembab yang tidak terkena sinar matahari langsung. Bentuk daunnya bulat dengan ujung runcing berbentuk jantung. Berwarna hijau segar. Umbi berbentuk bulat rata sebesar buah pala.
Karakterisasi simplisia umbi keladi tikus dilakukan dengan pemeriksaan kadar air, kadar sari yang larut dalam air, kadar sari yang larut dalam etanol, kadar abu total dan kadar abu yang tidak larut dalam asam. Ekstrak umbi keladi tikus diperoleh secara perkolasi dengan menggunakan pelarut n-heksan, etilasetat dan etanol. Ekstrak umbi keladi tikus diuji terhadap Artemia salina Leach. Data diolah menggunakan analisis regresi linear untuk memperoleh harga LC50.
Pengamatan makroskopik terhadap simplisia umbi keladi tikus (tuber Typhonii) yaitu berwarna coklat muda, kecil-kecil dan berbau khas seperti bau tikus. Pemeriksaan mikroskopik serbuk simplisia menunjukkan adanya hilus, butir pati, dan Ca oksalat. Hasil karakteristik simplisia kadar air 7,99%, kadar sari yang larut dalam air 5,44%, kadar sari larut dalam etanol 16,59%, kadar abu total 3,62%, kadar abu yang tidak larut dalam asam 0,43%.
Hasil uji aktivitas biologi terhadap ekstrak n-heksan adalah LC50 11,48 μg/ml, ekstrak etilasetat LC50 adalah 30,90 μg/ml, dan ekstrak etanol LC50 adalah 6,31 μg/ml. Semua ekstrak memiliki aktivitas biologi. Menurut Meyer at al., (1982), ekstrak dikatakan memiliki aktivitas biologi bila LC50 < 1000 μg/ml.
Kata kunci: Artemia salina Leach, ekstrak, karakterisasi, simplisia, tuber
CHARACTERIZATION OF SIMPLEX, PHYTOCHEMICAL SCREENING AND TOXICITY TEST OF EXTRACT KELADI TIKUS TUBER (tuber Typhonii) METHOD WITH BRINE SHRIMP LETHALITY
TEST (BST)
Abstract
Keladi tikus is a kind of herbal plant and is extensively used in traditional medicine. It is a plant of the same kind as talas, with the height ranged from 25 to 30 cm, and prefers damp places not reached by direct sunlight. It’s leaves are round shaped with sharp ends the from of hearts. It’s color is fresh green. The tuber is shaped flat and round, with the size of nutmeg.
The characterization of keladi tikus tuber simplex was done by examining the water content, water – soluble essence content, ethanol – soluble essence content, total ash content and acid insoluble ash content. The extract of the tuber was obtained by the means of percolation using n-heksan, ethylacetate, and ethanol as solvents. The extract of the keladi tikus tuber was tested against Artemia salina Leach. The data were processed using linier regression analysis to abtain the LC50 value.
The macroscopic examination of the keladi tikus tuber simplex is that it is light brown in color, small – shaped and has a distinct smell like the tench of rats. The microscopic the examination of the simplex powder showed the presence of hylus, starch grains and calcium oxalate. The result of the simplex characterization showed the characteristic of 7.99% water content, 5.44% water soluble essence content, 16.59% ethanol soluble essence content, 3.62% total ash concent, and 0.43% acid insoluble ash content.
The result of the biological activity test for the n-heksan extract is LC50 11.48 µg/ml, for the ethylacetate extract is LC50 30.90 µg/ml, and for the ethanol extract is LC50 6.31 µg/ml. All extract show biological activity. According to Meyer at al., (1982), an extract is considered having biological activity if the LC50 value is lower than 1000 µg/ml.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR GAMBAR ... xi
DAFTAR TABEL ... xii
DAFTAR LAMPIRAN ... xiii
BAB I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah... 2
1.3 Hipotesis ... 2
1.4 Tujuan Penelitian ... 2
1.5 Manfaat Penelitian... 3
BAB II. TINJAUAN PUSTAKA ... 4
2.1 Uraian Tumbuhan ... 4
2.1.1 Sistematika Tumbuhan ... 4
2.1.2 Sinonim ... 4
2.1.4 Habitat dan Penyebaran ... 4
2.1.5 Morfologi ... 4
2.1.6 Kandungan Kimia ... 4
2.1.7 Khasiat Tumbuhan ... 4
BAB III. METODOLOGI PENELITIAN... 4
2.1 Alat-alat ... 4
2.2 Bahan-bahan ... 4
2.3 Pengumpulan dan Pengolahan sampel ... 5
2.3.1. Pengumpulan sampel ... 5
2.3.2. Identifikasi sampel ... 5
2.3.3. Pengolahan sampel ... 5
2.4 Lokasi penelitian ... 6
2.5 Pembuatan larutan pereaksi ... 6
2.6 Pemeriksaan karakteristik simplisia ... 8
2.6.1 Pemeriksaan makroskopik ... 8
2.6.2 Pemeriksaan mikroskopik ... 8
2.6.3 Penetapan kadar air ... 8
2.6.4 Penetapan kadar sari yang larut dalam air ... 9
2.6.5 Penetapan kadar sari yang larut dalam etanol ... 10
2.6.6 Penetapan kadar abu total ... 10
2.6.7 Penetapan kadar abu yang tidak larut dalam asam ... 10
2.7 Skrining fitokimia serbuk simplisia dan ekstrak ... 11
2.7.1 Pemeriksaan alkaloida ... 11
2.7.3 Pemeriksaan saponin ... 12
2.7.4 Pemeriksaan tanin ... 12
2.7.5 Pemeriksaan glikosida ... 12
2.7.6 Pemeriksaan antrakinon ... 13
2.7.7 Pemeriksaan steroida/triterpenoida ... 13
2.8 Pembuatan ekstrak ... 13
2.9 Uji Toksisitas ... 14
BAB IV. HASIL DAN PEMBAHASAN ... 16
BAB V. KESIMPULAN DAN SARAN ... 19
4.1 Kesimpulan ... 19
4.2 Saran ... 20
DAFTAR PUSTAKA ... 21
DAFTAR GAMBAR
Gambar Halaman
1. Simplisia umbi keladi tikus (tuber Typhonii)... 25
2. Mikroskopik serbuk umbi keladi tikus (tuber Typhonii)... 26
3. Bagan pengolahan simplisia... 32
DAFTAR TABEL
Tabel Halaman
1. Hasil karakterisasi simplisia ... 16
2. Hasil skrining fitokimia ... 17
3. Data persen kematian nauplii ekstrak n-heksan ... 35
4. Data persen kematian nauplii ekstrak etilasetat... 35
5. Data persen kematian nauplii ekstrak etanol ... 36
6. Perhitungan harga LC50 ekstrak n-heksan menggunakan metode analisa regresi linear... 37
7. Perhitungan harga LC50 ekstrak etil asetat menggunakan metode analisa regresi linear... 39
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil identifikasi umbi keladi tikus ... 23
2. Gambar simplisia umbi keladi tikus ... 25
3. Gambar mikroskopik serbuk umbi keladi tikus ... 26
4. Perhitungan kadar karakteristik simplisia ... 27
5. Bagan kerja ... 32
6. Bagan kerja Uji Aktivitas Biologi ... 34
7. Data persen kematian nauplii ... 35
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN UJI TOKSISITAS DARI EKSTRAK UMBI KELADI TIKUS (tuber Typhonii)
DENGAN METODE BRINE SHRIMP LETHALITY TES (BST)
Abstrak
Keladi tikus termasuk tumbuhan semak yang banyak digunakan untuk pengobatan tradisional. Tanaman keladi tikus adalah tumbuhan semak sejenis talas dengan tinggi 25 cm hingga 30 cm, menyukai tempat lembab yang tidak terkena sinar matahari langsung. Bentuk daunnya bulat dengan ujung runcing berbentuk jantung. Berwarna hijau segar. Umbi berbentuk bulat rata sebesar buah pala.
Karakterisasi simplisia umbi keladi tikus dilakukan dengan pemeriksaan kadar air, kadar sari yang larut dalam air, kadar sari yang larut dalam etanol, kadar abu total dan kadar abu yang tidak larut dalam asam. Ekstrak umbi keladi tikus diperoleh secara perkolasi dengan menggunakan pelarut n-heksan, etilasetat dan etanol. Ekstrak umbi keladi tikus diuji terhadap Artemia salina Leach. Data diolah menggunakan analisis regresi linear untuk memperoleh harga LC50.
Pengamatan makroskopik terhadap simplisia umbi keladi tikus (tuber Typhonii) yaitu berwarna coklat muda, kecil-kecil dan berbau khas seperti bau tikus. Pemeriksaan mikroskopik serbuk simplisia menunjukkan adanya hilus, butir pati, dan Ca oksalat. Hasil karakteristik simplisia kadar air 7,99%, kadar sari yang larut dalam air 5,44%, kadar sari larut dalam etanol 16,59%, kadar abu total 3,62%, kadar abu yang tidak larut dalam asam 0,43%.
Hasil uji aktivitas biologi terhadap ekstrak n-heksan adalah LC50 11,48 μg/ml, ekstrak etilasetat LC50 adalah 30,90 μg/ml, dan ekstrak etanol LC50 adalah 6,31 μg/ml. Semua ekstrak memiliki aktivitas biologi. Menurut Meyer at al., (1982), ekstrak dikatakan memiliki aktivitas biologi bila LC50 < 1000 μg/ml.
Kata kunci: Artemia salina Leach, ekstrak, karakterisasi, simplisia, tuber
CHARACTERIZATION OF SIMPLEX, PHYTOCHEMICAL SCREENING AND TOXICITY TEST OF EXTRACT KELADI TIKUS TUBER (tuber Typhonii) METHOD WITH BRINE SHRIMP LETHALITY
TEST (BST)
Abstract
Keladi tikus is a kind of herbal plant and is extensively used in traditional medicine. It is a plant of the same kind as talas, with the height ranged from 25 to 30 cm, and prefers damp places not reached by direct sunlight. It’s leaves are round shaped with sharp ends the from of hearts. It’s color is fresh green. The tuber is shaped flat and round, with the size of nutmeg.
The characterization of keladi tikus tuber simplex was done by examining the water content, water – soluble essence content, ethanol – soluble essence content, total ash content and acid insoluble ash content. The extract of the tuber was obtained by the means of percolation using n-heksan, ethylacetate, and ethanol as solvents. The extract of the keladi tikus tuber was tested against Artemia salina Leach. The data were processed using linier regression analysis to abtain the LC50 value.
The macroscopic examination of the keladi tikus tuber simplex is that it is light brown in color, small – shaped and has a distinct smell like the tench of rats. The microscopic the examination of the simplex powder showed the presence of hylus, starch grains and calcium oxalate. The result of the simplex characterization showed the characteristic of 7.99% water content, 5.44% water soluble essence content, 16.59% ethanol soluble essence content, 3.62% total ash concent, and 0.43% acid insoluble ash content.
The result of the biological activity test for the n-heksan extract is LC50 11.48 µg/ml, for the ethylacetate extract is LC50 30.90 µg/ml, and for the ethanol extract is LC50 6.31 µg/ml. All extract show biological activity. According to Meyer at al., (1982), an extract is considered having biological activity if the LC50 value is lower than 1000 µg/ml.
BAB I PENDAHULUAN 1.1Latar Belakang
Keladi tikus (Typhonium flagelliforme) suku Araceae merupakan salah satu tanaman yang digunakan untuk mengobati penyakit kanker karena dalam tumbuhan ini mengandung senyawa-senyawa yang berkhasiat sebagai sitotoksik. Secara empiris dapat digunakan untuk mengobati kanker. Dalam rangka pencarian obat baru, maka dilakukan pengujian bioassay secara in-vitro dengan menggunakan Metode Brine shrimp ini (Harfia., 2006).
Keladi tikus adalah salah satu tanaman yang langka. Dimana tanaman ini sangat sulit tumbuh ditempat terbuka, biasanya tumbuh ditempat lembab yang tidak terkena sinar matahari langsung. Pada akhir-akhir ini, kebanyakan masyarakat di Malaysia mengunakan tanaman keladi tikus ini sebagai obat tradisional yang biasanya digunakan untuk mengobati penyakit kanker, borok/koreng, luka, dan mampu menetralisir racun narkoba.
kemampuan untuk menghambat pertumbuhan sel kanker, namun biasanya pada dosis tertentu kemampuan menghambat pertumbuhan sel kanker pada daun justru menurun (Anonim, 2009).
Khasiat umbi keladi tikus mampu menghambat pertumbuhan sel kanker karena diduga mengandung senyawa golongan triterpenoid. Triterpenoid bekerja dengan menghambat kerja enzim DNA. Enzim itu berperan dalam proses replikasi dan proliferasi sel kanker. Terhentinya enzim itu bekerja membuat proses dalam sel terhenti dan menyebabkan kematian sel kanker. Daun dan umbi keladi tikus selama ini telah dimanfaatkan sebagai pengobatan kanker, termasuk kanker darah (Harfia, 2006).
Untuk mengetahui kandungan kimia aktif suatu tumbuhan dapat dilakukan uji aktivitas. Salah satu uji aktivitas yang paling sederhana, yang dapat dilakukan dengan mudah dan dapat diandalkan adalah uji aktivitas Metode Brine Shrimp menggunakan larva (nauplii) udang laut Artemia salina Leach. Kandungan kimia aktif dimaksudkan sebagai komponen aktif biologi terhadap manusia maupun hewan dan tumbuhan. Kandungan kimia aktif biologi dapat bersifat racun jika digunakan pada dosis yang tinggi, dengan demikian secara in vivo kematian suatu hewan percobaan dapat dipakai sebagai alat pemantau penapisan awal kandungan kimia aktif suatu bahan alam terhadap ekstrak, fraksi maupun isolate. Namun pengujian ini masih bersifat umum oleh karena itu perlu dilakukan uji lain yang lebih terarah untuk mengetahui aktivitas spesifiknya (Meyer, 1982)
Typhonii), serta melakukan uji toksisitas ekstrak n-heksan, ekstrak etilasetat, ekstrak etanol terhadap Artemia salina Leach dengan metode Brine Shrimp Lethality Test.
1.2 Perumusan Masalah
1. Monografi umbi keladi tikus belum terdapat pada Materia Medika Indonesia sehingga belum diketahui karakteristiknya.
2. Apakah umbi keladi tikus dapat disari sempurna dengan cara ekstraksi
bertingkat berdasarkan tingkat kepolarannya menggunakan pelarut n-heksan, etilasetat, dan etanol 96%.
3. Apakah ekstrak n-heksan, ekstrak etilasetat, ekstrak etanol dari umbi keladi tikus (tuber Typhonii) memiliki aktivitas biologi terhadap Artemia salina Leach. 1.3 Hipotesis
1. Karakteristik simplisia umbi keladi tikus dapat diperoleh dengan menggunakan prosedur Materia Medika Indonesia.
2. Umbi keladi tikus dapat disari sempurnadengan cara ekstraksi bertingkat berdasarkan tingkat kepolarannya menggunakan pelarut n- heksan, etilasetat, dan etanol 96%.
3. Ekstrak n-heksan, ekstrak etilasetat, ekstrak etanol dari umbi keladi tikus (tuber Typhonii) memiliki aktivitas terhadap Artemia salina Leach.
1.4 Tujuan Penelitian
2. Untuk mengetahui kandungan senyawa-senyawa kimia yang terdapat didalam umbi keladi tikus.
3. Untuk mengetahui perbedaan toksisitas ekstrak n- heksan, ekstrak etilasetat, dan ekstrak etanol dari umbi keladi tikus terhadap Artemia salina Leach.
1.5 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Sistematika Tumbuhan
Sistematika dari tumbuhan Keladi Tikus adalah sebagai berikut :
Divisio : Spermatophyta
Sub divisio : Gymnospermae
Classsis : Dicotyledonae
Ordo : Arales
Familia : Araceae
Genus : Typhonium
Spesies : Typhonium flagelliforme (Anonim, 2009)
2.1.2 Sinonim
Sinonim : Typhonium divaricatum
Coleus amboinicus Lour (Anonim, 2009)
2.1.3 Nama Daerah
Nama daerah dari tumbuhan Keladi tikus adalah: rodent tuber (Inggris); sek su (Cina); gofu sepa (Ternate); bira kecil, daun panta susu, ki babi, trenggiling, mentik, ileus, kalamoyang.
Tumbuh di tempat terbuka pada ketinggian 1000 meter di atas permukaan laut. Terdapat di Malaysia, Korea bagian selatan, dan Indonesia. Di Indonesia penyebarannya terdapat di sepanjang pulau Jawa, sebagian Kalimantan dan Sumatra dan Papua. (Harfia, 2006).
2.1.5 Morfologi
Tanaman keladi tikus adalah tanaman sejenis talas setinggi 25 cm hingga 30 cm, termasuk tumbuhan semak, menyukai tempat lembab yang tak terkena sinar matahari langsung. Tanaman berbatang basah ini biasanya tumbuh di tempat terbuka pada ketinggian 1000 meter di atas permukaan laut. Bentuk daun bulat dengan ujung runcing berbentuk jantung. Berwarna hijau segar. Umbi berbentuk bulat rata sebesar buah pala (Harfia, 2006).
2.1.6 Kandungan Kimia
Tanaman Keladi tikus Typhonium flagelliforme mengandung: Alkaloid, triterpenoid dan lignan (polifenol).
2.1.7 Khasiat Tumbuhan
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak larut dengan pelarut cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid, dan lain-lain. Dengan diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat (Ditjen POM, 2000).
Pemabagian metode ekstraksi menurut DitJen POM (2000) yaitu : A. Cara dingin
1. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar). Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif yang akan larut, karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dan di luar sel maka larutan terpekat didesak keluar.
2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna yang umumnya dilakukan pada temperatur ruangan. Proses terdiri dari tahapan pengembangan, tahap maserasi antara, tahap perkolasi sebenarnya terus-menerus sampai diperoleh ekstrak (perkolat). Cara perkolasi lebih baik
- Aliran cairan penyari menyebabkan adanya pergantian larutan yang terjadi dengan larutan yang konsentrasinya lebih rendah, sehingga meningkatkan derajat perbedaan konsentrasi.
- Ruangan diantara butir-butir serbuk simplisia membentuk saluran tempat mengalir cairan penyari. Karena kecilnya saluran kapiler tersebut, maka kecepatan pelarut cukup untuk mengurangi lapisan batas, sehingga dapat meningkatkan perbedaan konsentrasi.
B. Cara Panas 1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
2. Sokletasi
Sokletasi adalah ekstraksi dengan menggunakan pelarut yang selalu baru dan yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstrak kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
3. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-50 0C.
4. Infundasi
Infundasi adalah proses penyarian yang umumnya dilakukan untuk
5. Dekok
Dekok adalah infus pada waktu yang lebih lama dan temperatur sampai titik didih air, yakni 30 menit pada suhu 90-100 0C.
2.3 Uji Aktivitas Biologi
Dewasa ini penelitian terhadap senyawa aktif dari bahan alam sangat digalakkan. Tetapi banyak bahan-bahan obat alami yang telah diisolasi,
dikarakterisasi dan dipublikasikan tanpa dilanjutkan dengan uji aktivitas biologi. Aktivitas biologi tumbuhan tersebut tidak diketahui hingga bertahun-tahun. Hal ini disebabkan karena karena pencarian untuk senyawa yang memiliki aktivitas farmakologi sering menggunakan uji aktivitas dengan biaya yang mahal. Hambatan biaya ini mempengaruhi kegiatan farmakologis. Oleh karena itu di dibutuhkan suatu uji aktivitas yang secara umum sederhana, mudah dan murah namun dapat dipercaya dan dapat mendeteksi adanya senyawa yang mempunyai aktivitas biologi secara luas yang terdapat pada ekstrak, fraksi dan isolat (Rahman, 1991). Beberapa uji pendahuluan yang memenuhi syarat-syarat di atas antara lain: Metode Potato Disk, Brine Shrimp Lethality Test (BST) dan Uji terhadap Lemna minor L (McLaughlin, 1998).
2.3.1 Metode Potato Disk (menghambat tumor crown gall)
Crown gall adalah penyakit tumor pada tumbuhan yang ditimbulkan oleh
strain yang spesifik dari bakteri gram negatif Agrobacterium tumefaciens.
alami. Penghambatan pertumbuhan crown gall tumor pada potato disk oleh ekstrak alami, menunjukkan bahwa ekstrak bahan alami tersebut aktif (Mclaughlin, 1998).
2.3.2 Brine Shrimp Lethality Test
Senyawa bioaktif hampir selalu toksik pada dosis tinggi. Oleh karena itu daya bunuh in vivo dari senyawa terhadap organisme hewan dapat digunakan untuk menapis ekstrak tumbuhan yang mempunyai bioaktvitas dan juga untuk memonitor fraksi bioaktif selama fraksinasi dan pemurnian
Salah satu organisme yang sangat sesuai untuk hewan uji tersebut adalah brine shrimp (udang laut). Brine shrimp test sudah digunakan untuk berbagai sistem bioassay yaitu untuk menganalisa residu pestisida, mikotoksin, polutan pada air sungai, anastetik, toksin dinoflagelata senyawa yang berupa morfin, toksisitas pada dispersant minyak dan kokarsinogenik ester phorbol. Dalam fraksinasi yang diarahkan dengan bioassay, metode brine shrimp telah digunakan untuk memonitor fraksi aktif mikotoksin dan antibiotik pada ekstrak jamur (Meyer, 1982).
Artemia salina Leach adalah sejenis udang air asin. Telurnya merupakan
makanan ikan tropis dan telur tersebut dapat dijumpai di toko-toko yang menjual ikan hias tropis dengan nama brine shrimp eggs. Telur ini dapat bertahan selama bertahun-tahun dalam keadaan kering. Setelah ditempatkan dalam larutan air laut, telur-telur akan menetas dalam menetas dalam waktu 48 jam dan menghasilkan sejumlah nauplii. Nauplii Artemia salina Leach ini dapat dipakai sebagai alat yang baik untuk mendeteksi senyawa-senyawa yang memiliki aktivitas biologi
2.3.3 Uji Terhadap Lemna minor L.
Lemna minor L. adalah tumbuhan monokotil yang hidup di daerah
perairan. Pada kondisi normal, kondisi ini secara langsung menghasilkan anak daun. Jika ekstrak bahan alami dapat menghambat pertumbuhan dari anak daun tumbuhan Lemna minor L., maka ekstrak bahan alami tersebut dapat berkhasiat sebagai antitumor (McLaughlin, 1998)
2.3.4 Uji Terhadap cell line
Bahan alami yang telah dinyatakan aktif pada uji pendahuluan, selanjutnya dilakukan uji pada tahap berikutnya yaitu uji cell line. Uji ini menggunakan sel-sel kanker secara in vitro, zat-zat antikanker diuji langsung terhadap sel kanker. Contoh-contoh cell line yang banyak digunakan dalam pengujian zat-zat antikanker antara lain L-1210 (leukimia pada tikus), S-256 (sarcoma pada manusia) (McLaughlin, 1998).
2.4 Uraian Artemia salina Leach.
Artemia merupakan zooplankton yang diklasifikasikan ke dalam filum Arthropoda dan kelas Crustaceae. Secara lengkap sistematika artemia dapat dijelaskan sebagai berikut:
Filum : Arthropoda Kelas : Crustaceae Subkelas : Branchiophoda Ordo : Anostraca Famili : Artemiidae Genus : Artemia
Pada kondisi alamiah, artemia hidup di danau–danau dan perairan bersalinitas tinggi. Oleh karena itu, artemia disebut juga udang renik asin (brine shrimp). Secara fisik, artemia tidak mempunyai pertahanan tubuh, oleh karena itu
kemampuan hidup didanau dengan salinitas tinggi merupakan sistim pertahanan alamiah artemia terhadap musuh-musuh pemangsanya. Artemia dapat tumbuh baik pada temperatur 25-30oC.
Apabila telur artemia (udang laut) yang kering direndam dalam air laut, akan menetas dalam waktu 24-36 jam. Dalam cangkang keluar larva yang disebut dengan istilah nauplii. Dalam perkembangan selaaanjutnya, nauplii akan mengalami 15 kali perubahan bentuk (metamorfosis). Setiap kali mengalami perubahan bentuk merupakan satu tingkatan. Tahapan perkembangan pertama disebut instar I, bentuk lonjong dengan panjang sekitar 0,4 mm dan beratnya 15 µg/ml. Warnanya kemerah-merahan karena masih banyak mengandung cadangan makanan. Oleh karena itu masih belum perlu makan. Setelah 24 jam, nauplii akan berubah menjadi instar II. Pada tingkat ini nauplii mulai mempunyai mulut, saluran pencernaan, dan dubur. Oleh karena itu mereka mulai mencari makanan, dan bersamaan dengan itu cadangan makanannya pun mulai habis. Artemia mempunyai cara makan dengan jalan menyaring makanannya atau filter feeder. Selama perubahan terjadi, nauplii akan mengalami perubahan mata majemuk, antenna dan kaki. Setelah menjadi instar XV, kakinya sudah lengkap 11 pasang maka nauplii telah berubah menjadi nauplii Artemia dewasa. Proses ini
BAB III
METODOLOGI PENELITIAN
Metode yang digunakan adalah metode eksperimental meliputi pengumpulan dan pengolahan sampel, pemeriksaan karakteristik, pembuatan ekstrak, dan uji aktivitas ekstrak umbi keladi tikus menggunakan larva Artemia salina Leach.
2.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas laboratorium, pipet tetes, kertas saring, aluminium foil, kaca penutup, kaca objek, vial, bejana penetasan telur Artemia salina Leach, lampu 18 watt (Hannochs), cawan berdasar rata, botol bersumbat, krusen tang, seperangkat alat penetapan kadar air, cawan porselen, eksikator, mikroskop (Olympus), oven listrik (Stork), elektromantel (EM 2000), neraca analitik (Vibra AJ), dan penangas air (Yenaco).
2.2 Bahan-bahan
Bahan-bahan yang digunakan pada penelitian ini adalah umbi keladi tikus (tuber Typhonii), telur Artemia salina Leach (ISO), garam laut, ragi, aqua
bidestilata, Aquadest.
2.3 Pengumpulan dan Pengolahan Bahan Tumbuhan 2.3.1 Pengumpulan Bahan Tumbuhan
Pengumpulan sampel dilakukan secara purposif, yaitu tanpa membandingkan dengan daerah lain. Umur sampel yang diambil tidak
diperhitungkan. Sampel yang digunakan adalah tanaman dari umbi keladi tikus segar diambil dari UPT Matria Medica, Kota Batu, Jawa timur.
2.3.2 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Pusat Lembaga Ilmu Pengetahuan, Jakarta. Hasil identifikasi tumbuhan dapat dilihat pada lampiran 1 halaman 23. 2.3.3 Pengolahan Sampel
Sampel yang digunakan adalah umbi keladi tikus sebanyak 4 kg. Umbi keladi tikus dibersihkan dari kotoran dengan cara mencucinya dibawah air mengalir hingga bersih, ditiriskan kemudian ditimbang beratnya 1500 g. Setelah itu umbi keladi tikus di potong-potong, dirajang dan dikeringkan dilemari
pengering pada suhu 400C. Setelah kering, ditimbang beratnya 800 g kemudian di blender sampai menjadi serbuk.
2.4 Lokasi Penelitian
Penelitian dilakuk an di Laboratorium Farmakognosi Fakultas Farmasi Unversitas Sumatera Utara Medan.
2.5 Pembuatan Larutan Pereaksi 2.5.1. Larutan Pereaksi Asam Klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling hingga 100 ml (Ditjen POM, 1978).
Sebanyak 8,002 g natrium hidroksida dilarutkan dalam air suling bebas karbondioksida hingga 100 ml (Ditjen POM, 1978).
2.5.3. Larutan pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, kemudian dilarutkan dalam air suling, ditambahkan iodium sebanyak 2 g dan dicukupkan dengan air suling hingga 100 ml (Ditjen POM, 1978).
2.5.4. Larutan pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml. Pada wadah lain dilarutkan 5 g kalium iodida dalam 10 ml air suling. Kemudian keduanya dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM, 1978).
2.5.5. Larutan Pereaksi Dragendorff
Sebanyak 8 g bismut (III) nitrat ditimbang, kemudian dilarutkan dalam 20 ml asam nitrat pekat. Pada wadah lain dilarutkan 27,2 g kalium iodida dalam 50 ml air suling. Kemudian kedua larutan dicampurkan sama banyak dan didiamkan sampai memisah sempurna. Larutan yang jernih diambil dan diencerkan dengan air suling hingga 100 ml (Ditjen POM, 1978).
2.5.6. Larutan Pereaksi Besi (III) Klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100 ml (Ditjen POM, 1989).
2.5.7. Larutan Pereaksi Liebermann- Burchard
anhidrida dengan 1 bagian asam sulfat pekat dan 50 bagian kloroform. Larutan penyemprot ini harus dibuat baru (Harborne, 1987).
2.5.8. Larutan Pereaksi Molisch
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N hingga diperoleh volume 100 ml (Ditjen POM, 1978).
2.5.9. Larutan Air Kloroform
Sebanyak 2,5 ml kloroform dikocok dengan 900 ml air suling, encerkan dengan air suling hingga 1000 ml (Ditjen POM, 1995).
2.5.10. Larutan Kloralhidrat
Sebanyak 50 gram kloralhidrat ditimbang dan dilarutkan dalam 20 ml air suling (Ditjen POM, 1979).
2.5.11. Larutan Pereaksi Timbal (II) Asetat 0,4 N
Sebanyak 15,17 gram timbal (II) asetat dilarutkan dalam air suling bebas karbondioksida secukupnya hingga 100 ml (Ditjen POM, 1989).
2.5.12. Pereaksi Asam Nitrat 0,5 N
Sebanyak 3,4 ml asam nitrat pekat diencerkan dengan air suling hingga volume 100 ml (Ditjen POM, 1979).
2.6 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik dan mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total, dan penetapan kadar abu yang tidak larut dalam asam.
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk, warna, bau dan rasa umbi keladi tikus. Gambar simplisia umbi keladi tikus dapat dilihat pada lampiran 2 halaman 24.
2.6.2. Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia dengan cara menaburkan serbuk simplisia di atas kaca objek yang telah ditetesi dengan kloralhidrat dan aquadest kemudian ditutupi dengan cover glass (kaca penutup) setelah itu dilihat dibawah mikroskop. Gambar mikroskopik dapat dilihat pada lampiran 3 halaman 26.
2.6.3. Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen) ( WHO, 1992).
Cara kerja :
1. Penjenuhan toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu alas bulat, didestilasi selama 2 jam. Kemudian toluen didinginkan selama 30 menit dan volume air pada tabung penerima dibaca dengan 0,05 ml.
2. Penetapan kadar air simplisia
penerima dibiarkan dingin sampai suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen, dapat dilihat pada lampiran 4 halaman 27. 2.6.4. Penetapan kadar sari yang larut dalam air
Sebanyak 5 gram serbuk yang telah dikeringkan di udara dimaserasi selama 24 jam dengan 100 ml air-kloroform dalam labu bersumbat sambil berkali-kali dikocok selama 6 jam pertama kemudian dibiarkan selama 18 jam lalu disaring. Sejumlah 20 ml filtrat diuapkan hingga kering dalam cawan penguap berdasar rata yang telah ditara. Sisa dipanaskan pada suhu 105 0C sampai bobot tetap. Kadar sari larut dalam air dihitung dengan persen terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1989). Hasil perhitungan kadar sari yang larut dalam air dapat dilihat pada lampiran 4 halaman 28.
2.6.5. Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 gram serbuk yang telah dikeringkan di udara dimaserasi selama 24 jam dengan 100 ml etanol 96% dalam labu bersumbat sambil dikocok selama 18 jam. Kemudian disaring cepat untuk menghindari penguapan etanol 96%, sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan penguap berdasar rata yang telah ditara dan sisanya dipanaskan pada suhu 105 0C sampai bobot tetap. Kadar sari larut dalam etanol dihitung dalam persen terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1989). Hasil perhitungan kadar sari yang larut dalam etanol dapat dilihat pada lampiran 4 halaman 29.
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukkan ke dalam cawan porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 500 - 600° C selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (WHO, 1992). Hasil perhitungan kadar abu total dapat dilihat pada lampiran 4 halaman 30.
2.6.7. Penetapan kadar abu yang tidak larut dalam asam
Abu yang telah diperoleh dalam penetapan kadar abu total dididihkan dalam 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring dipijarkan sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang dikeringkan diudara (WHO, 1992). Hasil
perhitungan kadar abu yang tidak larut dalam asam dapat dilihat pada lampiran 4 halaman 31.
2.7 Skrining fitokimia
Skrining fitokimia serbuk simplisia meliputi pemeriksaan senyawa gologan alkaloid, flavonoida, glikosida, glikosida antrakinon, saponin,tanin, dan steroid/triterpenoida (Ditjen POM, 1989; Farnsworth, 1966). Hasil skrining fitokimia serbuk simplisia dapat dilihat pada lampiran 5 halaman 32. Skrining fitokimia ekstrak n-heksan, etilasetat dan etanol dilakukan dengan cara yang sama dengan skrining fitokimia serbuk simplisia.
Serbuk simplisia ditimbang sebanyak 0,5 g, kemudian ditambah 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit. Dinginkan dan disaring. Filtrat dipakai untuk percobaan berikut :
a. Filtat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Mayer, akan terbentuk endapan menggumpal berwarna putih atau kuning bila terdapat alkaloida.
b. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Bouchardat, akan terbentuk endapan berwarna coklat sampai hitam bila terdapat alkaloida.
c. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes pereaksi Dragendorf akan terbentuk warna merah atau jingga bila terdapat alkaloida.
2.7.2. Pemeriksaan Flavonoida
Sebanyak 10 g serbuk simplisia ditambah 100 ml air panas, dididihkan selama 5 menit dan saring dalam keadaan panas. Kedalam 5 ml filtrat
ditambahkan serbuk Magnesium, 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok kuat dan dibiarkan memisah.Bila terdapat flavonoida ditunjukkan dengan timbulnya warna merah, kuning atau jingga pada lapisan amil alkohol.
2.7.3. Pemeriksaan Saponin
Sebanyak 0,5 g serbuk simplisia, dimasukkan ke dalam tabung reaksi, ditambahkan 10 ml air panas, dinginkan kemudian dikocok selama 10 detik. Jika terbentuk busa setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan asam klorida 2 N bila adanya saponin.
Sebanyak 0,5 g serbuk simplisia, disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru atau hijau kehitaman bila adanya tanin.
2.7.5. Pemeriksaan Glikosida
Sebanyak 3 g serbuk simplisia disari dengan 30 ml campuran etanol 95% dengan air (7:3) dan 10 ml asam sulfat 2 N, direfluks selama 1 jam, didinginkan dan disaring. Pada 20 ml filtrat ditambahkan 25 ml air dan 25 ml timbal asetat 0,4 M, dikocok, diamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3), dilakukan sebanyak 3 kali. Kumpulan sari air diuapkan pada temperatur tidak lebih dari 50oC. Sisanya dilarutkan dalam 2 ml metanol. Larutan sisa dimasukkan dalam tabung reaksi selanjutnya, diuapkan di atas penangas air, pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molisch. Tambahkan hati- hati 2 ml asam sulfat pekat melalui dinding tabung, terbentuknya cincin ungu pada batas kedua cairan bila adanya gula.
2.7.6. Pemeriksaan Antrakinon
Sebanyak 0,2 g serbuk simplisia dicampur dengan 5 ml asam sulfat 2 N, dipanaskan sebentar, lalu didinginkan, ditambahkan 10 ml benzena, dikocok, didiamkan. Lapisan benzena dipisahkan dan disaring. Kocok lapisan benzena dengan 2 ml NaOH 2 N, diamkan. Lapisan air berwarna merah dan lapisan benzena tidak berwarna bila adanya glikosida antrakinon.
2.7.8. Pemeriksaan Steroida/triterpenoida
ditambahkan 2 tetes Liebermann-Burchard. Apabila terbentuk warna ungu atau merah berubah menjadi ungu atau biru hijau bila adanya steroida/triterpenoida.
2.8 Pembuatan Ekstrak
Cara kerja :
Sebanyak 200 gram umbi keladi tikus yang telah diserbukkan dimasukkan ke dalam bejana tertutup, lalu direndam dengan cairan penyari selama 3 jam. Kemudian massa dimasukkan ke dalam perkolator, lalu pelarut n-heksan dituang secukupnya sampai terdapat selapis larutan penyari diatas serbuk simplisia, mulut perkolator ditutup dengan plastik dan aluminium foil dan dibiarkan selama 24 jam. Setelah 24 jam keran perkolator dibuka dan cairan perkolat dibiarkan menetes dengan kecepatan 1 tetes per detik dan ditampung dalam botol berwarna bening. Perkolasi dihentikan setelah tetesan terakhir perkolat tidak berwarna lagi atau apabila sebanyak 500 mg cairan perkolat diuapkan di atas penangas air tidak meninggalkan sisa. Perkolat dipekatkan dengan bantuan alat penguap rotary evaporator pada temperatur tidak lebih dari 40 0C, lalu ampas dikeluarkan dari alat perkolator dan dikeringkan dengan cara diangin- anginkan selama 1 jam. Perkolasi dengan penyari etil asetat dan etanol dilakukan dengan cara yang sama. Bagan pembuatan ekstrak dapat dilihat pada lampiran 5 halaman 33.
2.9 Uji Toksisitas
Metode ini dilakukan terhadap ekstrak n-heksan, ekstrak etilasetat, ekstrak etanol dan fraksi ekstrak menggunakan larva Artemia salina Leach, yaitu sebagai berikut :
penetasan disekat menjadi dua bagian, yaitu bagian yang besar dan bagian yang kecil, lalu diberi lubang pada sekatnya. Setelah air laut sintetik dimasukkan ke dalam bejana, telur Artemia salina Leach ditaburkan ke dalam bagian yang kecil kemudian bagian atasnya ditutup dengan aluminium foil sedangkan bagian yang besar dibiarkan terbuka menghadap lampu. Setelah 48 jam, telur akan menetas menjadi larva dan siap digunakan untuk hewan uji. Disiapkan larutan uji yang terdiri dari ekstrak n-heksan, ekstrak etilasetat, ekstrak etanol dan fraksi ekstrak dengan konsentrasi : 1000, 100 dan 10 bpj, disiapkan 3 vial untuk masing-masing konsentrasi larutan uji sehingga semuanya menjadi 9 vial dan 1 vial untuk kontrol. Larutan induk I dibuat dengan menimbang 50 mg ekstrak lalu dilarutkan dengan pelarut yang sesuai sampai 5 ml sehingga diperoleh konsentrasi 10.000 bpj. Dari larutan induk I dipipet 0,5 ml lalu diencerkan sampai 5 ml sehingga diperoleh larutan induk II dengan konsentrasi 1000 bpj. Dari larutan induk II dipipet 0,5 ml lalu diencerkan sehingga diperoleh konsentrasi 100 bpj. Dari konsentrasi 100 bpj dipipet 0,5 ml lalu diencerkan sampai 5 ml sehingga diperoleh konsentrasi 10 bpj. Dimasukkan masing-masing larutan uji ke dalam vial, lalu pelarutnya dibiarkan menguap seluruhnya. Pada ekstrak n-heksan dan kontrolnya ditambahkan 1 ml suspensi Na-CMC. Dimasukkan kira-kira 3 ml air laut buatan ke dalam masing-masing vial. Dimasukkan 10 ekor larva Artemia salina Leach, lalu ditambahkan air laut sintetik sampai 5 ml. Ditambahkan 1 tetes suspensi ragi sebagai
BAB IV
HASIL DAN PEMBAHASAN
Hasil identifikasi yang dilakukan oleh Pusat lembaga Ilmu Pengetahuan Indonesia (LIPI) – Pusat Penelitian dan Pengembangan Biologi – Bogor terhadap keladi tikus yang diteliti adalah keladi tikus (Typhonium flagelliforme) suku Araceae.
Hasil pemeriksaan secara makroskopik yang dilakukan terhadap umbi keladi tikus (tuber Typhonii) yaitu berwarna coklat muda, bentuk tidak beraturan dan kecil-kecil, bau seperti tikus.
Hasil pemeriksaan secara mikroskopik yang dilakukan terhadap serbuk simplisia umbi keladi tikus terlihat hilus, butir pati, dan Ca. Oksalat bentuk jarum. Tabel 1: Hasil karakterisasi simplisia
Hasil pemeriksaan karakteristik serbuk simplisia umbi keladi tikus (tuber Typhonii) diperoleh kadar air 7,99%, hal ini disebabkan sampel memiliki
kandungan air yang banyak. Kadar sari yang larut dalam air 5,44%, ini
menunjukkan bahwa umbi keladi tikus banyak mengandung senyawa-senyawa
No Karakteristik Simplisia Kadar (%)
1 Kadar air 7,99 %
2 Kadar sari yang larut dalam air 5,44 % 3 Kadar sari yang larut dalam etanol 16,59 %
4 Kadar abu total 3,62 %
yang larut dalam air. Kadar sari yang larut dalam etanol 16,59%, ini menunjukkan bahwa umbi keladi tikus banyak mengandung senyawa-senyawa yang larut dalam lemak dan juga senyawa yang larut dalam air. Kadar abu total 3,62%, ini
menunjukkan bahwa kadar abu total umbi keladi tikus sangat sedikit. Kadar abu yang tidak larut dalam asam 0,43%, ini menunjukkan bahwa umbi keladi tikus mengandung cukup banyak senyawa anorganik yang tidak larut dalam asam. Tabel 2 : Hasil skrining fitokimia
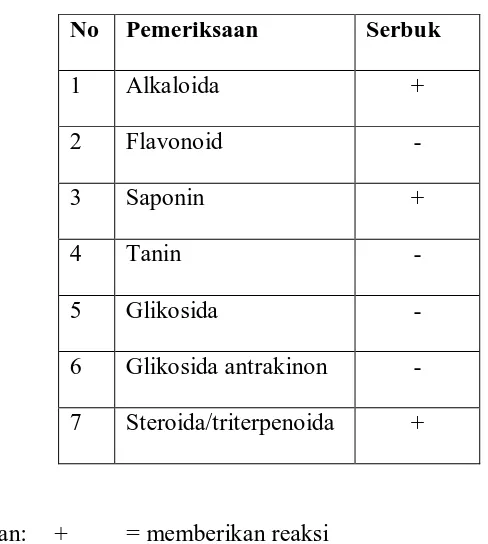
No Pemeriksaan Serbuk
1 Alkaloida +
2 Flavonoid -
3 Saponin +
4 Tanin -
5 Glikosida -
6 Glikosida antrakinon - 7 Steroida/triterpenoida +
Keterangan: + = memberikan reaksi - = tidak memberikan reaksi
Hasil skrining fitokimia serbuk simplisia umbi keladi tikus menunjukkan bahwa umbi keladi tikus mengandung senyawa kimia golongan alkaloid, saponin, steroida/triterpenoida.
umbi keladi tikus diperoleh ekstrak n-heksan sebanyak 2,576 g, ekstrak etilasetat sebanyak 0,715 g dan ekstrak etanol sebanyak 10,132 g.
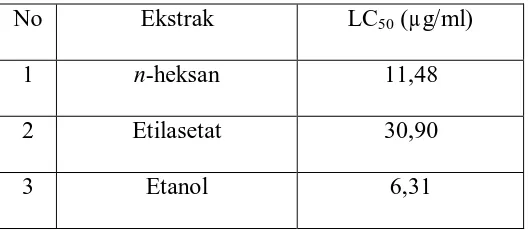
Tabel 9: Hasil Uji Toksisitas
Harga LC50 yang diperoleh dari hasil uji toksisitas ekstrak n-heksan, ekstrak etilasetat dan ekstrak etanol menunjukkan bahwa ketiga ekstrak tersebut bersifat toksik terhadap Artemia salina Leach. Ekstrak dikatakan bersifat toksik atau memiliki aktivitas biologi terhadap Artemia salina Leach (Brine shrimp) apabila memiliki LC50 < 1000 µg/ml (Meyer at al., 1982)
Harga LC50 ekstrak etanol yaitu 6,31µg/ml menunjukkan bahwa ekstrak etanol ini lebih toksik, hal ini disebabkan oleh adanya kandungan senyawa golongan saponin yang memberikan efek sinergis sehingga menghasilkan toksisitas yang lebih kuat dibandingkan dengan ekstrak n-heksan dan ekstrak etilasetat. Saponin bersifat racun karena dapat mengakibatkan hemolisa darah serta alkaloid mempunyai aktivitas.
No Ekstrak LC50 (µg/ml)
1 n-heksan 11,48
2 Etilasetat 30,90
BAB V
KESIMPULAN DAN SARAN
4.1. Kesimpulan
Hasil pemeriksaan makroskopik yang dilakukan terhadap umbi keladi tikus yaitu berwarna coklat muda, berbentuk tidak beraturan dan kecil-kecil, mempunyai bau khas seperti bau tikus. Hasil pemeriksaan mikroskopik yang dilakukan terhadap serbuk simplisia umbi keladi tikus yaitu terlihat hilus, butir pati, dan Ca. Oksalat bentuk jarum.
Hasil pemeriksaan karakteristik serbuk simplisia umbi keladi tikus
diperoleh kadar air 7,99%, kadar sari yang larut dalam air 5,44 %, kadar sari yang larut dalam etanol 16,59 %, kadar abu total 3,62 % dan kadar abu yang tidak larut dalam asam 0,43 %.
Hasil penapisan fitokimia terhadap serbuk simplisia umbi keladi tikus mengandung senyawa kimia golongan alkaloid, saponin, dan
steroida/triterpenoida. Hasil penapisan fitokimia terhadap ekstrak n-heksan umbi keladi tikus terdapat senyawa steroida/triterpenoida. Penapisan fitokimia terhadap ekstrak etilasetat umbi keladi tikus terdapat senyawa kimia golongan alkaloid. Sedangkan penapisan fitokima terhadap ekstrak etanol umbi keladi tikus terdapat senyawa kimia golongan alkaloid, saponin.
4.2. Saran
DAFTAR PUSTAKA
Anonim. (2009). Keladi tikus.CCRC Farmasi UGM. Tanggal akses 20 Februari 2010.www.ugm.ac.id/ccrc.
Anonim, (2010). Telur Pindang. Institut Pertanian Bogor. Tanggal akses 05 Mei 2010 Ditjen POM. (1978). Materia Medika Indonesia. Jilid II. Departemen Kesehatan
RI. Jakarta. Halaman 150 – 156, 165 – 167.
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Departemen Kesehatan RI. Jakarta. Halaman 33 – 34, 696.
Ditjen POM. (1986). Sediaan Galenik. Jilid II. Departemen Kesehatan RI. Jakarta. Halaman 19 - 22.
Ditjen POM. (1989). Materia Medika Indonesia. Jilid V. Departemen Kesehatan RI. Jakarta. Halaman 516, 518, 522.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Departemen Kesehatan RI. Jakarta. Halaman 925.
Farnsworth, N. (1966). Biological and Phytochemical Screening of Plant. Journal of Pharmaceutical Sciences. 55(3): 262 - 263.
Harborne, J.B. (1987). Metode Fitokimia, Penuntun Cara Modern Menganalisa Tumbuhan.Terjemahan K. Padmawinata. Edisi II. Bandung: ITB Press. Halaman 76.
Harfia, M., (2006), Uji Aktivitas Ekstrak Etanol 50% Umbi Keladi Tikus (Typhonium flagelliforme (Lood) Bl) terhadap Sel Kanker Payudara (MCF-7 Cell line) secara In-Vitro, Puslitbang Biomedis dan Farmasi, Badan Litbang Kesehatan.
Hariana, A.H. (2007). Tumbuhan Obat dan Khasiatnya. Seri 2. Jakarta. Halaman 23 – 24.
McLaughlin, J.L., Rogers,L.L. (1998). The Use Of Biological Assays To Evaluate Botanicals. Drug Information Journal. Pages 513 - 517
Permadi, A.H., Meer, P.Q. (1992). Prosea Foundation Plant Resources of South-East Asia Vegetable. Plant Resources Of South-South-East Asia. Journal Of Ethnopharmacology.(12)2. Bogor-Indonesia
Rodrigues A., Fogliano V., Graziani G., Mendes, S., Vale, A. and Goncalves, C., 2003. Nutrition Value of Onion Regional Varieties in Northwest Portugal, EJEAFChe 2(4). Pages 519 - 524.
Stahl, E. (1985). Analisis Obat Secara Kromatografi dan Mikroskopik. Penerjemah: Padmawinata, K. Dan Soediro. Penerbit ITB. Bandung. Halaman 252.
Lampiran 2
Gambar 1: Tanaman Keladi tikus segar (Typhonium flagelliforme)
Gambar 2: Umbi keladi tikus (Tuber Typhonii) Lampiran 2 (lanjutan)
Gambar 3: Simplisia umbi keladi tikus
Lampiran 4. Bagan Kerja
a. Bagan pengolahan simplisia
dicuci dengan air kran mengalir ditiriskan
ditimbang
Dipotong – potong, lalu dirajang
dikeringkan di dalam lemari pengering dengan suhu 40-50 0C ditimbang
dihaluskan dengan menggunakan blender
Umbi keladi tikus segar
Berat basah umbi keladi tikus = 1500 g
Berat kering umbi keladi tikus = 800 g
Serbuk simplisia umbi keladi tikus
Ekstraksi Karakterisasi simplisia : - Kadar air
- Kadar sari larut dalam etanol - Kadar sari larut dalam air - Kadar abu total
Skrining fitokimia : -Alkaloida
Lampiran 4 (lanjutan)
b. Bagan ekstraksi serbuk simplisia secara perkolasi
diperkolasi dengan n-heksan
diperkolasi dengan etilasetat dipekatkan
diperkolasi dengan etanol dipekatkan
dipekatkan
Serbuk simplisia
Ampas Perkolat
Ampas perkolat Ekstrak kental n-heksan
Ampas Perkolat
Ekstrak kental etilasetat
Uji BST
Ekstrak kental etanol
Lampiran 7. Data Persen Kematian Nauplii
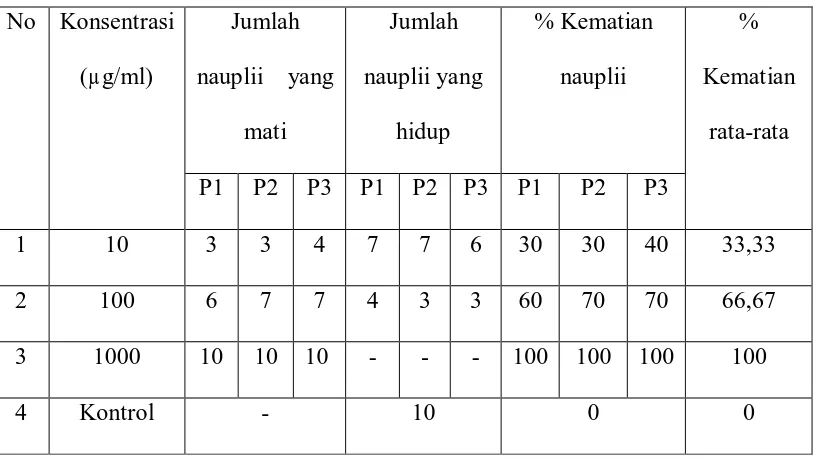
Tabel 3: Data Persen Kematian Nauplii Ekstrak n-Heksan No Konsentrasi
Lampiran 7 (lanjutan)
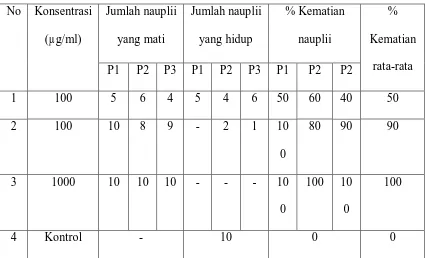
Tabel 5: Data Persen Kematian Nauplii Ekstrak Etanol No Konsentrasi
(µg/ml)
Jumlah nauplii yang mati
Jumlah nauplii yang hidup
% Kematian nauplii
% Kematian
rata-rata P1 P2 P3 P1 P2 P3 P1 P2 P2
1 100 5 6 4 5 4 6 50 60 40 50
2 100 10 8 9 - 2 1 10
0
80 90 90
3 1000 10 10 10 - - - 10 0
100 10 0
100
Lampiran 8. Perhitungan Uji Bioassay 1. Perhitungan Persentase Kematian
Persentase Kematian =
(
)
X100%Total Kontrol Tes−
Tes = Jumlah kematian nauplii larutan uji Kontrol = Jumlah kematian nauplii larutan kontrol Total = Jumlah nauplii yang digunakan
2. Perhitungan Harga LC50
Menggunakan Analisa Regresi Linear.
2.1. Perhitungan harga LC50 untuk ekstrak n-heksan
Konsentrasi yang digunakan adalah 10, 100 dan 1000 µg/ml
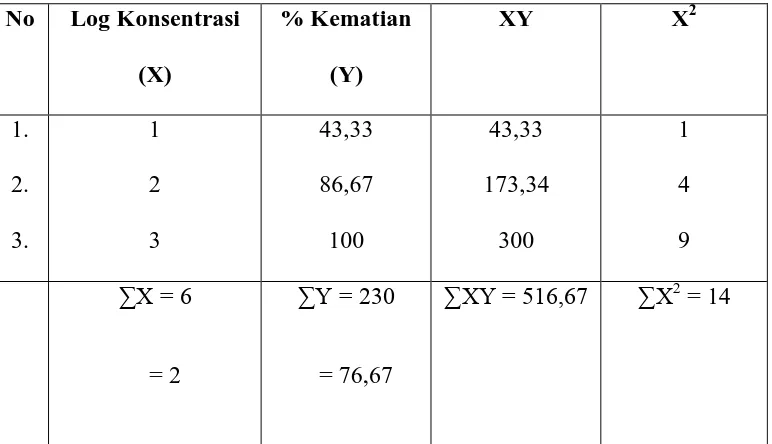
Tabel 6: Perhitungan harga LC50 ekstrak n-heksan menggunakan metode Analisa Regresi Linear
Lampiran 8 (lanjutan) X = log konsentrasi
Lampiran 8 (lanjutan)
2.2. Perhitungan harga LC50 untuk ekstrak etilasetat
Konsentrasi yang digunakan adalah 10, 100 dan 1000 µg/ml
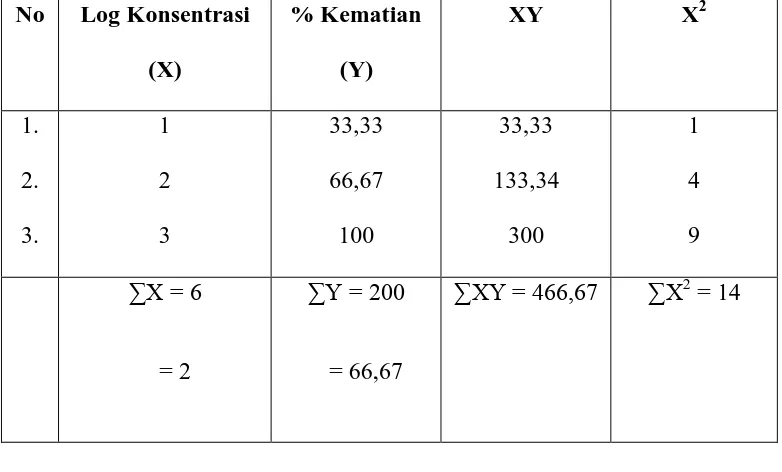
Tabel 7: Perhitungan harga LC50 ekstrak etil-asetat menggunakan metode Analisa Regresi Linear
No Log Konsentrasi (X) Y = konsentrasi kematian
X = log konsentrasi
=
2 67 , 66
Lampiran 8 (lanjutan) = 33,335 b = Y - aX
= 66,67 – 33,335 . 2 = 66,67 – 66,67 = 0
Y = aX + b = 33,335 X Untuk Y = 50
50 = 33,335X
X =
335 , 33
50
= 1,49
Lampiran 8 (lanjutan)
2.3. Perhitungan harga LC50 untuk ekstrak etanol
Konsentrasi yang digunakan adalah 10, 100 dan 1000 µg/ml
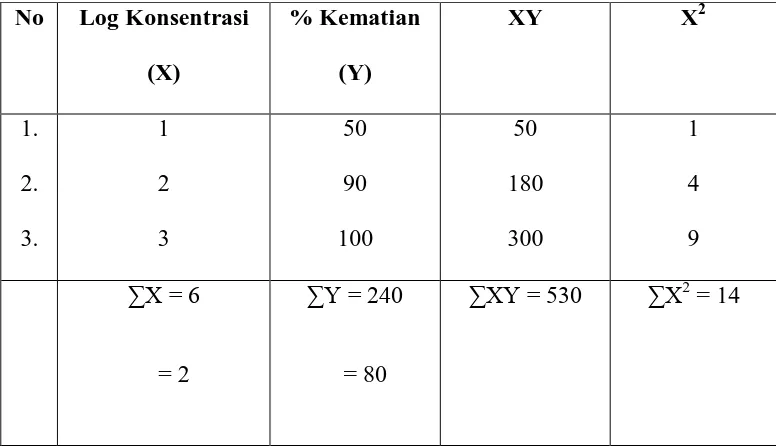
Tabel 8: Perhitungan harga LC50 ekstrak etanol menggunakan metode Analisa Regresi Linear
No Log Konsentrasi (X) Y = konsentrasi kematian
X = log konsentrasi
=
2 50
Lampiran 8 (lanjutan) = 25
b = Y - aX
= 80 – 25 . 2 = 30
Y = aX + b = 25x – 30 Untuk Y = 50
50 = 25 X – 30
X =
25 30 50−
X = 0,8