INDUKSI VARIASI SOMAKLONAL DAN SELEKSI IN VITRO
KALUS EMBRIOGENIK JAHE (Zingiber officinale Rosc.)
MENGGUNAKAN FILTRAT BAKTERI Ralstonia solanacearum
UNTUK KETAHANAN TERHADAP BAKTERI LAYU
MEYNARTI SARI DEWI IBRAHIM
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis dengan judul Induksi Variasi
Somaklonal dan Seleksi In Vitro Kalus Embriogenik Jahe (Zingiber officinale Rosc.)
Menggunakan Filtrat Bakteri Ralstonia solanacearum Untuk Ketahanan Terhadap
Bakteri Layu adalah karya saya dengan arahan dari komisi pembimbing dan belum
diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi
yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah
disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka pada akhir tesis ini.
Bogor, Februari 2009
Meynarti Sari Dewi Ibrahim
NRP A151060051
ABSTRACT
Meynarti Sari Dewi Ibrahim. Somaclonal variation induction and embryogenic callus in vitro selection of ginger (Zingiber officinale Rosc.) using Ralstonia solanacearum filtrate for bacterial wilt resistance. Supervised by Dr.Ir. Nurul khumaida, MSi. as chairman, Dr. Otih Rostiana MSc, and Dr.Ir. SupriadiMSc. as members. incompatibility, and low pollen fertility that cause difficulty in conventional cross breeding. Therefore, genetic variability enhancement has to be carried out to obtain ginger variety resistant to diseases. Somaclonal variation induction during the in vitro callus culture especially by applying selective medium as bacterial filtrate, could be effective method for generating somaclones resistant to certain diseases. In this study, R. solanacearum filtrate was applied as selective medium for ginger callus culture. The purposes of this study were obtaining (1) the concentration of R. solanacearum filtrate which could induce and selective embryogenic calli variability in ginger and (2) new resistant calli variant. This research was conducted in 5 stages: 1) the induction of embryogenic calli, 2) the analysis of embryogenic calli, 3) the induction of ginger calli resistance against bacterial wilt through stratified selective medium approach (filtrate concentration 0-50%), 4) the analysis of calli salicylic acid content, and 5) the histological analysis of selected calli. The use of R. solanacearum filtrate as selection agent in ginger in vitro culture medium has caused changes in calli color from yellowish-white into blackish-brown. The increase of R. solanacearum filtrate concentration at the 1st and 2nd selection stages decreased the calli weight and diameter, globular embryo number and torpedo embryo number. The calli histological analysis showed the damage symptom especially in calli protoderm layer. The increase of R. solanacearum filtrate concentration has caused the increase of calli salicylic acid content. The consentration of R. solanacearum filtrat at 0.3% - 2% at the 1st selection mediumand 3% - 20% at the 2nd selection could induce and select the resistant embryogenic calli of ginger.
RINGKASAN
MEYNARTI SARI DEWI IBRAHIM. Induksi Variasi Somaklonal dan Seleksi In Vitro Kalus Embriogenik Jahe (Zingiber officinale Rosc.) Menggunakan Filtrat
Bakteri Ralstonia solanacearum Untuk Ketahanan Terhadap Bakteri Layu.
Dibimbing oleh Dr.Ir.Nurul Khumaida, MSi, Dr.Otih Rostiana, MSc. dan
Dr.Ir.Supriadi, MSc.
Penyakit layu bakteri yang disebabkan oleh Ralstonia solanacearum
merupakan salah satu penyakit penting pada tanaman jahe (Zingiber officinale Rosc.) yang seringkali menyebabkan kehilangan hasil. Berbagai teknik pengendalian, baik dengan menggunakan antibiotik (agrimicin, agrept), mikroba antagonis (Bacillus subtillis, Pseudomonas fluorescens, P. putida, P. cepacia) maupun kultur teknis anjuran, belum mampu mengatasi kendala tersebut secara optimal. Hal ini dikarenakan belum ada varietas jahe tahan terhadap R. solanacearum. Kendala utama untuk memperoleh varietas jahe tahan terhadap R. solanacearum adalah terbatasnya sumber gen ketahanan (narrow genetic stock) dan hambatan fisiologis karena adanya sifat inkompatibilitas sendiri (self-incompatibility), serta rendahnya fertilitas polen sehingga persilangan konvensional sulit dilakukan. Karena itu upaya untuk memperoleh varietas jahe tahan penyakit perlu dilakukan dengan meningkatkan ketahanan secara inkonvensional. Induksi variasi somaklonal dan seleksi in vitro kalus embriogenik menggunakan filtrat merupakan salah satu metode yang dapat
digunakan untuk meningkatkan ketahanan. Tujuan Penelitian adalah ; (1)
Mendapatkan konsentrasi filtrat R. solanacearum yang dapat menginduksi dan menyeleksi ketahanan kalus embriogenik jahe, dan (2) Mendapatkan varian kalus baru yang memiliki ketahanan terhadap filtrat R. solanacearum.
Penelitian dilaksanakan lima tahap. Tahap 1 dilakukan untuk mendapatkan kalus embriogenik, tahap 2 menganalisis kalus embriogenik, tahap 3 untuk menginduksi dan menyeleksi ketahanan kalus jahe terhadap penyakit layu bakteri yang dilakukan dengan menggunakan medium selektif secara bertingkat (konsentrasi filtrat 0 - 50%), tahap 4 menganalisis kandungan asam salisilat pada kalus, dan tahap 5 menganalisis histologi kalus.
Sebanyak 300 meristem (inner shoot bud) dari mata tunas aksilar jahe putih besar var. Cimanggu-I berumur 3 minggu digunakan sebagai sumber eksplan. Kalus embriogenik diinduksi dengan mengkulturkan meristem aseptik di dalam medium MS (Murashige and Skoog) dengan penambahan 2% sukrosa, 100 mg/l glutamin, 1,0 mg/l 2,4-D dan 3,0 mg/l BA. Kalus embriogenik yang berumur 8 minggu lalu disubkultur ke media yang sama untuk memperoleh kalus embriogenik dalam kuantitas yang cukup banyak dan respon induksi kalus embriogenik yang lebih seragam. Kalus ini digunakan pada tahapan seleksi dengan menggunakan filtrat bakteri R. solanacearum.
Kalus kemudian disubkultur ke media seleksi tahap kedua dengan konsentrasi filtrat; 0%, 1%, 2%, 3%, 4%, 5%, 10%, 20%, 30%, 40%, dan 50%. Kalus yang bertahan hidup disubkultur kembali ke dalam medium MS (tanpa filtrat). Masing-masing tahapan seleksi dilakukan selama 3 minggu.
Analisis histologi kalus dilakukan dengan menggunakan metode Nakamura (1995). Histologi kalus dilakukan pada saat sebelum dan setelah seleksi kalus dengan filtrat R. solanacearum (setelah tahapan pemulihan kedua). Sementara kandungan asam salisilat dilihat pada saat kalus telah diperlakukan dengan filtrat R. solanacearum. Analisis kandungan asam salisilat dalam jaringan kalus ditentukan
dengan metode Bevilacgua & Califano (1989) menggunakan HPLC (High
Performance Liquid Chomography).
Peubah yang diamati meliputi: Jumlah kalus yang terbentuk (%), morfologi kalus, bobot segar kalus, diameter kalus, kematian kalus, histologi kalus dan kandungan asam salisilat. Penelitian menggunakan Rancangan Acak Lengkap (RAL) dengan 10 ulangan. Rancangan perlakuan yang digunakan adalah faktor tunggal, yaitu konsentrasi filtrat bakteri patogen (R. solanacearum). Pengujian hipotesis dilakukan dengan uji F pada taraf 5%. Sebagai uji lanjut dari uji F, digunakan Uji Jarak Berganda Duncan (UJGD) pada taraf 5%.
Hasil penelitian memperlihatkan penggunaan filtrat R. solanacearum di dalam medium kultur in vitro jahe pada seleksi tahap pertama dan kedua menyebabkan terjadinya perubahan warna kalus dari putih kekuningan menjadi kuning kecoklatan dan coklat kehitaman. Berat dan diameter kalus, jumlah embrio globularsertajumlah embrio torpedo berkurang secara nyata setelah perlakuan filtrat R. solanacearum pada seleksi tahap pertama maupun kedua seiring dengan bertambah tingginya konsentrasi filtrat R. solanacearum.
Hasil histologi kalus memperlihatkan bahwa kalus yang diberi perlakuan filtrat R. solanacearum 40% dan 50% menunjukkan adanya gejala kerusakan (nekrosis). Kerusakan terutama tampak pada bagian lapisan protroderm kalus. Kandungan asam salisilat dalam kalus meningkat sejalan dengan meningkatnya konsentrasi filtrat R. solanacearum yang diberikan dengan kandungan asam salisilat tertinggi (75,27 ppm) dijumpai pada perlakuan filtrat 50% dan terendah (41,15) pada media tanpa perlakuan filtrat.
Berdasarkan perbedaan morfologi kalus (warna kalus), perubahan fisiologis sel (pengerutan sel dan sel nekrosis), perubahan karakter kuantitatif (jumlah embrio globular, jumlah embrio torpedo), dan perubahan biokimia (kandungan asam salisilat) pada kalus setelah diperlakukan dengan filtrat R.solanacearum diduga telah diperoleh varian-varian kalus baru yang tahan filtrat R.solanacearum.
Konsentrasi filtrat R. solanacearum yang mampu menginduksi dan
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan
atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian,
penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau
tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumpulkan dan memperbanyak sebagian atau seluruh karya tulis
INDUKSI VARIASI SOMAKLONAL DAN SELEKSI IN VITRO
KALUS EMBRIOGENIK JAHE (Zingiber officinale Rosc.)
MENGGUNAKAN FILTRAT BAKTERI Ralstonia solanacearum
UNTUK KETAHANAN TERHADAP BAKTERI LAYU
MEYNARTI SARI DEWI IBRAHIM
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Departemen Agromomi dan Hortikultura
Judul Tesis : Induksi Variasi Somaklonal dan Seleksi In Vitro Kalus Embriogenik
Jahe (Zingiber officinale Rosc.) Menggunakan Filtrat Bakteri
Ralstonia solanacearum Untuk Ketahanan Terhadap Bakteri Layu
Nama : Meynarti Sari Dewi Ibrahim
Nomor Pokok : A151060051
Disetujui
Ketua Komisi Pembimbing
Dr.Ir. Nurul Khumaida, MSi. Ketua
Dr.Otih Rostiana, MSc. Dr.Ir.Supriadi, MSc.
Anggota Anggota
Diketahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr.Ir.Munif Ghulamahdi, MS. Prof.Dr.Ir.Khairil A.Notodiputro, MS.
PRAKATA
Syukur Alhamdulillah penulis panjatkan ke hadirat Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan karya ilmiah yang menjadi tugas Studi Magister pada program Studi Agronomi, Institut Pertanian Bogor.
Penghargaan dan ucapan terima kasih yang sebesar-besarnya penulis sampaikan kepada Ibu Dr.Ir.Nurul Khumaida MSi, Ibu Dr.Otih Rostiana, MSc, dan Bapak Dr.Ir.Supriadi, MSc. Selaku pembimbing yang telah banyak meluangkan waktu memberikan masukan dan saran baik selama persiapan dan pelaksanaan penelitian maupun penulisan hasilnya. Ucapan terima kasih juga penulis sampaikan kepada Bapak Dr.Ir.Darda Efendi, MSi yang telah memberikan masukan dan saran yang sangat berarti untuk perbaikan karya tulis ini. Di samping itu penulis menyampaikan terimakasih kepada Ibu Dr.Ir.Yulianti, MSc., Dra. Siti Fatimah Syaid, teman-teman Pascasarjana angkatan 2006, seluruh staf Laboratorium Kultur Jaringan dan Penyakit Balai Penelitian Tanaman Obat dan Aromatik, staf Laboratorium Pengujian Balai Besar Pasca Panen, dan staf Laboratorium Mikrotehknik Departemen Biologi, Fakultas MIPA, IPB yang telah membantu dalam menyelesaikan penelitian ini.
Penulis menyampaikan terima kasih kepada Badan Litbang Pertanian, Departemen Pertanian RI yang telah memberikan kesempatan dan beasiswa kepada penulis untuk melanjutkan studi pada program Magister di sekolah Pascasarjana IPB. Terimakasih yang mendalam penulis sampaikan kepada ibunda Siti Nadra Sikumbang dan ayahanda Ibrahim Sulaiman yang selalu mendoakan ananda. Khusus buat suami tercinta Abdul Majid dan Anak-anakku tersayang; Syarifah Meutiah Eka Sari, Said Abdul Razaek, dan Said Muhammad Iqbal penulis mengucapkan terimakasih atas pengorbanan yang begitu besar, dorogan semangat, motivasi dan doa agar Tesis ini dapat terujud.
RIWAYAT HIDUP
Penulis dilahirkan di Sibolga pada tanggal 19 Mei 1971 sebagai anak tunggal
dari pasangan Ibrahim Sulaiman dan Siti Nadra Sikumbang. Pendidikan Sarjana
ditempuh penulis di Program Studi Pemuliaan Tanaman, Jurusan Budidaya Pertanian,
Fakultas Pertanian, Universitas Sumatera Utara pada tahun 1989 dan lulus tahun
1994. Pada tahun 2006 penulis mendapatkan beasiswa pendidikan dari Badan Litbang
Pertanian, Departemen Pertanian untuk melanjutkan studi di Program Studi
Agronomi, Program Pascasarjana IPB.
Penulis mulai bekerja sebagai peneliti di Balai Penelitian Tanaman Rempah
dan Obat (Bogor) pada tahun 1995. Bidang penelitian yang ditekuni penulis selama
bekerja adalah bidang pemuliaan tanaman. Sejak tahun 2007 sampai sekarang penulis
bekerja di Balai Penelitian Tanaman Rempah dan Aneka Tanaman Industri
(Sukabumi).
Pada tahun 1995 penulis menikah dengan Abdul Majid dan dikaruniai tiga
orang anak, yaitu Syarifah Meutiah Eka Sari (12 th), Said Abdul Razaek (10 th), dan
IV.HASIL DAN PEMBAHASAN….……….……… 29
Induksi Kalus Embriogenik...………...…… 29
Seleksi Kalus dengan Filtrat Bakteri (R. solanacearum)…...………. 32
Morfologi Kalus... 32
Bobot Segar Kalus... 39
Diameter Kalus... 40
Jumlah Embrio Globular... 43
Jumlah Embrio Torpedo... 44
Kematian Kalus... 47
Histologi Kalus ………...………...……... 48
Kandungan Asam Salisilat...…...……….... 50
Pembahasan Umum... 52
V. KESIMPULAN DAN SARAN ...………... 59
Kesimpulan... 59
Saran... 60
DAFTAR PUSTAKA... 61
DAFTAR TABEL
Tabel Halaman
1. Perlakuan Seleksi Filtrat R. solanacearum Pada Kultur Kalus Jahe... 23
2. Penetapan Angka Kematian Kalus Perbotol Kultur... 28
3. Tahapan Perkembangan Kalus Meristem Jahe... 29
4. Persentase Pembentukan Kalus embriogenik Setelah Subkultur... 31
5. Keragaan kalus Jahe Pada Medium Seleksi Tahap 1... 33
DAFTAR GAMBAR
Gambar Halaman
1. Bagan Alir Penelitian...……... 5
2. Keragaan Tanaman jahe (Zingiber offinale Rosc)... 7
3. Proses pertumbuhan embriogenesis somatik kultur Meristem Jahe... 11
4. Tahapan isolasi eksplan meristem jahe... 25
13. Rataan Diameter Kalus Jahe Setelah Seleksi Tahap 1... 41
14. Rataan Diameter Kalus Jahe Setelah Seleksi Tahap 2... 42
15. Keragaan Diameter Kalus Jahe Setelah Seleksi Tahap 2... 42
16. Rataan Jumlah Embrio Globular Setelah seleksi tahap 1... 43
17. Rataan Jumlah Embrio Globular Setelah seleksi tahap 2... 44
18. Rataan Jumlah Embrio Torpedo Jahe Setelah Seleksi Tahap 1... 45
19. Keragaan Kalus Embriogenik Jahe pada perlakuan Filtrat... 45
20. Rataan Jumlah Embrio Torpedo Jahe Setelah Seleksi Tahap 2... 46
21. Rataan Nilai Kematian Kalus Jahe... 47
22. Penampang membujur jaringan meristem jahe... 48
23. Penampang membujur kalus embriogenik jahe umur 10 minggu... 49
24. Penampang membujur embrio globular dan Torpedo... 50
25. Keragaan Kalus Nekrosis... 50
DAFTAR LAMPIRAN
Lampiran Halaman
1. Tahapan perkembangan tunas dari embriosomatik hasil seleksi ... 70
2. Mekanisme resistensi melalui Systemic Acuired Resistance (SAR)... 71
3. Formulasi Media MS... 72
4. Deskripsi Jahe... 73
5. Prosedur Histologi Jaringan... 74
6. Sidik ragam bobot kalus setelah seleksi tahap 1... 75
7. Sidik ragam diameter kalus setelah seleksi tahap 1... 75
8. Sidik ragam jumlah embrio globular setelah seleksi tahap 1... 75
9. Sidik ragam jumlah embrio torpedo(transformasi) setelah seleksi tahap 1.. 76
10.Sidik ragam bobot kalus setelah seleksi tahap 2... 76
11.Sidik ragam diameter kalus setelah seleksi tahap 2... 76
12.Sidik ragam jumlah embrio globular setelah seleksi tahap 2... 77
I. PENDAHULUAN
Latar Belakang
Jahe (Zingiber officinale Rosc.) merupakan salah satu komoditas ekspor dan di
dalam negeri digunakan untuk bahan baku obat tradisional maupun fitofarmaka.
Komoditas ini juga berperan cukup berarti dalam penyerapan tenaga kerja dan
penerimaan devisa negara. Dalam sepuluh tahun terakhir, ekspor jahe dari Indonesia
berupa rimpang jahe segar, jahe kering, acar jahe (pikel), dan minyak atsiri,
berfluktuasi sangat tajam.
Sebagian besar (50%) pasokan jahe di pasaran dunia saat ini dikuasai oleh
India. Pada tahun 2004, produksi jahe nasional (104.789 ton) mengalami penurunan
sebesar 20.597 ton jika dibandingkan tahun 2003 (125.386 ton), walaupun pada
tahun 2005 jumlahnya sedikit meningkat (125.827) ton. Penurunan produksi tersebut
terutama disebabkan oleh turunnya produksi di sentra pengembangan jahe utama
(Jawa Barat) akibat serangan organisme pengganggu tanaman (OPT) dan budidaya
yang kurang optimal. Tahun 2006 produksi nasional naik menjadi 177.137 ton.
Kenaikan produksi ini dikarenakan penambahan jumlah areal pertanaman jahe yang
cukup signifikan dari 61.494.919 m2 menjadi 89.041.808 m2 (Deptan 2008).
Di samping kendala OPT dan budidaya, pengembangan jahe di Indonesia juga
mengalami hambatan karena terbatasnya bibit bermutu. Secara konvensional bibit
jahe diambil dari potongan rimpang. Dengan cara ini diperlukan bibit dalam jumlah
yang banyak, antara 2-3 ton/ha untuk jahe yang dipanen tua dan 5-6 to/ha untuk yang
dipanen muda (Januwati & Rosita 1997).
Untuk mengantisipasi hal-hal tersebut di atas, sangat penting bagi petani dan
penangkar benih untuk menggunakan bahan tanaman (benih) bermutu dari varietas
yang sudah dilepas, bersertifikat, bebas OPT dan penerapan teknik budidaya anjuran
yang dapat meningkatkan produktivitas tanaman. Pada tahun 2001 Balai Penelitian
Tanaman Rempah dan Obat sudah melepas 1 varietas unggul jahe (Cimanggu-1)
Halina -4) (Bermawie et al. 2007). Namun, varietas yang sudah dilepas tersebut
rentan terhadap penyakit layu bakteri yang disebabkan oleh Ralstonia solanacearum.
Ralstonia solanacearum merupakan OPT utama yang dapat menggagalkan
hasil dan sulit ditanggulangi karena di samping menyerang jahe, juga dapat
menyerang tanaman temu-temuan lainnya seperti kunyit dan kencur dan sayuran
(tomat dan cabe), serta beberapa macam gulma (Supriadi et al. 1995). Hal ini
mengindikasikan bahwa isolat R. solanacearum dari jahe mempunyai kisaran inang
yang cukup luas. Serangan penyakit layu bakteri pada jahe semakin meluas akibat
penggunaan benih yang sudah mengandung R. solanacearum.
Berbagai teknik pengendalian, baik dengan menggunakan antibiotik (agrimicin,
agrept), mikroba antagonis (Bacillus subtillis, Pseudomonas fluorescens, P.putida,
P.cepacia) maupun kultur teknis anjuran, belum mampu mengatasi kendala tersebut
secara optimal. Usaha pengendalian masih belum efektif, terutama karena belum ada
klon jahe yang tahan terhadap R. solanacearum (Supriadi et al. 2000). Kendala utama
untuk memperoleh varietas jahe tahan terhadap R. solanacearum adalah terbatasnya
sumber gen ketahanan (narrow genetic stock) dan hambatan fisiologis karena adanya
sifat inkompatibilitas sendiri (self-incompatibility), serta rendahnya fertilitas polen
sehingga persilangan konvensional sulit dilakukan. Oleh karena itu upaya untuk
memperoleh varietas jahe tahan penyakit perlu dilakukan dengan meningkatkan
ketahanan penyakit secara inkonvensional.
Seleksi in vitro dengan menggunakan medium selektif merupakan salah satu
metode yang dapat digunakan untuk meningkatkan ketahanan jahe terhadap bakteri R.
solanacearum. Berbagai agen penyeleksi seperti filtrat atau toksin dari
mikroorganisme patogen maupun non patogen, serta elisator kimia (Svabova &
Lebeda 2005; Pradhanang et al. 2005) sudah banyak diaplikasikan pada beberapa
tanaman budidaya dan berhasil memperoleh varian baru yang tahan terhadap
organisme pengganggu tanaman tertentu.
dan pektin methyl esterase (Pme). Enzim - enzim tersebut berperan dalam degradasi
dinding sel tanaman (Cell Wall Degrading Enxymes; CWDEs), yang dikeluarkan
melalui sistem sekresi tipe II (T2Ss) (Denny et al. 1990; González & Allen 2003;
Huang & Allen 1997 & 2000; Tans-Kersten et al. 1998; Liu et al. 2005; Hikichi et al.
2007). Selain itu, Liu et al. 2005 melaporkan bahwa suatu mutan yang kekurangan
enam gen penyandi CWDEs menyebabkan tanaman layu lebih signifikan dari tipe
liarnya. Saat ini CWDEs sedang dikaji kemungkinan peranannya dalam mengontrol
virulensi bakteri.
Induksi resistensi penyakit pada tanaman menghasilkan suatu perlindungan
patogen yang memiliki spektrum luas pada daerah infeksi utama dan bagian distal
tanaman. Fenomena ini antara lain berhubungan dengan akumulasi asam salisilat
(SA) yang diperlukan untuk signal transduksi dan mendorong pengaturan ekspresi
hubungan antara patogenesis protein (PR) dengan aktivitas mikroba (Delaney et al.
1994; Hammerschmidt et al. 1982; Kuc 1995; Faize et al. 2004). Dengan demikian
peningkatan kadar SA dalam tanaman dapat dijadikan sebagai salah satu indikator
ketahanan.
Keberhasilan aplikasi variasi somaklonal dan teknik seleksi in vitro untuk
mendapatkan sifat ketahanan memerlukan ketersedian metode/teknik kultur jaringan
yang efektif dan mampu meregenerasikan planlet dan adanya media selektif yang
mampu menghambat pertumbuhan sel/jaringan normal sekaligus meningkatkan
perkembangan sel/jaringan varian dengan sifat tertentu (Yusnita 2005;Purwati 2007).
Metode kultur jaringan dan regenerasi untuk tanaman jahe telah diperoleh pada
penelitian Sitinjak (2005) dan Rostiana & Syahid (2008), sedangkan media untuk
penyeleksi yang mampu menginduksi dan menyeleksi ketahanan jahe terhadap
bakteri Ralstonia solanacearum pada kultur jaringan jahe belum pernah diteliti
Tujuan Penelitian
1. Mendapatkan konsentrasi filtrat Ralstonia solanacearum yang dapat menginduksi
dan menyeleksi ketahanan pada kalus embriogenik jahe.
2. Mendapatkan varian kalus baru yang memiliki ketahanan terhadap filtrat Ralstonia
solanacearum.
Hipotesis Penelitian
1. Konsentrasi filtrat bakteri Ralstonia solanacearum berpengaruh terhadap
morfologi, histologi dan kandungan asam salisilat kalus embriogenik jahe.
2. Seleksi bertingkat secara in vitro pada kalus embriogenik jahe dengan filtrat
Ralstonia solanacearum akan menghasilkan varian kalus.
Untuk mencapai tujuan penelitian dan menjawab hipotesis yang diajukan,
dilakukan lima tahapan percobaan dengan bagan alir penelitian seperti disajikan pada
(Media MS + Sukrosa 2% + Glutamine 100 mg/l + 2,4-D 1 mg/l + BA 3 mg/l)
II. TINJAUAN PUSTAKA
Botani Tanaman Jahe (Zingiber officinale Rosc)
Deskripsi tanaman jahe (Zingiber officinale Rosc.) menurut Lawrence (1951)
dan Jansen (1981) dapat diklasifikasikan sebagai berikut :
Kingdom : Plantae
Divisi : Angiospermae
Kelas : Monokotiledoneae
Bangsa : Zingiberales
Suku : Zingiberaceae
Sub suku : Zingiberoideae
Marga : Zingiber
Jenis : Zingiber officinale Rosc.
Jahe merupakan tanaman herba tahunan yang tumbuh pada lahan dataran
rendah sampai menengah (300 - 900 m dpl). Di Indonesia dikenal tiga jenis jahe yaitu
; Jahe putih besar, jahe putih kecil dan jahe merah. Jahe putih besar mempunyai
rimpang yang tumbuh bergerombol pada pangkal batangnya, berdaging dan
berukuran tebal serta bercabang tidak beraturan tetap secara normal hanya pada arah
vertikal. Ukuran panjang dan lebar rimpang berkisar antara 15,83 - 32,75 cm dan 6,20
- 11,30 cm. Jahe putih besar mempunyai aroma dan rasanya kurang tajam
dibandingkan jenis yang lainnya. Jahe putih kecil ukuran rimpangnya relatif lebih
kecil 6,13 - 31,70 cm dan 6,38 - 11,10 cm sedangkan jehe merah 12,33 - 12,60 dan
5,26 - 10,40 cm (Rostiana et al. 1991). Dari ketiga jenis jahe tersebut jahe putih besar
lebih banyak dibudidayakan karena lebih menguntungkan dibandingkan jenis lainnya.
Tanaman jahe mempunyai batang semu (pseudostems) yang berbentuk bulat
(teres). Tinggi tanamaan ini rata-rata 68,63 ± 12,5 cm, tegak, tidak bercabang,
Gambar 2. Keragaan Tanaman Jahe (Zingiber officinale Rosc). A. Tanaman Jahe umur 6 bulan B. Rimpang Jahe
Akar jahe berbentuk bulat, ramping, dan berserat. Panjang akar jahe 12,93 -
21,52 cm dengan diameter 4,5 - 6,3 mm, berwarna putih sampai kecoklatan. Akar
jahe keluar dari garis lingkaran sisik rimpang (Rostiana et al. 1991). Jahe mempunyai
jumlah kromosom 2n = 22 (Ajijah et al. 1997).
Daun tanaman jahe terdiri atas upih dan helaian. Upih daun melekat
membungkus batang dengan helaian daun yang tersusun berseling (folia disticha).
Pada setiap buku terdapat dua daun. Helaian daun tipis, berbentuk bagun garis
(linearis) sampai lanset (lanceolatus), berwarna hijau gelap pada bagian atas dan
lebih pucat pada bagian bawah, panjang berkisar antar 5 - 25 cm dan lebar berkisar
antara 1 - 3 cm. Tulang (urat) daun tampak jelas bersusun sejajar, pada bagian
permukaan atas terdapat bulu- bulu putih. Ujung daun meruncing (acumilatus) dan
tumpul (obtusus) dan membulat (rounded/rotundus) pada bagian pangkal (Ajijah et
al. 1997).
Bunga jahe jarang terlihat, tetapi pada beberapa pertanaman jahe bunga mekar
pada siang hari sekitar jam 1300 - 1600 WIB, kemudian gugur keesokan harinya
(Bermawie & Martono 1994). Bunga muncul langsung dari rimpangnya, tersusun
dalam rangkaian bulir berbentuk seperti jagung. Setiap bunga dilindungi oleh daun
pelindung berwarna hijau, berbentuk bulat telur atau jorong (elliptic). Pada setiap
daun pelindung terdapat satu bunga yang muncul pada bagian tengah (Purseglove et
Tanaman jahe sangat jarang dapat membentuk buah. Hal ini karena kesuburan
serbuk sari yang rendah dan adanya faktor inkompatibilitas sendiri. Fertilitas polen
jahe sangat rendah (< 30%), karena stuktur bunga yang memiliki bulu sehingga
tepung sari sulit untuk menempel dan berkecambah pada kepala putik.
Inkompatibilitas adalah fenomena yang terjadi pada tanaman normal dimana polen
dan ovulnya fertil tidak dapat menghasilkan biji karena faktor ketidaksesuaian dari
cara berpasangan gen atau adanya reaksi penolakan antara gen yang sama yang
diekspresikan di dalam pollen dan stigma yang menghambat pembuahan. Sistem
inkompatibilitas ada dua yaitu; sporophytik dan gametophytik. Inkompatibilitas
sporophytik dibagi lagi atas dua bagian ; heteromorphik dan homomorphik. Sistem
inkompatibilitas homomorphik adalah jika bentuk atau stuktur bunga, stigma atau
anter tanaman sama. Sedangkan sistem inkompatibilitas heteromorphik jika tanaman
mempunyai bentuk atau stuktur bunga, stigma atau anter yang berbeda. Pada jahe
inkompatibilitas terjadi secara sporophytik heteromorofik karena kepala putik berada
di atas kepala sari sehingga peluang untuk terjadinya penyerbukan sendiri sangat
kecil (Syahid & Rostiana 2007 ; Roy 2000 ; Berwawie & Martono 1994).
Kultur in vitro Jahe (Zingiber officinale Rosc.)
Kultur in vitro tanaman merupakan tehnik untuk menumbuhkan organ,
jaringan, dan sel tanaman. Jaringan dapat dikulturkan pada medium padat, semi
padat, maupun cair. Beberapa peneliti menyatakan bahwa kultur in vitroadalah suatu
metode mengisolasi bagian tanaman seperti protoplas, sel, jaringan atau organ, serta
menumbuhkannya dalam kondisi aseptik, sehinggga bagian-bagian tanaman tersebut
dapat tumbuh dan memperbanyak diri serta beregenerasi menjadi tanaman lengkap
(Gunawan, 1992).
Kelebihan menggunakan tehnik kultur in vitro antara lain; Tanaman dapat
diperbanyak setiap saat tanpa tergantung musim, daya multifikasinya tinggi, tanaman
Perbanyakan tanaman jahe umumnya dilakukan secara vegetatif, yaitu dengan
menggunakan rimpang berukuran 2,5 - 5 cm, dengan bobot 25 - 60 gram.
Perbanyakan vegetatif pada tanaman jahe menyebabkan keragaman genetik jahe
sangat rendah. Pengembangan tanaman jahe diarahkan untuk mendapatkan rimpang
yang besar, berwarna cerah, aroma kurang tajam, sedikit serat dan tahan terhadap
hama serta penyakit (Rostiana et al. 2004).
Penyediaan benih melalui kultur in vitro dapat dilakukan baik melalui induksi
tunas langsung maupun fase kalus dengan menggunakan sumber eksplan vegetatif
(Mariska & Syahid 1992), tetapi menghasilkan tanaman baru yang berimpang kecil
bahkan pada tanaman generasi kedua (Syahid & Hobir 1996). Hal ini diduga telah
terjadi perubahan genetik selama proses inisiasi dan regenerasi tanaman secara in
vitro, atau terjadi perubahan epigenetik yang disebabkan oleh tekanan fisiologis
akibat kondisi kultur yang bersifat sementara. Oleh karena itu, untuk mengeliminasi
perubahan genetik selama proses in vitro, perlu memperhatikan sumber eksplan dan
tingkat ploidi dari tanaman yang akan digunakan, serta model regenerasi tanaman
(Chowdhury et al. 1994; Karp 1985; 1991; Peschke & Phillips 1992; Veilleux &
Johnson 1998).
Regenerasi tanaman melalui kultur in vitro dapat dilakukan melalui 2 jalur,
yaitu jalur organogenesis dan jalur embriogenesis somatik. Untuk produksi bibit
melalui kultur jaringan, pembentukan benih somatik dari embrio somatik dapat
menghasilkan bibit yang jauh lebih banyak dari pada hasil regenerasi melalui
organogenesis. Di samping itu, dalam perbaikan tanaman melalui kultur in vitro,
regenerasi melalui jalur embriogenesis somatik lebih disukai karena dapat berasal
dari satu sel sehingga kepastian hasil perbaikan sifat genetik lebih tinggi. Secara
umum dinyatakan bahwa tanaman yang dihasilkan melalui proses embriogenesis
somatik merupakan klon yang identik dengan induknya (Evans & Sharp 1986;
Jimenez 2001), meskipun beberapa perbedaan akan ditemukan tergantung dari jenis
tanamannya.
Keberhasilan menginduksi embriogenesis somatik dipengaruhi oleh banyak
lingkungan tumbuh. Jaringan meristematik seperti mata tunas, antera/polen dan
epi/hipokotil memberikan tingkat keberhasilan lebih tinggi untuk pembentukan
sel-sel embriogenik (Mariska 1997). Di samping itu, penggunaan eksplan meristem dapat
mengurangi jumlah kultur yang terkontaminasi dan memberikan peluang untuk
mendapatkan tanaman normal yang lebih tinggi (Sherwood, 1964).
Meristem merupakan jaringan yang bersifat embrionik dalam tanaman dan
merupakan asal dari jaringan permanen. Jaringan meristem apikal dan akar
berdiameter sekitar 0,1 mm dengan panjang sekitar 0,25 mm. Jaringan tersebut
tersusun dari sel - sel yang membelah secara aktif dan tidak berdifferensiasi, serta
tidak mempunyai sistem vaskula (Slack and Tufford 1995).
Penggunaan sumber eksplan daun aseptik, antera dan meristem dari jahe putih
besar var. Cimanggu-1, menunjukkan bahwa eksplan asal meristem memberikan
potensi regenerasi lebih baik dari daun aseptik dan antera pada media tumbuh yang
diaplikasikan untuk menginduksi embriogenesis somatik (Syahid & Rostiana 2007 ;
Rostiana et al. 2002). Peluang untuk memperoleh ukuran rimpang normal melalui
sistem regenerasi ini cukup tinggi (Rostiana & Syahid 2008), sehingga metode
tersebut potensial untuk dikembangkan guna memperoleh benih jahe sehat bebas
penyakit serta diaplikasikan untuk memperoleh varietas jahe tahan penyakit melalui
seleksi in vitro dan transformasi gen (rekayasa genetik).
Menurut Gray (2005), ada beberapa hal yang perlu diperhatikan dalam
menginduksi sel menjadi sel embriogenik, di antaranya adalah ; mengatur konsentrasi
zat pengatur tumbuh khususnya auksin dan sitokinin, mengatur nisbah dari N
tereduksi dan N teroksidasi, mengatur konsentrasi sumber energi, dan mengatur
konsentrasi asam amino.
Proses embriogenesis somatik pada jahe berlangsung melalui beberapa tahapan,
yaitu ; induksi kalus embriogenik, proliferasi, pendewasaan, regenerasi dan
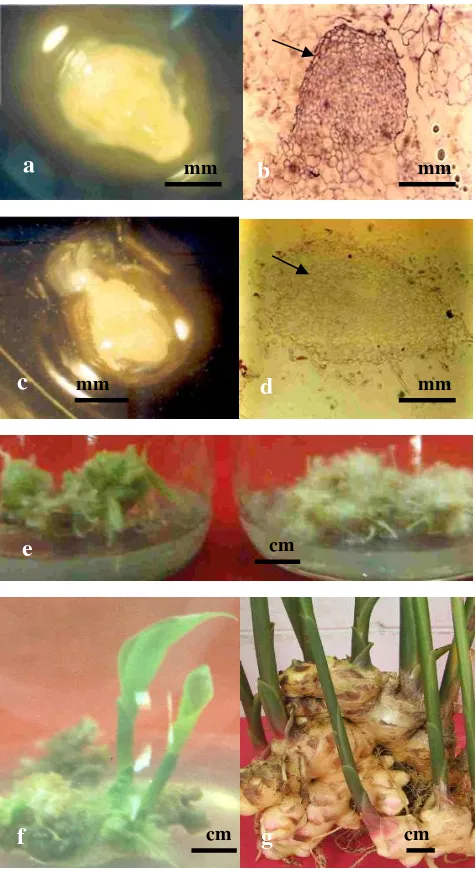
Gambar 3.Proses pertumbuhan embriogenesis somatik kultur meristem jahe.
a. Bentuk embrio globular jahe (4 minggu setelah disubkultur ke media proliferasi). b. Sayatan embrio globular (2 minggu di media proliferasi) Tanda panah memperlihatkan lapisan protroderm mulai berdeferensiasi. c. Bentuk embrio torpedo jahe (18 hari setelah disubkultur ke media pendewasaan). d. Sayatan embrio tropedo (18 hari setelah disubkultur ke media pendewasaan embrio). Tanda panah memperlihatkan deferensiasi procambium. e. Perkecambahan embrio somatik pada media MS + BA 1 mgl-1 (kiri) dan pertumbuhan akar embrio somatik pada media MS (kanan), 30 hari setelah sub kultur (skala 1 : 1,4). f. Planlet jahe, 8 minggu setelah disubkultur ke media MS (skala 1: 1,3). g. Tanaman jahe asal kultur meristem menghasilkan rimpang berukuran normal (Rostiana &
a b
c d
e
f g
mm mm
mm mm
cm cm
Induksi Keragaman Somaklonal
Keragaman somaklonal didefenisikan sebagai keragaman dari tanaman yang
dihasilkan oleh sel somatik tanaman yang ditumbuhkan secara in vitro (Larkin &
Scrowcrot 1981). Keragaman somaklonal merupakan fenomena umum dalam sistem
perbanyakan tanaman, yang melibatkan fase pembentukan kalus.
Media kultur jaringan dapat menginduksi perubahan genetik karena pada
kondisi in vitro terjadi pembelahan sel sangat cepat sehingga memungkinkan
terjadinya kesalahan pada pembelahan mitosis. Induksi mutasi sangat mungkin terjadi
karena perbanyakan secara vegetatif melalui kultur in vitro sebagai akibat
penggunaan bahan kimia atau lingkungan terkendali yang berlangsung secara terus
menerus. Terjadinya perubahan ini justru memberi keuntungan kerena meningkatkan
keragaman sifat yang disebut variasi somaklonal (Larkin & Scrowcrot 1981 ;
Wattimena et al. 1992)
Keragaman somaklonal dapat berasal dari keragaman genetik yang telah ada
sebelumnya (pre-existing) pada eksplan dan keragaman terinduksi selama fase kultur
jaringan. Keragaman somaklonal terdiri dari dua tipe yaitu: heritabel dan epigenetik.
Keragaman heritabel adalah keragaman yang stabil dan diwariskan melalui siklus
seksual maupun propagasi akseksual yang berulang, sementara keragaman epigenetik
bersifat tidak stabil (Skirvin et al. 1994).
Keragaman yang timbul akibat induksi pada kultur in vitro lebih sering terjadi
dan mudah diamati, karena varian diperoleh dari tempat yang terbatas dan dalam
waktu singkat. Keragaman somaklonal dapat berupa defisiensi klorofil, mutasi gen
tunggal, poliploidi, perubahan kromosom, modifikasi hasil, kualitas, ketahanan
penyakit, atau kadang-kadang muncul keragaman yang sebelumnya tidak pernah ada
di alam (Ahloowalia 1986).
Pada era tahun 1980-an sampai 1990-an, berbagai keberhasilan dalam
peningkatan kualitas tanaman budidaya melalui induksi keragaman somaklonal sudah
kariotik, fisiologis, biokimia dan perubahan pada tingkat molekular lainnya (Bajaj
1992).
Timbulnya keragaman genetik selama proses kultur in vitro dipengaruhi oleh
faktor internal maupun eksternal (Karp 1991). Faktor internal yang berpengaruh
antara lain genotipa tanaman, sumber eksplan yang digunakan, dan tingkat ploidi
(Karp 1991; Peschke & Phillips 1992; Chowdhury et al. 1994). Semakin rendah
tingkat ploidi, semakin stabil suatu genotip tanaman selama proses kultur in vitro.
Sedangkan faktor eksternal adalah komposisi media, zat pengatur tumbuh (ZPT) serta
proses regenerasi seperti fase kalus dan periode kultur terutama dalam fase kalus
(Karp 1991; Veilleux & Johnson 1998). Pada umumnya tahapan regenerasi melalui
proses pembentukan kalus akan menginduksi variasi genetik. Penggunaan auksin kuat
yang menginduksi kalus seperti 2,4-D dan Dicamba, pada konsentrasi tinggi dan
periode kultur yang panjang terbukti menimbulkan keragaman somaklonal yang
relatif signifikan (Veilleux & Johnson 1998).
Keragaman somaklonal yang ditunjukkan dengan sifat fenotif akibat proses in
vitro kultur jaringan, melibatkan perubahan genetik seperti aberasi kromosom, gen
amplifikasi dan deamplifikasi, mutasi gen tunggal, ekspresi multi gen famili,
mobilisasi elemen trasposisi, dan metilasi DNA (Peschke & Phillips 1992). Induksi
keragaman somaklonal pada tingkat morfologi dan beberapa karakter kuantitatif
terbukti dapat memperbaiki sifat agronomis penting pada beberapa tanaman budidaya
seperti bunga matahari, Cyclamen, gandum, kentang, krisan, padi dan tomat (Van den
Bulk et al. 1990; Wattanasiri & Walton 1993; Antonetti & Pinon 1993; Kawata et al.
1995; Symillides et al. 1995; Dillen et al. 1996; Wallner et al. 1996).
Penyakit Layu Bakteri (Ralstonia solanacearum)
Penyakit layu bakteri disebabkan oleh Ralstonia solanacearum yang dahulu
dikenal sebagai Pseudomonas solanacearum merupakan salah satu kendala utama
dalam budidaya jahe. Serangan penyakit layu bakteri pada suatu areal pertanaman
jahe dapat menyebabkan semua tanaman di areal tersebut terinfeksi dengan cepat
Bakteri Ralstonia solanacearum berbentuk batang, mempunyai satu atau
beberapa flagel poler (lofotrik), koloni putih atau kuning. Membentuk pigmen yang
larut dalam air, berwarna hijau kebiru-biruan atau hijau kekuning-kuningan. Tidak
membentuk spora, bereaksi gram negatif dengan kandungan DNA (G + C ) 58-70
mol % (Semangun 1996).
Suhu optimum untuk perkembangan bakteri R. solanacearum berkisar antara
270C - 370C, sedangkan pada suhu 150 C bakteri ini kurang berkembang. Selain faktor
suhu udara, faktor yang tidak kalah pentingnya adalah kelembaban tanah dan suhu
tanah. Akiew (1985) diacu dalam Yusriadi (1988) menyatakan bahwa populasi R.
solanacearum akan menurun tajam dengan meningkatnya suhu temperatur tanah dan
menurunnya kelambaban tanah. Sebaliknya, pada kelembaban tanah yang tinggi dan
suhu yang rendah, bakteri ini menunjukkan kemampuan bertahan hidup untuk jangka
waktu yang lama.
Bakteri ini menyerang lebih dari 200 spesies tanaman, khususnya famili
tanaman yang tumbuh di wilayah tropik dan subtropik. Tanaman yang rentan
terhadap serangan potogen ini antara lain ; jahe, kentang, tomat, tembakau, terong,
cabai, pisang dan kacang tanah.
Tanaman inang bakteri R solanacearum antara lain temumangga, temuputih,
tomat, terung, nilam, tembakau, kacang tanah, kacang hijau, kedelai, kacang asu,
tapak dara, kenaf, rosella, hortensia, kembang biru, ubi kayu, kemuning, tomat, cabai,
kentang, kacang panjang, kembang kertas, wijen, turi, takokak, Beberapa jenis gulma
antara lain babadotan, meniran, ceplukan, Commelina sp., Spigelia anthelmia,
Erechtites sp., dan krokot (Supriadi 1997).
Penyakit layu bakteri dilaporkan telah menimbulkan kerugian pada pertanaman
jahe di India, Amerika Serikat (Hawai), Australia, Afrika, Mauritius, Filipina,
Thailand, Malaysia dan Indonesia. Di Indonesia serangan bakteri R. solanacearum
dapat menimbulkan kerugian hasil lebih dari 90%. Penyakit ini pertama kali
Jawa Barat dan Jawa Tengah (Harmono 2005 ; Supriadi et al. 2000 ; Sitepu 1991;
Asman & Hadad 1989).
Tanaman jahe biasanya mulai menunjukkan gejala layu bakteri pada umur 3
bulan. Gejala pertama adalah daun menguning dan menggulung, dimulai dari daun
yang lebih tua kemudian diikuti daun yang lebih muda, selanjutnya sampai semua
helai daun kuning dan mati. Gejala menguning pada daun biasanya dimulai dari
pinggir daun kemudian menyebar ke seluruh helai daun. Pada bagian pangkal batang
terlihat gejala cekung basah dan garis-garis hitam atau abu-abu sepanjang batang.
Pada tahap perkembangan gejala demikian, batang mudah dicabut dari bagian
rimpang. Kalau potongan pangkal batang atau rimpang dipijit dengan tangan akan
keluar eksudat bakteri berwarna putih susu. Kerusakan yang ditimbulkan
bervariasi antara ringan sampai berat, tergantung dari beberapa hal seperti : umur
tanaman terserang, curah hujan, mutu benih rimpang, dan tingkat pencemaran tanah.
Bakteri R. solanacearum memiliki banyak strain. Pendekatan yang dilakukan
untuk mendeteksi strain ini dilakukan dengan dua cara: 1) pendekatan berdasarkan
inang utama disebut ras, dan 2) pendekatan kedua berdasarkan kemampuan
mengoksidasi beberapa jenis sumber karbon, disebut biovar. Menurut Persley et al.
(1985), R. solanacearum terbagi atas lima Ras, yakni Ras 1 (Solanaceous strain)
menyerang tanaman famili solanaceae dan Leguminoceae, Ras 2 (Musaceous strain),
hanya menyerang pisang, Ras 3 (potato Strain) menyerang tanaman kentang, Ras 4
(Gingger strain) yang menyerang tanaman jahe dan Ras 5 (Mulberry strain) yang
menyerang tanaman mulberry.
Pengendalian terhadap penyakit layu bakteri pada jahe terbukti sangat sulit
untuk dilakukan. Pengendalian secara kimia kurang efektif dan mahal. Cara yang
mungkin dilakukan adalah dengan merotasi tanaman dan tidak menanam jahe pada
Aplikasi Tehnik In Vitro Untuk Sifat Ketahanan Tanaman
Seleksi in vitro merupakan salah satu metode menginduksi variasi somaklonal.
Teknik ini lebih efektif dan efisien karena perubahan sifat lebih terarah kepada sifat
yang diinginkan, seperti memberikan tekanan seleksi dalam media kultur atau dengan
memberikan kondisi tertentu agar diperoleh somaklon-somaklon dengan sifat yang
diiginkan. Pada berbagai tanaman, seleksi in vitro telah terbukti dapat menghasilkan
varietas baru yang tahan penyakit dan sifat tersebut diwariskan pada turunannya (Van
den Bulk, 1991).
Seleksi tanaman secara in vitro memiliki beberapa kelebihan yaitu; waktu yang
relatif lebih singkat, biaya lebih murah, tidak memerlukan lahan yang luas, tidak
menimbulkan masalah pada lingkungan, dapat dilakukan pada populasi sel, kalus dan
tunas yang banyak dalam waktu yang relatif lebih singkat dan seleksi dilakukan pada
kondisi yang terkontrol (Samanhudi 2001; Wattimena et al. 2001).
Kesulitan utama yang sering dihadapi pada seleksi galur sel untuk
menghasilkan tanaman yang resisten adalah ketidak stabilan akibat perubahan genetik
yang singkat atau adaptasi epigenetik. Untuk itu perlu dilakukan seleksi bertingkat
dalam waktu tertentu sampai diperoleh galur sel yang stabil (Gonzales & Widholm
1991). Dengan seleksi bertingkat diharapkan sel atau jaringan akan lebih meningkat
sifat ketahanannya dibandingkan seleksi satu tahap. Disamping itu dengan adanya
pengulangan seleksi, sel atau jaringan normal yang lolos pada seleksi tahap pertama
dapat dihambat perkembangannya pada seleksi tahap kedua. Hal ini akan
meningkatkan efektifitas seleksi dan akan menurunkan kemungkinan adanya
kesalahan dalam mengidentifikasi.
Hemon (2006) menyatakan seleksi berulang mempunyai potensi lebih besar
untuk menghadirkan perubahan genetik dibandingkan seleksi yang hanya dilakukan
dalam jangka pendek. Selain itu, seleksi in vitro berulang menyebabkan hilangnya
beberapa karakter varian karena adanya tekanan seleksi in vitro. Sehingga diharapkan
sudah dilakukan (Svabova & Labuda 2005). Induksi variasi somaklonal dan seleksi
in vitro telah digunakan untuk menghasilkan galur tanaman yang resisten terhadap
penyakit (Borras et al. 2001).
Pada tanaman seledri, induksi keragaman somaklonal melalui kultur kalus in
vitro dengan penambahan filtrat jamur Septoria apiicola selama 7 - 10 hari periode
kultur, menghasilkan varian baru (somaklon) yang tahan terhadap patogen tersebut
(Evenor et al. 1994). Hasil yang sama juga ditunjukkan pada seleksi in vitro pada
tanaman tahunan Populus sp. dengan menggunakan medium selektif filtrat S. musiva
(Ostry & Skilling 1988). Induksi ketahanan terhadap patogen pada kultur kalus
geranium in vitro dengan mengaplikasikan 4% - 20% filtrat jamur patogen (Altenaria
alternata) juga memberikan hasil yang cukup signifikan dalam upaya memperoleh
kultivar geranium baru tahan terhadap patogen tersebut (Saxena et al. 2007).
Purwati (2007), berhasil mendapatkan tanaman abaka yang imun, tahan, dan
agak tahan terhadap F.oxysporium dengan menyeleksi secara in vitro dengan
menggunakan filtrat kultur sebagai agens penyeleksi. Sementara Yusnita (2005)
berhasil mendapatkan beberapa galur kacang tanah (Arachis hypogea L.) yang
resisten terhadap penyakit busuk batang (Sclerotium rolfsii Sacc.) melalui seleksi in
vitro.
Meskipun filtrat atau toksin bakteri R. solanacearum belum pernah
diaplikasikan sebagai medium selektif untuk seleksi in vitro, pada jenis bakteri lain
seperti Clavibacter michiganensis dan Pseudomonas syringae, seleksi in vitro dengan
menggunakan toksin maupun filtrat sebagai agen seleksi, terbukti menghasilkan
somaklon tomat dan protoklon tembakau yang tahan terhadap patogen tersebut
Asam Salisilat
Sejak 1933, telah banyak publikasi yang menyatakan bahwa tanaman akan
memberikan perlindungan terhadap infeksi sekunder. Namun baru tahun 1960 Ross
melakukan penelitian yang hasilnya memperlihatkan adanya infeksi lokal tanaman
tembakau pada Tobacco Mosaic Virus (TMV), yang disebutnya sebagai Response
systemic acquired resistence (SAR) (Delaney 2004).
Salah satu senyawa yang dibutuhkan dalam jalur signal transduksi untuk
induksi SAR (Systemic Acquired Resistence) dalam mekanisme ketahanan penyakit
adalah asam salisilat. Asam salisilat pertama kali ditemukan oleh White pada tahun
1979 yang melakukan penelitian pada tanaman tembakau. Hasilnya memperlihatkan
aspirin (acetylsalycilic acid) dapat menginduksi ketahanan pada tembakau (Delaney
2004).
Tumbuhan akan mengembangkan serangkaian respon terhadap sejumlah signal
dari lingkungan, serangan patogen maupun signal dari lingkungan agar dapat
mengendalikan pertumbuhan dan perkembangan tanaman. Beberapa penelitian
terdahulu memperlihatkan bahwa sejumlah tanaman ketika melawan serangan
mikroba, fungi, patogen dan herbivora, memproduksi lebih banyak senyawa kimia
pelindung seperti ; asam salisilat, 2,6-dicloroisonocotinic acid, benzo
(1,2,3)-thiadiazole-7-carbothioic acid s-methyl ester, mercuric choride (Van 1999 ; Vernooij
et al. 1994 ; Gorlach et al. ; Moris et al. 1998 ; De Tapia et al. 1986 Diacu dalam
Fernandes et al. 2006).
Asam salisilat merupakan salah satu senyawa yang mengindikasikan respon
pertahanan tanaman yang telah dibuktikan dengan baik oleh Gaffney et al. (1993).
Mereka menggunakan tanaman transgenik tembakau yang dapat mengekspresikan
gen Nah, yang berfungsi mengkode enzim hidroksilase yang diisolasi dari
Pseudomonas putida yang dapat mengkonversi asam salisilat menjadi kotekol.
Akibatnya tanaman transgenik tersebut tidak mampu mengakumulasi asam salisilat
Di dalam tanaman, asam salisilat tersedia dalam bentuk asam bebas dan
metabolit terkonjugasi melalui metilasi, hidroksilasi, dan glukosilasi. Asam salisilat
yang disintesis pada tembakau setelah diinokulasi TMV akan terglukosilasi dan
termetilasi. Konjugat asam salisilat terglukosilasi memiliki bentuk 2- 0 –
-D-glukosida (SAG) dan glukosil salisilat (GS), dan metil asam salisilat (MSA) yang
bersifat votil. Pembentukan senyawa asam salisilat terkonjugasi, asam salisilat dan
SAG, dirangsang oleh adanya infeksi patogen dan aplikasi asam salisilat eksogen
(Enyeni et al 1992; Lee & Raskin 1999 di dalam Purwanto 2007).
Hidrogen peroksidase (H2O2) diduga merupakan signal bagi sintesis asam
salisilat. Pengaruh oksidatif yang cepat akan terjadi akibat invasi patogen sehingga
terjadi peningkatan konsentrasi H2O2 dan senyawa oksigen reaktif lainnya yang
menginduksi respon hipersensitif (HR). Kondisi ini berpengaruh pada konsentrasi
Asam benzoate (BA) bebas dan aktivitas Asam benzoat 2- hidroksilase (BA2H).
Sebagai konsekuensinya konsentrasi asam salisilat akan meningkat (Leon et al 1995;
Klessig et al 2000 didalam purwanto 2007).
Beberapa penelitian memperlihatkan bahwa asam salisilat merupakan senyawa
yang dibutuhkan dalam proses pensignalan SAR. Hal ini dibuktikan dengan adanya
peningkatan konsentrasi asam salisilat pada tanaman tembakau dan ketimun setelah
diinfeksi patogen. Penelitian Kubota & Nishi (2005) menunjukkan bahwa pada
tanaman ketimun (Cucumis sativus) kandungan asam salisilat pada hipokotil dan akar
meningkat secara nyata setelah dinduksi dengan patogen antracnose (Colletotrichum
lagenarium). Sementara pada penelitian Palva et al. (1994) pada tanaman tembakau
menunjukkan bahwa tembakau berumur 2 - 3 minggu yang diperlakukan dengan
asam salisilat 1mM pada medium kultur tanaman, menjadi tahan terhadap inokulasi
patogen Erwinia carotovora subsp. carotovora. Dari beberapa penelitian terdahulu
dapat dinyatakan bahwa ada korelasi antara konsentrasi asam salisilat dengan
III. BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilakukan mulai bulan April 2007 sampai Oktober 2008, di
Laboratorium Kultur Jaringan dan Laboratorium Penyakit Balai Penelitian Tanaman
Obat dan Aromatik (Balittro), Laboratorium Pengujian Balai Besar Pasca Panen, dan
Laboratorium Mikroteknik Departement Biologi, Fakultas MIPA, IPB
Bahan dan Peralatan
Bahan tanaman yang digunakan adalah meristem jahe putih besar (inner shoot
bud) var. Cimanggu 1 hasil perbanyakan vegetatif. Bahan kimia yang digunakan
meliputi: unsur hara makro, mikro dan vitamin untuk media dasar Murashige and
Skoog (MS), glutamin, L-proline, sukrosa, manitol, zat pengatur tumbuh 2,4-D, BA,
acetocarmine, tween 20, clorox, agar, spiritus, alkohol, dithane/benlate, asetic asid
(asam asetat), asam salisilat (SA), methanol, H3PO4, xilol, safranin, fast green,
paraplast, n-Butanol, etanol, dan etil alkohol. Jenis bakteri yang akan diuji (filtrat)
untuk medium selektif yaitu: Isolat bakteri patogen R. solanacearum.
Alat yang digunakan meliputi: Laminar air flow cabinet, autoklaf, timbangan
analitik, oven, mikroskop, pH meter, HPLC, sentrifius, mikrotom putar, mikroskop
camera, botol kultur, cawan petri, gelas piala, galas ukur, pipet pengaduk, pinset,
skapel, lampu spritus dan hand sprayer, kertas saring Whatman 41 (0,45 m), filter
steril (Millifore), alumunium foil, karet gelang, dissecting set, slide gelas, dan film.
Metode Penelitian
Penelitian menggunakan Rancangan Acak Lengkap (RAL) dengan 10 ulangan.
Rancangan perlakuan yang digunakan adalah faktor tunggal, yaitu konsentrasi filtrat
bakteri patogen (R. solanacearum). Pada seleksi tahap satu konsentrasi filtrat R.
Konsentrasi filtrat bakteri patogen (R. solanacearum) tahap 2 adalah: 0 (kontrol), 1%,
2%, 3%, 4% ,5%, 10%, 20%, 30%, 40%, 50% dalam media MS.
Model matematika yang digunakan adalah model linier rancangan acak lengkap
sebagai berikut :
dari uji F, digunakan Uji Jarak Berganda Duncan (UJGD) pada taraf 5%.
Penelitian dilaksanakan lima tahap. Tahap pertama dilakukan untuk
mendapatkan kalus embriogenik, tahap kedua menganalisis kalus embriogenik, tahap
ketiga untuk menginduksi ketahanan kalus jahe terhadap penyakit layu bakteri yang
dilakukan melalui pendekatan medium selektif, tahap keempat menganalisis
kandungan asam salisilat pada kalus dan tahap kelima menganalisis kalus hasil
seleksi. Tahapan penelitian disesuaikan dengan tahap pertumbuhan dan
perkembangan kalus yaitu :
Induksi Kalus Embriogenik
Sebanyak 300 meristem (inner shoot bud) dari mata tunas aksilar jahe putih
besar var. Cimanggu-I berumur 3 minggu digunakan sebagai eksplan. Untuk
menyeragamkan asal eksplan, jahe yang digunakan dipanen pada umur yang sama.
Setelah disterilisasi mata tunas diisolasi di bawah mikroskop untuk mendapatkan
meristem tunas. Kalus embriogenik diinduksi dengan mengkulturkan meristem
aseptik di dalam medium terbaik hasil penelitian sebelumnya (Rostiana & Syahid
2008) yaitu MS (Murashige and Skoog) dengan penambahan 2% sukrosa, 100 mg/l
Kalus embriogenik yang berumur 8 minggu lalu disubkultur ke media yang
sama untuk memperoleh kalus embriogenik dalam kuantitas yang cukup banyak dan
respon induksi kalus embriogenik yang lebih seragam. Diharapkan pada tahapan ini
dapat diperoleh satuan eksperimen (kalus embriogenik) dalam jumlah banyak
sehingga memungkinkan untuk digunakan pada tahap selanjutnya. Pada tahap ini
tidak diterapkan metode perancangan percobaan, karena sudah ditentukan medium
dasar terbaik berdasarkan hasil penelitian sebelumnya.
Seleksi Kalus dengan Menggunakan Filtrat Bakteri R. solanacearum
Bahan yang digunakan untuk seleksi adalah kalus embriogenik yang telah
diinduksi pada tahap satu. Filtrat bakteri R. solanacearum yang diperoleh dari
koleksi laboratorium bakteri Balittro ditambahkan ke dalam medium selektif. Filtrat
yang dikulturkan bersama-sama dengan kalus embriogenik digunakan sebagai
penyeleksi.
Media selektif yang digunakan sebagai perlakuan yaitu medium dasar MS cair
yang ditambahkan manitol 3% dan agen selektif sebagai berikut:
1. MS [Kontrol (kalus dikulturkan di dalam medium MS cair tanpa filtrat)]
2. MS + filtrat bakteri patogen (R. solanacearum) dengan konsentrasi, 0,1%, 0,2%,
0,3%, 0,4%, 0,5%, 1%, 2%, 3%, 4%, 5% (tahap 1), dan 1%, 2%, 3%, 4%, 5%,
10%, 20%, 30%, 40%, 50% (tahap 2).
Metode seleksi yang digunakan adalah seleksi bertingkat, yaitu pada setiap
tingkat seleksi konsentrasi filtrat ditingkatkan. Pada seleksi tingkat pertama, kalus
dikulturkan ke dalam media yang diberi perlakuan filtrat selama 3 minggu. Kalus
yang bertahan hidup disubkultur ke dalam medium MS (tanpa filtrat) selama 3
minggu. Pada seleksi tingkat kedua konsentrasi filtrat ditingkatkan sampai 10 kali
konsentrasi awal kalus dikulturkan selama 3 minggu, kalus yang bertahan hidup
Tabel 1. Perlakuan filtrat R. solanacearum pada kultur kalus embriogenik jahe
Keterangan : Tanda panah memperlihatkan tahapan subkultur pada proses seleksi
Analisis Histologi kalus
Analisis jaringan sel dilakukan untuk menentukan sumber eksplan adalah kalus
embriogenik dan melihat perbedaan karakter anatomi kalus. Histologi dilakukan
sebelum seleksi untuk menentukan kalus yang digunakan merupakan kalus
embriogenik, sementara untuk melihat perbedaan karakter anatomi akibat akibat
perlakuan filtrat, pengamatan histologi dilakukan setelah kalus diseleksi dengan filtrat
bakteri R. solanacearum.
Analisis Kandungan Asam Salisilat (Salicylic Acid/SA)
Analisis total kandungan asam salisilat dalam jaringan kalus ditentukan dengan
menggunakan HPLC (High Performance Liquid Chomography). Total SA ditentukan
dengan cairan khromatograpi. Analisis dilakukan pada saat seleksi tahap kedua
selesai dilaksanakan (sebelum disubkultur ke medium MS/tahap pemulihan ke-2).
Pelaksanaan Penelitian
Pembuatan Media
Bahan kimia yang diperlukan untuk membuat larutan media MS dapat dilihat
pada Lampiran 1. Stok larutan baku yang telah dibuat dipipet sesuai keperluan. Ke
dalam larutan ditambahkan 2% sukrosa, 100 mg/l glutamin, 1,0 mg/l 2,4-D dan 3,0
mg/l BA pada tahap induksi kalus, sementara untuk tahap seleksi ditambahkan
Manitol 30 gram. Larutan diaduk rata, kemudian pH-nya diatur ± 5,7 dengan
menggunakan pH meter. Untuk menaikkan dan menurunkan pH media diberikan
larutan NaOH 0,1 N atau HCl 0,1 N. Volume larutan dicukupkan hingga 1000 ml
dengan menambahkan aquades. Sebagai pemadat ditambahkan 8 gram bacto agar.
Larutan dipanaskan hingga menjadi homogen. Media dituangkan ke dalam
botol kultur sebanyak ± 20 ml perbotol. Botol ditutup dengan almunium foil, lalu
diikat dengan karet, kemudian diautoklaf selama 20 menit pada suhu 1200C dengan
tekanan 17,5 psi. Media yang telah disterilisasi diletakkan pada rak kultur di dalam
ruang kultur.
Sterilisasi Eksplan, Isolasi Meristem dan Induksi Kalus
Tunas jahe untuk eksplan dipilih dari rimpang yang sehat. Mata tunas dipotong
sepanjang ± 1 cm, dicuci dengan air mengalir lalu direndam larutan marsal 2%
selama 1 jam, kemudian dibilas dengan air steril. Selanjutnya direndam larutan
dithane 2 g/l dan agrimisin 2 g/l selama 1 jam, dan dibilas air steril. Terakhir eksplan
direndam dengan alkohol 70% dan HgCl2 0,2% selama 5 menit, klorox 20% selama 8
Gambar 4. Tahapan Isolasi Eksplan Meristem Jahe. A. Isolasi meristem jahe B. Kultur meristem jahe (Skala 1 : 2)
Sebanyak 300 mata tunas steril jahe diisolasi di bawah mikroskop untuk
mendapatkan meristem tunas. Meristem aseptik dikulturkan di dalam medium MS
(Murashige & Skoog 1962) dengan penambahan 2% sukrosa, 100 mg/l glutamin, 1,0
mg/l 2,4-D dan 3,0 mg/l BA untuk diinduksi menjadi kalus embriogenik (Gambar 4).
Setelah selesai pengkulturan, botol kultur diletakkan pada ruang inkubasi pada
suhu ± 27 ºC. Rak inkubasi diselimuti dengan kain berwarna hitam untuk
menghindari masuknya cahaya.
Kalus yang berumur 8 minggu disubkultur ke media yang sama. Hal ini
dilakukan untuk menyeragamkan dan memperbanyak jumlah kalus embriogenik,
sehingga diperoleh jumlah yang cukup untuk diperlakukan pada tahapan selanjutnya.
Seleksi Kalus dengan Menggunakan Filtrat Bakteri R. solanacearum
Bahan yang digunakan untuk seleksi adalah kalus embriogenik jahe yang
telah diinduksi pada media MS dengan penambahan 2% sukrosa, 100 mg/l glutamin,
1,0 mg/l 2,4-D dan 3,0 mg/l BA. Bakteri R. solanacearum diperoleh dari koleksi
laboratorium bakteri Balittro di sub kultur pada media tumbuh SPA, diinkubasi pada
suhu 280 C selama 3 hari, kemudian inokulum dimasukkan ke dalam media cair
Sukrosa Peptone (SP) pada suhu ruang selama 3 hari. Filtrat dipisahkan dari sel
dengan cara sentrifugasi pada 10.000 rpm selama 20 menit. Filtrat disterilkan dengan
cara filtrasi menggunakan filter steril 0,45 m (Whatman). Filtrat disimpan pada suhu
40 C sampai siap digunakan.
Filtrat yang telah steril ditambahkan ke media MS yang ditambahkan manitol
3% sesuai dengan konsentrasi perlakuan. Kalus embriogenik yang telah terbentuk
ditimbang masing- masing seberat 0,5 gram. Kalus kemudian dimasukkan ke dalam
botol kultur yang telah berisi media MS, 3% manitol dan filtrat R. solanacearum.
Botol kultur diletakkan di atas seker di ruang inkubasi dengan suhu ± 27 ºC. Selama
proses seleksi, seker diselimuti dengan kain berwarna hitam untuk menghindari
masuknya cahaya.
Analisis Histologi Kalus
Analisis histologi kalus menggunakan metode Nakamura (1995). Kalus nodular
difiksasi dalam larutan FAA (Formaldehid, Asam asetat glasssal, Alkohol) selama 24
jam. Kalus dihidrasi dalam seri n-butanal dengan waktu perendaman masing- masing
tahap 60 menit. Kalus kemudian diinfiltrasi dengan menambahkan paraplas cair
dalam n-butanol. Kalus di inkubasi pada suhu kamar selama 12 jam, lalu
dipindahkan ke oven dengan suhu 58º C selama 24 jam. Selanjutnya cairan paraplas
dibuang diganti dengan paraplas baru dan disimpan dalam oven pada suhu 58oC
selama 3 hari. Kalus diblok di dalam paraplas dalam cawan cetakan. Tahapan
selanjutnya spesimen tersebut dipotong setebal 10 m dengan mikrotom putar
(Yamato RV-240) dan diwarnai dengan pewarnaan ganda yaitu larutan safranin 2 %
dan fastgreen 0,5 %. Akhirnya diletakkan pada kaca glass untuk diamati dengan
mikroskop cahaya.
Analisis Kandungan Asam Salisilat (Salicylic Acid/SA)
Analisis kandungan asam salisilat menggunakan metode Bevilacgua & Califano
(1989). Untuk melihat kandungan asam salisilat pada kalus yang telah diberi
kemudian disentrifius pada kecepatan 4000 rpm selama 15 menit. Supernatan
selanjutnya diinjek ke dalam HPLC (High Performance Liquid Chomography). Total
SA ditentukan dengan cairan khromatografi dengan SA komersial digunakan sebagai
pembanding.
Peubah yang Diamati
Peubah yang diamati meliputi: Jumlah kalus yang terbentuk (%), morfologi
kalus, bobot segar kalus, diameter kalus, kematian kalus, histologi kalus dan
kandungan asam salisilat. Jumlah kalus yang terbentuk diamati pada saat eksplan
berumur 8 minggu setelah tanam. Persentasi jumlah kalus yang berhasil terbentuk
dihitung dibandingkan dengan jumlah eksplan yang ditanam.
Morfologi kalus dilihat dengan memperhatikan tekstur kalus dan warna kalus
yang terlihat pada kalus setelah diperlakukan dengan filtrat R. solanacearum
dibandingkan dengan kontrol. Morfologi kalus diamati setelah kalus 3 minggu dalam
media selektif filtrat R. solanacearum tahap 1 dan 2.
Untuk bobot segar dan diameter kalus ditimbang dan diukur setiap 3 minggu
pada saat kalus telah dimasukkan kemedia perlakuan filtrat R. solanacearum dan
sewaktu dipindahkan ke media tahap seleksi selanjutnya. Bobot kalus ditimbang
dengan menggunakan timbangan analitik sementara diameter kalus diukur dengan
mengukur panjang kalus terpanjang dan kalus terlebar.
Kematian kalus dilihat dengan cara melihat persentase kematian kalus dalam
satu botol kultur. Pengamatan kematian kalus dilakukan setelah kalus seleksi tahap 2
dengan filtrat R. solanacearum. Kalus yang telah diseleksi kemudian disubkultur ke
dalam media MS + manitol 3% dan kemedia pendewasaan embrio yaitu MS +
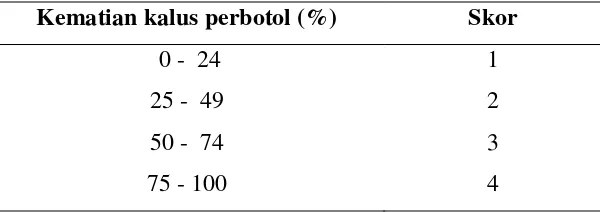
sukrosa 6%. Untuk mempermudah melihat tingkat kematian kalus dilakukan skoring
(penetapan angka) dengan kisaran seperti terlihat pada tabel 2. Kisaran tingkat
kematian kalus berdasarkan perbedaan volume permukaan kalus yang mati dan yang
Tabel 2. Penetapan angka kematian kalus perbotol kultur
Kematian kalus perbotol (%) Skor
0 - 24 1
25 - 49 2
50 - 74 3
75 - 100 4
Histologi kalus dilakukan pada saat kalus sebelum diseleksi dengan R.
solanacearum dan pada saat setelah diperlakukan dengan filtrat R. solanacearum
(setelah tahap pemulihan kedua). Sementara kandungan asam salisilat dilihat pada
IV. HASIL DAN PEMBAHASAN
Induksi Kalus Embriogenik
Eksplan meristem (inner shoot bud) mulai menunjukkan respon yang berarti
setelah dikulturkan selama 2 minggu pada media MS yang ditambah 1,0 mg/l 2,4-D
dan 3,0 mg/l BA, 2% sukrosa, 100 mg/l glutamin. Inisiasi kalus ditandai dengan
adanya pembengkakan di bagian sekitar tepi dasar meristem, kemudian melebar ke
ujung kubah. Pada minggu ketiga pembengkakan meristem melebar keseluruh
eksplan sehingga ukuran eksplan terlihat membesar 2 sampai 3 kali ukuran awal.
Memasuki minggu keempat mulai terjadi induksi kalus pada bagian tepi dasar
meristem. Pada minggu kelima induksi kalus melebar keseluruh permukan meristem,
kalus bertambah banyak dan bertambah besar sampai minggu keenam dan ketujuh,
kemudian pada minggu kedelapan seluruh eksplan telah menjadi kalus kecuali pada
bagian dasar (Tabel 3). Perkembangan kalus selama delapan minggu dapat dilihat
2 Pembengkakan dibagian tepi dasar meristem kemudian melebar
keujung kubah
3 Pelebaran pembengkakan meristem
4 Mulai terjadi induksi kalus pada tepi dasar meristem
5 Induksi kalus melebar keseluruh permukaan meristem
6 Kalus yang terbentuk bertambah banyak
7 Ukuran kalus semakin membesar
ERROR: stackunderflow OFFENDING COMMAND: ~