DAYA TAHAN SPERMATOZOA KUDA DALAM PENGENCER
DIMITROPOULOS YANG DISUPLEMENTASI DENGAN
FRUKTOSA, TREHALOSA ATAU RAFINOSA
J U D I
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis “Daya Tahan Spermatozoa Kuda dalam
Pengencer Dimitropoulos yang disuplementasi dengan Fruktosa, Trehalosa atau Rafinosa” adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari
karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan di
dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2006
ABSTRAK
JUDI. Daya Tahan Spermatozoa Kuda dalam Pengencer Dimitropoulos yang Disuplementasi dengan Fruktosa,Trehalosa atau Rafinosa .Dibimbing oleh BAMBANG PURWANTARA,TUTY L.YUSUF dan MOZES R.TOELIHERE.
Peternakan kuda di Indonesia belum mendapat perhatian serius dari pemerintah dan masyarakat.Perkembangabiakannya masih mengandalkan perkawinan alam, sehingga populasinya terus menurun.Padahal kuda dapat dimanfaatkan sebagai sarana transportasi, olahraga,hiburan,hewan kesayangan dan sumber protein hewani (daging dan susu).Oleh karena itu perlu usaha untuk meningkatkan populasinya,misalnya dengan penerapan teknik inseminasi buatan (IB)menggunakan semen cair. Hingga saat ini pengolahan semen cair kuda di Indonesia belum banyak dilakukan, sehingga jenis media dan metode yang tepat belum diketahui.Beberapa penelitian menunjukkan bahwa enambahan disakarida dan oligosakarida mampu mempertahankan kualitas semen cair beberapa ternak.Oleh karena itu,pada enelitian ini ingin diketahui karakteristik dan daya simpan semen segar kuda,kualitas semen cair dalam pengencer dimitropoulos (DV)yang disuplementasi dengan fruktosa,trehalosa atau rafinosa,dan kualitas semen cair dengan konsentrasi spermatozoa berbeda. Semen (ejakulat)dikoleksi dengan vagina buatan dua kali per ming gu dari 3 ekor kuda (4-8 tahun,fertil).Ejakulat dievaluasi secara makroskopik dan mikroskopik.Sampel disimpan dalam tabung tertutup pada suhu ruang (26-28 o
C)dan lemari es (4-6oC) untuk mengetahui daya tahannya.Taha
berikutnya,semen disentrifugasi pada 3000 rpm selama 20 menit,dan pelet dilarutkan dengan DV (osmolaritas 293 mOsm/kg) yang disuplementasi fruktosa 50,100 dan 150 mM (osmolaritas 349,409 dan 461 mOsm/kg); trehalosa 50,100 dan 150 mM (osmolaritas 352,410 dan 472 mOsm/kg);atau rafinosa 50, 100 dan 150 mM (osmolaritas 354,414 dan 479 mOsm/kg);sampai konsentrasi 200 x 10 6
sel/mL.Tahap selanjutnya,semen diencerkan dengan DV yang disuplementasi fruktosa 50 mM sampai konsentrasi 200,100 dan 50 x 10 6 sel/mL.Sampel
disimpan dalam tabung tertutup pada suhu ruang dan lemari es.Semen cair dievaluasi presentase motilitas (M%) dan presentase hidup (H%)setiap 3 jam (suhu ruang)dan 12 jam (lemari es). Secara umum,karakteristik ejakulat berada pada kisaran normal (volume 29.3 mL, M%67.1,dan konsentrasi 211.9 x 10 6
sel/mL).Persentase motilitas ejakulat pada suhu ruang sebesar 48.33%dan 10.42%dicapai setelah 3 jam dan 12 jam penyimpanan.Ini menunjukkan bahwa daya tahan spermatozoa cukup baik.Uji daya tahan memperlihatkan bahwa M%dan H%pada suhu ruang selalu lebih tinggi daripada suhu lemari es.Hal ini menunjukkan bahwa spermatozoa kuda rentan terhadap cold shock . Pada suplementasi pengencer DV dengan karbohidrat,fruktosa 50 mM mampu memperbaiki kualitas semen cair.Sedangkan fruktosa 100 mM,trehalosa 50 mM dan rafinosa 50 mM cenderung tidak berbeda nyata dengan kontrol.Semakin besar suplementasi karbohidrat cenderung menurunkan kualitas semen cair.Hal ini kemungkinan berkaitan dengan peningkatan osmolaritas media.Semen cair dengan konsentrasi 50 x 10 6 sel/mL memperlihatkan M%nyata lebih tinggi
lemari es).Sedangkan berdasarkan H%berbeda nyata setelah 9 jam (suhu ruang)dan 42 jam (lemari es).Pada suhu ruang semen cair dapat dipakai untuk IB hingga 12-18 jam,sedangkan pada suhu 4-6 o C hingga 60-84 jam
penyimpanan.Dapat disimpulkan,suplementasi karbohidrat hingga osmolaritas melebihi 400 mOsm/kg dan konsentrasi spermatozoa di atas 100 x 10 6 sel/mL
DAYA TAHAN SPERMATOZOA KUDA DALAM PENGENCER
DIMITROPOULOS YANG DISUPLEMENTASI DENGAN
FRUKTOSA, TREHALOSA ATAU RAFINOSA
J U D I
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Biologi Reporoduksi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Daya Tahan Spermatozoa Kuda dalam Pengencer
Dimitropoulos yang Disuplementasi dengan Fruktosa,
Trehalosa atau Rafinosa
Nama : Judi
Nomor Pokok : B651020011
Disetujui
Komisi Pembimbing:
Dr. drh. Bambang Purwantara, M.Sc. (Ketua)
Dr. drh. Tuty L. Yusuf, M.S. Prof. Dr. drh. Mozes R. Toelihere, M.Sc. (Alm.)
(Anggota) (Anggota)
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Biologi Reproduksi
Dr. drh. Tuty L. Yusuf, M.S. Dr. Ir. Khairil Anwar Notodiputro, M.S.
KATA PENGANTAR
Puji dan syukur penulis sampaikan kepada Allah SWT, yang telah
memberikan rahmat dan hidayah-Nya sehingga penelitian dan penulisan tesis ”Daya
Tahan Spermatozoa Kuda dalam Pengencer Dimitropoulos yang Disuplementasi
dengan Fruktosa, Trehalosa atau Rafinosa” dapat diselesaikan. Tesis ini disusun
sebagai salah satu syarat menyelesaikan pendidikan Program Magister Sains pada
Program Studi Biologi Reproduksi, Sekolah Pascasarjana Institut Pertanian Bogor.
Tesis ini merupakan hasil dari penelitian yang telah dilaksanakan pada bulan
Mei sampai dengan Oktober 2005. Penelitian dilaksanakan di Athena Stable
Sawangan, Kota Depok dan Laboratorium Teknologi Reproduksi, Bagian Reproduksi
dan Kebidanan, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran
Hewan Institut Pertanian Bogor.
Selama penelitian hingga selesainya penulisan tesis ini penulis banyak
mendapat bantuan dari berbagai pihak, untuk itu penulis sampaikan terima kasih.
Terutama, penulis menyampaikan terima kasih yang tulus kepada Komisi
Pembimbing: Dr. drh. Bambang Purwantara, MSc, Dr. drh. Tuty L. Yusuf, MS dan
Prof. Dr. drh. Mozes R. Toelihere, MSc (alm) atas bimbingan yang telah diberikan.
Terima kasih juga kepada Dr. drh. Iman Supriatna sebagai penguji dari luar komisi
atas masukannya untuk perbaikan tesis ini. Terima kasih kepada manajemen dan
pegawai Athena Stable yang telah mengijinkan pemakaian kuda. Tak lupa penulis
berterima kasih kepada seluruh staf dan pegawai di Bagian Reproduksi dan
Kebidanan, terutama Dra. Iis Arifiantini, MSi dan Bondan Ahmadi, SE dan
mahasiswa program sarjana FKH IPB (Don Bosko, Rizal, Azizah, Ami, dll). Terakhir,
penulis sampaikan terima kasih dan penghargaan kepada isteri tercinta Yuli Astuti, SP
dan puteri tersayang Fajrina Rizqi Riyadi, ibu/bapak, serta seluruh keluarga yang
senantiasa memberikan doa dan pengertian kepada penulis selama ini.
Penulis menyadari bahwa isi tesis ini masih jauh dari sempurna. Namun
demikian, penulis berharap tesis ini bermanfaat bagi para pembaca dan perkembangan
ilmu pengetahuan dan teknologi pada umumnya.
Bogor, Agustus 2006
RIWAYAT HIDUP
Penulis dilahirkan di Desa Brati, Kecamatan Kayen, Kabupaten Pati, Jawa
Tengah pada tanggal 6 Februari 1974. Penulis merupakan anak keempat dari enam
bersaudara dari pasangan Bapak Slamet Riyadi dan Ibu Sarinah.
Pendidikan SD, SMP dan SMA diselesaikan penulis di kota kelahiran,
masing-masing pada SDN 01 Brati Kecamatan Kayen (1988), SMPN 01 Kayen (1991), dan
SMAN 01 Pati (1994). Penulis masuk Institut Pertanian Bogor pada tahun 1994
melalui jalur Undangan Seleksi Masuk IPB (USMI). Pada tahun 1998 penulis
menyelesaikan pendidikan program sarjana pada Program Studi Kedokteran Hewan.
Pendidikan profesi dokter hewan penulis selesaikan dari perguruan tinggi yang sama
pada tahun 2000. Tahun 2002 penulis melanjutkan studi pada Program Magister
Sains, Program Studi Biologi Reproduksi Sekolah Pascasarjana IPB dengan beasiswa
dari Beasiswa Program Pascasarjana (BPPS) Direktorat Jenderal Pendidikan Tinggi,
Departemen Pendidikan Nasional.
Sejak tahun 2000 penulis bekerja sebagai staf pengajar pada Bagian
Reproduksi dan Kebidanan, Departemen Klinik, Reproduksi dan Patologi, Fakultas
Kedokteran Hewan - Institut Pertanian Bogor (FKH-IPB). Pada tahun 2003 penulis
menikah dengan Yuli Astuti, SP dan dikaruniai seorang putri Fajrina Rizqi Riyadi.
Selama menjadi staf pengajar di FKH-IPB penulis pernah mengikuti berbagai
kegiatan akademik baik di dalam maupun di luar negeri. Kegiatan tersebut antara
lain: Instruktur pada pelatihan tenaga lapangan untuk IB, PKB dan ATR di Dinas
Pertanian Kabupaten Blora Jawa Tengah (2001-2002), Instruktur pada Pelatihan
Pengolahan Semen untuk Program IB pada Sapi di Kabupaten Blora (November
2003), peserta pada Pelatihan Pemahaman Buku Ajar Perguruan Tinggi yang diadakan
oleh Dikti Depdiknas (Bandung, Oktober 2004), peserta pada Workshop on Semen
Processing and Artificial Insemination di BIB Bali (Asia Link Project, Agustus 2005),
peserta pada Short Course and Symposium on Spermatology and Reproductive
Biotechnology di Swedish University of Agricultural Sciences - Swedia (Asia Link
Project, November 2005), dan peserta pada Training Course and Symposium on
Swamp Buffalo Reproduction and Reproductive Biotechnology di Chulalongkorn
DAFTAR ISI
Bangsa, Populasi dan Manfaat Kuda di Indonesia ... 5
Anatomi-Fisiologi Organ Reproduksi Kuda Jantan ... 7
Koleksi Semen Kuda ... 9
Fisiologi Semen Kuda ... 10
Evaluasi Semen dan Dosis Inseminasi Buatan ... 15
Pengolahan Semen dan Pengaruhnya terhadap Spermatozoa ... 17
Karbohidrat di dalam Media Pengencer ... 21
Kuning Telur di dalam Media Pengencer ... 22
Pengencer Dimitropoulos (DV) ... 24
Daya Tahan Spermatozoa dalam Semen Segar ... 29
Kualitas Semen Cair dalam Pengencer Dimitropoulos yang Disuplementasi dengan Fruktosa, Trehalosa atau Rafinosa ... 29
Kualitas Semen Cair dengan Konsentrasi Spermatozoa Berbeda .... 30
Parameter yang Diamati ... 31
Rancangan Percobaan dan Analisis Data ... 31
HASIL DAN PEMBAHASAN ... 32
Karaktersitik Sifat Fisik Semen Segar ... 32
Daya Tahan Spermatozoa dalam Semen Segar ... 38
Kualitas Semen Cair dalam Pengencer Dimitropoulos yang Disuplementasi dengan Fruktosa, Trehalosa atau Rafinosa ... 43
SIMPULAN DAN SARAN ... 57
Simpulan ... 57
Saran ... 57
DAFTAR PUSTAKA ... 58
DAFTAR TABEL
Halaman
1. Perkembangan populasi kuda di Indonesia dan lima provinsi dengan
populasi terbesar (tahun 1995, 1997, 1999, 2001 dan 2003)…... 6
2. Kisaran normal parameter evaluasi semen segar kuda ... 16
3. Pengaruh jenis pengencer terhadap motilitas spermatozoa kuda pada suhu 5 o C ... 18
4. Komposisi bahan kimia di dalam kuning telur ayam ... 23
5. Komposisi dasar bahan pengencer Dimitropoulos ... 25
6. Data identitas hewan percobaan ... 26
7. Suplementasi fruktosa, trehalosa atau rafinosa dalam pengencer Dimitropoulos ... 30
8. Perlakuan semen cair dengan konsentrasi spermatozoa berbeda ... 31
9. Karakteristik sifat fisik semen segar kuda ... 32
10. Presentase spermatozoa motil progresif dan presentase hidup semen segar pada suhu ruang dan 4-6 o C ... 39
11. Penurunan presentase spermatozoa motil progresif semen segar pada suhu ruang dan 4-6 o C ... 49
12. Presentase motilitas dan hidup semen cair dalam pengencer DV yang disuplementasi dengan fruktosa, trehalosa atau rafinosa pada suhu ruang ... 45
13. Presentase motilitas dan hidup semen cair dalam pengencer DV yang disuplementasi dengan fruktosa, trehalosa atau rafinosa pada suhu suhu 4-6 o C ... 46
14. Presentase motilitas dan hidup semen cair dalam pengencer DV + fruktosa 50 mM dengan konsentrasi berbeda pada suhu ruang ... 51
15. Presentase motilitas dan hidup semen cair dalam pengencer DV + fruktosa 50 mM dengan konsentrasi berbeda pada suhu ruang ... 52
DAFTAR GAMBAR
Halaman
1. Skematis organ reproduksi kuda jantan ... 8
2. Tiga model dasar vagina buatan kuda ... 10
3. Ilustrasi spermatozoa dengan bagian-bagiannya ... 11
4. Jalur metabolisme glukosa dan fruktosa di dalam sel spermatozoa ... 14
5. Skematis hubungan proses metabolisme sel dan peroksidasi asam lemak ... 20
6. Pengaruh pendinginan dan pemanasan terhadap membran spermatozoa ... 20
7. Rangkaian alur seluruh tapan penelitian ... 27
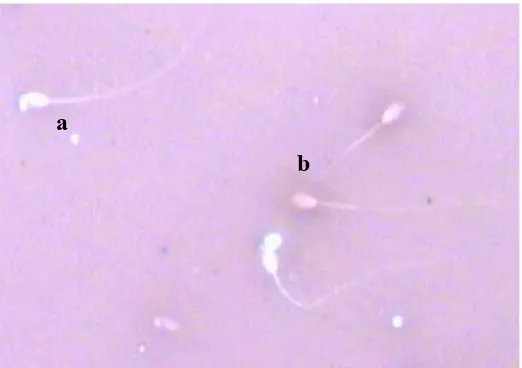
8. Spermatozoa hidup dan mati dengan pewarnaan eosin-negrosin 2% ... 35
9. Beberapa bentuk abnormalitas pada spermatozoa kuda ... 37
10. Jenis dan presentase abnormalitas primer pada spermatozoa kuda ... 37
11. Jenis dan presentase abnormalitas sekunder pada spermatozoa kuda ... 37
12. Grafik penurunan motilitas dan presentase hidup semen segar pada suhu ruang dan suhu 4-6 o C ... 40
13. Grafik penurunan motilitas semen cair dalam pengencer DV yang disuplementasi dengan fruktosa, trehalosa atau rafinosa pada suhu ruang ... 47
14. Grafik penurunan spermatozoa hidup semen cair dalam pengencer DV yang disuplementasi dengan fruktosa, trehalosa atau rafinosa pada suhu ruang ...47
15 Grafik penurunan motilitas semen cair dalam pengencer DV yang disuplementasi fruktosa, trehalosa atau rafinosa pada suhu 4-6 oC ... 49
16. Grafik penurunan presentase hidup semen cair dalam pengencer DV yang disuplementasi fruktosa, trehalosa atau rafinosa pada suhu 4-6 o C ... 49
17. Grafik penurunan motilitas dan spermatozoa hidup semen cair dengan konsentrasi spermatozoa berbeda pada suhu ruang ... 52
DAFTAR LAMPIRAN
Halaman
1. Pembuatan pengencer Dimitropoulos (DV)... 64
2. Metode pewarnaan diferensial eosin-negrosin untuk evaluasi hidup-mati dan abnormalitas spermatozoa ... 65
PENDAHULUAN
Latar Belakang
Pembangunan sektor peternakan akhir-akhir ini mendapat perhatian serius dari
pemerintah dan seluruh masyarakat seiring dengan peningkatan kebutuhan sumber
protein hewani (daging dan susu). Hal ini karena hingga saat ini produksi daging dan
susu dalam negeri sulit memenuhi kebutuhan masyarakat. Oleh karena itu, perlu
dikembangkan ternak alternatif misalnya kuda, disamping peternakan yang sudah ada
seperti sapi, kambing dan unggas. Peternakan kuda di Indonesia belum mendapatkan
perhatian serius dari pemerintah dan masyarakat. Bahkan perkembangbiakannya
masih mengandalkan perkawinan alam, sehingga populasinya terus menurun.
Sebenarnya, ternak kuda dapat dimanfaatkan sebagai sarana transportasi,
sarana olahraga, sarana hiburan, hewan kesayangan, serta sumber protein hewani
(daging dan susu). Di sekitar Yogyakarta dan Jawa Tengah cukup banyak masyarakat
mengkonsumsi daging kuda sebagai sumber protein hewani karena diyakini dapat
menghilangkan pegal linu, mempertinggi daya tahan tubuh, dan menambah vitalitas
pria (Putro 2003). Sementara itu, susu kuda liar (kuda Sumbawa) sudah lama
dikonsumsi oleh masyarakat karena diyakini bisa menyembuhkan kanker, bronkhitis,
tipus dan menambah stamina pria. Susu kuda Sumbawa terbukti mempunyai aktivitas
antimikroba paling baik diantara semua kuda di Indonesia (Hermawati 2003).
Hingga tahun 2003, di Indonesia terdapat 11 jenis kuda lokal, yaitu kuda
Gayo, kuda Batak, kuda Jawa, kuda Priangan, kuda Sulawesi, kuda Lombok, kuda
Bali, kuda Sumbawa, kuda Sandel, kuda Flores dan kuda Timor (Sudarjat 2003).
Namun demikian, populasi kuda terus mengalami penurunan yang diduga terkait
dengan tingginya angka pemotongan yang didorong oleh kesulitan ekonomi peternak
dan rendahnya angka kelahiran.
Usaha untuk meningkatkan populasi ternak kuda di Indonesia perlu terus
dilakukan, diantaranya dengan penerapan teknologi reproduksi inseminasi buatan
(IB). Saat ini, IB pada kuda telah dilakukan secara terbatas menggunakan semen beku
impor. Adanya Balai IB, balai/pusat penelitian bidang peternakan dan perguruan
tinggi, potensi kuda lokal dapat lebih dikembangkan melalui teknik IB. Pelaksanaan
Pelaksanaan IB dengan semen cair terbukti mempunyai fertilitas lebih tinggi dan lebih
murah daripada semen beku (Morel 1999). Squires dan Pickett (1986) mendapatkan
angka kebuntingan IB dengan segar, cair dan beku masing-masing adalah 76%, 65%
dan 56%.
Keberhasilan IB memerlukan semen yang berkualitas baik. Oleh karena itu,
proses pengolahannya perlu perhatian serius karena karakteristik semen kuda berbeda
dengan semen ternak lainnya. Semen kuda terdiri atas tiga fraksi, yaitu fraksi
pra-spermatozoa, fraksi kaya-spermatozoa dan fraksi pasca-spermatozoa (Allen 1988,
Morel 1999). Semen kuda mempunyai volume banyak dengan konsentrasi rendah.
Plasma semen, karena kandungan natrium yang tinggi diduga berpengaruh negatif
pada saat pengolahan, pendinginan atau pembekuan (Morel 1999). Untuk itu perlu
dilakukan pembuangan plasma semen, yang biasa dilakukan dengan sentrifugasi.
Pemrosesan semen kuda membutuhkan media pengencer yang spesifik, yang
seharusnya mengandung sumber energi, buffer, bahan anti cold shock, isotonik dengan
plasma semen, mengandung mineral tertentu yang seimbang, isotermal dengan semen
dan mengandung antibiotik. Toelihere (1979b) dan Morel (1999) menyatakan bahwa
sumber karbohidrat yang banyak digunakan pada preservasi semen kuda adalah
glukosa, sedangkan pada ternak lain adalah fruktosa. Namun demikian, penambahan
disakarida dan oligosakarida dalam media pengencer pada semen beberapa ternak
mampu mempertahankan kualitas semen cair maupun semen beku (Yildiz et al. 2000).
Penambahan trehalosa yang dikombinasikan dengan EDTA pada pembekuan semen
domba dilaporkan dapat meningkatkan persentase spermatozoa motil dibandingkan
dengan menggunakan fruktosa (Aisen et al. 2000).
Penentuan jenis karbohidrat sebagai sumber energi sekaligus sebagai
pelindung spermatozoa terhadap suhu rendah (anti-cold shock) menjadi penting
karena karbohidrat yang sesuai akan meningkatkan daya simpan spermatozoa. Di
samping itu, kualitas dan daya tahan semen cair selain dipengaruhi kualitas semen
segar dan media pengencer juga ditentukan oleh teknik pengolahan dan konsentrasi
semen cair. Hal ini karena metabolisme spermatozoa selama penyimpanan sangat
mempengaruhi daya tahannya (Toelihere 1979b).
Untuk itu pada penelitian ini ingin diketahui daya tahan simpan spermatozoa
digunakan di Eropa yaitu Dimitropoulos (DV) yang disuplementasi dengan fruktosa,
trehalosa dan rafinosa. Mengingat peternakan kuda di Indonesia tersebar di beberapa
daerah dan biasanya jauh dari perkotaan, maka penyimpanan semen pada suhu ruang
(26-28 o
C) dan lemari es (4-6 o
C) diharapkan memberi gambaran transportasi semen
dari tempat pengolahan ke peternak. Selanjutnya ingin diketahui daya simpan semen
pada konsentrasi spermatozoa berbeda, yang berkaitan dengan dosis dan volume IB.
Kerangka Pemikiran
Untuk menghasilkan semen cair dengan kualitas baik perlu dikembangkan
metode pengolahan dan bahan pengencer yang sesuai. Karbohidrat merupakan salah
satu komponen penting untuk memenuhi kebutuhan nutrisi spermatozoa selama dalam
penyimpanan. Pada penelitian ini akan dicobakan pengencer DV yang berbahan dasar
kuning telur, buffer Na-sitrat dan sumber energi berupa glukosa dan fruktosa.
Glukosa dan fruktosa merupakan monosakarida yang biasa dijumpai di dalam plasma
semen, dan umum ditambahkan ke dalam pengencer semen pada berbagai ternak.
Sedangkan trehalosa (disakarida) dan rafinosa (oligosakarida) dilaporkan dapat
berperan pada stabilitas membran plasma karena berfungsi sebagai krioprotektan
ekstra-seluler (anti-cold shock), disamping sebagai sumber energi. Oleh karena itu,
pada penelitian ini dilakukan suplementasi fruktosa, trehalosa atau rafinosa ke dalam
DV. Senyawa buffer yang baik akan mempertahankan pH media relatif tidak berubah.
Kuning telur sering ditambahkan ke dalam pengencer karena peranan lesitin dan
lipoprotein yang dikandungnya sebagai anti-cold shock. Dosis pengenceran semen
cair terkait dengan dosis inseminasi perlu diketahui untuk mendapatkan angka
kebuntingan yang tinggi pada program IB. Penyimpanan semen pada suhu ruang
(26-28 o
C) dan lemari es (4-6 o
C) diharapkan memberi gambaran transportasi semen dari
Tujuan Penelitian
Secara umum penelitian ini bertujuan untuk mempelajari metode produksi
semen cair yang aplikatif di lapangan dengan kualitas baik. Secara rinci, tujuan
penelitian adalah :
1. Mengetahui karakteristik ejakulat (semen segar) kuda
2. Mengetahui daya tahan simpan spermatozoa (semen segar) pada suhu ruang
(26-28 o
C) dan suhu lemari es (4-6 o
C).
3. Menentukan suplementasi karohidrat dalam pengencer dimitropoulos yang terbaik
pada semen cair yang disimpan pada suhu ruang dan lemari es.
4. Menentukan konsentrasi spermatozoa terbaik pada semen cair menggunakan
pengencer dimitropolous pada suhu ruang dan lemari es.
Manfaat Penelitian
Dari penelitian ini diharapkan akan dihasilkan metode pengolahan semen cair
kuda (preservasi) yang tepat sehingga aplikasi IB pada kuda dapat dioptimalkan
dengan semen cair untuk meningkatkan populasi dan kualitas kuda di Indonesia.
Apabila IB dilakukan kepada kuda betina lokal menggunakan semen cair dari kuda
impor (ras), maka secara tidak langsung program up grading telah dijalankan.
Hipotesis
Hipotesis yang diajukan pada penelitian ini adalah:
1. Penyimpanan semen segar di dalam lemari es (4-6 o
C) akan menurunkan kualitas
dan daya tahan spermatozoa kuda dibandingkan dengan suhu ruang (26-28 o
C).
2. Suplementasi fruktosa, trehalosa dan rafinosa dengan konsentrasi optimal dapat
memperbaiki kualitas semen cair kuda dalam pengencer Dimitropoulos.
3. Daya tahan semen cair kuda dengan konsentrasi spermatozoa lebih rendah akan
TINJAUAN PUSTAKA
Bangsa, Populasi dan Manfaat Kuda di Indonesia
Secara zoologis kuda termasuk pada ordo Perissodactyla, famili Equidae,
genus Equus, dan spesies Equus caballus (Radiopoetra 1977). Berdasarkan
asal-usulnya ada dua atau tiga jenis kuda yang memberikan kontribusi pada kuda yang
didomestikasikan saat ini, yaitu kuda liar (Equus przewalskii), keledai (Equus mullus)
dan zebra (Equus burchelli) (Soehadji 2003).
Menurut Bongianni (1995) terdapat 178 jenis kuda yang tesebar di seluruh
dunia dan 6 diantaranya terdapat di Indonesia, yaitu kuda Timor, Bali, Sandalwood,
Jawa, Batak dan Sumba-Sumbawa. Sedangkan menurut Sudarjat (2003), ada 11 jenis
kuda lokal Indonesia yaitu kuda Gayo, Batak, Jawa dan Bali, Priangan, Sulawesi,
Lombok, Sumbawa, Sandel, Flores dan Timor. Namun demikian, menurut
Soehardjono (1990) sampai tahun 1920-an sebenarnya terdapat 13 jenis kuda lokal
Indonesia, yaitu kuda Makasar, Gorontalo dan Minahasa, Sumba, Sumbawa, Bima,
Flores, Savoe, Roti, Timor, Sumatera, Bali, Lombok, dan Kuningan. Kuda Sumatera
terdiri atas empat jenis yaitu kuda Padang, Batak, Agam dan Gayo.
Populasi kuda di Indonesia terus mengalami penurunan. Pada tahun 1997
populasi kuda mencapai 582 300 ekor, sedangan tahun 2003 sekitar 452 900 ekor
(Tabel 1). Rata-rata penurunan populasi kuda di Indonesia dari tahun 1997 sampai
dengan 2003 adalah sekitar 22.20% (3.7% per tahun). Penurunan tersebut diduga
terkait dengan tingginya angka pemotongan yang didorong oleh kesulitan ekonomi
peternak, pengafkiran oleh berbagai sebab, dan rendahnya angka kelahiran.
Kuda banyak dimanfaatkan sebagai hewan pacu, olahraga polo, permainan
dalam sirkus, penarik kereta, penarik beban, tenaga pertanian, kepentingan militer
(kaveleri), pariwisata, serta sumber daging dan susu (Hermawati 2003, Putro 2003,
Sudarjat 2003). Susu kuda, karena kandungan kalsium, lisozim dan protein relatif
tinggi, sedangkan kandungan lemak dan kolesterol relatif rendah dipercaya dapat
meningkatkan kesehatan orang tua, orang dalam proses penyembuhan penyakit, dan
anak balita yang sering mengalami gangguan pencernaan (Soedarwanto et al. 1998).
Susu kuda liar (kuda Sumbawa) sudah lama dikonsumsi masyarakat karena diyakini
menambah stamina pria. Di samping itu, susu kuda Sumbawa terbukti mempunyai
aktivitas antimikroba, paling baik diantara semua jenis kuda yang ada di Indonesia
(Hermawati 2003). Beberapa bakteri yang peka terhadap susu kuda Sumbawa antara
lain adalah Salmonella typhymurium, Staphylococcus aureus, Vibrio cholera,
Pseudomonas aeruginosa, Escherichia coli, dan Bacillus subtilis.
Tabel 1. Perkembangan populasi kuda di Indonesia dan lima provinsi dengan populasi terbesar (tahun 1997, 1999, 2001 dan 2003)
No Provinsi Tahun (ekor) Keterangan : *) data sampai dengan akhir Mei 1999; (-) tidak ada data
(...) angka dalam kurung adalah jumlah pemotongan Sumber : a [Ditjennak Deptan dan Asohi](1999) (diolah)
b BPS (2001) (diolah) c BPS (2003) (diolah)
Daging kuda sebagai sumber protein hewani dikonsumsi oleh masyarakat di
beberapa daerah di Indonesia. Di beberapa wilayah di Yogyakarta dan Jawa Tengah
terdapat komunitas yang biasa mengkonsumsi daging kuda (Putro 2003). Hal ini
karena daging kuda diyakini mempunyai banyak manfaat, diantaranya adalah dapat
menghilangkan pegal linu, mempertinggi daya tahan tubuh, menambah vitalitas pria,
menyembuhkan gatal-gatal dan eksim, serta menyembuhkan sesak nafas dan batuk.
Namun, selain kadar lemak yang relatif lebih rendah (kuda 2.5%, sapi 1.5-13%) dan
protein yang relatif lebih tinggi (kuda 20%, sapi 16-22%), sesungguhnya kualitas
Anatomi-fisiologi Organ Reproduksi Kuda Jantan
Organ reproduksi kuda jantan terdiri atas organ kelamin primer (testis),
epididimis, kelenjar pelengkap yang terdiri atas ampulla, vesikularis (vesica
seminalis), prostat, bulbouretralis (Cowper’s), dan organ kelamin luar (penis)
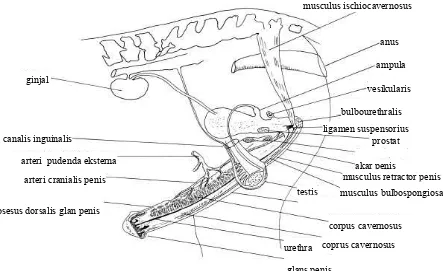
(Gambar 1) (Morel 1999).
Testis. Testis kuda terdapat sepasang dan berada pada bagian luar badan, dengan sumbu memanjang horisontal. Testis berbentuk oval dengan ukuran panjang
7.5-12.5 cm, lebar sekitar 4 cm dan tinggi 4-7 cm, dengan berat 150-170 g (Hafez &
Hafez 2000, Peter 2005). Pada Thoroughbred ukuran panjang, lebar dan tinggi testis
rata-rata adalah 10 cm, 6 cm, dan 5 cm, dan berat 300-350 g (Allen 1988). Ukuran ini
dapat meningkat sampai pertumbuhan maksimal, yaitu sekitar umur 5 tahun.
Testis berfungsi sebagai organ endokrin yang menghasilkan hormon (terutama
testosteron) dan tempat spermatogenesis (di tubuli seminiferi). Testis berada pada
bagian luar badan agar dapat mengatur suhunya 35-36 o
C (sekitar 3 o
C di bawah suhu
tubuh), sehingga spermatogenesis berlangsung optimal. Selama dalam kandungan
induk, testis terdapat pada ruang abdomen dekat ginjal dan akan turun masuk ke
dalam skrotum melalui canalis inguinalis dalam waktu 1-3 minggu setelah lahir
(Hafez 2000), atau hari ke-315 kebuntingan sampai dengan 2 minggu setelah lahir
(Peter 2005). Testis kuda yang menetap di dalam ruang abdomen (bila keduanya
disebut cryptorchid, bila salah satu disebut monorchid) mungkin tetap menghasilkan
spermatozoa, tetapi jumlahnya berkurang atau abnormalitasnya tinggi (Peter 2005).
Epididimis. Epididimis melekat pada bagian atas testis dengan kepala (caput), badan (corpus) dan ekor (cauda) epididimis terletak pada bagian depan, atas dan
belakang (Morel 1999, Peter 2005). Bagian kepala epididimis berhubungan dengan
beberapa saluran dari rete testis. Pada bagian ujung epididimis saluran-saluran kecil
tadi bergabung menjadi satu membentuk saluran tunggal yang disebut vas deferens.
Epididimis berperan di dalam pematangan (bagian kepala dan badan) dan
penyimpanan spermatozoa (bagian ekor), sehingga spermatozoa menjadi lebih motil
dan fertil (Hafez 2000).
Vas deferens. Vas deferens merupakan kelanjutan dari epididimis, dengan ukuran panjang 25-30 cm dan diameter 4-5 mm (Morel 1999). Pada bagian akhir yang
ternak lain fungsi vas deferens pada kuda lebih kompleks, terutama bagian yang
berdekatan dengan epididimis, dimana pada mukosanya terdapat banyak lipatan,
sehingga memperluas permukaan untuk penyimpanan spermatozoa. Vas deferens
memasuki ruang abdomen melalui canalis inguinalis, dan selanjutnya menyalurkan
spermatozoa ke uretra.
Gambar 1. Skematis organ reproduksi kuda jantan (Morel 1999)
Kelenjar pelengkap (accessory glands). Terdapat empat kelenjar pelengkap yaitu ampula, vesikularis (vesica seminalis), prostat dan bulbouretralis (Cowper’s)
(Morel 1999, Hafez 2000). Fungsi kelenjar tersebut bersama-sama menghasilkan
sebagian besar plasma semen. Ampula menghasilkan sekresi yang banyak
mengandung ergotionin, inositol, fruktosa dan asam sitrat. Kelenjar vesikularis
terdapat sepasang dan berlobus, menghasilkan sekresi yang banyak mengandung
kalium dan asam sitrat. Sekresi kelenjar vesikularis merupakan komponen terbanyak
dari plasma semen dan fraksi gel. Kelenjar prostat terdapat satu yang terdiri dari dua
lobus, menghasilkan sekresi seperti air, encer, pH asam dan banyak mengandung musculus ischiocavernosus
anus
ampula
vesikularis
bulbourethralis
ligamen suspensorius prostat
akar penis
musculus retractor penis musculus bulbospongiosa testis
corpus cavernosus
coprus cavernosus urethra
prosesus dorsalis glan penis arteri cranialis penis arteri pudenda eksterna canalis inguinalis
ginjal
protein, asam sitrat dan Zn. Kelenjar Cowper’s terdapat sepasang, menghasilkan
sekresi seperti air, encer dan banyak mengandung NaCl.
Penis. Penis dengan saluran uretra di dalamnya, merupakan organ kopulatoris (menyalurkan semen ke luar pada saat kopulasi). Penis terbagi atas bagian akar atau
pangkal (radix), badan (corpus) dan kepala (glans) penis. Pada posisi istirahat penis
terdapat di dalam dan dilindungi oleh preputium. Pada badan penis terdapat dua
corpora cavernosa, yang bagian bawah disebut corpus cavernosus uretra dan bagian
atas disebut corpus cavernosus penis (Morel 1999). Corpora cavernosa pada penis
kuda sangat besar (tipe musculocavernosum) sehingga pada saat ereksi penis nyata
bertambah besar karena cavernosa lebih banyak diisi darah dibandingkan dengan
hewan lain yang termasuk tipe fibroelastis, seperti sapi dan domba.
Koleksi Semen Kuda
Koleksi semen dari hewan dapat dilakukan dengan beberapa cara yaitu
mengambil kembali ejakulat dari vagina (recovery), menggunakan vagina buatan,
elekroejakulator dan pengurutan (masase) (Sorenson 1979). Pada kuda, koleksi semen
umumnya dilakukan dengan menggunakan vagina buatan, karena semen yang
dihasilkan paling mendekati fisiologik. Alternatif lain adalah stimulasi manual dengan
merangsang penis menggunakan handuk yang dihangatkan pada suhu 45-50 o
C.
Kualitas semen yang dihasilkan bervariasi, tetapi jika dilakukan secara rutin akan
menimbulkan kebiasaan sehingga semen terkoleksi berkualitas baik (Morel 1999).
Saat ini banyak model vagina buatan digunakan dalam koleksi semen kuda.
Tetapi, pada dasarnya terdiri atas tiga model yaitu model Nishikawa, Cambridge dan
Missouri (Gambar 2) (Morel 1999). Pengembangan model vagina buatan diantaranya
menghasilkan tipe lebih kecil (tipe Colorado, INRA, Hannover dan Roanoke) dan
vagina buatan open ended yang memungkinkan untuk mengkoleksi semen hanya dari
fraksi kaya-spermatozoa.
Sebelum digunakan, vagina buatan disiapkan dengan memasang semua
komponen, memasukkan air hangat, memompakan udara dan mengolesi pelicin pada
bagian dalam. Suhu pada bagian dalam vagina buatan sebaiknya adalah sekitar 43-45
o
berapa lapis untuk menyaring ejakulat sehingga fraksi gel tidak ikut masuk. Hal ini
karena fraksi gel mempunyai efek tidak baik terhadap spermatozoa (Morel 1999).
Gambar 2. Tiga model dasar vagina buatan kuda: a) tipe Nishikawa, b) tipe Cambridge, dan c) tipe Missouri (Morel 1999).
Fisiologi Semen Kuda Spermatozoa
Semen merupakan cairan suspensi yang terdiri atas sel gamet jantan
(spermatozoa) dan cairan yang disekresikan oleh saluran reproduksi dan kelenjar
pelengkap (plasma semen). Spermatozoa sebagai hasil akhir proses spermatogenesis
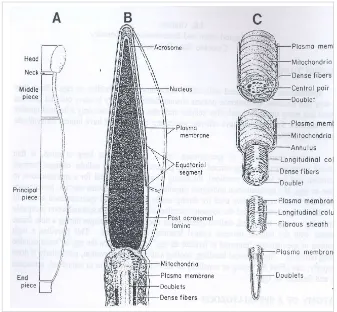
merupakan sel yang berbentuk memanjang dengan bagian kepala sedikit pipih dan
ekor yang panjang (Garner & Hafez 2000) (Gambar 3). Untuk proses fertilisasi,
spermatozoa harus mempunyai cukup energi untuk pergerakan, protein dan senyawa
lain yang penting selama dalam saluran kelamin betina, dan plasma membran yang
baik sehingga dapat melakukan fertilisasi tepat waktu (Graham 1996a).
Kepala spermatozoa secara umum berbentuk oval, sedikit pipih, dan terdapat
nukleus yang mengandung kromosom (deoxyribonucleic acid = DNA) (Morel 1999).
Pada bagian ujung depan kepala ditutupi oleh akrosom, yaitu sebuah kantung tipis
dengan membran-ganda yang mengandung acrosin, hyaluronidase, dan enzim
hidrolitik lain yang berperan pada penembusan corona radiata dan zona pellucida
pada proses fertilisasi (Bearden & Fuquay 1997). Sedangkan bagian equatorial
berperan sebagai tempat yang mengawali proses penempelan dan penggabungan
membran spermatozoa dengan membran oosit selama proses fertilisasi (Morel 1999).
Ekor spermatozoa terdiri atas bagian leher (neck), tengah (midle), principal
dan ujung (end) (Garner & Hafez 2000). Bagian leher menghubungkan kepala dengan
ekor. Ekor spermatozoa mengandung serabut-serabut fibril (axial filament) yang
tersusun secara radial. Axial filament ini tersusun mulai dari sentriol atas dan berjalan
sampai dengan ujung ekor. Susunannya dari luar ke tengah adalah 9 filamen besar, 9
pasang filamen kecil dan 2 filamen kecil di pusat (Bearden & Fuquay 1997).
Serabut-serabut ini bertanggung jawab terhadap pergerakan spermatozoa. Pada middle piece
serabut-serabut tersebut diselubungi oleh mitokondria yang tersusun secara heliks
mengelilingi sumbu memanjang. Mitokondria merupakan tempat metabolisme yang
menghasilkan energi. Pada principal piece, serabut-serabut yang ada hanya 2 filamen
pusat dikelilingi 9 pasang filamen kecil. Sedangkan pada end piece hanya
mengandung 2 filamen pusat yang diselubungi membran.
Plasma Semen
Plasma semen merupakan fraksi cair dari semen, yang sebagian besar
disekresikan oleh kelenjar pelengkap. Secara umum, plasma semen mengandung
banyak senyawa kimia yang penting bagi spermatozoa dan proses reproduksi berupa
ion anorganik, ion organik dan sumber energi. Kandungan senyawa kimia (anorganik)
pada plasma semen bervariasi antar-individu, level testosteron, frekuensi ejakulasi
(perkawinan), fraksi semen terkoleksi dan musim (Morel 1999).
Ion-ion anorganik utama pada plasma semen adalah Na, Cl, Ca, Mg dan K.
Ion-ion tersebut penting untuk viabilitas spermatozoa, melalui peranannya dalam
menjaga integritas membran dan tekanan osmotik (Bearden & Fuquay 1997).
Sedangkan ion organik yang utama adalah bikarbonat yang berperan sebagai buffer
(mencegah penurunan pH semen).
Semen kuda diejakulasikan dalam 6-8 jets. Semen yang diejakulasikan terdiri
atas tiga fraksi yaitu fraksi pra-spermatozoa, kaya-spermatozoa dan
pasca-spermatozoa (Morel 1999). Fraksi pra-pasca-spermatozoa merupakan cairan yang bertindak
sebagai pelumas uretra sehingga membuang sisa urin, mikroba dan kotoran lain di
sepanjang uretra. Fraksi pra-spermatozoa berasal dari sekresi kelenjar Cowper’s,
prostat dan mungkin ampula yang keluar sebelum berkopulasi, dengan konsistensi
encer seperti air. Pada fraksi ini umumnya tidak ditemukan spermatozoa, atau banyak
yang sudah tua atau mati. Fraksi ini hanya sedikit mengandung ergotionin,
glycerylphosphoryl choline (GPC) dan asam sitrat, tetapi banyak mengandung NaCl.
Fraksi kaya-spermatozoa mengandung 80–90% spermatozoa dan 80-90% komponen
biokimia semen. Plasma semen terutama berasal dari kelenjar sepanjang epididimis,
ampula dan Cowper’s. Fraksi ini banyak mengandung ergotionin dan GPC, tetapi
rendah NaCl dan asam sitrat. Fraksi kaya-spermatozoa diejakulasikan dalam 3 jets
pertama ejakulasi. Fraksi pasca-spermatozoa disebut juga fraksi gel, sebagian besar
berasal dari sekresi kelenjar vesikularis. Kandungan spermatozoa dan ergotionin pada
fraksi ini sedikit, tetapi banyak mengandung kalium.
Pada semen kuda, plasma semen dianggap mempunyai efek negatif terhadap
spermatozoa selama penyimpanan pada suhu dingin. Oleh karena itu, pemisahan
plasma semen perlu dilakukan untuk menghindari pengaruh negatif dari tingginya
pendinginan dan pembekuan (Morel 1999). Pemisahan plasma semen juga akan
membuang sebagian mikroba patogen yang ada (Pickett et al. 2005) dan
meningkatkan perlindungan terhadap kromatin spermatozoa (Love et al. 2002). Ini
ditunjukkan dengan semakin sedikit plasma semen yang tersisa dalam pengolahan
semen dalam berbagai jenis pengencer akan semakin tinggi motilitas spermatozoa.
Namun demikian, penambahan plasma semen dari kuda yang tahan pendinginan ke
kuda yang tidak tahan dapat meningkatkan motilitas dan keutuhan membran Aurich et
al. (1996). Hal ini kemungkinan terkait dengan konsentrasi kolesterol atau faktor
penghambat pelepasan kolesterol yang lebih tinggi pada plasma semen dari kuda yang
tahan pendinginan.
Metabolisme Spermatozoa
Mitokondria yang terdapat mengelilingi bagian midpiece spermatozoa
berperan di dalam metabolisme yang menghasilkan energi untuk pergerakan, dengan
bantuan berbagai enzim yang terdapat di dalamnya. Secara umum, sel spermatozoa
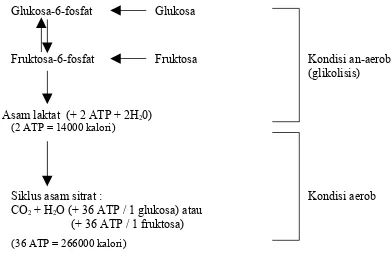
akan mengubah substrat menjadi energi melalui dua jalur, yaitu jalur glikolisis dan
jalur siklus Krebs. Pada kondisi an-aerob, spermatozoa akan mengubah glukosa,
fruktosa dan manosa menjadi energi dan asam laktat melalui jalur Embden-Meyerhof
(glikolisis) yang terjadi di dalam sitosol (Garner & Hafez 2000). Kondisi ini penting
bagi spermatozoa untuk bertahan hidup selama penyimpanan untuk keperluan
inseminasi buatan karena metabolisme anerobik berjalan lambat. Sedangkan pada
kondisi aerob, spermatozoa akan mengubah laktat atau piruvat hasil perombakan
fruktosa untuk menghasilkan karbon dioksida dan air melalui jalur siklus Krebs
(siklus asam sitrat) yang terjadi di dalam mitokondria (Mayes 1996, Mann 1964
dalam Morel 1999) (Gambar 4). Pada kondisi tanpa substrat eksogen, spermatozoa
akan menggunakan plasmalogen (glikolipid) membran sebagai sumber energi jangka
pendek (Garner & Hafez 2000).
Menurut Garner dan Hafez (2000), energi untuk motilitas spermatozoa berasal
dari perombakan adenosin trifosfat (ATP) di dalam membran mitokondria melalui
reaksi-reaksi penguraiannya menjadi adenosin difosfat (ADP) dan adenosin
monofosfat (AMP). Pengubahan ATP menjadi ADP menghasilkan energi sebanyak
Fosfatase
ATP + H2O ADP + H3PO4 + energi (7000 kalori/mol)
Perombakan glukosa atau fruktosa ekstraseluler menghasilkan 2 molekul ATP
melalui jalur glikolisis dan 36 ATP melalui siklus asam sitrat (Morel 1999) (Gambar
4). Pemanfaatan substrat ekstraseluler termasuk fosfolipid memenuhi 90% kebutuhan
energi spermatozoa, sedangkan sisanya berasal dari perombakan substrat intraseluler.
Pada sapi, 60% dari total ATP dipergunakan untuk pergerakan, sedangkan 40% ATP
untuk fosforilasi dan defosforilasi kembali dalam tahapan metabolisme.
Glukosa-6-fosfat Glukosa
Fruktosa-6-fosfat Fruktosa Kondisi an-aerob
(glikolisis)
Asam laktat (+ 2 ATP + 2H20)
(2 ATP = 14000 kalori)
Siklus asam sitrat : Kondisi aerob
CO2 + H2O (+ 36 ATP / 1 glukosa) atau
(+ 36 ATP / 1 fruktosa)
(36 ATP = 266000 kalori)
Sumber : Bearden dan Fuquay (1997) dan Morel (1999)
Gambar 4. Jalur metabolisme glukosa dan fruktosa di dalam sel spermatozoa
Sorbitol, GPC dan plasmalogen juga dapat dimetabolisme sebagai sumber
energi cadangan. Perombakan sorbitol dan GPC melalui jalur metabolisme yang mirip
dengan fruktosa dan glukosa, sedangkan plasmalogen (glikolipid) karena lebih bersifat
lipid melalui jalur metabolisme yang berbeda (Bearden & Fuquay (1997).
Proses metabolisme energi yang berlangsung dominan berbeda pada
metabolisme secara anaerobik, sedangkan pada spermatozoa kuda nampaknya lebih
banyak menjalani metabolisme secara aerobik untuk menghasilkan energi (Morel
1999). Asam laktat (sisa metabolisme anaerobik) dan CO2 (sisa metabolisme
anaerobik) dapat menurunkan pH media. Pada proses metabolisme aerobik akan
menghasilkan banyak hidrogen peroksida di dalam mitokondria, yang diketahui
mempunyai efek merusak membran plasma melalui peroksidasi asam lemak. Efek
peroksidasi asam lemak antara lain adalah menurunkan integritas membran, kerusakan
enzim, serta menurunkan motilitas dan daya tahan hidup. Di lain pihak, pada proses
metabolisme secara an-aerobik juga terbentuk asam laktat. Penumpukan asam laktat
akan menyebabkan penurunan pH media yang dapat berpengaruh pada motilitas dan
viabilitas spermatozoa.
Laju metabolisme spermatozoa dapat dipengaruhi oleh beberapa faktor, antara
lain suhu, pH, tekanan osmotik, konsentrasi spermatozoa, hormon, gas, cahaya, dan
anti-bakterial (Bearden & Fuquay 1997). Penurunan suhu, pH terlalu asam atau basa,
media tidak isotonik, dan adanya androgen dapat menurunkan laju metabolisme.
Peningkatan konsentrasi spermatozoa di atas konsentrasi ejakulat atau pengenceran
berlebihan menurunkan laju metabolisme spermatozoa. Peningkatan asam laktat dan
CO2 dapat menurunkan metabolisme, sedangkan peningkatan O2 meningkatkan
metabolisme. Intensitas cahaya berlebihan diketahui menurunkan metabolisme,
motilitas dan fertilitas spermatzoa. Antibakterial berperan menahan perkembangan
bakteri, sehingga pemanfaatan sumber energi oleh spermatozoa lebih optimal.
Evaluasi Semen dan Dosis Inseminasi Buatan
Evaluasi dilakukan untuk mengetahui kualitas semen yang dikoleksi, kadar
pengenceran dan jumlah betina yang dapat diinseminasi. Secara umum evaluasi semen
kuda dilakukan seperti pada semen ternak lain, yaitu evaluasi secara makroskopik dan
mikroskopik. Evaluasi secara makroskopik dilakukan untuk mengetahui volume,
warna, konsistensi dan pH semen. Sedangkan secara mikroskopik antara lain untuk
mengetahui motilitas, konsentrasi, persentase hidup, morfologi dan daya tahan simpan
(Tabel 2). Berdasarkan beberapa parameter tersebut dapat diputuskan apakah semen
Evaluasi secara makroskopik dilakukan untuk menduga kualitas semen
sebelum dievaluasi mikroskopik. Menurut Toelihere (1979b) semen kuda mempunyai
volume 60-100 mL, pH 7.4, warna putih terang sampai kelabu, dan konsistensi encer.
Semen kuda mempunyai motilitas sekitar 65%, konsentrasi (100-150) x 106
sel/mL,
dan morfologi normal sekitar 80%. Konsentrasi spermatozoa dapat dihitung dsengan
hemositometer atau spektrofotometer. Sedangkan evaluasi persentase hidup dan
morfologi spermatozoa dengan pewarna diferensial, misalnya eosin-nigrosin.
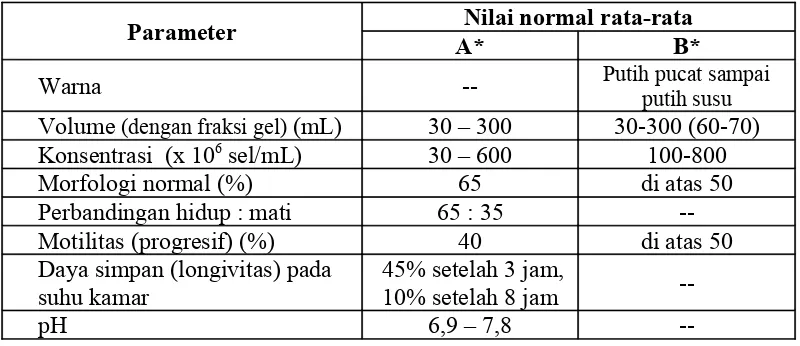
Tabel 2. Kisaran normal parameter evaluasi semen segar kuda
Parameter Nilai normal rata-rata
A* B*
Warna -- Putih pucat sampai
putih susu
Volume (dengan fraksi gel) (mL) 30 – 300 30-300 (60-70) Konsentrasi (x 106
sel/mL) 30 – 600 100-800
Morfologi normal (%) 65 di atas 50
Perbandingan hidup : mati 65 : 35
--Motilitas (progresif) (%) 40 di atas 50
berkaitan langsung dengan dosis IB. Sedikit berbeda dengan ternak lain, perhitungan
dosis IB pada kuda sedikit kompleks. Jumlah spermatozoa minimal yang
diinseminasikan dihitung dalam total spermatozoa normal motil (TNM = volume x
konsentrasi x % morfologi normal x % motilitas) (Colenbrander et al. 1992). Dosis
IB pada kuda setidaknya mengandung 300 x 106 TNM. Bahkan apabila semen harus
ditransportasi sekitar 5-6 jam (chilled semen), maka dosis perlu dinaikkan menjadi
600 x 106
TNM. Namun demikian, Jasko et al. (1992) dan Morel (1999) menyatakan
IB pada kuda cukup dengan dosis sekitar 250 x 106
spermatozoa motil progresif.
Untuk alasan jaminan fertilitas, semen beku dengan motilitas setelah thawing kurang
dari 25-30% sebaiknya tidak diinseminasikan (Pickett & Squires 1990, Colenbrander
Volume semen per dosis IB adalah sekitar 10-30 mL untuk semen segar, 30-60
mL untuk semen cair (chilled semen) dan 0.5-5.0 mL untuk semen beku (British
Equine Veterinary Association 1997 dalam Morel 1999). Namun demikian, Jasko et
al. (1992) berhasil mengoleksi embrio dengan hasil tidak berbeda nyata pada
inseminasi menggunakan semen cair dengan volume 10 dan 50 mL (konsentrasi 25 x
106
sel/mL). Dinyatakan juga bahwa pengenceran sampai dengan 5 x 106
sel/mL
sehingga semen terlalu encer dapat menurunkan fertilitas.
Pengolahan Semen dan Pengaruhnya terhadap Spermatozoa
Pengolahan semen dilakukan jika semen segar yang diperoleh berkualitas baik
yang ditandai dengan motilitas dan konsentrasi yang tinggi serta abnormalitas yang
rendah (Tabel 5). Permasalahan dalam pengolahan semen kuda adalah volume semen
yang tinggi dengan konsentrasi spermatozoa rendah, dan efek negatif dari plasma
semen. Oleh karena itu dalam pengolahan semen dilakukan sentrifugasi untuk
membuang plasma dan menggantikannya dengan bahan pengencer yang dapat
mempertahankan viabilitasnya. Beberapa kecepatan sentrifugasi yang sudah diteliti
tanpa banyak efek negatif adalah 400 g selama 9-15 menit, 350-450 g selama 12 menit
atau 2500-3000 rpm selama 10 menit (Morel 1999). Yang perlu diperhatikan adalah
semakin cepat dan semakin lama sentrifugasi mungkin dapat meningkatkan kerusakan
pada spermatozoa.
Untuk keperluan semen cair, setelah sentrifugasi pelet spermatozoa dilarutkan
menggunakan pengencer yang mengandung karbohidrat, buffer, lipoprotein sebagai
anti-cold shock, dan bakteristatik (antibiotika) (Garner & Hafez 2000). Karbohidrat
yang umum dipakai antara lain glukosa, fruktosa dan laktosa. Bahan buffer yang
sering ditambahkan adalah Tris dan Na-sitrat. Sedangkan bahan anti cold shock yang
sering ditambahkan untuk mencegah kerusakan spermatozoa akibat penyimpanan
pada suhu rendah adalah lipoprotein kuning telur atau lesitin kedelai. Berbagai bahan
pengencer yang telah digunakan dalam pengolahan semen kuda antara lain pengencer
berbahan dasar susu atau produk susu (misalnya E-Z Mixin, INRA 82 dan Kenney’s),
pengencer berbahan dasar Tris (misalnya Tris-Kuning telur), dan pengencer berbahan
Ijaz dan Ducharme (1995) meneliti berbagai jenis pengencer untuk mengetahui
kualitas (motilitas) semen cair kuda pada suhu 5 oC. Hasilnya pengencer INRA 82
mampu mempertahankan motilitas lebih baik dari dimitropoulos (DV), E-Mixin dan
Kenney’s hingga 96 jam penyimpanan (Tabel 3). Walaupun demikian, sampai dengan
48 jam penyimpanan motilitas spermatozoa dalam media INRA 82, dimitropoulos dan
E-Mixin tidak berbeda nyata. Sedangkan Singh et al. (1994) melaporkan bahwa
pengencer tris-fruktosa-kuning telur lebih baik dibandingkan dengan
tris-glukosa-kuning telur dan tris-laktosa-tris-glukosa-kuning telur dalam mempertahankan daya hidup
spermatozoa kerbau Murrah yang dibekukan. Namun demikian, pengencer
tris-laktosa-fruktosa lebih baik dibanding tris-fruktosa dan skim-fruktosa dalam
mempertahankan motilitas, persentase hidup, persentase membran plasma utuh dan
tudung akrosom utuh pada semen beku kerbau Lumpur (Amin, 1998).
Tabel 3. Pengaruh jenis pengencer terhadap motilitas spermatozoa kuda pada suhu 5 oC
Pengencer Motilitas (M%) (jam penyimpanan)
0 24 48 72 96
Dimitropoulos 74,7±9,1 56,0±7,7 40,7±8,3 28,6±9,9 13,1±16,0
INRA 82 74,8±3,0 67,0±4,2 58,4±9,8 61,1±8,2 56,1±4,6
Kenney’s 68,7±11,3 27,0±11,8 16,5±12,2 12,6±9,8 5,8±8,6
E-Mixin 72,7±8,3 47,0±7,1 49,1±6,1 47,9±6,8 40,5±8,5
Sumber : Ijaz dan Ducharme (1995)
Penyimpanan semen cair untuk preservasi seringkali mengalami kendala.
Penyimpanan pada suhu ruang menyebabkan spermatozoa cepat kehilangan sumber
energi, penurunan pH media karena penimbunan asam laktat sebagai sisa
metabolisme, perubahan penuaan dan pertumbuhan kuman (Toelihere 1979b). Di lain
pihak, penyimpanan pada suhu dingin dapat menekan metabolisme sehingga dapat
sumber energi, tetapi rentan terhadap efek cold shock (Brinsko et al. 2000). Oleh
karena penyimpanan spermatozoa kuda di bawah suhu 20 o
C sangat rentan terhadap
efek cold shock, maka perlu proses pendinginan secara perlahan dari 20 o
C sampai
dengan 5 o
C, yaitu sekitar 0.05 o
C/menit (Kayser et al. 1992) dan penambahan
senyawa anti-cold shock (Graham 1996a). Penyimpanan semen cair pada suhu rendah
yang terbaik adalah pada suhu 4-6 o
Kerentanan spermatozoa terhadap efek cold shock berkaitan dengan komposisi
asam lemak di dalam fosfolipid, dan kandungan kolesterol pada membran (White
1993). Semakin tinggi rasio asam lemak takjenuh (unsaturated fatty acids) terhadap
asam lemak jenuh (saturated fatty acids) dan semakin rendah kandungan kolesterol
pada struktur membran maka spermatozoa tersebut relatif lebih rentan terhadap efek
penyimpanan pada suhu dingin. Kandungan asam lemak takjenuh yang tinggi pada
kondisi aerob rentan terhadap reaksi peroksidasi yang menghasilkan radikal bebas
(anion superoksida), misalnya hydroxynonenal (White 1993). Pada spermatozoa kuda
dan sapi peroksidasi asam lemak terutama ditemukan pada daerah midpiece (Neild et
al. 2002). Efek peroksidasi pada spermatozoa domba, babi, kuda, manusia, kelinci
dan sapi menyebabkan kehilangan motilitas permanen, penghambatan fruktolisis dan
respirasi, serta kerusakan enzim intraseluler dan struktur membran plasma
(Hammerstedt 1993, White 1993). Di pihak lain, lesitin kuning telur yang
ditambahkan ke dalam media akan berikatan dengan membran sehingga membatasi
reaksi oksigen dengan asam lemak pada membran spermatozoa. Dengan demikian
akan mengurangi peroksidasi asam lemak dan pembentukan anion superoksida. Lebih
dari itu beberapa enzim intraseluler seperti peroksidase dan superoksida dismutase
dapat menyelamatkan sel dengan mengubah radikal bebas menjadi senyawa tidak
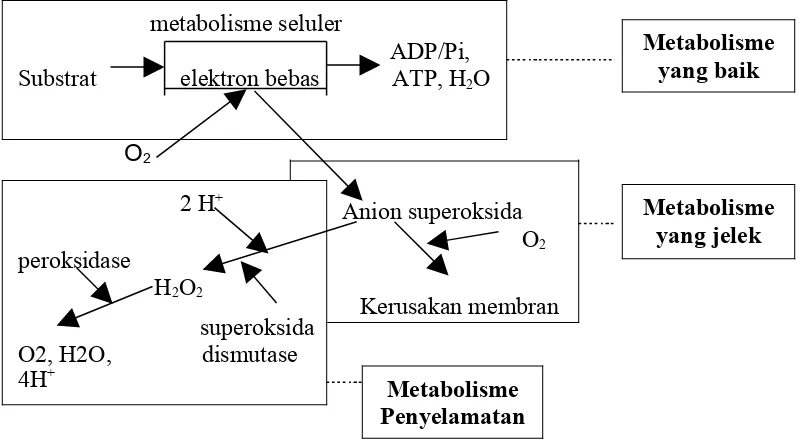
toksik, yaitu O2 dan H2O (Hammerstedt 1993) (Gambar 5).
Efek cold shock berkaitan dengan fase transisi fosfolipid, yaitu perubahan
bentuk dari cair (liqiud crystalline) ke bentuk gel (solid state) yang terjadi pada suhu
di bawah 20 oC (Kayser et al. 1992). Akibat perubahan bentuk fosfolipid diantaranya
adalah terjadi perubahan tatanan rantai asam lemak dan protein secara acak (berbeda
dari seharusnya) sehingga selektivitas membran menjadi menurun yang menyebabkan
ion-ion tertentu bebas masuk (Morel 1999). Akibat berkumpulnya asam lemak yang
tidak biasanya, dapat terbentuk formasi heksagonal-II sehingga pada tempat tertentu
terjadi kebocoran (Graham 1996a) (Gambar 6). Penyimpanan pada suhu dingin juga
dapat menyebabkan kehilangan fosfolipid substansial dari plasma membran
O2
Gambar 5. Skematis hubungan proses metabolisme sel dan peroksidasi asam lemak (Hammerstedt 1993)
Keterangan : A) Membran spermatozoa normal, B) Pendinginan 4oC, lipid tertentu (hitam) berkelompok mendekati fase transisi, protein berikatan dengan lipid yang tidak biasanya (putih), C) Pemanasan kembali ke suhu 37oC, interaksi lipid-lipid dan lipid-protein yang berbeda dari normal, D) Interaksi lipid-lipid oleh lipid yang secara normal berikatan dengan protein menyebabkan formasi heksagonal-II.
Sumber : Graham (1996a)
Gambar 6. Pengaruh pendinginan dan pemanasan terhadap membran spermatozoa metabolisme seluler
C D: pembentukan HEX-II, suhu 37 o
C
lipid menyukai konfigurasi bilayer
Karbohidrat di dalam Media Pengencer
Sebagai sumber energi selama dalam preservasi dan kriopreservasi, kedalam
media pengencer ditambahkan senyawa karbohidrat. Beberapa yang biasa
ditambahkan adalah monosakarida (glukosa dan fruktosa), disakarida (laktosa, sukrosa
dan trehalosa), dan oligosakarida (rafinosa).
Glukosa (C6H12O6)adalah heksosa, dimana gugus karbonil terdapat pada ujung
rantai (termasuk aldosa). Glukosa merupakan molekul karbohidrat yang berfungsi
sebagai sumber energi utama pada semua tipe sel organisme. Glukosa merupakan gula
pereduksi karena mempunyai gugus aldehid yang bebas (Girindra 1986). Fruktosa
(C6H12O6) adalah heksosa, dimana gugus kabonil tidak terdapat pada ujung rantai
(termasuk ketosa) (Girindra 1986). Fruktosa merupakan gula pereduksi, karena gugus
keton yang bebas. Gugus aldehid dan keton dapat direduksi secara kimia atau
enzimatis menjadi gula alkohol, misalnya sorbitol. Secara fisiologik fruktosa
ditemukan di dalam plasma semen yang merupakan sumber energi utama di dalam
metabolisme spermatozoa dari berbagai spesies (Morel 1999). Trehalosa (C12H22O11)
merupakan disakarida. Hidrolisis sempurna 1 molekul trehalosa akan menghasilkan 2
molekul glukosa. Trehalosa bukan merupakan gula pereduksi, karena 2 atom karbon
anomerik berikatan satu sama lain. Rafinosa (C18H32O16) merupakan oligosakarida.
Hidrolisis sempurna 1 molekul rafinosa akan menghasilkan masing-masing 1 molekul
glukosa, fruktosa dan galaktosa (Girindra 1986).
Toelihere (1979b), menyatakan bahwa fruktosa lebih mudah dimetabolisme
oleh spermatozoa dan umum ditambahkan kedalam pengencer semen cair maupun
semen beku pada berbagai ternak. Penambahan laktosa dengan konsentrasi 60 mM ke
dalam media pengencer tris dapat mempertahankan persentase motilitas, presentase
spermatozoa hidup, persentase membran plasma utuh dan persentase tudung akrosom
utuh setelah thawing dibandingkan dengan 0 mM dan 120 mM pada semen beku
domba Garut (Amin 2005). Sementara itu, Hartawan (2003) mencatat bahwa
penambahan laktosa (30 mM, 60 mM, dan 90 mM) kedalam media pengencer
tris-fruktosa-kuning telur tidak efektif dalam mempertahankan persentase motilitas,
persentase hidup dan persentase membran plasma utuh semen cair kambing Saanen.
Supriatna dan Pasaribu (1992) menyebutkan bahwa lipoprotein, sukrosa,
melindungi membran dari kerusakan selama penyimpanan pada suhu dingin dan
pembekuan. Namun demikian, nampak ada kecenderungan kespesifikan karbohidrat
diantara beberapa spesies. Penambahan disakarida dan oligosakarida dalam media
pengolahan semen selain berfungsi sebagai sumber energi juga berfungsi sebagai
kriprotektan ekstra-seluler (Suwarso 1999).
Kuning Telur di dalam Media Pengencer
Penambahan fosfolipid dan lipoprotein pada preservasi semen dapat
menstabilkan membran plasma, sehingga menjaga perubahan komposisi lipid
membran plasma selama penyimpanan dan pembekuan. Kuning telur (tanpa membran
vitelin) sering ditambahkan ke dalam media pengencer dan penyimpan spermatozoa.
Ketertarikan pada kuning telur dimulai sejak diketahui bahwa penurunan motilitas
spermatozoa setelah efek cold shock adalah karena kerusakan membran plasma, yang
diduga karena fosfolipid dan kolesterol yang hilang pada membran (White, 1993).
Kuning telur juga mempunyai sifat sebagai penyangga tekanan osmotik
sehingga spermatozoa lebih toleran terhadap lingkungan yang hipotonik atau
hipertonik (Burlee & Vadehra 1989 dalam Zeidler et al. 1994).Hal ini karena kuning
telur mengandung beberapa senyawa yang penting untuk kelangsungan hidup
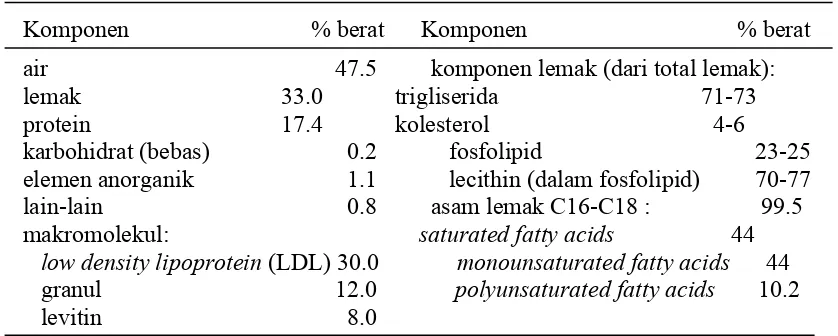
spermatozoa selama penyimpanan (Tabel 4). Komposisi fosfolipid kuning telur
menurut Juneja et al. (1994) terdiri atas phosphatidylcholine (lesitin) 80.8%,
phosphatidylethanolamine 11.7%, lysophosphatidylcholine 1.9%, sphingomyelin
1.9%, serta lemak netral (nonpolar) dan bahan lain 3.7%.
Fraksi lipoprotein pada kuning telur yang berperanan aktif pada perlindungan
proses pembekuan adalah spesifik, misalnya lecithin untuk sperma sapi dan domba,
phosphatidyl serine atau phosphatidyl ethanolamine untuk sperma babi (Weitze &
Petzoldt 1992). Sedangkan untuk sperma kuda biasanya digunakan lipoprotein dari
susu skim atau gliserin.
Diduga komponen yang berperan aktif dalam melindungi membran
spermatozoa selama pembekuan adalah fraksi dengan berat jenis rendah, yaitu low
density lipoprotein (LDL) (Moussa et al. 2002). Low density lipoprotein menyusun
jenis 0.982 g/mL, molekulnya bulat (spherical) dengan diameter 17-60 nm, dan
mempunyai inti lipid (trigliserida nonpolar dan ester kolesterol) yang dikelilingi oleh
lapisan fosfolipid dan protein dimana bagian ujung polarnya kontak dengan aquous
phase (Mayes 1999, Moussa et al. 2002). Low density lipoprotein tersusun atas
85-90% lipid (69% trigliserida, 26% fosfolipid dan 5% kolesterol) dan 10-15% protein.
Selama proses pembekuan fraksi lipid dan protein membran spermatozoa
rusak sehingga perlu menambahkan lipid dan protein dari luar. Fosfolipid (LDL) dari
kuning telur dapat menggantikan beberapa komponen lipid dan protein yang hilang
atau rusak, dan dapat membentuk membran protektif menempel pada permukaan
membran selama pembekuan, sehingga menjaga konsentrasi Ca di dalam sel (White
1993, Moussa et al. 2002). Lesitin kuning telur yang berikatan dengan membran
plasma spermatozoa akan membatasi reaksi oksigen dengan asam lemak pada
fosfolipid membran, sehingga akan mengurangi terbentuknya anion superoksida
(radikal bebas) yang terbentuk akibat peroksidasi asam lemak (Hammerstedt 1993).
Penambahan fraksi LDL disarankan adalah 5-10% dari total volume media.
Pada konsentrasi kurang dari 5%, LDL tidak mampu melindungi efek cold shock
selama penyimpanan, sedangkan diatas 10% akan menurunkan berat jenis dan tekanan
osmotik media, sehingga mempunyai efek tidak baik terhadap spermatozoa. Dengan
asumsi kuning telur mengandung sekitar 50% bahan kering dan LDL menyusun 2/3
bagian dari bahan kering tersebut, maka 6-7% (w/v) LDL diperoleh dengan
penambahan 20% kuning telur pada media preservasi (Moussa et al. 2002).
Tabel 4. Komposisi bahan kimia di dalam kuning telur ayam
Komponen % berat Komponen % berat
air 47.5 komponen lemak (dari total lemak):
lemak 33.0 trigliserida 71-73
protein 17.4 kolesterol 4-6
karbohidrat (bebas) 0.2 fosfolipid 23-25 elemen anorganik 1.1 lecithin (dalam fosfolipid) 70-77 lain-lain 0.8 asam lemak C16-C18 : 99.5 makromolekul: saturated fatty acids 44 low density lipoprotein (LDL) 30.0 monounsaturated fatty acids 44 granul 12.0 polyunsaturated fatty acids 10.2
levitin 8.0
Pengencer Dimitropoulos
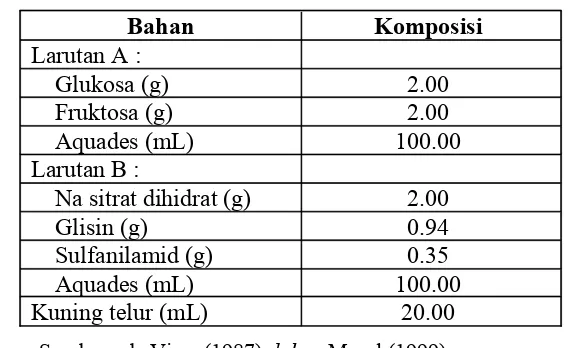
Pengencer dimitropoulos (DV) diperkenalkan oleh de Vires (1987) (Morel
1999). Dimitropoulos merupakan bahan pengencer berbahan dasar kuning telur
dengan buffer Na sitrat. Komposisi bahan penyusun pengencer dimitropoulos adalah
seperti pada Tabel 5. Ijaz dan Ducharme (1995) meneliti pengaruh dimitropoulos dan
pengencer lain (INRA 82, E-Mixin, dan Kenney’s) untuk mengetahui kualitas
(motilitas) semen cair kuda pada suhu 5 o
C. Hasilnya, sampai dengan 48 jam
penyimpanan motilitas spermatozoa dalam media dimitropoulos, INRA 82 dan
E-Mixin tidak berbeda nyata. Walaupun demikian, pada penyimpanan sampai dengan
96 jam pengencer INRA 82 mampu mempertahankan motilitas lebih baik daripada
dimitropoulos (DV), E-Mixin dan Kenney’s.
Manfaat kuning telur terhadap kualitas semen cair kuda juga pernah dilaporkan
oleh Jasko et al. (1992). Penambahan kuning telur sebanyak 4%, 8% dan 16% dari
volume media mampu meningkatkan motilitas semen cair dibandingkan dengan media
tanpa kuning telur, hingga 48 jam penyimpanan. Sedangkan Parlevliet et al. (1992)
menunjukkan bahwa penyimpanan semen cair dalam pengencer DV dan susu skim
pada suhu 20 o
C, hingga 18 jam memperlihatkan M% yang tidak berbeda nyata.
Namun demikian, setelah 42 jam penyimpanan pengencer DV memperlihatkan M%
nyata lebih baik daripada pengencer susu skim. Sebaliknya, penyimpanan pada suhu 5
oC menunjukkan pengencer susu skim mempunyai M% nyata lebih baik daripada
pengencer DV pada semua titik pengamatan.
Natrium sitrat sebagai buffer sebenarnya telah digunakan dalam menyusun
media oleh banyak peneliti. Salisbury et al. (1941) di dalam Toelihere (1979b)
berhasil menunjukkan manfaat Na sitrat pada pengenceran semen sapi, berdasarkan
daya tahan hidup dan fertilitasnya. Senyawa buffer yang sering digunakan dalam
media pengencer semen selain Na sitrat adalah Hepes, Na fosfat, Na bikarbonat dan
Tabel 5. Komposisi dasar bahan pengencer dimitropoulos (DV)
Bahan Komposisi
Larutan A :
Glukosa (g) 2.00
Fruktosa (g) 2.00
Aquades (mL) 100.00
Larutan B :
Na sitrat dihidrat (g) 2.00
Glisin (g) 0.94
Sulfanilamid (g) 0.35
Aquades (mL) 100.00
Kuning telur (mL) 20.00
Sumber : de Vires (1987) dalam Morel (1999)
Keterangan : 1. 100 mL DV dibuat dari : 30 mL larutan A, 50 mL larutan B dan 20 mL kuning telur
HASIL DAN PEMBAHASAN
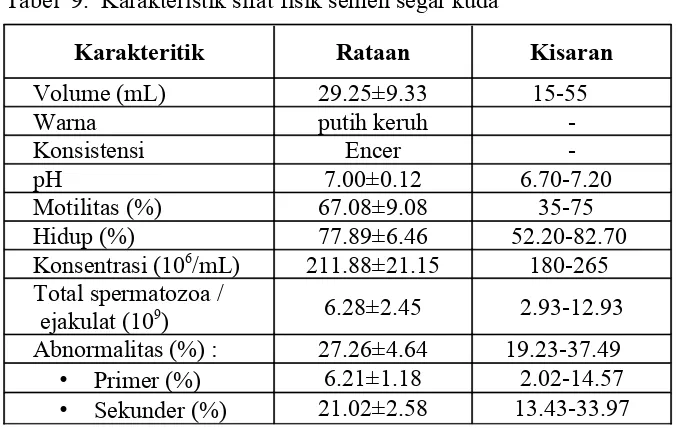
Karakteristik Sifat Fisik Semen Segar
Evaluasi terhadap karakteristik semen segar bertujuan untuk mengetahui
potensi reproduksi seekor pejantan. Selanjutnya akan diketahui apakah semen tersebut
layak diproses lebih lanjut menjadi semen cair atau semen beku. Dengan demikian
dapat diperkirakan jumlah betina yang dapat diinseminasi oleh seekor pejantan dalam
waktu tertentu. Seluruh pejantan pada penelitian ini menghasilkan semen segar
dengan kualitas cukup baik (Tabel 9). Data-data tersebut secara umum berada dalam
kisaran normal, sehingga semua semen segar dari ketiga pejantan layak diproses
menjadi semen cair.
Tabel 9. Karakteristik sifat fisik semen segar kuda
Karakteritik Rataan Kisaran
Volume (mL) 29.25±9.33 15-55
Warna putih keruh
-Konsistensi Encer
-pH 7.00±0.12 6.70-7.20
Motilitas (%) 67.08±9.08 35-75
Hidup (%) 77.89±6.46 52.20-82.70
Konsentrasi (106
/mL) 211.88±21.15 180-265
Total spermatozoa / ejakulat (109
) 6.28±2.45 2.93-12.93
Abnormalitas (%) : 27.26±4.64 19.23-37.49
• Primer (%) 6.21±1.18 2.02-14.57
• Sekunder (%) 21.02±2.58 13.43-33.97
Karakteristik Makroskopik
Secara keseluruhan semen segar kuda mempunyai rataan volume (tanpa fraksi
gel) sebesar 29.25±9.33 mL (berkisar 15-55 mL), berwarna putih-keruh, konsistensi
encer dan pH relatif netral dengan rataan 7.00±0.12 (berkisar 6.70-7.20). Volume
semen segar pada penelitian ini tidak berbeda dengan data Morel (1999) yang
menyebutkan bahwa volume semen dari kuda Thoroughbred adalah 28.3 mL (31.0
mL termasuk fraksi gel), Standarbred adalah 30.2 mL (33.3 mL termasuk fraksi gel),