PEMBUATAN MANISAN MANGGA (Mangifera indica L.)
DENGAN MEMANFAATKAN SIRUP GLUKOSA HASIL
HIDROLISIS SELULOSA KULIT BUAH KUINI (Mangifera
odorata G.) MENGGUNAKAN HCl 30%
SKRIPSI
FITRI MAYA SARI
070802035
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PEMBUATAN MANISAN MANGGA (Mangifera indica L.) DENGAN MEMANFAATKAN SIRUP GLUKOSA HASIL HIDROLISIS
SELULOSA KULIT BUAH KUINI (Mangifera odorata G.) MENGGUNAKAN HCl 30%
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains.
FITRI MAYA SARI 070802035
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2012
PERSETUJUAN
Judul : PEMBUATAN MANISAN MANGGA (Mangifera indica L.) DENGAN MEMANFAATKAN SIRUP GLUKOSA HASIL HIDROLISIS SELULOSA KULIT BUAH KUINI (Mangifera odorata G.) MENGGUNAKAN HCl 30%
Kategori : SKRIPSI
Nama : FITRI MAYA SARI Nomor Induk Mahasiswa : 070802035
Program Studi : SARJANA (S1) KIMIA Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Juli 2012
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Drs. Firman Sebayang, MS Prof. Dr. RA Harlinah SPW, M.Sc. NIP 195607261985031001 NIP 130175778
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PEMBUATAN MANISAN MANGGA (Mangifera indica L.) DENGAN
MEMANFAATKAN SIRUP GLUKOSA HASIL HIDROLISIS
SELULOSA KULIT BUAH KUINI (Mangifera odorata G.)
MENGGUNAKAN HCl 30%
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juli 2012
PENGHARGAAN
Alhamdulillah, puji dan syukur penulis ucapkan ke hadirat Allah SWT yang telah memberikan rahmat, hidayah, dan keberkahan yang sangat besar sehingga penulis dapat menyelesaikan penelitian dan skripsi ini.
ABSTRAK
THE MAKING OF CANDIED MANGO (Mangifera indica L.) BY USING GLUCOSE SYRUP FROM THE HYDROLYZED CELLULOSE FROM
KUINI’S (Mangifera odorata G.) PEEL USING HCl 30%.
ABSTRACT
DAFTAR ISI
2.2.3.2 Sifat-Sifat Selulosa 13
2.2.3.3 Hidrolisis Selulosa 14
2.3 Sirup Glukosa 15
2.4 Analisis Karbohidrat 17
2.4.1 Analisis Kualitatif 17
2.4.2 Analisis Kuantitatif 18
2.6 Manisan Buah 19
Bab 3 Metode Penelitian 22
3.2.2 Pembuatan Larutan Pereaksi 24
3.2.2.1 Larutan H2SO4
3.2.2.7 Larutan Arsenomolibdat 25
3.2.3 Cara Kerja 25
3.2.3.1 Isolasi dan Analisis Kadar Selulosa dari Kulit Buah
Kuini 25
3.2.3.2 Hidrolisis Selulosa dari Kulit Buah Kuini dan Analisis
Glukosa Hasil Hidrolisis Secara Kualitatif 26
3.2.3.3 Pengukuran Panjang Gelombang Maksimum
Larutan Glukosa Standar 26
3.2.3.4 Penyiapan Kurva Glukosa Standar 26
3.2.3.5 Analisis Kadar Glukosa Sampel 27
3.2.3.6 Pembuatan Manisan Mangga 27
3.2.3.7 Penentuan Nilai Organoleptik 27
3.3 Bagan Penelitian 28
3.3.1 Isolasi dan Analisis Kadar Selulosa dari Kulit Buah Kuini 28 3.3.2 Hidrolisis Selulosa dari Kulit Buah Kuini dan Analisis Glukosa
Hasil Hidrolisis Secara Kualitatif 29
3.3.3 Analisis Kadar Glukosa Hasil Hidrolisis Selulosa dari Kulit
Buah Kuini Secara Spektrofotometri 30
3.3.4 Pembuatan Manisan Mangga 31
3.3.5 Penentuan Nilai Organoleptik 31
Bab 4 Hasil dan Pembahasan 32
4.1 Hasil Penelitian 32
4.1.1 Perhitungan Kadar Selulosa Kulit Buah Kuini 33
4.1.2 Pengolahan Data Pengukuran Absorbansi Glukosa Hasil
Hidrolisis Selulosa Kulit Buah Kuini 34
4.1.3 Perhitungan Kadar Glukosa Hasil Hidrolisis Selulosa Kulit
Buah Kuini 35
Bab 5 Kesimpulan dan Saran 40
5.1 Kesimpulan 40
5.2 Saran 40
Daftar Pustaka 41
DAFTAR TABEL
Halaman
Tabel 2.1 Komposisi Kimia dan Nilai Gizi Buah Mangga 7
Tabel 2.2 Karakteristik Kimia Buah Kuini 9
Tabel 2.3 Standar Mutu Sirup Glukosa 17
Tabel 3.1 Skala Uji Hedonik 27
Tabel 4.1 Hasil Pengolahan Kulit Buah Kuini 32
Tabel 4.2 Hasil Analisis Kadar Selulosa Kulit Buah Kuini 32
Tabel 4.3 Hasil Analisis Kadar Glukosa Hasil Hidrolisis 33
Tabel 4.4 Nilai Organoleptik Manisan Buah Mangga 33
Tabel 4.5 Metode Least Square 35
Tabel 4.6 Perbandingan Gula Pasir dan Sirup Glukosa dalam Pembuatan
DAFTAR GAMBAR
Halaman
Gambar 2.1 Perbandingan Buah Kuini dan Bacang 9
Gambar 2.2 Struktur Glukosa 10
Gambar 2.3 Struktur Maltosa 11
Gambar 2.4 Struktur Selobiosa 12
Gambar 2.5 Struktur Sukrosa 12
Gambar 2.6 Struktur Selulosa 13
Gambar 2.7 Mekanisme Dasar Hidrolisis Selobiosa 15
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Penentuan Panjang Gelombang Maksimum (λmaks
Larutan Glukosa Standar 45
)
Lampiran 2. Data Absorbansi Glukosa Standar 45
Lampiran 3. Kurva Metode Least Square 46
Lampiran 4. Data Nilai Organoleptik Manisan Mangga 46
4.1 Nilai Organoleptik Terhadap Rasa Manisan Mangga 46
4.2 Nilai Organoleptik Terhadap Warna Manisan Mangga 47
4.3 Nilai Organoleptik Terhadap Aroma Manisan Mangga 47
Lampiran 5. Tabel Harga erf (t) atau ert (hx) dari Harga T 48
Lampiran 6. Gambar Bahan dan Hasil Penelitian 49
Lampiran 7. Gambar Uji Organoleptik Hasil Penelitian 50
ABSTRAK
THE MAKING OF CANDIED MANGO (Mangifera indica L.) BY USING GLUCOSE SYRUP FROM THE HYDROLYZED CELLULOSE FROM
KUINI’S (Mangifera odorata G.) PEEL USING HCl 30%.
ABSTRACT
BAB 1
PENDAHULUAN
1.1Latar Belakang
Selulosa adalah polisakarida yang merupakan polimer glukosa. Hidrolisis lengkap
dengan HCl 30% hanya menghasilkan D-glukosa (Fessenden, 1986). Selulosa
merupakan komponen utama dinding sel-sel tanaman. Sejumlah penelitian telah
dilakukan untuk hidrolisis selulosa menjadi glukosa, antara lain oleh Wijayanti (2005)
yang memperoleh 12,53% sirup glukosa dari hidrolisis rumput gajah (Pardosi, 2011),
Nurmala Sari (2010) yang memperoleh 2,4667% sirup glukosa dari hidrolisis selulosa
dami nangka, Sri Ningsih Pardosi (2011) yang memperoleh 9,40% sirup glukosa dari
hidrolisis selulosa ampas kelapa, dan Darmayanti Pratiwi (2011) yang memperoleh
10,66% sirup glukosa dari hidrolisis selulosa kulit buah sukun.
Selain selulosa, polisakarida lain yang memiliki monomer hanya berupa
glukosa adalah pati atau amilum. Beda amilum dan selulosa yaitu pada ikatan
glikosidiknya, dimana glukosa amilum terikat pada 1,4-α-D-glukosa. Hal ini
menyebabkan amilum dapat dicerna oleh tubuh karena enzim-enzim pencernaan tubuh
dapat menghidrolisis ikatan α-nya tetapi tidak mampu menghidrolisis ikatan β pada selulosa (Campbell, 2002).
Sejumlah penelitian yang telah dilakukan untuk menghidrolisis amilum
menjadi glukosa, antara lain oleh A. Sari (2003) yang memperoleh 17,33% sirup
glukosa dari hidrolisis pati sagu (Pardosi, 2011), A. Munandar (2006) yang
memperoleh 17,37% sirup glukosa dari hidrolisis pati pulp coklat (Pardosi, 2011),
Herty Dita Utami Nasution (2010) yang memperoleh 36,19% sirup glukosa dari
hidrolisis amilum biji mangga arumanis, dan Riri Mardawati (2010) yang memperoleh
Dalam pemanfaatannya, sirup glukosa tersebut digunakan sebagai pemanis
alternatif pengganti gula pasir. Gula pasir merupakan kebutuhan pokok masyarakat
dan industri dalam mengolah makanan dan minuman. Total kebutuhan gula nasional
tahun 2014 diperkirakan sebesar 5,7 juta ton, terdiri dari 2,96 juta ton untuk konsumsi
langsung masyarakat dan 2,74 juta ton untuk keperluan industri. Sementara itu
produksi gula tahun 2010 diketahui hanya 2,29 juta ton (http://ditjenbun.deptan.go.id),
Dengan kondisi yang demikian, membuat pemerintah berusaha mengimpor
gula untuk mencukupi kebutuhan dalam negeri. Selain itu, banyak dilakukan
pencarian alternatif pengganti gula selain gula pasir (sukrosa), antara lain pemanis
alami seperti anggur, jagung, dan bit, serta pemanis sintetis seperti siklamat, aspartam,
dan gula hasil hidrolisis polisakarida.
Industri makanan dan minuman saat ini memiliki kecenderungan untuk
menggunakan sirup glukosa. Hal ini didasari oleh beberapa kelebihan sirup glukosa
dibandingkan sukrosa diantaranya tidak mengkristal seperti halnya sukrosa jika
dilakukan pemasakan pada suhu tinggi, dimana inti kristal tidak terbentuk sampai
larutan sirup glukosa mencapai kejenuhan 75% (http://andyafood.wordpress.com).
Berdasarkan penelitian yang telah dilakukan sebelumnya mengenai
pemanfaatan sirup glukosa dari hasil hidrolisis selulosa yang diisolasi dari berbagai
bagian tanaman, seperti kulit buah atau ampas daging buah, maka peneliti juga ingin
memanfaatkan limbah produksi buah, dalam hal ini kulit buah kuini. Selain produksi
buah pertahun yang tinggi dengan berbagai pemanfaatan daging buahnya, pengupasan
kulit buah yang tebal dengan persentase kulit buah sebesar 16,76-32,75% (Antarlina,
2003) menyebabkan jumlah limbah kulit dari buah ini sangat besar dengan tidak
adanya pemanfaatan. Maka dari itu peneliti ingin memanfaatkan kulit buah kuini
untuk dijadikan sirup glukosa sebagai pengganti gula pasir yang diaplikasikan pada
pembuatan manisan buah mangga.
1.2Permasalahan
Karena gula pasir masih diimpor, maka salah satu pencarian alternatif pengganti gula
yaitu dengan sirup glukosa. Berdasarkan penelitian yang telah dilakukan sebelumnya,
diketahui sirup glukosa dapat diperoleh dari hidrolisis selulosa menggunakan HCl
daging buah. Dalam hal ini, peneliti ingin memanfaatkan kulit buah kuini untuk
dijadikan sirup glukosa sebagai pengganti gula pasir pada pembuatan manisan buah
mangga. Pemanfaatan kulit buah ini juga merupakan salah satu upaya membantu
pemerintah dalam program pelestarian lingkungan. Dimana produksi buah kuini di
Sumatera Utara mencapai 250 ton/tahun (www.medanpunya.com) dengan jumlah
limbah kulit buah kuini yang dihasilkan sangat besar. Berdasarkan hal tersebut, maka
permasalahan yang terjadi adalah apakah selulosa dari limbah kulit buah kuini dapat
dibuat menjadi sirup glukosa sebagai pemanis pada pembuatan manisan mangga
melalui hidrolisis menggunakan HCl 30%.
1.3Pembatasan Masalah
Dalam penelitian ini, masalah dibatasi sebagai berikut:
1. Perolehan sampel dibatasi hanya buah kuini yang diperoleh dari pedagang jus di
Setiabudi dan buah mangga udang yang diperoleh dari pasar Tavip Binjai.
2. Jenis polisakarida yang digunakan adalah selulosa dari kulit buah kuini.
3. Hidrolisis dilakukan dengan menggunakan HCl 30%.
4. Penentuan kadar glukosa dilakukan secara Spektrofotometri metode
Nelson-Somogyi.
5. Pemanis yang digunakan sebagai pembanding adalah gula pasir dengan
perbandingan gula pasir dan sirup glukosa (1:0), (1:1), (1:2), (1:3), dan (0:1).
1.4Tujuan Penelitian
Adapun tujuan dalam penelitian ini antara lain:
1. Untuk menentukan kandungan selulosa dari kulit buah kuini.
2. Untuk menentukan hasil hidrolisis selulosa dari kulit buah kuini sehingga
dihasilkan sirup glukosa.
3. Untuk mengetahui kadar glukosa hasil hidrolisis selulosa kulit buah kuini.
4. Untuk memanfaatkan sirup glukosa sebagai pemanis dalam pembuatan manisan
mangga.
5. Untuk menentukan uji organoleptik manisan mangga yang dibuat dari variasi
1.5Manfaat Penelitian
1. Dapat memanfaatkan limbah kulit buah kuini menjadi sirup glukosa dan
merupakan salah satu upaya membantu pemerintah dalam program pelestarian
lingkungan.
2. Sirup glukosa yang diperoleh dapat dijadikan sebagai salah satu pemanis alternatif
pengganti sukrosa pada gula pasir dari tanaman tebu.
3. Dari penelitian ini dapat diketahui adanya potensi nilai finansial dari limbah kulit
buah kuini yang dapat meningkatkan pendapatan masyarakat.
1.6Metodologi Penelitian
Penelitian ini bersifat eksperimental laboratorium. Dimana sampel berupa kulit buah
kuini yang diperoleh dari pedagang jus buah di Setiabudi dikumpulkan dan diambil
secara acak sederhana untuk kemudian diisolasi selulosanya. Selulosa yang diisolasi
diuji secara kualitatif dan kuantitatif. Kemudian selulosa dihidrolisis menggunakan
HCl 30% menghasilkan sirup glukosa dan diuji secara kualitatif, lalu ditentukan
kadarnya dengan metode Nelson-Somogyi menggunakan alat Spektrofotometer. Sirup
glukosa hasil hidrolisis dimanfaatkan untuk membuat manisan mangga udang.
1.7Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia/KBM FMIPA USU dan Pusat
BAB 2
TINJAUAN PUSTAKA
2.1 Tanaman Mangga (Mangifera indica L.)
Mangga yang berkembang di Indonesia diperkirakan berasal dari India, yang
dipercaya pemeliharaannya telah ada seiring peradaban India. Sejarah pun mencatat
bahwa mangga pertama kali ditemukan oleh Alexander Agung di lembah Indus, India.
Kata mangga sendiri berasal dari bahasa Tamil, yaitu mangas atau man-kay. Dalam bahasa botani, mangga disebut Mangifera indica L. yang berarti tanaman mangga berasal dari India.
Dari India, sekitar abad ke-4 SM, tanaman mangga menyebar ke berbagai
negara, yakni melalui pedagang India yang berkelana ke timur sampai ke
Semenanjung Malaysia. Pada tahun 1400 dan 1450, mangga mulai ditanam di
kepulauan Sulu dan Mindanau, Filipina, di pulau Lizon sekitar tahun 1600, dan di
kepulauan Maluku pada tahun 1665 (Pracaya, 2011).
2.1.1 Taksonomi dan Morfologi Tanaman Mangga
Dalam tatanama sistematika (taksonomi) tumbuhan, tanaman mangga diklasifikasikan
sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledonae
Ordo : Sapindales
Famili : Anacardiaceae
Genus : Mangifera
Tanaman mangga tumbuh dalam bentuk pohon berbatang tegak, bercabang
banyak, serta rindang dan hijau sepanjang tahun. Tinggi tanaman dewasanya bisa
mencapai 10-40 m dengan umur bisa mencapai lebih dari 100 tahun. Morfologi
tanaman mangga terdiri atas akar, batang, daun, dan bunga. Bunga menghasilkan buah
dan biji yang secara generatif dapat tumbuh menjadi tanaman baru (Pracaya, 2011).
Mangga rata-rata berbunga satu kali sehingga panen buah dapat dilakukan
beberapa kali dalam satu periode karena buah tidak masak bersamaan. Mangga
cangkokan mulai berbuah pada umur 4 tahun sedangkan mangga okulasi pada umur
5-6 tahun. Buah panen pertama hanya mencapai 10-15 buah, pada tahun ke-10 jumlah
buah dapat mencapai 300-500 buah/pohon, pada umur 15 tahun mencapai 1000
buah/pohon, dan produksi maksimum tercapai pada umur 20 tahun dengan potensi
produksi mencapai 2000 buah/pohon/tahun (Tafajani, 2011).
Buah mangga memiliki keanekaragaman bentuk antara lain bulat,
bulat-pendek dengan ujung pipih, dan bulat-panjang agak pipih. Susunan tubuh buah terdiri
dari beberapa lapisan, yaitu sebagai berikut :
a. Kulit buah
Buah mangga yang muda memiliki kulit berwarna hijau, namun menjelang matang
berubah warna menurut jenis dan varietasnya.
b. Daging buah
Buah mangga yang masih muda pada umumnya memiliki daging buah yang
berwarna kuning keputih-putihan. Menjelang tua daging buah berubah menjadi
kekuning-kuningan sampai kejingga-jinggan. Rasa daging buah mangga bervariasi,
yaitu asam sampai manis dengan aroma yang khas pada setiap varietas mangga.
c. Biji
Biji mangga berkeping dua dan memiliki sifat poliembrional, karena dari satu biji
dapat tumbuh lebih dari satu bakal tanaman (Rukmana, 1997).
2.1.2 Komposisi Kimia Buah Mangga
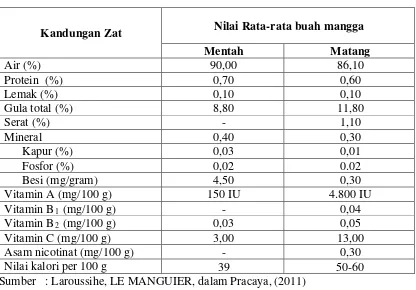
Tabel 2.1 Komposisi Kimia dan Nilai Gizi Buah Mangga
Kandungan Zat Nilai Rata-rata buah mangga Mentah Matang
Sumber : Laroussihe, LE MANGUIER, dalam Pracaya, (2011)
Komponen daging buah mangga yang paling banyak adalah air dan
karbohidrat. Selain itu juga mengandung protein, lemak, macam-macam asam,
vitamin, mineral, tanin, zat warna, dan zat yang mudah menguap sehingga
menciptakan aroma harum khas buah mangga.
Karbohidrat daging buah mangga terdiri dari gula sederhana, tepung, dan
selulosa. Gula sederhananya berupa sukrosa, glukosa, dan fruktosa yang memberikan
rasa manis dan bermanfaat bagi pemulihan tenaga pada tubuh manusia. Selain gula,
rasa dan karakteristik buah mangga juga dipengaruhi oleh tanin dan campuran asam.
Tanin pada buah mangga menyebabkan rasa kelat dan terkadang pahit. Tanin juga
menyebabkan buah mangga menjadi hitam setelah diiris. Sementara itu, rasa asam
pada buah mangga disebabkan oleh adanya asam sitrat (0,13-0,17%) dan vitamin C
(Pracaya, 2011).
2.1.3 Jenis dan Varietas Tanaman Mangga
Pengembangan varietas mangga dapat dilakukan secara generatif maupun vegetatif.
Masing-masing varietas mangga dapat dibedakan berdasarkan ukuran, warna daging,
pohon, ukuran, dan bentuk daun. Di Indonesia ada beberapa jenis dan varietas mangga
komersial yang sudah terkenal bagus mutunya, antara lain :
a. Mangga Golek
Dalam bahasa Jawa, golek berarti ”mencari”. Berdasarkan kata itu pulalah penamaan jenis mangga ini karena setelah menikmati rasanya orang akan mencari lagi buah
mangga yang baru saja dimakan. Daging buah tebal, lunak dengan warna kuning tua.
Daging buahnya boleh dikatakan tidak berserat, tidak berair (kalau diiris tidak banyak
mengeluarkan air). Aromanya cukup harum dengan rasa yang manis.
b. Mangga Arumanis
Disebut mangga arumanis karena rasanya manis dan aromanya harum (arum). Daging
buah tebal, lunak berwarna kuning, dan tidak berserat (serat sedikit). Aroma harum,
tidak begitu berair, dengan rasa yang manis, tapi bagian ujung kadang-kadang masih
ada rasa asam.
c. Mangga Manalagi
Disebut manalagi karena sekali makan orang akan mencarinya lagi. Rasa mangga
manalagi seperti perpaduan rasa antara golek dan arumanis. Kemungkinan pohon
mangga manalagi merupakan hasil persilangan alami antara golek dengan arumanis.
Buah ini sering dimakan dalam keadaan masih keras, tetapi daging buah sudah
kelihatan kuning.
d. Mangga Madu
Mangga ini disebut madu karena rasanya manis seperti madu lebah. Daging buah yang
sudah masak berwarna kuning. Bagian dalam kuningnya makin ke dalam makin tua
seperti warna madu. Serat daging buah sedikit. Kadar air buah sedang dengan rasanya
yang manis seperti madu dan aromanya harum (Pracaya, 2011).
e. Mangga Udang
Mangga ini berasal dari Desa Hutanagonang, Kecamatan Muara, Kabupaten Tapanuli
Utara. Panjang rata-rata mangga ini hanya sekitar 6 cm. Dikenal dua jenis mangga
udang, yaitu yang berukuran kecil dan berukuran besar. Buahnya berbentuk lonjong.
Kulitnya tipis dan berwarna hijau muda pada waktu muda, lalu berubah menjadi
kuning keemasan setelah tua. Daging buahnya berwarna kuning, lunak berair, rasanya
f. Kuini
Dalam taksonomi tumbuhan, kuini merupakan tanaman mangga dengan spesies
Mangifera odorata Griffith yang masih berkerabat dekat dengan bacang.
Gambar 2.1 Perbandingan Buah Kuini dan Bacang
Warna kulit buah muda hijau dan setelah masak hijau kekuningan pada
pangkalnya, dengan permukaan kulit licin. Warna daging buah kuning-orange.
Tekstur daging buah agak berserat. Bagi orang yang tidak tahan akan terasa gatal
apabila makan buah kuini ini. Rasa daging buah manis, kadang ada yang agak masam.
Bentuk buah lonjong dengan nisbah P/L sebesar 1,21-1,52. Ukuran buah sedang,
bobot buah sekitar 162-470 g. Bagian buah yang dapat dimakan sekitar 44,62-64,47%
(Antarlina, 2003).
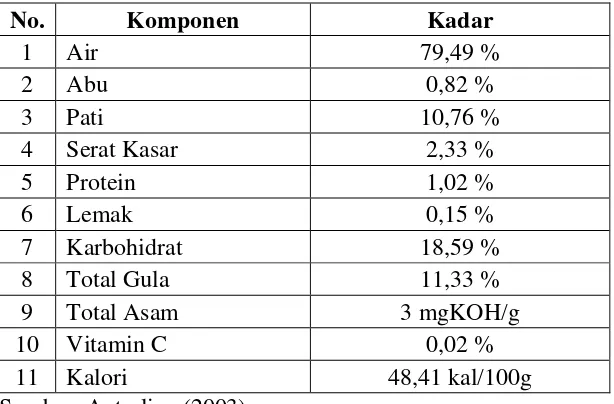
Tabel 2.2 Karakteristik Kimia Buah Kuini
No. Komponen Kadar
1 Air 79,49 %
2 Abu 0,82 %
3 Pati 10,76 %
4 Serat Kasar 2,33 %
5 Protein 1,02 %
6 Lemak 0,15 %
7 Karbohidrat 18,59 %
8 Total Gula 11,33 %
9 Total Asam 3 mgKOH/g
10 Vitamin C 0,02 %
11 Kalori 48,41 kal/100g
Sumber: Antarlina (2003)
2.2 Karbohidrat
Istilahkarbohidrat timbul karena rumus molekul senyawa ini dapat dinyatakan sebagai
hidrat dari karbon. Definisi karbohidrat ialah polihidroksialdehida, polihidroksiketon,
atau zat yang memberikan senyawa seperti ini jika dihidrolisis dengan asam berair,
dimana gugus hidroksil dan gugus karbonil merupakan gugus fungsi utama dalam
karbohidrat.
Karbohidrat biasanya digolongkan menurut strukturnya sebagai monosakarida,
oligosakarida, atau polisakarida. Istilah sakarida berasal dari kata Latin (sakarum,
gula) dan merujuk pada rasa manis dari beberapa karbohidrat sederhana (Hart, 2003).
2.2.1 Monosakarida
Monosakarida ialah karbohidrat yang tidak dapat dihidrolisis menjadi senyawa yang
lebih sederhana lagi. Monosakarida digolongkan berdasarkan jumlah atom karbon
yang ada (triosa, tetrosa, pentosa, heksosa, dan seterusnya) dan berdasarkan apakah
gugus karbonil yang ada sebagai aldehida atau sebagai keton (Hart, 2003).
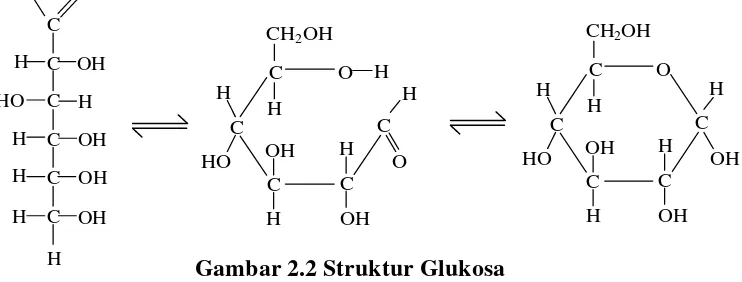
Glukosa, monosakarida yang paling umum, kadang-kadang disebut gula darah,
gula anggur, atau dekstrosa. Binatang menyusui dapat mengubah sukrosa, laktosa,
maltosa, dan pati menjadi glukosa, yang kemudian dapat digunakan sebagai energi
oleh organisme itu, atau disimpan sebagai glikogen (Fessenden, 1986).
Gambar 2.2 Struktur Glukosa
Glukosa merupakan heksosa yang paling penting secara nutrisi dan paling
melimpah di alam. Glukosa terdapat dalam madu dan buah seperti anggur, ara, dan
kurma. Anggur yang matang, sebagai contoh, terdiri dari 20-30% glukosa. Glukosa
juga dikenal sebagai gula darah karena gula diangkut oleh darah menuju jaringan
tubuh untuk memenuhi kebutuhan energi. Gula lainnya yang diserap dalam tubuh
harus dimetabolisme oleh liver menjadi glukosa. Glukosa pada umumnya digunakan
sebagai pemanis dalam manisan dan makanan lainnya, termasuk beberapa makanan
bayi (Seager, 2008).
2.2.2 Oligosakarida
Oligosakarida adalah polimer dengan derajat polimerisasi 2 sampai 10 yang biasanya
bersifat larut dalam air. Oligosakarida yang terdiri dari dua monosakarida disebut
disakarida, dan bila tiga molekul disebut triosa (Winarno, 1995).
Oligosakarida yang paling sering dijumpai ialah disakarida. Dalam disakarida,
dua monosakarida ditautkan oleh ikatan glikosidik antara karbon anomerik dari satu
unit monosakarida dan gugus hidroksil dari unit lainnya. Beberapa contoh disakarida :
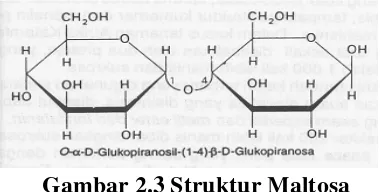
a. Maltosa
Maltosa ialah disakarida yang diperoleh lewat hidrolisis parsial dari pati. Hidrolisis
lanjutan dari maltosa hanya menghasilkan D-glukosa. Jadi, maltosa terdiri atas dua
unit glukosa yang bertautan.
Gambar 2.3 Struktur Maltosa
Karbon anomerik di unit glukosa sebelah kanan pada maltosa ialah suatu
hemiasetal. Secara alami, bila maltosa berada dalam larutan, fungsi hemiasetal ini
akan berkesetimbangan dengan bentuk aldehida rantai terbuka. Dengan begitu,
maltosa menghasilkan uji Tollens positif dan reaksi lain yang serupa seperti pada
karbon anomerik glukosa.
b. Selobiosa
Selobiosa ialah disakarida yang diperoleh dari hidrolisis parsial selulosa. Hidrolisis
selobiosa lebih lanjut hanya menghasilkan D-glukosa. Jadi, selobiosa merupakan
isomer maltosa. Pada kenyataannya, selobiosa berbeda dari maltosa hanya karena
struktur lainnya identik termasuk tautan antara C-1 dari unit di kiri dan gugus
hidroksil pada C-4 di unit kanan.
Gambar 2.4 Struktur Selobiosa
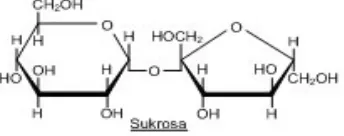
c. Sukrosa
Disakarida komersial yang paling penting ialah sukrosa, atau gula pasir. Sukrosa
terjadi dalam semua tumbuhan fotosintetik, yang berfungsi sebagai sumber energi.
Sukrosa diperoleh secara komersial dari batang tebu dan bit gula, yang kadarnya
14-20% dari cairan tumbuhan tersebut.
Hidrolisis sukrosa memberikan D-glukosa dan ketosa D-fruktosa dengan
jumlah mol yang ekuivalen. Sukrosa tidak mempunyai gugus aldehida bebas yang
berpotensi sehingga tidak dapat mereduksi reagen Tollens, Fehling, atau Benedict.
Oleh karena itu sukrosa disebut sebagai gula non-pereduksi (Hart, 2003).
Gambar 2.5 Struktur Sukrosa 2.2.3 Polisakarida
Polisakarida dalam bahan makanan berfungsi sebagai penguat tekstur (selulosa,
hemiselulosa, pektin, lignin) dan sebagai sumber energi (pati, dekstrin, glikogen,
fruktan). Polisakarida merupakan polimer molekul-molekul monosakarida yang dapat
berantai lurus atau bercabang dan dapat dihidrolisis. Hasil hidrolisis sebagian akan
menghasilkan oligosakarida dan dapat dipakai untuk menentukan struktur molekul
polisakarida (Winarno, 1995).
Sebagai contoh, pati ialah karbohidrat penyimpan energi bagi tumbuhan yang
tersusun dari unit-unit glukosa yang bergabung lewat ikatan 1,4-α-glikosidik,
1,6-α-glikosidik. Hidrolisis parsial dari pati menghasilkan maltosa dan hidrolisis
sempurna hanya menghasilkan D-glukosa.
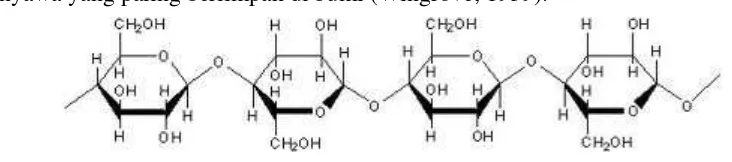
2.2.3.1 Selulosa
Selain pati, polisakarida yang banyak ditemukan di alam adalah selulosa. Selulosa
merupakan polimer tak bercabang dari sejumlah glukosa yang bergabung lewat ikatan
1,4-β-glikosidik. Pemeriksaan selulosa dengan sinar X menunjukkan bahwa selulosa
terdiri atas rantai linear dari unit selobiosa. Walaupun manusia dan beberapa hewan
dapat mencerna pati, tidak sama halnya dengan selulosa. Hal ini disebabkan oleh
perbedaan ikatan glikosidiknya (Hart, 2003).
Berat molekul selulosa berkisar antara 100.000 hingga 1.000.000. Kapas
merupakan salah satu sumber yang kaya akan selulosa, mengandung lebih dari 90%
selulosa per satuan berat. Kebanyakan tanaman lain juga mengandung persentase
selulosa yang tinggi secara relatif, pada umumnya berkisar antara 10-15%. Selulosa
sangat penting dalam industri kimia. Sebagai contoh, digunakan dalam industri pabrik
barang-barang kertas, cat, bahan peledak, dan rayon. Selulosa merupakan satu dari
senyawa yang paling berlimpah di bumi (Wingrove, 1939).
Gambar 2.6 Struktur Selulosa 2.2.3.2 Sifat-Sifat Selulosa
Selulosa tidak memiliki rasa, tidak berbau, tidak larut dalam
organik. Selulosa dapat dipecah menjadi unit-unit kimia glukosa dengan
mereaksikannya dengan asam pekat pada suhu tinggi.
Dibandingkan dengan pati, selulosa jauh lebih bersifat kristal. Dimana pati
mengalami transisi kristal menjadi amorf ketika dipanaskan dalam air pada suhu
mencapai 60-70ºC. Sedangkan selulosa membutuhkan suhu 320ºC dan tekanan 25
Kebanyakan sifat selulosa tergantung pada panjang rantai atau derajat
polimerisasi unit glukosa. Selulosa dari pulp kayu memiliki panjang rantai khas antara
300-1700 unit. Kapas dan serat tanaman lainnya sama seperti selulosa bakteri
memiliki panjang rantai berkisar antara 800-10.000 unit (Klemm, 2005).
Selulosa yang diturunkan dari tanaman biasanya ditemukan dalam suatu
campuran dengan hemiselulosa, lignin, pektin, dan zat-zat lain. Sementara selulosa
mikroba cukup murni, memiliki kadar air cukup tinggi dan terdiri dari rantai panjang.
Selulosa larut dalam kuprietilendiamin (CED), kadmiumetilendiamin (Cadoxen),
N-metilmorfolina N-oksida, dan litium klorida atau dimetilformamida. Pelarut-pelarut ini
digunakan dalam produksi selulosa diregenerasi dari pelarutan pulp (Stenius, 2000).
2.2.3.3 Hidrolisis Selulosa
Hidrolisis selulosa lengkap dengan HCl 30%, hanya menghasilkan D-glukosa.
Disakarida yang terisolasi dari selulosa yang terhidrolisis sebagian adalah selobiosa,
yang dapat dihidrolisis lebih lanjut menjadi D-glukosa dengan suatu katalis asam atau
dengan emulsin enzim. Selulosa sendiri tidak mempunyai karbon hemiasetal-selulosa
sehingga tidak dapat mengalami mutarotasi atau dioksidasi oleh reagensia seperti
Tollens (Fessenden, 1986).
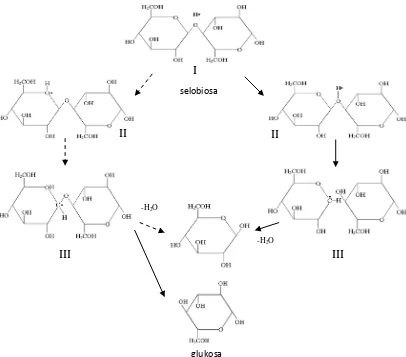
Selulosa Selobiosa Glukosa
Hidrolisis dalam suasana asam, yang menghasilkan pemecahan ikatan
glikosidik berlangsung dalam tiga tahap. Tahap pertama, proton yang bertindak
sebagai katalisator asam berinteraksi cepat dengan oksigen glikosida yang
menghubungkan dua unit gula (I), membentuk asam konjugat (II). Langkah ini diikuti
dengan pemecahan yang lambat dari ikatan C-O, yang menghasilkan zat antara kation
karbonium siklik (III). Protonasi dapat juga terjadi pada oksigen cincin (II),
menghasilkan pembukaan cincin dan kation karbonium nonsiklik (III). Tidak ada
kepastian ion karbonium mana yang paling mungkin terbesar pada kation siklik.
Akhirnya kation karbonium mulai mengadisi molekul air dengan cepat, membentuk
-H2O
-H2O
I
Gambar 2.7 Mekanisme Dasar Hidrolisis Selobiosa
2.3 Sirup Glukosa
Sirup glukosa merupakan salah satu bahan pemanis makanan dan minuman yang
berbentuk cairan dan dihasilkan melalui proses hidrolisis. Pembuatan sirup glukosa
pertama kali dilakukan pada tahun 1811 oleh ilmuwan Jerman bernama Gottlieb
Sigismund Constantin Krichhoff. Bahan baku utama produksi sirup glukosa di dunia
adalah pati berupa tepung tapioka, dan ada beberapa macam bahan lainnya seperti
tepung maizena, beras, kentang, akar-akaran dan sagu. Beberapa macam proses
pembuatan sirup glukosa melalui hidrolisis pati antara lain dengan katalis asam,
enzim, dan gabungan keduanya (http://letshare17.blogspot.com).
Proses pembuatan sirup glukosa dengan hidrolisis enzim dilakukan dengan
menghidrolisis pati dengan enzim α-amilase yang berfungsi memutuskan ikatan α-1,4 secara acak di bagian dalam molekul baik amilosa maupun amilopektin. Untuk sirup
-H2O
II II
III III
glukosa yang dihasilkan melalui hidrolisis pati dengan asam, katalis asam yang biasa
digunakan adalah asam klorida. Secara umum, pembuatan sirup glukosa dengan
hidrolisis asam (PT Indonesian Maltose Industry) adalah sebagai berikut:
Gambar 2.8 Diagram Alir Pembuatan Sirup Glukosa
Proses hidrolisis asam lebih mudah dilakukan dari pada hidrolisis enzim
karena peralatan yang digunakan pada hidrolisis asam cukup sederhana dan prosesnya
tidak rumit. Lain halnya dengan proses hidrolisis enzim yang membutuhkan peralatan
cukup banyak dengan proses yang rumit karena melibatkan kerja enzim dengan
Tabel 2.3 Standar Mutu Sirup Glukosa
No Komponen Spesifikasi
1. Air Maksimum 20%
2. Gula reduksi dihitung sebagai D-glukosa Maksimum 1%
3. Sulfur dioksida (SO2 Untuk kembang gula sekitar 400
ppm, yang lain maksimum 40 ppm.
)
4. Pemanis buatan Negatif
5. Logam berbahaya (Pb,Cu, Zn dan As) Negatif
6. Natrium Benzoat Maksimum 250 ppm
7. Warna Tidak berwarna sampai
kekuningan
8. Jumlah bakteri Maksimum 500 koloni/gram
9. Kapang Negatif
10. Khamir Negatif
Sumber : SII.0418-81
2.4 Analisis Karbohidrat 2.4.1 Analisis Kualitatif
Beberapa cara untuk mengetahui adanya karbohidrat dalam suatu bahan antara lain:
a. Uji Molisch
Karbohidrat oleh asam sulfat pekat akan dihidrolisis menjadi monosakarida dan
selanjutnya monosakarida mengalami dehidrasi oleh asam sulfat menjadi furfural atau
hidroksi metil furfural. Senyawa-senyawa ini dengan alfa naftol akan berkondensasi
membentuk senyawa kompleks yang berwarna ungu.
b. Uji Iodin
Karbohidrat golongan polisakarida akan memberikan reaksi dengan larutan iodin dan
memberikan warna spesifik bergantung pada jenis karbohidratnya. Amilosa dengan
iodin akan berwarna biru, amilopektin dengan iodin akan berwarna merah violet,
glikogen maupun dextrin dengan iodin akan berwarna merah coklat.
c. Uji Pembentukan Osason
Aldosa ataupun ketosa dengan fenilhidrasin dan dipanaskan akan membentuk
hidrason atau osason. Reaksi antar senyawaan tersebut merupakan reaksi
oksido-reduksi, atom C yang mengalami reaksi adalah atom C nomor satu dan dua dari aldosa
d. Uji Fehling
Larutan fehling yang terdiri dari campuran kupri sulfat, Na-K-tartrat dan natrium
hidroksida dengan gula reduksi dan dipanaskan akan terbentuk endapan berwarna
hijau, kuning orange atau merah bergantung dari macam gula reduksinya (Sudarmadji,
1987).
e. Uji Benedict
Pereaksi benedict berupa larutan yang mengandung kupri sulfat, natrium karbonat,
dan natrium sitrat. Glukosa dapat mereduksi ion Cu++ dari kupri sulfat menjadi ion Cu+ yang kemudian mengendap sebagai Cu2
2.4.2 Analisis Kuantitatif
O. Adanya natrium karbonat dan natrium
sitrat membuat pereaksi benedict bersifat basa lemah. Endapan yang terbentuk dapat
berwarna hijau, kuning, atau merah bata. Warna endapan ini tergantung pada
konsentrasi karbohidrat yang diperiksa (Poedjiadi, 1994).
Penentuan karbohidrat yang termasuk polisakarida maupun oligosakarida memerlukan
perlakuan pendahuluan yaitu hidrolisis terlebih dahulu sehingga diperoleh
monosakarida. Untuk keperluan ini, bahan dihidrolisis dengan asam atau enzim pada
suatu keadaan tertentu. Beberapa cara analisis kuantitatif monosakarida antara lain:
a. Metode Luff Schoorl
Pada penentuan gula secara Luff Schoorl, yang ditentukan adalah kuprioksida dalam
larutan sebelum direaksikan dengan gula reduksi (titrasi blanko) dan sesudah
direaksikan dengan sampel gula reduksi (titrasi sampel). Penentuannya dengan titrasi
menggunakan Na-tiosulfat. Selisih titrasi blanko dengan titrasi sampel ekuivalen
dengan kuprooksida yang terbentuk dan juga ekuivalen dengan jumlah gula reduksi
yang ada dalam bahan/larutan.
b. Metode Munson-Walker
Penentuan gula cara ini adalah dengan menentukan banyaknya kuprooksida yang
terbentuk dengan cara penimbangan atau dengan melarutkan kembali dengan asam
nitrat kemudian menitrasi dengan tiosulfat. Jumlah kuprooksida yang terbentuk
ekuivalen dengan banyaknya gula reduksi yang ada dalam larutan dan telah
disediakan dalam bentuk tabel Hammond, yakni hubungan antara banyaknya
c. Metode Lane-Eynon
Penentuan gula cara ini dengan menitrasi reagen Soxhlet (larutan CuSO4
d. Metode Nelson-Somogyi
, K-N-tartrat)
dengan larutan gula yang diselidiki. Banyaknya larutan sampel yang dibutuhkan untuk
menitrasi reagen Soxhlet dapat diketahui banyaknya gula yang ada dengan melihat
pada tabel Lane-Eynon (Sudarmadji, 1987).
Metode ini dapat digunakan untuk mengukur kadar gula reduksi dengan menggunakan
pereaksi tembaga arsenomolibdat. Kupri mula-mula direduksi menjadi bentuk kupro
dengan pemanasan larutan gula. Kupro yang terbentuk berupa endapan selanjutnya
dilarutkan dengan arsenomolibdat menjadi molibdenum berwarna biru yang
menunjukkan ukuran konsentrasi gula. Dengan membandingkannya terhadap larutan
standar, konsentrasi gula dalam sampel dapat ditentukan. Reaksi warna yang terbentuk
dapat menentukan konsentrasi gula dalam sampel dengan mengukur absorbansinya
(Sudarmadji, 1989).
Warna biru yang dihasilkan kemudian diukur absorbansinya dengan cara
spektrofotometri UV-Visible. Cara ini merupakan anggota teknik analisis
spektroskopik yang memakai sumber radiasi elektromagnetik ultra violet dekat
(190-380 nm) dan sinar tampak ((190-380-780 nm) dengan memakai instrumen
spektrofotometer.
Analisis dengan spektrofotometri UV-Visible selalu melibatkan pembacaan
absorban radiasi elektromagnetik oleh molekul atau radiasi elektromagnetik yang
diteruskan. Keduanya dikenal sebagai absorban (A) tanpa satuan dan transmitan
dengan satuan persen (%T) (Mulja, 1995).
Istilah log (P0
2.6 Manisan Buah
/P) disebut absorban dan diberi lambang A. Istilah lain yang
telah digunakan secara sinonim dengan absorban dan yang mungkin dijumpai dalam
literatur adalah ekstingsi (extinction), rapatan optik (optical density) dan absorbansi (absorbancy) (Underwood, 1986).
Manisan buah adalah buah-buahan yang direndam dalam larutan gula selama beberapa
nafsu makan. Teknologi membuat manisan merupakan salah satu cara
membuat kadar gula dalam buah meningkat dan kadar airnya berkurang. Keadaan ini
akan menghambat pertumbuha
lama (Muaris, 2003).
Ada dua jenis manisan, antara lain manisan basah dan manisan kering.
Manisan basah adalah manisan yang diperoleh setelah penirisan buah dari larutan
gula. Manisan basah mempunyai kandungan air yang lebih banyak dan penampakan
yang lebih menarik karena mirip dengan buah aslinya. Manisan ini biasanya dibuat
dari buah yang keras. Sedangkan manisan kering adalah manisan yang diperoleh
setelah buah ditiriskan kemudian dijemur hingga kering. Manisan kering memiliki
daya simpan yang lebih lama, kadar air yang lebih rendah, dan kadar gula yang lebih
tinggi. Manisan kering biasanya dibuat dari buah yang teksturnya lunak (Fatah, 2004).
2.7 Uji Organoleptik
Uji organoleptik merupakan hasil reaksi fisikologik berupa tanggapan atau kesan mutu
oleh panelis. Panelis adalah sekelompok orang yang bertugas menilai sifat atau
kualitas bahan berdasarkan kesan subyektif. Panelis dapat dibagi menjadi enam
kelompok yaitu panelis pencicipan perorangan, panelis pencicipan terbatas, panelis
terlatih, panelis agak terlatih, dan panelis konsumen. Pengujian bahan pangan dengan
panelis agak terlatih sering dilakukan karena tidak memerlukan panelis yang memiliki
kepekaan tinggi. Panelis agak terlatih biasanya merupakan sekelompok mahasiswa
atau staf peneliti (15 sampai 25 orang) yang mengetahui sifat-sifat sensorik dari
contoh yang dinilai melalui penjelasan atau latihan sekedarnya (Soekarto, 1985).
Tes yang paling umum digunakan untuk mengukur tingkat kesukaan sampel
adalah skala hedonik. Istilah "hedonik" didefinisikan sebagai "yang berkaitan dengan
kesenangan". Skala mencakup serangkaian pernyataan atau titik dimana panelis
menyatakan tingkat suka atau tidak suka untuk sampel. Skala yang paling umum
“tidak suka (dislike moderately)”, “sangat tidak suka (dislike very much)”, dan “amat sangat tidak suka (dislike extremely)”.
Sampel dikodekan dan disajikan dalam gaya presentasi identik. Urutan
presentasi sampel secara acak untuk masing-masing panelis dan dapat disajikan secara
BAB 3
METODE PENELITIAN
3.1 Alat dan Bahan
3.1.1 Alat-Alat
- Neraca Analitik Mettler Toledo
- Oven Memmert
- Blender
- Gelas Ukur Pyrex
- Gelas Beaker Pyrex
- Corong
- Kertas Saring
- Labu Erlenmeyer Pyrex
- Botol Akuades
- Hot Plate
- Indikator Universal Merck
- Tanur Gallenkamp
- Batang Pengaduk Pyrex
- Penangas Air Fisons
- Aluminium Foil
- Pipet Volume Pyrex
- Labu Takar Pyrex
- Tabung Reaksi Pyrex
- Spektrofotometer Genesys 20
- Termometer Fisher
3.2 Prosedur Penelitian
3.2.1 Pengambilan Sampel
Sampel berupa kulit buah kuini diperoleh dari pedagang jus Setiabudi, yang
dikumpulkan dan diambil secara acak sederhana. Sedangkan buah mangga udang
diperoleh dari pasar Tavip Binjai. Tanaman kuini dengan spesies Mangifera odorata
dan tanaman mangga dengan spesies Mangifera indica L..
3.2.2 Pembuatan Larutan
3.2.2.1 Larutan H2SO4 1,25 N
Dimasukkan 8,5 mL H2SO4(P) ke dalam labu takar 250 mL, kemudian diencerkan
dengan akuades sampai garis tanda.
3.2.2.2 Larutan NaOH 1,25 N
Dilarutkan 12,5 g NaOH dengan akuades, kemudian dimasukkan ke dalam labu takar
250 ml dan diencerkan dengan akuades sampai garis tanda.
3.2.2.3 Larutan NaOH 10%
Dilarutkan 10 g NaOH dengan akuades, kemudian dimasukkan ke dalam labu takar
100 mL dan diencerkan dengan akuades sampai garis tanda.
3.2.2.4 Larutan HCl 30 %
Dimasukkan 203 mL HCl 37% ke dalam labu takar 250 mL, kemudian diencerkan
dengan akuades sampai garis tanda.
3.2.2.5 Pereaksi Benedict
Dengan bantuan pemanasan, dilarutkan 173 g Na-sitrat dan 100 g Na2CO3
Dilarutkan 17,3 g CuSO
dalam 800
mL air. Disaring, kemudian ditambahkan akuades sampai volume larutan menjadi 850
mL (Larutan I).
4.5H2O dalam 100 mL air (dipanaskan bila perlu).
Bila larutan di atas sudah dingin, maka secara perlahan-lahan ditambahkan ke dalam
3.2.2.6 Pereaksi Nelson
Nelson A :
Dilarutkan 12,5 g Natrium karbonat anhidrat, 12,5 g garam Rochelle (K-Na-Tartrat),
10 g Natrium Bikarbonat, dan 100 g Natrium Sulfat anhidrat dalam 300 mL akuades
dan diencerkan sampai 500 mL.
Nelson B :
Dilarutkan 7,5 g CuSO4.5H2
Pereaksi Nelson dibuat dengan cara mencampur 25 bagian larutan Nelson A
dan 1 bagian Nelson B. Pencampuran dilakukan setiap kali akan digunakan.
O dalam 50 mL akuades dan ditambahkan 1 tetes asam
sulfat pekat.
3.2.2.7 Larutan Arsenomolibdat
Dilarutkan 25 g ammonium molibdat dalam 450 mL akuades dan ditambahkan 25 mL
H2SO4(p). Pada tempat yang lain, dilarutkan 3 g Na2HAsO4.7H2
Disimpan dalam botol berwarna coklat dan diinkubasi pada suhu 37
O dalam 25 mL
akuades, kemudian dituangkan larutan ini ke dalam larutan pertama.
o
C selama
24 jam. Larutan pereaksi ini dapat digunakan setelah masa inkubasi dan berwarna
kuning.
3.2.3 Cara Kerja
3.2.3.1 Isolasi dan Analisis Kadar Selulosa Kulit Buah Kuini
Sebanyak 1000 g kulit buah kuini dihaluskan, dikeringkan, kemudian ditimbang.
Ditambahkan 1500 mL etanol 96%, direndam selama 1 jam, lalu disaring.
Ditambahkan 1500 mL H2SO4 1,25 N, dipanaskan selama 30 menit lalu disaring.
Residu dicuci dengan akuades panas hingga pH netral. Kemudian ditambahkan 1500
mL NaOH 1,25 N, dipanaskan selama 30 menit lalu disaring. Residu dicuci dengan
akuades panas hingga pH netral. Kemudian dikeringkan dalam oven pada suhu 110ºC
dan ditimbang. Diambil 5 g, lalu diabukan dalam tanur pada suhu 600ºC selama 3 jam,
3.2.3.2 Hidrolisis Selulosa Kulit Buah Kuini dan Analisis Glukosa Hasil Hidrolisis Secara Kualitatif
Dimasukkan 27,413 g selulosa yg telah diisolasi dari kulit buah kuini ke dalam labu
Erlenmeyer. Ditambahkan 22 mL HCl 30%, ditutup dengan aluminium foil dan
didiamkan selama 30 menit. Kemudian ditambahkan 200 mL akuades dan direfluks
selama 1 jam, didinginkan dan disaring. Dimasukkan filtrat ke dalam labu ukur 250
mL, ditambahkan NaOH 10% hingga pH netral, ditambahkan akuades sampai garis
tanda. Dipipet 1 mL dan dimasukkan ke dalam tabung reaksi. Ditambahkan 5 mL
pereaksi Benedict, dipanaskan hingga terbentuk endapan merah bata.
3.2.3.3 Pengukuran Panjang Gelombang Maksimum Larutan Glukosa Standar
Ditimbang 1 g glukosa anhidrat dan dilarutkan dengan akuades hingga volume 1000
ml (larutan glukosa 1000 ppm atau 1 mg/mL). Dipipet 5 ml larutan glukosa 1 mg/mL
lalu diencerkan dengan akuades sampai volume 100 mL (larutan glukosa 0,05
mg/mL). Selanjutnya dipipet 1 mL larutan glukosa 0,05 mg/ml ke dalam tabung
reaksi, ditambahkan 1 mL pereaksi Nelson, ditutup dengan kapas dan dipanaskan pada
waterbath selama 30 menit, kemudian didinginkan. Ditambahkan 1 mL larutan arsenomolibdat lalu digojog hingga semua endapan larut. Kemudian ditambahkan 7
mL akuades, digojog hingga homogen, diukur serapannya pada panjang gelombang
600 – 800 nm. Maka diperoleh panjang gelombang maksimum (Lampiran 1).
3.2.3.4 Penyiapan Kurva Glukosa Standar
Disiapkan larutan glukosa standar dalam beberapa tabung reaksi dengan variasi
konsentrasi dari 0,02 – 0,20 mg/mL. Ditambahkan 1 mL larutan Nelson kemudian
dipanaskan selama 30 menit dan didinginkan. Ditambahkan 1 mL larutan
arsenomolibdat dan digojog hingga semua endapan larut. Ditambahkan 7 mL akuades
lalu digojog hingga homogen. Diukur serapannya pada panjang gelombang 740 nm.
Kemudian dibuat kurva standar yang menunjukkan hubungan antara konsentrasi gula
3.2.3.5 Analisis Kadar Glukosa Sampel
Dipipet 1 mL filtrat netral dan diencerkan dalam labu takar 10 mL sebanyak tiga kali.
Dipipet 1 mL dan dimasukkan ke dalam tabung reaksi. Ditambahkan 1 mL larutan
Nelson kemudian dipanaskan hingga mendidih selama 30 menit dan didinginkan.
Ditambahkan 1 mL larutan arsenomolibdat dan digojog. Ditambahkan 7 mL akuades
lalu digojog hingga homogen. Diukur serapannya pada panjang gelombang 740 nm.
3.2.3.6 Pembuatan Manisan Mangga
Buah mangga, yang telah disortasi, dikupas kulitnya dan dicuci bersih. Sebanyak 100
g daging buah mangga kemudian dipotong dengan ukuran 2 x 6 cm. Potongan buah
mangga tersebut direndam dalam larutan kapur 10% selama 1 jam. Ditiriskan dan
dicuci dengan air bersih. Direndam dalam campuran larutan gula pasir dan larutan
glukosa yang telah dipanaskan dan konsentrasinya divariasikan dengan perbandingan
(1:0), (1:1), (1:2), (1:3), dan (0:1) dimana total konsentrasi campuran tersebut adalah
40%.
3.2.3.7 Penentuan Nilai Organoleptik
Penentuan nilai organoleptik dilakukan dengan menggunakan uji hedonik (uji
kesukaan) berdasarkan Elisabeth Larmond, dengan skala 5 poin untuk mengetahui
mana yang lebih disukai panelis terhadap rasa, warna, dan aroma dari manisan
mangga. Pengujian dilakukan oleh 15 orang panelis. Panelis diberi formulir penilaian
organoleptik dengan skala 1-5 dengan kriteria:
Tabel 3.1 Skala Uji Hedonik
Skala Hedonik Skala Numerik
Amat Sangat Suka 5
Sangat Suka 4
Suka 3
Kurang Suka 2
Dihaluskan Dikeringkan
Ditambahkan 1500 mL etanol 96% Direndam selama 1 jam
Disaring
Dicuci dengan akuades panas hingga pH netral Ditambah 1500 mL NaOH 1,25 N
Dipanaskan selama 30 menit Disaring
Ditambah 1500 mL H2SO4 1,25 N
Dipanaskan selama 30 menit Disaring
Dicuci dengan akuades panas hingga pH netral Dikeringkan pada suhu 110oC
Ditimbang
Diambil 5 g
Diabukan pada suhu 600ºC Ditimbang
3.3 Bagan Penelitian
3.3.1 Isolasi dan Analisis Kadar Selulosa dari Kulit Buah Kuini
1000 g Kulit Buah Kuini
302,86 g Kulit Buah Kuini Halus
27,413 g Selulosa
Ditambahkan 22 mL HCl 30% Ditutup dengan aluminium foil Didiamkan selama 30 menit Ditambahkan 200 mL akuades Direfluks selama 1 jam
Sampel Terhidrolisis
Disaring
Residu Filtrat
Dimasukkan ke dalam labu takar 250 mL Ditambahkan NaOH 10% hingga pH netral Ditambahkan akuades hingga garis tanda
Dipipet 1 mL ke dalam tabung reaksi Ditambahkan 5 mL larutan Benedict Dipanaskan di penangas air
Endapan Merah Bata Filtrat Netral
Dipipet 1 mL
Diencerkan dalam labu takar 10 mL sebanyak tiga kali
Dipipet 1 mL
Dimasukkan ke dalam tabung reaksi
Ditambahkan 1 mL pereaksi Nelson
Ditutup dengan kapas
Dipanaskan di penangas selama 30 menit Didinginkan di bawah air yang mengalir
Digojog hingga homogen
Ditambahkan 1 mL larutan arsenomolibdat
Digojog hingga endapan larut
Ditambahkan 7 mL akuades
Digojog hingga homogen
Diukur absorbansinya pada panjang gelombang 740 nm
3.3.3 Analisis Kadar Glukosa Hasil Hidrolisis Selulosa dari Kulit Buah Kuini Secara Spektrofotometri
Filtrat netral hasil hidrolisis selulosa
1 mL larutan glukosa sampel
Larutan dengan endapan merah bata
Larutan berwarna biru
Dilakukan sortasi Dikupas kulitnya Dicuci hingga bersih
Dipotong dengan ukuran 2 x 6 cm
Direndam dalam larutan kapur 10% selama 1 jam Ditiriskan dan dicuci dengan air bersih
Direndam dalam campuran larutan gula pasir dan filtrat netral larutan glukosa yang telah dipanaskan dan konsentrasinya divariasikan dengan perbandingan (1:0), (1:1), (1:2), (1:3), dan (0:1) dimana total konsentrasi campuran tersebut adalah 40%
Disajikan kepada panelis
Dilakukan uji kesukaan (warna, rasa, dan aroma) Ditentukan skor nilainya
3.3.4 Pembuatan Manisan Mangga
3.3.5 Penentuan Nilai Organoleptik
Buah Mangga Udang
Hasil
Manisan
Hasil
Sebelum Setelah
Dalam pembuatan sirup glukosa, terlebih dahulu dilakukan isolasi selulosa kulit buah
kuini. Dari 1000 g kulit buah kuini basah diperoleh data berikut:
Tabel 4.1 Hasil Pengolahan Kulit Buah Kuini
Kulit Buah Kuini Berat (g)
Basah 1000
Kering 302,86
Hasil Isolasi Selulosa 42,413
a. Diabukan dengan 3 kali perlakuan (@ 5 g) 15
b. Dihidrolisis 27,413
Pada analisis kadar selulosa kulit buah kuini, 15 g selulosa hasil isolasi dibagi
menjadi 3 lalu diabukan pada suhu 600ºC selama 3 jam. Berat yang hilang kemudian
dihitung sebagai kadar selulosa.
Tabel 4.2 Hasil Analisis Kadar Selulosa Kulit Buah Kuini
Selulosa hasil isolasi kulit buah kuini kemudian dihidrolisis menggunakan HCl
30%. Hasil hidrolisis dianalisis secara kuantitatif dengan metode Nelson-Somogyi
Tabel 4.3 Hasil Analisis Kadar Glukosa Hasil Hidrolisis
Perulangan Absorbansi Konsentrasi Glukosa Kadar Glukosa Rataan Kadar Glukosa
I 1,124 0,118 mg/mL 15,07 %
15,96 %
II 1,243 0,134 mg/mL 17,11 %
III 1,161 0,123 mg/mL 15,71 %
Berdasarkan uji organoleptik manisan buah mangga untuk 15 orang panelis,
diperoleh data sebagai berikut:
Tabel 4.4 Nilai Organoleptik Manisan Buah Mangga
Variabel Gula Pasir : Sirup Glukosa Hasil Hidrolisis Selulosa Kulit Buah Kuini
1 : 0 1 : 1 1 : 2 1 : 3 0 : 1
Rasa 3,13 3,67 3,00 2,87 2,60
Warna 2,67 3,00 3,07 3,13 3,07
Aroma 2,53 3,13 3,00 2,93 2,80
4.1.1 Perhitungan Kadar Selulosa Kulit Buah Kuini
Selulosa dapat dihitung dengan rumus sebagai berikut:
B−S
BS
dimana:
B = berat sampel setelah pengeringan 110ºC = 5 g
S = berat sampel setelah pengeringan 600ºC
BS = berat sampel mula-mula = 35,704 g
maka kadar selulosanya adalah:
B−S
(13,808 + 13,713 + 13,928)%
4.1.2 Pengolahan Data Pengukuran Absorbansi Glukosa Hasil Hidrolisis Selulosa Kulit Buah Kuini
Pengolahan data pengukuran absorbansi glukosa hasil hidrolisis selulosa kulit buah
kuini dilakukan secara statistik dengan metode Chauvenet Criterion Test (CCT) yang diambil dari data absorbansi pada Lampiran 2.
Untuk melakukan CCT perlu harga ht dan hh
A = absorbansi
yang dapat dihitung dengan
hh= 1
S√n−1=
1
(0,0609)(1,4142)= 11,6
Hasil analisis untuk ketiga data absorbansi diperoleh htabel lebih besar dari
pada hhitung, maka data tersebut signifikan dan dapat diterima.
4.1.3 Perhitungan Kadar Glukosa Hasil Hidrolisis Selulosa Kulit Buah Kuini
Untuk menghitung kadar glukosa hasil hidrolisis selulosa kulit buah kuini, terlebih
dahulu harus dicari persamaan garis regresi larutan glukosa standar dari berbagai
konsentrasi.
Tabel 4.5 Metode Least Square
x y xy x²
Persamaan garis regresi:
y = ax + b
dimana: a = slope
b = intersept
x = kadar glukosa standar (mg/mL)
y = 7,4567x + 0,2439
Untuk pengukuran absorbansi sampel glukosa hasil hidrolisis selulosa kulit
buah kuini, diperoleh:
Karena sebelum diukur serapannya, setiap 1 mL dari 250 mL sampel glukosa
mengalami 3 kali pengenceran dalam labu takar 10 mL, maka konsentrasi sampel
glukosa:
kemudian disubstitusikan ke dalam rumus:
V
�= (15,07 + 17,11 + 15,71)%
3 = 15,96%
Nilai kadar glukosa yang diperoleh kemudian diperiksa dengan menggunakan
metode CCT.
Hasil analisis untuk ketiga data diperoleh h ’| = 0,98
tabel lebih besar dari pada hhitung,
maka data tersebut signifikan dan dapat diterima.
4.2 Pembahasan
Selulosa hasil isolasi kulit buah kuini diuji kualitatif yaitu secara fisika dengan
menambahkan air ke dalam serbuk selulosa kemudian digojog, dimana serbuk
tersebut tidak larut dalam air yang menunjukkan sifat dari selulosa. Kemudian secara
kimia dengan penambahan iodin, dimana tidak terbentuk warna jika direaksikan
dengan selulosa. Selulosa hasil isolasi kulit buah kuini kemudian diuji kuantitatif
dengan cara diabukan dan berdasarkan perhitungan didapat bahwa kadar selulosa yang
diperoleh sebesar 13,816%.
Setelah selulosa dihidrolisis, didapat hasil berupa cairan yang sangat kental
sangat asam karena adanya HCl dari proses hidrolisis sebelumnya. Untuk dapat diuji
baik secara kualitatif maupun kuantitatif, serta digunakan pada pembuatan manisan
buah mangga, maka sirup glukosa dinetralkan terlebih dahulu dengan NaOH 10%.
Dimana reaksi penetralan yang terbentuk menghasilkan NaCl yang tidak berbahaya
untuk dikonsumsi.
HCl + NaOH NaCl + H2
Selanjutnya larutan glukosa tersebut diuji secara kualitatif dengan penambahan
pereaksi Benedict lalu dipanaskan, terbentuk endapan merah bata yang membuktikan
adanya glukosa. Lalu diuji secara kuantitatif menggunakan alat spektrofotometer
visible. Berdasarkan pengolahan data CCT untuk absorbansi sampel glukosa,
diperoleh harga tabel > harga hitung yang menyatakan bahwa data tersebut adalah
signifikan dan tidak berbeda jauh untuk tiga kali perulangan sampel. O
Dari data absorbansi kemudian dihitung kadar glukosanya dengan analisis
regresi, dan diperoleh sebesar 15,96%. Data ini kemudian diperiksa kembali dengan
metode CCT untuk kadar glukosa. Pengolahan data menunjukkan bahwa harga tabel >
harga hitung yang menyatakan bahwa data tersebut adalah signifikan. Jika
dibandingkan dengan penelitian yang telah dilakukan sebelumnya, seperti oleh
Darmayanti berupa kulit buah sukun (10,66%), Sri Ningsih berupa ampas kelapa
(9,40%), Nurmala berupa dami nangka (2,4667%), dan Wijayanti berupa rumput
gajah (12,53%), diketahui bahwa untuk setiap sampel selulosa dari sumber yang
berbeda, menghasilkan kadar glukosa yang berbeda pula.
Tabel 4.6 Perbandingan Gula Pasir dan Sirup Glukosa dalam Pembuatan Manisan Mangga
Perbandingan
Gula Pasir dalam 100 mL Air
Larutan Glukosa Hasil Hidrolisis Selulosa Kulit Buah Kuini
Berat Konsentrasi Volume Berat Konsentrasi
1 : 0 40 g 40 % - - -
1 : 1 27,5 g 27,5 % 100 mL 12,5 g 12,5 %
1 : 2 15 g 15 % 200 mL 25 g 25 %
1 : 3 2,5 g 2,5 % 300 mL 37,5 g 37,5 %
Pada pembuatan manisan, digunakan buah mangga udang yang masih mentah,
dengan pH 4. Larutan gula berupa campuran gula pasir dan larutan glukosa dengan
berbagai perbandingan (Tabel 4.6). Setelah dilakukan perendaman buah mangga
dalam larutan gula tersebut, mengakibatkan pH larutan pada manisan menjadi 4-5.
Berdasarkan uji organoleptik terhadap 15 orang panelis, diketahui bahwa rasa manisan
buah mangga yang paling disukai adalah dengan perbandingan gula pasir dan sirup
glukosa 1 : 1. NaCl yang terbentuk pada reaksi penetralan menyebabkan manisan
untuk perbandingan 1 : 3 dan 0 : 1 terasa asin dan tidak disukai oleh panelis.
Sedangkan untuk perbandingan 1 : 1, adanya gula pasir mengurangi rasa asin pada
larutan gula dan disukai oleh panelis. Hal ini menjelaskan bahwa sirup glukosa yang
dihasilkan dapat digunakan sebagai pemanis alternatif pengganti atau substitusi pada
gula pasir, sehingga dapat mengurangi pemakaian gula pasir.
Untuk warna dan aroma pada manisan mangga diperoleh dari buah mangga itu
sendiri. Tidak ada perbedaan yang signifikan antara kelima perbandingan manisan
buah mangga tersebut. Walaupun demikian, dari uji organoleptik untuk warna dan
aroma, masing-masing diketahui bahwa perbandingan 1 : 3 dan 1 : 1 adalah manisan
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian yang diperoleh, dapat diambil kesimpulan bahwa kadar selulosa
dari kulit buah kuini adalah 13,816%, kadar glukosa hasil hidrolisis selulosa kulit
buah kuini adalah 15,96%, dan uji organoleptik menyatakan bahwa manisan buah
mangga yang paling disukai adalah rasa dengan perbandingan 1 : 1, warna dengan
perbandingan 1 : 3, dan aroma dengan perbandingan 1 : 1.
5.2 Saran
Kepada peneliti selanjutnya disarankan untuk:
1. Melakukan penelitian serupa untuk memperoleh hasil yang sempurna, seperti
sirup yang dihasilkan tidak dinetralkan tapi dibuat sama dengan keasaman buah
yaitu pH 4.
2. Membuat manisan dari buah mangga udang yang matang untuk diketahui apakah
hasilnya dapat dikatakan sebagai manisan.
DAFTAR PUSTAKA
Antarlina, S.S., Noor, I., Noor, D. H., Umar, S., dan Muhammad. 2003. Pemanfaatan Sumberdaya Tanaman Buah-buahan Lokal Kalimantan Selatan untuk Agroindustri. Banjarbaru: Laporan Akhir Balittra.
Brewer, J. M., Pesce, A. J., dan Ashworth, R. B. 1974. Experimental Techniques in Biochemistry. New Jersey: Prentice Hall.
Campbell, N. A., Reece, J. B., dan Mitchell, L.G. 2002. Biologi. Jilid 1. Edisi ke-5. Jakarta: Erlangga.
Pratiwi, D. 2011. Pemanfaatan Sirup Glukosa Hasil Hidrolisa Selulosa dari Kulit Buah Sukun (Artocarpus altilis) dengan HCl 30% Untuk Pembuatan Manisan Jambu Biji (Psidium guajava L.) dengan Variasi Konsentrasi. Skripsi S1. Jurusan Kimia. Medan: FMIPA USU.
Deguchi, S., Tsujii, K., dan Horikoshi, K. 2006. Cooking Cellulose in Hot and
Compr
Fatah, M. A. 2004. Membuat aneka manisan buah. Jakarta: AgroMedia Pustaka. Fessenden, R. J. dan Fessenden, J. S. 1986. Kimia Organik. Jilid 2. Edisi ke-3. Jakarta:
Erlangga.
Hart, H., Craine, L. E., dan Hart, D. J. 2003. Kimia Organik. Edisi ke-11. Jakarta: Erlangga.
http:/ /andyafood.wordpress.com. Diakses tanggal 11 Februari 2012.
http://ditjenbun.deptan.go.id. Diakses tanggal 8 Juli 2012.
http:/ /letshare17.blogspot.com. Diakses tanggal 8 Juli 2012.
http:/ /naturindonesia.com. Diakses tanggal 5 Juni 2012.
Klemm, D., 2005. Cellulose : Fascinating Biopolymer and Sustainable Raw Material.
Kusumawardhani, G. D. 2001. Pemekatan Sirup Glukosa dengan Proses Mikrofiltrasi Crossflow. Skripsi S1. Jurusan Teknologi Industri Pertanian. Bogor: Fakultas Teknologi Pertanian IPB.
Mardawati, R. 2010. Pemanfaatan Sirup Glukosa Hasil Hidrolisa Amilum dari Biji Kweni (Mangifera odorata Grift) Sebagai Pemanis pada Pembuatan Manisan dari Buah Salak (Salacca edulis Reinw). Skripsi S1. Jurusan Kimia. Medan: FMIPA USU.
Muaris, H. 2003. Manisan buah. Jakarta: Gramedia Pustaka Utama.
Mulja, M. 1995. Analisis Instrumental. Surabaya: Airlangga University Press.
Nasution, H. D. U. 2011. Pemanfaatan Sirup Glukosa Hasil Hidrolisa Amilum dari Biji Mangga Arumanis (Mangifera indica Linn) Sebagai Pemanis Pada Pembuatan Manisan dari Buah Kedondong (Spondias dulcis Forst). Skripsi S1. Jurusan Kimia. Medan: FMIPA USU.
Pardosi, S. N. 2011. Pemanfaatan Sirup Glukosa Hasil Hidrolisis Serat dari Ampas Kelapa dalam Pembuatan Gula Jawa/Gula Merah dengan Volume Bervariasi.
Skripsi S1. Jurusan Kimia. Medan: FMIPA USU.
Poedjadi, A. dan Supriyanti, T. 1994. Dasar-Dasar Biokimia. Jakarta: UI Press. Pracaya. 2011. Bertanam Mangga. Jakarta: Penebar Swadaya.
Rukmana, R. 1997. Mangga: Budidaya dan Pasca Panen. Yogyakarta: Kanisius. Sari, N. 2010. Pemanfaatan Sirup Glukosa Hasil Hidrolisa Selulosa dari Dami
Nangka (Artocarpus heterophyllus lamk) Sebagai Pemanis pada Pembuatan Manisan Buah Kelapa (Cocos nucifera L.). Skripsi S1. Jurusan Kimia. Medan: FMIPA USU.
Seager, S. L. dan Slabaugh, M. R. 2008. USA: Thomson Brooks Cole.
Soekarto, S. T. 1985. Penilaian Organoleptik: Untuk Industri Pangan dan Pertanian.
Jakarta: Bhrata Karya Aksara.
Stenius, P. 2000. Forest Products Chemistry. Finlandia: Fapet OY.
Sudarmadji, S. Haryono, B., dan Suhardi. 1987. Analisa Bahan Makanan dan
Pertanian. Yogyakarta: Liberty.
Sudarmadji, S, Haryono, B., dan Suhardi. 1989. Prosedur Analisa Untuk Bahan Makanan dan Pertanian. Edisi ke-3. Yogyakarta: Liberty.
Tafajani, D. S. 2011. Panduan Komplit Bertanam Sayur dan Buah-Buahan.
Yogyakarta: Cahaya Atma.
Torget, R. W., Pettersson, P. O., Lee, Y. Y., dan Xiang, Q. 2003. Applied Biochemistry and Biotechnology: Heterogeneous Aspect of Acid Hydrolysis of
Underwood, A. L. dan Day, R. A. 1986. Analisis Kimia Kuantitatif. Edisi ke-5. Jakarta: Erlangga.
Winarno, F. G. 1995. Kimia Pangan dan Gizi. Jakarta: PT Gramedia Pustaka Utama. Wingrove, A. S. dan Caret, R. L. 1939. Organic Chemistry. New York: Harper and
Row Publisher.
λ Absorbansi
Lampiran 1. Penentuan Panjang Gelombang Maksimum (λmaks
Glukosa Standar
) Larutan
Lampiran 3. Kurva Metode Least Square
Lampiran 4. Data Nilai Organoleptik Manisan Mangga
4.1 Nilai Organoleptik Terhadap Rasa Manisan Mangga
1 : 0 1 : 1 1 : 2 1 : 3 0 : 1
1 2 4 3 2 2
2 4 2 2 4 2
3 3 4 3 2 3
4 3 4 5 3 2
5 3 4 1 3 2
6 3 3 3 3 3
7 4 3 3 4 4
8 1 5 2 2 1
9 5 3 4 2 1
10 4 5 4 4 5
11 2 3 3 2 3
12 2 2 2 2 3
13 3 5 4 4 3
14 5 5 4 4 3
15 3 3 2 2 2
Jumlah 47 55 45 43 39
Rata-Rata 3.13 3.67 3.00 2.87 2.60
Panelis
4.2 Nilai Organoleptik Terhadap Warna Manisan Mangga
4.3 Nilai Organoleptik Terhadap Aroma Manisan Mangga
1 : 0 1 : 1 1 : 2 1 : 3 0 : 1
Rata-Rata 2.67 3.00 3.07 3.13 3.07
Panelis
Gula Pasir : Sirup Glukosa Hasil Hidrolisis Selulosa Kulit Buah Kuini
Rata-Rata 2.53 3.13 3.00 2.93 2.80
Panelis
Lampiran 5. Tabel Harga erf (t) atau ert (hx) dari Harga T
Lampiran 6. Gambar Bahan dan Hasil Penelitian
Kulit Buah Kuini Pengeringan Kulit Buah Kuini
Hasil Isolasi Selulosa Kulit Buah Kuini
Hasil Hidrolisis Selulosa Sirup Glukosa Buah Mangga
Kulit Buah Kuini
Lampiran 7. Gambar Uji Organoleptik Hasil Penelitian