I. PENDAHULUAN
Bagian pendahuluan ini membahas latar belakang masalah defisiensi fosfor (P) pada tanaman padi, terutama di Indonesia, yang merupakan masalah signifikan mengingat luas lahan kering masam yang signifikan. Diskusi ini menekankan pentingnya mengembangkan varietas padi toleran terhadap defisiensi P untuk mengurangi ketergantungan pada pupuk dan meningkatkan produktivitas di lahan marginal. Tujuan penelitian dijabarkan dengan jelas, yakni memperoleh informasi polimorfisme mikrosatelit, mendapatkan galur padi dengan gen Pup1, dan menganalisis pengaruh introgresi Pup1 terhadap toleransi defisiensi P. Strategi penelitian yang terinci dipaparkan, mencakup uji varietas, analisis molekuler, persilangan, seleksi marka molekuler, dan pengujian fenotipik di berbagai kondisi (larutan hara, tanah, dan lapangan). Secara pedagogis, bagian ini memperkenalkan konteks masalah riil pertanian dan memperkenalkan metode riset ilmiah yang komprehensif dalam menjawab tantangan tersebut.
II. TINJAUAN PUSTAKA
Tinjauan pustaka ini memberikan landasan teoritis yang kuat mengenai peran fosfor dalam fisiologi tanaman, mekanisme toleransi terhadap defisiensi P, dan perkembangan marka molekuler dalam pemuliaan tanaman. Pembahasan mencakup pengaruh P pada proses-proses biokimiawi vital, seperti sintesis asam nukleat dan transfer energi. Mekanisme toleransi tanaman terhadap defisiensi P dijelaskan secara rinci, meliputi aspek morfologi akar, sekresi asam organik, dan efisiensi penggunaan P. Perkembangan marka molekuler, khususnya penggunaan marka mikrosatelit, dibahas sebagai metode modern dalam seleksi genotipe toleran. Bagian ini memberikan pemahaman mendalam tentang teori-teori dan prinsip-prinsip yang mendasari penelitian, relevan dengan pembelajaran botani, biokimia, dan genetika tanaman. Penggunaan referensi ilmiah memperkuat validitas isi dan melatih kemampuan literatur review mahasiswa.
III. IDENTIFIKASI MARKA POLIMORFIK UNTUK PEMULIAAN PADI TOLERAN DEFISIENSI FOSFOR
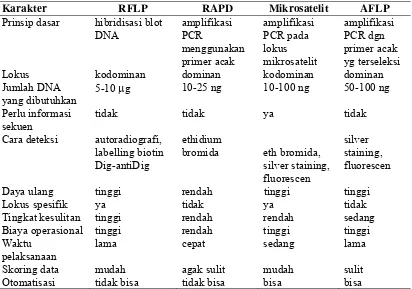
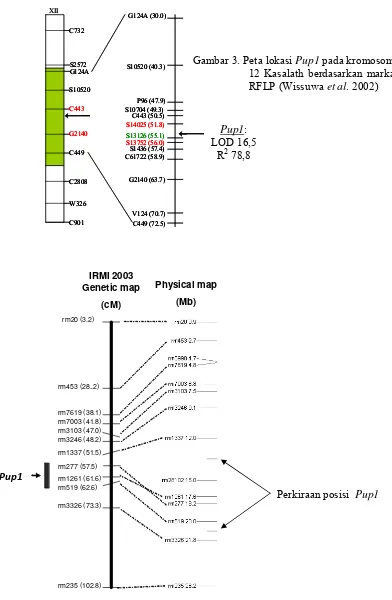
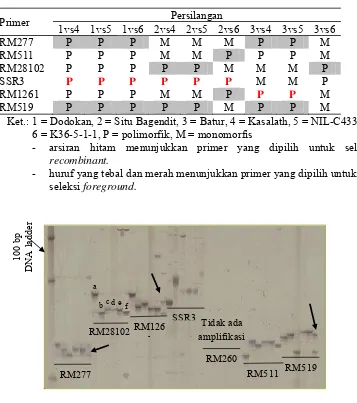
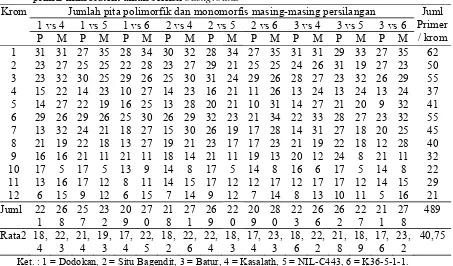
Bagian ini memaparkan metodologi identifikasi marka polimorfik menggunakan primer mikrosatelit untuk seleksi galur padi toleran defisiensi P. Metodologi yang digunakan meliputi pemilihan tetua, ekstraksi DNA, amplifikasi PCR, dan analisis gel. Hasil analisis polimorfisme ditampilkan dan diinterpretasi untuk memilih primer yang berguna dalam pemuliaan. Pembahasan menekankan aspek teknis analisis molekuler, termasuk interpretasi hasil elektroforesis. Secara pedagogis, bagian ini memberi kesempatan mahasiswa untuk memahami langkah-langkah praktis dalam penelitian molekuler, analisis data, dan interpretasi hasil penelitian dengan pendekatan biologi molekuler. Kemampuan analisa data kuantitatif juga terasah melalui pemahaman tabel dan grafik yang disajikan.
IV. APLIKASI MARKA MOLEKULER UNTUK SELEKSI GALUR-GALUR PUP1 HASIL PERSILANGAN SITUBAGENDIT DAN BATUR
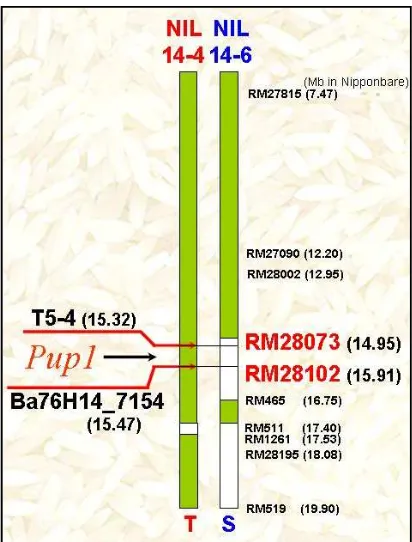
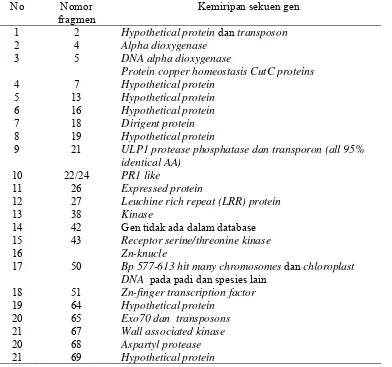
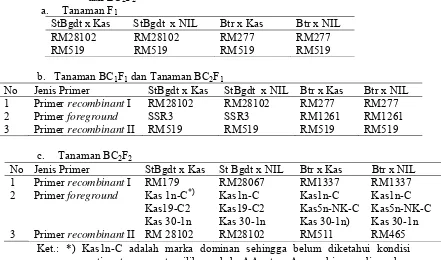
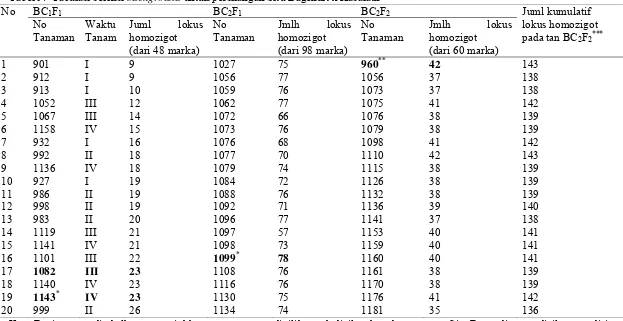
Bagian ini menjelaskan aplikasi marka molekuler (foreground, recombinant, dan background) dalam seleksi galur padi hasil persilangan yang mengandung gen Pup1. Metodologi persilangan dan seleksi, yang meliputi metode silang balik (backcross) dan penggunaan primer spesifik, dijelaskan secara detail. Hasil seleksi molekuler disajikan dan diinterpretasi untuk memilih galur-galur unggul. Pembahasan menekankan pentingnya pendekatan marka molekuler dalam pemuliaan tanaman untuk efisiensi waktu dan biaya. Aspek pedagogis bagian ini melatih kemampuan mahasiswa dalam merancang eksperimen pemuliaan, melakukan analisis data genetika populasi, dan memahami aplikasi teknologi molekuler dalam pemuliaan tanaman. Penggunaan metode silang balik juga memperkenalkan metode pemuliaan konvensional.
V. PENGUJIAN GALUR-GALUR BC2F3-PUP1 MENGGUNAKAN LARUTAN HARA YOSHIDA
Bagian ini membahas pengujian fenotipik galur-galur padi hasil seleksi menggunakan larutan hara Yoshida dengan variasi kadar P dan Al. Metodologi pengujian, meliputi persiapan larutan hara, penanaman, pengukuran parameter pertumbuhan, dan analisis data, dijelaskan secara rinci. Hasil pengujian, termasuk analisis sidik ragam dan korelasi antar parameter, disajikan dan diinterpretasi untuk menilai pengaruh Pup1 terhadap toleransi defisiensi P. Pembahasan menekankan pentingnya pendekatan kontrol lingkungan dalam pengujian fenotipik. Secara pedagogis, bagian ini mengajarkan mahasiswa tentang desain eksperimen, teknik pengukuran parameter pertumbuhan tanaman, dan analisis data statistik dalam penelitian pertanian. Penggunaan larutan hara juga memperkenalkan metode penelitian terkontrol untuk meminimalisir variabel yang mempengaruhi hasil.
VI. PENGUJIAN GALUR-GALUR BC2F3-PUP1 MENGGUNAKAN TANAH PODSOLIK MERAH KUNING
Bagian ini menjelaskan pengujian fenotipik galur-galur padi pada kondisi tanah Ultisol (Podsolik Merah Kuning) dengan perlakuan pemupukan P yang berbeda. Metodologi yang digunakan, termasuk analisis karakteristik tanah, penanaman, pengukuran parameter pertumbuhan, dan analisis data, diuraikan secara detail. Hasil pengujian, analisis sidik ragam, dan korelasi antar parameter, disajikan untuk menilai pengaruh Pup1 pada kondisi tanah yang lebih realistis. Pembahasan menekankan pentingnya menguji galur-galur di kondisi lingkungan yang beragam untuk validasi hasil. Dari sisi pedagogis, bagian ini melengkapi pemahaman mahasiswa tentang pentingnya mengevaluasi galur-galur unggul dalam kondisi lingkungan yang bervariasi. Penggunaan tanah Ultisol juga memberikan pemahaman tentang kondisi tanah khas Indonesia.
VII. PENGUJIAN GALUR-GALUR BC2F3-PUP1 DI LAPANGAN
Pengujian di lapangan ini dilakukan di KP Taman Bogo, Lampung, dengan perlakuan pemupukan P. Metodologi pengujian, meliputi persiapan lahan, penanaman, pengukuran parameter pertumbuhan dan hasil panen, dan analisis data, dijabarkan secara detail. Hasil pengujian, analisis sidik ragam, dan korelasi antar parameter, disajikan untuk mengevaluasi performa galur-galur dalam kondisi lingkungan lapangan yang kompleks. Pembahasan menekankan pentingnya pengujian di lapangan untuk validasi hasil penelitian dan penerapannya di kondisi pertanian sebenarnya. Secara pedagogis, bagian ini mengajarkan mahasiswa tentang skala dan kompleksitas penelitian lapangan, serta pentingnya mengintegrasikan hasil penelitian dengan kondisi pertanian di lapangan. Penting untuk memahami perbedaan antara kondisi terkontrol (laboratorium/rumah kaca) dan kondisi riil di lapang.
VIII. PEMBAHASAN UMUM
Bagian pembahasan umum ini mengintegrasikan hasil dari semua bab sebelumnya untuk memberikan gambaran komprehensif tentang efek introgresi gen Pup1 terhadap peningkatan toleransi padi terhadap defisiensi fosfor. Pembahasan meliputi sintesis temuan, diskusi mengenai implikasi hasil terhadap strategi pemuliaan padi, dan pertimbangan praktis dalam implementasi varietas toleran defisiensi P. Bagian ini juga membahas keterbatasan penelitian dan saran untuk penelitian selanjutnya. Secara pedagogis, bagian ini melatih mahasiswa untuk berpikir kritis, menginterpretasikan data yang kompleks, dan menyusun kesimpulan yang terstruktur dan berbasis bukti ilmiah. Kemampuan sintesis dan analisa data sangat terasah di bagian ini.
IX. SIMPULAN DAN SARAN
Bagian ini menyajikan kesimpulan ringkas dari seluruh penelitian, dengan penekanan pada kontribusi utama penelitian dan implikasinya bagi pengembangan varietas padi toleran defisiensi P di Indonesia. Saran untuk penelitian selanjutnya juga diberikan, yang dapat mencakup perluasan skala penelitian, uji coba di lokasi lain, dan eksplorasi mekanisme molekuler yang lebih detail. Secara pedagogis, bagian ini melatih kemampuan mahasiswa untuk merumuskan kesimpulan yang tepat berdasarkan data empiris dan memberikan saran yang relevan untuk pengembangan penelitian selanjutnya. Ini merupakan bagian penting untuk menunjukkan kemampuan mahasiswa dalam menjabarkan implikasi dari penelitian yang telah dilakukan.