JUMLAH TUNAS
TIARA DWI KURNIASARI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ii
ABSTRAK
TIARA DWI KURNIASARI. Perlakuan Cekaman
In Vitro
Terhadap Tunas
Aksiler
Mucuna bracteata
untuk Peningkatan Jumlah Tunas. Dibimbing oleh I
MADE ARTIKA dan TETTY CHAIDAMSARI.
iii
ABSTRACT
TIARA DWI KURNIASARI. In Vitro Stress Treatment On Axillary Shoots of
Mucuna bracteata
to Increase Shoot Number. Under the direction of I MADE
ARTIKA and TETTY CHAIDAMSARI.
iv
PERLAKUAN CEKAMAN
IN VITRO
TERHADAP TUNAS
AKSILER
Mucuna bracteata
UNTUK PENINGKATAN
JUMLAH TUNAS
TIARA DWI KURNIASARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
v
Judul Skripsi : Perlakuan Cekaman
In Vitro
Terhadap Tunas Aksiler
Mucuna
bracteata
untuk Peningkatan Jumlah Tunas
Nama
: Tiara Dwi Kurniasari
NIM
: G84070056
Disetujui
Komisi Pembimbing
Dr. Ir. I Made Artika, M.App.Sc
Dr. Tetty Chaidamsari, M. Si
Ketua
Anggota
Diketahui
Dr. Ir. I Made Artika, M.App.Sc
Ketua Departemen Biokimia
vi
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT yang telah
memberikan kemampuan kepada penulis untuk menyelesaikan skripsi yang
berjudul
“
Perlakuan Cekaman
In Vitro
Terhadap Tunas Aksiler
Mucuna bracteata
untuk Peningkatan Jumlah Tunas
”
. Penelitian ini dilaksanakan selama tiga bulan
mulai dari Maret sampai Juni 2011, bertempat di Laboratorium Kultur Jaringan,
Balai Penelitian Bioteknologi Perkebunan Indonesia, Bogor.
Penulis mengucapkan terima kasih kepada semua pihak yang telah
membantu dalam penyelesaian penelitian ini, antara lain kepada Dr. Ir. I Made
Artika, M.App.Sc selaku pembimbing utama dan Dr. Tetty Chaidamsari, M.Si
selaku pembimbing lapangan yang telah memberikan saran, kritik, dan
bimbingannya serta Mba Herti, Mba Aan, Mba Dini, Mba Nina serta segenap staf
di Laboratorium Biologi Molekuler dan Rekayasa Genetika, Balai Penelitian
Bioteknologi Perkebunan Indonesia atas peran dan kerjasamanya yang telah
banyak membantu dalam menyelesaikan penelitian ini.
Ucapan terima kasih juga penulis sampaikan kepada orang tua, kakak,
adik, dan Biokimia 44 untuk semua doa, dukungan, dan bimbingan yang sangat
berarti bagi penulis. Serta kepada kabinet BEM KM IPB BERSAHABAT,
penghuni Wisma Balio Atas dan teman-teman yang senantiasa memberikan
motivasi dan doa. Penulis berharap semoga karya ilmiah ini dapat memberikan
manfaat bagi semua orang yang memerlukannya.
Bogor, Januari 2012
vii
RIWAYAT HIDUP
Penulis dilahirkan di Bekasi pada tanggal 2 Januari 1989 dari ayah Yogo
Utomo dan ibu Sugiwiarti. Penulis merupakan anak kedua dari empat bersaudara.
Pendidikan penulis dimulai dari SD Bani Saleh 5 Bekasi, kemudian melanjutkan
pendidikan ke SMPN 1 Bekasi. Tahun 2007 penulis lulus dari SMAN 4 Bekasi
dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan
Seleksi Masuk IPB (USMI). Penulis memilih mayor departemen Biokimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan penulis aktif dalam kegiatan organisasi
kemahasiswaan, diantaranya penulis aktif sebagai sekretaris gedung Asrama Putri
TPB, sebagai sekretaris departemen Pengembangan Potensi Sumber Daya
Mahasiswa, Badan Eksekutif Mahasiswa Fakultas Mahasiswa dan Ilmu
Pengetahuan Alam (BEM FMIPA), kabinet Ksatria Pembaharu 2008/2009 dan
bendahara umum kabinet Totalitas Kebangkitan, BEM FMIPA 2009/2010. Pada
tahun 2010/2011, penulis aktif sebagai bendahara umum Badan Eksekutif
Mahasiswa Keluarga Mahasiswa IPB kabinet IPB Bersahabat. Penulis juga aktif
sebagai asisten Pendidikan Agama Islam, pengajar privat dan staf pengajar
bimbingan belajar Gama UI serta tim pendidik Lembaga Swadaya Masyarakat
Rubi Indonesia. Penulis termasuk salah satu penerima hibah Wirausaha Muda
Mandiri 2009/2010. Selain itu, penulis termasuk 10 terbaik Surat Untuk Rektor
pada tahun 2011. Penulis melakukan Praktik Lapang di PT Martina Berto sebagai
staf
Quality Control
dan melakukan penelitian di Balai Penelitian Bioteknologi
viii
DAFTAR ISI
Halaman
DAFTAR GAMBAR
... ix
DAFTAR TABEL
... ix
DAFTAR LAMPIRAN
... ix
PENDAHULUAN
... 1
TINJAUAN PUSTAKA
... 1
Mucuna bracteata
... 1
Kultur Jaringan
... 2
Media
... 3
BAHAN DAN METODE
... 5
Alat dan Bahan
... 5
Metode
... 5
Persiapan Media dan Kondisi Kultur
... 5
Penanaman eksplan
Mucuna bracteata
... 5
Penentuan Waktu Perlakuan Cekaman
... 5
Pemeliharaan
... 5
Pengamatan
... 5
HASIL DAN PEMBAHASAN
... 6
Penentuan Waktu Perlakuan Cekaman
... 6
Perlakuan Cekaman Media MS makro terhadap Tunas Aksiler
Mucuna bracteata
... 7
Perlakuan Cekaman Surosa, Vitamin, dan MS makro 0-25% terhadap Tunas Aksiler
Mucuna bracteata
... 8
Perlakuan Cekaman In Vitro Cahaya Terang dan Gelap Terhadap Tunas Aksiler
Mucuna bracteata
... 10
SIMPULAN DAN SARAN
... 11
Simpulan
... 11
Saran
... 11
DAFTAR PUSTAKA
... 11
ix
DAFTAR GAMBAR
Halaman
1 Daun
Mucuna bracteata
... ..2
2
Mucuna bracteata
di perkebunan kelapa sawit ... ..2
3 Peningkatan jumlah tunas aksiler pada berbagai perlakuan cekaman .... ..6
4 Peningkatan jumlah tunas pada perlakuan MS makro ... ..7
5 Struktur kinetin... ..8
6 Struktur Benzil Amino Purin ... ..8
7 Peningkatan jumlah tunas pada perlakuan sukrosa, vitamin, dan MS
makro... ..8
8 Morfologi eksplan
Mucuna bracteata
setelah mengalami cekaman. ... 10
9 Eksplan
Mucuna bracteata
pada perlakuan cekaman gelap ... 11
10 Peningkatan jumlah tunas pada perlakuan MS makro dengan perlakuan
cahaya ... 11
DAFTAR TABEL
Halaman
1 Unsur hara esensial untuk tumbuhan tingkat tinggi dan konsentrasi
yang berkecukupan... ..4
2 Media perlakuan ... ..5
3 Kode perlakuan pemeliharaan ... ..5
4 Komposisi media Murashige dan Skoog... 16
5 Komposisi media multiplikasi... 16
6 Data peningkatan jumlah tunas
Mucuna bracteta.
... 17
DAFTAR LAMPIRAN
Halaman
1 Diagram alir metode penelitian. ... 15
2 Komposisi media perlakuan. ... 16
gulma. Mucuna bracteata merupakan tanaman yang sangat efektif digunakan sebagai legume cover crop (LCC), yakni tanaman penutup tanah yang berfungsi menekan pertumbuhan gulma, sehingga biaya produksi untuk memberantas gulma dapat berkurang. Berdasarkan pengaruhnya terhadap kesuburan tanah ternyata M. bracteata memenuhi syarat sebagai penutup tanah yang ideal. Tanaman ini menghasilkan bahan organik yang tinggi dan akan sangat bermanfaat jika ditanam di daerah yang sering mengalami kekeringan dan pada areal yang rendah kandungan organik (Subronto dan Harahap 2002).
Tingkat kesuburan yang relatif tinggi dan kelembaban yang selalu terjaga diduga menjadi penyebab utama produktivitas tanaman di areal berpenutup tanah M. bracteata lebih tinggi dibandingkan pada areal berpenutup tanah kovensional. Serasah yang berasal dari biomassa penutup tanah M. bracteata yang jumlahnya sangat besar merupakan sumber hara penting bagi peningkatan kesuburan tanah (Sebayang et. al
2004).
Menurut Wilmot (2008) pemberian pupuk buatan atau organik, pergiliran tanaman dengan tanaman Leguiminosa dan menghindari pembakaran atau sisa-sisa tanaman adalah cara untuk menghindari dan memulihkan kerusakan tanah. Jenis tanaman ini merupakan tanaman polong-polongan dengan sistem perakaran yang mampu bersimbiosis dengan bakteri rhizobium dan membentuk bintil akar yang mempunyai kemampuan mengikat nitrogen dari udara (Purwanto 2007).
Mucuna salah satu tanaman polong-polongan yang memenuhi syarat sebagai penutup lahan karena tumbuh cepat sehingga bisa menutup tanah dalam jangka waktu singkat, memiliki perakaran yang lebar dan kokoh ke dalam, dan ditanam pada daerah kering Mucuna memiliki efisiensi tinggi terhadap air (Pahan 2008). Selain itu, M. bracteata dikenal sebagai tanaman yang sangat toleran dan dapat tumbuh dengan baik pada berbagai jenis tanah (Aulia 2011).
M. bracteata juga memiliki kelemahan, yakni bibitnya hanya ada di India, harganya relatif mahal dan pertumbuhannya hanya sekitar 50% dari semula. Sebaliknya, kebutuhan benih dan bibit M. bracteata terus meningkat karena semakin banyak orang yang
tersebut dipenuhi dengan melakukan perbanyakan tanaman dengan teknik kultur jaringan. Teknik kultur jaringan adalah teknik perbanyakan tanaman secara vegetatif menggunakan bagian tertentu dari tanaman dengan jumlah sangat kecil. Teknologi kultur jaringan telah terbukti dapat digunakan sebagai teknologi pilihan yang menjanjikan untuk pemenuhan kebutuhan bibit tanaman yang akan dieksploitasi secara luas (Benson 2000). Satu eksplan tanaman ini, dapat diperbanyak minimal berjumlah tiga kali lipat dari semula.
Pada subkultur ketiga dari media multiplikasi ke subkultur selanjutnya terjadi penurunan pertumbuhan tunas M. bracteata.
Hal ini sangat menghambat produktivitas kultur jaringan M. bracteata. Penelitian mengenai perlakuan cekaman in vitro
terhadap tunas aksiler M. bracteata untuk peningkatan jumlah tunas penting untuk dilakukan guna mendapat solusi dari permasalahan yang ada.
Penelitian ini bertujuan meningkatkan jumlah tunas M. bracteata dengan metode cekaman pada kultur induksi tunas. Hipotesis yang diajukan adalah perlakuan cekaman in vitro terhadap tunas M. bracteata dapat meningkatkan hasil kultur jaringan. Hasil penelitian ini diharapkan dapat memberikan informasi mengenai media dan perlakuan yang cocok untuk meningkatkan produktivitas
M. bracteata.
TINJAUAN PUSTAKA
Mucuna bracteata
Tanaman M. bracteata merupakan salah satu tanaman kacang-kacangan yang pertama kali ditemukan di areal hutan Negara bagian Tripura, India Utara, dan telah ditanam secara luas sebagai penutup tanah di Perkebunan Karet Kerala, India Selatan. Tanaman ini pertama kali ditanam sebagai tanaman pakan hijau (CSIR, 1962; Duke, 1981; Wilmot-Dear, 1984). M. bracteata memiliki daun trifoliat berwarna hijau gelap dengan ukuran 15 cm x 10 cm (Gambar 1). Helaian daun akan menutup apabila suhu lingkungan terlalu tinggi (termonasti), sehingga sangat efisien dalam mengurangi penguapan permukaan (Harahap et al. 2008).
(Preston 2003). Mucuna tidak dapat menghasilkan polong bila ditanam di dataran rendah, di tempat asalnya tanaman ini tumbuh pada ketinggian 5.000 kaki di atas permukaan laut. Sulur dengan nodus yang kontak langsung dengan tanah membentuk akar yang dapat menembus ke dalam tanah hingga 2-3 m, laju pertumbuhan akar cukup tinggi, sehingga pada umur di atas tiga tahun akar utamanya dapat mencapai kedalaman 3 m (Subronto dan Harahap 2002).
Tanaman M.bracteata (Gambar 2) mampu tumbuh dengan baik pada kondisi tanam dengan pH 5 sampai 8. Meskipun kondisi tanah miskin hara, tanaman ini mampu menghasilkan bahan organik dari sisa-sisa tanaman sebesar 1.75 ton/ha (Kaljeet 2011).
Keunggulan M. bracteata sebagai LCC, antara lain pertumbuhan yang cepat dan menghasilkan biomassa yang tinggi, mudah ditanam dengan input yang rendah, tidak disukai ternak karena kandungan fenol yang tinggi, toleran terhadap serangan hama dan penyakit, memiliki sifat allelopati sehingga memiliki daya kompetisi yang tinggi terhadap gulma, memiliki perakaran yang dalam, sehingga dapat memperbaiki sifat fisik tanah dan menghasilkan serasah yang tinggi sebagai humus yang terurai lambat. Kesuburan tanah berimbaskan dapat mengendalikan erosi, sebagai Leguminosae dapat menambat nitrogen bebas dari udara, relatif lebih tahan naungan dan cekaman kekeringan (Subronto dan Harahap 2002).
Gambar 1 DaunMucuna bracteata (PPKS 2011)
Gambar 2 Mucuna bracteata di perkebunan kelapa sawit (Vissoh 2005)
Tanaman ini menghasilkan bahan organik yang tinggi dan akan sangat bermanfaat jika ditanam di daerah yang sering mengalami kekeringan terutama pada areal yang rendah kandungan organiknya. Kandungan karbon, total fosfor, dan kalium tukar dalam tanah yang ditumbuhi M.
bracteata meningkat sangat tajam
dibandingkan dengan lahan yang ditumbuhi gulma (Subronto dan Harahap 2002).
Kultur Jaringan
Teknik kultur jaringan tanaman adalah metode atau teknik mengisolasi jaringan, organ sel, maupun proptoplas tanaman, menjadikan eksplan dan menumbuhkannya dalam media pertumbuhan yang aseptik sehingga eksplan tersebut dapat tumbuh dan berkembang, berorganogenesis, dan dapat menjadi tanaman sempurna (Matjik 2005). Kultur jaringan mengandung dua prinsip dasar yang jelas, yaitu bahan tanam yang bersifat totipotensi dan budidaya yang terkendali. Santoso (2003) menjelaskan bahwa teknik kultur jaringan berkembang dari totipotensi sel, sehingga akhirnya menjadi suatu teknik perbanyakan tanaman secara vegetatif yang banyak digunakan. Kultur jaringan in vitro
terbukti sangat efisien digunakan untuk pemeliharaan sumber genetik, bernilai ekonomi tinggi karena tidak memerlukan tempat yang luas. Kultur jaringan juga dapat mengurangi resiko kerusakan oleh hama, penyakit serta memudahkan pengawasan dan pengelolaan (Anderson 2000).
Metode perbanyakan tanaman secara in vitro menurut George dan Sherrington (1984) dapat dilakukan dengan dua cara, yakni multiplikasi tunas dari mata tunas aksilar dan pembentukan tunas-tunas adventif atau embrio somatik adventif, secara langsung pada eksplan atau secara tidak langsung melalui jaringan kalus.
Menurut Novita (2003). kultur jaringan dibagi menjadi beberapa macam, diantaranya a) kultur meristem yaitu budaya jaringan dengan menggunakan eksplan dari jaringan muda atau meristem; b)kultur haploid yaitu kultur yang berasal dari bagian reproduktif tanaman seperti pollen (serbuk sari) dan
Syarat awal untuk menerapkan metode kultur jaringan sebagai suatu cara perbanyakan pada suatu tanaman, yaitu 1) kecepatan organogenesis atau embriogenesis untuk pembentukan planlet tinggi; 2) planlet yang dihasilkan secara in vitro harus bertahan di lapang seperti yang diharapkan atau lebih baik; 3) penggunaan kultur jaringan dapat memberikan keuntungan lebih dibandingkan sistem perbanyakan secara konvensional, dan; 4) sifat-sifat yang diinginkan harus dipertahankan. Teori sel menyatakan bahwa sel tanaman mengandung informasi genetik dan organel-organel yang penting untuk beregenerasi menjadi tanaman utuh bila ditempatkan dan ditumbuhkan pada lingkungan yang cocok (Sa’adah 2009).
Lingkungan tumbuh merupakan salah satu faktor pendukung dalam kultur jaringan. Lingkungan tumbuh yang dibutuhkan tanam-an secara kultur in vitro dapat berbeda dengan tanaman yang ditumbuhkan secara in vivo. Faktor-faktor lingkungan yang mempengaruhi pertumbuhan dan perkembangan kultur secara
in vitro adalah cahaya, temperatur, kelembab-an, karbondioksida, dan oksigen (Wetherell 1982). Unsur cahaya yang harus diperhatikan adalah kualitas cahaya, panjang penyinaran, dan intensitas cahaya. Cahaya yang baik untuk pertumbuhan kultur adalah cahaya putih. Lampu fluorescent sangat baik dan sangat efisien dalam penggunaan energi bila dibandingkan dengan lampu pijar (Gunawan 1992). Suhu pada kultur jaringan biasanya dipertahankan konstan pada 24-260C. Kelembaban ruang kultur yang terlalu tinggi menyebabkan terjadinya pertumbuhan mikroba di luar kultur. Hal ini dapat menaikkan derajat kontaminasi (Wetherell 1982).
Selain faktor lingkungan, genotip tanaman asal eksplan diisolasi juga mempengaruhi keberhasilan kultur jaringan. Perbedaan respon genotip tanaman tersebut dapat diamati pada perbedaan eksplan masing-masing varietas untuk tumbuh dan beregenerasi. Masing-masing varietas tanam-an berbeda kemamputanam-annya dalam mertanam-ang- merang-sang pertumbuhan tunas aksilar, baik jumlah tunas maupun kecepatan pertumbuhan tunas aksilarnya. Hal serupa juga terjadi pada pembentukan kalus, laju pertumbuhan kalus serta regenerasi kalus menjadi tanaman lengkap baik melalui pembentukan organ-organ adventif maupun embrio somatik. Regenerasi dan perkembangan organ adventif dan embrio somatik juga sangat ditentukan oleh varietas tanaman induk. Perbedaan
pengaruh genetik ini disebabkan karena perbedaan kontrol genetik dari masing-masing varietas serta jenis kelamin tanaman induk. Menurut Nugroho (1996) semakin besar ukuran eksplan semakin tinggi kemampuan-nya untuk hidup dan semakin cepat tumbuh. Tetapi semakin besar pula kemungkinan terjadi kontaminasi. Eksplan yang digunakan umumnya berukuran panjang 5 mm-10 mm.
Media
Faktor penting yang menentukan keberhasilan kultur jaringan diantaraya adalah komposisi media tanam dan bentuk media (Sumardi 2011). Media tumbuh sangat penting untuk pertumbuhan dan produksi tanaman optimal, sehingga perlu adanya suatu usaha mencari media tumbuh yang sesuai. Harjadi (1989) menyatakan bahwa media tanam terdiri dari dua tipe yaitu campuran tanah (soil-mixes) yang mengandung tanah alami dan campuran tanpa tanah ( soilless-mixes) yang tidak mengandung tanah.
Bahan-bahan campuran media tanam harus memiliki peranan yang khusus di dalam campuran tersebut. Faktor yang harus dipertahankan dalam memilih media untuk dijadikan campuran antara lain kualitas dari bahan tersebut, tersedia di pasaran, murah, mudah cara penggunaannya, dapat digunakan untuk berbagai macam tanaman, tidak membawa hama dan penyakit, mempunyai drainase dan kelembaban yang baik, memiliki pH yang sesuai dengan jenis tanaman dan mengandung unsur hara untuk mendukung pertumbuhan tanaman (Acquah 2002).
Pada kultur jaringan terdapat beberapa macam media, yaitu media padat, semi padat, dan media cair. Media padat dan semi padat dibuat dengan menggunakan agar, sedangkan media cair dibuat tanpa penambahan agar. Pemilihan jenis media yang digunakan untuk kultur jaringan bergantung pada jenis tanaman yang digunakan, faktor aerasi, bentuk pertumbuhan dan diferensiasi yang diingin-kan.
diatas permukaan media sehingga tidak memerlukan alat bantu untuk aerasi, tunas dan akar tanaman tumbuh teratur (George dan Sherrington 1984). Kekurangan media padat adalah dapat mengakibatkan penghambatan pada pertumbuhan akar dan sulitnya penyerapan unsur hara dari dalam media oleh akar eksplan.
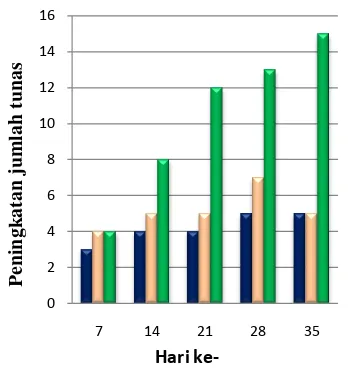
Komposisi media yang digunakan tergantung pada tanaman yang akan dikulturkan. Kebutuhan nutrisi kebanyakan tanaman secara umum adalah sama (Tabel 1). Media kultur jaringan pada prinsipnya harus menyediakan unsur-unsur hara untuk pertumbuhan seperti unsur-unsur hara yang terkandung di dalam tanah. Media kultur jaringan terdiri atas hara makro dan mikro, campuran garam-garam anorganik, karbon, vitamin, asam amino, zat pemadat (agar), gula, dan zat pengatur tumbuh (Santoso 2003).
Unsur makro yang sering digunakan adalah media Murashige dan Skoog (MS), karena banyak tanaman memberikan respon yang baik pada penggunaan media MS. Media MS tidak digunakan untuk beberapa spesies tanaman berkayu karena kandungan garamnya relatif tinggi.
Unsur-unsur mikro memilki fungsi penting dalam fungsi enzim sebagai ko-faktor (Collin dan Edwards 1998). Gula merupakan sumber energi dan karbon bagi tanaman. Jenis gula yang terbaik dalam kultur in vitro adalah sukrosa, karena translokasi sukrosa ke meristem apikal lebih efektif.
Vitamin adalah bahan organik bagian dari enzim yang esensial untuk metabolisme (Lieberman dan Bruning 1990). Vitamin diperlukan tanaman untuk pertumbuhan jaringan. Vitamin yang biasanya digunakan adalah vitamin B1 (thiamin), vitamin B6 (pyridoxine) dan niasin.Asam amino diperlukan dalam mensintesis protein dan diferensiasi dari jaringan.Asam amino yang diperlukan adalah asam aspartat, glisin, dan tirosin (Gunawan 1992).
Zat pengatur tumbuh merupakan senyawa organik bukan nutrisi yang aktif dalam konsentrasi rendah dan menimbulkan tanggap secara biokimia, fisiologis, dan morfologis (Watimena 1988). Zat pengatur tumbuh yang sering digunakan dalam kegiatan kultur jaringan adalah auksin, sitokinin, dan asam absisi (Gunawan 1992). Zat pengatur tumbuh yang biasa digunakan untuk peningkatan jumlah tunas adalah benzin amino purin (BAP).
Unsur Simbol Bentuk tersedia Konsentrasi (ppm) Berkecukupan (%)
Karbon C CO2 450.000 45
Hidrogen H H2O 450.000 45
Oksigen N O2, H2O 60.000 6
Nitrogen O NO3-, NH4+ 15.000 1,5
Kalium K K+ 10.000 1
Kalsium Ca Ca2+ 5.000 0,5
Magnesium Mg Mg2+ 2.000 0,2
Fosfor P H2PO4-, HPO42- 2.000 0,2
Belerang S SO4 1.000 0,1
Khlor Cl Cl- 100 0,01
Besi Fe Fe2+, Fe3+ 100 0,01
Mangan Mn Mn2+ 50 0,005
Boron B H3BO3 20 0,002
Seng Zn Zn2+ 20 0,002
Tembaga Cu Cu2+ 6 0,0006
Molibdenum Mo MoO42- 0,1 0,00001
Sumber :Lakitan 2011
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan selama penelitian meliputi gelas piala, gelas ukur, mesin autoklaf, pH meter, botol kecil, labu erlenmeyer, timbangan analitik, mikropipet, tip, aluminium foil, korek api, laminar flow,
cawan petri, bunsen, tisu steril, pinset, pisau steril, dan plastik wrap.
Bahan-bahan yang digunakan selama penelitian adalah eksplan sub kultur kedua, alkohol, dan spiritus. Aquades steril, gula pasir, KOH 1 N, HCl 1 N, agar, garam- garam makro dan mikro, vitamin, benzil amino purin (BAP), dan stok larutan MS cair digunakan sebagai bahan pembuatan media.
Metode
Persiapan Media dan Kondisi Kultur
Persiapan media dilakukan dengan sterilisasi alat dan bahan terlebih dahulu. Sterilisasi alat dan bahan dilakukan dengan menggunakan mesin autoklaf selama 15 menit pada suhu 1210C dan tekanan 1 atm. Sterilisasi laminar dilakukan dengan menggunakan sinar UV dan alkohol 70%. Terdapat lima jenis media yang berbeda komposisinya (Tabel 2). Selanjutnya pH media ditepatkan dengan menggunakan larutan HCl 1 N dan KOH 1 N hingga mencapai nilai pH 5.7-5.8. Kemudian kedalamnya ditambahkan aquades steril untuk mencapai volume media yang diinginkan. Media selanjutnya ditambahkan dengan agar sebanyak 2 gram/L. Setelah itu, media diautoklaf pada suhu 1210C dan tekanan 1 atm selama 15 menit lalu dituang ke dalam botol steril di ruang laminar.
Tabel 2 Media perlakuan
Kode Unsur Media Perlakuan (mL/L)
A MS- Makro 50- 75%
B MS- Makro 25- 50% C MS- Makro 1- 25% D Sukrosa 50- 75%
E Vitamin 50- 75%
Penanaman eksplan Mucuna bracteata Eksplan yang dipilih adalah eksplan yang telah berumur kurang lebih lima sampai enam bulan dan secara fisiologis dapat disubkultur kembali dan tidak berpotensi untuk didewasakan. Eksplan M. bracteata
tersebut segera ditanam ke media perlakuan
A, B, C, D, atau E. Setelah itu, botol ditutup kembali dengan kertas wrap. Penanaman pada medium dilakukan di laminar flow cabinet
secara aseptik. Semua alat-alat yang digunakan dalam proses penanaman harus dalam keadaan steril.
Penentuan Waktu Perlakuan Cekaman
Cekaman dilakukan dengan tiga perlakuan, yakni di media cekaman selama 7 hari, 10 hari, dan 14 hari. Selain perlakuan terhadap jangka waktu, cekaman dilakukan dengan dua kondisi, yakni terang dan gelap. Dari tiga perlakuan jangka waktu cekaman, kemudian dipilih perlakuan yang hasil peningkatan eksplannya paling optimal. Optimalisasi jumlah tunas ditentukan dengan membandingkan selisih jumlah tunas diawal kulturdan di akhir subkultur.
Pemeliharaan
Botol-botol yang telah berisi eksplan dan telah ditutup kembali dengan kertas wrap
diletakkan pada rak kultur di ruang kultur. Suhu ruangan di ruang kultur berkisar antara 25-280C dilengkapi dengan air conditioner
(AC). Setelah empat belas hari, eksplan dipindahkan kembali ke media multiplikasi dan diamati perubahannya setiap hari. Setiap 20 hari eksplan disubkultur kembali ke media multiplikasi. Masing-masing botol eksplan diberi kode, dapat dilihat pada Tabel 3.
Tabel 3 Kode perlakuan pemeliharaan
Perlakuan Kode Keterangan perlakuan
MS- Makro A Kondisi A terang 50-75% Ag Kondisi A gelap MS- Makro B Kondisi B terang 25-50% Bg Kondisi B gelap MS- Makro C Kondisi C terang 0-25% Cg Kondisi C gelap Sukrosa D Kondisi D terang 50-75% Dg Kondisi D gelap Vitamin E Kondisi E terang 50-75% Eg Kondisi E gelap Tidak ada N Kontol
Pengamatan
HASIL DAN PEMBAHASAN
Penentuan Waktu Perlakuan Cekaman
Kultur jaringan M. bracteata diawali dari biji yang ditanam dalam media pasir selama 14 hari. Setelah itu, pucuk daun sebagai eksplan dipindahkan dalam media induksi tunas selama 60 hari. Kemudian eksplan yang telah bertambah tunasnya disubkultur pada media multiplikasi hingga eksplan siap untuk disubkultur dalam media pendewasaan selama satu bulan. Selanjutnya dipindahkan ke media perakaran selama 9 hari. Setelah itu, eksplan siap diaklimatisasi.
Eksplan di media multiplikasi mengalami peningkatan jumlah tunas. Pada kurun waktu satu bulan, disubkultur pertama dan kedua rata-rata peningkatan jumlah tunas sebanyak empat buah. Namun, pada subkultur ketiga tidak terjadi peningkatan jumlah tunas.
Pada penelitian ini, sebelumnya dilaku-kan perlakuan cekaman untuk menentudilaku-kan waktu yang tepat membuat eksplan stres. Perlakuan jangka waktu cekaman, yakni di media cekaman selama 7 hari, 10 hari, dan 14 hari. Selain perlakuan terhadap jangka waktu, cekaman juga dilakukan dengan dua kondisi cahaya, yakni terang dan gelap. Saat keadaan tercekam eksplan menunjukkan tanda-tanda kekurangan unsur hara, eksplan menanggapi kurangnya pasokan unsur esensial dengan menunujukkan gejala yang khas. Gejala yang terlihat meliputi terhambatnya pertumbuhan akar, batang atau daun. Gejala kekurangan
suatu unsur esensial bergantung pada dua faktor, yakni fungsi unsur tersebut dan kemudahan unsur tersebut berpindah dari daun tua ke daun yang lebih muda (Salisbury dan Ross 1995). Eksplan pada kondisi gelap tumbuh menyerupai kecambah. Hal ini dikarenakan tanaman kekurangan cahaya untuk mengaktifkan zat hijau daun. Selain itu, tanaman dengan perlakuan cekaman dikondisi gelap akan mengaktifkan hormon auksin endogennya, sehingga akan terjadi peman-jangan sel yang cukup tinggi (Joyce 2003).
Pertumbuhan dan morfogenesis tanaman secara in vitro dikendalikan oleh keseimbang-an hormon ykeseimbang-ang ada dalam eksplkeseimbang-an. Hormon dalam eksplan bergantung pada hormon endogen dan hormon eksogen yang diserap dari media tumbuh (Wattimena1992). Penambahan hormon eksogen akan berpeng-aruh terhadap jumlah dan kerja hormon endogen untuk mendorong pertumbuhan dan perkembangan eksplan (Gunawan 1998). Hormon eksogen diberikan dalam bentuk BAP (Ardiana 2009).
Hasil pada Gambar 3 menunjukkan bahwa perlakuan cekaman media selama 7 hari dan 10 hari, eksplan tidak mengalami peningkatan jumlah tunas yang banyak, tapi yang terjadi adalah beberapa eksplan mati setelah perlakuan cekaman. Hal ini menandakan bahwa cekaman selama 7 hari dan 10 hari dengan perlakuan cahaya terang dan gelap menyebabkan stres yang negatif bagi eksplan.
Gambar 3 Peningkatan jumlah tunas aksiler pada perlakuan cekaman selama 7 hari ( ), 10 hari ( ), dan 14 hari ( )
-4 -2 0 2 4 6 8 10 12
A Ag B Bg C Cg D Dg E Eg N
P
e
n
in
gk
at
an
j
u
m
la
h
t
u
n
as
Berbeda dengan perlakuan cekaman media selama 14 hari, eksplan mengalami gejala kekurangan unsur hara. Namun, setelah melewati masa stres eksplan mengalami peningkatan jumlah tunas yang banyak. Hal ini menunjukkan bahwa cekaman selama 14 hari merupakan waktu yang optimal untuk eksplan memacu hormon pertumbuhannya.
Hormon sitokinin merupakan salah satu hormon pertumbuhan pada kultur jaringan tanaman. Fungsi hormon ini antara lain untuk proses pembelahan sel dan pada beberapa tanaman, sitokinin dibutuhkan untuk prolife-rasi kalus (Wattimena1992). BAP dengan konsentrasi yang tepat dibutuhkan dalam perpanjangan tunas pada kultur jaringan (Ardiana 2009).
Perlakuan CekamanMedia MS makro terhadap Tunas Aksiler Mucuna bracteata
Tumbuhan adalah organisme autotrofik, mensintesa sendiri senyawa organik yang diperlukan untuk tumbuh dari senyawa anorganik. Untuk dapat melakukan kehidup-an autotrofik ini, tumbuhkehidup-an dilengkapi dengkehidup-an sistem penyerapan unsur hara dan sistem biosintesis yang bertugas untuk mengubah senyawa anorganik yang diserap menjadi senyawa organik (Adipura 2009).
Pada tumbuhan tingkat tinggi, sistem penyerapan unsur hara biasanya berupa suatu organ yang dikenal sebagai akar dan sistem pemanenan energi sinar matahari untuk mensintesa senyawa organik karbohidrat dikenal dengan daun. Pada beberapa spesies, sistem ini mengalami adaptasi struktur yang disesuaikan dengan lingkungan hidupnya (Altman 2003).
Perlakuan cekaman merupakan perlakuan mengurangi jumlah unsur-unsur esensial yang terdapat pada media kultur jaringan. Perlakuan cekaman dilakukan selama 14 hari. Unsur-unsur esensial yang dibutuhkan tanaman dalam jumlah relatif besar diistilahkan sebagai unsur-unsur makro (Zulkarnain 2009). Terdapat dua kriteria utama untuk menentukan keesensialan suatu unsur bagi tanaman. Pertama, suatu unsur disebut esensial jika tanaman tidak mampu menyempurnakan daur hidupnya tanpa unsur tersebut. Kedua, suatu unsur adalah esensial bila unsur tersebut menjadi bagian dari molekul atau kandungan tumbuhan yang esensial bagi tanaman itu (Salisbury dan Ross 1995). Sehingga tanaman tidak dapat melakukan proses-proses biokimiawi untuk menunjang daur hidupnya. Unsur-unsur makro karbon, hidrogen, dan oksigen tersedia
bagi tanaman melalui air dan udara. Sementara itu, kebutuhan akan unsur-unsur makro yang lain seperti nitrogen, fosfor, kalium, kalsium, magnesium, dan belerang dipenenuhi melalui media tumbuh.
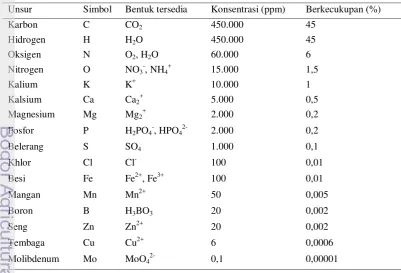
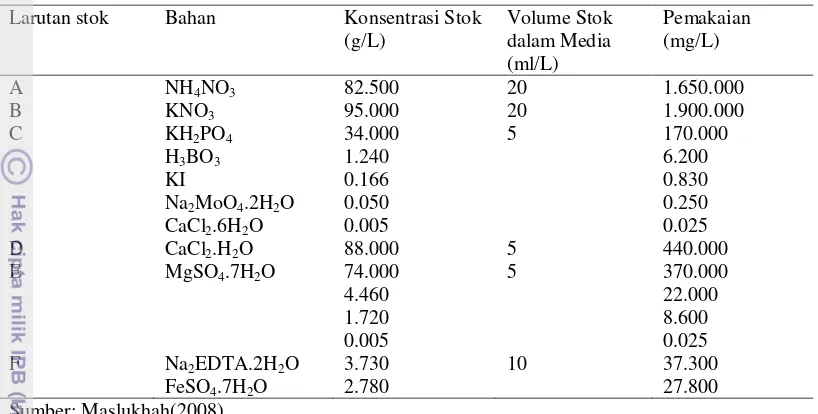
Dari hasil pengamatan (Gambar 4), perlakuan MS makro 50-75% (A), 25-50% (B), dan 0-25% (C) menunjukkan bahwa perlakuan MS makro 0-25% (C) peningkatan jumlah tunasnya paling banyak daripada perlakuan cekaman A dan B hingga hari ke-35.
Pada perlakuan cekaman A, hampir setiap minggu peningkatan jumlah tunas terus meningkat walaupun tidak terlalu banyak. Berbeda dengan perlakuan cekaman B, peningkatan jumlah tunas terjadi hingga minggu keempat. Setelah itu, tanaman mengalami kerontokkan dalam jumlah yang cukup banyak. Hal ini sesuai dengan pernyataan Salisbury dan Ross (1995) bahwa pertumbuhan tanaman yang kekurangan nitrogen akan lambat. Ditandai dengan daun menguning dan mengering, lalu rontok. Dapat pula diartikan cekaman optimum terjadi dengan perlakuan C. Pada perlakuan A dan B, komposisi media cekaman belum optimum untuk mengkondisikan eksplan stres.
Eksplan selama di media cekaman telah beradaptasi dengan kondisi miskin unsur nitrogen. Ketika dipindahkan ke media yang kaya nutrisi maka penyerapan nutrisinya akan terjadi secara sempurna. Masing-masing unsur hara berfungsi secara optimum.
Gambar 4 Peningkatan jumlah tunas pada perlakuan MS makro 50-75% (A terang ( ), 25-50% (B terang ( )),,dan 0-25% (C terang ( )) 0 2 4 6 8 10 12 14 16
7 14 21 28 35
ke-Pada kultur in vitro, nitrogen diberikan dalam jumlah terbesar dalam bentuk senyawa NH4NO3 dan KNO3. Senyawa NH4NO3 dan
KNO3 terdapat di larutan stok media MS
makro. Nitrogen dalam tanaman berfungsi untuk memacu pertumbuhan tanaman secara umum, terutama pada fase vegetatif, berperan dalam pembentukan klorofil, lemak, enzim, dan persenyawaan lain, merupakan bagian dari sel ( organ ) tanaman itu sendiri, sintesis asam amino dan protein dalam tanaman, morfogenesis (pertumbuhan akar dan tunas), pertumbuhan dan pembentukan embrio zigotik.
Nitrogen dalam tanaman dibutuhkan dalam bentuk nitrat (NO3
-). Nitrat sering diserap terlalu cepat sehingga menyebabkan pH larutan hara naik dengan cepat pula. Hal ini dikarenakan penyerapan nitrat disertai dengan penyerapan H+ atau pengeluaran OH -untuk mempertahankan kesetimbangan muatan. Oleh karena itu, pemberian nitrogen dalam bentuk garam amonium agar masalah pH dapat diperkecil. Mekanismenya adalah penyerapan NH4+ dan kation lain terjadi bersamaan dengan penyerapan OH- atau perpindahan H+ dari akar ke larutan sekitarnya (Chandler 1983).
Selain nitrogen, hormon sitokinin sangat mempengaruhi peningkatan jumlah tunas. Sitokinin adalah kelompok senyawa organik yang menyebabkan pembelahan sel yang dikenal dengan proses sitokinesis (Armini et al. 1992). Menurut Arteca (1996), sitokinin di substitusi komponen-komponen adenin yang meningkatkan pembelahan sel dan fungsi pertumbuhan lainnya yang prosesnya sama seperti kinetin (N6 furfuril adenin), suatu turunan dari basa adenin (Gambar 5) (Wattimena 1998).
Sitokinin merupakan zat penumbuh tumbuhan yang mendorong pembelahan (sitokinesis). Beberapa macam sitokinin merupakan sitokinin alami, yakni kinetin dan zeatin. Sitokinin alami dihasilkan pada jaringan yang tumbuh aktif terutama pada akar, embrio, dan buah. Sitokinin yang diproduksi di akar selanjutnya diangkut oleh xilem menuju sel-sel target pada batang.
BAP merupakan sitokinin sintetik turunan adenin yang disubtitusi pada posisi 6 yang strukturnya serupa dengan kinetin (Wattimena 1998). Sitokinin ini sangat aktif dalam mendorong pertumbuhan jumlah tunas M. bracteata. Bentuk isomer 1-benzil adenin mempunyai aktivitas kimia yang rendah. Untuk dapat aktif harus dirubah menjadi 6-benzil adenin (Gambar 6).
Gambar 5 Struktur kinetin
Gambar 6 Struktur Benzil Amino Purin (Benzil adenin)
Perlakuan Cekaman Surosa, Vitamin, dan MS makro 0-25% terhadap Tunas Aksiler
Mucuna bracteata
Komponen medium kultur jaringan, tidak hanya berupa unsur hara saja, tapi juga perlu adanya sukrosa sebagai sumber karbon dan energi. Sukrosa adalah disakarida dari gluko-sa dan fruktogluko-sa. Dalam tanaman, sukrogluko-sa merupakan produk fotosintesis antara yang paling utama. Sukrosa merupakan bentuk utama dalam transport gula dari daun ke bagian-bagian lain tanaman melalui sistem vaskular. Keuntungan sukrosa dibandingkan glukosa sebagai bentuk transport gula karena atom karbon anomernya berada dalam keadaan terikat, jadi melindungi sukrosa dari serangan oksidatif atau hidrolitik oleh enzim-enzim tanaman sampai molekul ini mencapai tujuan akhirnya di dalam tanaman (Lehninger 1982).
kultur jaringan kurang sempurna dan mengganggu kerja metabolisme eksplan.
Menurut Iraqi dan Tremblay (2001), sukrosa pada media berperan dalam induksi maupun pendewasaan embrio somatik. Hal ini dikarenakan, pertama, sukrosa dihidrolisis enzim invertase dan sukrosa-sintase menjadi heksosa yaitu glukosa dan fruktosa yang bisa langsung dimanfaatkan tumbuhan. Kedua hasil hidrolisis sukrosa meningkatkan konsentrasi osmotik media. Ketiga, sukrosa berperan sebagai sinyal bagi sintesis protein penyimpan. Oleh karena itu, saat di media cekaman pada tanaman terdapat kekeringan pada daun-daunnya disebabkan terhambat oleh potensi osmotik yang berkurang di medium.
Suatu respon fisiologi yang cukup penting ialah kemampuan tanaman memperta-hankan tekanan turgor dengan menurunkan potensial osmotik sebagai mekanisme toleransi terhadap kondisi cekaman (Hamim et al. 1996). Banyak proses fisiologi dan biokimia dalam tumbuhan yang sangat dipengaruhi oleh perubahan tekanan turgor (Watanabe 2000). Menurut Haledan Orcutt (1987) faktor yang dapat membantu mempertahankan turgor ialah penurunan potensial osmotik dan kemampuan mengakumulasi senyawa-senyawa terlarut.
Dalam proses penyesuaian osmosis, senyawa-senyawa terlarut yang biasa diakumulasi ialah gula dan asam amino (Girousse et al. 1996). Hal ini menunjukkan bahwa jumlah gula dan asam amino berpengaruh terhadap pertumbuhan tanaman (Sopandi et al. 1996).
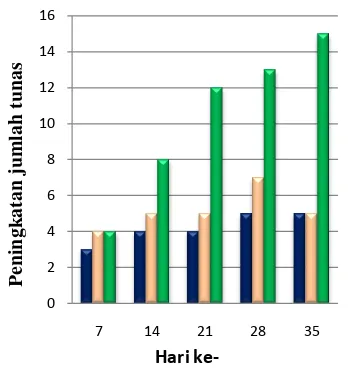
Komponen penyusun media kultur jaringan meliputi garam-garam anorganik, zat pengatur tumbuh, vitamin, asam-asam amino dan amida, sukrosa, agar, dan air. Salah satu perlakuan dalam penelitian ini adalah pemberian vitamin 50-75% ke dalam media selama 14 hari. Dapat dilihat pada gambar 5, peningkatan jumlah tunas setelah hari ke-21 terjadi penurunan setiap minggunya hingga hari ke-28. Setelah itu, peningkatan jumlah tunas terjadi walau tidak terlalu banyak jumlahnya.
Vitamin memiliki fungsi katalitik pada sistem enzim dan dibutuhkan dalam jumlah kecil. Pada saat eksplan di media cekaman vitamin, eksplan tidak dalam kondisi tercekam karena ia mampu memproduksi vitaminnya. Hal ini, selaras dengan penelitian Dravnicks (1969) bahwa kultur salah satu tanaman model, yakni tembakau mampu memproduksi sendiri vitaminnya. Hal ini menandakan
bahwa cekaman dengan perlakuan vitamin 50-75% tidak optimum untuk membuat eksplan stres dan memacu hormon pertumbuhannya.
Berbeda dengan perlakuan MS makro 0-25% (C) yang menghasilkan cekaman optimum. Jumlah MS makro dibutuhkan paling banyak daripada komposisi media yang lainnya. Hal ini dikarenakan kandungan utama MS makro adalah nitrogen yang merupakan unsur hara esensial dalam tanaman sehingga ketika kondisi kekurangan MS makro tanaman mengalami stres. Kondisi stres selama perlakuan yang memacu hormon pertumbuhan tanaman untuk memperbanyak tunasnya.
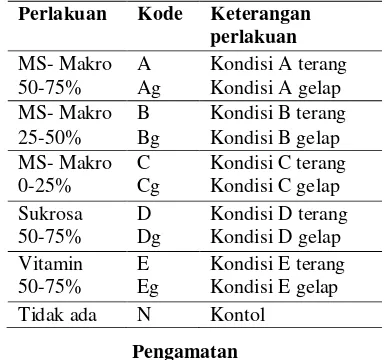
Peningkatan jumlah tunas terjadi secara linear setiap minggunya dan cukup banyak jumlahnya dibandingkan dengan perlakuan cekaman yang lain, sehingga pada hari ke-35 tanaman dapat disubkultur kembali hingga 4-5 botol steril kultur jaringan. Selain disubkultur kembali, tanaman yang mengalami cekaman dengan perlakuan C, cukup baik dan relatif lebih cepat untuk didewasakan di media pendewasaan. Dapat dilihat secara berturut-turut perkembangannya pada Gambar 8. Pada Gambar 8a, keadaan M. bracteata sudah memilik tunas, namun tidak sebanyak pada hari ke-14 (Gambar 8b). Keadaan batang pada hari ke-14 juga lebih kokoh daripada ketika awal subkultur. Setelah hari ke-21 (Gambar 8c) daun-daun pada eksplan mulai membuka sebagian. setelah hari ke-42, daun pada eksplan telah membuka secara keseluruhan (Gambar 8d). Hal ini menandakan eksplan sudah siap untuk dipindahkan ke media pendewasaan. Setelah di media pendewasaan selam 14 hari (Gambar 8e), maka eksplan dipindahkan ke media perakaran (Gambar 8f).
Gambar 7 Peningkatan jumlah tunas pada media MS makro 0-25% (C terang ( )), sukrosa 50-75 (D terang ( )), dan vitamin 50-75% (E terang ( ))
0 2 4 6 8 10 12 14 16
7 14 21 28 35
ke-(a) (b) (c)
(d) (e) (f)
Gambar 8 Morfologi eksplan Mucuna bracteata setelah mengalami cekaman; (a) awal subkultur; (b) eksplan pada hari ke-14; (c) eksplan pada hari ke 21; (d) eksplan pada hari ke 42, siap untuk pendewasaan; (e) eksplan dimedia pendewasaan; (f) planlet Mucuna
bracteata yang telah berakar mmmmmmmmmmmmmmmmmmmmmmmmmmmmmm
Konsentrasi perlakuan cekaman media C merupakan konsentrasi yang paling ideal. Eksplan yang telah beradaptasi pada media yang miskin hara, lalu dipindahkan ke media yang kaya akan unsur haranya, maka penyerapan seluruh nutrisinya akan terserap sempurna dan semua aspek yang menunjang pertumbuhan eksplan seperti hormon tumbuh (auksin dan sitokinin) dapat berperan secara optimal (Sumardi 2011).
Selain media dan kurun waktu cekaman, seleksi eksplan juga menentukan keberhasilan penelitian. Terdapat tiga aspek utama dalam seleksi eksplan, yaitu genotip, umur, dan kondisi fisiologis bahan tersebut (Pierik 1997). Keadaan lingkungan kultur, seperti cahaya, suplai air, suplai hara, dan zat pengatur tumbuh dapat dimodifikasi untuk mengontrol kondisi fisiologis eksplan.
Perlakuan Cekaman In Vitro Cahaya Terang dan Gelap Terhadap Tunas Aksiler
Mucuna bracteata
Perlakuan cekaman terhadap cahaya juga dilakukan, yakni cahaya terang dan gelap.
Pada dasarnya, peranan cahaya tidak terlalu penting pada fotosintesis in vitro
dibandingkan dengan fotosintesis in vivo. Hal ini dikarenakan, laju fotosintesis kebanyakan bahan tanaman yang dikulturkan secara in vitro lebih rendah karena kultur tersebut sangat bergantung pada suplai sukrosa dari media. Cahaya pada kultur jaringan berpengaruh terhadap fotomorfogenesis bukan fotosintesis. Proses fotomorfogenesis dibantu oleh kerja hormon auksin endogen.
Pada Gambar 9, dapat dilihat bahwa perlakuan cekaman dengan cahaya gelap akan menghasilkan pertumbuhan yang ditandai dengan terjadinya pemanjangan sel (batang), tetapi tidak terjadi perbanyakan tunas sehingga eksplan yang ditanam hanya terlihat bertambah tinggi seperti kecambah. Hal ini dikarenakan auksin endogen lebih berpengaruh daripada hormon eksogen yang diberikan. Selain itu, eksplan memiliki batang berwarna putih karena kekurangan cahaya untuk mengaktifkan zat hijau daun.
peningkatan jumlah tunas karena pertumbuhan in vitro jaringan tanaman yang telah terorganisasi membutuhkan cahaya untuk mendapatkan hasil yang optimal dalam melakukan fotomorfogenesis.
Menurut Gunawan (1992), level zat pengatur tumbuh endogen merupakan salah satu faktor yang mendorong proses pertumbuhan dan morfogenesis. Pada kondisi gelap, hormon auksin endogen akan terpacu untuk melakukan pembelahan sel. Auksin yang terkandung dalam eksplan berperan memacu pertumbuhan batang eksplan, sintesis nukleotida DNA dan RNA serta sintesis protein dan enzim yang selanjutnya digunakan dalam proses pertumbuhan dan perkembangan pada eksplan.
Auksin dapat mempengaruhi pertumbuh-an jaringpertumbuh-an melalui dua cara. Pertama, auksin menginduksi ion H+ keluar sel melalui dinding sel. Pengasaman dinding sel menyebabkan K+ diambil, dan pengambilan ini mengurangi potensial air dalam sel. Akibatnya air masuk ke dalam sel dan sel membesar. Kedua yaitu dengan mempenga-ruhi metabolisme RNA yang berarti metabo-lisme protein, diduga melalui transkripsi molekul RNA, dan akhirnya menyebabkan terjadinya pengaturan senyawa-senyawa yang dapat mempengaruhi pertumbuhan sel tanaman (Gunawan 1992).
Auksin merupakan senyawa kimia yang memiliki fungsi utama mendorong peman-jangan kuncup yang sedang berkembang. Beberapa auksin dihasikan secara alami oleh tumbuhan, misalnya IAA (asam indolasetat), PAA (asam fenilasetat), 4-chloroIAA (asam 4-kloroidol asetat) dan IBA (asam indolebutrik). Auksin sintetik, misalnya NAA (asam naftalen astetat), 2,4 D (2,4 asam diklorofenoksiasetat) dan MCPA (asam 2-metil-4klorofenoksiasetat).
Gambar 9 Eksplan Mucuna bracteata pada perlakuan cekaman gelap
Gambar 10 Peningkatan jumlah tunas pada perlakuan MS makro dengan cahayaterang ( ) dan cahaya gelap ( )
SIMPULAN DAN SARAN
Simpulan
Perlakuan cekaman terhadap eksplan M. bracteata ternyata mampu meningkatkan jumlah tunas eksplan. Perlakuan yang paling efektif adalah dengan perlakuan MS makro 0-25% dalam kondisi terang selama 14 hari.
Saran
Penelitian lebih lanjut mengenai cekaman kedua setelah perlakuan cekaman pertama mengalami penurunan kembali jumlah tunas. Selain itu, perlu dicari pula alternarif lain untuk meningkatkan jumlah tunas, yakni dengan cara embriosomatik untuk diarahkan ke kalus.
DAFTAR PUSTAKA
Acquaah G. 2002. Horticulture: Principles
and Practies. 2nd. Ed. New
Jersey:Pearson Education..
Adipura IGK. 2009. Aklimatisasi bibit anggrek pada awal pertumbuhannya diluar kultur jaringan. [terhubung berkala] http://distan.riau.go.id. [11 Desember 2011].
Anderson. 2000. Effect of level and duration supplementary light on development of chrysanthemum. J Hort 61: 148-155.
Altman A. 2003. From plant tissue culture to biotechnology: scientific revolutions,
0 2 4 6 8 10 12 14 16
7 14 21 28 35
P
eni
ngk
at
an
Jum
lah
tun
as
ke-abiotic stress tolerance, and forestry. J Dev. Biol.—Plant 39:75–84.
Ardiana DW. 2009. Teknik pemberian benzil amino purin untuk memacu perumbuhan kalus dan tunas pada kotiledon melon (Cucumis meloL.). J Buletin Teknik Pertanian.14: 50-53.
Armini NM, GA. Wattimena, LW Gunawan. 1992. Perbanyakan Tanaman: Bioteknologi Tanaman. Dirjen Pendidikan Tinggi, Pusat Antar Universitas Bioteknologi. Bogor: IPB.
Arteca RN. 1996. Plant Growth Substances: Principles and Application. Chapman and Hall. New York: International Thomson Publishing.
Benson EE. 2000. In vitro plant recalcitrance: an introduction. J Dev. Biol.—Plant
36:141–148.
Chandler SF, Doods JH. 1983. The effect of phosphate, nitrogen and sucrose on the production of phenolics and solasodine in callus cultures of Solanum laciniatum. J Plant Cell Reports 2:205-208.
[CSIR] Council of Scientific and Industrial Research.1962. The wealth of India: a dictionary of Indian raw materials and industrial product. New Delhi: CSIR.
Duke JF. 1981. Handbook of Legumes of World Economic Importance. New York: Plenum Pr.
George EF, Sherrington PD. 1984. Plant Propagation by Tissue Culture: Handbook and Directory of Commercial Laboratories. London: Exegetics Limited.
Girousse C, Bournoville R, Bonnemain JL. 1996. Water defisit-induced changes in concentrations in proline and some other amino acids in the phloem sap of alfalfa.
J Plant Physiol 111:109-113.
Gunawan LW. 1992. Teknik Kultur Jaringan
Tumbuhan. Depdikbud. Dirjen
Pendidikan Tinggi, Pusat Antar Universitas Bioteknologi. Bogor: IPB.
Hale MG, Orcutt DM. 1987. The Physiology of Plants Under Stress. New York: J Willey Sons.
Hamim, Sopandie D, Jusuf M. 1996. Beberapa karakteristik morfologi dan fisiologi kedelai toleran dan peka terhadap cekaman kekeringan. J Hayati
1:30-34.
Harahap IY et al. 2008. Mucuna bracteata Pengembangan dan Pemanfaatannya di Perkebunan Kelapa Sawit. Medan: Pusat Penelitian Kelapa Sawit.
Harjadi SS. 1989. Dasar- Dasar Hortikul-tura. Bogor: Institut Pertanian Bogor.
Hilda A. 2011. Laju penutupan tanah oleh pertumbuhan Mucuna bracteata DC. dan Centrosema pubescens benih pada ex-borrow pit jabung timur, Jambi. [skripsi] Institut Pertanian Bogor.
Joyce SM, Cassels AC, Jain SM. 2003. Stress and aberrant phenotypes in vitro culture.
J Plant Cell 74: 103–121.
Kaljeet S, Keyeo F, Amir HG. 2011. Influence of carrier and materials and storage temperature on survivabilty of rhizobial inoculant. J Asian Journal of Plant Sciences 10: 331-337.
LakitanB. 2011. Dasar-Dasar Fisiologi Tumbuhan. Jakarta: PT. Raja Drafindo Persada.
Lehninger A. 1994. Dasar-dasar Biokimia Jilid 2. Jakarta: Erlangga.
Lieberman S, Bruning N. 1990. The Real Vitamin & Mineral Book. New York: Avery Group.
Maslukhah U. Ekstrak pisang sebagai suplemen media MS dalam media kultur tunas pisang raja bulu (Musa paradisiacal L. AAB group) in vitro
[skripsi]. Bogor: Institut Pertanian Bogor.
Novita L. 2003. Pengenalan dasar-dasar kultur jaringan tanaman [makalah]. Tangerang: Balai pengkajian dan Penerapan Teknologi.
Nugroho K. 1996. Studi multiplikasi tunas aksilar macadamia integrifolia melalui metode kultur jaringan [skripsi]. Bogor: Institut Pertanian Bogor.
Pahan I. 2008.Panduan Lengkap Kelapa Sawit: Manajemen Agribisnis dari Hulu hingga Hilir. Jakarta: Penebar Swadaya.
[PPKS] Pusat Perkebunan Kelapa Sawit. 2011. Mucuna bracteata sebagai tanaman pengendali gulma: perbanyak-kannya dengan stek dan biji di Indonesia. [terhubung berkala]. http://www.iopri.org [20 Desember 2011].
Preston S. 2003. Overview of cover crops and green manures. [terhubung berkala]. http://www.plant-trees.org [14 Desem-ber 2011].
Purwanto I. 2007.Mengenal Lebih Dekat Leguminoseae. Yogyakarta: Kanisius.
Sa’adah N. 2009. Transformasi gen kitinase ke dalam kalus kelapa sawit (Elaeis guineensis Jacq) melalui Agrobacterium tumefaciens [skripsi]. Bogor: Institut Pertanian Bogor.
Salisbury FB, Ross CW. 1995.Fisiologi Tumbuhan Jilid I; Diah RL, Sumaryono, penerjemah. Bandung: ITB. Terjemahan dari: Plant Phsyology, Ed. 1.
Santoso U, Fatimah N. 2003. Kultur Jaringan Tanaman. Malang: UMM Pr.
Sebayang SY, Sutarta ES, Harahap IY. 2004. Penggunaan Mucuna bracteata pada kelapa sawit: pengalaman di Kebun Tinjowan Sawit II, PT. Perkebunan Nusantara IV. J Warta PPKS 12: 15-22.
Sopandie D, Hamim, Jusuf M, Heryani N. 1996. Toleransi tanaman kedelai
terhadap cekaman air: akumulasi prolina dan asam absisik dan hubungannya dengan potensial osmotik daun dan penyesuaian osmotik. J Bul Agron 24:9-14.
Subronto, Harahap IY. 2002. Penggunaan kacangan penutup tanah Mucuna bracteata pada pertanaman kelapa sawit.
J Warta PPKS 10:1-6.
Sumardi D. 2011.Pengaruh konsentrasi media Murashige dan Skoog (MS) terhadap pertumbuhan planlet ubi jalar varietas nirkum pada dua bentuk media secara in
vitro. [terhubung berkala].
http://www.tarmdgs.org. [11 Desember 2011].
Vissoh P et al. 2005. Experiences with M. bracteata in West Africa. Africa: International Development Research Centre.
Watanabe S et al. 2000. Effects of saline and osmotic stress on proline and sugar accumulation in Populus euphraticain vitro. J Plant Cell 63: 199–206.
Wattimena GA et al. 1992. Bioteknologi Tanaman. Pusat Antar Universitas Bioteknologi. Bogor: Institut Pertanian Bogor.
.
Wetherell DF. 1982. Pengantar Propagasi Tanaman Secara In Vitro. Semarang: IKIP Semarang Pr.
Wilmot D. 1984. A revision of M. bracteata
(Leguminose-Phaseoleae) in China and Japan. J Kew Bulletin. 39: 23-65.
Wilmot D. 2008. Mucuna Adans. (Legu-minosae) in Thailand. J Thai For Bull
36: 114–139.
Yusnita. 2003. Kiat Mengatasi Permasalahan Praktis Kultur Jaringan. Jakarta: Agromedia Pustaka.
Zulkarnain. 2009. Kultur Jaringan Tanaman
Lampiran I Diagram alir metode penelitian
Pemilihan tanaman yang dapat dikultur
Pembuatan media perlakuan Sterilisasi bahan dan alat
Subkultur eksplan ke media perlakuan
Pemeliharaan eksplan dalam ruang subkultur
Subkultur eksplan ke media multiplikasi
Pengamatan Pengamatan kultur
Lampiran 2 Komposisi media perlakuan
Tabel 3 Komposisi Murashige dan Skoog.
Larutan stok Bahan Konsentrasi Stok (g/L)
Volume Stok dalam Media (ml/L)
Pemakaian (mg/L)
A NH4NO3 82.500 20 1.650.000
B KNO3 95.000 20 1.900.000
C KH2PO4
H3BO3
KI
Na2MoO4.2H2O
CaCl2.6H2O
34.000 1.240 0.166 0.050 0.005
5 170.000
6.200 0.830 0.250 0.025
D CaCl2.H2O 88.000 5 440.000
E MgSO4.7H2O 74.000
4.460 1.720 0.005
5 370.000
22.000 8.600 0.025 F Na2EDTA.2H2O
FeSO4.7H2O
3.730 2.780
10 37.300
27.800 Sumber: Maslukhah(2008)
Tabel 4 Komposisi media multiplikasi.
Larutan Stok Jumlah/L
MS A 20 ml
MS B 20 ml
MS C 5 ml
MS D 5 ml
MS E 5 ml
MS F 10 ml
Vitamin 10 ml
BAP 0.5 ml
Agar 2 g
Lampiran 3 Data peningkatan jumlah tunas Mucuna bracteta
No perlakuan No Botol Tunas di awal media
cekaman
Jumlah tunas di media multiplikasi setelah di media cekaman 14 hari
Tunas awal (hari ke-0)
hari ke- 17
Hari ke- 24
Hari ke-31
Hari ke-38
1 A1 32.2.2.1 3 3 4 4 5 5
2 A2 27.1.1.1 4 4 4 5 4 5
3 A3 100.1.1.1 6 6 7 8 8 8
4 A4 27.4.2.1 4 4 5 5 7 7
5 A5 48.2.2.1 3 3 4 4 5 7
6 A6 26.1.1.1 9 9 10 10 10 10
7 A7 15.1.1.1 8 9 9 10 10 10
8 A8 125.1.1.1 4 4 4 5 6 8
9 A9 40.1.1.1 5 5 7 8 9 9
10 A10 1.2.1.2 3 3 5 6 6 8
11 B1 1.3.1.4 2 2 3 3 4 4
12 B2 41.1.1.2 4 5 5 5 5 5
13 B3 27.5.2.1 6 6 6 7 9 9
14 B4 101.1.2.1 8 8 8 9 9 10
15 B5 12.3.1.2 3 3 3 4 4 5
16 B6 22.3.1.3 5 5 5 6 6 6
17 B7 125.1.1.2 3 3 5 6 9 9
18 B8 16.1.1.1 2 2 2 3 5 5
19 B9 15.2.1.1 3 4 4 4 4 5
20 B10 47.1.1.4 4 4 4 4 5 5
21 C1 85.2.1.1 6 8 13 15 18 18
22 C2 27.4.1.1 2 2 3 3 5 7
23 C3 10.3.1.1 4 5 8 12 13 15
24 C4 47.1.1.3 3 3 4 5 8 8
25 C5 95.1.1.2 7 7 7 9 13 13
26 C6 27.5.1.1 6 6 9 9 9 9
27 C7 27.4.1.1 5 9 9 9 9 10
28 C8 19.2.2.2 5 6 6 7 7 7
29 C9 13.2.1.1 5 6 6 7 7 8
30 C10 27.4.1.2 3 4 10 10 10 10
31 D1 1.3.1.3 7 7 7 7 7 10
32 D2 27.4.2.1 4 4 5 6 6 7
33 D3 85.2.1.2 2 2 4 4 5 5
34 D4 16.2.1.2 3 2 5 5 5 5
35 D5 27.4.1.1 3 3 6 9 9 9
36 D6 12.1.2.1 1 1 2 2 3 4
37 D7 40.1.1.1 2 2 2 3 3 4
Lanjutan Lampiran 3 Data peningkatan jumlah tunas Mucuna bracteta
No Perlakuan No Botol Tunas di awal media
cekaman
Jumlah tunas di media multiplikasi setelah di media cekaman 14 hari
Tunas awal (hari ke-0)
hari ke- 17
Hari ke- 24
Hari ke-31
Hari ke-38
39 D9 53.1.2.2 5 5 5 5 6 6
40 D10 27.4.1.1 5 6 9 9 10 10
41 E1 106.1.1.1 5 5 5 5 6 6
42 E2 96.1.1.2 4 4 4 4 6 6
43 E3 19.2.2.4 6 6 6 6 6 6
44 E4 25.1.1.2 3 3 3 3 3 3
45 E5 15.2.1.2 5 5 5 5 5 5
46 E6 31.2.1.1 7 8 8 9 11 11
47 E7 21.2.1.1 7 7 7 7 8 8
48 E8 16.1.1.3 4 4 4 4 4 4
49 E9 19.2.1.1 4 5 5 5 5 5
TIARA DWI KURNIASARI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ii
ABSTRAK
TIARA DWI KURNIASARI. Perlakuan Cekaman
In Vitro
Terhadap Tunas
Aksiler
Mucuna bracteata
untuk Peningkatan Jumlah Tunas. Dibimbing oleh I
MADE ARTIKA dan TETTY CHAIDAMSARI.
iii
ABSTRACT
TIARA DWI KURNIASARI. In Vitro Stress Treatment On Axillary Shoots of
Mucuna bracteata
to Increase Shoot Number. Under the direction of I MADE
ARTIKA and TETTY CHAIDAMSARI.
HASIL DAN PEMBAHASAN
Penentuan Waktu Perlakuan Cekaman
Kultur jaringan M. bracteata diawali dari biji yang ditanam dalam media pasir selama 14 hari. Setelah itu, pucuk daun sebagai eksplan dipindahkan dalam media induksi tunas selama 60 hari. Kemudian eksplan yang telah bertambah tunasnya disubkultur pada media multiplikasi hingga eksplan siap untuk disubkultur dalam media pendewasaan selama satu bulan. Selanjutnya dipindahkan ke media perakaran selama 9 hari. Setelah itu, eksplan siap diaklimatisasi.
Eksplan di media multiplikasi mengalami peningkatan jumlah tunas. Pada kurun waktu satu bulan, disubkultur pertama dan kedua rata-rata peningkatan jumlah tunas sebanyak empat buah. Namun, pada subkultur ketiga tidak terjadi peningkatan jumlah tunas.
Pada penelitian ini, sebelumnya dilaku-kan perlakuan cekaman untuk menentudilaku-kan waktu yang tepat membuat eksplan stres. Perlakuan jangka waktu cekaman, yakni di media cekaman selama 7 hari, 10 hari, dan 14 hari. Selain perlakuan terhadap jangka waktu, cekaman juga dilakukan dengan dua kondisi cahaya, yakni terang dan gelap. Saat keadaan tercekam eksplan menunjukkan tanda-tanda kekurangan unsur hara, eksplan menanggapi kurangnya pasokan unsur esensial dengan menunujukkan gejala yang khas. Gejala yang terlihat meliputi terhambatnya pertumbuhan akar, batang atau daun. Gejala kekurangan
suatu unsur esensial bergantung pada dua faktor, yakni fungsi unsur tersebut dan kemudahan unsur tersebut berpindah dari daun tua ke daun yang lebih muda (Salisbury dan Ross 1995). Eksplan pada kondisi gelap tumbuh menyerupai kecambah. Hal ini dikarenakan tanaman kekurangan cahaya untuk mengaktifkan zat hijau daun. Selain itu, tanaman dengan perlakuan cekaman dikondisi gelap akan mengaktifkan hormon auksin endogennya, sehingga akan terjadi peman-jangan sel yang cukup tinggi (Joyce 2003).
Pertumbuhan dan morfogenesis tanaman secara in vitro dikendalikan oleh keseimbang-an hormon ykeseimbang-ang ada dalam eksplkeseimbang-an. Hormon dalam eksplan bergantung pada hormon endogen dan hormon eksogen yang diserap dari media tumbuh (Wattimena1992). Penambahan hormon eksogen akan berpeng-aruh terhadap jumlah dan kerja hormon endogen untuk mendorong pertumbuhan dan perkembangan eksplan (Gunawan 1998). Hormon eksogen diberikan dalam bentuk BAP (Ardiana 2009).
Hasil pada Gambar 3 menunjukkan bahwa perlakuan cekaman media selama 7 hari dan 10 hari, eksplan tidak mengalami peningkatan jumlah tunas yang banyak, tapi yang terjadi adalah beberapa eksplan mati setelah perlakuan cekaman. Hal ini menandakan bahwa cekaman selama 7 hari dan 10 hari dengan perlakuan cahaya terang dan gelap menyebabkan stres yang negatif bagi eksplan.
Gambar 3 Peningkatan jumlah tunas aksiler pada perlakuan cekaman selama 7 hari ( ), 10 hari ( ), dan 14 hari ( )
-4 -2 0 2 4 6 8 10 12
A Ag B Bg C Cg D Dg E Eg N
P
e
n
in
gk
at
an
j
u
m
la
h
t
u
n
as
Berbeda dengan perlakuan cekaman media selama 14 hari, eksplan mengalami gejala kekurangan unsur hara. Namun, setelah melewati masa stres eksplan mengalami peningkatan jumlah tunas yang banyak. Hal ini menunjukkan bahwa cekaman selama 14 hari merupakan waktu yang optimal untuk eksplan memacu hormon pertumbuhannya.
Hormon sitokinin merupakan salah satu hormon pertumbuhan pada kultur jaringan tanaman. Fungsi hormon ini antara lain untuk proses pembelahan sel dan pada beberapa tanaman, sitokinin dibutuhkan untuk prolife-rasi kalus (Wattimena1992). BAP dengan konsentrasi yang tepat dibutuhkan dalam perpanjangan tunas pada kultur jaringan (Ardiana 2009).
Perlakuan CekamanMedia MS makro terhadap Tunas Aksiler Mucuna bracteata
Tumbuhan adalah organisme autotrofik, mensintesa sendiri senyawa organik yang diperlukan untuk tumbuh dari senyawa anorganik. Untuk dapat melakukan kehidup-an autotrofik ini, tumbuhkehidup-an dilengkapi dengkehidup-an sistem penyerapan unsur hara dan sistem biosintesis yang bertugas untuk mengubah senyawa anorganik yang diserap menjadi senyawa organik (Adipura 2009).
Pada tumbuhan tingkat tinggi, sistem penyerapan unsur hara biasanya berupa suatu organ yang dikenal sebagai akar dan sistem pemanenan energi sinar matahari untuk mensintesa senyawa organik karbohidrat dikenal dengan daun. Pada beberapa spesies, sistem ini mengalami adaptasi struktur yang disesuaikan dengan lingkungan hidupnya (Altman 2003).
Perlakuan cekaman merupakan perlakuan mengurangi jumlah unsur-unsur esensial yang terdapat pada media kultur jaringan. Perlakuan cekaman dilakukan selama 14 hari. Unsur-unsur esensial yang dibutuhkan tanaman dalam jumlah relatif besar diistilahkan sebagai unsur-unsur makro (Zulkarnain 2009). Terdapat dua kriteria utama untuk menentukan keesensialan suatu unsur bagi tanaman. Pertama, suatu unsur disebut esensial jika tanaman tidak mampu menyempurnakan daur hidupnya tanpa unsur tersebut. Kedua, suatu unsur adalah esensial bila unsur tersebut menjadi bagian dari molekul atau kandungan tumbuhan yang esensial bagi tanaman itu (Salisbury dan Ross 1995). Sehingga tanaman tidak dapat melakukan proses-proses biokimiawi untuk menunjang daur hidupnya. Unsur-unsur makro karbon, hidrogen, dan oksigen tersedia
bagi tanaman melalui air dan udara. Sementara itu, kebutuhan akan unsur-unsur makro yang lain seperti nitrogen, fosfor, kalium, kalsium, magnesium, dan belerang dipenenuhi melalui media tumbuh.
Dari hasil pengamatan (Gambar 4), perlakuan MS makro 50-75% (A), 25-50% (B), dan 0-25% (C) menunjukkan bahwa perlakuan MS makro 0-25% (C) peningkatan jumlah tunasnya paling banyak daripada perlakuan cekaman A dan B hingga hari ke-35.
Pada perlakuan cekaman A, hampir setiap minggu peningkatan jumlah tunas terus meningkat walaupun tidak terlalu banyak. Berbeda dengan perlakuan cekaman B, peningkatan jumlah tunas terjadi hingga minggu keempat. Setelah itu, tanaman mengalami kerontokkan dalam jumlah yang cukup banyak. Hal ini sesuai dengan pernyataan Salisbury dan Ross (1995) bahwa pertumbuhan tanaman yang kekurangan nitrogen akan lambat. Ditandai dengan daun menguning dan mengering, lalu rontok. Dapat pula diartikan cekaman optimum terjadi dengan perlakuan C. Pada perlakuan A dan B, komposisi media cekaman belum optimum untuk mengkondisikan eksplan stres.
Eksplan selama di media cekaman telah beradaptasi dengan kondisi miskin unsur nitrogen. Ketika dipindahkan ke media yang kaya nutrisi maka penyerapan nutrisinya akan terjadi secara sempurna. Masing-masing unsur hara berfungsi secara optimum.
Gambar 4 Peningkatan jumlah tunas pada perlakuan MS makro 50-75% (A terang ( ), 25-50% (B terang ( )),,dan 0-25% (C terang ( )) 0 2 4 6 8 10 12 14 16
7 14 21 28 35
[image:32.595.327.501.495.681.2]ke-Pada kultur in vitro, nitrogen diberikan dalam jumlah terbesar dalam bentuk senyawa NH4NO3 dan KNO3. Senyawa NH4NO3 dan
KNO3 terdapat di larutan stok media MS
makro. Nitrogen dalam tanaman berfungsi untuk memacu pertumbuhan tanaman secara umum, terutama pada fase vegetatif, berperan dalam pembentukan klorofil, lemak, enzim, dan persenyawaan lain, merupakan bagian dari sel ( organ ) tanaman itu sendiri, sintesis asam amino dan protein dalam tanaman, morfogenesis (pertumbuhan akar dan tunas), pertumbuhan dan pembentukan embrio zigotik.
Nitrogen dalam tanaman dibutuhkan dalam bentuk nitrat (NO3
-). Nitrat sering diserap terlalu cepat sehingga menyebabkan pH larutan hara naik dengan cepat pula. Hal ini dikarenakan penyerapan nitrat disertai dengan penyerapan H+ atau pengeluaran OH -untuk mempertahankan kesetimbangan muatan. Oleh karena itu, pemberian nitrogen dalam bentuk garam amonium agar masalah pH dapat diperkecil. Mekanismenya adalah penyerapan NH4+ dan kation lain terjadi bersamaan dengan penyerapan OH- atau perpindahan H+ dari akar ke larutan sekitarnya (Chandler 1983).
Selain nitrogen, hormon sitokinin sangat mempengaruhi peningkatan jumlah tunas. Sitokinin adalah kelompok senyawa organik yang menyebabkan pembelahan sel yang dikenal dengan proses sitokinesis (Armini et al. 1992). Menurut Arteca (1996), sitokinin di substitusi komponen-komponen adenin yang meningkatkan pembelahan sel dan fungsi pertumbuhan lainnya yang prosesnya sama seperti kinetin (N6 furfuril adenin), suatu turunan dari basa adenin (Gambar 5) (Wattimena 1998).
Sitokinin merupakan zat penumbuh tumbuhan yang mendorong pembelahan (sitokinesis). Beberapa macam sitokinin merupakan sitokinin alami, yakni kinetin dan zeatin. Sitokinin alami dihasilkan pada jaringan yang tumbuh aktif terutama pada akar, embrio, dan buah. Sitokinin yang diproduksi di akar selanjutnya diangkut oleh xilem menuju sel-sel target pada batang.
BAP merupakan sitokinin sintetik turunan adenin yang disubtitusi pada posisi 6 yang strukturnya serupa dengan kinetin (Wattimena 1998). Sitokinin ini sangat aktif dalam mendorong pertumbuhan jumlah tunas M. bracteata. Bentuk isomer 1-benzil adenin mempunyai aktivitas kimia yang rendah. Untuk dapat aktif harus dirubah menjadi 6-benzil adenin (Gambar 6).
Gambar 5 Struktur kinetin
Gambar 6 Struktur Benzil Amino Purin (Benzil adenin)
Perlakuan Cekaman Surosa, Vitamin, dan MS makro 0-25% terhadap Tunas Aksiler
Mucuna bracteata
Komponen medium kultur jaringan, tidak hanya berupa unsur hara saja, tapi juga perlu adanya sukrosa sebagai sumber karbon dan energi. Sukrosa adalah disakarida dari gluko-sa dan fruktogluko-sa. Dalam tanaman, sukrogluko-sa merupakan produk fotosintesis antara yang paling utama. Sukrosa merupakan bentuk utama dalam transport gula dari daun ke bagian-bagian lain tanaman melalui sistem vaskular. Keuntungan sukrosa dibandingkan glukosa sebagai bentuk transport gula karena atom karbon anomernya berada dalam keadaan terikat, jadi melindungi sukrosa dari serangan oksidatif atau hidrolitik oleh enzim-enzim tanaman sampai molekul ini mencapai tujuan akhirnya di dalam tanaman (Lehninger 1982).
kultur jaringan kurang sempurna dan mengganggu kerja metabolisme eksplan.
Menurut Iraqi dan Tremblay (2001), sukrosa pada media berperan dalam induksi maupun pendewasaan embrio somatik. Hal ini dikarenakan, pertama, sukrosa dihidrolisis enzim invertase dan sukrosa-sintase menjadi heksosa yaitu glukosa dan fruktosa yang bisa langsung dimanfaatkan tumbuhan. Kedua hasil hidrolisis sukrosa meningkatkan konsentrasi osmotik media. Ketiga, sukrosa berperan sebagai sinyal bagi sintesis protein penyimpan. Oleh karena itu, saat di media cekaman pada tanaman terdapat kekeringan pada daun-daunnya disebabkan terhambat oleh potensi osmotik yang berkurang di medium.
Suatu respon fisiologi yang cukup penting ialah kemampuan tanaman memperta-hankan tekanan turgor dengan menurunkan potensial osmotik sebagai mekanisme toleransi terhadap kondisi cekaman (Hamim et al. 1996). Banyak proses fisiologi dan biokimia dalam tumbuhan yang sangat dipengaruhi oleh perubahan tekanan turgor (Watanabe 2000). Menurut Haledan Orcutt (1987) faktor yang dapat membantu mempertahankan turgor ialah penurunan potensial osmotik dan kemampuan mengakumulasi senyawa-senyawa terlarut.
Dalam proses penyesuaian osmosis, senyawa-senyawa terlarut yang biasa diakumulasi ialah gula dan asam amino (Girousse et al. 1996). Hal ini menunjukkan bahwa jumlah gula dan asam amino berpengaruh terhadap