SABRI SUDIRMAN
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
SABRI SUDIRMAN. Aktivitas Antioksidan dan Komponen Bioaktif Kangkung Air (Ipomoea aquatica Forsk.). Dibimbing oleh NURJANAH dan ASADATUN ABDULLAH.
Kangkung air (Ipomoea aquatica Forsk.) merupakan tanaman air yang banyak tersebar di wilayah Asia Tenggara, India dan Cina bagian Tenggara. Kangkung air telah dimanfaatkan sebagai obat-obatan di kalangan masyarakat. Tanaman ini menarik untuk diteliti komponen bioaktif dan aktivitas antioksidan alami yang terkandung di dalamnya. Kangkung air diduga memiliki senyawa fitokimia atau komponen bioaktif dan antioksidan alami yang berguna bagi tubuh. Antioksidan alami memiliki potensi yang besar untuk dikembangkan, mengingat antioksidan sintetik yang juga berguna dalam meredam radikal bebas dikhawatirkan memberi efek samping berbahaya bagi kesehatan manusia.
Tujuan dari penelitian ini adalah menentukan rendemen, kandungan gizi (lemak, protein, abu dan karbohidrat), komponen bioaktif dan aktivitas antioksidan yang terkandung dalam kangkung air. Pada penelitian ini dilakukan (1) pengambilan dan preparasi bahan baku, (2) karakterisasi bahan baku, (3) ekstraksi komponen bioaktif dan (4) pengujian aktivitas antioksidan.
Karakteristik kangkung air (Ipomoea aquatica) yang berasal dari Desa Carang Pulang, meliputi rendemen daun, tangkai daun dan batang segar masing-masing sebesar 34,34%; 19,07% dan 46,59%. Rendemen dalam kondisi kering memiliki penurunan, yaitu rendemen daun, tangkai daun dan batang masing-masing sebesar 10,31%; 9,91% dan 6,46%. Kangkung air segar memiliki kadar air (90,00%), kadar abu (1,09%), protein kasar (2,35%), lemak (0,55%), karbohidrat (6,02%), abu tidak larut asam (0,10%), dan serat kasar (1,04%). Kangkung air memiliki komponen kimia yang banyak dibutuhkan oleh tubuh.
SABRI SUDIRMAN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
NRP : C34070079 Departemen : Teknologi Hasil Perairan
Menyetujui,
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP. 1961 0410 1986 01 1 002
Tanggal Lulus: 17 Februari 2011 Pembimbing I
Dr. Ir. Nurjanah, MS. NIP. 1959 1013 1986 01 2 002
Pembimbing II
Dengan ini saya menyatakan bahwa skripsi dengan judul ”Aktivitas
Antioksidan dan Komponen Bioaktif Kangkung Air (Ipomoea aquatica Forsk.)” adalah karya saya sendiri dan belum diajukan dalam
bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Februari 2011
Sabri Sudirman
Penulis dilahirkan di Kabupaten Bone, Provinsi Sulawesi Selatan pada tanggal 4 Juni 1988 sebagai anak kedua dari empat bersaudara pasangan Sudirman Beda dan Masniati.
Penulis memulai jenjang pendidikan formal di SDS Perguruan ”Cikini” Kiani, Mangkajang, Kabupaten Berau (sampai tahun 2001), selanjutnya penulis melanjutkan
pendidikan di SLTPS Perguruan ”Cikini” Kiani, Mangkajang, Kabupaten Berau (tahun 2001-2004). Pendidikan menengah atas ditempuh penulis di SMA PLUS BERAU dan lulus pada tahun 2007. Pada tahun yang sama,
penulis diterima sebagai mahasiswa di Institut Pertanian Bogor melalui Jalur Beasiswa Utusan Daerah (BUD).
Selama masa perkuliahan, penulis aktif dalam berbagai organisasi kemahasiswaan, seperti Pasukan Pengibar Bendera di Institut Pertanian Bogor tahun 2007-2008, Dewan Perwakilan Mahasiswa Tingkat Persiapan Bersama (Staff Komisi Sosial Politik) dan Majelis Permusyawaatan Mahasiswa
(Koordinator Pengembangan Mutu dan Hubungan Kelembagaan) tahun 2007-2008, Badan Eksekutif Mahasiswa Fakultas Perikanan dan Ilmu Kelautan (Staff Departemen Sosial dan Lingkungan) tahun 2008-2009, Badan Eksekutif Mahasiswa Fakultas Perikanan dan Ilmu Kelautan (Kepala
Departemen Sosial Lingkungan dan Kemahasiswan) tahun 2009-2010. Penulis juga aktif sebagai asisten praktikum m.k. Ekologi Perairan tahun 2009-2010.
Penulis juga aktif dalam kepanitiaan di beberapa kegiatan mahasiswa di Institut Pertanian Bogor.
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas
berkat, rahmat, hidayah dan bimbingan-Nya, sehingga penulis dapat menyelesaikan penyusunan skripsi ini dengan baik.
Skripsi ini disusun sebagai salah satu syarat untuk mendapatkan Gelar Sarjana di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Skripsi hasil penelitian ini berjudul “Aktivitas Antioksidan dan Komponen Bioaktif
Kangkung Air (Ipomoea aquatica Forsk.)”.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu penulis menyelesaikan penyusunan skripsi ini, terutama kepada:
1. Dr. Ir. Nurjanah, MS dan Asadatun Abdullah, S.Pi, M.Si selaku dosen
pembimbing, atas segala bimbingan, pengarahan dan masukan yang telah diberikan kepada penulis.
2. Dra Pipih Suptijah, M.BA sebagai dosen penguji pada sidang skripsi.
3. Dr. Ir. Ruddy Suwandi, MS, M.Phil selaku Ketua Departemen Teknologi Hasil Perairan.
4. Dr. Ir. Agoes Mardiono Jacoeb Dipl.Biol selaku Ketua Komisi Pendidikan Departemen Teknologi Hasil Perairan.
5. Dosen dan Bagian Administrasi Departemen Teknologi Hasil Perairan yang telah membantu kelancaran penyelesaian skripsi ini.
6. Keluarga terutama Bapak dan Ibu yang telah memberikan semangat dan
pesan serta do’a yang dapat membantu penulis dalam penyelesaian skripsi ini. 7. Bu Emma dan Mba Lastri yang telah banyak membantu penulis selama
melakukan penelitian di laboratorium.
8. Kak Ignasius Sunutri Susanto, Kak Laili Izzati, Kak Aulia Azka, Kak
Fauziyah Naryuningtyas dan Kak Zehra Khalisi yang telah membantu dalam pelakasanaan penelitian ini.
9. Adikku yang kubanggakan (Ernayanti dan Nur Fila Sari) yang telah memberikan semangat dan do’a sehingga penulis dapat meyelesaikan skripsi ini dengan baik.
v
penulisan skripsi ini.
Penulis menyadari bahwa masih banyak kekurangan dalam penulisan skripsi ini. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun dari berbagai pihak dalam proses penyempurnaan skripsi ini. Semoga tulisan ini
bermanfaat bagi pihak-pihak yang memerlukannya.
Bogor, Februari 2011
Halaman
2.4.1 Fungsi antioksidan ………. 11
2.4.2 Sumber antioksidan ………. 13
2.4.3 Mekanisme kerja antioksidan ………. 14
2.5Ekstraksi Senyawa Aktif ………. 15
2.6Uji Aktivitas Antioksidan ………... 16
3 METODOLOGI ……….. 18
3.1Waktu dan Tempat ……….. 18
3.2Bahan dan Alat ……… 18
3.3Metode Penelitian ……… 19
3.3.1 Pengambilan dan preparasi bahan baku ……….. 19
3.3.2 Analisis proksimat ………... 20
3.3.3 Analisis antioksidan ………. 23
viii
4.1.1 Rendemen ………. 30
4.1.2 Kandungan gizi ……….… 32
4.2Ekstrak Komponen Bioaktif Kangkung Air ……….... 36
4.2.1 Ekstrak kasar ……… 40
4.2.2 Komponen bioaktif pada ekstrak kasar ……… 42
4.3Aktivitas Antioksidan ……….. 47
5 KESIMPULAN DAN SARAN ……… 52
5.1Kesimpulan ……….. 52
5.2Saran ………. 52
DAFTAR PUSTAKA ………. 53
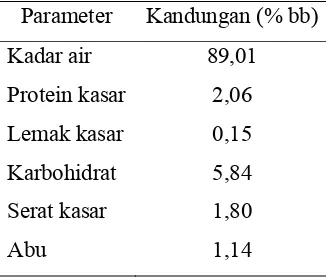
Nomor Halaman 1 Komposisi kimia kangkung (Farida et al. 2004) ..……….…… 4
Nomor Halaman 1 Kangkung air (Ipomoea aquatica Forsk.) (Vymazalet al. 2008) .… 3
2 Sketsa bentuk molekul asam amino (Winarno 2008) …….…..…... 11
3 Reaksi umum oksidasi asam lemak (Siagian 2002) ………..…….. 12
4 Struktur DPPH: (a) DPPH dalam bentuk radikal, (b) DPPH bentuk tereduksi (Molyneux 2004) ……….….…. 16
5 Struktur kimia butyl hidroksi toluene (BHT) (Herawati dan Akhlus 2006) ……….…... 17
6 Diagram alir proses ekstraksi kangkung air (Ipomoea aquatica) (Khusniya 2004) ………..………..….…. 25
7 Kangkung air (Ipomoea aquatica) segar yang telah dipisahkan daun, tangkai daun dan batang ………...…. 29
8 Diagram batang rendemen kangkung air ………..….…. 30
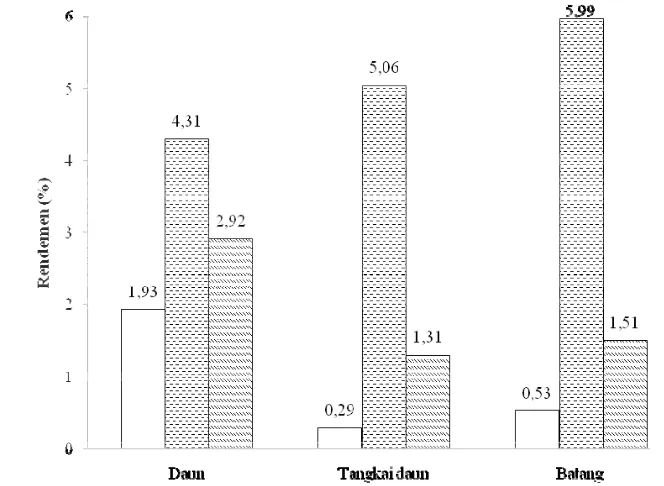
9 Diagram batang rendemen ekstrak kasar kangkung air ………... 41
10 Grafik total rendemen ekstrak kasar kangkung air ………. 41
Nomor Halaman
1 Lokasi pengambilan sampel kangkung air ………..… 58
2 Perhitungan pembuatan larutan stok dan proses pengencerannya 58 3 Perhitungan rendemen kangkung air segar ..………... 60
4 Perhitungan hasil uji proksimat ……….……….. 60
5 Ekstrak kasar kangkung air ………. 61
1.1 Latar Belakang
Kangkung air (Ipomoea aquatica Forsk.) merupakan tanaman air yang banyak ditemukan di beberapa wilayah, yaitu di Asia Tenggara, India dan Cina bagian Tenggara (Austin 2007; Wang et al. 2008). Tanaman ini banyak dikonsumsi oleh masyarakat Indonesia. Produksi tanaman kangkung di Indonesia meningkat dari tahun 2003-2007, yaitu 208,45 ton menjadi 335,08 ton (Deptan 2008).
Tanaman kangkung banyak mengandung vitamin A dan C serta mineral terutama zat besi yang berguna untuk pertumbuhan dan kesehatan tubuh manusia (Dibiyantoro 1996). Kangkung air diduga memiliki mengandung komponen bioaktif yang sangat berguna bagi tubuh. Kangkung telah banyak dimanfaatkan sebagai obat tradisional di kalangan masyarakat, namun masih belum cukup informasi untuk menjelaskan hal-hal tersebut secara ilmiah. Kangkung air merupakan salah satu objek yang penting dan menarik untuk diuji komponen bioaktif dan aktivitas antioksidan alami yang terkandung di dalamnya.
Antioksidan merupakan bahan atau senyawa yang dapat menghambat atau mencegah terjadinya oksidasi pada substrat yang mudah teroksidasi dan telah banyak dimanfaatkan oleh masyarakat. Antioksidan dikelompokkan menjadi dua berdasarkan sumbernya, yaitu antioksidan yang diperoleh secara alami (antioksidan alami) dan sintetik (antioksidan sintetik) (Winarsi 2007; Juniarti et al. 2009).
Fitokimia merupakan senyawa bioaktif alami yang terdapat pada tanaman, dapat berperan sebagai nutrisi dan serat alami yang dapat mencegah penyakit, yaitu kanker, penyakit pada hati, stroke, tekanan darah tinggi, katarak, osteoporosis dan infeksi saluran pencernaan (Hamburger dan Hostettmaun 1991; Juniarti et al. 2009). Senyawa-senyawa fitokimia yang umum terdapat di tanaman, yaitu golongan alkaloid, flavonoid, kuinon, tannin, polifenol, saponin, steroid dan triterpenoid (Harborne 1987).
Beberapa penelitian sebelumnya, bagian tanaman yang diuji aktivitas antioksidannya lebih banyak ke arah daun. Penelitian-penelitian tersebut, misalnya yang dilakukan oleh Arifin et al. (2006), yaitu ekstrak etanol daun
Eugenia cumini Merr, Juniarti et al. (2009), yaitu antioksidan ekstrak daun saga (Abrus precatorius L.) dan Suratmo (2009) tentang ekstrak daun sirih merah (Piper crocatum) sebagai antioksidan. Karakterisasi bahan baku yang dilakukan pada penelitian ini, selain menentukan rendemen, juga bertujuan menguji
komponen bioaktif dan aktivitas antioksidan yang terkandung pada masing-masing bagian, yaitu daun, tangkai daun dan batang kangkung air.
1.2 Tujuan Penelitian
2.1 Kangkung Air (Ipomoea aquatica Forsk.)
Kangkung air (Ipomoea aquatica Forsk.) merupakan tanaman air yang
banyak ditemukan di beberapa wilayah Asia Tenggara, India dan Cina bagian
Tenggara. Tanaman ini tumbuh dengan cara merambat dan dapat mengapung di
atas air (Austin 2007; Wang et al. 2008).
Klasifikasi kangkung air (Ipomoea aquatica Forsk.) menurut
Suratman et al. (2000) adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Ordo : Tubiflorae
Famili : Convolvulaceae
Genus : Ipomoea
Spesies : Ipomoea aquatica Forsk.
Famili Covovulaceae merupakan herba atau semak berkayu, kebanyakan
merayap atau membelit, daun tunggal, duduk tersebar tanpa daun penumpu.
Famili ini memiliki sekitar 50 genus dan lebih dari 1200 spesies, 400 spesies di
antaranya termasuk genus Ipomoea (Suratman et al. 2000).
Anggota genus Ipomoea banyak dikenal, antara lain Ipomoea aquatica
(kangkung air) dan Ipomoea reptans (kangkung darat). Kedua jenis kangkung ini Gambar 1 Kangkung air (Ipomoea aquatica Forsk.)
berhabitat sebagai herba. Ipomoea aquatica memiliki daun panjang, ujung agak
tumpul, berwarna hijau tua, bunga putih kekuningan atau kemerah-merahan,
sedangkan Ipomoea reptans memiliki daun panjang, ujung agak runcing, warna
hijau keputih-putihan dan bunga putih. Kangkung merupakan tanaman menetap
yang dapat tumbuh lebih dari satu tahun, di dataran rendah sampai dataran tinggi
2000 m di atas permukaan laut (Rukmana 1994). Kangkung air termasuk tanaman
yang mampu melakukan adaptasi dengan baik pada kondisi tanah atau lingkungan
dengan kisaran toleransi yang luas. Tanaman kangkung dapat tumbuh pada
kondisi dengan sumber nitrogen sangat terbatas (Djukri 2005).
Nilai gizi atau komposisi kimia masing-masing organisme berbeda-beda.
Hal ini ditentukan oleh jenis dan habibat organisme tersebut. Kangkung dapat
menghasilkan energi sebesar 475 kalori/gram (Farida et al. 2004). Komposisi
kimia kangkung menurut Farida et al. (2004) dapat dilihat pada Tabel 1 dan
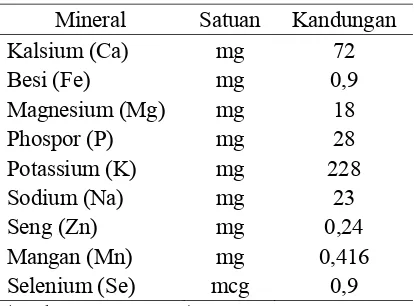
beberapa mineral yang terkandung dalam kangkung dapat dilihat pada Tabel 2.
Tabel 1 Komposisi kimia kangkung
Parameter Kandungan (% bb)
Kadar air 89,01
Kangkung air merupakan tanaman yang mengandung serat tinggi. Serat
makanan (diatery fiber) merupakan komponen dalam tanaman yang tidak dicerna
secara enzimatik menjadi bagian-bagian yang dapat diserap saluran pencernaan.
Serat terdiri atas berbagai substansi yang kebanyakan di antaranya adalah
karbohidrat kompleks. Serat makanan dibagi menjadi dua kelompok, yaitu serat
larut (soluble fiber) dan serat tidak larut (insoluble fiber). Tanaman mengandung
kedua-duanya dengan serat tidak larut pada porsi yang lebih banyak. Serat larut
merupakan serat yang larut di dalam air, antara lain pektin, getah tanaman dan
Serat dalam tubuh dapat bermanfaat sebagai bahan pencegah kanker, menurunkan
kolesterol, mencegah sembelit, mengontrol kadar gula darah dan mengontrol
berat badan (Gunawan 2002).
Tabel 2 Kandungan mineral kangkung
Mineral Satuan Kandungan
Radikal bebas adalah suatu senyawa atau molekul yang memiliki satu atau
lebih elektron tidak berpasangan pada orbital luarnya. Adanya elektron yang tidak
berpasangan menyebabkan senyawa tersebut reaktif mencari pasangan dengan
cara menyerang dan mengikat elektron molekul yang berada di sekitarnya.
Senyawa yang mudah teroksidasi secara umum adalah senyawa yang berikatan
kovalen. Ikatan kovalen akan sangat berbahaya karena ikatan yang digunakan
secara bersama-sama pada orbital terluarnya. Senyawa yang memiliki ikatan
kovalen umumnya merupakan molekul-molekul besar (biomakromolekul), yaitu
lipid, protein maupun DNA. Target utama radikal bebas adalah protein, asam
lemak tak jenuh dan lipoprotein serta unsur DNA termasuk karbohidrat. Asam
lemak tak jenuh merupakan molekul yang paling rentan terhadap serangan radikal
bebas. Radikal bebas memiliki reaktivitas yang tinggi, yaitu sifatnya yang segera
menarik atau menyerang elektron di sekelilingnya. Senyawa radikal bebas juga
dapat mengubah suatu molekul menjadi radikal bebas (Winarsi 2007). Senyawa
radikal bebas di dalam tubuh dapat merusak asam lemak tak jenuh ganda
pada membran sel yang mengakibatkan dinding sel menjadi rapuh. Senyawa
sistem info genetika dan berlanjut pada pembentukan sel kanker. Jaringan lipid
juga akan dirusak oleh senyawa radikal bebas sehingga terbentuk peroksida yang
memicu munculnya penyakit degeneratif (Winarsi 2007; Juniarti et al. 2009).
2.3 Senyawa Fitokimia
Senyawa fitokimia merupakan senyawa bioaktif alami yang terdapat
pada tanaman yang dapat berperan sebagai nutrisi dan serat alami yang dapat
mencegah penyakit (Harborne 1987). Beberapa penelitian menunjukkan bahwa
fitokimia terdapat pada nutrisi yang terkandung dalam buah-buahan,
sayur-sayuran dan kacang-kacangan. Komponen bioaktif tersebut dapat menghambat
proses penuaan dini dan menurunkan resiko terhadap berbagai penyakit, misalnya
kanker, penyakit pada hati, stroke, tekanan darah tinggi, katarak, osteoporosis dan
infeksi saluran pencernaan (Hamburger dan Hastettmaun 1991).
Senyawa-senyawa fitokimia yang umum terdapat pada tanaman, yaitu golongan
alkaloid, flavoniod, kuinon, tanin dan polifenol, saponin, steroid dan triterpenoid
(Harborne 1987). Senyawa fitokimia berperan dalam menjaga kesehatan.
Senyawa-senyawa tersebut saling melengkapi dalam mekanisme kerja yang
terjadi dalam tubuh, termasuk di dalamnya adalah antioksidan, detoksifikasi oleh
enzim, stimulasi dari sistem imun, metabolisme hormon dan antibakteri serta
antivirus (Hamburger dan Hastettmaun 1991).
2.3.1 Alkaloid
Alkaloid merupakan metabolit basa yang mengandung satu atau lebih atom
nitrogen, biasanya dalam gabungan sebagai bagian dari sistem siklik. Alkaloid
adalah senyawa kimia tanaman hasil metabolit sekunder yang terbentuk
berdasarkan prinsip pembentukan campuran. Alkaloid biasanya tanpa warna,
seringkali bersifat optis aktif, kebanyakan berbentuk kristal dan hanya sedikit
yang berbentuk cairan pada suhu kamar, contohnya pada nikotina.
Senyawa-senyawa golongan alkaloid misalnya caffeine, theobromine dan
theophylline (Sirait 2007). Kelompok senyawa alkaloid terdiri dari alkaloid
sesungguhnya, protoalkaloid dan pseudoalkaloid. Alkaloid sesungguhnya adalah
racun, senyawa tersebut menunjukkan aktivitas phisiologi yang luas,
heterosiklis, diturunkan dari asam amino, dan biasanya terdapat
dalam tanaman sebagai garam asam organik. Protoalkaloid merupakan amin
yang relatif sederhana, nitrogen asam amino tidak terdapat cincin heterosiklis,
dan diperoleh berdasarkan biosintesis dari asam amino yang bersifat basa.
Pseudoalkaloid tidak diturunkan dari prekursor asam amino dan biasanya
senyawa ini bersifat basa (Sastrohamidjojo 1996).
2.3.2 Flavonoid
Flavonoid merupakan kelompok besar fitokimia yang bersifat melindungi
dan banyak terdapat pada buah dan sayuran. Flavonoid sering dikenal
sebagai bioflavonoid yang berperan sebagai antioksidan. Antioksidan
dapat menetralkan atau menginaktifkan reaksi yang tidak stabil pada molekul
yang disebut sebagai radikal bebas yang dapat menyerang sel tubuh. Flavonoid
terdapat beberapa jenis dan masing-masing berperan dalam menjaga kesehatan.
Senyawa-senyawa flavonoid termasuk di dalamnya adalah resveratrol,
anthocyanin, quercetin, hesperidin, tangeritin, kaemferol, myricetin dan apigenin.
Flavonoid telah ditemukan pada jeruk, kiwi, apel, anggur merah, brokoli dan
teh hijau. Flavonoid adalah bagian dari senyawa fenolik yang terdapat
pada pigmen tumbuh-tumbuhan. Kesehatan manusia sangat tergantung
pada flavonoid sebagai antioksidan untuk mencegah kanker. Manfaat utama
flavonoid adalah untuk melindungi struktur sel, membantu memaksimalkan
manfaat vitamin C, mencegah keropos tulang, sebagai antibiotik dan
anti-inflamasi (Winarsi 2007).
Kehidupan dan fungsi sel mikroorganisme (virus dan bakteri)
dapat terancam karena keberadaan flavonoid yang bertindak langsung
sebagai antibiotik, bahkan keefektifan flavonoid dapat melemahkan virus HIV
penyebab penyakit mematikan AIDS. Virus herpes pun dapat lumpuh dengan
flavonoid. Flavonoid juga dapat berperan dalam pencegahan dan pengobatan
penyakit umum lainnya, yaitu periodontitis, wasir (ambeien), encok, rematik,
diabetes melitus, katarak dan asma. Istilah flavonoida diberikan untuk
senyawa-senyawa fenol yang berasal dari kata flavon yaitu nama dari salah satu flavonoida
2.3.3 Steroid/Triterpenoid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari
enam satuan isoprene dan secara biosintesis diturunkan dari
hidrokarbon C30 asiklik, yaitu skualena. Senyawa ini berstruktur siklik yang rumit,
kebanyakan berupa alkohol, aldehid atau asam karboksilat. Sterol atau steroid
adalah triterpenoid yang kerangka dasarnya cincin siklopentana
perhidrofenantren. Senyawa sterol pada tumbuhan disebut dengan fitosterol, yang
umum terdapat pada tumbuhan tinggi adalah sitosterol, stigmasterol dan
kampesterol. Senyawa ini dapat diklasifikasikan menjadi steroid dengan atom
karbon lebih dari 21, yaitu sterol, sapogenin, glikosida jantung dan vitamin D.
Senyawa ini dapat digunakan dalam pembuatan obat (Harborne 1987).
2.3.4 Saponin
Saponin atau glikosida sapogenin adalah salah satu tipe glikosida yang
tersebar luas dalam tanaman. Tiap saponin terdiri dari sapogenin yang merupakan
molekul aglikon dan sebuah gula. Saponin merupakan senyawa yang
menimbulkan busa jika dikocok dalam air dan pada konsentrasi yang rendah
sering menyebabkan hemolisis sel darah merah, sering digunakan sebagai
deterjen. Saponin dapat digunakan untuk meningkatkan diuretika serta
merangsang kerja ginjal. Saponin dapat menyebabkan iritasi pada selaput lendir,
bersifat toksik pada binatang berdarah dingin yaitu ikan (Harborne 1987).
Terdapat dua senyawa saponin, yaitu glikosida triterpenoid alkohol dan
glikosida struktur steroid tertentu yang mempunyai rantai samping spiroketal.
Kedua jenis ini larut dalam air dan etanol, tetapi tidak larut dalam eter.
Aglikonnya yang disebut sapogenin diperoleh dengan hidrolisis dalam suasana
asam atau hidrolisis memakai enzim dan tanpa bagian gula ciri kelarutannya sama
dengan ciri sterol lain (Robinson 1995).
2.3.5 Fenol hidrokuinon
Senyawa fenolik meliputi bermacam senyawa yang memiliki ciri, yaitu
berupa senyawa aromatis. Beberapa senyawa yang termasuk dalam golongan
fenolik, antara lain fenol sederhana, lignin, antrakuinon, flavonoid, tanin dan fenil
bersifat asam. Identifikasi senyawa fenol secara umum dapat menggunakan FeCl3,
akan dihasilkan larutan berwarna merah, violet atau merah-ungu (Harborne 1987).
Kuinon adalah senyawa berwarna dan mempunyai kromofor dasar,
yaitu kromofor pada benzokuinon, yang terdiri atas dua gugus karbonil yang
berkonjugasi dengan dua ikatan rangkap karbon-karbon. Dalam identifikasi
umumnya kuninon dibagi menjadi empat kelompok, yaitu benzokuinon,
naftokuinon, antrakuinon dan kuinon isoprenoid. Tiga kelompok pertama
biasanya terhidrolisasi dan bersifat senyawa fenol (Harbone 1987).
2.3.6 Karbohidrat
Karbohidrat merupakan sumber energi utama bagi manusia dan hewan yang
berasal tumbuh-tumbuhan. Melalui proses fotosintesis, klorofil tanaman dengan
sinar matahari mampu membentuk karbohidrat dari karbondioksida (CO2) yang
berasal dari udara dan air dari tanah. Proses fotosintesis menghasilkan karbohidrat
sederhana glukosa dan oksigen yang dilepaskan ke udara (Winarno 2008).
Karbohidrat dapat dikelompokkan menjadi monosakarida, oligosakarida dan
polisakarida. Monosakarida merupakan suatu molekul yang dapat terdiri atas lima
atau enam atom C, sedangkan oligosakrida merupakan polimer dari gabungan
2-10 monosakrida. Polisakarida umumnya merupakan polimer yang terdiri lebih
dari 10 monomer monosakarida. Komponen tersebut aktif secara optis, merupakan
alifatik polihidroksil yang biasanya sangat larut dalam air. Komponen ini sukar
untuk mengkristal bahkan dalam keadaan murni sekalipun dan biasanya diisolasi
dengan mereaksikannya dengan komponen lain (Harborne 1987). Peranan
karbohidrat dalam tubuh manusia dapat berguna untuk mencegah ketosis,
pemecahan protein tubuh yang berlebihan, kehilangan mineral dan berguna dalam
membantu metabolisme lemak dan protein (Winarno 2008).
2.3.7 Gula pereduksi
Sifat pereduksi dari suatu molekul ditentukan oleh ada atau tidaknya gugus
hidroksil (OH) bebas yang reaktif. Gugus hidroksil yang reaktif pada glukosa
(aldosa) biasanya terletak pada karbon nomor satu (anomerik), sedangkan pada
fruktosa (ketosa) terletak pada karbon nomor dua. Sukrosa tidak mempunyai
mempunyai OH bebas pada atom C nomor satu pada gugus glukosanya
(Winarno 2008).
Gula pereduksi merupakan kelompok gula atau karbohidrat yang mampu
mereduksi senyawa pengoksidasi. Monosakarida akan segera mereduksi
senyawa-senyawa pengoksidasi, yaitu ferisianida, hidrogen peroksida atau
ion kupri (Cu2+). Gula dioksidasi pada gugus karbonil dan senyawa pengoksidasi
menjadi tereduksi pada reaksi ini. Sifat gula pereduksi ini dapat berguna
dalam analisis gula, yaitu dengan mengukur jumlah dari senyawa pengoksidasi
yang tereduksi oleh suatu larutan gula tertentu (Lehninger 1988).
2.3.8 Peptida
Peptida merupakan ikatan kovalen antara dua atau lebih molekul asam
amino melalui ikatan amida substitusi. Ikatan ini dibentuk dengan menarik
senyawa H2O dari gugus karboksil suatu asam amino dan gugus α-amino
dari molekul lain dengan reaksi kondensasi yang kuat. Dua molekul asam amino
yang diikat oleh sebuah ikatan peptida disebut dipetida, tiga molekul asam amino
yang diikat oleh dua ikatan peptida disebut tripeptida dan seterusnya. Istilah oligopetida digunakan untuk kelompok yang memiliki ≤ 10 residu asam amino. Jika terdapat banyak asam amino yang bergabung dengan cara demikian,
maka akan menghasilkan struktur yang disebut polipeptida (Lehninger 1988).
Peptida dengan panjang bermacam-macam dibentuk oleh hidrolisis sebagian
dari rantai polipeptida yang panjang dari protein dan dapat mengandung ratusan
asam amino (Lehninger 1988). Pembentukan ikatan peptida memerlukan energi
yang besar, sedangkan hidrolisis praktis tidak memerlukan energi.
Reaksi keseimbangan ini lebih cenderung berjalan ke arah hidrolisis daripada
sintesis (Winarno 2008).
2.3.9 Asam amino
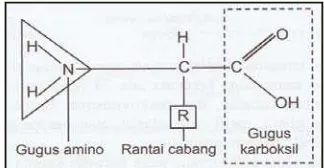
Asam amino merupakan unit struktural dasar protein dengan ikatan peptida
sebagai penghubung antara masing-masing asam amino. Meskipun demikian,
pada awal pembentukan protein hanya tersusun dari 20 asam amino yang dikenal
sebagai asam amino dasar atau asam amino baku. Struktur asam amino
gugus amina (NH2), gugus karboksil (COOH), atom hidrogen (H) dan satu gugus
sisa (R dari residu) (Winarno 2008). Semua asam amino berkonfigurasi alpha (α)
dan mempunyai konfigurasi L, kecuali glisin yang tidak mempunyai
atom C asimetrik. Hanya asam amino yang berkonfigurasi L yang merupakan
komponen protein (Fennema 1996). Sketsa bentuk molekul asam amino
secara umum dapat dilihat pada Gambar 2.
Gambar 2 Sketsa bentuk molekul asam amino (Sumber: Winarno 2008)
2.4 Antioksidan
Antioksidan adalah senyawa kimia yang dapat menyumbangkan satu atau
lebih elektron kepada radikal bebas, sehingga reaksi radikal bebas tersebut dapat
terhambat. Antioksidan juga dapat diartikan sebagai bahan atau senyawa yang
dapat menghambat atau mencegah terjadinya oksidasi pada substrat atau bahan
yang dapat teroksidasi, walaupun memiliki jumlah yang sedikit dalam makanan
atau tubuh jika dibandingkan dengan substrat yang akan teroksidasi. Antioksidan
merupakan senyawa pemberi elektron (electron donor) atau reduktan.
Senyawa ini memiliki berat molekul yang kecil, tetapi mampu menginaktivasi
berkembangnya reaksi oksidasi dengan cara mencegah terbentuknya radikal.
Antioksidan juga merupakan senyawa yang dapat menghambat reaksi oksidasi
dengan mengikat radikal bebas dan molekul yang sangat reaktif (Winarsi 2007).
2.4.1 Fungsi antioksidan
Antioksidan merupakan senyawa yang dapat menghambat reaksi oksidasi
dengan mengikat radikal bebas dan molekul yang sangat reaktif. Hal tersebut
dapat menghambat kerusakan sel. Berkaitan dengan reaksinya di dalam tubuh,
status antioksidan merupakan parameter penting untuk memantau kesehatan
seseorang. Tubuh manusia memiliki sistem antioksidan untuk menangkal
Jika jumlah senyawa oksigen reaktif ini melebihi jumlah antioksidan dalam tubuh,
kelebihannya akan menyerang komponen lipid, protein maupun DNA sehingga
mengakibatkan kerusakan-kerusakan yang disebut dengan stress oksidatif
(Winarsi 2007).
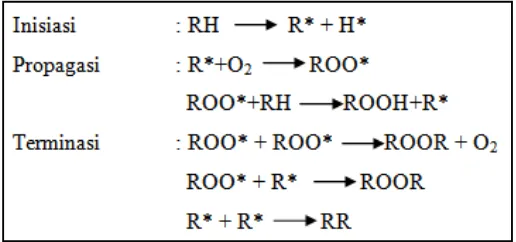
Mekanisme kerja antioksidan pada umumnya dapat dipahami setelah
mekanisme proses oksidasi lemak dalam bahan makanan atau pada sistem
biologis dipahami dengan baik. Oksidasi lemak terdiri dari 3 tahapan utama, yaitu
inisiasi, propagasi dan terminasi. Pada tahap inisiasi terjadi pembentukan radikal
asam lemak, yaitu suatu senyawa turunan lemak yang bersifat tidak stabil dan
sangat reaktif akibat hilangnya satu atom hidrogen. Pada tahap selanjutnya, yaitu
propagasi, radikal asam lemak akan bereaksi dengan oksigen membentuk radikal
peroksi. Radikal peroksi lebih lanjut akan menyerang asam lemak baru
(Winarsi 2007). Pada tahap terminasi terjadi reaksi antara radikal bebas
membentuk kompleks nonradikal. Adapun mekanisme reaksi tersebut dapat
dilihat pada Gambar 3.
Gambar 3 Reaksi umum oksidasi asam lemak (Sumber: Siagian 2002)
Antioksidan dibagi menjadi 4 tipe berdasarkan fungsinya (Siagian 2002;
Hariyatmi 2004), yaitu:
1. Tipe pemutus rantai reaksi pembentuk radikal bebas dengan cara
menyumbangkan atom H, contohnya vitamin E.
2. Tipe pereduksi yang mampu mentransfer atom H atau oksigen dan
bersifat pemulung, contohnya vitamin C.
3. Tipe pengikat logam yang mampu mengikat zat prooksidan (Fe2+ dan
4. Antioksidan selular yang mampu mendekomposisi hidrogen peroksida
menjadi bentuk stabil, contohnya pada manusia dikenal superoksida
dismutase, katalase dan glitation peroksidase.
Antioksidan mampu melindungi tubuh terhadap kerusakan yang disebabkan
spesies oksigen reaktif, mampu menghambat terjadinya penyakit degeneratif serta
mampu menghambat peroksidase lipid pada makanan (Winarsi 2007).
Antioksidan sangat bermanfaat bagi kesehatan dan berperan penting
untuk mempertahankan mutu produk pangan. Berbagai kerusakan,
yaitu ketengikan, perubahan gizi, perubahan warna dan aroma serta kerusakan
fisik lain pada produk pangan karena oksidasi. Proses oksidasi tersebut dapat
dihambat oleh antioksidan (Hernani dan Raharjo 2005).
2.4.2 Sumber antioksidan
Antioksidan dapat dikelompokkan menjadi dua kelompok berdasarkan
sumbernya, yaitu antioksidan alami dan antioksidan sintetik. Antioksidan alami
merupakan antioksidan hasil ekstraksi dari bahan-bahan alami, sedangkan
antioksidan sintetik merupakan antioksidan yang diperoleh dari hasil sintesa
reaksi kimia. Antioksidan alami di dalam makanan dapat berasal dari senyawa
antioksidan yang sudah ada dari satu atau dua komponen makanan, senyawa
antioksidan yang terbentuk dari reaksi-reaksi selama proses pengolahan dan
senyawa antioksidan yang diisolasi dari sumber alami dan ditambahkan
pada makanan sebagai bahan tambahan pangan (Winarno 2008).
Kebanyakan senyawa antioksidan yang diisolasi dari sumber alami berasal
dari tumbuhan. Kingdom tumbuhan angiospermae memiliki kira-kira 250.000
sampai 300.000 spesies dan dari jumlah ini kurang lebih 400 spesies yang telah
dikenal dapat menjadi bahan pangan manusia. Isolasi antioksidan alami telah
dilakukan dari tumbuhan yang dapat dimakan, tetapi tidak selalu dari bagian yang
dapat dimakan. Antioksidan alami tersebar di beberapa bagian tanaman,
yaitu pada kayu, kulit kayu, akar, daun, buah, bunga, biji dan serbuk sari.
Bahan-bahan pangan yang dapat menjadi sumber antioksidan alami, yaitu
rempah-rempah, dedaunan, teh, kokoa, biji-bijian, serealia, buah-buahan, sayur-sayuran
dan tumbuhan (alga laut). Bahan pangan ini mengandung jenis senyawa yang
golongan flavonoid, tokoferol, karotenoid, tanin, peptida, melanoidin,
produk-produk reduksi dan asam-asam organik lain (Pratt 1992).
Antioksidan sintetik ditambahkan ke dalam bahan pangan untuk mencegah
terjadinya ketengikan. Antioksidan sintetik yang banyak digunakan
adalah senyawa-senyawa fenol yang biasanya dapat beracun. Penambahan
antioksidan ini harus memenuhi beberapa persyaratan, misalnya tidak berbahaya
bagi kesehatan, tidak menimbulkan warna yang tidak diinginkan, efektif
pada konsentrasi rendah, larut dalam lemak, mudah diperoleh dan ekonomis.
Beberapa contoh antioksidan sintetik yang diijinkan untuk makanan, ada lima
antioksidan yang penggunaannya meluas dan menyebar di seluruh dunia, yaitu
butil hidroksi anisol (BHA), butil hidroksi toluene (BHT), propil galat (PG),
tert-butil hidroksi quinon (TBHQ) dan tokoferol (Buck 1991; Winarno 2008).
2.4.3 Mekanisme kerja antioksidan
Mekanisme antioksidan dalam menghambat oksidasi atau menghentikan
reaksi berantai pada radikal bebas dari lemak yang teroksidasi, dapat disebabkan
oleh 4 mekanisme reaksi, yaitu 1) pelepasan hidrogen dari antioksidan,
2) pelepasan elektron dari antioksidan, 3) adisi lemak ke dalam cincin aromatik
pada antioksidan dan 4) pembentukan senyawa kompleks antara lemak dan cincin
aromatik dari antioksidan (Ketaren 2008).
Antioksidan dapat dikelompokkan menjadi tiga kelompok berdasarkan
mekanisme reaksinya, yaitu antioksidan primer, sekunder dan tersier. Antioksidan
primer disebut juga antioksidan endogenous atau enzimatis. Suatu senyawa
dikatakan sebagai antioksidan primer apabila dapat memberikan atom hidrogen
secara cepat kepada radikal, kemudian radikal antioksidan yang terbentuk segera
menjadi senyawa yang lebih stabil. Antioksidan primer meliputi enzim
superoksida dismutase (SOD), katalase dan glutation peroksidase.
Enzim tersebut menghambat pembentukan radikal bebas dengan cara memutus
reaksi berantai (polimerisasi), kemudian mengubahnya menjadi produk yang lebih
stabil. Antioksidan sekunder disebut juga sebagai antioksidan eksogeneus atau
non-enzimatis. Antioksidan kelompok ini juga disebut sistem pertahanan
preventif, yaitu terbentuknya senyawa oksigen reaktif dihambat dengan
yaitu dengan cara memotong reaksi berantai dari radikal bebas atau dengan
cara menangkapnya. Antioksidan sekunder meliputi vitamin E, vitamin C, β-karoten, flavonoid, asam urat, bilirubin dan albumin. Kelompok antioksidan tersier meliputi sistem DNA-repair dan metionin sulfoksida reduktase.
Enzim-enzim ini berfungsi dalam perbaikan biomolekuler yang rusak akibat
reaktivitas radikal bebas. Kerusakan DNA yang tereduksi senyawa radikal bebas
dicirikan oleh oleh rusaknya struktur pada gugus non-basa maupun basa (Winarsi
2007). Mekanisme kerja serta kemampuan antioksidan sangat bervariasi.
Kombinasi beberapa antioksidan dapat memberikan perlindungan yang lebih baik
terhadap oksidasi dibandingkan satu jenis antioksidan saja (Siagian 2002).
2.5 Ekstraksi Senyawa Aktif
Ekstraksi merupakan suatu cara untuk memisahkan campuran beberapa zat
menjadi komponen-komponen yang terpisah. Ekstraksi juga dapat diartikan
sebagai proses penarikan komponen atau zat aktif menggunakan pelarut tertentu.
Proses ekstraksi bertujuan mendapatkan bagian-bagian tertentu dari bahan yang
mengandung komponen bioaktif (Harborne 1987).
Metode ekstraksi yang digunakan tergantung dari beberapa faktor,
antara lain tujuan ekstraksi, skala ekstraksi, sifat komponen-komponen
yang akan diekstrak dan sifat-sifat pelarut yang digunakan. Ekstraksi dapat
dilakukan dengan berbagai metode, misalnya ekstraksi dengan pelarut, destilasi,
supercritical fluid extraction (SFE), pengepresan dan sublimasi. Metode
yang banyak digunakan adalah destilasi dan ekstraksi menggunakan pelarut
(Houghton dan Raman 1998).
Suatu senyawa memiliki kelarutan yang berbeda-beda dalam pelarut yang
berbeda. Bahan dan senyawa kimia akan mudah larut pada pelarut yang relatif
sama kepolarannya. Pelarut yang bersifat polar mampu mengekstrak senyawa
alkaloid, fenolat dan flavonoid. Hasil ekstrak yang diperoleh akan tergantung
pada beberapa faktor, antara lain kondisi alamiah senyawa tersebut, metode
ekstraksi yang digunakan, ukuran partikel bahan ekstrak, kondisi dan waktu
penyimpanan, lama waktu ekstraksi dan perbandingan jumlah pelarut terhadap
sampel (Darusman et al. 1995). Jenis dan mutu pelarut yang digunakan
melarutkan zat yang diinginkan, mempunyai titik didih rendah, murah dan mudah
didapat, tidak toksik dan mudah terbakar (Ketaren 2008).
2.6 Uji Aktivitas Antioksidan
Metode yang digunakan pada penentuan aktivitas antioksidan kangkung air
pada penelitian ini adalah metode DPPH. Radikal bebas DPPH stabil dalam
larutan berair atau metanol. Metode DPPH merupakan metode yang sering
digunakan untuk penentuan aktivitas antioksidan dengan penggunaan radikal
bebas DPPH yang stabil dan memiliki warna ungu yang ditunjukkan oleh pita
absorbsi dalam pelarut metanol pada panjang gelombang sekitar 517 nm. Radikal
bebas DPPH bersifat peka terhadap cahaya, oksigen dan pH, tetapi bersifat stabil
dalam bentuk radikal sehingga memungkinkan untuk dilakukan pengukuran
antioksidan (Molyneux 2004). Radikal bebas DPPH dapat menangkap atom
hidrogen dari komponen aktif ekstrak yang dicampurkan kemudian bereaksi
menjadi bentuk tereduksinya yaitu yang terlihat pada Gambar 4.
Berdasarkan reaksi tersebut, senyawa antioksidan (AH) melepas atom
hidrogen menjadi radikal senyawa antioksidan (A*). DPPH merupakan radikal
bebas yang direaksikan dengan senyawa antioksidan dan menjadi DPPH bentuk
tereduksi (DPPH2). Mekanisme penangkapan radikal DPPH, yaitu melalui donor
atom H dari senyawa antioksidan yang menyebabkan peredaman warna radikal
pikrilhidrazil yang berwarna ungu menjadi pikrilhidrazil berwarna kuning
yang nonradikal (Molyneux 2004).
Penelitian ini menggunakan senyawa antioksidan sintetik BHT
yang digunakan sebagai kontrol positif karena diharapkan dapat memberikan
aktivitas antioksidan lebih besar dibandingkan antioksidan alami. Gambar 4 Struktur DPPH: (a) DPPH bentuk radikal, (b) DPPH bentuk
tereduksi
(Sumber: Molyneux 2004)
BHT memiliki nama kimia 2,6-bis (1,1-dimetiletil)-4-metilfenol dan rumus
kimianya C15H24O dengan bobot molekul 220,35 g/mol. Struktur BHT dapat
dilihat pada Gambar 5.
Gambar 5 Struktur kimia butil hidroksi toluene (BHT) (Sumber: Herawati dan Akhlus 2006)
Butil hidroksi toluene (BHT) digunakan sebagai zat aktif antioksidan pada
makanan, kosmetik, farmasi dan produk karet. Fungsi BHT hampir sama yaitu
vitamin E, yaitu sebagai zat yang mencegah reaksi autooksidasi atau oksidasi
yang disebabkan oleh O2 dari udara. Mekanisme reaksi BHT sebagai senyawa
antioksidan adalah sebagai berikut:
RO2* + ArOH ROOH + ArO*
Dengan peroksi (RO2*) sebagai radikal bebas direaksikan dengan BHT (ArOH)
menjadi hidroperoksida (ROOH) yang nonradikal sedangkan BHT menjadi
bentuk radikalnya (ArO*). Larutan DPPH yang berisi ekstrak sampel diukur
serapan cahayanya dan dihitung aktivitas antioksidannya dengan persen inhibisi,
yaitu banyaknya aktivitas senyawa antioksidan yang dapat menangkap radikal
bebas DPPH. Parameter yang umum digunakan untuk mengetahui besarnya
aktivitas antioksidan pada suatu ekstrak bahan adalah dengan menentukan
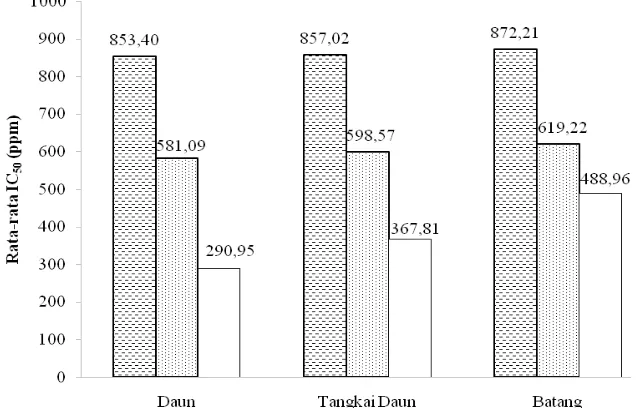
nilai inhibitor concentration 50% (IC50) bahan antioksidan tersebut. IC50
merupakan bilangan yang menunjukkan konsentrasi ekstrak yang mampu
3.1 Waktu dan Tempat
Penelitian ini dilakukan mulai bulan Desember 2009 hingga Mei 2010. Sampel diambil di Desa Carang Pulang, Kelurahan Cikarawang,
Kecamatan Dramaga, Bogor (Lampiran 1). Proses preparasi sampel dilakukan di Laboratorium Karakteristik Bahan Baku, sedangkan analisis aktivitas
antioksidan, uji fitokimia dan kadar abu serta kadar abu tidak larut asam dilakukan di Laboratorium Mikrobiologi Hasil Perairan dan Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu
Kelautan. Analisis proksimat (kadar air, lemak dan protein) dilakukan di Laboratorium Konservasi Satwa Langkah dan Harapan, Pusat Antar Universitas
(PAU), Institut Pertanian Bogor.
3.2 Bahan dan Alat
Bahan utama yang dibutuhkan untuk penelitian ini adalah kangkung air (Ipomoea aquatica Forsk). Bahan-bahan yang dibutuhkan untuk analisis proksimat meliputi kristal K2SO4, kjeltab (katalis selenium), larutan H2SO4 pekat, larutan H2O2, asam borat (H3BO3) 2% yang mengandung indikator bromcresol green 0,1% dan methyl red 0,1%, larutan NaOH 1,25%, larutan HCl 0,10 N, larutan HCl 10%, larutan AgNO3 0,1 N, pelarut lemak (n-heksana), larutan H2SO4 1,25% dan akuades. Bahan-bahan yang dibutuhkan untuk uji aktivitas
antioksidan, yaitu ekstrak kasar kangkung air, radikal bebas 1,1-diphenyl-2-picrylhydrazyl (DPPH), butylated hydroxyltoluene (BHT) sebagai
antioksidan pembanding. Bahan-bahan yang dibutuhkan untuk uji fitokimia meliputi pereaksi Wagner, pereaksi Meyer, pereaksi Dragendroff (uji alkaloid), kloroform, anhidrat asetat, asam sulfat pekat (uji steroid), serbuk magnesium, amil alkohol (uji flavonoid), air panas, larutan HCl 2 N (uji saponin), etanol 70%, larutan FeCl3 5% (uji fenol hidrokuinon), pereaksi Molisch, larutan H2SO4 pekat (uji Molisch), pereaksi Benedict (uji Benedict), pereaksi Biuret (uji Biuret) dan larutan Ninhidrin 0,1% (uji Ninhidrin).
kompor listrik, tanur pengabuan, kapas bebas lemak, labu lemak, tabung Soxhlet, penangas air, labu Kjeldahl, alat destilasi, labu erlenmeyer, buret, pipet
volumetrik, pipet mikro, gelas ukur, blender, sentrifuse, rotary vacuum evaporator, corong terpisah, botol vial, gelas piala, pipet tetes,
tabung reaksi, vortex, kertas saring Whatman ( : 10 dan 42) bebas abu, corong Buchner, labu takar dan spektrofotometer UV-Vis.
3.3 Metode Penelitian
Penelitian ini bersifat deskriptif dari data yang diperoleh dan terdiri atas beberapa tahapan, yaitu tahap pengambilan sampel, tahap perhitungan rendemen (daun, tangkai daun dan batang), tahap pembuatan ekstrak kasar kangkung air, tahap analisis komposisi kimia kangkung air berupa analisis proksimat (kadar air, lemak, protein, abu, abu tak larut asam dan serat kasar), uji fitokimia dan uji aktivitas antioksidan terhadap ekstrak kasar kangkung air.
3.3.1 Pengambilan dan preparasi bahan baku
Sampel kangkung air dilakukan di Desa Carang Pulang, Kelurahan Cikarawang, Kecamatan Dramaga, Bogor. Sampel dipetik secara langsung dalam area yang dibatasi transek kuadrat (1 m2). Kangkung tersebut kemudian dimasukkan dalam plastik dan segera dipreparasi di Laboratorium Karakterisasi Bahan Baku, Departemen Teknologi Hasil Perairan. Semua bagian kangkung dibersihkan dari kotoran seperti tanah, pasir dan lumpur. Kemudian sampel dihitung rendemennya dengan perumusan sebagai berikut:
Kangkung dibagi menjadi dua bagian. Bagian pertama merupakan bagian yang akan diuji kadar air, lemak, protein, kadar abu, abu tidak larut asam dan serat kasat (uji proksimat) dalam keadaan utuh dan segar. Kangkung dikecilkan ukurannya dengan pisau untuk mempermudah proses uji. Bagian kedua merupakan bagian yang akan dikeringkan dan diekstrak untuk diuji aktivitas antioksidan dan fitokimia yang terkandung di dalamnya, yaitu bagian daun,
dengan blender sehingga diperoleh bentuk serbuk halus. Serbuk halus tersebut akan diekstraksi dengan pelarut yang telah disiapkan dan selanjutnya akan diuji secara fitokimia dan uji aktivitas antioksidan.
3.3.2 Analisis proksimat
Analisis proksimat merupakan suatu analisis yang dilakukan untuk memprediksi komposisi kimia suatu bahan, termasuk di dalamnya analisis
kadar air, lemak, protein, abu, abu tidak larut asam dan serat kasar. 1) Kadar air (AOAC 2005)
Tahap pertama yang dilakukan untuk menganalisis kadar air adalah mengeringkan cawan porselen dalam oven pada suhu 105 oC selama 1 jam.
Cawan tersebut diletakkan ke dalam desikator (kurang lebih 15 menit) atau dibiarkan hingga beratnya konstan kemudian ditimbang. Sebanyak 5 gram contoh dimasukkan ke dalam cawan tersebut, kemudian dikeringkan dengan oven pada suhu 105 oC selama 5 jam atau hingga beratnya konstan. Cawan tersebut kemudian dimasukkan ke dalam desikator dan dibiarkan sampai beratnya konstan, selanjutnya ditimbang kembali.
Perhitungan kadar air :
2) Kadar lemak (AOAC 2005)
ke dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada suhu 105 oC, setelah itu labu didinginkan dalam desikator sampai beratnya konstan (W3).
Perhitungan kadar lemak kangkung air:
Keterangan : W1 = Berat sampel (g)
W2 = Berat labu lemak kosong (g) W3 = Berat labu lemak dengan lemak (g) 3) Kadar protein (AOAC 1980)
Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap, yaitu destruksi, destilasi dan titrasi. Pengukuran kadar protein dilakukan dengan metode mikro Kjeldahl. Sampel ditimbang sebanyak 0,25 gram dimasukkan ke dalam labu Kjeldahl 100 ml. Sebanyak 0,25 gram Selenium dan 3 ml H2SO4 pekat serta sampel didekstruksi (pemanasan dalam keadaan mendidih) pada suhu 410 oC selama 1 jam sampai larutan jernih. Setelah dingin ditambahkan 50 ml aquades dan 20 ml NaOH 40%, lalu didestilasi dengan suhu destilator 100 oC. Hasil destilasi ditampung dalam labu Erlenmeyer yang berisi campuran 10 ml H3BO3 2% dan 2 tetes indikator bromcherol green-methyl red berwarna merah muda (1:2). Setelah volume hasil tampungan (destilat) menjadi 40 ml dan berwarna hijau kebiruan, destilasi dihentikan dan destilat dititrasi dengan HCl 0,10 N sampai berwarna merah muda. Perlakuan yang sama dilakukan juga terhadap blanko. Dengan metode ini diperoleh kadar nitrogen total yang dihitung. Kadar protein dihitung dengan rumus sebagai berikut:
*) Faktor konversi alat = 2,5
4) Kadar abu (AOAC 2005)
Cawan pengabuan dikeringkan di dalam oven selama 1 jam pada suhu 105 oC, kemudian didinginkan selama 15 menit di dalam desikator
hingga didapatkan berat yang konstan dan ditimbang. Sampel sebanyak 5 gram dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api bunsen hingga tidak berasap lagi. Setelah itu dimasukkan ke dalam tanur pengabuan dengan suhu 400 oC selama 1 jam, kemudian dimasukkan dalam desikator hingga didapatkan berat yang konstan dan ditimbang.
Kadar abu ditentukan dengan rumus:
5) Kadar abu tidak larut asam menurut SNI 01-3836-2000 (BSN 2000) Abu hasil penetapan kadar abu total dilarutkan dalam 25 ml HCl 10% dan dididihkan selama 5 menit. Larutan tersebut kemudian disaring dengan kertas saring bebas abu dan dicuci dengan air suling sampai bebas klorida. Kertas saring kemudian dikeringkan dalam oven. Abu yang telah kering kemudian diabukan
kembali dalam tanur dengan menggunakan wadah cawan porselen. Cawan porselen tersebut kemudian didinginkan dalam desikator dan ditimbang
hingga beratnya tetap.
Kadar abu tidak larut asam ditentukan dengan rumus:
6) Kadar serat kasar (AOAC 1980)
Sebanyak 1 gram sampel dilarutkan dengan 100 ml H2SO4 1,25% dipanaskan hingga mendidih lalu dilanjutkan dengan destruksi selama 30 menit. Kemudian disaring menggunakan kertas saring Whatman ( : 10) dan dengan
air mendidih dan dengan air sebanyak 3 kali. Residu dekstruksi kembali dengan 100 ml NaOH 1,25% selama 30 menit. Lalu disaring dengan cara sama seperti di atas dan dibilas berturut-turut dengan 25 ml H2SO4 1,25% mendidih, 2,5 ml air sebanyak tiga kali dan 25 ml alkohol. Residu beserta kertas saring dipindahkan ke cawan porselin dan porselin ditimbang (A), lalu dimasukkan dalam tanur 600 oC selama 30 menit, didinginkan dan ditimbang kembali (B).
Kadar serat kasar dapat dihitung dengan perumusan sebagai berikut:
Keterangan:
W = bobot residu sebelum dibakar dalam tanur = A – (bobot kertas saring + cawan)
Wo = B – (bobot cawan)
A = bobot residu + kertas saring + cawan B = bobot residu + cawan
3.3.3 Analisis antioksidan
1) Ekstraksi bahan aktif (Quinn 1988 diacu dalam Darusman et al. 1995) Analisis yang dilakukan terhadap ekstrak kasar menggunakan dua uji, yaitu uji aktivitas antioksidan (metode DPPH) untuk mengetahui aktivitas
antioksidan dari ekstrak masing-masing pelarut dan uji fitokimia untuk menentukan senyawa kimia yang terdapat dalam kangkung air.
Tahapan analisis antioksidan terdiri atas beberapa langkah, yaitu persiapan sampel dan ekstraksi bahan aktif. Pada tahap persiapan sampel, bagian kangkung air (daun, tangkai daun dan batang) yang telah diambil segera dikeringkan dengan panas matahari selama 3 hari.
Bagian kangkung air yang telah kering kemudian dihaluskan dengan blender, sehingga diperoleh serbuk halus. Ukuran sampel yang kecil
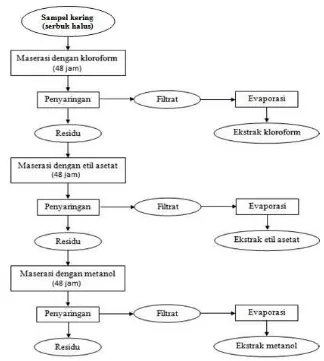
Langkah selanjutnya adalah ekstraksi bahan aktif. Metode ekstraksi yang digunakan adalah metode Quinn (1988) diacu dalam Darusman et al. (1995) yang telah dimodifikasi oleh Khusniya (2004). Pada metode ini digunakan tiga macam pelarut berdasarkan tingkat kepolarannya, yaitu kloroform (non polar), etil asetat (semi polar) dan metanol (polar).
Sampel sebanyak 25 g yang telah dihancurkan, dimaserasi dengan pelarut kloroform sebanyak 100 ml selama 48 jam dengan diberi goyangan menggunakan orbital shaker dengan kecepatan 8 rpm. Hasil maserasi yang berupa larutan kemudian disaring dengan kertas saring Whatman 42 sehingga diperoleh filtrat dan residu. Residu yang dihasilkan selanjutnya dimaserasi dengan etil asetat
sebanyak 100 ml selama 48 jam dengan diberi goyangan yang sama dengan maserasi sebelumnya, sedangkan filtrat yang diperoleh dievaporasi menggunakan rotary vacuum evaporator pada suhu 50 oC.
Hasil proses maserasi ke-2 selanjutnya disaring dengan kertas saring Whatman 42. Residu yang dihasilkan dilarutkan dengan metanol sebanyak 100 ml dan dimaserasi selama 48 jam dengan diberi goyangan menggunakan orbital shaker dengan kecepatan 8 rpm. Filtrat kemudian dievaporasi menggunakan rotary vacuum evaporator pada suhu 50 oC.
Hasil maserasi ke-3 dengan pelarut metanol kemudian disaring dengan kertas saring Whatman 42. Filtrat ekstrak metanol yang diperoleh dievaporasi menggunakan rotary vacuum evaporator pada suhu 50 oC, sedangkan residu yang tersisa dibuang. Berdasarkan proses ini, diperoleh ekstrak pelarut kloroform, ekstrak etil asetat dan ekstrak metanol. Hasil ekstrak yang diperoleh kemudian digunakan untuk uji fitokimia dan analisis aktivitas antioksidan. Adapun proses ekstraksi bertingkat tersebut dapat dilihat pada Gambar 6.
2) Uji aktivitas antioksidan (Blois 1958 diacu dalam Hanani et al. 2005) Aktivitas antioksidan ekstrak kasar kangkung air ditentukan dengan metode
DPPH seperti yang dinyatakan oleh Blois (1958) diacu dalam Hanani et al. (2005). Ekstrak kasar kangkung air diuji dalam beberapa
Antioksidan sintetik BHT digunakan sebagai pembanding dibuat dengan konsentrasi 2, 4, 6 dan 8 ppm. Perhitungan larutan stok dan proses
pengencerannya dapat dilihat pada Lampiran 2.
Gambar 6 Diagram alir proses ekstraksi kangkung air (Ipomoea aquatica) (Sumber: Khusniya 2004)
Aktivitas antioksidan masing-masing sampel ekstrak dan BHT dinyatakan dengan persentase penghambatan radikal bebas (persen inhibisi) yang dapat dihitung dengan formulasi sebagai berikut:
Nilai konsentrasi sampel (ekstrak kangkung air ataupun antioksidan pembanding BHT) dan hambatan ekstrak (persen inhibisi) diplot masing-masing pada sumbu x dan y pada persamaan regresi linear. Persamaan regresi linear yang diperoleh dalam bentuk persamaan: y = b(x) + a, digunakan untuk mencari nilai IC50 (inhibitor concentration 50%) masing-masing sampel, dengan menyatakan nilai y sebesar 50 dan nilai x sebagai IC50. Nilai IC50 menyatakan konsentrasi larutan sampel yang dibutuhkan untuk mereduksi DPPH sebesar 50%.
3.3.4 Uji fitokimia (Harborne 1987)
Uji fitokimia dilakukan untuk mengetahui ada tidaknya komponen-komponen bioaktif yang terdapat pada ekstrak kasar kangkung air yang memiliki
aktivitas antioksidan tertinggi. Uji fitokimia meliputi uji alkaloid, uji steroid/triterpenoid, flavonoid, saponin, fenol hidrokuinon, uji Molisch, uji Benedict, uji Biuret dan uji Ninhidrin.
1) Alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi Meyer, dan pereaksi Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi Wagner dan endapan merah hingga jingga dengan pereaksi Dragendorff.
Pereaksi Meyer dibuat dengan cara menambahkan 1 ml HgCl2 dengan
40 ml air. Larutan ini dicampur dengan larutan yang dibuat dari 8 gram kalium iodida dalam 20 ml air. Sebelum digunakan, 1 volume campuran ini diencerkan dengan 2,3 volume campuran 20 ml asam asetat glasial dan 100 ml air. Pereaksi ini berwarna jingga.
2) Steroid/Triterpenoid
Sejumlah sampel dilarutkan dalam 2 ml kloroform dalam tabung reaksi yang kering. Kemudian ke dalamnya ditambahkan 10 tetes anhidra asetat dan 3 tetes asam sulfat pekat. Terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau menunjukkan reaksi positif.
3) Flavonoid
Sejumlah sampel ditambahkan serbuk magnesium 0,1 mg dan 0,4 ml amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama) dan 4 ml alkohol kemudian campuran dikocok. Terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol menunjukkan adanya flavonoid. 4) Saponin
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan adanya saponin.
5) Fenol hidrokuinon (pereaksi FeCl3)
Sebanyak 1 gram sampel diekstrak dengan 20 ml etanol 70%. Larutan yang dihasilkan diambil sebanyak 1 ml kemudian ditambahkan 2 tetes larutan FeCl3 5%. Terbentuknya warna hijau atau hijau biru menunjukkan adanya senyawa fenol dalam bahan.
6) Uji Molisch
Sebanyak 1 ml larutan sampel diberi 2 tetes pereaksi Molish dan 1 ml asam sulfat pekat melalui dinding tabung. Uji positif yang menunjukkan adanya
karbohidrat ditandai terbentuknya kompleks berwarna ungu di antara 2 lapisan cairan.
7) Uji Benedict
8) Uji Biuret
Sebanyak 1 ml larutan sampel ditambahkan 4 ml pereaksi Biuret. Campuran dikocok dengan seksama. Terbentuknya larutan berwarna ungu menunjukkan hasil uji positif adanya peptida.
9) Uji Ninhidrin
Sebanyak 2 ml larutan sampel ditambah beberapa tetes larutan Ninhidrin 0,1%. Campuran dipanaskan dalam penangas air selama 10 menit.
4.1 Karakteristik Bahan Baku
Bahan baku yang digunakan dalam penelitian ini adalah kangkung air
(Ipomoea aquatica Forsk.). Sampel yang telah diambil segera dipreparasi dan
dikurangi kadar airnya melalui proses pengeringan. Pengeringan dilakukan
untuk menambah daya awet produk sebelum dianalisis dan mempermudah
penyimpanan. Kangkung air segar yang telah dipisahkan daun, tangkai daun dan
batangnya yang dapat dilihat pada Gambar 7.
Gambar 7 Kangkung air segar yang telah dipisahkan bagian daun, tangkai daun dan batang
Kangkung air yang telah kering memiliki bobot yang lebih ringan
dibandingkan kangkung air segar. Hal ini terjadi karena sebagian air dalam
kangkung air telah teruapkan oleh panas saat proses pengeringan. Kadar air
tersebut merupakan air bebas yang mudah dihilangkan, misalnya dengan proses
pengeringan (Winarno 2008). Ketiga bagian tersebut masing-masing dihancurkan
sehingga diperoleh bentuk serbuk halus. Bahan baku yang berbentuk serbuk halus
tersebut dapat mempermudah saat proses analisis maupun proses ekstraksi.
Permukaan bahan baku yang dapat kontak langsung dengan pelarut lebih luas.
bahan baku dari pengaruh lingkungan sekitar. Karakterisasi bahan baku dilakukan
untuk menentukan sifat dari bahan baku yang digunakan. Suatu bahan baku
memiliki sifat kimia yang berbeda dengan yang lainnya. Karakterisasi yang
dilakukan pada penelitian ini meliputi pengukuran rendemen dan analisis
kandungan gizi bahan baku (uji proksimat).
4.1.1 Rendemen
Rendemen merupakan persentase bagian bahan baku yang dapat digunakan
atau dimanfaatkan dengan total bahan baku. Rendemen yang semakin besar
menandakan bahwa bahan baku tersebut memiliki peluang untuk dimanfaatkan
lebih besar dibandingkan bahan baku yang memiliki nilai rendemen rendah atau
kecil (Kusumawati et al. 2008). Kangkung air ditimbang beratnya sebelum dan
sesudah pemisahan bagian daun, tangkai daun dan batang. Persentase rendemen
kangkung air merupakan perbandingan antara berat bagian-bagian kangkung air
segar dengan berat utuh kangkung air yang digunakan. Perhitungan rendemen
kangkung air dilakukan dalam keadaan segar dan setelah proses pengeringan.
Diagram batang hasil perhitungan rendemen tersebut dapat dilihat pada Gambar 8
dan contoh perhitungannya pada Lampiran 3.
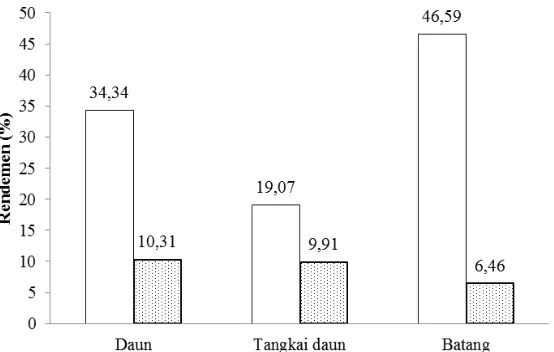
Gambar 8 Diagram batang rendemen kangkung air: ( ) segar; ( ) kering
Rendemen kangkung air segar, yaitu daun sebesar 34,34%, tangkai daun
sebesar 19,07% dan batang sebesar 46,59%. Rendemen terbesar terdapat
lebih besar daripada tangkai daun dan berongga. Batang tersebut juga sebagian
besar bersentuhan langsung dan terapung air, sehingga memiliki kadar yang cukup
banyak dibandingkan bagian-bagian lainnya. Penimbangan dalam keadaan segar
menyebabkan batang kangkung air memiliki rendemen yang paling besar.
Tangkai daun merupakan bagian di antara batang dan daun. Tangkai daun
berukuran lebih kecil daripada batang. Sebagian atau seluruh bagian tangkai daun
dapat terendam dalam air, namun bentuknya yang kecil dan tipis serta berongga
sehingga saat penimbangan menghasilkan rendemen yang paling kecil. Daun
kangkung air secara umumnya terdapat di atas permukaan yang yang ditopang
oleh tangkai daun. Rendemen daun berada di antara rendemen batang dan
tangkai daun.
Pengeringan dilakukan untuk menghilangkan sebagian kadar air dalam
bahan untuk memperlancar proses analisis dan menambah daya awet
bahan tersebut. Proses pengeringan dilakukan secara langsung di bawah sinar
matahari. Pengeringan yang baik ditandai dengan penyusutan berat bahan
yang dikeringkan. Proses pengeringan yang dilakukan menggunakan sinar
matahari. Setelah pengeringan kangkung air mengalami penurunan bobot pada
masing-masing bagian kangkung air yang dikeringkan, sehingga rendemen
masing-masing bagian kangkung air pun menurun.
Rendemen terbesar setelah pengeringan dihasilkan oleh daun, yaitu
sebesar 10,31% dan terendah pada rendemen batang yaitu sebesar 6,46%,
sedangkan rendemen pada tangkai daun sebesar 9,91%. Batang kangkung air
menyebar menjalar di permukaan air, sehingga kadar air pada batang lebih banyak
daripada bagian-bagian kangkung air lainnya. Oleh karena itu, selama
proses pengeringan dengan sinar matahari, kadar air bebas yang hilang memiliki
persentase yang lebih besar. Rendemen yang dihasilkan setelah pengeringan
lebih kecil.
Berbeda dengan batang kangkung air, daun kangkung air yang telah
dikeringkan memiliki rendemen yang terbesar. Dilihat dari luas penampang,
proses penguapan pada daun kangkung air memiliki peluang yang lebih besar
karena memiliki luas penampang yang lebih luas dibandingkan bagian-bagian
Penyusutan berat pada daun kangkung air lebih kecil, sehingga memiliki
rendemen dalam bentuk kering yang besar. Tangkai daun pada kangkung air
memiliki rendemen yang berada di antara daun dan batang kangkung air setelah
dikeringkan. Penampang tangkai daun yang lebih kecil daripada kedua bagian
lainnya menyebabkan bagian ini tidak banyak mengalami penguapan sehingga
tidak banyak mengalami penyusutan.
Hasil perhitungan rendemen kangkung air setelah dikeringkan tidak
memiliki jumlah 100%. Hal ini disebabkan adanya kadar air bebas yang hilang
pada saat proses pengeringan. Kadar air bebas merupakan sejumlah air yang
secara fisik terikat dalam jaringan matriks bahan, yaitu membran, kapiler dan serat
yang memiliki sifat air bebas dan mudah diuapkan (Winarno 2008).
4.1.2 Kandungan gizi
Kandungan gizi antara bahan baku berbeda-beda tergantung dari jenis bahan
baku, habitat dan fase serta umur bahan baku tersebut. Zat gizi merupakan
senyawa kimia yang sangat dibutuhkan dalam tubuh. Zat gizi berperan dalam
penyediaan energi, proses pertumbuhan, perbaikan jaringan, pengaturan serta
pemeliharaan proses fisiologis dan biokimiawi di dalam tubuh. Zat gizi
diklasifikasikan dalam 6 kelompok besar, yaitu karbohidrat, protein, lemak,
vitamin, mineral dan air (Winarno 2008).
Komponen non gizi merupakan komponen selain gizi. Berbeda dengan
komponen gizi, jika kekurangan komponen non gizi tidak menyebabkan
kekurangan gizi. Kekurangan komponen non gizi dapat mengganggu kelancaran
proses fisiologis dalam tubuh, yaitu proses pencernaan (Gunawan 2002).
Kelancaran proses pencernaan merupakan hal yang diinginkan. Keberadaan
komponen non gizi dalam tubuh juga diperlukan.
Kandungan gizi pada kangkung air dapat ditentukan melalui uji proksimat.
Uji proksimat dilakukan untuk memperoleh data kasar tentang komposisi kimia
bahan baku yang diuji. Zat gizi pada kangkung air yang diuji meliputi kadar air,
kadar abu, kadar abu tidak larut asam, kadar protein dan kadar lemak serta kadar
serat kasar (komponen non gizi). Kadar karbohidrat diperoleh dengan perhitungan
by difference. Hasil uji proksimat kangkung air segar dapat dilihat pada Tabel 3.
Tabel 3 Hasil analisis proksimat kangkung air (Ipomoea aquatica Forsk.)
Parameter Kandungan (% bb)
Kadar air 90,00 ± 0,05
Kadar abu 1,09 ± 0,15
Protein kasar 2,35 ± 0,28
Kadar lemak 0,55 ± 0,01
Karbohidrat 6,02 ± 0,07
Kadar abu tidak larut asam 0,10 ± 0,00
Serat kasar 1,04 ± 0,01
1) Kadar air
Semua bahan makanan mengandung air dalam jumlah yang berbeda-beda,
baik itu bahan makanan hewani maupun nabati. Kandungan air dalam bahan
pangan ikut menentukan acceptability, kesegaran dan daya tahan bahan pangan.
Kadar air pada kangkung air segar dapat ditentukan menggunakan uji proksimat.
Hasil uji proksimat kadar air kangkung air dapat dilihat pada Tabel 3.
Kadar air kangkung air tergolong tinggi, yaitu mencapai (90,00 ± 0,05)%.
Persentase kadar air tersebut didukung oleh penelitian yang telah dilakukan
oleh Farida et al. (2004) dengan komposisi kadar air sebesar 89,01%. Kadar air
pada bahan pangan dapat dipengaruhi oleh habitat atau lingkungan. Prinsip
analisis kadar air yang dilakukan dalam penelitian ini adalah mengukur berat air
bebas yang teruapkan dan tidak terikat kuat dalam jaringan bahan dengan bantuan
panas. Air yang teruapkan ini merupakan air tipe III. Air tipe III ini biasa disebut
air bebas dan merupakan air yang hanya terikat secara fisik dalam jaringan
matriks bahan yaitu membran, kapiler, serat dan lain sebagainya. Air ini dapat
dimanfaatkan untuk pertumbuhan mikroba dan media bagi reaksi-reaksi kimiawi
(Winarno 2008).
2) Kadar Lemak
Analisis kadar lemak pada bagian-bagian kangkung air dilakukan
untuk menentukan kandungan kadar lemak pada kangkung air. Lemak merupakan
komponen yang tersusun dari unit struktural yang bersifat hidrofobik. Penelitian
lemak yang rendah, yaitu sebesar (0,55 ± 0,01)%. Nilai ini tidak jauh berbeda
dengan hasil pengujian kadar lemak yang dilakukan oleh Farida et al. (2004),
yaitu 0,15%. Hasil tersebut juga didukukng oleh hasil penelitian Gusyana (2010)
yang menyatakan bahwa kadar lemak kangkung, yaitu sebesar 0,40%.
Kadar lemak yang rendah dapat disebabkan oleh kandungan air yang tinggi,
sehingga secara proporsional kadar lemak akan menurun. Hal ini sesuai
dengan pendapat Yunizal et al. (1998) yang menyatakan bahwa kadar air
umumnya berbanding terbalik dengan kadar lemak. Hubungan tersebut
mengakibatkan semakin rendahnya kadar lemak, apabila kadar air yang
terkandung pada bahan memiliki jumlah yang tinggi.
3) Kadar protein
Protein merupakan komponen utama dalam sel hidup, baik tumbuhan
maupun hewan. Protein merupakan komponen terbesar setelah air pada sebagian
besar jaringan tubuh. Kadar protein kangkung air segar tergolong rendah,
yaitu (2,35 ± 0,28)%. Hasil pengukuran ini tidak jauh berbeda dengan kadar
protein kasar yang telah diuji oleh Farida et al. (2004) yaitu kadar protein kasar
pada kangkung air adalah 2,06%.
Asam amino-asam amino yang biasanya sangat kurang dalam bahan
makanan disebut sebagai asam amino pembatas. Tumbuhan serelia asam amino
pembatasnya adalah lisin, sedangkan pada kacang-kacangan biasanya asam amino
metionin. Protein yang kekurangan satu atau lebih asam amino esensial
mempunyai mutu yang rendah. Kadar protein pada tumbuhan secara umum
memiliki mutu yang lebih rendah daripada kadar protein hewani. Protein hewani
lebih banyak menyediakan asam amino-asam amino esensial dan karenanya
disebut protein bermutu tinggi (Parman 2007, Winarno 2008).
4) Kadar abu
Bahan makanan terdiri atas 96% bahan organik dan air, sedangkan sisanya
terdiri atas unsur-unsur mineral. Unsur mineral juga dikenal sebagai zat anorganik
atau kadar abu. Bahan-bahan organik dalam proses pembakaran akan terbakar,
tetapi zat anorganiknya tidak terbakar, karena itulah disebut sebagai abu