(Ctenopharyngodon idella) MENGGUNAKAN PREMIKS
HORMON OODEV DAN PAKAN
Indigofera zollingeriana
DWI MULYASIH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Induksi Pematangan Gonad Ikan Grass Carp (Ctenopharyngodon idella) Menggunakan Premiks Hormon Oodev dan Pakan Indigofera zollingeriana” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Dwi Mulyasih
DWI MULYASIH. Induksi Pematangan Gonad Ikan Grass Carp
(Ctenopharyngodon idella) Menggunakan Premiks Hormon Oodev dan Pakan
Indigofera zollingeriana. Dibimbing oleh AGUS OMAN SUDRAJAT dan LUKI
ABDULLAH.
Ikan grass carp merupakan ikan herbivora yang memiliki kemampuan dalam menanganibloomingalga di perairan tawar tertutup seperti danau . Namun memiliki kendala waktu pemijahan yang lama dan pemeliharannya menggunakan pakan komersil dari tepung ikan. Oodev (Oocyte developer) mengandung hormon PMSG dan anti dopamin. PMSG (Pregnant Mare Serum Gonadotropin) merupakan hormon sintesis glikoprotein yang disekresikan dari sel-sel tropoblas kuda yang di dalamnya terkandung Follicle Stimulating Hormone (FSH) dan
Luteinizing Hormone (LH). Anti dopamin merupakan senyawa kimia yang menghambat kerja dari dopamin. Indigofera zollingeriana merupakan tumbuhan yang termasuk dalam tanaman leguminosa yang tumbuh liar di daerah subtropis dan tropis yang memiliki kandungan nutrisi yang tinggi. Indigofera memiliki kandungan karotenoid tinggi. Karotenoid merupakan antioksidan yang dapat menahan lemak agar tidak teroksidasi sehingga pada proses vitelogenesis folikel akan mensintesa hormon steroid dan membawanya ke dalam gonad untuk mengalami perkembangan gonad. Tujuan dari penelitian ini adalah mengkaji peran induksi hormonal menggunakan hormon oodev dan pakan yang yang mengandung indigofera dalam proses mempercepat pematangan gonad ikangrass carp.
Penelitian ini dilakukan dengan memberikan hormon Oodev dengan dosis 0,5 mL kg-1bobot tubuh ikan. Pakan yang diberikan adalah pakan indigofera dan komersil. Pakan diberikan sebanyak 3% dari bobot tubuh ikan dengan frekuensi pemberian sebanyak tiga kali yaitu pada pagi, siang dan sore hari. Penelitian ini menggunakan rancangan acak lengkap (RAL) yang terdiri dari lima perlakuan dan tiga ulangan. Perlakuan yang diberikan terdiri dari NaCl fisiologis 0,5 mL kg-1 dan pakan komersil (PK), NaCl fisiologis 0,5 mL kg-1 dan pakan indigofera (PI), hormon Oodev 0,5 mL kg-1 bobot tubuh dan pakan komersil (Od+PK), Oodev 0,5 mL kg-1 bobot tubuh dan pakan indigofera (Od+PI), Oodev 0,5 mL kg-1 bobot tubuh dalam pakan indigofera (OdPI). Pemberian hormon dilakukan setiap dua minggu sekali melalui penyuntikan. Pemeliharaan ikan dilakukan selama 12 minggu.
Hasil penelitian menunjukkan bahwa terdapat pengaruh nyata (P<0,05) pada bobot tubuh ikan grass carp. Hal ini dipengaruhi kandungan protein pada pakan komersil yaitu sebasar 28,55% sedangkan pada pakan indigofera sebesar 21,64%. Selain itu juga dipengaruhi oleh perbedaan serat kasar dimana pada pakan indigofera sebesar 10,39% lebih tinggi dibandingkan dengan pakan komersil yaitu 2,34%. Hal ini dikarenakan kandungan protein daun indigofera lebih rendah dibandingkan dengan daun yang lebih muda.
(Oodev 0,5 mL kg bobot tubuh dalam pakan indigofera) yaitu sebesar 1180,6pg mL-1. Peningkatan ini terjadi dikarenakan FSH bekerja dalam perkembangan oosit dan diduga mempengaruhi biosintetis estradiol-17β. FSH mempengaruhi sel teka untuk mengeluarkan substrat androgen yaitu testosteron yang akan menyebar ke dalam sel granulosa. Selanjutnya, pada tempat yang khusus enzim cP450 aromatase mengkonversinya menjadi estradiol-17β dan menyebabkan hati mensintesis vitellogenin yang akan dibawa oleh aliran darah menuju oosit.
Pada akhir penelitian didapatkan bahwa indeks kematangan gonad, histologi gonad dan protein gonad tertinggi terdapat pada perlakuan OdPI (Oodev 0,5 mL kg-1 bobot tubuh dalam pakan indigofera). Hasil histologi gonad ikan
grass carp didapatkan bahwa perlakuan dengan menggunakan hormon Oodev pada pakan indigofera dan komersil mengalami perkembangan gonad. Perlakuan hormon Oodev dan pakan indigofera lebih banyak terdapat granul kuning telur sehingga memiliki tingkat kematangan gonad yang lebih lanjut dibandingkan dengan pakan komersil. Hal ini dikarenakan peran dari FSH dalam hormon Oodev yang mempengaruhi biosintesis estradiol-17β dan gonad mengalami perkembangan. Selain itu, pakan indigofera dengan karotenoid yang tinggi juga memberikan pengaruh proses vitelogenesis.
Berdasarkan hasil penelitian ini, didapatkan bahwa pemberian pakan indigofera tidak mempengaruhi pertambahan bobot tubuh, akan tetapi mempengaruhi perkembangan reproduksi ikan grass carp. Penggunaan pakan indigofera dengan hormon Oodev dapat meningkatkan kandungan estradiol-17β, meningkatkan indeks kematangan gonad, dan meningkatkan protein pada gonad. Pemberian hormon Oodev dan pakan indigofera mampu meningkatkan kematangan gonad lebih baik daripada pakan komersil.
DWI MULYASIH. Gonadal Maturational Induction of Grass carp
(Ctenopharyngodon idella) Using Premix Hormone Oodev and Indigofera
zollingeriana feed. Supervised by AGUS OMAN SUDRAJAT and LUKI
ABDULLAH.
Grass carpis herbivorous fish that has ability to handle blooming alga in fresh water such as lake. However its culture still has problems of the long period of spawning and the use commercial feed from fish meal. Oodev (oocyte developer) contains PMSG and dopamine antagonist. PMSG (Pregnant Mare Serum Gonadotropin) is a glycoprotein synthesis hormone, secreted by mare tropoblas cell which contains Follicle Stimulating Hormone (FSH) and Luteinizing Hormone (LH). Dopamine antagonist is a chemical that inhibits the action of dopamine. Indigofera zollingeriana is a legume plant grow in the subtropical and tropical regions with high nutrient. Indigofera contain high carotenoids. Carotenoids are antioxidant that can protect fat not to be oxidized so that follicle in vitellogenensis will synthesize steroid hormones and bring into gonad to undergo development of gonad. This research was aimed to examine the role of Oodev and indigofera feed to accelerate gonadal maturation ofgrass carp.
An experiment was conducted by giving Oodev hormone dose of 0.5 mL kg-1body weight of fish. Feed gave are indigofera feed and commercial feed. Feed was given 3% of body weight three times daily in the morning, afternoon and evening. The research was laid in randomize couple design (CRD), using five treatments with five fishes replication, which were PK (NaCl 0.5 mL kg-1 body weight + commercial feed), PI (NaCl 0.5 mL kg-1body weight + indigofera feed), Od+PK (Oodev 0.5 mL kg-1body weight + commercial feed), Od+PI (Oodev 0.5 mL kg-1 body weight + indigofera feed) and OdPI (Oodev 0.5 mL kg-1 body weight in indigofera feed). Hormone treatments carried out every two weeks by injection. Fish were reared for 12 weeks.
The results showed that there were significan effect was of treatment (P <0.05) found on body weight of grass carp fish. It may be influenced by the difference of protein content between commercial feed 28.55% and indigofera feed 21.64%. the body weight gain was also affected by different of crude fiber content in which indigofera feed 10.39% and commercial feed 2.34%. This protein containt of indigofera leaf was lower than those of younger leaf.
histology and protein contained in the highest gonadal hormone treatment OdPI (Oodev 0.5 mL kg-1 body weight in indigofera feed). Histologically gonad of grass carp showed progressive development as a consequence of Oodev with indigofera and commercial feed treatment. Treatmens Oodev with indigofera feed produced more yolk granule that have more mature gonad than comemersial feed. It was due to FSH in Oodev affecting biosynthesis estradiol-17β and gonad have development. In addition, indigofera feed contain high carotenoids influenced that vitellogenesis.
Present study demonstrated that administration of indigofera feed did not influence body weight gain, however induceed reproduction development ofgrass carp. Indigofera feed with Oodev hormone can increased the content of estradiol-17β, gonadosomatic index, and protein of gonad. Oodev hormone and feed indigofera able to increased the maturity of gonad better than commercial feed.
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
(Ctenopharyngodon idella) MENGGUNAKAN PREMIKS
HORMON OODEV DAN PAKAN
Indigofera zollingeriana
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Induksi Pematangan Gonad Ikan Grass Carp (Ctenopharyngodon
idella) Menggunakan Premiks Hormon Oodev dan Pakan
Indigofera zollingeriana
Nama : Dwi Mulyasih
NIM : C151130151
Disetujui oleh
Komisi Pembimbing
Dr Ir Agus Oman Sudrajat, MSc Ketua
Prof Dr Ir Luki Abdullah, MScAgr Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Segala puji syukur penulis panjatkan kepada Allah subhanahu wa ta’ala
atas segala karunia-Nya sehingga tesis yang berjudul“Induksi Pematangan Gonad Ikan Grass Carp (Ctenopharyngodon idella) Menggunakan Hormon dan Pakan
Indigofera zollingeriana” ini berhasil diselesaikan. Karya ilmiah ini bersumber dari hasil penelitian yang dilakukan pada bulan Desember 2014 hingga Mei 2015 bertempat di Balai Besar Perikanan Budidaya Air Tawar Sukabumi, Jawa Barat.
Selesainya karya ilmiah ini tidak luput dari bantuan dan dorongan berbagai pihak. Melalui prakata ini penulis menyempaikan ucapan terima kasih kepada Bapak Dr. Ir. Agus Oman Sudrajat, M.Sc dan Bapak Prof. Dr. Ir. Luki Abdullah, MSc. Agr selaku komisi pembimbing atas bimbingan, arahan, dukungan serta koreksinya yang sangat membangun. Terima kasih juga penulis sampaikan kepada Dr. Dinamella Wahjuningrum, S.Si, M.Si selaku dosen penguji tamu dan Ketua Program Studi Ilmu Akuakultur SPS IPB yang telah memberikan masukan dan saran dalam perbaikan penulisan tesis ini.
Terima kasih tak terhingga penulis ucapkan kepada Ayahanda Tunggul Maryono dan Ibunda Maryani serta kakak dan adik tercinta Dian Septiana, Danu Tri Hadi dan Dhea Yunita, keluarga besar Muhammad Diran dan Bachtiar atas segala doa, dukungan dan perhatiannya.
Terima kasih kepada Bapak Ir Yade Sukmajaya, M.Si selaku pembimbing lapang atas segala masukan dan koreksinya. Terima kasih kepada Bapak Ayi Santika, S.Pi, M.Si yang telah bersedia memberikan izin menggunakan fasilitasi laboratorium selama penelitian. Terima kasih kepada Alexander Burhani Marda, Sekar Ayu Chairunnisa, Asep Akmal Aonullah, Radhi Fadillah, Windu Sukendar, Bapak Ade Tatang, Bapak Eneng, Bapak Cipto, Ibu Mira, siswa siswi SUPM Pontianak dan SMK Pertanian Riau atas semua bantuannya selama penelitian. Terima kasih kepada seluruh rekan-rekan pascasarjana Ilmu Akuakultur angkatan 2013 atas segala kebersamaan dan semangatnya.
Akhir kata, semoga karya ilmiah ini bermanfaat bagi pembaca dan dapat mendukung kemajuan ilmu pengetahuan dalam bidang akuakultur di Indonesia.
Bogor, September 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis 3
2 METODE 4
Waktu dan Tempat Penelitian 4
Materi Penelitian 4
Rancangan Penelitian 4
Prosedur Penelitian 4
Parameter Pengamatan 5
Analisis Data 6
3 HASIL DAN PEMBAHASAN 7
Hasil 7
Pembahasan 13
4 SIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 18
LAMPIRAN 22
DAFTAR TABEL
1 Pertambahan bobot ikan grass carp selama masa pemeliharaan yang diberi perlakuan premiks hormon Oodev dan pakanIndigofera zollingeriana 8 2 Hasil proksimat pakan indigofera dan pakan komersil yang digunakan
selama pemeliharaan 8
3 Kualitas air selama masa pemeliharaan ikangrass carp 13
DAFTAR GAMBAR
1 Mekanisme kerja premiks hormon Oodev dan pakan indigofera 3 2 Konsentrasi estradiol-17β pada plasma darah ikan grass carp yang diberi perlakuan premiks hormon Oodev dan pakanIndigofera zollingeriana 7 3 Nilai indeks kematangan gonad pada ikan grass carp pada awal dan akhir pemeliharaan yang diberi perlakuan premiks hormon Oodev dan pakan
Indigofera zollingeriana 9
4 Nilai hepatosomatic index pada ikan grass carp pada awal dan akhir pemeliharaan yang diberi perlakuan premiks hormon Oodev dan pakan
Indigofera zollingeriana 9
5 Sruktur gonad ikangrass carp pada akhir pemeliharaan yang diberi perlakuan premiks hormon Oodev dan pakanIndigofera zollingeriana 10 6 Histologi gonad ikangrass carppada akhir pemeliharaan yang diberi perlakuan premiks hormon Oodev dan pakanIndigofera zollingeriana 11 7 Kandungan protein gonad ikangrass carppada akhir pemeliharaan yang diberi perlakuan premiks hormon Oodev dan pakanIndigofera zollingeriana 12 8 Kandungan lemak gonad ikangrass carp pada akhir pemeliharaan yang diberi perlakuan premiks hormon Oodev dan pakanIndigofera zollingeriana 12
DAFTAR LAMPIRAN
1 Prosedur pengukuran hormon Estradiol 22
2 Prosedur histologi 22
Latar Belakang
Ikan grass carp (Ctenopharyngodon idella) merupakan salah satu komoditas perairan tawar yang memiliki peranan penting untuk menangani
blooming alga yang terjadi di perairan tawar tertutup seperti danau. Hal ini dikarenakan ikan grass carp merupakan ikan herbivor yang makanannya berupa makrofita seperti rumput, makroalga dan mikroalga (Cudmore dan Mandrak 2004, Mitchell dan Kelly 2006). Namun, dalam ketersediaan benih grass carp di Indonesia masih mengalami kendala. Salah satu kendalanya adalah lamanya waktu pemijahan ikan grass carp pada kegiatan budi daya yang terjadi hanya sekali dalam setahun.
Mekanisme sistem reproduksi ikan umumnya melibatkan hypothalamus, pituitari dan gonad. Proses reproduksi ikan umumnya terkait dengan hormon
Gonadotropin Releasing Hormone(GnRH) yang disekresikan oleh hypothalamus untuk menstimulasi Gonadotropin Hormone (GTH) yang terdiri dari Folicle Stimulating Hormone (FSH) dan Luteinizing Hormone (LH) yang disekresikan dari pituitari (Sherwood dan Adam 2005). Secara alamiah proses ini bisa terjadi di lingkungan alami. Namun, sulit terjadi ketika ikan sudah berada dalam lingkungan budi daya. Perbedaan lingkungan tempat hidup dan makanan yang dimakan dapat membatasi ikan untuk melakukan reproduksi. Selain itu, pengaruh lingkungan menyebabkan dopamin tersekresi dari hypotalamus yang menghambat sekresi GnRH sehingga proses maturasi tidak terjadi dan menyebabkan ikan tidak melakukan pemijahan (Yaron et al. 2011). Hal ini juga yang terjadi pada ikan
grass carp.
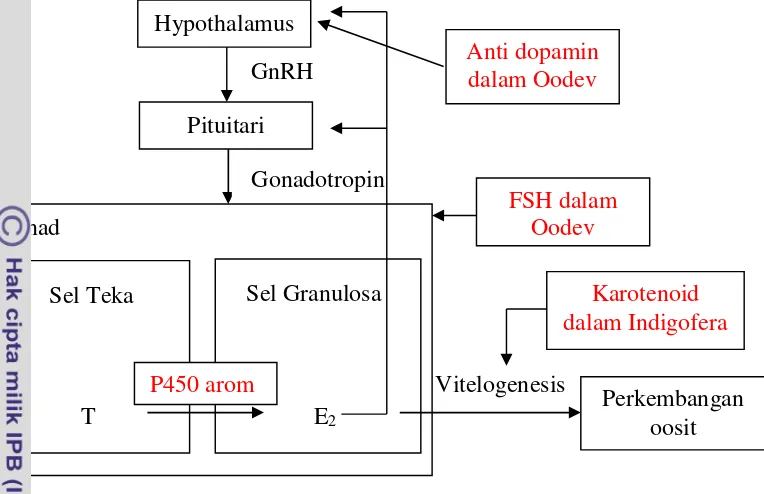
Induksi pematangan gonad dengan menggunakan hormon merupakan salah satu cara untuk mempercepat pematangan gonad pada ikan grass carp. Hormon Oodev (Oocyte developer) merupakan hormon yang di dalamnya terkandung PMSG dan anti dopamin. PMSG (Pregnant Mare Serum Gonadotropin) merupakan hormon sintesis glikoprotein yang disekresikan dari sel-sel tropoblas kuda yang di dalamnya terkandung Follicle Stimulating Hormone (FSH) dan Luteinizing Hormone (LH) (Moore dan Ward 1980). FSH dan LH merupakan kunci yang mengatur reproduksi (Aizen et al. 2012). Anti dopamin merupakan senyawa kimia yang menghambat kerja dari dopamin. Pada ikan, dopamin dapat menghambat tahapan akhir pada regulasi neuroendokrin yang merupakan tahap akhir dari gametogenesis yaitu pematangan oosit akhir dan ovulasi pada jantan dan betina (Dufouret al. 2010).
hormon Oodev. Selain itu hasilnya signifikan terjadi kematangan gonad lebih cepat, meningkatkan kuantitas serta kualitas telur dan larva ikan lele (Nainggolan
et al.2014).
Ikan grass carp merupakan ikan herbivora, namun dalam budi dayanya masih menggunakan pakan komersil yang berbahan dasar tepung ikan. Penggunaan pakan komersil memiliki harga yang cukup tinggi untuk grass carp
yang merupakan ikan herbivora. Selain itu, buangan feses dan pakan yang tidak termakan dari pakan komersil menyebabkan pencemaran air meningkat. Oleh karena itu, perlu dicari alternatif bahan lain yang dapat digunakan untuk memenuhi kebutuhan pakan induk grass carp yang memiliki protein sesuai dengan kebutuhannya. Salah satunya adalah menggunakan tumbuhan Indigofera zollingeriana.
Tumbuhan Indigofera zollingeriana merupakan tumbuhan leguminosa yang tumbuh liar di daerah subtropis dan tropis. Indigofera memiliki nutrisi yang tinggi, kandungan proteinnya bisa mencapai 31,31% (Abdullah dan Suharlina 2010, Abdullahet al. 2012b). Selain itu indigofera juga memiliki kandungan asam amino yang lengkap, kalsium, pospor, kalium, dan karotenoid (Akbarillah et al. 2002, Abdullahet al. 2012b, Palupi et al. 2014). Indigofera dapat meningkatkan produksi susu dan mengurangi penggunaan pakan komersil pada kambing (Abdullah et al. 2012a). Selain itu pemberian pakan indigofera menghasilkan kualitas telur burung puyuh (Akbarillahet al. 2008), itik (Akbarillahet al. 2010), dan ayam (Palupiet al. 2014, Palupi 2015) lebih baik serta kaya akan antioksidan dan vitamin dibandingkan dengan yang tidak diberikan. Pemberian pakan yang mengandung indigofera belum pernah dilakukan pada ikan. Oleh karena itu, pemberian hormon Oodev dan pakan indigofera yang memiliki kandungan nutrisi yang tinggi dari tumbuhan diharapkan dapat mempercepat pematangan gonad ikan
grass carp. Selain itu pemberian pakan yang mengandung indigofera diharapkan dapat mengurangi penggunaan pakan komersil yang mengandung tepung ikan tepung dan harga yang tinggi pada ikan grass carp serta dapat mengurangi pencemaran air pada lingkungan budi daya.
Perumusan Masalah
Periode waktu pematangan gonad pada induk ikangrass carp merupakan satu kendala dalam memenuhi kegiatan budidaya grass carp. Salah satu cara untuk mengatasinya adalah dengan melakukan manipulasi secara hormonal dan pakan untuk mempercepat pematangan gonad grass carp. Anti dopamin (AD) akan memblok dopamin yang terdapat pada otak sehingga Gonadotropin Releasing Hormone(GnRH) dapat terilis menuju pituitari. Pituitari mensekresikan
Gonadotropin Hormone (GtH) yaitu FSH dan LH yang akan mensintesis hormon
Sehingga pada proses vitelogenesis, folikel akan mensintesa hormon steroid dan membawanya ke dalam gonad untuk selanjutnya mengalami perkembangan oosit.
Gambar 1 Mekanisme kerja premiks hormon Oodev dan pakan indigofera (Modifikasi Rafiuddin 2014).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji peran induksi hormonal menggunakan hormon oodev dan pakan yang mengandung indigofera dalam mempercepat proses pematangan gonad ikangrass carp.
Manfaat Penelitian
Manfaat dari penelitian ini adalah untuk menyediakan informasi lebih rinci tentang peran hormon Oodev dan pakan indigofera dalam mempercepat pematangan gonad pada ikangrass carp.
Hipotesis
Induksi hormonal dengan menggunakan hormon Oodev dan pakan indigofera mampu mempercepat pematangan gonad ikangrass carp.
Hypothalamus
GnRH A
Vitelogenesis Pituitari
Gonadotropin
Gonad
Sel Teka Sel Granulosa
T E2
P450 arom
Anti dopamin dalam Oodev
FSH dalam Oodev
Perkembangan oosit
2 METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Desember 2014 sampai bulan Mei 2015. Penelitian dilakukan di Balai Besar Perikanan Budidaya Air Tawar Sukabumi, Jawa Barat. Analisis profil hormon dilakukan di Laboratorium Penelitian Integrasi Fakultas Kedokteran Hewan, Universitas Syiah Kuala. Histologi gonad dilakukan di Laboratorium Hispatologi Kedokteran Hewan IPB. Uji proksimat pakan dan gonad dilakukan di Pusat Penelitian Sumber Daya Hayati dan Bioteknologi IPB.
Materi Penelitian
Bahan yang digunakan dalam penelitian ini adalah induk ikan grass carp
betina, hormon dan pakan. Induk ikan grass carp betina yang digunakan berasal dari Balai Besar Pengembangan Budidaya Air Tawar Sukabumi dengan bobot rata-rata 3,22±0,42 kg sebanyak 25 ekor. Sedangkan hormon yang digunakan dalam penelitian adalah hormon Oodev dengan dosis 0,5 mL kg-1 bobot tubuh ikan. Pakan yang digunakan adalah pakan indigofera dan pakan komersil.
Rancangan Penelitian
Pada penelitian ini menggunakan rancangan acak lengkap (RAL) dengan ulangan individu 5 ekor. Adapun rancangan perlakuan dapat dijelaskan sebagai berikut.
NaCl fisiologis 0,5 mL kg-1bobot tubuh + pakan komersil (PK) NaCl fisiologis 0,5 mL kg-1bobot tubuh + pakan indigofera (PI) Oodev 0,5 mL kg-1bobot tubuh + pakan komersil (Od+PK) Oodev 0,5 mL kg-1bobot tubuh + pakan indigofera (Od+PI) Oodev 0,5 mL kg-1bobot tubuh dalam pakan indigofera (OdPI)
Prosedur Penelitian
Persiapan wadah
Tempat pemeliharaan digunakan pada ikan grass carp adalah kolam permanen. Kolam permanen yang digunakan diberi waring dengan ukuran 2x2x1 m dengan ketinggian 70-80 cm. Air kolam berasal dari aliran sungai yang sudah mengalami penyaringan.
Pemeliharaan induk ikanGrass carp
masing-masing. Setelah itu dilakukan pemeliharaan dengan perlakuan selama tiga bulan.
Penyuntikan Hormon
Penyuntikan hormon pada induk grass carp dilakukan secara
intramuscullar pada otot punggung. Penyuntikan dilakukan setiap dua minggu sekali selama 12 minggu pemeliharaan. Selama masa pemeliharaan induk juga diberi pakan komersil dan indigofera. Pakan diberikan sebanyak 3% dari bobot tubuh ikangrass carp. Pemberian pakan dilakukan sebanyak tiga kali sehari.
Pemberian Hormon dalam Pakan
Pemberian hormon Oodev dalam pakan indigofera adalah dengan cara disemprotkan ke pakan. Hormon Oodev yang digunakan sebanyak 0,5 mL kg-1 bobot tubuh dimasukkan ke dalam wadah kemudian dicampurkan NaCl fisiologis dan putih telur sebanyak 10% dari total pakan yang diberikan. Setelah itu disemprotkan ke dalam pakan indigofera. Pemberian hormon dalam pakan ini dilakukan setiap dua minggu sekali.
Pembuatan Pakan Indigofera
Bahan yang digunakan dalam pembuatan tepung indigofera adalah tanaman Indigofera zollingeriana. Tanaman ini diperoleh dari Pusat Penelitian Tanaman Fakultas Peternakan Institut Pertanian Bogor. Bagian tanaman yang digunakan dalam pembuatan pakan ini adalah bagian daun dan batang daun yang dipilih kemudian dilakukan pengeringan selama dua hari. Setelah itu dilakukan penepungan danpelleting. Prosespelleting indigofera ditambahkanbindertepung sagu dan minyak ikan sebanyak 30 g kg-1dari tepung indigofera (Darwisito et al. 2008).
Pengambilan Sampel Gonad, Hati dan Darah
Pengambilan sampel gonad dan hati untuk mengamati dan menganalisa tingkat indeks kematangan gonad (IKG) dan hepatosomatic index (HSI). Sampel gonad dan hati diambil satu ekor pada awal penelitian mewakili seluruh perlakuan. Kemudian satu ekor setiap perlakuan pada akhir penelitian. Selain itu terdapat pengambilan sampel darah pada ikan grass carp yang dilakukan setiap dua minggu sekali untuk menganalisa profil hormon. Darah diambil dari tiga ekor ikan setiap perlakuan dengan volume darah satu mL dari setiap ekor ikan grass carpdan dijadikan satu setiap perlakuan.
Parameter Pengamatan
Konsentrasi Estradiol
Pertambahan Bobot
Pengukuran bobot ini dilakukan pada induk yang digunakan dalam penelitian. Untuk pengukuran pertambahan bobot pada induk menggunakan persamaan sebagai berikut.
PB = Bt–B0
Keterangan :
PB : Pertambahan Bobot
Bt : bobot rata-rata ikangrass carppada saat pengamatan B0 : bobot rata-rata ikangrass carppada awal penelitian
Indeks Kematangan Gonad (IKG)
IKG = (Berat gonad ikan : Bobot tubuh ikan) x 100
Hepatosomatic Indeks(HSI)
HSI = (Berat hati ikan : Bobot tubuh ikan) x 100
Histologi Gonad
Histologi gonad dilakukan untuk mengamati gonad secara mikroskopis. Histologi gonad dilakukan dengan menggunakan pewarnaan hematoksilin dan eosin (H&E) (Lampiran 2).
Proksimat Gonad
Proksimat gonad dilakukan unutk mengetahui berapakah kandungan protein dan lemak yang terdapat pada gonad ikan grass carp pada setiap perlakuan. Proksimat gonad dilakukan pada akhir penelitian (Lampiran 3).
Kualitas Air
Parameter kualitas air yang diukur selama masa penelitian adalah suhu, oksigen terlarut (DO), pH, salinitas dan amonia yang dilakukan pada awal, tengah dan akhir penelitian.
Analisis Data
3 HASIL DAN PEMBAHASAN
Hasil
Konsentrasi Estradiol-17β
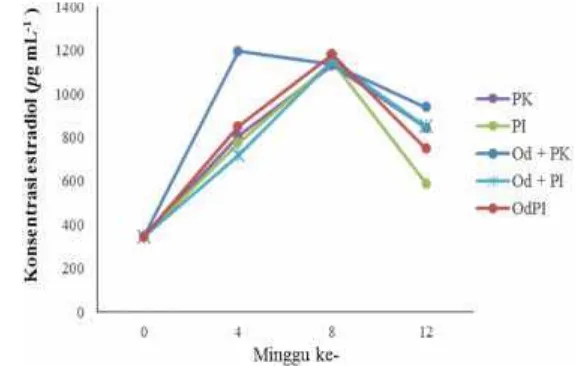
Pengukuran konsentrasi estradiol-17β pada plasma darah ikan grass carp, menggunakan metode ELISA (Lampiran 1). Pengukuran konsentrasi Estradiol dilakukan pada minggu ke 0, 4, 8 dan 12 (Gambar 2).
Keterangan: PK (NaCl 0,5 mL kg-1+ pakan komersil); PI (NaCl 0,5 mL kg-1+ pakan indigofera);
Od+PK (Oodev 0,5 mL kg-1bobot tubuh + pakan komersil); Od+PI (Oodev 0,5 mL
kg-1bobot tubuh+ pakanindigofera); OdPI (Oodev 0,5 mL kg-1pakan indigofera).
Gambar 2 Konsentrasi estradiol-17β pada plasma darah ikan grass carp yang diberi perlakuan premiks hormon Oodev dan pakan Indigofera zollingeriana
Pada minggu ke 0, konsentrasi estradiol-17β sebesar 344,6 pg mL-1. Pada minggu ke 4 dan ke 8 konsentrasi estradiol-17β mengalami peningkatan. Kandungan konsentrasi estradiol-17β pada plasma darah ikan grass carp pada minggu ke 4 secara berturut-turut dari yang tertinggi yaitu perlakuan hormon Od+PK yaitu 1194,8pg mL-1, OdPI yaitu 850,8pg mL-1, PK yaitu 806,5pg mL-1, PI yaitu 776,4 pg mL-1 dan konsentrasi teredah terdapat pada perlakuan Od+PI yaitu 720,5 pg mL-1. Selanjutnya pada minggu ke 8 secara berturut-turut konsentrasi estradiol-17β dari yang tertinggi terdapat pada perlakuan OdPI 1180,6
Pertambahan Bobot IkanGrass carp
Pengukuran bobot tubuh ikan grass carp dilakukan setiap dua minggu sekali. Setiap pengambilan sampel terdapat peningkatan bobot tubuh. Berdasarkan pertambahan bobot mutlak, yang memiliki nilai tertinggi terdapat pada perlakuan pakan komersil setelah itu diikuti dengan pakan indigofera (Tabel 1).
Tabel 1 Pertambahan bobot ikan grass carp selama masa pemeliharaan yang diberi perlakuan premiks hormon Oodev dan pakan Indigofera zollingeriana
Keterangan: PK (NaCl 0,5 mL kg-1+ pakan komersil); PI (NaCl 0,5 mL kg-1+ pakan indigofera);
Od+PK (Oodev 0,5 mL kg-1bobot tubuh + pakan komersil); Od+PI (Oodev 0,5 mL
kg-1bobot tubuh+ pakan indigofera); OdPI (Oodev 0,5 mL kg-1pakan indigofera).
Huruf superskrip yang berbeda menunjukkan perbedaan yang nyata (P<0,05) antara perlakuan.
Berdasarkan hasil pertambahan bobot ikan grass carp, didapatkan bahwa penggunaan pakan indigofera memiliki nilai yang masih dibawah pakan komersil. Hal ini disebabkan adanya perbedaan kandungan protein dan serat kasar yang terdapat pada masing-masing pakan (Tabel 2).
Tabel 2 Hasil proksimat pakan indigofera dan pakan komersil yang digunakan selama pemeliharaan
GE (kkal 100 g-1pakan) 355,86 394,29
Keterangan: GE: gross energy, 1 g protein=5,6 kkal GE, 1 g karbohidrat=4,1 kkal GE, 1 g lemak=9,4 kkal GE.
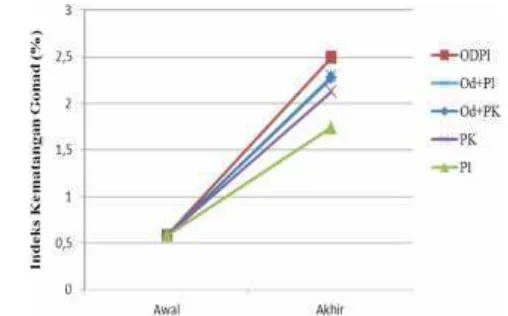
Indeks Kematangan Gonad (IKG)
2,29%. Lalu diikuti perlakuan induksi hormon Oodev yang diberi pakan komersil (Od+PK) yaitu 2,27%. Setelah itu perlakuan kontrol dengan pakan komersil (PK) yaitu 2,13%. Lalu nilai IKG terkecil terdapat pada perlakuan kontrol dengan pakan indigofera (PI) yaitu 1,74% (Gambar 3).
Keterangan: PK (NaCl 0,5 mL kg-1+ pakan komersil); PI (NaCl 0,5 mL kg-1+ pakan indigofera);
Od+PK (Oodev 0,5 mL kg-1bobot tubuh + pakan komersil); Od+PI (Oodev 0,5 mL
kg-1bobot tubuh+ pakanindigofera); OdPI (Oodev 0,5 mL kg-1pakan indigofera).
Gambar 3 Nilai indeks kematangan gonad pada ikangrass carp pada awal dan akhir pemeliharaan yang diberi perlakuan premiks hormon Oodev dan pakanIndigofera zollingeriana
Hepatosomatic Indeks(HSI)
Keterangan: PK (NaCl 0,5 mL kg-1+ pakan komersil); PI (NaCl 0,5 mL kg-1+ pakan indigofera);
Od+PK (Oodev 0,5 mL kg-1bobot tubuh + pakan komersil); Od+PI (Oodev 0,5 mL
kg-1bobot tubuh+ pakanindigofera); OdPI (Oodev 0,5 mL kg-1pakan indigofera).
Gambar 4 Nilaihepatosomatic indexpada ikangrass carp pada awal dan akhir pemeliharaan yang diberi perlakuan premiks hormon Oodev dan pakanIndigofera zollingeriana
dengan pakan komersil (PK) yaitu 2,81%. Perlakuan induksi hormon Oodev dengan pakan komersil (Od+PK) yaitu 2,25%. Perlakuan hormon Oodev yang dicampurkan ke dalam pakan indigofera (OdPI) yaitu 2,07%. Perlakuan kontrol dengan pakan indigofera (PI) yaitu 1,69% dan perlakuan induksi hormon Oodev dengan pakan indigofera (Od+PI) yaitu 1,60% (Gambar 4).
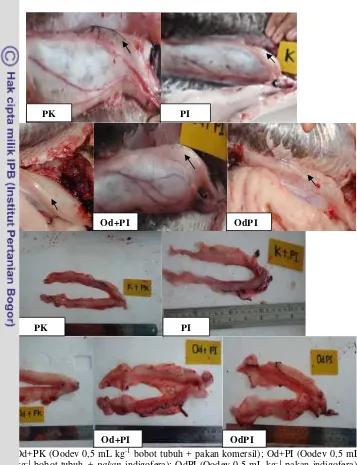
Struktur Gonad
Keterangan: Od+PK (Oodev 0,5 mL kg-1bobot tubuh + pakan komersil); Od+PI (Oodev 0,5 mL
kg-1 bobot tubuh+ pakanindigofera); OdPI (Oodev 0,5 mL kg-1pakan indigofera);
PK (NaCl 0,5 mL kg-1+ pakan komersil); PI (NaCl 0,5 mL kg-1+ pakan indigofera).
Gambar 5 Sruktur gonad ikan grass carp pada akhir pemeliharaan yang diberi perlakuan premiks hormon Oodev dan pakanIndigofera zollingeriana
Pada akhir penelitian dilakukan pembedahan untuk mengetahui perbedaan gonad ikan grass carp dari setiap perlakuan yang diberikan. Adapun perbedaan
Od+PK Od+PI OdPI
PK PI
Od+PK Od+PI OdPI
perkembangan gonad pada ikangrass carpsetiap perlakuannya dapat dilihat pada Gambar 5.
Histologi Gonad
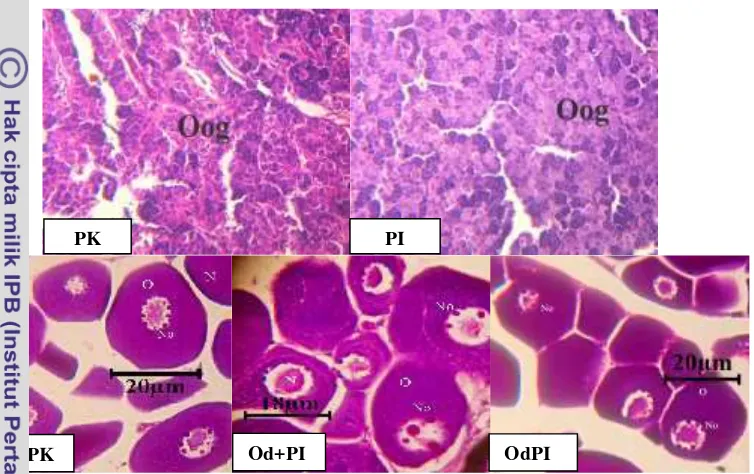
Pada akhir penelitian diambil gonad ikan untuk dilakukan uji histologi. Dari hasil histologi didapatkan bahwa perlakuan yang diberikan hormon Oodev baik secara induksi maupun melalui pakan mengalami perkembangan gonad. Sedangkan pada perlakuan kontrol gonad tidak berkembang (Gambar 6).
Keterangan: Od+PK (Oodev 0,5 mL kg-1 bobot tubuh + pakan komersil); Od+PI (Oodev 0,5 mL
kg-1bobot tubuh + pakan indigofera); OdPI (Oodev 0,5 mL kg-1 pakan indigofera);
PK (NaCl 0,5 mL kg-1+ pakan komersil); PI (NaCl 0,5 mL kg-1+ pakan indigofera).
Gambar 6 Histologi gonad ikan grass carp pada akhir pemeliharaan yang diberi perlakuan premiks hormon Oodev dan pakan Indigofera zollingeriana
(perbesaran mikroskop 40x10) (N:Nukleus, No:Nukleolus, O:Ooplasma, Oog:Oogonia).
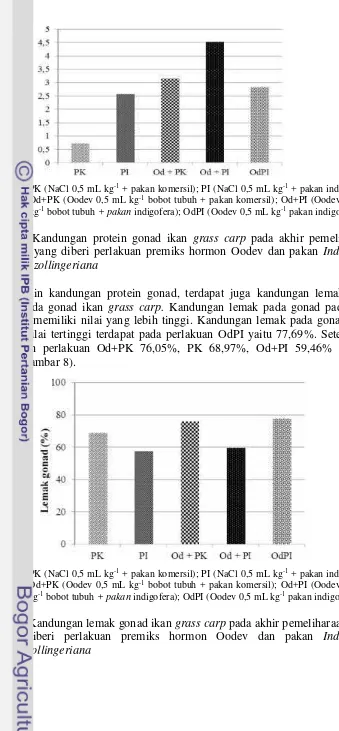
Proksimat Gonad
Berdasarkan hasil proksimat gonad ikan grass carp, didapatkan bahwa kandungan protein tertinggi terdapat pada gonad dengan perlakuan induksi hormon Oodev dengan pakan indigofera (Gambar 7). Adapun kandungan protein pada gonad ikan grass carp dari yang tertinggi hingga terendah secara berturut-turut adalah induksi hormon Oodev dengan pakan indigofera (Od+PI) 4,53%, induksi hormon Oodev dengan pakan komersil (Od+PK) 3,16%, hormon Oodev dalam pakan indigofera (OdPI) 2,83%, kontrol dengan pakan indigofera (PI) 2,57% dan kontrol dengan paka komersil (PK) 0,73%.
Od+PI
PK PI
OdPI
Keterangan: PK (NaCl 0,5 mL kg-1+ pakan komersil); PI (NaCl 0,5 mL kg-1+ pakan indigofera);
Od+PK (Oodev 0,5 mL kg-1bobot tubuh + pakan komersil); Od+PI (Oodev 0,5 mL
kg-1bobot tubuh+ pakanindigofera); OdPI (Oodev 0,5 mL kg-1pakan indigofera).
Gambar 7 Kandungan protein gonad ikan grass carp pada akhir pemeliharaan yang diberi perlakuan premiks hormon Oodev dan pakan Indigofera zollingeriana
Selain kandungan protein gonad, terdapat juga kandungan lemak yang terdapat pada gonad ikan grass carp. Kandungan lemak pada gonad pada ikan
grass carp memiliki nilai yang lebih tinggi. Kandungan lemak pada gonad yang memiliki nilai tertinggi terdapat pada perlakuan OdPI yaitu 77,69%. Setelah itu diikuti oleh perlakuan Od+PK 76,05%, PK 68,97%, Od+PI 59,46% dan PI 57,62% (Gambar 8).
Keterangan: PK (NaCl 0,5 mL kg-1+ pakan komersil); PI (NaCl 0,5 mL kg-1+ pakan indigofera);
Od+PK (Oodev 0,5 mL kg-1 bobot tubuh + pakan komersil); Od+PI (Oodev 0,5 mL
kg-1bobot tubuh+ pakanindigofera); OdPI (Oodev 0,5 mL kg-1pakan indigofera).
Kualitas Air
Kualitas air selama masa pemeliharaan tidak jauh berbeda pada setiap pengambilan sampel. Adapun parameter kualitas air yang diukur adalah suhu, kelarutan oksigen (DO), pH dan amonia (Tabel 3).
Tabel 3 Kualitas air selama pemeliharaan ikangrass carp
Parameter Kisaran kualitas air Standar
Suhu (oC) 24,23 - 24,87 21 - 30 (Messer 2002)
Oksigen terlarut (ppm) 1,01 - 3,76 5 (Boyd 2013)
pH 5,22 - 6,77 6,9 - 9 (Boyd 2013)
TAN (ppm) 0,49 - 0,91 < 1 (Boyd 2013)
Pembahasan
Induksi hormon Oodev pada ikan grass carp dapat mempengaruhi konsentrasi estradiol-17β. Pada Gambar 2 dapat dilihat bahwa perlakuan Od+PK memiliki laju peningkatan konsentrasi estradiol-17β tertinggi pada minggu ke-4 yaitu sebesar 1194,8 pg mL-1 dibandingkan dengan perlakuan lainnya. Pada minggu ke-8, konsentrasi estradiol-17β paling tinggi terdapat pada perlakuan OdPI yaitu sebesar 1180,6 pg mL-1. Dan pada akhir penelitian terjadi penurunan konsentrasi estradiol-17β. Meningkatnya konsentrasi estradiol-17β pada plasma darah ikan grass carp dipengaruhi oleh hormon Oodev. Berdasarkan penelitan sebelumnya, penggunaan hormon Oodev sebanyak 0,5 mL kg-1bobot tubuh dapat meningkatkan konsentrasi estradiol pada minggu kedua pada ikan tor soro (Farastuti 2014). Selain itu penggunaan PMSG dan anti dopamin dapat meningkatkan konsentrasi estradiol-17β pada plasma darah ikan belut (Putra 2013), ikan patin (Rachman 2013) dan ikan lele (Nainggolan et al. 2014). Peningkatan konsentrasi estradiol-17β pada beberapa penelitian tersebut juga terjadi pada ikangrass carp.
Hormon Oodev mempengaruhi peningkatkan konsentrasi estradiol-17β pada plasma darah ikan grass carp. Peningkatan konsentrasi estradiol-17β tersebut dikarenakan FSH bekerja dalam perkembangan oosit dan diduga mempengaruhi biosintetis estradiol-17β (Kobayashi et al. 2002, Nagahama dan Yamashita 2008). FSH mempengaruhi sel teka untuk mengeluarkan substrat androgen yaitu testosteron yang akan menyebar ke dalam sel granulosa. Selanjutnya, pada tempat yang khusus enzim cP450 aromatase mengkonversinya menjadi estradiol-17β (Senthilkumaran et al. 2004, Nagahama dan Yamashita 2008). Peningkatan level plasma estradiol-17β menyebabkan hati mensintesis vitelogenin kemudian dibawa oleh aliran darah menuju oosit (Nagahama et al. 1993, Kobayashiet al. 1996).
Anti dopamin yang terdapat pada hormon Oodev mempengaruhi kinerja dopamin yang terdapat pada ikangrass carp. Anti dopamin menghambat dopamin di pituitari sehingga GTH terilis (Yu dan Peter 1990, Dufour et al. 2010, Isomura
et al. 2013). Sehingga GTH dapat mengontrol sintesis estradiol-17β di ovari (Senthilkumaran et al. 2004). Dopamin merupakan salah satu neurontrasmiter ketokelamin yang dapat menghambat sekresi LH pada famili cyprinidae(Dufour
Oodev berfungsi untuk memblok dopamin agar GnRH dapat merilis GTH (FSH dan LH) di pituitari. Selain itu, anti dopamin dapat menyebabkan reflek pada daerah preoptik yang dapat memutuskan sintesis rantai peptida GnRH sehingga dapat meningkatkan LH pada akhir maturasi (Podhore dan Kouril 2009).
Pemberian pakan komersil dan pakan indigofera mempengaruhi pertambahan bobot pada ikangrass carp. Pertambahan bobot ikangras carplebih tinggi pada perlakuan dengan menggunakan pakan komersil dibandingan dengan pakan indigofera (Tabel 1). Kandungan protein pada pakan komersil yang digunakan dalam penelitian ini sebesar 28,55% lebih tinggi dibandingkan dengan pakan indigofera yang digunakan yaitu 21,64%. Kandungan serat kasar pada pakan indigofera lebih tinggi yaitu sebesar 10,39% dibandingkan dengan pakan komersil yaitu 2,34%.
Rendahnya kandungan protein pada pakan indigofera dan tingginya serat kasar ini diduga karena umur indigofera yang terlalu tua pada saat pemanenan. Semakin tua umur tanaman indigofera maka akan menyebabkan berkurangnya protein dan meningkatkan serat kasar. Selain itu bagian tanaman indigofera yang digunakan terdapat batang daun yang menyebabkan serat kasar menjadi tinggi. Bagian pucuk tanaman indigofera memiliki nutrien yang lebih baik jika dibandingkan dengan bagian lainnya (Palupiet al. 2014, Palupi 2015). Meskipun pada indiogfera memiliki kandungan protein yang rendah dibandingkan dengan pakan komersil, namun jika dicampurkan dengan hormon Oodev pakan indigofera memiliki pengaruh yang lebih baik terhadap perkembangan gonad ikan grass carp.
Pakan pada umumnya memiliki komponen terbesar yang terdiri dari karbohidrat, protein dan lemak. Komponen tersebut dicerna dan diserap menjadi komponen yang lebih kecil untuk selanjutnya mengalami katabolisme menjadi Asetil-KoA. Asetil-KoA dengan bantuan ATP selanjutnya diubah menjadi kolesterol dengan proses kolesterogenesis untuk selanjutnya diubah menjadi steroid melalui proses steroidogenesis (Mayes dan Bender 2003). Pada proses steroidogenesis. FSH dan LH pada hormon Oodev mempengaruhi kerja ATP dimana akan diubah menjadi menjadi cyclic adenosine monophosphate (cAMP). ATP diubah menjadi cAMP karena dikataslis oleh protein kinase A (PKA). PKA juga akan mempengaruhi kolesterol ester hidrolase sehingga menjadi kolesterol bebas. Kolesterol bebas inilah yang dibawa ke mitokondria untuk mengalami proses perkembangan gonad dan kematangan gonad. Di dalam mitokondria, kolesterol bebas disintesis dengan enzim P450scc kemudian diubah menjadi pregnenolon. Pregnenolon selanjutnya diubahmenjadi 17α-hydroxypregnenolone dengan bantuan enzim P450c17. Selanjutrnya dengan enzim 3β-HSD diubah menjadi 17α-hydroxyprogesteron yang kemudian diubah menjadi androstenedion. Dengan enzim 17β-HSD, androstenedion diubah menjadi testosteron. Setelah itu diubah oleh enzim P450 arom menjadi estradiol-17β selanjutnya mengalami vitelogenenis dan mengalami perkembangan oosit (Kobayashi et al. 1996, Young
et al. 2005).
indigofera memiliki kandungan karotenoid dan xanthophyl (Akbarillah et al. 2002). Karotenoid merupakan salah satu hasil sintesis yang umumnya tidak dapat dihasilkan oleh hewan (Cazzoneli 2011, Khoo et al. 2011). Xanthophyl merupakan salah satu karotenoid yang bersifat oksidatif. Xanthophyl merupakan atom oksigen dari karotenoid (Duttaet al. 2005). Karotenoid sangat penting untuk perkembangan normal pada embrio dan larva ikan (Izquerdo et al. 2001). Pakan yang mengandung antioksidan sangat dibutuhkan ikan selama reproduksi. Antioksidan seperti vitamin E dan C pada pakan induk ikan dapat menurunkan persentase telur abnormal dan meningkatkan fekuditas. Jika kurang dapat menyebabkan gonad ikan tidak matang dan menurunkan derajat tetas telur (Izquerdo et al. 2001). Pada burung, antioksidan pada karotenoid sangat penting dalam perkembangan embrio dan penetasan telur (Surai et al. 2001, Biard et al. 2005). Selain itu, antioksidan yang terdapat dalam karotenoid juga dapat meningkatkan respon imun pada tubuh dan melindungi ikan mas dari serangan penyakit Aeromonas hydrophilla (Eldahshan dan Singab 2013, Anbazahan et al. 2014).
Pada lobster air tawar, karotenoid berasosiasi dengan lipoprotein dari vitelin (Sagi et al. 1995). Pada ikan, karotenoid terdapat pada butiran minyak (partikel kilomikra) atau berasosiasi dengan lipoprotein (Lubzens et al. 2010). Karotenoid diserap melalui dinding usus dan dikirim bersama lemak dan vitamin yang larut lemak. Karotenoid dipecah menjadi unit retinal dikirim ke organ hati melalui sistem limfa dan peredaran darah dalam bentuk fragmen kilomikron (Tanaka et al. 2012). Setelah disintesis di hati, kemudian dibawa melalui plasma darah dengan lipoprotein menuju ovari (Palupi et al. 2014, Palupi 2015). Plasma kareteniod seperti xanthophyl dapat dipecah oleh sel ovari dan dapat membantu retinol pada proses vitelogenin bersama dengan lipoprotein untuk perkembangan oosit (Lubzenset al. 2010).
Pengambilan sampel gonad dilakukan untuk melihat perkembangan gonad ikangrass carp. Pada Gambar 3 dan 4 nilai indeks kematangan gonad (IKG) dan
Hasil histologi gonad ikan grass carp pada akhir penelitian didapatkan bahwa perlakuan dengan menggunakan hormon Oodev mengalami perkembangan dibandingkan dengan perlakuan yang tidak diberikan hormon Oodev. Hal ini terlihat pada Gambar 6 yaitu perlakuan yang diberikan hormon Oodev terdapat intisel yang sudah mengalami perkembangan awal vitelogenin dibandingkan dengan perlakuan kontrol. Berdasarkan perbandingan histologi gonad dari Koçet al. (2008) dan Lee et al. (2012), perlakuan Od+PK, OdPI dan Od+PI pada oosit terdapat ooplasma basofil dan sudah mengadung butiran lemak. Menurut Santos
et al. (2005), pada fase tersebut sudah termasuk fase ke tiga yaitu fase oosit perinukleus. Pada perlakuan kontrol belum terbentuk oosit dan masih dalam tahap pembentukan sel awal oogonia. Menurut Reidel et al. (2010) tahap tersebut merupakan tahap ikan tidak mengalami perkembangan gonad. Perkembangan gonad pada perlakuan hormon Oodev dengan pakan indigofera lebih terlihat banyaknya granul pada oosit (Gambar 6). Hal ini menunjukkan bahwa penggunaan hormon Oodev dengan pakan indigofera lebih meningkatkan kematangangan yang lebih lanjut dibandingkan perlakuan hormon Oodev dengan pakan komersil. Sehingga, membuktikan bahwa indigofera yang dicampurkan dengan hormon Oodev memberikan pengaruh lebih baik terhadap perkembangan gonad pada ikangrass carp.
Uji proksimat gonad pada akhir penelitian didapatkan bahwa perlakuan tanpa hormon dengan menggunakan pakan indigofera (PI) memiliki persentase kandungan protein yang lebih tinggi dibandingkan dengan pakan komersil (PK). Peningkatan kandungan protein gonad lebih tinggi dengan hormon Oodev dan pakan indigofera (Od+PI dan OdPI) dibandingan dengan hormon Oodev dan pakan komersil (Od+PK) (Gambar 7). Selain itu, kandungan lemak gonad pada perlakuan tanpa hormon lebih tinggi pada perlakuan pakan komersil (PK) dibandungkan dengan pakan indigofera (PI). Hal ini terjadi karena pakan indigofera banyak mengandung karotenoid dibandingkan dengan pakan komersil. Karotenoid yang terdapat pada indigofera dapat meningkatkan kandungan protein dan menurunkan kandungan lemak khususnya kolestrol di telur (Palupi et al.
2014, Palupi 2015). Hal ini dikarenakan karotenoid bersifat antioksidan yang dapat mencegah oksidasi lipid dan dapat menghambat kerja aktivasi enzim HMG Co-A reduktase dan tidak terbentuknya melanovat yang diperlukan untuk sintesis kolesterol (Einsenbrand 2005, Palupi 2015). Sehingga, diduga hal tersebut yang menyebabkan rendahnya lemak dan tingginya protein pada gonad ikangrass carp. Kualitas air merupakan salah satu faktor yang mempengaruhi kelangsungan hidup ikan. Nilai suhu, kelarutan oksigen, pH dan TAN selama pemeliharaan ikan grass carp memiliki kisaran yang tidak terlalu jauh (Tabel 3). Kisaran suhu selama masa pemeliharaan sebesar 24,23-24,87oC. Kisaran suhu ini masih dalam kondisi optimum untuk kehidupan dan konsumsi pakan pada ikan
pemeliharaan memiliki kisaran 0,49-0,91 ppm. Kisaran ini dibawah batas maksimum TAN pada perairan air tawar yaitu kurang dari 1 ppm (Boyd 2013). Dari hasil pengukuran tersebut didapatkan bahwa kualitas air selama masa pemeliharaan tidak mengganggu kelangsungan hidup ikangrass carp.
Secara ekonomi pakan indigofera memiliki harga yang murah dan efektif terhadap perkembangan gonad ikan grass carp. Pakan indigofera memiliki harga tiga ribu rupiah per kilogram, lebih rendah dibandingkan dengan pakan komersil yaitu 10 ribu rupiah per kilogram. Selain itu juga indigofera memiliki kandungan vitamin D, E dan K yang cukup tinggi sehingga tidak perlu ditambahkan vitamin lagi (Palupi et al. 2014, Palupi 2015). Sedangkan pada pakan komersil, dalam pembuatannya perlu penambahan vitamin untuk meningkatkan kualitas pakan. Meskipun dalam pertambahan bobot kurang menunjang pertumbuhan, namun dalam perkembangan gonad memiliki kemampuan yang lebih baik dibandingkan dengan pakan komersil jika dicampurkan dengan hormon Oodev. Selain itu, akumulasi jumlah protein gonad juga lebih banyak. Sehingga pakan indigofera dengan hormon Oodev dapat digunakan sebagai pakan dalam menunjang perkembangan reproduksigrass carp.
4 SIMPULAN DAN SARAN
Simpulan
Hormon Oodev (PMSG dan anti dopamin) dengan pakan indigofera dapat meningkatkan konsentrasi estradiol-17β pada plasma darah ikan grass carp. Ikan
grass carp yang diberi pakan indigofera yang mengandung hormon Oodev memiliki indeks kematangan gonad yang tinggi dan mengalami pematangan gonad yang lebih baik dibandingan dengan pakan komersil. Pemberian hormon melalui pakan lebih baik dibandingkan penyuntikan dalam meningkatkan pematangan gonad pada ikangrass carpselama tiga bulan pemeliharaan.
Saran
Untuk memacu perkembangan reproduksi gonad ikan grass carp
DAFTAR PUSTAKA
Abdullah L, Suharlina. 2010. Herbage yield and quality of two vegetative parts of Indigofera at different times of first regrowth defoliation. Media Peternakan33(1):44-49.
Abdullah L, Apriastuti D, Apdini TAP. 2012a. Use ofIndigofera zollingerianaas a forage protein source in dairy goat rations.Proceedings of the 1st Asia Dairy Goat Conference, Kuala Lumpur, Malaysia. Pp:70-72.
Abdullah L, Tarigan A, Suharlina, Budhi D, Jovintry I, Apdini TAP. 2012b.
Indigofera zollingeriana: A promising forage and shrubby legum crop for Indonesia. Proceeding of the 2nd International Seminar on Animal Industry.
Aizen J, Kobayashi M, Selicharova I, Sohn YC, Yoshizaki G, Levavi-Sivan B. 2012. Steroidogenic response of carp ovaries to piscine FSH and LH depends on the reproductive phase. General and Comparative Endocrinology178: 28–36.
Akbarillah TD, Kaharuddin, Kususiyah. 2002. Kajian daun tepung Indigofera sebagai suplemen pakan produksi dan kualitas telur. Laporan Penelitian.
Lembaga Penelitian Universitas Bengkulu, Bengkulu (ID).
Akbarillah T, Kususiyah D, Kaharuddin, Hidayat. 2008. Kajian tepung daun indigofera sebagai suplemen pakan terhadap produksi dan kualitas telur puyuh.Jurnal Peternakan Indonesia3(1): 20-23.
Akbarillah T, Kususiyah, Hidayat. 2010. Pengaruh penggunaan daun Indigofera segar sebagai suplemen pakan terhadap produksi dan warna yolk Itik.
Jurnal Sain Peternakan Indonesia5(1): 27-33.
Anbazahan SM, Mari LSS, Yogeshwari G, Jagruthi C, Thirumurugan R, Arockiaraj J, Velanganni AAJ, Krishnamoorthy P, Balasundaram C, Harikrishnan R. 2010. Immune response and disease resistance of carotenoids supplementation diet in Cyprinus carpio against Aeromonas hydrophila.Fish & Shellfish Immunology40: 9-13.
Biard C, Peter FS, Andres PM. 2005. Effect of carotenoid availability during laying on reproduction in the blue tit.Oecologia. 1-13.
Boyd C. 2013. Water quality. Lucas JS, Southgate PC, editor. Aquaculture: farming aquatic animals and plants.Edisi ke-2.
Cazzonelli CI. 2011. Carotenoids in nature: insights from plants and beyond.
Functional Plant Biology38: 833–847.
Cudmore B, and Mandrak NE. 2004. Biological synopsis of grass carp (Ctenopharyngodon della). Canadian Manuscript Report of Fisheries and Aquatic Sciences2705: 44 hal.
Darwisito S, Zairin JrM, Sjafei DS, Manalu W. 2008. Pemberian pakan mengandung vitamin E dan minyak ikan pada induk memperbaiki kualitas telur dan larva ikan nila (Oreochromis niloticus). Jurnal Akuakultur Indonesia7(1): 1-10.
Dufour S, Sebert M–E, Weltzien F–A, Rousseau K, Pasqualini C. 2010. Neuroendocrine control by dopamine of teleost reproduction. Journal of Fish Biology76:129–160.
Dutta D, Utpal RC, Runu C. 2005. Structure, health benefits, antioxidant property and processing and storage of carotenoids. African Journal of BiotechnologyVol. 4 (13): 1510-1520.
Eisenbrand. 2005. Toxicological Evalution Of Red Mold Rice. DFG- Senate Comision on Food Savety.
Eldahshan O A, Singab ANB. 2013. Carotenoids. Jurnal of Pharmacognosy and Phytochemistry. 2(1): 225-234.
Farastuti ER. 2014. Induksi maturasi gonad, ovulasi dan pemijahan ikan torsoro (Tor Soro) menggunakan kombinasi hormon. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Isomura N, Yamauchi C, Takeuchi Y, Takemura A. 2013. Does dopamine block the spawning of the acroporid coralAcropora tenuis?.Scientific Reports
3:2649.
Izquerdo M S, Ferna´ndez-Palacios H, Tacon AGJ. 2001. Effect of broodstock nutrition on reproductive performance of fish. Journal Aquaculture
(197): 25-42.
Khoo H-E, Nagendra F, Kin Weng K, Yueming J, Amin I. 2011. Carotenoids and their isomers: color pigments in fruits and vegetables. Molecule 16: 1710-1738.
Kobayashi D, Tanaka M, Fukada S, Nagahama Y. 1996. Steroidogenesis in the ovarian follicles of the Medaka (Oryzias latipes) during vitellogenesis and oocyte maturation. Zoological Science13: 921-927.
Kobayashi M, Sorensen PW, Stacey NE. 2002. Hormonal and pheromonal control of spawning behavior in the goldfish. Fish Physiology and Biochemistry
26: 71–84.
Koç ND, Yener A, Rikap Y. 2008. Ovary maturatıon stages and histological investigation of ovary of the Zebrafish (Danio rerio). Brazilian Archives of Biology Technology5(3): 513-522.
Lee M-F, Jing-Duan H, Ching-Fong C. 2012. Development of ovarian tissue and female germ cells in the Protandrous Black Porgy, Acanthopagrus schlegeli (Perciformes, Sparidae). Zoological Studie47(3): 302-316. Lubzens E, Young G, Bobe J, Cerdà J. 2010. Oogenesis in teleosts: how fish eggs
are formed.General and Comparative Endocrinology165: 367-389. Masser MP. 2002. Using grass carp in aquaculture and private impoundments.
Southern Regional Aquaculture Center3600.
Mayes PA, Bender DA. 2003. Overview of metabolism in harpe’s ilustrated biochemistry. Murray RK, Granner DK, Mayes PA, Rodwel VW. Twenty-sixty edition. Lange Medical Book.
Mitchell AJ, and Kelly AM. 2006. The public sector role in the establishment of
grass carpin the United States.Fisheries31:113–121.
Nagahama Y, Yoshikuni M, Yamashita M, Sakai N, Tanaka M. 1993. Molecular endocrinology of oocyte growth and maturation in fish. Fish Physiology and Biochemistry11: 1-6.
Nagahama Y, Yamashita M. 2008. Regulation of oocyte maturation in fish.
Development, Growth and Differentiation50. 195–219.
Nainggolan A, Sudrajat AO, Utomo NBP, Harris E. 2014. Ovarian maturation in Asian Catfish (Clarias sp.) by combination oodev and nutrition addition
Spirulina plantesis.International Journal of Sciences: Basic and Applied Research15(1): 564-583.
Palupi R. 2015. Subtitusi protein bungkil kedelai dengan protein tepung pucuk
Indigofera zollingeriana untuk menghasilkan telur fungsional tinggi antioksidan. [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Palupi R, Abdullah L, Astuti DA, Sumiati. 2014. Potensi dan pemanfaatan tepung pucuk Indigofera sp. sebagai bahan pakan subtitusi bungkil kedelai dalam ransum ayam petelur Jurnal Ilmu Ternak dan Veteriner 19(3): 210-219.
Podhorec P, Kouril J. 2009. Induction of final oocyte maturation in Cyprinidae fish by hypothalamic factor: a review. Veterinarni Medicana 54(3): 97-110.
Putra WKA. 2013. Induksi belut sawah (Monopterus albus) secara hormonal. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Rachman B. 2013. Manipulasi hormonal pada pematangan gonad ikan patin siam
Pangasianodon hypopthalmus. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Rafiuddin, MA. 2014. Karakterisasi, kloning dan rekayasa ekspresi segen FSH pada ikan patin selama awal perkembangan gonad. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Rahmatia, F. 2013. Kajian kombinasi penambahan spirulina platensis pada pakan dan penyuntikan oodev terhadap kinerja reproduksi ikan nila. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Reidel A, Boscolo WR, Feiden A, Romagosa E. 2010. The effect if diets with different levels protein ofRhamdia quelenstocked in cages. Aquaculture
298: 354-359.
Rosety M, Miguel B, Luisa GDC, Amalia G, Carmen S. 1992. Biochemical parameters during reproduction of the toad fish, Halobatrachus didactylus(Schneider, 1801).Science Marine56 (1): 87-94.
Sagi A, Rise M, Isam K, Araf S. 1995. Carotenoids and their derivates in organs of the maturing female crayfish Cherax quadrycarinatus. Biochemistry and Molecular 112(2): 309-313.
Santos IN, Andrade CC, Santos AF, Santos LN and Araujo FG. 2005. Hystological analysis of ovarian development of the characiform
Oligosarcus hepsetus (Cuvier, 1829) in a Brazilian reservoir. Brazilian Journal Biology65(1): 169-77.
Sherwood NM dan Adams BA. 2005. Gonadotropin-releasing hormone in fish: evolution, expression and regulation of the GnRH gene. Melamed P, Sherwood N. Hormones and their Receptors in Fish Reproduction. World Scientific Publishing Co. Singapore. Hal 1–39.
Surai PF, Speake BK, and Sparks NHC. 2001. Carotenoids in avian nutrition and embryonic development 1 absorption, availability and levels in plasma and egg yolk.Journal Poultry Science38: 1–27.
Takeuchi T. 1988. Laboratory work-cheical evaluation of dietery nutrients. In: Fish Nutrition and Mariculture (ed. By T. Watanabe), pp. 179-233. Kanagawa International Fisheries Training Center, Japan International Cooperation Agency, Kagawa.
Tanaka T, Shimizu M, Moribuaki H. 2012. Cancer chemoprevention by carotenoids.Moleculer17: 3202-3242.
Yaron Z, Gur G, Melamed P, Rosenfeld H, Elizur A,Levavi-Sivan B. Regulation of fish gonadotropins.International Review of Cytology225: 131-185. Young G, Kusakabe M, Ikumi N. 2005. Gonadal Steroidogenesis in teleost fish. in
hormones and their receptors in fish reproduction.Melamed P, Sherwood N.Hormones and their Receptors in Fish Reproduction. World Scientific Publishing Co. Singapore.Hal 155-223.
Yu KL dan Peter KE. 1990. Dopaminergic regulation of brain gonadotropin-releasing hormone in male gold fish during spawning behaviour.
Lampiran 1 Prosedur pengukuran hormon Estradiol
Metode ELISA (enzyme linked immuno sorbent assay)
1. Semua reagen dibiarkan pada suhu kamar (18-25 °C) sebelum digunakan 2. Selanjutnya dipersiapkan terlebih dahulu larutan standar dengan kosentrasi
25, 50, 100, 250, 500, 1000 dan 2000pg ml-1dan larutan QC (quality control) 3. Dimasukkan ke dalam masing-masing sumur pelat (microplate) sebanyak 25
μ l standar, sampel dan QC(quality control)
4. Ditambahkan 200 μ l konjugat enzim HRP Estradiol (Enzym Conjugate) ke dalam setiap sumur, kemudian dikocok perlahan selama kurang lebih 10 detik 5. Inkubasi pada suhu kamar selama 2 jam
6. Setelah diinkubasi, larutan pada pelat dibuang dan dicuci dengan larutan pencuci (washing solution) dengan volume 300 μ l setiap sumur. Pencucian dilakukan sebanyak 4 kali menggunakan alat Microplate Strip Washer.
Setelah pencucian selesai, dikeringkan dengan cara dibanting secara perlahan pada kertas penyerap
7. Ditambahkan 100 μ l larutan substrat (TBM Substrate) pada masing-masing sumur pelat
8. Inkubasi selama 20 menit pada suhu ruang
9. Setelah inkubasi dengan larutan substrat, reaksi enzimatis dihentikan dengan menambahkan 50μ L larutan penyetop (Stop Solution, H2SO40,5 M) ke dalam setiap sumur pelat
10. Setelah itu, absorbans dibaca pada panjang gelombang 450 nm menggunakan
ELISA reader(absorbance microplate reader, Biorad) yang telah dilengkapi dengan program MPM6. Pembacaan dilakukan tidak boleh lebih dari 10 menit setelah penambahan larutan penyetop reaksi
Lampiran 2 Prosedur histologi gonad
1. Ikan dibedah dan diambil gonadnya, gonad dicuci dengan NaCl fisiologis 0,65%, selanjutnya difiksasi dalam larutan bouin campuran asam piktrat, formalin dan asam asetat dengan perbandingan (15 : 5 : 1) selama 24 jam. Gonad yang sudah difiksasi dipindahkan ke dalam alkohol 70% beberapa kali hingga kuning telur hilang
2. Gonad didehidrasi ke dalam alkohol dengan konsentrasi bertingkat yaitu (80%, 85%, 90%, dan 95%) masing-masing selama 2 jam kemudian pindahkan ke dalam alkohol berkonsentrasi 100% sebanyak 4 kali masing-masing selama satu jam
3. Organ dibersihkan, didalam alkohol 100% + xylol (1 : 1) selama 45 menit, kemudian ke dalam xylol I, II dan III masing-masing selama 45 menit
4. Organ direndam kembali kedalam xylol + parafin (1 : 1) selama 45 menit pada suhu 60 oC. Kemudian direndam ke dalam parafin I, II dan III masing-masing selama 45 menit dalam suhu 65oC
5. Selanjutnya organ ditanam dalam blok parafin cair pada suhu 60 oC selama 24 jam.sampai parafin mengeras
6. Spesimen dipotong setebal 6-7 μ m, ditempel pada gelas obyek yang telah
7. Untuk deparafinasi, preparat berturut – turut direndam dengan menggunakan xylol I, II, alkohol 100% I, 100% II, 95%, 90%, 85%, 80%, 70% dan 50% dan dicuci sampai warna putih
8. Pewarnaan preparat dilakukan dengan merendam ke dalam cairan hamotoxylin selama 2 menit selanjutnya dibersihkan dengan mencuci dengan air kran mengalir
9. Dehidrasi terhadap preparat dilakukan dengan merendam secara berturut-turut dalam alkohol 70%, 80%, 85%, 90%, 95% I, 95% II, 100% I dan 100% II masing-masing selama satu menit
10. Penjernihan warna objek preparat dilakukan dengan merendam di dalam xylol I dan xylol II masing-masing selama 1 menit
11. Preparat diberi zat perekat Canada balsem, selanjutnya ditutup dengan gelas penutup, dikeringkan selama 10 menit dan di beri label sesuai dengan perlakuan sehingga didapatkan preparat permanen histologi gonad yang dapat diamati dibawah mikroskop
12. Pengamatan histologi dan pengambilan file gambar dilakukan menggunakan mikroskup binokuler Olympus CX31, gambar dikoneksikan dengan CCTV Sony mode SSC. G113 ke komputer. Selanjutnya ditampilkan pada monitor dengan menggunakan window 7 melalui program software Grabee. Objek amatan terbaik selanjutnya di simpan pada flashdisk
Lampiran 3 Prosedur uji proksimat
Prosedur analisis kadar air (Takeuchi 1988)
1. Cawan dipanaskan dalam oven pada suhu 100oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang sebanyak 2-3 g (A)
3. Cawan dan bahan dipanaskan dalam oven pada suhu 110oC selama 4 jam kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2)
Prosedur analisis kadar abu (Takeuchi 1988)
1. Cawan dipanaskan dalam oven pada suhu 100oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 g (A)
3. Cawan dan bahan dipanaskan dalam tanur pada suhu 600oC sampai mnejadi abu kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2)
Prosedur analisis kadar serat kasar (Takeuchi 1988)
1. Kertas filter dipanaskan dalam oven selama 1 jam pada suhu 110oC setelah itu didinginkan dalam desikator selama 15 menit dan ditimbang (X1)
2. Sampel ditimbang sebnayak 0,5 g sampel ditimbang (A) dan dimasukkan ke dalam erlenmeyer 250 mL
sebanyak 25 mL ditambahkan ke dalam erlenmeyer dan dipanaskan kembali selama 30 menit
4. Larutan dan bahan yang telah dipanaskan kemudian disraing dalam corong Buchner dan dihubungkan pada pompa vakum untuk mempercepat proses filtrasi
5. Larutan dan bahan yang ada pada corong Buchner kemudian dibilas secara berturut-turut dengan 50 mL air panas, 50 mL H2SO4 0,3 N, 50 mL air panas, dan 25 mL aseton
6. Kertas saring dan isinya dimasukkan dalam cawan porselin, lalu dipanaskan dalam oven pada suhu 105-110oC selama 1 jam, kemudian didinginkan dalam desikator 5-15 menit dan ditimbang (X2)
7. Setelah itu dipanaskan dalam tanur 600oC hingga berwarna putih atau menjadi abu (±4 jam). Kemudian dimasukkan dalam oven 105-110oC selama 15 menit, didinginkan dalam desikator selama 5-15 menit dan ditimbang (X3)
Prosedur analisis kadar protein (Takeuchi 1988) Metode semi mikro Kjedahl
1. Sampel ditimbang sebanyak 0,5 g dan dimasukkan ke dalam labu kjedahl dan salah satu labu digunakan sebagai blanko dimana labu tidak dimasukkan sampel
2. Ke dalam labu no. 1 ditambahkan 3 g katalis (K2SO4+CuSo4.5H2O) dengan rasio 9:1 dan ditambahkan 10 ml H2SO4
3. Labu no. 2 dipanaskan 3-4 jam sampai cairan dalam labu berwarna hijau bening
4. Larutan didinginkan, lalu ditambahkan air destilasi 30 mL, kemudian larutan no. 2 dimasukkan ke labu takar dan ditambahkan larutan destilasi sampai volume larutan menjadi 100 mL
5. Dilakukan proses destilasi untuk membebaskan kembali NH3 yang berasal dari proses destilasi no. 4
6. Erlenmeyer diisi 10 mL H2SO4 0,05 N dan ditambahkan 2 tetes indikator
methyl red diletakkan di bawah pipa pembuangan kondensor dengan cara dimiringkan sehingga ujung pipa tenggelam dalam cairan
7. Sebanyak 5 mL larutan sampel dimasukkan ke dalam tabung destilasi melalui corong, kemudian dibilas dengan akuades dan ditambahkan 10 mL NaOH 30% lalu dimasukkan melalui corong tersebut dan ditutup
8. Pemanasan dengan uap terhadap labu destilasi dilakukan minimal 10 menit setelah kondensasi uap terlihat pada kondensor
Prosedur analisis kadar lemak (Takeuchi 1988) Metode ekstraksi Soxhlet
1. Labu ekstraksi dipanaskan dalam oven pada suhu 110o dalam waktu 1 jam, kemudian didinginkan dalam desikator selama 30 menit dan ditimbang bobot labu tersebut (X1)
2. Sekitar 3-5 g sampel ditimbang (A), dimasukkan ke dalam selongsong tabung filter dan dimasukkan ke dalam soxhlet dan pemberat diletakkan di atasnya 3. N-hexan 100-150 ml dimasukkan ke dalam soxhlet sampai selongsong
terendam dan sisa N-hexan dimasukkan ke dalam labu
4. Labu yang telah dihubungkan dengan soxhlet dipanaskan di atas waterbath
sampai cairan yang merendam sampel dalam soxhlet berwarna bening 5. Labu dilepaskan dan tetap dipanaskan hingga N-hexan menguap
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung pada tanggal 29 Oktober 1989 sebagai anak kedua dari empat bersaudara oleh pasangan Tunggul Maryono dan Maryani. Penulis menyelesaikan pendidikan sekolah menengah atas di SMA Negeri 10 Bandar Lampung 2007. Pada Tahun yang sama penulis lulus seleksi masuk melalui jalur SPMB pada Universitas Lampung dan memilih Program Studi Budidaya Perairan/Perikanan. Pendidikan sarjana penulis selesaikan tahun 2011. Penulis pernah bekerja di PT Central Proteina Prima sebagai Analyst Technology Research Development. Pada tahun 2013 penulis mendapatkan kesempatan untuk menempuh pendidikan magister ke Sekolah Pascasarjana IPB, program studi Ilmu Akuakultur.