EFEKTIVITAS DAUN SEMBUKAN (
Paederia foetida
)
UNTUK PENCEGAHAN INFEKSI BAKTERI
Aeromonas
hydrophila
PADA IKAN NILA (
Oreochromis niloticus
)
MELALUI PAKAN
MULYATI HASANAH
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Efektivitas Daun Sembukan (Paederia foetida) untuk Pencegahan Infeksi Bakteri Aeromonas hydrophila pada Ikan Nila (Oreochromis niloticus) melalui Pakan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Mulyati Hasanah
ABSTRAK
MULYATI HASANAH. Efektivitas Daun Sembukan (Paederia foetida) untuk Pencegahan Infeksi Bakteri Aeromonas hydrophila pada Ikan Nila (Oreochromis niloticus) melalui Pakan. Dibimbing oleh DINAMELLA WAHJUNINGRUM dan RAHMAN.
Tujuan penelitian ini adalah untuk menentukan dosis daun sembukan (Paederia foetida) yang tepat dalam mencegah infeksi akibat Aeromonas hydrophila pada ikan nila (Oreochromis niloticus). Penelitian ini terdiri dari lima perlakuan yaitu kontrol negatif, kontrol positif, perlakuan 0,8%, perlakuan 1%, dan perlakuan 1,2% dengan masing-masing perlakuan terdiri dari tiga ulangan. Metode penambahan sembukan pada pakan dilakukan dengan metode coating. Pakan diberikan secara at satiation dengan frekuensi pemberian sebanyak 3 kali sehari. Pemeliharaan ikan dilakukan selama 20 hari dan pada hari kesebelas dilakukan uji tantang dengan menggunakan bakteri A. hydrophila. Hasil penelitian ini menunjukan bahwa tingkat kelangsungan hidup sebelum uji tantang tidak berbeda nyata (P>0,05), sedangkan setelah uji tantang diperoleh hasil yang berbeda nyata (P<0,05) antara kontrol positif (37,03%) dengan perlakuan 0,8% (88,89%), perlakuan 1% (74,08%), dan perlakuan 1,2% (74,08%). Berdasarkan hasil penelitian disimpulkan bahwa pemberian daun sembukan melalui pakan efektif untuk pencegahan infeksi A. hydrophila pada ikan nila dengan dosis terbaik yaitu 0,8%.
Kata kunci: Aeromonas hydrophila, Paederia foetida, ikan nila
ABSTRACT
MULYATI HASANAH. Efficacy of Skunkvine Leaves (Paederia foetida) as Prevention for Aeromonas hydrophila Infection in Tilapia (Oreochromis niloticus) through Feed. Supervised by DINAMELLA WAHJUNINGRUM and RAHMAN.
The purpose of this study was to determine the optimum dosage of Skunkvine leaves (Paederia foetida) to prevent Aeromonas hydrophila infection in tilapia (Oreochromis niloticus). This study consisted of five treatments, i.e negative control, positive control and different level of skunkive leave supplementation 0.8%, 1% and 1.2% in triplicate. Incorporation of skunkvine leave has done by coating method. Feed was given to satiation with a feeding frequency of three times a day. Fish were reared for 20 days, and challenge test using A. hydrophila has done on the 11th day after treatments for 10 days. The results of this study showed that survival levels before challenge test were unsignificant different (P<0.05), while survival levels after challenge test were significantly different (P<0.05) between positive control and skunkive treatments 0.8% (88.89%), 1% (74.08%) and 1.2% (74.08%). In concluse, the study showed that the addition skunkvine leave through feed is effective for prevention of A.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
EFEKTIVITAS DAUN SEMBUKAN (
Paederia foetida
)
UNTUK PENCEGAHAN INFEKSI BAKTERI
Aeromonas
hydrophila
PADA IKAN NILA (
Oreochromis niloticus
)
MELALUI PAKAN
MULYATI HASANAH
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Efektivitas Daun Sembukan (Paederia foetida) untuk Pencegahan Infeksi Bakteri Aeromonas hydrophila pada Ikan Nila (Oreochromis niloticus) melalui Pakan
Nama : Mulyati Hasanah
NIM : C14110003
Disetujui oleh
Dr Dinamella Wahjuningrum, S.Si M.Si Pembimbing I
Rahman, S.Pi M.Si Pembimbing II
Diketahui oleh
Dr Ir Sukenda, M.Sc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah dengan tema “Fitofarmaka” yang berjudul “Efektivitas Daun Sembukan (Paederia foetida) untuk Pencegahan Infeksi Bakteri Aeromonas hydrophila pada Ikan Nila (Oreochromis niloticus) melalui Pakan” dapat diselesaikan. Penelitian ini dilaksanakan pada bulan Februari-Maret 2015 bertempat di Laboratorium Kesehatan Ikan dan Laboratorium Lingkungan Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam proses penyusunan skripsi ini, terutama kepada:
1. Ibunda Sunarsih dan Ayahanda Hartoyo atas doa, kasih sayang, dan dukungannya.
2. Ibu Dr. Dinamella Wahjuningrum, S.Si, M.Si dan Bapak Rahman, S.Pi, M.Si selaku dosen pembimbing yang telah banyak memberikan bimbingan dan masukan.
3. Prof. Dr. Ir. M. Zairin Junior, M.Sc selaku dosen penguji tamu.
4. Ibu Julie Ekasari, S.Pi, M.Sc selaku perwakilan dari komisi pendidikan yang telah memberikan saran dan kritik untuk penulisan skripsi.
5. Bapak Ranta yang telah memberikan saran dan bantuan selama penelitian.
6. Teman-teman BDP 48, khususnya Kiki, Mita, Iqbal, Maley, Mina, Dila, Wikke, Yuri, dan teman-teman LKI 48.
7. Teman-teman IMPATA 48 dan A1 97 Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
METODE ... 2
Waktu dan Tempat ... 2
Materi Uji ... 2
Rancangan Penelitian ... 2
Prosedur Penelitian ... 3
Parameter Penelitian ... 6
Analisis Data ... 7
HASIL DAN PEMBAHASAN ... 7
Hasil ... 7
Pembahasan ... 11
KESIMPULAN ... 13
DAFTAR PUSTAKA ... 13
LAMPIRAN ... 15
DAFTAR GAMBAR
1. Skema rancangan perlakuan uji in vivo pada ikan nila ... 3
2. Tingkat kelangsungan hidup ikan nila sebelum uji tantang pada perlakuan kontrol positif, kontrol negatif, perlakuan 0,8% (P1), perlakuan 1% (P2), perlakuan 1,2% (P3) ... 7
3. Tingkat kelangsungan hidup ikan nila sesudah uji tantang pada perlakuan kontrol positif, kontrol negatif, perlakuan 0,8% (P1), perlakuan 1% (P2), perlakuan 1,2% (P3) ... 8
4. Jumlah konsumsi pakan ikan nila sebelum dan sesudah uji tantang pada perlakuan kontrol positif (K+), kontrol negatif (K-), perlakuan 0,8% (P1), perlakuan 1% (P2), dan perlakuan 1,2% (P3) ... 8
5. Konversi pakan ikan nila sebelum uji tantang pada perlakuan kontrol positif (K+), kontrol negatif (K-), perlakuan 0,8% (P1), perlakuan 1% (P2), dan perlakuan 1,2% (P3) ... 9
6. Konversi pakan ikan nila sesudah uji tantang pada perlakuan kontrol positif (K+), kontrol negatif (K-), perlakuan 0,8% (P1), perlakuan 1% (P2), dan perlakuan 1,2% (P3) ... 9
7. Gejala klinis pada ikan nila berupa inflamasi (A), hemoragi (B), dan tukak (C) ... 10
8. Organ dalam ikan nila berupa hati (A), limpa (B), dan ginjal (C) pada tiap perlakuan ... 10
9. (A) Ikan perlakuan kontrol positif mengalami tukak pada hari ke-3, (B) Ikan mati sebelum hari ke-10, (C) Ikan perlakuan 0,8% (P1) mengalami tukak pada hari ke-4, (D) Ikan mengalami penyembuhan pada hari ke-10, (E) Ikan perlakuan 1% (P2) mengalami tukak pada hari ke-4, (F) Ikan mengalami penyembuhan pada hari ke-10, (G) Ikan perlakuan 1,2% (P3) mengalami tukak pada hari ke-4, (H) Ikan mengalami penyembuhan pada hari ke-10 ... 11
DAFTAR LAMPIRAN
1. Daun Sembukan (Paederia foetida) ... 152. Perhitungan nilai LD50 ... 15
3. Hasil uji biokimia A. hydrophila ... 16
4. Zona hambat daun sembukan (Paederia foetida) ... 16
5. Analisis statistik kelangsungan hidup ikan nila sebelum uji tantang ... 16
6. Analisis statistik kelangsungan hidup ikan nila sesudah uji tantang ... 16
7. Analisis statistik konversi pakan ikan nila sebelum uji tantang ... 17
8. Analisis statistik konversi pakan ikan nila sebelum uji tantang ... 17
1
PENDAHULUAN
Latar Belakang
Ikan nila (Oreochromis niloticus) merupakan salah satu komoditas ikan air tawar yang memiliki nilai ekonomi penting dan telah dibudidayakan secara intensif. Ikan nila termasuk dalam jenis ikan yang tahan terhadap perubahan kondisi lingkungan. Ikan nila dapat hidup di lingkungan air tawar, air payau, dan air asin. Ikan ini dapat hidup, tumbuh, dan bereproduksi pada suhu optimum 25o -30o C (Firnanda et al. 2013).
Seiring dengan tingginya permintaan, proses budidaya ikan nila mulai berubah yaitu dari skala tradisional (ekstensif) menjadi intensif. Pada proses intensif inilah mulai muncul beberapa masalah seperti timbulnya penyakit pada organisme budidaya. Salah satu jenis penyakit yang menyerang ikan nila yaitu
motile aeromonad septicaemia (MAS). Penyakit ini umumnya menyerang ikan air tawar seperti gurame, mas, lele, dan nila (Tantu et al. 2013, Firnanda et al. 2013). Penyakit MAS merupakan penyakit yang disebabkan oleh bakteri Aeromonas hydrophila. Penyakit ini memiliki gejala-gejala antara lain nafsu makan yang berkurang, adanya luka-luka pada permukaan tubuh, terdapat pendarahan pada insang, perut membesar karena mengandung cairan, sisik lepas, sirip ekor rusak, dan jika dilakukan pembedahan maka akan terlihat adanya pembengkakan dan kerusakan pada jaringan hati, ginjal, dan limfa. Penyakit ini dapat menimbulkan tingkat kematian ikan hingga 80% (Tantu et al. 2013).
Salah satu upaya yang umumnya dilakukan untuk pencegahan penyakit akibat infeksi bakteri A. hydrophila yang tidak menimbulkan dampak negatif baik pada ikan, lingkungan, maupun konsumen yaitu vaksin dan fitofarmaka. Vaksin yang umumnya digunakan oleh kalangan petani merupakan jenis vaksin tradisional yang memiliki kelemahan seperti, resiko terjadinya infeksi (Nuryati et al. 2010) dan ikan yang divaksin perlu dilakukan vaksinasi secara berkala. Solusi dari permasalahan tersebut yaitu dengan penggunaan bahan-bahan alami seperti fitofarmaka sebagai imunostimulan dan antibakterial. Fitofarmaka memiliki beberapa keunggulan dibanding yang lain yaitu dapat dibuat dengan teknik yang sederhana, aman untuk pemakaian dalam jangka lama, lebih mudah dan praktis penggunaanya, serta tidak menimbulkan kerusakan lingkungan.
2
dilakukan sehingga dapat digunakan dalam pencegahan penyakit akibat infeksi bakteri.
Tujuan Penelitian
Penelitian ini bertujuan untuk menentukan efektivitas dan dosis daun sembukan (Paederia foetida) yang tepat dalam mencegah infeksi akibat bakteri A.
hydrophila pada ikan nila (Oreochromis niloticus).
METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Februari-Maret 2015 bertempat di Laboratorium Kesehatan Ikan dan Laboratorium Lingkungan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Materi Uji
Pada penelitian ini materi uji yang digunakan adalah bakteri, ikan nila, dan daun sembukan. Bakteri yang digunakan adalah bakteri Aeromonas hydrophila
yang diperoleh dari Laboratorium Kesehatan Ikan. Ikan nila yang digunakan memiliki strain nila GIFT (genetic improvement for farmed tilapia) dan berasal dari Laladon, Bogor, Jawa Barat dengan ukuran 11,04±1,08 cm. Tanaman sembukan (Lampiran 1) yang digunakan dalam penelitian ini diperoleh dari daerah Magetan, Jawa Timur. Tanaman sembukan memiliki daerah penyebaran di Jawa, Sumatera, Banda, dan Maluku (Abriyanto et al. 2012).
Rancangan Penelitian
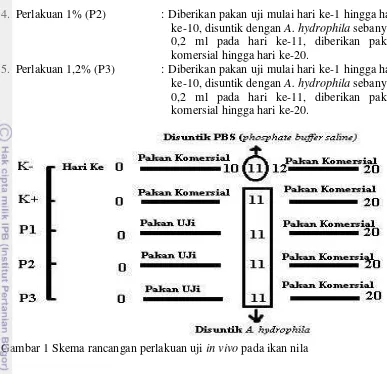
Penelitian utama (in vivo) terdiri dari lima perlakuan (kontrol negatif, kontrol positif, perlakuan dengan dosis 0,8%, 1%, dan 1,2%) dengan tiga kali ulangan. Secara lengkap perlakuan yang diberikan yaitu sebagai berikut:
1. Kontrol Negatif (K-) : Diberikan pakan komersial mulai hari ke-1 hingga hari ke-10, disuntik dengan Phosphate Buffer Saline (PBS) (Lampiran 9) pada hari ke-11, diberikan pakan komersial hingga hari ke-20.
2. Kontrol Positif (K+) : Diberikan pakan komersial mulai hari ke-1 hingga hari ke-10, disuntik dengan A. hydrophila sebanyak 0,2 ml pada hari ke-11, diberikan pakan komersial hingga hari ke-20. 3. Perlakuan 0,8% (P1),
: Diberikan pakan uji mulai hari ke-1 hingga hari ke-10, disuntik dengan A. hydrophila
3 4. Perlakuan 1% (P2) : Diberikan pakan uji mulai hari ke-1 hingga hari
ke-10, disuntik dengan A. hydrophila sebanyak 0,2 ml pada hari ke-11, diberikan pakan komersial hingga hari ke-20.
5. Perlakuan 1,2% (P3) : Diberikan pakan uji mulai hari ke-1 hingga hari ke-10, disuntik dengan A. hydrophila sebanyak 0,2 ml pada hari ke-11, diberikan pakan komersial hingga hari ke-20.
Gambar 1 Skema rancangan perlakuan uji in vivo pada ikan nila
Prosedur Penelitian
Penyediaan Bakteri Uji
Bakteri A. hydrophila disuntikkan pada ikan nila secara intramuskular untuk memelihara patogenitasnya. Kemudian dilakukan reisolasi bakteri dengan menggoreskan jarum ose ke bagian ginjal ikan. Setelah itu, bakteri dibiakkan di medium TSA (trypticase soy agar) dan diinkubasi selama 24 jam pada inkubator. Koloni dari isolat asli dan hasil reisolasi dilakukan pengamatan berdasarkan warna dan bentuk. Untuk memperoleh biakan murni, maka setiap koloni yang tumbuh terpisah dan berlainan morfologinya dimurnikan kembali dengan cara diisolasi kembali ke dalam media TSA agar miring dan diinkubasi selama 24 jam. Identifikasi yang dilakukan yaitu pewarnaan Gram, uji motilitas, uji oksidasi/ fermentasi (O/F), uji katalase, uji oksidase, dan uji gelatin (Austin 2007). Hasil uji biokimia bakteri A. hydrophila dapat dilihat pada Lampiran 3.
4
Penentuan Nilai LD50
Uji LD50 dilakukan untuk menentukan tingkat virulensi bakteri A. hydrophila pada ikan nila. Pengujian dilakukan dengan cara menginjeksikan bakteri pada ikan nila dengan metode intramuskular pada kepadatan 106 sampai 108 CFU/ml. Bakteri yang diinjeksikan yaitu sebanyak 0,2 ml/ekor sesuai dengan label kepadatan bakteri pada setiap akuarium (Hardi et.al 2014). Jumlah ikan yang digunakan yaitu 10 ekor/akuarium dengan 1 kali ulangan. Bakteri uji yang digunakan adalah bakteri hasil kultur pada media TSB yang dicuci dengan menggunakan PBS sebelum diinjeksikan pada ikan. Pengamatan dilakukan dengan menghitung jumlah kematian ikan sampai hari ke tujuh. Selanjutnya dilakukan perhitungan untuk mengetahui LD50 yaitu konsentrasi pada waktu ikan mati mencapai 50% dari populasi selama tujuh hari. Perhitungan LD50 dianalisis dengan menggunakan metode Reed dan Muench yaitu dengan cara menghitung jarak proporsi yang selanjutnya ditentukan logaritma perbandingan dosis (Rasyid
et al. 2012). Hasil perhitungan LD50 dengan metode Reed dan Muench dapat dilihat pada Lampiran 2.
Uji In Vitro (Penentuan Dosis)
Daun sembukan dikeringkan dengan menggunakan metode penjemuran ataupun pengovenan. Setelah kering, daun sembukan dijadikan serbuk, lalu disaring dengan saringan 500 µm agar diperoleh serbuk halus, dan disimpan diwadah kedap udara. Proses ekstraksi dilakukan dengan cara menyeduh serbuk daun sembukan dalam akuades steril. Akuades steril terlebih dahulu dipanaskan di penangas air (heater) hingga suhu 50oC. Setelah itu, serbuk daun sembukan dimasukkan dan diaduk. Campuran antara serbuk daun sembukan dan akuades steril didiamkan pada suhu 50oC selama 15 menit. Hasil seduhan disaring dengan menggunakan kain furing agar diperoleh cairan ekstrak yang siap digunakan.
Uji in vitro dilakukan untuk melihat aktivitas antibakteri dari ekstrak daun sembukan. Metode yang digunakan dalam uji in vitro adalah metode Kirby Bauer atau metode kertas cakram. Metode ini akan menghasilkan dosis optimum ekstrak daun sembukan yang efektif untuk menghambat bakteri A. hydrophila. Hasil uji aktivitas antibakteri pada metode kertas cakram ditunjukkan dengan adanya zona bening disekitar kertas cakram.
5
Persiapan Wadah
Akuarium dengan ukuran 60cm x 30cm x 30cm dicuci dengan menggunakan sabun, lalu dibilas dengan air bersih. Setelah itu, dilakukan desinfeksi akuarium dengan mengunakan chlorin sebanyak 30 ppm dan dikeringkan selama 24 jam. Selanjutnya, akuarium diisi dengan air yang berasal dari tandon hingga mencapai volume 36 L. Akuarium yang telah diisi air diberi aerasi kuat selama 24 jam. Jumlah aerasi yang digunakan sebanyak 15 buah atau terdapat 1 aerasi per akuarium.
Persiapan Ikan Uji
Ikan nila terlebih dahulu dipelihara dalam akuarium stok dengan ukuran 1 m x 0,6 m x 0,5 m untuk proses adaptasi selama lima hari. Setelah itu, ikan dipindahkan ke dalam akuarium perlakuan dengan kepadatan 10 ekor/akuarium. Selama proses adaptasi ikan diberi pakan pelet apung komersial dengan frekuensi pemberian sebanyak tiga kali sehari secara at satiation. Pengontrolan terhadap kualitas air selama proses adaptasi juga dilakukan agar kualitas media pemeliharaan berada pada kisaran toleransi.
Pembuatan Pakan Uji
Hasil optimum yang diperoleh dari uji in vitro digunakan untuk dosis perlakuan pada uji in vivo. Daun sembukan berupa serbuk kering ditimbang sesuai dosis yang digunakan yaitu 0 g/kg pakan (kontrol), 8 g/kg pakan, 10 g/kg pakan, dan 12 g/kg pakan. Selanjutnya, serbuk daun sembukan dicampur dengan putih telur sebanyak 2% dari jumlah pakan dan dilakukan pengadukan secara merata. Setelah itu pakan dicampur dengan campuran putih telur dan serbuk daun sembukan hingga merata. Pakan yang telah tercampur diletakkan pada wadah kedap udara kemudian dimasukkan ke dalam lemari pendingin.
Uji Tantang
Uji tantang dilakukan untuk mengetahui pengaruh pemberian daun sembukan melalui pakan terhadap daya tahan ikan nila. Uji tantang dilakukan pada hari kesebelas pemeliharaan dengan cara ikan disuntik dengan bakteri A.
hydrophila untuk perlakuan kontrol positif (K+) , perlakuan 0,8% (P1), 1% (P2), dan 1,2% (P3), sedangkan kontrol negatif (K-) disuntik dengan PBS. Ikan disuntik dengan metode penyuntikan intramuskular. Ikan yang luka setelah uji tantang diambil tiga ekor/akuarium untuk ditandai dengan benang agar dapat diketahui proses penyembuhannya.
Pemeliharaan Ikan selama Perlakuan
6
Pengukuran suhu dan pH dilakukan setiap hari, TAN dilakukan setiap seminggu sekali, dan DO diukur pada awal dan akhir pemeliharaan.
Tabel 1 Parameter kualitas air, satuan, dan alat ukur selama perlakuan
Parameter Satuan Alat ukur
DO (oksigen terlarut) mg/L DO meter
pH unit pH meter
TAN (total amonia nitrogen) mg/L Spektrofotometer
Suhu oC Thermometer
Tabel 2 Kisaran suhu, pH, DO, dan TAN selama 20 hari pemeliharaan ikan
Perlakuan Parameter
pH Suhu (oC) DO (mg/L) TAN (mg/L) Kontrol positif 6,78-7,92 25-27 5,6-8,8 0,330-0,938 Kontrol negatif 6,52-7,94 25-27 5,0-7,3 0,347-0,791 Perlakuan 0,8% 6,55-7,69 25-27 5,5-8,6 0,303-0,717 Perlakuan 1% 6,50-7,81 25-27 6,5-8,1 0,329-0,711 Perlakuan 1,2% 6,51-7,92 25-27 6,5-7,0 0,323-0,707
Nilai Optimuma 6,5-8,5 25-32 ≥3 ≤ 1
Keterangan: a. SNI (2009)
Parameter Penelitian
Kelangsungan Hidup (KH)
Tingkat kelangsungan hidup dengan menggunakan rumus:
Keterangan:
SR = tingkat kelangsungan hidup Nt = populasi ikan hari ke-t (ekor) No = populasi ikan hari ke-0 (ekor)
Jumlah Konsumsi Pakan (JKP)
Jumlah konsumsi pakan dihitung setiap hari dari awal perlakuan hingga akhir perlakuan selama 20 hari. Jumlah konsumsi pakan ditentukan berdasarkan jumah pakan yang termakan. Perhitungan jumlah konsumsi pakan yaitu selisih berat jumlah pakan yang diberikan dengan jumlah pakan yang tidak termakan.
Konversi Pakan (KP)
Konversi Pakan (KP) dihitung dengan menggunakan rumus yaitu:
Keterangan:
KP = konversi pakan
Pa = jumlah pakan yang dihabiskan (g) Bt = biomassa ikan pada akhir perlakuan (g) Bm = biomassa ikan mati (g)
7
Gejala Klinis dan Pengamatan Organ Dalam
Pengamatan terhadap gejala klinis dilakukan setiap hari setelah ikan uji diinfeksi bakteri A. hydrophila. Gejala klinis yang diamati pada bagian luar tubuh yaitu ada tidaknya inflamasi, hemoragi, dan tukak. Pengamatan organ dalam dilakukan diakhir perlakuan dengan cara mengamati morfologi organ dalam ikan.
Analisis Data
Penelitian ini menggunakan RAL (Rancangan Acak Lengkap) dengan 3 kali ulangan perlakuan. Data yang diperoleh dianalisis dengan menggunakan Microsoft Excel 2007 dan SPSS 22.0 serta uji lanjut dengan Duncan. Parameter yang dilakukan analisis secara kuantitatif adalah kelangsungan hidup dan konversi pakan. Sedangkan parameter yang dilakukan analisis secara deskriptif adalah jumlah konsumsi pakan, gejala klinis dan pengamatan organ dalam.
HASIL DAN PEMBAHASAN
Hasil
Kelangsungan Hidup
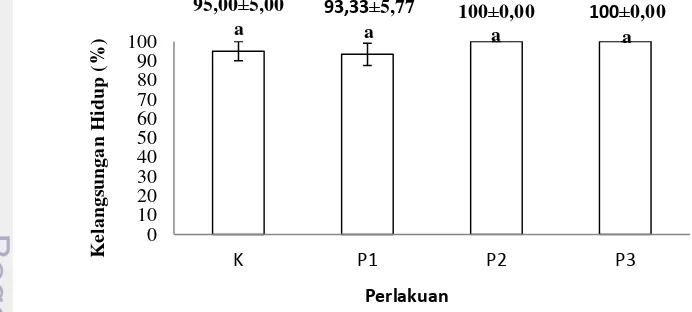
Kelangsungan hidup ikan nila sebelum uji tantang berkisar antara 93-100%. Kelangsungan hidup tertinggi sebelum uji tantang ditunjukkan oleh perlakuan P2 dan P3 yaitu sebesar 100%, namun tidak berbeda nyata pada tiap perlakuan (P>0,05) (Lampiran 5). Kelangsungan hidup ikan nila sebelum uji tantang dapat dilihat pada Gambar 2.
Keterangan:
Huruf yang sama pada setiap grafik batang menunjukkan hasil yang tidak berbeda nyata (P>0,05)
Gambar 2 Tingkat kelangsungan hidup ikan nila sebelum uji tantang pada perlakuan kontrol positif, kontrol negatif, perlakuan 0,8% (P1), perlakuan 1% (P2), perlakuan 1,2% (P3)
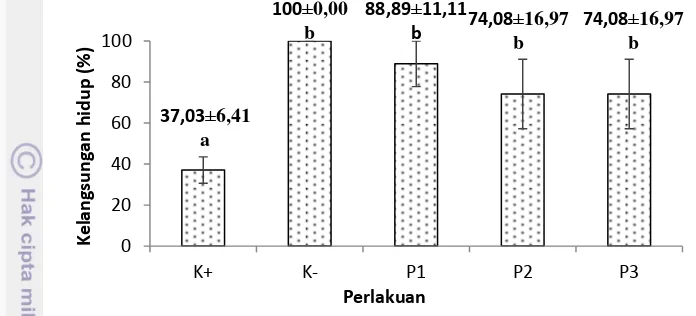
Tingkat kelangsungan hidup ikan nila setelah uji tantang yaitu berkisar 37-100%. Kelangsungan hidup tertinggi setelah uji tantang ditunjukkan oleh perlakuan kontrol negatif yaitu 100%. Kelangsungan hidup perlakuan P1
8
(88,89%), P2 (74,08%), dan P3 (74,08%) lebih baik dan berbeda nyata (P<0,05) dibandingkan dengan kontrol positif (37,03%) (Lampiran 6). Kelangsungan hidup ikan nila setelah uji tantang dapat dilihat pada Gambar 3.
Keterangan:
Huruf yang berbeda pada setiap grafik batang menunjukkan hasil yang berbeda nyata (P<0,05)
Gambar 3 Tingkat kelangsungan hidup ikan nila sesudah uji tantang pada perlakuan kontrol positif, kontrol negatif, perlakuan 0,8% (P1), perlakuan 1% (P2), perlakuan 1,2% (P3)
Jumlah Konsumsi Pakan (JKP)
Jumlah konsumsi pakan sebelum uji tantang cenderung stabil untuk semua perlakuan. Namun setelah uji tantang, jumlah konsumsi pakan mengalami penurunan. Hari ke-3 setelah uji tantang, konsumsi pakan mengalami peningkatan. Hari ke-4 dan selanjutnya, konsumsi pakan mulai stabil. Setelah uji tantang, pola konsumsi pakan perlakuan kontrol negatif (K-) paling tinggi dibandingkan dengan perlakuan lain. Perlakuan P1 memiliki pola konsumsi pakan yang lebih tinggi dibandingkan P2 dan P3. Sedangkan pola terendah terdapat pada perlakuan kontrol positif (K+). Jumlah konsumsi pakan ikan nila sebelum dan sesudah uji tantang dapat dilihat pada Gambar 4.
Gambar 4 Jumlah konsumsi pakan ikan nila sebelum dan sesudah uji tantang pada perlakuan kontrol positif (K+), kontrol negatif (K-), perlakuan 0,8% (P1), perlakuan 1% (P2), dan perlakuan 1,2% (P3)
9
Konversi Pakan
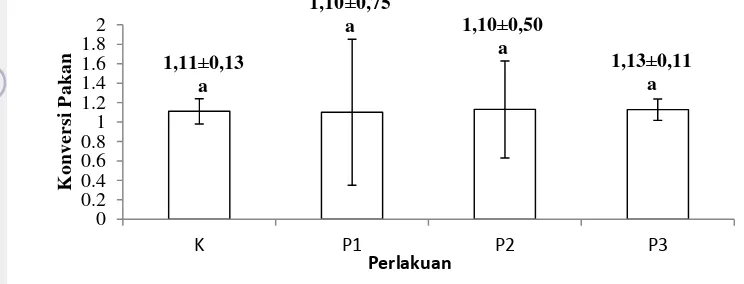
Konversi pakan sebelum dilakukan uji tantang yaitu berkisar antara 1,1-1,13. Konversi pakan sebelum uji tantang tidak berbeda nyata pada tiap perlakuan (P>0,05) (Lampiran 7). Konversi pakan ikan nila sebelum uji tantang dapat dilihat pada Gambar 5.
Keterangan:
Huruf yang sama pada setiap grafik batang menunjukkan hasil yang tidak berbeda nyata (P>0,05)
Gambar 5 Konversi pakan ikan nila sebelum uji tantang pada perlakuan kontrol positif (K+), kontrol negatif (K-), perlakuan 0,8% (P1), perlakuan 1% (P2), dan perlakuan 1,2% (P3)
Setelah dilakukan uji tantang, konversi pakan berkisar antara 1,32-2,59. Konversi pakan teringgi terdapat pada kontrol positif dan terendah pada kontrol negatif. Konversi pakan sesudah uji tantang berbeda nyata pada tiap perlakuan (P>0,05) (Lampiran 8). Konversi pakan ikan nila sesudah uji tantang dapat dilihat pada Gambar 6.
Keterangan:
Huruf yang berbeda pada setiap grafik batang menunjukkan hasil yang berbeda nyata (P<0,05)
Gambar 6 Konversi pakan ikan nila sesudah uji tantang pada perlakuan kontrol positif (K+), kontrol negatif (K-), perlakuan 0,8% (P1), perlakuan 1% (P2), dan perlakuan 1,2% (P3)
10
Gejala Klinis
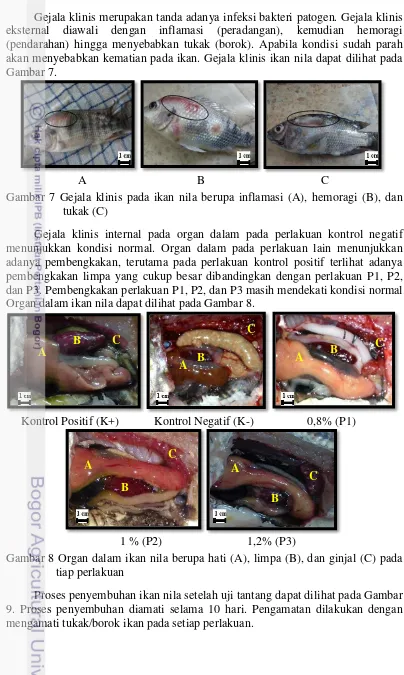
Gejala klinis merupakan tanda adanya infeksi bakteri patogen. Gejala klinis eksternal diawali dengan inflamasi (peradangan), kemudian hemoragi (pendarahan) hingga menyebabkan tukak (borok). Apabila kondisi sudah parah akan menyebabkan kematian pada ikan. Gejala klinis ikan nila dapat dilihat pada Gambar 7.
A B C
Gambar 7 Gejala klinis pada ikan nila berupa inflamasi (A), hemoragi (B), dan tukak (C)
Gejala klinis internal pada organ dalam pada perlakuan kontrol negatif menunjukkan kondisi normal. Organ dalam pada perlakuan lain menunjukkan adanya pembengkakan, terutama pada perlakuan kontrol positif terlihat adanya pembengkakan limpa yang cukup besar dibandingkan dengan perlakuan P1, P2, dan P3. Pembengkakan perlakuan P1, P2, dan P3 masih mendekati kondisi normal. Organ dalam ikan nila dapat dilihat pada Gambar 8.
Kontrol Positif (K+) Kontrol Negatif (K-) 0,8% (P1)
1 % (P2) 1,2% (P3)
Gambar 8 Organ dalam ikan nila berupa hati (A), limpa (B), dan ginjal (C) pada tiap perlakuan
Proses penyembuhan ikan nila setelah uji tantang dapat dilihat pada Gambar 9. Proses penyembuhan diamati selama 10 hari. Pengamatan dilakukan dengan mengamati tukak/borok ikan pada setiap perlakuan.
B C
A B
C
A
A
B
C
A B
C
A
B
11
Gambar 9 (A) Ikan perlakuan kontrol positif mengalami tukak pada hari ke-3, (B) Ikan mati sebelum hari ke-10, (C) Ikan perlakuan 0,8% (P1) mengalami tukak pada hari 4, (D) Ikan mengalami penyembuhan pada hari ke-10, (E) Ikan perlakuan 1% (P2) mengalami tukak pada hari ke-4, (F) Ikan mengalami penyembuhan pada hari ke-10, (G) Ikan perlakuan 1,2% (P3) mengalami tukak pada hari ke-4, (H) Ikan mengalami penyembuhan pada hari ke-10
Pembahasan
Tingkat kelangsungan hidup ikan nila selama pemeliharaan sebelum uji tantang tidak berbeda nyata pada setiap perlakuan. Kelangsungan hidup setelah uji tantang pada perlakuan mengalami perbedaan nyata dengan kontrol positif (Gambar 3). Adanya perbedaan tingkat kelangsungan hidup ikan nila perlakuan dibanding kontrol positif diduga dipengaruhi oleh senyawa aktif yang terdapat pada daun sembukan. Senyawa aktif yang terdapat pada daun sembukan antara lain saponin, tanin, fenol (143-384,5 mg/g), flavonoid (81-226,5 mg/g), terpenoid dan alkaloid (Upadhyaya 2013). Saponin dan terpenoid merupakan senyawa aktif yang memiliki kemampuan untuk menghambat pertumbuhan bakteri dengan mekanisme penghambatan terhadap sintesis protein sehingga terjadi perubahan
A B
C D
E F
12
komponen-komponen penyusun sel bakteri itu sendiri yaitu berupa kerusakan permeabilitas dinding sel (Rosyidah et al. 2010). Tanin merupakan suatu senyawa yang memiliki sifat antibakterial dan antioksidan, pada konsentrasi rendah dapat mengahambat pertumbuhan bakteri dan konsentrasi tinggi dapat menghambat pertumbuhan jamur (Apriasari et al. 2013). Fenol merupakan senyawa antibakteri yang dapat bermigrasi dari fase cair menuju fase lemak pada membran sel, yang mengakibatkan menurunnya tegangan permukaan yang diikuti denaturasi protein dan sel yang mengalami lisis (Reed 1982). Flavonoid merupakan senyawa polar yang umumnya larut pada pelarut polar yang memiliki fungsi sebagai antibakteri karena dapat merusak permeabilitas dinding sel bakteri (Sabir 2005). Alkaloid merupakan senyawa sekunder yang berfungsi sebagai antibakteri dengan cara mengganggu komponen penyusun peptidoglikan pada sel bakteri sehingga lapisan dinding sel tidak terbentuk yang mengakibatkan kematian sel tersebut (Juliantina
et al. 2009).
Daun sembukan memiliki fungsi tidak hanya sebagai antibakteri tetapi juga pemacu sistem imun. Sistem imun yang dipacu oleh bahan aktif daun sembukan yaitu sistem imun non spesifik. Mekanisme kerja bahan aktif terutama flavonoid dalam memacu sistem imun adalah mempercepat aktivasi leukosit dan makrofag sehingga proses fagositosis tehadap benda asing dapat dilakukan dalam waktu cepat (Angka 2005).
Jumlah konsumsi pakan pada uji in vivo (Gambar 4) mengalami penurunan dan kenaikan pasca dilakukan uji tantang. Penurunan secara signifikan terjadi setelah dilakukan uji tantang kemudian meningkat kembali setelah beberapa hari. Ikan akan mengalami stres baik akibat proses penyuntikan maupun infeksi A. hydrophila yang menyebabkan nafsu makan ikan menurun sehingga berdampak pada penurunan jumlah konsumsi pakan, tetapi jumlah konsumsi pakan akan meningkat setelah respon stres menghilang. Menurut Tantu et al. (2013) salah satu gejala akibat infeksi bakteri A. hydrophila adalah penurunan nafsu makan.
Konversi pakan ikan nila sebelum uji tantang (Gambar 5) menunjukkan hasil tidak berbeda nyata antar perlakuan (P<0,05). Hal ini menunjukkan bahwa pemberian daun sembukan dengan metode coating tidak mempengaruhi kualitas pakan. Jumlah konversi pakan dipengaruhi oleh kualitas pakan, spesies, ukuran ikan, dan kualitas air (NRC 1993). Semakin tinggi rasio konversi pakan maka tingkat efektivitas pakan semakin rendah.
Bakteri A. hydrophila merupakan salah satu bakteri yang memiliki virulensi tinggi. Bakteri A. hydrophila termasuk dalam golongan bakteri opurtunis yang selalu ada di perairan dan menyerang saat ikan dalam kondisi kurang baik. Gejala klinis ikan uji selama penelitian (Gambar 7) yaitu pendarahan (hemoragi), pembengkakan (inflamasi), dan adanya tukak pada tubuh ikan. Selain itu, nafsu makan ikan juga berkurang, pergerakan ikan kurang aktif) dan kondisi organ dalam ikan cenderung mengalami pembengkakan dan perubahan warna. Organ dalam ikan yang terinfeksi oleh A. hydrophila memiliki warna yang lebih pucat dibandingkan ikan kontrol negatif dan pembengkakan pada ikan perlakuan lebih kecil dibandingkan dengan ikan kontrol positif (Gambar 8). Gejala yang sama diamati pula oleh Hardi et.al (2014) yaitu ikan nila yang terinfeksi A. hydrophila
13 Bakteri A. hydrophila merupakan bakteri yang berkembang biak dalam usus (Cipriano 2001). Pemberian ekstrak melalui pakan dapat mempercepat bahan aktif yang terdapat dalam daun sembukan sampai ke usus, sehingga perlawanan terhadap patogenesis A. hydrophila lebih cepat. Menurut Apriasari et al. (2013), tanin merupakan senyawa sekunder yang menetap di saluran pencernaan. Oleh karena itu, pemberian daun sembukan melalui pakan cukup efektif untuk digunakan dalam menghambat kinerja bakteri.
Efektivitas daun sembukan jika dibandingkan dengan fitofarmaka lain yaitu jahe merah (Zingiber officinale), daun sembukan memiliki tingkat keefektivan yang lebih tinggi. Hal itu dikarenakan tingkat kelangsungan hidup ikan nila yang diberi jahe merah lebih rendah dibanding daun sembukan. Tingkat kelangsungan hidup ikan nila yang diberi jahe merah yaitu berkisar antara 40-57% (Indriani et al. 2014), sedangkan daun sembukan berkisar antara 74-88%.
Kualitas air merupakan salah satu faktor penyebab timbulnya penyakit pada ikan. Hal itu dipengaruhi oleh adanya interaksi antara lingkungan, inang, dan patogen yang tidak seimbang. Selama pemeliharaan kualitas air dijaga agar tetap sesuai dengan batas toleransi ikan, sehingga kualitas air bukan menjadi faktor pemicu timbulnya penyakit pada ikan uji.
KESIMPULAN
Pencegahan infeksi bakteri A. hydrophila dengan ekstrak daun sembukan melalui pakan cukup efektif. Dosis yang efektif yaitu 0,8% dengan tingkat kelangsungan hidup tertinggi sebesar 88,89%.
DAFTAR PUSTAKA
Angka S.L. 2005. Kajian penyakit Motile Aeromonad Septicaemia (MAS) pada ikan lele dumbo (Clarias sp.): patologi, pencegahan dan pengobatannya dengan fitofarmaka. [Disertasi]. Bogor (ID): Institut Pertanian Bogor.
Apriasari L.M, Iskandar, Suhartono E. 2013. Bioactive compound and antioxidant activity of methanol extract mauli bananas (Musa sp) stem. Biochemistry, 4: 110 - 115.
Abriyanto A.E., Sabikis, Sudarso. 2012. Aktivitas anti fungi ekstrak etanol daun sembukan (Paederia foetida L) terhadap Candida albicans. Jurnal Pharmacy, 9: 1-10.
Austin B., Austin D.A. 2007. Bacterial Fish Pathogens. England: Ellis Horwood Limited.
Cipriano R.C. 2001. Aeromonas hydrophila and motile aeromonad septicemias of fish. Fish Disease Leaflet 68. Fish and Wildlife Service Division if Fishery Research. United States Departement of The Interior. Washington DC. Firnanda R, Sugito, Fakhrurrazi, Ambarwati D.V.S. 2013. Isolasi Aeromonas
14
Hardi E.H., Pebrianto C.A., Hidayanti T., Handayani R.T. 2014. Infeksi
Aeromonas hydrophila melalui jalur yang berbeda pada ikan nila (Oreochromis niloticus) di Loa Kulu Kutai Kartanegara Kalimantan Timur.
Jurnal Kedokteran Hewan, 8: 130-133.
Indriani A.D., Prayitno S.B., Sarjito. 2014. Penggunaan jahe merah (Zingiber officinale var. Rubrum) sebagai alternatif pengobatan ikan nila (Oreochromis niloticus) yang diinfeksi bakteri Aeromonas hydrophila.
Journal of Aquaculture Management and Technology, 3: 58-65.
Juliantina F.R., Citra D.A., Nirwani B., Nurmasitoh T., Bowo E.T. 2009. Manfaat sirih merah (Piper crocatum) sebagai agen antibakteri gram positif dan gram negatif. JKKI. UIN Yogyakarta.
[NRC] National Research Council. 1993. Nutrient Requirement of Fishes. National Academic of Sciences. Washington DC.
Nuryati S., Maswan N. A., Alimuddin, Sukenda, Sumantadinata K., Pasaribu F.H., Soejoedono R.D., Santika A. 2010. Gambaran darah ikan mas setelah divaksinasi dengan vaksin DNA dan diuji tantang dengan koi herpes virus.
Jurnal Akuakultur Indonesia, 9: 9-15.
Rasyid M., Usmar, Subehan. 2012. Uji toksisitas akut ekstrak etanol lempuyang antibakteri fraksi saponin dari kulit batang tumbuhan kasturi (Mangifera casturi). Alchemy, 1: 53-103.
Sabir A. 2005. In vitro antibacterial activity of falvonoids Trigona sp. propolist against Streptococcus mutans. Dental Journal, 38: 135 – 141.
[SNI] Standar Nasional Indonesia. 2009. Produksi ikan nila (Oreochromis niloticus Bleeker) kelas pembesaran di kolam air tenang. Badan Standarisasi Nasional.
Tantu W., Tumbol R.A., Longdong S.N.J. 2013. Deteksi keberadaan bakteri
Aeromonas sp. pada ikan nila yang dibudidayakan di karamba jaring apung danau Tondano. Jurnal Budidaya Perairan, 1: 74 – 80.
Uddin B., Nahar T., Khalil M.I., Hossain S. 2007. In vitro antibacterial activity of the ethanol extract of Paederia foetida L. (Rubiaceae) leaves. Bangladesh Journal Life Science, 19: 141 – 143.
Upadhyaya S. 2012. Screening of phtochemicals, nutritional status, antioxidaant, and antimicrobial activity of Paederia foetida Linn. From different localities of Assam, India. Journal of Pharmacy Research, 7: 139 - 141.
Wahjuningrum D., Astrini R., Setiawati M. 2013. Pencegahan infeksi Aeromonas hydrophila pada benih ikan lele Clarias sp. yang berumur 11 hari menggunakan bawang putih Allium sativum dan meniran Phyllanthus niruri.
15
LAMPIRAN
Lampiran 1 Daun Sembukan (Paederia foetida)
Lampiran 2 Perhitungan nilai LD50 Rumus LD50: Keterangan: m = log LD50
Xi = log dosis kematian di bawah 50%
d = selisih log dosis kematian di bawah 50% dan di atas 50% %Xi = persentase kematian kumulatif dosis di bawah 50%
%X(i-1) = persentase kematian kumulatif dosis di atas 50%
Kepadatan bakteri (CFU/ml)
Log
Dosis ∑Mati ∑Hidup
Akumulasi
%Mati Mati Hidup Rasio
108 8 7 3 14 3 0,82 82,35%
107 7 5 5 7 8 0,47 46,67%
106 6 2 8 2 16 0,11 11,11%
16
Lampiran 3 Hasil uji biokimia A. hydrophila
Karakteristik Hasil uji Austin (2007)
Pewarnaan gram Negatif Negatif
Bentuk sel Batang Batang
O/F Fermentatif (F) Fermentatif (F)
Katalase + +
Oksidase + +
Lampiran 4 Zona hambat daun sembukan (Paederia foetida)
Hasil pengukuran zona hambat oleh daun sembukan dalam menghambat bekteri A. hydrophila
Perlakuan Ulangan (cm) Rataan (cm)
Lampiran 5 Analisis statistik kelangsungan hidup ikan nila sebelum uji tantang
ANOVA
Lampiran 6 Analisis statistik kelangsungan hidup ikan nila sesudah uji tantang
ANOVA
Jumlah Kuadrat DB Kuadrat Tengah F P
Perlakuan 6782,803 4 1695,701 11,448 0,001
Galat 1481,185 10 148,119
17
Lampiran 7 Analisis statistik konversi pakan ikan nila sebelum uji tantang
ANOVA
18
Lampiran 9
Komposisi
phosphate buffer saline
(PBS)
Bahan Jumlah
NaCl 8 g
K2HPO4 0,2 g
NaH2PO4 1,5 g
KCl 0,2 g
19